НУКЛЕИНОВО-КИСЛОТНЫЙ ЗОНД
Вид РИД
Изобретение
Настоящее изобретение относится к зонду для обнаружения нуклеиновой кислоты, способу с использованием упомянутого зонда и набору компонентов. Предпочтительно зонд по настоящему изобретению является применимым в способе обнаружения нуклеиновых кислот, происходящих из Chlamydia trachomatis и/или Neisseria gonorrhoeae, и может быть использован в диагностике хламидийной и/или гонорейной инфекций.
Амплификация нуклеиновых кислот является одним из наиболее ценных инструментов в области наук о жизни, включая такие ориентированные на практическое применение области, как клиническая медицина, где диагностика инфекционных заболеваний, генетических нарушений и генетических признаков особенно полезна. В дополнение к широко используемой детекции, основанной на ПЦР (полимерной цепной реакции, PCR, Saiki R.K., Scharf, S., Faloona, F., Mullis, K.B., Hom, G.T., Erlich, H.A. and Amheim, N. (1985) Science, 230, 1350-1354), было изобретено несколько способов амплификации. Примеры включают реакцию амплификации, основанной на последовательности нуклеиновой кислоты (nucleic acid sequence-based amplification (NASBA)), самоподдерживающуюся репликацию последовательности (self-sustained sequence replication (3SR)) и петлевую изотермическую амплификацию (loop-mediated isothermal amplification (LAMP)). ПЦР использует тепловую денатурацию двухцепочечных ДНК-продуктов с тем, чтобы способствовать следующему раунду синтеза ДНК. При 3SR и NASBA удается обходиться без тепловой денатурации, используя набор реакций транскрипции и обратной транскрипции для амплификации последовательности-мишени.
Данные способы могут обеспечивать одинаковую степень амплификации нуклеиновых кислот-мишеней, причем все способы характеризуются порогом обнаружения в менее 10 копий, причем для анализов достаточно часа или около того. Данные способы требуют либо точных приборов для амплификации, либо сложных способов для обнаружения амплифицированных продуктов из-за плохой специфичности при селекции последовательности-мишени. Несмотря на простоту и высокую степень амплификации, требование высокой точности к термоциклеру при ПЦР препятствует широкому применению данного мощного способа, например, в частных клиниках в качестве рутинного диагностического прибора. В противоположность этому, LAMP представляет собой способ, который может амплифицировать несколько копий ДНК до более 100 менее чем за час в изотермических условиях и с большей специфичностью.
Наряду с другими, упомянутыми выше технологиями, основанными на применении молекулярных зондов, анализы, основанные на петлевой изотермический амплификации (loop-mediated isothermal amplification, LAMP), могут использоваться для обнаружения присутствия специфических микроорганизмов в образце. Однако, данные способы обнаружения основаны на непосредственном визуальном обнаружении, оценке мутности или использовании неспецифичного ДНК-интеркалирующего красителя. Непосредственное визуальное измерение представляет собой измерение в конечной точке и не в состоянии обеспечить анализ в реальном времени. Измерение мутности и неспецифические интеркалирующие красители действительно обеспечивают анализ происходящей амплификации в реальном времени, который, однако, является неспецифическим, т.е. детектируется вся амплификация, будь то истинная положительная амплификация или ложная амплификация из-за ошибочного праймирования, перекрестной специфичности.
В соответствии с первым аспектом настоящего изобретения обеспечен зонд для применения при изотермической амплификации нуклеиновой кислоты, содержащий последовательность олигонуклеотидного зонда, комплементарную области целевой последовательности нуклеиновой кислоты, где упомянутая последовательность олигонуклеотидного зонда имеет только один флуорофор-лиганд, и данный лиганд связан с внутренним цитозиновым основанием, и где упомянутая последовательность олигонуклеотидного зонда не имеет терминатора на 3'-конце.
В предпочтительном варианте осуществления последовательность олигонуклеотидного зонда представляет собой ДНК-последовательность и целевая последовательность нуклеиновой кислоты представляет собой ДНК-последовательность.
Предпочтительно, флуоресценция увеличивается в том случае, когда надо указать на присутствие нуклеиновой кислоты-мишени в образце.
Предпочтительно, цитозиновое основание, по существу, центрально расположено по длине олигонуклеотида. Имеются определенные преимущества, связанные со внутренним мечением зонда по цитозиновому основанию. Специфичность ДНК-продукта, амплифицированного в изотермической реакции, может быть подтверждена с помощью анализа кривой плавления. Однако, из-за большого количества вариантов продукта, получаемых в данной реакции и низкого разрешения анализа кривой плавления с использованием интеркалирующих красителей, подобных V13, очень трудно различать специфические и неспецифические ДНК-продукты, полученные в изотермических условиях. Обычно используемые зонды, такие как зонд TaqMan®, не совместимы с LAMP-технологией в связи с активностью замещения цепи BST-полимеразы. Зонд по изобретению удлинен и оказывается включенным в ДНК-продукт в процессе изотермической амплификации, что позволяет осуществлять анализ кривой плавления на полученном продукте. В зонде по изобретению флуорофор конъюгирован с внутренним цитозином, комплементарным гуанину в антисмысловой цепи. Гуанин влияет на возбужденное состояние многих флуорофоров, что приводит к образованию уникальных "подписей" кривых плавления и позволяет различать специфические и неспецифические продукты, образующиеся в изотермических условиях.
Олигонуклеотид не содержит ддНТФ (дидезоксинуклеозидтрифосфата) с 3'-конца, что позволяет включение меченого олигонуклеотида в ампликон. Таким образом, 3'-конец зонда не "заблокирован".
Флуорофор может содержать любое одно или более из следующих: FAM, JOE, ТЕТ, HEX, TAMRA, ROX, ALEXA и АТТО.
Зонд может содержать следующую последовательность:
5' Xn С* Xm 3' (SEQ ID NO. 1)
где n>1, m>3, X представляет собой нуклеотидное основание; и * представляет собой флуорофор. Предпочтительно, нуклеотидное основание выбрано из А, Т, С и G. Предпочтительно, n более чем от 1 до 20 или менее, более предпочтительно более чем от 1 до 10 или менее. Предпочтительно, m более, чем от 3 до 20 или менее, более предпочтительно более чем от 3 до 10 или менее. Предполагается, что вышеупомянутые интервалы значений раскрывают все комбинации длин зонда, охватываемые возможными значениями числа нуклеотидов, которые n или m могут принимать.
Предпочтительно, зонд может содержать последовательность, выбранную из любой из следующих последовательностей:
SEQ ID NO.3: 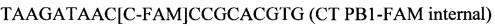
SEQ ID NO.5:
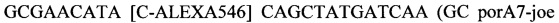
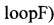 or
or
SEQ ID NO.6: 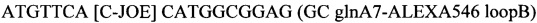
Флуоресценция предпочтительно увеличивается, когда олигонуклеотид включается в последовательность нуклеиновой кислоты-мишени, что приводит к изменению в конфигурации комплекса ампликон-зонд, приводящему к изменению возбужденного состояния флуорофора.
Цитозин, связанный с флуорофором-лигандом, не расположен на 5'- или 3'-конце или в непосредственной близости к 5'- или 3'-концу. Более предпочтительно он не расположен в позиции, соответствующей первым 3 основаниям либо от 5'-, либо от 3'-конца. Предпочтительно цитозин, связанный с флуорофором, расположен в позиции, соответствующей основанию, расположенному посредине зонда.
В соответствии с еще одним аспектом настоящего изобретения, обеспечивается зонд для изотермической амплификации нуклеиновой кислоты, как описано выше.
В соответствии с еще одним аспектом настоящего изобретения, обеспечивается зонд для петлевой изотермический амплификации, как описано выше.
Способы и композиции для определения по меньшей мере одной нуклеиновой кислоты-мишени в смеси нуклеиновых кислот, как правило, используют зонд, реагент гибридизации, а также один или более образующих фосфатную связь ферментов, ассоциированных с любыми требуемыми нуклеозидтрифосфатами, чтобы образовать цепь нуклеиновой кислоты.
Данные способы обычно включают амплификацию, такую, как включающую использование промотора вместе с РНК-полимеразой, сайта рестрикции, когда только одна цепь расщепляется и затем вытесняется удлинением с помощью ДНК-полимеразы, или реагента циклической гибридизации, когда производятся сцепленные повторы. Обнаружение амплифицированной нуклеиновой кислоты может осуществляться различными способами, но предпочтительно осуществляется с помощью флуорофора.
В соответствии с еще одним аспектом настоящего изобретения обеспечивается способ обнаружения нуклеиновой кислоты-мишени в образце, включающий:
a. амплификацию нуклеиновой кислоты-мишени в образце, чтобы обеспечить амплифицированную нуклеиновую кислоту;
b. зондирование амплифицированной нуклеиновой кислоты с помощью зонда, как описано выше; и
c. обнаружение присутствия одной или нескольких нуклеиновых кислот-мишеней. Нуклеиновая кислота-мишень может быть нуклеиновой кислотой из
микроорганизмов, грибов, дрожжей, вирусов, человека, животных, растений и т.д. Нуклеиновая кислота-мишень для LAMP, как известно, допускает синтез LAMP-праймеров и соответствующих специфичных зондов. Таким образом, может быть определено наличие или отсутствие упомянутых микроорганизмов, грибов, дрожжей, вирусов, человека, животных, растений в образце. Предпочтительно нуклеиновая кислота-мишень происходит из Chlamydia trachomatis или Neisseria gonorrhoeae.
Предпочтительно, флуоресценция увеличивается, что указывает на присутствие нуклеиновой кислоты-мишени в образце.
Процесс является изотермическим и позволяет проведение амплификации в одну стадию или последовательными стадиями в одном сосуде, где все реагенты совместимы.
В еще одном аспекте настоящее изобретение относится к способу диагностики хламидиоза и/или гонореи у пациента, включающему
предоставление образца, полученного от пациента;
добавление одного или более зондов по настоящему изобретению к образцу; и детектирование присутствия нуклеиновой кислоты, полученной из Chlamydia trachomatis или Neisseria gonorrhoeae, причем увеличение флуоресценции зонда указывает на наличие инфекции Chlamydia trachomatis и/или Neisseria gonorrhoeae.
Образец может быть обработан обычными способами для того, чтобы зонд связывался с любым нуклеотидом-мишенью, присутствующим в образце. Такая обработка может включать в себя центрифугирование и лизис образца, чтобы высвободить любую нуклеиновую кислоту-мишень из инфицирующего микроорганизма.
В одном варианте осуществления один тип зонда, специфичного для нуклеиновой кислоты либо из Chlamydia trachomatis либо из Neisseria gonorrhoeae, используется в способе, так что в образце детектируется либо только Chlamydia trachomatis, либо только Neisseria gonorrhoeae.
В предпочтительном варианте осуществления к образцу добавляют по меньшей мере два различных зонда, причем первый зонд помечен первой флуоресцентной меткой и является специфическим для зондирования нуклеиновой кислоты Chlamydia trachomatis и второй зонд помечен флуоресцентной меткой, отличающейся от метки первого зонда, и является специфическим для зондирования нуклеиновой кислоты Neisseria gonorrhoeae. В данном варианте осуществления можно одновременно обнаружить хламидийную и гонорейную инфекцию в одном образце, взятом у пациента.
В одном аспекте способа по настоящему изобретению образец от пациента может представлять собой образец крови, образец мочи, образец сыворотки или образец слюны.
В соответствии с еще одним аспектом настоящего изобретения, обеспечивается набор, включающий зонд, как описано выше, буфер для проведения LAMP-реакции, содержащий фермент полимеразу, дНТФ и LAMP-праймеры для мишени.
В одном варианте осуществления положительный и отрицательный контроль могут быть включены в набор. Реагенты могут быть представлены в виде влажных реагентов или в лиофилизированной форме.
Буфер, используемый в способе или наборе по настоящему изобретению, включает в себя дНТФ в концентрации от 1 до 10 мМ, одну или более солей в концентрации от 2 до 20 мМ, Трис-буфер рН 8,8 в концентрации от 10 до 100 мМ, трегалозу в концентрации от 10 до 100 мМ, BST-полимеразу в количестве от 1Е до 12Е и от 0,01% до 1% 1,2-пропандиола.
Сокращения
СТ - Chlamydia trachomatis
GC - Neisseria gonorrhoeae
GlnA7 - глутаминсинтетаза
PorA7 - пориновый белок А7
LAMP - петлевая изотермическая амплификация
ПЦР - полимеразная цепная реакция.
Настоящее изобретение будет описано, только в качестве примера, со ссылкой на следующие примеры и фигуры.
LAMP-реакция
Основанную на V13 детекцию СТ и GT ДНК-мишени LAMP-реакцией проводили с использованием LAMP-реакционного буфера V6.21, разработанного заявителем. Основанную на применении зонда детекцию ДНК-мишени проводили в V6.21p (без V13). Концентрации LAMP-праймеров были следующими: СТ РВ1 - 0,8 мкМ FIP & BIP праймера, 0,2 мкМ F3 & В3 и 0,4 мкМ Loop-праймеров, GC porA7 и GC glnA7 - 2 мкМ FIP & BIP праймера, 0,25 мкМ F3 & В3 и 0,5 мкМ Loop-праймеров. Все зонды использовали при конечной концентрации 0,625 мкМ. LAMP-реакции проводили в течение 60 мин при постоянной температуре 63°C с использованием прибора ABI7500 для проведения ПЦР в реальном времени. Показания флуоресцентного сигнала были получены в канале SybrGreen/FAM, Joe или Су3, в зависимости от обстоятельств.
Последовательности зондов
SEQ ID NO.2: 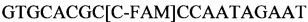
SEQ ID NO.3: 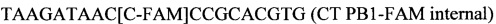
SEQ ID NO.4: 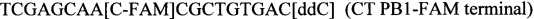
SEQ ID NO.5: 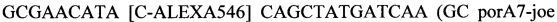
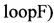
SEQ ID NO.6: 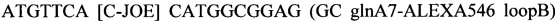
или
SEQ ID NO.7: 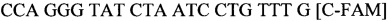
Целевые последовательности
Целевые последовательности ДНК, используемые в примерах, представляют собой
SEQ ID NO: 8: полная последовательность плазмиды pSotonGl Chlamydia trachomatis G/SotonG1 (GenBank: HE603235.1)



SEQ ID NO: 9: частичный ген porA для белка класса 1 наружной мембраны Neisseria gonorrhoeae, изолят GC3 (GenBank: НЕ681886.1)

SEQ ID NO: 10: ген глутаминсинтетазы (glnA), аллель glnA-14, Neisseria gonorrhoeae частичная cds (GenBank: AF520262.1)

Последовательности праймеров, используемые в LAMP-реакции, являются следующими:
СТ плазмида

GC porA7

GC glnA7

Буфер
Заявитель разработал буферную систему для использования с зондами по изобретению, которая обозначается V6.21 (или V6.21p без присутствующего красителя V13) в следующих примерах. Концентрации буферных компонентов после восстановления буфера:
V6.21
от 4 до 10 мМ дНТФ, 10 мМ соли, 30 мМ Трис рН 8,8, 30 мМ трегалозы, от 1 до 8Е Bst-полимеразы, краситель и 0,05% пропандиола.
V6.21p
от 4 до 10 мМ дНТФ, 10 мМ соли, 30 мМ Трис рН 8,8, 30 мМ трегалозы, от 1 до 8Е Bst-полимеразы и 0,05% пропандиола. ПЦР
Обнаружение CT/GC в клинических образцах с помощью ПЦР в реальном времени проводили с использованием анализа APTIMA CT/GC multiplex (Gen-Probe) в соответствии с инструкциями изготовителя.
Электрофорез в агарозном геле
Электрофорез ДНК проводили в 1% агарозном геле в 1×TAE буфере при 100 В. ДНК-продукты LAMP-реакции визуализировали с GelRed (Invitrogen) с трансиллюминатором.
Буферы V6.21 и V6.21p были разработаны заявителем. LAMP-праймеры были получены от Eurofins. Меченные флуорофором олигонуклеотиды были приобретены у компании Integrated DNA technologies. Трис-буфер, агарозный гель и вода ПЦР-класса были приобретены у компании Sigma. Стандарты СТ и GC ДНК были получены от АТСС.
Фигуры
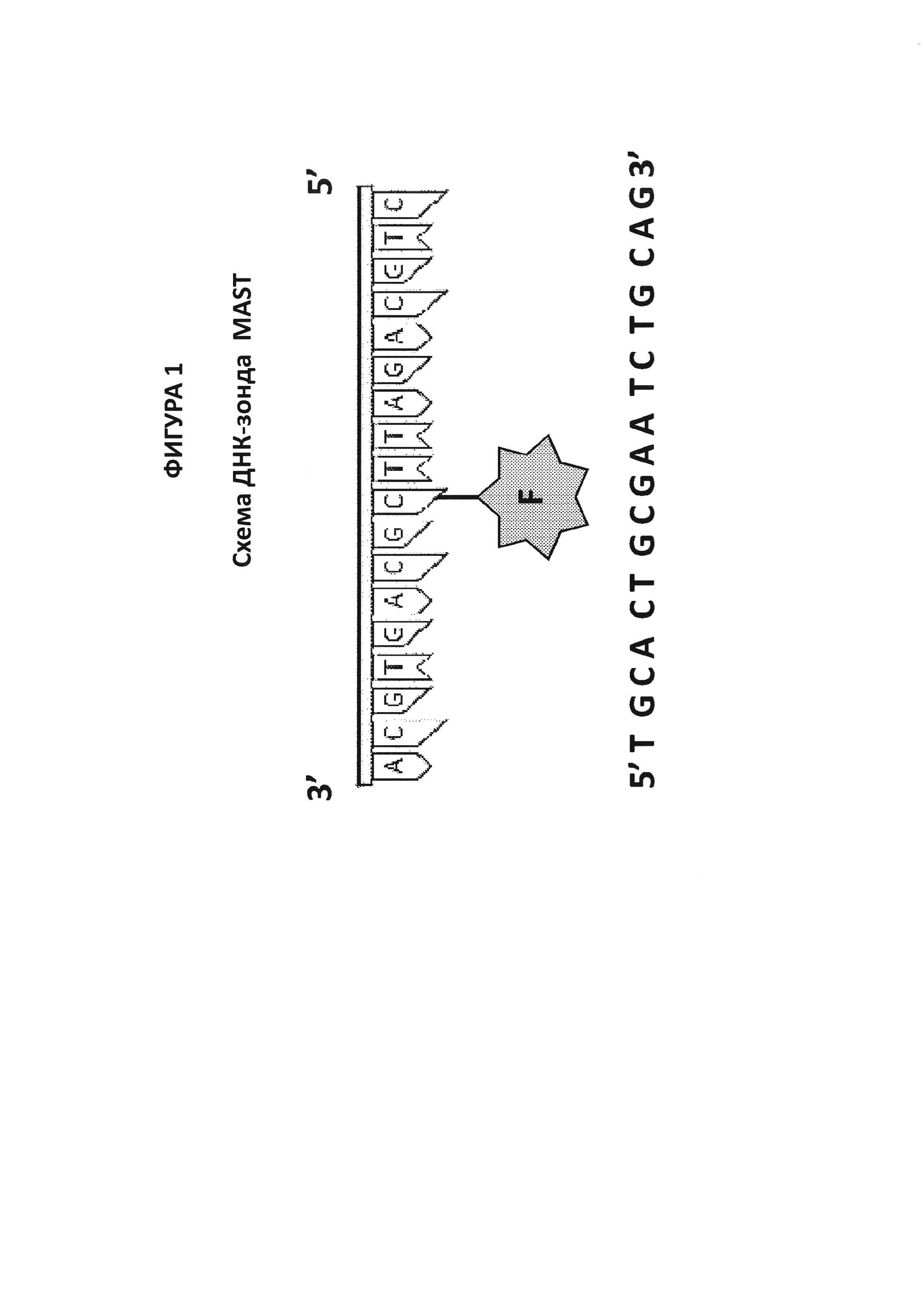
На фигуре 1 представлена схема ДНК-зонда по настоящему изобретению. Зонд состоит из олигонуклеотида с внутренним цитозином, конъюгированным с определенным флуорофором. Зонд может быть комплементарным к внутренней области ампликона, фланкированной праймерами FIP и BIP, или он может представлять собой модифицированный праймер LoopF или LoopB, изнутри меченный флуорофором.
Пример 1
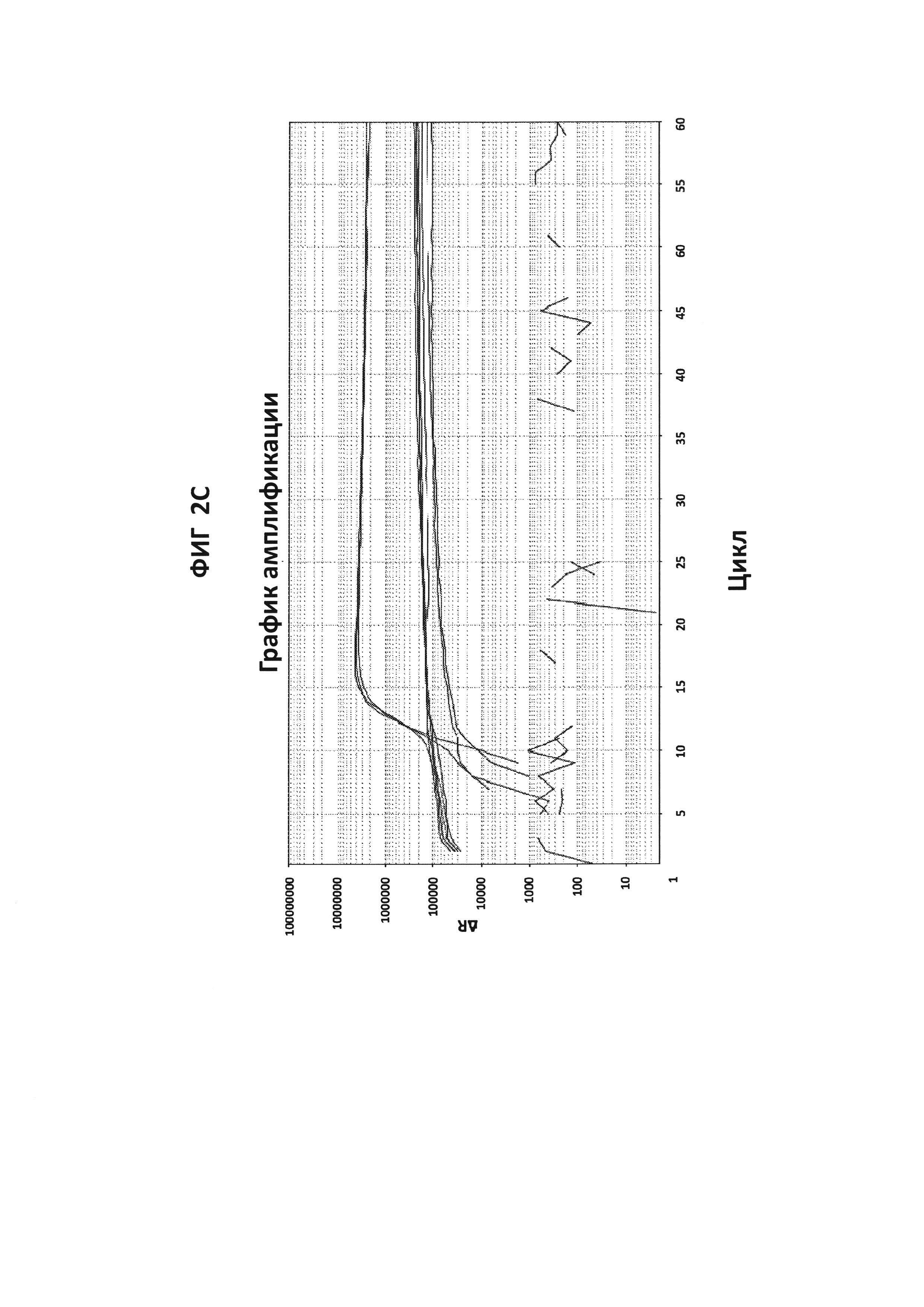
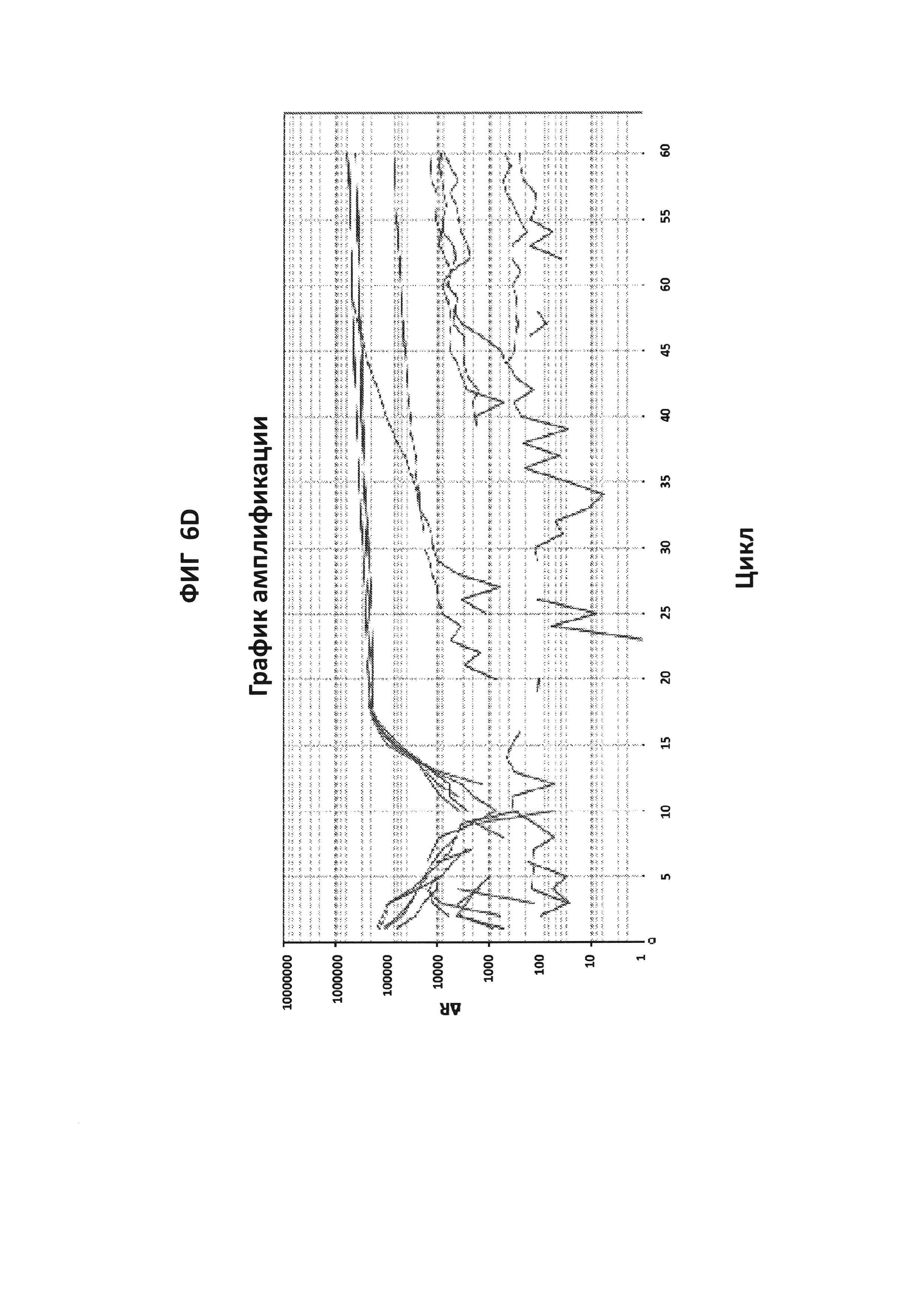
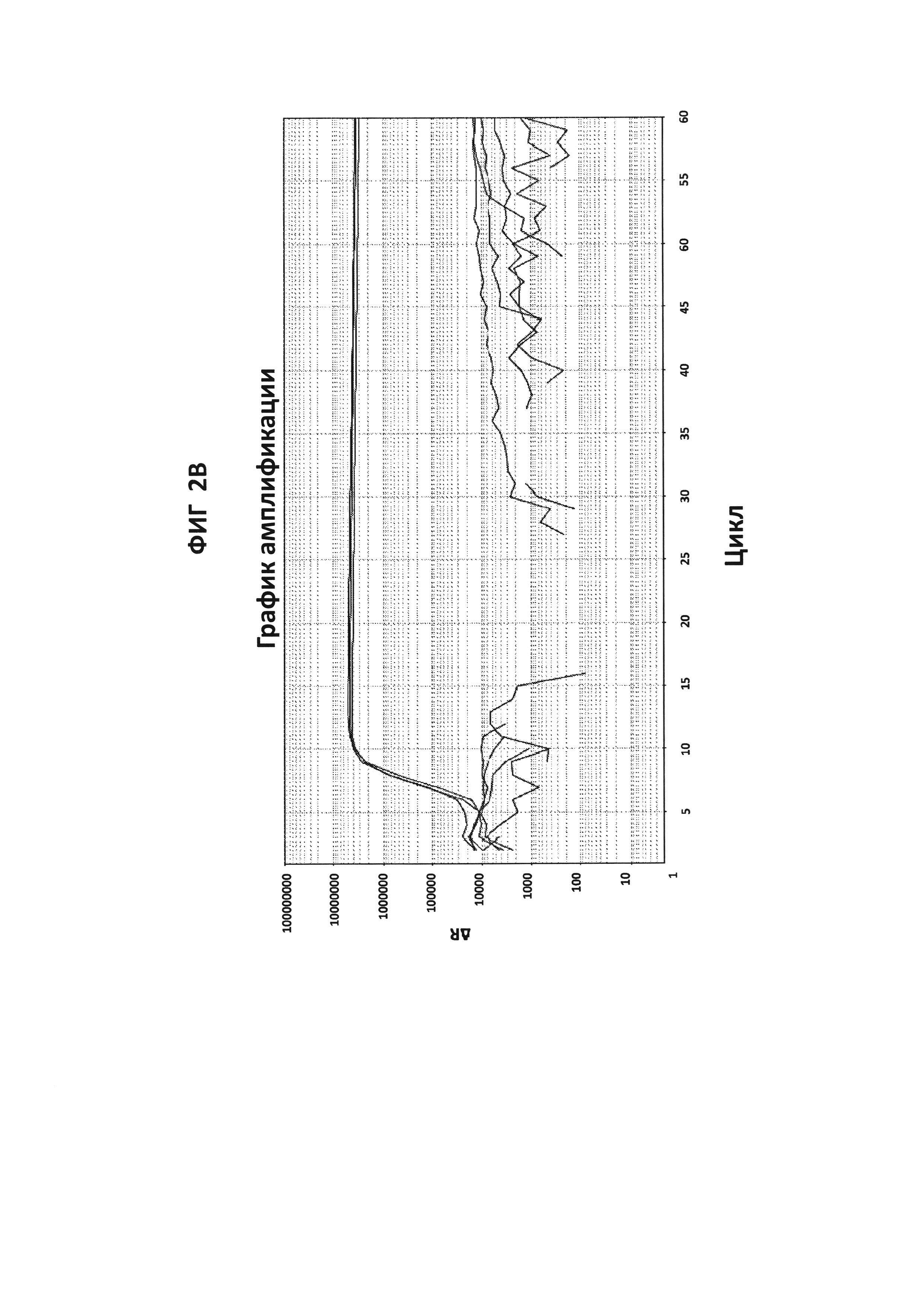
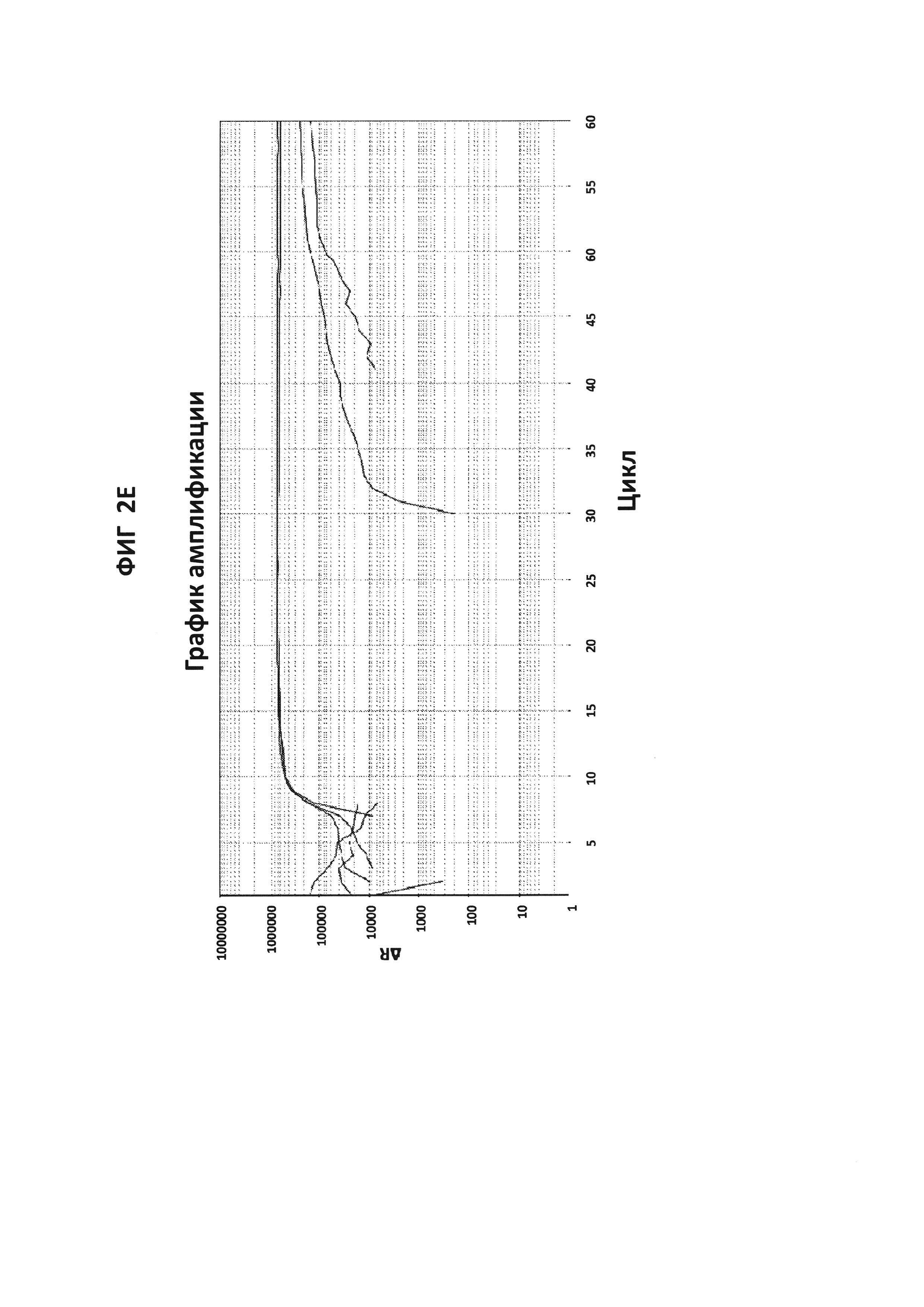
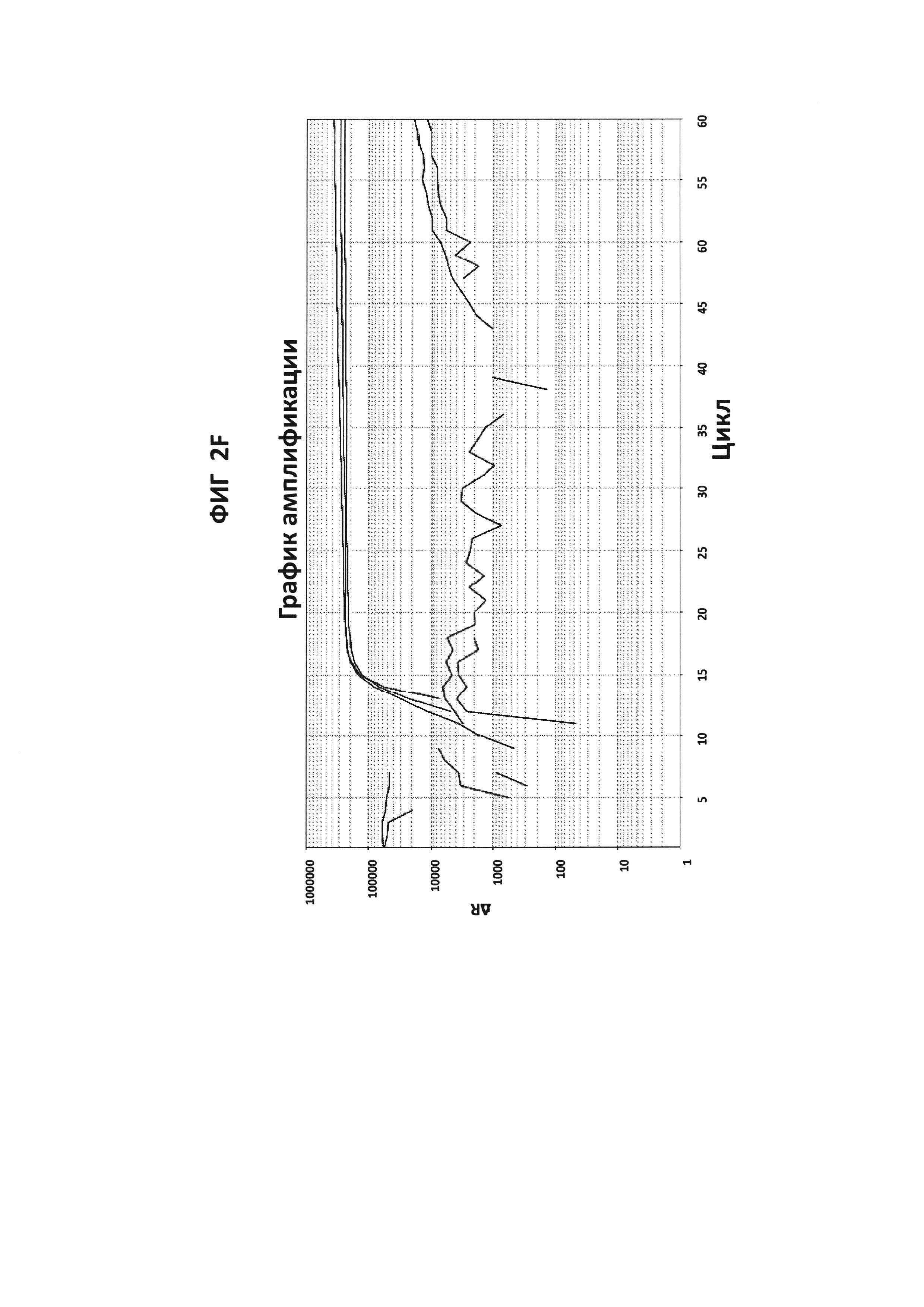
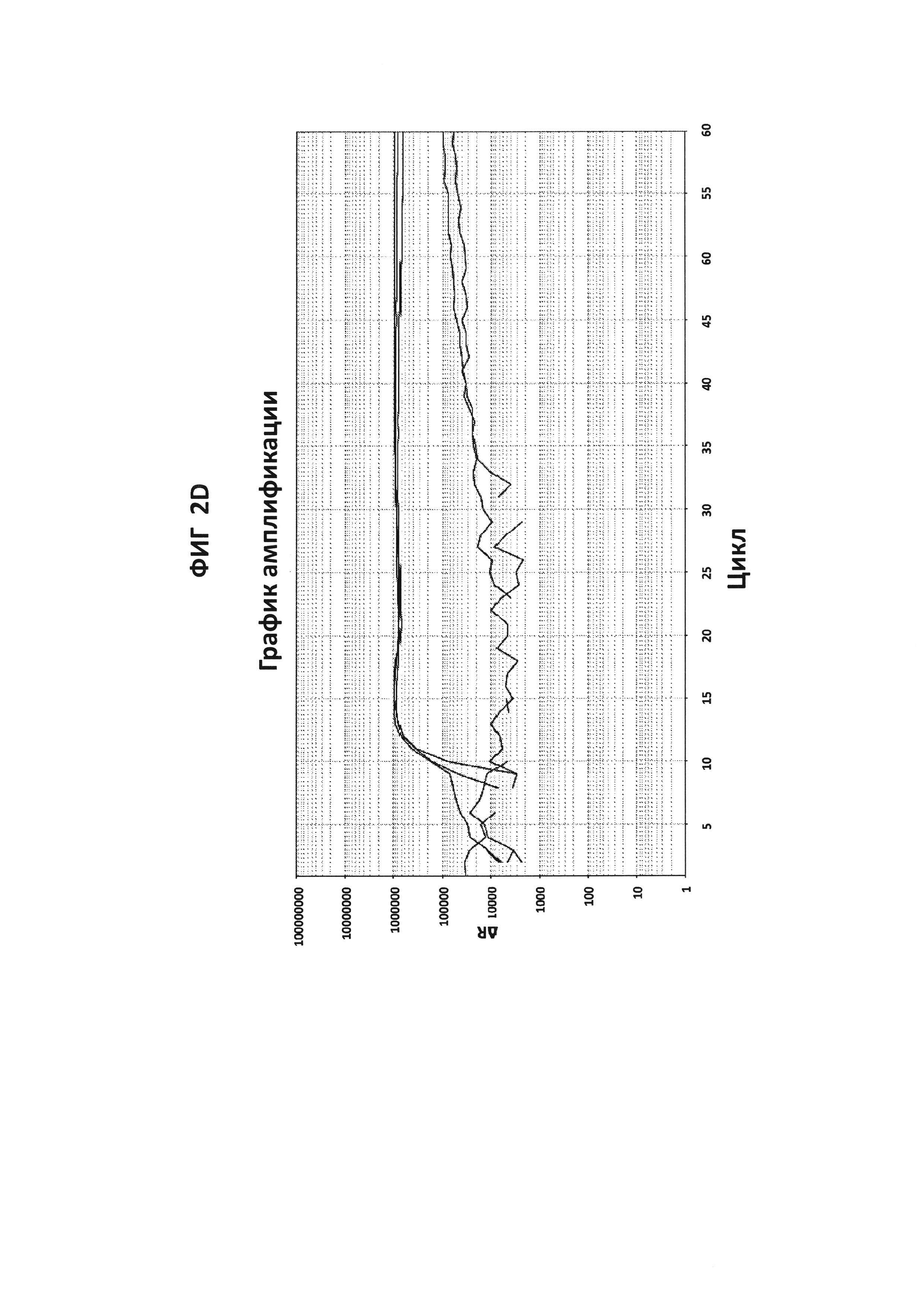
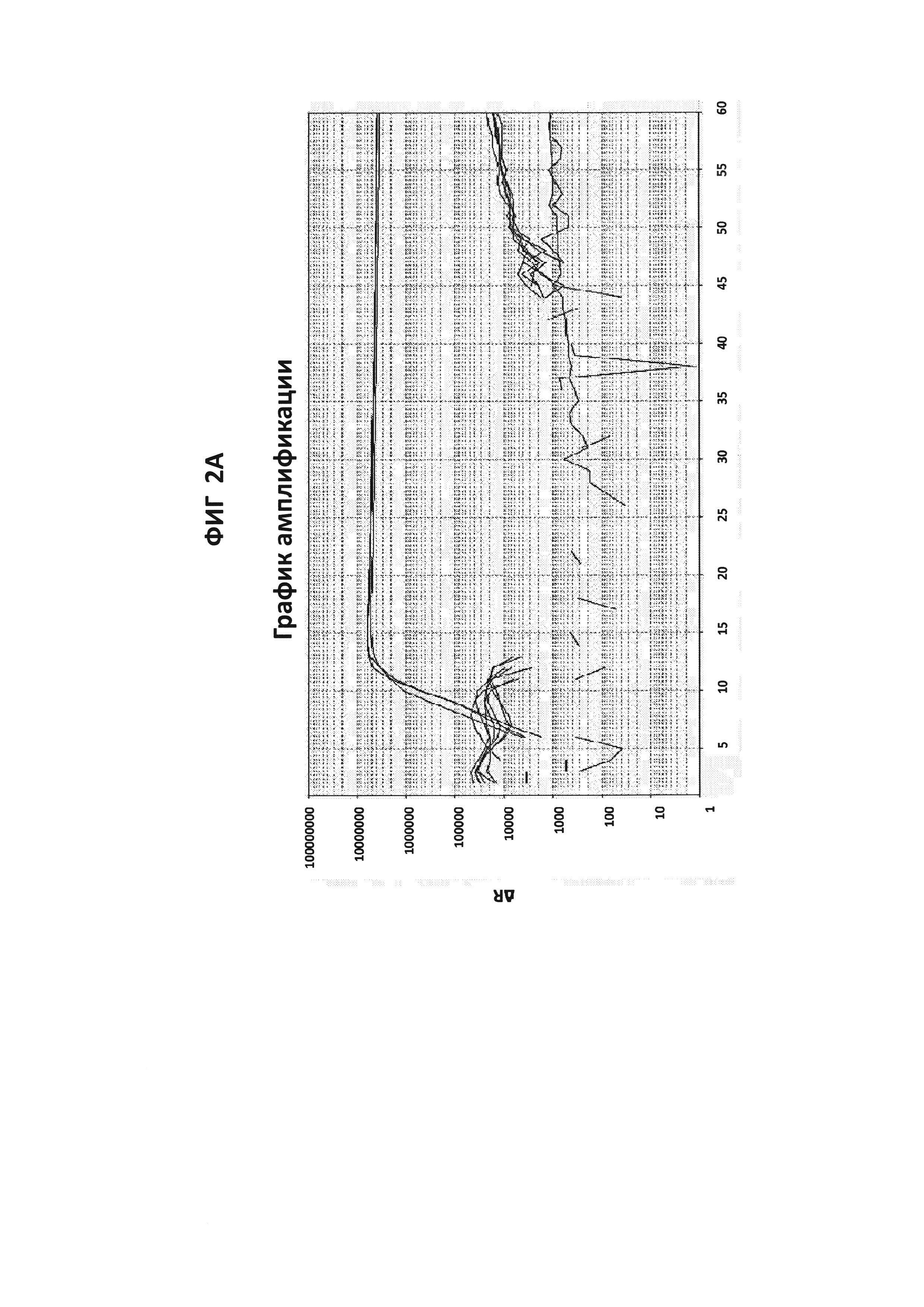
На фигурах от 2А до 2F приведены графики амплификации, полученные с СТ РВ1-праймерами (фигура 2А и фигура 2D), GC glnA7-праймерами (фигура 2В и фигура 2Е) и GC porA7-праймерами (фигура 2С и фигура 2F) в буфере V6.21, содержащем V13 (фигуры 2А, 2В и 2С), или буфере V6.21p без красителя V13 (фигуры 2D, 2Е и 2F). Целевые последовательности показаны в SEQ ID NO: от 8 до 10, с СТ РВ1-внутренним зондом, конъюгированным с FAM, GC glnA7-петлевым зондом, конъюгированным с Joe, и GC porA7-петлевым зондом, конъюгированным с Alexa546, соответственно. Все реакции проводили в течение 60 мин при постоянной температуре 63°C с прибором ABI7500.
Пример 2
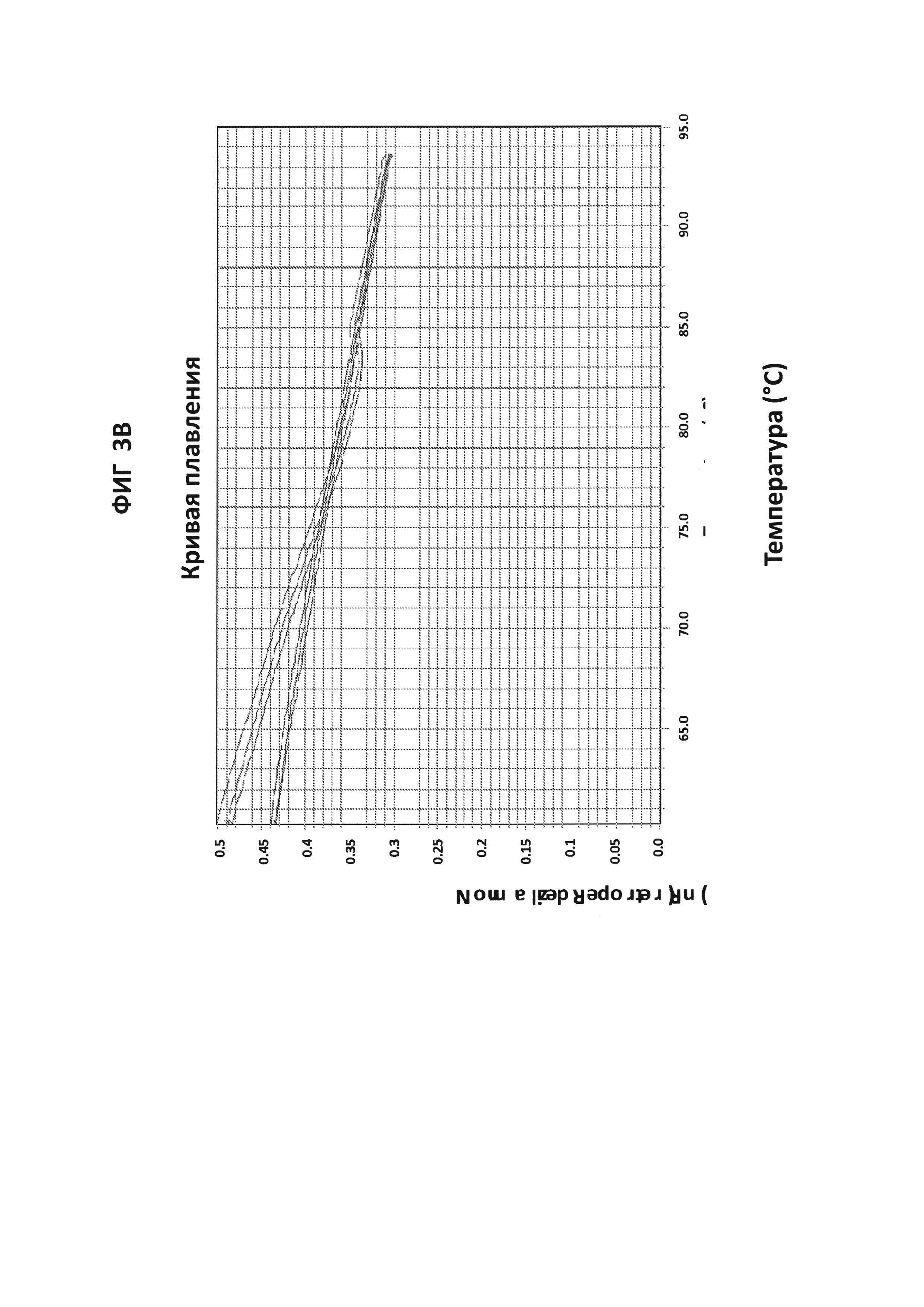
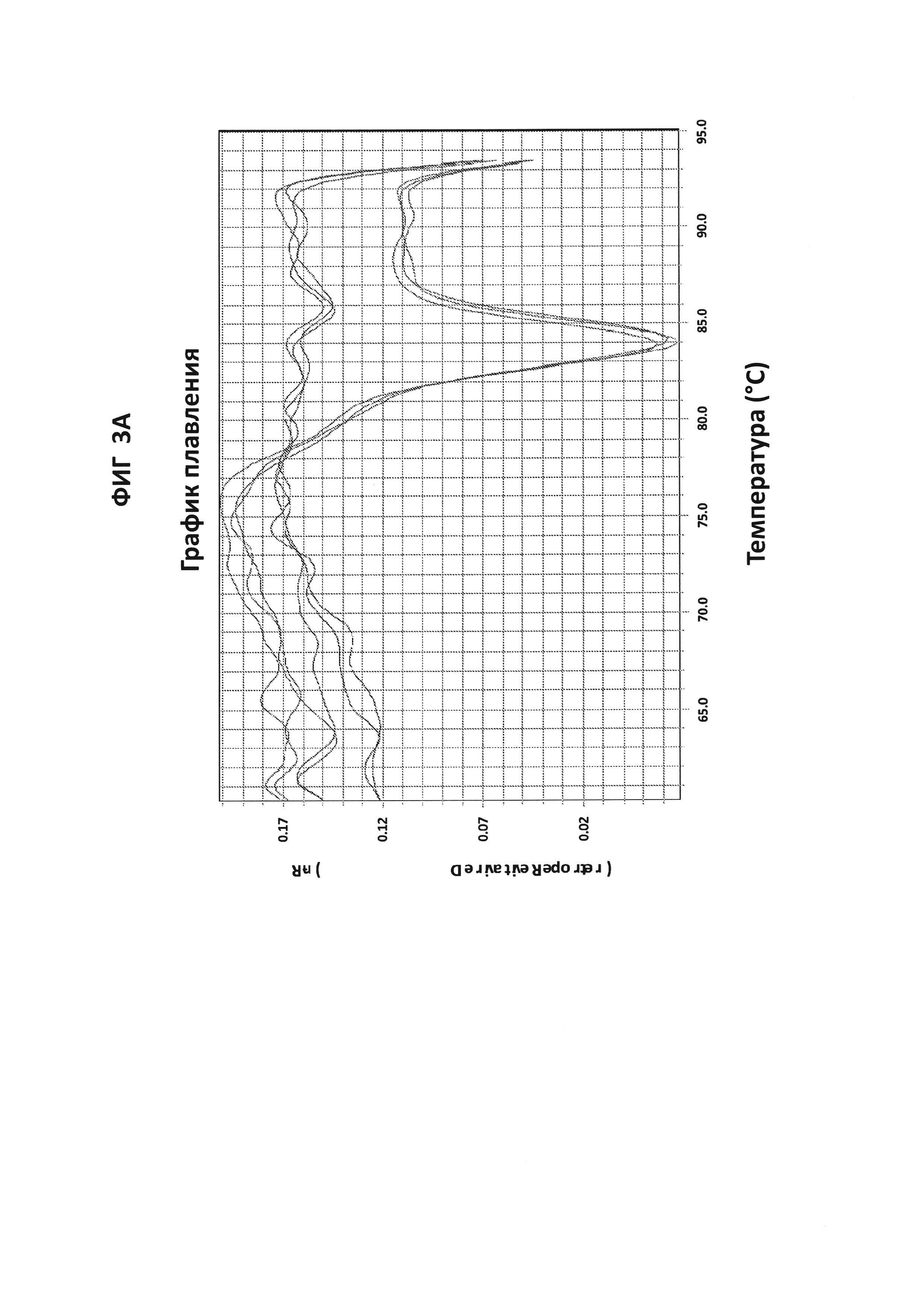
Фигуры 3А и 3В представляют собой анализы кривых плавления LAMP-продуктов, образующихся с праймерами СТ РВ1 в присутствии СТ РВ1-внутреннего зонда, конъюгированного с FAM. 100 пг на реакцию стандартной АТТС СТ ДНК использовали в качестве положительного контроля. А - нормированный репортерный график, В -производный репортерный график. Графики кривых плавления были получены на основе считываний в канале FAM с прибором ABI7500.
Пример 3
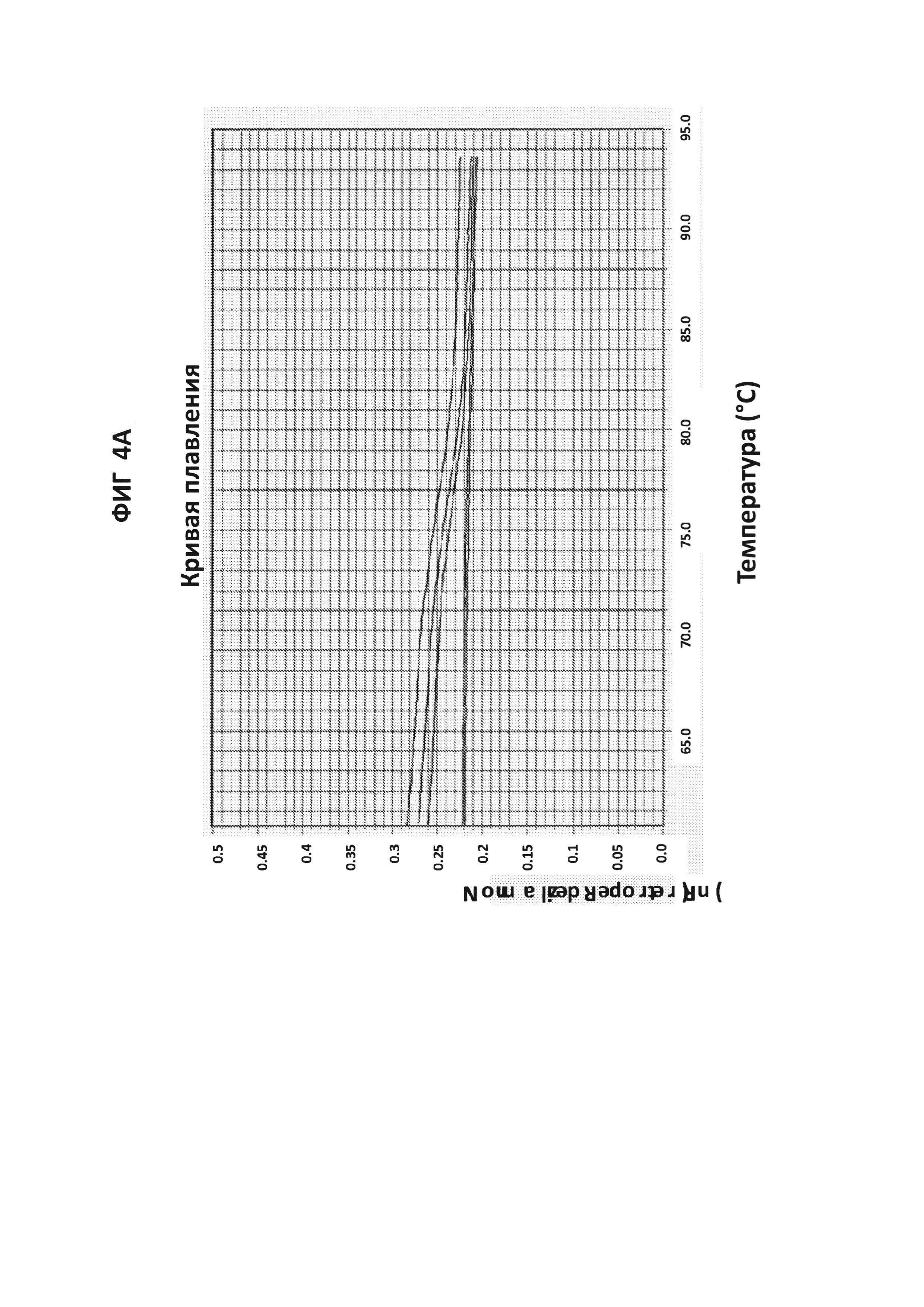
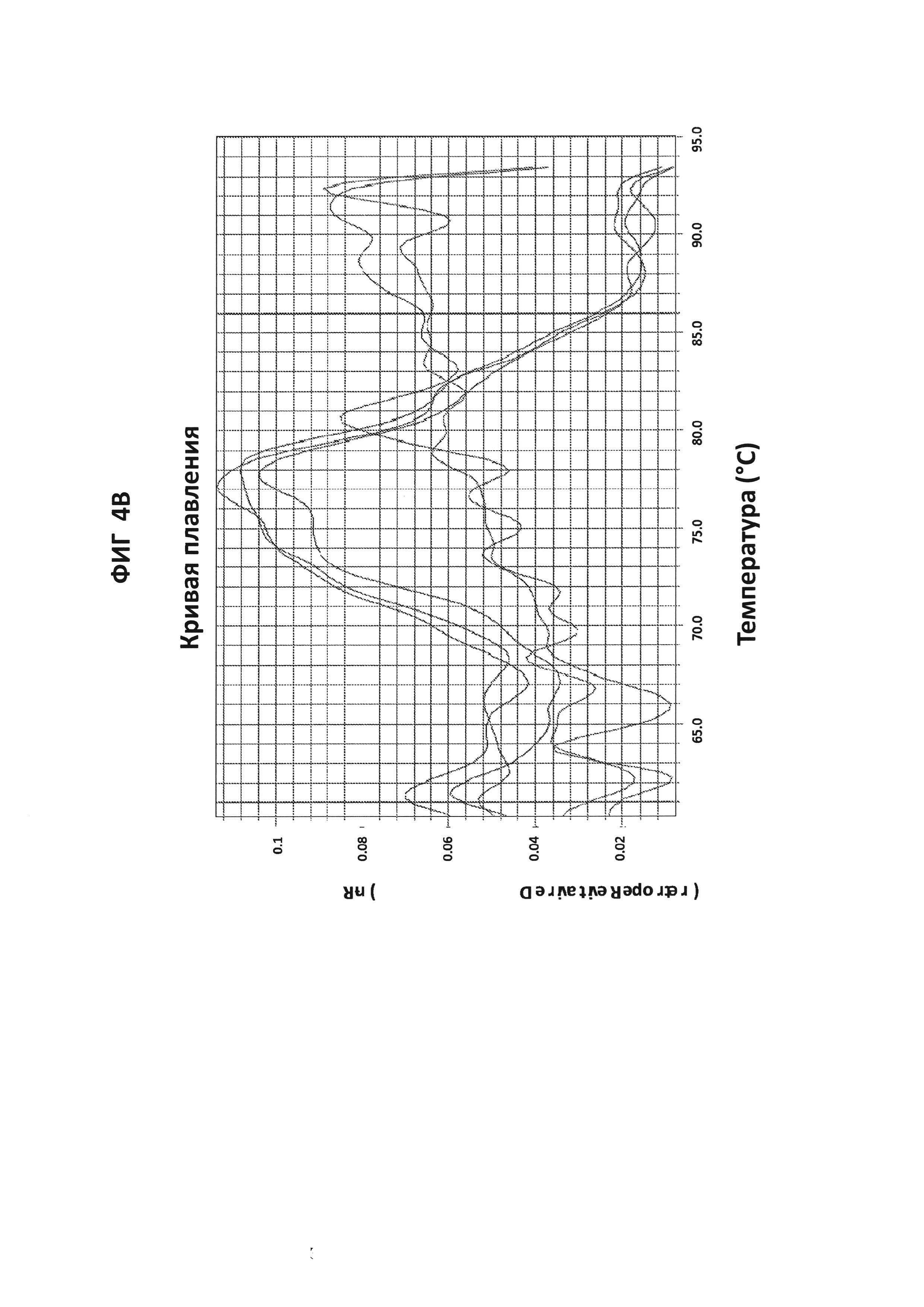
На фигурах 4А и В представлены анализы кривых плавления LAMP-продукта, образовавшегося с праймерами GC glnA7 в присутствии GC glnA7-петлевого зонда, конъюгированного с JOE. 100 пг на реакцию стандартной АТТС GC ДНК использовали в качестве положительного контроля. На фигуре 4А приведен нормированный репортерный график, и на фигуре 4 В приведен производный репортерный график. Графики кривых плавления были получены на основе считываний в канале JOE с прибором ABI7500.
Пример 4
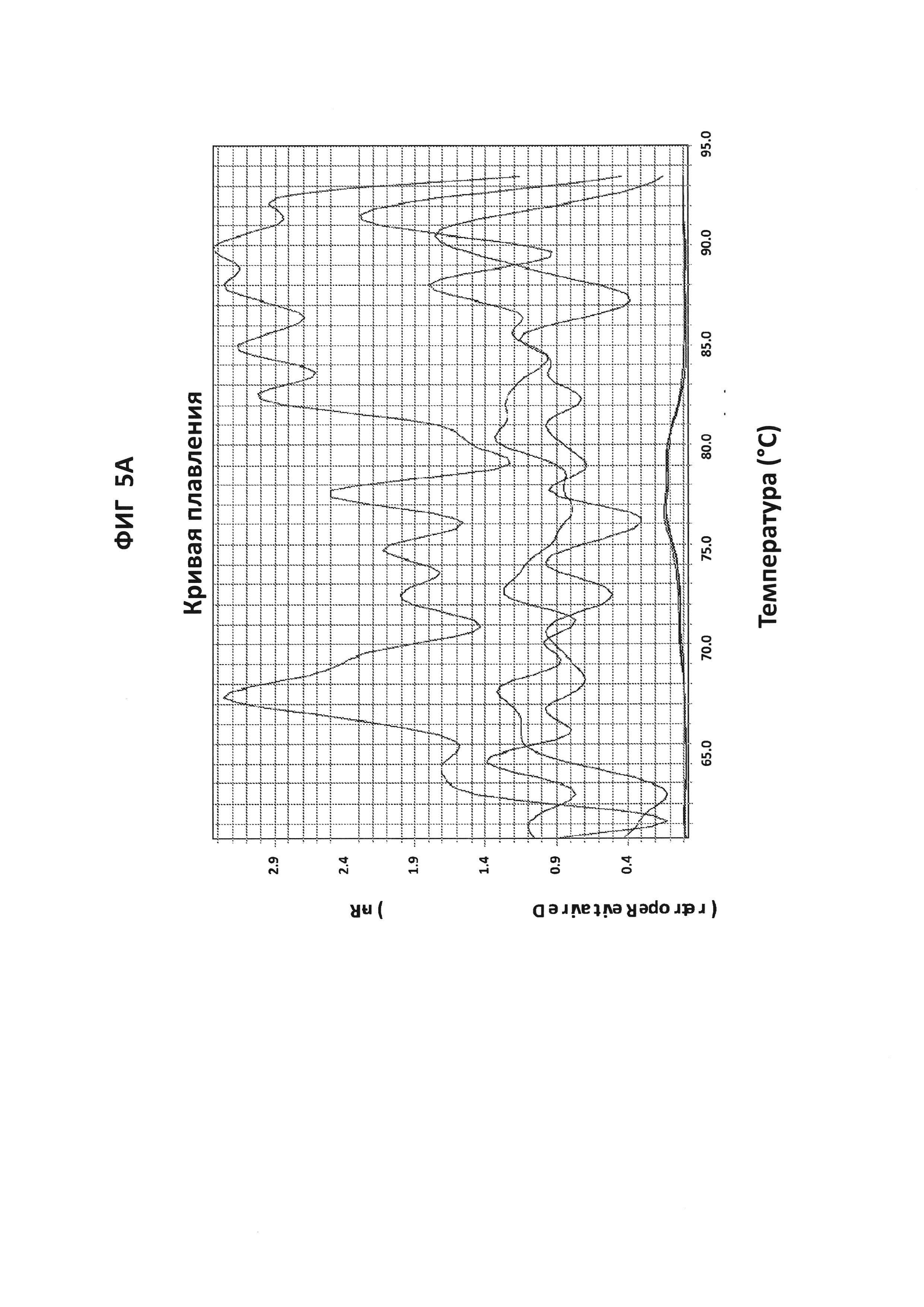
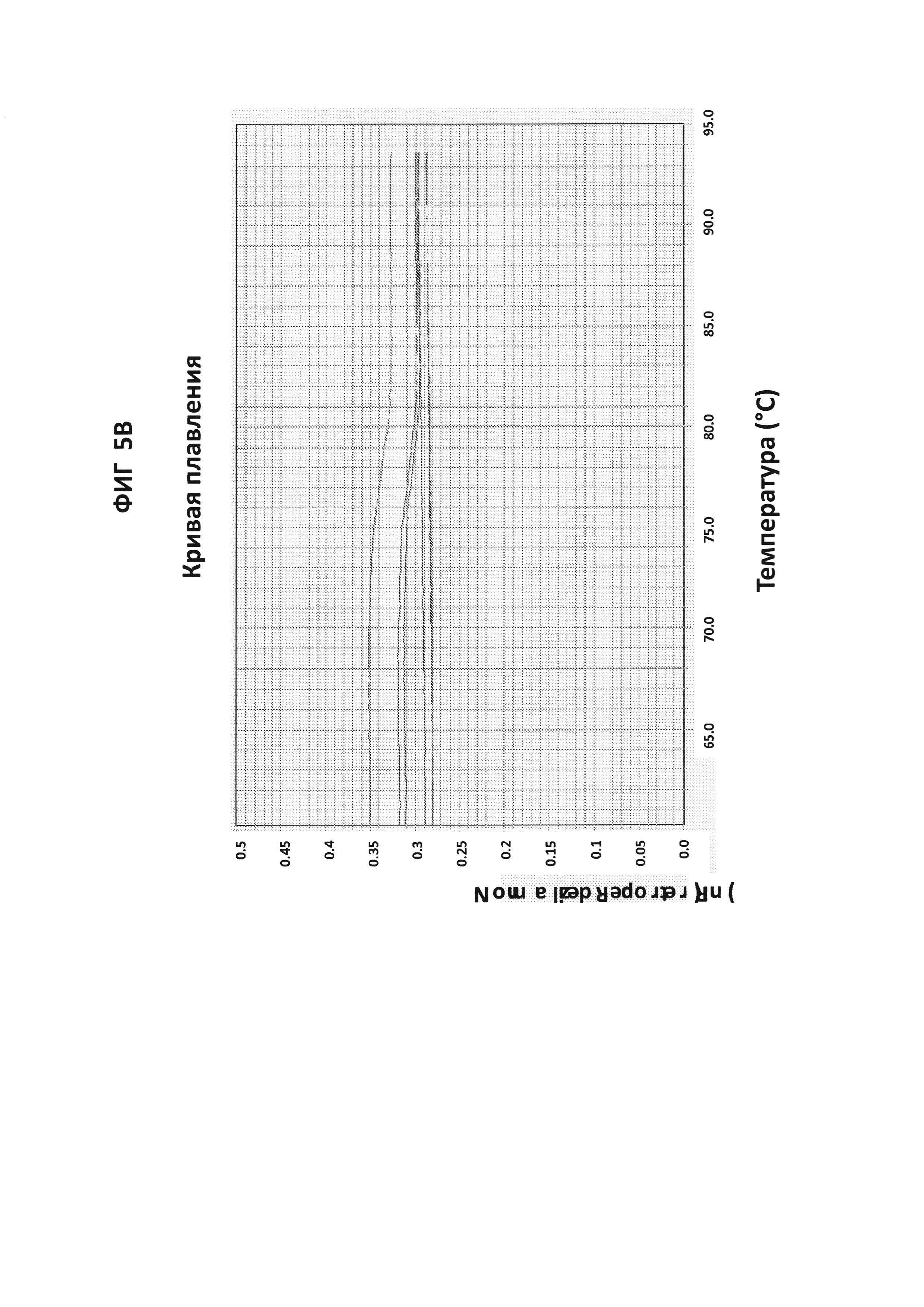
Фигуры 5А и 5В представляют собой анализы кривых плавления LAMP-продукта, образовавшегося с праймерами GC porA7 в присутствии GC porA7-петлевого зонда, конъюгированного с ALEXA546. 100 пг на реакцию стандартной АТТС GC ДНК использовали в качестве положительного контроля. На фигуре 5А приведен нормированный репортерный график и на фигуре 5В производный репортерный график. Графики кривых плавления были получены на основе считываний в канале Су3 с прибором ABI7500
Пример 5
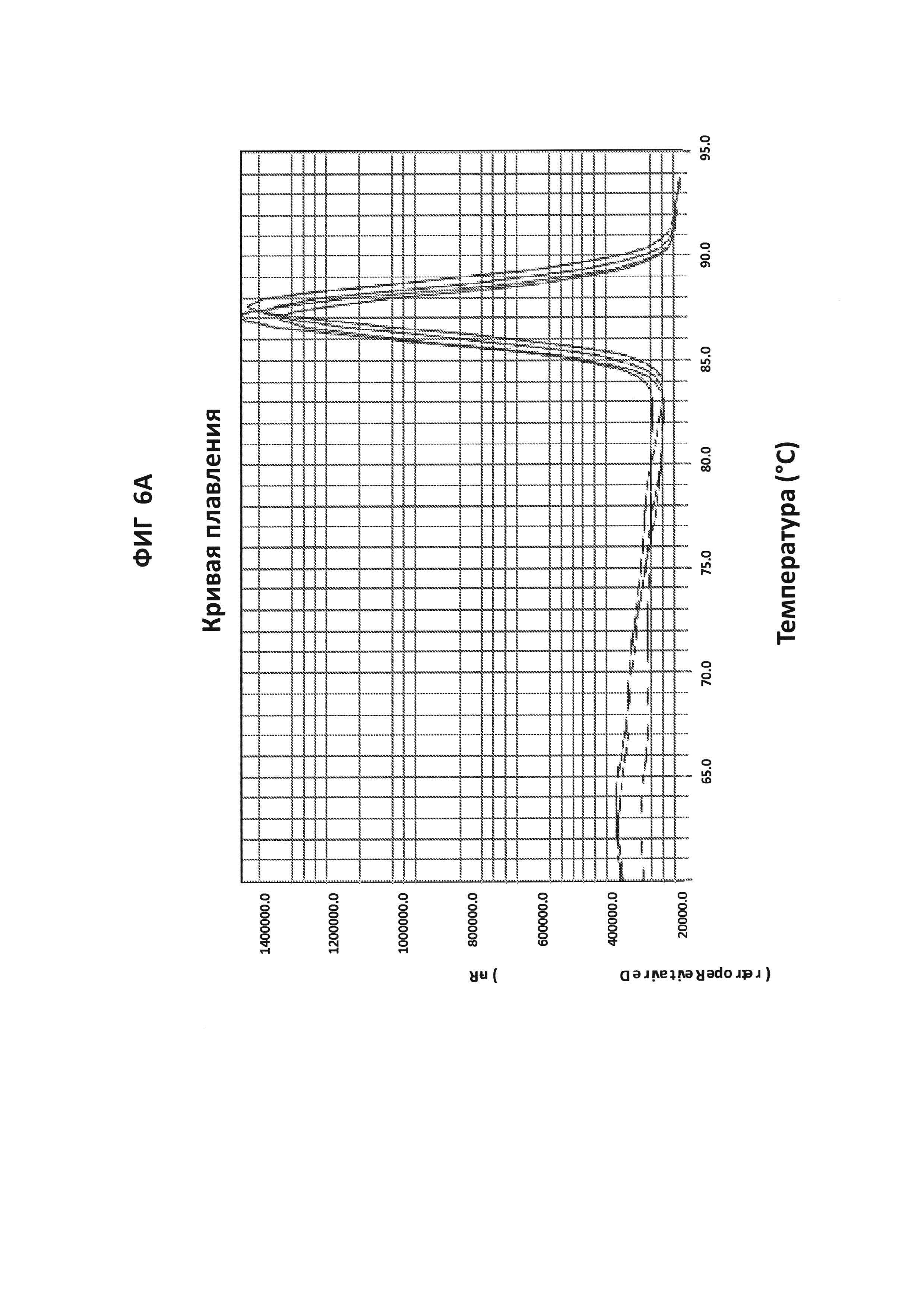
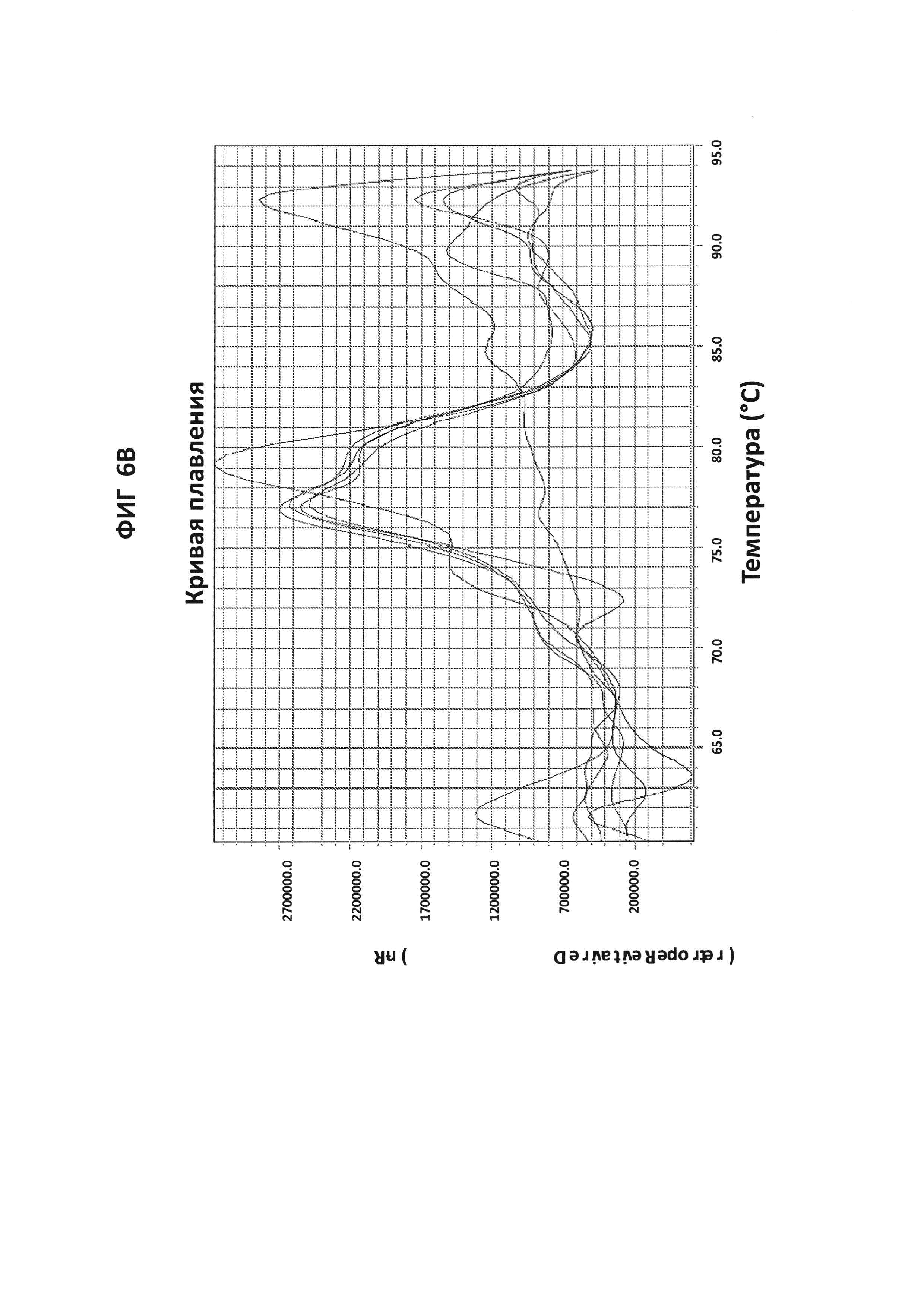
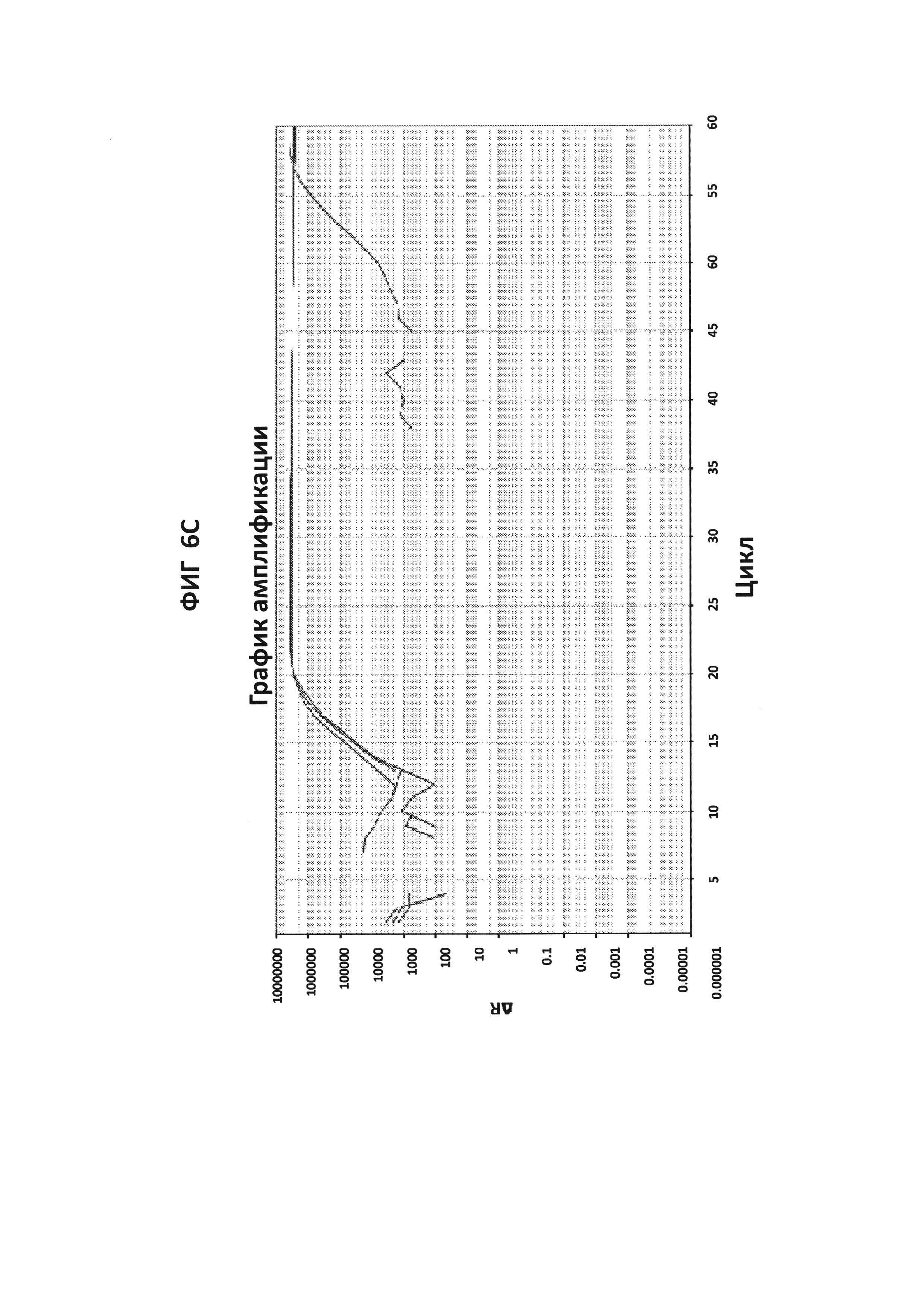
На фигурах 6A-6D показаны результаты теста для подтверждения специфичности ДНК-продукта с зондом по изобретению в петлевой изотермической амплификации. Запаздывание амплификации в ложно-положительных случаях (более чем на 30 минут относительно самой низкой концентрации ДНК-мишени, выявляемой в LAMP-реакции (100 фг GC ДНК), указывает на то, что неспецифическая амплификация может быть результатом образования димера праймера. Стандартный анализ кривой плавления не позволяет различать специфический и неспецифический продукт в данной LAMP-реакции, но неспецифический продукт может быть распознан с помощью зонда по изобретению. GC ДНК амплифицировали с помощью праймеров GC porA7 и визуализировали с помощью красителя V13 или GC porA7-ALEXA546-зондом, в зависимости от обстоятельств.
Пример 6
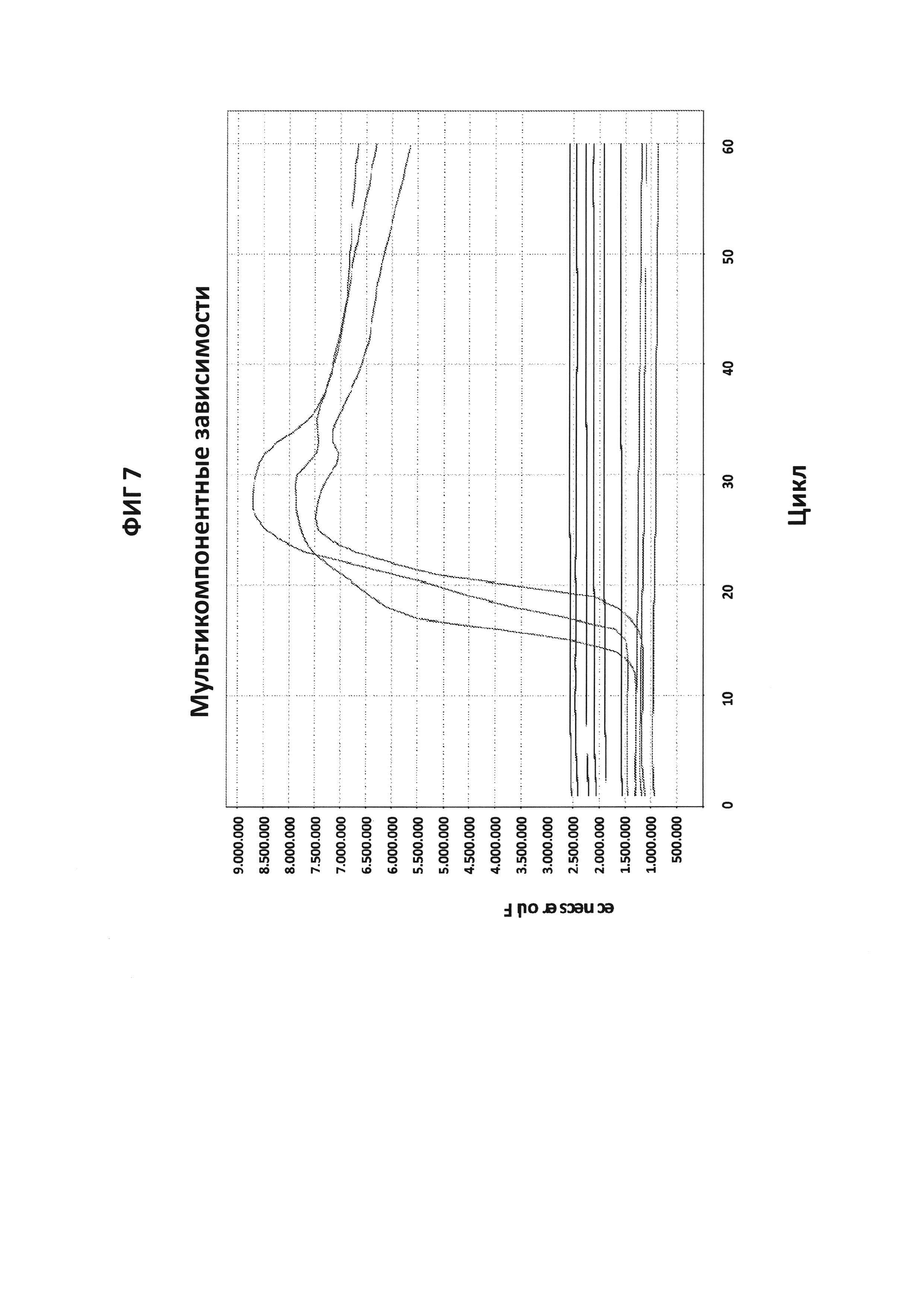
На фигуре 7 приведены графики амплификации, полученные с СТ РВ1-праймерами в буфере V6.21, содержащем V13, или буфере V6.21p без красителя V13, но при наличии СТ РВ1-терминального зонда (комплементарного к области петли) с внутренним С, конъюгированным с FAM, и 3'-терминатором (3'ddC). Несмотря на успешную амплификацию ДНК-мишени, подтвержденную возбуждением красителя V13 в контрольной реакции, зонд СТ РВ1 с 3'-терминатором не дает положительного сигнала.
Пример 7
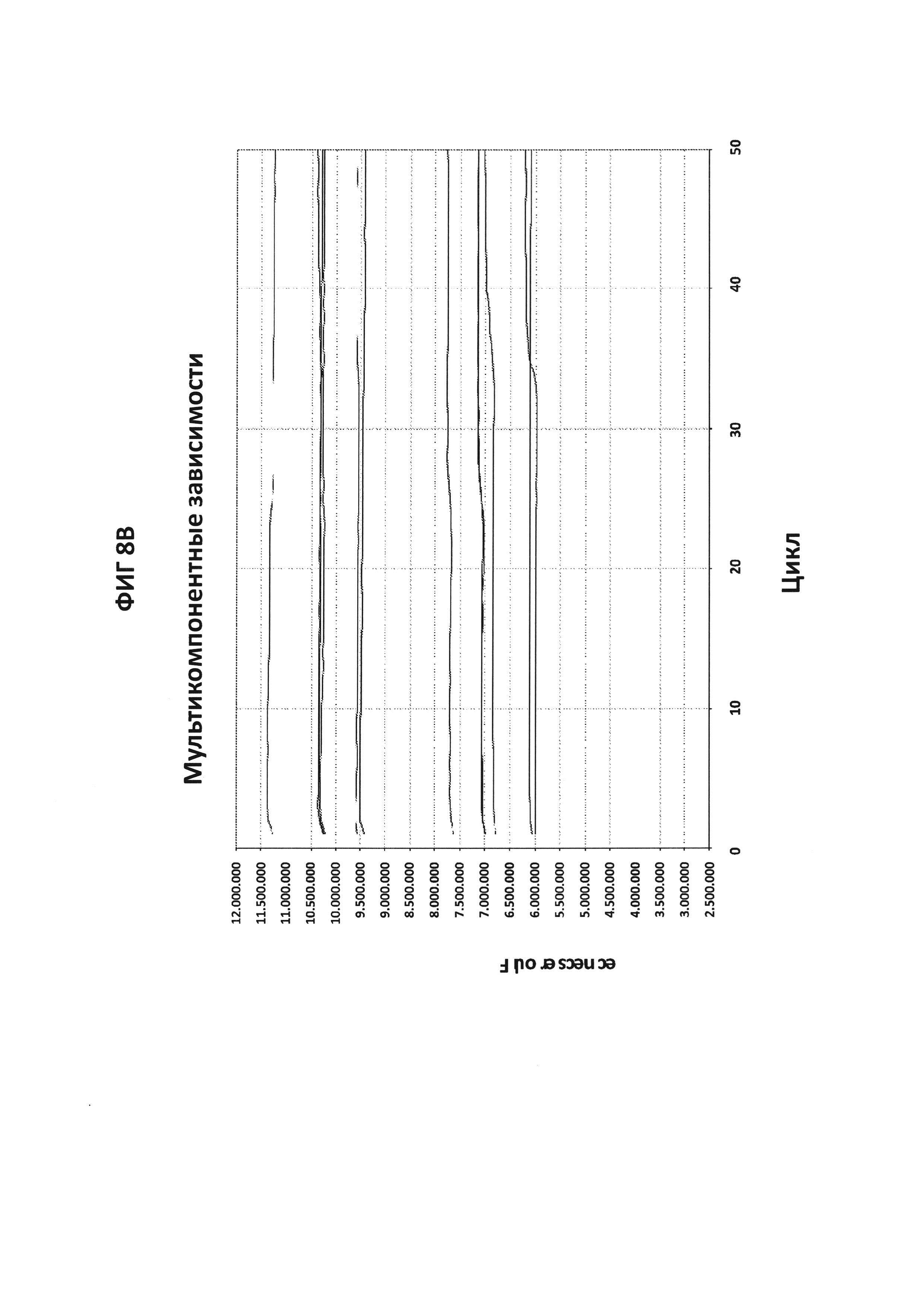
На фигурах 8А и 8В приведены графики амплификации, полученные в буфере V6.21p, содержащем ROX, в присутствии СТ PB1-праймеров и СТ РВ1-терминального зонда с внутренним цитозином, конъюгированным с FAM (фигура 8А), и универсальных праймеров и зонда 3'UP с 3'-терминальным цитозином, конъюгированным с FAM (фигура 8В). Первая кривая представляет собой сигналы, генерируемые ROX, а вторая кривая соответствует сигналу, генерируемому в канале FAM. Связывание зонда с изнутри меченным цитозином с ДНК-мишенью приводит к возбуждению FAM. Связывание зонда с меченным на 3'-конце цитозином с мишенью не изменяет возбужденное состояние FAM.
Пример 8
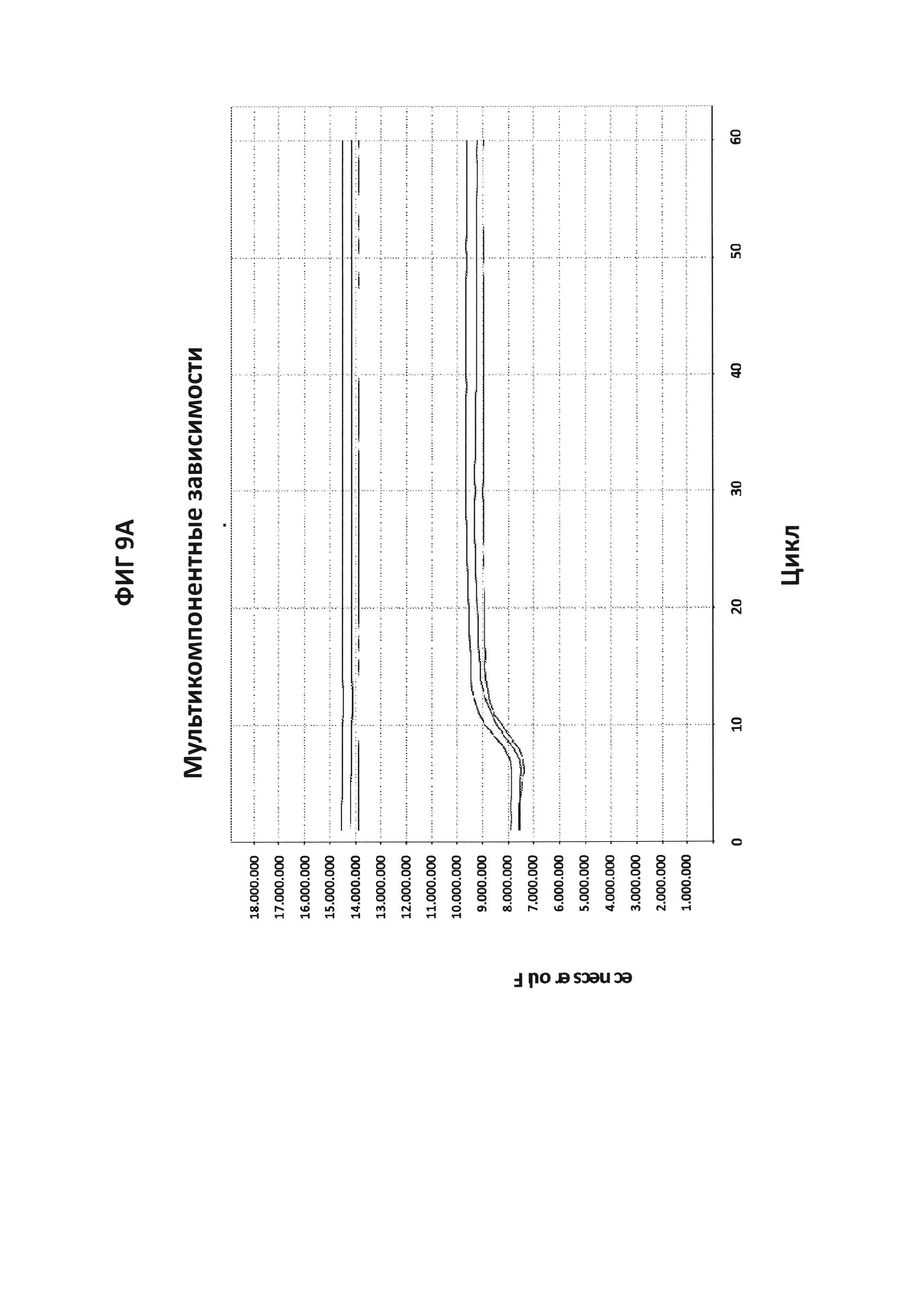
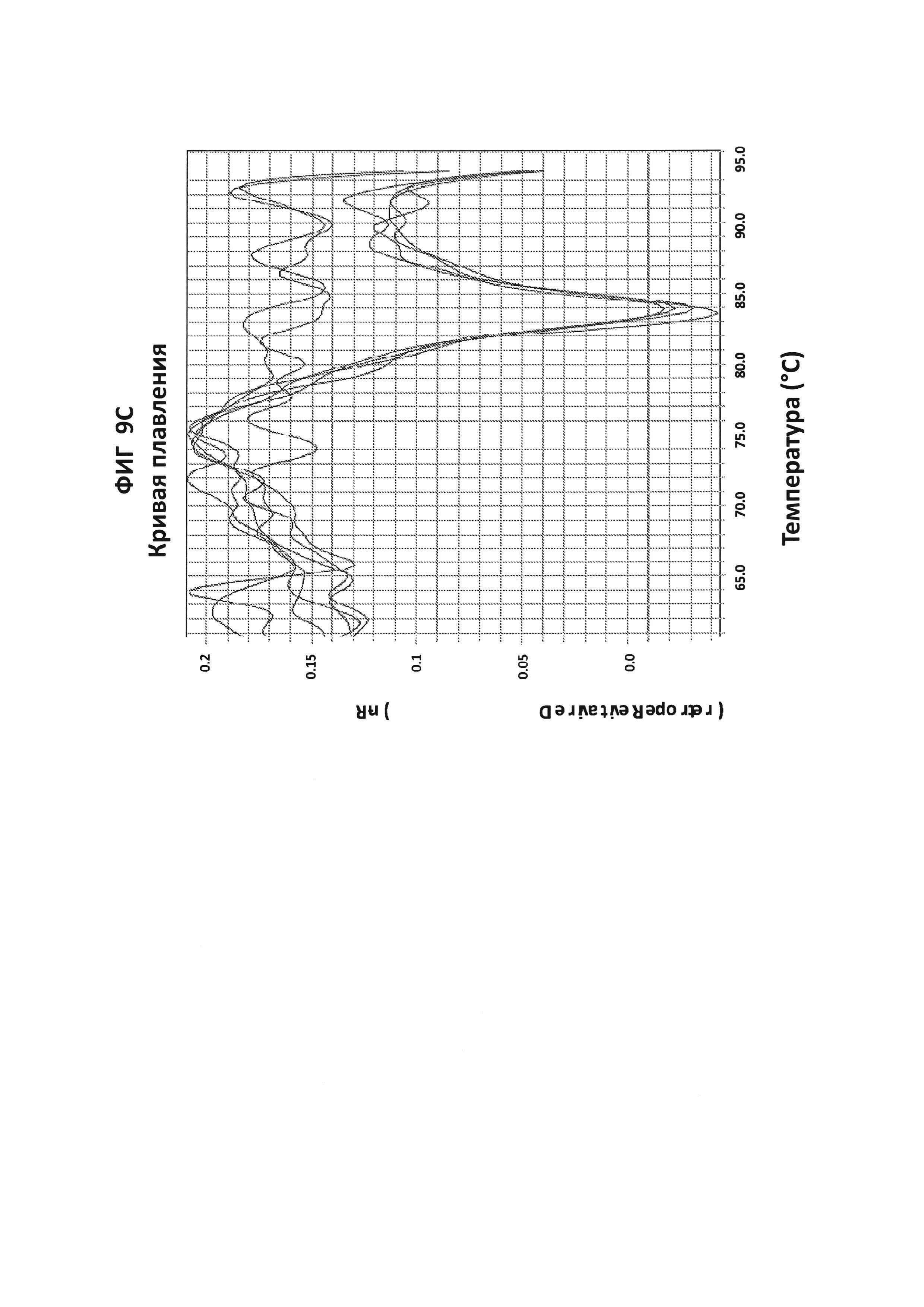
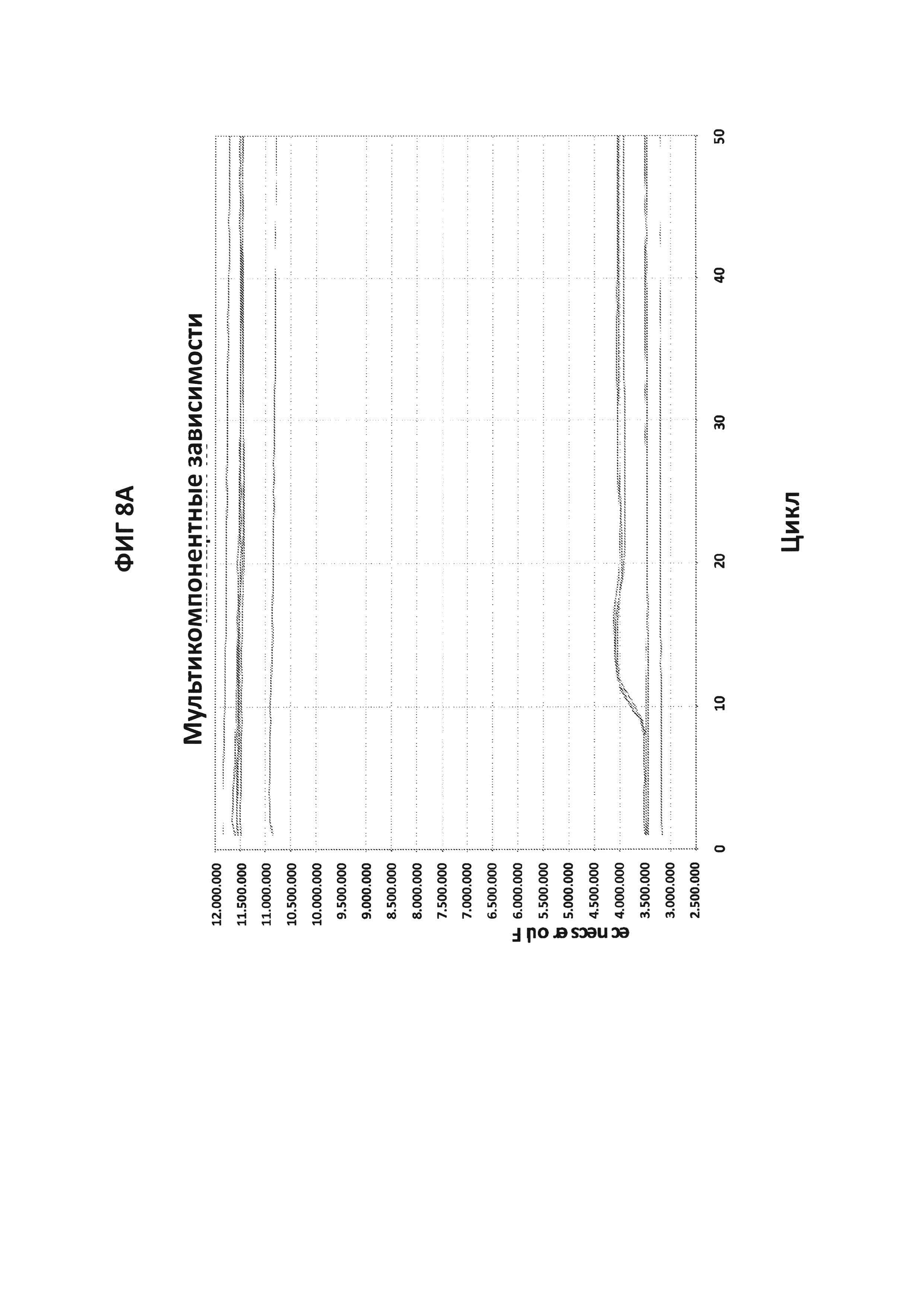
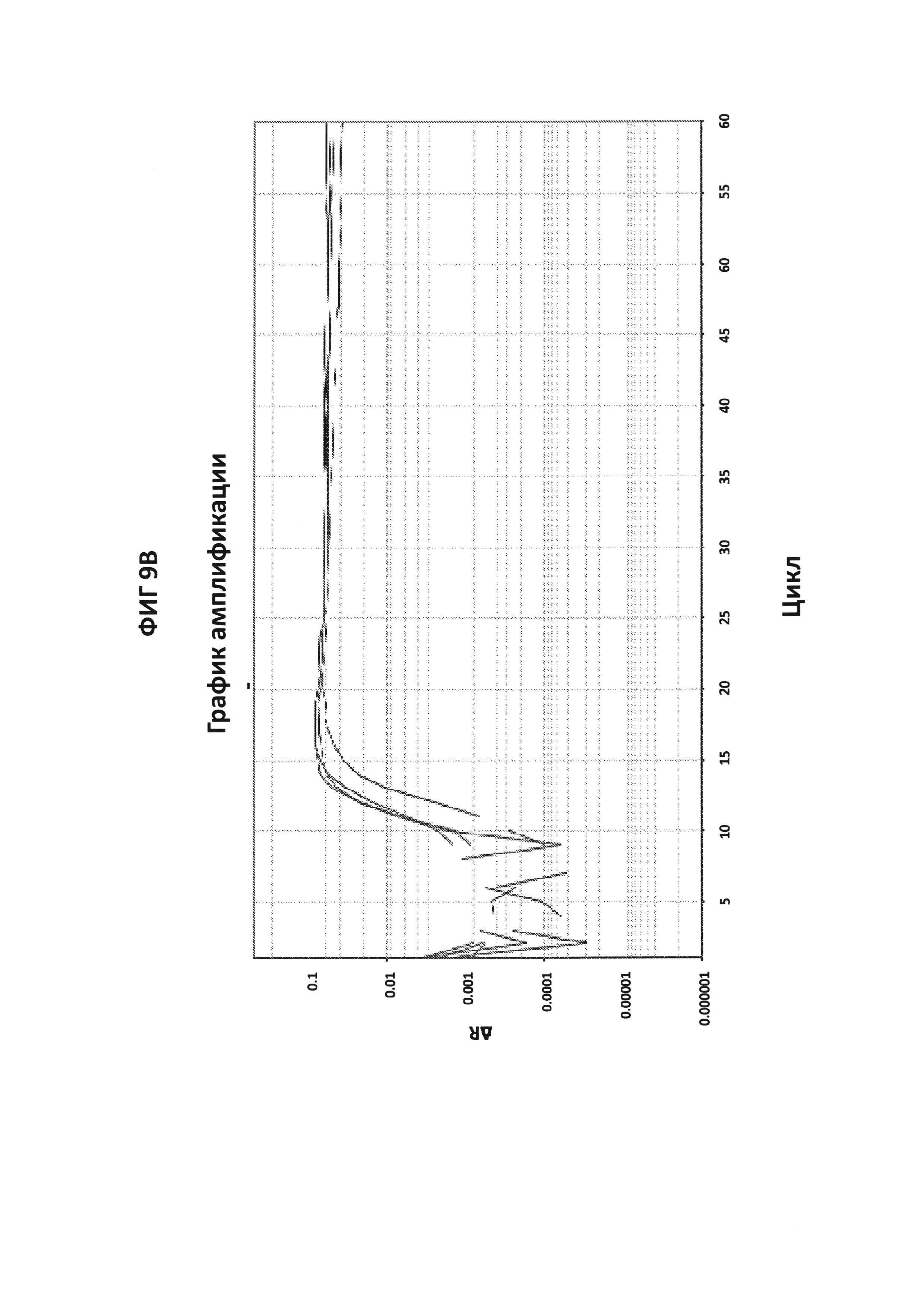
На фигурах 9А-9С приведены графики амплификации, полученные с СТ РВ1-праймерами в буфере V6.21p без V13 в присутствии СТ РВ1-внутреннего зонда с внутренним С, конъюгированным с FAM, и эталонного красителя (ROX). На фигуре 9А приведены необработанные данные, считывания из канала FAM в первой линии и из канала ROX во второй линии. На фигуре 9В приведены графики амплификации (генерируемые в канале FAM), нормированные в отношении ROX. На фигуре 9С приведены производные репортерные графики кривых плавления.
Пример 9
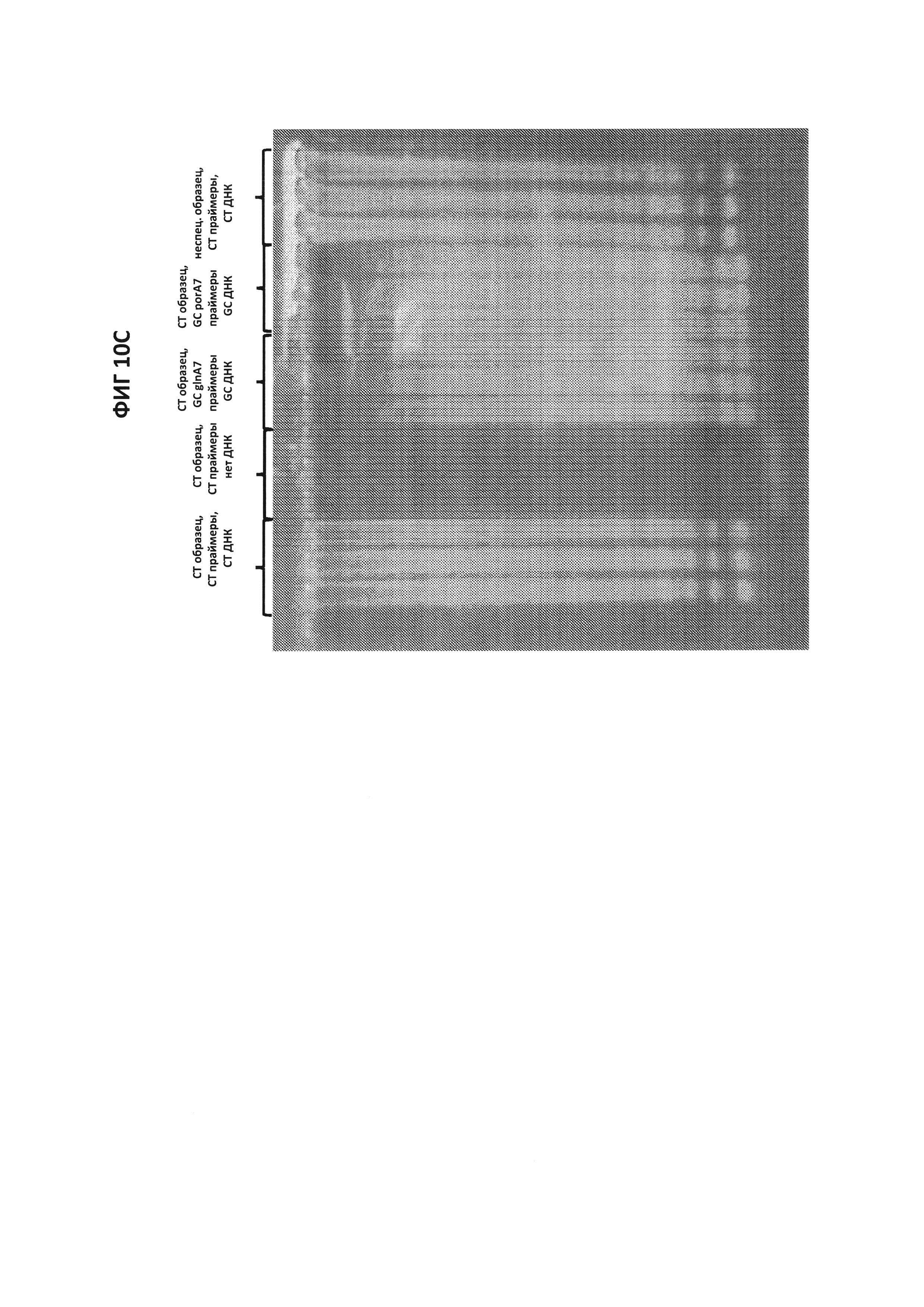
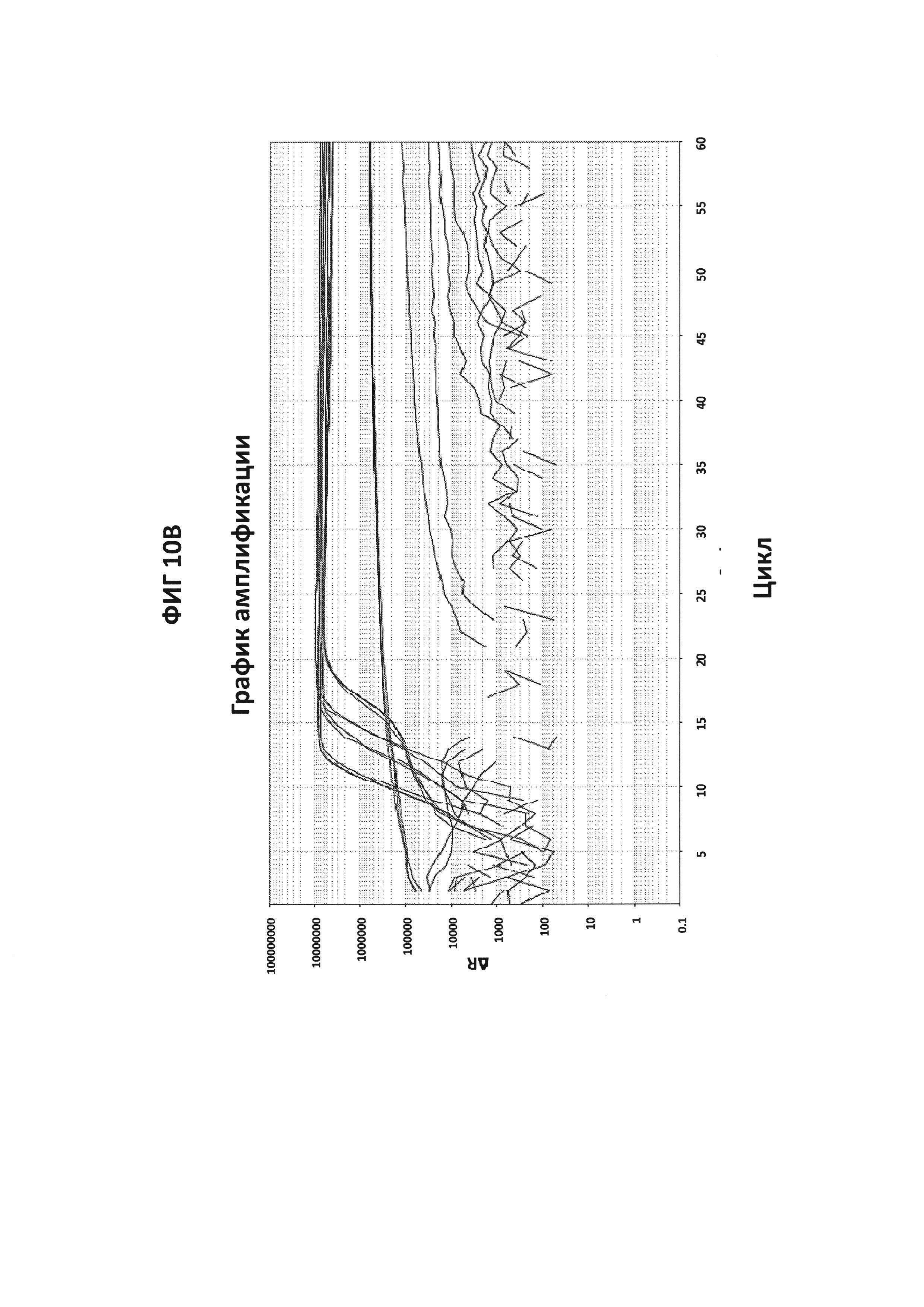
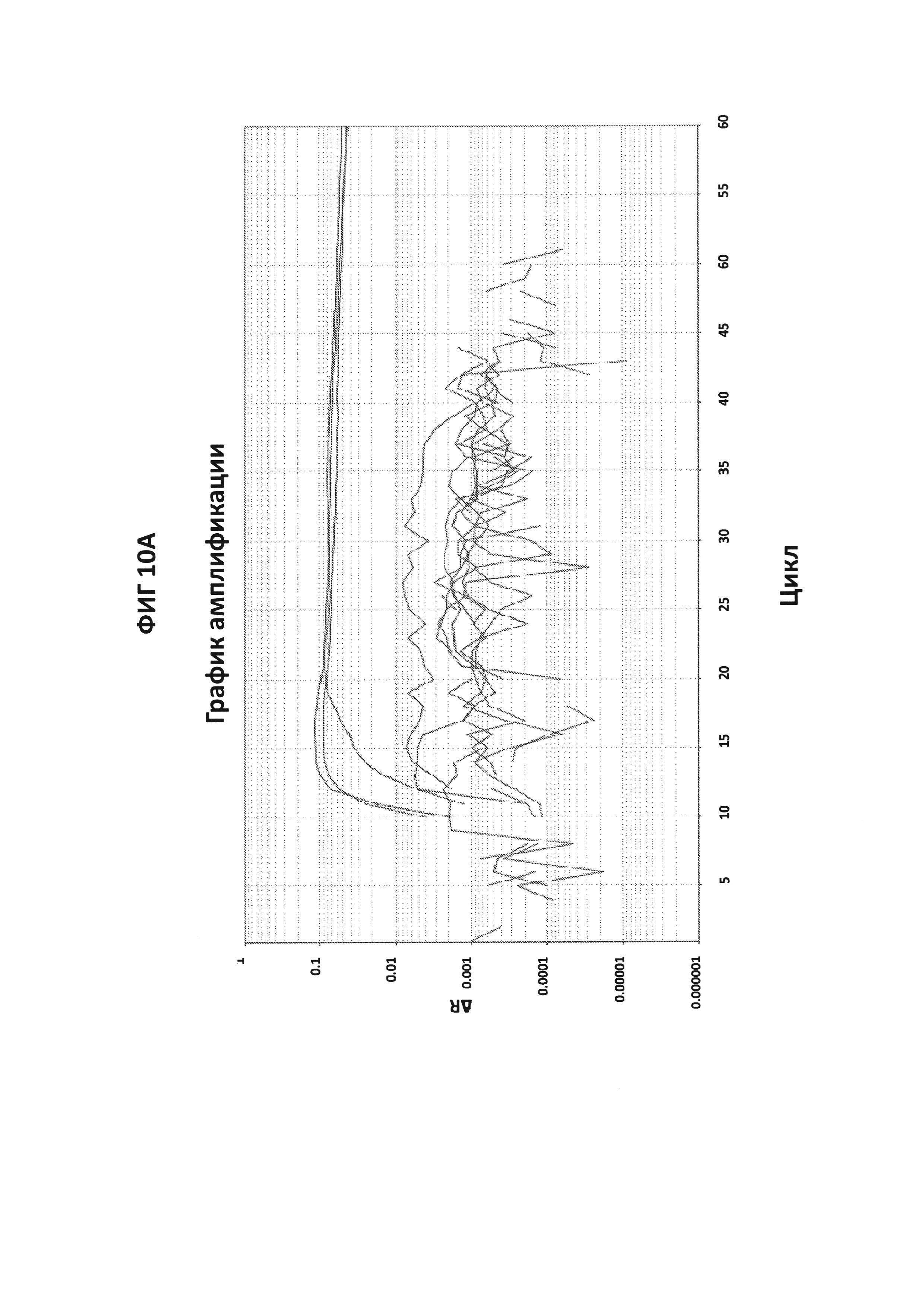
На фигурах 10А-10С представлены результаты проверки специфичности зонда СТ PB1-FAM. На фигуре 10А приведены графики амплификации, полученные с помощью зонда СТ PB1-FAM в присутствии СТ ДНК и СТ-праймеров. В качестве контроля, были проведены два набора реакций, где неспецифические гены, GC glnA7 и GC porA7, амплифицировались с соответствующими LAMP-праймерами в присутствии зонда СТ PB1-FAM. При проведении эксперимента в буфере V6.21p, графики амплификации в присутствии зонда СТ РВ1 в канале FAM были получены только в том случае, когда в реакционной смеси присутствовала СТ ДНК, и сигнал не генерировался, когда амплифицировались неспецифические гены (GC glnA7 и GC porA7). Сигнал также не генерировался, когда в реакции использовали неспецифической зонд, где СТ ДНК амплифицировали с помощью СТ-праймеров. На фигуре 10С приведены данные, полученные в аналогичном эксперименте, но проведенном в буфере V6.21, содержащем интеркалирующий краситель V31. На фигуре 10С показаны ДНК-продукты, генерируемые в эксперименте, описанном на фигуре 10A.
Пример 10
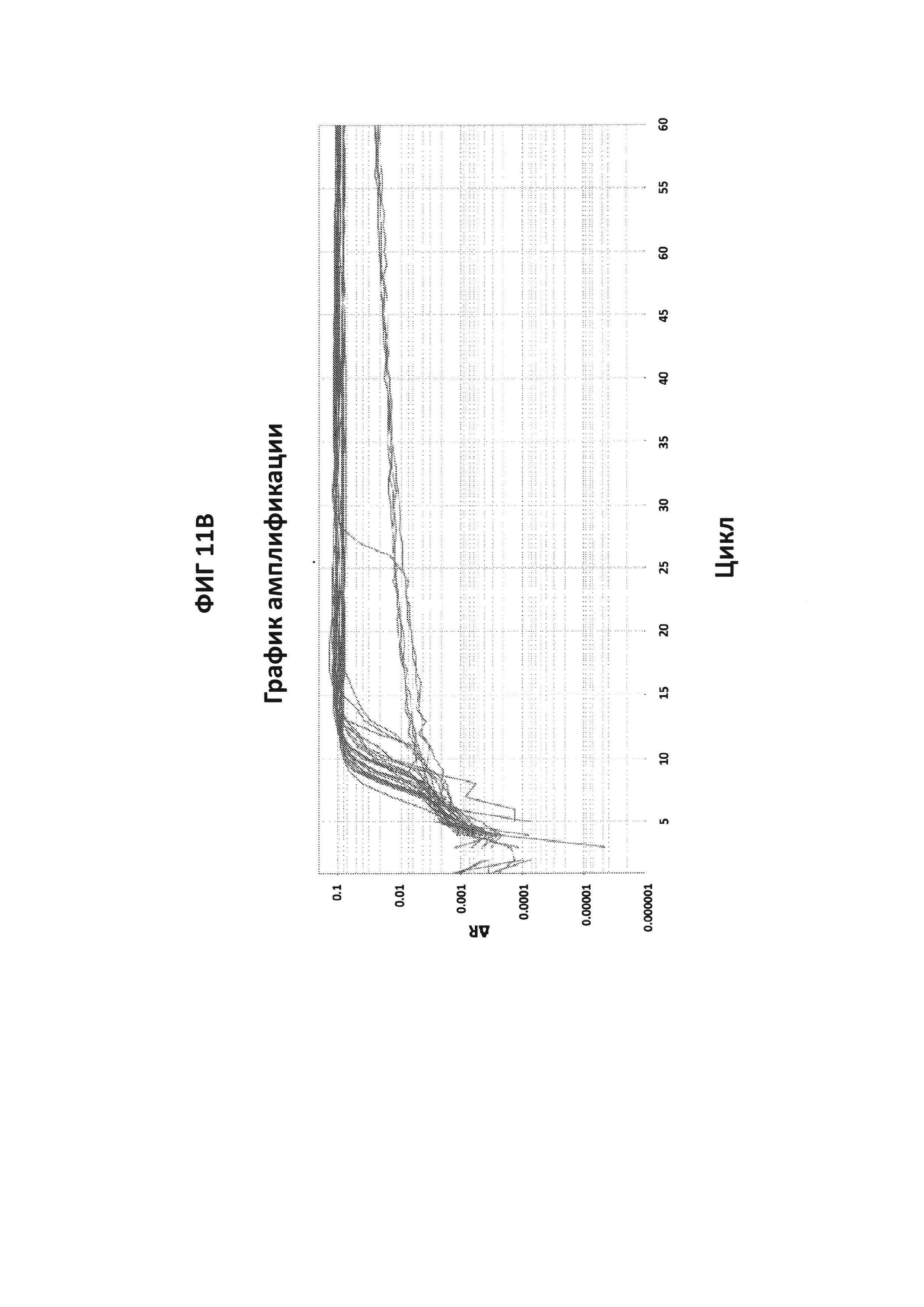
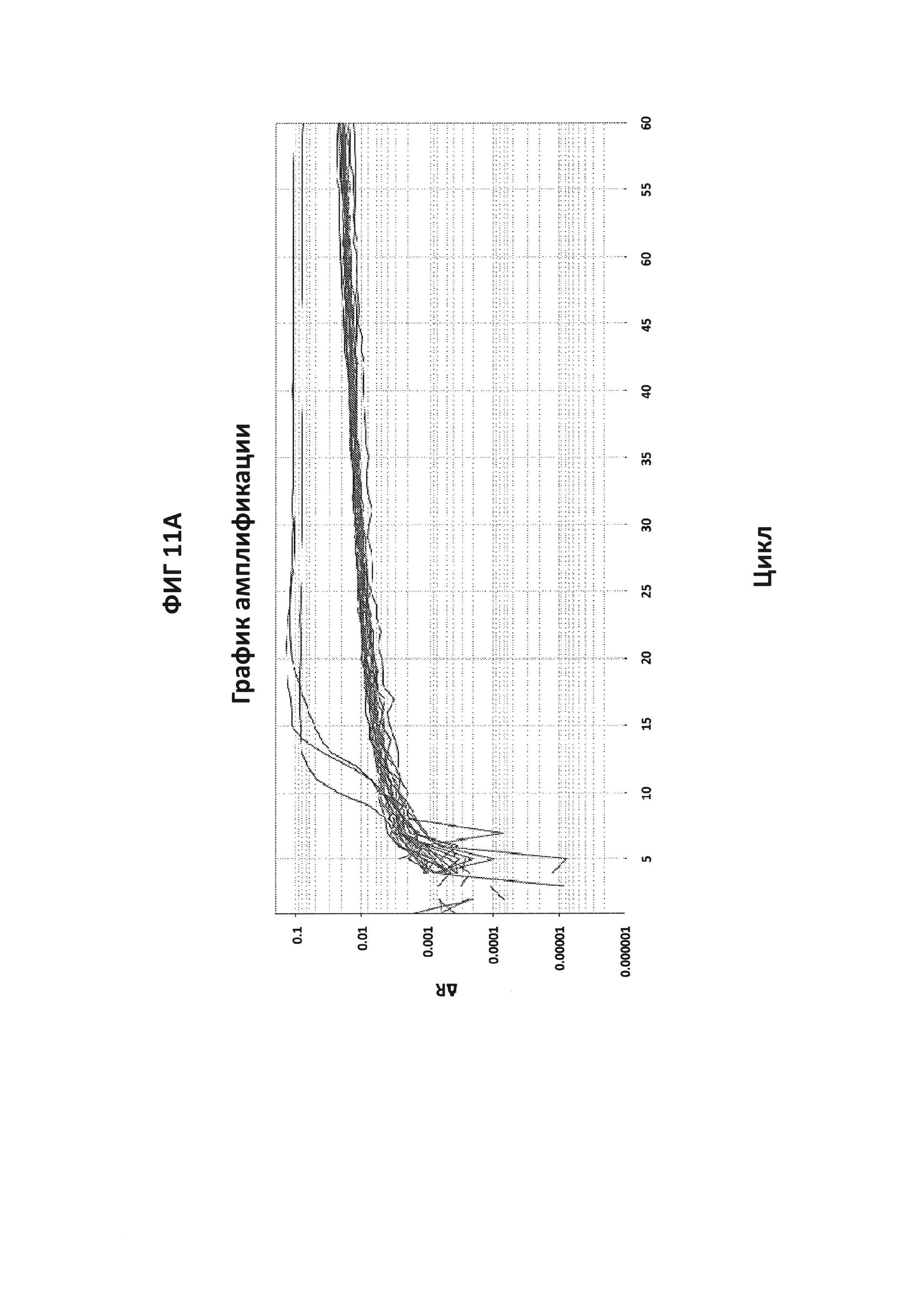
На фигурах 11А и 11В представлены результаты проверки специфичности зонда СТ PB1-FAM в отношении анализа APTIMA СТ. Пятьдесят клинических образцов, подтвержденных как дающие положительный ответ (n=29) (фигура 11А) или дающие отрицательный ответ (n=21) (фигура 11В) на СТ, были протестированы в буфере V6.21p с зондом СТ PB1-FAM. Из 50 образцов 24 дали отрицательный результат (фигура 11А) и 26 дали положительный результат (фигура 11В) для СТ с зондом СТ PB1-FAM. Имелось 86%-ное согласие между тестами Aptima и СТ PB-FAM.
Пример 11
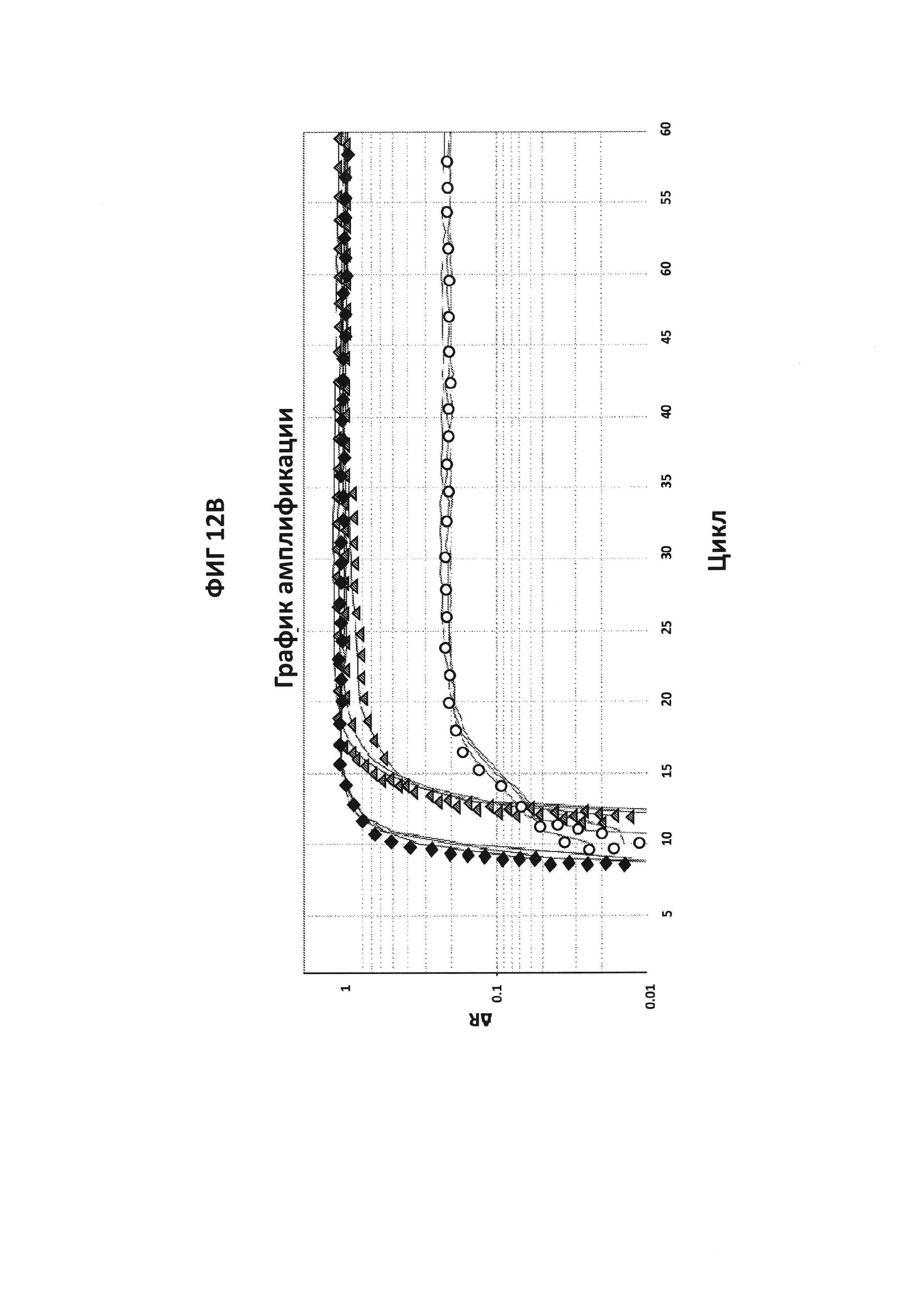
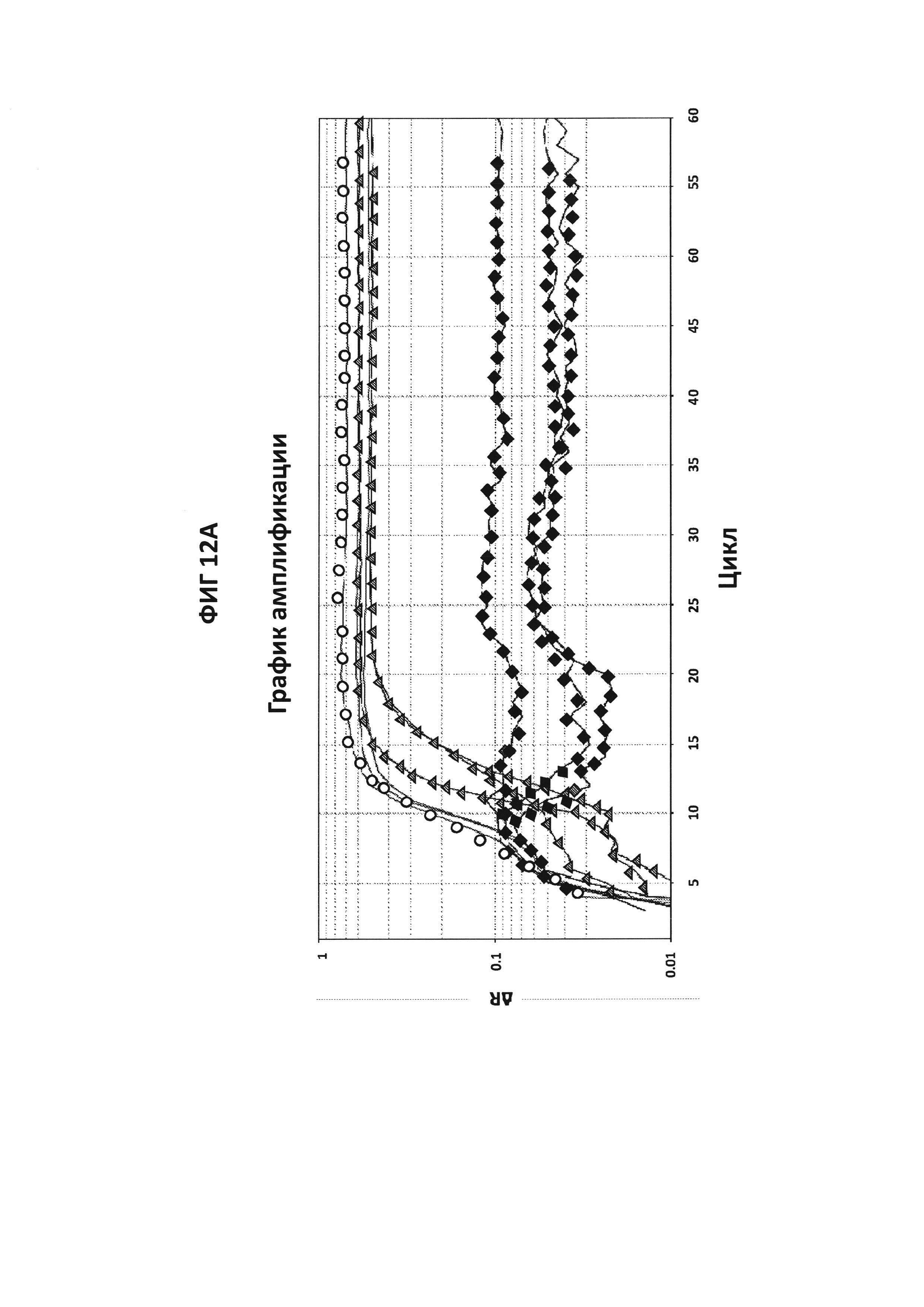
На фигурах 12А и 12В приведены графики амплификации, полученные в мультиплексе CT/GC с зондами СТ PB1-FAM+GC porA7-Alexa546. СТ и GC ДНК амплифицировали в отдельных реакциях или в конъюгировании в буфере V6.21p в присутствии зондов СТ Pb1-FAM и GC porA7-Alexa546. Считывания производились в каналах Су3 (фигура 12А) и FAM (фигура 12В). Эксперимент показал, что две ДНК-мишени могут быть амплифицированы и обнаружены в одновременном взаимодействии с зондами, меченными FAM и Alexa546, и что не было перекрестной реактивности между СТ РВ1- и GC porA7-праймерами и зондами.
Пример 12
Таблица 1 показывает результаты сравнения между V13 LAMP для СТ и GC, CT/GC Aptima и CT/GC мультиплексор (СТ PB1-FAM+GC porA7-Alexa546). ДНК, экстрагированную из 136 клинических образцов, испытывали с мультиплексом CT/GC Aptima, СТ РВ1-праймерами и GC porA7-праймерами в буфере V6.21, содержащем V13, или в мультиплексной реакции в буфере v6.21p в присутствии СТ PB1-праймеров и GC porA7-праймеров и зондов СТ PB1-FAM и GC porA7-Alexa546. В контрольном эксперименте образцы были также испытаны в симплексной реакции с зондом GC glnA7-Joe. В таблице приведены показатели степени согласия результатов между испытаниями.