Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ И АТТЕСТАЦИИ СТАНДАРТНОГО ОБРАЗЦА АНТИГЕНА ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА
Вид РИД
Изобретение
Изобретение относится к области медицинской биотехнологии, производству и контролю вирусных вакцин и касается способа получения и аттестации стандартного образца (СО) гликопротеина Е (gpE) вируса клещевого энцефалита (ВКЭ). Изобретение может быть использовано для решения практических задач медицинской биотехнологии -аттестации стандартного образца предприятия (СОП) для контроля специфической активности вакцины и определения количественного содержания гликопротеина Е в полуфабрикатах и готовом препарате вакцины КЭ.
Определение содержания антигена ВКЭ в вакцинах проводится с помощью метода иммуноферментного анализа (ИФА). При этом для количественного определения вирусного антигена методом ИФА необходимо использовать аттестованный СОП вакцины клещевого энцефалита с известной концентрацией белка Е.
Из-за вариабельности антигенных свойств разных штаммов ВКЭ, проявляющейся в индивидуальных особенностях взаимодействия вирусных антигенов каждого штамма с панелями моноклональных антител, наиболее достоверным вариантом является использование для изготовления и аттестации СО, СОП производственного штамма вируса, использующегося при производстве вакцины.
Другая методологическая проблема состоит в том, что белки ВКЭ (и в первую очередь основной иммуноген - gpE) нестабильны и чувствительны к воздействию рН и протеаз. Срок их хранения в жидком виде ограничен, а при замораживании-оттаивании (в том числе лиофилизации) происходят изменения структуры, ведущие к снижению аффинности в иммунологических реакциях.
При аттестации контрольных образцов необходимо применять методы, отличные по физико-химическим принципам от тех, в которых эти образцы в дальнейшем будут выступать стандартами. Наиболее подходящими являются прямые физические методы, например, гравиметрический. Поскольку аттестуемый СОП вакцины будет в дальнейшем использоваться в ИФА и отсутствуют международные или отраслевые стандарты белка Е, то нельзя применять методы, основанные на феномене взаимодействия антиген-антитело, так как результат этих методов будет зависеть от свойств применяемых антител.
Учитывая, что количество gpE в материале для изготовления стандарта невелико, а его очистка сопряжена с опасностью изменений структуры, то оптимальным вариантом является выделение цельновирионной фракции из культуральной жидкости. В составе вирионов gpE наиболее стабилен и сохраняет антигенную активность и иммуногенность. Между тем в таком виде нельзя определить его концентрацию прямыми методами, так как он находится в смеси с другими вирионными белками, белками клеток-продуцентов и компонентами питательной среды.
В связи с этим, в целях аттестации СО нами предложено применять опосредованные вычисления. После определения концентрации общего белка в образце по методу Лоури или Несслера, с помощью электрофореза в полиакриамидном геле (ПААГ) устанавливают долю содержания gpE в образце. Зная два этих показателя, вычисляют абсолютную концентрацию gpE.
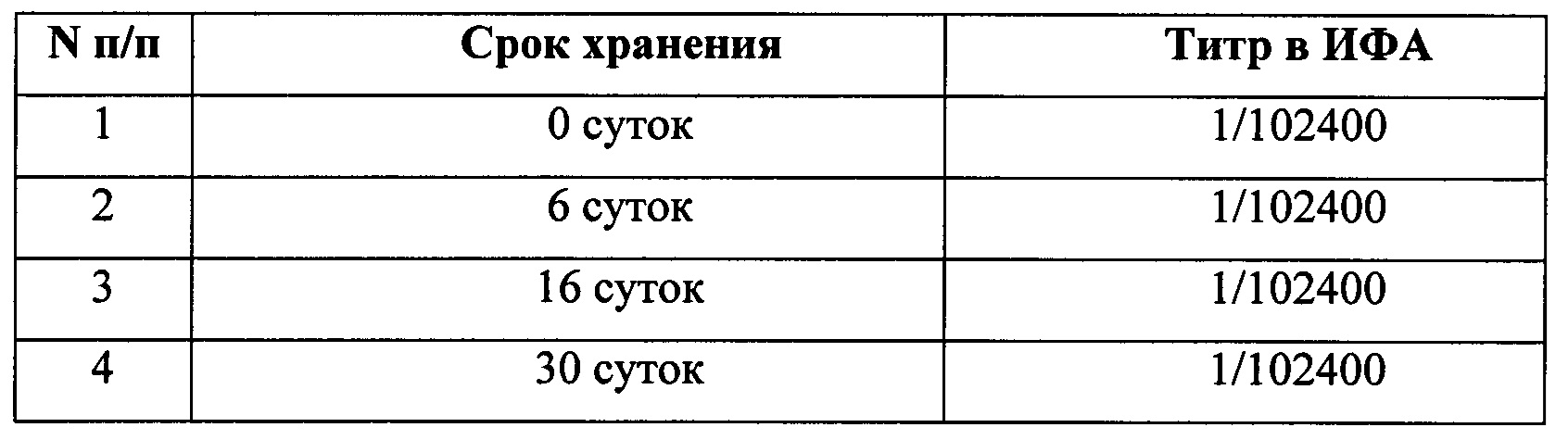
Стабильность такого стандартного образца (СО) вирусных белков ограничена. Из-за того, что СО вирусного антигена необходимо хранить в жидком виде, максимальный срок хранения составляет 1 месяц при температуре 2-8°С. Однако, этого времени достаточно для того, чтобы провести аттестацию лиофилизированного СОП вакцины КЭ.
Задачей, решаемой данным изобретением, является получение и аттестация стандартного образца гликопротеина Е вируса КЭ.
Поставленная задача решается следующим образом:
Для изготовления СО антигена ВКЭ используют производственный штамм ВКЭ 205, вирус репродуцируют в культуре первично-трипсинизированных фибробластов куриных эмбрионов. Полученную культуральную жидкость инактивируют формальдегидом, очищают с помощью осаждения протаминсульфатом, фильтрации. Затем концентрируют с помощью ультрафильтрации в тангенциальном потоке. Затем проводят тонкую очистку с помощью эксклюзионной хроматографии и финишное концентрирование с помощью центрифужных концентраторов.
Полученный концентрат СО антигена ВКЭ контролируют по следующим показателям:
- содержание общего белка;
- чистота высокомолекулярной фракции (ВЭЖХ);
- подлинность (идентификация электрофоретических полос, соответствующих gpE, в Western-blot);
- определение относительной концентрации gpE (электрофорез в ПААГ).
После этого расчетно определяют абсолютное содержание gpE в концентрате СО антигена ВКЭ, разводят до необходимой концентрации и упаковывают для хранения.
Новым в предлагаемом способе является использование комплекса методов очистки и характеризации гликопротеина Е в составе стандартного образца антигена вируса КЭ (электрофорез в ПААГ, Western-blot и определение концентрации общего белка), позволяющих напрямую рассчитать содержание основного иммуногена ВКЭ.
Пример 1.
В качестве материала для выделения антигена вируса КЭ использовали:
концентрат вирусной взвеси (с.57) объемом 1,10 л.
Основные показатели качества:
Общий белок 2,33 мг/мл
Антигенная активность 31,96 мкг/мл
Овальбумин 0,080 мкг/мл (80,38 нг/мл)
Концентрат был получен после инактивации, осветляющей фильтрации и концентрирования методом ультрафильтрации в тангенциальном потоке.
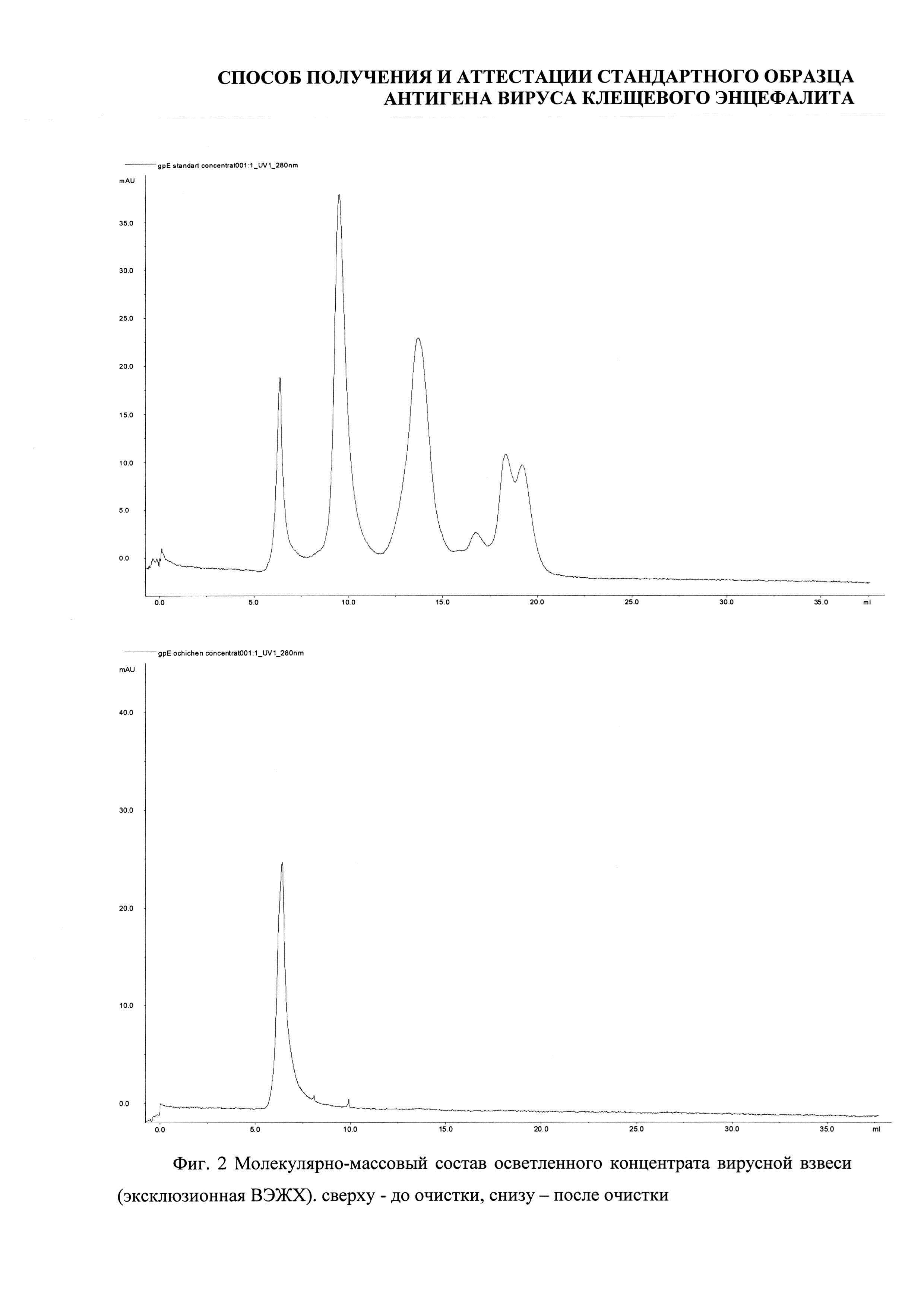
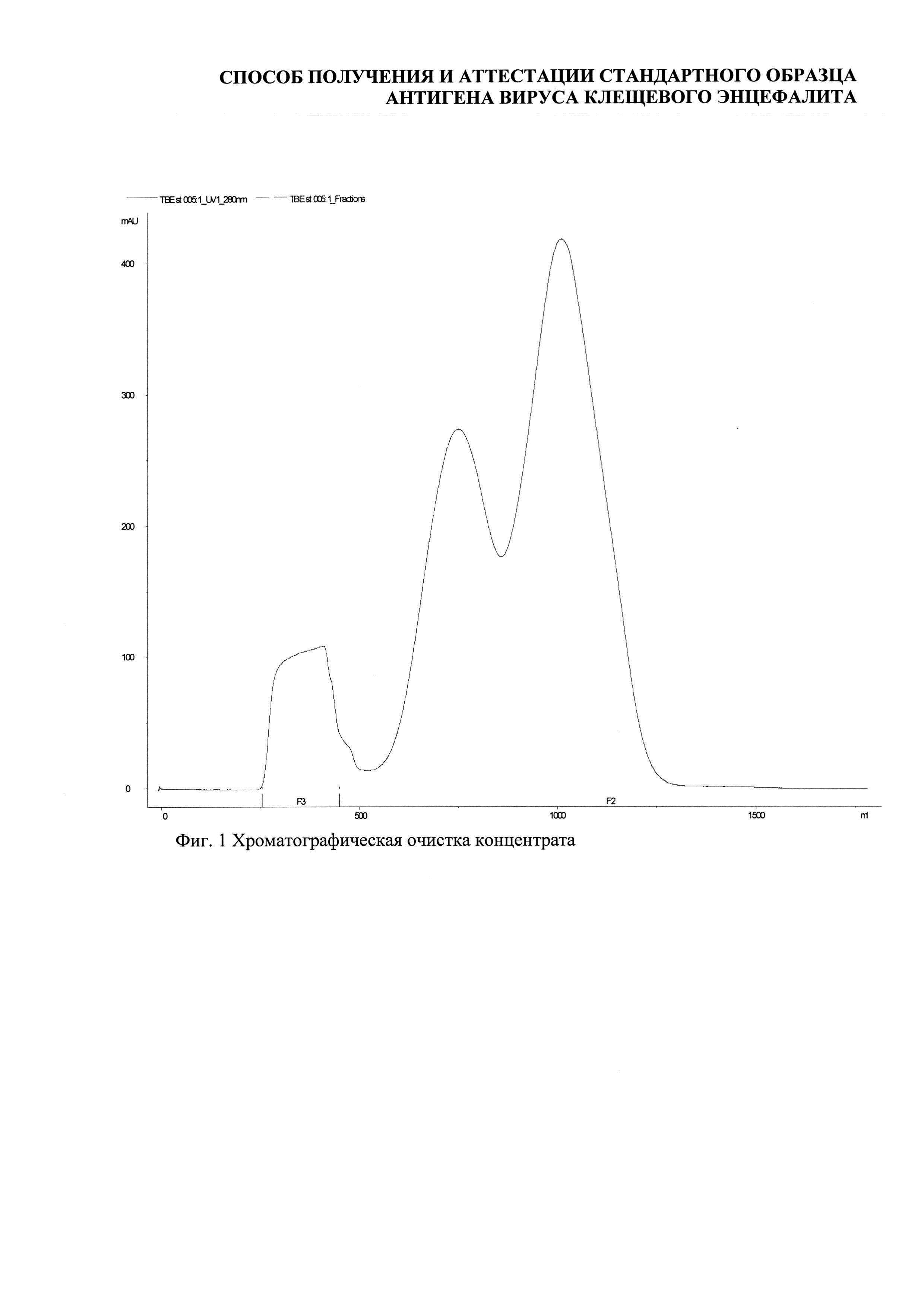
Хроматографическая очистка проводилась эксклюзионной хроматографией с использованием хроматографа АКТА Explorer 100 (Amersham bioscience, Sweden), колонны XK-50-70 (GE Healthcare, Sweden), Sepharose 6FF (GE HealthCare, Sweden), 0,05 M фосфатный буферный раствор, рН 7,5-7,7 (Фиг. 1).
Контроль чистоты цельновирионной фракции проводили с помощью ВЭЖХ (колонна ProteinPac 300 SW).
Контроль концентрации общего белка проводили по методу Лоури.
Контроль антигенной активности проводили в ИФА с помощью коммерческой тест-системы.
Условия хроматографии:
|
Анализ методом ВЭЖХ показал, что содержание высокомолекулярной фракции в осветленном концентрате вирусной взвеси составило 9,3%, в очищенном концентрате - 98,8% (Фиг. 2).
Концентрирование антигена ВКЭ проводили с помощью центрифуги Thermo Multifuge 4KR (ThermoScientific, USA; Heraeus, Germany) с баккет-ротором, центрифужных концентраторов MilliporeAmicon Ultra-15 с порогом отсечения 10,0 кДа (Millipore, France).
В каждый концентратор вносили 15 мл очищенного концентрат. Центрифугировали при 4000g, 15°С в течение 20-40,0 мин до объема 1,0 мл раствора в каждом концентраторе. После остановки центрифуги удаляли пермеат и доливали очищенный концентрат. Затем повторяли процесс.
Контроль концентрации общего белка проводили по методу Лоури.
Контроль антигенной активности проводили в ИФА.
В процессе концентрирования всего было получено 30,0 мл центрифужного концентрата и около 1,1 л пермеата. Таким образом, было проведено концентрирование по объему в 37,2 раза (табл. 1).
В ходе аттестации СО антигена ВКЭ проводили контроль концентрации общего белка по методу Лоури без осаждения (ГФ XII, ч. 2). В качестве стандарта использовали ОСО ФГБУ ГНЦ МЗ РФ с содержанием альбумина 10,1%. Измерение ОП растворов проводили на спектрофотометрах Shimazu 1800-UV и при длине волны 750 нм. Расчет концентраций белка в контрольном и исследуемом образцах осуществляли по калибровочной кривой.
Было проведено 5 серий исследований центрифужного концентрата. Среднее значение содержания общего белка составило 1,65 мг/мл.
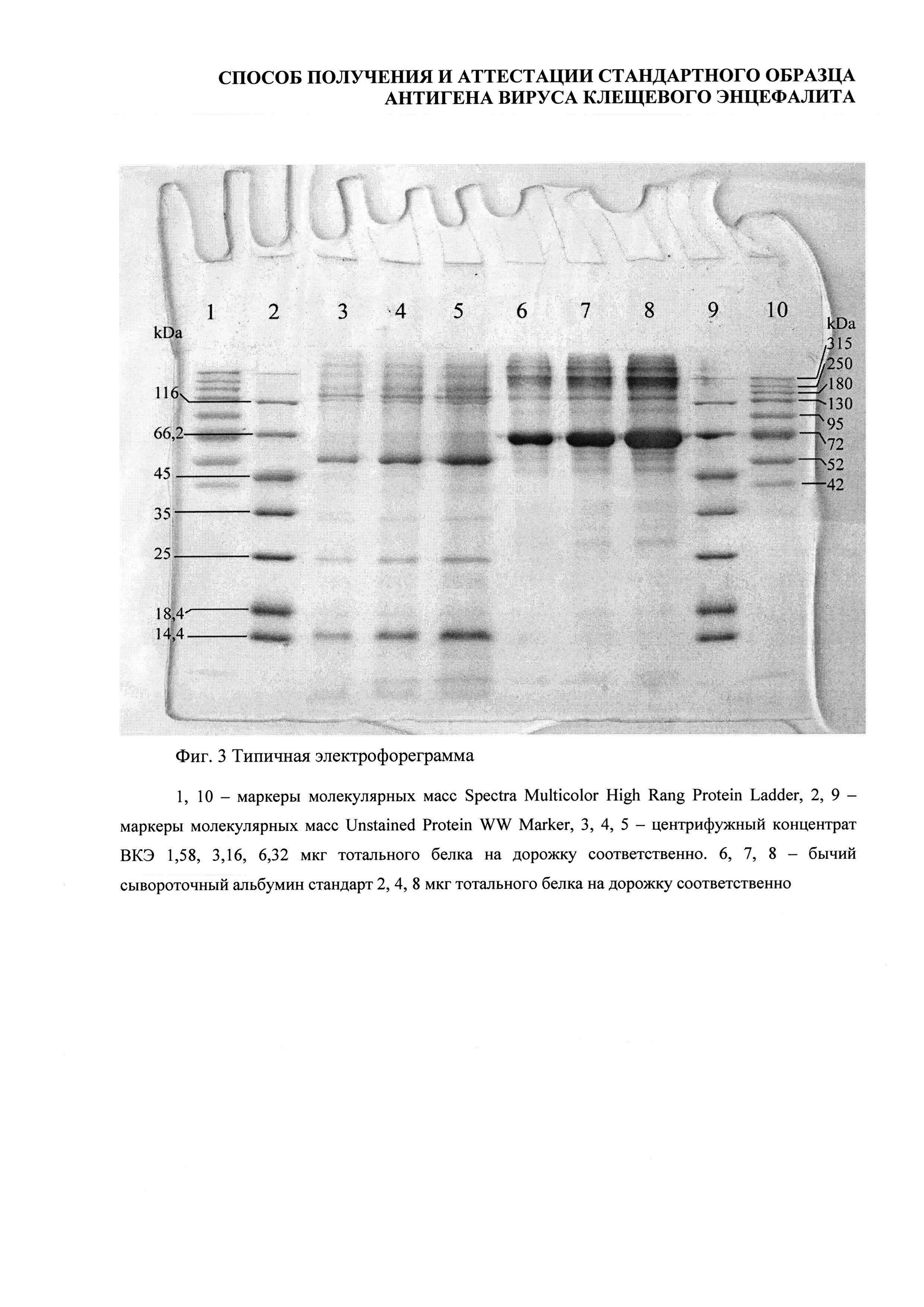
Определение относительного содержания gpE в СО проводили с помощью электрофореза в полиакриламидном геле, подтверждение подлинности gpE на электрофореграмме проводили с помощью Western-blot (Фиг. 3).
Для анализа использовали маркеры молекулярных масс Spectra Multicolor High Rang Protein Ladder 315-42 кДа и Unstained Protein WW Marker 116-14,4 кДа (ThermoFisher), Coomassi blue, Диаминобензидин («Sigma»), ECL detection reagent (Amersham), пленка Hyperfilm ECL (Amersham), PVDF-мембрану, первичные мышиные моноклональные антитела к белку Е линии 14D51 (ЗАО «Биосан»), вторичные моноклональные антитела к мышиным IgG, коньюгированные с пероксидазой хрена, камеру для электрофореза mini-protean 3 (BIO-RAD), камеру для полусухого переноса (BIO-RAD). Всего было проведено 11 серий исследований.
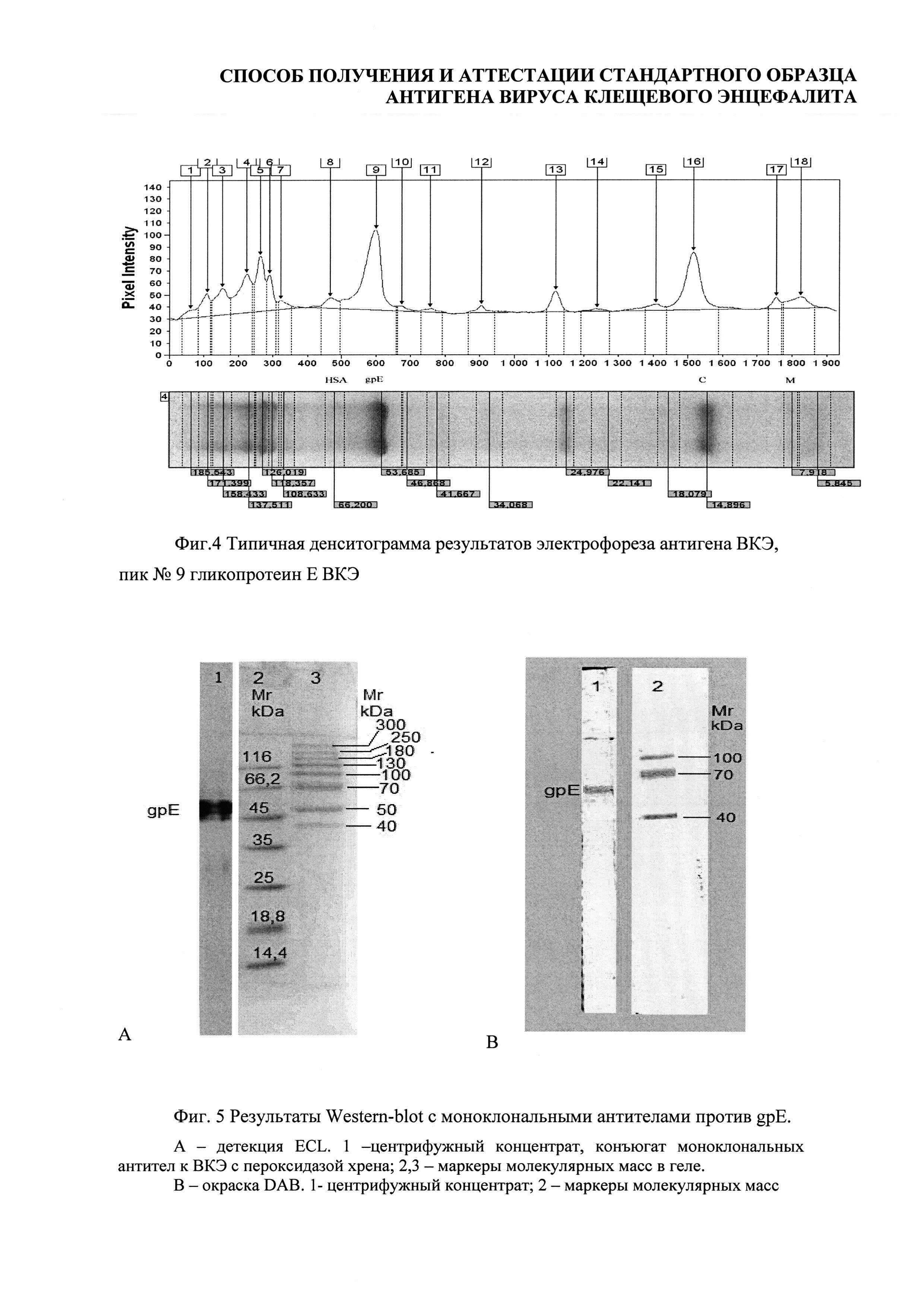
33 электрофорезные дорожки были подвергнуты денситометрии (Фиг. 4).
По денситограммам были определены молекулярные массы выявленных белков и их относительные концентрации (доля в суммарной площади пиков).
По электрофоретической подвижности можно идентифицировать сывороточный альбумин человека (66 кДа), гликопротеин Е вируса КЭ (53,68 кДа - полипептид, 55 кДа -гликозилированная форма), капсидный белок С ВКЭ (12,1 кДа) и мембранный белок М ВКЭ (8,2 кДа). Остальные полосы на электрофорезе соответствуют различным белкам субстратных клеток и компонентов питательной среды.
В проведенных исследованиях подвижность gpE варьировала от 52,72 до 56,03 кДа (средняя 54,17 кДа, табл. 2), что согласуется с литературными данными (Фиг. 4).
Принадлежность белка с электрофоретической подвижностью, соответствующей 54,17 кДа к gpE ВКЭ была подтверждена специфической реакцией с моноклональными антителами против gpE ВКЭ в Western-blot (Фиг. 5).
Относительную концентрацию целевого белка (gpE) вычисляли, как долю площади пика среди общей площади денситограммы. Она составляла от 18,6 до 32,4% (табл. 2). Однако два результата были исключены из дальнейшей обработки, так как отклонение их значений от среднего арифметического было больше двух стандартных отклонений (табл. 2, №14, 15 помечено серым).
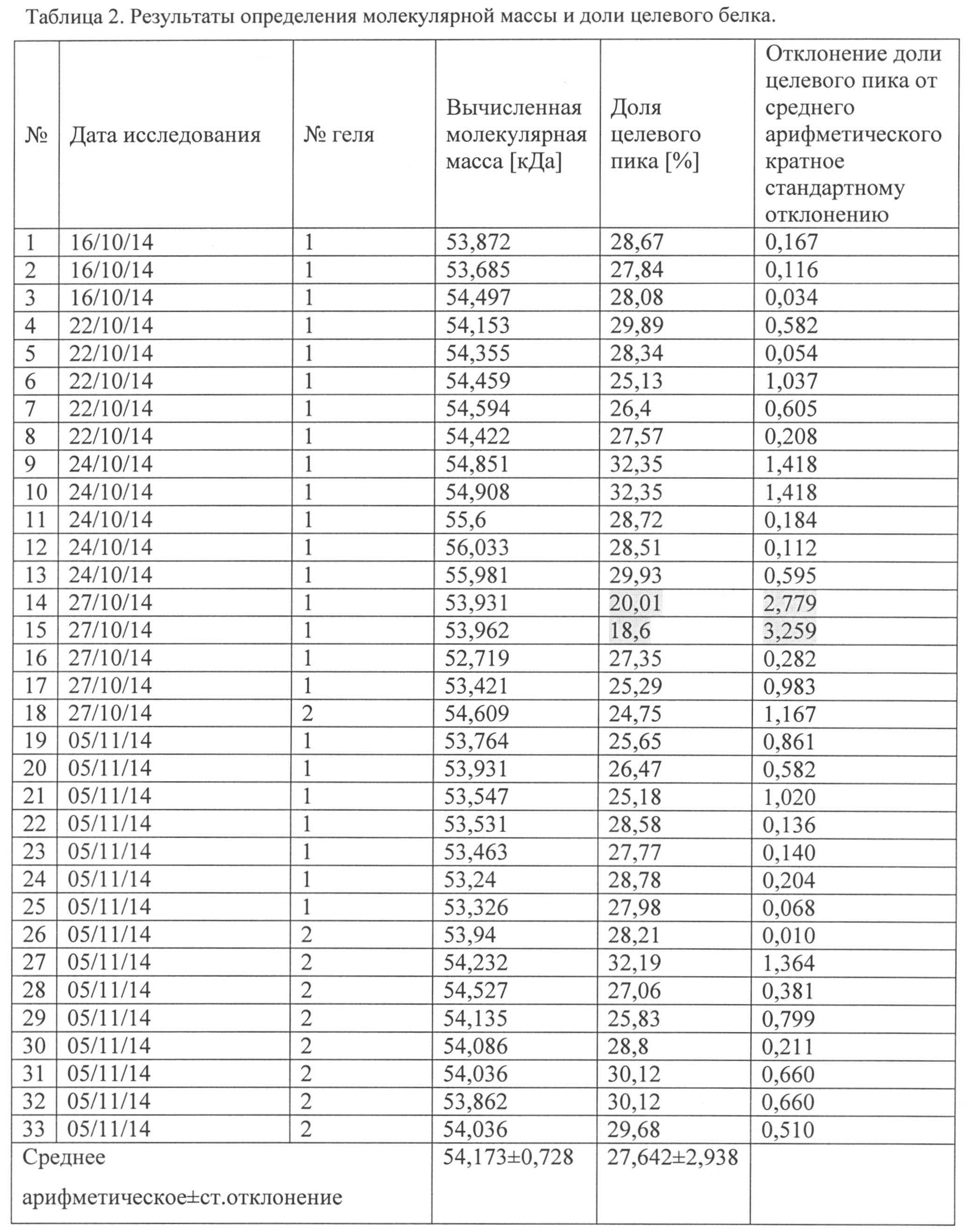
Таким образом, после исключения двух наблюдений, доля пика денситограммы, соответствующего gpE ВКЭ (относительная концентрация) составила 28,18±2,06%.
Расчет концентрации gpE вируса КЭ в центрифужном концентрате проводили по формуле:
CgpE=Ctotal*Pband/l 00%,
где
CgpE - концентрация gpE ВКЭ в пробе
Ctotal - концентрация общего белка в пробе
Pband - доля площади пика gpE ВКЭ (относительная концентрация)
CgpE=l.65 г/л*28.18%/100%=0.465 г/л
Расчет стандартного отклонения среднего концентрации gpE проводили по формуле:
σCgpE=CgpE*SQRT((σCtotal/Ctotal)2+(σPband/Pband)2),
где
CgpE - концентрация gpE ВКЭ в пробе
Ctotal - концентрация общего белка в пробе
Pband - доля площади пика gpE ВКЭ (относительная концентрация)
σ - стандартные отклонения соответствующих величин
σCgpE=0,465*SQRT((0,13/1,65)2+(2,06/28,18)2)=0,050
Таким образом, количественное содержание gpE ВКЭ в центрифужном концентрате составила 0.465±0,050 г/л.
Для приготовления стандартного образца антигена ВКЭ разводили центрифужный концентрат в стабилизирующем растворе в 8,4 раза. Получили СО антигена вируса КЭ (стандарт 1 уровня), содержащий 55,36±5,95 мкг/мл gpE ВКЭ. Полученный стандартный образец разлили в пластиковые пробирки с завинчивающимися крышками по 1 мл.
Стабильность СО в течение 1 месяца хранения при температуре 2-8°С