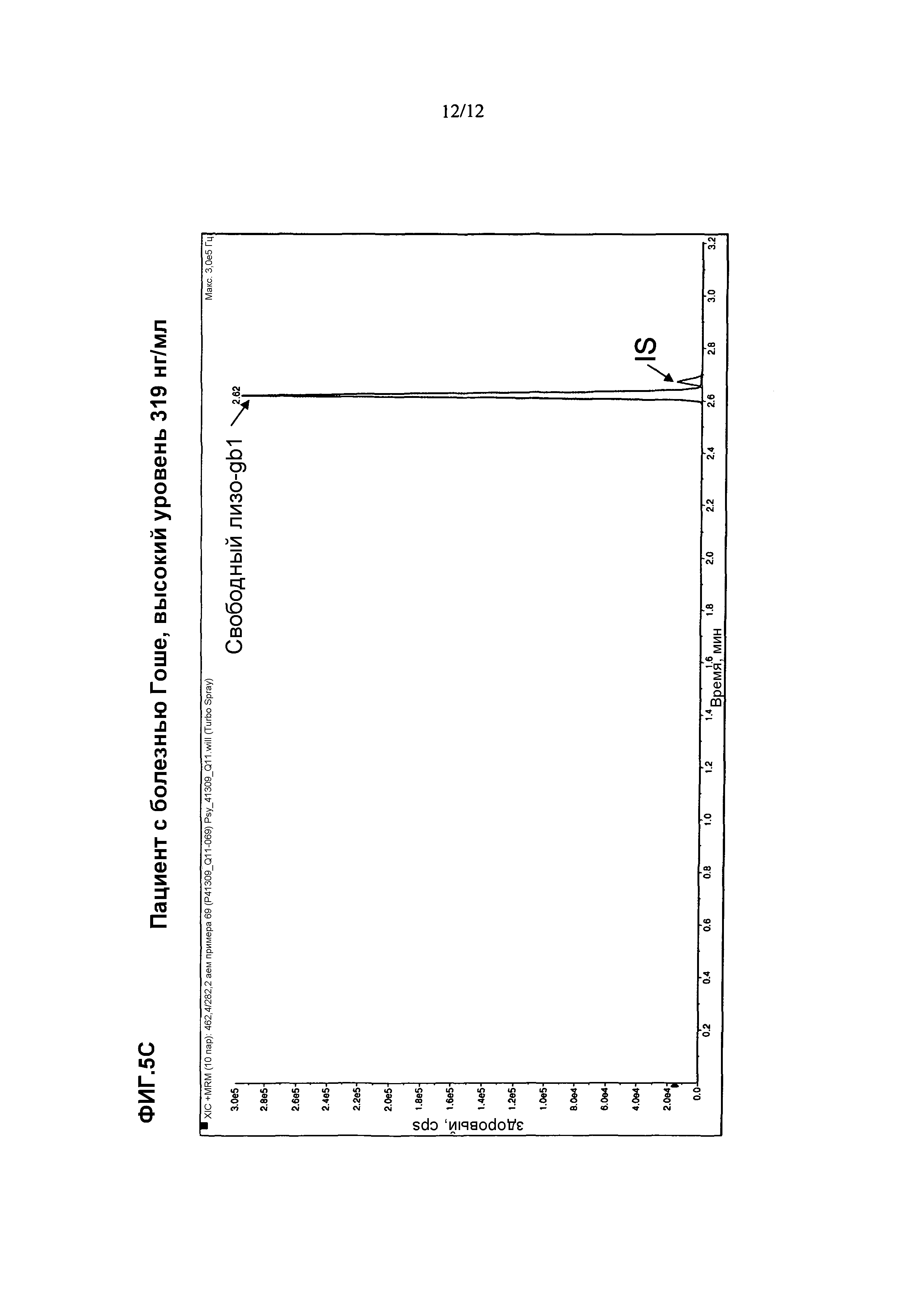
СПОСОБ ДИАГНОСТИКИ БОЛЕЗНИ ГОШЕ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к способу диагностики болезни Гоше у индивидуума, способу определения течения болезни Гоше у индивидуума, способу определения эффективности по меньшей мере одного способа лечения, применяемого у индивидуума с положительным результатом тестирования на наличие или риск развития болезни Гоше, способу определения эффективности соединения для лечения болезни Гоше, применению масс-спектрометрии для выявления биомаркера, применению биомаркера болезни Гоше, набору для определения присутствия биомаркера в образце от индивидуума и программному продукту, где биомаркером является свободный лизо-Gb1.
Уровень техники, к которому относится изобретение
Лизосомальные болезни накопления, также называемые в настоящем описании лизосомальными нарушениями накопления или LSD, представляют собой группу редких наследственных метаболических нарушений, которые являются результатом дефектов функции лизосом. LSD возникают, когда нарушаются функции определенной органеллы в клетках организма - лизосомы. Некоторыми из наиболее известных лизосомальных болезней накопления являются болезнь Гоше и болезнь Фабри.
LSD вызываются дисфункцией лизосом обычно вследствие дефицита единичного фермента, требуемого для метаболизма липидов, гликопротеинов или так называемых мукополисахаридов. По отдельности LSD встречаются с частотой приблизительно от 1:10000 до 1:250000, однако в качестве группы их встречаемость составляет приблизительно 1:5000. Большинство из этих нарушений наследуются аутосомно-рецессивным путем; однако некоторые из них наследуются X-сцепленным путем, такие как болезнь Фабри и синдром Хантера (MPS II).
Подобно другим генетическим заболеваниям индивидуумы обычно наследуют лизосомальные болезни накопления от их родителей. Хотя каждое нарушение является результатом отличающихся мутаций генов, которые обуславливают дефицит активности фермента, все они обладают общей биохимической характеристикой - практически все лизосомальные нарушения являются результатом аномального накопления веществ внутри лизосомы.
Лизосомальные болезни накопления по большей части поражают детей, и они часто погибают в раннем и непрогнозируемом возрасте, причем многие из них в пределах нескольких месяцев или лет после рождения. Многие другие дети погибают от этого заболевания после страдания в течение нескольких лет от различных симптомов их конкретного нарушения.
Симптомы лизосомальной болезни накопления варьируют, в зависимости от конкретного нарушения и других переменных, таких как возраст возникновения, и они могут быть от мягких до тяжелых. Они могут включать отставание в развитии, двигательные расстройства, судорожные припадки, деменцию, глухоту и/или слепоту. Некоторые люди с лизосомальной болезнью накопления имеют увеличенную печень (гепатомегалию) и увеличенную селезенку (спленомегалию), проблемы с легкими и сердцем, и аномальное развитие костей.
Отсутствуют этиологические способы лечения лизосомальных болезней накопления, и лечение по большей части является симптоматическим, хотя при некоторых показаниях используют трансплантацию костного мозга и фермент-заместительную терапию (ERT) с высоким успехом. Кроме того, при ряде из этих заболеваний в специализированных центрах проводят трансплантацию пуповинной крови. Кроме того, для некоторых из этих заболеваний в настоящее время оценивают субстратредукционную терапию (SRT) - способ, используемый для снижения накопления накапливающегося материала. Более того, для некоторых из этих нарушений используют терапию шаперонами - способ, используемый для стабилизации дефектных ферментов, продуцируемых у пациентов. Генная терапия представляет собой другую возможность лечения этих заболеваний.
На сегодняшний день окончательный диагноз болезни Гоше может быть поставлен только с использованием биохимического исследования, прямо измеряющего дефект фермента бета-глюкозидазы, совместно с генетическим подтверждением. Поскольку причиной конкретной лизосомальной болезни накопления могут быть различные генетические мутации, при болезни Гоше для подтверждения диагноза используют секвенирование всего гена бета-глюкозидазы.
Несмотря на наличие попыток использования способов диагностики на основе ассоциированных биохимических аномалий, таких как высокие уровни щелочной фосфатазы, ангиотензин-превращающего фермента (ACE) и иммуноглобулинов, или, в случае болезни Гоше, посредством клеточного анализа, демонстрирующего цитоплазму в виде "гофрированной бумаги" и нагруженные гликолипидами макрофаги, существует неудовлетворенная потребность в простом биохимическом тесте, демонстрирующим высоко специфическую и высоко чувствительную детекцию указанной лизосомальной болезни накопления на ранней стадии, мониторинг прогрессирования заболевания и ранний мониторинг эффективности используемых способов терапии.
Таким образом, идентификация биомаркеров для ранней детекции и диагностики болезни Гоше имеет высокий потенциал для повышения клинического исхода у пациентов. Это особенно важно для пациентов с неопределенными симптомами или без симптомов или для того, чтобы выявлять пациентов, которые не отвечают на терапию.
Биомаркер должен быть технически осуществимым в руках многих людей, легким для измерения; пригодным, с постоянной относительной величиной между экспериментами/пациентами и контролями, или подвергнутыми лечению и не подвергнутыми лечению; надежным, точным и достоверным клинически, и классифицируемым как высоко предсказательный или прогностический.
Было открыто, что при болезни Гоше некоторые лизосомальные ферменты, используемые в качестве непрямых биомаркеров, являются повышенными, включая тартрат-устойчивую кислую фосфатазу, гексозаминидазу и хитиназу человека, хитотриозидазу. Таким образом, предпринимаются попытки мониторинга снижения клеток накопления в тканях путем измерения таких заместительных маркеров клеток Гоше, как хитотриозидаза и CCL18 (C.E. Hollak et al. Marked elevation of plasma chitotriosidase activity. A novel hallmark of Gaucher disease, J. Clin. Invest. 93 (1994) 1288-1292; R.G. Boot et al. Marked elevation of the chemokine CCL18/PARC in Gaucher disease: a novel surrogate marker for assessing therapeutic intervention, Blood 103 (2004) 33-39). Однако помимо других недостатков при использовании хитотриозидазы в качестве биомаркера болезни Гоше, указанный фермент накапливается независимо от прямой связи с патологией болезни Гоше. Более того, вплоть до 35% приведенных этнических групп демонстрируют дефект гена, кодирующего хитотриозидазу, приводящий к искусственно сниженной или не поддающейся измерению активности хитотриозидазы.
Использование основных молекул накопления в качестве биомаркера оценивали для глюкозилцерамида (Gb1) в плазме пациентов с болезнью Гоше и сравнивали с уровнем Gb1 у здоровых индивидуумов (Groener et al. Biochim Biophys Acta. 2008 Jan-Feb; 1781 (1-2):72-8. Epub 2007 Dec 5.; Plasma glucosylceramide and ceramide in type 1 Gaucher disease patients: correlations with disease severity and response to therapeutic intervention.; Groener JE et al.). Тем не менее, хотя Gb1, измеренный в указанном испытании, был увеличен в плазме указанных пациентов, указанное увеличение Gb1 не было выраженным и, таким образом, специфичность и чувствительность этого способа были низкими, что демонстрирует, что Gb1 не применим в качестве биомаркера болезни Гоше.
Уже в 1989 году Rosengren et al. (Lysosulfatide (galactosylsphingosine-3-O-sulphate) from metachromatic leukodystrophy and normal human brain, Rosengren B, Fredman P, Mansson JE, Svennerholm L.; J Neurochem. 1989 Apr; 52(4): 1035-41) показали, что при липидозе нарушается не только катаболизм основного сфинголипида, но также и его лизосоединения. Тем не менее, указанное испытание привело к заключению, что лизосоединения не играют ключевую роль в патогенетических механизмах при сфинголипидозах. Таким образом, указанные лизосоединения могут не быть пригодными биомаркерами для диагностики сфинголипидозов, таких как болезнь Гоше.
Важно отметить, что до настоящего времени не было доступно применение высоко специфического и высоко чувствительного биомаркера и способа диагностики болезни Гоше, помимо способов, описанных выше, которые проявляют неудовлетворительный предел выявления, чувствительности и/или специфичности и, таким образом, которые, как показано, являются непригодными для клинического применения.
Таким образом, существует потребность в быстром, простом и, более важно, надежном способе диагностики болезни Гоше.
Ввиду вышесказанного, проблемой, служащей основанием для настоящего изобретения, является предоставление способа диагностики болезни Гоше.
Следующей проблемой, служащей основанием для настоящего изобретения, является предоставление способа определения течения и прогноза болезни Гоше.
Следующей проблемой, служащей основанием для настоящего изобретения, является предоставление способа довольно быстрого определения эффективности по меньшей мере одного способа лечения, используемого у индивидуума с положительными результатами тестирования на наличие или риск развития болезни Гоше.
Следующей проблемой, служащей основанием для настоящего изобретения, является предоставление способа определения эффективности соединения для лечения болезни Гоше.
Другой проблемой, служащей основанием для настоящего изобретения, является предоставление биомаркера, который позволяет специфическую и чувствительную диагностику болезни Гоше. Следующей проблемой, служащей основанием для настоящего изобретения, является набор, который содержит соединение, которое взаимодействует с биомаркером, который является специфическим и чувствительным для болезни Гоше.
Эти и другие проблемы решаются с помощью объекта прилагаемых независимых пунктов формулы изобретения. Предпочтительные варианты осуществления могут быть установлены из зависимых пунктов формулы изобретения.
Проблема, служащая основанием для настоящего изобретения, решается в первом аспекте, который также является первым вариантом осуществления первого аспекта, с помощью способа диагностики болезни Гоше у индивидуума, включающего стадию
a) выявления биомаркера в образце от индивидуума, где биомаркером является свободный лизо-Gb1.
Во втором варианте осуществления первого аспекта, который также является вариантом осуществления первого варианта осуществления первого аспекта, способ дополнительно включает стадию
b) определения уровня биомаркера, присутствующего в образце.
В третьем варианте осуществления первого аспекта, который также является вариантом осуществления первого и второго варианта осуществления первого аспекта, уровень биомаркера указывает на то, страдает ли индивидуумом или имеет ли индивидуум риск развития болезни Гоше.
В четвертом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго и третьего варианта осуществления первого аспекта, образец от индивидуума представляет собой образец от индивидуума, которого ранее лечили или у которого ранее была диагностирована болезнь Гоше.
В пятом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго и третьего варианта осуществления первого аспекта, образец от индивидуума представляет собой образец от индивидуума, у которого ранее не была диагностирована болезнь Гоше.
В шестом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого и пятого варианта осуществления первого аспекта, способ дополнительно включает стадию
c) применения, поддержания, уменьшения, усиления или не применения терапии, исходя из диагностики того, страдает ли индивидуум или имеет ли он риск развития болезни Гоше.
В седьмом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого и шестого варианта осуществления первого аспекта, способ дополнительно включает стадию
d) выявления биомаркера в образце от индивидуума после применения, поддержания, уменьшения, усиления или не применения терапии на стадии c).
В восьмом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого и седьмого варианта осуществления первого аспекта, способ дополнительно включает стадию
e) определения уровня биомаркера в образце от индивидуума после применения, поддержания, уменьшения, усиления или не применения терапии на стадии c).
В девятом варианте осуществления первого аспекта, который также является вариантом осуществления восьмого варианта осуществления первого аспекта, способ дополнительно включает стадию
f) определения того, является ли уровень биомаркера, определенный на стадии b), более низким, чем уровень биомаркера, определенный на стадии e).
В десятом варианте осуществления первого аспекта, который также является вариантом осуществления девятого варианта осуществления первого аспекта, способ дополнительно включает стадию
g) применения, поддержания, уменьшения, усиления или не применения терапии, исходя из стадии f).
В одиннадцатом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого и десятого варианта осуществления первого аспекта, способ дополнительно включает выявление по меньшей мере одного дополнительного биомаркера в образце от индивидуума.
В двенадцатом варианте осуществления первого аспекта, который также является вариантом осуществления одиннадцатого варианта осуществления первого аспекта, способ дополнительно включает определение уровня по меньшей мере одного дополнительного биомаркера в образце от индивидуума.
В тринадцатом варианте осуществления первого аспекта, который также является вариантом осуществления одиннадцатого и двенадцатого варианта осуществления первого аспекта, по меньшей мере один дополнительный биомаркер выбран из группы, включающей хитотриозидазу и CCL18.
В четырнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления тринадцатого варианта осуществления первого аспекта, по меньшей мере одним дополнительным биомаркером является хитотриозидаза.
В пятнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления тринадцатого варианта осуществления первого аспекта, по меньшей мере одним дополнительным биомаркером является CCL18.
В шестнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого и пятнадцатого вариантов осуществления первого аспекта, способ дополнительно включает выявление хитотриозидазы и CCL18.
В семнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого и шестнадцатого вариантов осуществления первого аспекта, биомаркер и/или по меньшей мере один дополнительный биомаркер выявляют с помощью иммуноанализа, масс-спектрометрического анализа, биочипа, функциональных нуклеиновых кислот и/или флуоресцентного производного свободного лизо-Gb1.
В восемнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления семнадцатого варианта осуществления первого аспекта, биомаркер выявляют с помощью масс-спектрометрического анализа.
В девятнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления восемнадцатого варианта осуществления первого аспекта, масс-спектрометрический анализ выбран из группы, состоящей из SELDI, MALDI, MALDI-Q TOF, МС/МС, TOF-TOF и ESI-O-TOF.
В двадцатом варианте осуществления первого аспекта, который также является вариантом осуществления девятнадцатого варианта осуществления первого аспекта, в масс-спектрометрическом анализе используется МС/МС.
В двадцать первом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого и двадцатого вариантов осуществления первого аспекта, способ дополнительно включает преципитацию белка и/или ВЭЖХ.
В двадцать втором варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого и двадцать первого вариантов осуществления первого аспекта, способ дополнительно включает преципитацию белка, ВЭЖХ и МС/МС.
В двадцать третьем варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого и двадцать второго вариантов осуществления первого аспекта, индивидуумом является человек.
В двадцать четвертом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго и двадцать третьего вариантов осуществления первого аспекта, стадия выявления биомаркера в образце включает проведение стадии преципитации белка в образце, преципитацию белка из образца, где преципитация белка из образца обеспечивает супернатант образца, проведение ВЭЖХ и МС/МС для супернатанта образца и определение количества биомаркера и/или меньшей мере одного дополнительного биомаркера, который присутствует в супернатанте образца.
Проблема, служащая основанием для настоящего изобретения, решается во втором аспекте, который также является первым вариантом осуществления второго аспекта, с помощью способа диагностики болезни Гоше у индивидуума, включающего
i) добавление внутреннего стандарта к образцу индивидуума, где образец от индивидуума выбран из группы, включающей плазму, сыворотку и кровь;
ii) необязательно смешение образца, содержащего внутренний стандарт;
iii) проведение стадии преципитации белка в образце, посредством которой преципитируют белок из образца и обеспечивают супернатант образца;
iv) необязательно проведение первой стадии отделения супернатанта образца, которая обеспечивает супернатант, причем предпочтительно первой стадией отделения является стадия центрифугирования;
v) проведение для супернатанта стадии c) или стадии d), или его части, второй стадии отделения, где вторая стадия отделения включает инжектирование части супернатанта в систему ВЭЖХ-МС/МС и использование колонки ВЭЖХ с градиентом от подкисленной воды до смеси ацетонитрил/ацетон; где колонка ВЭЖХ предпочтительно представляет собой колонку ВЭЖХ, выбранную из группы, включающей колонку ВЭЖХ C8 и C18, и где вторая стадия отделения обеспечивает отделенный образец;
vi) проведение для отделенного образца МС/МС, где МС/МС включает электрораспылительную ионизацию и множественный мониторинг реакции;
где способ предпочтительно представляет собой способ согласно любому из первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта;
и, кроме того, включающим стадию
a) выявления биомаркера в образце от индивидуума, где биомаркером является свободный лизо-Gb1;
и необязательно стадию
b) определения уровня биомаркера, присутствующего в образце.
Во втором варианте осуществления второго аспекта, который также является вариантом осуществления первого варианта осуществления второго аспекта, внутренний стандарт включает D5-флукатизонпропионат и/или лизо-Gb2.
В третьем варианте осуществления второго аспекта, который также является вариантом осуществления первого и второго варианта осуществления второго аспекта и первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта, стадия b) и/или стадия e) дополнительно включает сравнение уровня биомаркера в образце от индивидуума с пограничным уровнем.
В четвертом варианте осуществления второго аспекта, который также является вариантом осуществления первого, второго и третьего варианта осуществления второго аспекта и первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта, предпочтительно третьего варианта осуществления второго аспекта, уровень биомаркера в образце от индивидуума, который превышает пороговый уровень, указывает на то, что индивидуум страдает или имеет риск развития болезни Гоше.
В пятом варианте осуществления второго аспекта, который также является вариантом осуществления четвертого варианта осуществления второго аспекта, уровень биомаркера в образце от индивидуума, который является более низким, чем пороговый уровень, указывает на то, что индивидуум не страдает или не имеет риск развития болезни Гоше.
В шестом варианте осуществления второго аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого и пятого варианта осуществления второго аспекта и первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта, пороговый уровень выбирают так, чтобы чувствительность для диагностики болезни Гоше у индивидуума предпочтительно составляла приблизительно от 98,5% до 100%, более предпочтительно 100%, и чтобы специфичность для диагностики болезни Гоше у индивидуума предпочтительно составляла от 99,4% до 100%, более предпочтительно 100%.
В седьмом варианте осуществления второго аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого и шестого варианта осуществления второго аспекта и первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта, стадия b) и/или стадия e) дополнительно включает сравнение уровня биомаркера у указанного индивидуума с уровнем биомаркера, выявленным в образце контроля.
В восьмом варианте осуществления второго аспекта, который также является вариантом осуществления седьмого варианта осуществления второго аспекта, контролем является образец от индивидуума с положительным результатом тестирования на отсутствие болезни Гоше.
В девятом варианте осуществления второго аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого и восьмого варианта осуществления второго аспекта и первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта, уровень биомаркера в образце от индивидуума, который превышает уровень биомаркера в контрольном образце, указывает на то, что индивидуум страдает и/или имеет риск развития болезни Гоше.
В десятом варианте осуществления второго аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого и девятого варианта осуществления второго аспекта и первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта, болезнь Гоше выбрана из группы, включающей ненейронопатический тип I, хронический нейронопатический тип II и острый нейронопатический тип III.
В одиннадцатом варианте осуществления второго аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого и десятого варианта осуществления второго аспекта и первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта, предпочтительно десятого варианта осуществления второго аспекта, образец от индивидуума выбран из группы, состоящей из крови, продукта крови, мочи, слюны, цереброспинальной жидкости, стула, образца ткани и лимфы.
В двенадцатом варианте осуществления второго аспекта, который также является вариантом осуществления одиннадцатого варианта осуществления второго аспекта, образец от индивидуума выбран из группы, состоящей из крови и продукта крови.
В тринадцатом варианте осуществления второго аспекта, который также является вариантом осуществления одиннадцатого и двенадцатого варианта осуществления второго аспекта, продукт крови выбран из группы, включающей сыворотку и плазму.
В четырнадцатом варианте осуществления второго аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого и тринадцатого варианта осуществления второго аспекта первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта, предпочтительно тринадцатого варианта осуществления второго аспекта, способ имеет предел детекции 0,2 нг/мл.
В четырнадцатом варианте осуществления второго аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого и четырнадцатого варианта осуществления второго аспекта и первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта, предпочтительно любого из одиннадцатого, двенадцатого, тринадцатого, четырнадцатого и пятнадцатого варианта осуществления второго аспекта, пороговый уровень составляет 5,0 нг/мл.
В шестнадцатом варианте осуществления второго аспекта, который также является вариантом осуществления одиннадцатого и двенадцатого варианта осуществления второго аспекта, кровь является цельной кровью.
В семнадцатом варианте осуществления второго аспекта, который также является вариантом осуществления семнадцатого варианта осуществления второго аспекта, цельную кровь собирают на фильтровальную карту для высушенной крови.
В восемнадцатом варианте осуществления второго аспекта, который также является вариантом осуществления семнадцатого и восемнадцатого вариантов осуществления второго аспекта, способ имеет предел выявления 0,2 нг/мл.
В девятнадцатом варианте осуществления второго аспекта, который также является вариантом осуществления семнадцатого, восемнадцатого и девятнадцатого вариантов осуществления второго аспекта, пороговый уровень составляет 20,0 нг/мл.
Проблема, служащая основанием для настоящего изобретения, решается в третьем аспекте, который также является первым вариантом осуществления третьего аспекта, с помощью способа определения течения болезни Гоше у индивидуума, включающего стадию
a) определения в несколько моментов времени уровня биомаркера, присутствующего в образце от индивидуума, где биомаркером является свободный лизо-Gb1.
Во втором варианте осуществления третьего аспекта, который также является вариантом осуществления первого варианта осуществления третьего аспекта, индивидуума ранее лечили от болезни Гоше или у него была ранее диагностирована болезнь Гоше.
В третьем варианте осуществления третьего аспекта, который также является вариантом осуществления первого варианта осуществления третьего аспекта, индивидуума ранее не лечили от болезни Гоше или у индивидуума ранее не была диагностирована болезнь Гоше.
В четвертом варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго и третьего вариантов осуществления третьего аспекта, способ дополнительно включает стадию
b) применения, поддержания, уменьшения, усиления или не применения терапии, исходя из диагностики того, страдает ли индивидуумом или имеет ли он риск развития болезни Гоше.
В пятом варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго, третьего и четвертого вариантов осуществления третьего аспекта, способ дополнительно включает стадию
c) выявления биомаркера в образце от индивидуума после применения, поддержания, уменьшения, усиления или не применения терапии на стадии b).
В шестом варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого и пятого вариантов осуществления третьего аспекта, способ дополнительно включает стадию
d) определения уровня биомаркера в образце от индивидуума после применения, поддержания, уменьшения, усиления или не применения терапии на стадии b).
В седьмом варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого и шестого вариантов осуществления третьего аспекта, способ дополнительно включает стадии
e) определения того, является ли уровень биомаркера, определенный на стадии a), более низким, чем уровень биомаркера, определенный на стадии d);
В восьмом варианте осуществления третьего аспекта, который также является вариантом осуществления седьмого варианта осуществления третьего аспекта, способ дополнительно включает стадию
f) применения, поддержания, уменьшения, усиления или не применения терапии, исходя из стадии e).
В девятом варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого и восьмого вариантов осуществления третьего аспекта, способ дополнительно включает выявление по меньшей мере одного дополнительного биомаркера в образце от индивидуума.
В десятом варианте осуществления третьего аспекта, который также является вариантом осуществления девятого варианта осуществления третьего аспекта, способ дополнительно включает определение уровня по меньшей мере одного дополнительного биомаркера в образце от индивидуума.
В одиннадцатом варианте осуществления третьего аспекта, который также является вариантом осуществления девятого и десятого варианта осуществления третьего аспекта, по меньшей мере один дополнительный биомаркер выбран из группы, включающей хитотриозидазу и CCL18.
В двенадцатом варианте осуществления третьего аспекта, который также является вариантом осуществления одиннадцатого варианта осуществления третьего аспекта, по меньшей мере одним дополнительным биомаркером является хитотриозидаза.
В тринадцатом варианте осуществления третьего аспекта, который также является вариантом осуществления одиннадцатого варианта осуществления третьего аспекта, по меньшей мере одним дополнительным биомаркером является CCL18.
В четырнадцатом варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого и тринадцатого вариантов осуществления третьего аспекта, способ дополнительно включает выявление хитотриозидазы и CCL18.
В пятнадцатом варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого и четырнадцатого вариантов осуществления третьего аспекта, биомаркер и/или по меньшей мере один дополнительный биомаркер выявляют с помощью иммуноанализа, масс-спектрометрического анализа, биочипа, функциональных нуклеиновых кислот и/или флуоресцентного производного свободного лизо-Gb1.
В шестнадцатом варианте осуществления третьего аспекта, который также является вариантом осуществления пятнадцатого варианта осуществления третьего аспекта, биомаркер выявляют с помощью масс-спектрометрического анализа.
В семнадцатом варианте осуществления третьего аспекта, который также является вариантом осуществления шестнадцатого варианта осуществления третьего аспекта, масс-спектрометрический анализ выбран из группы, состоящей из SELDI, MALDI, MALDI-Q TOF, МС/МС, TOF-TOF и ESI-O-TOF.
В восемнадцатом варианте осуществления третьего аспекта, который также является вариантом осуществления семнадцатого варианта осуществления третьего аспекта, в масс-спектрометрическом анализе используется МС/МС.
В девятнадцатом варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого и восемнадцатого вариантов осуществления третьего аспекта, способ дополнительно включает преципитацию белка и/или ВЭЖХ.
В двадцатом варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого и девятнадцатого вариантов осуществления третьего аспекта, способ дополнительно включает преципитацию белка, ВЭЖХ и МС/МС.
В двадцать первом варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого и двадцать первого вариантов осуществления третьего аспекта, индивидуумом является человек.
В двадцать втором варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого и двадцать второго вариантов осуществления третьего аспекта, стадия выявления биомаркера в образце от индивидуума включает преципитацию белка из образца от индивидуума, где преципитация белка из образца обеспечивает супернатант образца, проведение ВЭЖХ и МС/МС для супернатанта образца и определение количества биомаркера и/или меньшей мере одного дополнительного биомаркера, который присутствует в образце от индивидуума.
В двадцать третьем варианте осуществления третьего аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго и двадцать третьего вариантов осуществления третьего аспекта, болезнь Гоше выбрана из группы, включающей ненейронопатический тип I, хронический нейронопатический тип II и острый нейронопатический тип III.
Проблема, служащая основанием для настоящего изобретения, решается в четвертом аспекте, который также является первым вариантом осуществления четвертого аспекта, с помощью способа определения эффективности по меньшей мере одного способа лечения, применяемого у индивидуума с положительными результатами тестирования на наличие или риск развитие болезни Гоше, включающего стадию
a) определение в несколько моментов времени уровня биомаркера, присутствующего в образце от индивидуума,
где биомаркером является свободный лизо-Gb1.
Во втором варианте осуществления четвертого аспекта, который также является вариантом осуществления первого варианта осуществления четвертого аспекта, индивидуума ранее лечили от болезни Гоше или у него была диагностирована болезнь Гоше.
В третьем варианте осуществления четвертого аспекта, который также является вариантом осуществления первого варианта осуществления четвертого аспекта, индивидуума ранее не лечили от болезни Гоше или у него ранее не была диагностирована болезнь Гоше.
В четвертом варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго и третьего вариантов осуществления четвертого аспекта, способ дополнительно включает стадию
b) применения, поддержания, уменьшения, усиления или не применения по меньшей мере одного способа лечения, применяемого у индивидуума, исходя из снижения уровня биомаркера.
В пятом варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго, третьего и четвертого вариантов осуществления четвертого аспекта, способ дополнительно включает стадию
c) выявления биомаркера в образце от индивидуума, где образец взят до начала лечения, после применения, поддержания, уменьшения, усиления или не применения по меньшей мере одного способа лечения на стадии b).
В шестом варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого и пятого вариантов осуществления четвертого аспекта, способ лечения выбран из группы, включающей фермент-заместительную терапию, субстратредукционную терапию, терапию шаперонами, генную терапию, трансплантацию стволовых клеток или пропускание ДНК/РНК.
В седьмом варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого и шестого вариантов осуществления четвертого аспекта, способ дополнительно включает стадии
d) определения того, является ли уровень биомаркера, определенный на стадии a), более низким, чем уровень биомаркера, определенный на стадии c).
В восьмом варианте осуществления четвертого аспекта, который также является вариантом осуществления седьмого варианта осуществления четвертого аспекта, способ дополнительно включает стадии
e) применения, поддержания, уменьшения, усиления или не применения по меньшей мере одного способа лечения, применяемого у индивидуума, исходя из стадии d).
В девятом варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого и восьмого вариантов осуществления четвертого аспекта, способ дополнительно включает выявление по меньшей мере одного дополнительного биомаркера в образце от индивидуума.
В десятом варианте осуществления четвертого аспекта, который также является вариантом осуществления девятого варианта осуществления четвертого аспекта, способ дополнительно включает определение уровня по меньшей мере одного дополнительного биомаркера в образце от индивидуума.
В одиннадцатом варианте осуществления четвертого аспекта, который также является вариантом осуществления девятого и десятого варианта осуществления четвертого аспекта, по меньшей мере один дополнительный биомаркер выбран из группы, включающей хитотриозидазу и CCL18.
В двенадцатом варианте осуществления четвертого аспекта, который также является вариантом осуществления одиннадцатого варианта осуществления четвертого аспекта, по меньшей мере одним дополнительным биомаркером является хитотриозидаза.
В тринадцатом варианте осуществления четвертого аспекта, который также является вариантом осуществления одиннадцатого варианта осуществления четвертого аспекта, по меньшей мере одним дополнительным биомаркером является CCL18.
В четырнадцатом варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого и тринадцатого вариантов осуществления четвертого аспекта, способ дополнительно включает выявление хитотриозидазы и CCL18.
В пятнадцатом варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого и четырнадцатого вариантов осуществления четвертого аспекта, любой биомаркер выявляют с помощью иммуноанализа, масс-спектрометрического анализа, биочипа, функциональных нуклеиновых кислот и/или флуоресцентного производного свободного лизо-Gb1.
В шестнадцатом варианте осуществления четвертого аспекта, который также является вариантом осуществления пятнадцатого варианта осуществления четвертого аспекта, биомаркер выявляют с помощью масс-спектрометрического анализа.
В семнадцатом варианте осуществления четвертого аспекта, который также является вариантом осуществления шестнадцатого варианта осуществления четвертого аспекта, масс-спектрометрический анализ выбран из группы, состоящей из SELDI, MALDI, MALDI-Q TOF, МС/МС, TOF-TOF и ESI-O-TOF.
В восемнадцатом варианте осуществления четвертого аспекта, который также является вариантом осуществления семнадцатого варианта осуществления четвертого аспекта, в масс-спектрометрическом анализе используется МС/МС.
В девятнадцатом варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого и восемнадцатого вариантов осуществления четвертого аспекта, способ дополнительно включает преципитацию белка и/или ВЭЖХ.
В двадцатом варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого и девятнадцатого вариантов осуществления четвертого аспекта, способ дополнительно включает преципитацию белка, ВЭЖХ и МС/МС.
В двадцать первом варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого и двадцатого вариантов осуществления четвертого аспекта, индивидуумом является человек.
В двадцать втором варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого и двадцать первого вариантов осуществления четвертого аспекта, стадия выявления биомаркера в образце от индивидуума включает преципитацию белка из образца от индивидуума, где преципитация белка из образца обеспечивает супернатант образца; проведение для объема супернатанта ВЭЖХ и МС/МС и определение количества биомаркера и/или по меньшей мере одного дополнительного биомаркера, который присутствует в образце от индивидуума.
В двадцать третьем варианте осуществления четвертого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого и двадцать второго вариантов осуществления четвертого аспекта, болезнь Гоше выбрана из группы, включающей ненейронопатический тип I, хронический нейронопатический тип II и острый нейронопатический тип III.
Проблема, служащая основанием для настоящего изобретения, решается в пятом аспекте, который также является первым вариантом осуществления пятого аспекта, с помощью способа определения эффективности соединения для лечения болезни Гоше, включающего стадии:
a) определения уровня биомаркера у индивидуума, имеющего болезнь Гоше;
b) введения указанному индивидууму указанного соединения;
c) определения вновь уровня биомаркера у указанного индивидуума;
d) определения того, является ли уровень биомаркера, определенный на стадии a), более низким, чем уровень биомаркера, определенный на стадии c),
где уровень биомаркера, определенный на стадии c), который является более низким, чем уровень биомаркера, определенный на стадии a), указывает на эффективность указанного соединения, и где биомаркером является свободный лизо-Gb1.
Во втором варианте осуществления пятого аспекта, который также является вариантом осуществления первого варианта осуществления пятого аспекта, способ дополнительно включает определение уровня биомаркера в контроле.
В третьем варианте осуществления пятого аспекта, который также является вариантом осуществления первого и второго варианта осуществления пятого аспекта, болезнь Гоше выбрана из группы, включающей ненейронопатический тип I, хронический нейронопатический тип II и острый нейронопатический тип III.
Проблема, служащая основанием для настоящего изобретения, решается в шестом аспекте, который также является первым вариантом осуществления шестого аспекта, с использованием масс-спектрометрии для выявления биомаркера, где биомаркером является свободный лизо-Gb1.
Во втором варианте осуществления шестого аспекта, который также является вариантом осуществления первого варианта осуществления шестого аспекта, выявление включает использование ВЭЖХ.
В третьем варианте осуществления шестого аспекта, который также является вариантом осуществления первого и второго варианта осуществления шестого аспекта, выявление включает МС/МС.
Проблема, служащая основанием для настоящего изобретения, решается в седьмом аспекте, который также является первым вариантом осуществления седьмого аспекта, с использованием биомаркера для болезни Гоше, предпочтительно в способе в соответствии с любым из первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта, первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого и девятнадцатого вариантов осуществления второго аспекта, первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго и двадцать третьего вариантов осуществления третьего аспекта, первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго и двадцать третьего вариантов осуществления четвертого аспекта и первого, второго и третьего вариантов осуществления пятого аспекта, где биомаркером является свободный лизо-Gb1.
Во втором варианте осуществления седьмого аспекта, который также является вариантом осуществления первого варианта осуществления седьмого аспекта, болезнь Гоше выбрана из группы, включающей ненейронопатический тип I, хронический нейронопатический тип II и острый нейронопатический тип III.
Проблема, служащая основанием для настоящего изобретения, решается в восьмом аспекте, который также является первым вариантом осуществления восьмого аспекта, с помощью набора для определения присутствия биомаркера в образце от индивидуума, где набор включает
a) партнера биомаркера по взаимодействию;
b) необязательно твердую подложку, содержащую по меньшей мере один реагент для улавливания, присоединенный к ней, где реагент для улавливания связывает биомаркер; и
c) инструкции по применению твердой подложки для выявления биомаркера, где биомаркером является свободный лизо-Gb1.
Во втором варианте осуществления восьмого аспекта, который также является вариантом осуществления первого варианта осуществления восьмого аспекта, набор предназначен для
a) диагностики болезни Гоше;
b) определения течения болезни Гоше у индивидуума; и/или
c) определения эффективности по меньшей мере одного способа лечения, применяемого у индивидуума,
где способ, используемый в a), b) и/или c), предпочтительно представляет собой способ согласно любому из первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго, двадцать третьего и двадцать четвертого вариантов осуществления первого аспекта, первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого и девятнадцатого вариантов осуществления второго аспекта, первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго и двадцать третьего вариантов осуществления третьего аспекта, первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого, двадцатого, двадцать первого, двадцать второго и двадцать третьего вариантов осуществления четвертого аспекта и первого, второго и третьего вариантов осуществления пятого аспекта.
В третьем варианте осуществления восьмого аспекта, который также является вариантом осуществления первого и второго варианта осуществления восьмого аспекта, болезнь Гоше выбрана из группы, включающей ненейронопатический тип I, хронический нейронопатический тип II и острый нейронопатический тип III.
Проблема, служащая основанием для настоящего изобретения, решается в девятом аспекте, который также является первым вариантом осуществления девятого аспекта, с помощью программного продукта, включающего
a) код, который дает доступ к данным, приписываемым образцу, причем данные включают выявление по меньшей мере одного биомаркера в образце, причем биомаркер выбран из группы выбранный из группы, включающей свободный лизо-Gb1, хитотриозидазу и CCL18; и
b) код, который выполняет алгоритм классификации, который классифицирует статус образца в отношении болезни Гоше в качестве функции выявления.
Во втором варианте осуществления девятого аспекта, который также является вариантом осуществления первого варианта осуществления девятого аспекта, болезнь Гоше выбрана из группы, включающей ненейронопатический тип I, хронический нейронопатический тип II и острый нейронопатический тип III.
Авторы настоящего изобретения неожиданно открыли, что свободный лизо-Gb1 представляет собой биомаркер, который обеспечивает способ диагностики болезни Гоше у индивидуума, более конкретно, диагностику болезни Гоше у индивидуума с высокой специфичностью и чувствительностью с использованием указанного свободного лизо-Gb1 в качестве биомаркера.
Авторы настоящего изобретения неожиданно обнаружили, что свободный лизо-Gb1, который может быть выявлен способами по настоящему изобретению, циркулирует в крови индивидуума в концентрации приблизительно 1/1000 от общего Gb1. Более того, авторы настоящего изобретения неожиданно обнаружили, что, в отличие от общего Gb1, свободный лизо-Gb1, который присутствует в крови индивидуума, является пригодным в способе диагностики болезни Гоше у индивидуума, включающем стадию выявления биомаркера в образце от индивидуума, где биомаркером является свободный лизо-Gb1. Авторы настоящего изобретения также неожиданно открыли, что уровень свободного лизо-Gb1, определенного в образце от индивидуума способами по настоящему изобретению, обеспечивает диагностику болезни Гоше с высокой чувствительностью и высокой специфичностью.
Таким образом, настоящее изобретение отличается от идеи уровня техники тем, что способ по настоящему изобретению включает определение уровня лизосоединения с использованием указанного лизосоединения в качестве биомаркера для диагностики сфинголипидозов. Более конкретно, авторы настоящего изобретения неожиданно открыли, что определение уровня свободного лизо-Gb1 в образце от индивидуума позволяет диагностику болезни Гоше с высокой чувствительностью и высокой специфичностью.
Также заслугой авторов настоящего изобретения является то, что они осознали, что часть общего Gb1, который накапливается при болезни Гоше, присутствует в качестве молекулы в ее лизоформе, т.е. свободного лизо-Gb1, и циркулирует в крови индивидуума в указанной лизоформе, помимо Gb1.
Термин "лизосомальное нарушение накопления", также называемый "лизосомальной болезнью накопления" или "LSD", как используют в рамках изобретения, предпочтительно относится к генетическим заболеваниям и метаболическим нарушениям, которые являются результатом дефектов лизосомальной функции. Лизосомальные нарушения накопления вызываются лизосомальной дисфункцией, обычно в результате дефицита одного фермента, требуемого для метаболизма липидов, гликопротеинов или так называемых мукополисахаридов. Подобно другим генетическим заболеваниям, индивидуумы наследуют лизосомальные болезни накопления от их родителей. Хотя каждое нарушение является результатом обособленных мутаций генов, которые обуславливают дефицит активности фермента, все они обладают общей биохимической характеристикой - все лизосомальные нарушения возникают в результате аномального накопления веществ внутри лизосомы.
Термин "болезнь Гоше", как используют в рамках изобретения, предпочтительно относится к лизосомальной болезни накопления (LSD), более конкретно к сфинголипидозам, которые характеризуются отложением глюкоцереброзида в клетках макрофагально-моноцитарной системы. Болезнь Гоше является наиболее распространенной из лизосомальных болезней накопления (James, William D.; Berger, Timothy G.; et al. (2006). Andrews' Diseases of the Skin: clinical Dermatology. Saunders Elsevier. ISBN 0-7216-2921-0). Она вызывается наследственным дефицитом фермента глюкоцереброзидазы. Указанный дефицит является результатом рецессивной мутации(й) в гене, кодирующем глюкоцереброзидазу - специфическую лизосомальную гидролазу (также известную как бета-глюкозидаза, EC 3.2.1.45, PDB 1OGS), расположенном на хромосоме 1 (1q21) и поражает как мужчин, так и женщин. Различные мутации в бета-глюкозидазе определяют остаточную активность фермента, и, в большой степени, фенотип.
Глюкоцереброзидазу также обозначают в настоящем документе как β-глюкоцереброзидаза, бета-глюкозидаза, кислая бета-глюкозидаза, глюкозилцерамидаза или D-глюкозил-N-ацилсфингозинглюкогидролаза.
Фермент представляет собой белок массой 55,6 кДа длиной 497 аминокислот, обладающий активностью глюкозилцерамидазы, т.е. этот фермент катализирует разрушение жирового вещества, называемого глюкоцереброзидом, путем расщепления, т.е. гидролиза, бета-глюкозидной связи глюкоцереброзида, который является промежуточным соединением в метаболизме гликолипидов. Глюкоцереброзид, также обозначаемый в настоящем описании как глюкозилцерамид или Gb1, представляет собой компонент клеточной мембраны эритроцитов и лейкоцитов. Когда фермент является дефектным, вещество накапливается, в частности в клетках мононуклеарного клеточного ростка. Это является следствием того, что макрофаги, которые устраняют эти клетки, неспособны устранять побочный продукт, который накапливается в фибриллах, и превращаются в так называемые клетки Гоше, которые при световой микроскопии напоминают мятую бумагу. Жировой материал может накапливаться в селезенке, печени, почках, легких, головном мозге и костном мозге.
Болезнь Гоше имеет три общих клинических подтипа.
- Ненейронопатический тип I, также обозначаемый в настоящем описании как тип I, является наиболее распространенной формой заболевания, встречающийся приблизительно в 1 из 50000 случаев рождения живого ребенка. Наиболее часто он встречается у лиц происхождения евреев ашкенази. Симптомы могут появляться рано в жизни или во взрослом возрасте и включают увеличенную печень и значительно увеличенную селезенку (совместно гепатоспленомегалия); селезенка может разрываться и вызывать дополнительные осложнения. Слабость скелетных мышц и заболевание костей могут быть выраженными. Увеличение селезенки и вытеснение костного мозга вызывают анемию, тромбоцитопению и лейкопению. Головной мозг не поражается патологически, однако может происходить нарушение легких и, редко, нарушение почек. У индивидуумов с заболеванием в этой группе обычно легко возникают кровоподтеки (вследствие низких уровней тромбоцитов), и они испытывают усталость вследствие низких количеств эритроцитов. В зависимости от возникновения и тяжести заболевания, пациенты с типом I могут хорошо жить до взрослого возраста. Многие индивидуумы с заболеванием имеют мягкую форму заболевания или могут не проявлять никаких симптомов.
- Хронический нейронопатический тип II, также обозначаемый в настоящем описании как тип II, может начинаться в любое время в детском возрасте или даже во взрослом состоянии, и встречается приблизительно в 1 из 100000 случаев рождения живых детей. Он характеризуется медленно прогрессирующими, но более мягкими неврологическими симптомами по сравнению с острым вариантом или типом III. Основные симптомы включают увеличенную селезенку и/или печень, судорожные припадки, плохую координацию, нарушения скелетных мышц, нарушения движения глаз, нарушения крови, включающие анемию и респираторные проблемы. Пациенты часто доживают до их раннего подросткового возраста и взрослого возраста.
- Острый нейронопатический тип III, также обозначаемый в настоящем описании как тип III, как правило, начинается в пределах 6 месяцев от рождения и имеет частоту встречаемости приблизительно 1 на 100000 случаев рождения живого ребенка. Симптомы включают увеличенную печень и селезенку, обширное и прогрессирующее повреждение головного мозга, нарушения движения глаз, спастичность, судорожные припадки, ригидность конечностей и плохую способность к сосанию и глотанию. Страдающие дети обычно погибают в возрасте до 2 лет.
Эти подтипы подверглись критике в связи с тем, что они не учитывают полный спектр наблюдаемых симптомов. Также существуют сложные гетерозиготные варианты, которые значительно увеличивает сложность прогнозирования течения заболевания.
При болезни Гоше типа II и III, глюкоцереброзид накапливается в головном мозге вследствие кругооборота комплексных липидов в ходе развития головного мозга и образования миелиновой оболочки нервов.
Симптомы могут включать увеличенную селезенку и печень, нарушение функции печени, нарушения скелета и повреждения костей, которые могут быть болезненными, тяжелые неврологические осложнения, опухание лимфатических узлов и (иногда) близлежащих суставов, вздутие живота, коричневатый оттенок кожи, анемию, низкий уровень тромбоцитов в крови и отложение желтого жира в белке глаза (склере). Лица, пораженные наиболее серьезно, также могут быть более чувствительными к инфекции.
Терапия: Фермент-заместительная терапия, также обозначаемая в настоящем описании как ERT, является предпочтительной для выбора терапией. Однако успешная трансплантация костного мозга может излечить неневрологические проявления заболевания, поскольку она предоставляет популяцию моноцитов с активной бета-глюкозидазой. Важно упомянуть, что эта процедура несет в себе существенный риск и ее редко проводят у пациентов с болезнью Гоше. Хирургическая операция для удаления селезенки (спленэктомия) может требоваться очень редко, если пациент имеет массивную анемию и когда увеличенный орган нарушает комфорт пациента. Для некоторых пациентов с анемией может быть полезным переливание крови. Для других пациентов может требоваться хирургическая операция по протезированию сустава для улучшения подвижности и качества жизни. Другие возможности лечения включают антибиотики от инфекций, противоэпилептические средства от судорожных припадков, бисфосфонаты от повреждения костей и трансплантаты печени.
ERT основана на постоянном внутривенном введении рекомбинантной глюкоцереброзидазы (имиглуцераза, Genzyme; велаглуцераза, Shire; талиглуцераза, Protalix) (G.A. Grabowski et al., Enzyme therapy in type I Gaucher's disease: comparative efficacy of mannose-terminated glucocerebrosidase from natural and recombinant sources, Ann. Intern. Med. 122 (1995) 33-39). Для пациентов с типом I и большинства пациентов с типом III, ERT с внутривенной рекомбинантной глюкоцереброзидазой (например, такой как имиглуцераза) может значительно уменьшать размер печени и селезенки, уменьшать скелетные аномалии, и обращать вспять другие проявления.
Позднее в качестве альтернативного способа лечения болезни Гоше была разработана субстратредукционная терапия, также обозначаемая в настоящем описании как SRT (F.M. Piatt et al. N-butyl-desoxynojirirnycin is a novel inhibitor of glycosphingolipid biosynthesis, J. Biol. Chem. 269 (1994) 8362-8365.). Частичное ингибирование синтеза глюкосфинголипида посредством N-бутилезоксинойиримицина (миглустат, Actelion) используют в попытках сбалансировать сниженную катаболическую способность у пациентов с болезнью Гоше. SRT может оказаться эффективной для остановки типа II, поскольку это средство может проходить через кровяной барьер в головной мозг. В настоящее время не существует эффективного способа лечения тяжелого повреждения головного мозга, которое может возникать у пациентов с болезнью Гоше типа II и III.
Как ERT, так и SRT, как правило приводят к значительным клиническим улучшениям, таким как снижение гепатоспленомегалии, коррекция гематологических аномалий, стабилизация или улучшение повреждений скелета.
Глюкоцереброзид, также обозначаемый в настоящем описании как глюкозилцерамид или Gb1, означает любой цереброзид, в котором моносахаридной концевой группой является глюкоза.
Специалистом в данной области будет понятно, что термин "лизо-Gb1", как используют в рамках изобретения, предпочтительно применительно к различным способам, предпочтительно означает, что молекула присутствует в ее свободной аминоформе. Точнее, лизо-Gb1, как используют в рамках изобретения, предпочтительно отличается от Gb1 тем, что с первичной аминогруппой части молекулы в виде сфингозина не связана часть в виде жирной кислоты. Более того, лизо-Gb1 также обозначают в настоящем описании как глюкозилсфингозин или лизо-глюкоцереброзид, и он имеет формулу:
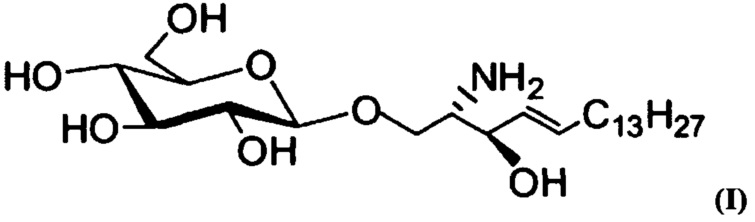
Специалистам в данной области будет понятно, что термин "свободный лизо-Gb1", как используют в рамках изобретения, предпочтительно относится к лизо-Gb1, который в таком качестве присутствуют в образце от индивидуума, таком как кровь, и, предпочтительно, не является результатом манипулирования с образцом указанного индивидуума. Такое манипулирование с образцом может представлять собой манипулирование, описанное Groener et al. (Groener et al. Plasma glucosylceramide and ceramide in type 1 Gaucher disease patients: Correlations with disease severity and response to therapeutic intervention. Biochimica et Biophysica Acta 1781(2908)72-78, 2007). В соответствии с указанным документом, свободный лизо-Gb1, который присутствует в таком качестве в крови индивидуума, от которого взят образец, более конкретно, не является лизо-Gb1, который образуется путем химической, биохимической или физической обработки образца, содержащегося в крови и образце, соответственно, предпочтительно вне организма пациента. Также специалистам в данной области будет понятно, что свободный лизо-Gb1, как используют в рамках изобретения, предпочтительно присутствует в дополнение к Gb1, и он представляет собой соединение, продуцируемое в результате метаболической активности индивидуума. Таким образом, Gb1, который представляет собой молекулу, которая накапливается в связи с болезнью Гоше, присутствующую в образце от индивидуума, имеет, по сравнению с молекулой в свободной лизо-форме, т.е. свободным лизо-Gb1, присутствующим в крови индивидуума, по меньшей мере одну часть жирной кислоты, связанную с первичной аминогруппой части в виде сфингозина в лизо-Gb1.
Термин "образец", как предпочтительно используют в настоящем описании, означает ограниченное количество материала индивидуума, где указанный материал индивидуума является частью или взят из индивидуума и/или организма индивидуума и где указанный материал выбран из группы, включающей жидкости организма, такие как кровь, продукт крови, моча, слюна, цереброспинальная жидкость и лимфа, а также стул или любой тип ткани и/или клеточного материала, являющийся частью индивидуума и/или организма индивидуума. Специалистом в данной области будет понятно, что предполагается, что присутствие и/или уровень биомаркера по изобретению в указанном образце являются сходными и отражают присутствие и/или уровень биомаркера в большем количестве материала индивидуума. Более точно и в качестве иллюстративного неограничивающего примера, уровень биомаркера по изобретению, определенный в образце, составляющем несколько мл крови индивидуума, также отражает уровень указанного биомаркера в крови организма индивидуума. Более того, в одном варианте осуществления способа по изобретению для диагностики болезни Гоше у индивидуума образец от индивидуума включает указанный материал индивидуума в форме, например обработанной, фиксированной и/или сохраненной так, чтобы указанный образец был пригодным для применения в способе по изобретению, причем такая обработка, фиксация и/или сохранение предпочтительно не приводят к образованию лизо-Gb1. Материал индивидуума в образце можно таким образом разбавлять, например, с помощью растворителя, пригодного для способа по изобретению, такого как метанол и/или вода, можно сушить, например на фильтровальной карте, можно растворять после высушивания, например, с помощью растворителя, пригодного для способа по изобретению, такого как метанол и/или вода, или можно добавлять вещество, где указанное вещество препятствует свертыванию крови, например, такое как ЭДТА или гепарин. Кроме того, специалисту в данной области будет понятно, что способ по изобретению включает разделение указанного материала индивидуума на отдельные компоненты указанного материала индивидуума, и/или отдельные компоненты указанного материала индивидуума экстрагируют из указанного материала индивидуума, например, кровь разделяют на плазму и сыворотку и клеточные компоненты крови или белок преципитируют из образца. Естественным образом будет понятно, что после такой обработки, фиксации и/или сохранения образец подвергают способам по изобретению для выявления и/или определения уровня биомаркера, содержащегося в указанном образце, причем такая обработка, фиксация и/или сохранение предпочтительно не приводят к образованию лизо-Gb1.
В одном варианте осуществления способа по настоящему изобретению, где цельную кровь собирают на фильтровальной карте с высушенной кровью, предпочтительно приблизительно 3 мкл цельной крови собирают в области указанной фильтровальной карты для высушенной крови, имеющей диаметр 3 мм. Специалисту в данной области будет понятно, что общий объем, собранный таким образом, может варьировать, в зависимости от гематокрита конкретного пациента.
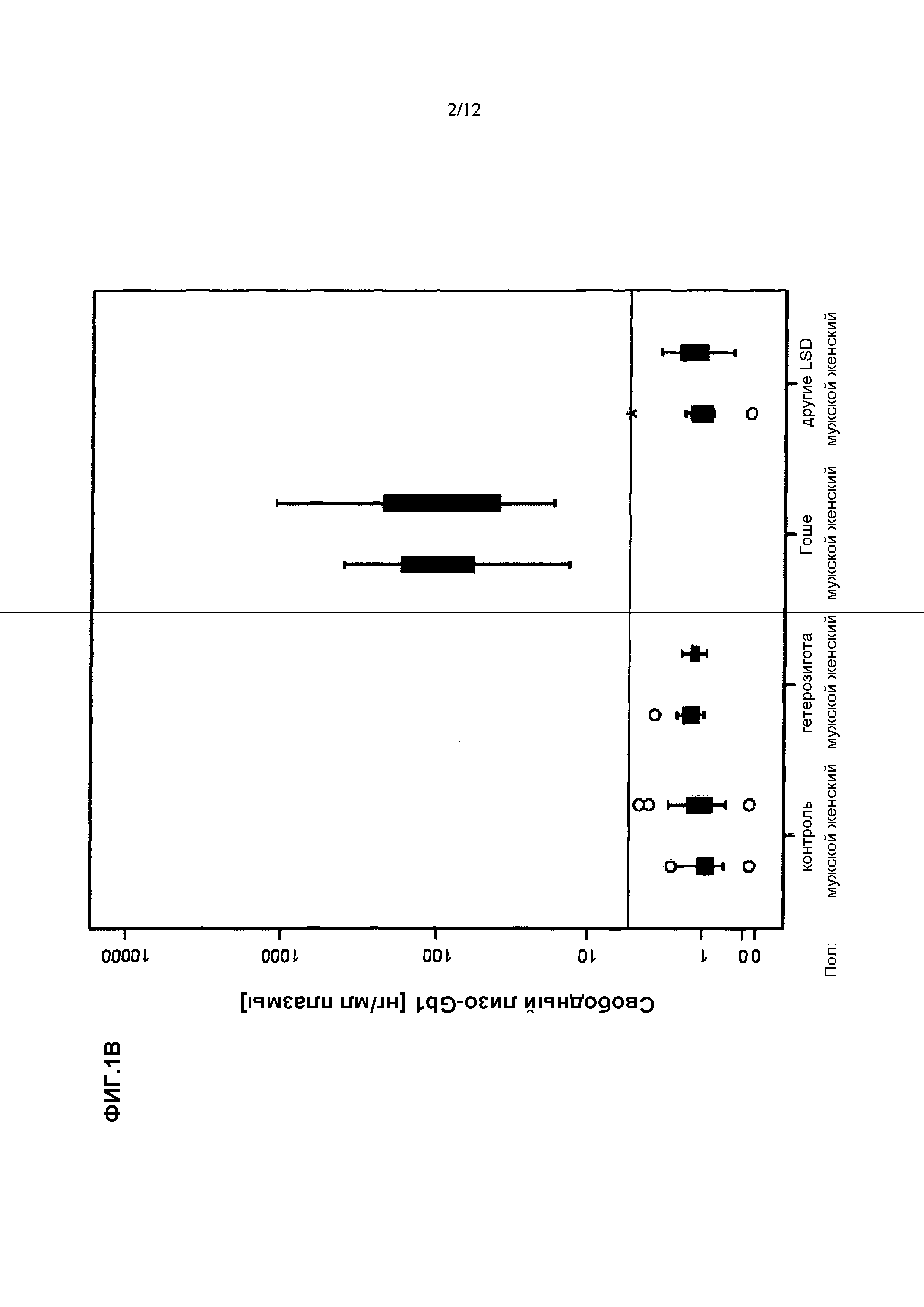
Уровни глюкозилцерамида и его предшественника церамида использовали на уровне техники для коррелирования их присутствия в плазме с тяжестью болезни Гоше типа I и ответа на применение терапии (Groener et al., Plasma glucosylceramide and ceramide in type 1 Gaucher's disease patients: Correlations with disease severity and response to therapeutic intervention. Biochimica et Biophysica Acta 1781(2908)72-78, 2007). Таким образом, было выявлено, что уровень Gb1 отличается, хотя уровни церамида не отличались значимо в плазме подвергнутых лечению и не подвергнутых лечению пациентов с болезнью Гоше типа I.
В исследовании, описанном Groener et al. (Groener et al., выше) соотношение Gb1/церамид использовали для отличения пациентов с болезнью Гоше от здоровых пациентов. Gb1 и церамид измеряли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), по существу как описано в Groener et al. (J.E.M. Groener et al., HPLC for simultaneous quantification of total ceramide, glucosylceramide, and ceramide trihexoside concentrations in plasma, Clin. Chern. 53 (2007) 742-747). Применительно к этому важно понять, что Gb1, присутствующий в плазме, главным образом, состоит из части в виде сахара и части в виде церамида. Часть в виде церамида содержит сфингозин и часть в виде жирной кислоты. В соответствии со способом уровня техники липиды экстрагируют и церамид и глюкозилцерамид деацитилируют щелочным гидролизом, таким образом, получая лизоформу, т.е. лизо-Gb1 (T. Taketomi et al., Rapid method of preparation of lysoglycosphingolipides and their confirmation by delayed extraction matrix-assisted laser desporption ionization time-of-flight mass spectrometry, J. Biochem. (Tokyo) 120 (1996) 573-579). Затем полученный таким образом лизо-Gb1 метят флуоресцентным красителем путем преобразования в производное с помощью O-фталдиальдегида (OPA) по первичной аминогруппе. После этого преобразованные в производные сфингоидные основания разделяют обращеннофазовой ВЭЖХ и выявляют с помощью детектора флуоресценции. Таким образом, указанный способ уровня техники способен выявлять общий Gb1, состоящий из свободного лизо-Gb1 и Gb1, и не способен отличить уровень свободного лизо-Gb1 от уровня Gb1 в образце от индивидуума. Уровень указанного общего Gb1 после отщепления различных частей в виде жирных кислот от NH2-группы Gb1 обычно находится в диапазоне от 5 до 30 мкг на мл плазмы или сыворотки. Из этого очевидно, что в способе Groener et al. (Groener et al., выше) общий Gb1, который может быть приготовлен и получен, соответственно, из образца, предпочтительно образца крови, от индивидуума, используют в качестве биомаркера вместо свободного лизо-Gb1, содержащегося в крови и, таким образом, также в образе, без проведения отщепления части/частей в виде жирной кислоты, предпочтительно расщепления, проводимого специалистом, обрабатывающим образец. Таким образом, настоящее изобретение относится к выявлению свободного лизо-Gb1, а не общего Gb1, как описано на уровне техники. Вариантом осуществления способов по настоящему изобретению, включающих выявление и/или определение уровня свободного лизо-Gb1 в образце от индивидуума, является то, что свободный лизо-Gb1 и/или уровень свободного лизо-Gb1 определяют отдельно и/или независимо от Gb1 или уровня Gb1, который может присутствовать в крови индивидуума. В следующем варианте осуществления Gb1 и/или уровень Gb1 выявляют/определяют в дополнение к выявлению и/или определению уровня свободного лизо-Gb1.
Важно, что каждый первичный амин, циркулирующий в плазме и являющийся достаточно липофильным, подлежащий экстракции одновременно с Gb1 с использованием органического растворителя в соответствии с указанным способом уровня техники, метят соответствующим образом, и, таким образом, он может препятствовать выявлению расщепленного лизо-Gb1.
Хотя общий Gb1, измеренный в качестве лизо-Gb1 в указанном исследовании уровня техники был увеличен в плазме указанных пациентов, указанное увеличение общего Gb1 не было выраженным, и, таким образом, специфичность и чувствительность способа были низкими, что демонстрирует, что Gb1 не пригоден в качестве биомаркера для болезни Гоше.
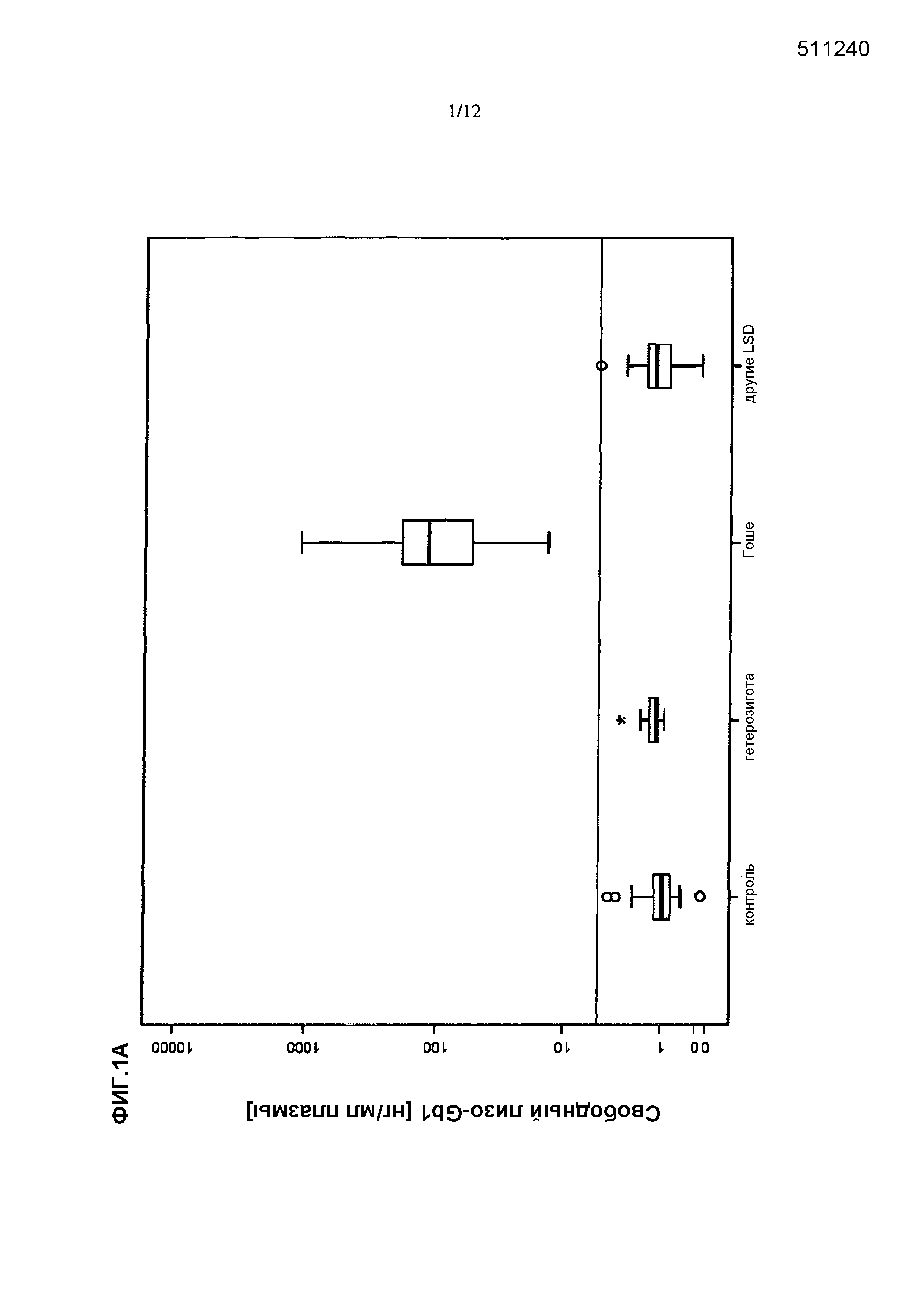
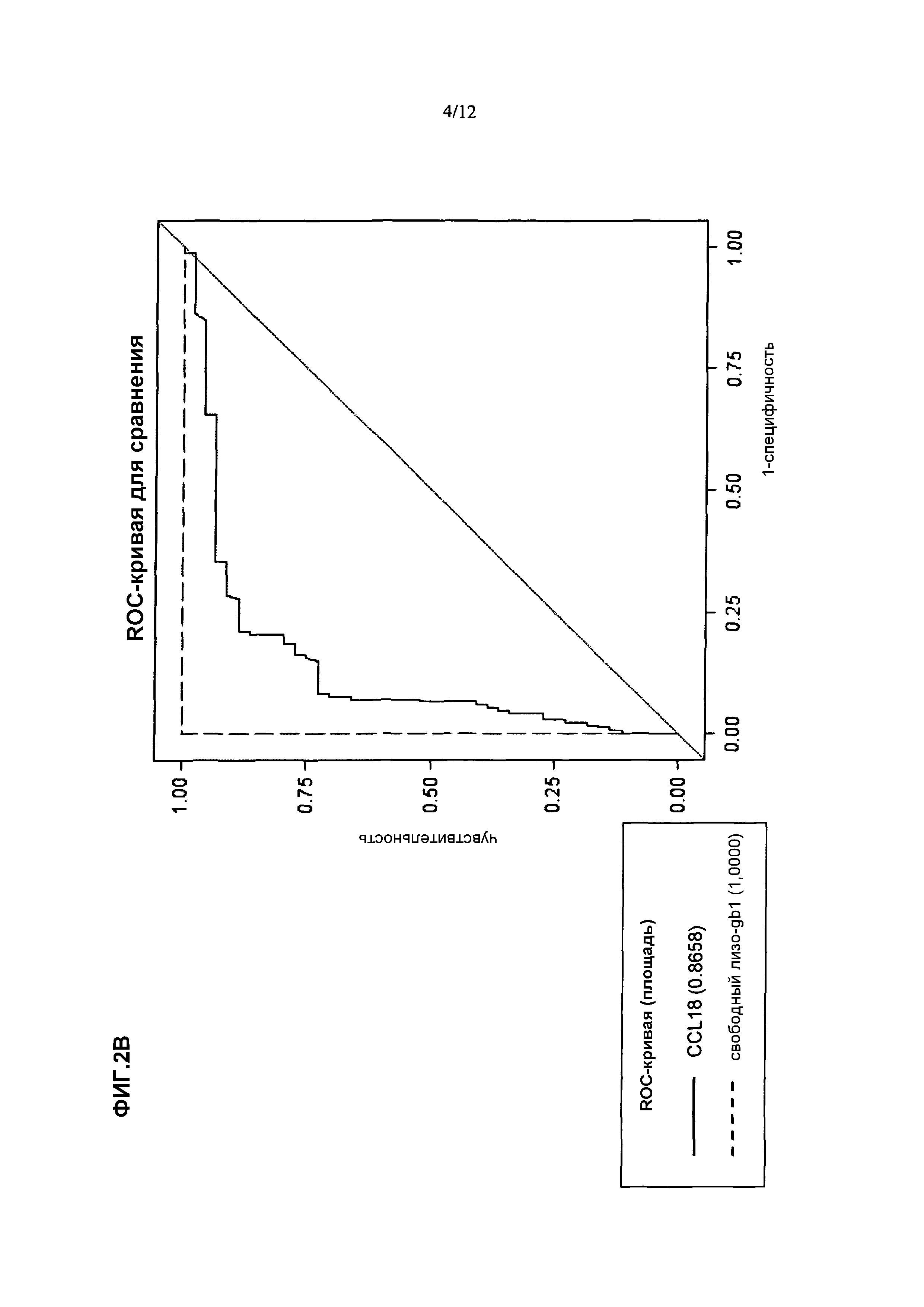
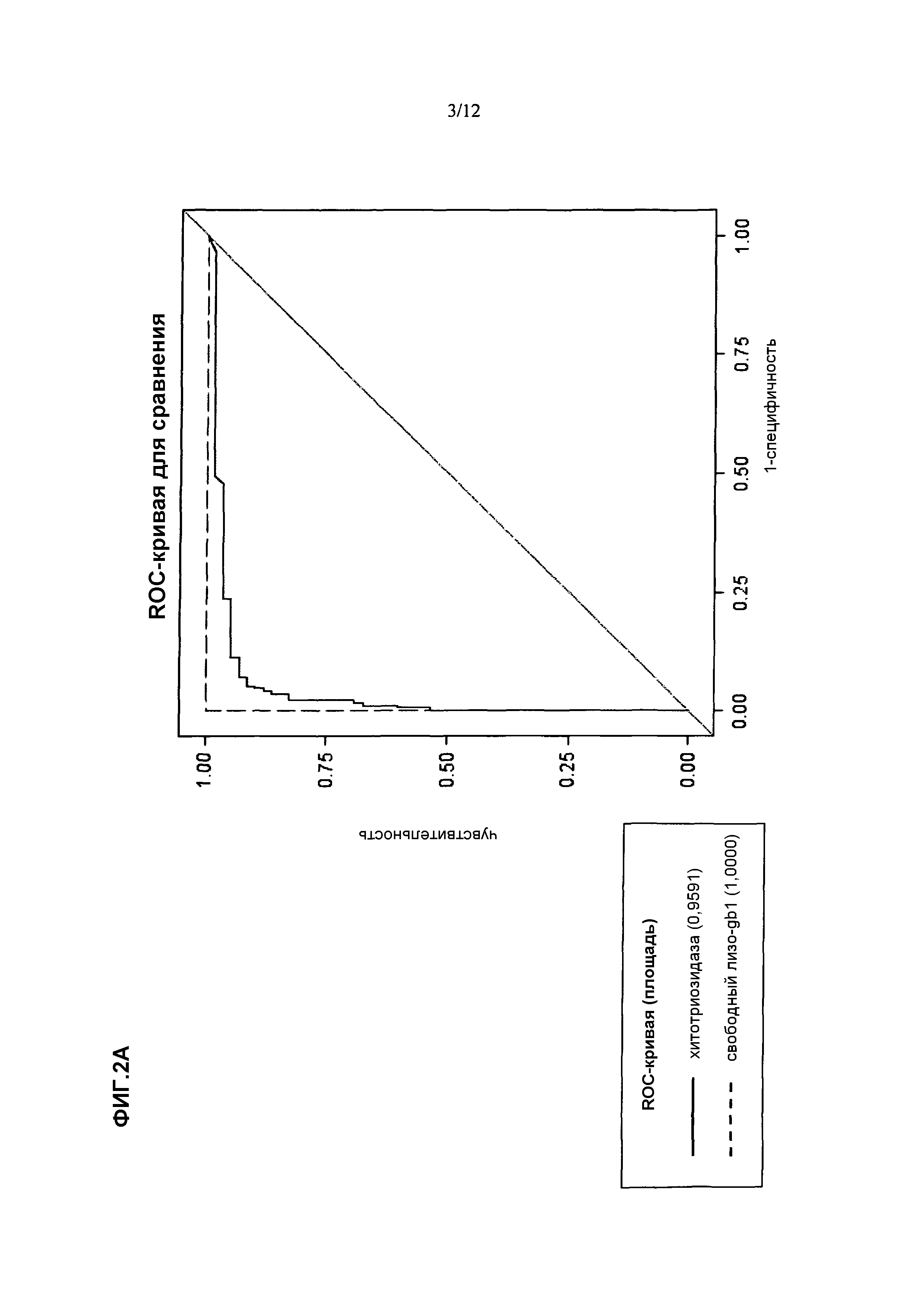
Применительно к этому, важно отметить, что в соответствии со знаниями авторов изобретения, данные, описанные в разделе "Примеры" настоящего описания применительно к настоящему изобретению отражают первый систематический анализ специфичности и чувствительности в отношении прямого сравнения биомаркеров болезни Гоше из уровня техники, т.е. хитотриозидазы и CCL18, и свободного лизо-Gb1.
Обеспечивая чувствительность и/или специфичность, составляющие >99,0%, свободный лизо-Gb1 при определении способами по настоящему изобретению является биомаркером, пригодным для клинического применения применительно к болезни Гоше. Таким образом, биомаркер по настоящему изобретению и его применение отчетливо превосходят эффективность биомаркеров, известных из уровня техники, более конкретно, одного из хитотриозидазы и CCL18. Будет хорошо понятно, что также способ, используемый Groener et al. (Groener et al., выше), является необъективным по сравнению со способами по настоящему изобретению в том, что специфичность и чувствительность указанного способа уровня техники являются более низкими и диагностика болезни Гоше на основе такого способа уровня техники с использованием общего Gb1, а не свободного лизо-Gb1, являются непригодными для надежного клинического его применения, т.е. способ не обладает чувствительностью и специфичностью, достаточными для диагностики болезни Гоше посредством надежного статистически достоверного прогнозирования.
Хитотриозидаза: ранее было открыто, что клетки Гоше секретируют хитотриозидазу и что хитотриозидаза в плазме пациентов с симптомами болезни Гоше повышена в среднем в несколько сотен раз (Hollak et al. Marked elevation of plasma chitotriosidase activity. A novel hallmark of Gaucher disease. J Clin Invest. 1994; 93: 1288-1292). Таким образом, хитотриозидазу в плазме используют в качестве заместительного маркера для проявлений болезни Гоше и используют для диагностики, раннего определения возникновения заболевания и мониторинга терапевтической эффективности (Hollak et al. Marked elevation of plasma chitotriosidase activity. A novel hallmark of Gaucher disease. J Clin Invest. 1994; 93: 1288-1292; Mistry et al. A practical approach to diagnosis and management of Gaucher's disease. Baillieres Clin Haematol. 1997; 10: 817-838; Cox et al. Novel oral treatment of Gaucher's disease with N-butyldesoxynojirimycin (OGT 918) to decrease substrate biosynthesis. Lancet. 2000; 355: 1481-1485; Hollak et al. Clinically relevant therapeutic endpoints in type I Gaucher disease. J Inherit Metab Dis. 2001; 24: 97-105).
Тем не менее, уровни хитотриозидазы в плазме не отражают один конкретный симптом, а скорее они отражают общую нагрузку на организм клеток Гоше (Aerts et al. Plasma and metabolic abnormalities in Gaucher's disease. Baillieres Clin Haematol. 1997;10: 691-709); более того они не отражают нагрузку заболевания, обуславливаемую патологией костей и повреждением головного мозга. Уровень хитотриозидазы не прямо связан с патофизиологией болезни Гоше. Кроме того, после лечения уровень хитотриозидазы изменяется крайне медленно, что делает хитотриозидазу непригодной для быстрой оценки эффективности лечения, которому пациента подвергают или подвергали, а также рецидива заболевания независимо от причины заболевания.
Более того, применению хитотриозидазы плазмы в качестве маркера клеток Гоше препятствует тот факт, что пациенты, включая пациентов с болезнью Гоше, могут иметь дефицит активности хитотриозидазы вследствие дупликации 24 пар оснований (п.о.) в гене хитотриозидазы. Очевидно, нельзя проводить мониторинг этих индивидуумов путем измерения активности хитотриозидазы в плазме (Hollak et al. Marked elevation of plasma chitotriosidase activity. A novel hallmark of Gaucher disease. J Clin Invest. 1994; 93: 1288-1292; Boot et al. The human chitotriosidase gene. Nature of inherited enzyme deficiency. J Biol Chem. 1998; 273: 25680-25685). Частота дупликации 24 п.о. в гене хитотриозидазы зависит от этнической принадлежности и может возрастать практически вплоть до 35% (Prof. Guiliani, Brasil, неопубликованные данные).
CCL18: Нагруженные глюкозилцерамидом макрофаги или клетки Гоше являются основным источником CCL18. Уровень CCL18 в плазме пациентов, имеющих болезнь Гоше, является значительно увеличенным (Boot, R.G. et al. 2004. Marked elevation of the chemokine CCL18/PARC in Gaucher disease: a novel surrogate marker for assessing therapeutic intervention. Blood 103:33-39.). Таким образом, существуют попытки применять уровень CCL18 в плазме в качестве заместительного маркера для мониторинга успеха применяемой терапии. Тем не менее, также было открыто, что повышенные уровни CCL18 ассоциированы с различными заболеваниями, таким как различные типы злокачественной опухоли и воспаления суставов, легких и кожи. Например, асцитные жидкости пациентов, имеющих карциному яичника, содержат значительно повышенный уровень CCL18 по сравнению с пациентами без карциномы яичника (синдром Бадда-Киари) (Schutyser, E. et al. 2002. Identification of biologically active chemokine isoforms from ascitic fluid and elevated levels of CCL18/pulmonary and activation-regulated chemokine in ovarian carcinoma. J Biol. Chem. 277:24584-24593). CCL18 играет роль в подавлении опухоли, поскольку он привлекает и активирует определенные иммунные клетки. Более того обнаружено, что дети, имеющие острый лимфоцитарный лейкоз, обладают повышенными уровнями CCL18, в то время как дети, имеющие острый миелоидный лейкоз, не проявляют повышенных уровней CCL18 в сыворотке (Struyf, S et al. 2003. ARC/CCL18 is a plasma CC chemokine with increased levels in childhood acute lymphoblastic leukemia. Am J Pathol. 163: 2065- 2075.). Более того, уровни CCL18 в плазме не отражают один конкретный клинический симптом, а вместо этого они отражают общую нагрузку на организм клеток Гоше. Как можно видеть из описанного выше, CCL18 проявляет крайне низкую специфичность для диагностики болезни Гоше и, таким образом, главным образом, используется как "вспомогательный" заместительный маркер для пациентов с дефицитом активности хитотриозидазы.
Применительно к использованию хитотриозидазы и CCL18 следует отметить, что хитотриозидаза не дает положительные результаты тестирования у 10-30% всех пациентов, т.е. результаты тестирования пациентов являются отрицательными, несмотря на наличие болезни Гоше и, таким образом, также отказываются от использования терапии. Более того, в этих случаях маркер нельзя далее использовать в качестве маркера для мониторинга в целях наблюдения, например, ERT. Если предполагается, что пациент имеет дефект хитотриозидазы, CCL18 используют в качестве биомаркера для диагностики болезни Гоше, причем способ, в котором используется CCL18 в качестве биомаркера, проявляет относительно низкую специфичность и чувствительность, т.е. дает ложноположительный или ложноотрицательный диагноз приблизительно у 25% всех пациентов.
Термин "статус болезни Гоше", как используют в рамках изобретения, предпочтительно относится к статусу заболевания у индивидуума. Примеры типов статусов болезни Гоше включают, но не ограничиваются ими, риск наличия или развития у индивидуума болезни Гоше, стадию заболевания у индивидуума и эффективность лечения заболевания. Другие статусы и степени каждого статуса известны в данной области. В одном варианте осуществления настоящего изобретения статус болезни Гоше включает статус болезни Гоше: тяжелый, мягкий или здоровый.
Термин "диагностика", как используют в рамках изобретения, предпочтительно означает определение наличия или отсутствия заболевания или нарушения у индивидуума и/или определение того, имеет ли индивидуум риск развития заболевания, нарушения или симптомов, связанных с заболеванием или нарушением, а также прогнозирование статуса заболевания.
Термин "выявление" в контексте настоящего изобретения означает способы, которые включают выявление присутствия или отсутствия вещества в образце и/или определение типа указанного вещества. Выявление можно проводить способами, известными в данной области и способами, дополнительно описанными в настоящем описании, включая, но не ограничиваясь ими, прямое измерение фермента глюкозидазы, например, секвенирование гена, кодирующего глюкозидазу. Для выявления одного или нескольких биомаркеров, описанных в настоящем описании, можно использовать любой пригодный способ. Эти способы включают, но не ограничиваются ими, масс-спектрометрию (например ВЭЖХ-МС/МС), флуоресценцию (например, сэндвич-иммуноанализ), ВЭЖХ-флуоресценцию или ВЭЖХ-УФ, предпочтительно после преобразования в производное свободного лизо-Gb1.
Биомаркер, как используют в рамках изобретения, предпочтительно представляет собой любое биологическое соединение, такое как белок и его фрагмент, пептид, полипептид, протеогликан, гликопротеин, липопротеин, углевод, липид, нуклеиновая кислота, органическое или неорганическое химическое соединение, природный полимер и низкомолекулярное соединение, которое дифференциально присутствует в образце от индивидуума с одним фенотипическим статусом (например, имеющего заболевание) по сравнению с другим фенотипическим статусом (например, не имеющего заболевание) и которое может быть выделено из образца от индивидуума или измерено в образце от индивидуума. Более того, биомаркер может представлять собой целую неизмененную молекулу или он может представлять собой ее часть, которую предпочтительно выявляют масс-спектрометрическим анализом, антитело, другой белок, специфически связывающий биомаркер, функциональные нуклеиновые кислоты, специфично связывающие биомаркер и/или флуоресцентную метку. Более того, биомаркер считается информативным, если поддающийся измерению аспект биомаркера ассоциирован с данным статусом пациента, таким как конкретный статус болезни Гоше. Такой поддающийся измерению аспект может включать, например, присутствие, отсутствие или уровень биомаркера в образце от индивидуума и/или его присутствие в качестве части профиля биомаркеров. Поддающийся измерению аспект также может представлять собой соотношение двух или более поддающихся измерению аспектов биомаркеров, причем эти биомаркеры, например, могут быть известного типа или могут не быть известного типа. Профиль биомаркеров включает по меньшей мере два таких поддающихся измерению аспекта, где поддающиеся измерению аспекты могут соответствовать одному и тому же или отличающимся классам биомаркеров, например, таким как нуклеиновая кислота и углевод. Профиль биомаркеров также может включать по меньшей мере три, четыре, пять, 10, 20, 30 или более поддающихся измерению аспектов. В одном варианте осуществления профиль биомаркеров включает сотни или даже тысячи поддающихся измерению аспектов. В другом варианте осуществления профиль биомаркеров включает по меньшей мере один поддающийся измерению аспект по меньшей мере одного биомаркера и по меньшей мере один поддающийся измерению аспект по меньшей мере одного внутреннего стандарта.
В одном варианте осуществления способа в соответствии с настоящим изобретением внутренний стандарт добавляют к образцу индивидуума. Будет понятно, что путем указанного добавления внутреннего стандарта, также обозначаемого в настоящем описании как IS, к образцу, т.е. дополнения образца, подлежащего проведению способа в соответствии с настоящим изобретением, концентрация IS в образце известна и, например, путем определения площади под пиком, т.е. площади пика внутреннего стандарта, например, на хроматограмме ВЭЖХ-масс спектрометрии, может быть вычислено соотношение между площадью пика и концентрацией вещества, например IS и/или биомаркера, который в данном случае представляет собой свободный лизо-Gb1, например, путем вычисления соотношения площади пика свободного лизо-Gb1 и площади пика IS. Специалисту в данной области будет, кроме того, понятно, что различные молекулы можно использовать в качестве IS. Тем не менее, IS, имеющий сходную химическую структуру по сравнению с молекулой, такой как биомаркер, например свободный лизо-Gb1, является предпочтительным. В соответствии с этим, авторы настоящего изобретения в одном варианте осуществления выбрали лизо-Gb2, который отличается от лизо-Gb1 тем, что он содержит дополнительную часть сахара и, кроме того, не присутствует как таковой в природе. В предпочтительном варианте осуществления молекулу, представляющую собой IS, можно отличить от свободного лизо-Gb1 в способе по настоящему изобретению. В следующем предпочтительном варианте осуществления выбирают такой IS, как молекула, которая в идеальном случае не встречается или редко встречается в природе. В одном варианте осуществления настоящего изобретения, где внутренний стандарт добавляют к образцу индивидуума, предпочтительно, чтобы IS добавляли так, чтобы он растворялся в растворителе, например этаноле, перед указанным добавлением к образцу. В следующем предпочтительном варианте осуществления этот растворитель выбирают так, чтобы указанный растворитель был способен вызывать преципитацию белка, предпочтительно был способен обеспечивать стадию преципитации белка в качестве участника способа по настоящему изобретению.
В некоторых вариантах осуществления настоящего изобретения преципитация белка и/или стадия преципитации белка являются частью способа по настоящему изобретению. Будет понятно, что преципитация, как используют в рамках изобретения, предпочтительно означает образование твердого вещества в растворе, т.е., например, образование преципитата белка в образце, например сыворотке, от индивидуума. Когда преципитация, например, преципитация белка, происходит в образце, образовавшееся твердое вещество называют преципитатом, или, при уплотнении с помощью центрифуги, осадком. Жидкость, остающуюся над твердым веществом в любом случае называют супернатантом. Настоящее изобретение предусматривает различные способы преципитации и/или разделения указанного супернатанта и указанного преципитата или осадка, включающие, среди прочих, осаждение или седиминтацию и центрифугирование. Специалисту в данной области будут известны другие способы преципитации белка и/или разделения супернатанта и преципитата белка, тем не менее, указанному квалифицированному специалисту будет понятно, что, если используют способ, предпочтительно способ по изобретению, где преципитированный белок выводит из строя устройство, такое как колонка или ВЭЖХ-колонка, используемого применительно к настоящему изобретению, преципитированный белок предпочтительно выделяют из растворителя и/или образца.
В некоторых вариантах осуществления настоящего изобретения уровень биомаркера по настоящему изобретению, например, свободного лизо-Gb1, определенный способом по настоящему изобретению, в образце сравнивают с уровнем того же или другого биомаркера по настоящему изобретению, определенным способом по настоящему изобретению в другом образце, например, из того же пациента, из другого пациента, из контроля и/или в один и тот же или в различные моменты времени, и/или с пороговым уровнем, и/или уровнем контроля и/или уровнем IS. Применительно к этому "сравнение" или "по сравнению с", как используют в рамках изобретения, предпочтительно означает математическое сравнение двух или более величин уровней биомаркера(ов). Таким образом, будет естественным путем очевидно, является ли одна из указанных величин более высокой, более низкой или являются ли они идентичными, если по меньшей мере две из таких величин сравнивают друг с другом.
В некоторых вариантах осуществления настоящего изобретения уровень биомаркера также определяют в контроле. Как используют в рамках изобретения, контроль предпочтительно представляет собой образец от индивидуума, где статус болезни Гоше указанного индивидуума известен. В одном варианте осуществления контролем является образец здорового пациента. В следующем варианте осуществления количество указанного биомаркера добавляют к указанному образцу от здорового пациента до определения уровня указанного биомаркера в указанном образце от здорового пациента, содержащем указанный добавленный биомаркер, с помощью способа по настоящему изобретению. В следующем варианте осуществления контролем является образец от по меньшей мере одного индивидуума, имеющего статус болезни Гоше, причем такой известный статус болезни Гоше включает статус болезни Гоше: тяжелый, мягкий или здоровый, например, контрольного пациента. В следующем предпочтительном варианте осуществления контролем является образец от индивидуума, не подвергаемого лечению от болезни Гоше. В следующем предпочтительном варианте осуществления контролем является образец от одного индивидуума или совокупность образцов от различных индивидуумов и/или образцов, взятых от индивидуума(ов) в различные моменты времени.
Термин "уровень" или "уровень биомаркера", как используют в рамках изобретения, предпочтительно означает концентрацию вещества, предпочтительно биомаркера по изобретению и, более предпочтительно, свободного лизо-Gb1, в образце или у индивидуума. Специалисту в данной области будет понятно, что в определенных вариантах осуществления указанный образец не обязательно подвергают способу по изобретению в качестве необработанного образца, где способ включает определение уровня указанного биомаркера, т.е. указанный образец можно подвергать, например стадии преципитации белка, разделения, например центрифугирования и/или ВЭЖХ, а затем подвергать стадии определения уровня биомаркера, например с использованием масс-спектрометрического анализа. Кроме того, следует отметить, что когда используют термин "уровень" биомаркера применительно к уровню биомаркера по изобретению, который определяют в соответствии с настоящим изобретением, подразумевают "уровень" биомаркера по настоящему изобретению, который определяют способами по настоящему изобретению и который содержится в образце, подвергнутом способу(ам) по изобретению.
Уровень биомаркера отличается между различными статусами болезни, если вычислено, что средний или срединный уровень биомаркера в различных группах является статистически значимым. Обычные критерии статистической значимости включают, среди прочих, t-критерий, ANOVA, критерий Вилкоксона, критерий Манна-Уитни, отношение шансов и критерий Крускала-Уоллиса. Биомаркеры, отдельно или в комбинации, обеспечивают показатели относительного риска того, что индивидуум относится к одному фенотипическому статусу или к другому. Таким образом, биомаркеры по настоящему изобретению пригодны в одном варианте осуществления настоящего изобретения в качестве маркеров для заболевания, терапевтической эффективности лекарственного средства или способа лечения.
Термин "определение уровня" биомаркера, как используют в рамках изобретения, предпочтительно означает способы, которые включают количественное определение по меньшей мере одного вещества в образце от индивидуума и/или количественное определение указанного вещества, содержащегося в части организма индивидуума, такой как слюна, кровь, лимфа, сыворотка, плазма или ликвор, и/или количественное определение указанного вещества у индивидуума, причем вещество выбрано из группы, содержащей биомаркер.
Специалистам в данной области будет понятно, что выявление и/или определение уровня свободного лизо-Gb1 в образце от индивидуума, таким образом, предпочтительно включает то, что Gb1, присутствующий в крови индивидуума, химически не конвертируется, трансформируется или не преобразуются в производное так, чтобы свободный лизо-Gb1 не мог быть выявлен и/или его уровень нельзя было определить отдельно от и/или помимо Gb1. Специалисту в данной области будет понятно, что Gb1, присутствующий в образце от индивидуума, который подвергают стадии деацетилирования, например, путем гидролиза в метанольном гидроксиде натрия, приведет к отщеплению части в виде жирной кислоты от Gb1, и, таким образом, нежелательным образом приведет к химически конвертированной, трансформированной или преобразованной в производное форме Gb1, которую нельзя дифференцировать от свободного лизо-Gb1. Таким образом, достоинством авторов настоящего изобретения является признание того, что свободный лизо-Gb1, помимо Gb1, пригоден в способе диагностики болезни Гоше.
В предпочтительном варианте осуществления способов по настоящему изобретению способ предназначен для выявления и/или определения уровня свободного лизо-Gb1 в образце от индивидуума, где Gb1, присутствующий в образце, не подвергают стадии, приводящей к деацетилированию Gb1, предпочтительно не подвергают стадии, приводящей к отщеплению части в виде жирной кислоты от Gb1, содержащегося в образце. В следующем предпочтительном варианте осуществления способа по настоящему изобретению Gb1, присутствующий в образце от индивидуума, химически не конвертируется, трансформируется или не преобразуется в производное. В следующем предпочтительном варианте осуществления способа по настоящему изобретению свободный лизо-Gb1, присутствующий в образце от индивидуума, отделяют от Gb1, присутствующего в образце от индивидуума, перед стадией, которая приводит к отщеплению части жирной кислоты от Gb1 и/или перед стадией, на которой Gb1 химически конвертируется, трансформируется или преобразуется в производное. В следующем предпочтительном варианте осуществления стадию выявления и/или определения уровня биомаркера в образце от индивидуума, где биомаркером является свободный лизо-Gb1, проводят после разделения с использованием ВЭЖХ путем применения масс-спектрометрического анализа.
Индивидуума считают здоровым индивидуумом в отношении болезни Гоше, если индивидуум не страдает от симптомов, ассоциированных с болезнью Гоше. Более того, в одном варианте осуществления способов по изобретению индивидуума считают здоровым, если он не имеет мутации функциональных частей гена цереброзидазы и/или не имеет мутации гена цереброзидазы, приводящей к снижению или дефициту фермента глюкоцереброзидазы или его активности, что приводит к симптомам, ассоциированным с болезнью Гоше. Указанные мутации будут выявляться, если образец от индивидуума подвергают генетическому исследованию на такие мутации, как описано в настоящем описании. В следующем варианте осуществления настоящего изобретения образец от здорового индивидуума используют в качестве контрольного образца или в качестве пустого матрикса в способах по настоящему изобретению. Пустой матрикс, как упоминают в настоящем описании, предпочтительно представляет собой образец от здорового индивидуума. Тем не менее, будет понятно, что такой пустой матрикс может содержать нативный уровень свободного лизо-Gb1.
В одном варианте осуществления настоящего изобретения уровень биомаркера указывает на то, что индивидуум страдает или имеет риск развития заболевания или нарушения. Уровень биомаркера, определенный способом в соответствии с настоящим изобретением, сравнивают с контрольным уровнем биомаркера, где результат указанного сравнения позволяет диагностику заболевания.
Более конкретно, сравнение уровня биомаркера в образце от индивидуума с контрольным уровнем биомаркера включает сравнение уровня биомаркера в образце от индивидуума с пороговым уровнем, где, если уровень биомаркера в образце от индивидуума является увеличенным или более высоким по сравнению с пороговым уровнем, это указывает на то, что индивидуум страдает или имеет риск развития болезни Гоше и/или, где, если уровень биомаркера в образце от индивидуума является сниженным или более низким по сравнению с пороговым уровнем, это указывает на то, что индивидуум не страдает или не имеет риска развития болезни Гоше. Также в пределы настоящего изобретения входит то, что сравнение уровня биомаркера в образце от индивидуума с контрольным уровнем позволяет определение тяжести болезни Гоше, где, если уровень биомаркера в образце от индивидуума является повышенным, увеличенным или более высоким по сравнению с контрольным уровнем, то это указывает на то, что индивидуум страдает или имеет риск развития болезни Гоше с более тяжелым статусом или прогрессированием; и где, если уровень биомаркера в образце от индивидуума является сниженным или более низким по сравнению с контрольным уровнем, то это указывает на то, что индивидуум страдает или имеет риск развития болезни Гоше с менее тяжелым статусом или прогрессированием. В следующем варианте осуществления настоящего изобретения это сравнение уровня биомаркера в образце от индивидуума с контрольным уровнем включает сравнение уровня биомаркера у указанного индивидуума с уровнем биомаркера, выявленным в образце контроля, где, если уровень биомаркера в образце от индивидуума повышен, увеличен или является более высоким по сравнению с контрольным образцом, это указывает на то, что индивидуум страдает и/или имеет риск развития болезни Гоше; и/или если уровень биомаркера в образце от индивидуума повышен, увеличен или является более высоким по сравнению с контрольным образцом, то это указывает на то, что индивидуум страдает или имеет риск развития болезни Гоше с более тяжелым статусом или прогрессированием. Указанный контроль предпочтительно выбран из группы, включающей здоровых индивидуумов, индивидуумов, страдающих болезнью Гоше или имеющих риск наличия симптомов болезни Гоше, индивидуумов с положительными результатами тестирования на мутацию или комбинацию мутаций гена цереброзидазы, где мутация или комбинация мутаций в гене цереброзидазы указывают на перспективу развития у индивидуума болезни Гоше с более тяжелым или менее тяжелым статусом или прогрессированием. В следующем варианте осуществления настоящего изобретения этот контрольный уровень определяют в образце от контроля, где необязательно свободный лизо-Gb1 добавляют к образцу от контроля в конкретном количестве перед определением уровня свободного лизо-Gb1 в образце от контроля.
Заслугой авторов настоящего изобретения является то, что они смогли разработать способ диагностики болезни Гоше у индивидуума, где способ включает выявление биомаркера в образце от индивидуума, где биомаркером является свободный лизо-Gb1, и предпочтительно дополнительно включает определение уровня биомаркера в образце от индивидуума, и более предпочтительно дополнительно включает сравнение уровня биомаркера в образце от индивидуума с пороговым уровнем, который проявляет высокую чувствительность, т.е. чувствительность по меньшей мере 99,0%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5%, 99,6%, 99,7%, 99,8%, 99,9% или 100%, и высокую специфичность, составляющую по меньшей мере 99,0%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5%, 99,6%, 99,7%, 99,8%, 99,9% или 100%. В следующем варианте осуществления настоящего изобретения эти способы в соответствии с настоящим изобретением позволяют диагностику болезни Гоше у индивидуума, независимо от статуса прогрессирования болезни Гоше у индивидуума. Более конкретно, способы по настоящему изобретению позволяют диагностику болезни Гоше у индивидуума, имеющего ранний статус болезни Гоше, а также у индивидуума, имеющего развернутый статус или статус прогрессирования болезни Гоше.
Эффективность способа в отношении правильной диагностики болезни Гоше обычно измеряют в качестве чувствительности способа, специфичности способа или площади под кривой соотношений правильного и ложного обнаружения сигналов (также называемой в настоящем описании "ROC-кривой"). ROC-кривая является графиком частоты истинных положительных результатов относительно частоты ложно-положительных результатов для различных возможных пороговых уровней диагностического способа. ROC-кривая демонстрирует взаимосвязь между чувствительностью и специфичностью. Чувствительность представляет собой процент истинно положительных результатов, для которых с помощью теста предсказано, что они являются положительными, в то время как специфичность представляет собой процент истинно отрицательных результатов, для которых с помощью теста предсказано, что они являются отрицательными. ROC-кривая обеспечивает чувствительность теста в качестве функции 1-специфичность. Чем большей является площадь под ROC-кривой, тем более мощной является предсказательная величина теста. Таким образом, увеличение чувствительности будет сопровождаться снижением специфичности. Чем более близко кривая проходит от левой оси, а затем к верхнему краю пространства ROC, тем более точным является тест. Напротив, чем более близко кривая проходит к диагонали под углом 45 градусов графика ROC, тем менее точным является тест. Таким образом, площадь под ROC является мерой точности теста. Точность теста зависит от того, насколько хорошо тест разделяет исследуемую группу на тех, кто имеет рассматриваемое заболевание, и тех, кто не имеет рассматриваемого заболевания. Площадь под кривой (также обозначаемая в настоящем описании как "AUC"), равная 1, отражает идеальный способ, в то время как площадь 0,5 соответствует менее пригодному способу. Таким образом, предпочтительные диагностические способы по настоящему изобретению имеют AUC более 0,50, более предпочтительные способы имеют AUC более 0,9 и наиболее предпочтительные способы имеют AUC более 0,998.
Другими пригодными и подходящими показателями применимости способа являются положительная предсказательная величина и отрицательная предсказательная величина. Положительная прогнозирующая величина представляет собой процент истинных положительных значений, которые в тесте являются положительными. Отрицательная прогнозирующая величина представляет собой процент истинных отрицательных значений, которые в тесте являются отрицательными.
Способы определения статуса болезни Гоше у индивидуума, в которых используются биомаркеры уровня техники, например хитотриозидаза и/или CCL18, демонстрируют чувствительность и специфичность, как правило, не превышающие 90%.
Специалисту в данной области будет понятно, что, хотя специфичность и чувствительность способов в соответствии с настоящим изобретением являются настолько высокими, как описано выше и их определяли, как описано в разделе "Примеры" далее, могут быть не исключены отдельные случаи, где пациент, имеющий болезнь Гоше, будет определен в тесте как ложноотрицательный, или где пациент, не имеющий болезни Гоше, будет определен как ложноположительный, с помощью способа по изобретению. Учитывая эти случая при определении специфичности и чувствительности способа в соответствии с настоящим изобретением, специфичность и чувствительность будут более низкими, чем описанные выше величины. Тем не менее, специалисту в данной области также будет понятно, что такая высокая специфичность и такая высокая чувствительность, как описано выше, никогда не были описаны раньше для способа диагностики болезни Гоше. Таким образом, важно отметить, что, несмотря на то, что чувствительность и специфичность способа по настоящему изобретению могут варьировать, если группы пациентов, отличные от группы пациентов, описанной в разделе "Примеры", например, отличающиеся количеством пациентов, будут объектом способов по настоящему изобретению, авторы настоящего изобретения твердо убеждены, что ни один из способов, известных в данной области, с использованием биомаркеров не достигнет более высокой специфичности и более высокой чувствительности по сравнению со способами в соответствии с настоящим изобретением. Это особенно справедливо, поскольку предел выявления способов по настоящему изобретению позволяет определение уровня свободного лизо-Gb1 у многих здоровых индивидуумов. Таким образом, индивидуум с заболеванием с ложноотрицательными результатами тестирования с использованием способов по настоящему изобретению определяется в тесте как ложноотрицательный по той причине, что уровень биомаркера в образце указанного индивидуума с заболеванием с ложноотрицательными результатами тестирования является таким же, как и уровень биомаркера в образце здорового индивидуума. В частности, важно отметить, что указанный индивидуум с ложноотрицательными результатами тестирования не определяется как отрицательный по той причине, что уровень биомаркера является слишком низким для определения с помощью способа по настоящему изобретению.
"Предел выявления" вещества, такого как свободный лизо-Gb1, как используют в рамках изобретения, предпочтительно представляет собой уровень вещества, определенный способом определения уровня вещества, где уровень, меньший или более низкий, чем указанный предел выявления, не может быть определен указанным способом. Таким образом, естественным образом понятно, что "пороговый уровень" и "предел выявления", как используют в рамках изобретения, предпочтительно не обязательно являются идентичными, хотя оба из них отражают определенный уровень вещества, например, биомаркера по настоящему изобретению. Будет естественным образом понятно, что, напротив, пороговый уровень предпочтительно будут выбирать так, чтобы селективность и чувствительность способа были настолько высокими, насколько это возможно. В противоположность этому предел выявления отражает абсолютный уровень биомаркера по настоящему изобретению, который отражает минимальный уровень биомаркера, который может быть выявлен с помощью способа определения уровня указанного биомаркера. Таким образом, естественным образом понятно, что предел выявления зависит от способа определения уровня вещества и от вещества, уровень которого подлежит определению с помощью способа. Квалифицированному специалисту будет хорошо понятно, что высокий предел выявления, например, более высокий, чем идеальный пороговый уровень, возможно приведет к низкой чувствительности способа, поскольку процент истинно положительных результатов, которые, как предсказано в тесте, являются положительными, также зависит от того, можно ли уровень биомаркера определять для указанных истинно положительных результатов. Иными словами, если предел выявления является более высоким, чем идеальный пороговый уровень, истинные положительные результаты, имеющие уровень биомаркера, немного превышающий пороговой уровень, могут не отличаться от истинных отрицательных результатов, имеющих уровень биомаркера, более низкий, чем пороговый уровень, поскольку не может быть определен уровень биомаркера как для истинно положительных результатов, имеющих уровень биомаркера, превышающий пороговый уровень, так и для отрицательных результатов, имеющих уровень биомаркера, более низкий, чем пороговый уровень. Таким образом, хорошо понятно, что низкий уровень выявления является преимуществом. Таким образом, также заслуга авторов изобретения состоит в том, что они показали, что более низкий уровень выявления обеспечивает способ диагностики болезни Гоше у индивидуума, включающий стадию определения уровня биомаркера, присутствующего в образце, с более высокой селективностью и чувствительностью. "Идеальный пороговый уровень", как используют в рамках изобретения, предпочтительно представляет собой пороговый уровень, как описано в настоящем описании, способ с использованием указанного идеального порогового уровня имеет наиболее высокую селективность и чувствительность.
Вариантом осуществления способов в соответствии с настоящим изобретением является то, что они включают стадию подтверждения указанного способа путем диагностики заболевания или нарушения, предпочтительно болезни Гоше, у индивидуума с помощью способа по настоящему изобретению; стадию диагностики заболевания или нарушения, предпочтительно болезни Гоше, у индивидуума путем генетического тестирования, включающего секвенирование гена, предпочтительно секвенирование гена, о котором специалисту в данной области известно, что мутация в нем вызывает заболевание или нарушение, более предпочтительно секвенирование гена цереброзидазы в случае болезни Гоше; и сравнение результатов указанного способа и указанного генетического тестирования. Как используют в рамках изобретения, здоровый индивидуум предпочтительно считается здоровым в отношении заболевания или нарушения, если указанный индивидуум не страдает от симптомов, ассоциированных с указанным заболеванием или нарушением и если результат генетического тестирования не выявляет мутаций гена, о котором специалисту в данной области известно, что мутация в нем вызывает заболевание или нарушение. Также подразумевают, что здоровый индивидуум имеет положительные результаты тестирования на отсутствие болезни Гоше.
Термин "определение статуса болезни Гоше" у индивидуума, как используют в рамках изобретения, предпочтительно означает классификацию профиля биомаркеров индивидуума, выбранного из группы, включающей идентификацию или выявление присутствия или отсутствия болезни Гоше у индивидуума, предсказание возникновения или риска развития болезни Гоше у индивидуума, определение течения болезни Гоше у индивидуума, определение и/или прогнозирование тяжести болезни Гоше у индивидуума, определение того, страдает ли индивидуум от раннего статуса болезни Гоше или развернутого статуса или статуса прогрессирования болезни Гоше, или определение того, изменяется ли уровень биомаркера у индивидуума с течением времени.
Термин "управление лечением у индивидуума" или "управление течением у индивидуума", как используют в рамках изобретения, предпочтительно относится к поведению клинициста или врача после определения статуса болезни Гоше. Например, если результат способа в соответствии с настоящим изобретением является неубедительным или существует причина, по которой подтверждение статуса является необходимым, врач может назначить новые тесты, такие как тестирование функции глюкоцереброзидазы и/или секвенирование гена, кодирующего глюкоцереброзидазу. Альтернативно, если статус указывает на то, что лечение болезни Гоше является обоснованным, врач может назначить индивидууму лечение болезни Гоше. Аналогично, если статус является отрицательным или если результаты показывают, что лечение является успешным, дальнейшее управление течением может не быть необходимым. Тем не менее, специалисту в данной области будет хорошо понятно, что, помимо генной терапии, любую используемую терапию, например ERT и/или SRT, необходимо применять на протяжении всей жизни пациента с болезнью Гоше. Более того вариантом осуществления настоящего изобретения является то, что управление лечением у индивидуума включает титрование дозы лекарственного средства, применяемого в качестве способа лечения болезни Гоше, например единиц рекомбинантного фермента, используемого в ERT, проводимой у пациента. В некоторых вариантах осуществления способов по настоящему изобретению, где уровень биомаркера, присутствующего в образце от индивидуума, определяют в несколько моментов времени или сравнивают с другими уровнями биомаркера, пороговым уровнем и/или уровнем указанного биомаркера в контроле, квалифицированный специалист будет применять или не будет применять терапию, или изменит уже примененную терапию, для лечения или не лечения, или для продолжения лечения болезни Гоше.
В пределы настоящего изобретения входит то, что квалифицированный специалист будет применять дозировку и/или поддерживать дозировку или изменять дозировку, например, применять дозировку или более высокую дозировку, т.е. увеличивать дозировку, если такое сравнение уровня биомаркера демонстрирует, например, что уровень указанного биомаркера является более высоким, чем, например, пороговый уровень, т.е. у пациента диагностируют наличие болезни Гоше; или что уровень, определенный у того же пациента ранее, является более низким или таким же, т.е. используемая терапия является недостаточной, т.е. не приводит к снижению уровня. С другой стороны, квалифицированный специалист будет использовать или не использовать дозировку или поддерживать или снижать дозировку, например, не применять дозировку или применять более низкую дозировку, т.е. снижать дозировку, если такое сравнение уровня биомаркера показывает, например, что уровень указанного биомаркера является более низким, чем, например, пороговый уровень, т.е. у пациента диагностируют отсутствие болезни Гоше; или что уровень, определенный у того же пациента раннее, является более высоким, т.е. использованная терапия является достаточной, т.е. приводит к снижению уровня. В одном варианте осуществления настоящего изобретения относительно высокий уровень свободного лизо-Gb1, исходя из такого сравнения, указывает на использование высокой дозы рекомбинантного фермента, используемого в ERT, и/или относительно низкий уровень свободного лизо-Gb1, исходя из такого сравнения, указывает на использование низкой дозировки рекомбинантного фермента, используемого в ERT. Тем не менее, также хорошо понятно, что квалифицированный специалист будет учитывать анамнез пациента, т.е. квалифицированный специалист, управляющий лечением пациента, страдающего болезнью Гоше и подвергаемого лечению, так чтобы уровень биомаркера являлся более низким, чем пороговый уровень, например, решит не прекратить лечение, а снизит дозировку и увеличит время между дальнейшими применениями способов по настоящему изобретению.
Течение болезни Гоше можно определять способом в соответствии с настоящим изобретением путем определения уровня биомаркера в образце от индивидуума в различные моменты времени в ходе заболевания. Важно отметить, что однократное применение способа диагностики болезни Гоше в соответствии с настоящим изобретением позволяет диагностировать болезнь Гоше и в определенных вариантах осуществления включает стадию определения течения лечения у индивидуума, исходя из диагностики того, страдает ли индивидуум или имеет ли он риск развития болезни Гоше. Если индивидуум, образец которого таким образом подвергают способу по настоящему изобретению, имеет положительные результаты тестирования на наличие или риск развития болезни Гоше, квалифицированному специалисту будет известно, какое решение принять в отношении управления лечением у индивидуума, т.е. как индивидуума будут лечить, например, с использованием определенной дозы фермента применительно к ERT. Хорошо понятно, что независимо от решения квалифицированного специалиста в отношении того, как управлять лечением у индивидуума, квалифицированный специалист может принять решение о по меньшей мере одном дополнительном использовании способа в соответствии с настоящим изобретением в более поздний момент времени. Таким образом, вариантом осуществления настоящего изобретения является то, что можно сравнивать уровни биомаркера, определенные в различные моменты времени, где различные моменты времени означают по меньшей мере два момента времени. Без связи с какой-либо теорией, авторы настоящего изобретения открыли, что уровень биомаркера по настоящему изобретению в образцах от одного конкретного пациента может коррелировать с тяжестью заболевания у указанного индивидуума в момент времени, когда проводят взятие образца от пациента. Таким образом, хорошо понятно, что повышенный уровень биомаркера, определенный в образце в более поздний момент времени, по сравнению с уровнем биомаркера, определенным в образце в более ранний момент времени, указывает на более тяжелый статус у индивидуума в более поздний момент времени по сравнению со статусом у индивидуума в более ранний момент времени. Сниженный уровень биомаркера, определенный в образце в более поздний момент времени по сравнению с уровнем биомаркера, определенным в образце в более ранний момент времени, указывает на менее тяжелый статус у индивидуума в более поздний момент времени по сравнению со статусом у индивидуума в более ранний момент времени. Таким образом, в одном аспекте настоящее изобретение относится к способу определения течения болезни Гоше у индивидуума, включающему стадию определения в несколько моментов времени уровня биомаркера, присутствующего в образце от индивидуума, где биомаркером является свободный лизо-Gb1. В следующем аспекте изобретение относится к способу определения эффективности по меньшей мере одного способа лечения, используемого у индивидуума с положительными результатами тестирования на наличие или риск развития болезни Гоше, включающему стадию определения в несколько моментов времени уровня биомаркера, присутствующего в образце от индивидуума, где биомаркером является свободный лизо-Gb1. Специалистам в данной области будет хорошо понятно, что способы по настоящему изобретению, таким образом, позволяют выбор терапии и/или коррекцию доз и/или дозировки выбранной терапии, исходя из результатов способа по изобретению. Если, например, индивидууму назначено лечение от болезни Гоше, способ диагностики болезни Гоше у индивидуума в соответствии с настоящим изобретением можно использовать каждые 3 месяца и уровни биомаркера, определенные таким образом, будут сравнивать для определения эффективности лечения(ий) и/или терапии/терапий, используемых у индивидуума. Если индивидуум достигает статуса, где стабильный уровень биомаркера поддерживается с течением времени, частота использования способа диагностики болезни Гоше у индивидуума в соответствии с настоящим изобретением может быть снижена до частоты раз в 6 месяцев. Если дозировку терапии изменяют, например единицы рекомбинантного фермента, используемого в ERT, снижают или увеличивают, частота использования способа диагностики болезни Гоше у индивидуума в соответствии с настоящим изобретением может быть установлена обратно на раз в 3 месяца. Путем сравнения определенных уровней биомаркера в образцах от индивидуума квалифицированный специалист определит, увеличивается ли, снижается ли уровень биомаркера или поддерживается ли стабильным уровень биомаркера с течением времени. Таким образом, квалифицированный врач может решить снизить дозировку терапии, например, количество единиц рекомбинантного фермента, используемого в ERT; увеличить дозировку терапии; или поддерживать дозировку терапии, в зависимости от сравнения уровней биомаркера, определенных способом в соответствии с настоящим изобретением. Снижение уровня свободного лизо-Gb1 приблизительно на 60% в течение периода 12 месяцев указывает на успешную терапию болезни Гоше, где снижение, как используют в рамках изобретения, предпочтительно означает, что уровень свободного лизо-Gb1, определенного способом по настоящему изобретению в конце периода времени, сравнивают с уровнем свободного лизо-Gb1, определенным способом по настоящему изобретению в начале указанного периода времени. Таким образом, квалифицированный врач может решить снизить дозировку используемой терапии или сохранить дозировку используемой терапии. Если снижение уровня свободного лизо-Gb1 является значительно более слабым, квалифицированный специалист может решить увеличить дозировку терапии. Также заслугой авторов настоящего изобретения является понимание того, что снижение уровня свободного лизо-Gb1 коррелирует с эффективностью терапии. Чем более сильным является снижение уровня свободного лизо-Gb1 в течение периода времени, например 12 месяцев, тем более успешной является терапия, например, такая как ERT, SRT или терапия шаперонами. Таким образом, следующим вариантом осуществления настоящего изобретения является то, что способ по настоящему изобретению предназначен для сравнения эффективности терапии или по меньшей мере двух способов терапии, используемых у индивидуума.
Таким образом, специалисту в данной области известно, что мониторинг прогрессирования, т.е. течения болезни Гоше, а также эффективности терапии у отдельного индивидуума можно осуществлять путем частого определения уровня свободного лизо-Gb1 в образцах от индивидуума.
В следующем аспекте изобретение относится к способу определения эффективности по меньшей мере одного способа лечения, используемого у индивидуума с положительными результатами исследования на наличие или риск развития болезни Гоше, включающему стадию определения в несколько моментов времени уровня биомаркера, присутствующего в образце от индивидуума, где биомаркером является свободный лизо-Gb1. Применительно тому, что описано выше в отношении управления лечением у индивидуума, специалисту в данной области будет хорошо понятно, что эффективность одного способа лечения или комбинации по меньшей мере двух способов лечения можно сравнивать с использованием способов по настоящему изобретению. Таким образом, с помощью способа по настоящему изобретению является возможным исследование и сравнение нескольких новых лекарственных средств, дозированных форм, дозировок или способов лечения болезни Гоше.
Вариантом осуществления настоящего изобретения является то, что способ диагностики болезни Гоше в соответствии с настоящим изобретением не зависит от того, лечили или не лечили индивидуума ранее от болезни Гоше. Таким образом, образец от индивидуума может представлять собой образец от индивидуума, которого ранее лечили от болезни Гоше, а также образец от индивидуума, которого ранее не лечили от болезни Гоше. Таким образом, следующим вариантом осуществления настоящего изобретения является то, что способ по настоящему изобретению включает стадию управления лечением индивидуума и/или определения уровня биомаркера в образце от индивидуума после управления течением у индивидуума. Указанное лечение индивидуума может быть основано на диагностике того, страдает ли индивидуум или имеет ли он риск развития болезни Гоше; на выявлении биомаркера в образце от индивидуума после управления течением у индивидуума; или на определении уровня биомаркера в образце от индивидуума после управления течением у индивидуума. Тем не менее, специалисту в данной области будет понятно, что образец некоторых пациентов, не имеющих болезнь Гоше, или некоторых пациентов, которых успешно лечат от болезни Гоше, продемонстрирует уровень свободного лизо-Gb1 ниже предела выявления.
Без связи с какой-либо теорией, авторы настоящего изобретения полагают, что уровень свободного лизо-Gb1, присутствующего в образце от индивидуума, кроме того, коррелирует с тяжестью заболевания у индивидуума, страдающего болезнью Гоше. В связи с этим, авторы настоящего изобретения обнаружили путем оценки результатов, представленных в настоящем описании (например, показанных на фиг.4 настоящего описания), что, несмотря на то, в принципе, что уровень свободного лизо-Gb1 отличается у конкретных индивидуумов, и, более конкретно, может отличаться у конкретных индивидуумов, имеющих одну и ту же мутацию(и), чем более высоким является уровень свободного лизо-Gb1, тем большей является тяжесть течения болезни Гоше с точки зрения статистического среднего значения для клинического показателя. Таким образом, уровень свободного лизо-Gb1 коррелирует с тяжестью болезни Гоше в том, что у пациентов с положительными результатами тестирования на отдельные мутации гена глюкоцереброзидазы, известные тем, что они обычно вызывают мягкое (например, мутация N370S) или более тяжелое (например, мутация L444P) течение болезни Гоше, уровень свободного лизо-Gb1, определенного у указанных пациентов, статистически коррелировал с тяжестью, обычно связанной с такой мутацией.
Таким образом, следующий вариант осуществления различных аспектов настоящего изобретения относится к способу определения тяжести болезни Гоше у индивидуума, включающему стадию
a) определения уровня биомаркера, присутствующего в образце от индивидуума, где биомаркером является свободный лизо-Gb1, и стадию
b) определения тяжести болезни Гоше, например, путем сравнения уровня свободного лизо-Gb1 у индивидуума, предпочтительно определенного способом по настоящему изобретению, с клиническим показателем.
Применительно к этому, важно отметить, что, если уровень свободного лизо-Gb1 определяют в образцах от пациентов, страдающих болезнью Гоше, обладающих мутацией L444P при секвенировании гена цереброзидазы (гомозиготная и сложная гетерозиготная), которых подвергли способу по настоящему изобретению, средний уровень свободного лизо-Gb1 превышает средний уровень свободного лизо-Gb1, определенный в образцах от пациентов, страдающих болезнью Гоше, обладающих мутацией N370S при секвенировании гена цереброзидазы, с использованием того же способа (фиг.4). Известно, что мутация L444P вызывает более тяжелое течение болезни Гоше - это особенно справедливо в случае, когда индивидуум является гомозиготным в отношении указанной мутации. В соответствии с этим, более высокий средний уровень свободного лизо-Gb1 определяется у гомозигот по сравнению с гомозиготной мутацией N370S (194 нг/мл и 159 нг/мл, соответственно, смотрите фиг.4). Более того пациенты, имеющие сложную гетерозиготную мутацию L444P имеют значительно более низкий уровень свободного лизо-Gb1, чем гомозиготы (89 нг/мл и 45,4 нг/мл, соответственно). Специалисту в данной области будут известны клинические показатели для определения категории тяжести болезни Гоше или симптомов или полноты ее симптомов. Таким образом, вариантом осуществления способа по настоящему изобретению является то, что предсказывают течение болезни Гоше у пациента, и, более конкретно, определяют тяжесть болезни Гоше, исходя из уровня биомаркера, определенного в соответствии со способом по настоящему изобретению.
Вариантом осуществления настоящего изобретения является то, что уровни хитотриозидазы, определенные у пациентов, не имеющих мутации гена хитотриозидазы, в частности, не имеющих дупликации 24 п.о., как описано в настоящем описании, служат в качестве основания для коррелирования с тяжестью болезни Гоше, поскольку средний уровень хитотриозидазы, определенный в образце от указанных пациентов, как описано в настоящем описании, коррелирует с тяжестью болезни Гоше. Таким образом, например, уровень хитотриозидазы ниже 200 нмольМЕ/ч/мл коррелирует со статусом болезни Гоше у пациента, не страдающего болезнью Гоше. Применительно к этому, важно отметить, что пациент, которого лечат от болезни Гоше, также может проявлять уровень хитотриозидазы ниже 200 нмольМЕ/ч/мл. Уровень более 2000 нмольМЕ/ч/мл коррелирует с статусом болезни Гоше "развернутая" или "тяжелая" и уровень хитотриозидазы от 200 до 2000 нмольМЕ/ч/мл коррелирует со статусом болезни Гоше "мягкая".
Применительно к этому важно отметить, что уровень хитотриозидазы от 200 до 1000 нмольМЕ/ч/мл также может встречаться в образце от индивидуума, страдающего другой LSD, такой как болезнь Ниманна-Пика типа C или болезнь Краббе, тем самым делая непригодным применение хитотриозидазы для диагностики болезни Гоше. Таким образом, описанные выше факторы применительно к использованию уровня хитотриозидазы для коррелирования с тяжестью болезни Гоше, как правило, применимы только для пациентов, где присутствие или отсутствие болезни Гоше и/или другой LSD, известной тем, что она проявляет повышенные уровни хитотриозидазы, доказано с помощью мутационного анализа.
Если уровень свободного лизо-Gb1 определяют в соответствии со способами по настоящему изобретению у указанных пациентов, не имеющих мутации в гене хитотриозидазы, в частности, не имеющих дупликацию из 24 п.о., как описано в настоящем описании, указанный уровень свободного лизо-Gb1, определенного в образце от каждого из указанных пациентов, коррелируют с уровнем хитотриозидазы у указанных пациентов и/или со степенью тяжести болезни Гоше и/или статусом болезни Гоше у указанного пациента. Таким образом, определяют степень тяжести болезни Гоше и/или статус болезни Гоше, включающий здоровый, мягкий или тяжелый, и более предпочтительно коррелируют с уровнями хитотриозидазы и/или диапазонами уровней хитотриозидазы, как описано выше.
Специалисту в данной области будет известно, что уровень биомаркера по настоящему изобретению, определенный в образце от индивидуума, где указанный уровень биомаркера коррелируют с тяжестью болезни Гоше, как описано выше, будет указывать на использование определенной терапии и/или дозы или дозировки указанной терапии. Например, если уровень биомаркера, определенный в соответствии со способами по изобретению, коррелирует с со статусом болезни Гоше "тяжелая" или "развернутая", индивидууму назначают лечение от болезни Гоше, и способ для диагностики болезни Гоше у индивидуума в соответствии с настоящим изобретением можно использовать каждые 3 месяца и уровни биомаркера, определенные таким образом, можно сравнивать для определения эффективности лечения(й) и/или терапии/терапий, используемых у индивидуума. Если индивидуум достигает статуса, где уровень биомаркера коррелируют с "мягкой" болезнью Гоше, или где стабильный уровень биомаркера поддерживается с течением времени, частота использования способа для диагностики болезни Гоше у индивидуума в соответствии с настоящим изобретением может быть снижена до частоты раз в 6 месяцев.
В другом аспекте настоящее изобретение относится к способу определения эффективности композиции для лечения болезни Гоше. Такой способ может включать стадии определения уровня свободного лизо-Gb1 у индивидуума, имеющего болезнь Гоше; введения указанному индивидууму указанного соединения в количестве, достаточном для определения эффективности указанного соединения; повторное определение уровня свободного лизо-Gb1 у указанного индивидуума; сравнение уровня свободного лизо-Gb1, определенного до и после введения указанной композиции, где более низкий уровень свободного лизо-Gb1, определенный после введения указанной композиции, по сравнению с уровнем свободного лизо-Gb1, определенным после введения указанной композиции, указывает на эффективность указанного соединения для лечения болезни Гоше.
Настоящее изобретение далее дополнительно иллюстрируется с помощью следующих фигур и примеров, из которых могут быть установлены дальнейшие признаки, варианты осуществления и преимущества.
Более конкретно,
на фиг.1A представлена ящичковая диаграмма, на которой указаны уровни свободного лизо-Gb1 в нг/мл плазмы;
на фиг.1B представлена ящичковая диаграмма, на которой указаны уровни свободного лизо-Gb1 в нг/мл плазмы, сгруппированные по полу индивидуумов;
на фиг.2A представлен график, на котором показаны кривые соотношений правильного и ложного обнаружения сигналов (ROC) для свободного лизо-Gb1 и хитотриозидазы;
на фиг.2B представлен график, на котором показаны кривые соотношений правильного и ложного обнаружения сигналов (ROC) для свободного лизо-Gb1 и CCL18;
на фиг.3A представлена диаграмма, на которой показан свободный лизо-Gb1 в нг/мл плазмы в качестве функции времени всего для 20 германских пациентов с болезнью Гоше;
на фиг.3B представлена диаграмма, на которой показан свободный лизо-Gb1 в нг/мл плазмы в качестве функции времени всего для 24 не подвергнутых лечению пациентов с болезнью Гоше (10 германских, 14 израильских пациентов);
на фиг.3C представлена диаграмма, на которой показан свободный лизо-Gb1 в нг/мл плазмы в качестве функции времени всего для 9 израильских пациентов с болезнью Гоше до и после начала терапии;
на фиг.3D представлена диаграмма, на которой показаны величины на основе регрессии для свободного лизо-Gb1 в нг/мл плазмы в качестве функции времени для израильских и германских пациентов с болезнью Гоше до и после начала терапии;
на фиг.4 представлена таблица, в которой показан срединный уровень свободного лизо-Gb1 для двух частых мутаций;
на фиг.5A представлена хроматограмма ВЭЖХ-масс-спектрометрии, на которой показана интенсивность пика свободного лизо-Gb1 и IS у здорового индивидуума;
на фиг.5B представлена хроматограмма ВЭЖХ-масс-спектрометрии, на которой показана интенсивность пика свободного лизо-Gb1 и IS пациента с болезнью Гоше;
на фиг.5C представлена хроматограмма ВЭЖХ-масс-спектрометрии, на которой показана интенсивность пика свободного лизо-Gb1 и IS у пациента с болезнью Гоше.
Краткое описание чертежей
На фиг.1A представлена ящичковая диаграмма, на которой указаны уровни свободного лизо-Gb1; на оси y продемонстрированы логарифмические уровни свободного лизо-Gb1 в нг/мл, определенные в плазме пациентов способом в соответствии с настоящим изобретением, где на оси x представлены группы пациентов, которые были разделены на группы, как описано в примере 2. Ящичковая диаграмма отражает 25 и 75 процентиль каждой группы пациентов с помощью нижней и верхней частей ящичков, соответственно; линия вблизи середины ящичка отражает 50 процентиль (т.е. медиану) каждой группы; усы отражают одно стандартное отклонение выше и ниже среднего значения данных; любые данные, не включенные между усами, представлены в качестве обособленных точек с помощью небольшого круга или звезды. Горизонтальная линия отражает пороговый уровень 5 нг/мл.
На фиг.1B представлена ящичковая диаграмма, на которой указаны уровни свободного лизо-Gb1, как представлено на фиг.1A, дополнительно сгруппированные по полу индивидуумов; на оси y представлены логарифмические уровни свободного лизо-Gb1 в нг/мл, определенные в плазме пациентов способом в соответствии с настоящим изобретением, где на оси x представлены группы пациентов, которые были разделены на группы, как описано в примере 2, и, кроме того, по полу пациентов. Ящичковая диаграмма отражает 25 и 75 процентиль каждой группы пациентов с помощью нижней и верхней частей ящичков, соответственно; линия вблизи середины ящичка отражает 50 процентиль (например, медиану) каждой группы; усы отражают одно стандартное отклонение выше и ниже среднего значения данных; любые данные, не включенные между усами, представлены в качестве обособленных точек с помощью небольшого круга или звезды. Горизонтальная линия отражает пороговый уровень 5 нг/мл.
На фиг.2A представлен график, на котором показаны кривые соотношений правильного и ложного обнаружения сигналов (ROC) для свободного лизо-Gb1 и хитотриозидазы; на оси x показана "1-специфичность" и на оси y представлена чувствительность. Свободный лизо-Gb1 демонстрирует 100% чувствительность и 100% специфичность, где хитотриозидаза в лучшем случае имеет чувствительность 0,9591 или 95,91%, соответственно.
На фиг.2B представлен график, на котором показаны кривые соотношений правильного и ложного обнаружения сигналов (ROC) для свободного лизо-Gb1 и CCL18; на оси x показана "1-специфичность" и на оси y представлена чувствительность. Свободный лизо-Gb1 демонстрирует 100% чувствительность и 100% специфичность, где CCL18 в лучшем случае имеет чувствительность 0,8658 и 86,58%, соответственно.
На фиг.3A ось y отражает уровни свободного лизо-Gb1 в качестве функции времени, определенные способом в соответствии с настоящим изобретением в нг/мл в плазме 20 германских пациентов с болезнью Гоше, которых подвергали терапии, точнее ERT, в ходе испытания. Каждая кривая и каждый номер пациента, соответственно, отражают уровни, определенные в плазме, взятой от одного и того же пациента в различные моменты времени, как указано на оси x. На оси x представлены моменты времени взятия плазмы, где нулевая точка указывает на первое измерение при терапии каждого пациента. Для анализа изменения уровня свободного лизо-Gb1 с течением времени у пациентов с болезнью Гоше, как описано в примере 3, неагрегированные данные использовали для тех пациентов, для которых анализировали более одного образца крови.
На фиг.3B представлена диаграмма, на которой показан свободный лизо-Gb1 в качестве функции времени, определенный способом в соответствии с настоящим изобретением в нг/мл плазмы всего 24 не подвергнутых лечению пациентов с болезнью Гоше (10 германских, 14 израильских пациентов); не подвергнутые лечению, как используют в рамках изобретения, предпочтительно означает, что не использовали лечения, например фермент-заместительной терапии, в отношении болезни Гоше. Для анализа изменения уровня свободного лизо-Gb1 с течением времени у пациентов с болезнью Гоше, как описано в примере 3, неагрегированные данные использовали для тех пациентов, для которых анализировали более одного образца крови.
На фиг.3C представлена диаграмма, на которой показан свободный лизо-Gb1 в качестве функции времени, причем свободный лизо-Gb1 определяли способом в соответствии с настоящим изобретением в нг/мл плазмы всего 9 израильских пациентов с болезнью Гоше в течение времени до и после начала терапии. На оси x указано время в месяцах, где "0" указывает на первый момент времени после начала терапии. Кривая, обозначенная как "общая", отражает основанные на регрессии величины свободного лизо-Gb1.
На фиг.3D представлена диаграмма, на которой показаны величины на основе регрессии свободного лизо-Gb1 в качестве функции времени, определенные способом в соответствии с настоящим изобретением в нг/мл плазмы израильских и германских пациентов с болезнью Гоше в течение времени до и после начала терапии. На оси x указано время в месяцах, где "0" указывает на первый момент времени после начала терапии. Кривая, обозначенная как "общая", отображает основанные на регрессии величины свободного лизо-Gb1.
На фиг.4 представлена таблица, на которой показан срединный уровень свободного лизо-Gb1 у пациентов с положительными результатами тестирования в отношении одной из двух частых мутаций гена глюкоцереброзидазы, а именно N370S и L444P, в гомозиготном, а также в сложном гетерозиготном случае, где сложная гетерозиготность представляет собой состояние наличия двух гетерогенных рецессивных аллелей в конкретном локусе, которые могут вызывать генетическое заболевание в гетерозиготном состоянии. Специалисту в данной области будет понятно, что пациенты, имеющие мутацию L444P в гене глюкоцереброзидазы, также имеют более злокачественный прогноз, что особенно справедливо в гомозиготной ситуации. Таким образом, вариантом осуществления настоящего изобретения является то, что способ в соответствии с настоящим изобретением включает определение тяжести болезни Гоше. Указанное определение тяжести болезни Гоше включает определение уровня биомаркера, предпочтительно свободного лизо-Gb1, присутствующего в образце от индивидуума, и/или сравнение указанного уровня указанного биомаркера, определенного в образца от индивидуумов, имеющих различные мутации в гене глюкоцереброзидазы и/или не имеющих мутации в гене глюкоцереброзидазы. Авторы настоящего изобретения открыли, что в образце от пациента с положительными результатами тестирования на наличие гомозиготной мутации L444P в гене цереброзидазы уровень свободного лизо-Gb1, определенный способом способ в соответствии с настоящим изобретением составляет приблизительно 194 нг/мл и является повышенным по сравнению с уровнем свободного лизо-Gb1, определенным в образце от пациента с положительными результатами тестирования на наличие гомозиготной мутации N370S в гене цереброзидазы, где уровень свободного лизо-Gb1, определенный способом в соответствии с настоящим изобретением, составляет приблизительно 159 нг/мл. Авторы изобретения также открыли, что в образце от пациента с положительными результатами тестирования на наличие сложной гетерозиготной мутации L444P уровень свободного лизо-Gb1, определенный способом в соответствии с настоящим изобретением, составляет 89 нг/мл и является значительно более низким по сравнению с уровнем свободного лизо-Gb1, определенным способом в соответствии с настоящим изобретением в образце от пациента с положительными результатами тестирования на наличие гомозиготной мутации L444P, где уровень свободного лизо-Gb1, определенный способом в соответствии с настоящим изобретением, составляет приблизительно 45,4 нг/мл. Без связи с какой-либо теорией авторы настоящего изобретения полагают, что уровень свободного лизо-Gb1 в образце от индивидуума, определенный способом по настоящему изобретению, указывает на тяжесть болезни Гоше. Таким образом, следующим вариантом осуществления настоящего изобретения является то, что способ по настоящему изобретению предназначен для определения эффективности по меньшей мере одного способа лечения, используемого у индивидуума с положительными результатами тестирования на наличие и/или риск развития болезни Гоше. Числа, представленные в скобках, указывают на диапазоны концентраций, измеренных в соответствующей группе пациентов. IQR означает интерквартильный размах. Всех пациентов, которых подвергали терапии от болезни Гоше, подвергали ERT.
На фиг.5A представлена хроматограмма ВЭЖХ-масс-спектрометрии, демонстрирующая максимальную интенсивность в cps свободного лизо-Gb1 и IS образца от здорового индивидуума в качестве функции времени удержания в минутах. Время удержания вещества, как используют в рамках изобретения, предпочтительно представлено на оси x и представляет собой прошедшее время между временем инжекции растворенного вещества, например биомаркера в соответствии с настоящим изобретением и/или внутреннего стандарта, и временем элюирования максимума пика указанного растворенного вещества. Специалисту в данной области будет понятно, что время удержания вещества в соответствии с описанными в настоящем описании способами является уникальной характеристикой указанного растворенного вещества и его можно использовать для целей идентификации. К образцу добавляли рабочий раствор внутреннего стандарта, содержащий лизо-Gb2 в качестве внутреннего стандарта, как описано в примере 1. Важно понимать, что путем указанного добавления IS к образцу, т.е. дополнения образца, подлежащего способу в соответствии с настоящим изобретением, концентрация IS в образце является известной и, таким образом, путем определения площади под пиком, т.е. площади пика, внутреннего стандарта на указанной хроматограмме ВЭЖХ-масс-спектрометрии может быть вычислено соотношение между площадью пика и концентрацией вещества, например IS и/или биомаркера. Точнее, специалисту в данной области будет известно, что площадь пика вещества, представленного на хроматограмме ВЭЖХ-масс-спектрометрии, такой как хроматограмма ВЭЖХ-масс-спектрометрии, представленная на фиг.5A, фиг.5B или фиг.5C, отражает показатель количества указанного вещества, подвергнутого анализу ВЭЖХ-масс-спектрометрии. Более того, специалист в данной области будет способен вычислить количество вещества в образце от индивидуума, подвергнутом анализу ВЭЖХ-масс-спектрометрии, например, количество свободного лизо-Gb1 в образце, подвергнутом способу по настоящему изобретению, с использованием соотношения площади пика свободного лизо-Gb1, количество которого подлежит определению указанным способом, и площади пика IS, например, свободного лизо-Gb2; а также калибровочных кривых, полученных с помощью указанного способа, и указанного свободного лизо-Gb1 и/или IS. Таким образом, это позволяет впоследствии определение уровня свободного лизо-Gb1.
На фиг.5B представлена хроматограмма ВЭЖХ-масс-спектрометрии, на которой представлена интенсивность пика свободного лизо-Gb1 и IS образца от пациента с болезнью Гоше, где был определен уровень свободного лизо-Gb1 17,1 нг/мл в соответствии со способом по настоящему изобретению, по существу как описано в примере 1. Сравнение указанного уровня биомаркера в образце от индивидуума с пороговым уровнем 5 нг/мл, который был выбран так, чтобы чувствительность диагностики болезни Гоше у индивидуума в соответствии со способами по настоящему изобретению составляла 100% и чтобы специфичность диагностики болезни Гоше у индивидуума в соответствии со способами по настоящему изобретению составляла 100%, повышенный уровень биомаркера в образце от индивидуума по сравнению с пороговым уровнем указывает на то, что индивидуум страдает болезнью Гоше.
На фиг.5С представлена хроматограмма ВЭЖХ-масс-спектрометрии, на которой представлена интенсивность пика свободного лизо-Gb1 и IS образца от пациента с болезнью Гоше, где был определен уровень свободного лизо-Gb1 319 нг/мл в соответствии со способом по настоящему изобретению, по существу как описано в примере 1. Сравнение указанного уровня биомаркера в образце от индивидуума с пороговым уровнем 5 нг/мл, который был выбран так, чтобы чувствительность диагностики болезни Гоше у индивидуума в соответствии со способами по настоящему изобретению составляла 100% и чтобы специфичность диагностики болезни Гоше у индивидуума в соответствии со способами по настоящему изобретению составляла 100%, повышенный уровень биомаркера в образце от индивидуума по сравнению с пороговым уровнем указывает на то, что индивидуум страдает болезнью Гоше.
Примеры
В примерах, описанных ниже, в качестве образца от индивидуума использовали плазму человека. Тем не менее специалисту в данной области будет понятно, что, в зависимости от используемого типа образца от индивидуума, например, включающего слюну, ликвор, плазму, сыворотку, цельную кровь, кровь на фильтровальной карте с высушенной кровью или другой продукт крови, способ по настоящему изобретению необходимо корректировать, в зависимости от типа образца и, более того, для каждого типа образца необходимо измерять пороговый уровень в соответствии со способом, описанным в примерах ниже. Авторы настоящего изобретения открыли, что использование образца сыворотки человека в способе, как описано ниже, вместо образца плазмы человека приведет к идентичным результатам выявления и, таким образом, определенному уровню свободного лизо-Gb1, если образец сыворотки человека и образце плазмы человека происходит от одного и того же индивидуума, и они были взяты в один и тот же момент времени; и где образцы измеряли параллельно; и, более конкретно, приведет к тому же пороговому уровню. Без связи и в качестве иллюстративных примеров, путем использования слюны от пациента-человека способ можно корректировать в зависимости от величины pH образца; или пороговый уровень может быть определен как составляющий 20 нг/мл при использовании цельной крови или крови, собранной на фильтровальной карте с высушенной кровью в качестве образца от индивидуума.
Пример 1: Способ выявления свободного лизо-Gb1 в сыворотке человека
Оборудование
Для выявления свободного лизо-Gb-1 в образце плазмы от индивидуума использовали следующее оборудование.
|
Реагенты
Для выявления свободного лизо-Gb-1 в образце плазмы от индивидуума использовали следующие реагенты.
Поскольку величины зависят от температуры (например, величина pH), такие величины определяли при температуре 25°C.
|
|
Сокращение "p.a.", как используют в рамках изобретения, означает "для анализа".
Термин "purum", как используют в рамках изобретения, предпочтительно означает коммерческую категорию химического соединения, имеющую чистоту выше указанной величины.
ASTM-I, как используют в рамках изобретения, относится к чистоте стандарта категории воды, достигаемой способами очистки, включающими обратный осмос и окисление с помощью ультрафиолетового излучения (УФ).
Получение калибровочных стандартов
Исходный раствор лизо-Gb1 получали путем растворения 1,70 мг лизо-Gb1 (доставляемого Matreya) в 5 мл MeOH.
Затем получали раствор V1-A-534 в качестве смеси 12 мкл исходного раствора лизо-Gb1 и 5 мл ДМСО/MeOH (1:1; об./об.), как представлено ниже:
|
Затем получали калибровочные стандарты путем добавления раствора Vl-A-534 или более высоко концентрированных калибровочных стандартов в растворитель MeOH/вода (1:1; об./об.).
Детальная схема добавления представлена ниже.
|
Для калибровки использовали калибровочные стандарты, имеющие семь уровней концентрации между 0,400 и 100 нг/мл, а именно калибровочные стандарты Std3A-534, Std4A-534, Std5A-534, Std6A-534, Std7A-534, Std8A-534 и Std9A-534.
Получение контрольных образцов
Контрольные образцы получали дополнением раствора V1-A-534 или более высоко концентрированного контрольного образца в пустой матрикс.
Детальная схема добавления представлена ниже.
|
Пустой матрикс
В качестве пустого матрикса использовали плазму человека от здорового индивидуума. Специалисту в данной области будет понятно, что указанная плазма от здорового индивидуума будет содержать нативный уровень свободного лизо-Gb1. Указанный нативный уровень свободного лизо-Gb1 составляет приблизительно 1,4 нг/мл в соответствии со способами по настоящему изобретению. Таким образом, очевидно, что контрольные образцы, полученные добавлением пустого матрикса, причем пустой матрикс содержит указанный нативный уровень свободного лизо-Gb1, также включают указанный нативный уровень свободного лизо-Gb1 в дополнение к уровню свободного лизо-Gb1, полученному путем добавления концентрированного раствора или более высоко концентрированного контрольного образца. Таким образом, уровень свободного лизо-Gb1 в контрольных образцах является следующим:
|
Специалисту в данной области будет понятно, что плазму человека от здорового индивидуума, используемую в качестве пустого матрикса, можно приобрести в любом коммерческом источнике, известном специалисту в данной области. Важно отметить, что, если случайно плазму нездорового индивидуума, т.е. индивидуума с болезнью Гоше, используют в качестве пустого матрикса, это приведет к необычно высоким уровням свободного лизо-Gb1 в контрольных образцах, определенным способом в соответствии с настоящим изобретением, и, таким образом, это будет сразу установлено, поскольку погрешность способа определяется как находящаяся в диапазоне на 15% выше или ниже оцененных уровней контролей, подвергнутых способу в соответствии с настоящим изобретением.
ИССЛЕДУЕМЫЕ ОБРАЗЦЫ
Получение внутреннего стандарта
Исходный раствор внутреннего стандарта (IS1) получали путем растворения 1,00 мг лизо-Gb2 (доставляемого Matreya) в 2 мл ДМСО/MeOH (1/1; об./об.).
Затем получали рабочий раствор внутреннего стандарта в качестве смеси 410 мкл исходного раствора IS1 и 500 мл этанола. Этанол может быть приобретен в любом коммерческом источнике, где этанол представляет собой абсолютный этанол категории, пригодной для способов, описанных в настоящем описании. Специалисту в данной области будет понятно, что белки, содержащиеся в 50 мкл образца, должны преципитировать, если 100 мкл указанного рабочего раствора внутреннего стандарта добавляют к образцу.
Хранение образцов и растворов
Контрольные образцы или исследуемые образцы либо сразу хранили при температуре ниже -20°C, либо аликвоты переносили в новые стеклянные флаконы до хранения в тех же условиях.
Концентрированные растворы (исходные растворы, V1-A-534 и т.д.), а также исходные растворы внутренних стандартов замораживали при температуре ниже -20°C до следующего добавления.
Рабочие растворы внутреннего стандарта хранили при температуре от 2°C до 8°C до применения.
Авторы настоящего изобретения открыли, что свободный лизо-Gb1 является стабильным в упомянутых выше условиях. Точнее, было выявлено, что уровни свободного лизо-Gb1 в образце плазмы и/или сыворотки пациента с болезнью Гоше, определенные способами в соответствии с настоящим изобретением, являются идентичными, если уровень свободного лизо-Gb1 был определен в указанных образцах до и после хранения при 37°C в течение 2 суток. Таким образом, растворы и образцы по настоящему изобретению можно транспортировать рядом способов, хорошо известных специалисту в данной области, где применение холодильной цепи для транспортировки материала пациента является предпочтительным, но не обязательно требуется. Специалисту в данной области также будут известны способы и их соответствующие условия для надлежащего хранения растворов и образцов, где, например, указанные растворы и образцы можно хранить в течение нескольких недель.
Приготовление образца для анализа
Все образцы, использованные в анализируемой партии, получают для анализа следующим образом:
Замороженные образцы размораживали при приблизительно от 20 до 25°C на водяной бане в условиях окружающей среды. После размораживания образцы смешивали.
50 мкл образца переносили во флакон для образца.
К образцу добавляли 100 мкл рабочего раствора внутреннего стандарта (в EtOH).
Затем полученную таким образом смесь смешивали с использованием устройства для встряхивания для множества пробирок DVX-2500 при 2500 об./мин. в течение приблизительно 30 секунд.
Полученную таким образом смесь центрифугировали для разделения фаз при 4000 об./мин. в течение 2 минут.
Объем супернатанта, достаточный для инжекции (приблизительно 100 мкл), переносили в подходящие (конические) флаконы для автоматического пробоотборника.
СПОСОБЫ
Параметры хроматографии и параметры автоматического пробоотборника
Образцы, полученные для анализа, как описано выше, затем подвергали способу, описанному ниже:
|
|
Колонку ACE 3 C8 (колонка ACE C8 № ACE-112-0502), использованную в этом эксперименте, приобретали от Advanced Chromatography Technologies, Aberdeen.
Специалистам в данной области будет понятно, что параметры, где указан "±" диапазон, отражают параметры, которые могут быть скорректированы между последовательностями. Последовательность, как используют в рамках изобретения, предпочтительно представляет собой партию определенных номеров образцов, предпочтительно максимум 250, анализируемых последовательно, где параметры, включающие поток и температуру, остаются неизмененными. Коррекция и калибровки, осуществляемые между последовательностями, известны специалистам в данной области и включают замену колонки.
Эти изменения в указанных пределах являются незначительными изменениями и зарегистрированы в исходных данных исследования на станции измерения.
Детекция
Затем полученные таким образом образцы подвергали способу детекции, параметры которого описаны ниже:
|
|
Специалисту в данной области будет понятно, что в способах выявления свободного лизо-Gb1 и/или определения уровня свободного лизо-Gb1 в образце от индивидуума с использованием масс-спектрометрического анализа также будут использоваться другие переходы и фрагменты, которые позволяют специфическое выявление и/или количественное определение свободного лизо-Gb1 в указанном образце от индивидуума.
Оценка и вычисление результатов
Для оценки и вычисления результатов, полученных описанными выше способами, использовали следующий протокол.
Процедура округления
Данные о концентрации, введенные и извлеченные из системы хроматографических данных (CDS) округляли до пяти значимых цифр. Дальнейшие вычисления в электронной таблице проводили для полной точности вычислений, а затем округляли до значимых цифр/десятичных знаков для отчета. Таким образом, могут существовать отклонения промежуточных результатов, вызванные округлением. Точность и коэффициенты отклонения (CV) сообщаются с одним или двумя десятичными знаками, соответственно.
В отношении процедуры округления следует отметить: последняя предоставленная цифра округлена в верхнюю сторону, если последующая цифра равна или превышает "5".
Регрессия и статистика
Исходя из калибровочных стандартов проводили аппроксимацию калибровочной кривой с использованием программного обеспечения для обработки данных посредством соотношений площадей пиков (площадь пика свободного лизо-вещества, содержащегося в образце от индивидуума/площадь пика внутреннего стандарта). Концентрации свободного лизо-вещества оценивали с использованием способа внутреннего стандарта. Квадратическую регрессионную модель (y=ax2+bx+c) с использованием коэффициента взвешивания 1/концентрация используют для вычисления концентрации каждого анализируемого соединения в каждой партии, подлежащей оценке. Концентрации вычисляли по следующей формуле:
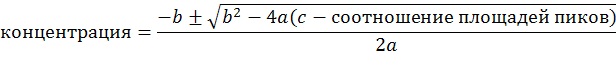
На основе этих средних величин, вычисляют точные результаты (в значениях CV) и погрешность (формула, представленная ниже) с использованием программы "Lotus 123".

Подходящие статистические модели описаны, например, в
Green, J.R., Statistical Treatment of Experimental Data (Elsevier, New York, 1977), page 210 ff.
Lothar Sachs, Angewandte Statistik - Anwendung statistischer Methoden (Springer, Berlin, Heidelberg, New York, Tokyo 1984)
Программное обеспечение
Получение данных, обработка данных, статистическую обработку и вычисления проводили с использованием программного обеспечения Analyst software 1.4.2 или выше (AB SCIEX, США/Канада), а также Lotus 1-2-3 97 или выше (Lotus Corp, США).
Справочники
Справочник Arbeiten mit SmartSuite 97 (Lotus Development Corp., Handbook 1997)
Документация по используемому программному обеспечению
Документация по программному обеспечению Analyst® Software (AB SCIEX, США/Канада):
Operator's Manual & Operator's Manual Addendum "New Functionality in Analyst 1.2" и Online Help System Analyst 1.4 (или выше).
Пример 2: Генетическое тестирование и классификация участников исследования
После получения согласия пациентов на участие в исследовании пациентов подвергали генетическому исследованию в отношении мутаций гена глюкоцереброзидазы. Таким образом, 5-10 мл крови ЭДТА секвенировали согласно Seeman et al. (Seeman et al., 1995). При необходимости дополнительно секвенировали другие гены, помимо глюкоцереброзидазы, в частности у контролей.
Более того, ген хитотриозидазы секвенировали для выявления дупликации 24 п.о., как упоминалось выше. Указанное генетическое тестирование контролировали с использованием исследуемых образцов соответствующих по возрасту и полу контрольных пациентов.
Исследовали 253 индивидуума.
В соответствии с результатом описанного выше генетического исследования, пациентов, участвующих в испытании, подразделяли на следующие группы:
1.) Пациенты, имеющие болезнь Гоше: золотым стандартом для диагностики было выявление двух патогенных мутаций в гене глюкоцереброзидазы, либо гомозиготных, либо сложных гетерозиготных (на фигурах группа названа как "Гоше");
2.) Пациенты, являющиеся гетерозиготными носителями мутации в гене глюкоцереброзидазы (как правило, родственники страдающих пациентов) (на фигурах группа названа как "гетерозиготы")
3.) Пациенты с другими лизосомальными нарушениями накопления в качестве контроля (на фигурах группа названа как "другие LSD"); она включает пациентов с дефицитом сфингомиелиназы (Niemann Pick A/B), болезнью Краббе и болезнью Ниманна-Пика типа C1; все диагнозы были подтверждены путем выявления двух патогенных мутаций.
4.) Здоровые совпадающие по возрасту и полу контроли (на фигурах группа названа как "контроль"). В следующей таблице 1a представлена классификация пациентов на описанные выше группы в соответствии с результатами описанного выше генетического тестирования.
|
Распределение по полу 232 германских пациентов, а также распределение по полу 21 израильского пациента, представлено в таблице 1b.
|
|
В таблице 1c ниже представлено распределение по возрасту 232 германских пациентов и классификация указанных пациентов, исходя из результатов описанного выше генетического тестирования, а также пола указанных пациентов.
|
Уровень свободного лизо-Gb1 в образцах указанных 253 индивидуумов определяли способом, описанным в примере 1. Уровень свободного лизо-Gb1 в образцах от указанных пациентов, в зависимости от классификации посредством генетического анализа, представлен на фиг.1A. На фиг.1B представлен уровень свободного лизо-Gb1 в образцах от указанных пациентов, в зависимости от классификации на основе генетических анализов и от пола пациентов.
Тип мутации и распределение типов мутаций гена глюкоцереброзидазы у пациентов, классифицированных как пациенты с болезнью Гоше в соответствии с результатами, полученными при генетическом тестировании, как описано выше, представлены в таблице 2 ниже.
|
|
Измерение активности хитотриозидазы
Активность хитотриозидазы измеряли, по существу как описано в Hollak et al. (Hollak CE, van Weely S, van Oers MH, Aerts JM. Marked elevation of plasma chitotriosidase activity. A novel hallmark of Gaucher disease. J Clin Invest. 1994 Mar;93(3): 1288-92) путем инкубации 10 мкл плазмы или сыворотки с ЭДТА со 100 мкл 0,022 мМ флуорогенного субстрата 4-метилумбеллиферил-f1-D-N,N'-триацетилхитотриозой (4 MU-хитотриозид; Sigma Aldrich, ST. Louis, MO, США) в качестве субстрата в буфере McIlvain (0,1 M лимонная кислота/0,2 M фосфат натрия, pH 5,2) при 37°C. У пациентов с болезнью Гоше образцы разбавляли 50× в деминерализованной воде до инкубации. Через 30 мин реакцию останавливали с помощью 200 мкл 0,5 M буфера глицин/NaOH (pH 10,5) путем смешения при комнатной температуре. Гидролиз субстрата посредством хитотриозидазы дает флуоресцентную молекулу 4-метилумбеллиферон, которую количественно определяли с помощью флуориметра (Tecan Group Ltd., Mannedorf, Швейцария), возбуждение при 366 нм и испускание при 446 нм, и сравнивали с калибровочной кривой для стандарта 4-метилумбеллиферона. Активность хитотриозидазы выражали в качестве наномоль субстрата, гидролизованного в час на миллилитр инкубированной сыворотки.
Количественное определение CCL18
CCL18 в плазме количественно определяли с помощью набора DuoSet ELISA Development kit, приобретенного от R&D Systems, Minneapolis, MN, США, в соответствии с инструкциями изготовителя. Чувствительность способа составляла 5 пг/мл.
Пример 3: Диагностика болезни Гоше с использованием свободного лизо-Gb1 в качестве биомаркера
Протоколы, описанные в примере 1 выше, использовали для получения хроматограмм ВЭЖХ-масс-спектрометрии для 485 образцов крови, взятых от 253 индивидуумов. Иллюстративные ВЭЖХ-масс-спектрометрические хроматограммы, отражающие интенсивность пика свободного лизо-Gb1 и IS для трех образцов от двух пациентов с болезнью Гоше и одного здорового контрольного индивидуума, представлены на фиг.5A, фиг.5B и фиг.5C.
Золотой стандарт для классификации пациентов в группу "Гоше" был основан на секвенировании всей кодирующей области, а также границах интрон-экзон гена глюкоцереброзидазы в соответствии с генетическим тестированием, как описано в примере 2, которое приводило к выявлению либо гомозиготной мутации, либо сложной гетерозиготности.
Результаты определения уровней хитотриозидазы или CCL18 в образцах от пациентов были доступны для 58 или 44 пациентов с болезнью Гоше, соответственно. Указанные результаты получали, как описано в примере 2.
Для сравнения диагностической величины различных биомаркеров и для вычисления корреляций между биомаркерами, данные, полученные способом, описанным выше, сначала объединяли с использованием наиболее раннего измеренного уровня каждого маркера для пациентов с болезнью Гоше до терапии и наиболее высокого уровня для индивидуумов без болезни Гоше для конкретного пациента, если было доступно более одного образца крови.
Для сравнения двух биомаркеров использовали статистические способы для парных выборок. В способе используется математическая эквивалентность AUC с U-статистикой Манна-Уитни (Delong E.R., Delong D.M., Clarke-Pearson D.L. (1988) Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach, Biometrics, 44, 837-45.)
Точность уровней различных биомаркеров (свободный лизо-Gb1, хитотриозидаза и CCL18), полученных способом, описанным в примере 1, оценивали для отличения пациентов с болезнью Гоше от пациентов без болезни Гоше с использованием анализа кривых соотношений правильного и ложного обнаружения сигналов (ROC) (Metz C.E. (1978) Basic principles of ROC analysis, Semin Nucl Med, 8, 283-98; Zweig M.H., Campbell G. (1993) Receiver-operating characteristic (ROC) plots: a fundamental evaluation tool in clinical medicine, Clin Chem, 39, 561-77). Измерение активности хитотриозидазы и CCL18 проводили, как описано в примере 2 настоящего описания.
Кривые ROC вычисляли с использованием PASW Statistics 18, Release Version 18.0.2 (© SPSS, Inc., 2009, Chicago, IL, www.spss.com). Сравнение кривых ROC и линейных смешанных моделей проводили с использованием программного обеспечения SAS, Version 9.2 SAS System для Windows. (© 2008 SAS Institute Inc., Cary, NC, США).
ROC-кривые, сравнивающие точность уровней хитотриозидазы и свободного лизо-Gb1, представлены на фиг.2A, и ROC-кривые, сравнивающие точность уровней CCL18 и свободного лизо-Gb1, представлены на фиг.2B, соответственно.
Результаты, представленные в ROC-кривых, представленных на фиг.2A и фиг.2B, также демонстрируют специфичность и чувствительность способа в соответствии с настоящим изобретением, в зависимости от различных пороговых уровней свободного лизо-Gb1. В таблице 3 ниже представлены, соответственно, чувствительность и специфичность способа в соответствии с настоящим изобретением, в зависимости от различных пороговых уровней свободного лизо-Gb1.
|
Сравнение уровня биомаркера в образце от индивидуума, определенного способом в соответствии с настоящим изобретением, с пороговым уровнем, предпочтительно пороговым уровнем, позволяющим диагностику, имеющую высокую специфичность и высокую чувствительность, таким образом, позволяет диагностику болезни Гоше у указанного индивидуума, где повышенный уровень биомаркера в образце от индивидуума по сравнению с пороговым уровнем указывает на то, что индивидуум страдает или имеет риск развития болезни Гоше, и где более низкий уровень биомаркера в образце от индивидуума по сравнению с пороговым уровнем указывает на то, что индивидуум не страдает или не имеет риск развития болезни Гоше.
Площадь под кривой (AUC) и 95% доверительный интервал для различных биомаркеров представлены в таблице 4.
|
Таким образом, в таблице 3 чувствительность и специфичность представленных биомаркеров, используемых в способе диагностики болезни Гоше в образце от индивидуума, сравнивают с использованием порогового уровня, имеющего наиболее высокую AUC, в соответствующем способе с использованием соответствующего биомаркера. Представлен идеальный пороговый уровень соответствующего способа. Измерение активности хитотриозидазы и CCL18 проводили, как описано в примере 2 настоящего описания. Свободный лизо-Gb1 определяли в соответствии со способом по настоящему изобретению. Идеальный пороговый уровень составляет 5 нг/мл.
Специалисту в данной области будет понятно, что способ в соответствии с настоящим изобретением с использованием свободного лизо-Gb1 в качестве биомаркера для диагностики болезни Гоше, очевидно, является преимущественным относительно способов с использованием CCL18 или хитотриозидазы. Это особенно справедливо, поскольку по меньшей мере 6% популяции европиоидов и вплоть до 35%, например, популяции латиноамериканцев, включая индивидуумов с болезнью Голе, имеют дефицит активности хитотриозидазы.
Таким образом, уровни свободного лизо-Gb1, определенные в образце от индивидуума в соответствии со способом настоящей заявки, превышающие 5,0 нг/мл, позволяют диагностирование того, что индивидуум страдает или имеет риск развития болезни Гоше с чувствительностью и специфичностью 100%.
Пример 4: Анализ изменений биомаркеров с течением времени
Способ и пациенты, используемые в этом примере, представляли собой способ и пациентов, как описано в примерах 1-3.
Для анализа того, как уровень биомаркеров изменялся с течением времени у пациентов, имеющих болезнь Гоше, неагрегированные данные анализировали для тех пациентов, для которых анализировали более одного образца крови. Нулевой момент времени был установлен для первого измерения в ходе терапии каждого пациента.
Уровни свободного лизо-Gb1 с течением времени для отдельных пациентов представлены на фиг.3A, фиг.3B и фиг.3C.
Для исследования значимости зависимого от времени снижения уровней свободного лизо-Gb1, указывающего на успешную терапию, уровни свободного лизо-Gb1 после начала терапии сравнивали с уровнями свободного лизо-Gb1 до начала терапии с использованием линейных смешанных моделей. Пациенты без лечения не продемонстрировали значимого снижения уровней свободного лизо-Gb1 с течением времени.
Таким образом, величины уровней свободного лизо-Gb1 преобразовывали в логарифмические для преодоления отклонения в распределении величин. Для учета гетерогенности между пациентов в начальных величинах, а также в скорости изменения, использовали модели случайного отсечения и наклона. Во всех моделях наблюдаемая гетерогенность была статистически значимой. Описаны только величины p для линейного уменьшения времени.
Значения для времени и величины, которые включали возведенное в квадрат значение для времени, центрировали для исследования нелинейной взаимосвязи между временем и уровнем маркера для хитотриозидазы и для CCL18. Для свободного лизо-Gb1 возведенное в квадрат значение не улучшало модель и не было включено в конечную модель.
В качестве терапии германским пациентам вводили 40 Е/кг массы тела в среднем, где единицы относятся к единицам рекомбинантной глюкоцереброзидазы при ERT. Снижение свободного лизо-Gb1 является особенно интенсивным после начала терапии (через 6 месяцев <0,0001). Однако также является значимым снижение с течением времени (<0,0001). Происходило снижение свободного лизо-Gb1 после лечения в течение 12 месяцев в среднем в диапазоне 60%.
Признаки настоящего изобретения, описанные в описании, формуле изобретения, списке последовательностей и/или чертежах могут как по отдельности, так и в комбинации, быть материалом для осуществления изобретения в различных его формах.