Результат интеллектуальной деятельности: 2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ
Вид РИД
Изобретение
Настоящее изобретение относится к соединениям общей формулы
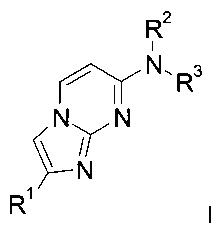 ,
,
где
R1 представляет собой фенил, возможно замещенный одним или двумя заместителями, выбранными из 3H, галогена, низшего алкила, диметиламино, NHC(O)-низшего алкила, C(O)O-низшего алкила, низшего алкокси, OC(3H)3, O11CH3, OCH2CH218F, низшего алкокси, замещенного галогеном, гидрокси, низшего алкила, замещенного гидрокси, S-низшего алкила, или гетероциклильной группой; или представляет собой бензо[d][1,3]диоксол-5-ил, 2,3-дигидробензо[b][1,4]диоксин-6-ил, индолин-2-он, или представляет собой гетероарил, выбранный из группы, состоящей из тиофенила, бензофуранила, бензотиофенила, пиразинила или бензотиазолила;
R2 представляет собой водород, низший алкил или низший алкил, замещенный галогеном;
R3 представляет собой низший алкил, C(3H)3, 11CH3, низший алкил, замещенный галогеном, -(CH2)2-O-низший алкил, замещенный галогеном, или циклоалкил; или
R2 и R3 вместе с атомом азота, к которому они присоединены, образуют кольцо, содержащее -CH2CH2CHRCH2CH2-, -СН2СН2СН2СН2-, -CH2CH2CH2-, -CH2CH2-NR-CH2CH2-, -СН2СН2-O-СН2СН2-, -CH2CH2CHRCH2-, -CH2CHRCH2- или 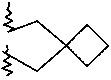 ;
;
R представляет собой водород, галоген, низший алкил, замещенный галогеном, или низший алкокси;
или к их фармацевтически приемлемым солям присоединения кислоты, рацемическим смесям или их соответствующим энантиомерам и/или оптическим изомерам.
Аналогичные соединения описаны, например, в WO 2011/117264 в качестве модуляторов фосфодиэстеразы 10А (PDE10A) для лечения заболеваний центральной нервной системы, и в WO 2010/068453 и WO 2010/068452 в качестве модуляторов гидролазы амидов жирных кислот.
2-Арил-3-(гетероарил)-имидазо(1,2-а)пиримидины описаны в WO 0134605 для лечения состояний, которые облегчаются путем снижения воспалительных цитокинов.
Показали, что соединения согласно настоящему изобретению могут быть использованы для связывания и визуализации тау-агрегатов и соответствующих агрегатов бета-листов, включая, помимо прочего, бета-амилоидные агрегаты или альфа-синуклеиновые агрегаты, особенно для применения в связывании и визуализации тау-агрегатов у пациентов с болезнью Альцгеймера.
Болезнь Альцгеймера (AD) представляет собой прогрессирующее нейродегенеративное заболевание, характеризующееся снижением когнитивной функции, необратимой потерей памяти, дезориентацией и нарушениями речи (Arch. Neurol., 1985, 42 (11), 1097-1105). Посмертное исследование участков мозга с AD показывает наличие обильных старческих бляшек (SPS), состоящих из бета-амилоидных (Aβ) пептидов, и многочисленных нейрофибриллярных клубков (NFT), образованных нитями гиперфосфорилированного тау-белка.
Тау-белок принадлежит к семейству ассоциированных с микротрубочками белков и, в основном, экспрессируется в нейронах, где он играет важную роль в сборке тубулиновых мономеров в микротрубочки с образованием сети нейронных микротрубочек как путей для аксонного транспорта (Brain Res. Rev. 2000, 33 (1), 95-130). Тау-белок транслируется из единственного гена, находящегося на хромосоме 17, а экспрессия эволюционно регулируется с помощью механизма альтернативного сплайсинга, генерирующего шесть различных изоформ в мозге взрослого человека, которые можно отличить по количеству связывающих доменов. Основные механизмы, ведущие к гиперфосфорилированию тау-белка, неправильному сворачиванию и агрегации, не очень хорошо понятны, но отложение тау-агрегатов происходит после стереотипного пространственно-временного пути как на внутриклеточном уровне, так и на уровне топографии головного мозга.
Недавнее открытие мутаций тау-генов, ведущих к лобно-височной деменции (FTD) с паркинсонизмом, связанным с хромосомой 17, усилило доминирующую роль, приписываемую тау-белку в патогенезе нейродегенеративных расстройств, и подчеркнуло тот факт, что различные наборы изоформ тау-белка, экспрессируемых в различных популяциях нейронов, могут привести к различным патологиям (Biochim. Biophys. Acta 2005, 1739(2) 240-250). Нейродегенеративные заболевания, характеризующиеся патологическим накоплением тау-белка, называют "тауопатиями" (Ann. Rev. Neurosci. 2001, 24, 1121-1159). Кроме того, AD и FTD, другие тауопатии включают прогрессивный супрануклеарный паралич (PSP), деменцию с преобладанием нейрофибриллярных клубков, болезнь Пика, лобно-височную лобарную дегенерацию (FTLD), синдром Дауна и другие.
Установили прямую корреляцию между прогрессивным вовлечением областей неокортекса и растущей тяжестью деменции, предполагающую, что патологические тау-агрегаты, такие как NFT, являются надежным маркером нейродегенеративного процесса. Степень участия NFT в AD определяется стадиями Браака (Acta Neuropathol. 1991, 82, 239-259). Стадии Браака I и II относятся к состоянию, когда участие NFT ограничено, в основном, трансэнторинальной областью мозга, стадии III и IV диагностируют, когда вовлечены лимбические области, такие как гиппокамп, и стадии V и VI относятся к состоянию, когда обнаруживают обширное вовлечение неокортекса.
В настоящее время обнаружение тау-агрегатов можно осуществить только гистологическим анализом материалов биопсии или аутопсии. Визуализация тауопатии in vivo обеспечила бы новый взгляд на отложение тау-агрегатов в мозге человека и позволила бы осуществить неинвазивное исследование степени тауопатии, количественную оценку изменений отложений тау-агрегатов в течение длительного времени, оценить ее корреляцию с познавательной функцией и анализировать эффективность терапии против тау-агрегатов. Потенциальные лиганды для обнаружения тау-агрегатов в живом мозге должны пересечь гематоэнцефалический барьер и обладать высоким сродством и специфичностью к тау-агрегатам. Для этого успешные радиоактивные метки нейровизуализации должны иметь соответствующую липофильность (logD 1-3) и низкую молекулярную массу (<450), проявлять быстрый клиренс из крови и низкое неспецифическое связывание.
Задачей настоящего изобретения является разработка средства визуализации, которое позволит улучшить диагностику путем выявления потенциальных пациентов с избытком тау-агрегатов в головном мозге, которые могут быть склонны к развитию болезни Альцгеймера. Оно также будет полезно для мониторирования прогрессирования заболевания. Когда будет доступно лекарственное средство против тау-агрегатов, визуализация клубков тау-белка в головном мозге может обеспечить необходимый инструмент для мониторирования лечения.
Другим предметом настоящего изобретения является способ визуализации отложений тау-агрегатов, в котором
- вводят млекопитающему детектируемое количество композиции,
- оставляют соединение формулы I на достаточное время для связывания с отложениями тау-агрегатов, и
- детектируют соединение, связанное с одним или более отложений тау-агрегатов.
Еще одним предметом настоящего изобретения является фармацевтическая композиция, содержащая соединение формулы I и фармацевтически приемлемые носители, которая может быть использована для идентификации потенциальных пациентов.
Следующие определения общих терминов, используемых в настоящем описании, применяются независимо от того, используются ли эти термины отдельно или в комбинации.
Термин "низший алкил", как используется здесь, означает насыщенную, т.е. алифатическую углеводородную группу, включая прямую или разветвленную углеродную цепь из 1-7 атомов углерода. Примерами "алкила" являются метил, этил, н-пропил и изопропил.
Термин "циклоалкил" означает неароматическое углеводородное кольцо, содержащее от 3 до 6 атомов углерода.
Термин "алкокси" означает группу -O-R', где R' представляет собой низший алкил, как определено выше.
Термин "галоген" означает хлор, бром, фтор или йод.
Термин "низший алкил, замещенный галогеном" означает алкильную группу, как определено выше, где по меньшей мере один атом водорода замещен атомом галогена.
Термин "низший алкокси, замещенный галогеном" означает алкокси группу, как определено выше, где по меньшей мере один атом водорода замещен атомом галогена.
Термин "гетероциклил" означает насыщенное кольцо, содержащее 1-3 гетероатома, выбранных из N, О или S, например, морфолинил, пиперазинил, пиперидинил или пирролидинил.
3Н означает атом трития.
Термин "фармацевтически приемлемая соль" или "фармацевтически приемлемая соль присоединения кислоты" включает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и тому подобное.
Было обнаружено, что соединения формулы I могут быть использованы для связывания и визуализации тау-агрегатов и соответствующих агрегатов бета-листов, включая, помимо прочего, бета-амилоидные агрегаты или альфа-синуклеиновые агрегаты.
Одним из предметов настоящего изобретения являются соединения формулы
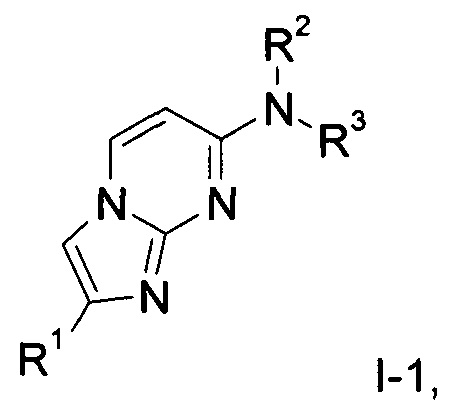
где
R1 представляет собой фенил, возможно замещенный одним или двумя заместителями, выбранными из 3Н, галогена, низшего алкила, диметиламино, NHC(O)-низшего алкила, С(O)O-низшего алкила, низшего алкокси, ОС(3Н)3, O11CH3, OCH2CH218F, низшего алкокси, замещенного галогеном, гидрокси, низшего алкила, замещенного гидрокси, S-низшего алкила, или гетероциклильной группой;
R2 представляет собой водород, низший алкил или низший алкил, замещенный галогеном;
R3 представляет собой низший алкил, С(3H)3, 11CH3, низший алкил, замещенный галогеном, -(CH2)2-O-низший алкил, замещенный галогеном, или циклоалкил; или
R2 и R3 вместе с атомом азота, к которому они присоединены, образуют кольцо, содержащее -CH2CH2CHRCH2CH2-, - СН2СН2СН2СН2-, -CH2CH2CH2-, -CH2CH2-NR-CH2CH2-, -СН2СН2-O-СН2СН2-, -CH2CH2CHRCH2-, -CH2CHRCH2- или 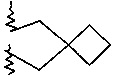 ;
;
R представляет собой водород, галоген, низший алкил, замещенный галогеном, или низший алкокси;
или их фармацевтически приемлемые соли присоединения кислоты, рацемические смеси или соответствующие энантиомеры, и/или оптические изомеры, например следующие соединения
N-метил-2-фенилимидазо[1,2-a]пиримидин-7-амин
7-(4-фторпиперидин-1-ил)-2-фенилимидазо[1,2-a]пиримидин
7-(4-фторпиперидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
2-(4-хлорфенил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
7-(4-фторпиперидин-1-ил)-2-(3-метоксифенил)имидазо[1,2-a]пиримидин
2-(4-фторфенил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
4-[4-[7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]фенил]морфолин
7-(4-фторпиперидин-1-ил)-2-(3-метилфенил)имидазо[1,2-a]пиримидин
7-(4-фторпиперидин-1-ил)-2-(4-метилфенил)имидазо[1,2-a]пиримидин
2-(2-фторфенил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
3-[7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]фенол
7-(4-фторпиперидин-1-ил)-2-(4-пирролидин-1-илфенил)имидазо[1,2-a]пиримидин
7-(4-фторпиперидин-1-ил)-2-[3-(трифторметокси)фенил]имидазо[1,2-a]пиримидин
2-[3-(фторметокси)фенил]-7-пирролидин-1-илимидазо[1,2-a]пиримидин
2-[3-(2-фторэтокси)фенил]-7-пирролидин-1-илимидазо[1,2-a]пиримидин
N,N-диметил-2-фенилимидазо[1,2-a]пиримидин-7-амин
7-[4-(2-фторэтил)пиперазин-1-ил]-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
7-[4-(2-фторэтил)пиперазин-1-ил]-2-(3-метоксифенил)имидазо[1,2-a]пиримидин
N-(2-фторэтил)-N-метил-2-фенилимидазо[1,2-a]пиримидин-7-амин
N-(2-фторэтил)-2-(3-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
N-(2-фторэтил)-2-(4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
7-[4-(2-фторэтил)пиперазин-1-ил]-2-фенилимидазо[1,2-a]пиримидин
4-[2-(4-метоксифенил)имидазо[1,2-a]пиримидин-7-ил]морфолин
4-[2-(3-метилфенил)имидазо[1,2-a]пиримидин-7-ил]морфолин
4-[2-(3,4-диметоксифенил)имидазо[1,2-a]пиримидин-7-ил]морфолин
4-(7-пирролидин-1-илимидазо[1,2-a]пиримидин-2-ил)фенол
2-[4-(2-фторэтокси)фенил]-7-пирролидин-1-илимидазо[1,2-a]пиримидин
2-[4-(фторметокси)фенил]-7-пирролидин-1-илимидазо[1,2-a]пиримидин
7-[(3R)-3-метоксипирролидин-1-ил]-2-фенилимидазо[1,2-a]пиримидин
7-[(3S)-3-метоксипирролидин-1-ил]-2-фенилимидазо[1,2-a]пиримидин
7-[(3R)-3-фторпирролидин-1-ил]-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
7-[(3S)-3-фторпирролидин-1-ил]-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
2-(3-метоксифенил)-N,N-диметилимидазо[1,2-a]пиримидин-7-амин
2-(4-метоксифенил)-N,N-диметилимидазо[1,2-a]пиримидин-7-амин
N,N-диметил-2-(4-метилфенил)имидазо[1,2-a]пиримидин-7-амин
N,N-диметил-2-(3-метилфенил)имидазо[1,2-a]пиримидин-7-амин
4-[2-(3-метоксифенил)имидазо[1,2-a]пиримидин-7-ил]морфолин
4-[2-(4-метилфенил)имидазо[1,2-a]пиримидин-7-ил]морфолин
2-(4-метоксифенил)-7-пирролидин-1-илимидазо[1,2-a]пиримидин
2-(4-метилфенил)-7-пирролидин-1-илимидазо[1,2-a]пиримидин
N,N-диметил-2-(4-морфолин-4-илфенил)имидазо[1,2-a]пиримидин-7-амин
2-[4-(диметиламино)фенил]-N,N-диметилимидазо[1,2-a]пиримидин-7-амин
2-(3-метоксифенил)-7-пирролидин-1-илимидазо[1,2-a]пиримидин
2-(3-метилфенил)-7-пирролидин-1-илимидазо[1,2-a]пиримидин
2-(4-метоксифенил)-7-пиперидин-1-илимидазо[1,2-a]пиримидин
2-(3-метоксифенил)-7-пиперидин-1-илимидазо[1,2-a]пиримидин
2-(4-метилфенил)-7-пиперидин-1-илимидазо[1,2-a]пиримидин
2-(3-метилфенил)-7-пиперидин-1-илимидазо[1,2-a]пиримидин
2-(3,4-диметоксифенил)-7-пиперидин-1-илимидазо[1,2-a]пиримидин
7-[4-(2-фторэтил)пиперидин-1-ил]-2-фенилимидазо[1,2-a]пиримидин
7-[4-(2-фторэтил)пиперидин-1-ил]-2-(3-метоксифенил)имидазо[1,2-a]пиримидин
7-[4-(2-фторэтил)пиперидин-1-ил]-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
7-[4-(2-фторэтил)пиперидин-1-ил]-2-(3-метилфенил)имидазо[1,2-a]пиримидин
7-[4-(2-фторэтил)пиперидин-1-ил]-2-(4-метилфенил)имидазо[1,2-a]пиримидин
4-[4-[7-[4-(2-фторэтил)пиперидин-1-ил]имидазо[1,2-a]пиримидин-2-ил]фенил]морфолин
N-метил-2-(3-метилфенил)имидазо[1,2-a]пиримидин-7-амин
N-[2-(2-фторэтокси)этил]-2-(4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
7-(2-азаспиро[3,3]гептан-2-ил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
N-этил-2-(4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
N,N-диэтил-2-(4-метоксифенил)имидазо[1,2-a]пиримидин-7-амин
N-[2-(2-фторэтокси)этил]-N-метил-2-(3-метилфенил)имидазо[1,2-a]пиримидин-7-амин
7-(азетидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
7-(3-фторазетидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
7-(3-фторазетидин-1-ил)-2-фенилимидазо[1,2-a]пиримидин
7-(3-фторазетидин-1-ил)-2-(3-метилфенил)имидазо[1,2-a]пиримидин
N,N-диметил-4-(7-морфолин-4-илимидазо[1,2-a]пиримидин-2-ил)анилин
N-циклопропил-2-(4-метоксифенил)имидазо[1,2-a]пиримидин-7-амин
N-изопропил-2-(4-метоксифенил)-имидазо[1,2-a]пиримидин-7-амин
2-(4-метоксифенил)-N-(2,2,2-трифторэтил)имидазо[1,2-a]пиримидин-7-амин
4-[7-(азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]фенол
7-(3-метоксиазетидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
N-метил-2-(4-метилфенил)имидазо[1,2-a]пиримидин-7-амин
2-(4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
N-(2-фторэтил)-N-метил-2-(4-метилфенил)имидазо[1,2-a]пиримидин-7-амин
N-(2-фторэтил)-N-метил-2-(3-метилфенил)имидазо[1,2-a]пиримидин-7-амин
2-(4-метоксифенил)-7-(3-метилазетидин-1-ил)имидазо[1,2-a]пиримидин
2-[4-(диметиламино)фенил]-N-метилимидазо[1,2-a]пиримидин-7-амин
4-[7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]-N,N-диметиланилин
2-[4-(диметиламино)фенил]-N-(2-фторэтил)-N-метилимидазо[1,2-a]пиримидин-7-амин
N-циклопропил-2-(4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
7-(азетидин-1-ил)-2-(4-метилфенил)имидазо[1,2-a]пиримидин
7-(азетидин-1-ил)-2-(3-метилфенил)имидазо[1,2-a]пиримидин
2-[4-(диметиламино)фенил]-N-(2-фторэтил)имидазо[1,2-a]пиримидин-7-амин
7-(азетидин-1-ил)-2-[4-(фторметокси)фенил]имидазо[1,2-a]пиримидин
2-метокси-4-[7-(метиламино)имидазо[1,2-a]пиримидин-2-ил]фенол
2-(3-бромфенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
7-(4-фторпиперидин-1-ил)-2-(4-метокси-2,6-дитритиофенил)имидазо[1,2-a]пиримидин
7-(азетидин-1-ил)-2-[4-(тритритиометокси)фенил)имидазо[1,2-a]пиримидин
2-(3-метилфенил)-N-(тритритиометил)имидазо[1,2-a]пиримидин-7-амин
N-[11C]метил-2-(м-толил)имидазо[1,2-a]пиримидин-7-амин
N-циклопропил-2-(4-[11C]метоксифенил)имидазо[1,2-a]пиримидин-7-амин
2-[4-(2-[18F]фторэтокси)фенил]-N-метил-имидазо[1,2-a]пиримидин-7-амин
[4-[7-(метиламино)имидазо[1,2-a]пиримидин-2-ил]фенил]метанол
2-(3-фтор-4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
N-(4-(7-(метиламино)имидазо[1,2-a]пиримидин-2-ил)фенил)ацетамид
7-(азетидин-1-ил)-2-(4-(2-фторэтокси)фенил)имидазо[1,2-a]пиримидин
7-(азетидин-1-ил)-2-(4-(3-фторпропокси)фенил)имидазо[1,2-a]пиримидин
7-(азетидин-1-ил)-2-(3-метоксифенил)имидазо[1,2-a]пиримидин
[3-[7-(метиламино)имидазо[1,2-a]пиримидин-2-ил]фенил]метанол
7-(азетидин-1-ил)-2-(3-(2-фторэтокси)фенил)имидазо[1,2-a]пиримидин
N-циклопропил-N-(2-фторэтил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин-7-амин
2-(3-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
7-(азетидин-1-ил)-2-(3-(фторметокси)фенил)имидазо[1,2-a]пиримидин
7-(азетидин-1-ил)-2-(4-фторфенил)имидазо[1,2-a]пиримидин
7-(азетидин-1-ил)-2-(3-фторфенил)имидазо[1,2-a]пиримидин
7-(азетидин-1-ил)-2-(3,5-диметоксифенил)имидазо[1,2-a]пиримидин
4-(7-(метиламино)имидазо[1,2-a]пиримидин-2-ил)фенол
2-(4-(2-фторэтокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
2-(4-(3-фторпропокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
3-(7-(метиламино)имидазо[1,2-a]пиримидин-2-ил)фенол
7-(азетидин-1-ил)-2-(3-(метилтио)фенил)имидазо[1,2-a]пиримидин
7-(азетидин-1-ил)-2-(3-метокси-4-метилфенил)имидазо[1,2-a]пиримидин
7-(азетидин-1-ил)-2-(3,4-диметоксифенил)имидазо[1,2-a]пиримидин 2-(3-(2-фторэтокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
2-(3-(3-фторпропокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
2-(3-(фторметокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
2-(4-(фторметокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
3-(7-(циклопропиламино)имидазо[1,2-a]пиримидин-2-ил)фенол
N-циклопропил-2-(3-(2-фторэтокси)фенил)имидазо[1,2-a]пиримидин-7-амин
аддукт [4-[7-(диметиламино)имидазо[1,2-a]пиримидин-2-ил]фенил]метанола с уксусной кислотой
метил-4-[7-(метиламино)имидазо[1,2-a]пиримидин-2-ил]бензоат
N-циклопропил-2-(3-(фторметокси)фенил)имидазо[1,2-a]пиримидин-7-амин
N-циклопропил-2-(4-(2-фторэтокси)фенил)имидазо[1,2-a]пиримидин-7-амин
N-циклопропил-2-(4-(3-фторпропокси)фенил)имидазо[1,2-a]пиримидин-7-амин
N-циклопропил-2-(4-(фторметокси)фенил)имидазо[1,2-a]пиримидин-7-амин
N-метил-2-(4-(метилтио)фенил)имидазо[1,2-a]пиримидин-7-амин
2-(3,4-диметоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
2-(3-метокси-4-метилфенил)-N-метилимидазо[1,2-a]пиримидин-7-амин или
2-(3,5-диметоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин.
Одним из предметов настоящего изобретения являются дополнительные соединения формулы
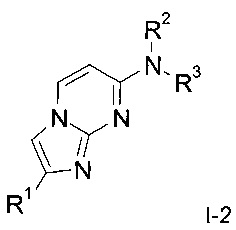 ,
,
где
R1 представляет собой бензо[d][1,3]диоксол-5-ил, 2,3-дигидробензо[b][1,4]диоксин-6-ил или индолин-2-он.
R2 представляет собой водород, низший алкил или низший алкил, замещенный галогеном;
R3 представляет собой низший алкил, C(3H)3, 11CH3, низший алкил, замещенный галогеном, -(CH2)2-O-низший алкил, замещенный галогеном, или циклоалкил; или
R2 и R3 вместе с атомом азота, к которому они присоединены, образуют кольцо, содержащее -CH2CH2CHRCH2CH2-, -CH2CH2CH2CH2-, -CH2CH2CH2-, -CH2CH2-NR-CH2CH2-, -CH2CH2-O-CH2CH2-, -CH2CH2CHRCH2-, -CH2CHRCH2- или 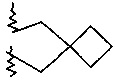 ;
;
R представляет собой водород, галоген, низший алкил, замещенный галогеном, или низший алкокси;
или их фармацевтически приемлемые соли присоединения кислоты, рацемические смеси или соответствующие энантиомеры, и/или оптические изомеры, например следующие соединения
2-(1,3-бензодиоксол-5-ил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
2-(2,3-дигидро-1,4-бензодиоксин-6-ил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
2-(1,3-бензодиоксол-5-ил)-N,N-диметилимидазо[1,2-a]пиримидин-7-амин
2-(2,3-дигидро-1,4-бензодиоксин-6-ил)-N,N-диметилимидазо[1,2-a]пиримидин-7-амин
2-(1,3-бензодиоксол-5-ил)-7-[4-(2-фторэтил)пиперидин-1-ил]имидазо[1,2-a]пиримидин
2-(2,3-дигидро-1,4-бензодиоксин-6-ил)-7-[4-(2-фторэтил)пиперидин-1-ил]имидазо[1,2-a]пиримидин
2-(1,3-бензодиоксол-5-ил)-N-метилимидазо[1,2-a]пиримидин-7-амин 2-(1,3-бензодиоксол-5-ил)-N-(2-фторэтил)-N-метилимидазо[1,2-a]пиримидин-7-амин или
5-(7-(метиламино)имидазо[1,2-a]пиримидин-2-ил)индолин-2-он.
Одним из предметов настоящего изобретения являются дополнительные соединения формулы
где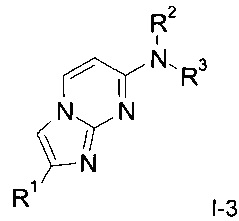 ,
,
R1 представляет собой гетероарил, выбранный из группы, состоящей из тиофенила, бензофуранила, бензотиофенила, пиразинила или бензотиазолила;
R2 представляет собой водород, низший алкил или низший алкил, замещенный галогеном;
R3 представляет собой низший алкил, C(3H)3, 11CH3, низший алкил, замещенный галогеном, -(CH2)2-O-низший алкил, замещенный галогеном, или циклоалкил; или
R2 и R3 вместе с атомом азота, к которому они присоединены, образуют кольцо, содержащее -CH2CH2CHRCH2CH2-, -СН2СН2СН2СН2-, -СН2СН2СН2-, -CH2CH2-NR-CH2CH2-, -СН2СН2-O-СН2СН2-, -CH2CH2CHRCH2-, -CH2CHRCH2- или 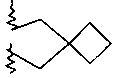 ;
;
R представляет собой водород, галоген, низший алкил, замещенный галогеном, или низший алкокси;
или их фармацевтически приемлемые соли присоединения кислоты, рацемические смеси или соответствующие энантиомеры, и/или оптические изомеры, например, следующие соединения:
7-(4-фторпиперидин-1-ил)-2-тиофен-3-илимидазо[1,2-a]пиримидин
2-(1-бензофуран-2-ил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
2-(1-бензотиофен-2-ил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
2-[7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]-1,3-бензотиазол
N,N-диметил-2-тиофен-3-илимидазо[1,2-a]пиримидин-7-амин или
7-(4-фторпиперидин-1-ил)-2-(пиразин-2-ил)имидазо[1,2-a]пиримидин.
Соединения формулы I могут быть использованы для связывания и визуализации тау-агрегатов, бета-амилоидных агрегатов, альфа-синуклеиновых агрегатов или агрегатов хантингтина.
Предпочтительное применение соединений формулы I - это применение для связывания и визуализации тау-агрегатов у пациентов с болезнью Альцгеймера.
Кроме того, соединения формулы I можно использовать для изучения связывания тау-белка.
Изобретение также используют для диагностической визуализации отложений тау-агрегатов в мозге млекопитающего.
Соединения формулы I
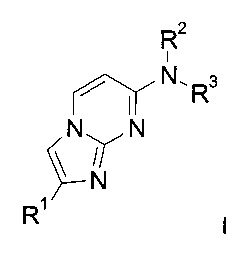
и их фармацевтически приемлемые соли могут быть получены способом, описанным ниже, включающим
a) конденсацию соединения формулы II (X=Cl, Br)
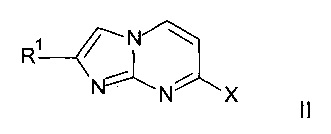
с подходящим амином HNR2R3 с получением соединения формулы I
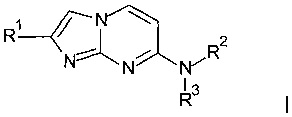 ,
,
где заместители R1, R2 и R3 являются такими, как определено выше,
и, при необходимости, превращение полученного соединения в его фармацевтически приемлемую соль присоединения кислоты или в соединение формулы I-2
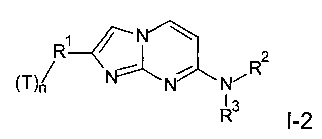
где T представляет собой тритий, и n представляет собой 1 или 2,
или
b) конденсацию соединения формулы III
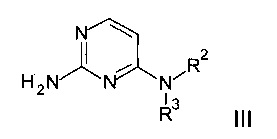
с α-активированным кетоном формулы IV
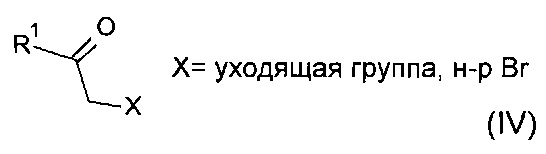
с получением соединения формулы I
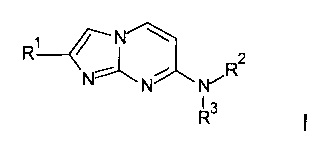
где заместители R1, R2 и R3 являются такими, как определено выше, и, при необходимости, превращение полученного соединения в его фармацевтически приемлемую соль присоединения кислоты или в соединение формулы I-2
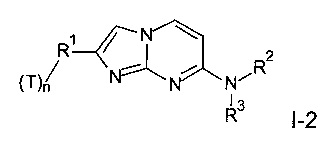
где T представляет собой тритий, и n представляет собой 1 или 2, или
c) осуществление взаимодействия соединения формулы V
с подходящим алкилирующим агентом с получением соединения формулы I
или соединения формулы I-3
 ,
,
где заместители R1, R2 и R3 являются такими, как определено выше, и где T представляет собой тритий, и, при необходимости, превращение полученного соединения в его фармацевтически приемлемую соль присоединения кислоты или в соединение формулы I-2.
Следующие схемы 1-4 описывают способы получения соединений формулы I более подробно. Исходные материалы являются известными соединениями или могут быть получены способами, известными в данной области.
Получение соединений формулы (I) настоящего изобретения можно осуществлять последовательными или пересекающимися путями синтеза. Навыки, необходимые для проведения реакции и очистки полученных продуктов известны специалистам в данной области. Заместители и индексы, используемые в следующем описании способов, имеют значения, описанные в данном документе, если не указано иное.
Более подробно, соединения формулы I могут быть получены способами, приведенными ниже, способами, приведенными в примерах, или аналогичными способами. Соответствующие условия для отдельных стадий реакций известны специалистам в данной области. Последовательность реакций не ограничена последовательностью, показанной на схемах 1-4, однако, в зависимости от исходных материалов и их соответствующей реакционной способности, последовательность стадий реакции может быть свободно изменена. Исходные материалы либо являются коммерчески доступными, либо могут быть получены способами, аналогичными способам, приведенным ниже, способами, описанными в ссылках, приведенных в описании, или в примерах, или способами, известными в данной области техники.
Схема 1
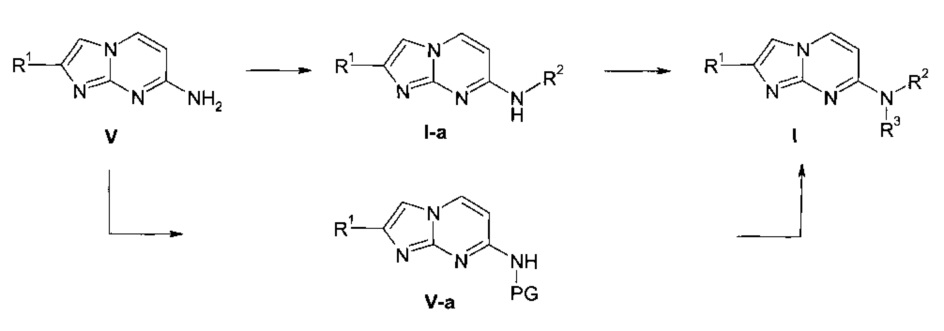
Согласно схеме 1, соединения формулы I, где заместители R1, R2 и R3 являются такими, как определено выше, могут быть получены с помощью последовательных реакций алкилирования аминов V подходящими алкилирующими агентами, например, йодистым метилом или алкилгалогенидом в присутствии основания, например гидрида натрия, в подходящем растворителе, например диметилформамиде (ДМФ) при температуре окружающей среды или повышенной температуре. Кроме того, амин V сначала превращают в защищенный амин V-a путем реакции с подходящим реагентом, например ди-трет-бутилдикарбонатом, в подходящем растворителе, а затем проводят реакцию алкилирования с подходящим алкилирующим агентом, например йодистым метилом или алкилгалогенидом, в присутствии основания, например гидрида натрия, в подходящем растворителе, например, ДМФ при температуре окружающей среды или повышенной температуре. Затем снятие защиты приводит к получению соединения формулы I.
Схема 2
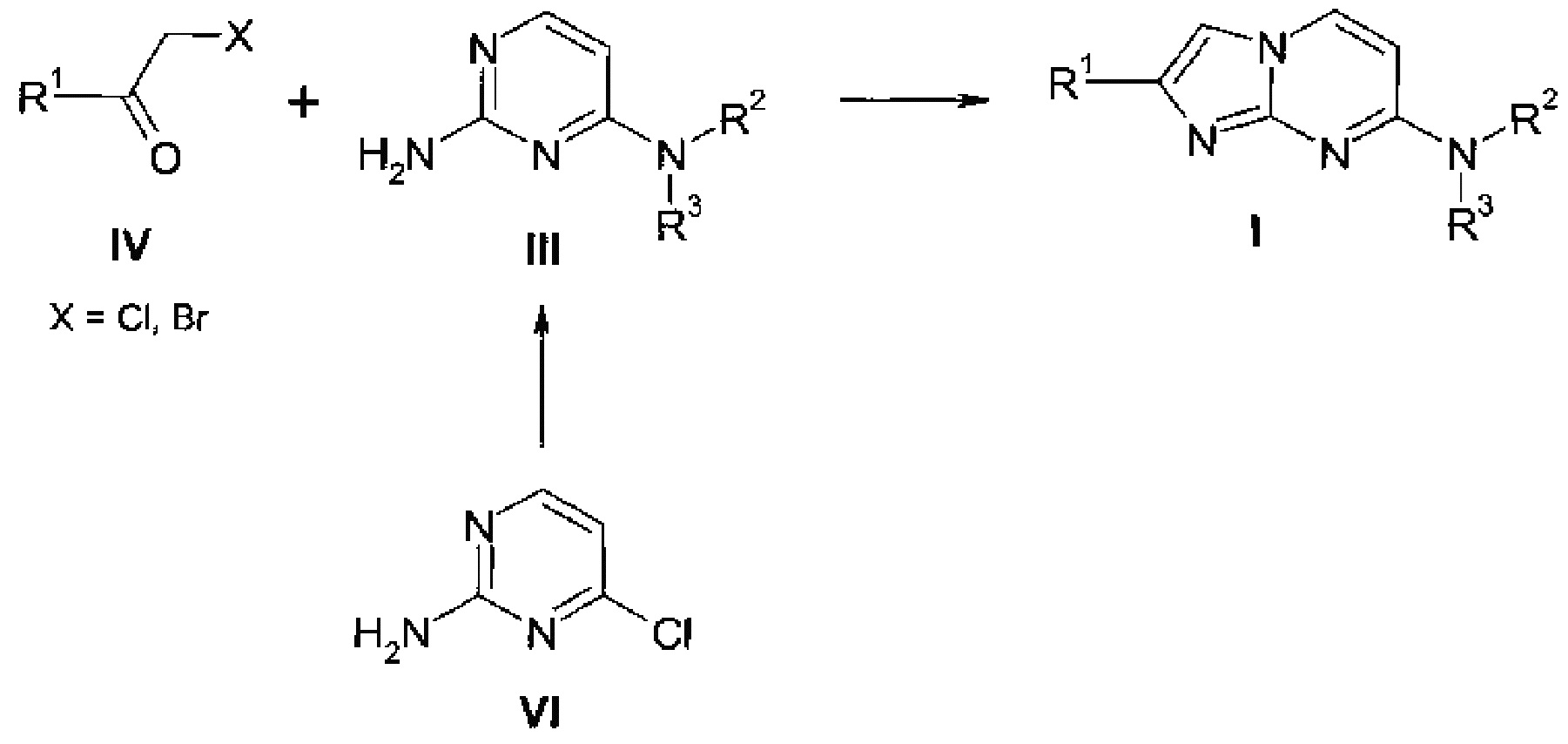
Согласно схеме 2 активированный кетон IV, где R1 является таким, как определено выше, и X представляет собой уходящую группу, например Cl или Br, взаимодействует с аминопиримидином III, заместители R2 и R3 являются такими, как определено выше, в подходящем растворителе, например ацетоне или этаноле, при повышенной температуре с получением соединения формулы I. Аминопиримидины III можно синтезировать, исходя из 2-амино-4-хлорпиримидина VI, путем нагревания с амином HNR2R3 и подходящим основанием, например карбонатом калия или карбонатом цезия, в подходящем растворителе, например сульфолане или N-метил-2-пирролидиноне (НМП) при повышенной температуре или при нагревании с амином HNR2R3 в воде при повышенной температуре.
Схема 3
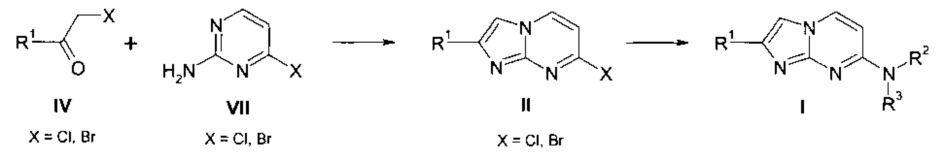
Согласно схеме 3 соединения формулы I, где заместители R1, R2 и R3 являются такими, как определено выше, можно получить путем конденсации активированного кетона IV, где R1 является таким, как определено выше, и X является уходящей группой, например Cl или Br, с аминопиримидином VII, где X является уходящей группой, например Cl или Br, в подходящем растворителе, например ацетоне или этаноле, при повышенной температуре с получением соединения формулы II. Конденсация, опосредованная переходным металлом, соединения формулы II с амином HNR1R2 в присутствии подходящего источника металла, например Pd2(dba)3, подходящего лиганда или добавок, например Xantphos, в подходящем растворителе, например диоксане, и в присутствии подходящего основания, например карбоната цезия, при повышенной температуре приводит к получению соединения формулы I.
Схема 4
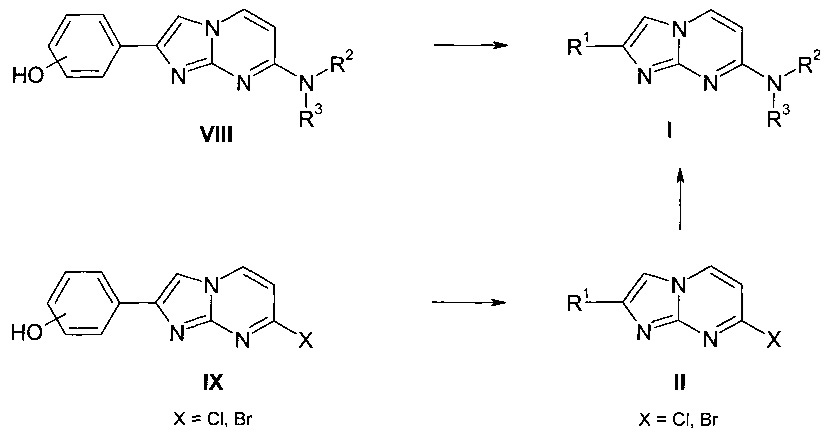
Согласно схеме 4 соединения формулы I, где заместители R1, R2 и R3 являются такими, как определено выше, также могут быть получены путем алкилирования фенолов VIII, с использованием подходящего алкилирующего агента, например алкилгалогенидов, таких как 1-фторэтилбромид, или алкилтозилатов, таких как фторметилтозилат, в присутствии подходящего основания, например карбоната цезия или гидрида натрия, в подходящем растворителе, например ДМФ, при комнатной или повышенной температуре. Аналогично, фенолы IX можно алкилировать с получением соединений формулы II, которые затем дополнительно превращают в соединения формулы I.
Соединения, в которых заместителем на R1 является 3H, OC(3H)3, O11CH3 или OCH2CH218F, или R3 представляет собой C(3H)3 или 11CH3, могут быть получены обычным способом, исходя из соединений формулы I или соединений формулы V, как описано в конкретных примерах 100-106.
Выделение и очистка соединений
Выделение и очистку соединений и промежуточных продуктов, описанных здесь, можно осуществить, при необходимости, с помощью любого подходящего способа разделения или очистки, такого как, например, фильтрование, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, толстослойная хроматография, препаративная жидкостная хроматография низкого или высокого давления, или с помощью комбинации этих способов. Конкретные иллюстрации пригодных способов разделения и выделения можно найти со ссылкой на препаративные примеры и примеры, представленные в данном описании ниже. Однако можно использовать другие эквивалентные способы разделения или выделения. Рацемические смеси хиральных соединений формулы I могут быть разделены с помощью хиральной ВЭЖХ.
Соли соединений формулы I
Соединения формулы I являются основными и могут быть превращены в соответствующую соль присоединения кислоты. Превращение осуществляют путем обработки по меньшей мере стехиометрическим количеством соответствующей кислоты, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, и органической кислоты, такой как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и тому подобное. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в аналогичном растворителе. Температуру поддерживают между 0°C и 50°C. Желаемая соль выпадает в осадок самопроизвольно, или может быть выделена из раствора с использованием менее полярного растворителя.
Соли присоединения кислоты основных соединений формулы I могут быть превращены в соответствующие свободные основания обработкой по меньшей мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и тому подобное.
Соединения были исследованы в соответствии с испытанием, приведенным ниже.
Анализ на замещение тау-специфичного радиолиганда in-vitro
Этот анализ связывания in vitro оценивает сродство соединений к естественным тау-агрегатам. Соединения инкубировали вместе с хорошо известным тау-специфичным радиолигандом [3H]T808, и определяли способность соединений к замещению связывания [3H]T808 с помощью авторадиографии in vitro с использованием срезов головного мозга человека с болезнью Альцгеймера (AD) (см. иллюстрацию ниже).
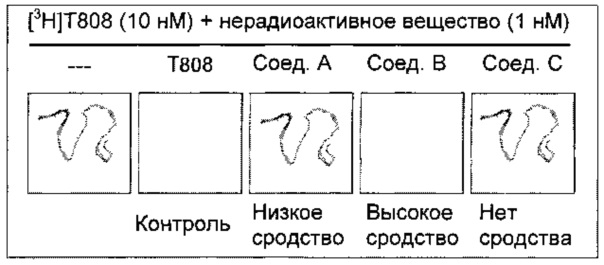
Материалы
Образцы мозга человека с AD приобретали в Научно-исследовательском институте Баннер-Сан (Sun Sun City, AZ, США). Патологическую диагностику AD проводили в соответствии со стандартными критериями NIA-Reagan на основе нейропатологических данных. Радиолиганд [3H]T808 ([3H]-2-[4-(2-Фтор-этил)-пиперидин-1-ил]-бензо[4,5]имидазо[1,2-a]пиримидин с радиохимической чистотой 99,0%) был синтезирован в институте. В качестве контроля использовали нерадиоактивный T808 (2-[4-(2-Фтор-этил)-пиперидин-1-ил]-бензо[4,5]имидазо[1,2-a]пиримидин). Для авторадиографии визуализирующие пластины FujiFilm (BAS-IP TR 2025) подвергают воздействию срезов и считывают считывающим устройством FujiFilm IP (BAS-5000).
Метод
Срезы мозга человека с AD толщиной 10 мкм получают с помощью криостата (Leica СМ3050) при температуре камеры -17°C и температуре объекта -15°C. Срезы переносят на пластины микроскопа Histobond+ (Marienfeld Laboratory Glasware). После сушки в течение 3 часов при комнатной температуре срезы хранят при -20°C. Срезы инкубируют с радиолигандом (10 нМ) и соответствующим нерадиоактивным соединением (в различных концентрациях) в 50 мМ Трис-буфера, pH 7,4 при комнатной температуре в течение 30 мин. После промывки 3×10 мин при 4°C в 50 мМ Трис-буфере с pH 7,4 и трех быстрых погружений в дист. H2O при 4°C срезы сушат при 4°C в течение 3 ч. Срезы помещают в кассету FujiFilm (BAS 2025), подвергают воздействию с визуализирующей пластиной в течение пяти дней и после этого сканируют с разрешением 25 мкМ на пиксель.
Анализ данных
Интенсивность сигнала (Dens - PSL/мм2) в интересующей области (ROI) на авторадиограмме количественно определяли с использованием программного обеспечения MCID (версия 7,0, Imaging Research Inc.) Специфическое связывание (SB) лиганда [3H]Т808 в отсутствие или в присутствии соединения рассчитывали путем вычитания сигнала неспецифического связывания в белом веществе, получая таким образом SB[3H]T808 только и SBсоединение. Значение % замещения различными соединениями рассчитывали следующим образом:
% замещения = 100-(SBсоединения/SB[3H]Т808 только)*100.
Проверка достоверности данных
В каждом эксперименте используют нерадиоактивный Т808 в качестве положительного внутреннего контроля. Ожидают, что совместная инкубация эквимолярных количеств радиоактивного и нерадиоактивного Т808 снижает специфическое связывание примерно на 50%.
Ссылки
А.К. Szardenings et al. 'Imaging agents for detecting neurological disorders'. US Patent Application US20110182812
W. Zhang et al., 'A highly selective и specific PET tracer for imaging of tau pathologies'. Journal of Alzheimer's Disease 31 (2012) 601-612.
Фармацевтические композиции
Соединения формулы I, а также их фармацевтически приемлемые соли можно вводить в форме фармацевтических композиций, обычно парентерально, например в форме растворов для инъекций.
Подходящими эксципиентами растворов для инъекций являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.п.
Примеры
Используемые сокращения:
|
Пример 1
N-Метил-2-фенилимидазо[1,2-a]пиримидин-7-амин
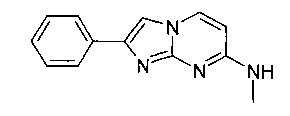
Стадия 1: N4-Метилпиримидин-2,4-диамин
К желтому раствору 4-хлорпиримидин-2-амина (2,00 г, 15,4 ммоль) в N-метил-2-пирролидиноне (12 мл) добавляли в атмосфере азота гидрохлорид метанамина (1,04 г, 15,4 ммоль) и карбонат калия (4,27 г, 30,9 ммоль). Реакционную смесь перемешивали при 120°C в течение 2 ч. Реакционную смесь концентрировали в вакууме, и сырое желтое масло очищали флэш-хроматографией (с использованием аминосиликагеля и градиента дихлорметан/метанол/аммиак). Полученное желтое масло растирали с трет-бутилметиловым эфиром (40 мл) в течение 15 мин с получением указанного в заголовке соединения после сушки в высоком вакууме в течение 4 ч в виде светло-желтого твердого вещества (0,76 г, 40%).
MS: m/z 125,2 (M+H)+
Стадия 2: N-Метил-2-фенилимидазо[1,2-а]пиримидин-7-амин
Желтую суспензию N4-метилпиримидин-2,4-диамина (50 мг, 403 мкмоль) и 2-бром-1-фенилэтанона (120 мг, 604 мкмоль) в ацетоне (2,75 мл) перемешивали при 65°C в течение ночи. Не совсем белую суспензию фильтровали и промывали водой (~1 мл) и ацетоном (~1 мл). Твердый осадок суспендировали в воде (1 мл) и гидрохлориде аммония (25%, 0,9 мл). Суспензию перемешивали в течение 10 мин при комнатной температуре, фильтровали и промывали еще раз водой с получением после сушки в высоком вакууме в течение 4 ч указанное в заголовке соединение в виде светло-красного твердого вещества (41 мг, 45%).
MS: m/z 225,5 (M+H)+
Пример 2
7-(4-Фторпиперидин-1-ил)-2-фенилимидазо[1,2-a]пиримидин
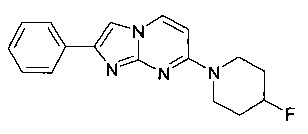
Стадия 1: 4-(4-Фторпиперидин-1-ил)пиримидин-2-амин
Смесь гидрохлорида 4-фторпиперидина (4,9 г, 35,1 ммоль), 4-хлорпиримидин-2-амина (5,00 г, 38,6 ммоль) и карбоната калия (14,6 г, 105 ммоль) в N-метил-2-пирролидиноне (15,0 мл) перемешивали в атмосфере аргона в течение 2 ч при 120°C. Реакционную смесь охлаждали до комнатной температуры, выливали в NaOH (1 М) и лед, и дважды экстрагировали этилацетатом. Органические слои промывали солевым раствором, объединяли, сушили над Na2SO4, фильтровали, и выпаривали летучие вещества с получением 8,33 г светло-желтого воскообразного твердого вещества. Твердое вещество растирали с трет-бутилметиловым эфиром (~10 мл) и перемешивали в течение 30 мин. Затем суспензию фильтровали и сушили в высоком вакууме с получением 6,38 г (83%, содержит остаточный N-метил-2-пирролидинон) светло-желтого твердого вещества. MS: m/z=197,5 (M+H)+
Стадия 2: 7-(4-Фторпиперидин-1-ил)-2-фенил-2,3-дигидроимидазо[1,2-a]пиримидин-2-ол
Бесцветный раствор 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (89 мг, 454 мкмоль) и 2-бром-1-фенилэтанона (135 мг, 680 мкмоль) в ацетоне нагревали в атмосфере аргона до 65°C и перемешивали в течение 6 ч. Светло-желтую суспензию фильтровали через бумагу из стекловолокна и промывали ацетоном (1 мл). Добавляли гидрохлорид аммония (25%, 2,5 мл) и воду (3,1 мл), и белую суспензию фильтровали через бумагу из стекловолокна и промывали H2O. Продукт получали после сушки в высоком вакууме в течение 3 ч в виде белого твердого вещества (78 мг, 58%).
MS: m/z = 315,6 (M+H)+
Стадия 3: 7-(4-Фторпиперидин-1-ил)-2-фенилимидазо[1,2-a]пиримидин
К не совсем белой суспензии 7-(4-фторпиперидин-1-ил)-2-фенил-2,3-дигидроимидазо[1,2-a]пиримидин-2-ола (78 мг, 248 мкмоль) в толуоле (2,6 мл) добавляли п-толуолсульфоновую кислоту (4,27 мг, 3,99 мкл, 24,8 мкмоль), и полученную смесь перемешивали в атмосфере аргона и нагревали до 125°C в течение 1 ч. Светло-желтую суспензию разбавляли небольшим количеством воды и добавляли гидрохлорид аммония (25%). Полученную суспензию фильтровали через бумагу из стекловолокна, и получали продукт после сушки в высоком вакууме в течение 3 ч в виде не совсем белого твердого вещества (56 мг, 76%).
MS: m/z = 297,5 (M+H)+
Пример 3
7-(4-Фторпиперидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
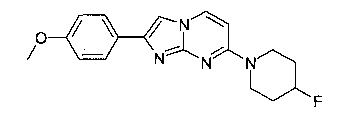
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (85 мг, 433 мкмоль, пример 2, стадия 1) и 2-бром-1-(4-метоксифенил)этанона (149 мг, 650 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде не совсем белого твердого вещества (80 мг, 57%).
MS: m/z = 327,5 (M+H)+
Пример 4
2-(4-Хлорфенил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
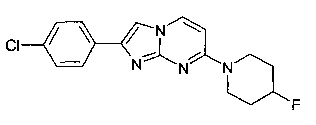
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (85 мг, 433 мкмоль, пример 2, стадия 1) и 2-бром-1-(4-хлорфенил)этанона (152 мг, 650 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-красного твердого вещества (80 мг, 56%).
MS: m/z = 331,5 (M+H)+
Пример 5
7-(4-Фторпиперидин-1-ил)-2-(3-метоксифенил)имидазо[1,2-a]пиримидин
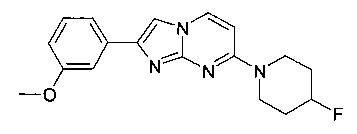
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (85 мг, 433 мкмоль, пример 2, стадия 1) и 2-бром-1-(3-метоксифенил)этанона (149 мг, 650 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, и после окончательной очистки с помощью флэш-хроматографии (с использованием аминосиликагеля и градиента гептан/этилацетат) в виде оранжевой пены (76 мг, 51%). MS: m/z = 327,5 (M+H)+
Пример 6
2-(4-Фторфенил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
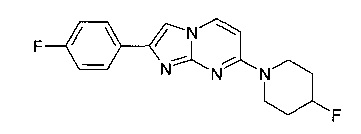
Раствор 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (90 мг, 459 мкмоль, пример 2, стадия 1) и 2-бром-1-(4-фторфенил) этанона (149 мг, 688 мкмоль) в ацетоне (2,5 мл) запаивали в микроволновой трубке и нагревали при 70°C в течение 20 ч. Реакционную смесь фильтровали и промывали ацетоном (~2 мл). К оставшемуся не совсем белому твердому веществу добавляли гидроксид аммония (25%, 2 мл) и воду (3 мл), и бело-серую суспензию фильтровали и промывали водой (~2 мл). После сушки в высоком вакууме получали указанное в заголовке соединение в виде светло-желтого твердого вещества (51 мг, 35%). MS: m/z = 315,5 (M+H)+
Пример 7
2-(1,3-Бензодиоксол-5-ил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
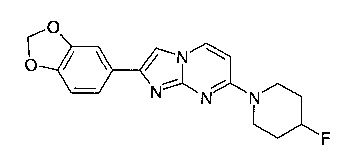
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (92 мг, 472 мкмоль, пример 2, стадия 1) и 1-(бензо[d][1,3]диоксол-5-ил)-2-бромэтанона (172 мг, 709 мкмоль) в соответствии со способом, описанным в примере 6, в виде светло-желтого твердого вещества (129 мг, 79%). MS: m/z = 341,6 (M+H)+
Пример 8
2-(2,3-Дигидро-1,4-бензодиоксин-6-ил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
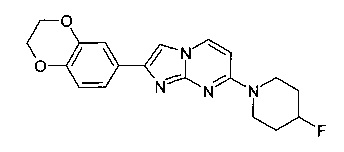
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (93 мг, 477 мкмоль, пример 2, стадия 1) и 2-бром-1-(2,3-дигидробензо[b][1,4]диоксин-6-ил)этанона (184 мг, 716 мкмоль) в соответствии со способом, описанным в примере 6, в виде светло-желтого твердого вещества (132 мг, 76%). MS: m/z = 355,5 (M+H)+
Пример 9
4-[4-[7-(4-Фторпиперидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]фенил]морфолин
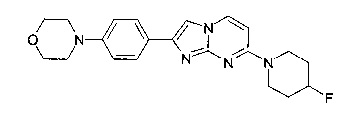
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (91 мг, 463 мкмоль, пример 2, стадия 1) и 2-бром-1-(4-морфолинофенил)этанона (197 мг, 695 мкмоль) в соответствии со способом, описанным в примере 6, в виде светло-желтого твердого вещества (58 мг, 32%). MS: m/z = 382,5 (M+H)+
Пример 10
7-(4-Фторпиперидин-1-ил)-2-(3-метилфенил)имидазо[1,2-a]пиримидин

Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (90 мг, 459 мкмоль, пример 2, стадия 1) и 2-бром-1-м-толилэтанона (147 мг, 688 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-желтого твердого вещества (100 мг, 70%). MS: m/z = 311,5 (M+H)+
Пример 11
7-(4-Фторпиперидин-1-ил)-2-(4-метилфенил)имидазо[1,2-a]пиримидин
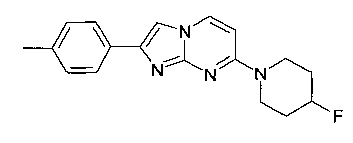
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (90 мг, 459 мкмоль, пример 2, стадия 1) и 2-бром-1-п-толилэтанона (147 мг, 688 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-желтого твердого вещества (107 мг, 75%). MS: m/z = 311,5 (M+H)+
Пример 12
2-(2-Фторфенил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
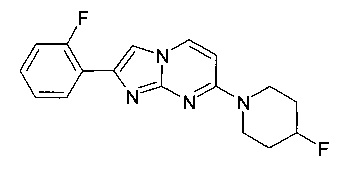
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (102 мг, 514 мкмоль, пример 2, стадия 1) и 2-бром-1-(2-фторфенил)этанона (167 мг, 771 мкмоль) в соответствии со способом, описанным в примере 6, в виде светло-желтого твердого вещества (36 мг, 22%). MS: m/z = 315,5 (M+H)+
Пример 13
3-[7-(4-Фторпиперидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]фенол
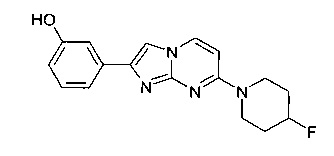
В соответствии со способом, описанным в примере 6, из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (96 мг, 491 мкмоль, пример 2, стадия 1) и 2-бром-1-(3-гидроксифенил)этанона (158 мг, 736 мкмоль) получали не совсем белое твердое вещество. К этому не совсем белому твердому веществу (188 мг) добавляли толуол (2,5 мл) и п-толуолсульфоновую кислоту (12,7 мг, 11,8 мкл, 73,6 мкмоль). Сосуд запаивали и нагревали при 100°C в течение 2 ч. Реакционную смесь фильтровали и промывали ацетоном и смесью воды с гидроксидом аммония (9:1) с получением продукта в виде не совсем белого твердого вещества (67 мг, 43%). MS: m/z = 313,5 (M+H)+
Пример 14
7-(4-Фторпиперидин-1-ил)-2-(4-пирролидин-1-илфенил)имидазо[1,2-a]пиримидин
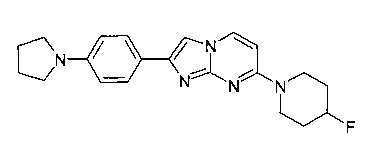
В соответствии со способом, описанным в примере 6, и из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (90 мг, 459 мкмоль, пример 2, стадия 1), 2-бром-1-(4-(пирролидин-1-ил)фенил)этанона (184 мг, 688 мкмоль) и п-толуолсульфоновой кислоты (7,9 мг, 7,38 мкл, 45,9 мкмоль) получали светло-желтое твердое вещество. К этому светло-желтому твердому веществу (176 мг) добавляли толуол (2,5 мл) и п-толуолсульфоновую кислоту (7,9 мг, 7,38 мкл, 45,9 мкмоль). Сосуд запаивали и нагревали при 100°C в течение 2 ч. Реакционную смесь фильтровали и промывали ацетоном и смесью воды с гидроксидом аммония (9:1) с получением сырого продукта. Продукт получали после очистки флэш-хроматографией (с использованием силикагеля и градиента дихлорметан/метанол) в виде светло-желтого твердого вещества (64 мг, 36%). MS: m/z = 366,5 (M+H)+
Пример 15
7-(4-Фторпиперидин-1-ил)-2-[3-(трифторметокси)фенил]имидазо[1,2-a]пиримидин
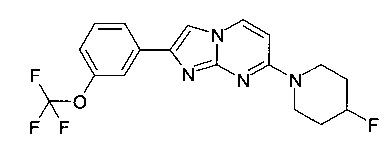
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (97 мг, 495 мкмоль, пример 2, стадия 1) и 2-бром-1-(3-(трифторметокси)фенил)этанона (140 мг, 495 мкмоль) в соответствии со способом, описанным в примере 6, и после окончательной очистки с помощью флэш-хроматографии (с использованием силикагеля и градиента дихлорметан/метанол) в виде светло-коричневого твердого вещества (81 мг, 42%). MS: m/z = 381,6 (M+H)+
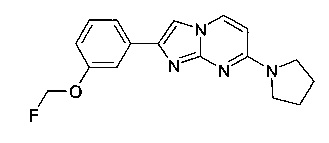
Пример 16
2-[3-(Фторметокси)фенил]-7-пирролидин-1-илимидазо[1,2-a]пиримидин
Стадия 1: 4-(Пирролидин-1-ил)пиримидин-2-амин
Светло-желтую суспензию 4-хлорпиримидин-2-амина (5,01 г, 38,7 ммоль), пирролидина (2,50 г, 2,91 мл, 35,2 ммоль) и карбоната калия (9,72 г, 70,3 ммоль) в N-метил-2-пирролидиноне (15,0 мл) перемешивали в атмосфере аргона при 120°C в течение 2 ч и при комнатной температуре в течение ночи. Реакционную смесь охлаждали до комнатной температуры и выливали в NaOH (1 М, 200 мл) и лед. Водный слой экстрагировали этилацетатом (200 мл), причем часть продукта осаждалась в водной фазе. Осадок фильтровали, промывали водой, растирали с дихлорметаном и сушили с получением 3,1 г продукта в виде белого твердого вещества. Отделенную этилацетатную фазу сушили над MgSO4, фильтровали и концентрировали в вакууме. Полученное светло-желтое твердое вещество растирали с дихлорметаном и сушили с получением 1,1 г продукта в виде белого твердого вещества. Водную фазу экстрагировали дихлорметаномом (3×100 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме. Полученное светло-желтое твердое вещество растирали с дихлорметаном с получением еще одной порции 0,52 г продукта в виде белого твердого вещества. Дихлорметановые слои объединяли, концентрировали в вакууме и продукт очищали с помощью флэш-хроматографии (с использованием силикагеля и градиента дихлорметан/метанол/аммиак) с получением еще одной порции 0,46 г продукта в виде светло-желтого твердого вещества. Всего было получено 5,18 г (89,7%) светло-желтого твердого вещества.
MS: m/z = 165,3 (M+H)+
Стадия 2: 3-(7-(Пирролидин-1-ил)имидазо[1,2-а]пиримидин-2-ил)фенол
Продукт получали из исходных веществ 4-(пирролидин-1-ил)пиримидин-2-амина (300 мг, 1,83 ммоль) и 2-бром-1-(3-гидроксифенил)этанона (589 мг, 2,74 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-желтого твердого вещества (460 мг, 90%). MS: m/z = 281,1 (M+H)+
Стадия 3: 2-[3-(Фторметокси)фенил]-7-пирролидин-1-илимидазо[1,2-а]пиримидин
К светло-желтому раствору 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола (100 мг, 357 мкмоль) и фторметил-4-метилбензолсульфоната (72,9 мг, 357 мкмоль) в ДМФ (1,00 мл) добавляли карбонат цезия в атмосфере аргона (151 мг, 464 мкмоль). Реакционную смесь нагревали до 70°C и перемешивали в течение 16 ч. Желтую суспензию разбавляли водой (5 мл) и экстрагировали этилацетатом (3×5 мл). Органические слои объединяли, промывали солевым раствором, сушили над MgSO4, фильтровали и выпаривали. Продукт получали после очистки флэш-хроматографией (с использованием силикагеля и градиента дихлорметан/метанол/аммиак) в виде светло-желтого твердого вещества (52 мг, 46%). MS: m/z = 313,5 (M+H)+
Пример 17
2-[3-(2-Фторэтокси)фенил]-7-пирролидин-1-илимидазо[1,2-a]пиримидин
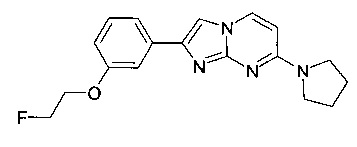
Продукт получали из исходных веществ 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола (100 мг, 357 мкмоль, пример 16, стадия 2) и 1-бром-2-фторэтана (45,3 мг, 357 мкмоль) в соответствии со способом, описанным в примере 16, стадия 3, в виде светло-желтого твердого вещества (57 мг, 49%). MS: m/z = 327,6 (M+H)+
Пример 18
N,N-Диметил-2-фенилимидазо[1,2-a]пиримидин-7-амин
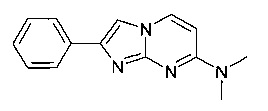
Стадия 1: N4,N4-Диметилпиримидин-2,4-диамин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (3,24 г, 25,0 ммоль), гидрохлорида диметиламина (2,24 г, 27,5 ммоль) и карбоната калия (10,4 г, 75,0 ммоль) в соответствии со способом, описанным в примере 2, стадия 1, в виде белого твердого вещества (1,48 г, 43%).
Стадия 2: N,N-Диметил-2-фенилимидазо[1,2-а]пиримидин-7-амин
Продукт получали из исходных веществ N4,N4-диметилпиримидин-2,4-диамина (100 мг, 724 мкмоль) и 2-бром-1-фенилэтанона (216 мг, 1,09 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-коричневого твердого вещества (97 мг, 56%). MS: m/z = 239,1 (M+H)+
Пример 19
7-[4-(2-Фторэтил)пиперазин-1-ил]-2-(4-метоксифенил)имидазо[1,2-a]пиримидина гидрохлорид
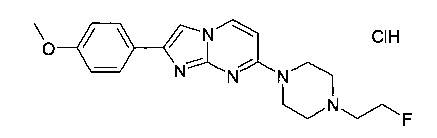
Стадия 1: 4-(4-(2-Фторэтил)пиперазин-1-ил)пиримидин-2-амин
Продукт получали из исходных веществ 1-(2-фторэтил)пиперазина гидрохлорида (705 мг, 3,55 ммоль), 4-хлорпиримидин-2-амина (506 мг, 3,91 ммоль) и карбоната калия (1,47 г, 10,7 ммоль) в N-метил-2-пирролидиноне (1,5 мл) в соответствии со способом, описанным в примере 2, стадия 1, после нагревания в течение ночи в виде светло-коричневого твердого вещества (642 мг, 79%). MS: m/z = 226,6 (M+H)+
Стадия 2: 7-[4-(2-Фторэтил)пиперазин-1-ил]-2-(4-метоксифенил)имидазо[1,2-a]пиримидина гидрохлорид
Сырой продукт получали из исходных веществ 4-(4-(2-фторэтил)пиперазин-1-ил)пиримидин-2-амина (156 мг, 693 мкмоль) и 2-бром-1-(4-метоксифенил)этанона (238 мг, 1,04 ммоль) в соответствии со способом, описанным в Примере 6. Полученное светло-желтое твердое вещество растирали с гептаном. Полученную суспензию фильтровали, промывали и сушили в вакууме с получением 243 мг светло-желтого твердого вещества. В этот материал добавляли ТГФ (1,00 мл) и HCl (4 М раствор в диоксане, 1,73 мл, 6,93 ммоль). Перемешивание продолжали при комнатной температуре в течение 2 ч, и суспензию фильтровали, промывали ТГФ и сушили в высоком вакууме. К полученному светло-желтому твердому веществу добавляли смесь гептан/этилацетат (2:1), и перемешивание продолжали при комнатной температуре в течение 15 мин. Суспензию фильтровали и промывали трет-бутилметиловым эфиром с получением продукта в виде светло-желтого твердого вещества (141 мг, 42%). MS: m/z = 356,2 (M-HCl+H)+
Пример 20
7-[4-(2-Фторэтил)пиперазин-1-ил]-2-(3-метоксифенил)имидазо[1,2-a]пиримидина гидрохлорид
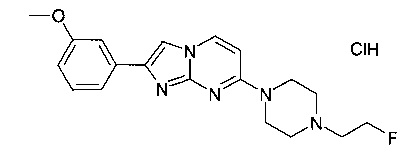
Продукт получали из исходных веществ 4-(4-(2-фторэтил)пиперазин-1-ил)пиримидин-2-амина (151 мг, 670 мкмоль, пример 19, стадия 1) и 2-бром-1-(3-метоксифенил)этанона (230 мг, 1,01 ммоль) в соответствии со способом, описанным в примере 19, стадия 2, в виде светло-желтого твердого вещества (114 мг, 35%). MS: m/z = 356,2 (M-HCl+H)+
Пример 21
N-(2-Фторэтил)-N-метил-2-фенилимидазо[1,2-a]пиримидин-7-амин
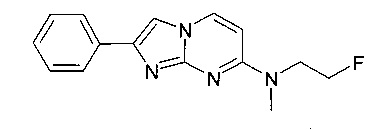
Стадия 1: N4-(2-Фторэтил)-N4-метилпиримидин-2,4-диамин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (500 мг, 3,86 ммоль), гидрохлорида 2-фтор-N-метилэтанамина (482 мг, 4,25 ммоль) и карбоната калия (1,6 г, 11,6 ммоль) в N-метил-2-пирролидиноне (2,5 мл) в соответствии со способом, описанным в примере 2, стадия 1, и после окончательной очистки с помощью флэш-хроматографии (с использованием силикагеля и градиента дихлорметан/метанол) в виде желтого твердого вещества (263 мг, 40%). MS: m/z = 171,3 (M+H)+
Стадия 2: N-(2-Фторэтил)-N-метил-2-фенилимидазо[1,2-а]пиримидин-7-амин
Продукт получали из исходных веществ N-4-(2-фторэтил)-N4-метилпиримидин-2,4-диамина (60 мг, 353 мкмоль) и 2-бром-1-фенилэтанона (105 мг, 529 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-желтого твердого вещества (41 мг, 41%). MS: m/z = 271,5 (M+H)+
Пример 22
N-(2-Фторэтил)-2-(3-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
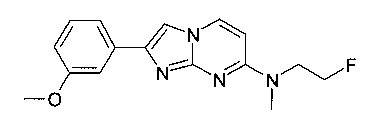
Продукт получали из исходных веществ N-4-(2-фторэтил)-N4-метилпиримидин-2,4-диамина (60 мг, 353 мкмоль, пример 21, стадия 1) и 2-бром-1-(3-метоксифенил)этанона (121 мг, 529 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (28 мг, 24%). MS: m/z = 301,5 (M+H)+
Пример 23
N-(2-Фторэтил)-2-(4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
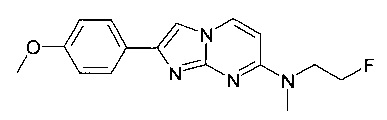
Продукт получали из исходных веществ N-4-(2-фторэтил)-N4-метилпиримидин-2,4-диамина (85 мг, 499 мкмоль, пример 21, стадия 1) и 2-бром-1-(4-метоксифенил)этанона (172 мг, 749 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (44 мг, 29%). MS: m/z = 301,5 (M+H)+
Пример 24
7-[4-(2-Фторэтил)пиперазин-1-ил]-2-фенилимидазо[1,2-a]пиримидина гидрохлорид
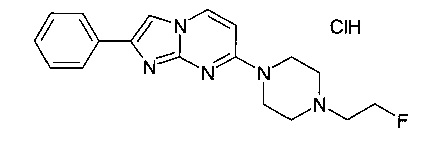
Продукт получали из исходных веществ 4-(4-(2-фторэтил)пиперазин-1-ил)пиримидин-2-амина (155 мг, 688 мкмоль, пример 19, стадия 1) и 2-бром-1-фенилэтанона (205 мг, 1,03 ммоль) в соответствии со способом, описанным в примере 19, стадия 2, в виде не совсем белого твердого вещества (57 мг, 18%). MS: m/z = 326,2 (M-HCl+H)+
Пример 25
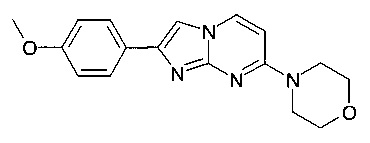
4-[2-(4-Метоксифенил)имидазо[1,2-a]пиримидин-7-ил]морфолин
Стадия 1: 4-Морфолин-4-илпиримидин-2-иламин
Продукт получали из исходных веществ 4-хлорпиримидин-2-иламина (3 г, 23,25 ммоль) и морфолина (2,25 мл, 25,6 ммоль) в соответствии со способом, описанным в примере 49, стадия 1, в виде белого твердого вещества (2,7 г, 64%). MS: m/z = 181,0 (M+H)+
Стадия 2: 4-[2-(4-Метоксифенил)имидазо[1,2-а]пиримидин-7-ил]морфолин
Продукт получали из исходных веществ 4-морфолин-4-илпиримидин-2-иламина (350 мг, 1,94 ммоль) и 2-бром-1-(4-метоксифенил)-этанона (667 мг, 2,91 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде серого твердого вещества (240 мг, 40%). MS: m/z = 311,2 (M+H)+
Пример 26
4-[2-(3-Метилфенил)имидазо[1,2-a]пиримидин-7-ил]морфолин
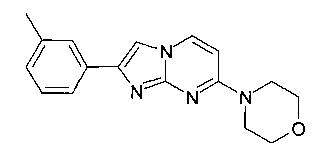
Продукт получали из исходных веществ 4-морфолин-4-илпиримидин-2-иламина (400 мг, 2,22 ммоль, пример 25, стадия 1) и 2-бром-1-м-толилэтанона (709 мг, 3,33 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде не совсем белого твердого вещества (65 мг, 10%). MS: m/z = 295,0 (M+H)+
Пример 27
4-[2-(3,4-Диметоксифенил)имидазо[1,2-a]пиримидин-7-ил]морфолин
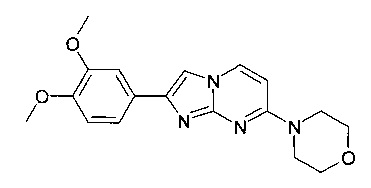
Продукт получали из исходных веществ 4-морфолин-4-илпиримидин-2-иламина (400 мг, 2,22 ммоль, пример 25, стадия 1) и 2-бром-1-(3,4-диметоксифенил)-этанона (862 мг, 3,32 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде не совсем белого твердого вещества (230 мг, 30%). MS: m/z = 341,0 (M+H)+
Пример 28
4-(7-Пирролидин-1-илимидазо[1,2-a]пиримидин-2-ил)фенол
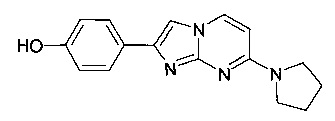
Продукт получали из исходных веществ 4-(пирролидин-1-ил)пиримидин-2-амина (500 мг, 3,04 ммоль, пример 16, стадия 1) и 2-бром-1-(4-гидроксифенил)этанона (982 мг, 4,57 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (786 мг, 90%). MS: m/z = 281,5 (M+H)+
Пример 29
2-[4-(2-Фторэтокси)фенил]-7-пирролидин-1-илимидазо[1,2-a]пиримидин
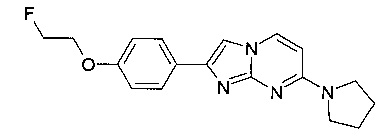
К светло-желтому раствору 4-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола (100 мг, 357 мкмоль, пример 28) и 1-бром-2-фторэтана (45,3 мг, 357 мкмоль) в ДМФ (1,00 мл) добавляли в атмосфере аргона карбонат цезия (151 мг, 464 мкмоль). Реакционную смесь перемешивали при 70°C в течение 22 ч. Коричневую суспензию разбавляли водой (5 мл) и экстрагировали дихлорметаномом (2×5 мл). Органические слои объединяли, промывали солевым раствором (5 мл), сушили над MgSO4, фильтровали и выпаривали. Продукт получали после очистки флэш-хроматографией (с использованием силикагеля и градиента дихлорметан/метанол/аммиак) в виде желтого твердого вещества (86 мг, 74%). MS: m/z = 327,5 (M+H)+
Пример 30
2-[4-(Фторметокси)фенил]-7-пирролидин-1-илимидазо[1,2-a]пиримидин
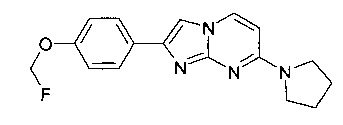
Продукт получали из исходных веществ 4-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола (100 мг, 357 мкмоль, пример 28) и фторметил-4-метилбензолсульфоната (72,9 мг, 357 мкмоль) в соответствии со способом, описанным в примере 29 в виде желтого твердого вещества (52 мг, 47%).
MS: m/z = 313,5 (M+H)+
Пример 31
7-[(3R)-3-Метоксипирролидин-1-ил]-2-фенилимидазо[1,2-a]пиримидин
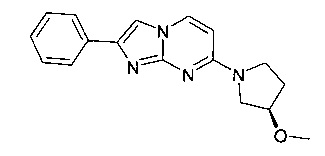
Стадия 1: (R)-4-(3-Метоксипирролидин-1-ил)пиримидин-2-амин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (255 мг, 1,97 ммоль), (R)-3-метоксипирролидина гидрохлорида (298 мг, 2,17 ммоль) и карбоната калия (816 мг, 5,91 ммоль) в соответствии со способом, описанным в примере 2, стадия 1, и после окончательной очистки с помощью флэш-хроматографии (с использованием силикагеля и градиента дихлорметан/метанол/аммиак) в виде светло-желтого твердого вещества (321 мг, 84%). MS: m/z = 195,2 (M+H)+
Стадия 2: 7-[(3S)-3-Метоксипирролидин-1-ил]-2-фенилимидазо[1,2-а]пиримидин
Продукт получали из исходных веществ R)-4-(3-метоксипирролидин-1-ил)пиримидин-2-амина (80 мг, 412 мкмоль, экв: 1,00) и 2-бром-1-фенилэтанона (123 мг, 618 мкмоль, экв: 1,5) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (63 мг, 52%). MS: m/z = 295,8 (M+H)+
Пример 32
7-[(3S)-3-Метоксипирролидин-1-ил]-2-фенилимидазо[1,2-a]пиримидин
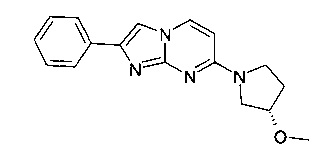
Стадия 1: (S)-4-(3-Метоксипирролидин-1-ил)пиримидин-2-амин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (360 мг, 2,78 ммоль), (S)-3-метоксипирролидина (309 мг, 3,06 ммоль) и карбоната калия (768 мг, 5,56 ммоль) в соответствии со способом, описанным в примере 2, стадия 1, и после окончательной очистки с помощью флэш-хроматографии (с использованием силикагеля и градиента дихлорметан/метанол/аммиак) в виде желтого твердого вещества (288 мг, 52%). MS: m/z = 195,2 (M+H)+
Стадия 2: 7-[(3S)-3-Метоксипирролидин-1-ил]-2-фенилимидазо[1,2-а]пиримидин
Продукт получали из исходных веществ (S)-4-(3-метоксипирролидин-1-ил)пиримидин-2-амина (70 мг, 360 мкмоль) и 2-бром-1-фенилэтанона (108 мг, 541 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (11 мг, 9%). MS: m/z = 295,5 (M+H)+
Пример 33
7-[(3R)-3-Фторпирролидин-1-ил]-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
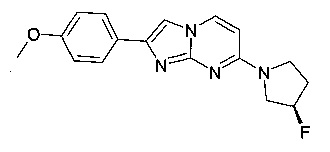
Стадия 1: (R)-4-(3-Фторпирролидин-1-ил)пиримидин-2-амин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (250 мг, 1,93 ммоль), (R)-3-фторпирролидина гидрохлорида (242 мг, 1,93 ммоль) и карбоната калия (533 мг, 3,86 ммоль) в соответствии со способом, описанным в примере 2, стадия 1, и после окончательного растирания с дихлорметаном в виде светло-желтого твердого вещества (192 мг, 54%). MS: m/z = 183,2 (M+H)+
Стадия 2: 7-[(3R)-3-Фторпирролидин-1-ил]-2-(4-метоксифенил)имидазо[1,2-а]пиримидин
Продукт получали из исходных веществ (R)-4-(3-фторпирролидин-1-ил)пиримидин-2-амина (80,0 мг, 439 мкмоль) и 2-бром-1-(4-метоксифенил)этанона (151 мг, 659 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-желтого твердого вещества (89 мг, 65%). MS: m/z = 313,6 (M+H)+
Пример 34
7-[(3S)-3-Фторпирролидин-1-ил]-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
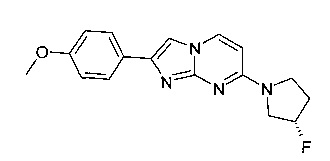
Стадия 1: (S)-4-(3-Фторпирролидин-1-ил)пиримидин-2-амин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (360 мг, 2,78 ммоль), (S)-3-фторпирролидина гидрохлорида (349 мг, 2,78 ммоль) и карбоната калия (768 мг, 5,56 ммоль) в соответствии со способом, описанным в примере 2, стадия 1, и после окончательного растирания с дихлорметаном в виде не совсем белого твердого вещества (319 мг, 63%). MS: m/z = 183,2 (M+H)+
Стадия 2: 7-[(3S)-3-Фторпирролидин-1-ил]-2-(4-метоксифенил)имидазо[1,2-а]пиримидин
Продукт получали из исходных веществ (S)-4-(3-фторпирролидин-1-ил)пиримидин-2-амина (70 мг, 384 мкмоль) и 2-бром-1-(4-метоксифенил)этанона (132 мг, 576 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-желтого твердого вещества (77 мг, 64%). MS: m/z = 313,5 (M+H)+
Пример 35
2-(3-Метоксифенил)-N,N-диметилимидазо[1,2-a]пиримидин-7-амин
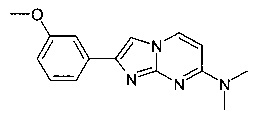
Продукт получали из исходных веществ N4,N4-диметилпиримидин-2,4-диамина (100 мг, 724 мкмоль, пример 18, стадия 1) и 2-бром-1-(3-метоксифенил)этанона (249 мг, 1,09 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде красного твердого вещества (118 мг, 61%). MS: m/z = 269,1 (M+H)+
Пример 36
2-(4-Метоксифенил)-N,N-диметилимидазо[1,2-a]пиримидин-7-амин
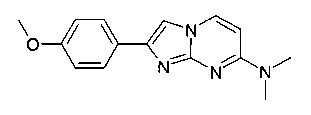
Продукт получали из исходных веществ N4,N4-диметилпиримидин-2,4-диамина (100 мг, 724 мкмоль, пример 18, стадия 1) и 2-бром-1-(4-метоксифенил)этанона (249 мг, 1,09 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (102 мг, 53%). MS: m/z = 269,1 (M+H)+
Пример 37
2-(1,3-Бензодиоксол-5-ил)-N,N-диметилимидазо[1,2-a]пиримидин-7-амин
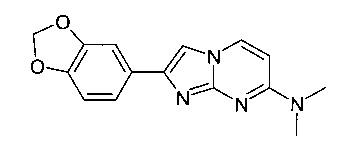
Продукт получали из исходных веществ N4,N4-диметилпиримидин-2,4-диамина (100 мг, 724 мкмоль, пример 18, стадия 1) и 1-(бензо[d][1,3]диоксол-5-ил)-2-бромэтанона (264 мг, 1,09 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде не совсем белого твердого вещества (127 мг, 62%). MS: m/z = 283,1 (M+H)+
Пример 38
2-(2,3-Дигидро-1,4-бензодиоксин-6-ил)-N,N-диметилимидазо[1,2-a]пиримидин-7-амин
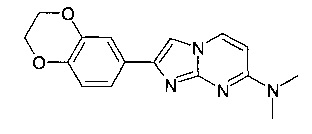
Продукт получали из исходных веществ N4,N4-диметилпиримидин-2,4-диамина (100 мг, 724 мкмоль, пример 18, стадия 1) и 2-бром-1-(2,3-дигидробензо[b][1,4]диоксин-6-ил)этанона (279 мг, 1,09 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (140 мг, 65%). MS: m/z = 297,3 (M+H)+
Пример 39
N,N-Диметил-2-(4-метилфенил)имидазо[1,2-a]пиримидин-7-амин
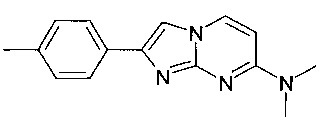
Продукт получали из исходных веществ N4,N4-диметилпиримидин-2,4-диамина (100 мг, 724 мкмоль, пример 18, стадия 1) и 2-бром-1-п-толилэтанона (231 мг, 1,09 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (86 мг, 47%). MS: m/z = 253,1 (M+H)+
Пример 40
N,N-Диметил-2-(3-метилфенил)имидазо[1,2-a]пиримидин-7-амин
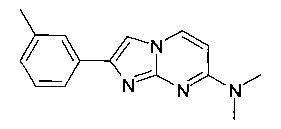
Продукт получали из исходных веществ N4,N4-диметилпиримидин-2,4-диамина (100 мг, 724 мкмоль, пример 18, стадия 1) и 2-бром-1-м-толилэтанона (462 мг, 2,18 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде белого твердого вещества (117 мг, 64%). MS: m/z = 253,1 (M+H)+
Пример 41
4-[2-(3-Метоксифенил)имидазо[1,2-a]пиримидин-7-ил]морфолин
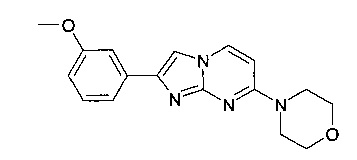
Продукт получали из исходных веществ 4-морфолин-4-илпиримидин-2-иламина (400 мг, 2,22 ммоль, пример 25, стадия 1) и 2-бром-1-(3-метоксифенил)-этанона (763 мг, 3,33 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде не совсем белого твердого вещества (70 мг, 10%). MS: m/z = 311,0 (M+H)+
Пример 42
4-[2-(4-Метилфенил)имидазо[1,2-a]пиримидин-7-ил]морфолин
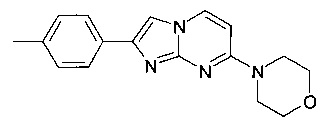
Продукт получали из исходных веществ 4-морфолин-4-илпиримидин-2-иламина (400 мг, 2,22 ммоль, пример 25, стадия 1) и 2-бром-1-п-толилэтанона (709 мг, 3,33 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде белого твердого вещества (230 мг, 35%). MS: m/z = 294,8 (M+H)+
Пример 43
2-(4-Метоксифенил)-7-пирролидин-1-илимидазо[1,2-a]пиримидин
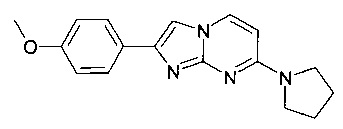
Продукт получали из исходных веществ 4-пирролидин-1-илпиримидин-2-амина (400 мг, 2,22 ммоль, пример 16, стадия 1) и 2-бром-1-(4-метоксифенил)-этанона (762 мг, 3,33 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде светло-коричневого твердого вещества (65 мг, 10%). MS: m/z = 295,0 (M+H)+
Пример 44
2-(4-Метилфенил)-7-пирролидин-1-илимидазо[1,2-a]пиримидин
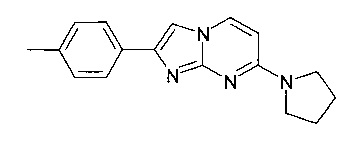
Продукт получали из исходных веществ 4-пирролидин-1-илпиримидина-амина (450 мг, 2,49 ммоль, пример 16, стадия 1) и 2-бром-1-п-толилэтанона (797 мг, 3,74 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде не совсем белого твердого вещества (130 мг, 19%). MS: m/z = 279,0 (M+H)+
Пример 45
N,N-Диметил-2-(4-морфолин-4-илфенил)имидазо[1,2-a]пиримидин-7-амин
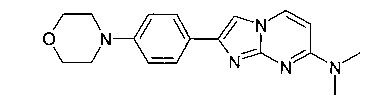
Продукт получали из исходных веществ N4,N4-диметилпиримидин-2,4-диамина (100 мг, 724 мкмоль, пример 18, стадия 1) и 2-бром-1-(4-морфолинофенил)этанона (308 мг, 1,09 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (116 мг, 50%). MS: m/z = 324,2 (M+H)+
Пример 46
2-[4-(Диметиламино)фенил]-N,N-диметилимидазо[1,2-a]пиримидин-7-амин
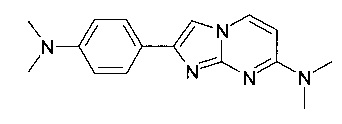
Продукт получали из исходных веществ N4,N4-диметилпиримидин-2,4-диамина (100 мг, 724 мкмоль, пример 18, стадия 1) и 2-бром-1-(4-(диметиламино)фенил)этанона (263 мг, 1,09 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (138 мг, 68%). MS: m/z = 282,8 (M+H)+
Пример 47
2-(3-Метоксифенил)-7-пирролидин-1-илимидазо[1,2-a]пиримидин
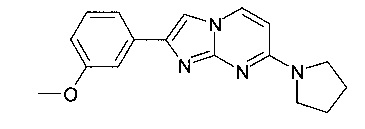
Продукт получали из исходных веществ 4-пирролидин-1-илпиримидин-2-амина (300 мг, 1,66 ммоль, пример 16, стадия 1) и 2-бром-1-(3-метоксифенил)-этанона (572 мг, 2,49 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде не совсем белого твердого вещества (30 мг, 6%). MS: m/z = 295,0 (M+H)+
Пример 48
2-(3-Метилфенил)-7-пирролидин-1-илимидазо[1,2-a]пиримидин
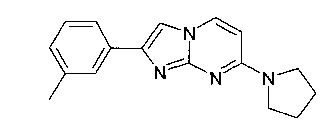
Продукт получали из исходных веществ 4-пирролидин-1-илпиримидин-2-амина (300 мг, 1,66 ммоль, пример 16, стадия 1) и 2-бром-1-м-толилэтанона (532 мг, 2,49 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде не совсем белого твердого вещества (30 мг, 6%). MS: m/z = 278,8 (M+H)+
Пример 49
2-(4-Метоксифенил)-7-пиперидин-1-илимидазо[1,2-a]пиримидин
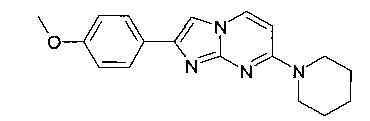
Стадия 1: 4-Пиперидин-1-илпиримидин-2-амин
Смесь 4-хлорпиримидин-2-иламина (4 г, 31 ммоль), пиперидина (2,9 мл, 34,1 ммоль), карбоната калия (6,42 г, 46,5 ммоль) и N-метил-2-пирролидинона (8 мл) нагревали в запаянной пробирке при 120°C в течение 12 ч. После охлаждения до комнатной температуры реакционную смесь выливали в NaOH (1М водный раствор, 120 мл) и экстрагировали дихлорметаномом (3×150 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Продукт получали после очистки флэш-хроматографией (с использованием силикагеля и градиента дихлорметан/метанол) в виде не совсем белого твердого вещества (3 г, 54%).
MS: m/z = 179,0 (M+H)+
Стадия 2: 2-(4-Метоксифенил)-7-пиперидин-1-илимидазо[1,2-а]пиримидин
К раствору 4-пиперидин-1-илпиримидин-2-иламина (400 мг, 2,24 моль) в ацетоне (10 мл) добавляли в атмосфере азота 2-бром-1-(4-метоксифенил)-этанон (763 мг, 3,33 ммоль) и п-толуолсульфоновую кислоту (каталитическое количество) при 25°C. Реакционную смесь перемешивали при 65°C в течение 12 ч. Все летучие вещества удаляли при пониженном давлении. Остаток распределяли между водой и дихлорметаном и водную фазу экстрагировали дихлорметаномом (3×150 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Продукт получали после очистки флэш-хроматографией (с использованием силикагеля и градиента дихлорметан/метанол) в виде не совсем белого твердого вещества (20 мг, 3%). MS: m/z = 308,8 (M+H)+
Пример 50
2-(3-Метоксифенил)-7-пиперидин-1-илимидазо[1,2-a]пиримидин
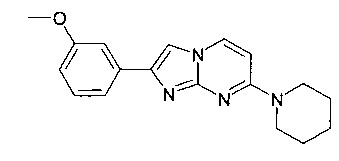
Продукт получали из исходных веществ 4-пиперидин-1-илпиримидин-2-иламина (350 мг, 1,96 ммоль, пример 49, стадия 1) и 2-бром-1-(3-метоксифенил)-этанона (676 мг, 2,94 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде не совсем белого твердого вещества (45 мг, 7%). MS: m/z = 309,3 (M+H)+
Пример 51
2-(4-Метилфенил)-7-пиперидин-1-илимидазо[1,2-a]пиримидин
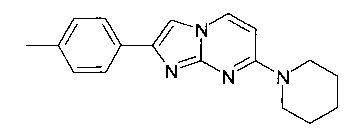
Продукт получали из исходных веществ 4-пиперидин-1-илпиримидин-2-иламина (400 мг, 2,24 ммоль, пример 49, стадия 1) и 2-бром-1-п-толилэтанона (718 мг, 3,37 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде не совсем белого твердого вещества (200 мг, 30%). MS: m/z = 293,0 (M+H)+
Пример 52
2-(3-Метилфенил)-7-пиперидин-1-илимидазо[1,2-a]пиримидин
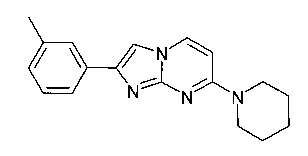
Продукт получали из исходных веществ 4-пиперидин-1-илпиримидин-2-иламина (350 мг, 1,96 ммоль, пример 49, стадия 1) и 2-бром-1-м-толилэтанона (628 мг, 2,95 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде не совсем белого твердого вещества (25 мг, 4%). MS: m/z = 293,3 (M+H)+
Пример 53
2-(3,4-Диметоксифенил)-7-пиперидин-1-илимидазо[1,2-a]пиримидин
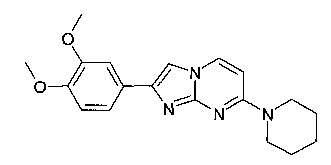
Продукт получали из исходных веществ 4-пиперидин-1-илпиримидин-2-иламина (250 мг, 1,40 ммоль, пример 49, стадия 1) и 2-бром-1-(3,4-диметоксифенил)-этанона (545 мг, 2,10 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, в виде не совсем белого твердого вещества (49 мг, 10%).
Пример 54
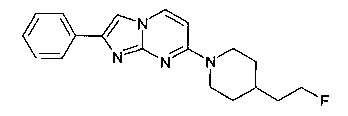
7-[4-(2-Фторэтил)пиперидин-1-ил]-2-фенилимидазо[1,2-a]пиримидин
Стадия 1: Трет-бутил-4-(2-гидроксиэтил)пиперидин-1-карбоксилат
К раствору 2-(пиперидин-4-ил)этанола (2,42 г, 18,7 ммоль) в дихлорметане (24 мл) добавляли в атмосфере азота при 0°C дитрет-бутилдикарбонат (4,09 г, 4,35 мл, 18,7 ммоль). Наблюдалось сильное выделение газа! Раствор перемешивали при 0°C в течение 15 мин и при комнатной температуре в течение 4 ч. Реакционную смесь промывали водой (50 мл), гидросульфатом калия (10% водный раствор, 50 мл) и солевым раствором (50 мл). Водные слои снова экстрагировали дихлорметаном (50 мл). Объединенные органические слои сушили над сульфатом натрия с получением бесцветного масла (4,1 г, 95%). MS: m/z = 230,5 (M+H)+
Стадия 2: Трет-бутил-4-(2-фторэтил)пиперидин-1-карбоксилат
К раствору трет-бутил-4-(2-гидроксиэтил)пиперидин-1-карбоксилата (2,22 г, 9,7 ммоль) в дихлорметане (20 мл) добавляли по каплям при температуре 0-8°C трифторид диэтиламиносеры (1,72 г, 1,41 мл, 10,7 ммоль) в атмосфере азота. Раствор перемешивали при 0°C в течение 1 ч и при комнатной температуре в течение еще 2 ч. Реакционную смесь разбавляли этилацетатом (50 мл) и промывали карбонатом натрия (1 М водный раствор, 50 мл), водой (50 мл) и солевым раствором (50 мл). Водные слои снова экстрагировали этилацетатом (50 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и выпаривали. Продукт получали после очистки флэш-хроматографией (с использованием силикагеля и градиента гептан/этилацетат) в виде бесцветной жидкости (1,26 г, 56%). MS: m/z = 231 (M)+
Стадия 3: 4-(2-Фтор-этил)-пиперидина гидрохлорид
Суспензию трет-бутил-4-(2-фторэтил)пиперидин-1-карбоксилата (1,21 г, 5,23 ммоль) в соляной кислоте (4Mb диоксане, 5,23 мл, 20,9 ммоль) перемешивали при комнатной температуре в течение 2 ч. Раствор концентрировали в вакууме и сушили в высоком вакууме с получением продукта в виде белого твердого вещества (906 мг, 100%). MS: m/z = 132,2 (M-HCl+H)+
Стадия 4: 4-[4-(2-Фтор-этил)-пиперидин-1-ил]-пиримидин-2-иламин
Продукт получали из исходных веществ 4-хлорпиримидин-2-иламина (4 г, 31 ммоль), 4-(2-фтор-этил)-пиперидина гидрохлорида (5,7 г, 34,1 ммоль) и карбоната калия (6,4 г, 46,5 ммоль) в соответствии со способом, описанным в примере 49, стадия 1, в виде светло-желтого липкого твердого вещества (5,4 г, 78%). MS: m/z = 225,0 (M+H)+
Стадия 5: 7-[4-(2-Фторэтил)пиперидин-1-ил]-2-фенилимидазо[1,2-а]пиримидин
Продукт получали из исходных веществ 4-[4-(2-фтор-этил)-пиперидин-1-ил]-пиримидин-2-иламина (250 мг, 1,11 ммоль) и 2-бром-1-фенилэтанона (332 мг, 1,67 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, и после окончательной очистки с помощью препаративной ВЭЖХ (с использованием колонки Reprosil Gold, 250×20 мм, 5мк/C18, метанол/10 мМ ацетата аммония в воде) в виде не совсем белого твердого вещества (90 мг, 25%). MS: m/z = 325,3 (M+H)+
Пример 55
7-[4-(2-Фторэтил)пиперидин-1-ил]-2-(3-метоксифенил)имидазо[1,2-a]пиримидин
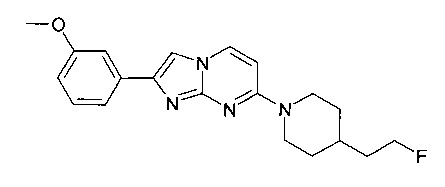
Продукт получали из исходных веществ 4-[4-(2-фтор-этил)-пиперидин-1-ил]-пиримидин-2-иламина (250 мг, 1,11 ммоль, пример 54, стадия 4) и 2-бром-1-(3-метоксифенил)-этанона (383 мг, 1,67 ммоль) в соответствии со способом, описанным в примере 54, стадия 5, в виде не совсем белого твердого вещества (30 мг, 8%). MS: m/z = 355,1 (M+H)+
Пример 56
7-[4-(2-Фторэтил)пиперидин-1-ил]-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
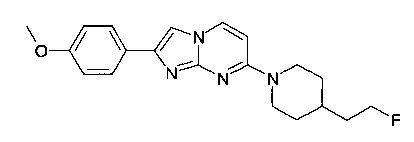
Продукт получали из исходных веществ 4-[4-(2-фтор-этил)-пиперидин-1-ил]-пиримидин-2-иламина (300 мг, 1,34 ммоль, пример 54, стадия 4) и 2-бром-1-(4-метоксифенил)-этанона (460 мг, 2,0 ммоль) в соответствии со способом, описанным в примере 49, стадия 2, и после окончательной очистки с помощью препаративной ВЭЖХ (с использованием колонки Xterra RP18, 250×19 мм, 10мк/С18, ацетонитрил/0,1% аммиак в воде) в виде не совсем белого твердого вещества (60 мг, 13%). MS: m/z = 355,2 (M+H)+
Пример 57
2-(1,3-Бензодиоксол-5-ил)-7-[4-(2-фторэтил)пиперидин-1-ил]имидазо[1,2-a]пиримидин
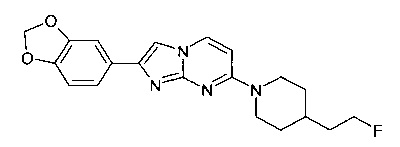
Продукт получали из исходных веществ 4-[4-(2-фтор-этил)-пиперидин-1-ил]-пиримидин-2-иламина (250 мг, 1,11 ммоль, пример 54, стадия 4) и 1-бензо[1,3]диоксол-5-ил-2-бром-этанона (406 мг, 1,67 ммоль) в соответствии со способом, описанным в примере 54, стадия 5, в виде не совсем белого твердого вещества (20 мг, 5%). MS: m/z = 369,1 (M+H)+
Пример 58
2-(2,3-Дигидро-1,4-бензодиоксин-6-ил)-7-[4-(2-фторэтил)пиперидин-1-ил]имидазо[1,2-a]пиримидин
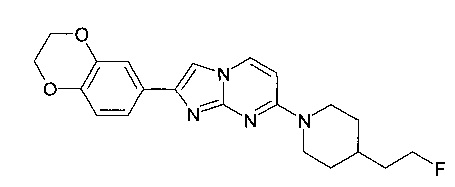
Продукт получали из исходных веществ 4-[4-(2-фтор-этил)-пиперидин-1-ил]-пиримидин-2-иламина (250 мг, 1,11 ммоль, пример 54, стадия 4) и 2-бром-1-(2,3-дигидро-бензо[1,4]диоксин-6-ил)-этанона (430 мг, 1,67 ммоль) в соответствии со способом, описанным в примере 54, стадия 5, в виде не совсем белого твердого вещества (110 мг, 26%). MS: m/z = 383,2 (M+H)+
Пример 59
7-[4-(2-Фторэтил)пиперидин-1-ил]-2-(3-метилфенил)имидазо[1,2-a]пиримидин
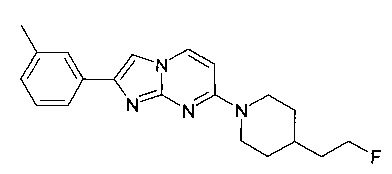
Продукт получали из исходных веществ 4-[4-(2-фтор-этил)-пиперидин-1-ил]-пиримидин-2-иламина (250 мг, 1,11 ммоль, пример 54, стадия 4) и 2-бром-1-м-толилэтанона (356 мг, 1,67 ммоль) в соответствии со способом, описанным в примере 54, стадия 5, в виде не совсем белого твердого вещества (90 мг, 24%). MS: m/z = 339,1 (M+H)+
Пример 60
7-[4-(2-Фторэтил)пиперидин-1-ил]-2-(4-метилфенил)имидазо[1,2-a]пиримидин
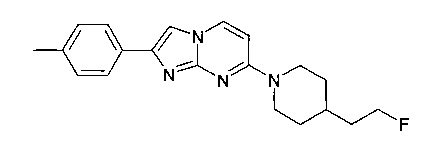
Продукт получали из исходных веществ 4-[4-(2-фтор-этил)-пиперидин-1-ил]-пиримидин-2-иламина (300 мг, 1,34 ммоль, пример 54, стадия 4) и 2-бром-1-п-толилэтанона (427 мг, 2,00 ммоль) в соответствии со способом, описанным в примере 54, стадия 5, в виде не совсем белого твердого вещества (15 мг, 3%). MS: m/z = 339,3 (M+H)+
Пример 61
4-[4-[7-[4-(2-Фторэтил)пиперидин-1-ил]имидазо[1,2-a]пиримидин-2-ил]фенил]морфолин
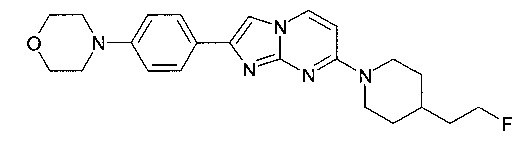
Продукт получали из исходных веществ 4-[4-(2-фтор-этил)-пиперидин-1-ил]-пиримидин-2-иламина (250 мг, 1,11 ммоль, пример 54, стадия 4) и 2-бром-1-(4-морфолин-4-ил-фенил)-этанона (474 мг, 1,67 ммоль) в соответствии со способом, описанным в примере 54, стадия 5, в виде не совсем белого твердого вещества (30 мг, 6%). MS: m/z = 410,2 (M+H)+
Пример 62
N-Метил-2-(3-метилфенил)имидазо[1,2-a]пиримидин-7-амин
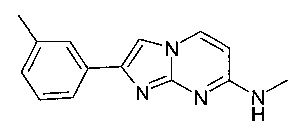
Продукт получали из исходных веществ N4-метилпиримидин-2,4-диамина (30,0 мг, 242 мкмоль, пример 1, стадия 1) и 2-бром-1-м-толилэтанона (77,2 мг, 362 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-желтого твердого вещества (18 мг, 31%). MS: m/z = 239,4 (M+H)+
Пример 63
7-(4-Фторпиперидин-1-ил)-2-тиофен-3-илимидазо[1,2-a]пиримидин
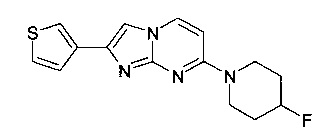
К светло-желтому раствору 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (50 мг, 255 мкмоль, пример 2, стадия 1) и 2-бром-1-(тиофен-3-ил)этанона (57,5 мг, 280 мкмоль) в ацетоне (1 мл) добавляли при комнатной температуре моногидрат п-толуолсульфоновой кислоты (48,5 мг, 255 мкмоль), и смесь перемешивали при 60°C в течение 48 ч. Растворитель удаляли в вакууме, и остаток перемешивали в NaHCO3 (насыщенный водный раствор, 5 мл). Смесь экстрагировали дихлорметаном (3×15 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и выпаривали. Продукт получали после очистки флэш-хроматографией (с использованием силикагеля и градиента этилацетат/метанол) и последующей препаративной ВЭЖХ (с использованием колонки Gemini 5мк/C18, 50×21,2 мм, 5мк/С18, ацетонитрил/0,1% триэтиламин в воде) в виде белого твердого вещества (2,4 мг, 3%). MS: m/z = 303,5 (M+H)+
Пример 64
N-[2-(2-Фторэтокси)этил]-2-(4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
Стадия 1: 7-хлор-2-(4-метоксифенил)имидазо[1,2-а]пиримидин и 7-бром-2-(4-метоксифенил)имидазо[1,2-а]пиримидин
Светло-желтый раствор 4-хлорпиримидин-2-амина (2,0 г, 15,4 ммоль) и 2-бром-1-(4-метоксифенил)этанона (5,3 г, 23,2 ммоль) в ацетоне (94,0 мл) перемешивали при 65°C в течение 16 ч. Реакционную смесь фильтровали и промывали ацетоном (~20 мл), и полученное желтое твердое вещество сушили в высоком вакууме в течение 4 ч. Сырой продукт выливали в NaHCO3 (насыщенный водный раствор, 200 мл) и экстрагировали этилацетатом (6×100 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и выпаривали. Смесь продуктов получали после очистки флэш-хроматографией (с использованием силикагеля и этилацетата) в виде светло-желтого твердого вещества (245 мг, 5%). MS: m/z = 260,0 & 304,0 (M+H)+
Стадия 2: N-[2-(2-Фторэтокси)этил]-2-(4-метоксифенил)-N-метилимидазо[1,2-а]пиримидин-7-амин
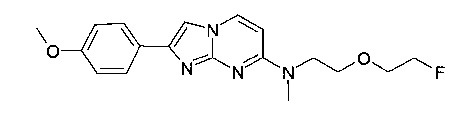
Смесь 7-хлор-2-(4-метоксифенил)имидазо[1,2-a]пиримидина и 7-бром-2-(4-метоксифенил)имидазо[1,2-a]пиримидина (50 мг, 193 мкмоль в пересчете на хлорид) объединяли с диметилсульфоксидом (ДМСО) (1,0 мл) в атмосфере азота с получением не совсем белой суспензии. Добавляли 2-(2-фторэтокси)-N-метилэтанамина гидрохлорид (36,4 мг, 231 мкмоль) и диизопропилэтиламин, (99,5 мг, 131 мкл, 770 мкмоль) и перемешивали реакционную смесь при 130°C в течение 3 ч. Коричневый раствор разбавляли водой (5 мл) и экстрагировали дихлорметаном (3×5 мл). Органические слои объединяли, промывали солевым раствором (5 мл), сушили над MgSO4, фильтровали и выпаривали. Продукт получали после очистки флэш-хроматографией (с использованием аминосиликагеля и градиента гептан/этилацетат) в виде желтого твердого вещества (45 мг, 67%). MS: m/z = 345,5 (M+H)+
Пример 65
7-(2-Азаспиро[3,3]гептан-2-ил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
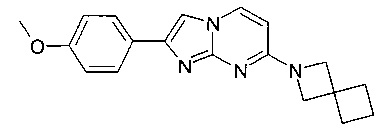
Продукт получали из исходных веществ 7-хлор-2-(4-метоксифенил)имидазо[1,2-a]пиримидина и 7-бром-2-(4-метоксифенил)имидазо[1,2-a]пиримидина (50 мг, 193 мкмоль в пересчете на хлорид, пример 64, стадия 1) и 2-азаспиро[3,3]гептана гидрохлорида (25,7 мг, 193 мкмоль) в соответствии со способом, описанным в примере 64, стадия 2, в виде светло-желтого твердого вещества (14 мг, 22%). MS: m/z = 321,5 (M+H)+
Пример 66
N-Этил-2-(4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
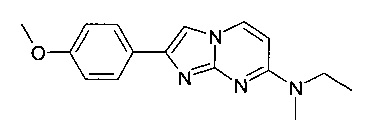
Продукт получали из исходных веществ 7-хлор-2-(4-метоксифенил)имидазо[1,2-a]пиримидина и 7-бром-2-(4-метоксифенил)имидазо[1,2-a]пиримидина (50 мг, 193 мкмоль в пересчете на хлорид, пример 64, стадия 1) и N-метилэтанамина (11,4 мг, 193 мкмоль) в соответствии со способом, описанным в примере 64, стадия 2, в виде желтого твердого вещества (10 мг, 18%). MS: m/z = 283,5 (M+H)+
Пример 67
N,N-Диэтил-2-(4-метоксифенил)имидазо[1,2-a]пиримидин-7-амин
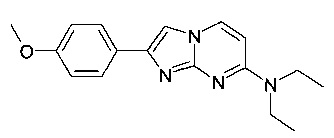
Продукт получали из исходных веществ 7-хлор-2-(4-метоксифенил)имидазо[1,2-a]пиримидина и 7-бром-2-(4-метоксифенил)имидазо[1,2-a]пиримидина (50 мг, 193 мкмоль в пересчете на хлорид, пример 64, стадия 1) и диэтиламина (21,2 мг, 30 мкл, 290 мкмоль) в соответствии со способом, описанным в примере 64, стадия 2, в виде желтого твердого вещества (26 мг, 45%). MS: m/z = 297,2 (M+H)+
Пример 68
N-[2-(2-Фторэтокси)этил]-N-метил-2-(3-метилфенил)имидазо[1,2-a]пиримидин-7-амин
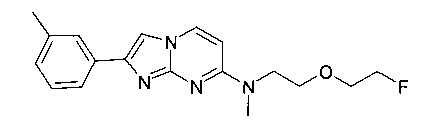
Стадия 1: 7-Хлор-2-м-толилимидазо[1,2-a]пиримидин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (1,0 г, 7,72 ммоль) и 2-бром-1-м-толилэтанона (2,47 г, 11,6 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде коричневого твердого вещества (535 мг, 25%). MS: m/z = 244,4 (M+H)+
Стадия 2: N-[2-(2-Фторэтокси)этил]-N-метил-2-(3-метилфенил)имидазо[1,2-а]пиримидин-7-амин
Продукт получали из исходных веществ 7-хлор-2-м-толилимидазо[1,2-a]пиримидина (50 мг, 205 мкмоль) и 2-(2-фторэтокси)-N-метилэтанамина гидрохлорида (38,8 мг, 246 мкмоль) в соответствии со способом, описанным в примере 64, стадия 2, и после препаративной ТЖХ (с использованием силикагеля 1 мм и этилацетата) в виде светло-коричневого маслянистого твердого вещества (18 мг, 27%). MS: m/z = 329,5 (M+H)+
Пример 69
7-(Азетидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
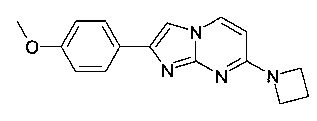
Стадия 1: 4-(Азетидин-1-ил)пиримидин-2-амин
В сосуд для микроволновой обработки помещали 4-хлорпиримидин-2-амин (0,300 г, 2,32 ммоль), азетидин (271 мг, 0,32 мл, 4,75 ммоль), N,N-диизопропилэтиламин (363 мг, 0,49 мл, 2,81 ммоль) и метанол (3,0 мл). Сосуд продували аргоном, закрывали и перемешивали при 60°C (температура масляной бани) в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали. Остаток (бледно-желтое твердое вещество) суспендировали в воде, фильтровали и промывали водой. Продукт получали после сушки остатка в высоком вакууме в виде не совсем белого порошка (287 мг, 82%). MS: m/z = 151.4 (M+H)+
Стадия 2: 7-(Азетидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-а]пиримидин
В сосуд для микроволновой обработки помещали 4-(азетидин-1-ил)пиримидин-2-амин (0,050 г, 333 мкмоль), 2-бром-1-(4-метоксифенил)этанон (80 мг, 349 мкмоль) и ацетон (0,6 мл). Сосуд продували аргоном и закрывали. Реакционную смесь перемешивали при 70°C (температура масляной бани) в течение ночи, охлаждали до комнатной температуры и экстрагировали дихлорметаном и насыщенным раствором Na2CO3. Водный слой дважды экстрагировали дихлорметаном. Органические слои объединяли, сушили над Na2SO4, фильтровали и концентрировали. Продукт получали после растирания остатка (светло-желтого твердого вещества) с этилацетатом и несколькими каплями метанола в виде не совсем белого порошка (72 мг, 77%). MS: m/z = 281.5 (M+H)+
Пример 70 проверено
7-(3-Фторазетидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
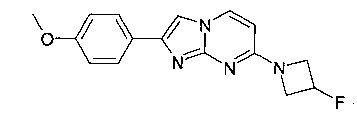
Стадия 1: 4-(3-Фторазетидин-1-ил)пиримидин-2-амин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (0,400 г, 3,09 ммоль) и 3-фторазетидина гидрохлорида (379 мг, 3,4 ммоль) в соответствии со способом, описанным в примере 69, стадия 1, в виде не совсем белого порошка (257 мг, 50%). MS: m/z = 169,3 (M+H)+
Стадия 2: 7-(3-Фторазетидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-а]пиримидин
В сосуд для микроволновой обработки помещали 4-(3-фторазетидин-1-ил)пиримидин-2-амин (0,050 г, 297 мкмоль), 2-бром-1-(4-метоксифенил)этанон (72 мг, 314 мкмоль) и ацетон (0,5 мл). Сосуд продували аргоном и закрывали. Реакционную смесь перемешивали при 70°C (температура масляной бани) в течение ночи, охлаждали до комнатной температуры, разбавляли ацетоном (~0,5 мл), водой (1 мл) и щелочным раствором гидроксида аммония (~25%, ~0,5 мл). Суспензию перемешивали при комнатной температуре в течение 5 мин, фильтровали и промывали водой и ацетоном. Продукт получали после сушки остатка в высоком вакууме в виде не совсем белого твердого вещества (41 мг, 46,2%). MS: m/z = 299,4 (M+H)+
Пример 71
7-(3-Фторазетидин-1-ил)-2-фенилимидазо[1,2-a]пиримидин
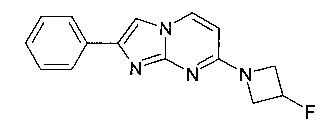
Продукт получали из исходных веществ 4-(3-фторазетидин-1-ил)пиримидин-2-амина (50 мг, 297 мкмоль, пример 70, стадия 1) и 2-бром-1-фенилэтанона (63 мг, 317 мкмоль) в соответствии со способом, описанным в примере 69, стадия 2, в виде не совсем белого порошка (45 мг, 56%). MS: m/z = 269.4 (M+H)+
Пример 72
7-(3-Фторазетидин-1-ил)-2-(3-метилфенил)имидазо[1,2-a]пиримидин
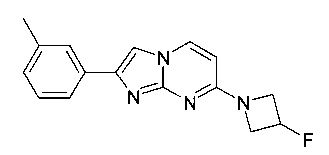
Продукт получали из исходных веществ 4-(3-фторазетидин-1-ил)пиримидин-2-амина (50 мг, 297 мкмоль, пример 70, стадия 1) и 2-бром-1-м-толилэтанона (72 мг, 321 мкмоль) в соответствии со способом, описанным в примере 69, стадия 2, в виде светло-желтого порошка (39 мг, 46%). MS: m/z = 283.5 (M+H)+
Пример 73
2-(1-Бензофуран-2-ил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
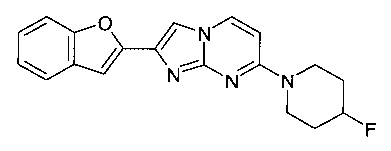
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (50 мг, 255 мкмоль, пример 2, стадия 1) и 1-(бензофуран-2-ил)-2-бромэтанона (67,0 мг, 280 мкмоль) в соответствии со способом, описанным в примере 63, после единственной очистки путем флэш-хроматографии в виде не совсем белого твердого вещества (31 мг, 36%). MS: m/z = 337,6 (M+H)+
Пример 74
N,N-Диметил-4-(7-морфолин-4-илимидазо[1,2-a]пиримидин-2-ил)анилин
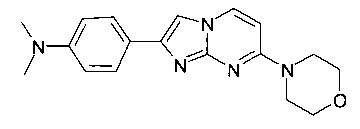
Продукт получали из исходных веществ 4-морфолин-4-илпиримидин-2-иламина (120 мг, 666 мкмоль, пример 25, стадия 1) и 2-бром-1-(4-(диметиламино)фенил)этанона (161 мг, 666 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-желтого твердого вещества (19 мг, 8%). MS: m/z = 324,5 (M+H)+
Пример 75
2-(1-Бензотиофен-2-ил)-7-(4-фторпиперидин-1-ил)имидазо[1,2-a]пиримидин
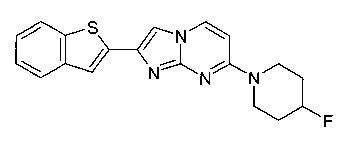
Суспензию 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (74 мг, 377 мкмоль, пример 2, стадия 1), 1-(бензо[b]тиофен-2-ил)-2-бромэтанона (144 мг, 566 мкмоль) и NaHCO3 (47,5 мг, 566 мкмоль) в метаноле (1,5 мл) перемешивали при 76°C в атмосфере аргона в течение 3 ч, охлаждали до комнатной температуры и выливали в NaOH (1н водный раствор). Смесь дважды экстрагировали дихлорметаном. Органические слои объединяли, сушили над Na2SO4, фильтровали и концентрировали. Продукт получали после очистки флэш-хроматографией (с использованием аминосиликагеля и градиента гептан/этилацетат) в виде светло-коричневого твердого вещества (85 мг, 64%). MS: m/z = 353,4 (M+H)+
Пример 76
N-Циклопропил-2-(4-метоксифенил)имидазо[1,2-a]пиримидин-7-амин
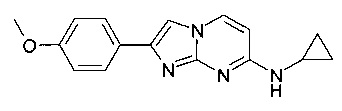
Стадия 1: N4-Циклопропилпиримидин-2,4-диамин
В суспензию 4-хлорпиримидин-2-амина (0,300 г, 2,32 ммоль) и карбоната калия (640 мг, 4,63 ммоль) в ДМФ (3,0 мл) добавляли циклопропиламин (1207 мг, 1,49 мл, 21,15 ммоль), и реакционную смесь перемешивали при 100°C (температура масляной бани) в течение ночи. Реакционную смесь охлаждали до комнатной температуры и экстрагировали этилацетатом и водой, и водный слой снова экстрагировали этилацетатом. Органические слои промывали три раза водой и один раз солевым раствором. Органические слои объединяли, сушили над Na2SO4, фильтровали и концентрировали. Продукт получали после растирания остатка (желтого твердого вещества) с диэтиловым эфиром в виде не совсем белого твердого вещества (193 мг, 55%). MS: m/z = 151,4 (M+H)+
Стадия 2: N-ииклопропил-2-(4-метоксифенил)имидазо[1,2-а]пиримидин-7-амин
Продукт получали из исходных веществ N4-циклопропилпиримидин-2,4-диамина (50 мг, 333 мкмоль) и 2-бром-1-(4-метоксифенил)этанона (81 мг, 354 мкмоль) в соответствии со способом, описанным в примере 69, стадия 2, в виде светло-желтого твердого вещества (43 мг, 41%). MS: m/z = 281,5 (M+H)+
Пример 77
N-Изопропил-2-(4-метоксифенил)-имидазо[1,2-a]пиримидин-7-амин
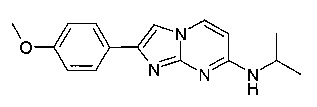
Стадия 1: N4-Изопропилпиримидин-2,4-диамин
В сосуд для микроволновой обработки помещали 4-хлорпиримидин-2-амин (300 мг, 2,32 ммоль), изопропиламин (828 мг, 1,2 мл, 14,0 ммоль) и воду (1,0 мл). Сосуд продували аргоном, закрывали и перемешивали при 180°C в течение 30 мин при облучении микроволнами (предупреждение: давление достигало >20 бар!). Реакционную смесь охлаждали до комнатной температуры и экстрагировали дихлорметаном и водой. Органический слой промывали водой, и водные слои повторно экстрагировали дихлорметаном. Органические слои объединяли, сушили над Na2SO4, фильтровали и концентрировали. Продукт получали после растирания остатка с диэтиловым эфиром и несколькими каплями этилацетата в виде не совсем белого твердого вещества (282 мг, 80%). MS: m/z = 153,4 (M+H)+
Стадия 2: N-Изопропил-2-(4-метоксифенил)имидазо[1,2-а]пиримидин-7-амин
Продукт получали из исходных веществ N4-изопропилпиримидин-2,4-диамина (0,050 г, 329 мкмоль) и 2-бром-1-(4-метоксифенил)этанона (79 мг, 345 мкмоль) в соответствии со способом, описанным в примере 69, стадия 2, и после окончательной очистки с помощью флэш-хроматографии (с использованием силикагеля и градиента дихлорметан/метанол) в виде светло-желтого твердого вещества (59 мг, 64%). MS: m/z = 283,5 (M+H)+
Пример 78
2-(4-Метоксифенил)-N-(2,2,2-трифторэтил)имидазо[1,2-a]пиримидин-7-амин
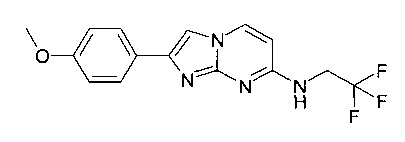
Стадия 1: N4-(2,2,2-Трифторэтил)пиримидин-2,4-диамин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (300 мг, 2,32 ммоль) и 2,2,2-трифторэтиламина (1,26 г, 1,0 мл, 12,7 ммоль) в соответствии со способом, описанным в примере 77, стадия 1, без окончательного растирания в виде светло-желтого твердого вещества (121 мг, 26%).
Стадия 2: 2-(4-Метоксифенил)-N-(2,2,2-трифторэтил)имидазо[1,2-а]пиримидин-7-амин
Продукт получали из исходных веществ N4-(2,2,2-трифторэтил)пиримидин-2,4-диамина (0,055 г, 272 мкмоль) и 2-бром-1-(4-метоксифенил)этанона (66 мг, 288 мкмоль) в соответствии со способом, описанным в примере 69, стадия 2, в виде светло-желтого твердого вещества (47 мг, 54%). MS: m/z = 323,4 (M+H)+
Пример 79
2-[7-(4-Фторпиперидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]-1,3-бензотиазол
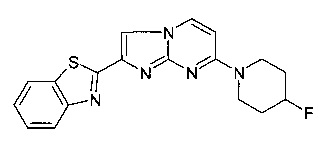
В сосуд для микроволновой обработки помещали 4-(4-фторпиперидин-1-ил)пиримидин-2-амин (50 мг, 255 мкмоль) и MeOH (849 мкл) и перемешивали в течение 5 мин с получением бесцветного раствора. Добавляли 1-(бензо[d]тиазол-2-ил)-2-бромэтанон (91,4 мг, 357 мкмоль) и бикарбонат натрия (21,4 мг, 255 мкмоль), сосуд запаивали, и реакционную смесь перемешивали при 76°C в течение 3 ч. Растворитель выпаривали, остаток разбавляли 1 М NaOH и экстрагировали дихлорметаном. Органическую фазу сушили над MgSO4 и концентрировали при пониженном давлении. Продукт получали после очистки флэш-хроматографией (с использованием силикагеля и градиента дихлорметан/метанол/аммиак) в виде оранжевого порошка (67 мг, 74%). MS: m/z = 354,5 (M+H)+
Пример 80
4-[7-(Азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]фенол
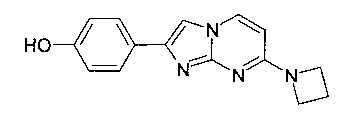
В сосуд для микроволновой обработки помещали 4-(азетидин-1-ил)пиримидин-2-амин (70 мг, 466 мкмоль, пример 69, стадия 1), 2-бром-1-(4-гидроксифенил)этанон (105 мг, 489 мкмоль) и ацетон (0,70 мл). Сосуд продували аргоном, закрывали и перемешивали при 70°C (температура масляной бани) в течение ночи. Реакционную смесь охлаждали до комнатной температуры, затем разбавляли дихлорметаном и насыщенным раствором NaHCO3, причем осадок образовывался в водном слое. Водный слой фильтровали, промывали водой и этилацетатом, и получали продукт после сушки остатка в высоком вакууме в виде светло-желтого твердого вещества (115 мг, 93%). MS: m/z = 267,5 (M+H)+
Пример 81
7-(3-Метоксиазетидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин
Стадия 1: 4-(3-Метоксиазетидин-1-ил)пиримидин-2-амин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (300 мг, 2,32 ммоль), 3-метоксиазетидина гидрохлорида (572 мг, 4,63 ммоль) и N,N-диизопропилэтиламина (888 мг, 1,2 мл, 6,87 ммоль) в соответствии со способом, описанным в примере 77, стадия 1, после окончательного растирания с этилацетатом в виде светло-желтого твердого вещества (179 мг, 43%). MS: m/z = 181,4 (M+H)+
Стадия 2: 7-(3-Метоксиазетидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-а]пиримидин
Продукт получали из исходных веществ 4-(3-метоксиазетидин-1-ил)пиримидин-2-амина (0,050 г, 277 мкмоль) и 2-бром-1-(4-метоксифенил)этанона (67 мг, 292 мкмоль) в соответствии со способом, описанным в примере 69, стадия 2, и после окончательной очистки с помощью флэш-хроматографии (с использованием силикагеля и градиента дихлорметан/метанол) в виде светло-желтого твердого вещества (54 мг, 63%). MS: m/z = 311,5 (M+H)+
Пример 82
N-Метил-2-(4-метилфенил)имидазо[1,2-a]пиримидин-7-амин
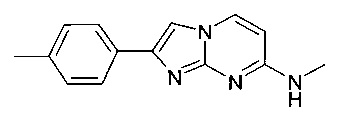
Продукт получали из исходных веществ N4-метилпиримидин-2,4-диамина (50 мг, 403 мкмоль, пример 1, стадия 1) и 2-бром-1-п-толилэтанона (129 мг, 604 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде не совсем белого твердого вещества (38 мг, 40%). MS: m/z = 239,5 (M+H)+
Пример 83
2-(4-Метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
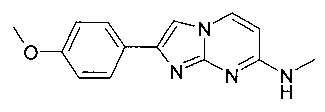
Продукт получали из исходных веществ N4-метилпиримидин-2,4-диамина (200 мг, 1,61 ммоль, пример 1, стадия 1) и 2-бром-1-(4-метоксифенил)этанона (554 мг, 2,42 ммоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (284 мг, 69%). MS: m/z = 255,5 (M+H)+
Пример 84
2-(1,3-Бензодиоксол-5-ил)-N-метилимидазо[1,2-a]пиримидин-7-амин
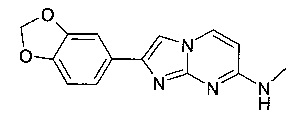
Продукт получали из исходных веществ N4-метилпиримидин-2,4-диамина (50 мг, 403 мкмоль, пример 1, стадия 1) и 1-(бензо[d][1,3]диоксол-5-ил)-2-бромэтанона (147 мг, 604 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-желтого твердого вещества (57 мг, 53%). MS: m/z = 269,4 (M+H)+
Пример 85
N,N-Диметил-2-тиофен-3-илимидазо[1,2-a]пиримидин-7-амин
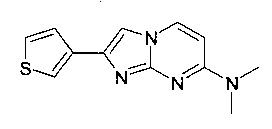
Продукт получали из исходных веществ N4,N4-диметилпиримидин-2,4-диамина (100 мг, 724 мкмоль, пример 18, стадия 1) и 2-бром-1-(тиофен-3-ил)этанона (223 мг, 1,09 ммоль) в соответствии со способом, описанным в примере 75, в виде светло-желтого твердого вещества (40 мг, 23%). MS: m/z = 245.4 (M+H)+
Пример 86
N-(2-Фторэтил)-N-метил-2-(4-метилфенил)имидазо[1,2-a]пиримидин-7-амин
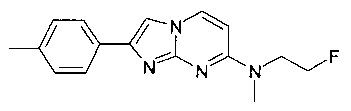
Продукт получали из исходных веществ N4-(2-фторэтил)-N4-метилпиримидин-2,4-диамина (50 мг, 294 мкмоль, пример 21, стадия 1) и 2-бром-1-п-толилэтанона (93,9 мг, 441 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде белого твердого вещества (5,4 мг, 6%). MS: m/z = 285.5 (M+H)+
Пример 87
2-(1,3-Бензодиоксол-5-ил)-N-(2-фторэтил)-N-метилимидазо[1,2-a]пиримидин-7-амин
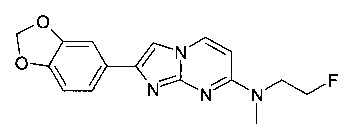
Продукт получали из исходных веществ N4-(2-фторэтил)-N4-метилпиримидин-2,4-диамина (50 мг, 294 мкмоль, пример 21, стадия 1) и 1-(бензо[d][1,3]диоксол-5-ил)-2-бромэтанона (107 мг, 441 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-желтого твердого вещества (43 мг, 44%). MS: m/z = 315,4 (M+H)+
Пример 88
N-(2-Фторэтил)-N-метил-2-(3-метилфенил)имидазо[1,2-a]пиримидин-7-амин
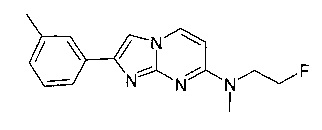
Продукт получали из исходных веществ N4-(2-фторэтил)-N4-метилпиримидин-2,4-диамина (50 мг, 294 мкмоль, пример 21, стадия 1) и 2-бром-1-м-толилэтанона (93,9 мг, 441 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-коричневого твердого вещества (5 мг, 5%). MS: m/z = 285,5 (M+H)+
Пример 89
2-(4-Метоксифенил)-7-(3-метилазетидин-1-ил)имидазо[1,2-a]пиримидин
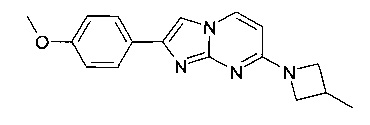
Стадия 1: 4-(3-Метилазетидин-1-ил)пиримидин-2-амин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (0,240 г, 1,85 ммоль), 3-метилазетидина бензолсульфоната (680 мг, 2,96 ммоль) и N,N-диизопропилэтиламина (666 мг, 0,90 мл, 5,15 ммоль) в соответствии со способом, описанным в примере 77, стадия 1, и после окончательного растирания с очень небольшим количеством этилацетата в виде светло-желтого твердого вещества (112 мг, 33%). MS: m/z = 165,4 (M+H)+
Стадия 2: 2-(4-Метоксифенил)-7-(3-метилазетидин-1-ил)имидазо[1,2-а]пиримидин
Продукт получали из исходных веществ 4-(3-метилазетидин-1-ил)пиримидин-2-амина (0,055 г, 301 мкмоль) и 2-бром-1-(4-метоксифенил)этанона (76 мг, 332 мкмоль) в соответствии со способом, описанным в примере 69, стадия 2, и после окончательной очистки с помощью флэш-хроматографии (с использованием силикагеля и градиента дихлорметан/метанол) в виде светло-желтого твердого вещества (68 мг, 77%). MS: m/z = 295,5 (M+H)+
Пример 90
2-[4-(Диметиламино)фенил]-N-метилимидазо[1,2-a]пиримидин-7-амин
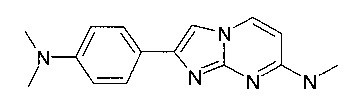
Продукт получали из исходных веществ N4-метилпиримидин-2,4-диамина (100 мг, 806 мкмоль, пример 1, стадия 1) и 2-бром-1-(4-(диметиламино)фенил)этанона (234 мг, 967 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (168 мг, 78%). MS: m/z = 268,5 (M+H)+
Пример 91
4-[7-(4-Фторпиперидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]-N,N-диметиланилин
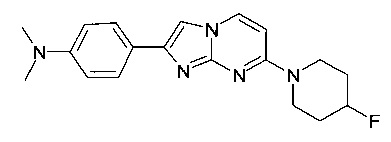
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина (50 мг, 255 мкмоль, пример 2, стадия 1) и 2-бром-1-(4-(диметиламино)фенил)этанона (92,5 мг, 382 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-желтого твердого вещества (13 мг, 15%). MS: m/z = 340,5 (M+H)+
Пример 92
2-[4-(Диметиламино)фенил]-N-(2-фторэтил)-N-метилимидазо[1,2-a]пиримидин-7-амин
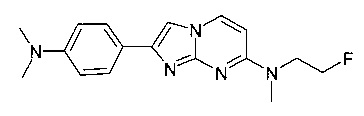
Продукт получали из исходных веществ N4-(2-фторэтил)-N4-метилпиримидин-2,4-диамина (120 мг, 705 мкмоль, пример 21, стадия 1) и 2-бром-1-(4-(диметиламино)фенил)этанона (205 мг, 846 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, после растирания сырого продукта с диэтиловым эфиром и после окончательной очистки с помощью флэш-хроматографии (с использованием аминосиликагеля и градиента гептан/этилацетат) в виде желтого твердого вещества (42 мг, 19%). MS: m/z = 314,5 (M+H)+
Пример 93
N-Циклопропил-2-(4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
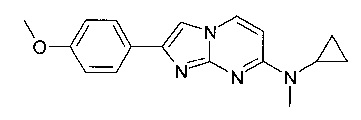
Стадия 1: N4-Циклопропил-N4-метилпиримидин-2,4-диамин
Продукт получали из исходных веществ 4-хлорпиримидин-2-амина (300 мг, 2,32 ммоль) и N-метилциклопропанамина (494 мг, 6,95 ммоль) в соответствии со способом, описанным в примере 77, стадия 1, и после окончательного растирания с этилацетатом в виде белого твердого вещества (237 мг, 62%). MS: m/z = 165,4 (M+H)+
Стадия 2: N-Циклопропил-2-(4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
Продукт получали из исходных веществ N4-циклопропил-N4-метилпиримидин-2,4-диамина (60 мг, 365 мкмоль) и 2-бром-1-(4-метоксифенил)этанона (88 мг, 384 мкмоль) в соответствии со способом, описанным в примере 69, стадия 2, и после окончательного растирания с ацетоном в виде не совсем белого твердого вещества (67 мг, 59%). MS: М = 295,5 (M+H)+
Пример 94
7-(Азетидин-1-ил)-2-(4-метилфенил)имидазо[1,2-a]пиримидин
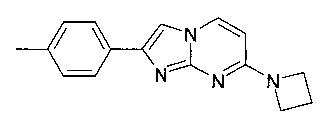
Продукт получали из исходных веществ 4-(азетидин-1-ил)пиримидин-2-амина (60 мг, 400 мкмоль, пример 69, стадия 1) и 2-бром-1-п-толилэтанона (90 мг, 422 мкмоль) в соответствии со способом, описанным в примере 69, стадия 2, с последующей очисткой путем флэш-хроматографии (с использованием силикагеля и градиента дихлорметан/метанол) и после окончательного растирания с этилацетатом и несколькими каплями метанола в виде не совсем белого твердого вещества (75 мг, 71%). MS: m/z = 265,4 (M+H)+
Пример 95
7-(Азетидин-1-ил)-2-(3-метилфенил)имидазо[1,2-a]пиримидин
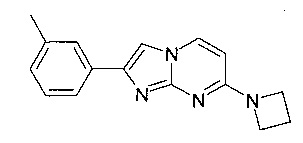
Продукт получали из исходных веществ 4-(азетидин-1-ил)пиримидин-2-амина (60 мг, 400 мкмоль, пример 69, стадия 1) и 2-бром-1-м-толилэтанона (90 мг, 422 мкмоль) в соответствии со способом, описанным в примере 69, стадия 2, и после окончательной очистки с помощью флэш-хроматографии (с использованием силикагеля и градиента дихлорметан/метанол) в виде светло-желтого твердого вещества (65 мг, 61%). MS: m/z = 265,4 (M+H)+
Пример 96
2-[4-(Диметиламино)фенил]-N-(2-фторэтил)имидазо[1,2-a]пиримидин-7-амин
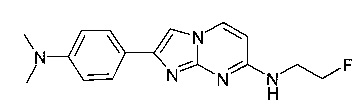
Стадия 1: N4-(2-Фторэтил)пиримидин-2,4-диамин
В желтую суспензию 4-хлорпиримидин-2-амина (0,50 г, 19,3 ммоль) в N-метил-2-пирролидиноне (3 мл) добавляли карбонат калия (2,67 г, 19,3 ммоль) и 2-фторэтанамина гидрохлорид (1,15 г, 11,6 ммоль). Реакционную смесь нагревали до 150°C при облучении микроволнами в течение 10 мин. Смесь выливали в ледяную воду (50 мл) и NaOH (1N, 4 мл), и экстрагировали этилацетатом (3×30 мл). Органические слои объединяли, сушили и выпаривали. Продукт получали после очистки флэш-хроматографией (с использованием силикагеля и градиента дихлорметан/метанол/аммиак) в виде желтого твердого вещества (70 мг, 12%). MS: m/z = 157,1 (M+H)+
Стадия 2: 2-[4-(Диметиламино)фенил]-N-(2-фторэтил)имидазо[1,2-а]пиримидин-7-амин
Продукт получали из исходных веществ N4-(2-фторэтил)пиримидин-2,4-диамина (70 мг, 448 мкмоль) и 2-бром-1-(4-(диметиламино)фенил)этанона (163 мг, 672 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (24 мг, 18%). MS: m/z = 300,2 (M+H)+
Пример 97
7-(Азетидин-1-ил)-2-[4-(фторметокси)фенил]имидазо[1,2-a]пиримидин
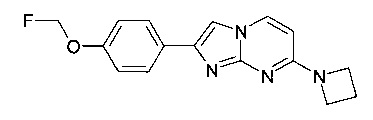
Продукт получали из исходных веществ 4-(7-(азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола (120 мг, 451 мкмоль, пример 80), фторметил-4-метилбензолсульфоната (129 мг, 631 мкмоль) и карбоната цезия (294 мг, 901 мкмоль) в соответствии со способом, описанным в примере 29, и после окончательной очистки с помощью флэш-хроматографии (с использованием силикагеля и градиента дихлорметан/метанол) в виде светло-коричневого твердого вещества (67 мг, 47%). MS: m/z = 299,5 (M+H)+
Пример 98
2-Метокси-4-[7-(метиламино)имидазо[1,2-a]пиримидин-2-ил]фенол
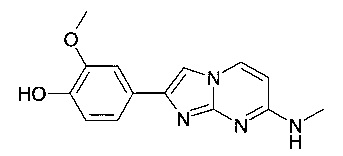
Продукт получали из исходных веществ N4-метилпиримидин-2,4-диамина (70 мг, 564 мкмоль, пример 1, стадия 1) и 2-бром-1-(4-гидрокси-3-метоксифенил)этанона (200 мг, 818 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, с увеличением времени реакции (72 ч) в виде оранжевого твердого вещества (56 мг, 37%). MS: m/z = 271,1 (M+H)+
Пример 99
2-(3-Бромфенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
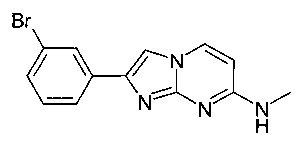
Продукт получали из исходных веществ N4-метилпиримидин-2,4-диамина (20 мг, 161 мкмоль, пример 1, стадия 1) и 2-бром-1-(3-бромфенил)этанона (65 мг, 234 мкмоль) в соответствии со способом, описанным в примере 1, стадия 2, при увеличении времени реакции (72 ч) в виде желтого твердого вещества (13 мг, 26%). MS: m/z = 303,0 (M+H)+
Пример 100
7-(4-фторпиперидин-1-ил)-2-(4-метокси-2,6-дитритиофенил)имидазо[1,2-a]пиримидин
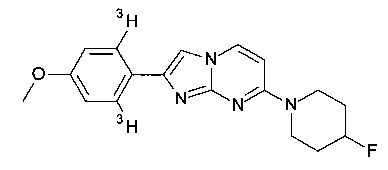
В колбе для растирания на 2 мл растворяли 7-(4-фторпиперидин-1-ил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин (2,2 мг, 6,7 мкмоль) и катализатор Крэбтри (5,2 мг, 6,5 мкмоль) в дихлорметане (1,0 мл). Колбу присоединяли к трубке для подачи трития (RC-TRITEC) и дегазировали путем замораживания-откачивания-оттаивания. Вводили тритиевый газ и перемешивали светло-оранжевый раствор энергично в течение 4 часов в атмосфере трития при 1200 мбар. Раствор охлаждали жидким азотом и избыток газообразного трития в реакционном сосуде поглощали урановой ловушкой для отходов трития. Растворитель лиофилизировали, лабильный тритий удаляли лиофилизацией смесью 9:1 этанола и воды (3×1 мл) и толуолом (2×1 мл). Оставшееся коричневатое масло растворяли в этаноле (1,5 мл) и переносили на катионит SCX-2. Оставшийся катализатор элюировали MeOH (10 мл) и отбрасывали, продукт элюировали NH3 в MeOH (3,5 N, 10 мл), собирали отдельно и концентрировали при пониженном давлении. Сырой продукт очищали с помощью препаративной ВЭЖХ (колонка Nucleodur 100-5 Prep С-18, 5 мкм, 10×250 мм) с использованием ацетонитрила, воды и буфера с pH 7 в качестве элюента. Получили 900 МБк (24 мКи) указанного в заголовке соединения с радиохимической чистотой 94% и удельной активностью 2,1 ТБк/ммоль (58 Ки/ммоль), определенной МС-спектрометрией. Соединение хранили в виде раствора этанола. MS m/z: 331,2 (M+H)+
Пример 101
7-(Азетидин-1-ил)-2-[4-(тритритиометокси)фенил)имидазо[1,2-a]пиримидин
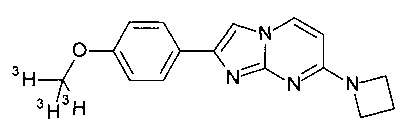
Раствор [3H3]-метилнозилата в толуоле (1 мл, 1,85 ГБк, 0,66 мкмоль) переносили в реактор на 1,5 мл и концентрировали под током аргона. Добавляли раствор 4-[7-(азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]фенола (220 мг, 0,85 мкмоль) в ДМФ (0,2 мл) и карбонат цезия (540 мг, 1,6 мкмоль) и герметично закрывали реактор. Коричневый раствор перемешивали при 55°C в течение 3 ч. Реакционную смесь разбавляли дихлорметаном (10 мл) и переносили в колбу на 25 мл. Растворитель и летучие побочные продукты удаляли в вакууме. Неочищенный продукт очищали с помощью препаративной ВЭЖХ (колонка XBridge С18, 5 мкм, 10×250 мм) с использованием ацетонитрила, воды и буфера с pH 9 в качестве элюента. Получали 150 МБк (4,1 мКи) желаемого соединения с радиохимической чистотой более 93% и удельной активностью 2,8 ТБк/ммоль (76 Ки/ммоль). MS m/z: 286,2 (M+H)+
Пример 102
2-(3-Метилфенил)-N-(тритритиометил)имидазо[1,2-a]пиримидин-7-амин
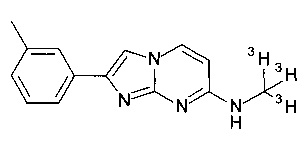
Раствор [3H3]-метилнозилата в толуоле (1 мл, 1,85 GBq, 0,66 мкмоль) переносили в реактор на 1,5 мл и концентрировали в потоке аргона. Добавляли раствор 2-(3-метилфенил)-имидазо[1,2-a]пиримидин-7-амина (380 мкг, 1,7 мкмоль) в ТГФ (0,24 мл) и карбонат цезия (1400 мг, 4,3 мкмоль) и концентрировали реакционную смесь до примерно 50 мкл. После промывки ТГФ (50 мкл) реактор плотно закрывали и реакционную смесь перемешивали в течение 24 ч. Реакционную смесь постепенно разбавляли дихлорметаном (30 мл) и переносили в колбу на 50 мл. Растворитель и летучие продукты удаляли в вакууме. Сырой продукт очищали препаративной ВЭЖХ (XBridge C18, 5 мкм, 10×250 мм) с использованием ацетонитрила, воды и буфера с pH 2,5 в качестве элюента. Получали 460 МБк (12,4 мКи) желаемого соединения с радиохимической чистотой 94% и удельной активностью 2,6 ТБк/ммоль (70 Ки/ммоль). MS m/z: 244,9 (M+H)+
Пример 103
N-[11C]Метил-2-(м-толил)имидазо[1,2-a]пиримидин-7-амин
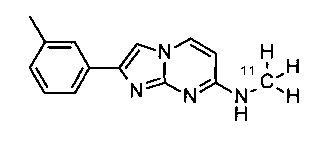
За десять минут до окончания получения [11C] двуокиси углерода, предшественник, 2-(м-толил)имидазо[1,2-a]пиримидин-7-амин, (0,7±0,3 мг) растворяли в 200 мкл диметилсульфоксида и добавляли 5 мкл 6 н гидроксида натрия. Йодистый метил-углерод-11 ([11C]Mel) получали из [11C]двуокиси углерода через [11C]метан в модуле General Electric FXMel. Примерно через 10 минут через сосуд с предшественником барботировали [11C]Mel. Когда радиоактивность достигала плато, барботирование останавливали и сосуд с предшественником нагревали при 80°C в течение 3 минут.
Реакционную смесь разбавляли 1 мл воды для ВЭЖХ и вводили в полупрепаративную колонку ВЭЖХ (XBridge C-18, 10 мкм, 10×150 мм), которую элюировали смесью 20:80 ацетонитрил:вода (0,1 М формиат аммония) со скоростью потока 10 мл/мин.
Эффлюент из колонки ВЭЖХ контролировали при 254 нм и детектором радиоактивности он-лайн. Продукт, который элюировался примерно на 8,5 минуты, собирали в 50 мл воды, содержащей примерно 250 мг аскорбиновой кислоты. После загрузки продукта на уравновешенную колонку C-18 SepPak Plus, колонку SepPak промывали 10 мл воды. Меченый продукт элюировали из колонки SepPak 1 мл абсолютного этанола, а затем 10 мл стерильного физиологического раствора через стерильный фильтр в сосуд с конечным продуктом.
Отбирали аликвоты из сосуда с конечным продуктом для анализа контроля качества. Для определения радиохимической и химической чистоты, удельной активности и химической идентичности использовали аналитическую колонку ВЭЖХ (XBridge С-18, 3,5 мкм, 4,6×100 мм), которую элюировали смесью 25:75 ацетонитрил:буфер ТЭА с pH 7,2 со скоростью потока 2 мл/мин при контроле на длине волны 254 нм.
Конечный продукт, N-[11C]метил-2-(м-толил)имидазо[1,2-a]пиримидин-7-амин, выделяли со средним скорректированным выходом (без распада) 7,5% (n=4) через 32 минуты. Средняя удельная радиоактивность конечного продукта составляла 5534 мКи/мкмоль со средней радиохимической чистотой 95,5%.
Пример 104
N-Циклопропил-2-(4-[11C]метоксифенил)имидазо[1,2-a]пиримидин-7-амин
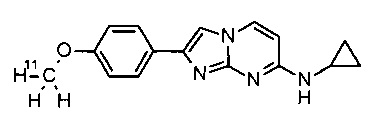
За десять минут до окончания получения [11C] двуокиси углерода, предшественник, 4-[7-(циклопропиламино)имидазо[1,2-a]пиримидин-2-ил]фенол, (1,0±0,3 мг) растворяли в 200 мкл диметилсульфоксида и добавляли твердого гидроксида натрия (0,6-1,0 мг). Йодистый метил-углерод-11 ([11C] Mel) получали из [11C]двуокиси углерода через [11C]метан в модуле General Electric FXMel. Примерно через 10 минут барботировали [11C]Ме1 через сосуд с предшественником. Когда радиоактивность достигала плато, барботирование останавливали и нагревали сосуд с предшественником при 80°C в течение 3 минут.
Реакционную смесь разбавляли 200 мкл воды для ВЭЖХ и вводили в полупрепаративную колонку ВЭЖХ (XBridge C-18, 10 мкм, 10×150 мм), которую элюировали смесью 25:75 абсолютный этанол:вода (0,1 М формиат аммония) со скоростью потока 10 мл/мин.
Эффлюент из колонки ВЭЖХ контролировали при 254 нм и детектором радиоактивности он-лайн. Продукт, который элюировался примерно на 7 минуте, собирали в 50 мл воды, содержащей примерно 250 мг аскорбиновой кислоты. После загрузки продукта на уравновешенную колонку Oasis SepPak Plus, колонку SepPak промывали 10 мл воды, содержащей примерно 50 мг аскорбиновой кислоты. Меченый продукт элюировали из колонки SepPak 1 мл абсолютного этанола, а затем 10 мл стерильного физиологического раствора через стерильный фильтр в сосуд с конечным продуктом.
Отбирали аликвоты из сосуда с конечным продуктом для анализа контроля качества. Для определения радиохимической и химической чистоты, удельной активности и химической идентичности использовали аналитическую колонку ВЭЖХ (XBridge С-18, 3,5 мкм, 4,6×100 мм), которую элюировали смесью 25:75 ацетонитрил:буфер ТЭА с pH 7,2 со скоростью потока 2 мл/мин при контроле на длине волны 254 нм.
Конечный продукт, N-циклопропил-2-(4-[11C]метоксифенил)имидазо[1,2-a]пиримидин-7-амин, выделяли со средним скорректированным выходом (без распада) 7,3% (n=4) через 33,5 минуты. Средняя удельная радиоактивность конечного продукта составляла 16870 мКи/мкмоль со средней радиохимической чистотой 97,5%.
Пример 105
2-[4-(2-[18F]Фторэтокси)фенил]-N-метил-имидазо[1,2-a]пиримидин-7-амин
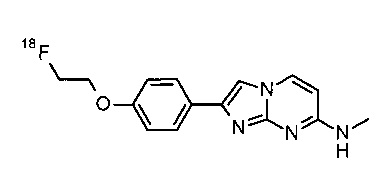
Предшественник, 2-[4-[7-(метиламино)имидазо[1,2-a]пиримидин-2-ил]фенокси]этил-4-метилбензолсульфонат (2±0,5 мг) растворяли в 400 мкл диметилсульфоксида перед окончанием облучения (ЕОВ). По окончании облучения [18F]фторид-ион в воде, полученный путем облучения протонами воды, обогащенной [18O], захватывали на ионообменной колонке. Ионообменную колонку элюировали с использованием 150 мкл исходного раствора Krytpofix 2.2.2/карбонат калия (48 мг Kryptofix 2.2.2 и 10 мг карбоната калия, растворенных в 600 мкл смеси 1:1 ацетонитрил:вода) в реакционный сосуд, затем 250 мкл ацетонитрила. Раствор фторида выпаривали досуха при 110°C потоком азота, затем сушили азеотропно путем двукратного добавления ацетонитрила (каждый раз по 250 мкл). Реакционный сосуд дистанционно переносили в микроволновую камеру (Resonance Instruments) и охлаждали сжатым воздухом в течение 2 минут. Добавляли предшественник, затем облучали микроволнами мощностью 50 ватт в течение 80 сек, затем раствор гасили 1 мл воды.
Реакционную смесь вводили в полупрепаративную колонку ВЭЖХ (XBridge С18, 10 мкм, 10×150 мм), которую элюировали смесью 30:70 метанол:буфер триэтиламин (pH 7,2) со скоростью потока 15 мл/мин.
Эффлюент из колонки ВЭЖХ контролировали при 254 нм и детектором радиоактивности он-лайн. Получали полупрепаративную хроматограмму (показана ниже) собирали пик продукта 2-[4-(2-[18F]фторэтокси)фенил]-N-метил-имидазо[1,2-a]пиримидин-7-амина в 50 мл воды, содержащей 250 мг аскорбиновой кислоты, и переформулировали с использованием автоматического модуля SPE. Раствор продукта элюировали через Waters Oasis Plus SPE, промывали 10 мл воды Milli-Q, затем элюировали 1 мл абсолютного этанола, затем 10 мл обычного солевого раствора в сосуд с конечным продуктом через стерилизующий фильтр Millipore FG 0,22 мкм.
Отбирали аликвоты из сосуда с конечным продуктом для анализа контроля качества. Для определения радиохимической и химической чистоты, удельной активности и химической идентичности использовали аналитическую колонку ВЭЖХ (XBridge C-18, 3,5 мкм, 4,6×100 мм), которую элюировали смесью 20:80 ацетонитрил:буфер ТЭА с pH 7,2 со скоростью потока 2 мл/мин при контроле на длине волны 254 нм.
В результате 40-ти минутного радиосинтеза получали конечный продукт 2-[4-(2-[18F]фторэтокси)фенил]-N-метил-имидазо[1,2-a]пиримидин-7-амин, имеющий 145 мКи, со скорректированным выходом (без распада), 12,5% (n=1). Конечный продукт имел удельную радиоактивность 49,751 мКи/мкмоль и радиохимическую чистоту 96%.
Пример 106
7-(4-Фторпиперидин-1-ил)-2-(пиразин-2-ил)имидазо[1,2-a]пиримидин
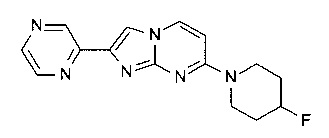
Продукт получали из исходных веществ 4-(4-фторпиперидин-1-ил)пиримидин-2-амина и гидробромида 2-бром-1-(пиразин-2-ил)этанона вместо 1-(бензо[d]тиазол-2-ил)-2-бромэтанона в соответствии со способом, описанным в примере 79, в виде светло-желтого твердого вещества (25 мг, 31%). MS: m/z = 299,5 (M+H)+
Пример 107
Аддукт [4-[7-(Метиламино)имидазо[1,2-a]пиримидин-2-ил]фенил]метанола с уксусной кислотой
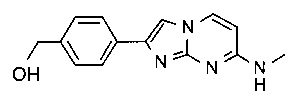
К раствору метилового эфира 4-(7-метиламино-имидазо[1,2-a]пиримидин-2-ил)-бензойной кислоты (100 мг, 0,35 ммоль, пример 136) в ТГФ (5 мл) добавляли гидрид диизобутилалюминия (2М раствор в толуоле; 0,35 мл, 0,708 ммоль) при 0°C, и реакционную смесь перемешивали при 25°C в течение 1 ч. К этой смеси снова добавляли гидрид диизобутилалюминия (2М раствор в толуоле; 0,885 мл, 1,77 ммоль) при 0°C, и смесь перемешивали при 25°C в течение 30 мин. Смесь гасили насыщенным водным раствором NH4Cl, растворитель выпаривали в вакууме. Сырой продукт экстрагировали 30% MeOH в дихлорметане. Органический слой промывали солевым раствором (20 мл), сушили над безводным Na2SO4, фильтровали, и выпаривали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с получением продукта в виде белой липкой жидкости (30 мг, 33%). MS: m/z = 254,8 (M+H)+
Пример 108
2-(3-Фтор-4-метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
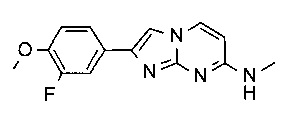
Продукт получали из исходных веществ N4-метилпиримидин-2,4-диамина и 2-бром-1-(3-фтор-4-метоксифенил)этанона вместо 2-бром-1-фенилэтанона в соответствии со способом, описанным в примере 1, стадия 2 в виде белого твердого вещества (65 мг, 45%). MS: m/z = 273,1 (M+H)+
Пример 109
N-(4-(7-(Метиламино)имидазо[1,2-a]пиримидин-2-ил)фенил)ацетамид
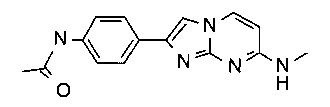
Продукт получали из исходных веществ N-4-метилпиримидин-2,4-диамина и N-(4-(2-бромацетил)фенил)ацетамида вместо 2-бром-1-фенилэтанона в соответствии со способом, описанным в примере 1, стадия 2, в виде белого твердого вещества (70 мг, 48%). MS: m/z = 282,1 (M+H)+
Пример 110
5-(7-(Метиламино)имидазо[1,2-a]пиримидин-2-ил)индолин-2-он

Продукт получали из исходных веществ N-4-метилпиримидин-2,4-диамина и 5-(2-бромацетил)индолин-2-она вместо 2-бром-1-фенилэтанона в соответствии со способом, описанным в примере 1, стадия 2, в виде светло-коричневого твердого вещества (137 мг, 93%). MS: m/z = 280,1 (M+H)+
Пример 111
7-(Азетидин-1-ил)-2-(4-(2-фторэтокси)фенил)имидазо[1,2-a]пиримидин
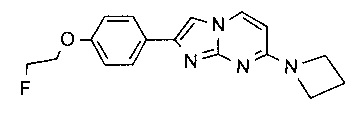
Стадия 1) 4-[7-(Азетидин-1-ил)имидазо[1,2-а]пиримидин-2-ил]фенол
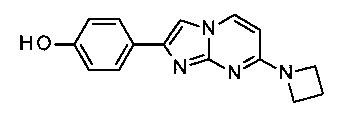
Продукт получали из исходных веществ 4-(азетидин-1-ил)пиримидин-2-амина и 2-бром-1-(4-гидроксифенил)этанона вместо 2-бром-1-(4-метоксифенил)этанона в соответствии со способом, описанным в примере 69, стадия 2, в виде светло-желтого твердого вещества (302 мг, 77%). MS: m/z = 267,4 (M+H)+
Стадия 2) 7-(Азетидин-1-ил)-2-(4-(2-фторэтокси)фенил)имидазо[1,2-а]пиримидин

Продукт получали из исходных веществ 4-[7-(азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]фенола вместо 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и 1-бром-2-фторэтана в соответствии со способом, описанным в примере 16, стадия 3, в виде светло-коричневого твердого вещества (73 мг, 50%). MS: m/z = 313,6 (M+H)+
Пример 112
7-(Азетидин-1-ил)-2-(4-(3-фторпропокси)фенил)имидазо[1,2-a]пиримидин
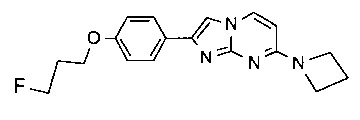
Продукт получали из исходных веществ 4-[7-(азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]фенола вместо 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и 1-фтор-3-иодпропана вместо 1-бром-2-фторэтана в соответствии со способом, описанным в примере 16, стадия 3, в виде не совсем белого твердого вещества (18 мг, 10%). MS: m/z = 327,6 (M+H)+
Пример 113
7-(Азетидин-1-ил)-2-(3-метоксифенил)имидазо[1,2-a]пиримидин
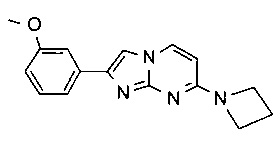
Продукт получали из исходных веществ 4-(азетидин-1-ил)пиримидин-2-амина и 2-бром-1-(3-метоксифенил)этанона вместо 2-бром-1-(4-метоксифенил)этанона в соответствии со способом, описанным в примере 69, стадия 2, в виде не совсем белого твердого вещества (18 мг, 15%). MS: m/z = 281,6 (M+H)+
Пример 114
Аддукт [3-[7-(Метиламино)имидазо[1,2-a]пиримидин-2-ил]фенил]метанола с уксусной кислотой
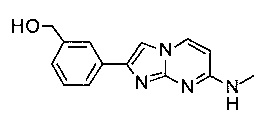
Стадия 1) Метил 3-[7-(метиламино)имидазо[1,2-а]пиримидин-2-ил]бензоат
Продукт получали в соответствии со способом, описанным в примере 136, из исходных веществ N-4-метилпиримидин-2,4-диамина (200 мг, 1,63 ммоль, пример 1, стадия 1) и метилового эфира 3-(2-бром-ацетил)-бензойной кислоты (1,5 г, 6,04 ммоль) в виде белого твердого вещества (135 мг, 12%). MS: m/z = 283,0 (M+H)+
Стадия 2) Аддукт [3-[7-(Метиламино)имидазо[1,2-а]пиримидин-2-ил]фенил]метанола с уксусной кислотой
Продукт получали в соответствии со способом, описанным в примере 107, из исходного вещества метил-3-[7-(метиламино)имидазо[1,2-a]пиримидин-2-ил]бензоата (135 мг, 0,478 ммоль) в виде коричневого твердого вещества (45 мг, 37%). MS: m/z = 254,8 (M+H)+
Пример 115
7-(Азетидин-1-ил)-2-(3-(2-фторэтокси)фенил)имидазо[1,2-a]пиримидин
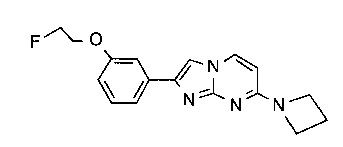
Стадия 1) 3-[7-(Азетидин-1-ил)имидазо[1,2-а]пиримидин-2-ил]фенол
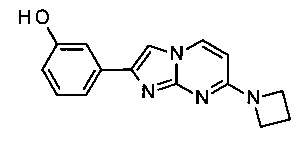
Продукт получали из исходных веществ 4-(азетидин-1-ил)пиримидин-2-амина и 2-бром-1-(3-гидроксифенил)этанона вместо 2-бром-1-(4-метоксифенил)этанона в соответствии со способом, описанным в примере 69, стадия 2, в виде не совсем белого твердого вещества (445 мг, 67%). MS: m/z = 267,5 (M+H)+
Стадия 2) 7-(Азетидин-1-ил)-2-(3-(2-фторэтокси)фенил)имидазо[1,2-a]пиримидин
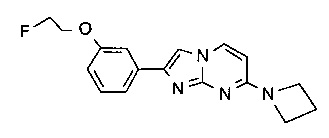
Продукт получали из исходных веществ 3-[7-(азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил]фенола вместо 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и 1-бром-2-фторэтана в соответствии со способом, описанным в примере 16, стадия 3, в виде светло-желтого твердого вещества (76 мг, 58%). MS: m/z = 313,6 (M+H)+
Пример 116
N-Циклопропил-N-(2-фторэтил)-2-(4-метоксифенил)имидазо[1,2-a]пиримидин-7-амин
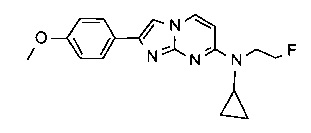
В круглодонной колбе на 25 мл растворяли N-циклопропил-2-(4-метоксифенил)имидазо[1,2-a]пиримидин-7-амин (0,095 г, 305 мкмоль, Пример 76) в 2,0 мл ДМФ. Добавляли 60% дисперсию в минеральном масле гидрида натрия (24 мг, 550 мкмоль) и перемешивали реакционную смесь при комнатной температуре в течение 45 мин. Затем добавляли 1-бром-2-фторэтан (47,6 мг, 28 мкл, 375 мкмоль) и перемешивали реакционную смесь при комнатной температуре в течение ночи.
Затем дополнительно добавляли 60% дисперсию в минеральном масле гидрида натрия (24 мг, 550 мкмоль) и перемешивали реакционную смесь при комнатной температуре в течение 30 мин. Затем добавляли 1-бром-2-фторэтан (47,6 мг, 28 мкл, 375 мкмоль) и перемешивали реакционную смесь при комнатной температуре в течение 3 ч. Реакционную смесь гасили водой и экстрагировали этилацетатом. Водный слой опять экстрагировали этилацетатом. Органические слои промывали два раза водой и один раз солевым раствором. Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Очистка флэш-хроматографией (дихлорметан: метанол = 100: 0 до 95: 5) давала указанное в заголовке соединение (41 мг, 39%) в виде светло-желтого твердого вещества. MS: m/z = 327,5 (M+H)+
Пример 117
2-(3-Метоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
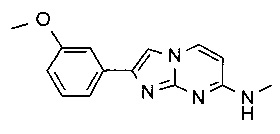
Продукт получали из исходных веществ N-4-метилпиримидин-2,4-диамина и 2-бром-1-(3-метоксифенил)этанона вместо 2-бром-1-фенилэтанона в соответствии со способом, описанным в примере 1, стадия 2, в виде белого твердого вещества (93 мг, 73%). MS: m/z = 255,6 (M+H)+
Пример 118
7-(Азетидин-1-ил)-2-(3-(фторметокси)фенил)имидазо[1,2-a]пиримидин
Продукт получали из исходных веществ 3-(7-(азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и фторметил-4-метилбензолсульфоната в соответствии со способом, описанным в примере 29, в виде желтого твердого вещества (34 мг, 19%). MS: m/z = 299,6 (M+H)+
Пример 119
7-(Азетидин-1-ил)-2-(4-фторфенил)имидазо[1,2-a]пиримидин
Продукт получали из исходного вещества 4-(азетидин-1-ил)пиримидин-2-амина и 2-бром-1-(4-фторфенил)этанона вместо 2-бром-1-(4-метоксифенил)этанона в соответствии со способом, описанным в примере 69, стадия 2, в виде желтоватого твердого вещества (61 мг, 54%). MS: m/z = 269,5 (M+H)+
Пример 120
7-(Азетидин-1-ил)-2-(3-фторфенил)имидазо[1,2-a]пиримидин
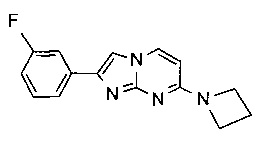
Продукт получали из исходных веществ 4-(азетидин-1-ил)пиримидин-2-амина и 2-бром-1-(3-фторфенил)этанона вместо 2-бром-1-(4-метоксифенил)этанона в соответствии со способом, описанным в примере 69, стадия 2, в виде светло-желтого твердого вещества (58 мг, 58%). MS: m/z = 269,5 (M+H)+
Пример 121
7-(Азетидин-1-ил)-2-(3,5-диметоксифенил)имидазо[1,2-a]пиримидин
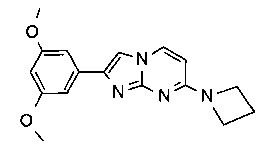
Продукт получали из исходных веществ 4-(азетидин-1-ил)пиримидин-2-амина и 2-бром-1-(3,5-диметоксифенил)этанона вместо 2-бром-1-(4-метоксифенил)этанона в соответствии со способом, описанным в примере 69, стадия 2, в виде белого твердого вещества (55 мг, 46%). MS: m/z = 311,5 (M+H)+
Пример 122
4-(7-(Метиламино)имидазо[1,2-a]пиримидин-2-ил)фенол
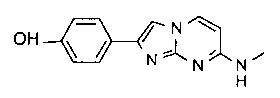
Продукт получали из исходных веществ N-4-метилпиримидин-2,4-диамина и 2-бром-1-(4-гидроксифенил)этанона вместо 2-бром-1-фенилэтанона в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (647 мг, 91%). MS: m/z = 241,6 (M+H)+
Пример 123
2-(4-(2-Фторэтокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
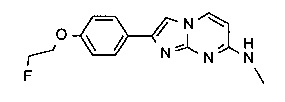
Продукт получали из исходного вещества 4-(7-(метиламино)имидазо[1,2-a]пиримидин-2-ил)фенола вместо 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и 1-бром-2-фторэтана в соответствии со способом, описанным в примере 16, стадия 3, в виде желтого твердого вещества (75 мг, 43%). MS: m/z = 287,6 (M+H)+
Пример 124
2-(4-(3-Фторпропокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
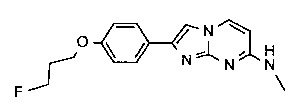
Продукт получали из исходного вещества 4-(7-(метиламино)имидазо[1,2-a]пиримидин-2-ил)фенола вместо 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и 1-фтор-3-иодпропана вместо 1-бром-2-фторэтана в соответствии со способом, описанным в примере 16, стадия 3, в виде светло-желтого твердого вещества (73 мг, 42%). MS: m/z = 301,6 (M+H)+
Пример 125
3-(7-(Метиламино)имидазо[1,2-a]пиримидин-2-ил)фенол
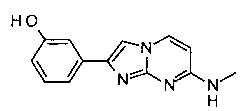
Продукт получали из исходных веществ N4-метилпиримидин-2,4-диамина и 2-бром-1-(3-гидроксифенил)этанона вместо 2-бром-1-фенилэтанона в соответствии со способом, описанным в примере 1, стадия 2, в виде желтого твердого вещества (185 мг, 59%). MS: m/z = 241,6 (M+H)+
Пример 126
7-(Азетидин-1-ил)-2-(3-(метилтио)фенил)имидазо[1,2-a]пиримидин
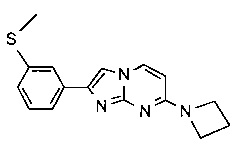
Продукт получали из исходных веществ 4-(азетидин-1-ил)пиримидин-2-амина и 2-бром-1-(3-(метилтио)фенил)этанона вместо 2-бром-1-(4-метоксифенил)этанона в соответствии со способом, описанным в примере 69, стадия 2, в виде не совсем белого твердого вещества (53 мг, 44%). MS: m/z = 297,5 (M+H)+
Пример 127
7-(Азетидин-1-ил)-2-(3-метокси-4-метилфенил)имидазо[1,2-a]пиримидин
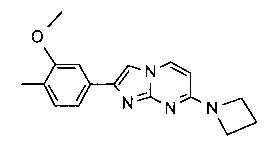
Продукт получали из исходных веществ 4-(азетидин-1-ил)пиримидин-2-амина и 2-бром-1-(3-метокси-4-метилфенил)этанона вместо 2-бром-1-(4-метоксифенил)этанона в соответствии со способом, описанным в примере 69, стадия 2, в виде не совсем белого твердого вещества (6 мг, 5%). MS: m/z = 295,5 (M+H)+
Пример 128
7-(Азетидин-1-ил)-2-(3,4-диметоксифенил)имидазо[1,2-a]пиримидин
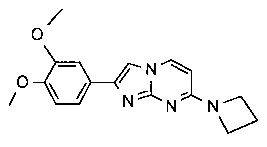
Продукт получали из исходных веществ 4-(азетидин-1-ил)пиримидин-2-амина и 2-бром-1-(3,4-диметоксифенил)этанона вместо 2-бром-1-(4-метоксифенил)этанона в соответствии со способом, описанным в примере 69, стадия 2, в виде не совсем белого твердого вещества (21 мг, 18%). MS: m/z = 311,5 (M+H)+
Пример 129
2-(3-(2-Фторэтокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
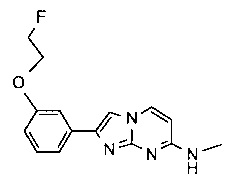
Продукт получали из исходного вещества 3-(7-(метиламино)имидазо[1,2-a]пиримидин-2-ил)фенола вместо 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и 1-бром-2-фторэтана в соответствии со способом, описанным в примере 16, стадия 3, в виде не совсем белого твердого вещества (23 мг, 18%). MS: m/z = 287,6 (M+H)+
Пример 130
2-(3-(3-Фторпропокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
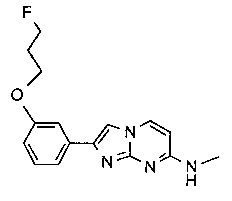
Продукт получали из исходных веществ 3-(7-(метиламино)имидазо[1,2-a]пиримидин-2-ил)фенола вместо 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и 1-фтор-3-иодпропана вместо 1-бром-2-фторэтана в соответствии со способом, описанным в примере 16, стадия 3, в виде белого твердого вещества (29 мг, 21%). MS: m/z = 301,6 (M+H)+
Пример 131
2-(3-(Фторметокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
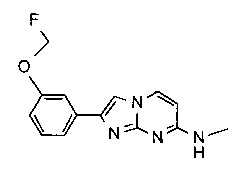
Продукт получали из исходного вещества 3-(7-(метиламино)имидазо[1,2-a]пиримидин-2-ил)фенола вместо 3-(7-(азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и фторметил-4-метилбензолсульфоната в соответствии со способом, описанным в примере 29, в виде белого твердого вещества (61 мг, 34%). MS: m/z = 273,5 (M+H)+
Пример 132
2-(4-(Фторметокси)фенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
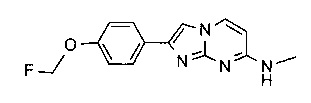
Продукт получали из исходного вещества 4-(7-(метиламино)имидазо[1,2-a]пиримидин-2-ил)фенола вместо 3-(7-(азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и фторметил-4-метилбензолсульфоната в соответствии со способом, описанным в примере 29, в виде белого твердого вещества (36 мг, 20%). MS: m/z = 273,5 (M+H)+
Пример 133
3-(7-(Циклопропиламино)имидазо[1,2-a]пиримидин-2-ил)фенол
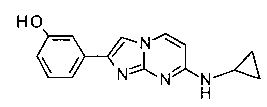
Продукт получали из исходных веществ N4-циклопропилпиримидин-2,4-диамина вместо 4-(азетидин-1-ил)пиримидин-2-амина и 2-бром-1-(3-гидроксифенил)этанона вместо 2-бром-1-(4-метоксифенил)этанона в соответствии со способом, описанным в примере 69, стадия 2, в виде светло-желтого твердого вещества (594 мг, 98%). MS: m/z = 267,6 (M+H)+
Пример 134
N-Циклопропил-2-(3-(2-фторэтокси)фенил)имидазо[1,2-a]пиримидин-7-амин
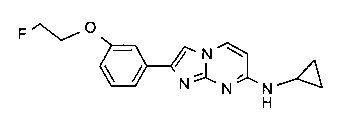
Продукт получали из исходного вещества 3-(7-(циклопропиламино)имидазо[1,2-a]пиримидин-2-ил)фенола вместо 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и 1-бром-2-фторэтана в соответствии со способом, описанным в примере 16, стадия 3, в виде не совсем белого твердого вещества (43 мг, 29%). MS: m/z = 313,6 (M+H)+
Пример 135
Аддукт [4-[7-(диметиламино)имидазо[1,2-a]пиримидин-2-ил]фенил]метанола с уксусной кислотой
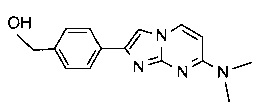
Стадия 1) Метил 4-[7-(диметиламино)имидазо[1,2-а]пиримидин-2-ил]бензоат
Продукт получали в соответствии со способом, описанным в примере 136, из исходных веществ N4,N4-диметилпиримидин-2,4-диамина (500 мг, 3,62 ммоль, пример 18, стадия 1) и метилового эфира 4-(2-бромацетил)-бензойной кислоты (1,4 г, 5,44 ммоль) в виде желтого твердого вещества (270 мг, 25%). MS: m/z = 297,0 (M+H)+
Стадия 2) Аддукт [4-[7-(диметиламино)имидазо[1,2-а]пиримидин-2-ил]фенил]метанола с уксусной кислотой
Продукт получали в соответствии со способом, описанным в примере 107, из исходного вещества метил-4-[7-(диметиламино)имидазо[1,2-a]пиримидин-2-ил]бензоата (100 мг, 0,337 ммоль) в виде желтого липкого твердого вещества (50 мг, 55%). MS: m/z = 268,8 (M+H)+
Пример 136
Метил 4-[7-(метиламино)имидазо[1,2-a]пиримидин-2-ил]бензоат
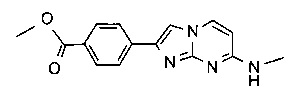
К раствору N-4-метилпиримидин-2,4-диамина (250 мг, 2,01 ммоль, пример 1, стадия 1) в ацетоне (10 мл) добавляли метиловый эфир 4-(2-бром-ацетил)-бензойной кислоты (780 мг, 3,021 ммоль) и реакционную смесь оставляли перемешиваться в течение 30 мин при 25°C. К этой смеси добавляли п-толуолсульфоновую кислоту (каталитическое количество) и реакционную смесь кипятили в течение 8 ч. Все летучие вещества удаляли при пониженном давлении, полученный сырой продукт гасили насыщенным водным раствором NaHCO3 и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и выпаривали в вакууме. Полученный сырой продукт очищали флэш-хроматографией (с использованием аминосиликагеля и 90% этилацетат в гексане) с получением продукта в виде не совсем белого твердого вещества (100 мг, 18%). MS: m/z = 283,0 (M+H)+
Пример 137
N-Циклопропил-2-(3-(фторметокси)фенил)имидазо[1,2-a]пиримидин-7-амин
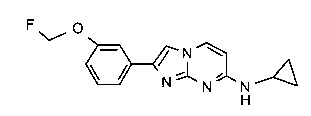
Продукт получали из исходного вещества 3-(7-(циклопропиламино)имидазо[1,2-a]пиримидин-2-ил)фенола вместо 3-(7-(азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и фторметил-4-метилбензолсульфоната в соответствии со способом, описанным в примере 29, в виде не совсем белого твердого вещества (49 мг, 33%). MS: m/z = 299,6 (M+H)+
Пример 138
N-Циклопропил-2-(4-(2-фторэтокси)фенил)имидазо[1,2-a]пиримидин-7-амин
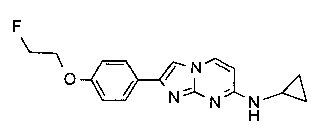
Продукт получали из исходного вещества 4-(7-(циклопропиламино)имидазо[1,2-a]пиримидин-2-ил)фенола гидробромида вместо 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и 1-бром-2-фторэтана в соответствии со способом, описанным в примере 16, стадия 3, в виде светло-желтого твердого вещества (28 мг, 22%). MS: m/z = 313,6 (M+H)+
Пример 139
N-Циклопропил-2-(4-(3-фторпропокси)фенил)имидазо[1,2-a]пиримидин-7-амин
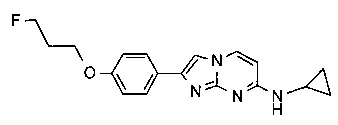
Продукт получали из исходных веществ 4-(7-(циклопропиламино)имидазо[1,2-a]пиримидин-2-ил)фенола гидробромида вместо 3-(7-(пирролидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и 1-фтор-3-иодпропана вместо 1-бром-2-фторэтана в соответствии со способом, описанным в примере 16, стадия 3, в виде белого твердого вещества (67 мг, 50%). MS: m/z = 327,6 (M+H)+
Пример 140
N-Циклопропил-2-(4-(фторметокси)фенил)имидазо[1,2-a]пиримидин-7-амин
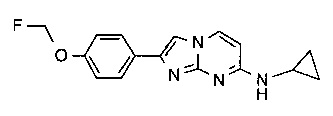
Продукт получали из исходных веществ 4-(7-(циклопропиламино)имидазо[1,2-a]пиримидин-2-ил)фенола вместо 3-(7-(азетидин-1-ил)имидазо[1,2-a]пиримидин-2-ил)фенола и фторметил-4-метилбензолсульфоната в соответствии со способом, описанным в примере 29, в виде желтого твердого вещества (52 мг, 46%). MS: m/z = 299,6 (M+H)+
Пример 141
N-Метил-2-(4-(метилтио)фенил)имидазо[1,2-a]пиримидин-7-амин
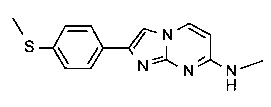
Продукт получали из исходных веществ N4-метилпиримидин-2,4-диамина и 2-бром-1-(4-(метилтио)фенил)этанона вместо 2-бром-1-фенилэтанона в соответствии со способом, описанным в примере 1, стадия 2, в виде не совсем белого твердого вещества (14 мг, 12%). MS: m/z = 271,5 (M+H)+
Пример 142
2-(3,4-Диметоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
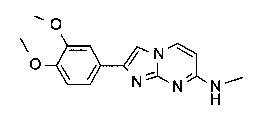
Продукт получали из исходных веществ N-4-метилпиримидин-2,4-диамина и 2-бром-1-(3,4-диметоксифенил)этанона вместо 2-бром-1-фенилэтанона в соответствии со способом, описанным в примере 1, стадия 2, в виде не совсем белого твердого вещества (20 мг, 18%). MS: m/z = 285,5 (M+H)+
Пример 143
2-(3-Метокси-4-метилфенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
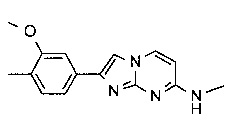
Продукт получали из исходных веществ N-4-метилпиримидин-2,4-диамина и 2-бром-1-(3-метокси-4-метилфенил)этанона вместо 2-бром-1-фенилэтанона в соответствии со способом, описанным в примере 1, стадия 2, в виде не совсем белого твердого вещества (43 мг, 39%). MS: m/z = 269,5 (M+H)+
Пример 144
2-(3,5-Диметоксифенил)-N-метилимидазо[1,2-a]пиримидин-7-амин
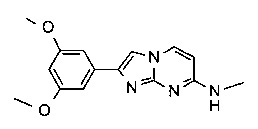
Продукт получали из исходных веществ N-4-метилпиримидин-2,4-диамина и 2-бром-1-(3,5-диметоксифенил)этанона вместо 2-бром-1-фенилэтанона в соответствии со способом, описанным в примере 1, стадия 2, в виде не совсем белого твердого вещества (33 мг, 30%). MS: m/z = 285,5 (M+H)+
![2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ](https://fips.edrid.ru/images/rid/c2/39/55/6bc19fc63d81dc5e4caf611de3c436c6.jpg)
![2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ](https://fips.edrid.ru/images/rid/c2/39/55/b8da4792adf37ebdaa7d140354e4d149.jpg)
![2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ](https://fips.edrid.ru/images/rid/c2/39/55/457202491e23202fd0ab6e95606cf2d3.jpg)
![2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ](https://fips.edrid.ru/images/rid/c2/39/55/507156192bb95662c96097966c80a65c.jpg)
![2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ](https://fips.edrid.ru/images/rid/c2/39/55/3aa96a64f654cf53e79d4d0637ec9319.jpg)
![2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ](https://fips.edrid.ru/images/rid/c2/39/55/38f59fce3578974e139d11431e7b1c53.jpg)
![2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ](https://fips.edrid.ru/images/rid/c2/39/55/bb13253d7a513d77b7ee9df796ac3bb3.jpg)
![2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ](https://fips.edrid.ru/images/rid/c2/39/55/5deda7a7d45fcf4bf54f855dab160bb3.jpg)
![2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ](https://fips.edrid.ru/images/rid/c2/39/55/f63ce286b4bdf0228802087b86e405c6.jpg)
![2-ФЕНИЛИМИДАЗО[1,2-А]ПИРИМИДИНЫ В КАЧЕСТВЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ](https://fips.edrid.ru/images/rid/c2/39/55/65c8f095dc9cc5b2225f051473fee7e6.jpg)

