Результат интеллектуальной деятельности: СПОСОБ ПРОФИЛАКТИКИ АТОПИЧЕСКОГО ДЕРМАТИТА У МЛАДЕНЦЕВ ПУТЕМ МОДУЛЯЦИИ МИКРОБНОГО МЕХАНИЗМА ГИСТАМИНООБРАЗОВАНИЯ
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к педиатрии, дерматологии и аллергологии, и может быть использовано для профилактики атопического дерматита у младенцев.
На современном этапе аллергическая патология занимает первое место среди наиболее распространенных хронических заболеваний в детском возрасте. Первым проявлением аллергии у детей раннего возраста чаще всего является атопический дерматит, который вызывает особую обеспокоенность в связи с ростом заболеваемости у детей первых месяцев жизни и торпидным течением на фоне проводимой терапии.
В связи с этим становится очевидной важность профилактики аллергических заболеваний в раннем детском возрасте, когда ребенок особенно уязвим. Поскольку до появления первых симптомов невозможно достоверно сказать, кто из детей будет страдать от аллергических заболеваний, профилактика направлена, прежде всего, на детей из так называемой группы риска. К этой группе относятся дети с отягощенным семейным анамнезом по аллергическим заболеваниям.
Манифестация атопического дерматита, как правило, происходит из-за нарушения формирования иммунной системы слизистой оболочки тонкой кишки, иммунологической толерантности на антигенную нагрузку в первые месяцы жизни. Основным фактором, влияющим на становление и постнатальное развитие иммунной системы кишечника, является состав кишечной микробиоты. Доказано, что количественные и качественные изменения кишечной микробиоты предшествуют появлению клинических симптомов аллергии. В связи с этим представляет интерес профилактика аллергических заболеваний с помощью модификации кишечной микробиоты посредством приема пробиотиков и/или пребиотиков.
Уровень техники.
Известно достаточно способов профилактики аллергии у детей с использованием пробиотиков.
 et al. показали эффективность Lactobacillus GG у детей группы риска в профилактике атопических болезней, включая атопический дерматит. Показано, что назначение Lactobacillus GG матерям в период беременности и лактации снижает у детей частоту атопического дерматита [1].
et al. показали эффективность Lactobacillus GG у детей группы риска в профилактике атопических болезней, включая атопический дерматит. Показано, что назначение Lactobacillus GG матерям в период беременности и лактации снижает у детей частоту атопического дерматита [1].
В исследованиях японских ученых была доказана эффективность пренатального и постнатального приема бифидобактерий в качестве первичной профилактики аллергических заболеваний. Беременным женщинам за 1 мес до родов и их детям в течение первых 6 мес жизни назначались пробиотики, содержащие Bifidobacterium breve M-16 V и Bifidobacterium longum BB536. У детей, принимавших пробиотики риск развития атопического дерматита значительно уменьшался [2].
Шведские исследователи показали, что прием беременными женщинами пробиотиков вплоть до родов может влиять на состав микрофлоры кишечника младенца [3].
Назначение пробиотиков L. rhamnosus GG и B. lactis BB-12 в двойном слепом плацебо-контролируемом исследовании матерей и детей с высоким риском атопии было установлено, применение пробиотиков на 70% снижало риск развития атопического дерматита у ребенка в течение первых 2 лет жизни по сравнению с группой плацебо [4].
Организацией, которая рекомендует применение пробиотиков во время беременности, является Всемирная аллергологическая организация (WAO), которая рекомендует применение пробиотиков для профилактики развития атопического дерматита у беременных женщин, дети которых входят в группу риска по развитию аллергопатологии.
Применение пробиотиков при беременности и грудном вскармливании включено в Рекомендации по ведению пациентов с атопическим дерматитом, разработанные Американской академией дерматологии, и имеет самый высокий уровень доказательности [5].
В согласительном документе Всемирной гастроэнтерологической организации говорится о том, что на сегодняшний день самая качественная доказательная база существует в отношении снижения риска развития атопического дерматита при применении определенных штаммов пробиотиков у беременных матерей и новорожденных детей до возраста 6 месяцев [6].
Однако другие исследования не подтверждают положительного эффекта от назначения пробиотиков для профилактики аллергопатологии. В исследовании Karla Gale (2010) 415 беременных женщин, получивших пробиотическое молоко или плацебо в срок с 36 недель беременности до трех месяцев постнатального периода кормления грудью не было выявлено достоверной разницы между группами сравнения [7].
Согласительный документ по пищевой аллергии и анафилаксии Европейской академии аллергологии и клинической иммунологии (EAACI) не рекомендует женщинам изменять свою диету во время беременности или принимать пробиотики с целью предотвращения развития пищевой аллергии у детей [8].
В исследовании, проведенном с участием 250 беременных женщин, имевших высокий риск развития аллергических заболеваний у их детей, беременные принимали LGG только в период с 36-й недели беременности до родов и по результатам исследования не было выявлено достоверного снижения риска развития атопического дерматита у детей в возрасте до года [9]. M.V. Kopp и соавторы в своем исследовании, включившем 105 беременных женщин, также показали, что прием пробиотиков LGG с 36-й недели беременности не оказывает профилактического воздействия на развитие и тяжесть течения атопического дерматита у детей в возрасте до 2 лет [10].
Большое исследование, проведенное в Новой Зеландии с участием 474 беременных женщин, получавших Lactobacillus rhamnosus HN001, Bifidobacterium animalis subsp lactis HN019 или плацебо. Препарат получали женщины в течение месяца до родов и затем 6 месяцев на фоне лактации, кроме того, препарат давали непосредственно детям с рождения до 2 лет. В группе пациентов, принимавших L. rhamnosus, заболеваемость атопическим дерматитом снизилась на 50%, в то время как в группе детей, получавших бифидобактерии, снижения заболеваемости не отмечено [11].
Авторы этого исследования подчеркивают важность используемого штамма: прием не любого пробиотика показывает эффективность.
Все эти способы не учитывают, что некоторые штаммы лактобацилл содержат гистаминазы - диаминоксидазы, метаболизирующие гистамин, основной медиатор воспаления и аллергии. В большом количестве гистамин может синтезироваться в желудочно-кишечном тракте при участии кишечной микробиоты. Увеличение количества микроорганизмов с высокой способностью к гистаминообразованию, негативно отражается на течении аллергических процессов.
Рубальским Е.О. с соавторами были разработаны пробиотические композиции на основе штаммов L. helveticus JCH, L. helveticus NKJC и L. casei KAA, применение которых у Macaca mulatta позволило полностью элиминировать или значительно снизить титр бактерий, способных к синтезу гистамина [12].
Исследования по экспериментальному применению пробиотических штаммов лактобацилл с учетом их диаминооксидазной активности показали эффективность для коррекции нарушений микробиоты и нормализации содержания гистамина в слюне у лиц групп риска по круглогодичному аллергическому риниту [13].
Однако в литературе отсутствуют сведения о влиянии превентивной коррекции микроэкологических нарушений кишечной микробиоты на модуляцию содержания пула гистамина и снижение риска аллергопатологии в системе «мать-плод-новорожденный».
В качестве ближайшего аналога заявляемого изобретения избран способ пренатальной профилактики риска развития атопического дерматита у детей при применении пробиотика IRID-BL, в котором показано, что пренатальное применение пробиотика, содержащего Bifidobacterium longum 7х и Propionibacterium avidum l, Lactobacillus acidophilus, Lactobacillus bulgaricus, Streptococcus thermophilus 108, 66-1413, Streptococcus diacetilactis 13c 65-64 снижает частоту развития атопического дерматита у детей из группы риска [14].
Предлагаемый нами способ профилактики атопического дерматита имеет следующие отличия: перинатальная коррекция состава кишечной микробиоты применением композиции из лактобактерий, содержащей штамм с определенной диаминооксидазной активностью и препарата интерферона, эффективно способствует снижению видового состава и количественного содержания кишечных микроорганизмов с высокой гистидиндекарбоксилазной активностью, позитивно влияя на пул свободного гистамина, снижает частоту и сроки манифестации атопического дерматита.
Новизна исследования - впервые показана целесообразность и установлена эффективность перинатальной коррекции с использованием пробиотической композиции, содержащей в своем составе штамм лактобактерий с диаминооксидазной активностью, физиологически снижающей пул гистамина у новорожденных детей группы риска для первичной профилактики аллергопатологии.
Раскрытие сущности изобретения. Перинатальная иммунобиокоррекция с включением штаммов лактобактерий с диаминооксидазной активностью, уменьшая видовой состав и количественное содержание кишечных микроорганизмов с высокой гистидиндекарбоксилазной активностью, повышает уровень колонизационной резистентности кишечника, эффективно снижает частоту развития и степень выраженности кожного аллергического процесса в первый год жизни.
Осуществление изобретения. Беременной женщине на сроке 35-36 недель гестации назначается курс пробиотика, содержащего штамм лактобактерий с определенной диаминооксидазной активностью (L. acidophilus NK-1) и препарат интерферона ректально, ее новорожденному ребенку - курс пробиотика, содержащего Lactobacillus rhamnosus GG и препарат интерферона ректально, что способствует снижению видового состава и количественного содержания кишечных микроорганизмов с высокой гистидиндекарбоксилазной активностью, позитивно влияя на пул свободного гистамина и снижает частоту и сроки манифестации атопического дерматита.
У женщин использовали мультипробиотический комплекс, разрешенный к применению во время беременности, содержащий композиции на основе консорциума штаммов лактобактерий (L. acidophilus, L. acidophilus NK-1 с определенной диаминооксидазной активностью, L. plantarum, L. casei) и бифидобактерий (В. bifidum, В. longum, В. adolescentis), инулин, олигофруктозу, витамины и минеральные вещества курсом 14 дней по 1 капсуле 3 раза в день во время еды в сочетании с препаратом, содержащим интерферон альфа-2b и антиоксидант, разрешенный к применению с 14 недель беременности по 1 суппозиторию ректально 2 раза в сутки 10 дней с учетом преморбидного фона (патология соматической и репродуктивной систем) и осложненного течения беременности.
У новорожденных детей использовали препарат, разрешенный к применению с рождения, содержащий штаммы Lactobacillus rhamnosus GG (1×109) КОЕ/сашет, абсолютно безопасные для организма человека и пребиотик-фруктоолигосахариды, назначаемый по 1 саше в день 14 дней тоже в сочетании с препаратом интерферона альфа-2b и антиоксидантом по 1 суппозиторию ректально 2 раза в сутки 5 дней. Оценка эффективности корригирующей терапии проводилась суммарно по клинико-микробиологическим данным.
Было проведено клинико-микробиологическое обследование 70 пар «мать-дитя» с высоким риском развития аллергопатологии у детей. В зависимости от вида превентивной коррекции пары были разделены на три группы, репрезентативные по степени выраженности микроэкологических нарушений кишечника: основная группа (n=24) которых получила перинатальную профилактику, группа сравнения (n=28) - постнатальную, группа контроля (n=18) - не получившие по разным причинам биокоррекции.
Статистическая обработка полученных результатов проводилась на основании общепринятых методов вариационной статистики с помощью операционной системы Windows-8, программного комплекса Excel-2010 и Statistika 6.0. Определяемые величины: средняя арифметическая (М); ошибка средней арифметической (m), х2 Пирсона, угловой критерий Фишера, отношение шансов, доверительный интервал, анализ ранговой корреляции по Spearman, G-критерий знаков. Достоверными считались результаты, соответствовавшие уровню значимости (р) не более 0,05.
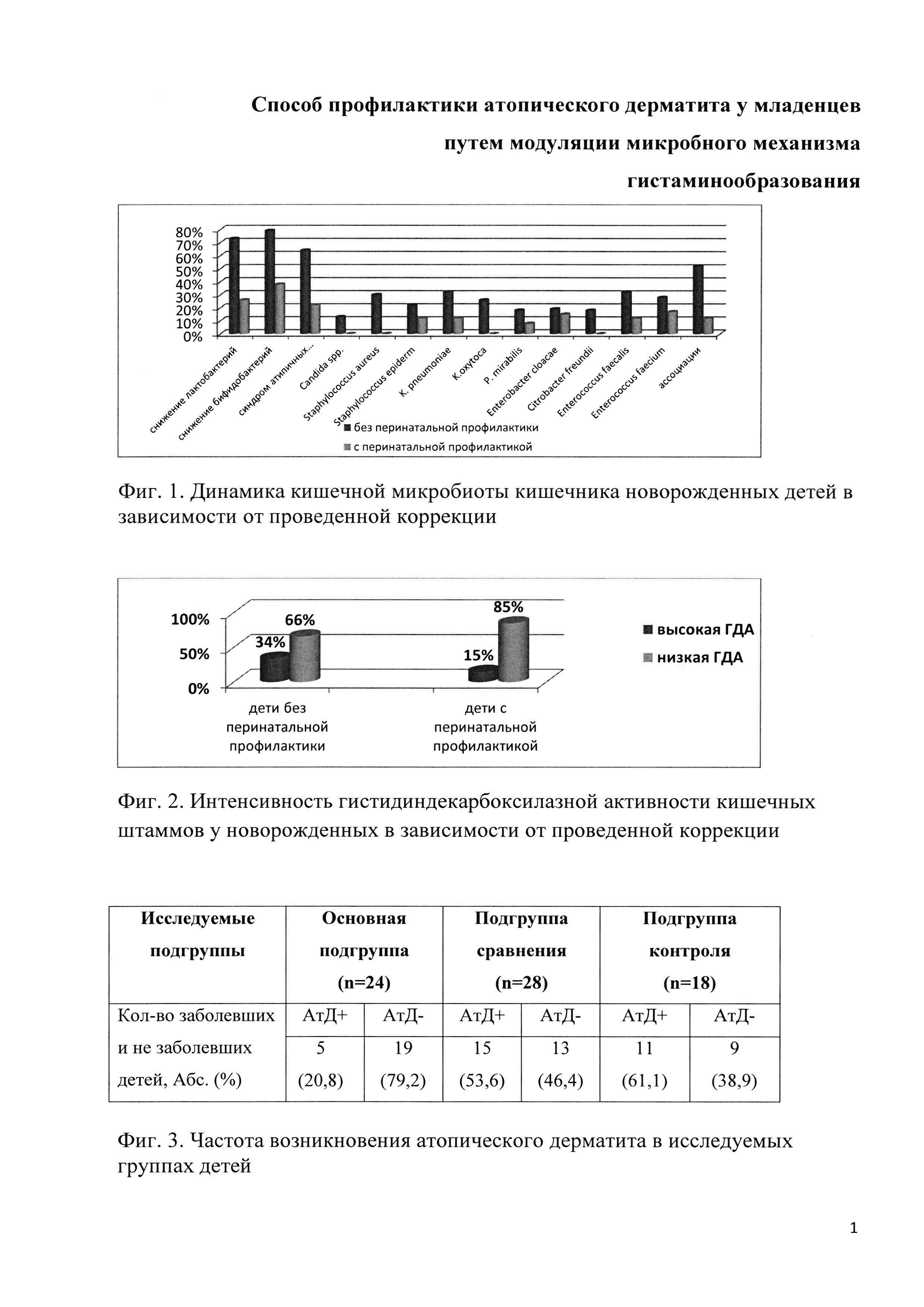
Первичное микробиологическое исследование содержимого толстой кишки новорожденных, матери которых получили иммунобиокоррекцию, выявило статистически значимые отличия показателей формирования кишечной микробиоты с группами младенцев, получивших постнатальную профилактику и не получивших ее. У большинства из них микроэкологические нарушения были незначительными, количественный уровень бифидобактерий и лактобацилл был близок к оптимальному (68,5%), колонизация УПБ была невысокой - в допустимых пределах (ОШ=3,2; ДИ=1,1-8,8; χ2=4,1; р=0,0433) (Фиг. 1. Динамика кишечной микробиоты кишечника новорожденных детей в зависимости от проведенной коррекции).
Степень интенсивности гистаминообразования кишечной микробиоты в этой группе была достоверно ниже (ОШ=5,4; ДИ=1,7-17,4; χ2=7,8; р=0,0054), чем в группах сравнения и контроля. У них кишечные штаммы с высокой гистидиндекарбоксилазной активностью (ГДА) определялись лишь у 12,4% (χ2=7,4; р=0,006), у 42,6% таких штаммов обнаружено не было (фигура 2. Интенсивность гистидиндекарбоксилазной активности кишечных штаммов у новорожденных в зависимости от проведенной коррекции).
У детей, получивших перинатальную профилактику, инфекционно-воспалительные заболевания периода новорожденности отмечались достоверно реже по сравнению с группой сравнения (ОШ=3,4; ДИ=1,5-7,9; χ2=7,4; р=0,006) и особенно контрольной группой (ОШ=5,4; ДИ=1,7-17,4; χ2=7,8; р=0,0054). Функциональные нарушения кишечника регистрировались лишь у части из них (15,2%).
Первичное микробиологическое исследование кишечной микробиоты новорожденных, матери которых во время беременности не получили иммунобиокоррекции, выявило выраженные отклонения в ее составе, характеризующиеся значительным снижением бифидобактерий (78,6%), лактобацилл (72,5%) и общего количества типичных E. coli (52,3%). Важно отметить и увеличение числа идентификации E. coli с гемолитической активностью (64,4%), лактозонегативных и лактозодефективных форм (48,4%). Так же у этих младенцев отмечалась активная колонизация различных видов аэробных грамотрицательных и грамположительных условно-патогенных бактерий (чаще Staphylococcus spp., Enterococcus spp., Candida spp., Enterobacter spp., Proteus spp., Klebsiella spp.) в диагностических концентрациях (82,5%), нередко в ассоциациях. При этом видовой состав выделенных УПБ был практически идентичен материнским.
Первичное обследовании младенцев групп сравнения и контроля выявило наличие ГДА у 22,4% кишечных штаммов, интенсивность которой у трети из них (38,5%) была высокой, у 35,9% - незначительной (обнаружено 1-2 штамма на 1-2 балла), у 25,6% - отсутствовала.
Исследование кишечной микробиоты после перинатальной иммунобиокоррекции выявило у более половины младенцев оптимальный количественный уровень бифидобактерий (62,3%), лактобацилл (78,6%) и полноценных эшерихий, снижение видового состава и количественного уровня УПБ. После постнатальной коррекции позитивные сдвиги были достоверно ниже - прослеживалась тенденция к повышению количественного уровня бифидобактерий и лактобактерий на фоне сохраняющейся активной колонизации УПБ (72,4%) (χ2=5; р=0,025). В группе контроля позитивных сдвигов не отмечалось, более того - почти у четверти из них (22,6%) выраженность микроэкологических нарушений возросла.
Достигнутые перинатальной иммунобиокоррекцией позитивные результаты отразились уменьшением количества штаммов с ГДА и снижением ее интенсивности, имеющие достоверный характер (χ2=5,7; р=0,017). В группе сравнения позитивные сдвиги были ниже, в виде наметившейся тенденции к снижению интенсивности гистаминообразования и не носили достоверный характер (χ2=1,4; р=0,245).
Так же количественно разнились кожные проявления аллергии, составив 20,8% после перинатальной, 53,6% после постнатальной, значительно превысив этот показатель в основной группе и приблизившись к таковому в контрольной (61,1%), показав статистически значимые отличия по частоте развития атопического дерматита между основной группой и сравнения (χ2=4,6; р=0,033), основной и контрольной группами (χ2=5,5; р=0,019). Между контрольной группой и сравнения различия статистически незначимы (χ2=0; р=0,842) (фигура. 3. Частота возникновения атопического дерматита в исследуемых группах детей).
Сроки манифестации кожного аллергического процесса в первые 6 месяцев жизни так же коррелировали с видом проведенной коррекции: в основной группе этот показатель был минимальным (1 случай), в группе сравнения - значительно выше (7 случаев), без существенной разницы с группой контроля (8 случаев) (р>0,05).
Результаты оценки шкалы SCORAD показали, что в основной группе детей кожные проявления АтД отмечались только в легкой форме (100%). В группе сравнения у 88,3% детей было легкое течение АтД, у 12,4% - среднетяжелое. В контрольной группе наблюдалось тяжелое течение заболевания (10,2%), среднетяжелое течение (22,5%), легкое течение АД было у 68,6% детей.
По данным IDLQI умеренное ухудшение качества жизни было у 100% младенцев основной группы, у 88,3% группы сравнения и у 66,8% детей контрольной группы. Выраженное ухудшение качества жизни зафиксировано у 12,4% младенцев группы сравнения, у 20,5% контрольной группы, у 14,3% младенцев этой группы отмечалось сильно выраженное ухудшение, что полностью соответствует данным шкалы SCORAD.
Использованные источники
1. Kalliomaki, M. Probiotics in primary prevention of atopic disease: a randomised placebo-controlled trial / M. Kalliomaki, S. Salminen, H. Arvilommi et al. // Lancet. - 2001. - Vol. 357 (9262). - Р. 1076-1079.
2. Foolad, N. Effect of nutrient supplementation on atopic dermatitis in children: a systematic review of probiotics, prebiotics, formula, and fatty acids / N. Foolad, E.A. Brezinski, E.P. Chase, A.W. Armstrong // JAMA Dermatol. - 2013. - V. 149, № 3. - Р. 350-355.
3. Lahtinen S.J., Boyle R.J., Kivivuori S., Oppedisano F., Smith K.R., Robins-Browne R., Salminen S.J., Tang M.L. Prenatal probiotic administration can influence Bifidobacterium microbiota development in infants at high risk of allergy. J. Allergy Clin. Immunol. 2009; 123:499-501.
4. Fiocchi, A. Clinical Use of Probiotics in Pediatric Allergy (CUPPA): A World Allergy Organization Position Paper / A. Fiocchi, W. Burks, S.L. Bahna, Bielory L., R.J. Boyle, R. Cocco et al. // World Allergy Organ J. - 2012. - V. 5, № 11. - Р. 148-167.
5. Hanifin, J.M. Guidelines of care for atopic dermatitis, developed in accordance with the American Academy of Dermatology (AAD) / American Academy of Dermatology Association Administrative Regulations for Evidence-Based Clinical Practice Guidelines / J. Hanifin, K.D. Cooper, V.C. Ho et al. // J. Am. Acad. Dermatol. - 2004. - V. 50, № 3. - Р. 391-404.
6. Guarner, F. World Gastroenterology Organisation Global Guidelines: probiotics and prebiotics, October 2011 / F. Guarner, A.G. Khan, J. Garisch et al. // J Clin Gastroenterol. - 2012. - Vol. 46 (6). - Р. 468-481.
7. Karla, G. Probiotics in Pregnancy Reduce Eczema in Infants / G. Karla // Br J Dermatol. - Published online June 9, 2010.
8. Morelli, L. FAO/WHO guidelines on probiotics: 10 years later / Morelli, L., Capurso L. // J Clin Gastroenterol. - 2012. - Vol. 46. - Р. 1-2.
9. Boyle R.J., Ismail I.H., Kivivuori S., Licciardi P.V., Robins-Browne R.M., Mah L.J., Axelrad C., Moore S., Donath S., Carlin J.B., Lahtinen S.J., Tang M.L. Lactobacillus GG treatment during pregnancy for the prevention of eczema: a randomized controlled trial. Allergy. 2011; 66:509-16.
10. Kopp M.V., Hennemuth I., Heinzmann A., Urbanek R. Randomized, Double-Blind, Placebo-Controlled Trial of Probiotics for Primary Prevention: No Clinical Effects of Lactobacillus GG Supplementation. Pediatrics. 2008; 121(4):850-56.
11. Wickens K., Black P.N., Stanley T.V., Mitchell E., Fitzharris P., Tannock G.W., Purdie G., Crane J. A differential effect of 2 probiotics in the prevention of eczema and atopy: a double-blind, randomized, placebo-controlled trial. J. Allergy Clin. Immunol. 2008; 122:788-94.
12. Рубальский, Е.О. Влияние пробиотических композиций на физиологические показатели пула гистамина Macaca mulatta / Е.О. Рубальский, К.Н. Смирнова, С.С. Афанасьев, В.А. Алешкин, Д.Л. Теплый, А.В. Караулов, С.В. Орлов, Б.А. Лапин, А.В. Алешкин, А.Д. Даудова, Э.К. Джикидзе, И.М. Аршба, М.С. Афанасьев, А.Х. Ахминеева // Астраханский медицинский журнал. - 2015. - Т. 10, № 4. - С. 67-78.
13. Куяров, А.В. Роль нормальной микрофлоры и лизоцима в выборе пробиотических штаммов для профилактики аллергических заболеваний у студенческой молодежи севера: автореф. дис. … канд. биол. наук: 03.01.06, 03.02.03 / Куяров Артем Александрович. - М., 2015. - 24 с.
14. Юлдашев М.А., Рихсиев У.Ш., Мун А.В. Пренатальная профилактика риска развития атопического дерматита у детей при применении пробиотика IRID-BL // Молодой ученый. - 2015. - №10. - С. 474-477.
Способ профилактики атонического дерматита у младенцев путем модуляции микробного механизма гистаминообразования, заключающийся в назначении перед родами беременной женщине с аллергопатологией и затем ее новорожденному ребенку курса пробиотиков, отличающийся тем, что женщине на сроке 35-36 недель гестации назначают курс пробиотика, содержащего штамм лактобактерий с определенной диаминооксидазной активностью Lactobacillus acidophilus NK-1 по 1 капсуле 3 раза в день, 14 дней и ректально 2 раза в сутки 10 дней препарат, содержащий интерферон альфа-2b и антиоксидант, по 1 суппозиторию; новорожденному ребенку назначают курс пробиотика, содержащего штаммы Lactobacillus rhamnosus GG по 1 саше в день 14 дней и препарат интерферона альфа-2b с антиоксидантом по 1 суппозиторию ректально 2 раза в сутки 5 дней.