Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ЭФИРА ГЕТЕРОАРИЛКАРБОНОВОЙ КИСЛОТЫ
Вид РИД
Изобретение
Предпосылки создания изобретения
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым соединениям, производным эфира гетероарилкарбоновой кислоты, которые обладают ингибирующей серинпротеазу (особенно трипсин и энтеропептидазу) активностью. Настоящее изобретение также относится к содержащей такие соединения фармацевтической композиции и лекарственным средствам для лечения или профилактики диабета. Настоящее изобретение дополнительно относится к способам лечения и/или профилактики диабета посредством введения таких производных эфира гетероарилкарбоновой кислоты.
Уровень техники
В настоящее время усиливающие секрецию инсулина средства (сульфонилмочевины), ингибиторы абсорбции глюкозы (ингибиторы α-глюкозидазы), сенсибилизаторы инсулина (бигуанид, производные тиазолидина) и т.п. клинически используют в качестве терапевтических лекарственных средств для диабета. Однако так как их применение сопровождается побочными эффектами, такими как гипогликемия, диарея, лактоцидоз, отек и т.п.; проявление недостаточного действия; и т.п., все еще требуется удовлетворяющее клинические потребности лекарственное средство.
В последние годы сообщалось, что эфир бензойной кислоты, обладающий ингибирующей протеазу активностью, который представлен нижеследующим соединением, проявляет подавляющее повышение уровня глюкозы в крови действие на животной модели диабета (см. Международную заявку WO-2006/057152, которая включена во всей ее полноте в данное описание посредством ссылки). Полагают, что нижеследующее соединение проявляет ингибирующую фермент активность относительно трипсина, тромбина, панкреатического и плазменного калликреинов, плазмина и т.п. и антагонистическое действие на лейкотриеновый рецептор. Кроме того, сообщалось также об ингибирующей энтеропептидазу активности нижеследующего соединения (см. Biochemical Research (2001), 22(5), 257-260, содержание которого включено во всей его полноте в данное описание посредством ссылки). Однако остается много неясных моментов во взаимоотношении между такими действиями и подавляющим повышение уровня глюкозы в крови действием.
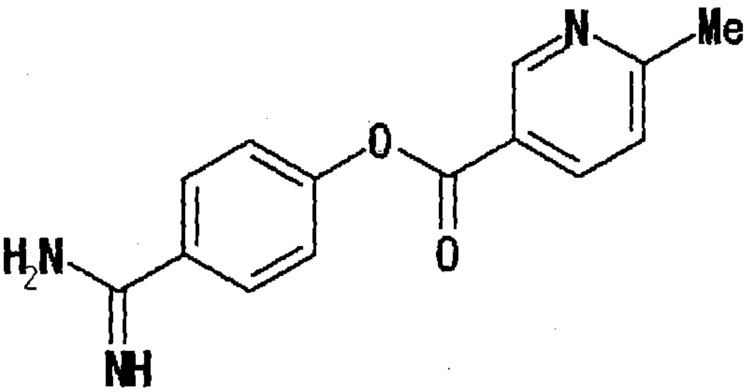
С другой стороны, что касается структур эфира гетероарилкарбоновой кислоты, в патентной заявке Японии JP-A-161385, которая включена во всей ее полноте в данное описание посредством ссылки, раскрывается соединение в качестве терапевтического лекарственного средства для лечения панкреатита. В этом документе раскрываются только производные эфира гетероарилкарбоновой кислоты, где заместителем остатка гетероарилкарбоновой кислоты является метильная группа или метоксигруппа, или незамещенные производные, как представлено нижеследующей формулой. Тогда как эти производные раскрыты как проявляющие ингибирующую активность относительно трипсина, химотрипсина и тромбина, не дано описание в отношении ингибирующей энтеропептидазу активности и подавляющего повышение уровня глюкозы в крови действия.
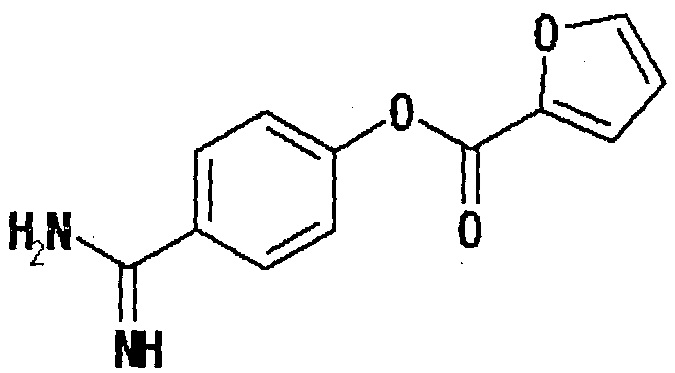
Кроме того, в «Advances in Experimental Medicine» и Biology (1989) 247 B (Kinins 5, часть В), 271-6, которые включены во всей их полноте в данное описание посредством ссылки, также описывается эфир гетероарилкарбоновой кислоты, обладающий ингибирующей протеазу активностью, который представлен нижеследующей формулой. Однако раскрыты только соединения, где гетероарильный остаток является незамещенным, и не дано описание в отношении ингибирующей энтеропептидазу активности и подавляющего повышение уровня глюкозы в крови действия этих соединений.
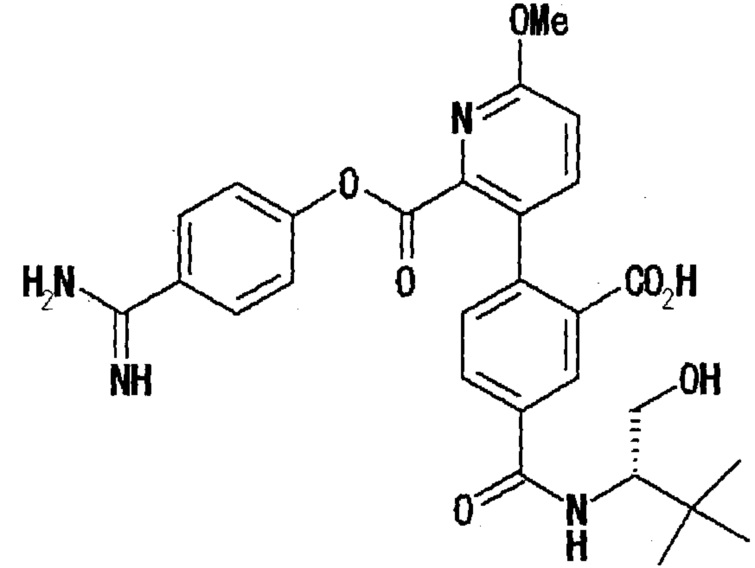
Кроме того, в WO-99/41231, которая включена во всей ее полноте в данное описание посредством ссылки, описывается соединение, представленное нижеследующей формулой. Однако оно имеет структуру, где арильная группа, замещенная карбоксильной группой, непосредственно связана с гетероарильным остатком, который полностью отличен от соединения по настоящему изобретению. В этом документе раскрывается ингибирующая активность против фактора коагуляции крови VIIa; однако, не дано описание в отношении ингибирующей энтеропептидазу активности и подавляющего повышение уровня глюкозы в крови действия.
С другой стороны, трипсин является одной из интестинальных серинпротеаз и продуцируется путем расщепления неактивного трипсиногена энтеропептидазой. Известно, что трипсин активирует различные пищеварительные ферменты посредством воздействия на химотрипсиноген, проэластазу, прокарбоксилэстеразу, проколипазу и про-сахарозу-изомальтозу, и т.п. Следовательно, полагают, что ингибитор энтеропептидазы и трипсина снижает пищеварительную способность в отношении белка, липида и углеводов и является эффективным в качестве лекарственного средства для лечения или профилактики ожирения и гиперлипидемии.
В WO-2006/050999, которая включена во всей ее полноте в данное описание посредством ссылки, описывается, что лекарственное средство, которое ингибирует как энтеропептидазу, так и трипсин, представляет интерес в качестве жироснижающего агента. Кроме того, в WO-2009/071601, которая включена во всей ее полноте в данное описание посредством ссылки, сообщается о соединении, которое обладает ингибирующей активностью против энтеропептидазы, трипсина, плазмина, калликреина и т.п., в качестве лекарственного средства против ожирения. Однако ни в одной из этих публикаций не описывается подавление повышения уровня глюкозы в крови и гипогликемического эффекта, возникающего за счет одновременного ингибирования энтеропептидазы и трипсина, и ингибитор протеазы, описанный там, имеет структуру, полностью отличную от соединения по настоящему изобретению.
Соответственно, остается потребность в соединениях, которые пригодны для лечения или профилактики диабета. Следовательно, для дальнейшего удовлетворения клинических потребностей с точки зрения эффекта, безопасности и т.п., желателен гипергликемический ингибитор, обладающий ингибирующим серинпротеазу действием, который представляет собой новое лекарственное средство для лечения или профилактики диабета.
Сущность изобретения
Соответственно, одной задачей настоящего изобретения является получение новых соединений, которые пригодны для лечения или профилактики диабета.
Еще одной задачей настоящего изобретения является получение новых соединений, которые проявляют ингибирующее серинпротеазу действие.
Еще одной задачей настоящего изобретения является получение новых ингибиторов серинпротеазы (особенно трипсина и энтеропептидазы).
Еще одной задачей настоящего изобретения является получение новых ингибиторов интестинальной серинпротеазы (особенно трипсина и энтеропептидазы).
Еще одной задачей настоящего изобретения является получение новых гипергликемических ингибиторов или гипогликемических агентов и дополнительно лекарственных средств для лечения и/или профилактики любого из диабета, ожирения, гиперлипидемии, диабетического осложнения и метаболического синдрома.
Еще одной задачей настоящего изобретения является предоставление новых способов лечения и/или профилактики любого из диабета, ожирения, гиперлипидемии, диабетического осложнения и метаболического синдрома.
Еще одной задачей настоящего изобретения является предоставление новых способов улучшения чувствительности к инсулину.
Эти и другие задачи, которые станут очевидными на протяжении нижеследующего подробного описания, были достигнуты обнаружением авторами настоящего изобретения того, что описываемые ниже производные эфира гетероарилкарбоновой кислоты обладают ингибирующей серинпротеазу активностью и пригодны для лечения и/или профилактики любого из диабета, ожирения, гиперлипидемии, диабетического осложнения и метаболического синдрома.
Таким образом, ввиду указанной выше современной ситуации, авторы настоящего изобретения провели интенсивные исследования и приняли во внимание, что одновременное ингибирование трипсина и энтеропептидазы является особенно эффективным для подавления повышения уровня глюкозы в крови. Они синтезировали различные производные эфира гетероарилкарбоновой кислоты, которые являются новыми соединениями, оценили ингибирующую трипсин и энтеропептидазу активность и обнаружили, что некоторые производные эфира гетероарилкарбоновой кислоты являются ингибиторами протеазы, которые одновременно ингибируют трипсин и энтеропептидазу. Кроме того, авторами настоящего изобретения также обнаружено, что такие типичные соединения проявляют подавляющее повышение уровня глюкозы в крови действие на животной модели диабета.
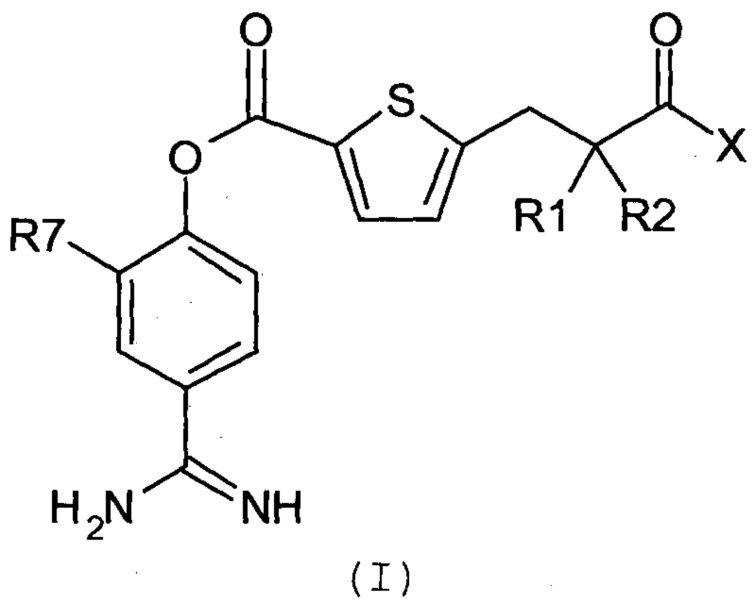
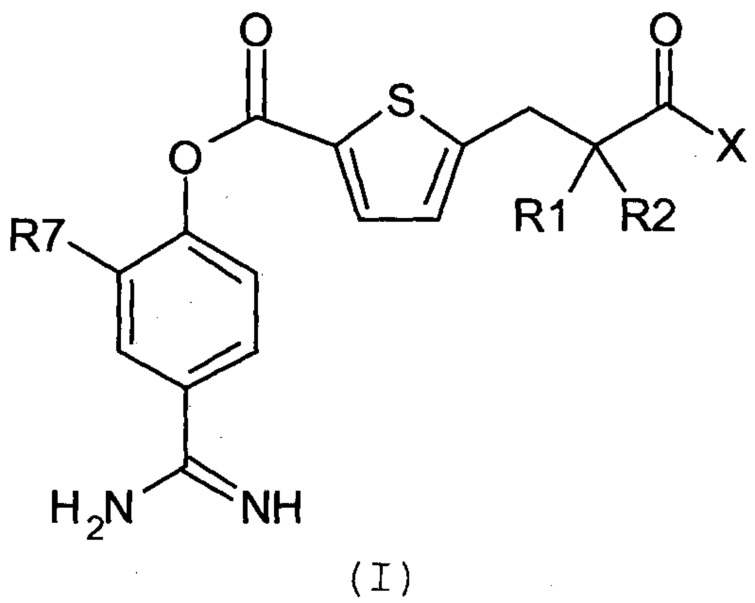
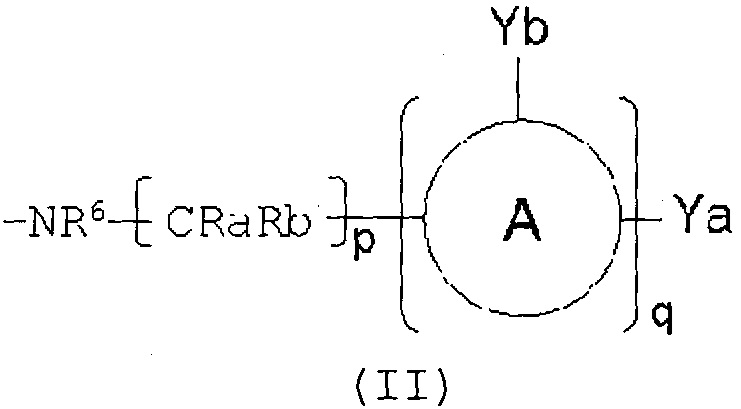
Соответственно, настоящее изобретение относится к соединению, представленному формулой (I):
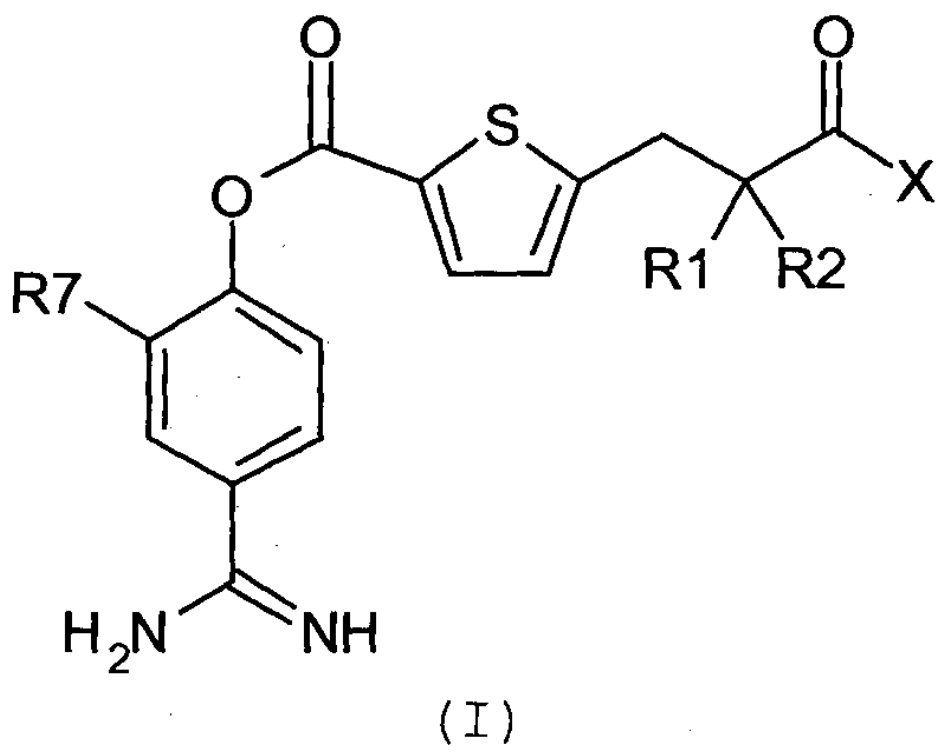
где:
R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой С1-4алкильную группу или С2-4алкенильную группу или R1 и R2 вместе с атомом углерода, с которым они связаны, образуют С3-8циклоалкановое кольцо;
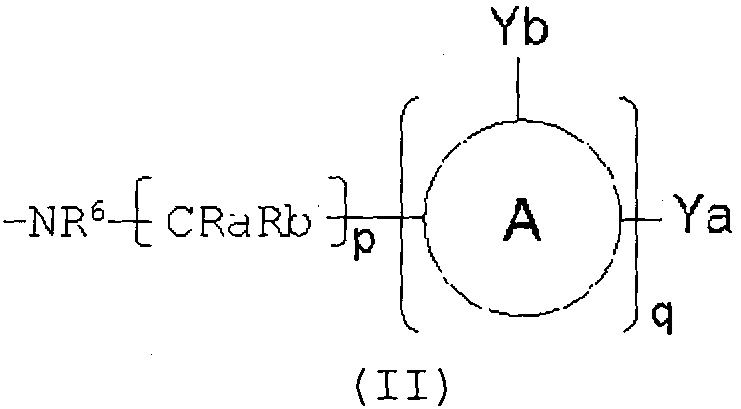
Х представляет собой -OR3, -NR4R5 или группу, представленную формулой (II):
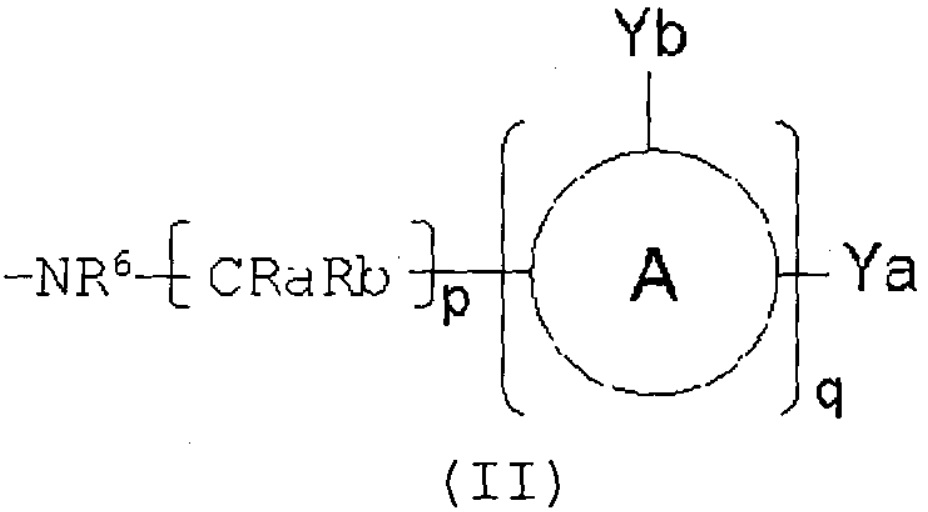
где:
R3 представляет собой атом водорода или С1-4алкильную группу;
R4, R5 и R6 являются одинаковыми или различными, и каждый независимо представляет собой атом водорода, С1-8алкильную группу, карбоксилС1-8алкильную группу или С3-8алкенильную группу, или R4 и R5, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл, где указанная С1-8алкильная группа, указанная карбоксилС1-8алкильная группа, указанная С3-8алкенильная группа и указанный С2-9 гетероцикл могут быть замещены одним или более заместителями;
Ra и Rb являются одинаковыми или различными, и каждый независимо представляет собой атом водорода, С1-8алкильную группу, карбоксилС1-8алкильную группу, карбоксильную группу, арильную группу, С3-6 гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из О, N и S, или С3-8циклоалкильную группу, или Ra и Rb, вместе с атомом(ми), с которым(ми) они связаны, образуют С3-8циклоалкановое кольцо или С3-9 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из О, N и S, где указанная С1-8алкильная группа, указанная карбоксилС1-8алкильная группа, указанная арильная группа, указанная С3-6 гетероциклическая группа, указанная С3-8циклоалкильная группа, указанное С3-8циклоалкановое кольцо и указанный С3-9 гетероцикл могут быть замещены одним или более заместителями;
кольцо А представляет собой арен, С3-6 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, С3-8циклоалкановое кольцо или С3-8циклоалкеновое кольцо, где указанный С3-6 гетероцикл, указанное С3-8циклоалкановое кольцо и указанное С3-8циклоалкеновое кольцо могут быть дополнительно замещены оксогруппой в дополнение к Ya и Yb;
Ya представляет собой атом водорода, атом галогена, карбоксильную группу, гидроксильную группу, С1-3алкоксикарбонильную группу, карбоксилС1-3алкильную группу или сульфогруппу;
Yb представляет собой атом водорода, атом галогена, карбоксильную группу, гидроксильную группу, С1-3алкоксикарбонильную группу, карбоксилС1-3алкильную группу, нитрогруппу, цианогруппу или С1-3алкоксильную группу;
p равен 0, 1, 2, 3 или 4;
q равен 0 или 1; и
R7 представляет собой атом водорода, атом галогена или нитрогруппу;
при условии, что, когда R1 и R2, оба, представляют собой метильные группы, тогда Х не является группой, представленной формулой:
 ,
,
или к его фармацевтически приемлемой соли.
Кроме того, настоящее изобретение относится к соединению, представленному формулой (I):

где:
R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой С1-4алкильную группу или С2-4алкенильную группу или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют С3-8циклоалкановое кольцо;
Х представляет собой -OR3, -NR4R5 или группу, представленную формулой (II):

где:
R3 представляет собой атом водорода или С1-4алкильную группу;
R4, R5 и R6 являются одинаковыми или различными, и каждый независимо представляет собой атом водорода, С1-8алкильную группу, карбоксилС1-8алкильную группу или С3-8алкенильную группу, или R4 и R5, вместе с атомом азота, с которым они связаны, образуют С3-9 гетероцикл, где указанная С1-8алкильная группа, указанная С3-8алкенильная группа и указанный С3-9 гетероцикл могут быть замещены одним или более заместителями;
Ra и Rb являются одинаковыми или различными, и каждый независимо представляет собой атом водорода, С1-8алкильную группу, карбоксилС1-8алкильную группу, карбоксильную группу, арильную группу, С3-6 гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из О, N и S, или С3-8циклоалкильную группу, или Ra и Rb, вместе с атомом(ми), с которым(ми) они связаны, образуют С3-8циклоалкановое кольцо или С3-9 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из О, N и S, где указанная С1-8алкильная группа, указанная арильная группа, указанная С3-8циклоалкильная группа, указанное С3-8циклоалкановое кольцо и указанный С3-9 гетероцикл могут быть замещены одним или более заместителями;
кольцо А представляет собой арен, С3-6 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, или С3-8циклоалкановое кольцо;
Ya представляет собой атом водорода, атом галогена, карбоксильную группу, гидроксильную группу, карбонильную группу, карбоксилС1-3алкильную группу или сульфогруппу;
Yb представляет собой атом водорода, атом галогена, карбоксильную группу, гидроксильную группу, карбонильную группу, карбоксилС1-3алкильную группу, нитрогруппу, цианогруппу или С1-3алкоксильную группу;
p равен 0, 1, 2, 3 или 4;
q равен 0 или 1; и
R7 представляет собой атом водорода, атом галогена или нитрогруппу;
при условии, что, когда R1 и R2, оба, представляют собой метильные группы, тогда ни R4, ни R5 не являются этильной группой, замещенной двумя карбоксильными группами, и, когда R1 и R2, оба, представляют собой метильные группы, тогда группа, представленная формулой (II), не является группой, представленной формулой:
 ,
,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой NR4R5 или группу, представленную формулой (II), где R4, R5 и R6, каждый независимо, представляет собой атом водорода или С1-8алкильную группу,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой NR4R5, где R4 и R5, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл, замещенный атомом галогена, карбоксильной группой, карбоксилС1-3алкильной группой или гидроксильной группой,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой группу, представленную формулой (II), где р равен 1 или 2, и q равен 0, или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой группу, представленную формулой (II), где р равен 0, и q равен 1, или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой группу, представленную формулой (II), где р равен 1, q равен 1, и Ra и Rb являются одинаковыми или различными, и каждый независимо представляет собой атом водорода или С1-8алкильную группу, или Ra и Rb, вместе с атомом(ми), с которым(ми) они связаны, образуют С3-8циклоалкановое кольцо, где указанная С1-8алкильная группа и указанное С3-8циклоалкановое кольцо могут быть замещены группой, выбранной из карбоксильной группы, карбамоильной группы, гидроксильной группы, фенильной группы и С3-8циклоалкильной группы,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой метильную группу, этильную группу или пропильную группу, или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют циклобутановое кольцо или циклопентановое кольцо,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой метильную группу, этильную группу или пропильную группу, или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют циклобутановое кольцо или циклопентановое кольцо, и Х представляет собой -ОН,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой группу, представленную формулой (II), где q равен 1, и кольцо А представляет собой бензольное кольцо, пиридиновое кольцо, 1,2-дигидропиридиновое кольцо или С3-6 гетероцикл, содержащий 1-4 атома кислорода, где указанное 1,2-дигидропиридиновое кольцо и указанный гетероцикл, содержащий 1-4 атома кислорода, могут быть дополнительно замещены оксогруппой, в дополнение к Ya и Yb,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой группу, представленную формулой (II), где q равен 1, Ya представляет собой атом галогена, карбоксильную группу, карбоксилС1-3алкильную группу, гидроксильную группу, сульфогруппу или С1-3алкоксикарбонильную группу, и Yb представляет собой атом водорода, атом галогена, карбоксильную группу или гидроксильную группу,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой -NR4R5, где, когда R4 или R5 имеет заместитель(ли), указанный заместитель выбирают из группы, состоящей из атома галогена, карбоксильной группы, гидроксильной группы, карбоксилС1-3алкильной группы, С3-8алкенильной группы, карбамоильной группы, фенильной группы, аминогруппы, сульфогруппы, цианогруппы, С3-8циклоалкильной группы и С1-8 гетероциклической группы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из О, N и S,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой группу, представленную формулой (II), где, когда Ra или Rb имеет заместитель(ли), указанный заместитель выбирают из группы, состоящей из карбоксильной группы, гидроксильной группы, фенильной группы, аминогруппы, метилтиогруппы, сульфанильной группы, карбамоильной группы, гуанидиногруппы, С3-8циклоалкильной группы и С1-8 гетероциклической группы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из O, N и S,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где
R4 представляет собой
(1) карбоксилС1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из (а) гидроксильной группы, (b) арильной группы, (с) С3-8циклоалкильной группы, (d) карбамоильной группы, (е) аминогруппы, (f) арильной группы, необязательно замещенной гидроксильной группой, (g) С1-3алкилкарбамоильной группы, необязательно замещенной карбоксильной группой, и (h) C1-8 гетероциклической группы, или
(2) С1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из (а) сульфогруппы, (b) цианогруппы, (с) С1-8 гетероциклической группы и (d) арильной группы, необязательно замещенной карбоксильной группой, и
R5 представляет собой атом водорода, С1-3алкильную группу, необязательно замещенную С3-8циклоалкильной группой, или С3-8алкенильную группу;
или
R4 и R5, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл, замещенный 1-3-заместителями, выбранными из (1) атома галогена, (2) гидроксильной группы, (3) карбоксильной группы и (4) карбоксилС1-3алкильной группы;
R6 представляет собой атом водорода, С1-3алкильную группу, необязательно замещенную С3-8циклоалкильной группой, или С3-8алкенильную группу;
Ra и Rb являются одинаковыми или различными, и каждый независимо представляет собой
(1) атом водорода,
(2) С1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из (а) арильной группы, (b) гидроксильной группы, (с) карбамоильной группы и (d) С1-8 гетероциклической группы, содержащей 1-4 гетероатома, выбранных из O, N и S,
(3) карбоксилС1-8алкильную группу,
(4) арильную группу, необязательно замещенную гидроксильной группой,
(5) С3-6 гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из О, N и S, или
(6) С3-8циклоалкильную группу, или
Ra и Rb, вместе с атомом(ми), с которым(ми) они связаны, образуют С3-8циклоалкановое кольцо или С3-9 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, каждый из которых необязательно замещен оксогруппой, или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой -OR3, или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой -OН, или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где Х представляет собой -ОН, -NR4R5 или группу, представленную формулой (II), и каждый из -NR4R5 и группы, представленной формулой (II), имеет одну карбоксильную группу, или к его фармацевтически приемлемой соли.
Кроме того, настоящее изобретение относится к соединению, представленному формулой (I), где
R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой С1-4алкильную группу или С2-4алкенильную группу, или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют С3-8циклоалкановое кольцо;
Х представляет собой -OR3 или -NR8R9, где
R3 представляет собой атом водорода или С1-4алкильную группу;
R8 представляет собой необязательно замещенную С1-8алкильную группу, необязательно замещенную арильную группу, необязательно замещенную С3-6 гетероциклическую группу, необязательно замещенную С3-8циклоалкильную группу или необязательно замещенную С3-8циклоалкенильную группу, и
R9 представляет собой атом водорода, необязательно замещенную С1-8алкильную группу или необязательно замещенную С3-8алкенильную группу; или
R8 и R9, вместе с атомом азота, с которым они связаны, образуют необязательно замещенный С2-9 гетероцикл; и
R7 представляет собой атом водорода, атом галогена или нитрогруппу;
при условии, что, когда R1 и R2, оба, представляют собой метильные группы, тогда Х не является группой, представленной формулой:
 ,
,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где
R8 представляет собой
(1) С1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из (а) карбоксильной группы, (b) гидроксильной группы, (с) арильной группы, необязательно замещенной карбоксильной группой или гидроксильной группой, (d) сульфогруппы, (е) С3-8циклоалкильной группы, (f) карбамоильной группы, (g) аминогруппы, (h) цианогруппы, (i) С1-8 гетероциклической группы и (j) С1-3алкилкарбамоильной группы, необязательно замещенной карбоксильной группой,
(2) арильную группу, необязательно замещенную 1-3 заместителями, выбранными из (а) карбоксильной группы, (b) гидроксильной группы, (с) С1-3алкильной группы, необязательно замещенной карбоксильной группой, (d) С1-3алкоксикарбонильной группы и (е) сульфогруппы,
(3) С3-6 гетероциклическую группу, необязательно замещенную 1-3 заместителями, выбранными из (а) оксогруппы, (b) С1-3алкоксильной группы и (с) атома галогена,
(4) С3-8циклоалкильную группу, необязательно замещенную карбоксильной группой, или
(5) С3-8циклоалкенильную группу, необязательно замещенную карбоксильной группой, и
R9 представляет собой атом водорода, С1-8алкильную группу, необязательно замещенную С3-8циклоалкильной группой, или С3-8алкенильную группу;
или
R8 и R9, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл, необязательно замещенный 1-3 заместителями, выбранными из (1) карбоксильной группы, (2) С1-3алкильной группы, необязательно замещенной карбоксильной группой, (3) атома галогена и (4) гидроксильной группы,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где
Х представляет собой -ОН или -NR8’R9’, где
R8’ представляет собой замещенную С1-8алкильную группу, замещенную арильную группу, замещенную С3-6 гетероциклическую группу, замещенную циклоалкильную группу или замещенную С3-8циклоалкенильную группу, каждая из которых имеет одну карбоксильную группу, и
R9’ представляет собой атом водорода, необязательно замещенную С1-8алкильную группу, которая не содержит карбоксильной группы, или необязательно замещенную С3-8алкенильную группу, которая не содержит карбоксильной группы; или
R8’ и R9’, вместе с атомом азота, с которым они связаны, образуют замещенный С2-9 гетероцикл, который имеет одну карбоксильную группу,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где
R8’ представляет собой
(1) С1-8алкильную группу, замещенную 1-3 заместителями, выбранными из (а) карбоксильной группы, (b) гидроксильной группы, (с) арильной группы, необязательно замещенной карбоксильной группой или гидроксильной группой, (d) сульфогруппы, (е) С3-8циклоалкильной группы, (f) карбамоильной группы, (g) аминогруппы, (h) цианогруппы, (i) С1-8 гетероциклической группы и (j) С1-3алкилкарбамоильной группы, необязательно замещенной карбоксильной группой, при условии, что указанная замещенная С1-8алкильная группа имеет одну карбоксильную группу,
(2) арильную группу, замещенную 1-3 заместителями, выбранными из (а) карбоксильной группы, (b) гидроксильной группы, (с) С1-3алкильной группы, замещенной карбоксильной группой, (d) C1-3алкоксикарбонильной группы и (е) сульфогруппы, при условии, что указанная замещенная арильная группа имеет одну карбоксильную группу,
(3) С3-8циклоалкильную группу, замещенную одной карбоксильной группой,
или
(4) С3-8циклоалкенильную группу, замещенную одной карбоксильной группой,
и
R9’ представляет собой атом водорода, С1-8алкильную группу, необязательно замещенную С3-8циклоалкильной группой, или С3-8алкенильную группу;
или
R8’ и R9’, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл, замещенный 1-3 заместителями, выбранными из (1) карбоксильной группы, (2) С1-3алкильной группы, необязательно замещенной карбоксильной группой, (3) атома галогена и (4) гидроксильной группы, при условии, что указанный выше замещенный С2-9 гетероцикл, образованный R8’ и R9’, имеет одну карбоксильную группу,
или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой С1-3алкильную группу, или к его фармацевтически приемлемой соли.
Настоящее изобретение также относится к соединению, представленному приведенной выше формулой (I), где R7 представляет собой атом галогена, или к его фармацевтически приемлемой соли.
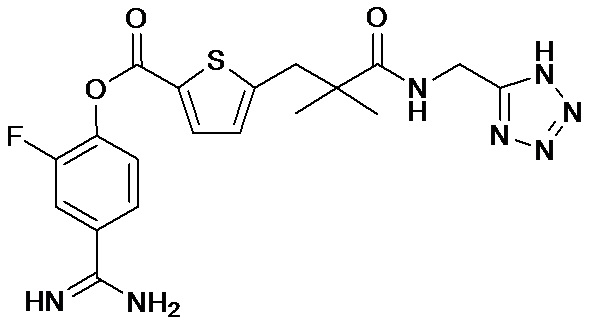
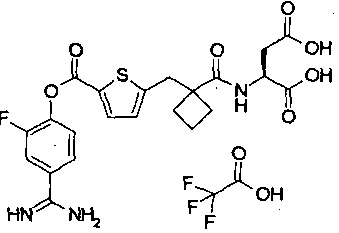
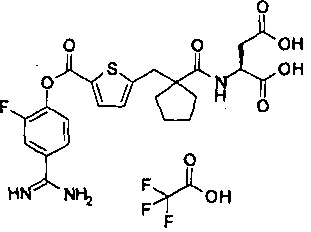
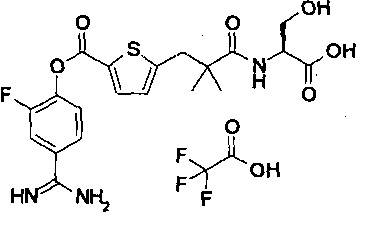
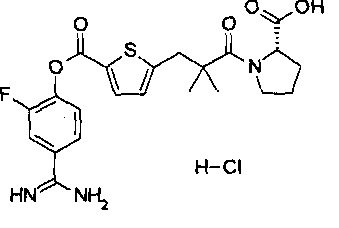
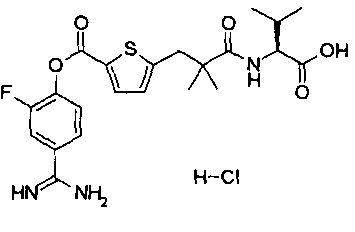
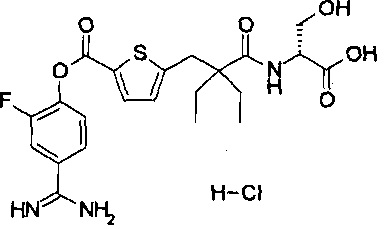
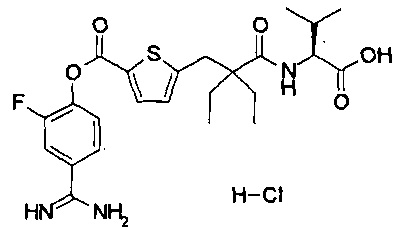
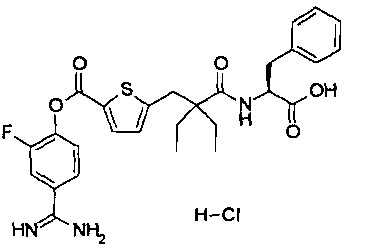
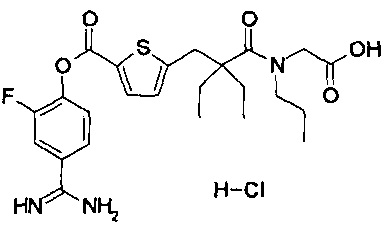
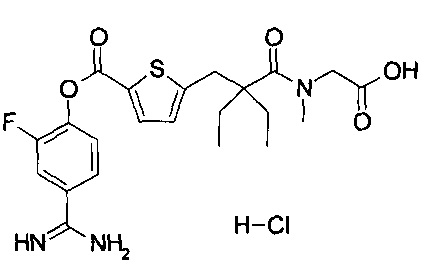
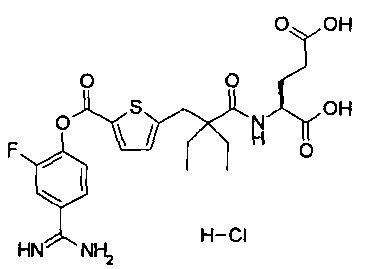
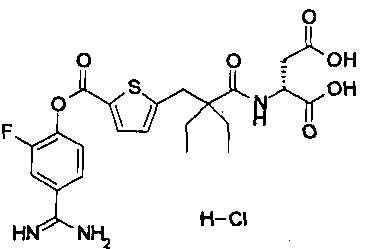
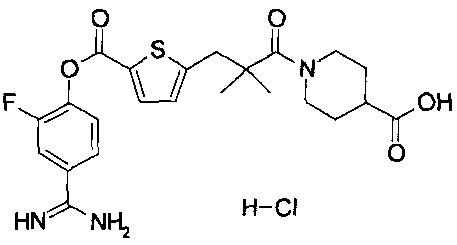
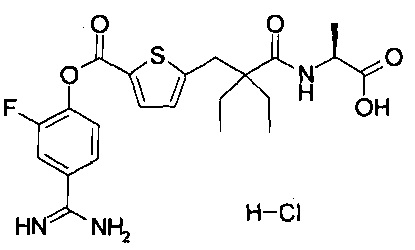
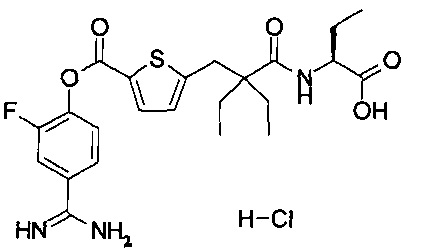
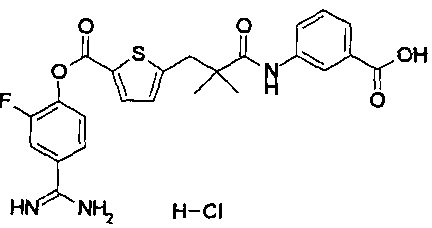
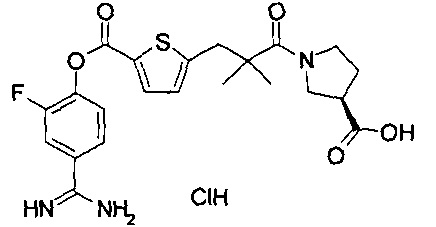
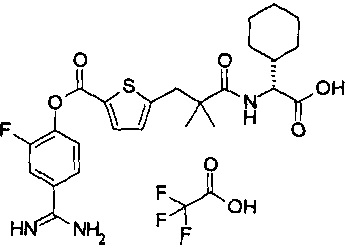
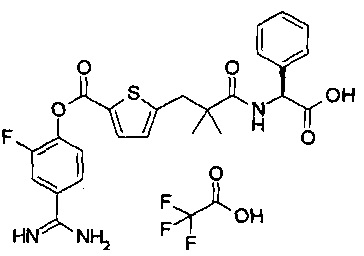
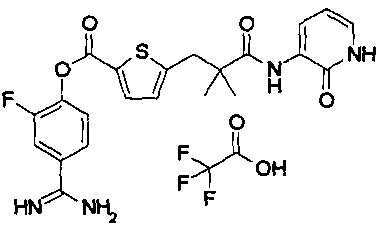
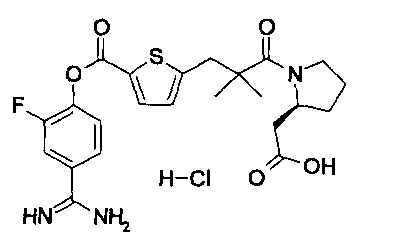
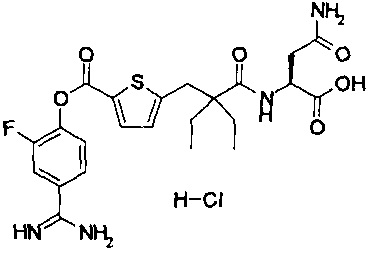
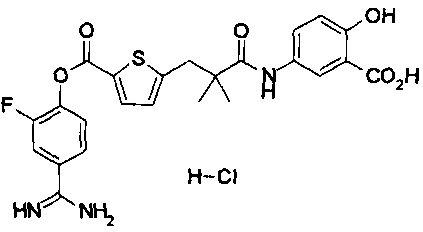
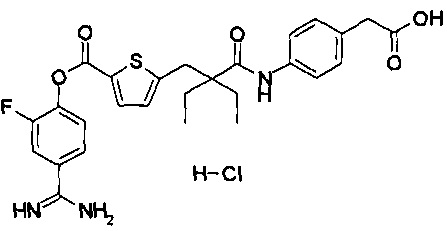
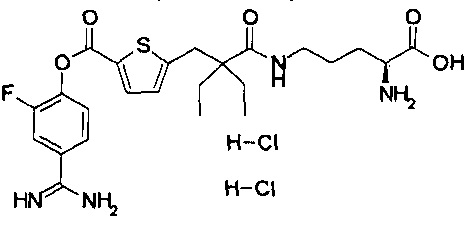
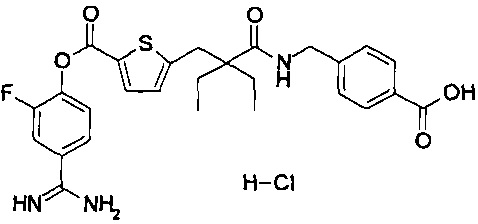
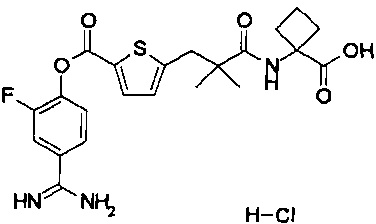
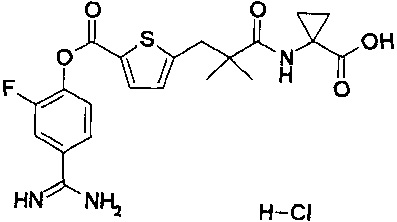
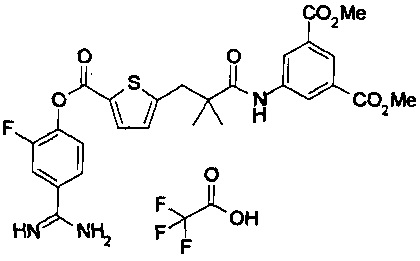
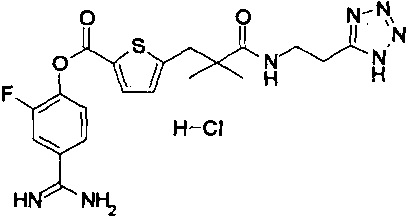
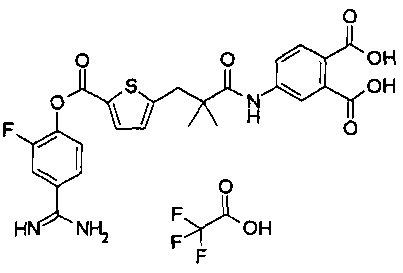
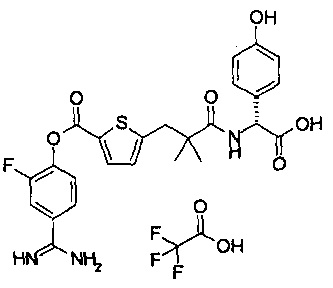
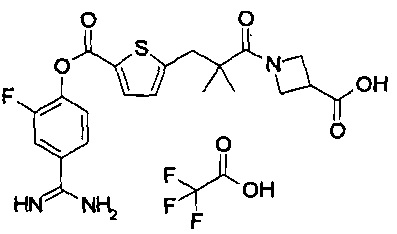
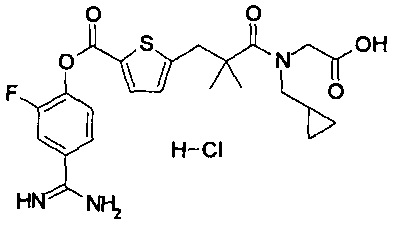
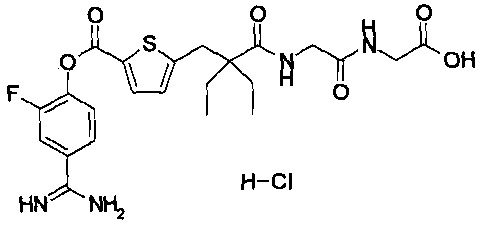
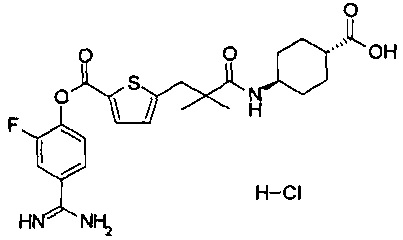
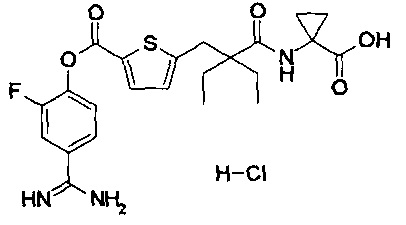
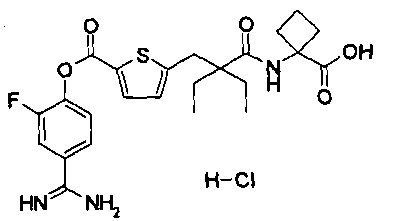
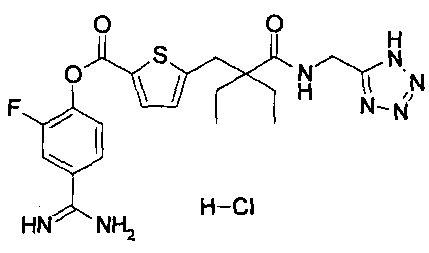
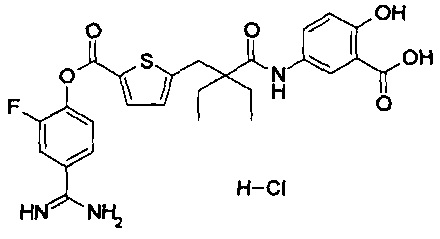
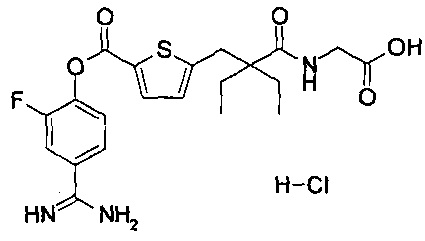
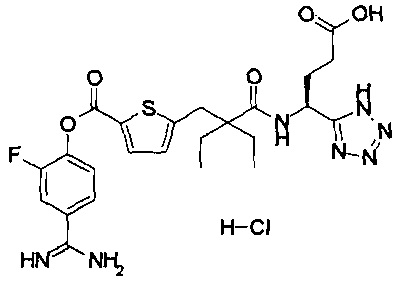
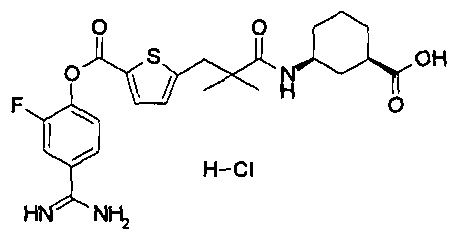
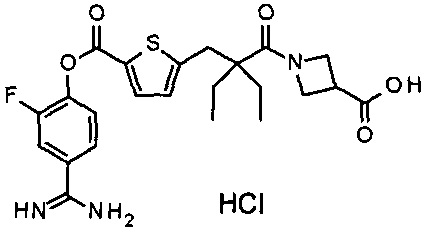
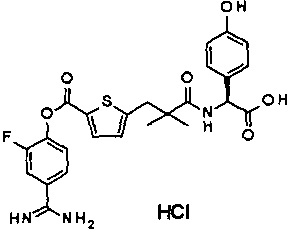
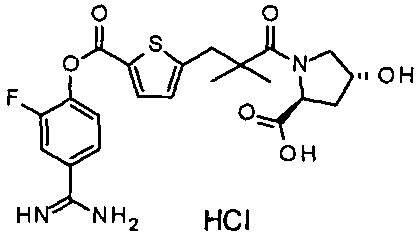
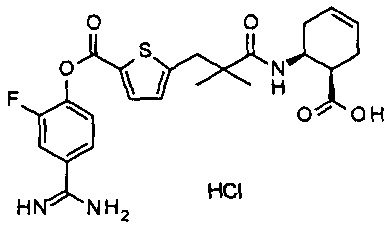
Кроме того, настоящее изобретение относится к соединению, представленному любой из следующих формул:
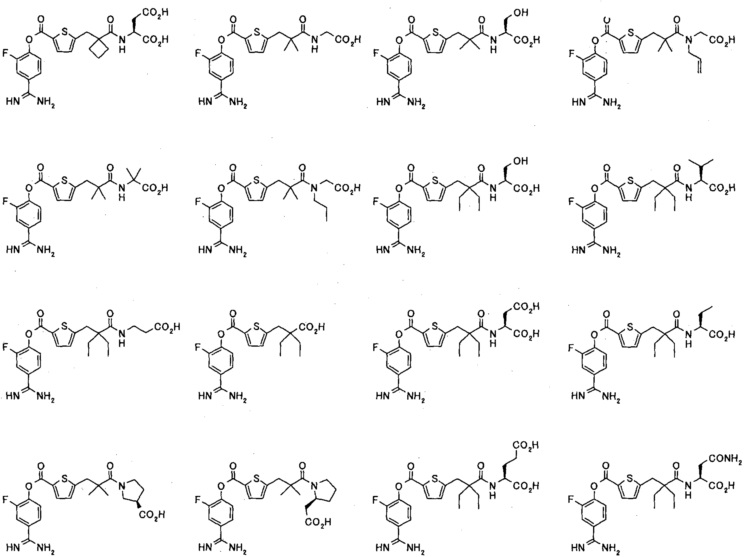
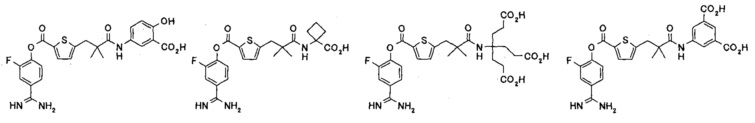
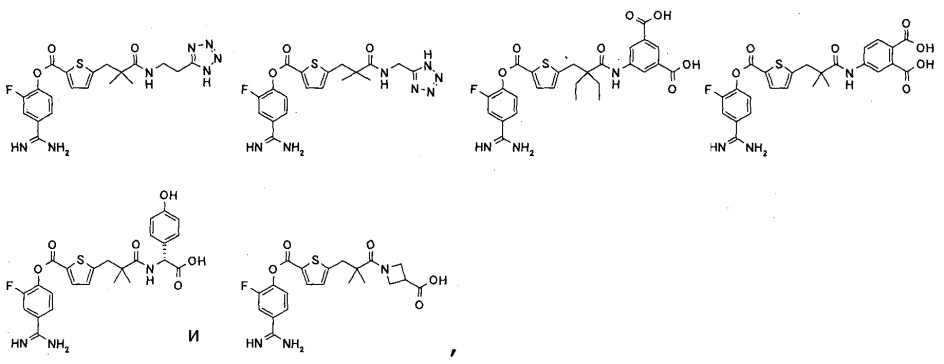
или к фармацевтически приемлемой соли указанного выше соединения.
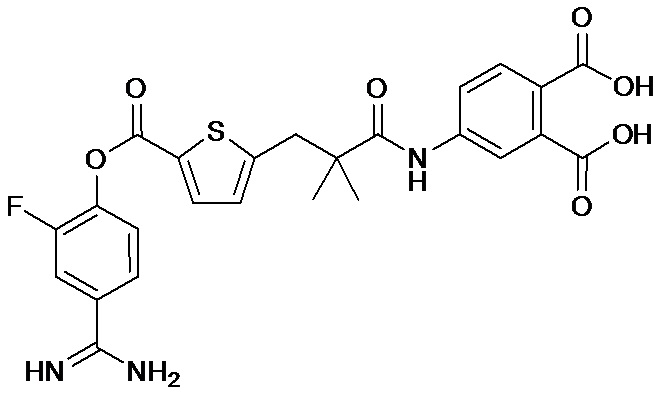
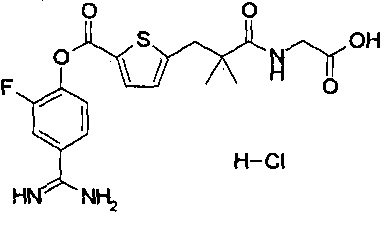
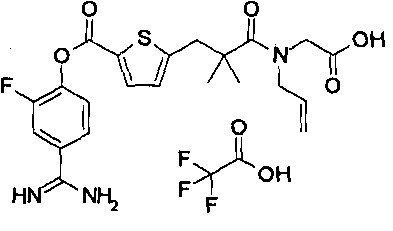
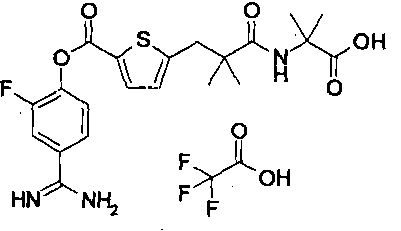
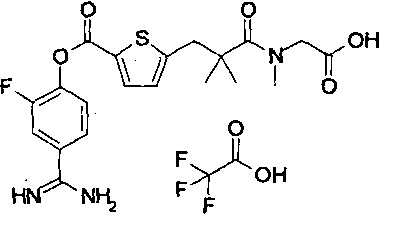
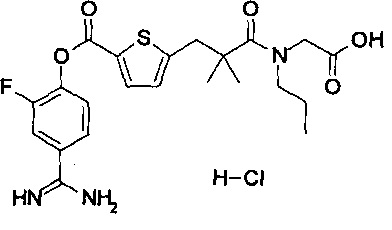
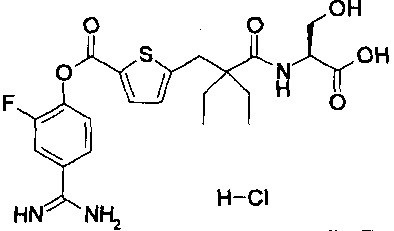
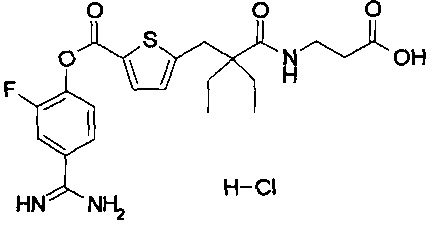
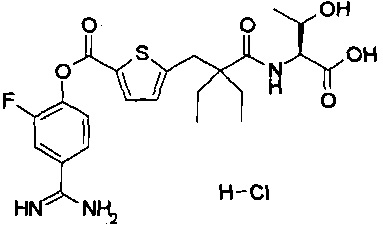
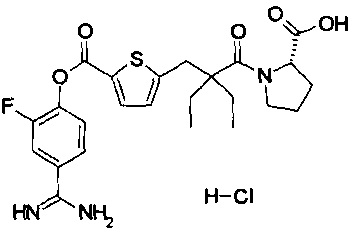
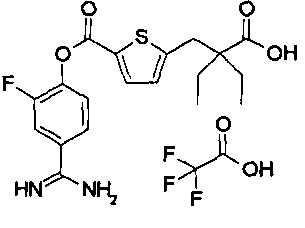
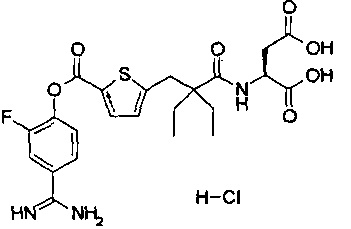
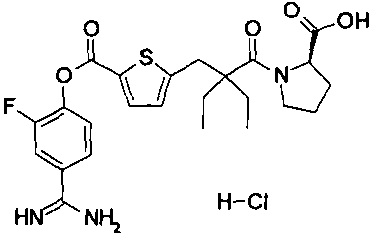
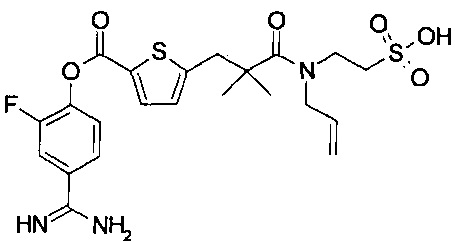
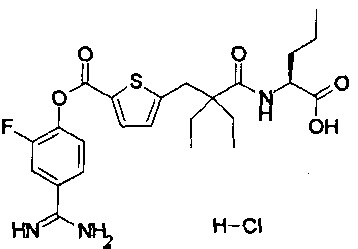
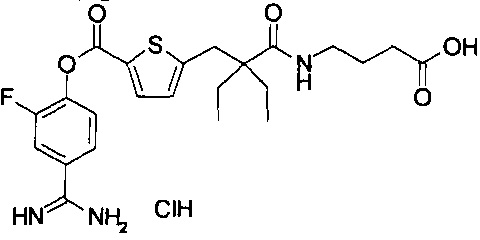
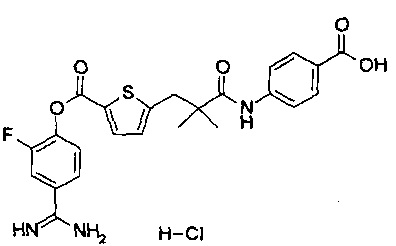
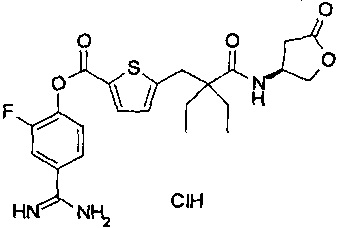
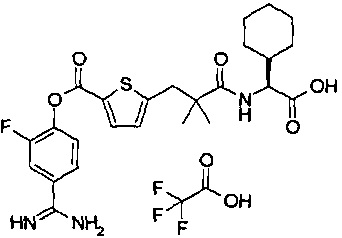
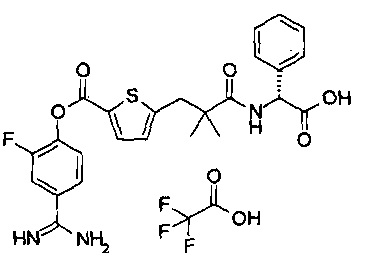
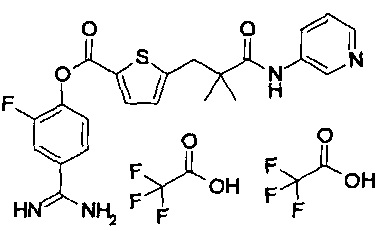
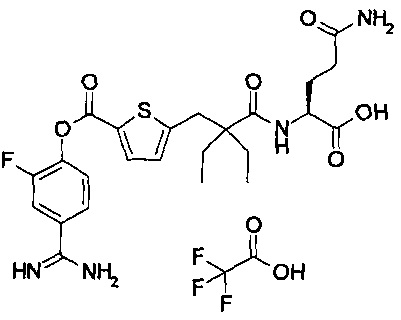
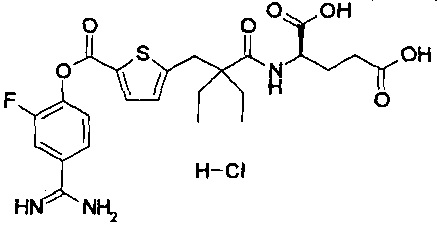
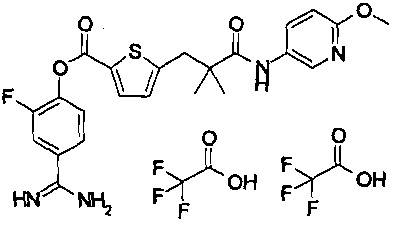
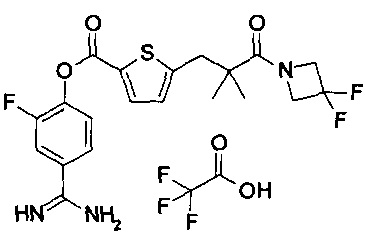
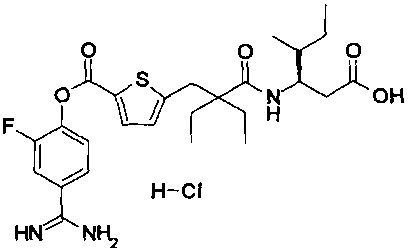
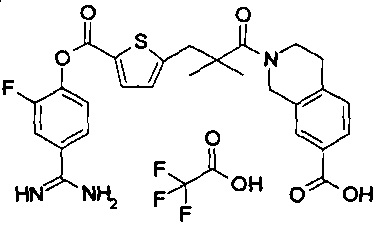
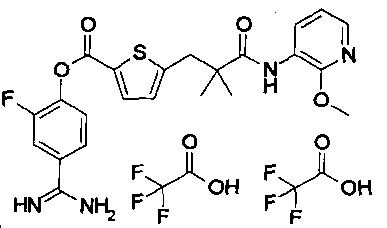
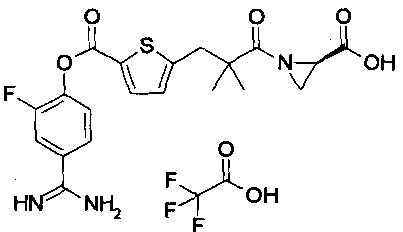
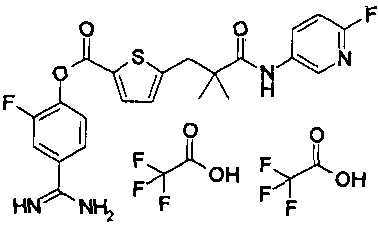
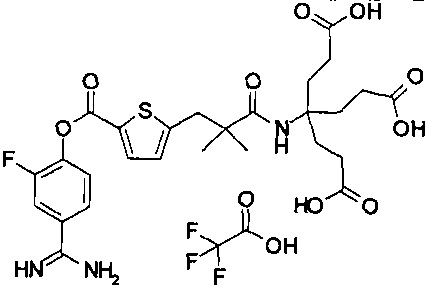
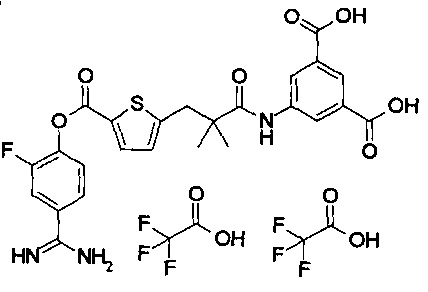
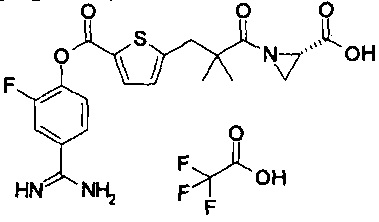
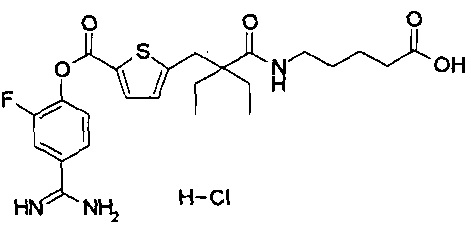
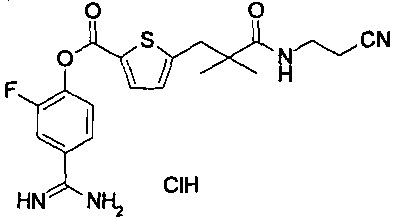
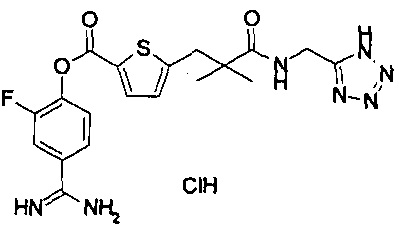
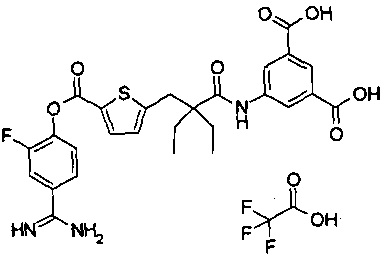
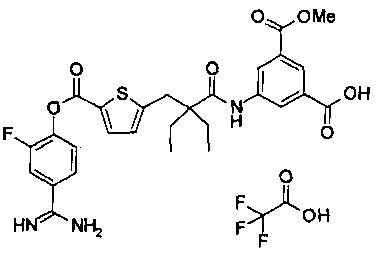
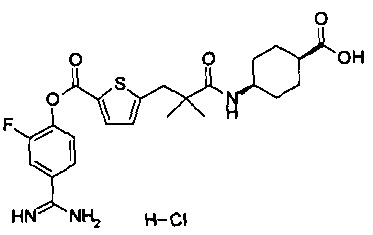
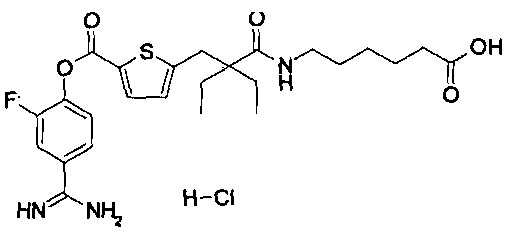
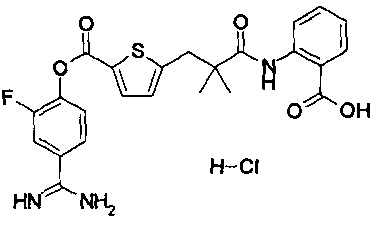
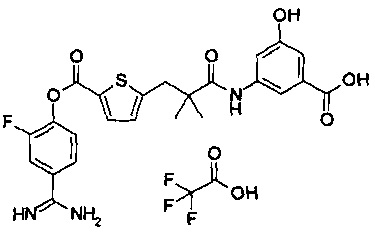
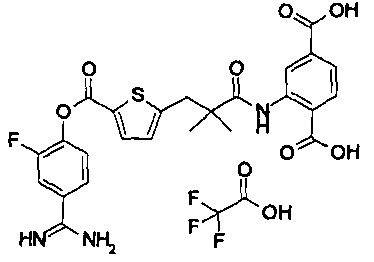
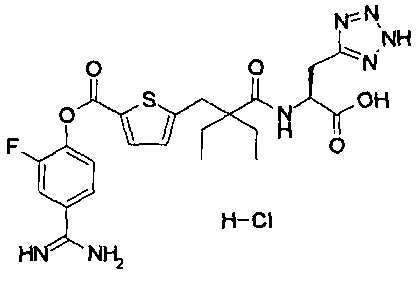
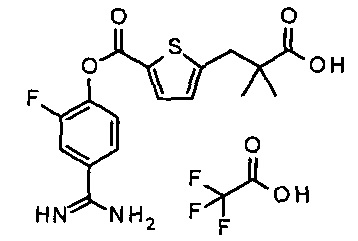
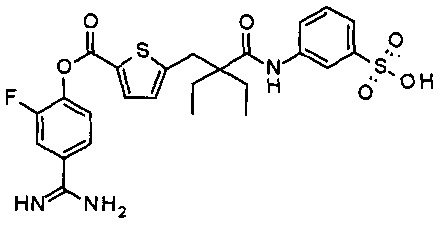
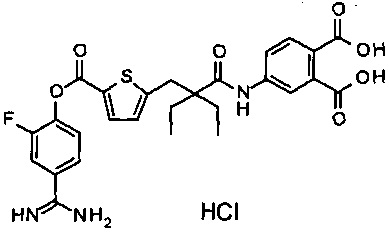
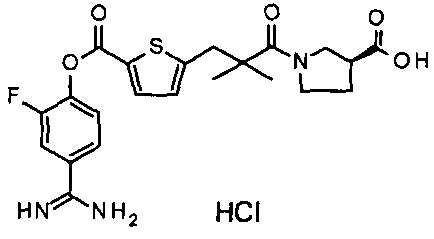
Далее, настоящее изобретение относится к соединению, представленному любой из следующих формул:
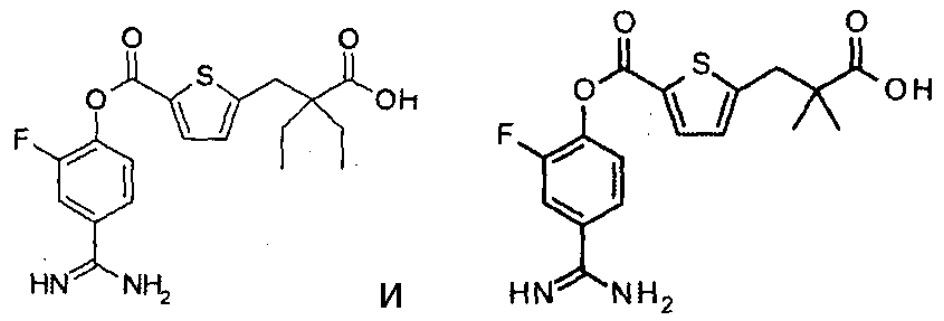 ,
,
или к фармацевтически приемлемой соли указанного соединения.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей указанное выше соединение или его фармацевтически приемлемую соль и, по меньшей мере, один фармацевтически приемлемый носитель или эксципиент.
Далее, настоящее изобретение относится к фармацевтической композиции, содержащей указанное выше соединение или его фармацевтически приемлемую соль в качестве активного ингредиента.
Настоящее изобретение также относится к способу ингибирования серинпротеазы, включающему введение эффективного количества указанного выше соединения или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
Настоящее изобретение также относится к способу ингибирования интестинальной серинпротеазы, включающему введение эффективного количества указанного выше соединения или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
Настоящее изобретение также относится к способу ингибирования трипсина и энтеропептидазы, включающему введение эффективного количества указанного выше соединения или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
Настоящее изобретение также относится к способу лечения гипергликемии, включающему введение эффективного количества указанного выше соединения или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
Настоящее изобретение также относится к способу профилактики или лечения диабета, включающему введение эффективного количества указанного выше соединения или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
Настоящее изобретение также относится к способу улучшения чувствительности к инсулину, включающему введение эффективного количества указанного выше соединения или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
Настоящее изобретение также относится к способу профилактики или лечения ожирения, гиперлипидемии, диабетического осложнения или метаболического синдрома, включающему введение эффективного количества указанного выше соединения или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
Настоящее изобретение также относится к ингибитору интестинальной серинпротеазы, включающему указанное выше соединение или его фармацевтически приемлемую соль в качестве активного ингредиента.
Настоящее изобретение также относится к двойному ингибитору трипсина и энтеропептидазы, включающему указанное выше соединение или его фармацевтически приемлемую соль в качестве активного ингредиента.
Настоящее изобретение также относится к гипергликемическому ингибитору или гипогликемическому агенту, включающему указанное выше соединение или его фармацевтически приемлемую соль в качестве активного ингредиента.
Настоящее изобретение также относится к профилактическому или терапевтическому лекарственному средству для диабета, включающему указанное выше соединение или его фармацевтически приемлемую соль в качестве активного ингредиента.
Настоящее изобретение также относится к сенсибилизатору инсулина, включающему указанное выше соединение или его фармацевтически приемлемую соль в качестве активного ингредиента.
Настоящее изобретение также относится к профилактическому или терапевтическому лекарственному средству против ожирения, гиперлипидемии, диабетического осложнения или метаболического синдрома, включающему указанное выше соединение или его фармацевтически приемлемую соль в качестве активного ингредиента.
Настоящее изобретение также относится к применению указанного выше соединения или его фармацевтически приемлемой соли для профилактики или лечения диабета.
Настоящее изобретение также относится к применению указанного выше соединения или его фармацевтически приемлемой соли для ослабления резистентности к инсулину.
Настоящее изобретение также относится к применению указанного выше соединения или его фармацевтически приемлемой соли для профилактики или лечения ожирения, гиперлипидемии, диабетического осложнения или метаболического синдрома.
Соединение по настоящему изобретению обладает подавляющим повышение уровня глюкозы в крови действием и может быть предпочтительно применено в качестве лекарственного средства для лечения или профилактики диабета.
Краткое описание фигур
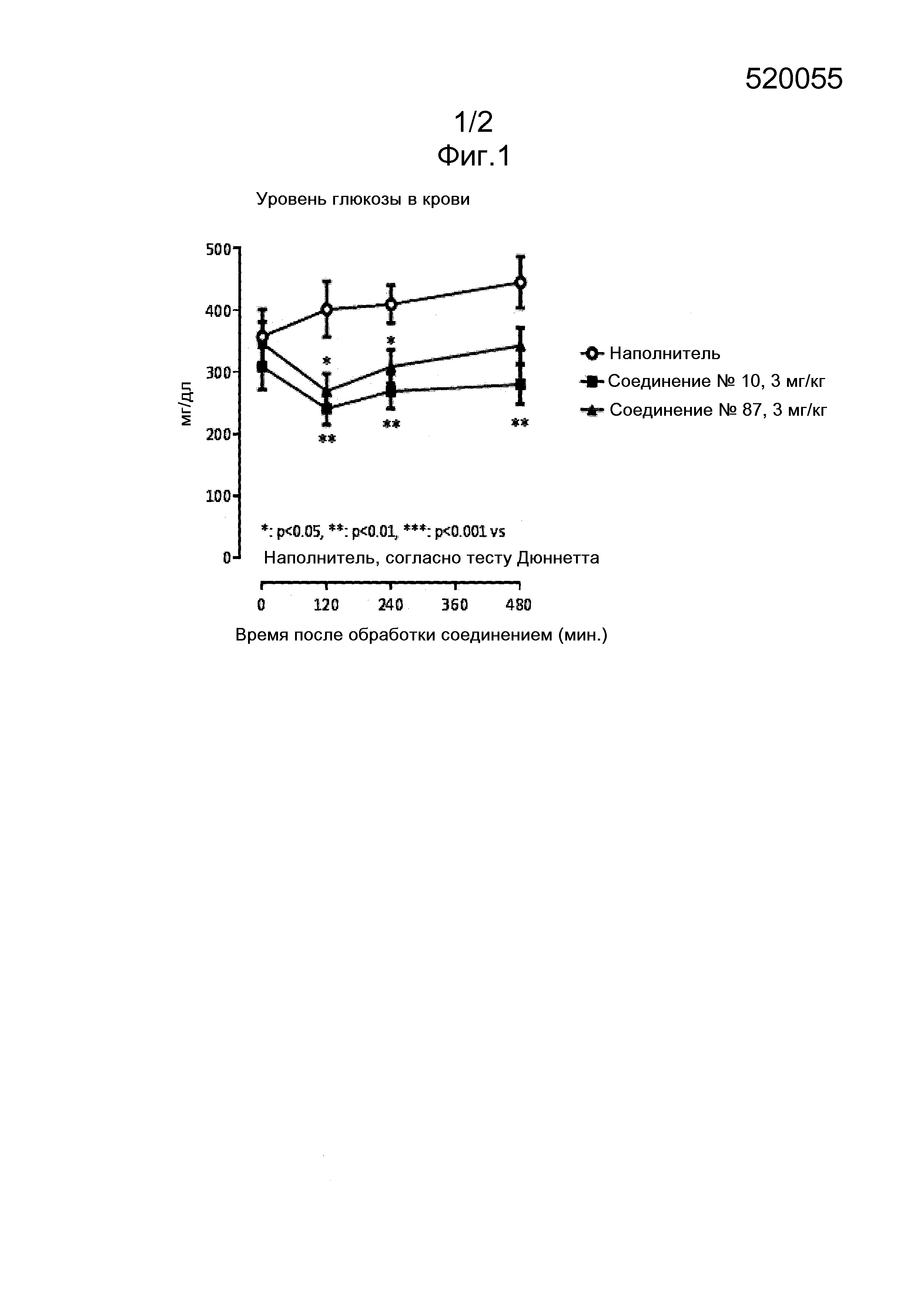
На фиг. 1 представлены уровни глюкозы в крови спустя 0, 2, 4 и 8 часов после дозирования соединений № 10 и № 87 и наполнителя в дозе 3 мг/кг KK-AY/JCL мышам.
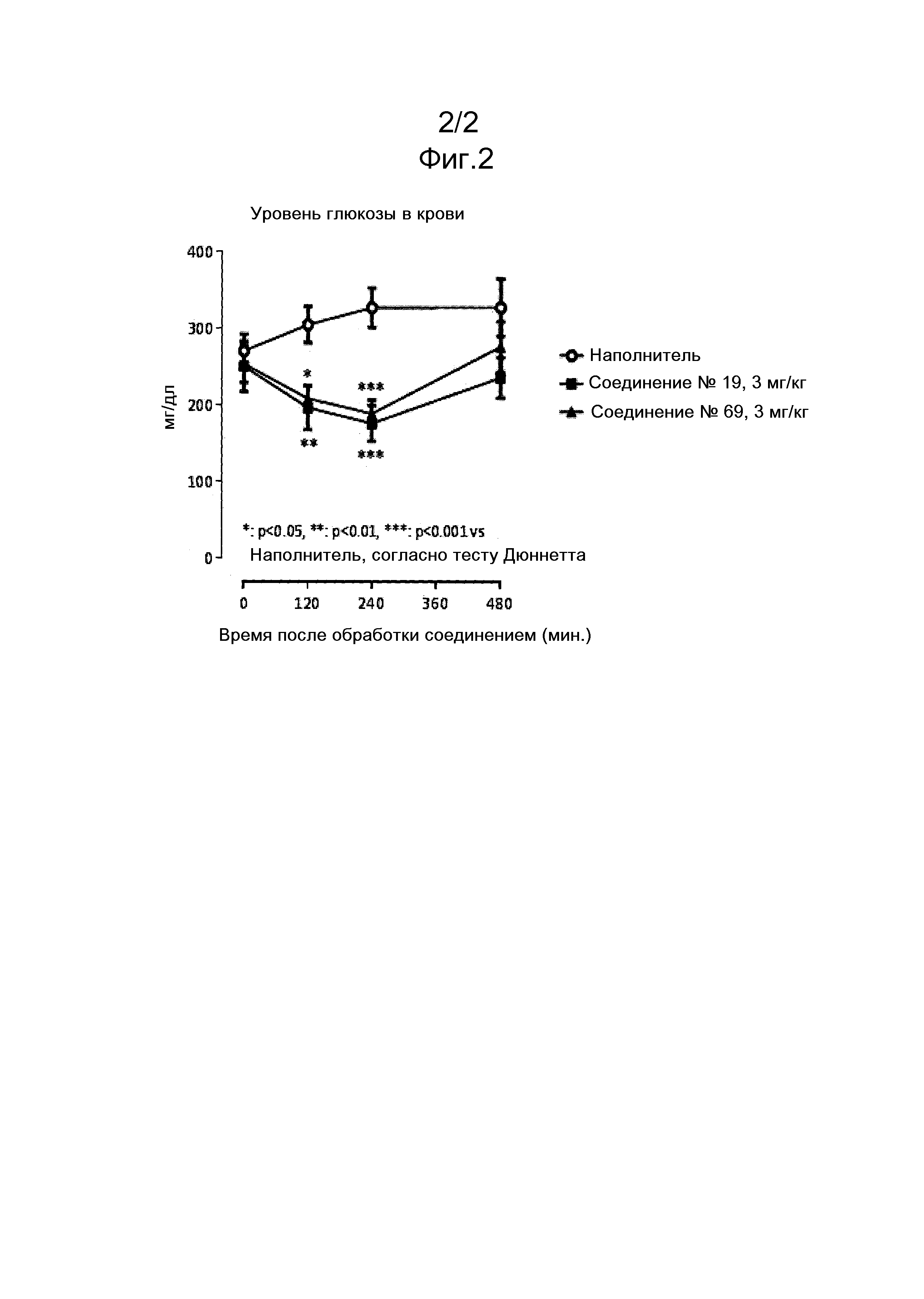
На фиг. 2 представлены уровни глюкозы в крови спустя 0, 2, 4 и 8 часов после дозирования соединений № 19 и № 69 и наполнителя в дозе 3 мг/кг KK-AY/JCL мышам.
Подробное описание предпочтительных вариантов осуществления
Настоящее изобретение подробно пояснено согласно нижеследующему.
В настоящем описании фраза «может быть замещенным» или «необязательно имеющий заместитель(ли)» означает «замещенный или незамещенный». Если не указано иное, положение и число заместителей могут быть любыми и конкретно не ограничены. Когда замещено двумя или более заместителями, заместители могут быть одинаковыми или различными. Примеры заместителей включают нитрогруппу, атом галогена, цианогруппу, гидроксильную группу, сульфанильную группу, аминогруппу, гуанидиногруппу, формильную группу, фенильную группу, низшую алкильную группу, низшую алкенильную группу, низшую алкинильную группу, низшую ацильную группу, карбоксильную группу, сульфогруппу, фосфоногруппу, низшую алкоксильную группу, низшую алкилтиогруппу, низшую алкиламиногруппу, низшую алкоксикарбонильную группу, карбамоильную группу, низшую алкилкарбамоильную группу, низшую алкилсульфониламиногруппу, сульфамоильную группу и т.п.
В настоящем описании примеры заместителя «арильной группы, необязательно имеющей заместитель(ли)» и «гетероциклической группы, необязательно имеющей заместитель(ли)» включают нитрогруппу, атом галогена, цианогруппу, гидроксильную группу, сульфанильную группу, аминогруппу, гуанидиногруппу, формильную группу, низшую алкильную группу, низшую алкенильную группу, низшую алкинильную группу, низшую ацильную группу, карбоксильную группу, сульфогруппу, фосфоногруппу, низшую алкоксильную группу, низшую алкилтиогруппу, низшую алкиламиногруппу, низшую алкоксикарбонильную группу, карбамоильную группу, низшую алкилкарбамоильную группу, низшую алкилсульфониламиногруппу, сульфамоильную группу и т.п.
Термин «циклическая аминогруппа» в настоящем описании означает насыщенную или ненасыщенную циклическую аминогруппу с числом атомов углерода от 2 до 7, которая может содержать один или более гетероатомов в кольце, как например атом азота, атом кислорода, атом серы и т.п. Например, могут быть указаны пирролидинильная группа, пирролинильная группа, пиперидильная группа, морфолинильная группа, пиперазинильная группа, тиоморфолинильная группа, пиперидинонильная группа, пиперазинонильная группа и т.п.
Термин «низший», например, в случае низшей алкильной группы, в настоящем описании указывает, что группа имеет 1-6 атомов углерода, предпочтительно, 1-4 атома углерода и, более предпочтительно, 1-3 атома углерода, если не указано иное.
Термин «алкильная группа» представляет собой линейную или разветвленную или циклическую алкильную группу (в частности, алкильную группу с линейной или разветвленной цепью), предпочтительно, с числом атомов углерода от 1 до 10, более предпочтительно, с числом атомов углерода 1-8 (то есть, «С1-8алкил»). Например, можно указать метильную группу, этильную группу, н-пропильную группу, н-бутильную группу, н-пентильную группу, н-гексильную группу, изопропильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, изопентильную группу, трет-пентильную группу, неопентильную группу, 2-пентильную группу, 3-пентильную группу, 2-гексильную группу, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу и т.п. Примеры «С1-4алкильной группы» включают алкильную группу с 1-4 атомами углерода, из числа указанных выше алкильных групп. Примеры «С1-3алкильной группы» включают алкильную группу с 1-3 атомами углерода, из числа указанных выше алкильных групп. Примеры «С3-4алкильной группы» включают алкильную группу с 3 или 4 атомами углерода, из числа указанных выше алкильных групп.
«КарбоксилС1-8алкильная группа» представляет собой С1-8алкильную группу, замещенную одной или более (например, 1-3, предпочтительно, 1 или 2, более предпочтительно, одной) карбоксильными группами. «КарбоксилС1-3алкил» представляет собой С1-3алкильную группу, замещенную одной или более (например, 1-3, предпочтительно, 1 или 2, более предпочтительно, одной) карбоксильными группами.
«Циклоалкильная группа» представляет собой циклическую алкильную группу, предпочтительно, имеющую число атомов углерода от 3 до 10. Примеры «циклоалкила» включают циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу и т.п. Примеры «С3-8циклоалкильной группы» включают циклоалкильную группу с 3-8 атомами углерода, из числа указанных выше циклоалкильных групп.
«Циклоалкановое кольцо» представляет собой кольцевой остаток в циклоалкильной группе, предпочтительно, имеющий число атомов углерода от 3 до 10. Примеры «циклоалканового кольца» включают циклопропановое кольцо, циклобутановое кольцо, циклопентановое кольцо, циклогексановое кольцо и т.п. Примеры «С3-8циклоалканового кольца» включают циклоалкановое кольцо с 3-8 атомами углерода, из числа указанных циклоалкановых колец. Примеры «С3-5циклоалкановых колец» включают циклоалкановое кольцо с 3-5 атомами углерода, из числа указанных выше циклоалкановых колец.
«Алкенильная группа» представляет собой линейную или разветвленную алкенильную группу, предпочтительно, имеющую число атомов углерода от 2 до 10, которая включает любой изомер. Например, можно указать винильную группу, аллильную группу, пропенильную группу, бутенильную группу, пентенильную группу, гексенильную группу и т.п. Примеры «С3-8алкенильной группы» включают алкенильную группу с 3-8 атомами углерода, из числа указанных выше алкенильных групп. Примеры «С2-4алкенильной группы» включают алкенильную группу с 2-4 атомами углерода, из числа указанных выше алкенильных групп.
«Циклоалкенильная группа» представляет собой циклическую алкенильную группу, предпочтительно, имеющую число атомов углерода от 3 до 10. Например, можно указать циклопропенильную группу, циклобутенильную группу, циклопентенильную группу, циклогексенильную группу и т.п. Примеры «С3-8циклоалкенильной группы» включают циклоалкенильную группу с 3-8 атомами углерода, из числа указанных выше циклоалкенильных групп.
«С3-8циклоалкеновое кольцо» представляет собой кольцевой остаток в циклической алкенильной группе, имеющий число атомов углерода от 3 до 8. Например, можно указать циклопропеновое кольцо, циклобутеновое кольцо, циклопентеновое кольцо, циклогексеновое кольцо и т.п.
«Алкинильная группа» представляет собой линейную или разветвленную алкинильную группу, имеющую число атомов углерода от 2 до 10, которая включает любой изомер. Например, можно указать этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 2-бутинильную группу, 3-бутинильную группу, пентинильную группу и т.п.
Примеры «атома галогена» включают атом фтора, атом хлора, атом брома, атом йода и т.п.
«Ацильная группа» представляет собой ацильную группу, имеющую линейную или разветвленную или циклическую алкильную группу, или алкенильную группу, имеющую число атомов углерода от 1 до 10, предпочтительно, 1-8, более предпочтительно, 1-6. Например, можно указать ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу, валерильную группу, изовалерильную группу, пивалоильную группу, гексаноильную группу, акрилоильную группу, метакрилоильную группу, кротоноильную группу, изокротоноильную группу, циклопропаноильную группу, циклобутаноильную группу, циклопентаноильную группу, циклогексаноильную группу и т.п.
«Алкоксильная группа» представляет собой алкоксильную группу, имеющую линейную или разветвленную или циклическую алкильную группу, имеющую число атомов углерода 1-10, предпочтительно, 1-8, более предпочтительно, 1-6 и, еще более предпочтительно, 1-3 (то есть, «С1-3алкоксильная группа»). Например, можно указать метоксигруппу, этоксигруппу, н-пропоксигруппу, н-бутоксигруппу, н-пентилоксигруппу, н-гексилоксигруппу, изопропоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу и циклогексилоксигруппу. Примеры «С1-3алкоксильной группы» включают алкоксильную группу с 1-3 атомами углерода, из числа указанных выше алкоксильных групп.
«Алкилтиогруппа» представляет собой алкилтиогруппу, имеющую линейную или разветвленную или циклическую алкильную группу, имеющую число атомов углерода от 1 до 10, предпочтительно, 1-8, более предпочтительно, 1-6. Например, можно указать метилтиогруппу, этилтиогруппу, н-пропилтиогруппу, изопропилтиогруппу, н-бутилтиогруппу, изобутилтиогруппу, втор-бутилтиогруппу, трет-бутилтиогруппу, циклопропилтиогруппу, циклобутилтиогруппу, циклопентилтиогруппу, циклобутилтиогруппу и т.п.
«Алкиламиногруппа» представляет собой аминогруппу, моно- или дизамещенную указанной выше «алкильной группой», предпочтительно, «низшей алкильной группой». Например, можно указать метиламиногруппу, этиламиногруппу, пропиламиногруппу, изопропиламиногруппу, диметиламиногруппу, диэтиламиногруппу, дипропиламиногруппу, диизопропиламиногруппу, этилметиламиногруппу и т.п.
«Ацилоксигруппа» представляет собой группу, где атом кислорода связан с атомом углерода карбонильного остатка указанной выше «ацильной группы», предпочтительно, «низшей ацильной группы». Например, можно указать ацетилоксигруппу, пропионилоксигруппу, бутирилоксигруппу, изобутирилоксигруппу, валерилоксигруппу, изовалерилоксигруппу, пивалоилоксигруппу, гексаноилоксигруппу, акрилоилоксигруппу, метакрилоилоксигруппу, кротоноилоксигруппу, изокротоноилоксигруппу и т.п.
«Ациламиногруппа» представляет собой группу, где атом азота связан с атомом углерода карбонильного остатка указанной выше «ацильной группы», предпочтительно, «низшей ацильной группы». Например, можно указать ацетиламиногруппу, пропиониламиногруппу, бутириламиногруппу, изобутириламиногруппу, валериламиногруппу, изовалериламиногруппу, пивалоиламиногруппу, гексаноиламиногруппу, акрилоиламиногруппу, метакрилоиламиногруппу, кротоноиламиногруппу, изокротоноиламиногруппу и т.п.
«Алкоксикарбонильная группа» представляет собой карбонильную группу, имеющую указанную выше «алкоксильную группу», предпочтительно, «низшую алкоксильную группу», такую как С1-3алкоксильная группа. Например, можно указать метоксикарбонильную группу, этоксикарбонильную группу, пропоксикарбонильную группу, изопропоксикарбонильную группу, н-бутоксикарбонильную группу, изобутоксикарбонильную группу, втор-бутоксикарбонильную группу, трет-бутоксикарбонильную группу и т.п. Примеры «С1-3алкоксикарбонильной группы» включают карбонильную группу с указанной выше С1-3алкоксильной группой, из числа указанных выше алкоксикарбонильных групп.
«Алкилкарбамоильная группа» представляет собой группу, где атом азота указанной выше «алкиламиногруппы» или «циклической аминогруппы» и атом углерода карбонильной группы связаны. Например, можно указать N-метилкарбамоильную группу, N-этилкарбамоильную группу, N,N-диметилкарбамоильную группу, 1-пирролидинилкарбонильную группу, 1-пиперидилкарбонильную группу, 4-морфолинилкарбонильную группу и т.п. Примеры «С1-3алкилкарбамоильной группы» включают алкилкарбамоильную группу с 1-3 атомами углерода в «алкиламиногруппе» или в «циклической аминогруппе», из числа указанных выше алкилкарбамоильных групп.
«Алкилсульфониламиногруппа» представляет собой группу, где атом азота связан с сульфонильной группой, где указанная «алкильная группа», предпочтительно, «низшая алкильная группа», связана с атомом серы. Например, можно указать метилсульфониламиногруппу, этилсульфониламиногруппу, пропилсульфониламиногруппу, изопропилсульфониламиногруппу, бутилсульфониламиногруппу, изобутилсульфониламиногруппу и т.п.
«Арилсульфониламиногруппа» представляет собой группу, где атом азота связан с атомом серы сульфонильной группы, замещенной арильной группой. Например, можно указать фенилсульфониламиногруппу, нафтилсульфониламиногруппу и т.п.
Примеры «арильной группы» включают арильную группу, имеющую число атомов углерода от 6 до 14, такую как фенильная группа, нафтильная группа и т.п., предпочтительно, фенильная группа.
«Арен» представляет собой кольцевой остаток в арильной группе, имеющий число атомов углерода от 6 до 14. Примеры «арена» включают бензол, нафталин и т.п., предпочтительно, бензол.
«Гетероциклическая группа» представляет собой 3-14-членную моноциклическую до трициклической гетероциклическую группу, содержащую в качестве атома кольца 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота. Любой атом углерода в качестве атома кольца может быть замещен оксогруппой, и атом серы или атом азота могут быть окислены до образования оксида. В дополнение, эта группа может быть конденсирована с бензольным кольцом. Например, можно указать пиридильную группу, пиридазинильную группу, пиримидинильную группу, пиразинильную группу, фурильную группу, тиенильную группу, пирролильную группу, изоксазолильную группу, оксазолильную группу, изотиазолильную группу, тиазолильную группу, пиразолильную группу, имидазолильную группу, оксадиазолильную группу, тиадиазолильную группу, триазолильную группу, тетразолильную группу, бензофуранильную группу, бензотиенильную группу, индолильную группу, изоиндолильную группу, бензоксазолильную группу (=бензооксазолильную группу), бензотиазолильную группу, бензимидазолильную группу (=бензоимидазолильную группу), индазолильную группу, бензизоксазолильную группу, бензизотиазолильную группу, бензофуразанильную группу, бензотиадиазолильную группу, пуринильную группу, хинолинильную группу, изохинолильную группу, циннолинильную группу, фталазинильную группу, хиназолинильную группу, хиноксалинильную группу, птеридинильную группу, имидазооксазолильную группу, имидазотиазолильную группу, имидазоимидазолильную группу, дибензофурильную группу, дибензотиенильную группу, карбазолильную группу, акридинильную группу, пирролидинильную группу, пиразолидинильную группу, имидазолидинильную группу, пирролинильную группу, пиразолинильную группу, имидазолинильную группу, тетрагидрофурильную группу, тетрагидротиофенильную группу, тиазолидинильную группу, пиперидильную группу, пиперазинильную группу, хинуклидинильную группу, тетрагидропиранильную группу, тетрагидротиопиранильную группу, морфолинильную группу, тиоморфолинильную группу, диоксоланильную группу, гомопиперидильную группу, гомопиперазинильную группу, индолинильную группу, изоиндолинильную группу, хроманильную группу, изохроманильную группу, тетрагидронафтиридинильную группу, азаиндолильную группу, тетрагидроизохинолинильную группу, азиридинильную группу, азетидинильную группу, дигидропиридильную группу и т.п. Предпочтительно, можно указать тиадиазолильную группу, имидазолильную группу, 1Н-тетразолильную группу, пиперидильную группу, пиперазинильную группу, тиазолидинильную группу, тетрагидроизохинолинильную группу, азиридинильную группу, азетидинильную группу, тетрагидрофурильную группу, дигидропиридильную группу и т.п. Примеры «С3-8 гетероциклической группы» включают гетероциклическую группу с 3-8 атомами углерода в качестве атомов кольца, из числа указанных выше гетероциклических групп. Примеры «С3-6 гетероциклической группы» включают гетероциклическую группу с 3-6 атомами углерода в качестве атомов кольца, из числа указанных выше гетероциклических групп. Примеры «С1-8 гетероциклической группы» включают гетероциклическую группу с 1-8 атомами углерода в качестве атомов кольца, из числа указанных выше гетероциклических групп.
«Гетероцикл» представляет собой 3-14-членную моноциклическую до трициклической гетероциклическую группу, содержащую в качестве атома кольца 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота. Любой атом углерода в качестве атома кольца может быть замещен оксогруппой, и атом серы или атом азота может быть окислен до образования оксида. В дополнение, гетероцикл может быть конденсирован с бензольным кольцом. Например, можно указать пиридин, пиридазин, пиримидин, пиразин, фуран, тиофен, пиррол, изоксазол, оксазол, изотиазол, тиазол, пиразол, имидазол, оксадиазол, тиадиазол, триазол, тетразол, бензофуран, бензотиофен, индол, изоиндол, бензоксазол (=бензооксазол), бензотиазол, бензимидазол (=бензоимидазол), индазол, бензизоксазол, бензизотиазол, бензофуразан, бензотиадиазол, пурин, хинолин, изохинолин, циннолин, фталазин, хиназолин, хиноксалин, птеридин, имидазооксазол, имидазотиазол, имидазоимидазол, дибензофуран, дибензотиофен, карбазол, акридин, пирролидин, пиразолидин, имидазолидин, пирролин, пиразолин, имидазолин, тетрагидрофуран, тетрагидротиофен, тиазолидин, пиперидин, пиперазин, хинуклидин, тетрагидропиран, тетрагидротиопиран, морфолин, тиоморфолин, диоксолан, гомопиперидин, гомопиперазин, индолин, изоиндолин, хроман, изохроман, тетрагидронафтиридин, азаиндол, тетрагидроизохинолин, азиридин, азетидин, дигидропиридин и т.п. Предпочтительно, можно указать тиадиазол, имидазол, тетразол, пиперидин, пиперазин, тиазолидин, тетрагидроизохинолин, азиридин, азетидин, тетрагидрофуран, дигидропиридин и т.п. Примеры «С2-9 гетероцикла» включают гетероцикл с 2-9 атомами углерода в качестве атомов кольца, из числа указанных выше гетероциклов. Примеры «С3-9 гетероцикла» включают гетероцикл с 3-9 атомами углерода в качестве атомов кольца, из числа указанных выше гетероциклов. Примеры «С3-6 гетероцикла» включают гетероцикл с 3-6 атомами углерода в качестве атомов кольца, из числа указанных выше гетероциклов. Примеры «С1-6 гетероцикла» включают гетероцикл с 1-6 атомами углерода в качестве атомов кольца, из числа указанных выше гетероциклов.
«Серинпротеаза» в настоящем описании означает протеазу, имеющую в качестве каталитического остатка остаток серина, обладающий нуклеофильностью. Например, можно указать трипсин, химотрипсин, эластазу, энтеропептидазу, калликреин, тромбин, фактор Ха и триптазу, и т.п. Кроме того, термин «ингибирование серинпротеазы» в настоящем описании означает снижение или исчезновение активности указанной выше серинпротеазы. Предпочтительно, это представляет собой ингибирование активности интестинальных серинпротеаз, таких как трипсин, энтеропептидаза, химотрипсин, эластаза и т.п., особенно предпочтительно, ингибирование активностей трипсина и энтеропептидазы.
Ингибитор серинпротеазы согласно настоящему изобретению представляет собой двойной ингибитор, который одновременно ингибирует, по меньшей мере, трипсин и энтеропептидазу.
Диабет в настоящем описании означает сахарный диабет типа I и сахарный диабет типа II, причем предпочтение отдается сахарному диабету типа II.
В настоящем изобретении соединение, представленное формулой (I), или его фармацевтически приемлемая соль, являются предпочтительными, как следует ниже.
В формуле (I) R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой С1-4алкильную группу или С2-4алкенильную группу, или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют С3-8циклоалкановое кольцо. Предпочтительно, R1 и R2 являются одинаковыми или отличаются друг от друга, и каждый независимо представляет собой С1-4алкильную группу с линейной или разветвленной цепью (в особенности, метильную группу, этильную группу и т.п.) или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют С3-5циклоалкановое кольцо (в особенности, циклобутановое кольцо, циклопентановое кольцо и т.п.). Более предпочтительно, R1 и R2 независимо представляют собой С1-3алкильную группу (в особенности, метильную группу, этильную группу и т.п.), особо предпочтительно, метильную группу и этильную группу и т.п.
В другом аспекте также является предпочтительным, что R1 и R2 являются одинаковыми.
В еще одном аспекте R1 и R2, предпочтительно, оба, представляют собой метильную группу или этильную группу. В еще одном из аспектов R1 и R2, предпочтительно, оба, представляют собой метильные группы. В еще одном аспекте R1 и R2, предпочтительно, оба, представляют собой этильные группы.
В еще одном аспекте R1 и R2, предпочтительно, являются одинаковыми или различными, и каждый независимо представляет собой метильную группу, этильную группу или пропильную группу, или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют циклобутановое кольцо или циклопентановое кольцо.
В формуле (I) Х представляет собой -OR3, -NR4R5 или группу, представленную формулой (II):

предпочтительно, -NR4R5 или группу, представленную формулой (II), более предпочтительно, группу, представленную формулой (II). В еще одном аспекте Х, более предпочтительно, представляет собой -NR4R5. В еще одном аспекте Х, предпочтительно, представляет собой -OR3, более предпочтительно, -ОН.
В еще одном из аспектов Х, предпочтительно, представляет собой -ОН, -NR4R5 или группу, представленную формулой (II), и каждый из -NR4R5 и группы, представленной формулой (II), имеет одну карбоксильную группу, в особенности, Х представляет собой -ОН, с точки зрения стабильности и некоторых побочных эффектов.
В группе -OR3, R3 представляет собой атом водорода или С1-4алкильную группу, предпочтительно, атом водорода (то есть, -OR3, предпочтительно, представляет собой -ОН).
В группе -NR4R5, R4 и R5 являются одинаковыми или различными, и каждый независимо представляет собой атом водорода, С1-8алкильную группу, карбоксилС1-8алкильную группу или С3-8алкенильную группу, или R4 и R5, вместе с атомом азота, с которым они связаны, образуют С3-9 гетероцикл, где указанная С1-8алкильная группа, указанная С3-8алкенильная группа и указанный С3-9 гетероцикл могут быть замещены одним или более заместителями.
В другом аспекте, в группе -NR4R5, R4 и R5 являются одинаковыми или различными, и каждый независимо представляет собой атом водорода, С1-8алкильную группу, карбоксилС1-8алкильную группу или С3-8алкенильную группу, или R4 и R5, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл, где указанная С1-8алкильная группа, указанная карбоксилС1-8алкильная группа, указанная С3-8алкенильная группа и указанный С2-9 гетероцикл могут быть замещены одним или более заместителями.
Предпочтительно, R4 и R5 являются одинаковыми или различными, и каждый независимо представляет собой атом водорода, С1-8алкильную группу, карбоксилС1-8алкильную группу или С3-8алкенильную группу, где указанная С1-8алкильная группа, указанная карбоксилС1-8алкильная группа и указанная С3-8алкенильная группа могут быть замещены одним или более заместителями.
Более предпочтительно, R4 и R5 являются одинаковыми или различными, и каждый независимо представляет собой атом водорода, С1-3алкильную группу или карбоксилС1-3алкильную группу, где указанная С1-3алкильная группа и указанная карбоксилС1-3алкильная группа могут быть замещены одним или более заместителями.
В другом аспекте, предпочтительно, R4 представляет собой:
(1) карбоксилС1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из:
(а) гидроксильной группы,
(b) арильной группы (в особенности, фенильной группы и т.п.),
(с) С3-8циклоалкильной группы (в особенности, циклогексильной группы и т.п.),
(d) карбамоильной группы,
(е) аминогруппы,
(f) арильной группы (в особенности, фенильной группы и т.п.), необязательно замещенной гидроксильной группой,
(g) С1-3алкилкарбамоильной группы (в особенности, N-метилкарбамоильной группы и т.п.), необязательно замещенной карбоксильной группой, и
(h) С1-8 гетероциклической группы (в особенности, 1Н-тетразолильной группы и т.п.), или
(2) С1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из:
(а) сульфогруппы,
(b) цианогруппы,
(с) С1-8 гетероциклической группы (в особенности, 1Н-тетразолильной группы и т.п.), и
(d) арильной группы (в особенности, фенильной группы и т.п.), необязательно замещенной карбоксильной группой, и
R5 представляет собой атом водорода, С1-3алкильную группу, необязательно замещенную С3-8циклоалкильной группой (в особенности, циклопропильной группой и т.п.) или С3-8алкенильной группой; или
R4 и R5, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл, замещенный 1-3 заместителями, выбранными из группы, состоящей из:
(1) атома галогена (в особенности, атома фтора и т.п.),
(2) гидроксильной группы,
(3) карбоксильной группы, и
(4) карбоксилС1-3алкильной группы (в особенности, карбоксиметильной группы и т.п.).
Более предпочтительно, R4 представляет собой:
(1) карбоксилС1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из:
(а) гидроксильной группы,
(b) арильной группы (в особенности, фенильной группы и т.п.),
(с) С3-8циклоалкильной группы (в особенности, циклогексильной группы и т.п.),
(d) карбамоильной группы,
(е) аминогруппы,
(f) арильной группы (в особенности, фенильной группы и т.п.), необязательно замещенной карбоксильной группой или гидроксильной группой,
(g) С1-3алкилкарбамоильной группы (в особенности, N-метилкарбамоильной группы и т.п.), необязательно замещенной карбоксильной группой, и
(h) С1-8 гетероциклической группы (в особенности, 1Н-тетразолильной группы и т.п.), или
(2) С1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из:
(а) сульфогруппы,
(b) цианогруппы и
(с) С1-8 гетероциклической группы (в особенности, 1Н-тетразолильной группы и т.п.), и
R5 представляет собой атом водорода, С1-3алкильную группу, необязательно замещенную С3-8циклоалкильной группой (в особенности, циклопропильной группой и т.п.), или С3-8алкенильную группу.
В другом аспекте, предпочтительно, R4 представляет собой атом водорода, метильную группу, этильную группу, пропильную группу или пропенильную группу, и R5 представляет собой С3-4алкильную группу, имеющую 1 или 2 заместителя, выбранных из группы, состоящей из карбоксильной группы и гидроксильной группы.
В еще одном аспекте, предпочтительно, R4 представляет собой атом водорода, метильную группу, этильную группу, пропильную группу или пропенильную группу, и R5 представляет собой С1-6алкильную группу, имеющую 1 или 2 заместителя, выбранных из группы, состоящей из карбоксильной группы, гидроксильной группы, аминогруппы и карбамоильной группы.
В еще одном аспекте, предпочтительно, R4 и R5, каждый независимо, представляет собой атом водорода или С1-8алкильную группу.
В еще одном аспекте, предпочтительно, R4 и R5, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл, замещенный атомом галогена (в особенности, атомом фтора и т.п.), карбоксильной группой, карбоксилС1-3алкильной группой (в особенности, карбоксиметильной группой и т.п.) или гидроксильной группой.
В качестве С1-8алкильной группы или С1-3алкильной группы для R4 и R5 можно указать метильную группу, этильную группу, пропильную группу и т.п.
В качестве карбоксилС1-8алкильной группы для R4 и R5 можно указать карбоксилС1-8алкильную группу с линейной или разветвленной цепью, такую как 1,2-дикарбоксиэтильная группа, карбоксиметильная группа, 1-карбокси-1-метилэтильная группа, 1-карбокси-2-метилпропильная группа, 2-карбоксиэтильная группа, 1-карбоксиэтильная группа, 1,3-дикарбоксипропильная группа, 1-карбоксипропильная группа, 1-карбоксибутильная группа, 3-карбоксипропильная группа, 1-(карбоксиметил)-2-метилпропильная группа, 4-карбоксибутильная группа, 1,1-бис(2-карбоксиэтил)-3-карбоксипропильная группа и 5-карбоксипентильная группа; и циклическую карбоксилС3-8алкильную группу, такую как 1-карбоксициклопропильная группа, 1-карбоксициклобутильная группа, 2-карбоксициклогексильная группа и 3-карбоксициклогексильная группа.
В качестве карбоксилС1-3алкильной группы для R4 и R5 можно указать карбоксилС1-3алкильную группу с линейной или разветвленной цепью, такую как 1,2-дикарбоксиэтильная группа, карбоксиметильная группа, 1-карбокси-1-метилэтильная группа, 2-карбоксиэтильная группа, 1-карбоксиэтильная группа, 1,3-дикарбоксипропильная группа, 1-карбоксипропильная группа и 3-карбоксипропильная группа; и 1-карбоксициклопропильную группу.
В качестве С3-8алкенильной группы для R4 и R5 можно указать аллильную группу и т.п.
В одном аспекте, когда С1-8алкильная группа, карбоксилС1-8алкильная группа, С3-8алкенильная группа, С1-3алкильная группа или карбоксилС1-3алкильная группа для R4 или R5 имеет один или более заместителей, если не указано иное, примеры заместителя включают нитрогруппу, атом галогена, цианогруппу, гидроксильную группу, сульфанильную группу, аминогруппу, гуанидиногруппу, формильную группу, низшую ацильную группу, карбоксильную группу, сульфогруппу, фосфоногруппу, низшую алкоксильную группу, низшую алкилтиогруппу, низшую алкиламиногруппу, низшую ацилоксигруппу, низшую ациламиногруппу, низшую алкоксикарбонильную группу, карбамоильную группу, низшую алкилкарбамоильную группу, низшую алкилсульфониламиногруппу, арилсульфониламиногруппу, необязательно имеющую заместитель(и), циклоалкильную группу, необязательно имеющую заместитель(и), арильную группу, необязательно имеющую заместитель(и), арилоксигруппу, необязательно имеющую заместитель(и), арилтиогруппу, необязательно имеющую заместитель(и), аралкильную группу, необязательно имеющую заместитель(и), аралкилоксигруппу, необязательно имеющую заместитель(и), аралкилтиогруппу, необязательно имеющую заместитель(и), гетероциклическую группу, необязательно имеющую заместитель(и), гетероциклилоксигруппу, необязательно имеющую заместитель(и), гетероциклилтиогруппу, необязательно имеющую заместитель(и), оксогруппу и т.п. Атом галогена, гидроксильная группа, карбоксильная группа, сульфогруппа, цианогруппа, фосфоногруппа, низшая алкоксикарбонильная группа, арильная группа, необязательно имеющая заместитель(и), гетероциклическая группа, необязательно имеющая заместитель(и), оксогруппа и т.п. являются предпочтительными, и гидроксильная группа, карбоксильная группа, сульфогруппа, низшая алкоксикарбонильная группа и т.п. являются особенно предпочтительными. Карбоксильная группа, гидроксильная группа, карбоксилС1-3алкильная группа, С3-8алкенильная группа, атом галогена, карбамоильная группа, фенильная группа, аминогруппа, сульфогруппа, цианогруппа, С3-8циклоалкильная группа и С1-8 гетероциклическая группа, содержащая 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, и т.п., также являются предпочтительными. В качестве С1-8 гетероциклической группы, содержащей 1-4 гетероатома, можно предпочтительно указать 1Н-тетразолильную группу, 2,4-диоксо-1,3-тиазолидинильную группу и т.п. Число заместителей, предпочтительно, составляет 1-3, более предпочтительно, 1 или 2.
В другом аспекте, когда С1-8алкильная группа, карбоксилС1-8алкильная группа, С3-8алкенильная группа, С1-3алкильная группа или карбоксилС1-3алкильная группа для R4 или R5 имеет один или более заместителей, если не указано иное, примеры заместителя включают низшую алкилкарбамоильную группу, необязательно имеющую заместитель(и), гидроксильную группу, сульфогруппу, циклоалкильную группу, карбамоильную группу, аминогруппу, цианогруппу, арильную группу, необязательно имеющую заместитель(и), С1-8 гетероциклическую группу и т.п. Предпочтительные примеры заместителя включают С1-3алкилкарбамоильную группу (в особенности, N-метилкарбамоильную группу и т.п.), необязательно замещенную карбоксильной группой, гидроксильную группу, сульфогруппу, С3-8циклоалкильную группу (в особенности, циклопропильную группу, циклогексильную группу и т.п.), карбамоильную группу, аминогруппу, цианогруппу, арильную группу (в особенности, фенильную группу и т.п.), необязательно замещенную карбоксильной группой или гидроксильной группой, С1-8 гетероциклическую группу (в особенности, 1Н-тетразолильную группу и т.п.) и т.п. Число заместителей, предпочтительно, составляет 1-3, более предпочтительно, 1 или 2.
В качестве С2-9 гетероцикла или С3-9 гетероцикла (то есть, циклической аминогруппы), образованного R4 и R5, связанными друг с другом, предпочтительными являются азиридин, азетидин, пирролидин, пиперидин, тетрагидроизохинолин и т.п.
В одном варианте осуществления, когда С2-9 гетероцикл или С3-9 гетероцикл, образованный R4 и R5, связанными друг с другом, имеет один или более заместителей, если не указано иное, примеры заместителя включают нитрогруппу, атом галогена, цианогруппу, гидроксильную группу, сульфанильную группу, аминогруппу, гуанидиногруппу, формильную группу, низшую алкильную группу, низшую алкенильную группу, низшую алкинильную группу, низшую ацильную группу, карбоксильную группу, сульфогруппу, фосфоногруппу, низшую алкоксильную группу, низшую алкилтиогруппу, низшую алкиламиногруппу, низшую алкоксикарбонильную группу, карбамоильную группу, низшую алкилкарбамоильную группу, низшую алкилсульфониламиногруппу, сульфамоильную группу, оксогруппу и т.п. Карбоксильная группа, гидроксильная группа, карбоксилС1-3алкильная группа, С3-8алкенильная группа, атом галогена, карбамоильная группа, фенильная группа, аминогруппа, сульфогруппа и С1-8 гетероциклическая группа, содержащая 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, и т.п. являются предпочтительными. Гидроксильная группа, карбоксильная группа, сульфогруппа, фосфоногруппа, низшая алкоксикарбонильная группа и т.п., также являются предпочтительными. Число заместителей, предпочтительно, составляет 1-3, более предпочтительно, 1 или 2. В качестве С1-8 гетероциклической группы, содержащей 1-4 гетероатома, можно предпочтительно указать 1Н-тетразолильную группу, 2,4-диоксо-1,3-тиазолидинильную группу и т.п.
В другом аспекте, когда С2-9 гетероцикл или С3-9 гетероцикл, образованный R4 и R5, связанными друг с другом, имеет один или более заместителей, если не указано иное, примеры заместителя включают атом галогена, гидроксильную группу, карбоксильную группу, низшую алкильную группу, необязательно имеющую заместитель(и), и т.п. Предпочтительные примеры заместителя включают атом галогена (в особенности, атом фтора и т.п.), гидроксильную группу, карбоксильную группу, карбоксилС1-3алкильную группу (в особенности, карбоксилметильную группу и т.п.) и т.п. Число заместителей, предпочтительно, составляет 1-3, более предпочтительно, 1 или 2.
В формуле (II) R6 представляет собой атом водорода, С1-8алкильную группу, карбоксилС1-8алкильную группу или С3-8алкенильную группу, где указанная С1-8алкильная группа, указанная карбоксилС1-8алкильная группа и указанная С3-8алкенильная группа может быть замещена одним или более заместителями.
В еще одном аспекте в формуле (II) R6 представляет собой атом водорода, С1-8алкильную группу, карбоксилС1-8алкильную группу или С3-8алкенильную группу, где указанная С1-8алкильная группа и указанная С3-8алкенильная группа может быть замещена одним или более заместителями.
Предпочтительно, R6 представляет собой атом водорода, С1-8алкильную группу или С3-8алкенильную группу, где указанная С1-8алкильная группа и указанная С3-8алкенильная группа может быть замещена одним или более заместителями.
Более предпочтительно, R6 представляет собой атом водорода или С1-3алкильную группу, где указанная С1-3алкильная группа может быть замещена одним или более заместителями.
В еще одном аспекте, предпочтительно, R6 представляет собой атом водорода, С1-3алкильную группу, необязательно замещенную С3-8циклоалкильной группой (в особенности, циклопропильной группой и т.п.), или С3-8алкенильную группу.
В еще одном аспекте, предпочтительно, R6 представляет собой атом водорода или С1-8алкильную группу.
В качестве С1-3алкильной группы или С1-8алкильной группы для R6 можно указать метильную группу, пропильную группу и т.п. В качестве С3-8алкенильной группы для R6 можно указать аллильную группу.
Когда С3-8алкенильная группа, С1-3алкильная группа, С1-8алкильная группа или карбоксилС1-8алкильная группа для R6 имеет один или более заместителей, если не указано иное, примеры заместителя включают циклоалкильную группу. Предпочтительные примеры заместителя включают С3-8циклоалкильную группу (в особенности, циклопропильную группу и т.п.).
В формуле (II) Ra и Rb являются одинаковыми или различными, и каждый независимо представляет собой атом водорода, С1-8алкильную группу, карбоксилС1-8алкильную группу, карбоксильную группу, арильную группу, С3-6 гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, или С3-8циклоалкильную группу, или Ra и Rb, вместе с атомом(ами), с которым(и) они связаны, образуют С3-8циклоалкановое кольцо или С3-9 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, где указанная С1-8алкильная группа, указанная арильная группа, указанная С3-8циклоалкильная группа, указанное С3-8циклоалкановое кольцо и указанный С3-9 гетероцикл могут быть замещены одним или более заместителями.
В еще одном аспекте в формуле (II) Ra и Rb являются одинаковыми или различными, и каждый независимо представляет собой атом водорода, С1-8алкильную группу, карбоксилС1-8алкильную группу, карбоксильную группу, арильную группу, С3-6 гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, или С3-8циклоалкильную группу, или Ra и Rb, вместе с атомом(ами), с которым(и) они связаны, образуют С3-8циклоалкановое кольцо или С3-9 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, где указанная С1-8алкильная группа, указанная карбоксилС1-8алкильная группа, указанная арильная группа, указанная С3-6 гетероциклическая группа, указанная С3-8циклоалкильная группа, указанное С3-8циклоалкановое кольцо и указанный С3-9 гетероцикл могут быть замещены одним или более заместителями.
В формуле (II), когда Ra и Rb не образуют кольцо, предпочтительно, Ra и Rb являются одинаковыми или различными, и каждый независимо представляет собой атом водорода, фенильную группу, С1-8алкильную группу, карбоксильную группу или карбоксилС1-8алкильную группу, где указанная фенильная группа, указанная С1-8алкильная группа и указанная карбоксилС1-8алкильная группа могут быть замещены одним или более заместителями.
В формуле (II), когда Ra и Rb не образуют кольцо, более предпочтительно, Ra и Rb являются одинаковыми или различными, и каждый независимо представляет собой атом водорода или С1-3алкильную группу, где указанная С1-3алкильная группа может быть замещена одним или более заместителями.
В формуле (II), когда Ra и Rb образуют кольцо, указанное кольцо является, предпочтительно, С3-8циклоалкановым кольцом, которое может иметь один или более заместителей, более предпочтительно, циклопропановым, циклобутановым или циклопентановым кольцом, которые могут иметь один или более заместителей.
В другом аспекте, предпочтительно, Ra и Rb являются одинаковыми или различными, и каждый независимо представляет собой атом водорода или С1-8алкильную группу, или Ra и Rb, вместе с атомом(ами), с которым(и) они связаны, образуют С3-8циклоалкановое кольцо, где указанная С1-8алкильная группа и указанное С3-8циклоалкановое кольцо могут быть замещены группой, выбранной из группы, состоящей из карбоксильной группы, карбамоильной группы, гидроксильной группы, фенильной группы и С3-8циклоалкильной группы.
В еще другом аспекте, предпочтительно, Ra и Rb являются одинаковыми или различными, и каждый независимо представляет собой:
(1) атом водорода,
(2) С1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из (а) арильной группы (в особенности, фенильной группы), (b) гидроксильной группы, (с) карбамоильной группы и (d) С1-8 гетероциклической группы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из O, N и S (в особенности, 1Н-тетразолильной группы),
(3) карбоксилС1-8алкильную группу,
(4) арильную группу, необязательно замещенную гидроксильной группой,
(5) С3-6 гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, или
(6) С3-8циклоалкильную группу, или
Ra и Rb, вместе с атомом(ами), с которым(и) они связаны, образуют С3-8циклоалкановое кольцо или С3-9 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, каждый из которых необязательно замещен оксогруппой.
В качестве С1-8алкильной группы или С1-3алкильной группы для Ra и Rb можно указать метильную группу, этильную группу, пропильную группу, изопропильную группу, втор-бутильную группу и т.п.
В качестве карбоксилС1-8алкильной группы для Ra и Rb можно указать карбоксиметильную группу, 2-карбоксиэтильную группу и т.п. В качестве арильной группы для Ra и Rb можно указать фенильную группу. В качестве С3-6 гетероциклической группы для Ra и Rb можно указать 1Н-тетразолильную группу и т.п. В качестве С3-8циклоалкильной группы для Ra и Rb можно указать циклогексильную группу и т.п.
Когда С1-8алкильная группа, С1-3алкильная группа, карбоксилС1-8алкильная группа, арильная группа, С3-6 гетероциклическая группа или С3-8циклоалкильная группа для Ra или Rb могут иметь один или более заместителей, если не указано иное, примеры заместителя включают нитрогруппу, атом галогена, цианогруппу, гидроксильную группу, сульфанильную группу, аминогруппу, гуанидиногруппу, формильную группу, низшую ацильную группу, карбоксильную группу, сульфогруппу, фосфоногруппу, низшую алкоксильную группу, низшую алкилтиогруппу, низшую алкиламиногруппу, низшую ацилоксигруппу, низшую ациламиногруппу, низшую алкоксикарбонильную группу, карбамоильную группу, низшую алкилкарбамоильную группу, низшую алкилсульфониламиногруппу, арилсульфониламиногруппу, необязательно имеющую заместитель(и), циклоалкильную группу, необязательно имеющую заместитель(и), арильную группу, необязательно имеющую заместитель(и), арилоксигруппу, необязательно имеющую заместитель(и), арилтиогруппу, необязательно имеющую заместитель(и), аралкильную группу, необязательно имеющую заместитель(и), аралкилоксигруппу, необязательно имеющую заместитель(и), аралкилтиогруппу, необязательно имеющую заместитель(и), гетероциклическую группу, необязательно имеющую заместитель(и), гетероциклилоксигруппу, необязательно имеющую заместитель(и), гетероциклилтиогруппу, необязательно имеющую заместитель(и), оксогруппу и т.п. Карбоксильная группа, гидроксильная группа, фенильная группа, аминогруппа, низшая алкилтиогруппа, сульфанильная группа, карбамоильная группа, гуанидиногруппа, С3-8циклоалкильная группа, С1-8 гетероциклическая группа, содержащая 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, и т.п. являются предпочтительными, и гидроксильная группа, карбоксильная группа, сульфогруппа, низшая алкоксикарбонильная группа, 1Н-тетразолильная группа и т.п. являются особенно предпочтительными.
В еще одном аспекте, когда С1-8алкильная группа, С1-3алкильная группа, карбоксилС1-8алкильная группа, арильная группа, С3-6 гетероциклическая группа или С3-8циклоалкильная группа для Ra и Rb имеет один или более заместителей, если не указано иное, примеры заместителя включают (а) арильную группу (в особенности, фенильную группу), (b) гидроксильную группу, (с) карбамоильную группу и (d) С1-8 гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из O, N и S (в особенности, 1Н-тетразолильную группу), являются особенно предпочтительными.
В еще одном аспекте, когда Ra или Rb имеет заместитель(и), если не указано иное, указанный выше заместитель выбирают из группы, состоящей из карбоксильной группы, гидроксильной группы, фенильной группы, аминогруппы, метилтиогруппы, сульфанильной группы, карбамоильной группы, гуанидиногруппы, С3-8циклоалкильной группы и С1-8 гетероциклической группы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из O, N и S.
В качестве С3-8циклоалканового кольца, образованного Ra и Rb, связанных друг с другом, можно указать циклопропановое кольцо, циклобутановое кольцо, циклопентановое кольцо и т.п., причем, циклопропановое кольцо и циклобутановое кольцо являются предпочтительными.
В качестве С3-9 гетероциклического кольца, образованного Ra и Rb, связанными друг с другом, можно указать тетрагидрофурановое кольцо, пирролидиновое кольцо и т.п., причем тетрагидрофурановое кольцо является предпочтительным.
Когда С3-8циклоалкановое кольцо, С3-9 гетероцикл, циклопропановое кольцо, циклобутановое кольцо или циклопентановое кольцо, образованные Ra и Rb, связанными друг с другом, имеют один или более заместителей, если не указано иное, примеры заместителя включают нитрогруппу, атом галогена, цианогруппу, гидроксильную группу, сульфанильную группу, аминогруппу, гуанидиногруппу, формильную группу, низшую алкильную группу, низшую алкенильную группу, низшую алкинильную группу, низшую ацильную группу, карбоксильную группу, сульфогруппу, фосфоногруппу, низшую алкоксильную группу, низшую алкилтиогруппу, низшую алкиламиногруппу, низшую алкоксикарбонильную группу, карбамоильную группу, низшую алкилкарбамоильную группу, низшую алкилсульфониламиногруппу, сульфамоильную группу, оксогруппу и т.п. Карбоксильная группа, гидроксильная группа, оксогруппа, фенильная группа, аминогруппа, низшая алкилтиогруппа, сульфанильная группа, карбамоильная группа, гуанидиногруппа, С3-8 гетероциклическая группа, содержащая 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, С3-8циклоалкильная группа и т.п. являются предпочтительными, причем оксогруппа является более предпочтительной. Число заместителей, предпочтительно, составляет 1-3, более предпочтительно, 1 или 2, особенно предпочтительно, 1.
В формуле (II) кольцо А представляет собой арен (в особенности, бензол и т.п.), С3-6 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из O, N и S (в особенности, пиридин и т.п.), или С3-8циклоалкановое кольцо (в особенности, циклогексан и т.п.).
В еще одном аспекте в формуле (II) кольцо А представляет собой арен (в особенности, бензол и т.п.), С3-6 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из O, N и S (в особенности, пиридин, 1,2-дигидропиридин, тетрагидрофуран и т.п.), С3-8циклоалкановое кольцо (в особенности, циклогексановое кольцо и т.п.) или С3-8циклоалкеновое кольцо (в особенности, циклогексеновое кольцо и т.п.), где указанный выше С3-6 гетероцикл, указанное С3-8циклоалкановое кольцо и указанное С3-8циклоалкеновое кольцо (предпочтительно, указанный выше С3-6 гетероцикл) могут быть дополнительно замещены оксогруппой, в дополнение к Ya и Yb.
В формуле (II) кольцо А, предпочтительно, представляет собой бензольное кольцо, пиридиновое кольцо, 1,2-дигидропиридиновое кольцо или С3-6 гетероцикл, содержащий 1-4 атома кислорода (в особенности, тетрагидрофурановое кольцо и т.п.), более предпочтительно, бензольное кольцо, пиридиновое кольцо или С3-6 гетероцикл, содержащий 1-4 атома кислорода (в особенности, тетрагидрофуран и т.п.), еще более предпочтительно, бензольное кольцо или пиридиновое кольцо наиболее предпочтительно, бензольное кольцо, где указанный выше 1,2-дигидропиридин и указанный выше С3-6 гетероцикл, содержащий 1-4 атома кислорода, могут быть дополнительно замещены оксогруппой, в дополнение к Ya и Yb.
В формуле (II) Ya представляет собой атом водорода, атом галогена, карбоксильную группу, гидроксильную группу, карбонильную группу (например, С1-3алкоксикарбонильную группу), карбоксилС1-3алкильную группу или сульфогруппу.
В еще одном аспекте в формуле (II) Ya представляет собой атом водорода, атом галогена, карбоксильную группу, гидроксильную группу, С1-3алкоксикарбонильную группу, карбоксилС1-3алкильную группу или сульфогруппу.
В формуле (II) Ya, предпочтительно, представляет собой карбоксильную группу, карбоксилС1-3алкильную группу, гидроксильную группу, сульфогруппу, атом галогена или С1-3алкоксикарбонильную группу, более предпочтительно, карбоксильную группу, карбоксилС1-3алкильную группу, гидроксильную группу или атом галогена, еще более предпочтительно, карбоксильную группу или карбоксилС1-3алкильную группу.
В качестве атома галогена для Ya можно указать атом фтора и т.п. В качестве карбоксилС1-3алкильной группы для Ya можно указать карбоксиметильную группу. В качестве С1-3алкоксикарбонильной группы для Ya можно указать метоксикарбонильную группу и т.п.
В формуле (II) Yb представляет собой атом водорода, атом галогена, карбоксильную группу, гидроксильную группу, карбонильную группу (например, С1-3алкоксикарбонильная группа), карбоксилС1-3алкильную группу, нитрогруппу, цианогруппу или С1-3алкоксильную группу.
В еще одном аспекте в формуле (II) Yb представляет собой атом водорода, атом галогена, карбоксильную группу, гидроксильную группу, С1-3алкоксикарбонильную группу, карбоксилС1-3алкильную группу, нитрогруппу, цианогруппу или С1-3алкоксильную группу.
В формуле (II) Yb, предпочтительно, представляет собой атом водорода, С1-3алкоксикарбонильную группу, гидроксильную группу или атом галогена, более предпочтительно, карбоксильную группу или гидроксильную группу.
В еще одном аспекте в формуле (II) Yb, предпочтительно, представляет собой атом водорода, атом галогена, карбоксильную группу или гидроксильную группу.
В еще одном аспекте в формуле (II) Yb, предпочтительно, представляет собой атом водорода, карбоксильную группу, гидроксильную группу, С1-3алкоксикарбонильную группу или С1-3алкоксильную группу.
В качестве С1-3алкоксикарбонильной группы для Yb можно указать метоксикарбонильную группу и т.п. В качестве С1-3алкоксильной группы для Yb можно указать метоксигруппу и т.п.
В формуле (II) p равен 0, 1, 2, 3 или 4, предпочтительно, 0, 1, 2 или 3, более предпочтительно, 0, 1 или 2.
В формуле (II) q равен 0 или 1, предпочтительно, 1.
В формуле (II) предпочтительными комбинациями р и q являются такие, когда р равен 1 или 2, и q равен 0, и, когда р равен 0 или 1, и q равен 1, дальнейшими предпочтительными комбинациями являются такие, когда р равен 1 или 2, и q равен 0, или, когда р равен 0, и q равен 1.
В формуле (I) R7 представляет собой атом водорода, атом галогена или нитрогруппу, предпочтительно, атом водорода, атом галогена, такой как атом фтора или атом хлора, более предпочтительно, атом галогена, такой как атом фтора или атом хлора, еще более предпочтительно, атом фтора. Взаимоотношение структура-активность для вариации относительно этого заместителя полностью подтверждены предыдущей заявкой авторов настоящего изобретения, WO-2011/071048, которая включена во всей ее полноте в данное описание посредством ссылки.
В еще одном предпочтительном варианте осуществления в формуле (I) Х представляет собой -OR3 или -NR8R9, предпочтительно, -OR3, более предпочтительно, -ОН.
R8 представляет собой необязательно замещенную С1-8алкильную группу, необязательно замещенную арильную группу, необязательно замещенную С3-6 гетероциклическую группу, необязательно замещенную С3-8циклоалкильную группу или необязательно замещенную С3-8циклоалкенильную группу, и
R9 представляет собой атом водорода, необязательно замещенную С1-8алкильную группу или необязательно замещенную С3-8алкенильную группу; или
R8 и R9, вместе с атомом азота, с которым они связаны, образуют необязательно замещенный С2-9 гетероцикл.
Предпочтительно, R8 представляет собой:
(1) С1-8алкильную группу (например, метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, пентильную группу, 1,2-диметилбутильную группу, 1,1-диэтилпропильную группу), необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из:
(а) карбоксильной группы,
(b) гидроксильной группы,
(с) арильной группы (например, фенильной группы), необязательно замещенной карбоксильной группой или гидроксильной группой,
(d) сульфогруппы,
(е) С3-8циклоалкильной группы (например, циклогексильной группы),
(f) карбамоильной группы,
(g) аминогруппы,
(h) цианогруппы,
(i) С1-8 гетероциклической группы (например, 1Н-тетразолильной группы), и
(j) С1-3алкилкарбамоильной группы (например, N-метилкарбамоильной группы), необязательно замещенной карбоксильной группой,
(2) арильной группы (например, фенильной группы), необязательно замещенной 1-3 заместителями, выбранными из группы, состоящей из:
(а) карбоксильной группы,
(b) гидроксильной группы,
(с) С1-3алкильной группы (например, метильной группы), необязательно замещенной карбоксильной группой,
(d) С1-3алкоксикарбонильной группы (например, метоксикарбонильной группы) и
(е) сульфогруппы,
(3) С3-6 гетероциклическую группу (например, тетрагидрофурильную группу, пиридильную группу, 1,2-дигидропиридильную группу), необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из:
(а) оксогруппы,
(b) С1-3алкоксильной группы (например, метоксигруппы) и
(с) атома галогена (например, атома фтора),
(4) С3-8циклоалкильную группу (например, циклопропильную группу, циклобутильную группу, циклогексильную группу), необязательно замещенную карбоксильной группой, или
(5) С3-8циклоалкенильную группу (например, циклогексенильную группу), необязательно замещенную карбоксильной группой, и
R9 представляет собой атом водорода, С1-8алкильную группу (например, метильную группу, пропильную группу), необязательно замещенную С3-8циклоалкильной группой (например, циклопропильной группой) или С3-8алкенильной группой (например, аллильной группой); или
R8 и R9, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл (например, азиридин, азетидин, пирролидин, пиперидин, тетрагидроизохинолин), необязательно замещенный 1-3 заместителями, выбранными из группы, состоящей из:
(1) карбоксильной группы,
(2) С1-3алкильной группы (например, метильной группы), необязательно замещенной карбоксильной группой,
(3) атома галогена (например, атома фтора), и
(4) гидроксильной группы.
В более предпочтительном варианте осуществления Х предпочтительно представляет собой -ОН или -NR8’R9’, более предпочтительно, -ОН, с точки зрения стабильности и некоторых побочных эффектов.
R8’ представляет собой замещенную С1-8алкильную группу, замещенную арильную группу, замещенную С3-6 гетероциклическую группу, замещенную С3-8циклоалкильную группу или замещенную С3-8циклоалкенильную группу, каждая из которых имеет одну карбоксильную группу, и
R9’ представляет собой атом водорода, необязательно замещенную С1-8алкильную группу, которая не имеет карбоксильной группы, или необязательно замещенную С3-8алкенильную группу, которая не имеет карбоксильной группы; или
R8’ и R9’, вместе с атомом азота, с которым они связаны, образуют замещенный С2-9 гетероцикл, который имеет одну карбоксильную группу.
Предпочтительно, R8’ представляет собой:
(1) С1-8алкильную группу (например, метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, пентильную группу, 1,2-диметилбутильную группу, 1,1-диэтилпропильную группу), замещенную 1-3 заместителями, выбранными из группы, состоящей из:
(а) карбоксильной группы,
(b) гидроксильной группы,
(с) арильной группы (например, фенильной группы), необязательно замещенной карбоксильной группой или гидроксильной группой,
(d) сульфогруппы,
(е) С3-8циклоалкильной группы (например, циклогексильной группы),
(f) карбамоильной группы,
(g) аминогруппы,
(h) цианогруппы,
(i) С1-8 гетероциклической группы (например, 1Н-тетразолильной группы) и
(j) С1-3алкилкарбамоильной группы (например, N-метилкарбамоильной группы), необязательно замещенной карбоксильной группой,
при условии, что указанная замещенная С1-8алкильная группа имеет одну карбоксильную группу,
(2) арильную группу (например, фенильную группу), замещенную 1-3 заместителями, выбранными из группы, состоящей из:
(а) карбоксильной группы,
(b) гидроксильной группы,
(с) С1-3алкильной группы (например, метильной группы), необязательно замещенной карбоксильной группой,
(d) С1-3алкоксикарбонильной группы (например, метоксикарбонильной группы) и
(е) сульфогруппы,
при условии, что указанная замещенная арильная группа имеет одну карбоксильную группу,
(3) С3-8циклоалкильную группу (например, циклопропильную группу, циклобутильную группу, циклогексильную группу), замещенную одной карбоксильной группой, или
(4) С3-8циклоалкенильную группу (например, циклогексенильную группу), замещенную одной карбоксильной группой, и
R9’ представляет собой атом водорода, С1-8алкильную группу (например, метильную группу, пропильную группу), необязательно замещенную С3-8циклоалкильной группой (например, циклопропильной группой) или С3-8алкенильной группой (например, аллильной группой); или
R8’ и R9’, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл (например, азиридин, азетидин, пирролидин, пиперидин, тетрагидроизохинолин), замещенный 1-3 заместителями, выбранными из группы, состоящей из:
(1) карбоксильной группы,
(2) С1-3алкильной группы (например, метильной группы), необязательно замещенной карбоксильной группой,
(3) атома галогена (например, атома фтора) и
(4) гидроксильной группы,
при условии, что указанный выше замещенный С2-9 гетероцикл, образованный R8’ и R9’, имеет одну карбоксильную группу.
Более предпочтительно, R8’ представляет собой:
(1) С1-8алкильную группу (например, метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, пентильную группу, 1,2-диметилбутильную группу), замещенную 1-3 заместителями, выбранными из группы, состоящей из:
(а) карбоксильной группы,
(b) гидроксильной группы,
(с) арильной группы (например, фенильной группы), необязательно замещенной карбоксильной группой или гидроксильной группой,
(d) С3-8циклоалкильной группы (например, циклогексильной группы),
(е) карбамоильной группы,
(f) аминогруппы,
(g) С1-8 гетероциклической группы (например, 1Н-тетразолильной группы) и
(h) С1-3алкилкарбамоильной группы (например, N-метилкарбамоильной группы), необязательно замещенной карбоксильной группой,
при условии, что указанная замещенная С1-8алкильная группа имеет одну карбоксильную группу,
(2) арильную группу (например, фенильную группу), замещенную 1-3 заместителями, выбранными из группы, состоящей из:
(а) карбоксильной группы,
(b) гидроксильной группы,
(с) С1-3алкильной группы (например, метильной группы), необязательно замещенной карбоксильной группой, и
(d) С1-3алкоксикарбонильной группы (например, метоксикарбонильной группы),
при условии, что указанная замещенная арильная группа имеет одну карбоксильную группу,
(3) С3-8циклоалкильную группу (например, циклопропильную группу, циклобутильную группу, циклогексильную группу), замещенную одной карбоксильной группой, или
(4) С3-8циклоалкенильную группу (например, циклогексенильную группу), замещенную одной карбоксильной группой, и
R9’ представляет собой атом водорода, С1-8алкильную группу (например, метильную группу, пропильную группу), необязательно замещенную С3-8циклоалкильной группой (например, циклопропильной группой) или С3-8алкенильной группой (например, аллильной группой); или
R8’ и R9’, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл (например, азиридин, азетидин, пирролидин, пиперидин, тетрагидроизохинолин), замещенный 1-3 заместителями, выбранными из группы, состоящей из:
(1) карбоксильной группы,
(2) С1-3алкильной группы (например, метильной группы), необязательно замещенной карбоксильной группой, и
(3) гидроксильной группы,
при условии, что указанный выше замещенный С2-9 гетероцикл, образованный R8’ и R9’, имеет одну карбоксильную группу.
В формуле (I), когда R1 и R2, оба, представляют собой метильные группы, тогда ни R4, ни R5, не являются этильной группой, замещенной двумя карбоксильными группами, и, когда R1 и R2, оба, представляют собой метильные группы, то группа, представленная формулой (II), не является группой, представленной формулой:
 .
.
В еще одном аспекте в формуле (I), когда R1 и R2, оба, представляют собой метильные группы, тогда Х не является группой, представленной формулой:
 .
.
В качестве предпочтительных вариантов осуществления соединения, представленного формулой (I), или его фармацевтически приемлемой соли, также может быть указано нижеследующее;
при условии, однако, что, когда R1 и R2, оба, представляют собой метильные группы, тогда Х не является группой, представленной формулой:
 ,
,
в формуле (I).
Соединение 1-А
Соединение, представленное формулой (I), где:
R1 и R2, оба, представляют собой метильные группы,
Х представляет собой -NR4R5, где
R4 представляет собой атом водорода, метильную группу, этильную группу, пропильную группу или пропенильную группу,
R5 представляет собой С3-4алкильную группу, имеющую 1 или 2 заместителя, выбранных из группы, состоящей из карбоксильной группы и гидроксильной группы, и
R7 представляет собой атом фтора,
или его фармацевтически приемлемая соль.
Соединение 1-В
Соединение, представленное формулой (I), где:
R1 и R2, оба, представляют собой этильные группы,
Х представляет собой -NR4R5, где
R4 представляет собой атом водорода, метильную группу, этильную группу, пропильную группу или пропенильную группу,
R5 представляет собой С1-6алкильную группу, имеющую 1 или 2 заместителя, выбранных из группы, состоящей из карбоксильной группы, гидроксильной группы, аминогруппы и карбамоильной группы, и
R7 представляет собой атом фтора,
или его фармацевтически приемлемая соль.
Соединение 1-С
Соединение, представленное формулой (I), где:
R1 и R2, оба, представляют собой метильные группы или этильную группу,
Х представляет собой группу, представленную формулой (II), где
R6 представляет собой атом водорода или метильную группу,
R7 представляет собой атом фтора,
р равен 0,
q равен 1,
кольцо А представляет собой фенильную группу, 3-пиридильную группу или 4-пиридильную группу,
Ya представляет собой атом водорода, карбоксильную группу, гидроксильную группу, метоксигруппу, карбоксиметильную группу, оксогруппу или атом галогена,
Yb представляет собой атом водорода или атом галогена,
или его фармацевтически приемлемая соль.
Соединение 2-А
Соединение, представленное формулой (I), где:
R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой С1-4алкильную группу или С2-4алкенильную группу, или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют С3-8циклоалкановое кольцо;
Х представляет собой -OR3, -NR4R5 или группу, представленную формулой (II), где
R3 представляет собой атом водорода или С1-4алкильную группу;
R4 представляет собой:
(1) карбоксилС1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из (а) гидроксильной группы, (b) арильной группы, (с) С3-8циклоалкильной группы, (d) карбамоильной группы, (е) аминогруппы, (f) арильной группы, необязательно замещенной гидроксильной группой, (g) С1-3алкилкарбамоильной группы, необязательно замещенной карбоксильной группой, и (h) С1-8 гетероциклической группы, или
(2) С1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из (а) сульфогруппы, (b) цианогруппы, (с) С1-8 гетероциклической группы и (d) арильной группы, необязательно замещенной карбоксильной группой, и
R5 представляет собой атом водорода, С1-3алкильную группу, необязательно замещенную С3-8циклоалкильной группой или С3-8алкенильной группой;
или
R4 и R5, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл, замещенный 1-3 заместителями, выбранными из группы, состоящей из (1) атома галогена, (2) гидроксильной группы, (3) карбоксильной группы и (4) карбоксилС1-3алкильной группы;
R6 представляет собой атом водорода, С1-3алкильную группу, необязательно замещенную С3-8циклоалкильной группой, или С3-8алкенильную группу;
и
Ra и Rb являются одинаковыми или различными, и каждый независимо представляет собой:
(1) атом водорода,
(2) С1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из (а) арильной группы, (b) гидроксильной группы, (с) карбамоильной группы и (d) С1-8 гетероциклической группы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из O, N и S,
(3) карбоксилС1-8алкильную группу,
(4) арильную группу, необязательно замещенную гидроксильной группой,
(5) С3-6 гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, или
(6) С3-8циклоалкильную группу, или
Ra и Rb, вместе с атомом(ами), с которым(и) они связаны, образуют С3-8циклоалкановое кольцо или С3-9 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, каждый из которых необязательно замещен оксогруппой;
кольцо А представляет собой арен, С3-6 гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из O, N и S, С3-8циклоалкановое кольцо или С3-8циклоалкеновое кольцо, где указанный С3-6 гетероцикл, указанное С3-8циклоалкановое кольцо и указанное С3-8циклоалкеновое кольцо могут быть дополнительно замещены оксогруппой, в дополнение к Ya и Yb;
Ya представляет собой атом водорода, атом галогена, карбоксильную группу, гидроксильную группу, С1-3алкоксикарбонильную группу, карбоксилС1-3алкильную группу или сульфогруппу;
Yb представляет собой атом водорода, атом галогена, карбоксильную группу, гидроксильную группу, С1-3алкоксикарбонильную группу, карбоксилС1-3алкильную группу, нитрогруппу, цианогруппу или С1-3алкоксильную группу;
p равен 0, 1, 2, 3 или 4;
q равен 0 или 1; и
R7 представляет собой атом водорода, атом галогена или нитрогруппу,
или его фармацевтически приемлемая соль.
Соединение 2-В
Соединение, представленное формулой (I), где:
R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой С1-4алкильную группу или С2-4алкенильную группу, или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют С3-8циклоалкановое кольцо;
Х представляет собой -OR3, где
R3 представляет собой атом водорода или С1-4алкильную группу; и
R7 представляет собой атом водорода, атом галогена или нитрогруппу,
или его фармацевтически приемлемая соль.
Соединение 2-С
Соединение, представленное формулой (I), где:
R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой С1-4алкильную группу или С2-4алкенильную группу, или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют С3-8циклоалкановое кольцо;
Х представляет собой -ОН, и
R7 представляет собой атом водорода, атом галогена или нитрогруппу,
или его фармацевтически приемлемая соль.
Соединение 2-А'
Соединение, представленное формулой (I), где:
R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой С1-4алкильную группу или С2-4алкенильную группу, или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют С3-8циклоалкановое кольцо;
Х представляет собой -OR3 или -NR8R9, где
R3 представляет собой атом водорода или С1-4алкильную группу;
R8 представляет собой:
(1) С1-8алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из (а) карбоксильной группы, (b) гидроксильной группы, (с) арильной группы, необязательно замещенной карбоксильной группой или гидроксильной группой, (d) сульфогруппы, (е) С3-8циклоалкильной группы, (f) карбамоильной группы, (g) аминогруппы, (h) цианогруппы, (i) С1-8 гетероциклической группы и (j) С1-3алкилкарбамоильной группы, необязательно замещенной карбоксильной группой,
(2) арильную группу, необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из (а) карбоксильной группы, (b) гидроксильной группы, (с) С1-3алкильной группы, необязательно замещенной карбоксильной группой, (d) С1-3алкоксикарбонильной группы и (е) сульфогруппы,
(3) С3-6 гетероциклическую группу, необязательно замещенную 1-3 заместителями, выбранными из группы, состоящей из (а) оксогруппы, (b) С1-3алкоксильной группы и (с) атома галогена,
(4) С3-8циклоалкильную группу, необязательно замещенную карбоксильной группой, или
(5) С3-8циклоалкенильную группу, необязательно замещенную карбоксильной группой, и
R9 представляет собой атом водорода, С1-8алкильную группу, необязательно замещенную С3-8циклоалкильной группой, или С3-8алкенильную группу;
или
R8 и R9, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл, необязательно замещенный 1-3 заместителями, выбранными из группы, состоящей из (1) карбоксильной группы, (2) С1-3алкильной группы, необязательно замещенной карбоксильной группой, (3) атома галогена и (4) гидроксильной группы; и
R7 представляет собой атом водорода, атом галогена или нитрогруппу,
или его фармацевтически приемлемая соль.
Соединение 2-В’
Соединение, представленное формулой (I), где:
R1 и R2 являются одинаковыми или различными, и каждый независимо представляет собой С1-4алкильную группу или С2-4алкенильную группу, или R1 и R2, вместе с атомом углерода, с которым они связаны, образуют С3-8циклоалкановое кольцо;
Х представляет собой -OН или -NR8’R9’, где
R8’ представляет собой:
(1) С1-8алкильную группу, замещенную 1-3 заместителями, выбранными из группы, состоящей из (а) карбоксильной группы, (b) гидроксильной группы, (с) арильной группы, необязательно замещенной карбоксильной группой или гидроксильной группой, (d) сульфогруппы, (е) С3-8циклоалкильной группы, (f) карбамоильной группы, (g) аминогруппы, (h) цианогруппы, (i) С1-8 гетероциклической группы и (j) С1-3алкилкарбамоильной группы, необязательно замещенной карбоксильной группой, при условии, что указанная замещенная С1-8алкильная группа имеет одну карбоксильную группу,
(2) арильную группу, замещенную 1-3 заместителями, выбранными из группы, состоящей из (а) карбоксильной группы, (b) гидроксильной группы, (с) С1-3алкильной группы, необязательно замещенной карбоксильной группой, (d) С1-3алкоксикарбонильной группы и (е) сульфогруппы, при условии, что указанная замещенная арильная группа имеет одну карбоксильную группу,
(3) С3-8циклоалкильную группу, замещенную одной карбоксильной группой, или
(4) С3-8циклоалкенильную группу, замещенную одной карбоксильной группой, и
R9’ представляет собой атом водорода, С1-8алкильную группу, необязательно замещенную С3-8циклоалкильной группой, или С3-8алкенильную группу;
или
R8’ и R9’, вместе с атомом азота, с которым они связаны, образуют С2-9 гетероцикл, замещенный 1-3 заместителями, выбранными из группы, состоящей из (1) карбоксильной группы, (2) С1-3алкильной группы, необязательно замещенной карбоксильной группой, (3) атома галогена и (4) гидроксильной группы; при условии, что указанный выше замещенный С2-9 гетероцикл, образованный R8’ и R9’, имеет одну карбоксильную группу; и
R7 представляет собой атом водорода, атом галогена или нитрогруппу,
или его фармацевтически приемлемая соль.
Соединение 3-А
Соединение, представленное любой из следующих формул:
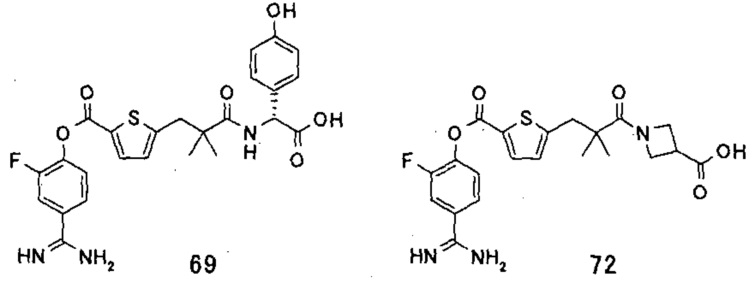
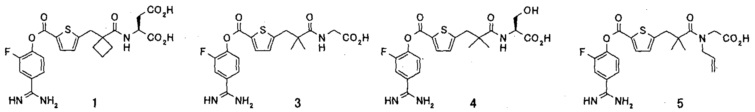
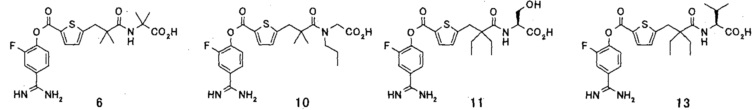
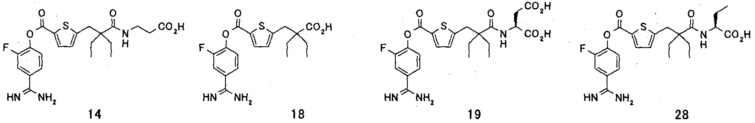
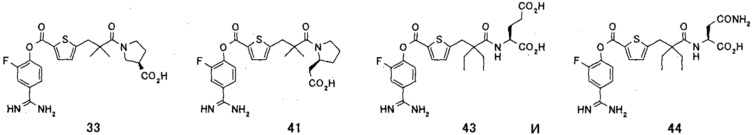 ,
,
или его фармацевтически приемлемая соль.
Соединение 3-В
Соединение, представленное любой из следующих формул:
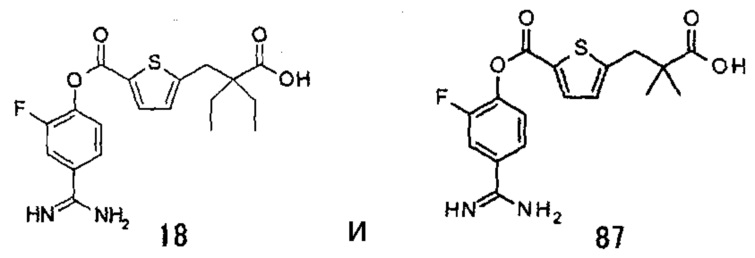 ,
,
или его фармацевтически приемлемая соль.
В качестве ингибирующей серинпротеазу активности, предпочтительной является активность одновременного ингибирования трипсина и энтеропептидазы.
Когда соединение по настоящему изобретению может образовывать соль, предпочтительной является фармацевтически приемлемая соль. Примеры таких фармацевтически приемлемых солей в случае соединения, имеющего кислотную группу, такую как карбоксильная группа и т.п., включают соль аммония, соли со щелочными металлами, такими как натрий, калий и т.п., соли со щелочноземельными металлами, такими как кальций, магний и т.п., соль алюминия, соль цинка, соли с органическими аминами, такими как триэтиламин, этаноламин, морфолин, пирролидин, пиперидин, пиперазин, дициклогексиламин и т.п., и соли с основными аминокислотами, такими как аргинин, лизин и т.п. Примеры таких фармацевтически приемлемых солей в случае соединения, имеющего основную группу, включают соли с неорганическими кислотами, такими как хлористоводородная кислота, серная кислота, фосфорная кислота, азотная кислота, бромистоводородная кислота и т.п., соли с органическими карбоновыми кислотами, такими как уксусная кислота, лимонная кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, винная кислота, янтарная кислота, дубильная кислота, масляная кислота, памоевая кислота, энантовая кислота, каприновая кислота, салициловая кислота, молочная кислота, щавелевая кислота, миндальная кислота, яблочная кислота и т.п., и соли с органическими сульфоновыми кислотами, такими как метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота и т.п.
Соединение по настоящему изобретению также охватывает все оптические изомеры, стереоизомеры, таутомеры, ротамеры и их смеси, в необязательных пропорциях. Они могут быть получены, каждый, в виде единственного продукта, в соответствии с само по себе известными способами синтеза и способами разделения. Например, оптический изомер может быть получен посредством использования оптически активного промежуточного продукта синтеза или посредством оптического разделения рацемата промежуточного продукта синтеза или конечного продукта стандартным способом.
Соединение по настоящему изобретению также включает сольваты этого соединения, такие как гидраты, спиртовые аддукты и т.п.
Соединение по настоящему изобретению может быть преобразовано в пролекарство. Пролекарство по настоящему изобретению представляет собой соединение, которое конвертируется в организме с высвобождением соединения по настоящему изобретению. Например, когда активная форма содержит карбоксильную группу или группу фосфорной кислоты, можно указать ее сложный эфир, ее амид и т.п. Когда активная форма содержит карбоксильную группу, можно указать группу, конвертируемую в карбоксильную группу путем окислительного метаболизма, такую как гидроксиметильная группа и т.п. Кроме того, когда активная форма содержит аминогруппу, примеры этой группы включают ее амид, ее карбамат и т.п. Когда активная форма содержит гидроксильную группу, примеры этой группы включают ее сложные эфиры, ее карбонаты, ее карбаматы и т.п. Когда соединение по настоящему изобретению преобразовывают в пролекарство, то оно может быть связано с аминокислотой или сахаридом.
Настоящее изобретение также охватывает метаболит соединения по настоящему изобретению. Метаболит соединения по настоящему изобретению представляет собой соединение, образованное в результате конверсии соединения по настоящему изобретению за счет фермента метаболического процесса и т.п. в организме. Например, можно указать соединение, где гидроксильная группа введена в бензольное кольцо соединения по настоящему изобретению вследствие метаболизма, соединение, где глюкуроновая кислота, глюкоза или аминокислота связаны с остатком карбоновой кислоты соединения по настоящему изобретению или добавлена гидроксильная группа посредством метаболизма, и т.п.
Соединение по настоящему изобретению и его фармацевтически приемлемая соль обладают превосходным, подавляющим повышение уровня глюкозы в крови, действием в случае млекопитающих, таких как люди, коровы, лошади, собаки, мыши, крысы, кошки и т.п., и они могут быть использованы в качестве лекарственного средства, которое вводят само по себе или в виде фармацевтической композиции, содержащей соединение или его соль, смешанное(ную) с фармацевтически приемлемым носителем, согласно самому по себе известному способу. Тогда как пероральное введение, как правило, является предпочтительным, также можно использовать парентеральное введение (например, такими путями, как внутривенное введение, подкожное введение, внутримышечное введение, введение в виде суппозитория, клизмы, мази, пластыря, сублингвальное введение, введение в виде глазных капель, введение в виде ингаляции и т.п.). Тогда как дозу, используемую для указанных выше целей, определяют в соответствии с желаемым в результате лечения эффектом, способом введения, длительностью лечения, возрастом, массой тела и т.п., используют суточную дозу, составляющую от 1 мкг до 10 г, для перорального введения, и от 0,01 мкг до 1 г, предпочтительно, от 0,1 мкг до 1 г, для парентерального введения, которую обычно вводят взрослому пероральным или парентеральным путем, от одной до нескольких частей в сутки. Кроме того, содержание соединения по настоящему изобретению в указанной выше фармацевтической композиции составляет примерно 0,01-100% масс., в расчете на всю композицию.
Примеры фармацевтически приемлемого носителя для фармацевтической композиции по настоящему изобретению включают различные органические или неорганические вещества-носители, обычно используемые в качестве веществ для получения. Например, можно указать эксципиент, лубрикант, связующее вещество, дезинтегрирующий агент, водорастворимый полимер и основную неорганическую соль в твердой готовой лекарственной форме; растворитель, солюбилизирующие агенты, суспендирующий агент, изотонический агент, буферирующий агент и успокоительный агент в жидкой готовой лекарственной форме, и т.п. Если необходимо, также можно использовать общепринятые добавки, такие как консервант, антиоксидант, краситель, подсластитель, окислитель, вспенивающий агент, вкусовая добавка и т.п.
Дозированная форма такой фармацевтической композиции может быть в виде таблетки, порошка, пилюли, гранулы, капсулы, суппозитория, раствора, покрытого сахаром средства, «депо», сиропа, суспензии, эмульсии, пастилки, сублингвального агента, адгезивной готовой формы, перорального дезинтегрирующего средства (таблетка), средства для ингаляции, клизмы, мази, пластыря, липкой ленты или глазных капель, и эти лекарственные формы могут быть получены, используя вспомогательные стандартные технологии изготовления лекарственных средств в соответствии с обычными способами.
Фармацевтическая композиция по настоящему изобретению может быть получена в соответствии со способом, обычно используемым в области составления фармацевтических композиций, например, способ, описанный в Japanese Pharmacopoeia, которая включена во всей ее полноте в данное описание посредством ссылки, и т.п. Конкретные способы получения готовой лекарственной формы подробно объяснены ниже.
Например, когда соединение по настоящему изобретению получают в виде перорального препарата, добавляют эксципиент и, если необходимо, связующее вещество, дезинтегрирующий агент, лубрикант, краситель, вкусовую добавку и т.п., и смесь подвергают обработке для получения, например, таблетки, порошка, пилюли, гранулы, капсулы, суппозитория, раствора, покрытого сахаром средства, «депо», сиропа и т.п., в соответствии со стандартным способом. Примеры эксципиента включают лактозу, кукурузный крахмал, сахарозу, глюкозу, сорбит, кристаллическую целлюлозу и т.п. Примеры связующего вещества включают поливиниловый спирт, простой поливиниловый эфир, этилцеллюлозу, метилцеллюлозу, гуммиарабик, трагакант, желатин, шеллак, гидроксипропилцеллюлозу, гидроксипропилкрахмал, поливинилпирролидон и т.п. Примеры дезинтегрирующего агента включают крахмал, агар, желатиновый порошок, кристаллическую целлюлозу, карбонат кальция, гидрокарбонат натрия, цитрат кальция, декстран, пектин и т.п. Примеры лубриканта включают стеарат магния, тальк, полиэтиленгликоль, диоксид кремния, гидрогенизированное растительное масло и т.п. В качестве красителя, используют такой, который приемлем для добавления к фармацевтическому продукту, и в качестве вкусовой добавки используют порошок какао, ментол, ароматическую кислоту, мятное масло, борнеол, порошкообразную кору коричного дерева и т.п. Где необходимо, на эти таблетки и гранулы наносят соответствующее покрытие, как например сахарное покрытие, желатиновое покрытие и т.п.
Когда должен быть получен инъекционный раствор, где необходимо, добавляют регулятор рН, буферирующий агент, стабилизатор, консервант и т.п., и смесь подвергают обработке для получения подкожного, внутримышечного или внутривенного инъекционного раствора согласно стандартному способу.
Тогда как соединение по настоящему изобретению может быть использовано в качестве средства для лечения или профилактики диабета, как указано выше, оно также может быть использовано в комбинации с другими терапевтическими средствами для лечения диабета и средствами для лечения или профилактики диабетических осложнений, которые обычно используют. Примеры терапевтических средств для лечения диабета и средств для лечения или профилактики диабетических осложнений, которые обычно используют, включают комбинации и смеси из одного или более типов инсулинового препарата, производного инсулина, инсулиноподобного средства, стимулятора секреции инсулина, сенсибилизатора инсулина, бигуанида, ингибитора глюконеогенеза, ингибитора абсорбции глюкозы, ингибитора реабсорбции глюкозы в почках, агониста β3-адренорецептора, глюкагоноподобного пептида-1 (7-37), аналогов глюкагоноподобного пептида-1 (7-37), агониста рецептора глюкагоноподобного пептида-1, ингибитора дипептидилпептидазы IV, ингибитора альдозоредуктазы, ингибитора образования конечного продукта повышенного гликозилирования, ингибитора гликогенсинтазакиназы-3, ингибитора гликогенфосфорилазы, антигиперлипидемического лекарственного средства, снижающего аппетит лекарственного средства, ингибитора липазы, антигипертензивного средства, улучшающего периферическое кровообращение средства, антиоксиданта, терапевтического лекарственного средства для лечения диабетической невропатии и т.п.
Лекарственное средство, используемое в комбинации с соединением по настоящему изобретению, может быть смешано для получения единого средства или каждое может быть получено в виде раздельных препаратов, или получено в виде комбинированного препарата (комплект, набор или блок), полученного путем упаковки каждого из раздельно составленных препаратов в один контейнер.
Форма введения комбинированного использования не является особо ограниченной и, например, можно указать (1) введение в виде единого препарата, (2) одновременное введение раздельных препаратов посредством одного и того же пути введения, (3) введение раздельных препаратов в ступенчатом порядке посредством одного и того же пути введения, (4) одновременное введение раздельных препаратов посредством различных путей введения, (5) введение раздельных препаратов в ступенчатом порядке посредством различных путей введения, и т.п.
Кроме того, соединение по настоящему изобретению также является пригодным даже, когда содержится в пищевом продукте.
Пищевая композиция, содержащая соединение по настоящему изобретению, является пригодной в виде пищевого продукта для лечения или профилактики диабета.
Термин «пищевой продукт» по настоящему изобретению представляет собой обычные пищевые продукты, которые включают пищевые продукты для специфицированного использования в отношении здоровья и пищевые продукты с притязаниями на питательную функцию, описанные в Food with Health Claims of Consumer Affairs Agency, Government of Japan, в дополнение к обычным пищевым продуктам, включая так называемую полноценную пищу, и дополнительно охватывает диетические добавки.
Форма пищевой композиции по настоящему изобретению не является особо ограниченной и эта композиция может находиться в любой форме, пока она может быть перорально проглатываемой.
Примеры такой формы включают порошок, гранулу, таблетку, твердые капсулы, мягкую капсулу, жидкость (напитки, желеобразные напитки и т.п.), леденец, шоколад и т.п., все из которых могут быть получены согласно самому по себе известному в данной области способом.
Содержание соединения по настоящему изобретению в пищевой композиции соответствующим образом определяют для получения соответствующей дозы в указанном диапазоне.
В пищевой композиции по настоящему изобретению можно использовать другие пищевые добавки, когда необходимо. Примеры таких пищевых добавок включают такие, которые обычно используются в качестве компонентов лечебных продуктов, такие как фруктовый сок, декстрин, циклический олигосахарид, сахариды (моносахариды, такие как фруктоза, глюкоза и т.п., и полисахариды), подкислитель, ароматизатор, порошкообразный зеленый чай и т.п., которые используют для контроля и улучшения вкуса, эмульгатор, коллаген, порошкообразное цельное молоко, загуститель полисахарида, агар и т.п., которые используют для улучшения текстуры, и дополнительно витамины, кальций из яичной скорлупы, пантотенат кальция, другие минералы, маточное молочко, прополис, мед, пищевая клетчатка, растворимый в воде экстракт из клеток плодового тела гриба Агарика бразильского, хитин, хитозан, флавониды, каротиноиды, лютеин, традиционное японское травяное лекарственное средство, хондроитин, различные аминокислоты и т.п.
Способ получения конкретного соединения, производного эфира гетероарилкарбоновой кислоты, представленного формулой (I), которое представляет собой соединение по настоящему изобретению, представлен ниже.
Производное эфира гетероарилкарбоновой кислоты (Н), представленное формулой (I), где Х представляет собой -OR3, и R3 является таким, как описано выше, может быть получено следующим образом.
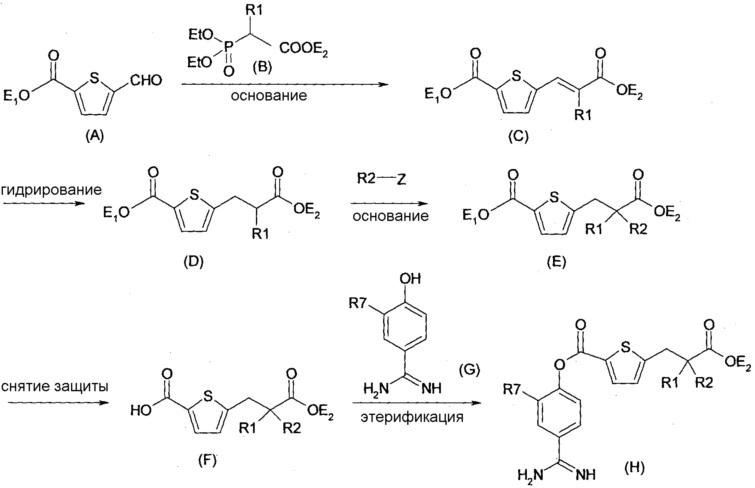
где Е1 представляет собой защитную группу, такую как метильная группа, этильная группа, трет-бутильная группа, бензильная группа и т.п., Е2 подобен R3, и R1, R2 и R7 являются такими, как описано выше.
Алкениленовое производное (С) может быть синтезировано путем взаимодействия альдегида (А) с реагентом Виттига (В), например, в растворителе, который не оказывает неблагоприятного влияния на реакцию, как например тетрагидрофуран, N,N-диметилформамид и т.п., в присутствии, например, основания, такого как гидрид натрия и т.п. Алкениленовое производное (С) может быть преобразовано в алкиленовое производное (D) путем гидрирования в присутствии катализатора, как, например, 10%-ный палладий-на-углероде, гидроксид палладия-на-углероде и т.п., в атмосфере водорода, в растворителе, который не оказывает неблагоприятного влияния на реакцию, как например этилацетат, метанол, тетрагидрофуран, дихлорметан, хлороформ и т.п.
После преобразования алкиленового производного (D) в енолят, с помощью основания, такого как бис(триметилсилил)азанид лития, диизопропиламид лития и т.п., в растворителе, как например тетрагидрофуран, N,N-диметилформамид и т.п., при низкой температуре, полученный продукт может быть подвергнут взаимодействию с R2-Z (где Z представляет собой удаляемую группу, такую как атом йода, атом брома и т.п.), что может приводить к получению диалкильного производного (Е).
Производное карбоновой кислоты (F) может быть получено путем снятия защиты с диалкильного производного (Е), например, путем гидролиза с помощью основания, такого как гидроксид натрия и т.п., путем гидролиза с помощью кислоты, такой как хлористоводородная кислота, трифторуксусная кислота и т.п., или путем обработки, например, 10%-ным палладием-на-углероде и т.п., в атмосфере водорода.
Производное эфира гетероарилкарбоновой кислоты (Н) может быть получено путем этерификации производного карбоновой кислоты (F) с производным амидинофенола (G).
Реакция этерификации может быть осуществлена известным способом, который, например, представляет собой (1) способ с использованием галогенангидрида кислоты, (2) способ с использованием конденсирующего агента, и т.п.
(1) Способ с использованием галогенангидрида кислоты осуществляют, например, путем взаимодействия хлорангидрида кислоты, полученного путем взаимодействия с тионилхлоридом, оксалилхлоридом и т.п., в растворителе, который не оказывает неблагоприятного влияния на реакцию, таком как дихлорметан, N-метилпирролидон и т.п., или без растворителя, в присутствии или в отсутствие, например, катализатора, такого как N,N-диметилформамид и т.п., со спиртом, в растворителе, который не оказывает неблагоприятного влияния на реакцию, таком как дихлорметан, тетрагидрофуран и т.п., в присутствии основания, такого как пиридин и триэтиламин.
(2) Способ с использованием конденсирующего агента осуществляют, например, путем взаимодействия карбоновой кислоты со спиртом, например, в растворителе, который не оказывает неблагоприятного влияния на реакцию, таком как тетрагидрофуран, N,N-диметилформамид, дихлорметан, 1,2-дихлорэтан, пиридин и т.п., например, в присутствии или в отсутствие основания, такого как пиридин, триэтиламин и т.п., при использовании конденсирующего агента, такого как 1-этил-3-(3'-диметиламинопропил)карбодиимид (WSC), 1,3-дициклогексилкарбодиимид и т.п.
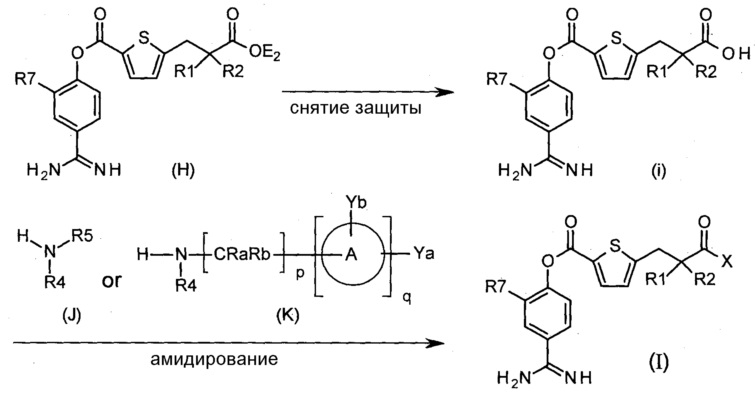
где каждый символ является таким, как описано выше, при условии, однако, что Х является другим, чем -OR3.
Производное эфира гетероарилкарбоновой кислоты (Н) может быть преобразовано в производное карбоновой кислоты (i) таким же образом, как в случае указанной выше реакции снятия защиты.
Производное эфира гетероарилкарбоновой кислоты (I) может быть получено путем амидирования производного карбоновой кислоты (i) с помощью амина (J) или (K). H-NR8R9 или H-NR8’R9’, где каждый символ является таким, как описано выше, может быть вместо амина (J) или (K). Реакцию амидирования производного карбоновой кислоты осуществляют, используя соответствующий амин вместо спирта, и таким же образом, как в случае указанной выше реакции этерификации.
Диалкильное производное (Е) также может быть синтезировано путем взаимодействия альфа-диалкилкарбоновой кислоты (L) с алкилгалогенидом (М) (где Z представляет собой удаляемую группу, такую как атом хлора, атом брома и т.п.).
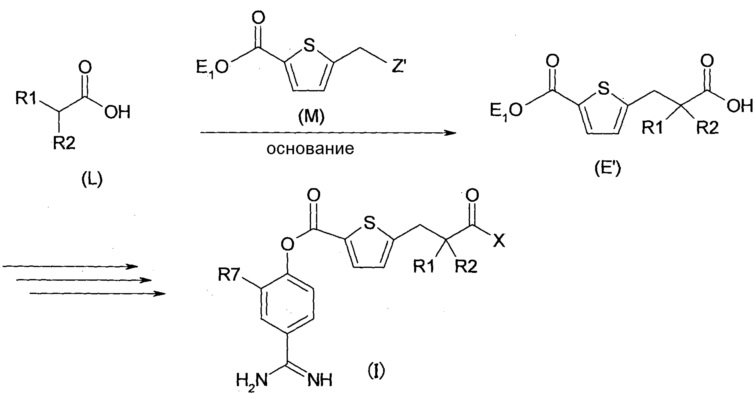
где каждый символ является таким, как описано выше.
После преобразования альфа-диалкилкарбоновой кислоты (L) в енолят, с помощью основания, такого как бис(триметилсилил)азанид лития, диизопропиламид лития и т.п., в растворителе, как, например, тетрагидрофуран, N,N-диметилформамид и т.п., при низкой температуре, полученный продукт может быть подвергнут взаимодействию с алкилгалогенидом (М), и это приводит к получению диалкильного производного (Е').
Диалкильное производное (Е') может быть преобразовано в производное эфира гетероарилкарбоновой кислоты (I) таким же образом, как в случае вышеуказанного введения защиты, снятия защиты, этерификации и амидирования.
Амины (J) или (K) могут быть получены в соответствии со следующими примерами или любыми известными способами.
Другие признаки настоящего изобретения станут очевидны в ходе следующего описания конкретных вариантов осуществления, которые приводятся для иллюстрации настоящего изобретения и не предназначены для ограничения настоящего изобретения.
ПРИМЕРЫ
Пример 1
Синтез трифторацетата N-[1-{5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-илметил}циклобутилкарбонил]-L-аспарагиновой кислоты (соединение 1)
Стадия 1. Синтез гидрохлорида 3-фтор-4-гидроксибензамидина
К 3-фтор-4-гидроксибензонитрилу (7,56 г, 55,2 ммоль) добавляют этанол (20 мл) и 4н раствор хлористого водорода в 1,4-диоксане (100 мл), и смесь перемешивают при комнатной температуре. Спустя 5 суток, смесь концентрируют и сушат с помощью вакуумного насоса. Затем смесь растворяют в этаноле (100 мл), добавляют карбонат аммония (11,0 г, 115 ммоль) и смесь перемешивают при комнатной температуре. Спустя 12 часов, растворитель выпаривают, и остаток растворяют в воде (100 мл). Смесь лиофилизируют, с получением указанного в заголовке соединения (11,2 г, количественный выход).
1H-ЯМР (300 МГц, ДМСО-d6) δ 11,28 (1H, ушир.с), 9,19 (2H, ушир.с), 9,02 (2H, ушир.с), 7,75 (1H, дд, J=2,4, 12,0 Гц), 7,59 (1H, м), 7,18 (1H, дд, J=8,4, 8,7 Гц).
МС (ESI) m/z: 155 (М+Н)+.
Стадия 2. Синтез трет-бутилового эфира 5-формил-2-тиофенкарбоновой кислоты
К раствору 5-формил-2-тиофенкарбоновой кислоты (25 г, 0,16 моль) в трет-бутиловом спирте (200 мл) и дихлорметане (100 мл) добавляют ди-трет-бутилдикарбонат (41 г, 0,19 моль), N,N-диметиламинопиридин (2,0 г, 0,016 моль) и пиридин (5 мл), и смесь перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь концентрируют при пониженном давлении. Остаток добавляют к этилацетату и 0,5н раствору хлористоводородной кислоты, органический слой отделяют, и водный слой два раза экстрагируют этилацетатом. Органические слои объединяют, промывают 0,5н раствором гидроксида натрия и насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель из фильтрата, после фильтрования, выпаривают при пониженном давлении, с получением указанного в заголовке соединения (32,1 г, 0,15 моль, выход 94%).
1H-ЯМР (400 МГц, CDCl3) δ 9,95 (1H, с), 7,75 (1H, д, J=4,0 Гц), 7,70 (1H, д, J=4,0 Гц), 1,59 (9H, с).
Стадия 3. Синтез трет-бутилового эфира 5-хлорметил-2-тиофенкарбоновой кислоты
К раствору трет-бутилового эфира 5-формил-2-тиофенкарбоновой кислоты (5 г, 23,6 ммоль) в тетрагидрофуране (50 мл) и метаноле (5 мл) добавляют боргидрид натрия (0,50 г, 13,0 ммоль) при температуре 0°С, и смесь перемешивают в течение 2 часов при комнатной температуре. Реакционную смесь распределяют между этилацетатом и 0,5н раствором хлористоводородной кислоты. Водный слой экстрагируют этилацетатом, и объединенные органические слои промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель удаляют при пониженном давлении и полученный остаток растворяют в дихлорметане (100 мл), добавляют метансульфонилхлорид (1,9 мл, 24 ммоль) и диизопропилэтиламин (5,7 мл, 33 ммоль) при температуре 0°С, и смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают при пониженном давлении, к остатку добавляют 0,5н раствор хлористоводородной кислоты и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, с получением указанного в заголовке соединения (5,3 г, 23 ммоль).
1H ЯМР (400 МГц, CDCl3) δ 7,56 (1H, д, J=3,8 Гц), 7,03 (1H, д, J=3,8 Гц), 4,75 (2H, с), 1,57 (9H, с).
Стадия 4. Синтез 1-{5-(трет-бутоксикарбонил)тиофен-2-илметил}циклобутилкарбоновой кислоты
К раствору диизопропиламина (905 мкл, 6,44 ммоль) в тетрагидрофуране (0,5 мл) добавляют н-бутиллитий (3,9 мл, 1,65М раствор в гексане) при температуре -78°С. После перемешивания при температуре 0°С в течение 25 минут, смесь охлаждают до температуры -78°С. К реакционной смеси добавляют циклобутилкарбоновую кислоту (372 мкл, 3,58 ммоль) и перемешивают при комнатной температуре в течение 15 минут. После охлаждения до температуры -78°С, к реакционной смеси добавляют трет-бутиловый эфир 5-хлорметил-2-тиофенкарбоновой кислоты, полученный на стадии 3 (333 мг, 1,43 ммоль), в тетрагидрофуране (0,5 мл). После перемешивания при комнатной температуре в течение 2 часов, реакционную смесь распределяют между этилацетатом и 1н раствором хлористоводородной кислоты. Водный слой экстрагируют этилацетатом, и объединенные органические слои промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель удаляют при пониженном давлении, и полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением указанного в заголовке соединения (60 мг, 0,201 ммоль, выход 14%).
1H-ЯМР (400 МГц, CDCl3) δ 7,53 (1H, д, J=3,7 Гц), 6,79 (1H, д, J=3,7 Гц), 3,30 (2H, с), 2,63-2,47 (2H, м), 2,18-2,05 (2H, м), 2,05-1,88 (2H, м), 1,53 (9H, с).
МС (ESI) m/z: 297 (М+Н)+.
Стадия 5. Синтез диметилового эфира N-{1-(5-карбокситиофен-2-илметил)циклобутилкарбонил}-L-аспарагиновой кислоты
3-{5-(трет-Бутилкарбоксил)тиофен-2-ил}-2-циклобутилпропановую кислоту (50 мг, 0,169 ммоль) растворяют в сульфонилхлориде (0,5 мл) и перемешивают при температуре 60°С в течение 30 минут. После удаления растворителя при пониженном давлении, к раствору продукта, полученного на стадии 4, в дихлорметане (0,3 мл), добавляют диметиловый эфир L-аспарагиновой кислоты (50 мг, 0,253 ммоль) и пиридин (0,3 мл). После перемешивания реакционной смеси при комнатной температуре в течение 1 часа, добавляют WSC-гидрохлорид (60 мг, 0,338 ммоль) и перемешивают при комнатной температуре в течение 3 часов. После удаления растворителя при пониженном давлении, остаток снова растворяют в трифторуксусной кислоте (0,5 мл). После перемешивания раствора при комнатной температуре в течение 1 часа, реакционную смесь концентрируют при пониженном давлении. Полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением указанного в заголовке соединения (32 мг, 0,093 ммоль, выход 55%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,18 (1H, д, J=7,9 Гц), 7,52 (1H, д, J=3,7 Гц), 6,85 (1H, д, J=3,7 Гц), 4,72-4,53 (1H, м), 3,61 (3H, с), 3,60 (3H, с), 3,28 (2H, с), 2,84 (1H, дд, J=16,2, 6,2 Гц), 2,66 (1H, дд, J=16,2, 7,9 Гц), 2,39-2,20 (2H, м), 2,01-1,78 (3H, м), 1,77-1,63 (1H, м).
МС (ESI) m/z: 384 (М+Н)+.
Стадия 6. Синтез трифторацетата N-[1-{5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-илметил}циклобутилкарбонил]-L-аспарагиновой кислоты (соединение 1)
К раствору диметилового эфира N-{3-(5-карбокситиофен-2-ил)-2-циклобутилпропаноил}-L-аспарагиновой кислоты (30 мг, 0,087 ммоль) в пиридине (1,0 мл) добавляют гидрохлорид 3-фтор-4-гидроксибензамидина (25 мг, 0,131 ммоль) и WSC-гидрохлорид (34 мг, 0,175 ммоль), и смесь перемешивают при комнатной температуре в течение ночи. После удаления растворителя при пониженном давлении, полученный остаток растворяют в 4н растворе хлористого водорода в 1,4-диоксане (0,6 мл) и воде (0,2 мл). После перемешивания реакционной смеси при температуре 60°С в течение 9 часов, реакционную смесь концентрируют при пониженном давлении. Полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением указанного в заголовке соединения (18 мг, 0,030 ммоль, выход 34%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,42 (2H, ушир.с), 9,09 (2H, ушир.с), 8,07 (1H, д, J=8,0 Гц), 7,99-7,83 (2H, м), 7,92-7,82 (1H, м), 7,79-7,69 (2H, м), 7,06 (1H, д, J=3,9 Гц), 4,56 (1H, дд, J=13,9, 7,6 Гц), 3,48 (2H, с), 2,74 (1H, дд, J=16,4, 6,0 Гц), 2,64-2,49 (1H, м), 2,40-2,25 (2H, м), 2,05-1,83 (3H, м), 1,80-1,69 (1H, м).
МС (ESI) m/z: 492 (М+Н)+.
Пример 2
Синтез трифторацетата N-{1-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-илметил]циклопентилкарбонил}-L-аспарагиновой кислоты (соединение 2)
Соединение 2 синтезируют способом, аналогично описанному в примере 1.
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,36 (2H, ушир.с), 9,08 (2H, ушир.с), 7,97 (1H, д, J=7,9 Гц), 7,89-7,80 (2H, м), 7,72-7,63 (2H, м), 7,00 (1H, д, J=3,9 Гц), 4,49 (2H, дт, J=12,9, 6,4 Гц), 3,17 (2H, с), 2,69 (1H, дд, J=16,4, 6,0 Гц), 2,57-2,45 (2H, м), 2,02-1,81 (2H, м), 1,63-1,37 (6H, м).
МС (ESI) m/z: 506 (М+Н)+.
Пример 3
Синтез гидрохлорида N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропионил}-L-валина (соединение 9)
Стадия 1. Синтез метилового эфира 2-(диэтилфосфоно)пропановой кислоты
Смешивают метил-2-бромпропионат (100 г, 0,60 моль) и триэтилфосфит (109 г, 0,66 моль) и смесь перемешивают при температуре 110°С в течение 2 суток. Реакционную смесь сушат при пониженном давлении, с получением указанного в заголовке соединения.
Стадия 2. Синтез трет-бутилового эфира 5-[(1Е)-2-(метоксикарбонил)проп-1-ен-1-ил]тиофен-2-карбоновой кислоты
Метиловый эфир 2-(диэтилфосфоно)пропановой кислоты (23,0 г, 0,103 моль) растворяют в тетрагидрофуране (150 мл), добавляют гидрид натрия (60%-ная дисперсия в вазелиновом масле; 2,4 г, 0,06 моль) при температуре 0°С, и смесь перемешивают в течение 30 минут. К реакционной смеси добавляют раствор трет-бутилового эфира 5-формил-2-тиофенкарбоновой кислоты, полученного в примере 1, стадия 2 (11,0 г, 0,052 моль), в тетрагидрофуране (10 мл), и смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают, и остаток распределяют между этилацетатом и 1н раствором хлористоводородной кислоты, и последовательно промывают водой и насыщенным раствором соли. После сушки над безводным сульфатом магния, остаток очищают колоночной хроматографией на силикагеле, с получением указанного в заголовке соединения (13,1 г, 0,047 моль, выход 90%).
1H-ЯМР (400 МГц, CDCl3) δ 7,89 (1H, с), 7,68 (1H, д, J=4,0 Гц), 7,19 (1H, д, J=4,0 Гц), 3,82 (3H, с), 2,24 (3H, с), 1,59 (9H, с).
Стадия 3. Синтез трет-бутилового эфира 5-(2-метоксикарбонилпропил)тиофен-2-карбоновой кислоты
трет-Бутиловый эфир 5-[(1Е)-2-(метоксикарбонил)проп-1-ен-1-ил]тиофен-2-карбоновой кислоты (13,77 г, 0,049 моль) растворяют в этилацетате (60 мл), метаноле (20 мл) и хлороформе (10 мл), добавляют гидроксид палладия (2,8 г) и смесь перемешивают при комнатной температуре в течение ночи в атмосфере водорода. После завершения реакции, гидроксид палладия удаляют фильтрованием через целит, и растворитель выпаривают при пониженном давлении, с получением указанного в заголовке соединения (13,14 г, 0,046 моль, выход 94%).
1H-ЯМР (400 МГц, CDCl3) δ 7,53 (1H, д, J=4,0 Гц), 6,77 (1H, д, J=4,0 Гц), 3,67 (3H, с), 3,18 (1H, дд, J=14,4, 7,2 Гц), 2,91 (1H, дд, J=14,4, 7,2 Гц), 2,77 (1H, м), 1,56 (9H, с), 1,21 (3H, д, J=7,2 Гц).
Стадия 4. Синтез трет-бутилового эфира 5-(2-метил-2-метоксикарбонилпропил)тиофен-2-карбоновой кислоты
трет-Бутиловый эфир 5-(2-метоксикарбонилпропил)тиофен-2-карбоновой кислоты (13,14 г, 46,3 ммоль) растворяют в тетрагидрофуране (250 мл), по каплям добавляют 1,09М раствор бис(триметилсилил)азанида лития в тетрагидрофуране (65 мл, 70,9 ммоль) при температуре -78°С, и смесь перемешивают в течение 2 часов. К реакционной смеси добавляют метилйодид (11,7 г, 82,4 ммоль) при температуре -78°С, и смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении. Остаток добавляют к этилацетату и 0,5н раствору хлористоводородной кислоты, органический слой отделяют, и водный слой два раза экстрагируют этилацетатом. Органические слои объединяют, промывают раствором тиосульфата натрия и насыщенным раствором соли, и сушат над безводным сульфатом магния. Растворитель из фильтрата, после фильтрования, выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, с получением указанного в заголовке соединения (12,36 г, 41,4 ммоль, выход 89%).
1H-ЯМР (400 МГц, CDCl3) δ 7,53 (1H, д, J=3,6 Гц), 6,73 (1H, д, J=3,6 Гц), 3,71 (3H, с), 3,05 (2H, с), 1,56 (9H, с), 1,23 (6H, с).
Стадия 5. Синтез трифторацетата 3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропановой кислоты
К трет-бутиловому эфиру 5-(2-метил-2-метоксикарбонилпропил)тиофен-2-карбоновой кислоты (5,0 г, 16,8 ммоль) добавляют трифторуксусную кислоту (20 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. Растворитель выпаривают и остаток растворяют в пиридине (30 мл), добавляют гидрохлорид 3-фтор-4-гидроксибензамидина (3,2 г, 16,8 ммоль) и WSC-гидрохлорид (3,8 г, 19,8 ммоль), и смесь перемешивают при температуре 50°С в течение 5 часов. Реакционную смесь концентрируют при пониженном давлении, к полученному остатку добавляют 4н раствор хлористоводородной кислоты (10 мл) и 4н раствор хлористого водорода в 1,4 диоксане (10 мл), и смесь перемешивают при температуре 80°С в течение 2 часов. Реакционную смесь концентрируют при пониженном давлении, и полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением указанного в заголовке соединения (2,8 г, 5,86 ммоль, выход 35%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,41 (2H, ушир.с), 9,10 (2H, ушир.с), 7,96 (1H, д, J=4,0 Гц), 7,93 (1H, д, J=8,1 Гц), 7,80-7,70 (2H, м), 7,09 (1H, д, J=4,0 Гц), 3,14 (2H, с), 1,16 (6H, с).
МС (ESI) m/z: 365 (М+Н)+.
Стадия 6. Синтез гидрохлорида N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропионил}-L-валина (соединение 9)
Трифторацетат 3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропановой кислоты, полученный на стадии 5, (53 мг, 0,10 ммоль) растворяют в тионилхлориде (3 мл) и смесь перемешивают при комнатной температуре в течение 3 часов. Тионилхлорид выпаривают при пониженном давлении, с получением хлорангидрида кислоты. Полученный хлорангидрид кислоты растворяют в дихлорметане (3 мл), добавляют туда гидрохлорида трет-бутилового эфира L-валина (25 мг, 0,12 ммоль) и пиридин (0,1 мл), и смесь перемешивают при комнатной температуре в течение ночи. После выпаривания растворителя, добавляют трифторуксусную кислоту (2 мл) и смесь перемешивают при комнатной температуре в течение 1 часа. Смесь концентрируют при пониженном давлении. Полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением трифторацетата указанного в заголовке соединения.
К полученному трифторацетату добавляют 0,05н раствор хлористоводородной кислоты (10 мл) и смесь лиофилизируют, с получением указанного в заголовке соединения (40 мг, 0,80 ммоль, выход 80%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,41 (2H, ушир.с), 9,10 (2H, ушир.с), 8,00-7,89 (2H, м), 7,80-7,70 (2H, м), 7,57 (1H, д, J=7,2 Гц), 7,08 (1H, с), 4,13 (1H, м), 3,21 (1H, д, J=16,0 Гц), 3,15 (1H, д, J=16,0 Гц), 2,15-2,05 (1H, м), 1,76-1,50 (4H, м), 0,90 (3H, д, J=6,8 Гц), 0,86-0,75 (6H, м).
МС (ESI) m/z: 464 (М+Н)+.
Пример 4
Синтез гидрохлорида N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропионил}-N-пропилглицина (соединение 10)
Стадия 1. Синтез гидрохлорида бензилового эфира N-аллилглицина
К раствору гидрохлорида аллиламина (5,0 г, 53,4 ммоль) в тетрагидрофуране (100 мл) добавляют диизопропилэтиламин (10 мл) и бензиловый эфир бромуксусной кислоты (3,06 г, 13,3 ммоль) при температуре 0°С, и смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют этилацетат и 1н раствор хлористоводородной кислоты, органический слой отделяют, и водный слой два раза экстрагируют этилацетатом. Органические слои объединяют, промывают раствором тиосульфата натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, и к полученному маслу добавляют 4н раствор хлористого водорода в 1,4-диоксане (3,5 мл). Смесь концентрируют при пониженном давлении и лиофилизируют, с получением указанного в заголовке соединения (2,12 г, 8,79 ммоль, выход 66%).
1H-ЯМР (400 МГц, CDCl3) δ 7,40-7,35 (5H, м), 6,12-6,02 (1H, м), 5,49-5,43 (2H, м), 5,22 (2H, с), 3,82 (2H, с), 3,78 (2H, д, J=7,2 Гц).
МС (ESI) m/z: 206 (М+Н)+.
Стадия 2. Синтез трифторацетата бензилового эфира N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропионил}-N-аллилглицина
Трифторацетат 3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропановой кислоты (100 мг, 0,20 ммоль), полученный в примере 3, стадия 5, растворяют в тионилхлориде (3 мл) и смесь перемешивают при температуре 60°С в течение 20 минут. Тионилхлорид выпаривают при пониженном давлении, с получением хлорангидрида кислоты. Полученный хлорангидрид кислоты растворяют в дихлорметане (5 мл), добавляют туда гидрохлорид бензилового эфира N-аллилглицина, полученный на стадии 1, (51 мг, 0,21 ммоль) и пиридин (0,1 мл), и смесь перемешивают при комнатной температуре в течение ночи. Смесь концентрируют при пониженном давлении. Полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением указанного в заголовке соединения. (37 мг, 0,056 ммоль, выход 28%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,40 (2H, ушир.с), 9,05 (2H, ушир.с), 7,90 (2H, м), 7,72 (2H, м), 7,38-7,28 (5H, м), 7,11 (1H, д, J=4,0 Гц), 5,86-5,73 (1H, м), 5,25-5,15 (2H, м), 5,12 (2H, с), 4,28-4,18 (2H, м), 4,01-4,91 (2H, м), 3,19 (2H, с), 1,23 (6H, с).
МС (ESI) m/z: 552 (М+Н)+.
Стадия 3. Синтез гидрохлорида N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропионил}-N-пропилглицина (соединение 10)
Трифторацетат бензилового эфира N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропионил}-N-аллилглицина (1,94 г, 2,91 ммоль) растворяют в этаноле (40 мл) и воде (10 мл), добавляют гидроксид палладия (0,4 г) и смесь перемешивают при комнатной температуре в течение 6 часов в атмосфере водорода. Реакционную смесь фильтруют через целит и фильтрат концентрируют при пониженном давлении. К полученному остатку добавляют 0,01н раствор хлористоводородной кислоты (250 мл) и смесь лиофилизируют, с получением указанного в заголовке соединения (1,19 г, 2,02 ммоль, выход 70%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,41 (2H, ушир.с), 9,05 (2H, ушир.с), 7,93 (2H, м), 7,74 (2H, м), 7,11 (1H, д, J=3,6 Гц), 3,75-3,65 (2H, м), 3,18 (2H, с), 1,58-1,48 (2H, м), 1,25 (6H, ушир.с), 0,84 (3H, м).
МС (ESI) m/z: 464 (М+Н)+.
Пример 5
Синтез трифторацетата 3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропановой кислоты (соединение 18)
Стадия 1. Синтез метилового эфира 2-(диэтилфосфоно)масляной кислоты
Смешивают метил-2-бромбутаноат (92 г, 0,508 моль) и триэтилфосфит (95 г, 0,57 моль) и смесь перемешивают при температуре 110°С в течение 3 суток. Реакционную смесь сушат при пониженном давлении, с получением указанного в заголовке соединения.
1H-ЯМР (400 МГц, CDCl3) δ 4,20-4,05 (4H, м), 3,76 (3H, с), 2,88 (1H, ддд, J=22,4, 10,4, 4,0 Гц), 2,18-1,98 (2H, м), 1,35-1,30 (6H, м), 1,19 (3H, т, J=8,0 Гц).
Стадия 2. Синтез трет-бутилового эфира 5-[(1Е)-2-(метоксикарбонил)бут-1-ен-1-ил]тиофен-2-карбоновой кислоты
Метиловый эфир 2-(диэтилфосфоно)масляной кислоты (46 г, 0,193 моль) растворяют в тетрагидрофуране (300 мл), добавляют гидрид натрия (60%-ная дисперсия в вазелиновом масле; 6,6 г, 0,165 моль) при температуре 0°С, и смесь перемешивают в течение 30 минут. К реакционной смеси добавляют раствор трет-бутилового эфира 5-формил-2-тиофенкарбоновой кислоты, полученного в примере 1, стадия 2 (32,1 г, 0,15 моль), в тетрагидрофуране (10 мл), и смесь перемешивают при комнатной температуре в течение 2 часов. Растворитель выпаривают, и остаток распределяют между этилацетатом и 1н раствором хлористоводородной кислоты и последовательно промывают водой и насыщенным раствором соли. После сушки над безводным сульфатом магния, остаток очищают колоночной хроматографией на силикагеле, с получением указанного в заголовке соединения (35,6 г, 0,12 моль, выход 80%).
1H-ЯМР (400 МГц, CDCl3) δ 7,71 (1H, с), 7,65 (1H, д, J=4,0 Гц), 7,17 (1H, д, J=4,0 Гц), 3,82 (3H, с), 2,73 (2H, кв., J=7,6 Гц), 1,56 (9H, с), 1,18 (3H, т, J=7,6 Гц).
Стадия 3. Синтез (Е)-3-(5-трет-бутоксикарбонилтиофен-2-ил)-2-этилпропеновой кислоты
трет-Бутиловый эфир 5-[(1Е)-2-(метоксикарбонил)бут-1-ен-1-ил]тиофен-2-карбоновой кислоты (34,6 г, 120 моль) растворяют в тетрагидрофуране (150 мл) и метаноле (60 мл), добавляют 1н раствор гидроксида лития (144 мл, 144 ммоль) и смесь перемешивают при комнатной температуре в течение 2 суток. Смесь концентрируют при пониженном давлении. К полученному остатку добавляют 0,5н раствор хлористоводородной кислоты и этилацетат, органический слой отделяют, и водный слой три раза экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли и сушат над безводным сульфатом магния. После фильтрования, растворитель из фильтрата выпаривают при пониженном давлении, с получением указанного в заголовке соединения (32,2 г, 114 ммоль, выход 95%).
1H-ЯМР (400 МГц, CDCl3) δ 7,82 (1H, с), 7,66 (1H, д, J=4,0 Гц), 7,21 (1H, д, J=4,0 Гц), 2,74 (2H, кв., J=7,6 Гц), 1,59 (9H, с), 1,21 (3H, т, J=7,6 Гц).
Стадия 4. Синтез 2-((5-трет-бутоксикарбонилтиофен-2-ил)метил)бутановой кислоты
(Е)-3-(5-трет-Бутоксикарбонилтиофен-2-ил)-2-этилпропеновой кислоты (20,43 г, 72,4 ммоль) растворяют в этилацетате (300 мл), метаноле (20 мл) и хлороформе (10 мл), добавляют гидроксид палладия (2,0 г) и смесь перемешивают при комнатной температуре в течение ночи в атмосфере водорода. После завершения реакции, гидроксид палладия удаляют фильтрованием через целит и растворитель выпаривают при пониженном давлении, с получением указанного в заголовке соединения (20,6 г, количественный выход).
Стадия 5. Синтез трет-бутилового эфира 5-(2-бензилоксикарбонилбутил)тиофен-2-карбоновой кислоты
2-(5-трет-Бутоксикарбонилтиофен-2-ил)метилбутановую кислоту (20,6 г, 72,2 ммоль) растворяют в N,N-диметилформамиде (100 мл), добавляют карбонат калия (10,4 г, 75,3 ммоль) и бензилбромид (13,0 г, 76,0 ммоль) и смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь фильтруют через целит, и фильтрат концентрируют при пониженном давлении. К полученному остатку добавляют 0,5н раствор хлористоводородной кислоты и этилацетат, органический слой отделяют, и водный слой три раза экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли и сушат над безводным сульфатом магния. После фильтрования, растворитель из фильтрата выпаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, с получением указанного в заголовке соединения (27,0 г, 72,1 ммоль, выход 96%).
1H-ЯМР (400 МГц, CDCl3) δ 7,49 (1H, д, J=3,6 Гц), 7,35-7,25 (5H, м), 6,71 (1H, д, J=3,6 Гц), 5,11 (1H, д, J=12,4 Гц), 5,07 (1H, д, J=12,4 Гц), 3,16 (1H, дд, J=14,8, 8,8 Гц), 2,96 (1H, дд, J=14,8, 6,0 Гц), 2,72 (1H, м), 1,73-1,60 (2H, м), 1,56 (9H, с), 0,92 (3H, т, J=7,6 Гц).
Стадия 6. Синтез трет-бутилового эфира 5-(2-бензилоксикарбонил-2-этилбутил)тиофен-2-карбоновой кислоты
трет-Бутиловый эфир 5-(2-бензилоксикарбонилбутил)тиофен-2-карбоновой кислоты (29,5 г, 78,8 ммоль) растворяют в тетрагидрофуране (200 мл), по каплям добавляют 1,09М раствор бис(триметилсилил)азанида лития в тетрагидрофуране (94 мл, 102 ммоль) при температуре -78°С, и смесь перемешивают в течение 2 часов. К реакционной смеси добавляют этилйодид (12,3 г, 156 ммоль) при температуре -78°С, и смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении. Остаток добавляют к этилацетату и 0,5н раствору хлористоводородной кислоты, органический слой отделяют, и водный слой два раза экстрагируют этилацетатом. Органические слои объединяют, промывают раствором тиосульфата натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, с получением указанного в заголовке соединения (24,9 г, 61,9 ммоль, выход 78%).
1H-ЯМР (400 МГц, CDCl3) δ 7,49 (1H, д, J=4,0 Гц), 7,40-7,30 (5H, м), 6,67 (1H, д, J=4,0 Гц), 5,15 (2H, с), 3,11 (2H, с), 1,70-1,59 (4H, м), 1,56 (9H, с), 0,85 (6H, т, J=7,6 Гц).
Стадия 7. Синтез 5-(2-бензилоксикарбонил-2-этилбутил)тиофен-2-карбоновой кислоты
К трет-бутиловому эфиру 5-(2-бензилоксикарбонил-2-этилбутил)тиофен-2-карбоновой кислоты (24,9 г, 61,9 ммоль) добавляют трифторуксусную кислоту (20 мл) и смесь перемешивают при комнатной температуре в течение 2 часов. Растворитель выпаривают, с получением указанного в заголовке соединения (количественный выход).
Стадия 8. Синтез трифторацетата бензилового эфира 3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропановой кислоты
5-(2-Бензилоксикарбонил-2-этилбутил)тиофен-2-карбоновую кислоту (5,0 г, 14,4 ммоль) растворяют в N-метилпирролидоне (5 мл) и дихлорметане (5 мл), добавляют тионилхлорид (1,27 мл, 17,6 ммоль) при температуре 0°С, и смесь перемешивают в течение 15 минут при температуре 0°С. К реакционной смеси добавляют гидрохлорид 3-фтор-4-гидроксибензамидина (2,7 г, 14,2 ммоль) и пиридин (7 мл), и смесь перемешивают в течение 2 часов при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении, и полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением указанного в заголовке соединения (4,3 г, 7,21 ммоль, выход 51%).
МС (ESI) m/z: 483 (М+Н)+.
Стадия 9. Синтез трифторацетата 3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропановой кислоты (соединение 18)
Трифторацетат бензилового эфира 3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропановой кислоты (4,3 г, 7,21 ммоль) растворяют в 2-пропаноле (160 мл) и воде (40 мл), добавляют гидроксид палладия (0,9 г) и смесь перемешивают при комнатной температуре в течение ночи в атмосфере водорода. Реакционную смесь фильтруют через целит и фильтрат концентрируют при пониженном давлении. К остатку добавляют воду и ацетонитрил, смесь лиофилизируют, с получением указанного в заголовке соединения (3,61 г, 7,12 ммоль, выход 99%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,42 (2H, ушир.с), 9,24 (2H, ушир.с), 7,97 (1H, д, J=4,0 Гц), 7,94 (1H, д, J=10,4 Гц), 7,80-7,70 (2H, м), 7,10 (1H, д, J=4,0 Гц), 3,15 (2H, с), 1,60-1,40 (4H, м), 0,85 (6H, т, J=7,6 Гц).
МС (ESI) m/z: 393 (М+Н)+.
Пример 6
Синтез гидрохлорида N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропионил}-L-серина (соединение 11)
Трифторацетат 3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропановой кислоты (соединение 18) (616 мг, 1,2 ммоль) растворяют в тионилхлориде (6 мл) и смесь перемешивают при температуре 60°С в течение 20 минут. Тионилхлорид выпаривают при пониженном давлении, с получением хлорангидрида кислоты. Полученный хлорангидрид кислоты растворяют в дихлорметане (20 мл), добавляют туда гидрохлорид трет-бутилового эфира О-трет-бутил-L-серина (334 мг, 1,32 ммоль) и пиридин (0,5 мл) и смесь перемешивают при комнатной температуре в течение ночи. После выпаривания растворителя, добавляют трифторуксусную кислоту (5 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. Смесь концентрируют при пониженном давлении. Полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением трифторацетата указанного в заголовке соединения.
К полученному трифторацетату добавляют 0,05н раствор хлористоводородной кислоты (30 мл) и смесь лиофилизируют, с получением указанного в заголовке соединения (513 мг, 0,99 ммоль, выход 83%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,41 (2H, ушир.с), 9,10 (2H, ушир.с), 7,95-7,90 (2H, м), 7,78-7,72 (2H, м), 7,63 (1H, д, J=7,6 Гц), 7,10 (1H, д, J=4,0 Гц), 4,34 (1H, м), 3,75-3,64 (1H, м), 3,64-3,56 (1H, м), 3,16 (2H, с), 1,62-1,46 (4H, м), 0,88-0,78 (6H, м).
МС (ESI) m/z: 480 (М+Н)+.
Пример 7
Синтез гидрохлорида N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропионил}саркозина (соединение 21)
Стадия 1. Синтез трифторацетата бензилового эфира N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропионил}саркозина
Трифторацетат 3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропановой кислоты (соединение 18) (100 мг, 0,20 ммоль) растворяют в тионилхлориде (2 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. Тионилхлорид выпаривают при пониженном давлении, с получением хлорангидрида кислоты. Полученный хлорангидрид кислоты растворяют в 1,2-дихлорэтане (5 мл), добавляют туда гидрохлорид бензилового эфира саркозина (47 мг, 0,22 ммоль) и пиридин (0,2 мл), и смесь перемешивают при температуре 60°С в течение 5 часов. Смесь концентрируют при пониженном давлении. Полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением указанного в заголовке соединения (83 мг, 0,12 ммоль, выход 62%).
Стадия 2. Синтез гидрохлорида N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропионил}саркозина (соединение 21)
Трифторацетат бензилового эфира N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропионил}саркозина (83 мг, 0,12 ммоль) растворяют в 2-пропаноле (5 мл) и воде (5 мл), добавляют гидроксид палладия (50 мг) и смесь перемешивают при комнатной температуре в течение 2 часов в атмосфере водорода. Смесь концентрируют при пониженном давлении. Полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением трифторацетата указанного в заголовке соединения. К полученному трифторацетату добавляют 0,01н раствор хлористоводородной кислоты (30 мл) и смесь лиофилизируют, с получением указанного в заголовке соединения (32 мг, 0,064 ммоль, выход 53%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,35 (2H, ушир.с), 9,22 (2H, ушир.с), 7,90-7,85 (2H, м), 7,70-7,65 (2H, м), 7,06 (1H, д, J=3,6 Гц), 3,92 (2H, м), 3,15 (3H, с), 3,12 (2H, ушир.с), 1,70-1,60 (2H, м), 1,60-1,50 (2H, м), 0,76 (6H, т, J=7,2 Гц).
МС (ESI) m/z: 464 (М+Н)+.
Пример 8
Синтез N-аллил-N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропионил}таурина (соединение 23)
Стадия 1. Синтез изопропилового эфира N-аллилтаурина
2-Хлорэтилсульфонилхлорид (2 г, 12,3 ммоль) растворяют в 2-пропаноле (20 мл), добавляют пиридин (2,7 мл) и смесь перемешивают при комнатной температуре в течение 3 часов. Добавляют гидрохлорид аллиламина (1,15 г, 12,3 ммоль) и диизопропилэтиламин (6,4 мл) и перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выпаривают при пониженном давлении, к остатку добавляют 5%-ный раствор бикарбоната натрия и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, с получением указанного в заголовке соединения (0,5 г, 2,4 ммоль, выход 20%).
1H-ЯМР (400 МГц, CDCl3) δ 6,55 (1H, дд, J=10,0, 16,8 Гц), 6,39 (1H, д, J=16,8 Гц), 6,07 (1H, д, J=10,0 Гц), 4,81 (1H, с, J=6,3 Гц), 1,40 (6H, д, J=6,3 Гц).
МС (ESI) m/z: 208 (М+Н)+.
Стадия 2. Синтез N-аллил-N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропионил}таурина (соединение 23)
Трифторацетат 3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диметилпропановой кислоты (200 мг, 0,40 ммоль), полученный в примере 3, стадия 5, растворяют в тионилхлориде (4 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. Тионилхлорид выпаривают при пониженном давлении, с получением хлорангидрида кислоты. Полученный хлорангидрид кислоты растворяют в 1,2-дихлорэтане (10 мл), добавляют туда изопропиловый эфир N-аллилтаурина, полученный на стадии 1, (88 мг, 0,43 ммоль) и пиридин (0,4 мл), и смесь перемешивают при температуре 50°С в течение ночи. Смесь концентрируют при пониженном давлении. Полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением изопропилового эфира указанного в заголовке соединения. Полученное твердое вещество растворяют в 0,01н водном растворе хлористоводородной кислоты (20 мл) и перемешивают при комнатной температуре в течение 5 часов, и осадившееся твердое вещество собирают фильтрованием. Твердое вещество промывают водой и сушат, с получением указанного в заголовке соединения (47 мг, 0,092 ммоль, выход 23%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,41 (2H, ушир.с), 9,02 (2H, ушир.с), 7,95-7,88 (2H, м), 7,81-7,70 (2H, м), 7,10 (1H, д, J=3,6 Гц), 5,76 (1H, м), 5,20-5,05 (2H, м), 4,15-3,85 (2H, м), 3,70-3,45 (2H, м), 3,21 (2H, с), 2,67 (2H, м), 1,26 (6H, с).
МС (ESI) m/z: 512 (М+Н)+.
Пример 9
Синтез гидрохлорида N-{3-[5-(4-амидино-2-фторфеноксикарбонил)тиофен-2-ил]-2,2-диэтилпропионил}бета-гомоизолейцина (соединение 49)
Соединение 18 (76 мг, 0,15 ммоль) растворяют в тионилхлориде (1,5 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. Тионилхлорид выпаривают при пониженном давлении, с получением хлорангидрида кислоты. Полученный хлорангидрид кислоты растворяют в дихлорметане (1,5 мл), добавляют туда гидрохлорид метилового эфира бета-гомоизолейцина (44 мг, 0,225 ммоль) и пиридин (0,2 мл), и смесь перемешивают при комнатной температуре в течение ночи. После выпаривания растворителя, добавляют трифторуксусную кислоту (5 мл) и смесь перемешивают при температуре 60°С в течение 1 часа. Смесь концентрируют при пониженном давлении. После выпаривания растворителя, добавляют 4н раствор хлористого водорода в 1,4-диоксане (2 мл) и воду (1 мл), и смесь перемешивают при температуре 80°С в течение 30 минут. Смесь концентрируют при пониженном давлении. Полученный остаток очищают высокоэффективной жидкостной хроматографией (вода-ацетонитрил, каждый из которых содержит 0,1% трифторуксусной кислоты), с получением трифторацетата указанного в заголовке соединения.
К полученному трифторацетату добавляют 0,1н раствор хлористоводородной кислоты (10 мл) и смесь лиофилизируют, с получением указанного в заголовке соединения (35,6 мг, 0,064 ммоль, выход 43%).
1H ЯМР (400 МГц, ДМСО-d6) δ 12,09 (1H, с), 9,44 (2H, с), 9,17 (2H, с), 7,98-7,91 (2H, м), 7,78-7,72 (2H, м), 7,37 (1H, д, J=8,2 Гц), 7,06 (1H, д, J=3,8 Гц), 4,19-4,09 (1H, м), 3,17-3,06 (2H, м), 2,43-2,30 (2H, м), 1,63-1,44 (4H, м), 1,40-1,27 (1H, м), 1,11-0,98 (1H, м), 0,89-0,73 (10H, м).
МС (ESI) m/z: 520 (М+Н)+.
Соединения 39, 40, 45, 46, 51, 55, 63, 64, 65, 68, 81 и 89, представленные в следующей ниже таблице 1, каждое синтезировано с использованием соединения 16 или соединения, полученного в примере 3, стадия 5, и коммерчески доступных реагентов, и способом, аналогично описанному в примере 4, стадия 2.
Соединения 3, 4, 6, 12, 13, 14, 15, 16, 19, 24, 25, 27, 28, 29, 30, 31, 34, 42, 43, 44, 52, 58, 83 и 87, представленные в следующей ниже таблице 1, каждое синтезировано с использованием соединения 16 или соединения, полученного в примере 3, стадия 5, и коммерчески доступных реагентов, и способом, аналогично описанному в примере 6.
Соединения 7, 8, 17, 20, 22, 26, 32, 33, 41, 48, 56, 57, 62, 66, 67, 69, 70, 71, 73, 75, 76, 77, 78, 79, 80, 84, 85, 86, 88, 90, 91, 92 и 93, представленные в следующей ниже таблице 1, каждое синтезировано с использованием соединения 16 или соединения, полученного в примере 3, стадия 5, и коммерчески доступных реагентов, и способом, аналогично описанному в примере 7.
Соединения 5, 35, 36, 37, 38, 47, 50, 53, 54, 59, 60, 61, 72, 74, 82 и 94, представленные в следующей ниже таблице 1, каждое синтезировано с использованием соединения 16 или соединения, полученного в примере 3, стадия 5, и коммерчески доступных реагентов, и способом, аналогично описанному в примере 9.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Экспериментальный пример 1
Измерение ингибирующей трипсин активности
Используя 96-луночный планшет (№ 3915, Costar), тестируемое соединение (25 мкл) смешивали с 20 мкМ ферментного субстрата для флуоресценции (Boc-Phe-Ser-Arg-AMC, 50 мкл), смешанного с 200 мМ буфера Tris-HCl (рН=8,0), и добавляли человеческий трипсин (Sigma, 25 мкл). Используя планшет-ридер для флуоресценции fmax (Molecular Devices, Inc.), скорость реакции измеряли по изменениям с течением времени при длине волны возбуждения 355 нм и длине волны флуоресценции 460 нм. Значение Ki рассчитывали из концентрации тестируемого соединения, обратной скорости реакции и значения Km ферментного субстрата, и посредством использования графика Dixon. Результаты представлены в таблице 2.
Экспериментальный пример 2
Измерение ингибирующей энтеропептидазу активности
Используя 96-луночный планшет (№ 3915, Costar), смешивали тестируемое соединение (25 мкл), 400 мМ буфера Tris-HCl (рН=8,0, 25 мкл) и 0,5 мг/мл ферментного субстрата для флуоресценции (Gly-Asp-Asp-Asp-Asp-Lys-β-нафтиламид, 25 мкл) и добавляли рекомбинантную энтеропептидазу человека (R&D Systems, Inc., 25 мкл). Используя планшет-ридер для флуоресценции fmax (Molecular Devices, Inc.), скорость реакции измеряли по изменениям с течением времени при длине волны возбуждения 320 нм и длине волны флуоресценции 405 нм. Значение Ki рассчитывали из концентрации тестируемого соединения, обратной скорости реакции и значения Km ферментного субстрата, и посредством использования графика Dixon. Результаты представлены в таблице 2.
|
|
|
|
|
Таким образом, подтверждено, что соединение по настоящему изобретению проявляет превосходную в отношении ингибирования энтеропептидазы активность и превосходную в отношении ингибирования трипсина активность. Следовательно, показано, что соединение по настоящему изобретению, обладающее ингибирующей активностью в отношении энтеропептидазы и трипсина, снижает пищеварительную способность белка, липида и углеводов и является эффективным в качестве терапевтического или профилактического лекарственного средства против ожирения и гиперлипидемии.
Экспериментальный пример 3
Оценка антидиабетического действия
Антидиабетическое действие соединения или его фармацевтически приемлемой соли по настоящему изобретению может быть подтверждено, например, посредством следующего способа:
Приобретали KK-AY/JCL-мышей (самцы, в возрасте 5-7 недель, CLEA Japan, Inc.), известных в отношении спонтанного развития диабета «тучных» типа 2, и, спустя одну неделю подготовительного периода выращивания, произвольно распределяли по группам (6 на группу) по отношению к массе тела и уровням глюкозы в крови не натощак в качестве показателей. Животных индивидуально помещали в поликарбонатные клетки и позволяли свободно пить воду из поилки. В течение периода тестирования, им позволяли свободно проглатывать смесь из тестируемого соединения, которое может быть в виде его соли, (например, 5,6 мг/100 г или 16,8 мг/100 г) и порошкообразного корма CRF-1 (Oriental Yeast Co., Ltd.). Контрольной группе давали один CRF-1. Спустя одну неделю периода дозирования, аспират крови (6 мкл) собирали из хвостовой вены и уровень глюкозы в крови определяли посредством ACCU-CHEK Aviva (Roche Diagnostics K.K.).
Экспериментальный пример 4
Оценка гипогликемического действия
Гипогликемическое действие некоторых соединений было подтверждено, например, посредством следующего способа:
Крыс с диабетом «тучных» (самцы, в возрасте 11-19 недель, Charles River Japan, Inc.), известных спонтанным развитием гипергликемии, произвольно распределяли по группам (6 на группу). Животных индивидуально помещали в поликарбонатные клетки и позволяли свободно пить воду из поилки. Животных в получающих соединение группах принудительно кормили соединениями № 10, №87, №19 или №69 в дозе 3 мг/кг. Эти соединения использовали в форме их гидрохлоридной соли, конвертируемой по способу согласно примеру 3, стадия 6, из их формы ТФУК-соли, при необходимости. Животных в контрольной группе обрабатывали только наполнителем (0,5% метилцеллюлоза). Животным давали свободный доступ к корму (CRF-1, Oriental Yeast Co., Ltd.) в течение эксперимента. Аспират крови (6 мкл) собирали из хвостовой вены в момент времени непосредственно перед дозированием (время 0), а также спустя 2, 4 и 8 часов после дозирования. Уровни глюкозы в крови определяли посредством ACCU-CHEK Aviva (Roche Diagnostics K.K.). Последовательные изменения уровней глюкозы в крови животных представлены на фиг. 1 и фиг. 2. Уровни глюкозы в крови у получавшей соединение группы значительно снижены по сравнению с уровнями в получавшей наполнитель группе спустя 2 или 4 часа после дозирования.
Таким образом, подтверждено, что тестируемые соединения проявляют значительное гипогликемическое действие. Показано, что соединение по настоящему изобретению, обладающее ингибирующей энтеропептидазу активностью и ингибирующей трипсин активностью, проявляет подавляющее повышение уровня глюкозы в крови действие или гипогликемическое действие. Кроме того, также может быть показано, что соединение по настоящему изобретению проявляет сенсибилизирующую инсулин активность, а также является пригодным в качестве профилактического или терапевтического агента против ожирения, диабетических осложнений или метаболического синдрома, так как проявляет подавляющее повышение уровня глюкозы в крови действие или гипогликемическое действие.
Промышленная применимость
Ингибирующее трипсин и энтеропептидазу соединение по настоящему изобретению может быть использовано в качестве активного ингредиента терапевтического или профилактического лекарственного средства против диабета или диабетических осложнений.
Там, где в данном описании установлен числовой предел или диапазон, включены конечные точки. Также, конкретно включены все величины и диапазоны внутри числового предела или диапазона, как если были точно описаны.
Безусловно, возможны числовые модификации и вариации согласно настоящему изобретению в свете указанных выше аспектов. Следовательно, следует понимать, что в объеме прилагаемой формулы изобретения настоящее изобретение может быть осуществлено на практике иным образом, чем в виде конкретно описанного в данном описании.
Все патенты и другие ссылки, приведенные выше, полностью включены в данное описание посредством ссылки, как если были полностью изложены.
Настоящая заявка основана на патентной заявке № 13/517805, поданной в США, содержание которой полностью включено в данное описание.