Результат интеллектуальной деятельности: СРЕДА ОПРЕДЕЛЕННОГО СОСТАВА ДЛЯ РАЗМНОЖЕНИЯ И ОБНОВЛЕНИЯ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СМЕЖНУЮ ЗАЯВКУ
Настоящая заявка испрашивает преимущество предварительной заявки на патент США № 61/607706, поданной 7 марта 2012 г., содержание которой полностью включено в настоящий документ путем ссылки для любых целей.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области пролиферации и обновления плюрипотентных стволовых клеток в условиях среды определенного состава.
УРОВЕНЬ ТЕХНИКИ
Для размножения недифференцированных плюрипотентных стволовых клеток традиционно использовали питающие клетки, которые обеспечивали достаточно факторов для поддержки иммобилизации, пролиферации и обновления плюрипотентных маркеров. Ранее существовавшие способы образования и культивирования человеческих эмбриональных стволовых клеток требовали использования мышиных эмбриональных фибробластов (MEF) в качестве питающих клеток. В последующих методиках применяли «кондиционированные среды» и покрытие внеклеточным матриксом для замещения питающих клеток. Под кондиционированными средами понимают такие среды, которые были модифицированы питающими клетками, такими как MEF. Однако недостаток данных способов заключается в расхождениях в партиях кондиционированных сред или культурах питающих клеток для постоянной поддержки размножения плюрипотентных стволовых клеток. Более того, обе системы приводят к появлению неопределенных факторов, которые могут по-разному воздействовать на плюрипотентные стволовые клетки. Соответственно, приготовление недорогой воспроизводимой культуральной среды определенного состава, которая способствует постоянному размножению плюрипотентных стволовых клеток, представляет большой интерес для области регенеративной медицины.
Определяющая характеристика человеческих эмбриональных стволовых клеток (клетки hES) состоит в том, что клетки проявляют тенденцию к дифференцировке в различные линии клеток. Такая нежелательная дифференцировка может препятствовать единообразной и направленной дифференцировке, необходимой для последующего образования желаемых конкретных типов клеток. На самом деле, как питающие клетки, так и условия кондиционированных сред, как правило, обеспечивают определенный уровень нежелательной дифференцировки, в частности, по краям растущей колонии ES-клеток или в центре колонии.
Результаты недавно проведенных исследований привели к замене питающих клеток или кондиционированной среды на целый ряд вариантов замещенных культур, например: заменитель нокаутной сыворотки (KSR) в средах (2005, Nature Methods, 2:185-189). KSR содержит неочищенную фракцию альбумина бычьей сыворотки (БСА) неопределенного состава. В других случаях было продемонстрировано продолжительное сохранение плюрипотентности в среде определенного химического состава с FGF2, активином A и инсулином (Vallier et al., 2005, J Cell Sci, 118:4495-4509). Доступные в продаже составы сред, включая среду mTeSR®1 (StemCell Technologies, г. Ванкувер, Канада) и StemPro™ (Invitrogen, штат Калифорния), также ранее использовали для обновления и пролиферации человеческих плюрипотентных стволовых клеток. Предшествующий уровень техники по разработкам сред определенного состава также отражен в US7449334, US7442548, US7005252, US2008/0268534, US7410798, US7297539 и US6800480. Более того, в недавних публикациях также улучшался состав среды mTeSR®1 до восьми компонентов (Nature Methods, 2011, 8:424-424), и отмечали, что даже в средах определенного состава присутствует стороннее (-ие) вещество (-а), что может на самом деле замедлять пролиферацию клеток ES или подавлять их плюрипотентное состояние. Улучшенная среда mTeSR®1 содержит основную среду DMEM/F12 с добавками инсулина, селена, трансферрина, аскорбиновой кислоты, FGF2 (bFGF) и TGFβ или ингибиторов нодального сигнала с коррекцией рН с помощью NaHCO3.
Следовательно, очевидно, что по-прежнему существует потребность в полностью определенных условиях среды, которые обеспечивают постоянство в отношении размножения плюрипотентных клеток при одновременном минимальном количестве добавляемых компонентов.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к определенному составу культивирования клеток для культивирования, обновления и размножения плюрипотентных стволовых клеток, причем определенный состав культивирования клеток содержит основную среду, инсулин, трансферрин, селен, свободный от жирных кислот альбумин, лиганд TGF-β, bFGF и аскорбиновую кислоту; и причем культивирование стволовых клеток в определенном составе культивирования клеток обеспечивает сохранение плюрипотентности и кариотипической стабильности стволовых клеток в течение по меньшей мере 10 пассажей. В некоторых вариантах осуществления настоящего изобретения состав культивирования клеток дополнительно содержит инсулиноподобный фактор роста 1 (IGF-1). В некоторых вариантах осуществления настоящего изобретения состав культивирования клеток содержит DMEM-F12.
Настоящее изобретение относится к определенному составу культивирования клеток для культивирования, обновления и размножения плюрипотентных стволовых клеток, причем определенный состав культивирования клеток содержит основную среду, инсулин, трансферрин, селен, свободный от жирных кислот альбумин, лиганд TGF-β, bFGF, аскорбиновую кислоту, следовые количества элементов C, 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту, хлорид лития, глюкозу, липиды определенного состава и дипептид L-аланин-L-глутамин; и причем культивирование стволовых клеток в определенном составе культивирования клеток обеспечивает сохранение плюрипотентности и кариотипической стабильности стволовых клеток в течение по меньшей мере 10 пассажей. В некоторых вариантах осуществления настоящего изобретения состав культивирования клеток содержит MCDB-131.
В некоторых вариантах осуществления настоящего изобретения ITS-X представляет инсулин, трансферрин и селен для определенного состава культивирования клеток настоящего изобретения. В некоторых вариантах осуществления настоящего изобретения ITS-X присутствует в концентрации от приблизительно 0,5% до приблизительно 2%. В некоторых вариантах осуществления настоящего изобретения ITS-X присутствует в концентрации приблизительно 1%. В некоторых вариантах осуществления настоящего изобретения используется химически чистый свободный от жирных кислот альбумин. В некоторых вариантах осуществления настоящего изобретения химически чистый свободный от жирных кислот БСА присутствует в концентрации от приблизительно 0,2% до приблизительно 2,5%. В некоторых вариантах осуществления настоящего изобретения химически чистый свободный от жирных кислот БСА присутствует в концентрации приблизительно 2%.
В некоторых вариантах осуществления лиганд TGF-β в определенном составе культивирования клеток представляет собой TGF-β1. В некоторых вариантах осуществления настоящего изобретения TGF-β1 присутствует в концентрации от приблизительно 0,5 нг/мл до приблизительно 10 нг/мл. В некоторых вариантах осуществления настоящего изобретения TGF-β1 присутствует в концентрации приблизительно 1 нг/мл.
В некоторых вариантах осуществления настоящего изобретения bFGF присутствует в определенном составе культивирования клеток в концентрации от приблизительно 50 нг/мл до приблизительно 100 нг/мл. В некоторых вариантах осуществления настоящего изобретения bFGF присутствует в определенном составе культивирования клеток в концентрации приблизительно 50 нг/мл. В некоторых вариантах осуществления настоящего изобретения bFGF присутствует в определенном составе культивирования клеток в концентрации приблизительно 100 нг/мл.
В некоторых вариантах осуществления настоящего изобретения инсулиноподобный фактор роста 1 (IGF-1) присутствует в концентрации от приблизительно 10 нг/мл до приблизительно 50 нг/мл. В некоторых вариантах осуществления настоящего изобретения IGF-1 присутствует в определенном составе культивирования клеток в концентрации приблизительно 20 нг/мл.
В некоторых аспектах настоящего изобретения аскорбиновая кислота присутствует в определенном составе культивирования клеток в концентрации от приблизительно 0,2 мМ до приблизительно 0,3 мМ. В некоторых аспектах настоящего изобретения аскорбиновая кислота присутствует в определенном составе культивирования клеток в концентрации приблизительно 0,25 мМ.
В одном из вариантов осуществления настоящее изобретение относится к определенному составу культивирования клеток, который содержит по существу основную среду DMEM-F12, ITS-X (для внесения инсулина, трансферрина и селена), свободный от жирных кислот альбумин, лиганд TGF-β, bFGF, инсулиноподобный фактор роста 1 (IGF-1) и аскорбиновую кислоту.
В одном из вариантов осуществления настоящее изобретение относится к определенному составу культивирования клеток, содержащему по существу MCDB-131, ITS-X (как источник инсулина, трансферрина и селена), свободный от жирных кислот альбумин, лиганд TGF-β, bFGF, аскорбиновую кислоту, следовые количества элементов C, 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту, хлорид лития, глюкозу, липиды определенного состава и дипептид L-аланин-L-глутамин.
В одном из вариантов осуществления настоящее изобретение относится к способу размножения человеческих плюрипотентных стволовых клеток, который включает культивирование человеческих плюрипотентных стволовых клеток на матриксе без питающих клеток в определенном составе культивирования клеток; причем определенный состав культивирования клеток содержит основную среду, инсулин, трансферрин, селен, свободный от жирных кислот альбумин, лиганд TGF-β, bFGF и аскорбиновую кислоту; и причем культивирование стволовых клеток в определенном составе культивирования клеток обеспечивает сохранение плюрипотентности и кариотипической стабильности клеток в течение по меньшей мере 10 пассажей. В некоторых вариантах осуществления определенный состав культивирования клеток дополнительно содержит инсулиноподобный фактор роста 1 (IGF-1). В некоторых вариантах осуществления состав культивирования клеток содержит DMEM-F12.
В одном из вариантов осуществления настоящее изобретение относится к способу размножения человеческих плюрипотентных стволовых клеток, который включает культивирование человеческих плюрипотентных стволовых клеток на матриксе без питающих клеток в определенном составе культивирования клеток; причем определенный состав культивирования клеток содержит основную среду, инсулин, трансферрин, селен, свободный от жирных кислот альбумин, лиганд TGF-β, bFGF, аскорбиновую кислоту, IGF-1, следовые количества элементов C, 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту, хлорид лития, глюкозу, липиды определенного состава и дипептид L-аланин-L-глутамин. В некоторых вариантах осуществления состав культивирования клеток, который используется в способе для размножения человеческих плюрипотентных стволовых клеток, содержит MCDB-131.
Одним из вариантов осуществления настоящего изобретения является популяция клеток in vitro, причем более 50% популяции клеток являются положительными по экспрессии белков OCT4, SOX2, NANOG, FOXA2 и отрицательными или с низкой экспрессией SSEA-4 и ZFP42. Популяцию получали культивированием плюрипотентных стволовых клеток в определенном составе культивирования клеток, содержащем основную среду с добавками IGF-1, инсулина, bFGF, лиганда TGF-B и свободного от жирных кислот альбумина; и причем определенный состав культивирования клеток не содержит аскорбиновой кислоты.
В некоторых вариантах осуществления настоящего изобретения определенный состав культивирования клеток содержит основную среду DMEM/F12. В некоторых вариантах осуществления настоящего изобретения определенный состав культивирования клеток содержит инсулин в форме ITS-X. В некоторых вариантах осуществления настоящего изобретения ITS-X присутствует в концентрации от приблизительно 0,5% до приблизительно 2%. В некоторых аспектах настоящего изобретения ITS-X присутствует в концентрации приблизительно 1%. В некоторых вариантах осуществления настоящего изобретения используется химически чистый свободный от жирных кислот альбумин. В некоторых аспектах настоящего изобретения химически чистый свободный от жирных кислот альбумин присутствует в концентрации от приблизительно 0,2% до приблизительно 2,5%. В некоторых вариантах осуществления настоящего изобретения химически чистый свободный от жирных кислот альбумин присутствует в концентрации приблизительно 2%. В некоторых аспектах настоящего изобретения лиганд TGF-B представляет собой TGF-B1. В некоторых вариантах осуществления настоящего изобретения TGF-В1 присутствует в концентрации от приблизительно 0,5 нг/мл до приблизительно 10 нг/мл. В некоторых аспектах настоящего изобретения TGF-B1 присутствует в концентрации приблизительно 1 нг/мл.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На Фиг. 1A-1D представлены фазоконтрастные изображения клеток H1, культивированных при 3 пассажах в IH-3 (ФИГ. 1A), IH-1 (ФИГ. 1B), IH-6 (ФИГ. 1C) и mTeSR®1 (ФИГ. 1D).
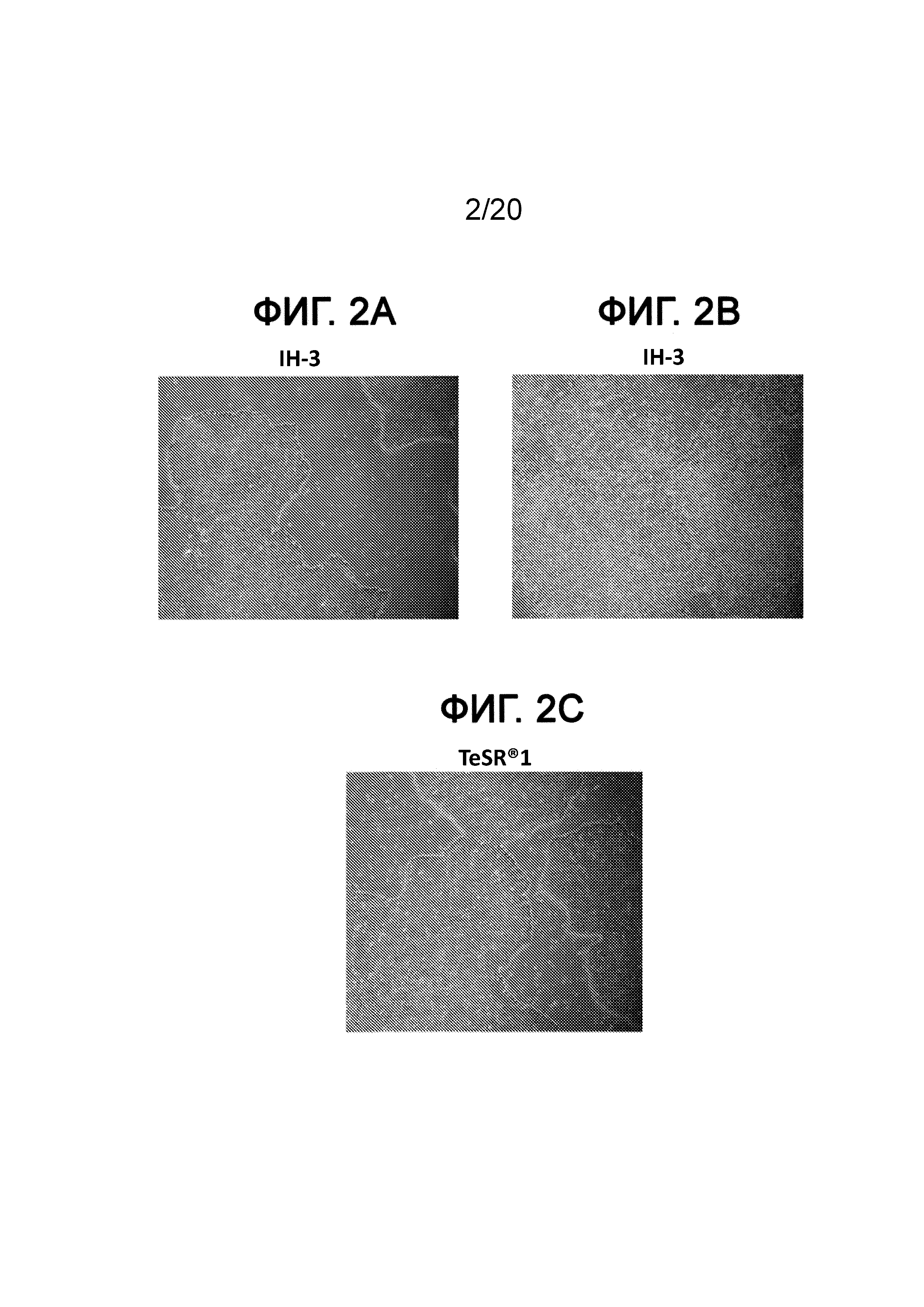
На Фиг. 2A-2C представлены фазоконтрастные изображения клеток H1, культивированных при 10 пассажах в IH-3 (ФИГ. 2A), IH-1 (ФИГ. 2B) и среде mTeSR®1 (ФИГ. 2C).
На Фиг. 3A-3C представлены фазоконтрастные изображения клеток H1, культивированных при 18 пассажах в IH-3 (ФИГ. 3A), IH-1 (ФИГ. 3B) и среде mTeSR®1 (ФИГ. 3C).
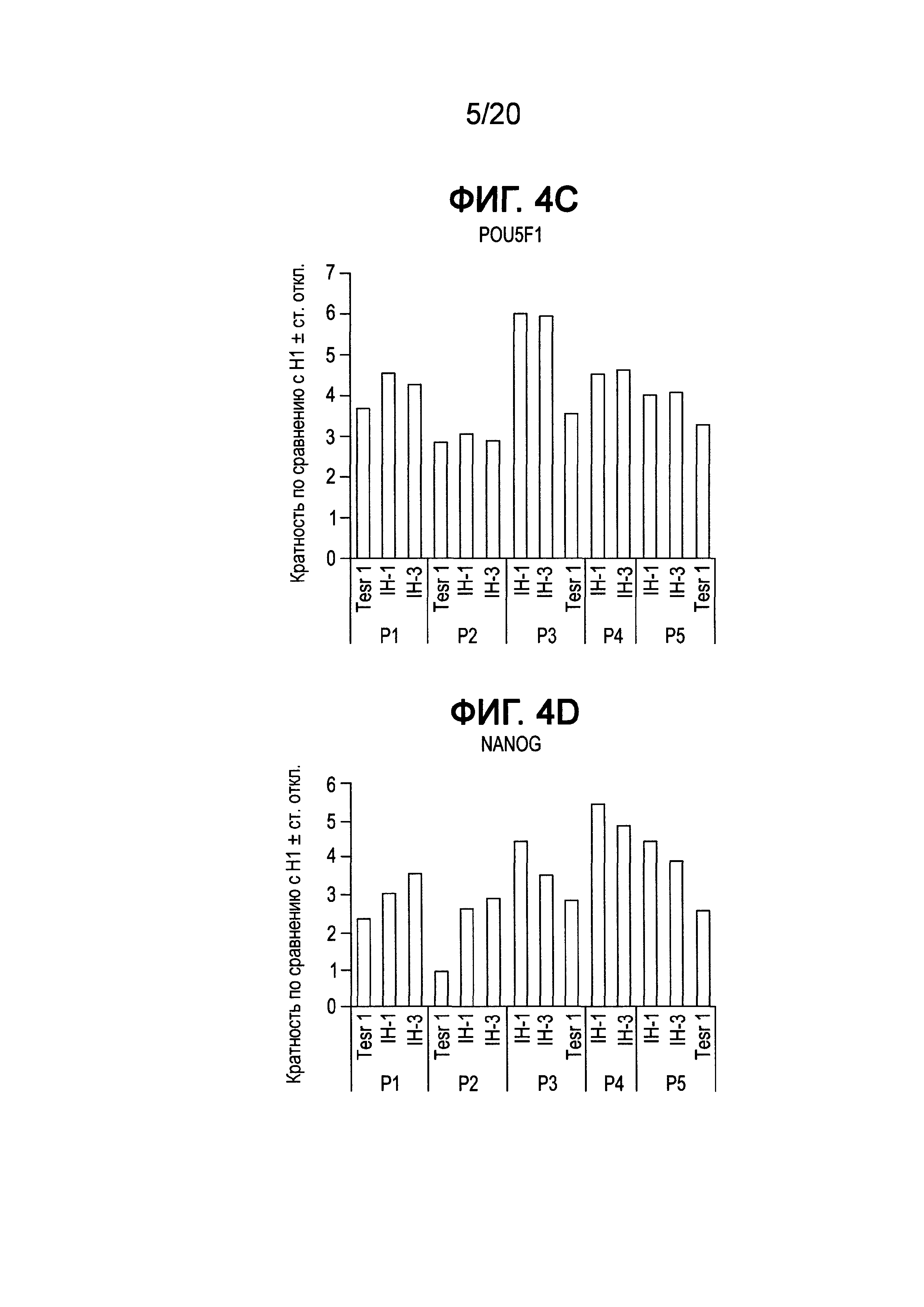
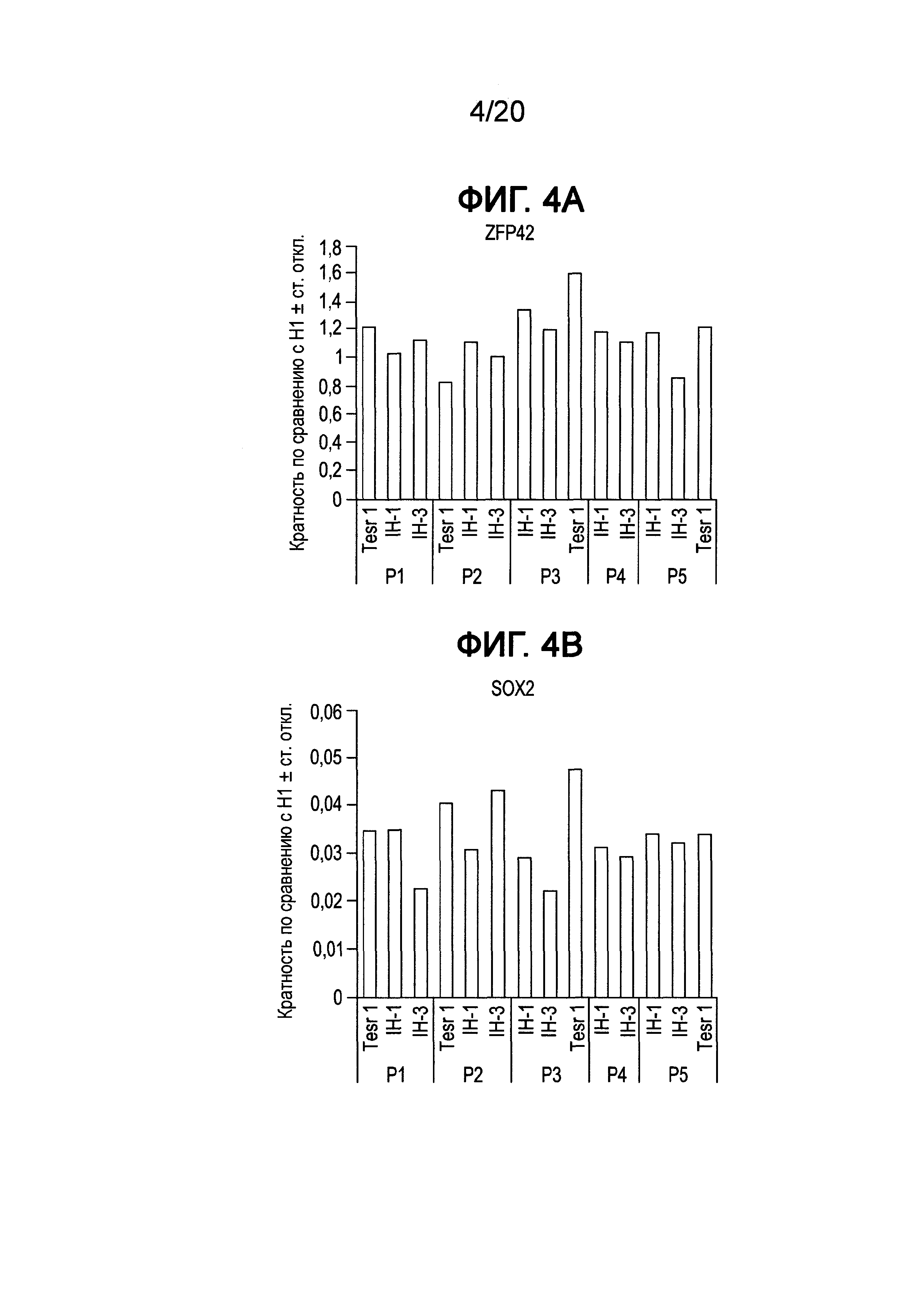
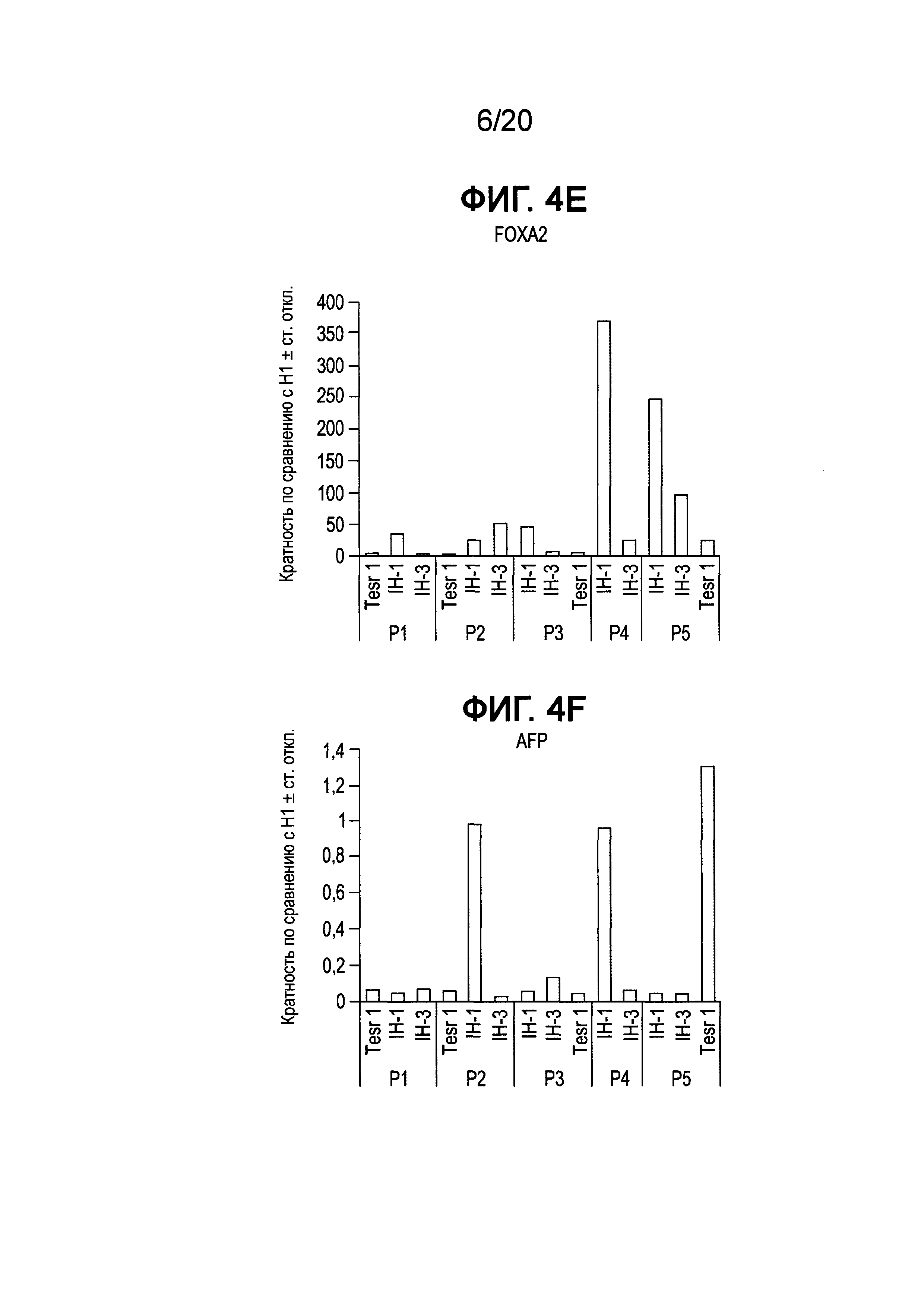
На Фиг. 4A-4F представлены данные ПЦР в реальном времени для экспрессии следующих генов в клетках линии H1 человеческих эмбриональных стволовых клеток, культивированных в среде, описанной в примере 1, и собранных при пассажах 1-5 (P1-P5); ZFP42 (ФИГ. 4A), SOX2 (ФИГ. 4B), POU5F1 (OCT4) (ФИГ. 4C), Nanog (ФИГ. 4D), FOXA2 (ФИГ. 4E) и AFP (ФИГ. 4F).
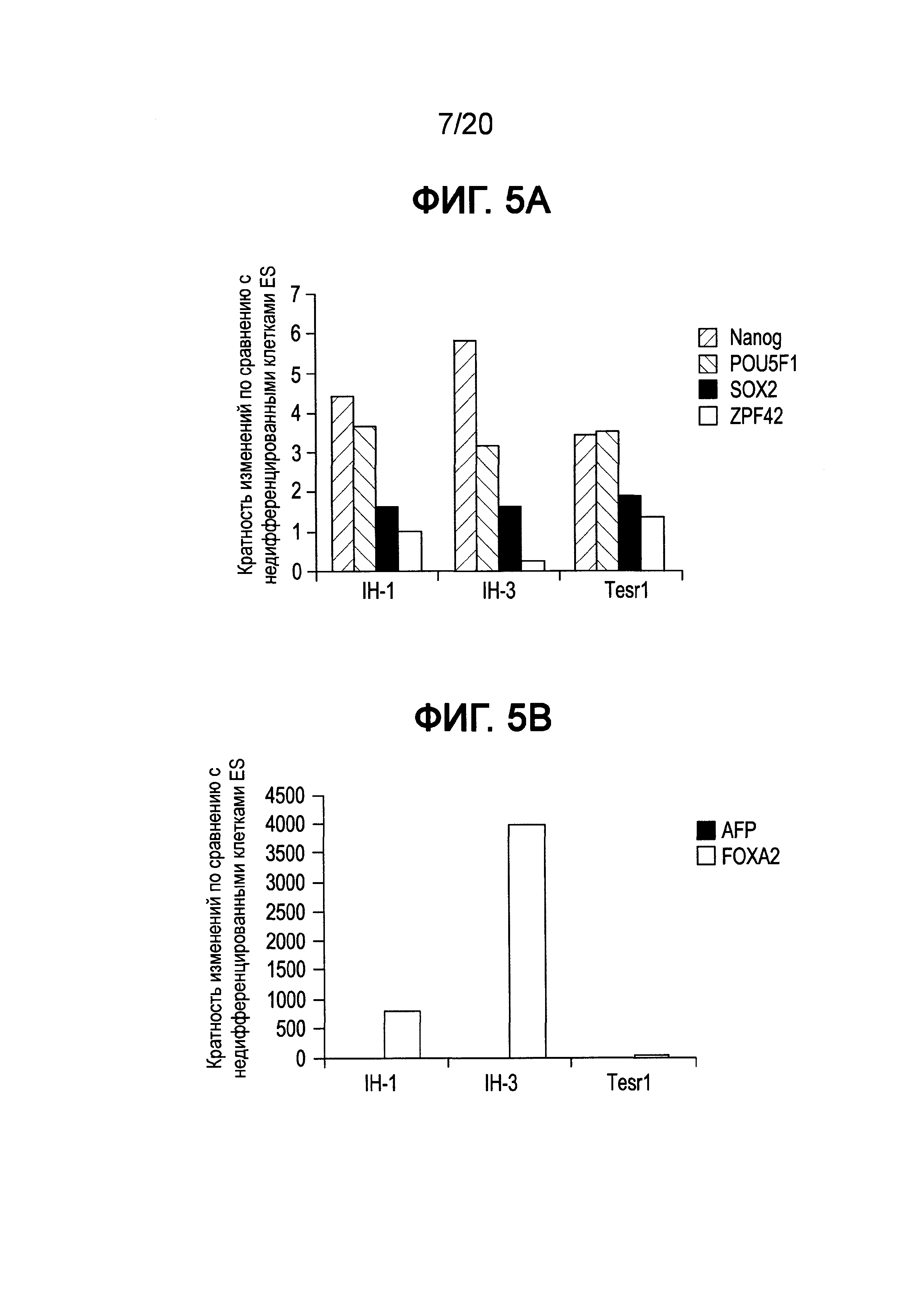
На Фиг. 5A-5B представлены данные ПЦР в реальном времени для экспрессии Nanog, POU5F1 (OCT4), SOX2 и ZFP42 (ФИГ. 5A), а также AFP и FOXA2 (ФИГ. 5B) в клетках линии Н1 человеческих эмбриональных стволовых клеток, культивированных в среде, описанной в примере 1, и собранных при пассаже 10.
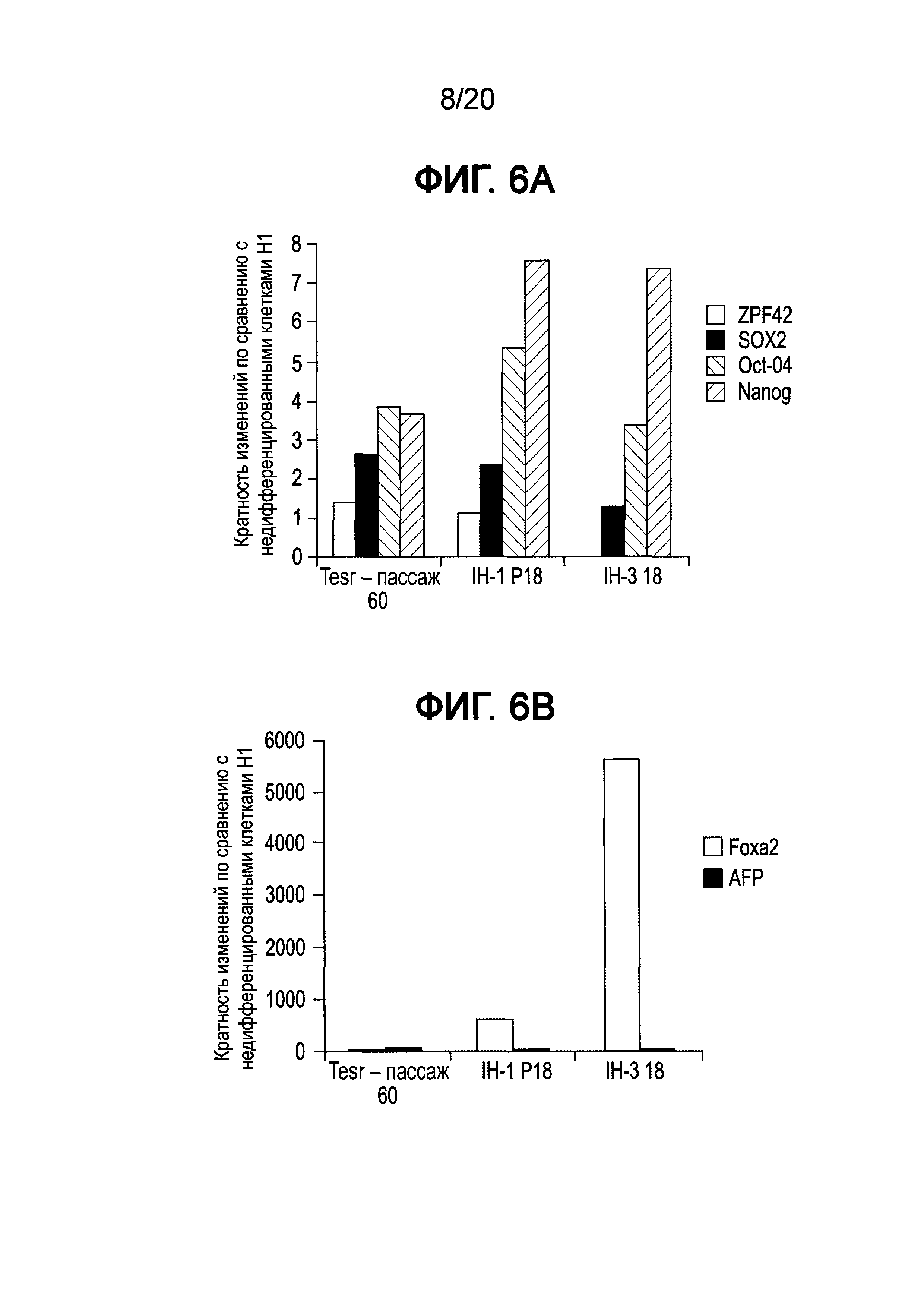
На Фиг. 6А-6В представлены данные ПЦР в реальном времени для экспрессии ZFP42, SOX2, POU5F1 (OCT4) и Nanog (ФИГ. 6A), а также AFP и FOXA2 (ФИГ. 6B) в клетках линии Н1 человеческих эмбриональных стволовых клеток, культивированных в среде, описанной в примере 1, и собранных при пассаже 18.
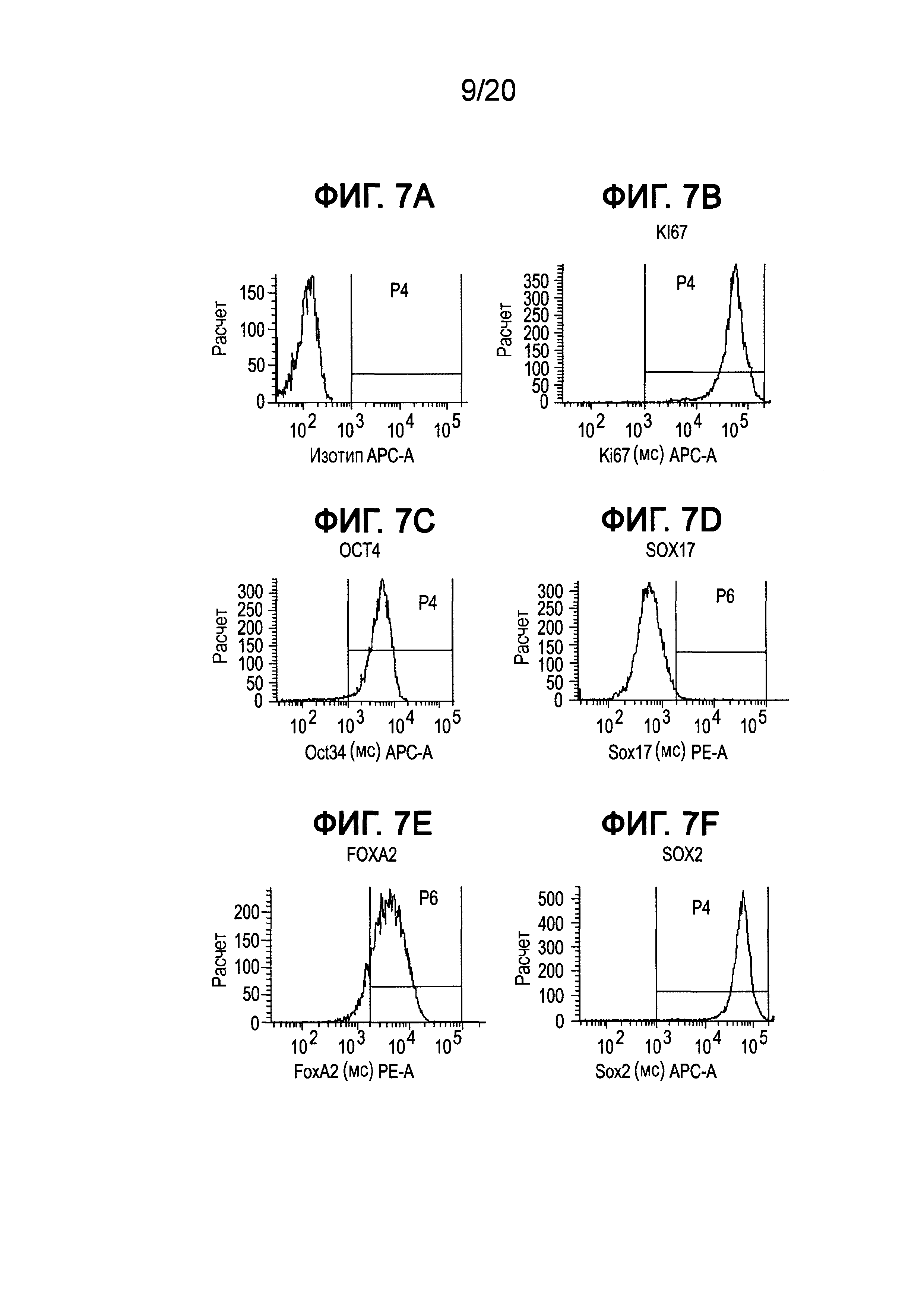
На Фиг. 7А-7F представлена гистограмма FACS для профилей экспрессии следующих маркеров в клетках, культивированных при 18 пассажах в среде IH-3, описанной в примере 1: изотипный контроль (ФИГ. 7A); KI-67 (ФИГ. 7B); OCT4 (ФИГ. 7C); SOX17 (ФИГ. 7D); FOXA2 (ФИГ. 7E); и SOX2 (ФИГ. 7F). На каждой гистограмме представлен процент экспрессии каждого маркера.
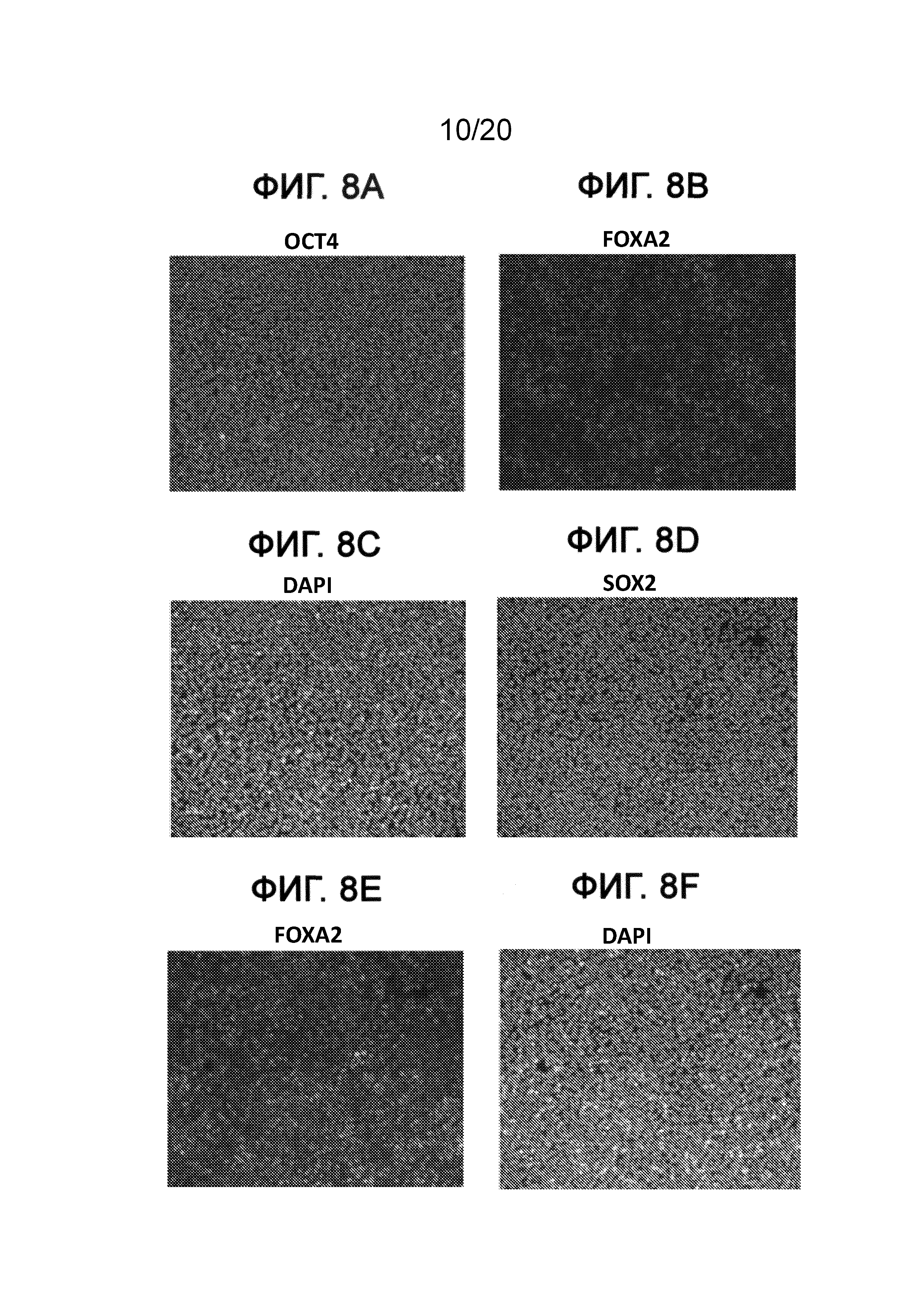
На Фиг. 8A-8F представлены изображения клеток, культивированных при 18 пассажах в среде IH-3, описанной в примере 1, с иммунным окрашиванием для OCT-4, FOXA2, SOX2 и флуоресцентной меткой для ДНК с использованием DAPI. Изображения, полученные для OCT4 (ФИГ. 8A), FOXA2 (ФИГ. 8B) и окрашенной DAPI ДНК (ФИГ. 8C), регистрировали в одном и том же оптическом поле, но с различными фильтрами. Аналогичным образом изображения, полученные для SOX2 (ФИГ. 8D), FOXA2 (ФИГ. 8E) и окрашенной DAPI ДНК (ФИГ. 8F), регистрировали в одном и том же оптическом поле, но с другими фильтрами.
На Фиг. 9A-9F представлены фазоконтрастные изображения клеток H1, культивированных при пяти пассажах в среде mTeSR®1 (ФИГ. 9A) и в составах IH-3 (ФИГ. 9B), IH-3-1 (ФИГ. 9C), IH-3-2 (ФИГ. 9D), IH-3-3 (ФИГ. 9E) и IH-3-4 (ФИГ. 9F), описанных в примере 2.
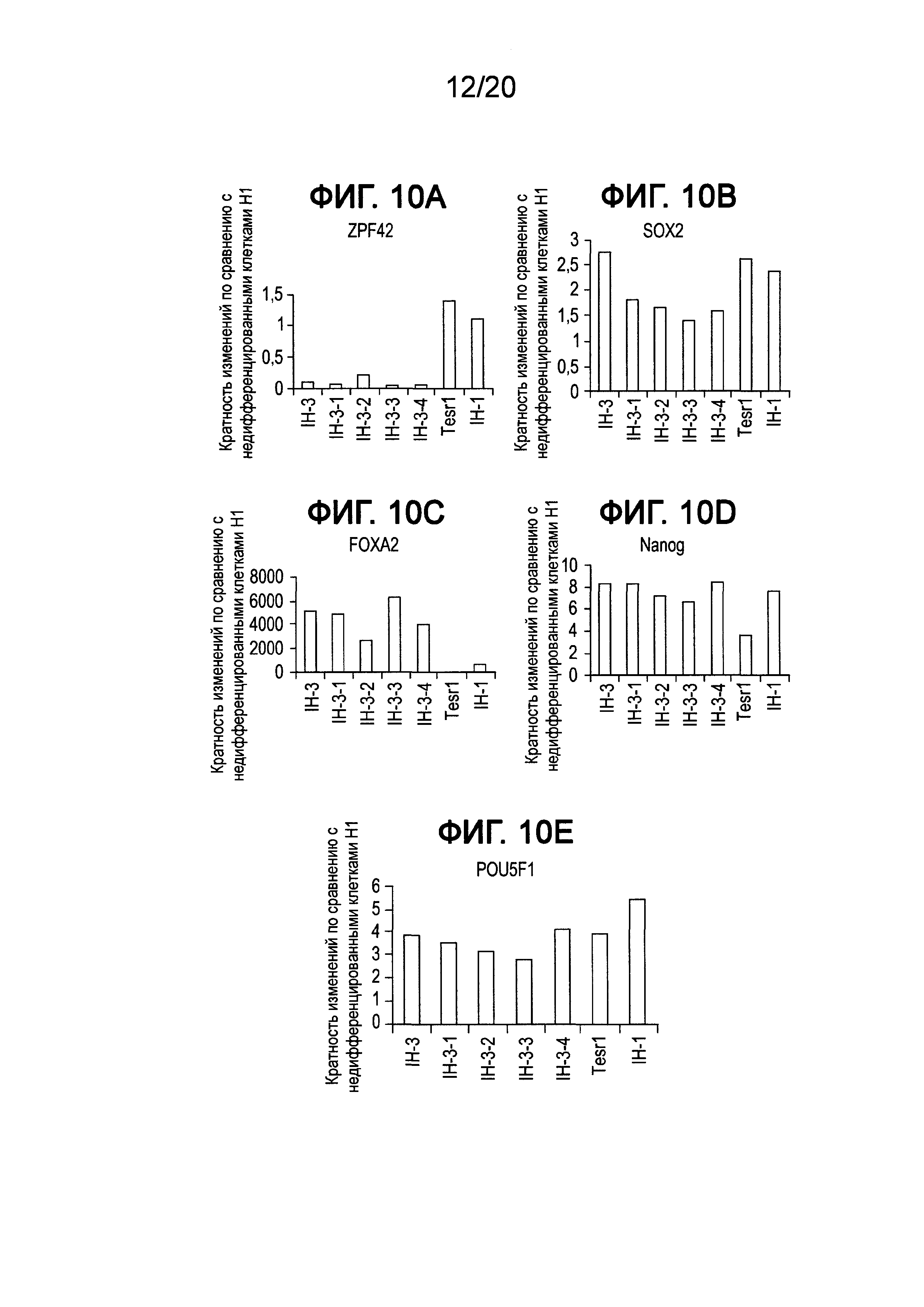
На Фиг. 10A-10E представлены данные ПЦР в реальном времени для экспрессии следующих генов в клетках линии Н1 человеческих эмбриональных стволовых клеток, культивированных в среде, описанной в примере 2, и собранных при пассаже 5: ZFP42 (ФИГ. 10A), SOX2 (ФИГ. 10B), FOXA2 (ФИГ. 10C), Nanog (ФИГ. 10 D) и POU5F1 (OCT4) (ФИГ. 10E).
На Фиг. 11A-11D представлены фазоконтрастные изображения клеток H1, культивированных при 20 пассажах в составах сред mTeSR®1 (ФИГ. 1A), IH-3 (ФИГ. 11B), IH-1 (ФИГ. 11C) и IH-3RT (ФИГ. 11D), описанных в примере 3.
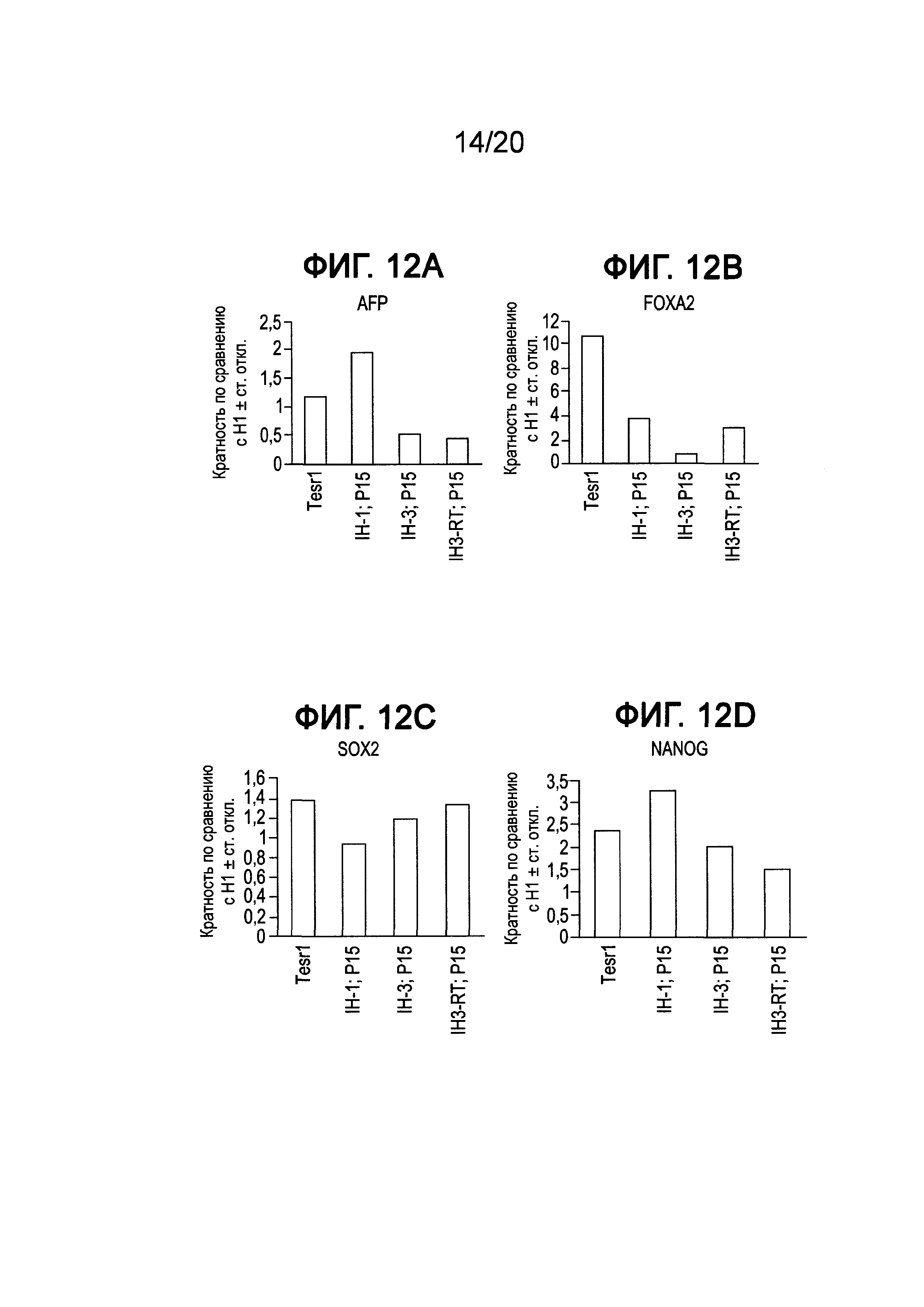
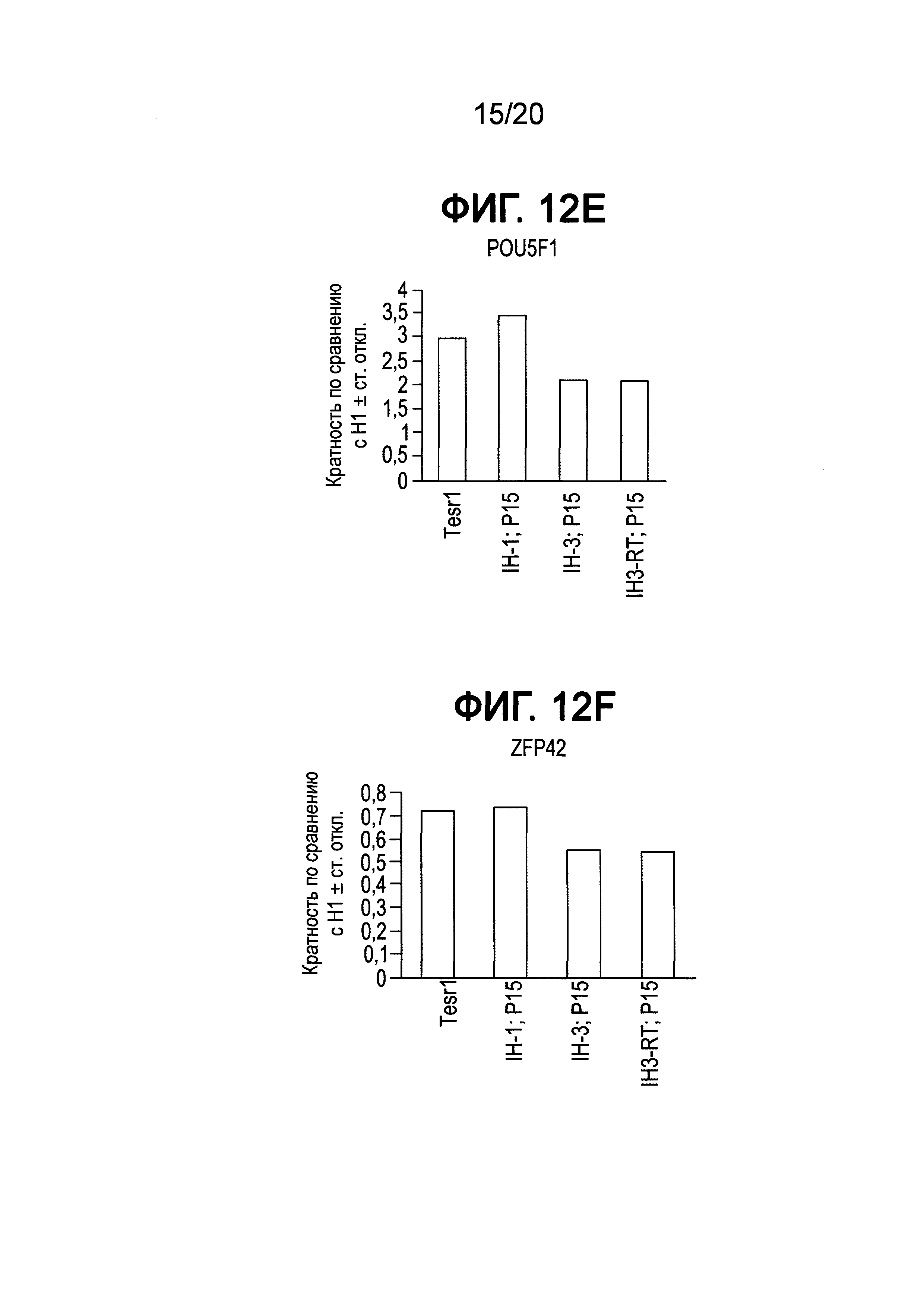
На Фиг. 12A-12F представлены данные ПЦР в реальном времени для экспрессии следующих генов в клетках линии Н1 человеческих эмбриональных стволовых клеток, культивированных при 15 пассажах в среде, описанной в примере 3: AFP (ФИГ. 12A), FOXA2 (ФИГ. 12B), SOX2 (ФИГ. 12C), Nanog (ФИГ. 12D), POU5F1 (OCT4) (ФИГ. 12E) и ZFP42 (ФИГ. 12F).
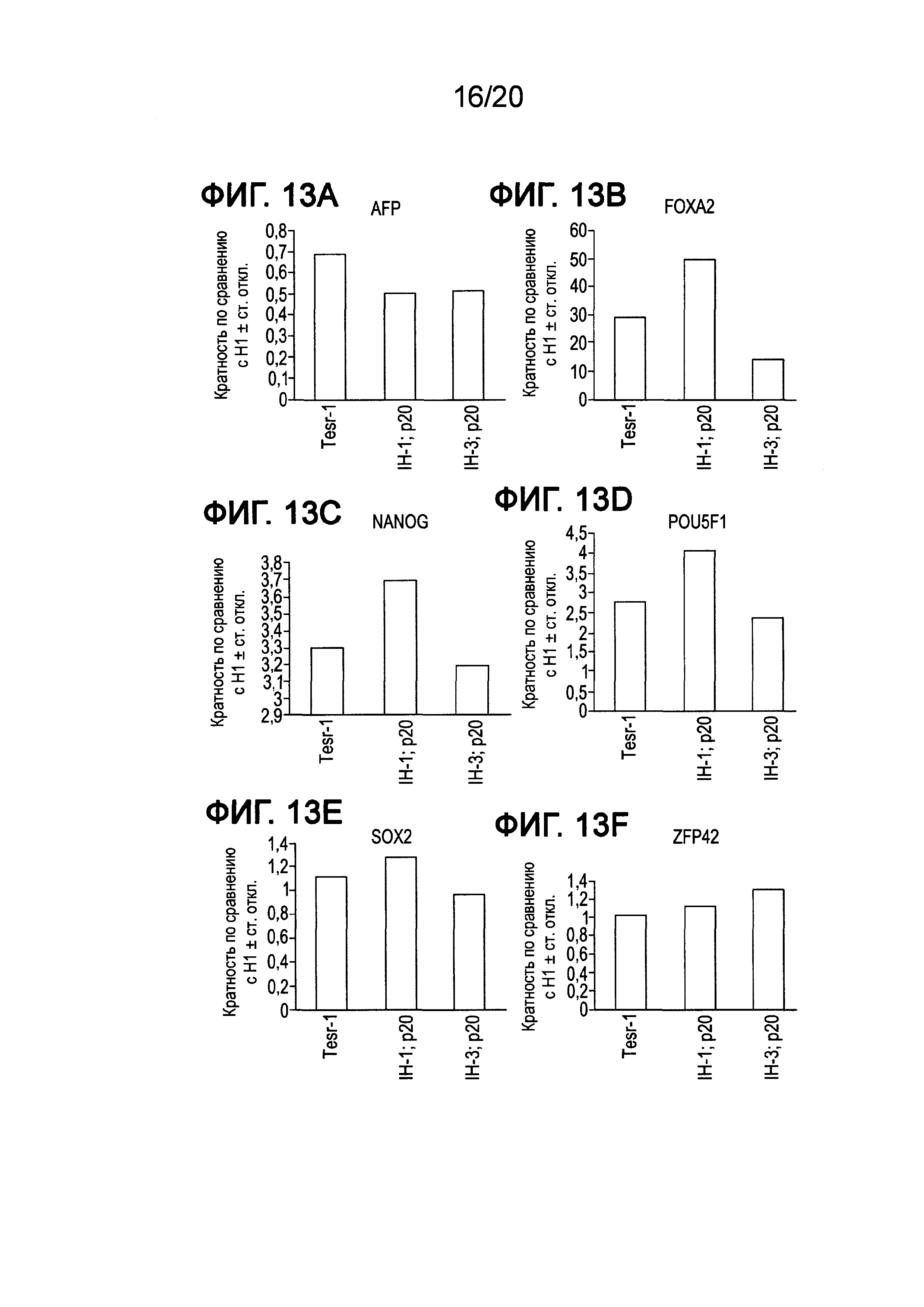
На Фиг. 13A-13F представлены данные ПЦР в реальном времени для экспрессии следующих генов в клетках линии Н1 человеческих эмбриональных стволовых клеток, культивированных при 20 пассажах в среде mTeSR®1 и в средах IH-1 и IH-3, описанных в примере 3: AFP (ФИГ. 13A), FOXA2 (ФИГ. 13B), NANOG (ФИГ. 13C), POU5F1 (OCT4) (ФИГ. 13D), SOX2 (ФИГ. 13E) и ZFP42 (ФИГ. 13F).
На Фиг. 14A-14B представлены фазоконтрастные изображения клеток Н1, культивированных в течение 4 суток в составах сред, описанных в примере 5, которые содержат Sigma БСА (ФИГ. 14A) или свободный от жирных кислот БСА (ФИГ. 14B).
На Фиг. 15A-15B представлены фазоконтрастные изображения для клеток Н1, культивированных при трех пассажах в составах сред, описанных в примере 5, содержащих Sigma БСА (ФИГ. 15A) или свободный от жирных кислот БСА (ФИГ. 15B).
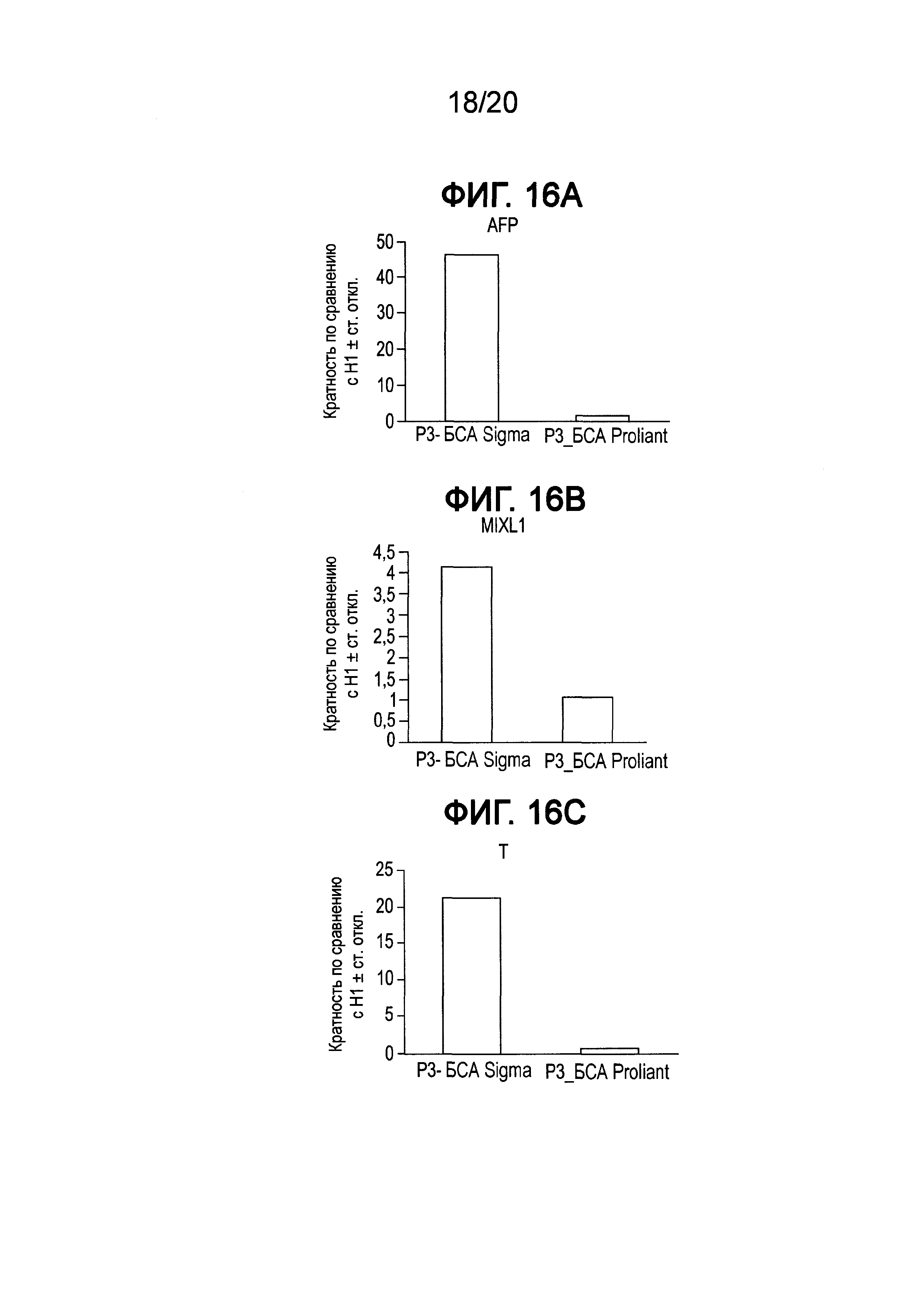
На Фиг. 16A-16C представлены данные ПЦР в реальном времени для экспрессии следующих генов в клетках линии Н1 человеческих эмбриональных стволовых клеток, культивированных при трех пассажах в составах сред, описанных в примере 5 и содержащих Sigma БСА или свободный от жирных кислот БСА: AFP (ФИГ. 16A), MIXL1 (ФИГ. 16B) и T (BRY) (ФИГ. 16C).
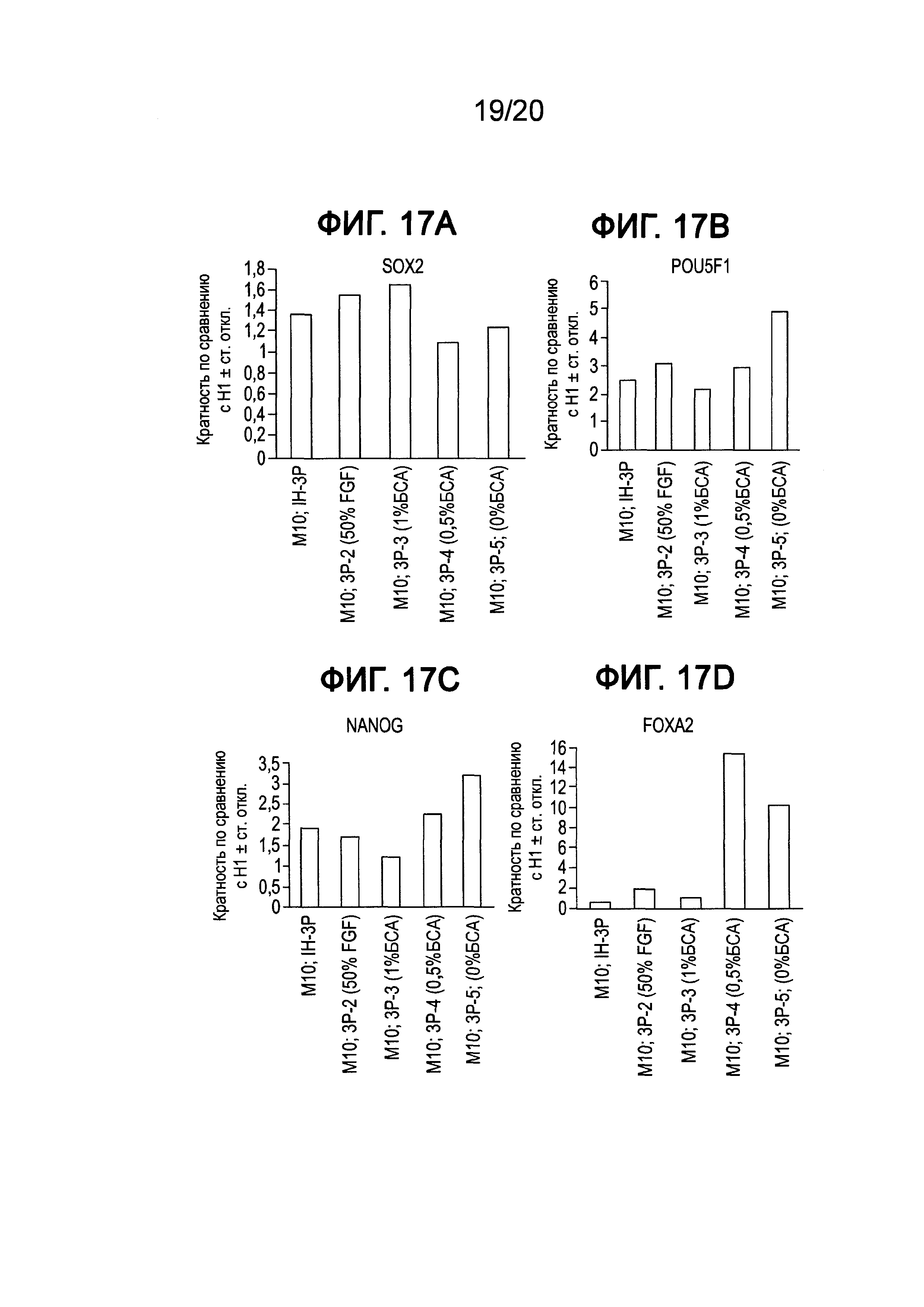
На Фиг. 17A-17D представлены данные ПЦР в реальном времени для экспрессии следующих генов в клетках линии Н1 человеческих эмбриональных стволовых клеток, культивированных при десяти пассажах в составах сред, описанных в примере 6: SOX2 (ФИГ. 17A), POU5F1 (ФИГ. 17B), NANOG (ФИГ. 17C) и FOXA2 (ФИГ. 17C).
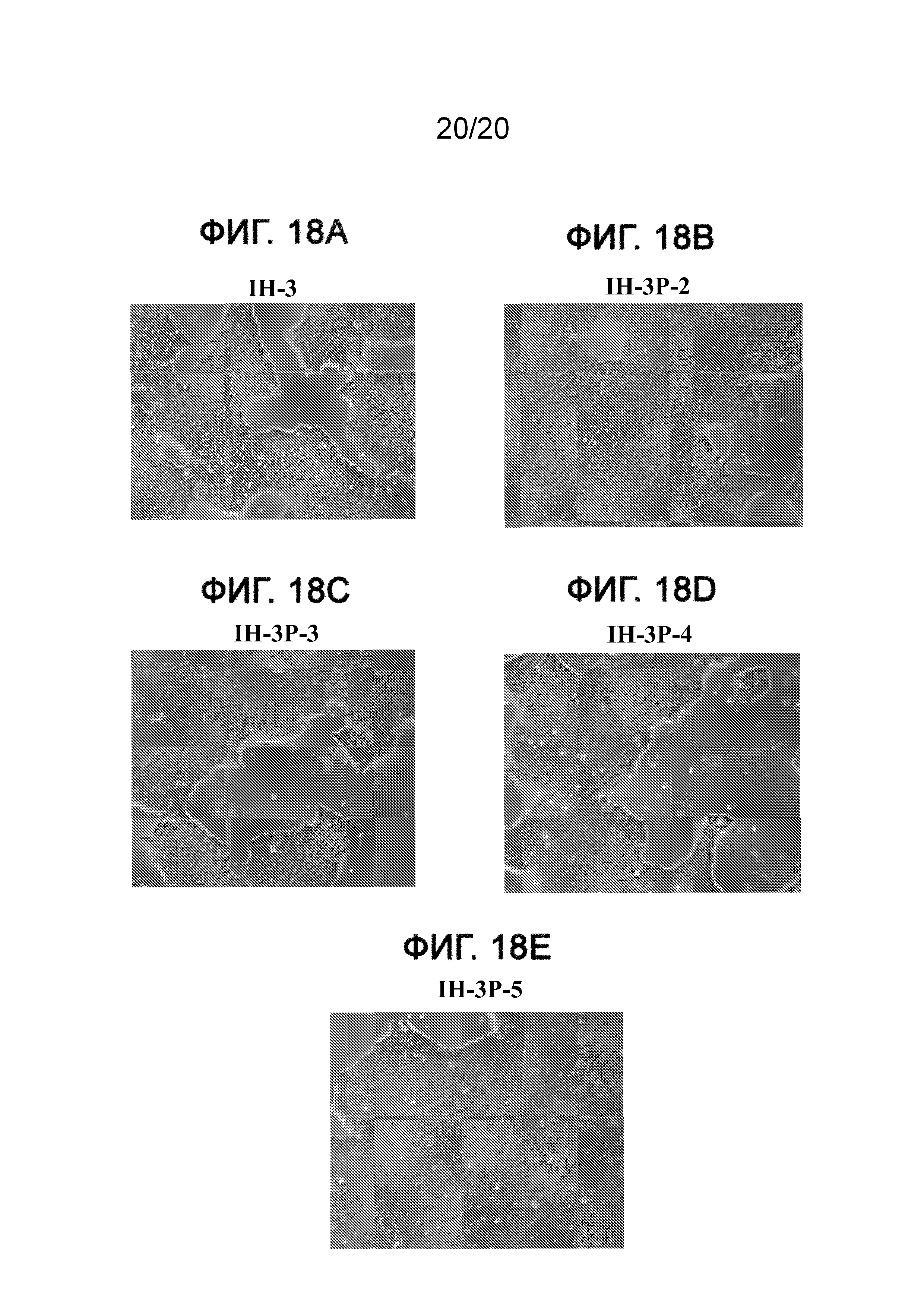
На Фиг. 18A-18E представлены фазоконтрастные изображения клеток Н1, культивированных при 10 пассажах в составах сред IH-3 (ФИГ. 18A), IH-3P-2 (ФИГ. 18B), IH-3P-3 (ФИГ. 18C), IH-3P-4 (ФИГ. 18D) и IH-3P-5 (ФИГ. 18E), описанных в примере 6.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для четкости описания, а не для ограничения изобретения, подробное описание настоящего изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные элементы, варианты осуществления или области применения настоящего изобретения.
Определения
Стволовые клетки представляют собой недифференцированные клетки, определяемые по их способности на уровне единичной клетки как самообновляться, так и дифференцироваться с образованием клеток-потомков, таких как самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий дифференцировки из множества зародышевых листков (энтодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от множества зародышевых листков, и вносить существенный вклад в формирование большинства, если не всех, тканей после инъекции в бластоцисты.
Стволовые клетки классифицируют по потенциалу развития следующим образом: (1) тотипотентные, т.е. способные преобразоваться в любой из эмбриональных и внеэмбриональных типов клеток; (2) плюрипотентные, т.е. способные преобразоваться во все типы эмбриональных клеток; (3) мультипотентные, т.е. способные преобразоваться в подмножество клеточных линий дифференцировки, но все в рамках конкретной ткани, органа или физиологической системы (например, гемопоэтические стволовые клетки (ГСК) могут образовывать потомство, включая ГСК (самообновление), рестриктированные олигопотентные клетки-предшественники клеток крови и все типы клеток и элементы (например, тромбоциты), представляющие собой стандартные компоненты крови); (4) олигопотентные, т.е. способные преобразоваться в более рестриктированное подмножество клеточных линий дифференцировки, чем мультипотентные стволовые клетки; и (5) унипотентные, т.е. способные преобразоваться в единственную клеточную линию дифференцировки (например, сперматогенные стволовые клетки).
Дифференцировка представляет собой процесс, при помощи которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, например, такой как нервная или мышечная клетка. Дифференцированная клетка или клетка с индуцированной дифференцировкой представляет собой клетку, занявшую более специализированное («коммитированное») положение в линии дифференцировки клетки. Термин «коммитированная» применительно к процессу дифференцировки относится к клетке, дошедшей в процессе дифференцировки до стадии, от которой в нормальных условиях она продолжит дифференцироваться до определенного типа клеток или подмножества типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток или вернуться обратно к менее дифференцированному типу клеток. Дедифференцировкой называется процесс, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в линии дифференцировки клетки. При использовании в настоящем документе термин «линия дифференцировки клетки» определяет наследственность клетки, т.е. определяет, из какой клетки произошла данная клетка и каким клеткам она может дать начало. В линии дифференцировки клетка помещается в наследственную схему развития и дифференцировки. Маркером, специфичным для линии дифференцировки, называется характерная особенность, специфически ассоциированная с фенотипом клеток интересующей линии дифференцировки, которую можно использовать для оценки дифференцировки некоммитированной клетки в интересующей линии дифференцировки.
При использовании в настоящем документе термин «маркеры» означает молекулы нуклеиновых кислот или полипептидов с дифференциальной экспрессией в интересующей клетке. В данном контексте под дифференциальной экспрессией подразумевается повышение уровня экспрессии для положительного маркера и понижение уровня экспрессии для отрицательного маркера. Поддающийся обнаружению уровень маркерной нуклеиновой кислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет идентифицировать интересующую клетку и отличить ее от других клеток с помощью любого из множества способов, известных в данной области.
«Основной средой» называют раствор солей, питательных веществ и витаминов, который может поддерживать рост плюрипотентных стволовых клеток в культуре. В качестве основной среды, помимо прочих, можно использовать модифицированную по способу Дульбекко среду Игла (DMEM), среду MCDB, RPMI. DMEM может также представлять собой DMEM/F12 (также называется DM-F12) или DMEM с высоким содержанием глюкозы (также называется DMEM-hg). Среду MCDB можно выбрать из любых доступных сред MCDB, в частности, MCDB-131. В альтернативном варианте осуществления основную среду можно выбрать из смесей перечисленных выше составов основных сред в соответствующих соотношениях, чтобы обеспечить пролиферацию и обновление плюрипотентности эмбриональных стволовых клеток. В некоторых вариантах осуществления основной средой в определенных составах культивирования клеток настоящего изобретения является DMEM-F12. В некоторых вариантах осуществления основной средой в определенных составах культивирования клеток настоящего изобретения является MCDB-131.
«Питающими клетками» называют не являющиеся плюрипотентными стволовые клетки, на которые высеваются плюрипотентные стволовые клетки. Питающие клетки обеспечивают достаточно растворимых и нерастворимых факторов, способствующих иммобилизации, пролиферации и обновлению плюрипотентных маркеров плюрипотентными стволовыми клетками.
«Кондиционированной средой» называют среду, которая также дополняется растворимыми факторами, полученными из питающих клеток.
«Внеклеточный матрикс» или «матрикс определенного состава», или «синтетический матрикс» обозначает одно или более веществ, которые могут обеспечивать иммобилизацию, пролиферацию и обновление плюрипотентных маркеров плюрипотентными стволовыми клетками. В настоящем документе термины IGF и IGF-1, которые относятся к инсулиноподобному фактору роста 1, используются взаимозаменяемо. В организме человека данный белок вырабатывается в печени и выполняет по большей части те функции, которые относятся к человеческому гормону роста.
В настоящем документе термины FGF2 и bFGF, которые относятся к человеческому основному фактору роста фибробластов, используются взаимозаменяемо.
В настоящем документе термины «TGF beta», «TGF-B» и «TGF-β» используются взаимозаменяемо. Лиганд TGF-β может быть выбран из костных морфогенетических белков (BMP), фактора роста и дифференцировки (GDF), активинов (активин A, активин AB, активин B, активин C), ингибиторов нодального сигнала и TGF-β. TGF-β может быть выбран из TGF-β1, TGF-β2, активина A и TGF-β3.
Выделение, размножение и культивирование плюрипотентных стволовых клеток
Характеристика плюрипотентных стволовых клеток
Плюрипотентные стволовые клетки могут экспрессировать один или более стадиеспецифических эмбриональных антигенов (SSEA) 3 и 4, а также маркеры, поддающиеся обнаружению антителами, обозначенными как Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998). Дифференцировка плюрипотентных стволовых клеток in vitro приводит к утрате экспрессирования SSEA-4, Tra1-60 и Tra1-81 (если имеются) и к увеличению экспрессии SSEA-1. В недифференцированных плюрипотентных стволовых клетках, как правило, активна щелочная фосфатаза, которую можно обнаружить путем фиксации клеток с помощью 4% параформальдегида с последующим обнаружением с помощью Vector Red, применяемого в качестве субстрата, в соответствии с инструкциями производителя (Vector Laboratories, г. Берлингейм, штат Калифорния). Недифференцированные плюрипотентные стволовые клетки также, как правило, экспрессируют OCT4 и TERT, обнаруживаемые с помощью ОТ-ПЦР.
Другим желательным фенотипическим свойством выращенных плюрипотентных стволовых клеток является потенциал дифференцировки в клетки всех трех зародышевых листков: в энтодермальные, мезодермальные и эктодермальные ткани. Плюрипотентность стволовых клеток можно подтвердить, например, путем инъекции клеток мышам с тяжелым комбинированным иммунодефицитом (SCID), фиксирования образующихся тератом с помощью 4% параформальдегида и их последующего гистологического исследования на наличие клеточных типов, происходящих от трех зародышевых листков. Альтернативно плюрипотентность можно определить по созданию эмбриоидных телец и анализа их на присутствие маркеров, ассоциируемых с тремя зародышевыми листками.
Выращенные линии плюрипотентных стволовых клеток можно кариотипировать с применением стандартного способа G-бэндинга и сравнения с опубликованными кариотипами соответствующих видов приматов. Желательно получить клетки, имеющие «нормальный кариотип», т.е. эуплоидные клетки, в которых все человеческие хромосомы присутствуют и не имеют видимых изменений. Плюрипотентные клетки можно легко размножить в культуре путем использования различных питательных слоев или с помощью сосудов, покрытых матриксными белками. Альтернативно химически определенные поверхности в комбинации со средами определенного состава, такими как среды mTeSR® 1 (StemCell Technologies, г. Ванкувер, Канада), можно использовать для обычного размножения клеток. Плюрипотентные клетки можно легко удалить из планшетов с культурой при помощи ферментативной, механической обработки или с использованием различных кальцийхелатирующих агентов, таких как EDTA (этилендиаминтетрауксусная кислота). Альтернативно плюрипотентные клетки можно размножить в суспензии в отсутствие каких-либо матриксных белков или питательного слоя.
Источники плюрипотентных стволовых клеток
Типы подходящих плюрипотентных стволовых клеток включают в себя устойчивые линии плюрипотентных клеток, получаемые из формируемой после вынашивания плода ткани, включая преэмбриональную ткань (такую как бластоциста), эмбриональной ткани или ткани плода, взятой в любой момент в ходе вынашивания, как правило, но не обязательно, до срока приблизительно 10-12 недель беременности. Не имеющими ограничительного характера примерами являются устойчивые линии эмбриональных стволовых клеток человека или эмбриональных зародышевых клеток человека, такие как, например, линии H1, H7 и H9 эмбриональных стволовых клеток человека (WiCell Research Institute, г. Мэдисон, штат Висконсин). Также возможно использование описываемых в настоящем документе композиций в ходе первоначального установления или стабилизации таких клеток, в данном случае исходными клетками являются первичные плюрипотентные клетки, взятые непосредственно из тканей-источников. Также подходящими являются клетки, взятые из популяции плюрипотентных стволовых клеток, уже культивированных в отсутствие питающих клеток. Также подходящими являются индуцибельные плюрипотентные клетки (IPS) или перепрограммированные плюрипотентные клетки, которые могут быть получены из взрослых соматических клеток с помощью принудительной экспрессии ряда факторов, относящихся к плюрипотентным транскрипционным факторам, таким как OCT4, Nanog, Sox2, KLF4 и ZFP42 (Annu Rev Genomics Hum Genet, 2011, 12:165-185).
Эмбриональные стволовые клетки человека можно приготовить, как описано в публикации Thomson et al. (патент США № 5843780; Science, 1998; 282:1145-1147; Curr Top Dev Biol, 1998; 38:133-165; 1995, Proc Natl Acad Sci USA 92:7844-7848).
Характеристики плюрипотентных стволовых клеток хорошо известны специалистам в данной области, и продолжается выявление дополнительных характеристик плюрипотентных стволовых клеток. Маркеры плюрипотентных стволовых клеток включают в себя, например, экспрессию одного или более следующих маркеров: ABCG2, CRIPTO, FOXD3, Connexin43, Connexin45, OCT4, SOX2, Nanog, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60, Tra 1-81.
Маркеры дифференцирования, которые, как правило, присутствуют в культурах эмбриональных стволовых клеток, включают в себя, например, AFP, FOXA2, SOX17, T(BRY) и MIXL1.
В одном из вариантов осуществления настоящего изобретения человеческие плюрипотентные стволовые клетки культивируют в среде определенного состава, содержащей аскорбиновую кислоту, IGF, инсулин, bFGF, лиганд TGF-B и свободный от жирных кислот альбумин для поддержки пролиферации плюрипотентных стволовых клеток при одновременном сохранении плюрипотентности и кариотипической стабильности размножающихся клеток по меньшей мере в течение 10 пассажей.
Одним из вариантов осуществления настоящего изобретения является популяция клеток in vitro, причем более 50% популяции клеток являются положительными по экспрессии белков OCT4, SOX2, NANOG, FOXA2 и положительными, но с низкой экспрессией SSEA-4 и ZFP42.
В другом аспекте настоящего изобретения описан определенный состав культивирования клеток in vitro, содержащий IGF, инсулин, bFGF, TGF-B, свободный от жирных кислот альбумин, но без аскорбиновой кислоты, что позволяет получить популяцию клеток, где более 50% клеточной популяции являются положительными по окрашиванию на белки OCT4, SOX2, NANOG, FOXA2 и с низким уровнем экспрессии белка SSEA-4 и ZFP42.
Настоящее изобретение дополнительно проиллюстрировано, без ограничений, следующими примерами, в которых части и проценты даны в весовом выражении, а градусы приводятся в Цельсиях, если не указано иное. Должно быть понятно, что данные примеры, где представлены предпочтительные варианты осуществления настоящего изобретения, приводятся исключительно для иллюстрации. Из приведенного выше описания и приведенных ниже примеров специалист в данной области может установить основные характеристики настоящего изобретения и провести различные изменения и модификации настоящего изобретения для адаптации его к различным условиям и типам применения без отклонения от его сущности и объема. Таким образом, различные модификации настоящего изобретения в дополнение к показанным и описанным в настоящем документе будут очевидны специалистам в данной области на основании вышеизложенного описания. Такие модификации также входят в объем прилагаемой формулы изобретения. Публикации, цитируемые в настоящем документе, полностью включены в настоящий документ путем ссылки.
Пример 1
Испытание различных условий культивирования для идентификации оптимальных компонентов среды для пролиферации недифференцированных эмбриональных стволовых клеток
Клетки линии Н1 человеческих эмбриональных стволовых клеток (пассажи с 35 по 40), которые культивировали на покрытых MATRIGEL™ (разведение 1:30; BD Biosciences, г. Франклин Лейкс, штат Нью-Джерси) чашках в среде mTeSR®1 (StemCell Technologies, г. Ванкувер, Канада) и пересеивали с помощью ЭДТА, использовали в качестве исходной популяции для испытания различных композиций сред. Клетки пересеивали малыми колониями с обработкой ЭДТА в течение 5-10 минут при комнатной температуре. Культуры стандартным образом делились в соотношении от 1:6 до 1:10 при каждом пассаже. В таблице I перечислены исходные составы сред, испытанные с точки зрения их способности к пролиферации клеток Н1 при одновременном сохранении их недифференцированных маркеров морфологии и плюрипотентности.
|
|
|
Использование IH-4 и IH-5 для дальнейших оценок было прекращено, поскольку клетки, культивированные с помощью IH-4 и IH-5, не удавалось вырастить после пассажа 2. На пассаже 2 клетки, выращенные в IH-2, демонстрировали существенные изменения в морфологии, которые соответствовали дифференцированным клеткам и потере массы колоний. Среды IH-1, IH-3 и IH-6 выбирали для дальнейшей оценки. На пассаже 3-5 клетки, культивированные в IH-6, демонстрировали морфологические свидетельства дифференцированных клеток на периферии колоний ES (можно сравнить ФИГ. 1C с ФИГ. 1A, ФИГ. 1B и ФИГ. 1D).
После пассажа 5 только среды IH-1 и IH-3 по-прежнему использовали для сравнения с клетками, культивированными в среде mTeSR®1. На пассажах с 5 по 18 отбирали образцы из культур IH-1, IH-3 и mTeSR®1 и анализировали их с помощью FACS, ПЦР, кариотипического анализа (G-бэндинг или FISH) и иммунофлуоресцентного окрашивания. Результаты анализа FISH представлены в таблице II. Данные результаты показывают, что клетки H1, культивированные в среде IH-1 или в среде IH-3, демонстрировали нормальный кариотип, тогда как клетки, культивированные в среде mTeSR®1, проявляли аномальную трисомию 12 на пассаже 10 и 18.
|
Более того, аналогично росту клеток в среде mTeSR®1 клетки, постоянно пересеиваемые в среде IH-1, сохраняли характерную морфологию колонии ES с очень небольшим количеством дифференцированных клеток вокруг колоний. Однако после пассажа 10 клетки, выращенные в среде IH-3, начали утрачивать характерную морфологию колонии ES (см. ФИГ. 1A, ФИГ. 2A и ФИГ. 3A).
Анализ маркеров клеточной поверхности и внутренних маркеров, связанных с плюрипотентностью, использовали для оценки воздействия испытуемых составов на сохранение плюрипотентности. Как показано в таблице III, при пассаже 5 клетки, культивированные в IH-1 и IH-3, демонстрировали профиль маркеров клеточной поверхности, который был аналогичен культурам, выращиваемым в среде mTeSR®1. Однако к пассажу 10 клетки Н1, культивированные в среде IH-3, демонстрировали существенное падение экспрессии SSEA-4 и умеренное падение экспрессии TRA1-60 и 1-81. Клетки H1, культивированные в среде IH-1 при 10 пассажах, сохраняли характеристики экспрессии, которые были аналогичны культивированным в среде mTeSR®1.
|
Неожиданно было обнаружено, что аналогично клеткам Н1, культивированным в средах mTeSR®1 и IH-1, клетки H1, культивированные в среде IH-3, сохраняли высокий уровень экспрессии маркеров OCT4 и SOX2 на пассаже 11 (таблица IV). Это наблюдалось несмотря на очень низкий уровень экспрессии SSEA-4 для клеток H1, культивированных в среде IH-3.
|
Как показано на Фиг. 4, экспрессия мРНК основными маркерами плюрипотентности, например, Nanog (ФИГ. 4D), OCT4 (ФИГ. 4C), SOX2 (ФИГ. 4B) и ZPF42 (ФИГ. 4A), сохранялась в течение всего пассажа 5 для клеток Н1, культивированных в средах IH-1 и IH-3, на том же уровне, что и в клетках Н1, культивированных в mTeSR®1. Однако к пассажам с 10 по 18 отмечали существенное падение экспрессии ZFP42, тогда как экспрессия OCT4, Nanog и SOX2 изменилась незначительно для клеток, выросших в среде IH-3, по сравнению с клетками Н1, культивированными в среде IH-1 или mTeSR®1 (см. ФИГ. 5A и ФИГ. 6A). Более того, анализ FACS клеток Н1, культивированных в среде IH-3 в течение 18 пассажей, показал, что >97% клеток представляли собой OCT4+ (ФИГ. 7C), SOX2+ (ФИГ. 7F) и KI-67+ (ФИГ. 7B). Приблизительно 1% клеток представлял собой SOX17+ (ФИГ. 7D), и ~85% клеток представляли собой FOXA2+ (ФИГ. 7E). На Фиг. 8A-8F приведены изображения иммунофлуоресцентного окрашивания клеток H1, культивированных в среде IH-3 при 18 пассажах. Данные изображения демонстрируют, что существенное количество OCT4 и SOX2 положительных клеток также представляли собой FOXA2+. Клетки H1, культивированные в среде IH3, приобретали фенотип, в котором по меньшей мере 70% клеток представляли собой Oct4+ NANOG+ SOX2+ KI-67+ ZFP42- и FOXA2+. Такая популяция клеток до сих пор была не описана в данной области.
Пример 2
Культивирование клеток Н1 в среде IH-3 с добавкой аскорбиновой кислоты восстанавливает основные свойства недифференцированных эмбриональных стволовых клеток
Для выяснения причины падения SSEA-4 и ZPF42 для клеток Н1, культивированных в IH-3, по сравнению с культивированными в средах IH-1 и mTeSR®1 проводили анализ расхождений, чтобы выявить основные реагенты, присутствующие в mTeSR®1 и IH-1, но отсутствующие в среде IH-3. В среду IH-3, как показано в таблице V, добавляли следовые количества элементов C, аскорбиновую кислоту, хлорид лития или липиды определенного состава.
|
Клетки H1, культивированные при 14 пассажах в IH-3, затем культивировали в приведенных выше составах сред, а результаты сопоставляли с клетками, культивированными в среде IH-3. На стадии различных пассажей для клеток Н1, культивированных с использованием различных составов сред, проводили анализ плюрипотентных маркеров. Как показано в таблице VI, после пяти дополнительных пассажей клетки Н1, культивированные в среде IH-3-2 (IH-3 с добавлением аскорбиновой кислоты), восстанавливали незначительный процент своей экспрессии SSEA-4 по сравнению с клетками, культивированными в других испытуемых средах.
|
Как показано на ФИГ. 9D, клетки H1, культивированные в среде IH-3-2, сохраняли характерную морфологию эмбриональных стволовых клеток, аналогичную с клетками, культивированными в среде mTeSR®1 (ФИГ. 9A). Однако клетки Н1, культивированные в IH-3, IH-3-1, IH-3-3 и IH-3-4, демонстрировали рыхлую морфологию колонии (см. ФИГ. 9B, ФИГ. 9C и ФИГ. 9F). Анализ ПЦР для клеток, культивированных в указанных выше составах сред, также подтвердил, что клетки Н1, культивированные в среде IH-3-2, восстанавливали определенный уровень экспрессии ZFP42 и снижали экспрессию FOXA2 (см. ФИГ. 10A-10E). Приведенные выше данные показывают, что присутствие аскорбиновой кислоты необходимо для сохранения плюрипотентности клеток ES наряду с их характерной морфологией колонии/клетки и низкой экспрессии маркеров дифференцирования. На основе полученных данных дальнейшее культивирование клеток Н1 в среде IH-3 проводили с добавлением 0,25 мМ аскорбиновой кислоты.
Клетки, культивированные в IH-3-2, частично восстанавливали определенную характерную морфологию колонии клеток ES, тогда как клетки, культивированные в других составах сред IH, демонстрировали более рыхлую морфологию.
Пример 3
Продолжительное культивирование клеток Н1 в средах IH-3 и IH-1 обеспечивает сохранение плюрипотентности и стабильного кариотипа
Клетки линии Н1 человеческих эмбриональных стволовых клеток (пассажи с 35 по 40), которые культивировали на покрытых MATRIGEL™ (разведение 1:30) чашках в среде mTeSR®1 и пересеивали с помощью ЭДТА, как описано в примере 1, использовали в качестве исходной популяции для оценки продолжительного культивирования с использованием сред IH-1, IH-3-2 и mTeSR®1. Клетки пересеивали малыми колониями с обработкой ЭДТА в течение 5-10 минут при комнатной температуре. Компоненты испытуемых сред перечислены в таблице VII.
|
Как показано на ФИГ. 11A-11D, клетки H1, культивированные при 20 пассажах в IH-1, IH-3-2 и IH-3RT, сохраняли характерную морфологию ES. Результаты ПЦР анализа для клеток Н1, культивированных при 15 пассажах в IH-1, IH-3-2 и IH-3RT, представлены на ФИГ. 12A-12F. Результаты ПЦР анализа для клеток Н1, культивированных при 20 пассажах в IH-1, IH-3-2 и IH-3RT, представлены на ФИГ. 13A-13F. Проведенный анализ подтвердил, что аналогично клеткам Н1, культивированным в среде mTeSR®1, клетки, культивированные при 15 или 20 пассажах в средах IH-1, IH-3-2 и IH-3RT (рекомбинантный человеческий трансферрин), сохраняли все основные маркеры плюрипотентности, одновременно демонстрируя очень низкий уровень экспрессии FOXA2 и AFP. Анализ FACS на пассаже 15 и пассаже 20 также подтверждает экспрессию маркеров клеточной поверхности, связанных с плюрипотентными клетками, до тех же уровней, что и в клетках Н1, культивированных в среде mTeSR®1 (см. таблицу VIII).
|
Клетки H1, постоянно культивированные в IH-1, IH-3-2 и IH-3RT, демонстрировали нормальный кариотип, как показали результаты G-бэндинга и анализа FISH. Однако клетки Н1, культивированные при пассажах с 10 по 20 в mTeSR®1, демонстрировали аномальные количества хромосом (см. таблицу IX).
|
Пример 4
Одинаковые скорости пролиферации для клеток Н1, культивированных в средах IH-1, IH-3 и mTeSR®1
Чтобы сравнить скорости пролиферации клеток, культивированных в ранее испытанных средах, клетки Н1, культивированные в средах IH-1, IH-3-2 и mTeSR®1, отделяли с помощью TrypLE (Invitrogen) и высеивали с плотностью 5×105 клеток на 10 см в покрытые MATRIGEL™ чашки. Для снижения апоптоза одиночных клеток и повышения уровня иммобилизации отделенные клетки предварительно обрабатывали 10 мкM ингибитора Rock (Sigma). Среду меняли ежедневно в течение трех суток после высевания. На 3 сутки клетки отделяли в виде единичных клеток и подсчитывали с помощью гемоцитометра. Как показано в таблице X, клетки, культивированные во всех трех составах сред, демонстрировали равные времена удвоения.
|
Пример 5
Высокочистый свободный от жирных кислот БСА способствует размножению плюрипотентных клеток
Клетки линии Н1 человеческих эмбриональных стволовых клеток (пассажи с 35 по 40), культивированные в покрытых MATRIGEL™ (разведение 1:30) чашках в среде mTeSR®1 и пересеиваемые с помощью ЭДТА, использовали в качестве исходной популяции для оценки непродолжительно культивируемых клеток с использованием среды IH-3-2 с добавлением либо 2% БСА Sigma (№ кат. A2153; партия: 061M1804V), либо свободного от жирных кислот БСА (Proliant, № кат. 7500804; партия: 11G54001). Клетки пересеивали малыми колониями с обработкой ЭДТА в течение 5-10 минут при комнатной температуре. На Фиг. 14A и Фиг. 14B представлены фазоконтрастные изображения клеток Н1, культивированных в течение 4 суток в среде составов, которые содержат БСА Sigma (ФИГ. 14A) или свободный от жирных кислот БСА (ФИГ. 14B). На Фиг. 15А и Фиг. 15В представлены фазоконтрастные изображения клеток Н1, культивированных при трех пассажах в среде составов, которые содержат БСА Sigma (ФИГ. 15А) или свободный от жирных кислот БСА (ФИГ. 15В). Как показано на ФИГ. 14A, уже на 4 сутки после высевания наблюдали морфологические признаки дифференцированных клеток в культурах в присутствии БСА Sigma. Однако не наблюдали совокупных признаков морфологии дифференцированных клеток, обработанных свободным от жирных кислот БСА (см. ФИГ. 14B). Такую же тенденцию отмечали на пассаже 3, где регистрировали морфологические признаки дифференцированных клеток в культурах, где использовали БСА Sigma (см. ФИГ. 15A), тогда как не наблюдали совокупных признаков морфологии дифференцированных клеток, культивированных в среде, содержащей свободный от жирных кислот БСА (см. ФИГ. 15B). Более того, наблюдали существенное падение конфлюентности клеток, культивированных в среде, содержащей БСА Sigma, по сравнению с клетками, культивированными в среде, содержащей свободный от жирных кислот БСА (можно сравнить ФИГ. 15A и ФИГ. 15B).
Данные ПЦР в реальном времени для экспрессии AFP (ФИГ. 16A), MIXL1 (ФИГ. 16B) и T (BRY) (ФИГ. 16C) в клетках линии Н1 человеческих эмбриональных стволовых клеток, культивированных при трех пассажах в составах сред, содержащих БСА Sigma или свободный от жирных кислот БСА, показаны на ФИГ. 16A, 16B и 16C. Данные ПЦР на пассаже 3 четко указывали на существенное повышение экспрессии маркеров, связанных с дифференцированными клетками, для клеток, культивированных в среде, содержащей БСА Sigma. Полученные данные однозначно подтверждают, что использование свободного от жирных кислот БСА является очень важным для сохранения плюрипотентности, морфологии колонии и пролиферации клеток.
Пример 6
Плюрипотентные стволовые клетки могут размножаться и сохранять плюрипотентность в среде IH-3 в присутствии свободного от жирных кислот БСА и bFGF в широком диапазоне концентраций
Клетки линии Н1 человеческих эмбриональных стволовых клеток (пассажи с 35 по 40), которые культивировали на покрытых MATRIGEL™ (разведение 1:30) чашках в среде mTesr®1 и пересеивали с помощью ЭДТА, использовали в качестве исходной популяции для оценки краткосрочного и продолжительного культивирования с использованием среды IH-3 с добавками, которые приведены в таблице XI.
|
|
На пассаже 10 клетки оценивали морфологически с помощью ПЦР с точки зрения плюрипотентности и генов, связанных с дифференцированием. Более того, клетки оценивали на кариотипическую стабильность с помощью анализа FISH по хромосомам 12 и 17. На Фиг. 17A-17D приведены данные ПЦР в реальном времени для экспрессии SOX2 (ФИГ. 17A), POU5F1 (ФИГ. 17B), NANOG (ФИГ. 17C) и FOXA2 (ФИГ. 17D) в клетках линии Н1 человеческих эмбриональных стволовых клеток, культивированных при десяти пассажах в составах среды, приведенных в таблице XI. Как показано на данных фигурах, все из приведенных выше составов сохраняли высокий уровень экспрессии плюрипотентных маркеров по сравнению с клетками, выращенными в среде mTeSR®1. Однако клетки, выращенные при 0-0,5% БСА, демонстрировали более высокий уровень экспрессии FOXA2, что указывает на более высокий уровень спонтанного дифференцирования в данных культурах по сравнению с другими испытуемыми составами. На Фиг. 18A-18E представлены фазоконтрастные изображения клеток Н1, культивированных при 10 пассажах в составах сред IH-3-2 (ФИГ. 18A), IH-3P-2 (ФИГ. 18B), IH-3P-3 (ФИГ. 18C), IH-3P-4 (ФИГ. 18D) и IH-3P-5 (ФИГ. 18E), перечисленных в таблице XI. Как показано на данных фигурах, все испытанные в данном примере составы способствовали образованию колоний ES с минимальными признаками совокупной дифференцированной морфологии.
|
Как показано в таблице XII, клетки H1, культивированные при десяти пассажах в составах сред, перечисленных в таблице XI, сохраняли нормальное число хромосом 12 и 17, что подтверждается анализом FISH. Приведенные выше данные показывают, что среда определенного состава, содержащая основную среду DMEM/F12 с добавками ITS-X, химически чистого свободного от жирных кислот БСА, TGF-B1, IGF-1 и аскорбиновой кислоты, обеспечивает размножение плюрипотентных клеток, одновременно сохраняя плюрипотентность клеток при использовании свободного от жирных кислот БСА и bFGF в широком диапазоне концентраций.