Результат интеллектуальной деятельности: СПОСОБ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ МАРКЕРОВ ПОЗДНЕЙ ФОРМЫ БОЛЕЗНИ ПАРКИНСОНА
Вид РИД
Изобретение
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к области медицины и может использоваться для предварительной идентификации генетических маркеров, имеющих прогностическую ценность в диагностике болезни Паркинсона для повышения эффективности и информативности экзомного секвенирования. Способ в соответствии с настоящим изобретением может быть востребован в клинической неврологической практике для проведения генетического консультирования, диагностики и оценки генетической предрасположенности к болезни Паркинсона в первую очередь в семьях с документированными случаями болезни Паркинсона.
Предшествующий уровень техники настоящего изобретения
Работы по выявлению новых генов и ДНК маркеров болезни Паркинсона проводятся с использованием методов экзомного секвенирования - определения последовательности ДНК только кодирующих белок участков генома. Экзомное секвенирование используется при диагностике генетических заболеваний. Экзомный анализ проводится с использованием методов NGS-секвенирования («Next Generation Sequencing», секвенирование нового поколения).
Наиболее часто семейные случаи болезни Паркинсона связаны с мутациями в генах паркина (PARK2) и дардарина (LRRK2). Анализ мутаций и полиморфных вариантов этих генов в настоящее время находит применение в клинической практике для изучения семей с аутосомно-рецессивной и аутосомно-доминантной формами семейной болезни Паркинсона, в том числе в России. Однако изучение известных генетических систем, связанных с развитием болезни Паркинсона, не позволяет провести исчерпывающую оценку генетического риска в связи с тем, что неидентифицированы все патогенетически значимые мутации и полиморфизмы и не определены все связанные с развитием болезни Паркинсона локусы.
В связи с этим предполагается идентификация новых генетических маркеров, связанных с развитием болезни Паркинсона. При этом основное внимание уделяется анализу семейной формы заболевания и пациентов со спорадической формой болезни Паркинсона с ранним возрастом клинического дебюта, так как у этих больных наиболее высока вероятность выявления новых генетических маркеров заболевания.
Из предшествующего уровня техники известны способы выявления различных генетических заболеваний с использованием различных методов секвенирования. Например, в международной патентной публикации WO 98/59050 (дата публикации 30.12.1998 г.) раскрыт способ выявления субъектов с повышенным риском болезни Паркинсона, предусматривающий получение образца, содержащего нуклеиновую кислоту, белки или ткани, и выявление в них мутаций, связанных с болезнью Паркинсона. Однако предварительное типирование мутаций и полиморфизмов, связанных с этим заболеванием, не используется.
Наиболее близким техническим решением к настоящему изобретению, изложенным в международной патентной публикации WO 2010/056337 (дата публикации 20.05.2010 г.), является способ выявления биомаркеров различных заболеваний, в том числе и болезни Паркинсона, у субъекта с применением технологии NGS-секвенирования, при реализации которой применяются различные методики ПЦР и электрофореза. Однако предварительное типирование основных ассоциированных с развитием заболевания для исключения уже известных маркерных мутаций и полиморфизмов до выполнения секвенирования не проводится, что отрицательно сказывается на информативности и эффективности способа.
Таким образом, несмотря на широкое применение метода экзомного секвенирования остается не решенной проблема повышения его информативности и эффективности.
Описание чертежей
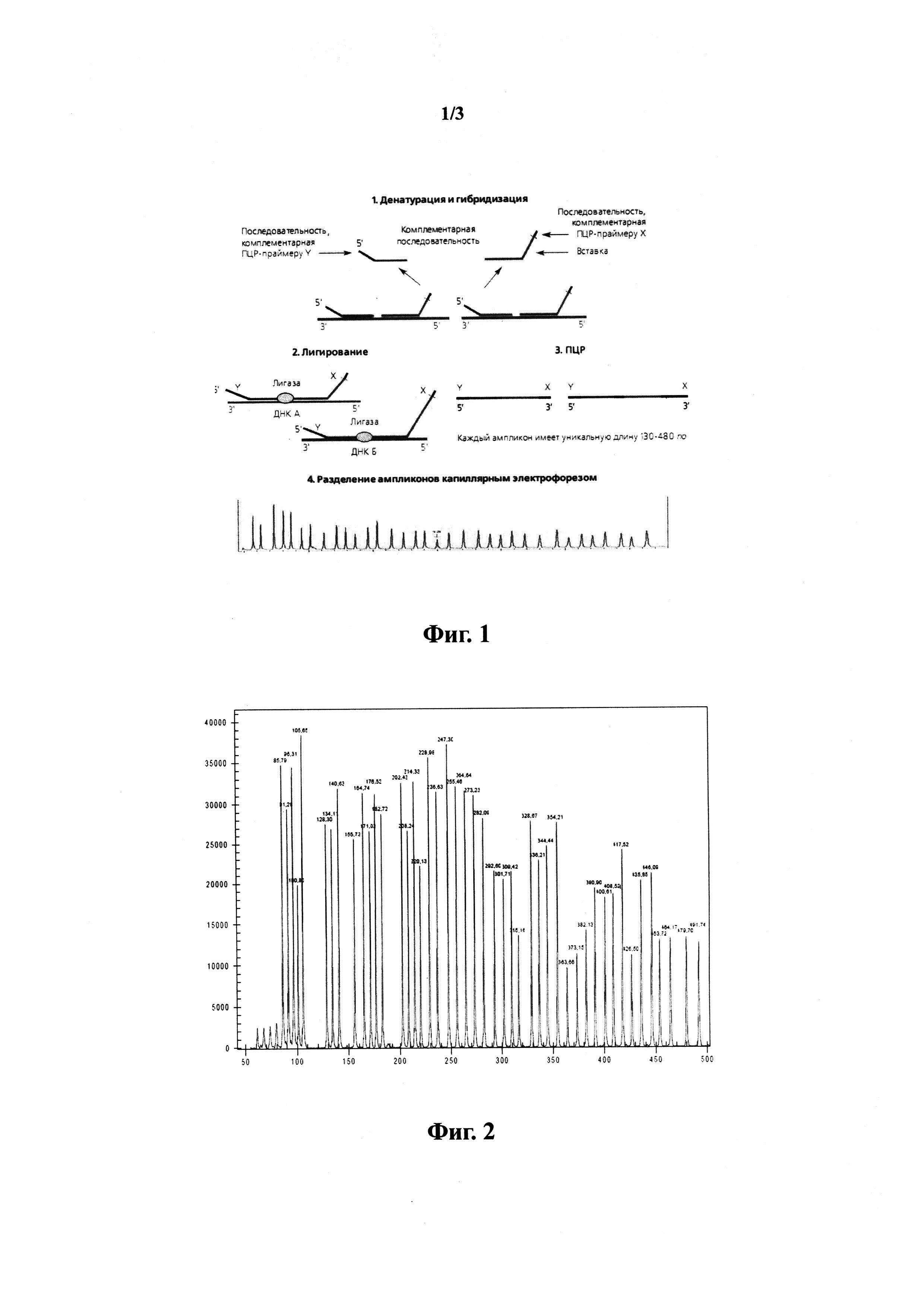
На фиг.1 представлена схема проведения МЛПР (множественной лигазной полимеразной реакции).
На фиг.2 показан пример фрагментного анализа контрольного образца ДНК с нормальным соотношением величины пиков от геномной ДНК (начиная с пика 128 п.н.) с контрольными пиками (размером от 64 до 105 п.н.).
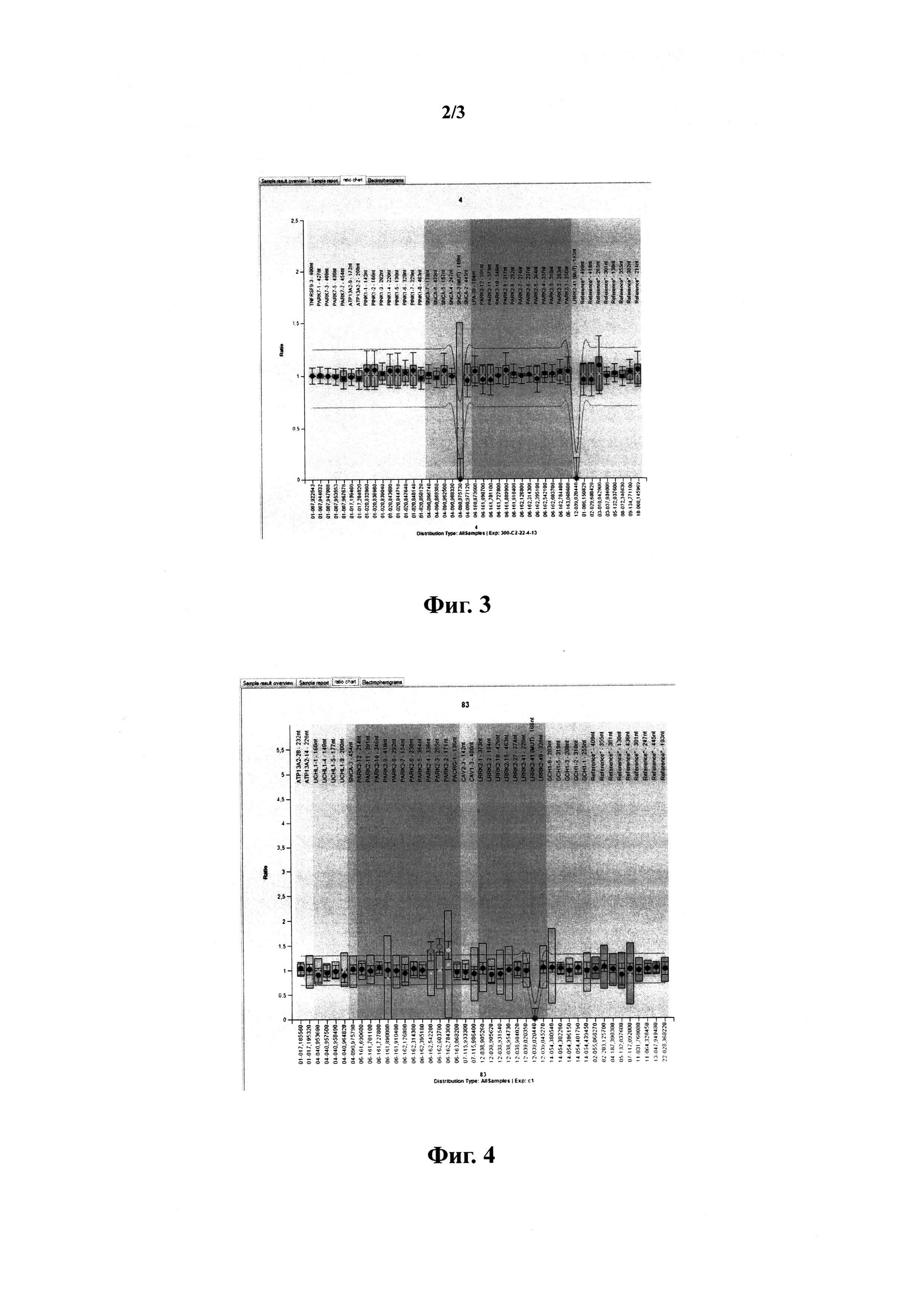
На фиг.3 представлены результаты сравнительного анализа МЛПР контрольного образца ДНК с отсутствием мутаций в изучаемых генах и образца ДНК пациента с болезнью Паркинсона с невыявленными мутациями.
На фиг.4 представлены результаты сравнительного анализа МЛПР контрольного образца ДНК с отсутствием мутаций в изучаемых генах и образца ДНК пациента с болезнью Паркинсона с гетерозиготной дупликацией трех экзонов (2, 3 и 4) в гене PARK2.
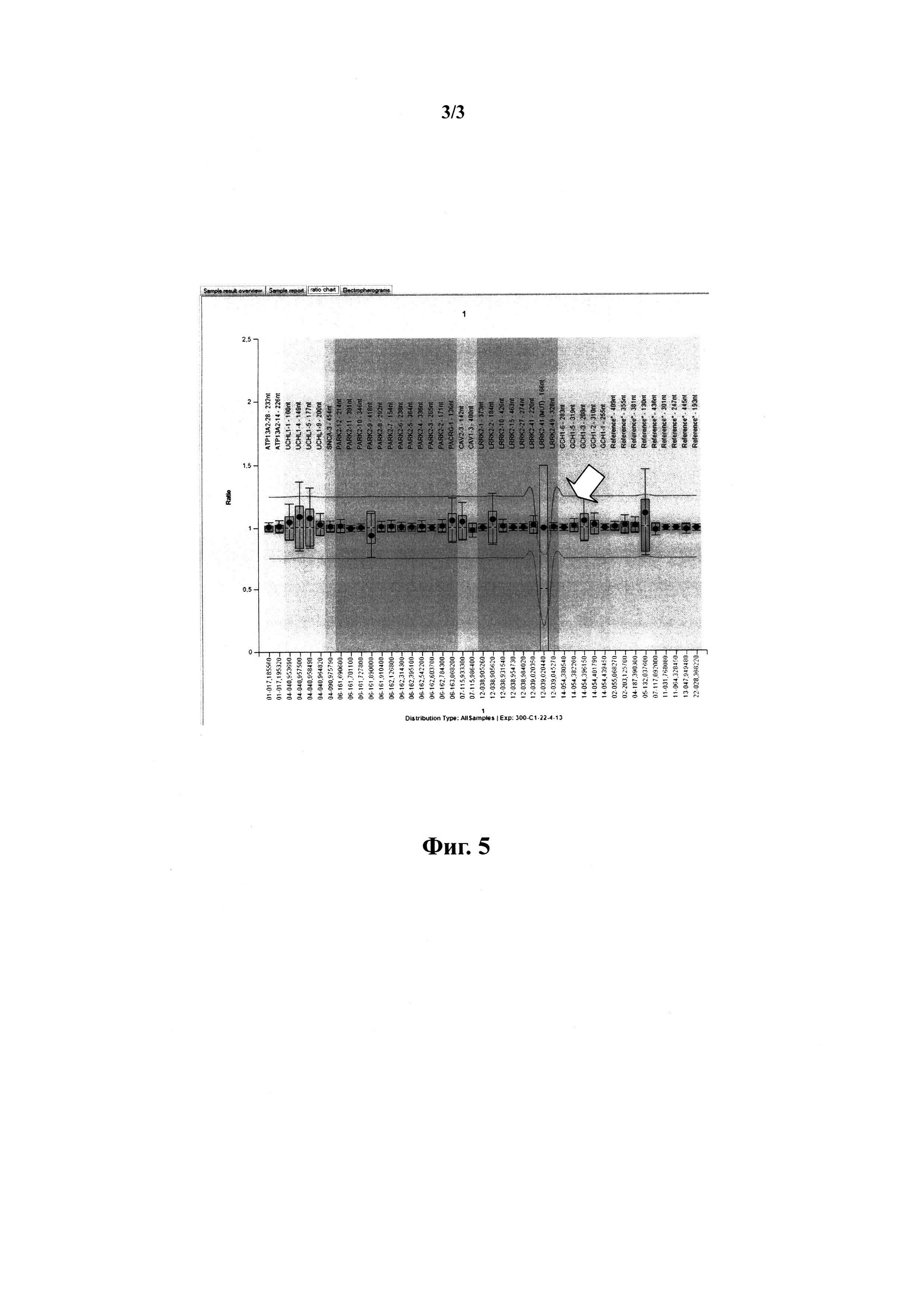
На фиг.5 представлены результаты сравнительного анализа МЛПР контрольного образца ДНК с отсутствием мутаций в изучаемых генах и образцах ДНК пациента с болезнью Паркинсона с ТМ G2019S (rs34637584) в гене LRRK2.
Раскрытие настоящего изобретения
Целью настоящего изобретения является повышение эффективности и информативности выявления новых патогенетически значимых мутаций для болезни Паркинсона методом экзомного секвенирования (NGS-секвенирования) и выявление основных ассоциированных с развитием болезни Паркинсона мутаций и полиморфизмов, являющихся маркерами указанного заболевания.
В соответствии с настоящим изобретением перед проведением экзомного анализа с использованием методов NGS-секвенирования осуществляется типирование основных ассоциированных с развитием заболевания известных мутаций и полиморфизмов, что повышает информативность экзомного анализа.
Вновь выявленные ДНК-маркеры дополняют панель используемых для оценки генетического риска мутаций и полиморфных вариантов генов семейной формы заболевания и позволяют выявлять значительное число лиц с высоким генетическим риском развития болезни Паркинсона до проявления первых клинических признаков заболевания.
Выявление генов и ДНК-маркеров, вовлеченных в патогенез спорадической и семейной форм болезни Паркинсона, обеспечивает раннюю (доклиническую) ДНК-диагностику этого заболевания с целью проведения его профилактического лечения в тот момент, когда дегенерация дофаминергических нейронов находится на ранней стадии и затрагивает ограниченное число нейронов этого типа. Это позволяет замедлить (если не остановить) развитие патологических процессов в нервной ткани, тем самым, сдвигая возраст клинического дебюта заболевания и снижая его клиническую тяжесть. Таким образом, способ в соответствии с настоящим изобретением позволяет перевести лечение болезни Паркинсона на качественно новый уровень - индивидуализированной профилактической медицины.
Указанная цель достигается тем, что осуществляется предварительный подбор пациентов с болезнью Паркинсона перед проведением экзомного секвенирования для анализа биологического материала - геномной ДНК, полученной от пациентов с болезнью Паркинсона с их информированного согласия, на предмет выявления маркерных мутаций и полиморфизмов, ассоциированных с болезнью Паркинсона. Для этого предусматривается использование метода множественной лигазной полимеразной реакции (МЛПР). МЛПР основана на использовании термостабильной лигазы для лигирования только полностью комплементарных последовательности геномной ДНК олигонуклеотидных зондов. Если последний 3'-нуклеотид зонда оказывается не комплементарен в результате мутации в геномной ДНК, лигирования не происходит. После лигирования продукты лигазной реакции амплифицируют с помощью праймеров, комплементарных последовательности, общей для всех зондов. Полученные продукты амплификации анализируют с использованием капиллярного гель-электрофореза, оценивая длину полученных ампликонов и величину пиков. На фиг. 1 схематично представлен принцип способа в соответствии с настоящим изобретением. Таким образом, способ в соответствии с настоящим изобретением предусматривает следующие стадии:
а) подготовка образцов ДНК из взятого у пациентов с болезнью Паркинсона биологического материала;
б) проведение реакции множественной лигазной полимеразной реакции (МЛПР);
в) проведение типирования основных известных маркерных мутаций и полиморфизмов, ассоциированных с болезнью Паркинсона;
г) оценка качества анализа;
д) анализ полученных при проведении МЛПР данных;
е) отбор пациентов для проведения экзомного секвенирования с исключением тех пациентов, в ДНК которых выявлены известные маркеры;
ж) осуществление экзомного секвенирования ДНК отобранных пациентов; и
з) выявление основных ассоциированных с развитием поздней формы болезни Паркинсона мутаций и полиморфизмов, являющихся маркерами указанного заболевания.
Соответственно, технический результат, обеспечиваемый изобретением, состоит в ускорении и удешевлении анализа мутаций у пациентов с болезнью Паркинсона за счет введения перед этапом полноэкзомного секвенирования ДНК предварительной стадии типирования частых мутаций с использованием метода МЛПР.
Все работы осуществляются в стерильном лабораторном блоке, специализированном для проведения ПЦР. Сборка ПЦР-смесей производится в ПЦР-боксе, например в UV-cleaner box 1200 (Biosan, Латвия), оборудованном проточным бактерицидным УФ-рециркулятором воздуха, например бактерицидным рециркулятором воздуха UVR-M (Biosan, Латвия), который обеспечивает постоянное обеззараживание внутри бокса во время работы во избежание загрязнения компонентов смесей и биологического материала.
Биологический материал (геномная ДНК из лейкоцитов периферической крови) выделяется из крови, предпочтительно венозной, пациентов с болезнью Паркинсона, полученной с их информированного согласия. Венозная кровь отбирается предпочтительно под 0,5 М раствора EDTA (этилендиаминтетрауксусной кислоты) (pH 8,0) (в соотношении на 1 объем крови 0,1 объема раствора EDTA). Выделение геномной ДНК проводится традиционными методами, предпочтительно фенол-хлороформным методом (Маниатис Т., Фрич Э., Сэмбрук Д. Молекулярное клонирование. Москва, "Мир", 1984). Для анализа образцов ДНК методом множественной лигазной полимеразной реакции используются традиционные наборы, например, набор SALSA MLPA (MRC-Holland b.v., Нидерланды), для которого требуется от 50 до 250 нг ДНК.
Для осуществления способа подбора пациентов с болезнью Паркинсона для проведения экзомного секвенирования используется следующее оборудование: амплификатор в реальном времени, например, StepOnePlus с ноутбуком (Life technologies, США); амплификатор для проведения рутинной ПЦР, например, Biometra Т3 Thermocycler (Biometra, Германия); прибор для капиллярного электрофореза, например, ABI-Prism 3100 (Applied Biosystems, США); гель-документирующая система, например, GelDoc XR (Bio-Rad Laboratories, США); вакуумный концентратор, например, Concentrator plus Complete System (Eppendorf, Германия); морозильник низкотемпературный, например, DW-86L388 (Haier, Германия) или SFR 167 (Indesit, Италия); холодильник с морозильной камерой, например, ХМ-6025 (Атлант, Беларусь); система для горизонтального электрофореза, например система для горизонтального электрофореза от Bio-Rad Laboratories (США); система очистки воды, например система Simplysity (Millipore, США) или система Milli-DI (Millipore; США); центрифуга, например микроцентрифуга 5424 (Eppendorf, Германия), микроцентрифуга-вортекс Микроспин FV-2400 (Biosan, Латвия) или персональный вортекс V-1 plus (Biosan, Латвия); флюориметр, например флюориметр Qubit 1.0 (Live Technologies, США); набор пипеток, например набор автоматических пипеток Biohit от 0,5 мкл до 10 мкл, от 10 мкл до 100 мкл, от 20 мкл до 200 мкл, от 100 мкл до 1000 мкл, от 1000 мкл до 5000 мкл (Sartorius, США); весы аналитические, например весы EP214C до 210 г (Ohaus, США); источник питания, например, источник питания PowerPac НС Power Supply (Bio-Rad Laboratories, США); pH-метр, например pH-метр PB-11 (Sartorius, США); насос мембранный, например насос мембранный Millivac (Millipore, США); магнитная мешалка, например магнитная мешалка MSH-300 с подогревом (Biosan, Латвия).
|
Согласно одному из вариантов осуществления настоящего изобретения способ предусматривает стадии, на которых
1. Готовят образцы ДНК:
а) 100 нг геномной ДНК человека переносят в пробирку для ПЦР на 200 мкл и переосаждают двумя объемами холодного (-20°C) этанола (96%) в присутствии 100 мМ NaCl;
б) осадок дважды промывают 70% и 96% холодным спиртом, сушат (на воздухе или в вакуумной сушке);
в) осадок растворяют в 5 мкл TE, pH 8,2.
2. Осуществляют реакцию МЛПР:
а) панель анализируемых образцов должна содержать не менее 10 образцов ДНК (3 образца ДНК здоровых доноров и 7 образцов ДНК исследуемых пациентов), при анализе большего количества образцов ДНК на каждые 7 образцов ДНК от пациентов добавляют дополнительный контрольный образец ДНК; в каждую панель включают один образец отрицательного контроля, в котором ДНК заменена на 5 мкл TE (10 мМ Tris-HCl, 0,1 мМ EDTA, pH 8,2);
б) геномную ДНК из панели образцов денатурируют в ПЦР-термоциклере с нагреваемой крышкой в течение 15 минут при 98°C, затем пробирки охлаждают до 25°C;
в) готовят смесь, содержащую для каждой реакции 1,5 мкл зондов для МЛПР и 1,5 мкл буфера SALSA MLPA (см. таблицу 1), и добавляют к каждому образцу ДНК для гибридизации зондов с ДНК;
г) продолжают выполнение программы термоциклера: инкубируют 1 минуту при 95°C, а затем 16-20 часов при 60°C;
д) вносят 32 мкл лигазной смеси, содержащей для каждой реакции 25 мкл бидистилированной воды, 3 мкл лигазного буфера A, 3 мкл лигазного буфера B и 1 мкл лигазы, в предварительно нагретую до 54°C пробирку с анализируемой ДНК;
е) реакционную смесь инкубируют 15 минут при температуре 54°C;
ж) затем реакционную смесь инкубируют 5 минут при 98°C;
з) реакционную смесь охлаждают до 20°C;
и) для проведения ПЦР готовят смесь, содержащую для каждой реакции 7,5 мкл H2O, 2 мкл смеси праймеров SALSA PCR и 0,5 мкл SALSA-полимеразы;
к) при комнатной температуре добавляют по 10 мкл смеси в каждую пробирку и продолжают выполнение программы: 35 циклов: 30 секунд при 95°C, 30 секунд при 60°C, 60 секунд при 72°C;
л) 20 минут инкубируют образцы при 72°C с паузой 15°C;
м) ПЦР-продукты запаковывают в алюминиевую фольгу и хранят при - 20°C.
3. Проводят фрагментный анализ:
а) анализируют размер и количество полученных ампликонов с использованием капиллярного электрофореза с использованием капилляра длиной 36 см;
б) готовят инъекционную смесь из 0,7 мкл ПЦР-продукта, 0,2 мкл маркера LIZ, 9 мкл формамида;
в) проводят электрофорез при следующих условиях: напряжение при введении составляет 1,6 кВ, время инъекции составляет 15 секунд, напряжение при проведении электрофореза составляет 15 кВ;
г) инкубируют при 80°C и быстро охлаждают, время проведения электрофореза составляет 30 минут;
д) оценивают первичные данные и сопоставляют полученные пики с информацией о них в наборе праймеров и зондов на мутации и полиморфизмы (см. таблицу 2) с использованием программного обеспечения Coffalyser. Net (MRC-Holland, Нидерланды).
4. Оценивают качество анализа:
а) оценку качества всех реакций МЛПР проводят с использованием входящих в состав реакционной смеси контрольных фрагментов размером:
- 92 п.н. (эталонный стандарт);
- 64, 70, 76, 82 п.н. (фрагменты для оценки количества введенной в реакцию геномной ДНК), при этом при высоте пиков от геномной ДНК менее 30% от величины стандартных пиков результаты анализа считают недостоверными;
- 86 и 96 п.н. (контроль денатурации), при этом при высоте пиков от геномной ДНК менее 40% от величины стандартных пиков результаты анализа считают недостоверными;
- 100 и 105 п.н. (специфичны для X и Y хромосомы соответственно, и используются для контроля за полом пациента и предупреждения ошибок типирования образцов ДНК);
б) в реакции отрицательного контроля при МЛПР детектируют только фрагменты размером 64, 70, 76 и 82 п.н., при этом наличие дополнительных фрагментов ДНК, достигающих по величине 50% любого из этих пиков, указывает на ошибку при проведении анализа, в этом случае всю панель образцов ДНК исключают из данного конкретного эксперимента;
в) допускают детекцию множественных малых по размеру фоновых пиков с фрагментами длиной менее 64 п.н., которые не препятствуют проведению дальнейшей обработки первичных электрофоретических данных; вариант осуществления настоящего изобретения фрагментного анализа образца ДНК с нормальным соотношением пиков приведен на фиг.2.
5. Проводят анализ данных, полученных при проведении МЛПР:
а) для нормализации используют данные, прошедшие оценку первичных результатов и паттернов пиков;
б) нормализацию проводят в два этапа, поскольку абсолютные флуоресцентные интенсивности сигналов, детектируемые капиллярным электрофорезом, зависят от многих факторов;
в) нормализуют величину всех пиков в каждом образце ДНК по величине стандартного пика для фрагментов размером 92, 64, 70, 76, 82 п.н., при этом полученные нормализованные значения пиков от различных стандартных фрагментов должны отличаться между собой не более чем на 0,1 относительной единицы;
г) на основании усредненной по разным стандартным фрагментам величины пика для конкретного фрагмента ДНК проводят нормализацию величины этого пика у анализируемого пациента по величине пика, полученной для контрольного образца ДНК здорового человека;
д) если эта относительная величина блика к единице, считают, что контрольный образец ДНК и образец ДНК пациента не отличаются по копийности данного фрагмента, как показано на фиг.3;
е) при отклонении этого соотношения от 1 данные интерпретируют в соответствии с фиг.4.
6. Отбирают пациентов для проведения экзомного секвенирования, исключая тех пациентов, в ДНК которых выявляют известные маркеры:
панель геномной ДНК (ДНК из периферической крови пациентов с болезнью Паркинсона), сформированную для проведения экзомного секвенирования, анализируют с использованием анализа МЛПР согласно этапу 2; при этом из сформированной панели исключают образцы ДНК, в которых выявляют основные известные мутации и полиморфизмы, ассоциированные с болезнью Паркинсона и приведенные в таблице 1.
7. Осуществляют экзомное секвенирование.
Экзомное секвенирование на стадии 7 осуществляют с использованием традиционных технологий, известных специалистам в данной области техники и не являющихся предметом настоящего изобретения.
Согласно варианту осуществления настоящего изобретения в ходе проведения работ с использованием способа подбора пациентов с болезнью Паркинсона для проведения экзомного секвенирования типировали 54 мутации и полиморфизма в 11 генах. В таблице 2 представлен перечень маркерных мутаций и полиморфизмов, которые должны быть типированы.
|
В таблице 3 представлены следующие пороговые значения соотношения в величине нормализованного сигнала у пациента с болезнью Паркинсона и здоровых лиц:
|
Для анализа точковых мутаций предусматриваются следующие условия:
- для каждой точковой мутации в панель праймеров и зондов должно входить два типа зондов - на аллель дикого типа и мутантный аллель;
- этим аллелям должны соответствовать два отличающихся по размеру фрагмента;
- появление соответствующего мутантному аллелю фрагмента говорит о наличии у пациента той или иной мутации в соответствии с фиг.5.
Пример осуществления настоящего изобретения
Способ подбора пациентов с болезнью Паркинсона для проведения экзомного секвенирования использовали для анализа ранее сформированной на основании клинико-генеалогического анализа выборки пациентов со спорадической с ранним началом развития и аутосомно-доминантной формой болезней Паркинсона (70 пациентов). Список проанализированных пациентов и результаты МЛПР анализа приведены в таблице 4.
|
У семи пациентов (10%) выявляли различные мутации и исключали их из дальнейшего анализа. В трех случаях обнаруживали миссенс-мутацию G2019S в гене дардарина LRRK2 (что подтверждает ранее полученные данные о высокой частоте этой мутации у пациентов с аутосомно-доминантной болезнью Паркинсона в различных этнических группах, в том числе в России). У трех больных выявляли различные перестройки экзонов гена паркина PARK2, при этом обнаруживали как гетерозиготные делеции этого гена (у двух пациентов), так и гетерозиготную дупликацию (у одного пациента). Интересно, что во всех трех случаях перестройки захватывали экзоны 3 и 4, которые авторами настоящего изобретения ранее определялись как «горячие точки» при перестройках гена PARK2 при болезни Паркинсона. Необходимо отметить, что эти мутации в гене PARK2 выявляли как у пациентов со спорадической формой болезни Паркинсона, так и у пациентов с семейной аутосомно-доминантной формой развития заболевания. Это говорит о том, что не исключено, что в некоторых случаях гетерозиготные делеции в гене PARK2 могут манифестировать как доминантные мутации и приводить к поздней форме заболевания. В то же время, гомозиготность по мутациям в этом гене вызывает раннюю аутосомно-рецессивную форму болезни Паркинсона с медленным прогрессированием патологического процесса.
Таким образом, способ в соответствии с настоящим изобретением обеспечил проведение типирования основных известных маркерных мутаций и полиморфизмов, ассоциированных с болезнью Паркинсона, что позволило исключить из дальнейшего анализа семь пациентов, т.е. значительно сократить (на 10%) выборку, сформированную для экзомного секвенирования. В результате была сформирована выборка пациентов с недиагностированными патогенетически значимыми вариантами.
Это значительно повысит информативность и эффективность дальнейшего анализа, проводимого с использованием экзомного секвенирования.