Результат интеллектуальной деятельности: МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ИНГИБИРУЮЩЕЕ ФЕРМЕНТАТИВНУЮ АКТИВНОСТЬ СОСУДИСТОЙ ЭНДОТЕЛИАЛЬНОЙ ЛИПАЗЫ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к моноклональному антителу, которое ингибирует ферментативную активность сосудистой эндотелиальной липазы (далее по тексту также относится к EL), и фармацевтической композиции, содержащей его. Конкретнее, изобретение относится к антителу, которое селективно ингибирует ферментативную активность EL, или его фрагменту и фармацевтической композиции, содержащей его.
Уровень техники
EL представляет фосфолипазу, которая относится к триглицеридлипазе (далее по тексту относится к семейству TG) (непатентный документ 1): 1) Человеческая EL состоит из 500 аминокислот (инвентарный номер в NCBI NP_006024.1, SEQ ID NO:1, и кроличья EL состоит из 500 аминокислот (инвентарный номер в NCBI NP_001182567, SEQ ID NO:2). Липопротеинлипаза (далее по тексту относится к LPL) и печеночная липаза (далее по тексту относится к HL) входят в состав семейства TG.
Исследования на мышах с нокаутом гена EL и трансгенных мышах по EL выявили, что EL связана с метаболизмом холестерина высокой плотности (далее относится к ХВП) за счет ее высокой фосфолипазной активности, и этот фермент привлек внимание в качестве фактора, который контролирует уровень ХВП в крови (непатентный документ 2). Хорошо известно, что имеется отрицательная корреляция между болезнью коронарных артерий (далее по тексту относится к CAD) и уровнем холестерина высокой плотности в крови. ХВП проявляет антиатерогенное действие, опосредуемое антиоксидантным эффектом, противовоспалительное действие и участвует в обратном транспорте холестерина и так далее, наличие холестерина высокой плотности на низком уровне в крови рассматривается в качестве одного из факторов риска CAD. Следовательно, ингибитор EL может стать терапевтическим агентом для лечения CAD посредством повышения ХВП в крови. Действительно, сообщалось, что у мышей с атеросклеротическими очагами с нокаутом гена EL имел место повышенный уровень ХВП и менее выраженные атеросклеротические очаги (непатентный документ 3).
Данные установленные факты указывают, что селективный ингибитор EL является полезным в качестве терапевтического агента для лечения аномалий липидного обмена и артериосклероза.
Селективное ингибирование EL является полезным в качестве терапевтического агента для лечения аномалий липидного обмена и артериосклероза, и таким образом, продукция антител к EL, которые ингибируют активность EL, является одним из важных подходов. К настоящему времени сообщалось, что получено кроличье поликлональное антитело, которое ингибирует активность EL, которое повышало уровень ХВП после введения антитела (непатентный документ 4).
Поликлональные антитела распознают различные области EL и не обладают высокой селективностью в отношении EL. Также невозможно использовать кроличьи поликлональные анти-EL-антитела, обладающие высокой иммуногенностью для человека, в качестве терапевтического агента для лечения хронического заболевания, поскольку терапевтические агенты для лечения хронических заболеваний, таких как аномалии липидного обмена и артериосклероза, связанных с EL, вводятся в течение длительного периода времени. Кроме того, трудно контролировать иммуногенность поликлональных антител.
В результате этих обстоятельств требуется моноклональное антитело, селективно ингибирующее ферментативную активность EL.
Непатентный документ 1: Nature Genetics, 1999, vol. 21, p. 424
Непатентный документ 2: TCM., 2004, vol. 14(5), p. 202-206
Непатентный документ 3: The Journal of Biological Chemistry, 2004, vol. 279, No. 43, 22, p. 45085-45092
Непатентный документ 4: J. Clin. Invest., 2003, vol. 111(3), p. 357.
Сущность изобретения
Проблема для решения изобретением
Целью настоящего изобретения является обеспечение антитела, которое селективно ингибирует ферментативную активность EL, или фрагмента антитела, и фармацевтической композиции, содержащей его.
Способы решения проблемы
В результате кропотливых усилий заявители настоящего изобретения преуспели в изыскании моноклонального антитела, которое селективно ингибирует ферментативную активность EL.
Для того чтобы быть более конкретными, настоящее изобретение обеспечивает следующее:
(1) Моноклональное антитело, которое ингибирует ферментативную активность сосудистой эндотелиальной липазы, или фрагмент антитела, где оно распознает по меньшей мере одну аминокислоту в положениях 1-157 в аминокислотной последовательности SEQ ID NO:1.
(2) Моноклональное антитело по п. (1), или фрагмент антитела, где оно распознает по меньшей мере одну аминокислоту в положениях 50-100 в аминокислотной последовательности SEQ ID NO:1.
(3) Моноклональное антитело по пп. (1) или (2), или фрагмент антитела, где оно распознает по меньшей мере одну аминокислоту, выбранную из аргинина в положении 50, глутаминовой кислоты в положении 60, тирозина в положении 65 и аспарагина в положении 100 в аминокислотной последовательности SEQ ID NO:1.
(4) Моноклональное антитело по пп. (1) или (2), или фрагмент антитела, где оно распознает по меньшей мере тирозин в положении 65 в аминокислотной последовательности SEQ ID NO:1.
(5) Моноклональное антитело по п. (4), или фрагмент антитела, где оно распознает по меньшей мере одну аминокислоту, выбранную из аргинина в положении 50, аспарагина в положении 52, аргинина в положении 54, аспарагиновой кислоты в положении 58, глутаминовой кислоты в положении 60, гистидина в положении 61, глицина в положении 63 и аспарагина в положении 100 в аминокислотной последовательности SEQ ID NO:1.
(6) Моноклональное антитело, которое ингибирует ферментативную активность сосудистой эндотелиальной липазы, или фрагмент антитела, где оно распознает по меньшей мере одну аминокислоту в положениях 202-305 в аминокислотной последовательности SEQ ID NO:1.
(7) Моноклональное антитело по п. (6), или фрагмент антитела, где оно распознает по меньшей мере одну аминокислоту в положениях 220-273 в аминокислотной последовательности SEQ ID NO:1.
(8) Моноклональное антитело по пп. (6) или (7), или фрагмент антитела, где оно распознает по меньшей мере одну аминокислоту, выбранную из гистидина в положении 220, треонина в положении 221, тирозина в положении 222, треонина в положении 223, аргинина в положении 224, фенилаланина в положении 226, глицина в положении 227, глицина в положении 231, изолейцина в положении 232, глутамина в положении 233, метионина в положении 234, аспарагиновой кислоты в положении 240, тирозина в положении 242, пролина в положении 243, аспарагина в положении 244, глицина в положении 246, глутамина в положении 249, пролина в положении 250, глицина в положении 251, лейцина в положении 254, лейцина в положении 258, тирозина в положении 263, валина в положении 269 и глуминовой кислоты в положении 273 в аминокислотной последовательности SEQ ID NO:1.
(9) Моноклональное антитело по пп. (6) или (7), или фрагмент антитела, где оно распознает по меньшей мере одну аминокислоту, выбранную из гистидина в положении 220, треонина в положении 221, аспарагиновой кислоты в положении 240, тирозина в положении 242, пролина в положении 243, аспарагина в положении 244, глицина в положении 246, глутамина в положении 249, пролина в положении 250 и глицина в положении 251 в аминокислотной последовательности SEQ ID NO:1.
(10) Моноклональное антитело по пп. (6) или (7), или фрагмент антитела, где оно распознает все аминокислоты, выбранные из гистидина в положении 220, треонина в положении 221, аспарагиновой кислоты в положении 240, тирозина в положении 242, пролина в положении 243, аспарагина в положении 244, глицина в положении 246, глутамина в положении 249, пролина в положении 250 и глицина в положении 251 в аминокислотной последовательности SEQ ID NO:1.
(11) Моноклональное антитело по одному из пп. (1)-(10), где оно ингибирует ферментативную активность сосудистой эндотелиальной липазы со значением IC50, равным 10 нМ или ниже.
(12) Моноклональное антитело по п. (11), где оно ингибирует ферментативную активность сосудистой эндотелиальной липазы со значением IC50, равным 5 нМ или ниже.
(13) Моноклональное антитело по п. (11), где оно ингибирует ферментативную активность сосудистой эндотелиальной липазы со значением IC50, равным 2 нМ или ниже.
(14) Моноклональное антитело или его фрагмент, выбранное из группы, включающей:
1) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:10, аминокислотную последовательность SEQ ID NO:11 и аминокислотную последовательность SEQ ID NO:12, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:14, аминокислотную последовательность SEQ ID NO:15 и аминокислотную последовательность SEQ ID NO:16;
2) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:10, аминокислотную последовательность SEQ ID NO:11 и аминокислотную последовательность SEQ ID NO:12, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:14, аминокислотную последовательность SEQ ID NO:15 и аминокислотную последовательность SEQ ID NO:16, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
3) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:10, аминокислотную последовательность SEQ ID NO:11 и аминокислотную последовательность SEQ ID NO:12, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:14, аминокислотную последовательность SEQ ID NO:15 и аминокислотную последовательность SEQ ID NO:16, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
4) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:10, аминокислотную последовательность SEQ ID NO:11 и аминокислотную последовательность SEQ ID NO:12, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:14, аминокислотную последовательность SEQ ID NO:15 и аминокислотную последовательность SEQ ID NO:16, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
5) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:18, аминокислотную последовательность SEQ ID NO:19 и аминокислотную последовательность SEQ ID NO:20, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:22, аминокислотную последовательность SEQ ID NO:23 и аминокислотную последовательность SEQ ID NO:24;
6) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:18, аминокислотную последовательность SEQ ID NO:19 и аминокислотную последовательность SEQ ID NO:20, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:22, аминокислотную последовательность SEQ ID NO:23 и аминокислотную последовательность SEQ ID NO:24, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
7) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:18, аминокислотную последовательность SEQ ID NO:19 и аминокислотную последовательность SEQ ID NO:20, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:22, аминокислотную последовательность SEQ ID NO:23 и аминокислотную последовательность SEQ ID NO:24, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
8) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:18, аминокислотную последовательность SEQ ID NO:19 и аминокислотную последовательность SEQ ID NO:20, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:22, аминокислотную последовательность SEQ ID NO:23 и аминокислотную последовательность SEQ ID NO:24, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
9) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:26, аминокислотную последовательность SEQ ID NO:27 и аминокислотную последовательность SEQ ID NO:28, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:30, аминокислотную последовательность SEQ ID NO:31 и аминокислотную последовательность SEQ ID NO:32;
10) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:26, аминокислотную последовательность SEQ ID NO:27 и аминокислотную последовательность SEQ ID NO:28, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:30, аминокислотную последовательность SEQ ID NO:31 и аминокислотную последовательность SEQ ID NO:32, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
11) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:26, аминокислотную последовательность SEQ ID NO:27 и аминокислотную последовательность SEQ ID NO:28, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:30, аминокислотную последовательность SEQ ID NO:31 и аминокислотную последовательность SEQ ID NO:32, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
12) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:26, аминокислотную последовательность SEQ ID NO:27 и аминокислотную последовательность SEQ ID NO:28, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:30, аминокислотную последовательность SEQ ID NO:31 и аминокислотную последовательность SEQ ID NO:32, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
13) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:34, аминокислотную последовательность SEQ ID NO:35 и аминокислотную последовательность SEQ ID NO:36, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:38, аминокислотную последовательность SEQ ID NO:39 и аминокислотную последовательность SEQ ID NO:40;
14) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:34, аминокислотную последовательность SEQ ID NO:35 и аминокислотную последовательность SEQ ID NO:36, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:38, аминокислотную последовательность SEQ ID NO:39 и аминокислотную последовательность SEQ ID NO:40, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
15) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:34, аминокислотную последовательность SEQ ID NO:35 и аминокислотную последовательность SEQ ID NO:36, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:38, аминокислотную последовательность SEQ ID NO:39 и аминокислотную последовательность SEQ ID NO:40, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
16) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:34, аминокислотную последовательность SEQ ID NO:35 и аминокислотную последовательность SEQ ID NO:36, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:38, аминокислотную последовательность SEQ ID NO:39 и аминокислотную последовательность SEQ ID NO:40, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
17) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:42, аминокислотную последовательность SEQ ID NO:43 и аминокислотную последовательность SEQ ID NO:44, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:46, аминокислотную последовательность SEQ ID NO:47 и аминокислотную последовательность SEQ ID NO:48;
18) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:42, аминокислотную последовательность SEQ ID NO:43 и аминокислотную последовательность SEQ ID NO:44, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:46, аминокислотную последовательность SEQ ID NO:47 и аминокислотную последовательность SEQ ID NO:48, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
19) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:42, аминокислотную последовательность SEQ ID NO:43 и аминокислотную последовательность SEQ ID NO:44, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:46, аминокислотную последовательность SEQ ID NO:47 и аминокислотную последовательность SEQ ID NO:48, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
20) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:42, аминокислотную последовательность SEQ ID NO:43 и аминокислотную последовательность SEQ ID NO:44, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:46, аминокислотную последовательность SEQ ID NO:47 и аминокислотную последовательность SEQ ID NO:48, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
21) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:50, аминокислотную последовательность SEQ ID NO:51 и аминокислотную последовательность SEQ ID NO:52, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:54, аминокислотную последовательность SEQ ID NO:55 и аминокислотную последовательность SEQ ID NO:56;
22) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:50, аминокислотную последовательность SEQ ID NO:51 и аминокислотную последовательность SEQ ID NO:52, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:54, аминокислотную последовательность SEQ ID NO:55 и аминокислотную последовательность SEQ ID NO:56, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
23) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:50, аминокислотную последовательность SEQ ID NO:51 и аминокислотную последовательность SEQ ID NO:52, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:54, аминокислотную последовательность SEQ ID NO:55 и аминокислотную последовательность SEQ ID NO:56, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
24) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:50, аминокислотную последовательность SEQ ID NO:51 и аминокислотную последовательность SEQ ID NO:52, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:54, аминокислотную последовательность SEQ ID NO:55 и аминокислотную последовательность SEQ ID NO:56, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
25) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:58, аминокислотную последовательность SEQ ID NO:59 и аминокислотную последовательность SEQ ID NO:60, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:62, аминокислотную последовательность SEQ ID NO:63 и аминокислотную последовательность SEQ ID NO:64;
26) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:58, аминокислотную последовательность SEQ ID NO:59 и аминокислотную последовательность SEQ ID NO:60, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:62, аминокислотную последовательность SEQ ID NO:63 и аминокислотную последовательность SEQ ID NO:64, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
27) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:58, аминокислотную последовательность SEQ ID NO:59 и аминокислотную последовательность SEQ ID NO:60, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:62, аминокислотную последовательность SEQ ID NO:63 и аминокислотную последовательность SEQ ID NO:64, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
28) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:58, аминокислотную последовательность SEQ ID NO:59 и аминокислотную последовательность SEQ ID NO:60, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:62, аминокислотную последовательность SEQ ID NO:63 и аминокислотную последовательность SEQ ID NO:64, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
29) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:66, аминокислотную последовательность SEQ ID NO:67 и аминокислотную последовательность SEQ ID NO:68, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:70, аминокислотную последовательность SEQ ID NO:71 и аминокислотную последовательность SEQ ID NO:72;
30) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:66, аминокислотную последовательность SEQ ID NO:67 и аминокислотную последовательность SEQ ID NO:68, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:70, аминокислотную последовательность SEQ ID NO:71 и аминокислотную последовательность SEQ ID NO:72, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
31) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:66, аминокислотную последовательность SEQ ID NO:67 и аминокислотную последовательность SEQ ID NO:68, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:70, аминокислотную последовательность SEQ ID NO:71 и аминокислотную последовательность SEQ ID NO:72, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
32) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:66, аминокислотную последовательность SEQ ID NO:67 и аминокислотную последовательность SEQ ID NO:68, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:70, аминокислотную последовательность SEQ ID NO:71 и аминокислотную последовательность SEQ ID NO:72, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
33) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:74, аминокислотную последовательность SEQ ID NO:75 и аминокислотную последовательность SEQ ID NO:76, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:78, аминокислотную последовательность SEQ ID NO:79 и аминокислотную последовательность SEQ ID NO:80;
34) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:74, аминокислотную последовательность SEQ ID NO:75 и аминокислотную последовательность SEQ ID NO:76, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:78, аминокислотную последовательность SEQ ID NO:79 и аминокислотную последовательность SEQ ID NO:80, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
35) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:74, аминокислотную последовательность SEQ ID NO:75 и аминокислотную последовательность SEQ ID NO:76, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:78, аминокислотную последовательность SEQ ID NO:79 и аминокислотную последовательность SEQ ID NO:80, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
36) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:74, аминокислотную последовательность SEQ ID NO:75 и аминокислотную последовательность SEQ ID NO:76, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:78, аминокислотную последовательность SEQ ID NO:79 и аминокислотную последовательность SEQ ID NO:80, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
37) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:82, аминокислотную последовательность SEQ ID NO:83 и аминокислотную последовательность SEQ ID NO:84, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:86, аминокислотную последовательность SEQ ID NO:87 и аминокислотную последовательность SEQ ID NO:88;
38) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:82, аминокислотную последовательность SEQ ID NO:83 и аминокислотную последовательность SEQ ID NO:84, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:86, аминокислотную последовательность SEQ ID NO:87 и аминокислотную последовательность SEQ ID NO:88, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
39) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:82, аминокислотную последовательность SEQ ID NO:83 и аминокислотную последовательность SEQ ID NO:84, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:86, аминокислотную последовательность SEQ ID NO:87 и аминокислотную последовательность SEQ ID NO:88, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
40) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:82, аминокислотную последовательность SEQ ID NO:83 и аминокислотную последовательность SEQ ID NO:84, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:86, аминокислотную последовательность SEQ ID NO:87 и аминокислотную последовательность SEQ ID NO:88, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
41) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:90, аминокислотную последовательность SEQ ID NO:91 и аминокислотную последовательность SEQ ID NO:92, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:94, аминокислотную последовательность SEQ ID NO:95 и аминокислотную последовательность SEQ ID NO:96;
42) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:90, аминокислотную последовательность SEQ ID NO:91 и аминокислотную последовательность SEQ ID NO:92, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:94, аминокислотную последовательность SEQ ID NO:95 и аминокислотную последовательность SEQ ID NO:96, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
43) Моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:90, аминокислотную последовательность SEQ ID NO:91 и аминокислотную последовательность SEQ ID NO:92, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:94, аминокислотную последовательность SEQ ID NO:95 и аминокислотную последовательность SEQ ID NO:96, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
44) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:90, аминокислотную последовательность SEQ ID NO:91 и аминокислотную последовательность SEQ ID NO:92, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:94, аминокислотную последовательность SEQ ID NO:95 и аминокислотную последовательность SEQ ID NO:96, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
45) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:100, аминокислотную последовательность SEQ ID NO:101 и аминокислотную последовательность SEQ ID NO:102, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:104, аминокислотную последовательность SEQ ID NO:105 и аминокислотную последовательность SEQ ID NO:106;
46) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:100, аминокислотную последовательность SEQ ID NO:101 и аминокислотную последовательность SEQ ID NO:102, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:104, аминокислотную последовательность SEQ ID NO:105 и аминокислотную последовательность SEQ ID NO:106, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
47) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:100, аминокислотную последовательность SEQ ID NO:101 и аминокислотную последовательность SEQ ID NO:102, и
вариабельную область легкой цепи, включающую три CDR, содержащих аминокислотную последовательность SEQ ID NO:104, аминокислотную последовательность SEQ ID NO:105 и аминокислотную последовательность SEQ ID NO:106, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
48) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:100, аминокислотную последовательность SEQ ID NO:101 и аминокислотную последовательность SEQ ID NO:102, и
вариабельную область легкой цепи, включающую три CDR, где указанные три CDR состоят из аминокислот, представляющих одну или несколько аминокислот, которые делецированы, заменены или добавлены по меньшей мере в одном из трех CDR, где указанные три CDR содержат аминокислотную последовательность SEQ ID NO:104, аминокислотную последовательность SEQ ID NO:105 и аминокислотную последовательность SEQ ID NO:106, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы.
(15) Моноклональное антитело или его фрагмент, выбранное из группы, включающей:
1) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:9, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:13;
2) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:9, и
и вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:13, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
3) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:9, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:13, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
4) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:9, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:13, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
5) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:17, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:21;
6) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:17, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:21, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
7) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:17, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:21, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
8) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:17, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:21, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
9) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:25, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:29;
10) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:25, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:29, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
11) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:25, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:29, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
12) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:25, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:29, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
13) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:33, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:37;
14) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:33, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:37, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
15) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:33, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:37, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
16) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:33, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:37, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
17) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:41, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:45;
18) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:41, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:45, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
19) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:41, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:45, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
20) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:41, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:45, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
21) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:49, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:53;
22) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:49, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:53, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
23) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:49, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:53, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
24) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:49, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:53, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
25) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:57, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:61;
26) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:57, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:61, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
27) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:57, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:61, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
28) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:57, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:61, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
29) моноклональное антитело или его фрагмент, содержащеевариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:65, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:69;
30) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:65, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:69, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
31) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:65, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:69, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
32) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:65, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:69, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
33) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:73, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:77;
34) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:73, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:77, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
35) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:73, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:77, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
36) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:73, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:77, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
37) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:81, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:85;
38) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:81, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:85, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
39) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:81, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:85, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
40) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:81, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:85, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
41) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:89, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:93;
42) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:89, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:93, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
43) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:89, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:93, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
44) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:89, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:93, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
45) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:99, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:103;
46) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:99, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:103, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
47) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:99, и
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:103, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы;
48) моноклональное антитело или его фрагмент, содержащее
вариабельную область тяжелой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:99, и
вариабельную область легкой цепи, содержащую аминокислоты, где указанные аминокислоты представляют одну или несколько аминокислот, которые делецированы, заменены или добавлены, в аминокислотной последовательности SEQ ID NO:103, и
ингибирующее ферментативную активность сосудистой эндотелиальной липазы.
(16) Фармацевтическая композиция для лечения и профилактики заболевания, связанного с сосудистой эндотелиальной липазой, содержащая моноклональное антитело по одному из пп. (1)-(15) или фрагмент антитела.
(17) Фармацевтическая композиция по п. (16), где заболевание, связанное с сосудистой эндотелиальной липазой, является дислипидемией.
(18) Моноклональное антитело по одному из пп. (1)-(15) или фрагмент антитела для лечения и профилактики заболевания, связанного с сосудистой эндотелиальной липазой.
(19) Моноклональное антитело по п. (18) или фрагмент антитела, где заболевание, связанное с сосудистой эндотелиальной липазой, является дислипидемией.
(20) Способ лечения или профилактики заболевания, связанного с сосудистой эндотелиальной липазой, отличающийся введением моноклонального антитела по одному из пп. (1)-(15) или фрагмента антитела.
(21) Способ по п. (20), где заболевание, связанное с сосудистой эндотелиальной липазой, является дислипидемией.
Эффект изобретения
Поскольку моноклональное антитело по настоящему изобретению обладает способностью селективно ингибировать ферментативную активность EL, то фармацевтические композиции, содержащие моноклональное антитело по настоящему изобретению, являются пригодными в качестве лекарственного препарата, в частности, лекарственного препарата для профилактики и/или лечения дислипидемии, гиперлипидемии, артериосклероза, атеросклероза, гиперхолестеринемии, гипертриглицеридемии, диабета, ожирения и/или синдрома Х.
Краткое описание фигур
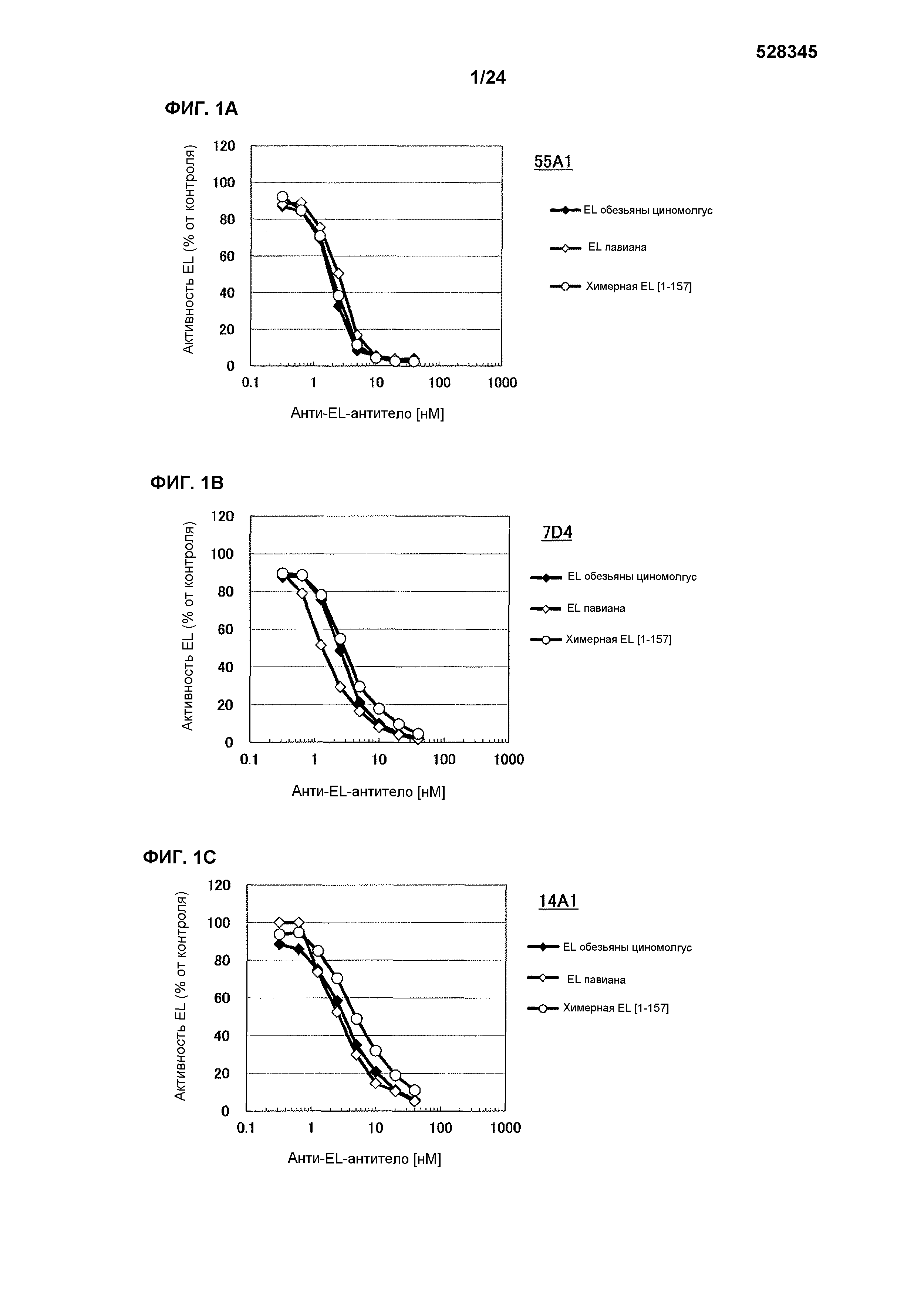
[Фиг. 1А] На фиг. 1А приведены результаты определения ингибирования антителом 55А1 ферментативной активности EL обезьяны циномолгус, EL павиана и химерной EL человек(1-157)мышь.
[Фиг. 1В] На фиг. 1В приведены результаты определения ингибирования антителом 7D4 ферментативной активности EL обезьяны циномолгус, EL павиана и химерной EL человек(1-157)мышь.
[Фиг. 1С] На фигуре 1С приведены результаты определения ингибирования антителом 14А1 ферментативной активности EL обезьяны циномолгус, EL павиана и химерной EL человек(1-157)мышь.
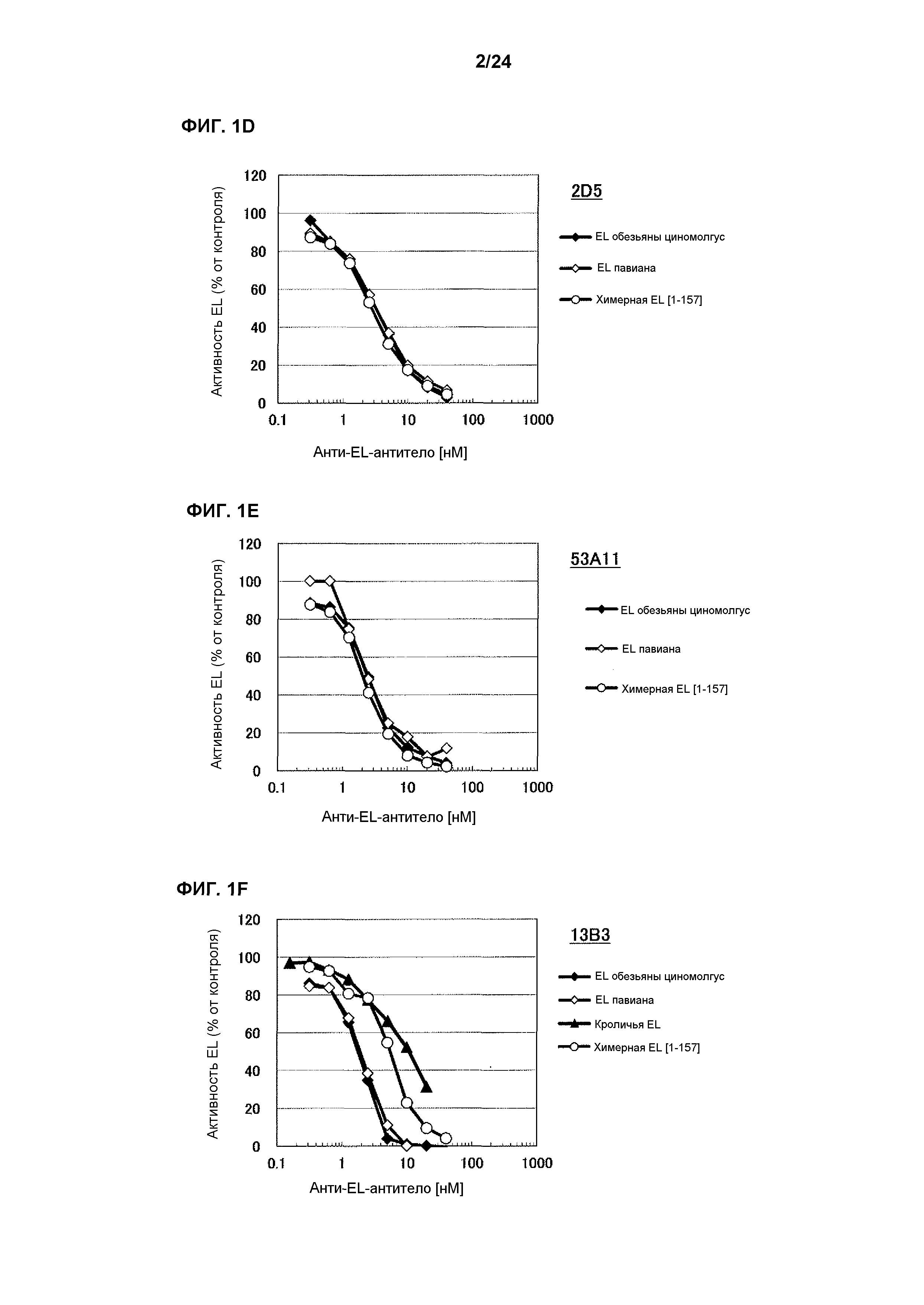
[Фиг. 1D] На фиг. 1D приведены результаты определения ингибирования антителом 2D5 ферментативной активности EL обезьяны циномолгус, EL павиана и химерной EL человек(1-157)мышь.
[Фиг. 1Е] На фиг. 1Е приведены результаты определения ингибирования антителом 53А11 ферментативной активности EL обезьяны циномолгус, EL павиана и химерной EL человек(1-157)мышь.
[Фиг. 1F] На фиг. 1F приведены результаты определения ингибирования антителом 13В3 ферментативной активности EL обезьяны циномолгус, EL павиана и химерной EL человек(1-157)мышь.
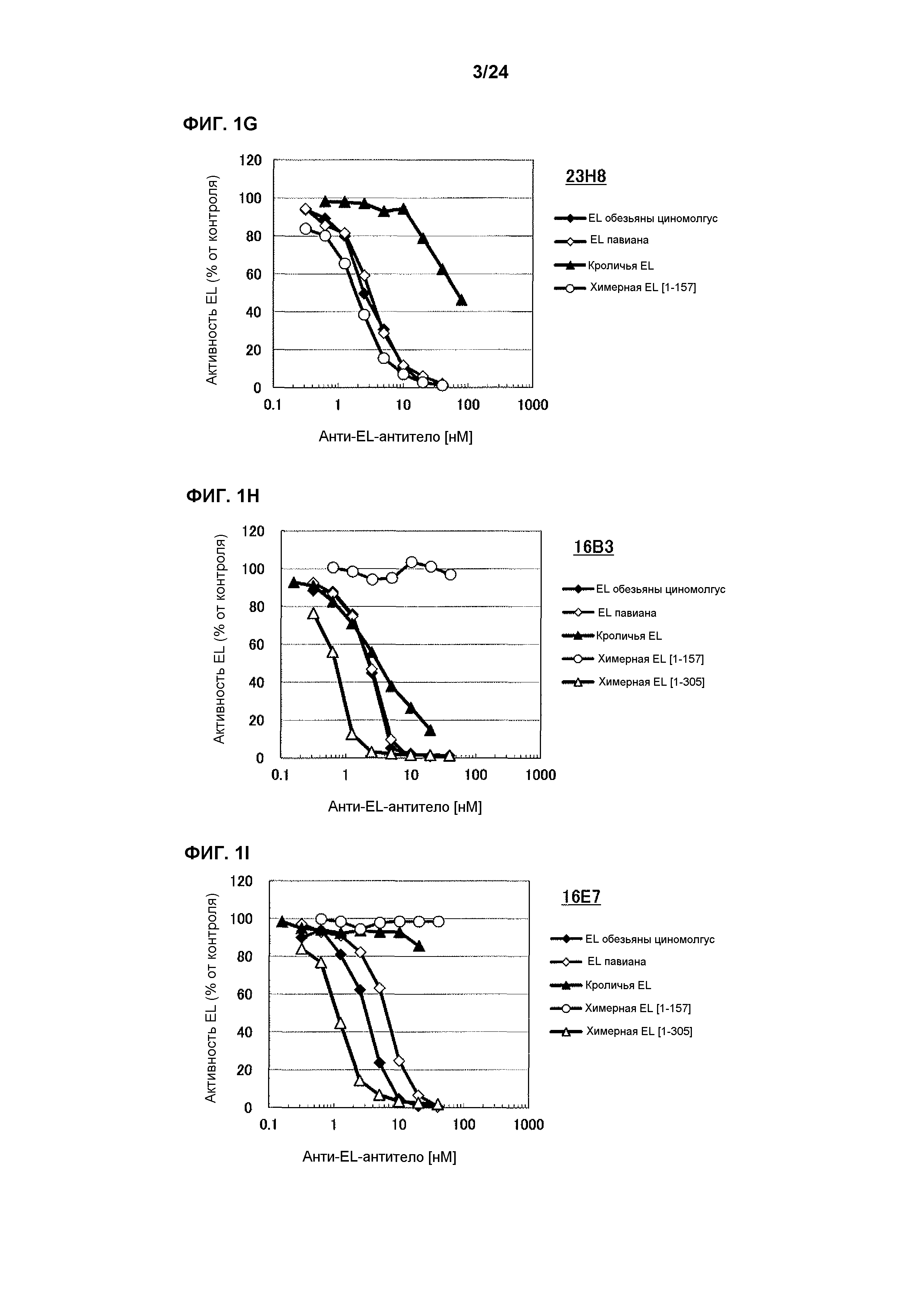
[Фиг. 1G] На фиг. 1G приведены результаты определения ингибирования антителом 23H8 ферментативной активности EL обезьяны циномолгус, EL павиана, кроличьей EL и химерной EL человек(1-157)мышь.
[Фиг. 1H] На фиг. 1H приведены результаты определения ингибирования антителом 16B3 ферментативной активности EL обезьяны циномолгус, EL павиана, кроличьей EL, химерной EL человек(1-157)мышь и химерной EL человек(1-305)мышь.
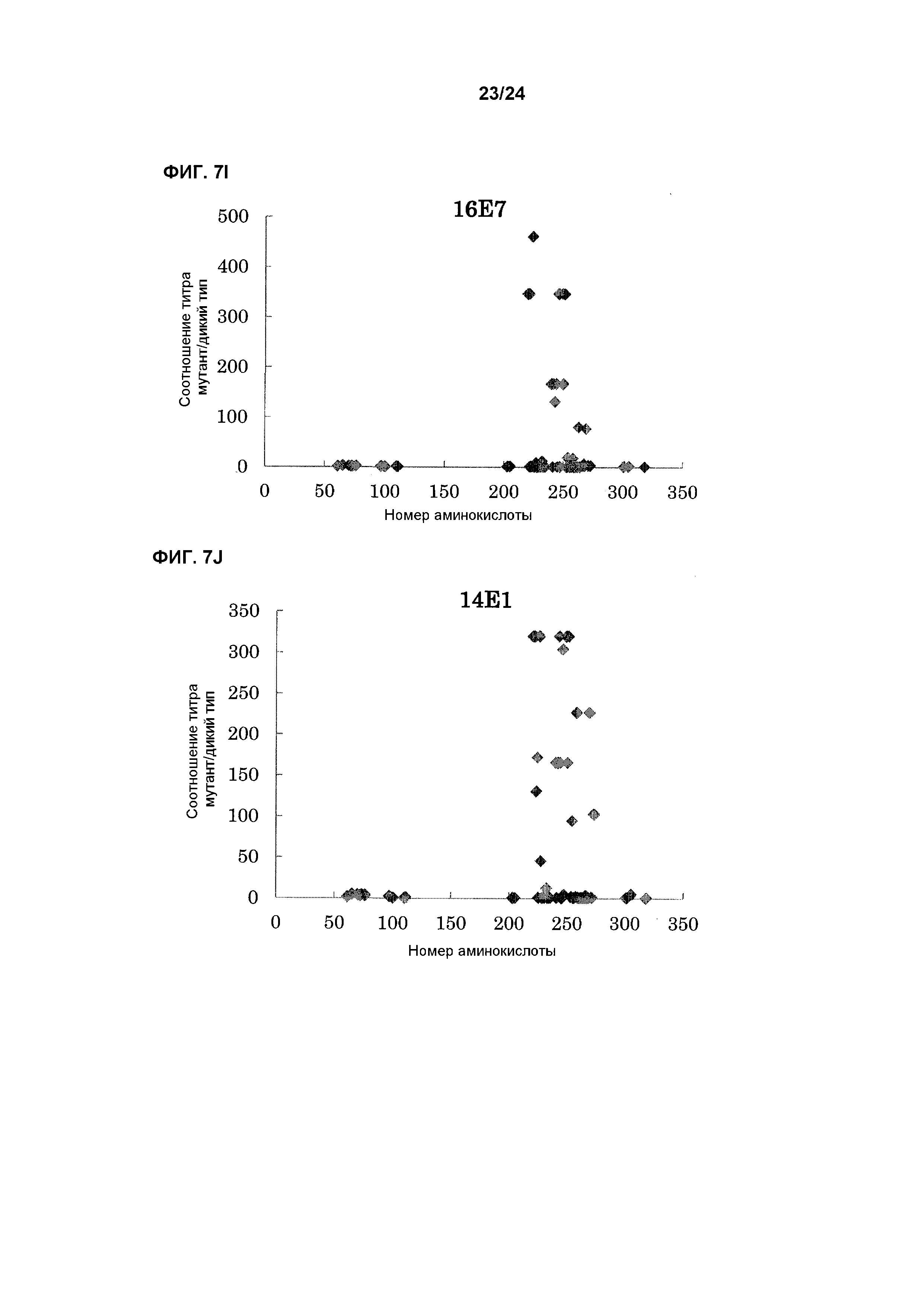
[Фиг. 1I] На фиг. 1I приведены результаты определения ингибирования антителом 16E7 ферментативной активности EL обезьяны циномолгус, EL павиана, кроличьей EL, химерной EL человек(1-157)мышь и химерной EL человек(1-305)мышь.
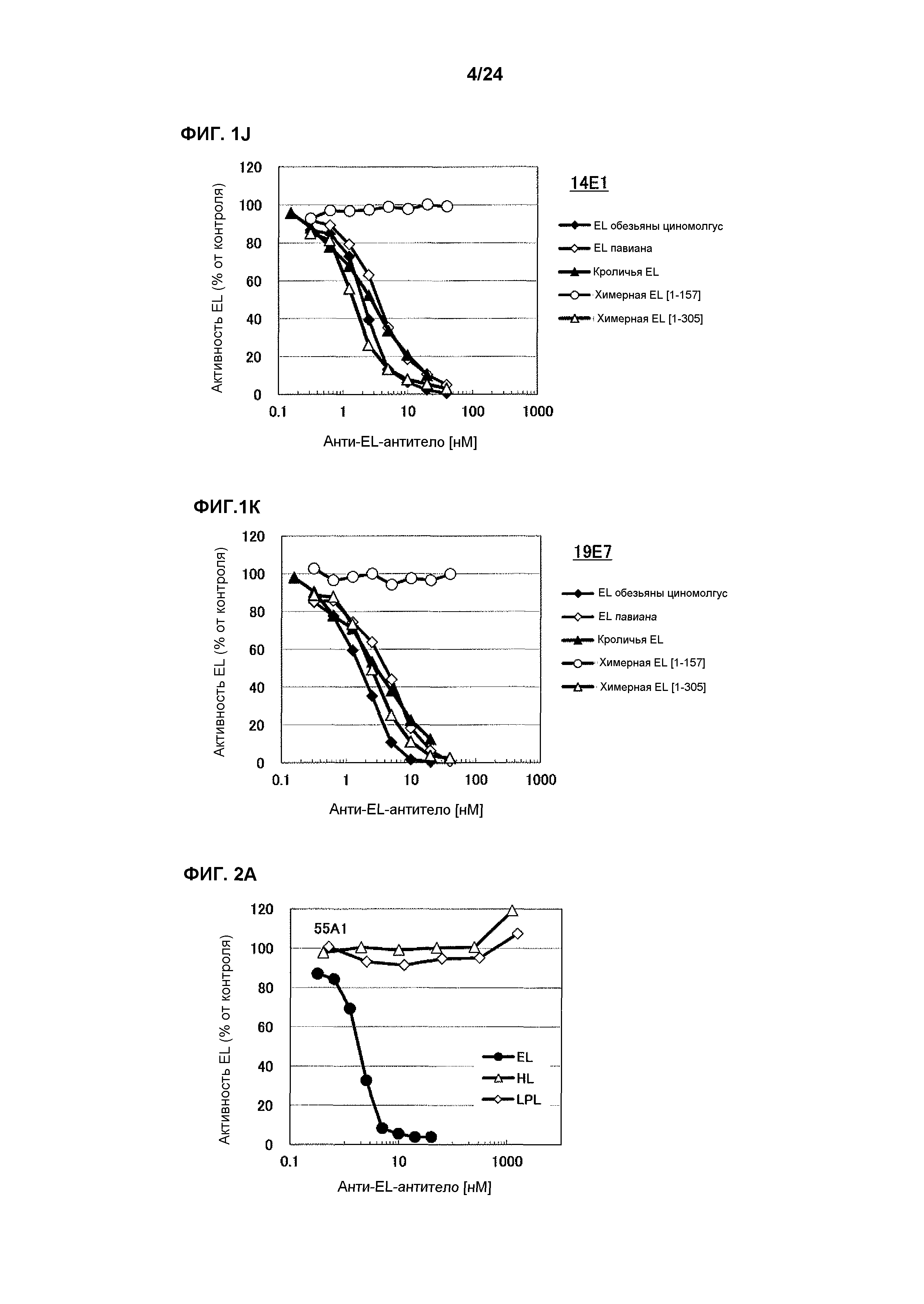
[Фиг. 1J] На фиг. 1J приведены результаты определения ингибирования антителом 14E1 ферментативной активности EL обезьяны циномолгус, EL павиана, кроличьей EL, химерной EL человек(1-157)мышь и химерной EL человек(1-305)мышь.
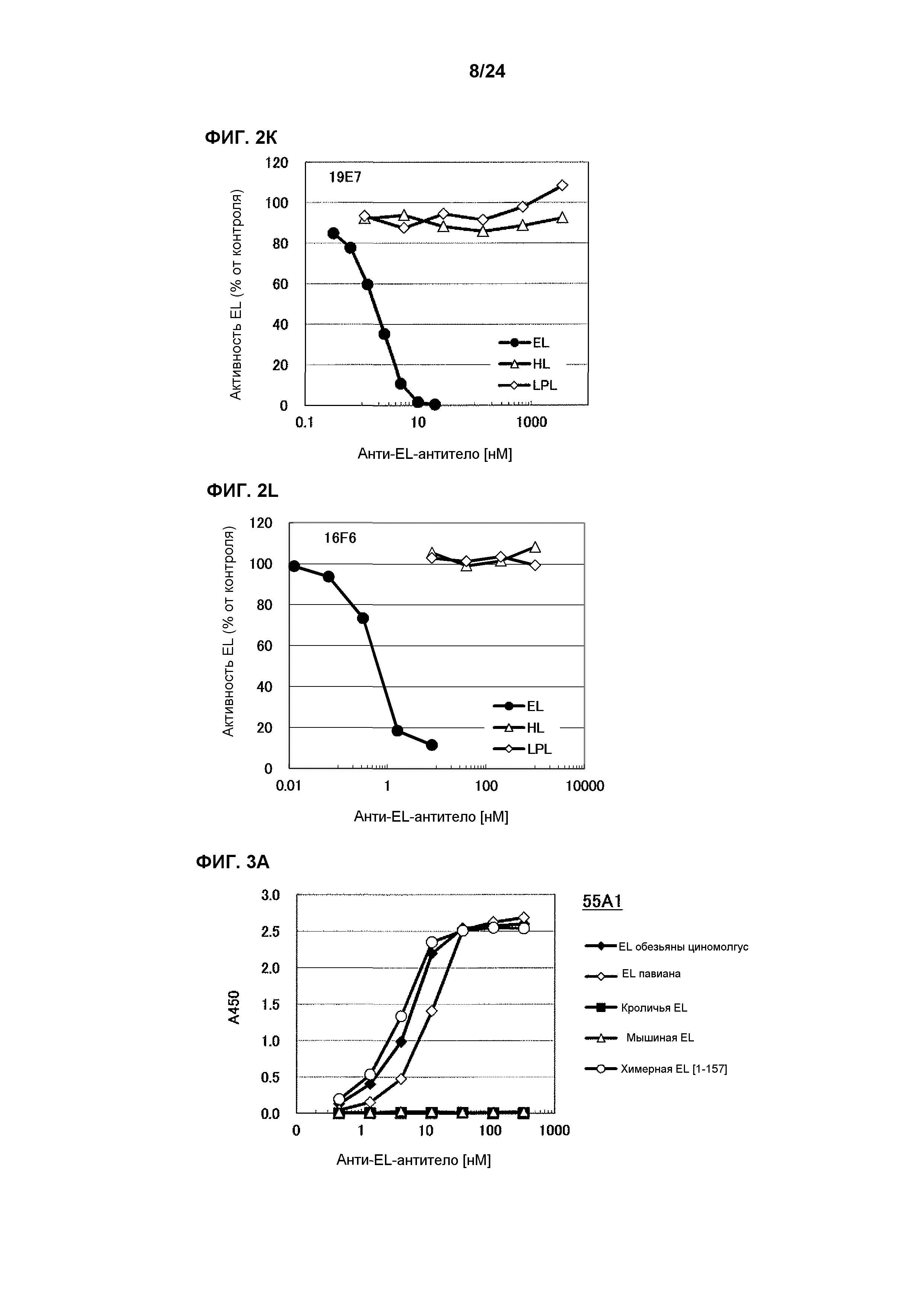
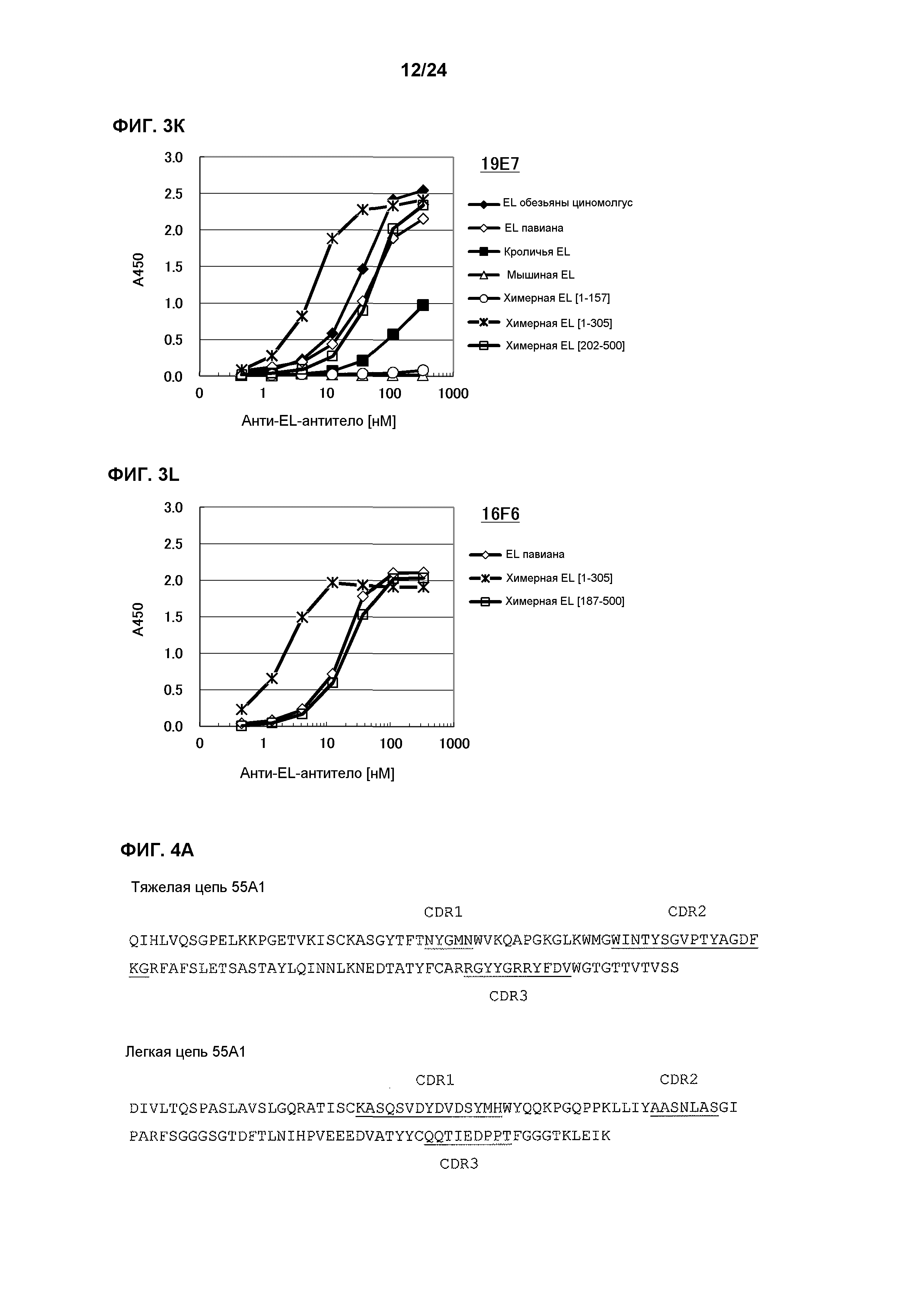
[Фиг. 1K] На фиг. 1K приведены результаты определения ингибирования антителом 19E7 ферментативной активности EL обезьяны циномолгус, EL павиана, кроличьей EL, химерной EL человек(1-157)мышь и химерной EL человек(1-305)мышь.
[Фиг. 2А] На фиг. 2А приведены результаты определения ингибирования антителом 55А1 ферментативной активности HL человека и LPL человека.
[Фиг. 2B] На фиг. 2B приведены результаты определения ингибирования антителом 7D4 ферментативной активности HL человека и LPL человека.
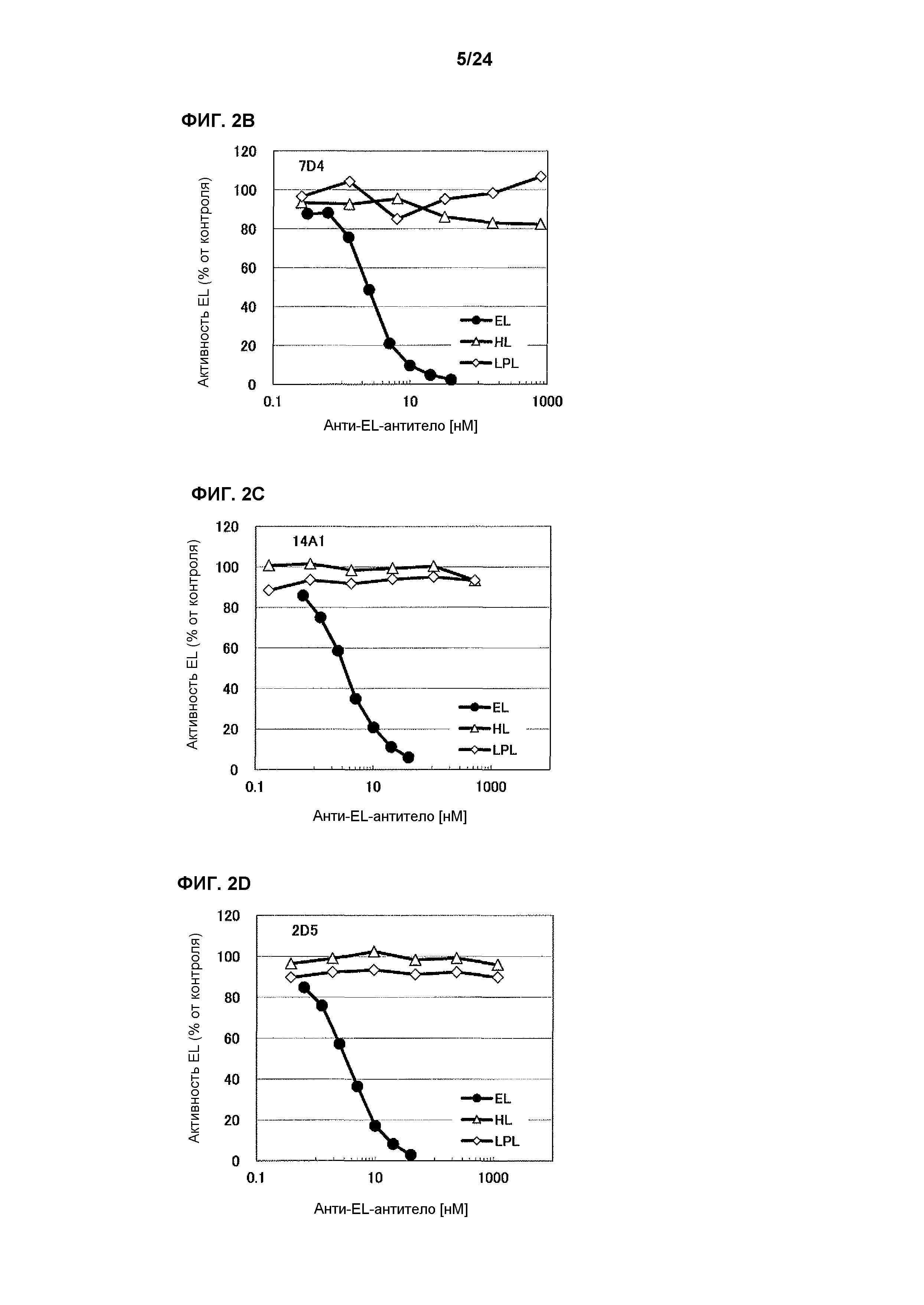
[Фиг. 2C] На фиг. 2C приведены результаты определения ингибирования антителом 14A1 ферментативной активности HL человека и LPL человека.
[Фиг. 2D] На фиг. 2D приведены результаты определения ингибирования антителом 2D5 ферментативной активности HL человека и LPL человека.
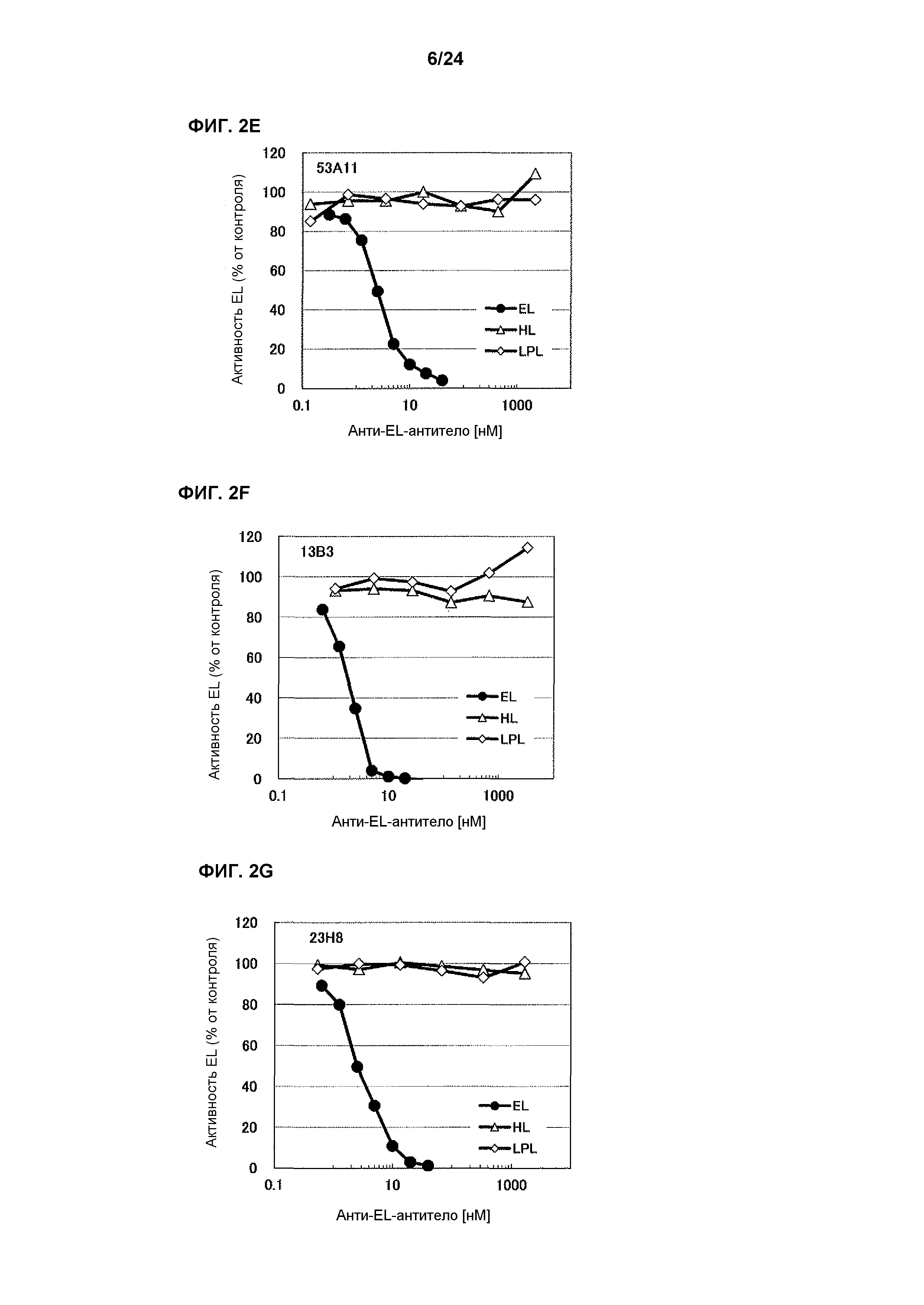
[Фиг. 2E] На фиг. 2E приведены результаты определения ингибирования антителом 53A11 ферментативной активности HL человека и LPL человека.
[Фиг. 2F] На фиг. 2F приведены результаты определения ингибирования антителом 13B3 ферментативной активности HL человека и LPL человека.
[Фиг. 2G] На фиг. 2G приведены результаты определения ингибирования антителом 23H8 ферментативной активности HL человека и LPL человека.
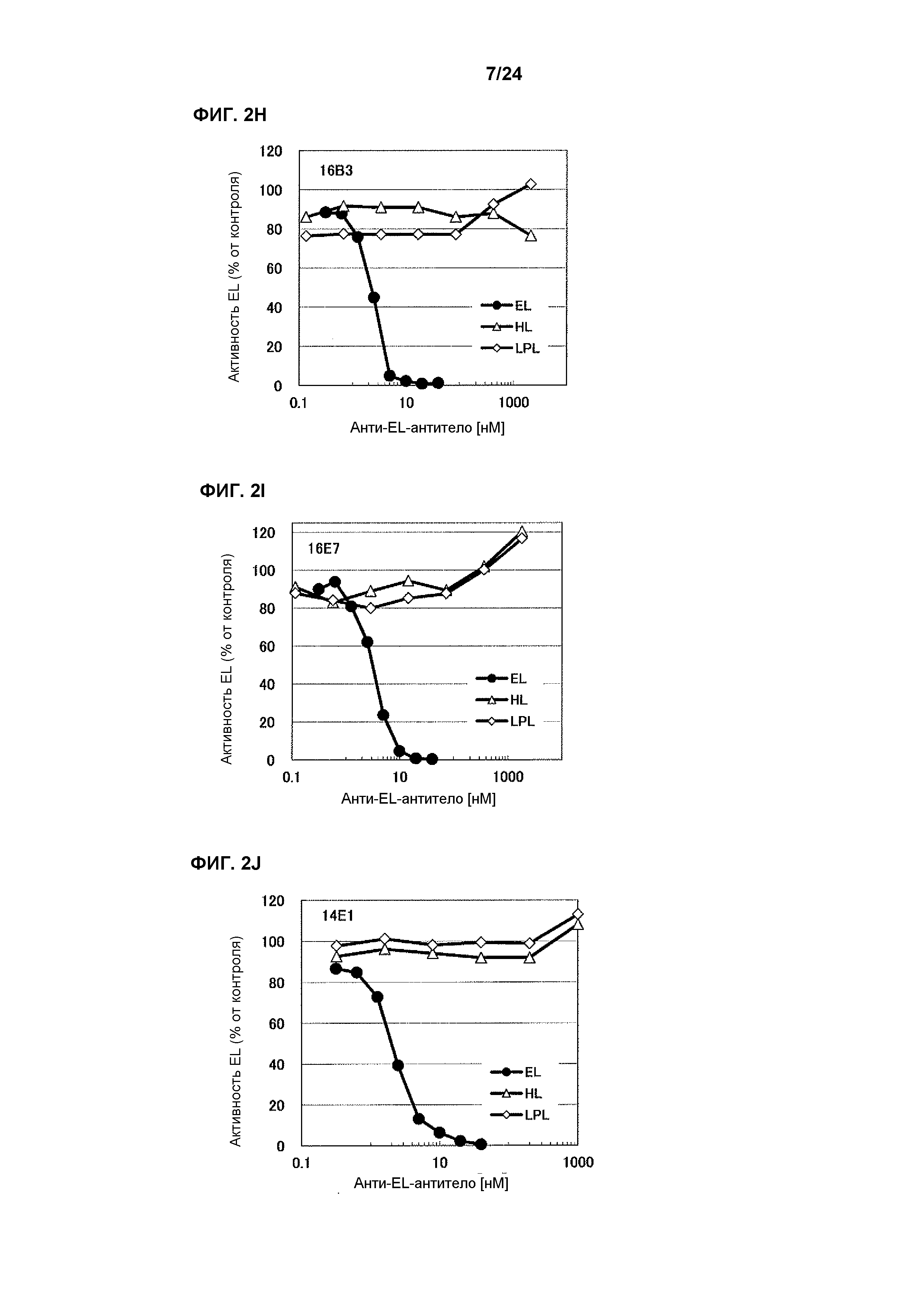
[Фиг. 2H] На фиг. 2H приведены результаты определения ингибирования антителом 16B3 ферментативной активности HL человека и LPL человека.
[Фиг. 2I] На фиг. 2I приведены результаты определения ингибирования антителом 16E7 ферментативной активности HL человека и LPL человека.
[Фиг. 2J] На фиг. 2J приведены результаты определения ингибирования антителом 14E1 ферментативной активности против EL человека и LPL человека.
[Фиг. 2K] На фиг. 2K приведены результаты определения ингибирования антителом 19E7 ферментативной активности HL человека и LPL человека.
[Фиг. 2L] На фиг. 2L приведены результаты определения ингибирования антителом 16F6 ферментативной активности HL человека и LPL человека.
[Фиг. 3А] На фиг. 3А приведены результаты определения связывающей активности антитела 55А1 в отношении EL обезьяны циномолгус, EL павиана, EL мыши и химерной EL человек(1-157)мышь.
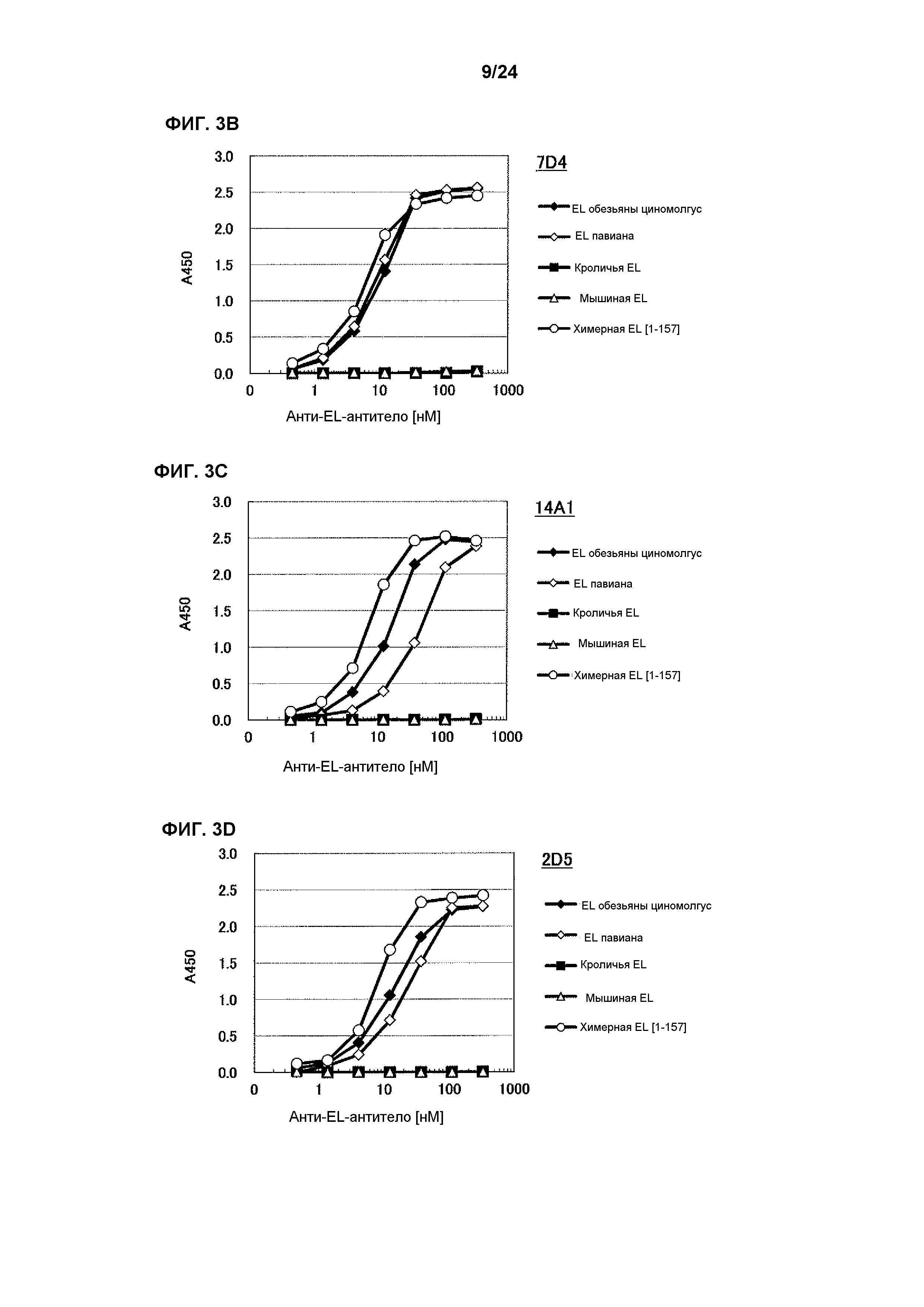
[Фиг. 3В] На фиг. 3В приведены результаты определения ингибирования антителом 7D4 ферментативной активности EL обезьяны циномолгус, EL павиана, EL кролика, EL мыши и химерной EL человек(1-157)мышь.
[Фиг. 3C] На фиг. 3C приведены результаты определения ингибирования антителом 14A1 ферментативной активности EL обезьяны циномолгус, EL павиана, EL кролика, EL мыши и химерной EL человек(1-157)мышь.
[Фиг. 3D] На фиг. 3D приведены результаты определения ингибирования антителом 2D5 ферментативной активности EL обезьяны циномолгус, EL павиана, EL кролика, EL мыши и химерной EL человек(1-157)мышь.
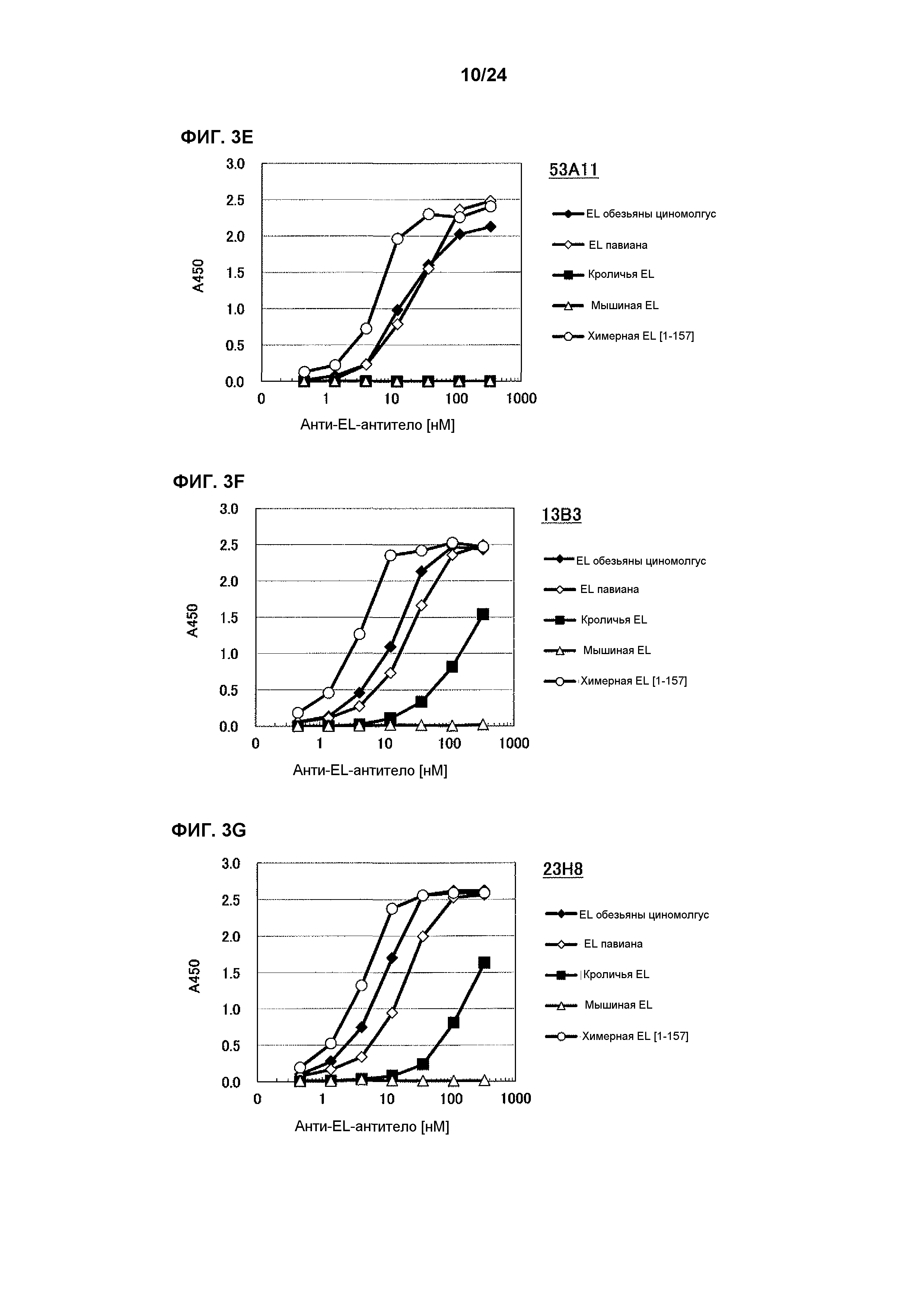
[Фиг. 3E] На фиг. 3E приведены результаты определения ингибирования антителом 53A11 ферментативной активности EL обезьяны циномолгус, EL павиана, EL кролика, EL мыши и химерной EL человек(1-157)мышь.
[Фиг. 3F] На фиг. 3F приведены результаты определения ингибирования антителом 13B3 ферментативной активности EL обезьяны циномолгус, EL павиана, EL кролика, EL мыши и химерной EL человек(1-157)мышь.
[Фиг. 3G] На фиг. 3G приведены результаты определения ингибирования антителом 23H8 ферментативной активности EL обезьяны циномолгус, EL павиана, EL кролика, EL мыши и химерной EL человек(1-157)мышь.
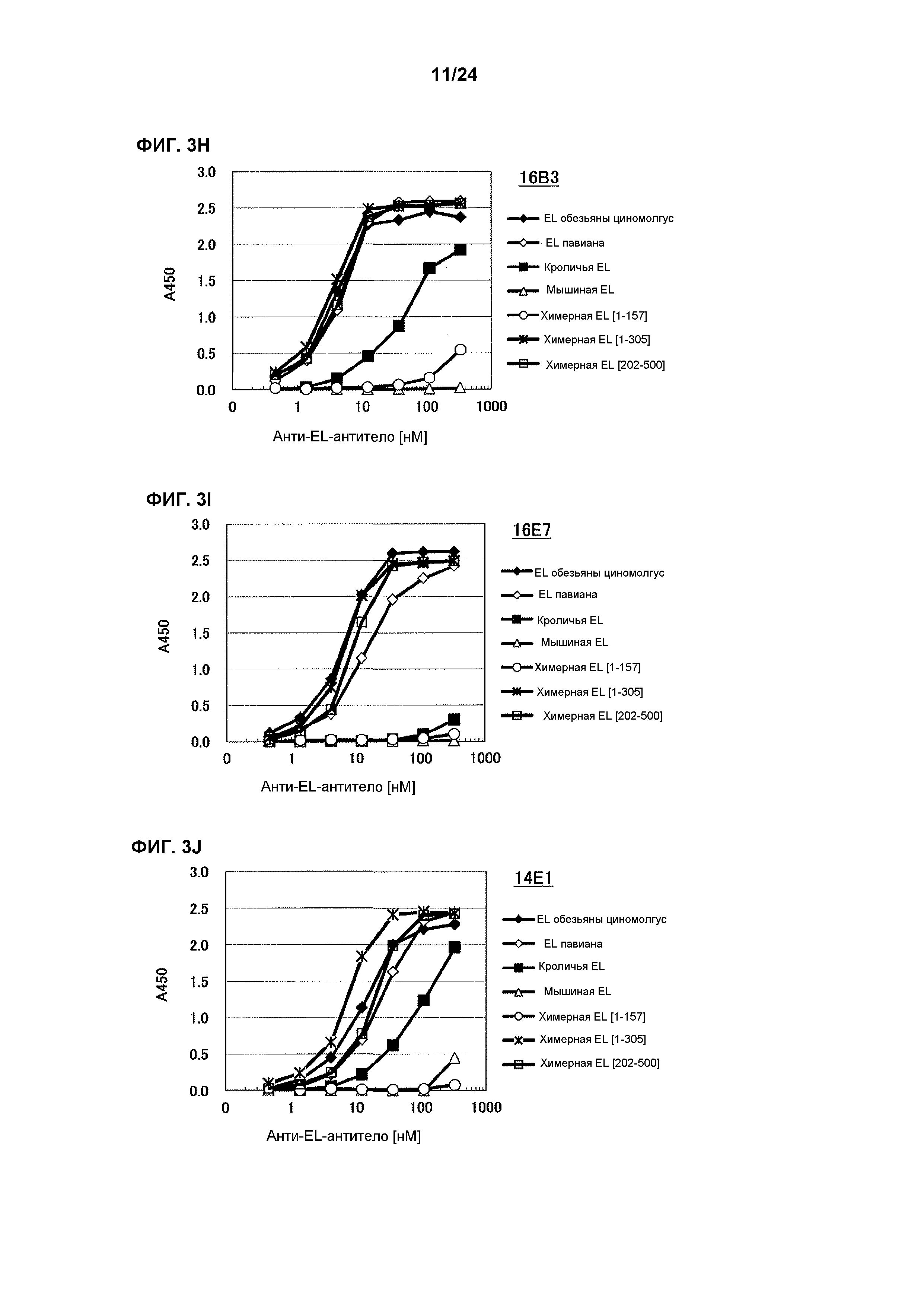
[Фиг. 3H] На фиг. 3H приведены результаты определения ингибирования антителом 16B3 ферментативной активности EL обезьяны циномолгус, EL павиана, EL кролика, EL мыши, химерной EL человек(1-157)мышь, химерной EL человек(1-305)мышь и химерной EL человек(202-500)мышь.
[Фиг. 3I] На фиг. 3I приведены результаты определения ингибирования антителом 16E7 ферментативной активности EL обезьяны циномолгус, EL павиана, EL кролика, EL мыши, химерной EL человек(1-157)мышь, химерной EL человек(1-305)мышь и химерной EL человек(202-500)мышь.
[Фиг. 3J] На фиг. 3J приведены результаты определения ингибирования антителом 14E1 ферментативной активности EL обезьяны циномолгус, EL павиана, EL кролика, EL мыши, химерной EL человек(1-157)мышь, химерной EL человек(1-305)мышь и химерной EL человек(202-500)мышь.
[Фиг. 3K] На фиг. 3K приведены результаты определения ингибирования антителом 19E7 ферментативной активности EL обезьяны циномолгус, EL павиана, EL кролика, EL мыши, химерной EL человек(1-157)мышь и химерной EL человек(1-305)мышь.
[Фиг. 3L] На фиг. 3L приведены результаты определения ингибирования антителом 16F6 ферментативной активности EL обезьяны циномолгус, химерной EL человек(1-305)мышь и химерной EL человек(187-500)мышь.
[Фиг. 4A] На фиг. 4А приведена аминокислотная последовательность вариабельной области антитела 55A1.
[Фиг. 4B] На фиг. 4B приведена аминокислотная последовательность вариабельной области антитела 7D4.
[Фиг. 4C] На фиг. 4C приведена аминокислотная последовательность вариабельной области антитела 14A1.
[Фиг. 4D] На фиг. 4D приведена аминокислотная последовательность вариабельной области антитела 2D5.
[Фиг. 4E] На фиг. 4E приведена аминокислотная последовательность вариабельной области антитела 53A11.
[Фиг. 4F] На фиг. 4F приведена аминокислотная последовательность вариабельной области антитела 13B3.
[Фиг. 4G] На фиг. 4G приведена аминокислотная последовательность вариабельной области антитела 23H8.
[Фиг. 4H] На фиг. 4H приведена аминокислотная последовательность вариабельной области антитела 16B3.
[Фиг. 4I] На фиг. 4I приведена аминокислотная последовательность вариабельной области антитела 16E7.
[Фиг. 4J] На фиг. 4J приведена аминокислотная последовательность вариабельной области антитела 14E1.
[Фиг. 4K] На фиг. 4K приведена аминокислотная последовательность вариабельной области антитела 19E7.
[Фиг. 4L] На фиг. 4L приведена аминокислотная последовательность вариабельной области антитела 16F6.
[Фиг. 5A] На фиг. 5А приведено выравнивание аминокислотных последовательностей вариабельной области тяжелой цепи антитела 55A1, антитела 7D4, антитела 14A1 и антитела 2D5.
[Фиг. 5В] На фиг. 5В приведено выравнивание аминокислотных последовательностей вариабельной области легкой цепи антитела 55A1, антитела 7D4, антитела 14A1 и антитела 2D5.
[Фиг. 5С] На фиг. 5С приведено выравнивание аминокислотных последовательностей вариабельной области тяжелой цепи антитела 53A11, антитела 13В3 и антитела 23Н8.
[Фиг. 5D] На фиг. 5D приведено выравнивание аминокислотных последовательностей вариабельной области легкой цепи антитела 53A11, антитела 13В3 и антитела 23Н8.
[Фиг. 6А] На фиг. 6A приведено выравнивание аминокислотных последовательностей вариабельной области тяжелой цепи антитела 16В3 и антитела 16Е7.
[Фиг. 6B] На фиг. 6B приведено выравнивание аминокислотных последовательностей вариабельной области легкой цепи антитела 16В3 и антитела 16E7.
[Фиг. 6C] На фиг. 6С приведено выравнивание аминокислотных последовательностей вариабельной области тяжелой цепи антитела 14E1 и антитела 19E1.
[Фиг. 6D] На фиг. 6D приведено выравнивание аминокислотных последовательностей вариабельной области легкой цепи антитела 14E1 и антитела 19E1.
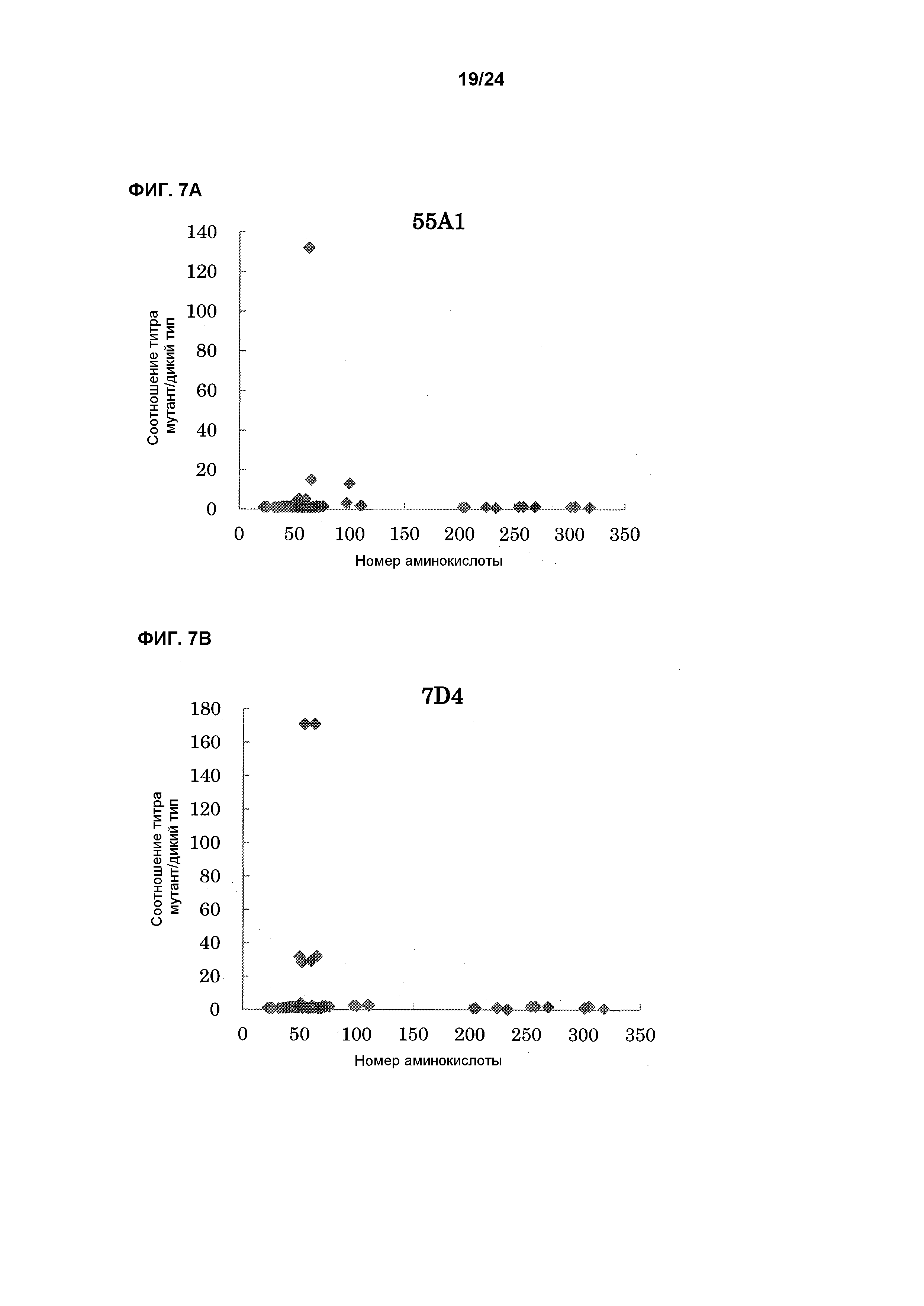
[Фиг. 7А] На фиг. 7А показана связывающая активность антитела 55А1 с EL павиана, в которую была введена мутация.
[Фиг. 7B] На фиг. 7B показана связывающая активность антитела 7D4 с EL павиана, в которую была введена мутация
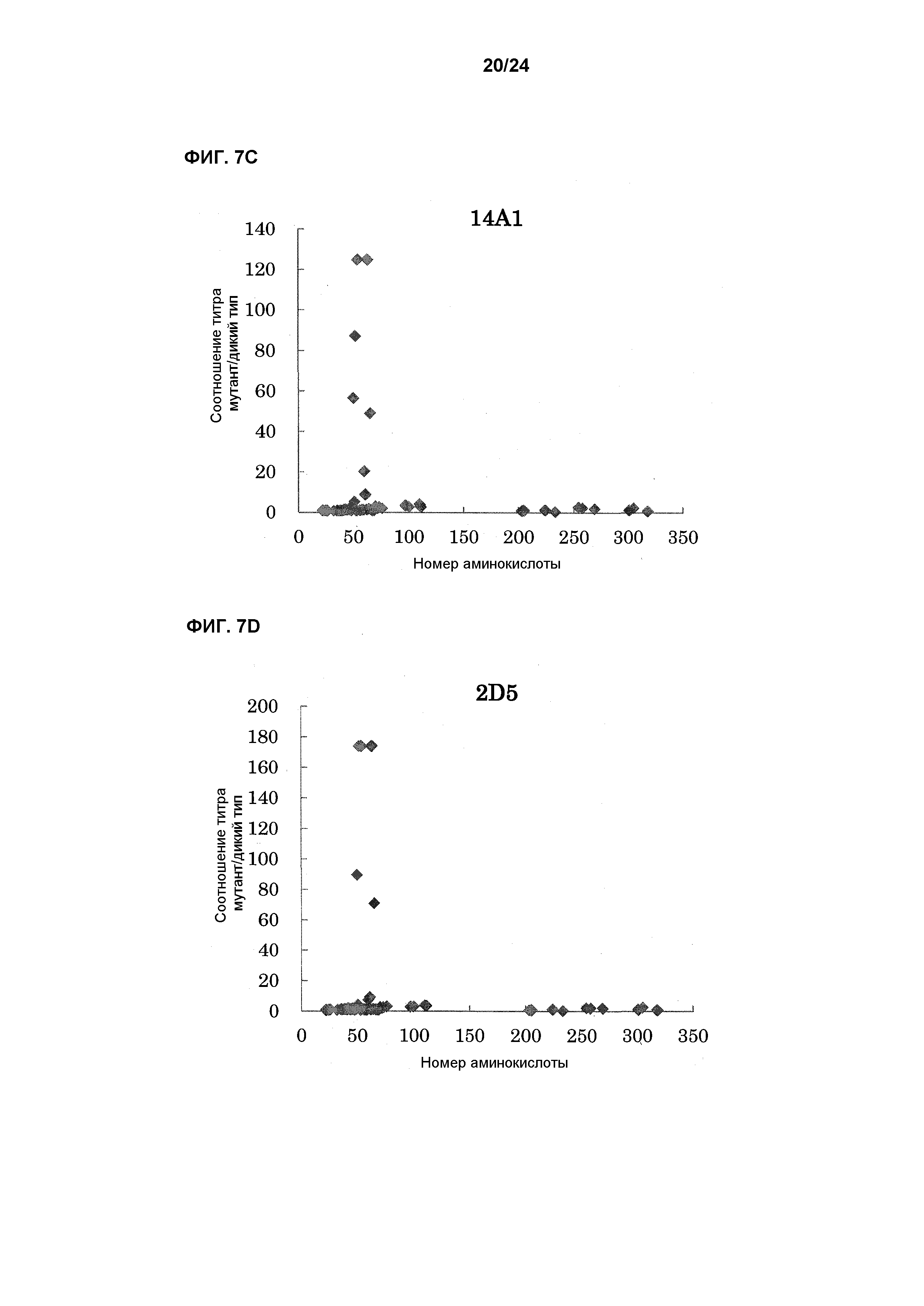
[Фиг. 7C] На фиг. 7C показана связывающая активность антитела 14A1 с EL павиана, в которую была введена мутация.
[Фиг. 7D] На фиг. 7D показана связывающая активность антитела 2D5 с EL павиана, в которую была введена мутация.
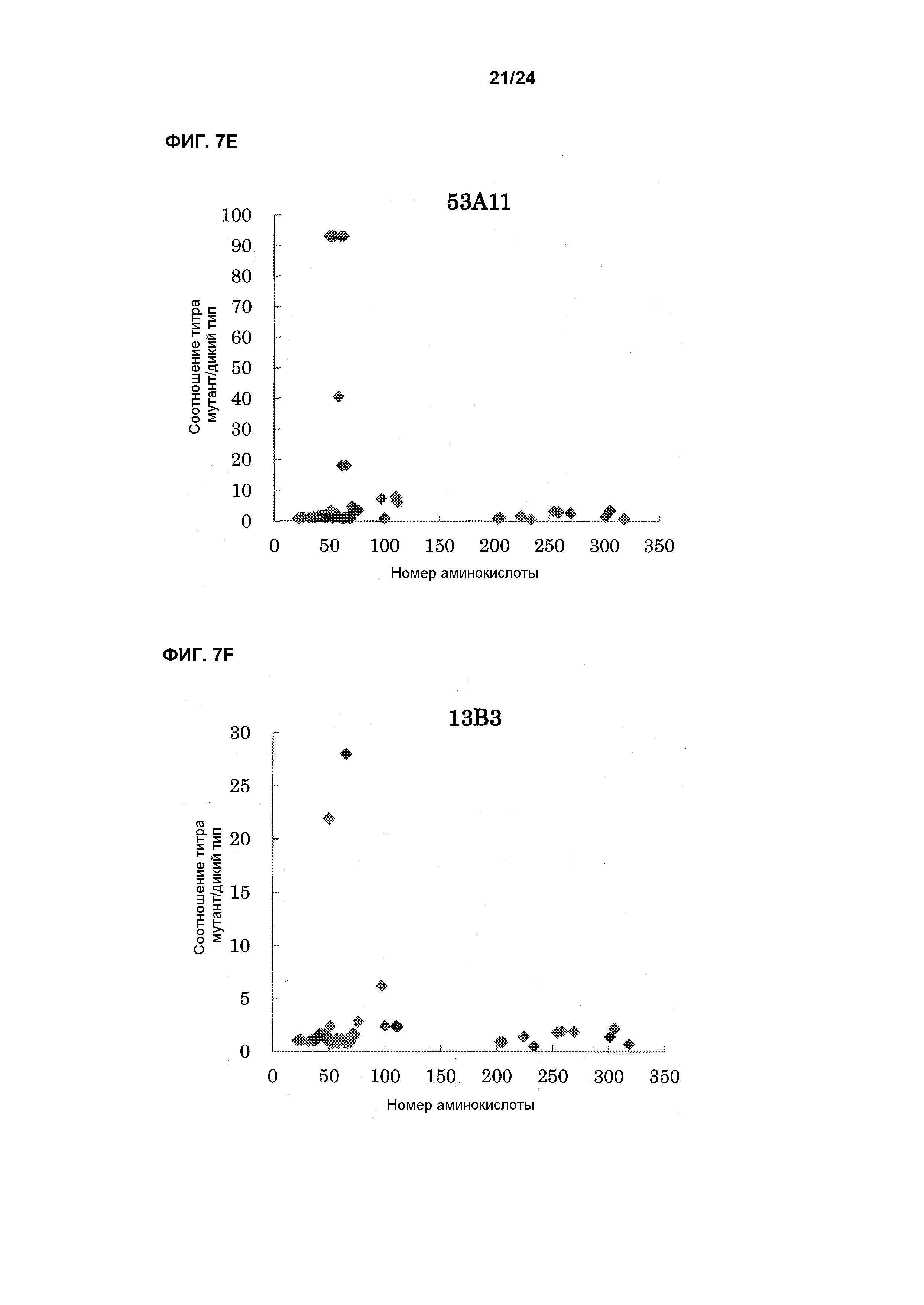
[Фиг. 7E] На фиг. 7E показана связывающая активность антитела 53A11 с EL павиана, в которую была введена мутация.
[Фиг. 7F] На фиг. 7F показана связывающая активность антитела 13B3 с EL павиана, в которую была введена мутация.
[Фиг. 7G] На фиг. 7G показана связывающая активность антитела 13B3 с EL павиана, в которую была введена мутация.
[Фиг. 7H] На фиг. 7H показана связывающая активность антитела 16B3 с EL павиана, в которую была введена мутация.
[Фиг. 7I] На фиг. 7I показана связывающая активность антитела 16E7 с EL павиана, в которую была введена мутация.
[Фиг. 7J] На фиг. 7J показана связывающая активность антитела 14E1 с EL павиана, в которую была введена мутация.
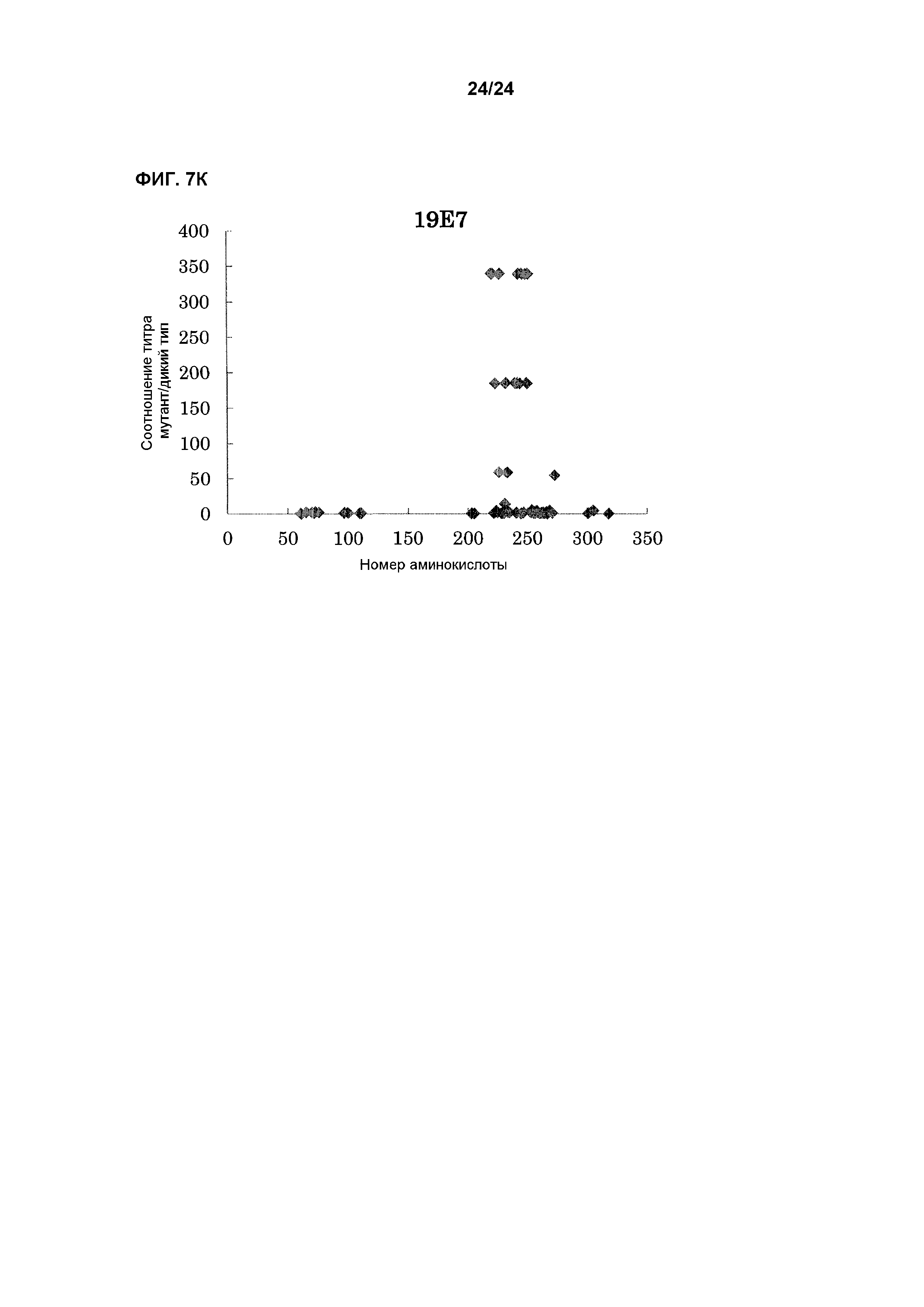
[Фиг. 7K] На фиг. 7K показана связывающая активность антитела 19E7 с EL павиана, в которую была введена мутация.
Способ осуществления изобретения
Настоящее изобретение относится к моноклональному антителу, отличающемуся тем, что оно селективно ингибирует ферментативную активность сосудистой эндотелиальной липазы. Поскольку моноклональное антитело по настоящему изобретению обладает способностью селективно ингибировать ферментативную активность сосудистой эндотелиальной липазы, то оно является пригодным в качестве лекарственного препарата для профилактики и/или лечения артериосклероза или метаболического синдрома.
Важно использовать пептид, имеющий последовательные аминокислотные остатки, содержащие аминокислотную последовательность области в положениях 1-157 или 202-305 в аминокислотной последовательности SEQ ID NO:1 в качестве антигена для получения моноклонального антитела по настоящему изобретению. Длина пептида особым образом не ограничивается, но желательны шесть или более остатков, которые обладают иммуногенностью. Можно использовать клеточные линии с высокой природной или синтетической экспрессией, это мембранные фракции, очищенные продукты, белки, слитые с другими белками или пептидами (например, белки с меткой, такой как FLAG-метка, HIS-метка, GST-метка или C2-метка и т.д., или флуоресцентные белки, такие как GFP или EGFP т.д.), или химически синтезированные пептиды в качестве конкретных примеров данных антител. Кроме того, специалистам в данной области известны способы получения данных иммуногенов.
Моноклональное антитело по настоящему изобретению может быть получено известным, обычно используемым способом получения. Конкретно млекопитающее, предпочтительно мышь, крысу, хомяка, морскую свинку, кролика, кошку, собаку, свинью, козу, овцу, осла, лошадь или быка, более предпочтительно мышь, крысу, хомяка, морскую свинку или кролика иммунизируют иммуногеном по настоящему изобретению вместе с адъювантом Фрейнда, при необходимости, один или несколько раз подкожной, внутримышечной, внутривенной инъекцией, инъекцией в подушечку конечности или внутрибрюшинной инъекцией. Обычно иммунизацию проводят от одного до четырех раз примерно каждые 1-21 сутки после первой иммунизации, и примерно через 1-10 суток после последней иммунизации от иммунизированного млекопитающего могут быть получены клетки, продуцирующие антитело. Количество иммунизаций и интервал времени между иммунизациями можно соответствующим образом изменить в зависимости от свойств используемого иммуногена.
Можно получить гибридому, которая секретирует моноклональное антитело, с использованием метода Kohler and Milstein (Nature, 1975, vol. 256, p. 495-497) и соответствующего метода. То есть, гибридому можно получить слиянием клеток, продуцирующих антитело, находящихся в селезенке, лимфатическом узле, костном мозге, миндалинах или тому подобное, предпочтительно в селезенке, полученной от млекопитающего, иммунизированного, как описано выше, и миеломных клеток, не обладающих способностью продуцировать аутоантитела, полученных предпочтительно от млекопитающего, такого как мышь, крыса, морская свинка, хомяк, кролик или человек, более предпочтительно от мыши, крысы или человека.
В качестве миеломной клетки, используемой для слияния клеток, как правило, применяют клеточные линии, полученные от мыши, например, P3-U1, NS-1, SP-2, 653, X63, AP-1 и тому подобное.
Гибридому, которая продуцирует моноклональное антитело, скринируют культивированием гибридомы, например, в микротитрационном планшете, определяют реактивность к иммуногену, используемому для иммунизации мышей, как описано выше, в культуральном супернатанте, находящемся в лунке, где определяют пролиферацию, с использованием метода оценки, такого как RIA, ELISA или FACS, и отбирают клон, который продуцирует моноклональное антитело, проявляющий специфическую аффинность с иммуногеном или гаптеном. При оценке указанной реактивности обычно иммуноген сорбируют на твердую фазу, и антитело в культуральном супернатанте, которое связывается с находящимся на твердой фазе иммуногеном, детектируется антимышиным вторичным антителом, меченным радиоактивным агентом, флуоресцентным агентом или ферментом. Затем в случае использования клеток, экспрессирующих иммуноген, к клеткам добавляют культуральный супернатант гибридомы, затем после взаимодействия с вторичными антителами, меченными флуоресцентной меткой, детектируют моноклональное антитело по настоящему изобретению, которое связывается с иммуногеном на клеточной мембране путем определения интенсивности флуоресценции клеток с использованием прибора для детектирования интенсивности флуоресценции, такого как проточный цитометр или тому подобное.
Продукцию моноклонального антитела из выбранной гибридомы можно осуществить культивированием гибридомы in vitro или в асцитной жидкости мыши, крысы, морской свинки, хомяка или кролика, предпочтительно мыши или крысы, или более предпочтительно мыши, с последующим выделением из полученного культурального супернатанта или асцитной жидкости млекопитающего. В случае культивирования in vitro гибридому культивируют в известной питательной среде или в любых питательных культурах, полученных и приготовленных из известной базовой среды, используемой для пролиферации, поддержания и хранения гибридомы, и для получения моноклонального антитела в культуральном супернатанте в зависимости от различных факторов, таких как свойства культивируемого клеточного типа, цели испытательного исследования и метода культивирования.
В качестве базовой среды можно упомянуть, например, среды с низким содержанием кальция, такие как среда Ham F19, среда MCDB153, или культуру MEM с низким содержанием кальция, и среды с высоким содержанием кальция, такие как среда MCDB104, среда MEM, среда D-MEM, среда RPMI1640, среда AF104 или среда RD, и такую базовую среду, которая может содержать, например, сыворотку, гормон, цитокин и/или различные неорганические или органические вещества в зависимости от объекта.
Выделение или очистку моноклонального антитела можно осуществить, подвергнув культуральный супернатант или асцитную жидкость, описанные выше, осаждению насыщенным раствором сульфата аммония, проведению ионообменной хроматографии (например, на колонке с DEAE или DE52), аффинной колоночной хроматографией, такой как хроматография на антииммуноглобулиновой колонке или колонке с протеином-А и тому подобное.
В качестве моноклонального антитела по настоящему изобретению можно использовать рекомбинантное антитело, которое получено с использованием метода рекомбинации генов таким образом, что ген антитела клонируют из клетки, продуцирующей антитело, например, гибридомы, и вставляют в соответствующий вектор, и вектор вводят в хозяина (например, Carl et al., THERAPEUTIC MONOCLONAL ANTIBODIES, опубликовано в 1990).
Конкретно из гибридомы, которая продуцирует целевое антитело, или из иммунной клетки, которая продуцирует антитело, например, из клетки, полученной иммортализацией сенсибилизированного лимфоцита или тому подобное раковым геном или тому подобное, выделяют мРНК, кодирующую вариабельную область (V-область) антитела. При выделении мРНК готовят цельную фракцию РНК с использованием известного метода, например, ультрацентрифугированием в гуанидине (Chirgwin J.M. et al., Biochemistry, 18, 5294-5299 (1979)) или тому подобное, и мРНК готовят с использованием набора реагентов для выделения мРНК (производства Pharmacia) или тому подобное.
Из полученной мРНК синтезируют кДНК V-области антитела с использованием обратной транскриптазы. Синтез кДНК можно провести с использованием набора реагентов для синтеза одноцепочечной кДНК с обратной транскриптазой AMV Synthesis Kit или подобного. Кроме того, для синтеза и амплификации кДНК можно использовать набор 5'-Ampli FINDER RACEKit (производства Clonetech) и метод 5'RACE с использованием ПЦР (Frohman M.A. et al., Proc. Natl. Acad. Sci. USA, 1988, vol. 85, 8998). Целевую ДНК выделяют из полученного продукта ПЦР и связывают с ДНК-вектором. Таким образом, конструируют рекомбинантный вектор и вставляют в E.coli или тому подобное, отбирают колонию и готовят желаемый рекомбинантный вектор. Подтверждают последовательность оснований в целевой ДНК с использованием известного метода, например, дидезокси-метода.
Если получают ДНК, кодирующую V-область целевого антитела, то ДНК соединяют с ДНК, кодирующей константную область желаемого антитела (С-область) и вставляют в экспрессионный вектор. Альтернативно ДНК, кодирующую V-область антитела, можно вставить в экспрессионный вектор, содержащий ДНК С-области антитела. Для получения антитела, используемого в настоящем изобретении, ген антитела вставляют в экспрессионный вектор таким образом, чтобы он экспрессировался под контролем регулирующей экспрессию области, например, энхансера/промотора. Затем клетку-хозяин можно трансформировать данным экспрессионным вектором для того, чтобы обеспечить экспрессию антитела.
Для экспрессии гена антитела тяжелую цепь (Н-цепь) или легкую цепь (L-цепь) антитела можно по отдельности включить в экспрессионные векторы, или хозяина можно котрансформировать данными экспрессионными векторами, или ДНК, кодирующую Н-цепь и L-цепь, можно включить в один экспрессионный вектор для трансформации хозяина полученным экспрессионным вектором (смотри WO94/11523).
Также можно использовать метод получения моноклонального антитела по настоящему изобретению, иной, чем вышеописанные, например, так называемую технологию фагового дисплея. Конкретно, например, библиотеку генов антител, приготовленных в виде материала В-лимфоцитов человека или животного (например, кролика, мыши, крысы, хомяка или тому подобное) с использованием известного метода, или полностью синтезированную библиотеку генов антител, полученную из выбранной и модифицированной последовательности зародышевой линии человека или животного, представляют на клеточной поверхности, на рибосоме или тому подобное бактериофага, Escherichia coli, дрожжей, клеток животных или тому подобное. В данном случае формы антитела для представления на клеточной поверхности включают молекулы IgG, молекулы IgM, Fab-фрагменты, одноцепочечные Fv-фрагменты (scFv) и т.д.
Гены антител можно получить реаранжировкой полученного таким образом фрагмента моноклонального антитела к соответствующей области гена IgG-антитела с использованием известного метода. Полученные таким образом гены вставляют в подходящий вектор, вектор вводят хозяину, получают антитело с использованием методов рекомбинантной ДНК (например, Carl et al., THERAPEUTIC MONOCLONAL ANTIBODIES, опубликовано в 1990).
Моноклональное антитело по настоящему изобретению отличается тем, что оно является селективным для ингибирования ферментативной активности сосудистой эндотелиальной липазы. Ниже приводится пример процедуры оценки способности антитела ингибировать ферментативную активность EL.
ДНК, кодирующую EL, клонируют в экспрессионный вектор pcDNA3.1 (Invitrogen). Экспрессионный вектор трансфектируют в клетки HEK293F и культивируют при 37°С в атмосфере 8% СО2 в течение 2 суток. Клеточные культуры центрифугируют, клетки собирают, клетки суспендируют в PBS, содержащий 20 Е/мл гепарина. Клеточную суспензию инкубируют при 37°С в течение 45 мин. Супернатант, полученный удалением клеток центрифугированием, используют в качестве раствора человеческого фермента EL для определения ингибирующей активности.
После добавления моноклонального антитела к раствору, содержащему 20 мМ Трис-HCl буфера (рН 7,5), 0,5% бычьего сывороточного альбумина, 4 мМ CaCl2, 150 мМ NaCl и 2 мг/мл HDL человека (Athens Research&Technology), добавляют раствор фермента EL. После проведения реакции при 37°С в течение 2 ч определяют свободные жирные кислоты (NEFA), образовавшиеся из HDL при участии фермента EL, с использованием С-теста NEFA Wako (Wakojyunyakukougyo), количество NEFA используют в качестве показателя ферментативной активности. Ферментативную активность без добавления антитела определяют в качестве контрольного значения и рассчитывают специфическую активность против контрольного значения при каждой концентрации антитела. По кривой ингибирования можно рассчитать концентрацию, при которой 50% антитела ингибировано.
Эффективную концентрацию (IC50) антитела, которая вызывает 50% ингибирование фермента EL, обычно используют в качестве показателя ингибирующей активности в отношении EL.
В настоящем изобретении моноклональное антитело или его фрагмент, ингибирующее ферментативную активность сосудистой эндотелиальной липазы, со значением IC50 на уровне 10 нМ или ниже означает моноклональное антитело или его фрагмент, показывающее значение IC50 на уровне 10 нМ или ниже, при использовании указанного метода [0027]-[0029]. Для определения может использоваться EL любого вида, если EL происходит от млекопитающего. Если моноклональное антитело или его фрагмент ингибирует ферментативную активность EL любого вида млекопитающих со значением IC50 на уровне 10 нМ или ниже, то моноклональное антитело или его фрагмент является моноклональным антителом или его фрагментом, показывающим значение IC50 на уровне 10 нМ или ниже.
И моноклональное антитело по настоящему изобретению отличается тем, что оно является селективным в отношении ингибирования ферментативной активности EL. Ниже приводится пример подтверждающей процедуры для определения способности селективно ингибировать ферментативную активность EL, другими словами, не ингибируя ферментативную активность LPL или HL.
ДНК, кодируют HL, клонируют в экспрессионный вектор pcDNA3.1 (Invitrogen). Экспрессионный вектор трансфектируют в клетки HEK293F и культивируют при 37°С в атмосфере 8% СО2 в течение 2 суток. Клеточные культуры центрифугируют, клетки собирают, клетки суспендируют в PBS, содержащий 20 Е/мл гепарина. Клеточную суспензию инкубируют при 37°С в течение 45 мин. Супернатант, полученный удалением клеток центрифугированием, используют в качестве раствора человеческого фермента HL. Раствор фермента LPL готовят с использованием аналогичных процедур. После добавления моноклонального антитела к раствору, содержащему 20 мМ Трис-HCl буфера (рН 7,5), 0,5% бычьего сывороточного альбумина, 4 мМ CaCl2, 150 мМ NaCl и 0,5 мг/мл VLDL человека (INTRACEL), добавляют раствор фермента HL или LPL. После проведения реакции при 37°С в течение 2 ч определяют свободные жирные кислоты (NEFA), образовавшиеся из VLDL при участии ферментов HL или LPL, с использованием С-теста NEFA Wako (Wakojyunyakukougyo), количество NEFA используют в качестве показателя ферментативной активности. Ферментативную активность без добавления антитела определяют в качестве контрольного значения и рассчитывают специфическую активность против контрольного значения при каждой концентрации антитела.
Выражение «является селективным для ингибирования ферментативной активности EL», означает ингибирование ферментативной активности HL или LPL не более чем 3%, когда моноклональное антитело добавляется в концентрации, равной IC50 для EL. Областью эпитопа моноклонального антитела по настоящему изобретению предпочтительно является область EL, которая не обладает гомологией с LPL или HL, поскольку моноклональное антитело по настоящему изобретению отличается не ингибированием ферментативной активности LPL или HL, а отличается тем, что является селективным для ингибирования ферментативной активности EL.
Моноклональное антитело по настоящему изобретению включает рекомбинантные моноклональные антитела, которые искусственно модифицированы в целях снижения гетерологичной антигенности для человека, например, химерное моноклональное антитело, гуманизированное моноклональное антитело и человеческое моноклональное антитело.
Моноклональное антитело по настоящему изобретению может представлять конъюгат антитела, связанного с различными молекулами, такими как полиэтиленгликоль (ПЭГ), радиоактивное вещество, токсин. Такие конъюгаты антител можно получить химической модификацией полученных антител. Методы модификации антитела хорошо известны в данной области. Данные конъюгаты антител включаются в объем моноклональных антител по настоящему изобретению.
И моноклональное антитело по настоящему изобретению может быть слиты с другими белками на N-конце или С-конце антитела (Clinical Cancer Research, 2004, 10, 1274-1281). Специалисты в данной области могут правильно выбрать слитый белок.
В настоящем изобретении термин «фрагмент моноклонального антитела» означает фрагмент вышеуказанного моноклонального антитела по настоящему изобретению и он обладает способностью специфически связываться с сосудистой эндотелиальной липазой, как и само моноклональное антитело, или означает фрагмент, который обладает способностью специфически связываться с сосудистой эндотелиальной как и само моноклональное антитело, и обладает эффектом ингибирования ферментативной активности сосудистой эндотелиальной липазы, как и само моноклональное антитело. Конкретно фрагменты, которые обладают специфической ассоциативностью в отношении EL, включают Fab, F(ab')2, Fab', одноцепочечное антитело (scFv), стабилизированное дисульфидными связями антитело (dsFv), фрагмент с димеризованными V-областями (диатело), пептид, содержащий CDR т.д. (Expert opinion on therapeutic patents, vol. 6, № 5, p. 441-456, 1996).
Моноклональное антитело по настоящему изобретению или его фрагмент является пригодным в качестве фармацевтической композиции. Следовательно, фармацевтическую композицию, содержащую моноклональное антитело по настоящему изобретению или его фрагмент, можно вводить системно или местно пероральным или парентеральным путем. Для парентерального введения можно выбрать, например, внутривенную инъекцию, такую как капельная инфузия, внутримышечную инъекцию, внутрибрюшинную инъекцию, подкожную инъекцию, внутриназальное введение, ингаляцию и тому подобное.
Также моноклональное антитело по настоящему изобретению применимо для диагностики дислипидемии, гиперлипидемии, артериосклероза, атеросклероза, гиперхолестеринемии, гипертриглицеридемии, диабета, ожирения и/или синдрома Х, поскольку моноклональное антитело по изобретению обладает способностью специфически связываться с сосудистой эндотелиальной липазой.
Моноклональное антитело по настоящему изобретению или его фрагмент отличается распознаванием по меньшей мере одной аминокислоты в положениях 1-157 в аминокислотной последовательности SEQ ID NO:1, или распознаванием по меньшей мере одной аминокислоты в положениях 202-305 в аминокислотной последовательности SEQ ID NO:1. Распознавание по меньшей мере одной аминокислоты в положениях 1-157 в аминокислотной последовательности SEQ ID NO:1 означает, что моноклональное антитело или его фрагмент распознает по меньшей мере одну аминокислоту в данной области.
Пациент для применения фармацевтической композиции по настоящему изобретению страдает артериосклерозом и метаболическим синдромом. Эффективная доза выбрана из пределов от 0,01 мг до 100 мг на 1 кг массы тела за один раз. Альтернативно можно выбрать дозу от 5 до 5000 мг, предпочтительно дозу от 10 до 500 мг на пациента. Однако доза фармацевтической композиции, содержащей моноклональное антитело по настоящему изобретению или его фрагмент, не ограничивается указанными дозировками. Продолжительность введения также может быть соответственно выбрана в зависимости от возраста, симптомов и подобных факторов у пациента. Фармацевтическая композиция по настоящему изобретению также может включать фармацевтически приемлемый носитель или добавку также в зависимости от используемого пути введения. Примеры такого носителя и добавки включают воду, фармацевтически приемлемый органический растворитель, коллаген, поливиниловый спирт, поливинилпирролидон, альгинат натрия, водорастворимый декстран, пектин, метилцеллюлозу, этилцеллюлозу, казеин, диглицерин, пропиленгликоль, полиэтиленгликоль, вазелин, человеческий сывороточный альбумин (HAS), маннит, сорбит, лактозу и поверхностно-активные вещества в качестве фармацевтической добавки. Добавку для применения соответствующим образом выбирают или объединяют, исходя из вышеприведенного перечня, в зависимости от лекарственной формы, но, не ограничиваясь этим.
Настоящее изобретение описано ниже более подробно с помощью примеров. Однако настоящее изобретение не ограничивается последующими примерами. Если не оговорено иначе, то в качестве процедуры для получения антитела, использовали способы, описанные в руководстве «Immunochemistry in Practice» (Blackwell Scientific Publications). Также, если не оговорено иначе, то в качестве общих методов конструирования использовали методы, описанные в руководстве «Molecular Cloning: A Laboratory Manual», 2nd Edition (Cold Sping Harbor Laboratory).
Пример 1
Получение рекомбинантного аденовируса для экспрессии EL павиана
кДНК EL павиана с С2-меткой клонировали в челночный вектор pShuttle (Clontech). Данный субклонированный вектор и вектор, несущий ген аденовирусного «скелета», расщепляли ферментами PI-SceI и I-CeuI (Adeno-x Accessory Kit, Clontech). Реакцию лигирования расщепленных фрагментов проводили при 16°С в течение 3 ч (Ligation high, TOYOBO) и продукты лигирования трансформировали в E.coli (OneShot stb13 Chemically Competent, Invitrogen). После селекции на ампициллине плазмидную ДНК выделяли из полученного клона (QIAprep spin Miniprep Kit, QIAGEN) и расщепляли ферментом PacI для вырезания зоны роста E.coli (New England Biolabs). Как описано выше, получали плазмидную ДНК для получения аденовирусного вектора. Полученную плазмидную ДНК трансфектировали в клетки HEK293 (Американская типовая коллекция тканевых культур) с использованием липофектамина 2000 (Invitrogen) и культивировали в среде DMEM, содержащей 10% FBS при 37°С. После трансфекции культуральную среду заменяли каждые 5 суток и культивирование клеток продолжали до подтверждения цитопатического эффекта (СРЕ). После подтверждения СРЕ собирали клетки и культуральный супернатант. Затем клетки подвергали пяти раундам замораживания/оттаивания на бане с сухим льдом/метанолом и теплой бане, супернатант получали центрифугированием в течение 15 мин и собирали в виде клеточных экстрактов. Культуральный супернатант смешивали с культуральной средой и использовали в качестве первичной биомассы вируса. Амплификацию биомассы вируса проводили добавлением вирусной биомассы к клетками HEK293 и повторяли те же процедуры. После амплификации вирусной биомассы полученные в конце клеточные экстракты обрабатывали бензоназой (Merck-Novagen) в течение 30 мин при 37°С, затем супернатант использовали для выделения вирусного вектора центрифугированием в градиенте плотности, которое проводили следующим образом. В центрифужную пробирку наслаивали PBS, содержащий хлорид цезия из расчета 1,5; 1,35; 1,25 г/см3, затем наслаивали супернатант. Проводили центрифугирование при 35000 об/мин в течение 1 ч при 16°С, и полученный вирусный вектор собирали визуально. Собранный вирусный вектор диализовали против PBS, содержащего 10% глицерина, и затем использовали в качестве очищенных аденовирусных векторов. Часть вирусного вектора использовали для титрации (набор Adeno-X rapid titer, Clontech) и появления прироста за счет потенциала самопролиферации, и использовали для иммунизации только без аномалий. Аминокислотная последовательность EL-C2-метка павиана представлена в SEQ ID NO:2.
Пример 2
Получение экстракта EL с гепарином
ДНК, кодирующую EL павиана, клонировали в экспрессионный вектор pcDNA3.1 (Invitrogen). Экспрессионный вектор трансфектировали в клетки HEK293F и культивировали при 37°С в атмосфере 8% СО2 в течение 2 суток. Клеточные культуры центрифугировали и клетки собирали, клетки суспендировали в PBS, содержащем 20 Е/мл гепарина. Клеточную суспензию инкубировали при 37°С в течение 45 мин. Супернатант, полученный удалением клеток центрифугированием, использовали в качестве раствора фермента EL павиана. Используя этот же метод, готовили экстракты с гепарином EL обезьяны циномолгус, химерной EL человек[1-157]мышь, химерной EL человек[1-53]мышь, химерной EL человек[61-111]мышь, кроличьей EL, мышиной EL, химерной EL человек[1-305]мышь и химерной EL человек[202-500]мышь. Аминокислотные последовательности EL обезьяны циномолгус, химерной EL человек[1-157]мышь, химерной EL человек[1-53]мышь, химерной EL человек[61-111]мышь, кроличьей EL, мышиной EL, химерной EL человек[1-305]мышь и химерной EL человек[202-500]мышь с С2-меткой приведены в SEQ ID NO:2, 3, 4, 5, 6, 7, 96 и 97.
Пример 3
Иммунизация экспрессионным аденовирусным вектором с EL павиана
6-недельных мышей-самок (A/J Jms Slc, полученные из питомника Nihon SLC) иммунизировали внутривенно, подкожно или внутримышечно 2×109 и.е. аденовирусного вектора, несущего ген EL павиана. Каждые 7 суток после введения отбирали пробы крови из хвостовой вены и определяли титр антител. И проводили дополнительное введение аденовирусного вектора, несущего ген EL павиана, внутривенно, подкожно или внутримышечно. Мышей, у которых обнаруживали высокий титр антител, иммунизировали повторно в хвостовую вену в качестве последнего введения.
Пример 4
Получение гибридомы, продуцирующей антитела
У мышей, у которых был обнаружен высокий титр антител, вскрывали брюшную полость и извлекали селезенку через 3 суток после последней иммунизации. Спленоциты и мышиные миеломные клетки (p3x63-Ag8.U1, Tokyo tumor laboratories) сливали с использованием 50% полиэтиленгликоля 4000, и гибридомные клетки подвергали селекции в культуральной среде, содержащей гипоксантин, аминоптерин и тимидин.
Пример 5
Скрининг гибридомных клеток, которые продуцируют антитела к EL павиана
Через 10 суток после слияния клеток отбирали гибридомные клетки, которые продуцировали антитела к EL павиана. В каждой лунке 384-луночного микротитрационного планшета (Nunc) иммобилизовали 35 мкл Трис-HCl буфера (50 мМ Трис-HCl буфер, рН 7,5), содержащего 0,35 мкг антимышиного IgG-Fc (Jackson Immuno Research). Планшеты инкубировали при 4°С в течение 16 ч. После промывки лунок один раз 90 мкл раствора для промывания (физиологический раствор, содержащий 0,01% Твина-20), в лунки добавляли 100 мкл Block-Ace (Dainihonsumitomo) и инкубировали при комнатной температуре в течение 2 ч (планшет с иммобилизованным антимышиным IgG-Fc антителом). После промывания лунок три раза 90 мкл буфера для промывки в лунки добавляли 15 мкл буфера для анализа, содержащего экстракт EL павиана с гепарином (50 мМ Трис-HCl буфер, рН 7,4, содержащий 4% Block-Ace, 0,05% твина-20, 150 мМ NaCl), и инкубировали при комнатной температуре при 4°С в течение 16 ч. После промывания лунок три раза 90 мкл буфера для промывания в лунки добавляли 15 мкл буфера для анализа, содержащего меченное биотином антитело к С2-метке и меченный ПХ стрептавидин (Thermo scientific), и инкубировали при комнатной температуре в течение 1 ч. После промывания лунок три раза 90 мкл буфера для промывания добавляли 15 мкл ТМВ+субстрат-хромоген (DAKO) и инкубировали при комнатной температуре в течение 30 мин. Реакцию останавливали добавлением 15 мкл 0,05 М H2SO4 и затем измеряли поглощение при длине волны 450 нм. В результате скрининга отбирали 11 гибридом (55А1, 7D4, 14A1, 2D5, 53A11, 13B3, 23H8, 16В3, 16E7, 14E1 и 19E7), которые продуцировали антитело к EL павиана. Антитело, которое продуцировали гибридомы 55А1, 7D4, 14A1, 2D5, 53A11, 13B3, 23H8, 16В3, 16E7, 14E1 и 19E7, соответственно называли антителом 55А1, 7D4, 14A1, 2D5, 53A11, 13B3, 23H8, 16В3, 16E7, 14E1 и 19E7. Подклассы IgG определяли с использованием набора для изотипирования мышиных иммуноглобулинов (BD Biosciences).
Подклассом антител 55А1, 2D5, 53A11, 13B3, 23H8, 16В3 и 19E7 был IgG2. Подклассом антител 7D4, 14A1, 16E7 и 14E1 был IgG1.
Пример 6
Определение ингибирующей активности анти-EL-антител в отношении EL
Ингибирующую активность анти-EL-антител (55А1, 7D4, 14A1, 2D5, 53A11, 13B3, 23H8, 16В3, 16E7, 14E1 и 19E7) в отношении EL павиана, EL обезьяны циномолгус, химерной EL человек[1-157]мышь, химерной EL человек[1-53]мышь, химерной EL человек[61-111]мышь, кроличьей EL, мышиной EL, химерной EL человек[1-305]мышь и химерной EL человек[202-500]мышь оценивали следующим образом. Раствор анти-EL-антитела, буфер для анализа (20 мМ Трис/HCl буфер (рН 7,5), 0,5% BSA, 4 мМ CaCl2, 150 мМ NaCl) и 2 мг/мл человеческого HDL (Athens Research&Technology) смешивали в микротитрационном планшете с последующим добавлением экстракта EL с гепарином. После инкубации при 37°С в течение 90 мин определяли неэстерифицированные жирные кислоты (NEFA), выделенные из HDL, с использованием промышленно доступного набора (NEFA C test-Wako, Wako). Количество NEFA использовали в качестве показателя активности фермента. Ферментативную активность в случае без добавления анти-EL-антитела использовали в качестве контрольного значения и специфическую активность рассчитывали против контрольного значения при каждой концентрации анти-EL-антитела (фиг. 1А-К). Концентрацию анти-EL-антитела, при которой активность EL ингибировалась на 50%, рассчитывали по кривой ингибирования в виде значения IC50.
Пример 7
Определение ингибирующей активности анти-EL-антитела в отношении HL и LPL
ДНК, кодирующую HL человека, клонировали в экспрессионный вектор pcDNA3.1 (Invitrogen). Экспрессионный вектор трансфектировали в клетки HEK293F и культивировали при 37°С в атмосфере 8% СО2 в течение 2 суток. Клетки центрифугировали и клетки собирали, клетки суспендировали в PBS, содержащем 20 Е/мл гепарина. Клеточную суспензию инкубировали при 37°С в течение 45 мин. Супернатант, полученный удалением клеток центрифугированием, использовали в качестве раствора фермента HL человека. Раствор фермента LPL готовили с использованием того же метода. После добавления анти-EL-антитела к раствору, содержащему 20 мМ Трис/HCl буфера (рН 7,5), 0,5% бычьего сывороточного альбумина, 4 мМ CaCl2, 150 мМ NaCl и 0,5 мг/мл человеческого VLDL (INTRACEL), ферментов человеческой HL или человеческой LPL (общий объем 10 мкл). После проведения реакции при 37°С в течение 2 ч определяли свободные жирные кислоты (NEFA), образовавшиеся из VLDL, при участии ферментов HL или LPL, с использованием NEFA C-теста Wako (Wako), количество NEFA использовали в качестве показателя активности фермента. Ферментативную активность в случае без добавления анти-EL-антитела использовали в качестве контрольного значения и специфическую активность рассчитывали против контрольного значения при каждой концентрации антитела (фиг. 2А-К). Для сравнения результаты описывали расположением рядом друг с другом кривых ингибирования EL обезьяны циномолгус. В результате было показано, что антитела 55А1, 7D4, 14A1, 2D5, 53A11, 13B3, 23H8, 16В3, 16E7, 14E1, 19E7 и 16F6 не ингибировали ферментативной активности ни HL, ни LPL.
Пример 8
Определение связывающей активности анти-EL-антител с EL
Буфер для анализа, содержащий 15 мкл анти-EL-антитела, добавляли в микротитрационный планшет с иммобилизованным антимышиным IgG-Fc и инкубировали в течение 2 ч. После промывания лунок три раза 90 мкл буфера для промывания добавляли 15 мкл экстракта с гепарином EL обезьяны циномолгус, EL павиана, кроличьей EL, мышиной EL, химерной EL человек[1-157]мышь, химерной EL человек[1-305]мышь или химерной EL человек[202-500]мышь и инкубировали при 4°С в течение 16 ч. После промывания лунок три раза 90 мкл буфера для промывания в лунки добавляли 15 мкл буфера для анализа, содержащего меченное биотином антитело к С2-метке и меченный ПХ стрептавидин, и инкубировали при комнатной температуре в течение 1 ч. После промывания лунок три раза 90 мкл буфера для промывания добавляли 15 мкл ТМВ+субстрат-хромоген (DAKO) и инкубировали при комнатной температуре в течение 30 мин и затем добавляли 15 мкл 0,05 М H2SO4 и измеряли поглощение при длине волны 450 нм (фиг. 3А-К).
В результате было установлено, что антитела 55А1, 7D4, 14A1, 2D5, 53A11, 13B3 и 23H8 связывались с EL обезьяны циномолгус, EL павиана и химерной EL человек[1-157]мышь, но не связывались с мышиной EL. Кроме того, антитела 13B3 и 23H8 связывались с кроличьей EL, но антитела 55А1, 7D4, 14A1, 2D5 и 53A11 - нет. С другой стороны, антитела 16В3, 16Е7, 14Е1 и 19Е7 связывались с EL обезьяны циномолгус, EL павиана, химерной EL человек[1-305]мышь и химерной EL человек[205-500]мышь, но не связывались с мышиной EL и химерной EL человек[1-157]мышь. Кроме того, антитела 16В3, 14Е1 и 19Е7 связывались с кроличьей EL, но антитело 16Е7 - нет.
Пример 9
Аффинность связывания анти-EL-антител
Аффинность связывания анти-EL-антител определяли с использованием Biacore. Антитело к С2-метке иммобилизовали на сенсорном чипе СМ5 (GE HealthCare) с использованием аминного сочетания, и экстракты с гепарином EL павиана, EL обезьяны циномолгус или химерной EL человек[1-305]мышь и EL захватывались на сенсорном чипе. Затем добавляли анти-EL-антитела и рассчитывали аффинность связывания с использованием программного обеспечения с бивалентной подстановкой данных BIAevaluation. Результаты приведены в таблицах 1-3.
|
|
|
По результатам примеров 5, 6, 8 и 9 были обобщены свойства анти-EL-антител, и они представлены в таблице 4.
|
Пример 10
Получение анти-EL-антитела, которое нейтрализует EL человека и мыши
Получали аденовирус, который экспрессирует мышиную EL, с использованием того же метода, который описан в примере 1, и иммунизировали мышей с нокаутом гена EL. Аналогично тому, как описано в примерах 4 и 5, получали анти-EL-антитело (16F6), и подкласс был определен как IgG1. Определяли нейтрализующую активность и аффинность связывания 16F6, и результаты приведены в таблицах 5 и 6.
|
|
Пример 11
Определение областей EL, которые участвуют в связывании антитела
Определяли область EL, которая принимает участие в связывании антитела, сканирующим гомологию мутагенезом или аланин-сканирующим мутагенезом. Связывающую активность анти-EL-антитела с мутантом EL анализировали с использованием ELIA. Аминокислотные остатки EL павиана мутировали в аланин с использованием набора для сайт-направленного мутагенеза QuickChange (Agilent Technologies), но аминокислотные остатки, которые отличались от EL павиана и мышиной EL, мутировали в аминокислотные остатки мышиной EL. Готовили экстракты мутированной EL с гепарином и определяли связывающую активность с анти-EL-антителом, как описано в примере 2 и примере 8. Относительный эффект каждой мутации оценивали по следующей формуле ([концентрация антитела, где А450 равно 1,0]-мутированная EL)/([концентрация антитела, где А450 равно 1,0]-EL дикого типа]. Относительная связывающая активность мутированной EL павиана с анти-EL-антителами (55А1, 7D4, 14A1, 2D5, 53A11, 13B3, 23H8, 16В3, 16E7, 14E1 и 19E7) показана на фигурах 7A-L.
Из данных, представленных на фиг. 7A-G, следует, что важными аминокислотами в связывании антитела 55А1, 7D4, 14A1, 2D5, 53A11, 13B3 и 23H8 и EL являются аргинин в положении 50, глутаминовая кислота в положении 60, гистидин в положении 61, тирозин в положении 65 и аспарагин в положении 100 в аминокислотной последовательности SEQ ID NO:1.
Из данных, представленных на фиг. 7H-K, следует, что важными аминокислотами в связывании антитела 16В3, 16E7, 14E1 или 19E7 и EL являются гистидин в положении 220, треонин в положении 221, тирозин в положении 222, треонин в положении 223, аргинин в положении 224, фенилаланин в положении 226, глицин в положении 227, глицин в положении 231, изолейцин в положении 232, глутамин в положении 233, метионин в положении 234, аспарагиновая кислота в положении 240, тирозин в положении 242, пролин в положении 243, аспарагин в положении 244, глицин в положении 246, глутамин в положении 249, пролин в положении 250, глицин в положении 251, лейцин в положении 254, лейцин в положении 258, тирозин в положении 263, тирозин в положении 263, валин в положении 269 и глутаминовая кислота в положении 273 в аминокислотной последовательности SEQ ID NO:1.
Пример 12
Анализ аминокислотной последовательности вариабельной области анти-EL-антител
Аминокислотную последовательность вариабельной области анти-EL-антитела определяли с использованием обычной процедуры, и она представлена на фиг. 4А-L.
Пример 13
Выравнивание аминокислотных последовательностей вариабельной области антител 55A1, 7D4, 2D5, 53A11, 13B3 и 23H8
Аминокислотные последовательности вариабельной области антител 55A1, 7D4, 2D5, 53A11, 13B3 и 23H8 выравнивали с использованием программного обеспечения GENETYX (фиг. 5A-D). На фиг. 5А и 5В показано, что все шесть CDR тяжелой цепи и легкой цепи антител 55A1, 7D4, 14А1 и 2D5 имели высокую степень сходства. На фиг. 5С показано, что CDR1 и CDR2 тяжелой цепи 55A11, 13В3 и 23H8 имели высокую степень сходства.
Анализ CDR тяжелой и легкой цепи антител 55A1, 7D4, 14А1 и 2D5 выявил следующие факты.
Аминокислотные последовательности CDR1 тяжелой цепи состояли из 5 аминокислот NYGMN.
Аминокислотные последовательности CDR2 тяжелой цепи состояли из 17 аминокислот WINTYSGVPTY (А или Т)(G или D)DFKG.
Аминокислотные последовательности CDR3 тяжелой цепи состояли из 11 аминокислот (R или F)(G или S)YYGR(R или H)YFD(V или Y).
Аминокислотные последовательности CDR1 легкой цепи состояли из 15 аминокислот KASQSVDYD (V или G)DSYM(H или N).
Аминокислотные последовательности CDR2 легкой цепи состояли из 7 аминокислот AASNLXS. «Х» представляет данную аминокислоту.
Аминокислотные последовательности CDR3 легкой цепи состояли из 10 аминокислот (H или Q)Q(T или S)(I или T или N)(E или D)DPP (- или W)T. «-» представляет делецию аминокислоты.
Анализ CDR тяжелой и легкой цепи антител 53А11, 13В3 и 23Н8 выявил следующие факты.
Аминокислотные последовательности CDR1 тяжелой цепи состояли из 5 аминокислот (D или E)(Y или N)T(M или I)H.
Аминокислотные последовательности CDR2 тяжелой цепи состояли из 17 аминокислот XINPYYGGTX (Y или N)NEKFKD. «Х» представляет данную аминокислоту.
В CDR3 тяжелой цепи отсутствовала совместимость аминокислотных остатков.
Пример 14
Выравнивание аминокислотных последовательностей вариабельной области антител 16В3, 16Е7, 14Е1 и 19Е7
Аминокислотные последовательности вариабельной области антител 16В3, 16Е7, 14Е1 и 19Е7 выравнивали с использованием программного обеспечения GENETYX (фиг. 6A-D). На фиг. 6А и 6В показано, что все шесть CDR тяжелой цепи и легкой цепи антител 16В3 и 16Е7 имели высокую степень сходства.
Анализ CDR тяжелой и легкой цепи антител 16В3, 16Е7, 14Е1 и 19Е7 выявил следующие факты.
Аминокислотные последовательности CDR1 тяжелой цепи состояли из 5 аминокислот (G или S)YTMS.
Аминокислотные последовательности CDR2 тяжелой цепи состояли из 17 аминокислот EISF(А или Т)(D или S)RAFYPDTVKG.
Аминокислотные последовательности CDR3 тяжелой цепи состояли из 13 аминокислот LGG(R или N)N(H или Y)DYWYFDV.
Аминокислотные последовательности CDR1 легкой цепи состояли из 15 аминокислот RASESVEYYGTSLMQ.
Аминокислотные последовательности CDR2 легкой цепи состояли из 7 аминокислот AASNVES.
Аминокислотные последовательности CDR3 легкой цепи состояли из 9 аминокислот QQSWKVPFT.
Промышленная применимость
Моноклональное антитело, которое ингибирует ферментативную активность сосудистой эндотелиальной липазы по настоящему изобретению, является пригодным в качестве лекарственного препарата для профилактики и/или лечения дислипидемии, гиперлипидемии, артериосклероза, атеросклероза, гиперхолестеринемии, гипертриглицеридемии, диабета, ожирения и/или синдрома Х, поскольку моноклональное антитело по изобретению обладает способностью специфически связываться с сосудистой эндотелиальной липазой.