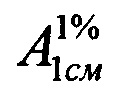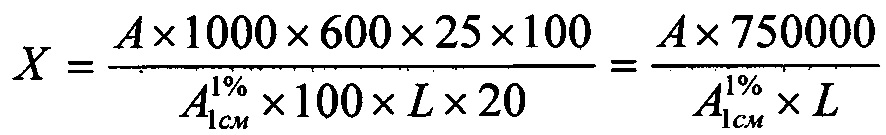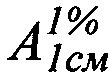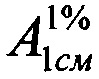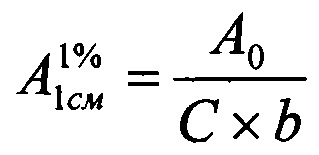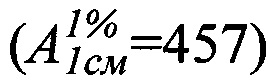Результат интеллектуальной деятельности: Способ количественного определения фенобарбитала в таблетках "Корвалол" способом УФ-спектрофотометрии с использованием удельного показателя поглощения
Вид РИД
Изобретение
Область техники
Изобретение относится к области фармацевтического анализа и может быть использовано для анализа таблеток «Корвалол» по показателям качества: «Растворение», «Однородность дозирования», «Количественное определение».
Уровень техники
Корвалол - комбинированный препарат, действие которого обусловлено свойствами входящих в его состав веществ. Оказывает седативное и спазмолитическое действие. Облегчает наступление естественного сна.
Входящие в состав препарата компоненты обеспечивают следующее действие:
- этилбромизовалерианат (этиловый эфир альфа-бромизовалериановой кислоты) обладает седативным (подобно эффекту валерианы) и спазмолитическим действием, обусловленным раздражением преимущественно рецепторов полости рта и носоглотки, снижением рефлекторной возбудимости в центральных отделах нервной системы и усилением торможения в нейронах коры и подкорковых структурах головного мозга, а также снижением активности центральных сосудодвигательных центров и прямым местным спазмолитическим действием на гладкую мускулатуру;
- фенобарбитал усиливает седативное влияние других компонентов, способствует снижению возбуждения центральной нервной системы (ЦНС) и облегчает наступление сна;
- мяты перечной масло оказывает рефлекторное вазодилатирующее, спазмолитическое, легкое желчегонное, антисептическое действие. Механизм действия связан со способностью раздражать «холодовые» рецепторы слизистой оболочки полости рта и рефлекторно расширять преимущественно сосуды сердца и головного мозга. Устраняет явления метеоризма за счет раздражения рецепторов слизистой оболочки желудочно-кишечного тракта (ЖКТ), усиливая перистальтику кишечника.
Из уровня техники в настоящее время не известно о существовании фармакопейных монографий на таблетки «Корвалол». В ведущих фармакопеях мира (Американская фармакопея, Британская фармакопея) описаны различные фенобарбиталсодержащие препараты. Методы количественного определения фенобарбитала в данных препаратах подразумевают использование фармакопейного стандартного образца фенобарбитала.
Вместе с тем использование фармакопейных стандартных образцов фенобарбитала в методиках анализа разрешено не каждой лаборатории, т.к. оборот фенобарбитала в настоящее время ограничен (ограничение относится, в том числе и к фармакопейным стандартным образцам). Конвенцией о психотропных веществах фенобарбитал включен в список IV. Постановлением Правительства РФ от 4 февраля 2013 г. №78 фенобарбитал внесен в Перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации (Список III - психотропные вещества, оборот которых в Российской Федерации ограничен и в отношении которых допускается исключение некоторых мер контроля).
В соответствии с действующим законодательством (Федеральный закон №3-ФЗ от 08.01.1998 г. «О наркотических средствах и психотропных веществах») оборот данного вещества предусматривает такие меры контроля, как: распределение, ввоз (вывоз), уничтожение; лицензирование всех видов деятельности, связанных с оборотом психотропных веществ (от разработки до уничтожения); оформление допуска к работе работников, осуществляющих оборот психотропных веществ; определение производства, хранения, ввоза (вывоза) данных веществ в пределах государственных квот; хранение веществ в специально оборудованном помещении в порядке, установленном Правительством Российской Федерации; охрана перевозимого груза или привлечение специализированной охраны при перевозке данных веществ; уголовная ответственность за выдачу рецепта на психотропное вещество без соответствующих медицинских показаний или с нарушением установленных правил оформления; запрещение использования данных веществ в медицинской деятельности частнопрактикующих врачей; предоставление отчетов об обороте указанных веществ; проведение ежемесячной инвентаризации с составлением баланса товарно-материальных ценностей; регистрация операций, связанных со всеми видами оборота данных веществ, в специальных журналах и др.
Препарат «Корвалол» достаточно хорошо известен потребителю и широко используется в медицинской практике в качестве седативного и спазмолитического средства, применяющегося при повышенной нервной возбудимости, нарушениях сна, бессоннице, раздражительности, чувстве внутреннего напряжения и т.д.
Вместе с тем, вышеуказанные требования к группе веществ фенобарбитала значительно усложняют не только оборот данного препарата, связанный с его производством и отпуском из аптек, но и его лабораторный анализ.
Данное изобретение позволяет проанализировать таблетки «Корвалол» без использования фенобарбитала, что оказывается очень удобным в рутинных лабораторных анализах, поскольку не возникает потребностей в покупке фенобарбитала, его правильном законном хранении и списании.
Задачей настоящего изобретения является разработка способа определения количественного содержания фенобарбитала в таблетках «Корвалол» без использования стандартных образцов фенобарбитала.
Техническим результатом изобретения является разработка УФ-спектрофотометрического способа определения фенобарбитала в таблетках «Корвалол» с использованием удельного показателя поглощения фенобарбитала 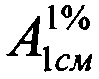 , полученного экспериментальным путем, который составил 457.
, полученного экспериментальным путем, который составил 457.
При эксперементальном установлении данного значения использование фенобарбитала требуется однакратно. В последующем, по установлении указанного значения, в соответствии с задачей настоящего изобретения, использование образцов и стандартов фенобарбитала не требуется.
Авторы данного изобретения провели эксперименты, устанавливающие значение удельного показателя поглощения фенобарбитала  , которое составило 457.
, которое составило 457.
Раскрытие изобретения.
Способ определения удельного показателя поглощения фенобарбитала:
Готовят 0,2 М раствора натрия гидроксида. 8,0 г натрия гидроксида растворяют в воде, свободной от углерода диоксида, доводят объем раствора до 1000,0 мл и перемешивают.
Раствор хранят при температуре 4-8°С в течение 1 мес.
Готовят 0,2 М раствора борной кислоты и калия хлорида: 12,37 г борной кислоты и 14,91 г калия хлорида растворяют в воде, доводят объем раствора водой до 1000,0 мл и перемешивают.
Раствор используют свежеприготовленным.
Готовят щелочный боратный буферный раствор рН 9,6. 50 мл 0,2 М раствора борной кислоты и калия хлорида помещают в мерную колбу вместимостью 200 мл, прибавляют 36,9 мл 0,2 М раствора натрия гидроксида, доводят объем раствора водой до метки и перемешивают. Если необходимо, доводят рН до 9,6 с помощью 0,2 М раствора натрия гидроксида или 0,2 М раствора борной кислоты и калия хлорида.
Раствор используют свежеприготовленным.
Готовят серию стандартных растворов фенобарбитала.
1. Раствор стандартного образца фенобарбитала (0,005 мг/мл).
Около 12,5 мг (точная навеска) фенобарбитала помещают в мерную колбу вместимостью 50 мл, прибавляют 25 мл щелочного боратного буферного раствора рН 9,6, обрабатывают ультразвуком в течение 5 мин, раствор охлаждают до комнатной температуры, доводят объем раствора тем же растворителем до метки и перемешивают. (0,25 мг/мл)
1,0 мл полученного раствора переносят в мерную колбу вместимостью 50 мл, прибавляют 40 мл воды, доводят объем раствора щелочным боратным буферным раствором рН 9,6 до метки и перемешивают. Раствор используют свежеприготовленным. (0,005 мг/мл)
2. Раствор стандартного образца фенобарбитала (0,007 мг/мл).
Около 17,5 мг (точная навеска) фенобарбитала помещают в мерную
колбу вместимостью 50 мл, прибавляют 25 мл щелочного боратного буферного раствора рН 9,6, обрабатывают ультразвуком в течение 5 мин, раствор охлаждают до комнатной температуры, доводят объем раствора тем же растворителем до метки и перемешивают.(0,35 мг/мл)
1,0 мл полученного раствора переносят в мерную колбу вместимостью 50 мл, прибавляют 40 мл воды, доводят объем раствора щелочным боратным буферным раствором рН 9,6 до метки и перемешивают. Раствор используют свежеприготовленным. (0,007 мг/мл)
3. Раствор стандартного образца фенобарбитала (0,008 мг/мл).
Около 20,0 мг (точная навеска) фенобарбитала помещают в мерную колбу вместимостью 50 мл, прибавляют 25 мл щелочного боратного буферного раствора рН 9,6, обрабатывают ультразвуком в течение 5 мин, раствор охлаждают до комнатной температуры, доводят объем раствора тем же растворителем до метки и перемешивают.(0,4 мг/мл)
1,0 мл полученного раствора переносят в мерную колбу вместимостью 50 мл, прибавляют 40 мл воды, доводят объем раствора щелочным боратным буферным раствором рН 9,6 до метки и перемешивают. Раствор используют свежеприготовленным. (0,008 мг/мл)
4. Раствор стандартного образца фенобарбитала (0,009 мг/мл).
Около 22,5 мг (точная навеска) фенобарбитала помещают в мерную колбу вместимостью 50 мл, прибавляют 25 мл щелочного боратного буферного раствора рН 9,6, обрабатывают ультразвуком в течение 5 мин, раствор охлаждают до комнатной температуры, доводят объем раствора тем же растворителем до метки и перемешивают. (0,45 мг/мл)
1,0 мл полученного раствора переносят в мерную колбу вместимостью 50 мл, прибавляют 40 мл воды, доводят объем раствора щелочным боратным буферным раствором рН 9,6 до метки и перемешивают. Раствор используют свежеприготовленным. (0,009 мг/мл)
5. Раствор стандартного образца фенобарбитала (0,01 мг/мл).
Около 12,5 мг (точная навеска) фенобарбитала помещают в мерную колбу вместимостью 25 мл, прибавляют 15 мл щелочного боратного буферного раствора рН 9,6, обрабатывают ультразвуком в течение 5 мин, раствор охлаждают до комнатной температуры, доводят объем раствора тем же растворителем до метки и перемешивают.(0,5 мг/мл)
1,0 мл полученного раствора переносят в мерную колбу вместимостью 50 мл, прибавляют 40 мл воды, доводят объем раствора щелочным боратным буферным раствором рН 9,6 до метки и перемешивают. Раствор используют свежеприготовленным. (0,01 мг/мл). Готовят шесть растворов для проверки воспроизводимости.
6. Раствор стандартного образца фенобарбитала (0,011 мг/мл).
Около 11,0 мг (точная навеска) фенобарбитала помещают в мерную колбу вместимостью 20 мл, прибавляют 10 мл щелочного боратного буферного раствора рН 9,6, обрабатывают ультразвуком в течение 5 мин, раствор охлаждают до комнатной температуры, доводят объем раствора тем же растворителем до метки и перемешивают.(0,55 мг/мл)
1,0 мл полученного раствора переносят в мерную колбу вместимостью 50 мл, прибавляют 40 мл воды, доводят объем раствора щелочным боратным буферным раствором рН 9,6 до метки и перемешивают. Раствор используют свежеприготовленным. (0,011 мг/мл)
7. Раствор стандартного образца фенобарбитала (0,012 мг/мл).
Около 15,0 мг (точная навеска) фенобарбитала помещают в мерную колбу вместимостью 25 мл, прибавляют 15 мл щелочного боратного буферного раствора рН 9,6, обрабатывают ультразвуком в течение 5 мин, раствор охлаждают до комнатной температуры, доводят объем раствора тем же растворителем до метки и перемешивают. (0,6 мг/мл)
1,0 мл полученного раствора переносят в мерную колбу вместимостью 50 мл, прибавляют 40 мл воды, доводят объем раствора щелочным боратным буферным раствором рН 9,6 до метки и перемешивают. Раствор используют свежеприготовленным. (0,012 мг/мл)
8. Раствор стандартного образца фенобарбитала (0,014 мг/мл).
Около 17,5 мг (точная навеска) фенобарбитала помещают в мерную колбу вместимостью 25 мл, прибавляют 15 мл щелочного боратного буферного раствора рН 9,6, обрабатывают ультразвуком в течение 5 мин, раствор охлаждают до комнатной температуры, доводят объем раствора тем же растворителем до метки и перемешивают. (0,7 мг/мл)
1,0 мл полученного раствора переносят в мерную колбу вместимостью 50 мл, прибавляют 40 мл воды, доводят объем раствора щелочным боратным буферным раствором рН 9,6 до метки и перемешивают. Раствор используют свежеприготовленным. (0,014 мг/мл)
Готовят растворитель.
10,0 мл щелочного боратного буферного раствора рН 9,6 помещают в мерную колбу вместимостью 50 мл, доводят объем раствора водой до метки и перемешивают.
Раствор используют свежеприготовленным.
Измеряют оптическую плотность растворов СО фенобарбитала на спектрофотометре в максимуме поглощения при длине волны 240±2 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют растворитель.
Концентрацию фенобарбитала в растворах в г/100 мл (%) (С) вычисляют по формуле:
 ,
,
где а0 - навеска фенобарбитала, мг;
V1 - объем мерной колбы, взятой для разведения (1 этап);
Р - содержание фенобарбитала в субстанции, в пересчете на сухое вещество;
1000 - пересчет мг в г.
Удельный показатель поглощения фенобарбитала  вычисляют по формуле:
вычисляют по формуле:
 ,
,
где А0 - оптическая плотность раствора стандартного образца фенобарбитала;
С - концентрация фенобарбитала, г/100 мл (%);
b - длина оптического пути или толщина слоя, см.
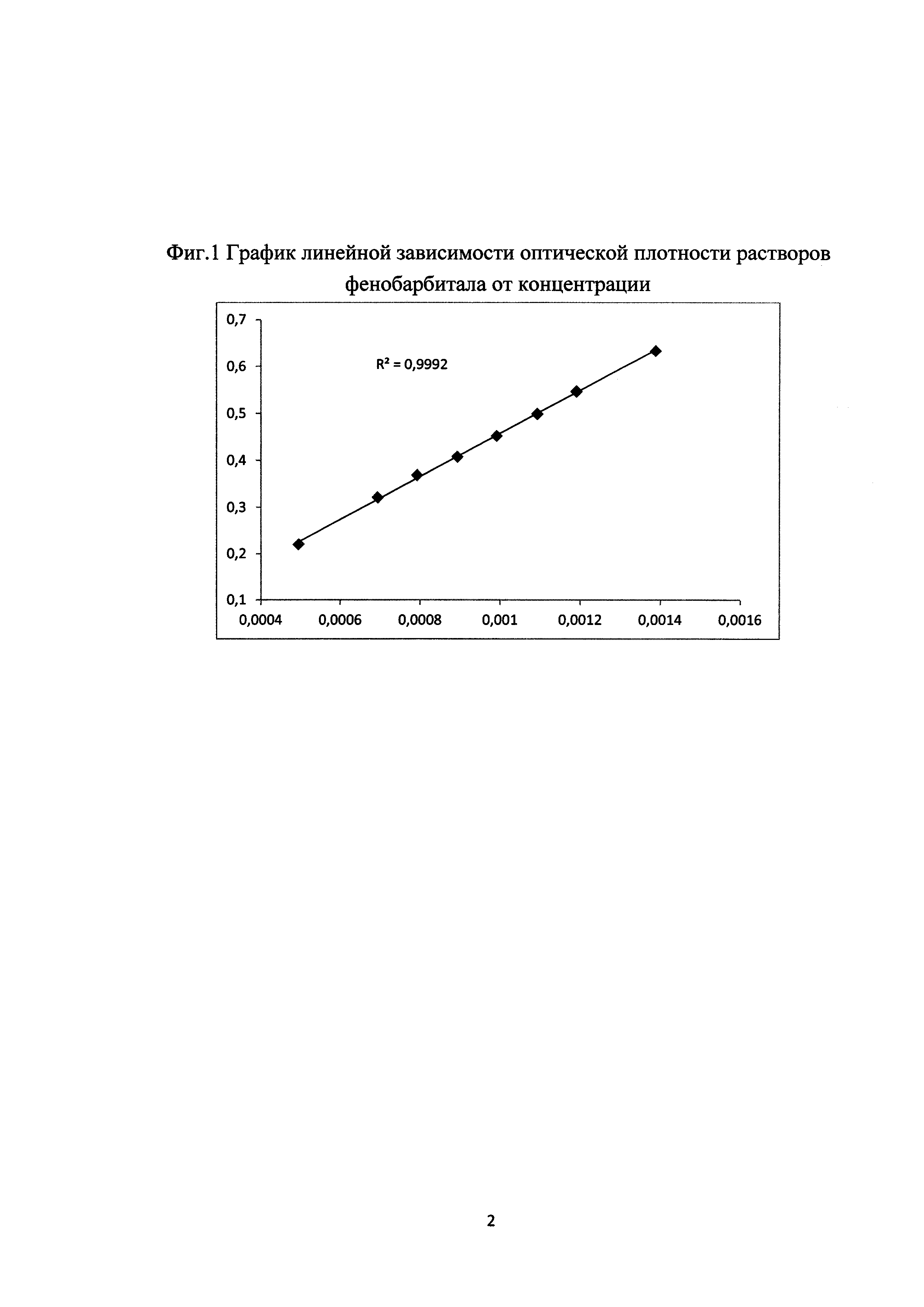
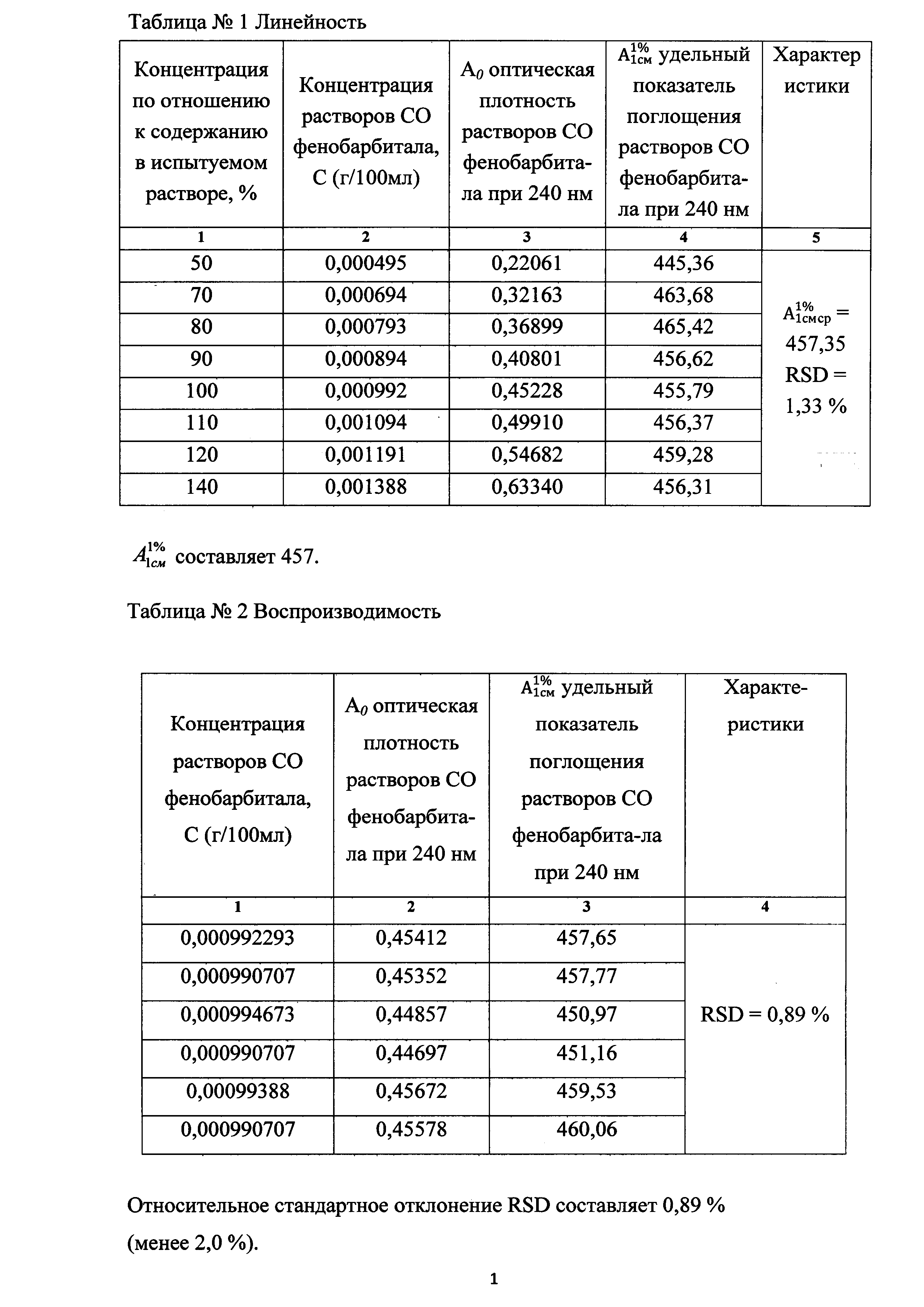
Все полученные результаты представлены в таблице 1 и на фиг. 1
Измеряют оптическую плотность шести приготовленных растворов стандартного образца фенобарбитала 0,01 мг/мл. Результаты по воспроизводимости представлены в таблице 2.
Таким образом, экспериментальным путем было установлено значение удельного показателя поглощения фенобарбитала, которое составило 457. На основании данного удельного показателя поглощения рассчитывается содержание фенобарбитала в таблетках «Корвалол».
Применяя полученный удельный показатель поглощения к способам анализа, получили следующие способы.
Растворение. Испытание проводят в соответствии с требованиями ГФ XIII, ОФС.1.4.2.0014.15 «Растворение для твердых дозированных лекарственных форм», используя прибор типа «Вращающаяся корзинка». Способ определения УФ-спектрофотометрия.
Среда растворения - вода, объем среды растворения - 600 мл, скорость вращения корзинки - 100 об/мин, время растворения - 45 мин.
В сосуд для растворения помещают одну таблетку; через 45 минут отбирают пробу раствора объемом 50 мл и фильтруют через мембранный фильтр из регенерированной целлюлозы с диаметром пор 0,45 мкм, отбрасывая первые 5 мл фильтрата. 20,0 мл полученного фильтрата переносят в мерную колбу вместимостью 25 мл, доводят объем раствора щелочным боратным буферным раствором рН 9,6 до метки и перемешивают (испытуемый раствор).
Измеряют оптическую плотность испытуемого раствора на спектрофотометре в максимуме поглощения при длине волны 240±2 нм в кювете с толщиной слоя 10 мм.
В качестве раствора сравнения используют растворитель.
Количество C12H12N2O3 (фенобарбитала), перешедшего в раствор из таблетки, в процентах (X) вычисляют по формуле:
 ,
,
где А - оптическая плотность испытуемого раствора;
 - удельный показатель поглощения фенобарбитала (
- удельный показатель поглощения фенобарбитала ( =457);
=457);
L - заявленное содержание фенобарбитала в таблетке, мг.
Через 45 мин в раствор должно перейти не менее 75% (Q) C12H12N2O3 (фенобарбитала) от заявленного содержания.
Однородность дозирования.
Фенобарбитал
Испытание проводят в соответствии с требованиями ГФ XIII, ОФС.1.4.2.0008.15 «Однородность дозирования», (способ 1), методом УФ-спектрофотометрии.
Норма: С12Н12N2О3 (фенобарбитала) в каждой таблетке, подвергнутой испытанию, должно соответствовать требованиям ГФ XIII, ОФС.1.4.2.0008.15 «Однородность дозирования».
Приготовление растворов.
Испытуемый раствор. Одну таблетку помещают в мерную колбу вместимостью 50 мл, прибавляют 35 мл щелочного боратного буферного раствора рН 9,6, обрабатывают ультразвуком в течение 40 мин, взбалтывают на орбитальном шейкере при 350 об/мин в течение 20 мин, охлаждают раствор до комнатной температуры. Доводят объем раствора тем же растворителем до метки, перемешивают и фильтруют через мембранный фильтр из регенерированной целлюлозы с диаметром пор 0,45 мкм, отбрасывая первые 1 мл фильтрата.
2,0 мл полученного фильтрата переносят в мерную колбу вместимостью 25 мл, прибавляют 20 мл воды, доводят объем раствора щелочным боратным буферным раствором рН 9,6 до метки и перемешивают.
Раствор используют свежеприготовленным.
Измеряют оптическую плотность испытуемого раствора на спектрофотометре в максимуме поглощения при длине волны 240±2 нм в кювете с толщиной слоя 10 мм.
В качестве раствора сравнения используют растворитель.
Содержание C12H12N2O3 (фенобарбитала) в одной таблетке в процентах (X) вычисляют по формуле:
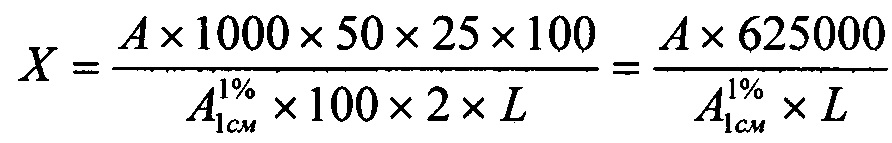
где А - оптическая плотность испытуемого раствора;
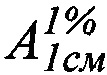 - удельный показатель поглощения фенобарбитала (
- удельный показатель поглощения фенобарбитала (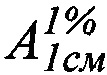 = 457);
= 457);
L - заявленное содержание фенобарбитала в таблетке, мг.
Количественное определение. Фенобарбитал.
Определение проводят методом УФ-спектрофотометрии.
Испытуемый раствор. Отбирают 20 таблеток, взвешивают с точностью до 0,001 г, определяют среднюю массу, тщательно растирают в порошок.
Около 1333,33 мг (точная навеска) порошка 20 растертых таблеток помещают в мерную колбу вместимостью 250 мл, прибавляют 180 мл щелочного боратного буферного раствора рН 9,6, обрабатывают ультразвуком в течение 40 мин, взбалтывают на орбитальном шейкере при 350 об/мин в течение 20 мин, охлаждают раствор до комнатной температуры. Доводят объем раствора тем же растворителем до метки, перемешивают и фильтруют через мембранный фильтр из регенерированной целлюлозы с диаметром пор 0,45 мкм, отбрасывая первые 1 мл фильтрата.
5,0 мл полученного фильтрата помещают в мерную колбу вместимостью 100 мл, прибавляют 80 мл воды, доводят объем раствора щелочным боратным буферным раствором рН 9,6 до метки и перемешивают.
Измеряют оптическую плотность испытуемого раствора на спектрофотометре в максимуме поглощения при длине волны 240±2 нм в кювете с толщиной слоя 10 мм.
В качестве раствора сравнения используют растворитель.
Содержание C12H12N2O3 (фенобарбитала) в таблетке в миллиграммах (X) вычисляют по формуле:
 ,
,
где А - оптическая плотность испытуемого раствора;
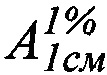 - удельный показатель поглощения фенобарбитала (
- удельный показатель поглощения фенобарбитала (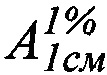 =457);
=457);
а - навеска порошка растертых таблеток, мг;
G - средняя масса таблетки, мг.
Содержание C12H12N2O3 (фенобарбитала) должно быть от 6,75 мг до 8,25 мг, считая на среднюю массу таблетки.
Таким образом, в соответствии с заявленными задачей и техническим результатом настоящего изобретения, был определен удельный показатель поглощения фенобарбитала  , составляющий 457, который может быть использован при УФ-спектрофотометрическом способе определения фенобарбитала в таблетках «Корвалол» без использования стандартных образцов фенобарбитала.
, составляющий 457, который может быть использован при УФ-спектрофотометрическом способе определения фенобарбитала в таблетках «Корвалол» без использования стандартных образцов фенобарбитала.