ЛИПИДНЫЕ НАНОЧАСТИЦЫ ДЛЯ РАНОЗАЖИВЛЕНИЯ
Вид РИД
Изобретение
Область настоящего изобретения
Настоящее изобретение относится к липидным наночастицам и их применению в качестве фармацевтических композиций для ранозаживления, прежде всего в виде суспензий, повязок или гелей, содержащих наночастицы, для местного нанесения.
Предпосылки создания настоящего изобретения
Лечение застарелых ран становится основной проблемой систем здравоохранения по всему миру, которая представляет собой серьезные экономические трудности и озабоченность учреждений здравоохранения. В настоящее время возрастающее воздействие факторов риска, таких как старение населения, курение, диабет и ожирение, может затруднять и замедлять процесс ранозаживления, что вызывает развитие труднозаживляемых ран.
В настоящее время для лечения застарелых ран у пожилых пациентов применяют ряд курсов паллиативного лечения, включая кислород при повышенном давлении, отрицательное давление и хирургическую обработку раны. Кроме того, на рынке имеется широкий спектр синтетических повязок для лечения хронических язв, хотя и отмечается их ограниченный лечебный эффект.
Эпидермальный фактор роста (EGF) играет важную роль в регенерации и восстановлении тканей благодаря стимуляции миграции, дифференциации и пролиферации клеток, а также благодаря ускорению образования грануляционной ткани. В клинике EGF используют для ускорения ранозаживления, прежде всего диабетической язвы стопы. В ходе клинических испытаний были получены данные о благоприятном действии после местного введения EGF при лечении нейропатических язв низкой степени, однако действие местных EGF-содержащих составов может снижаться, прежде всего при лечении ран тяжелой степени, так как в ранах такого типа была обнаружена повышенная протеазная активность. В Индии для лечения диабетических язв I и II степени выпускается гель Rengen-D 150™, содержащий 150 мкг/г рекомбинантного эпидермального фактора роста человека (rhEGF). При этом требуется введение два раза в день, а среднее время лечения составляет 6 недель. Лиофилизированный состав Heberprot®, содержащий 75 мкг rhEGF, вводят три раза в неделю с помощью внутриочаговых инъекций. Этот состав выпускается в Алжире, Аргентине, Колумбии, Кубе, Доминиканской республике и Венесуэлле. По данным пилотных испытаний, проведенных с участием 20 пациентов с диагнозом диабета, было установлено, что Heberprot® обеспечивает приемлемое и безопасное лечение, ускоряя ранозаживление у пациентов с застарелыми язвами на всю толщину кожи. Однако для повышения митогенного эффекта на эпителиальные клетки в связи с коротким периодом полураспада rhEGF требуется обеспечивать его непрерывное воздействие (по крайней мере 6-12 ч). Следовательно, для достижения значительного терапевтического действия при ранозаживлении требуется оптимизировать способ введения ростовых факторов, таких как rhEGF, то есть с учетом дозы, системы доставки и безопасности. С этой целью был разработан способ получения наночастиц на основе сополимера молочной и гликолевой кислот (PLGA), содержащих 2% rhEGF, как описано в статье Chu et al., Nanotechnology promotes the full-thickness diabetic wound healing effect of recombinant human epidermal growth factor in diabetic rats, Wound Repair Regen 15:499-505 (2010)). Степень включения rhEGF составляла 85,6% и препарат обеспечивал контролируемое высвобождение биологически активного rhEGF в течение вплоть до 24 ч. Местное нанесение таких наночастиц на раны на полную толщину кожи один раз в день диабетическим крысам индуцирует более высокие уровни пролиферации фибробластов и обеспечивает наиболее быстрое заживление по сравнению с неинкапсулированным rhEGF.
Кроме того, в патенте EP 1987817 В1 описан способ получения полимерных микросфер, содержащих rhEGF, для внутриочаговой инфильтрации в нижние конечности пациентов с диабетом, чтобы предотвратить ампутацию конечностей при диабете. Было установлено, что разработанные микросферы, содержащие 1,6-2,4% rhEGF, обеспечивают контролируемое высвобождение rhEGF на уровне 5 и 10 мкг в день в течение 14 дней и более быстрое заживление травм у людей по сравнению с эквивалентным количеством неинкапсулированного rhEGF.
Неожиданно авторами были разработаны липидные наночастицы, включающие эпидермальный фактор роста с высокой степенью включения, которые при нанесении в виде состава для местного применения два раза в неделю, улучшают ранозаживление.
Краткое описание сущности настоящего изобретения
В одном объекте настоящего изобретения предлагается липидная наночастица (наночастица по настоящему изобретению), которая включает по крайней мере один твердый при комнатной температуре липид, по крайней мере одно неионное ПАВ и один фактор роста.
В другом объекте предлагается способ получения липидной наночастицы по настоящему изобретению, который отличается тем, что включает следующие стадии:
(i) получение водного раствора, включающего неионное ПАВ,
(ii) получение липофильного раствора, включающего твердый при комнатной температуре липид в органическом растворителе,
(iii) добавление водного раствора (i) к липофильному раствору (ii), обработка полученной смеси ультразвуком до образования эмульсии,
(iv) упаривание полученной на стадии (iii) эмульсии для удаления органического растворителя и
(v) сбор липидных наночастиц,
при этом фактор роста добавляют в раствор (ii).
В еще одном объекте предлагается фармацевтическая композиция (фармацевтическая композиция по настоящему изобретению), включающая липидную наночастицу по настоящему изобретению и фармацевтический носитель.
В другом объекте предлагается липидная наночастица по настоящему изобретению и включающая ее фармацевтическая композиция по настоящему изобретению, предназначенная для применения при ранозаживлении.
Другие объекты, признаки, преимущества и аспекты настоящего изобретения представляются очевидными для специалистов в данной области техники после прочтения следующего описания и прилагаемой формулы изобретения.
Краткое описание фигур
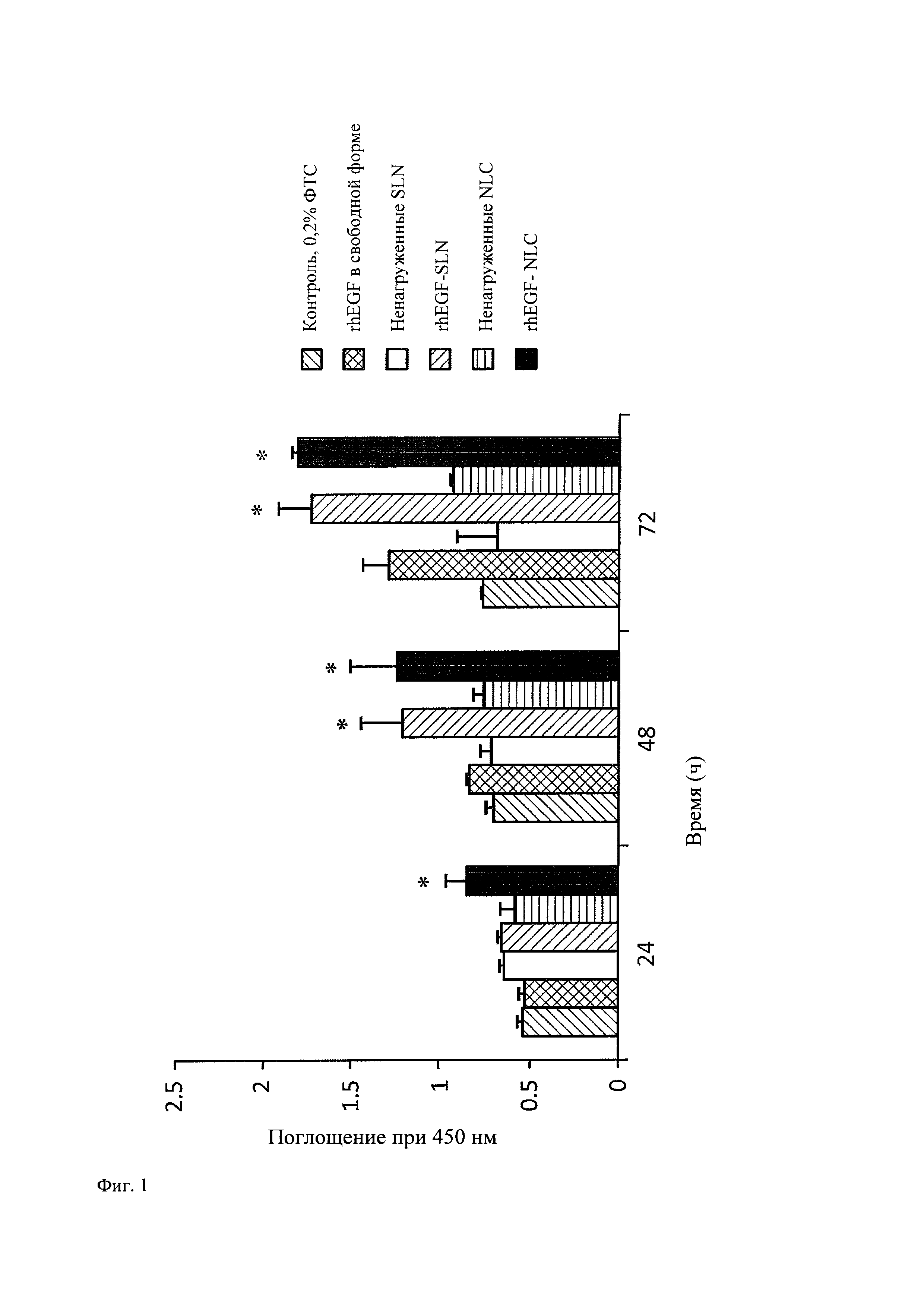
На фиг. 1 показано графическое представление действия in vitro rhEGF-нагруженных липидных наночастиц на клеточную пролиферацию.
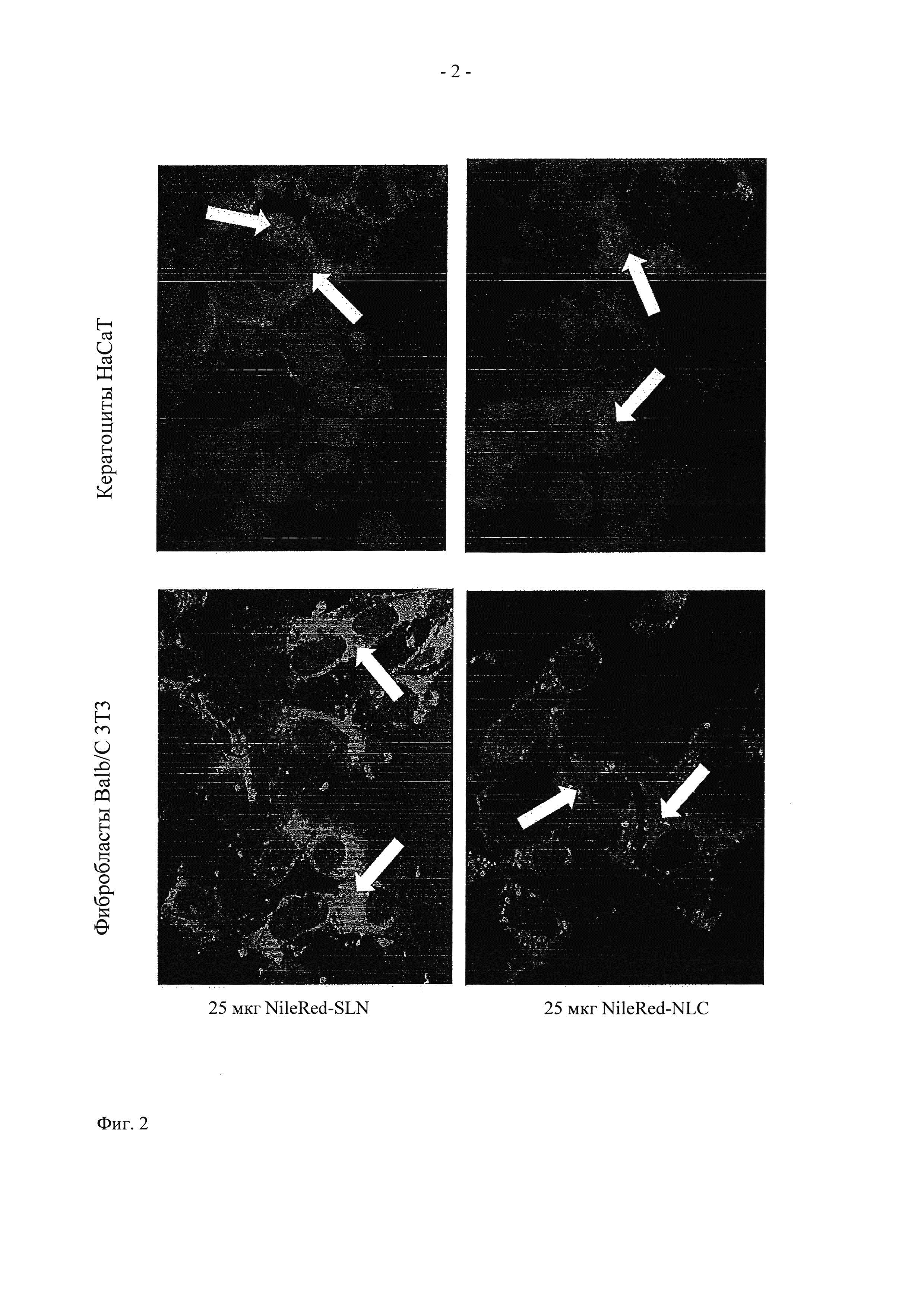
На фиг. 2 показана микрофотография захвата клетками частиц NileRed-SLN и NileRed-NLC.
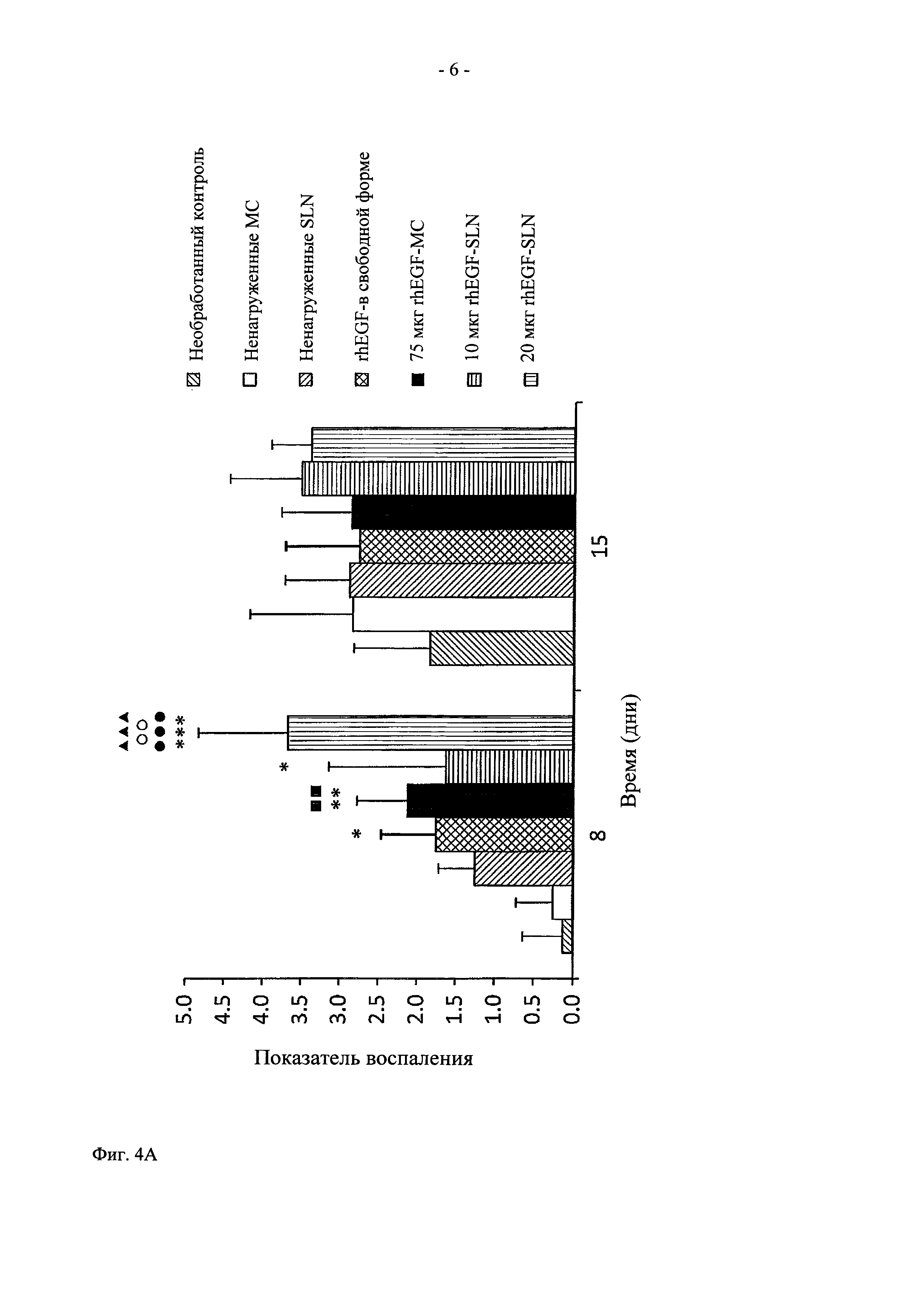
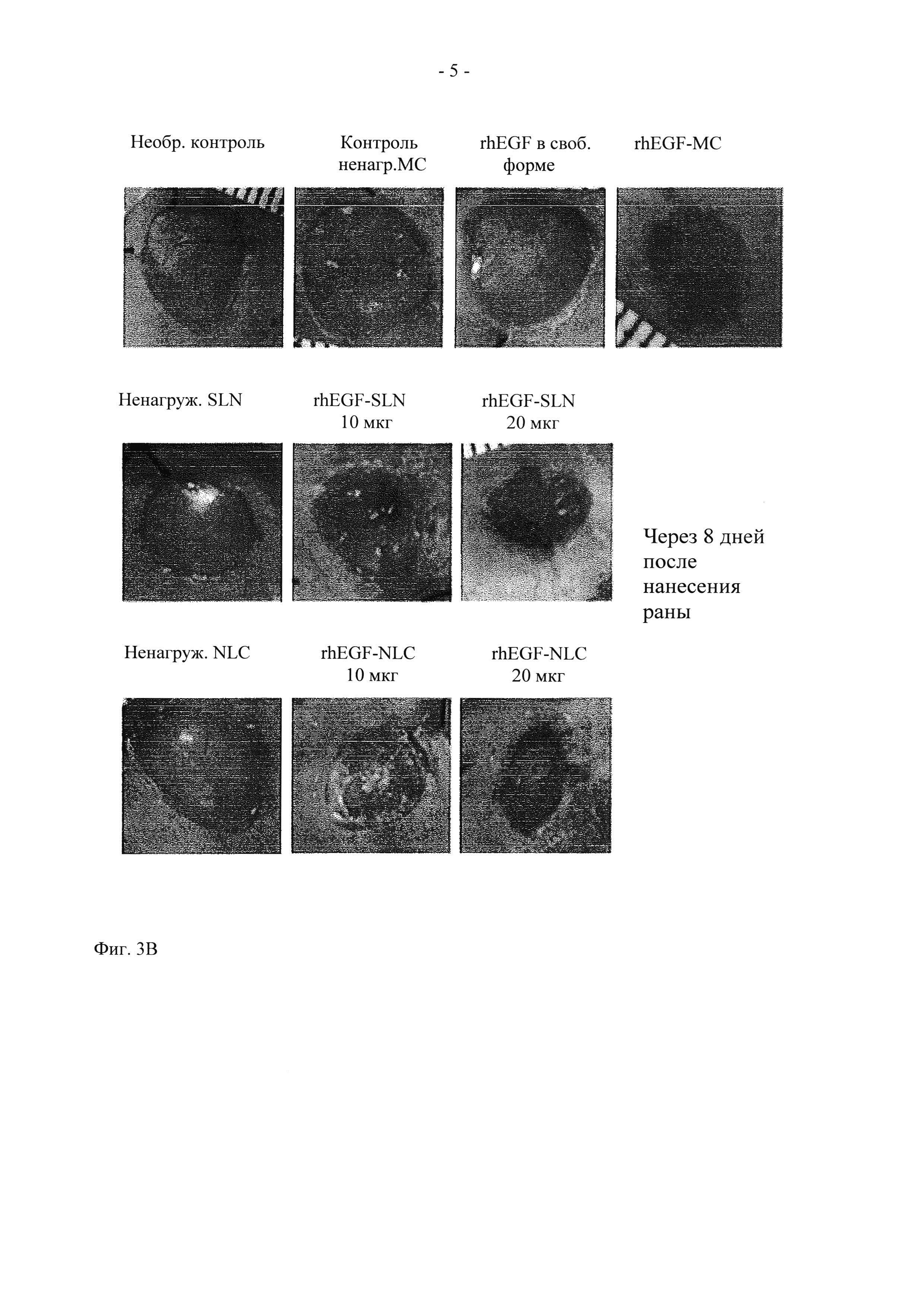
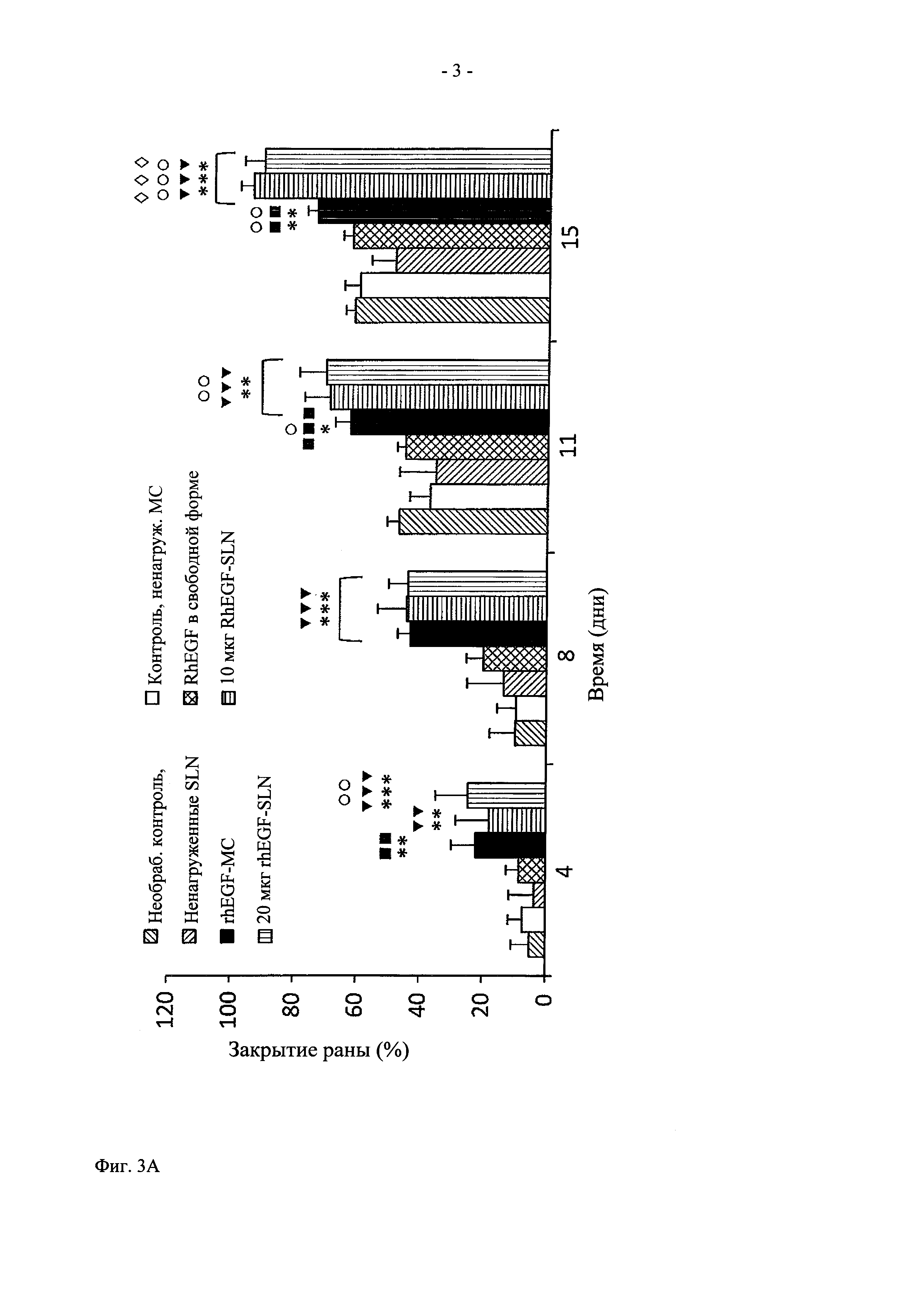
На фиг. 3 показано графическое представление действия in vivo (A) rhEGF-нагруженных частиц SLN и (Б) rhEGF-нагруженного состава NLC на закрытие раны, и (В) фотографии ран у контрольных необработанных крыс и у крыс, обработанных ненагруженными SLN, ненагруженными NLC, rhEGF-микросферами (rhEGF-MC), контрольными ненагруженными МС, rhEGF в свободной форме, 20 мкг rhEGF-SLN, 10 мкг rhEGF-SLN, 20 мкг rhEGF-NLC, 10 мкг rhEGF-NLC. Данные представлены в виде средних величин ± стандартное отклонение (СО).  Значительно выше по сравнению с необработанным контролем (
Значительно выше по сравнению с необработанным контролем ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001),
р<0,001),  Значительно выше по сравнению с ненагруженными контрольными МС (
Значительно выше по сравнению с ненагруженными контрольными МС ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001),
р<0,001),  Значительно выше по сравнению с ненагруженными SLN (
Значительно выше по сравнению с ненагруженными SLN ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001),
р<0,001),  Значительно выше по сравнению с ненагруженными NLC (
Значительно выше по сравнению с ненагруженными NLC ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001),
р<0,001),  Значительно выше по сравнению с rhEGF в свободной форме (
Значительно выше по сравнению с rhEGF в свободной форме ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001),
р<0,001),  Значительно выше по сравнению с 75 мкг rhEGF-MC (
Значительно выше по сравнению с 75 мкг rhEGF-MC ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 
 р<0,001),
р<0,001),  Значительно выше по сравнению с 10 мкг rhEGF-SLN (
Значительно выше по сравнению с 10 мкг rhEGF-SLN ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001).
р<0,001).
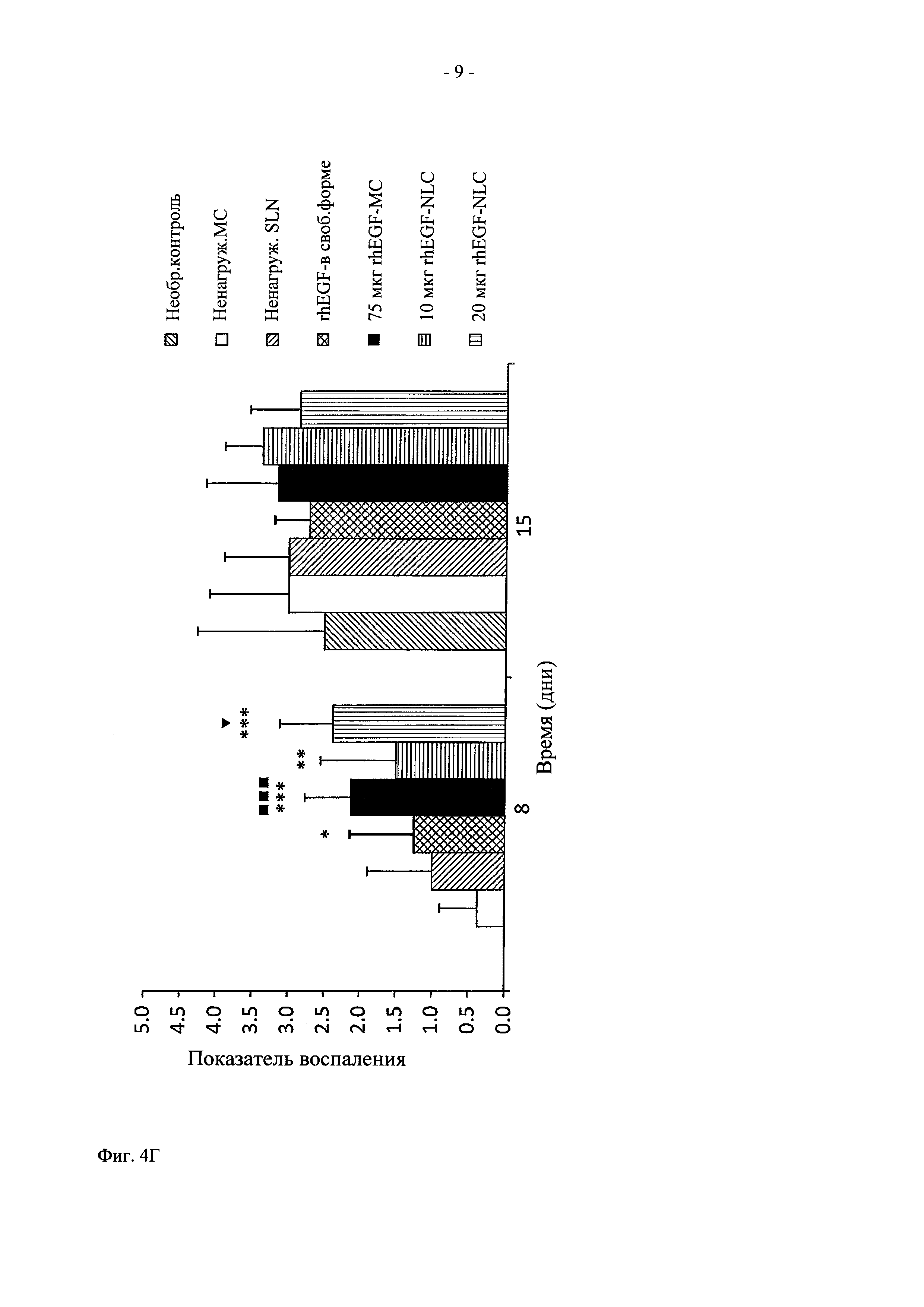
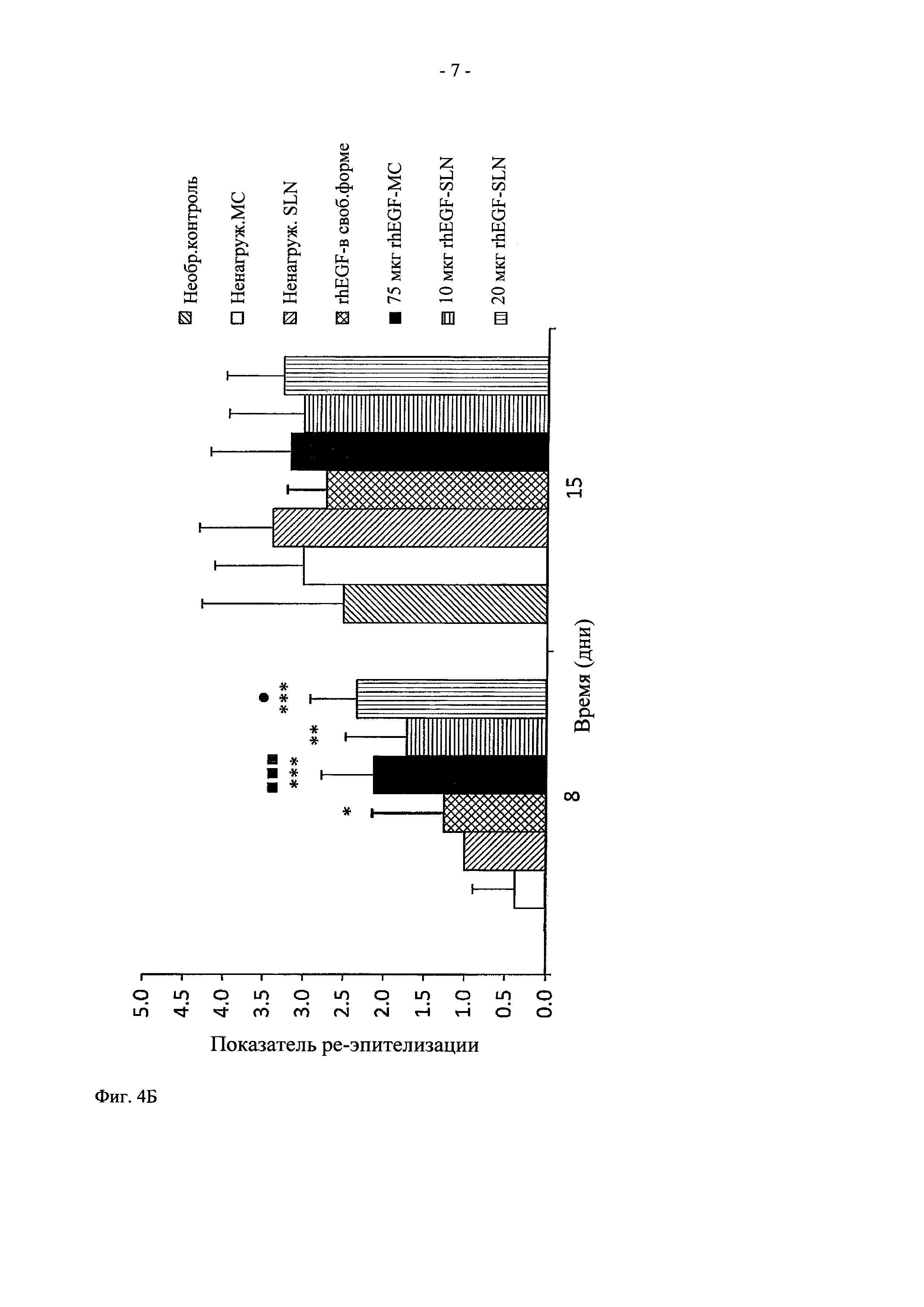
На фиг. 4 показано графическое представление действия in vitro rhEGF-нагруженных липидных наночастиц на показатель воспаления (А, В) и на показатель реэпителизации (Б, Г). Данные представлены в виде средних величин ± стандартное отклонение (СО).  Значительно выше по сравнению с необработанным контролем (
Значительно выше по сравнению с необработанным контролем ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001),
р<0,001),  Значительно выше по сравнению с ненагруженными контрольными МС (
Значительно выше по сравнению с ненагруженными контрольными МС ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001),
р<0,001),  Значительно выше по сравнению с ненагруженными SLN (
Значительно выше по сравнению с ненагруженными SLN ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001),
р<0,001),  Значительно выше по сравнению с ненагруженными NLC (
Значительно выше по сравнению с ненагруженными NLC ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001),
р<0,001),  Значительно выше по сравнению с rhEGF в свободной форме (
Значительно выше по сравнению с rhEGF в свободной форме ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001),
р<0,001),  Значительно выше 75 мкг rhEGF-MC (
Значительно выше 75 мкг rhEGF-MC ( р<0,05,
р<0,05, 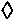
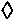 р<0,01 и
р<0,01 и 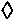
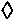
 р<0,001),
р<0,001),  Значительно выше 10 мкг rhEGF-SLN (
Значительно выше 10 мкг rhEGF-SLN ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001).
р<0,001).
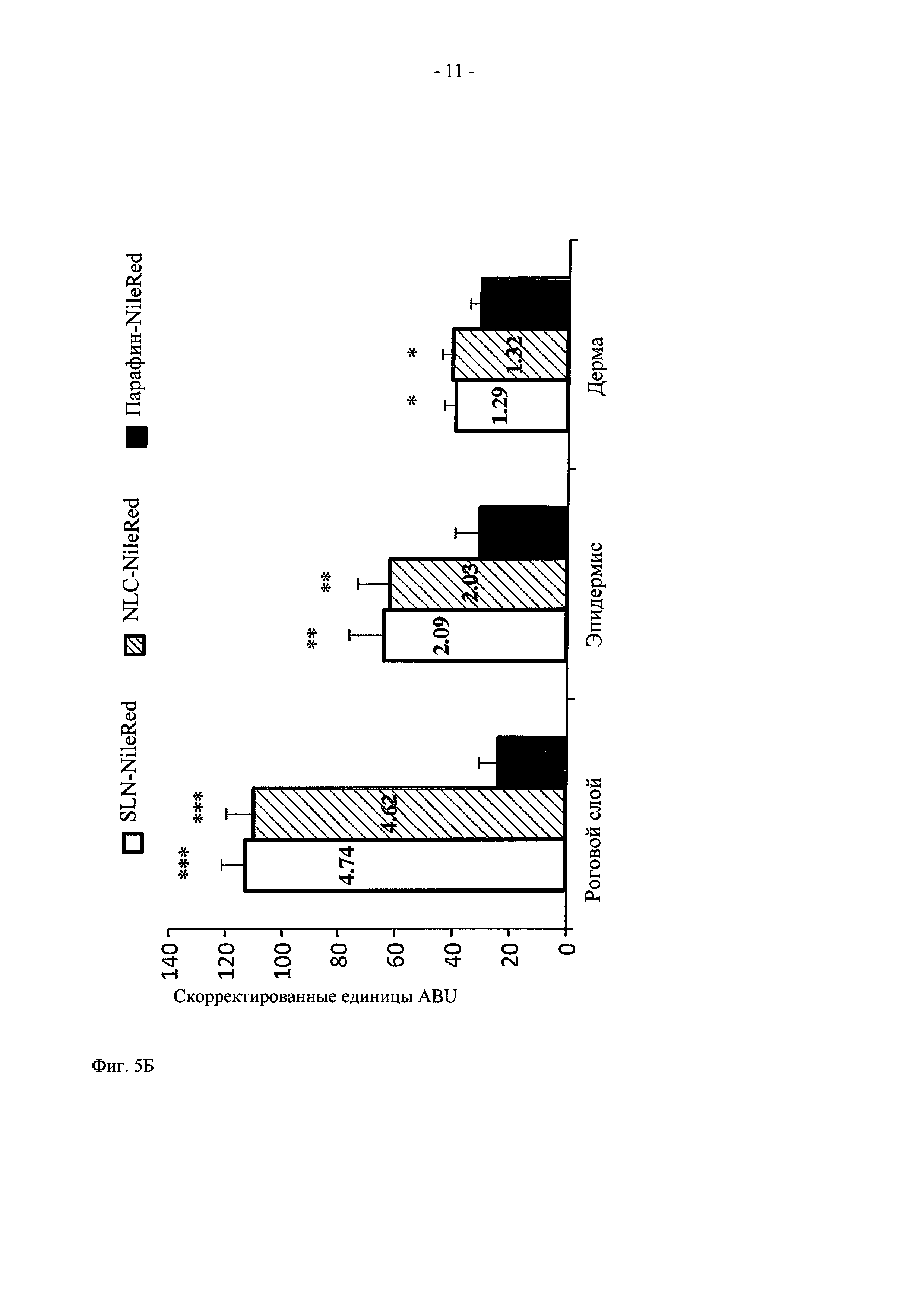
На фиг. 5 представлены микрофотографии (А) и графическое представление (Б) одновременного захвата частиц SLN-NileRed, NLC-NileRed и Paraffin-NileRed (произвольные единицы яркости в пикселях (ABU), скорректированы на фоновое значение флуоресценции, в роговом слое, эпидермисе и дерме).  Значительно выше по сравнению с составом Paraffin-NileRed (
Значительно выше по сравнению с составом Paraffin-NileRed ( р<0,05,
р<0,05, 
 р<0,01 и
р<0,01 и 

 р<0,001). Указанные на столбцах цифры означают соответствующую эффективность увеличения проникновения (ЭУП) по сравнению с парафиновым кремом.
р<0,001). Указанные на столбцах цифры означают соответствующую эффективность увеличения проникновения (ЭУП) по сравнению с парафиновым кремом.
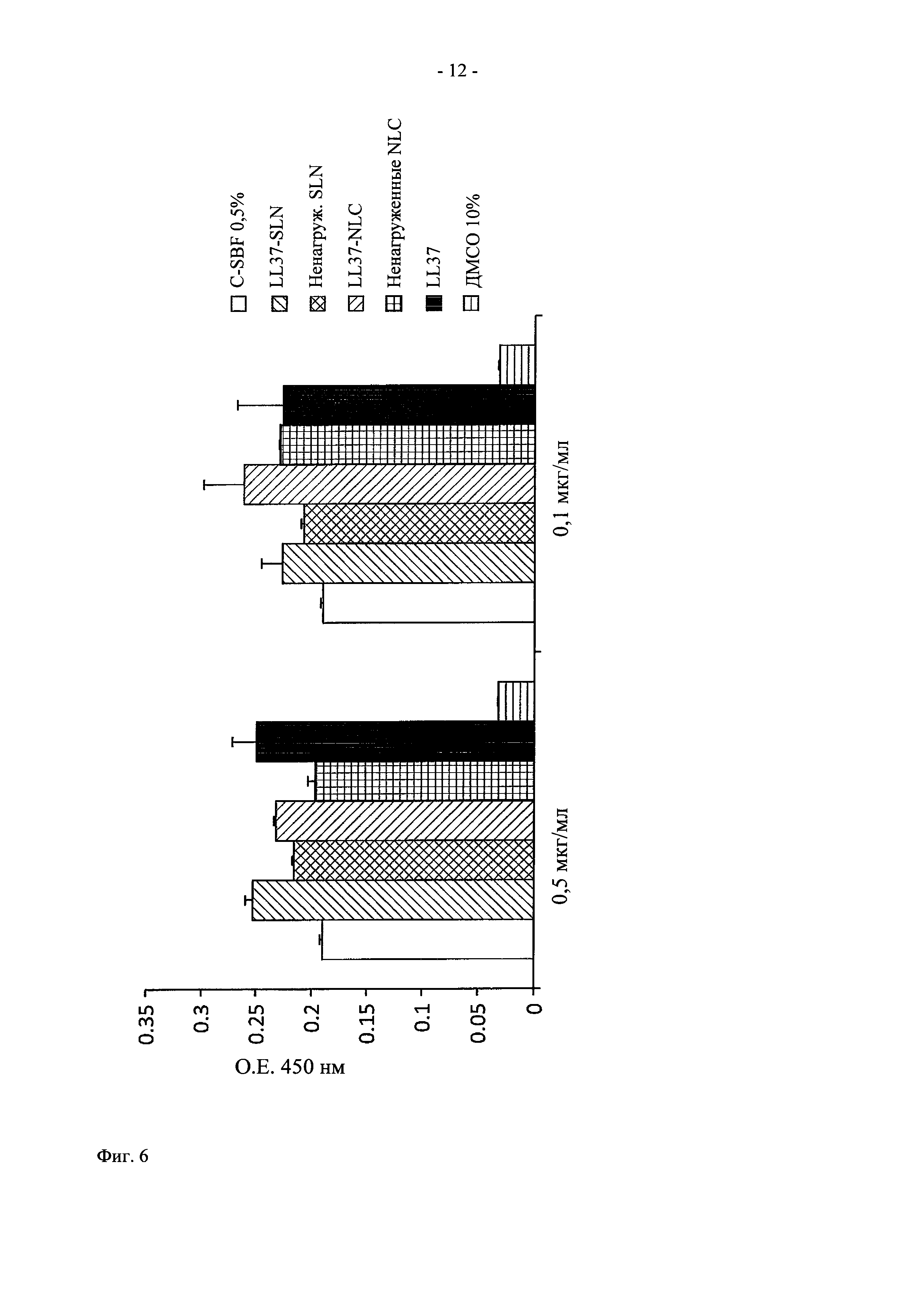
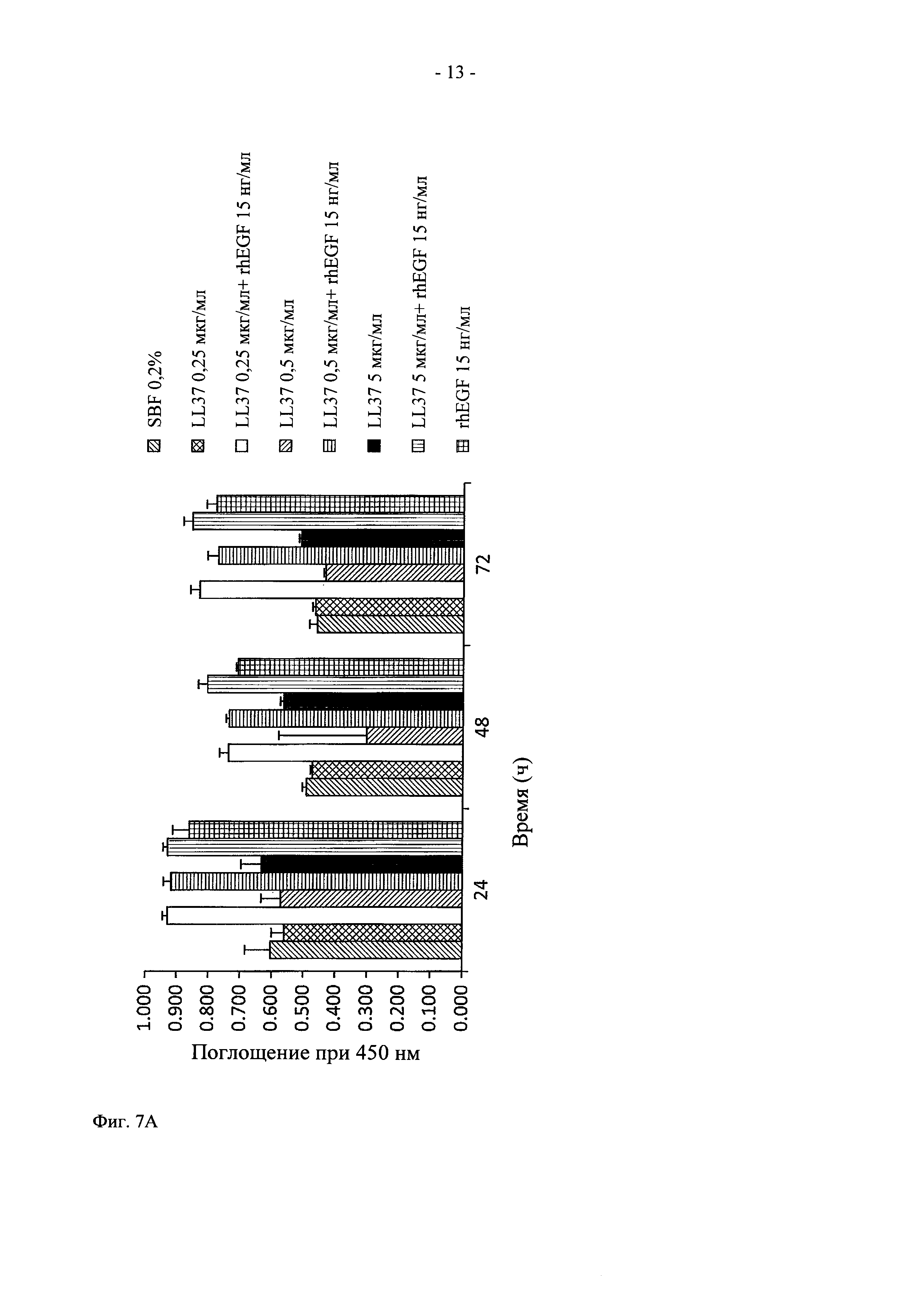
На фиг. 6 показано графическое представление действия in vitro LL37-нагруженных липидных наночастиц на пролиферацию клеток.
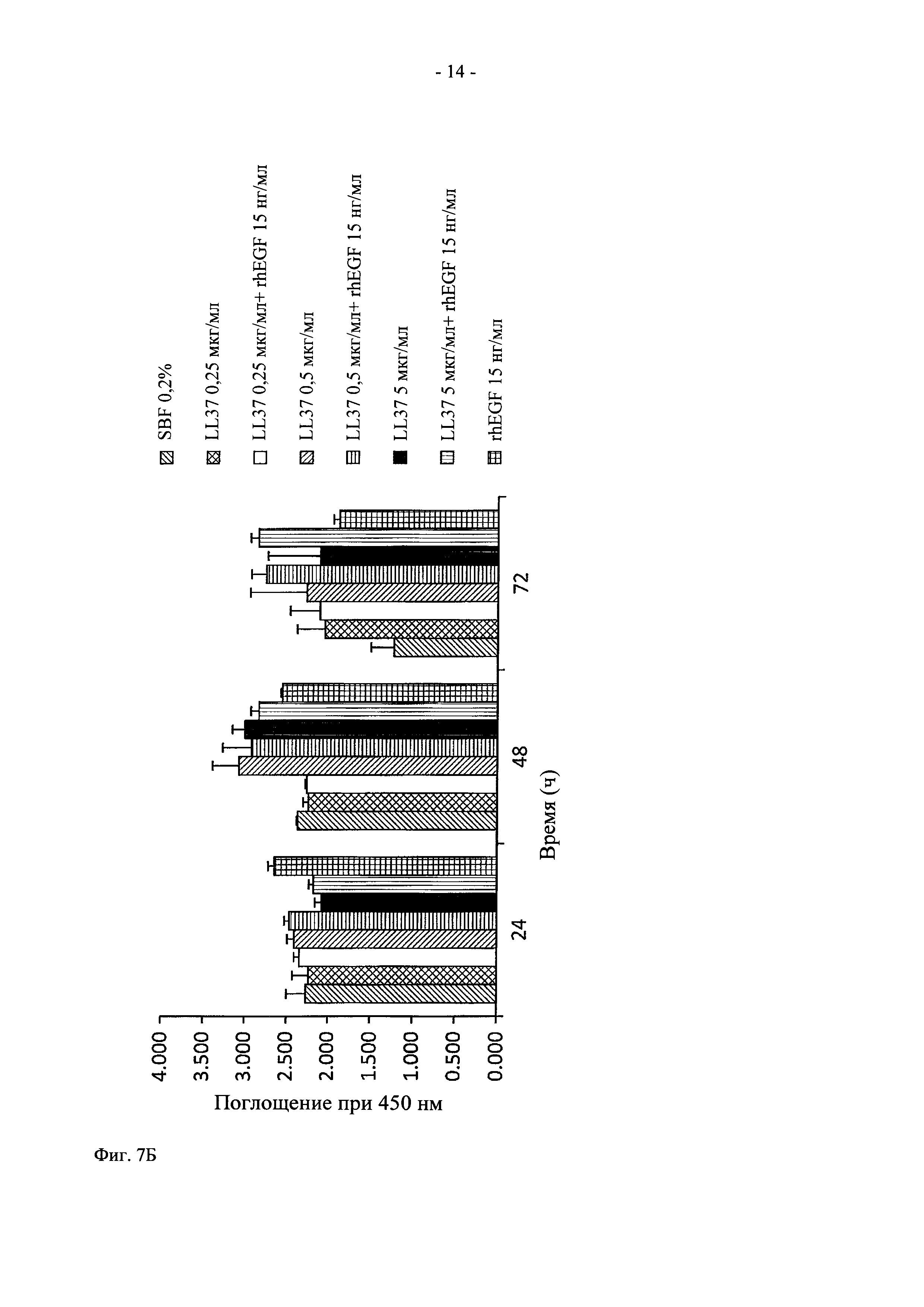
На фиг. 7 показано графическое представление действия in vitro комбинации rhEGF и LL37 на пролиферацию клеток.
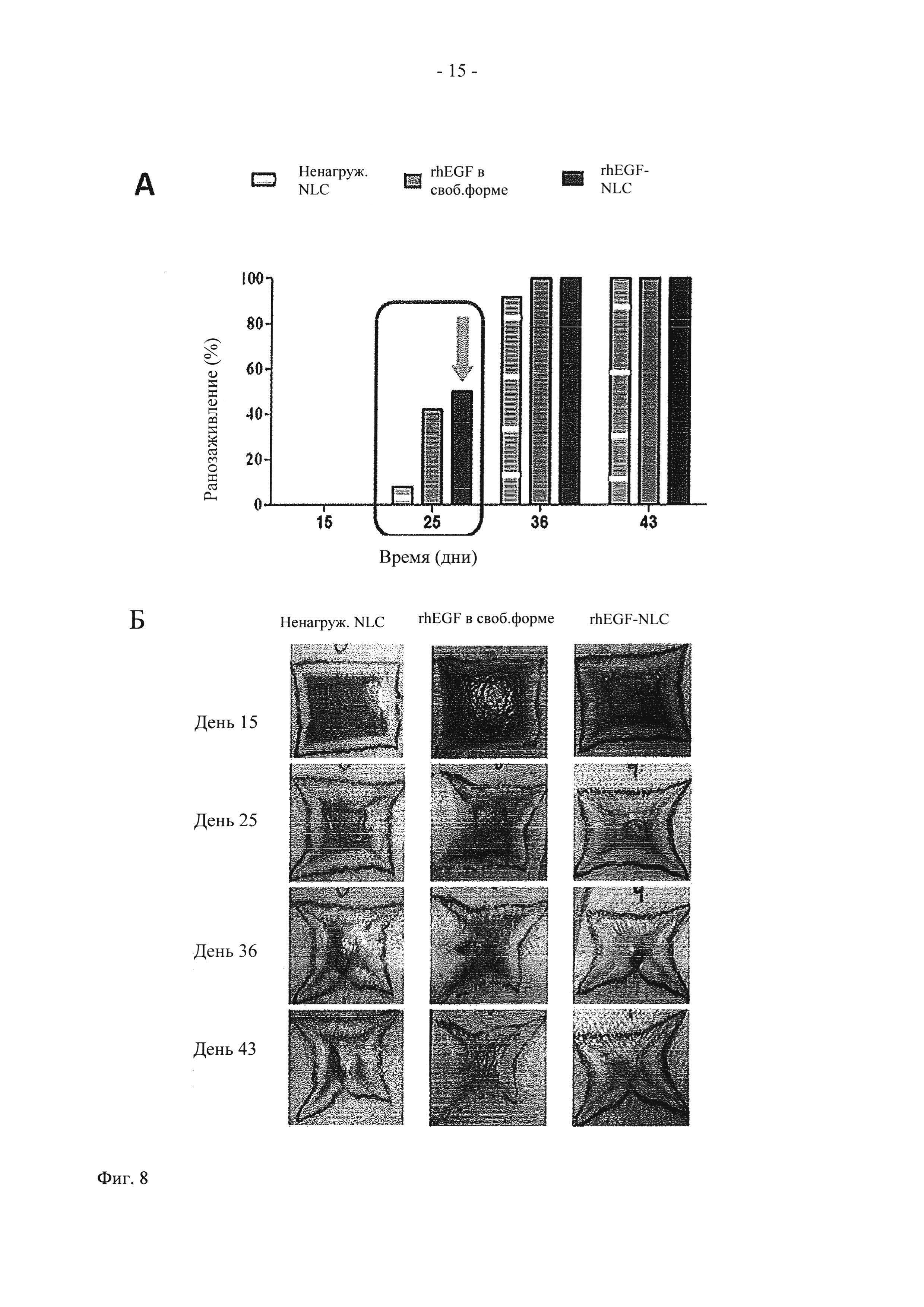
На фиг. 8 показаны (А) графическое представление действия in vivo ненагруженных NLC, rhEGF в свободной форме и 20 мкг rhEGF-NLC на закрытие раны у свиней в дни 15, 25, 35 и 43, и (Б) фотографии ран у свиней, обработанных ненагруженными NLC, rhEGF в свободной форме и 20 мкг rhEGF-NLC.
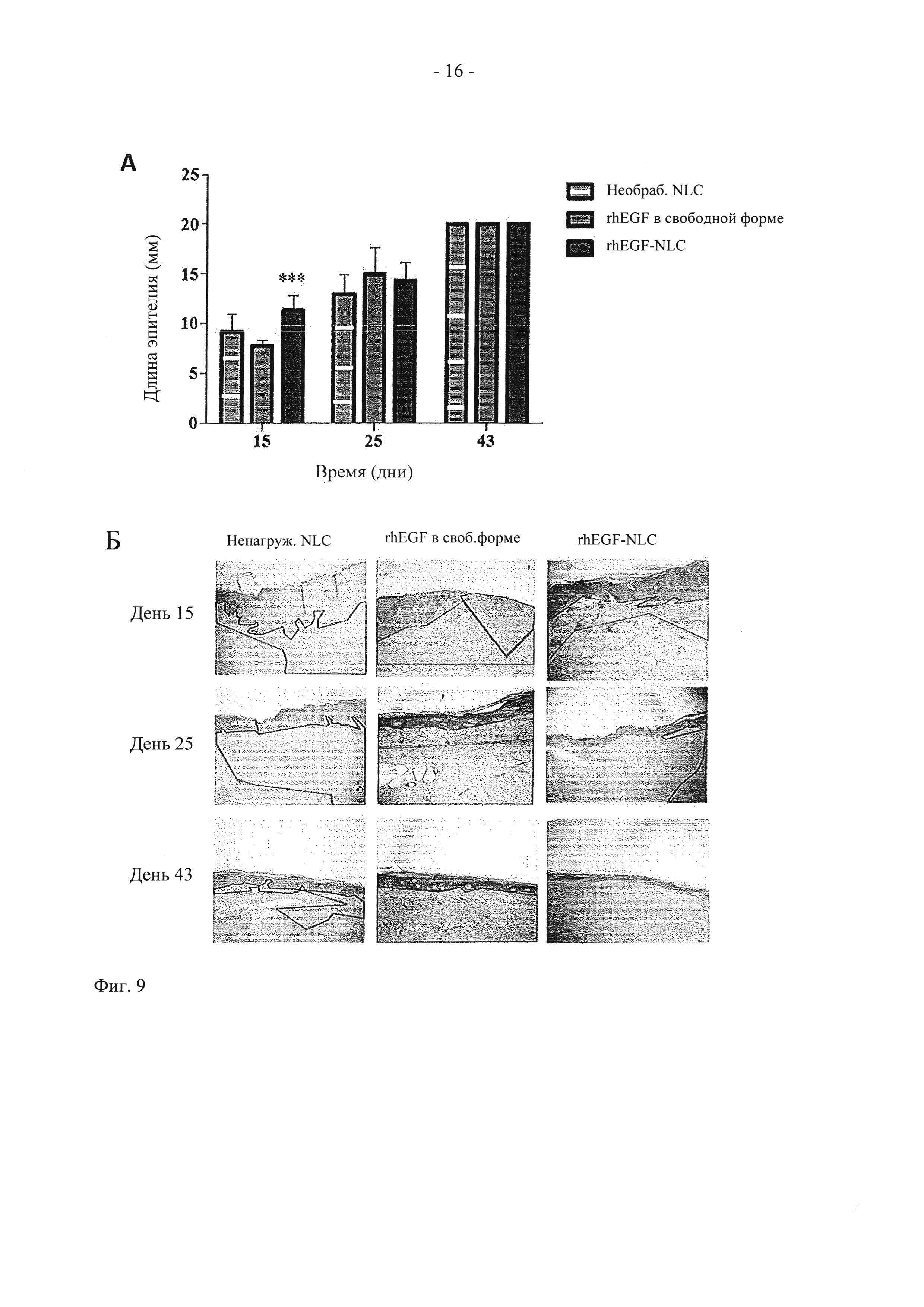
На фиг. 9 показаны (А) графическое представление длины эпителия в различных исследованных группах (ненагруженные NLC, rhEGF в свободной форме и 20 мкг rhEGF-NLC) в дни 15, 25 и 43, и (Б) гистологические изображения ран в дни 15, 25 и 43. Данные представлены в виде средних величин ± стандартное отклонение (СО). 

 Значительно выше по сравнению с ненагруженными NLC и rhEGF в свободной форме (р<0,001).
Значительно выше по сравнению с ненагруженными NLC и rhEGF в свободной форме (р<0,001).
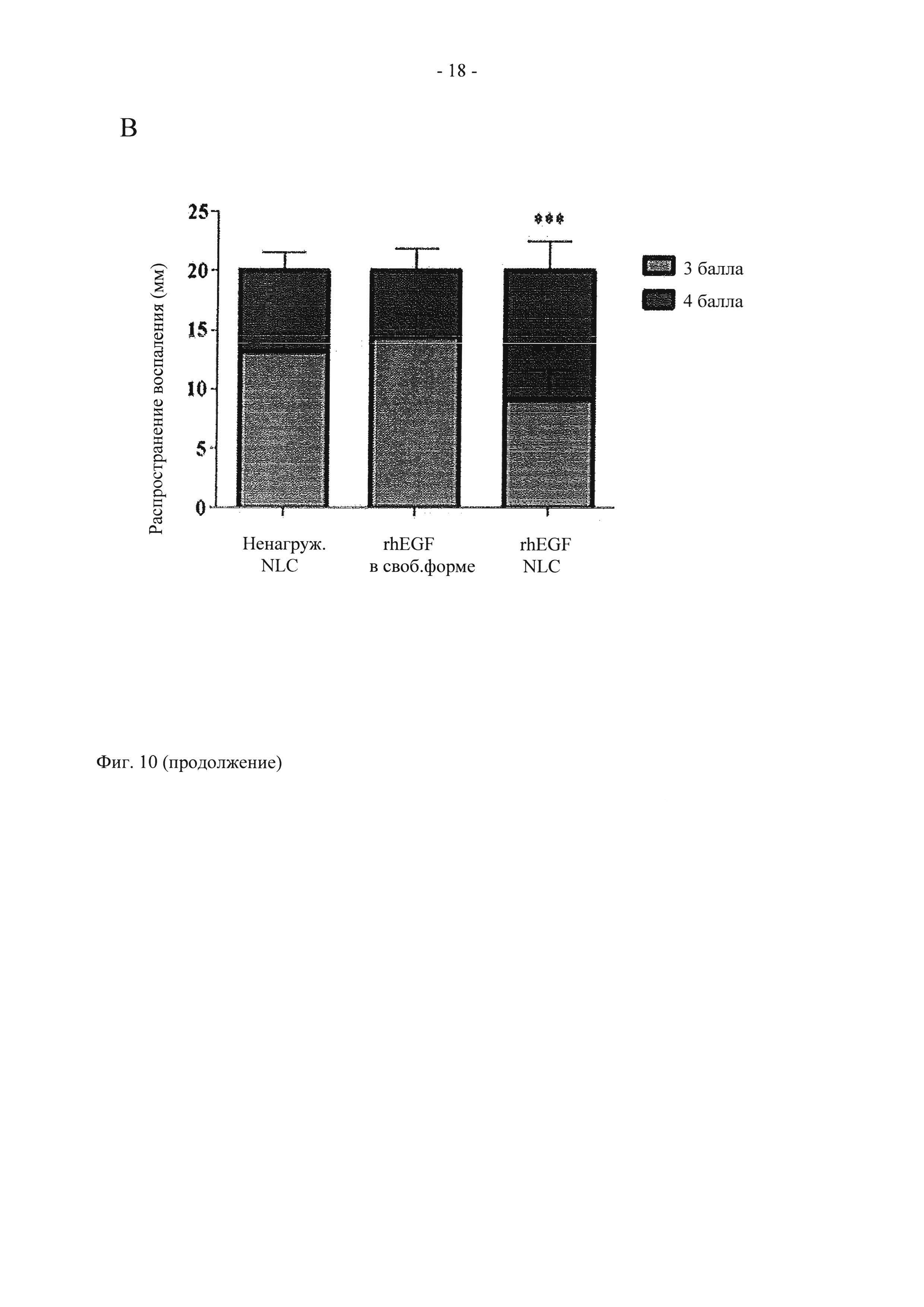
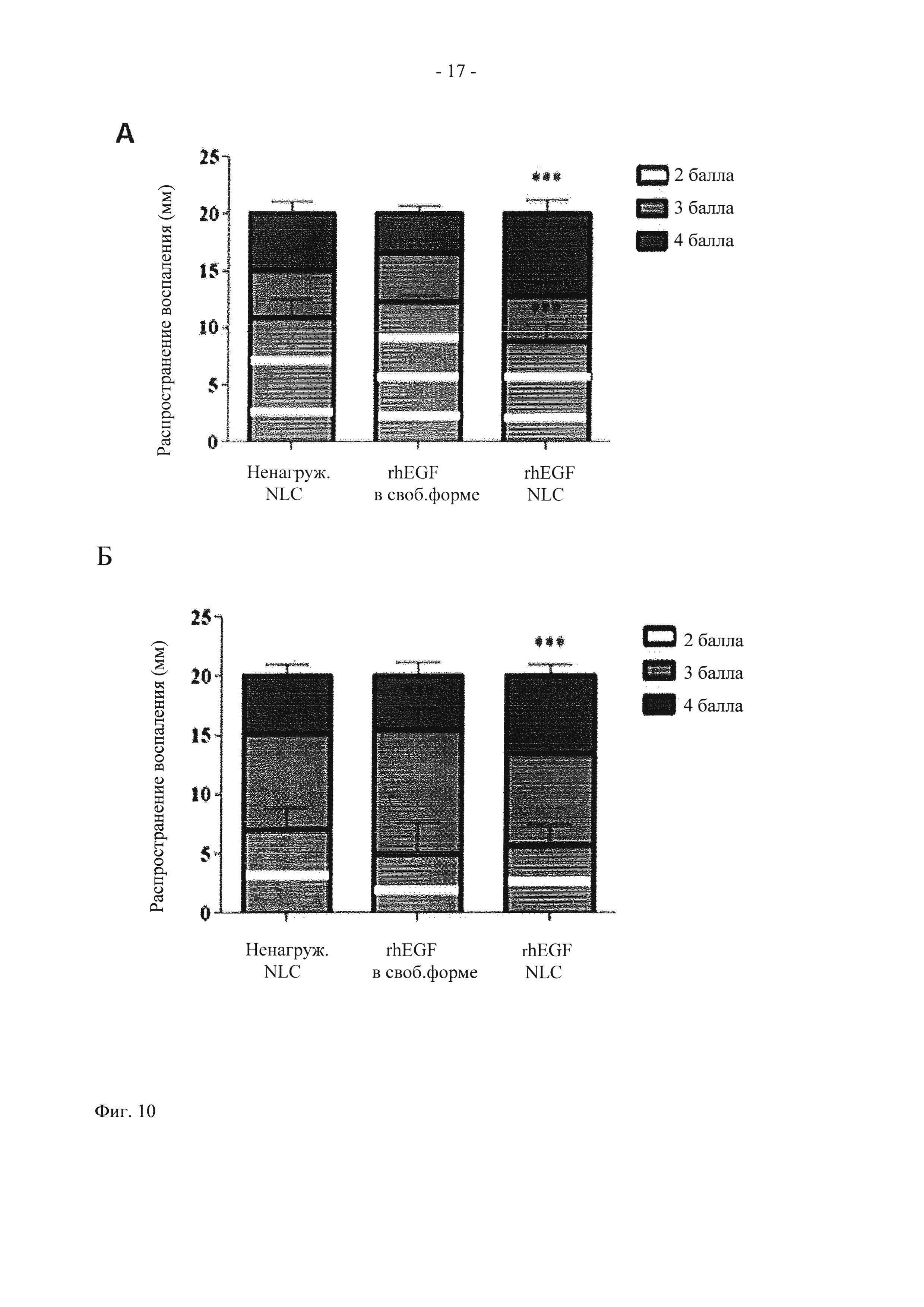
На фиг. 10 показано графическое представление распространения ранозаживления (мм) в день 15 (А), 25 (Б) и 43 (В). Данные представлены в виде средних величин±стандартное отклонение (СО). 

 по сравнению с группами, обработанными ненагруженными NLC и rhEGF в свободной форме (р<0,001).
по сравнению с группами, обработанными ненагруженными NLC и rhEGF в свободной форме (р<0,001).
Подробное описание настоящего изобретения
В первом объекте настоящего изобретения предлагается липидная наночастица, отличающаяся тем, что включает по крайней мере один твердый при комнатной температуре липид, по крайней мере одно неионное ПАВ и один фактор роста.
Следует отметить, что использованные в данном контексте формы в единственном числе включают формы во множественном числе, если явно не указано иное.
Использованный в настоящем изобретении термин «липидные наночастицы» означает частицы размером в нанометровом диапазоне, образующие твердую матрицу. Матрица содержит липиды, твердые не только при комнатной температуре, но и при температуре тела. В случае твердых липидных наночастиц (SLN) матрица содержит только твердый липид. В случае наноструктурированных липидных носителей (NLC) матрица содержит смесь твердых липидов с жидкими липидами (маслами), и такая смесь также остается твердой не только при комнатной температуре, но и при температуре тела (см. статью (Muller et al., Solid lipid nanoparticles (SLN) and nanostructured lipid carriers (NLC) in cosmetic and dermatological preparations. Advanced Drug Delivery Reviews 54 (1), S131-S155 (2002)). Термин «нагруженный фактором роста» означает фактор роста, включенный или инкапсулированный в матрицу наночастицы. Таким образом, в одном варианте осуществления настоящего изобретения липидные наночастицы представляют собой частицы SLN, а в другом особом варианте представляют собой частицы NLC. Таким образом, в особом варианте липидные наночастицы представляют собой частицы SLN или NLC.
В особом варианте осуществления настоящего изобретения фактор роста выбирают из группы, включающей фактор роста, принадлежащий к семейству эпидермального фактора роста (EGF), к семейству β-трансформирующего фактора роста (TGF-β), семейству фибробластного фактора роста (FGF), семейству сосудистого эндотелиального фактора роста (VEGF), гранулоцито-макрофаго-колониестимулирующего фактора (GM-CSF), тромбоцитарного фактора роста (PDGF), фактора роста соединительной ткани (CTGF), к семейству α-фактора некроза опухоли (TNFα), инсулиноподобных факторов роста (IGF). Предпочтительно фактор роста принадлежит к семейству эпидермального фактора роста (EGF) и более предпочтительно фактором роста является эпидермальный фактор роста (EGF). В особом варианте липидные наночастицы представляют собой EGF-нагруженные SLN (далее по тексту также EGF-SLN) и/или EGF-нагруженные NLC (далее по тексту также EGF-NLC). В особом варианте осуществления настоящего изобретения эпидермальный фактор роста представляет собой рекомбинантный эпидермальный фактор роста человека (rhEGF). Указанный rhEGF можно получить в виде коммерческого препарата (производства фирм Peprotech, Promega, Pharmchem и т.п.) или получить методом рекомбинантных ДНК, как описано, например, в статье Marioka-Fujimoto et al. Modified enterotoxin signal sequences increase secretion level of the recombinant human epidermal growth factor in Escherichia coli, J. Biol. Chem., Jan 25, 266(3): 1728-1732 (1991), или в заявке WO 91/18999 A1. В особом варианте осуществления настоящего изобретения содержание фактора роста, прежде всего EGF, в липидной наночастице по настоящему изобретению находится в интервале от 0,01 мас. % до 20 мас. % в расчете на общую массу липидной наночастицы, предпочтительно от 0,1 мас. % до 10 мас. % в расчете на общую массу липидной наночастицы и более предпочтительно от 0,5 мас. % до 5 мас. % в расчете на общую массу липидной наночастицы.
Как было указано выше, липидные наночастицы по настоящему изобретению включают по крайней мере один твердый при комнатной температуре липид. В контексте настоящего изобретения термин «твердый при комнатной температуре липид» означает липид, твердый при температуре ниже 45°C, который может быть насыщенным или ненасыщенным. Указанное определение включает моно-, ди- или триглицериды, жирные кислоты, стероиды и воски. Аналогичным образом можно использовать производные этих жирных кислот, которые представляют собой соединения, полученные в результате реакции кислотной группы со спиртами или аминами, такие как, например, сложные эфиры или амиды жирных кислот. Таким образом, в особом варианте осуществления настоящего изобретения твердый при комнатной температуре липид выбирают из ацилглицеридов, насыщенных жирных кислот, в цепи которых содержится по крайней мере 10 атомов углерода, их производных и их смесей. В предпочтительном варианте ацилглицериды выбирают из глицерилпальмитостеарата (Precirol® АТ05), глицерилмоностеарата (lmwitor® 900) и глицерилбегената (Compritol® 888АТО). В более предпочтительном варианте липидным компонентом является глицерилпальмитостеарат (Precirol® АТ05).
В особом варианте осуществления настоящего изобретения содержание твердого липида в липидной наночастице находится в интервале от 1 мас. % до 40 мас. % в расчете на общую массу липидной наночастицы, предпочтительно от 5 мас. % до 15 мас. %.
Как было указано выше, липидные наночастицы по настоящему изобретению также содержат неионное ПАВ. Термин «неионное поверхностно-активное вещество, ПАВ» означает соединение, содержащее гидрофобный фрагмент и гидрофильный фрагмент, которые обеспечивают образование эмульсии. В особом варианте неионное ПАВ выбирают из полисорбатов, сополимеров этилена и гликоля и сополимеров пропилена и гликоля, и их смесей. В особом варианте неионное ПАВ выбирают из группы, включающей твин, спан, полоксамер и их смеси. В предпочтительном варианте неионное ПАВ представляет собой твин 80, а в другом предпочтительном варианте неионное ПАВ представляет собой смесь твина 80 и полоксамера.
В особом варианте осуществления настоящего изобретения содержание неионного ПАВ находится в интервале от 0,01 мас. % до 10 мас. % в расчете на общую массу липидной наночастицы, предпочтительно от 0,05 мас. % до 5 мас. %.
В особом варианте осуществления настоящего изобретения липидная наночастица по изобретению включает от 1 мас. % до 40 мас. % твердого при комнатной температуре липида, от 0,01 мас. % до 10 мас. % неионного ПАВ и от 0,01 мас. % до 20 мас. % фактора роста, причем все процентные значения представлены в расчете на общую массу липидной наночастицы.
В особом варианте липидная наночастица по изобретению необязательно может представлять собой лиофилизированный или высушенный продукт.
Во втором объекте настоящего изобретения предлагаются липидные наночастицы по первому объекту, дополнительно включающие жидкий при комнатной температуре липид. В контексте настоящего изобретения термин «жидкий при комнатной температуре липид» означает липид, который остается жидким при комнатной температуре и ниже 45°C и может быть насыщенным или ненасыщенным. Жидкий при комнатной температуре выбирают из ненасыщенных или насыщенных сложных эфиров жирных кислот, масел, жирных кислот и триглицеридов, содержащих в цепи менее 10 атомов углерода, и их смесей (например, триглицерид каприловой и каприновой кислот (Mygliol®), соевое масло, изопропилмиристат, касторовое масло). В предпочтительном варианте в качестве жидкого липида используют липид Mygliol®. В предпочтительном варианте липидный компонент липидных наночастиц представляет собой комбинацию глицерилпальмитостеарата (Precirol® АТ05) и триглицерида каприловой и каприновой кислот (Mygliol®). В другом варианте этого второго объекта настоящего изобретения, если жидкий при комнатной температуре липид включен в наночастицу, его содержание находится в интервале от 1 мас. % до 30 мас. % в расчете на общую массу липидной наночастицы, предпочтительно от 5 мас. % до 15 мас. %. В еще одном варианте соотношение твердый липид / жидкий липид составляет от 0,5:10 до 5:10.
В третьем объекте настоящего изобретения предлагается способ (способ 1 по настоящему изобретению) для получения липидной наночастицы по первому объекту настоящего изобретения, определенному выше, отличающийся тем, что включает следующие стадии:
(i) получение водного раствора, включающего неионное ПАВ,
(ii) получение липофильного раствора, включающего твердый при комнатной температуре липид в органическом растворителе,
(iii) добавление водного раствора (i) к липофильному раствору (ii), обработка полученной смеси ультразвуком до образования эмульсии,
(iv) упаривание органического растворителя из полученной на стадии (iii) эмульсии и
(v) сбор липидных наночастиц,
при этом фактор роста добавляют в раствор (ii).
Липидные наночастицы, полученные способом 1, представляют собой SLN. Первая стадия (i) включает растворение неионного ПАВ в водном растворе, предпочтительно в воде. На второй стадии (ii) получения липофильного раствора твердый при комнатной температуре липид растворяют в органическом растворителе, при этом содержание твердого липида составляет по крайней мере 1 мас. % в расчете на общую массу органического растворителя. Фактор роста, предпочтительно EGF, и более предпочтительно rhEGF, растворяют вместе с липидом в органическом растворителе. Выбор органического растворителя в значительной степени зависит от липидного компонента. В особом варианте осуществления настоящего изобретения органический растворитель выбирают из дихлорметана, ацетона, хлороформа и их смесей, более предпочтительно органическим растворителем является дихлорметан.
После приготовления обоих растворов водный раствор (i) добавляют в липофильный раствор (ii). Затем полученную смесь обрабатывают ультразвуком до образования эмульсии и органический растворитель упаривают любым известным в данной области техники методом. В особом варианте стадию упаривания органического растворителя проводят при перемешивании эмульсии механической мешалкой в течение по крайней мере 60 мин, предпочтительно в течение по крайней мере 120 мин. После удаления органического растворителя липофильный раствор затвердевает и образуется суспензия наночастиц, которую затем фильтруют центрифугированием. И наконец, собранные липидные наночастицы промывают и ресуспендируют в очищенной воде.
В четвертом объекте настоящего изобретения предлагается способ (способ 2 по настоящему изобретению) для получения липидной наночастицы по второму объекту настоящего изобретения, описанному выше, который включает следующие стадии:
(i) получение водного раствора, включающего неионное ПАВ,
(ii) получение липофильного раствора, включающего смесь твердого липида и жидкого липида, расплавляющуюся при температуре, выше температуры плавления жидкого липида,
(iii) нагревание водного раствора (i) до температуры, равной температуре липофильного раствора (ii),
(iv) добавление водного раствора (i) к липофильному раствору (ii), обработка полученной смеси ультразвуком до образования эмульсии,
(v) охлаждение эмульсии (iv) до температуры 5°±3°C для рекристаллизации липида и образования наночастиц, и
(vi) сбор наночастиц,
при этом фактор роста добавляют в раствор (ii).
Липидные наночастицы, полученные этим способ 2, представляют собой NLC. Первая стадия (i) включает растворение неионного ПАВ в водном растворе, предпочтительно в воде. На второй стадии (ii) получения липофильного раствора смесь твердого липида и жидкого липида расплавляют при температуре, выше температуры плавления жидкого липида. Фактор роста, предпочтительно EGF, и более предпочтительно rhEGF, растворяют вместе со смесью липидов.
После нагревания водного раствора (i) до температуры, при которой смесь липидов расплавляется, водный раствор (i) добавляют к липофильному раствору (ii). Затем полученную смесь обрабатывают ультразвуком для образования эмульсии. Эмульсию (iv) охлаждают до температуры 5°C±3°C, чтобы обеспечить рекристаллизацию и образование наночастиц. После рекристаллизации липидов получают суспензию наночастиц, которую затем фильтруют центрифугированием. И наконец, собранные липидные наночастицы промывают и ресуспендируют в очищенной воде.
Пятый объект настоящего изобретения относится к липидным наночастицам, полученным способом 1, и липидным наночастицам, полученным способом 2.
Липидные наночастицы по первому, второму и пятому объектам настоящего изобретения отличаются тем, что их средний размер равен 1 мкм или менее, предпочтительно их средний размер находится в интервале от 1 нм до 1000 нм, более предпочтительно от 150 нм до 400 нм. Средний размер можно определять стандартным методами, известными специалисту в данной области техники и описанными, например, ниже в экспериментальной части (табл. 1, пример 2). Кроме того, липидные наночастицы могут характеризоваться поверхностным зарядом (измеренным методом Z потенциала), величина которого может изменяться от -50 мВ до +80 мВ (табл. 1, пример 2). Более того, липидные наночастицы характеризуются эффективностью включения более 40%, прежде всего более 70% для SLN и более 95% для NLC (табл. 1, пример 2).
Важный признак липидных наночастиц по настоящему изобретению заключается в том, что они высвобождают нагруженный в них фактор роста в режиме замедленного высвобождения. Нагруженные фактором роста липидные наночастицы обеспечивают профиль высвобождения, который характеризуется фазой начального высвобождения («взрывное» высвобождение), соответствующего процентному содержанию связанного на поверхности белка, последующей фазой быстрого высвобождения продолжительностью от 4 ч до 24 ч, медленной фазой продолжительностью от 24 ч до 72 ч и конечной фазой высвобождения общего количества фактора роста (табл. 3, пример 2).
Такой признак замедленного высвобождения является важным преимуществом, так как обеспечивает безопасное лечение по сравнению с кусами лечения EGF в свободной форме, в ходе которых для достижения равного терапевтического эффекта требуются непрерывное введение фактора роста и более высокие дозы. Кроме того, за счет снижения дозы можно снизить другие нежелательные отрицательные побочные эффекты, так как больше не требуется введение высоких доз фактора роста, поскольку включенный фактор роста высвобождается в течение периода времени в более низких, но более эффективных дозах. И наконец, замедленное высвобождение фактора роста позволяет уменьшить число введений, повышая при этом соблюдение пациентом предписанного курса лечения и следовательно качество жизни пациента.
Авторами неожиданно было установлено, что липидные наночастицы по настоящему изобретению, то есть EGF-нагруженные липидные наночастицы, характеризуются неожиданно более высокой скоростью пролиферации фибробластов in vitro по сравнению с EGF в свободной форме (пример 3, раздел 3.1, фиг. 1). Более того, липидные наночастицы по настоящему изобретению, то есть EGF-SLN и EGF-NLC, способны проникать в клетку (пример 3, раздел 3.2, фиг. 2).
Следует отметить, что испытания in vivo показали, что четыре местных введения rhEGF-SLN в дозе 10 мкг и 20 мкг rhEGF дополнительно улучшают ранозаживление с точки зрения закрытия раны (фиг. 3A, В), разрешение воспалительной реакции (фиг. 4А) и процесс реэпителизации (фиг. 4Б) по сравнению с 300 мкг rhEGF, введенного с помощью четырех внутриочаговых нанесений. Более того, испытания in vivo показали, что четыре местных введения rhEGF-NLC в дозе 10 мкг и 20 мкг rhEGF дополнительно улучшают ранозаживление с точки зрения закрытия раны (фиг. 3Б, В), разрешение воспалительной реакции (фиг. 4В) и процесс реэпителизации (фиг. 4Г) по сравнению с 300 мкг rhEGF, введенного с помощью четырех внутриочаговых нанесений. Кроме того, полученные данные свидетельствуют о том, что процесс ранозаживления значительно улучшается при введении 20 мкг или 10 мкг rhEGF, включенного в SLN или в NLC, с точки зрения закрытия раны в ходе испытаний в течение 8 и 11 дней, по сравнению с одним внутриочаговым введением дозы 75 мкг микросфер из сополимера молочной и гликолевой кислот (PLGA-MC). Таким образом применение липида в качестве материала матрицы для наночастиц является преимуществом по сравнению с применением стандартных биодеградабельных и гидролитически разлагающихся полимеров, таких как PLGA, так как липидные наночастицы позволяют вводить местным способом соединение, нагруженное в липидные наночастицы.
Кроме того, представленные в примере 6 (фиг. 8-10) результаты испытаний in vivo свидетельствуют, что локальное и местное введение rhEGF-NLC может повысить ранозаживление не только с точки зрения скорости ранозаживления и числа заживших ран (измерение закрытия раны), но и с точки зрения качества ранозаживления за счет вновь образовавшейся сети микрососудов, миграции фибробластов, отложения коллагена и развития воспалительного ответа. Кроме того, эти результаты имеют чрезвычайно важное значение, так как у животных, которым вводили местно 20 мкг NLC, наблюдалось в значительной степени улучшенное ранозаживление по сравнению с очагами, в которые вводили внутриочаговым способом 75 мкг rhEGF в свободной форме. Эти данные вместе с данными по числу закрытых ран (в процентах) и реэпителизации свидетельствуют о том, что нано-инкапсуляция rhEGF в частицы rhEGF-NLC позволяют вводить фактор роста местно и снизить дозу, так как инкапсуляция предотвращает деградацию фактора роста на участке раны.
Следует также отметить, что частицы EGF-SLN и EGF-NLC проявляют улучшенную способность к проникновению через кожу по сравнению с парафиновым кремом (пример 3, раздел 3.4, фиг. 5). Это свойство является важным преимуществом, так как позволяет наносить местно соединение, нагруженное в липидные наночастицы.
Таким образом, шестой объект настоящего изобретения относится к фармацевтической композиции, содержащей липидную наночастицу по настоящему изобретению, определенную в первом, втором и пятом объектах настоящего изобретения, как описано выше в любом абзаце, и фармацевтический носитель. В предпочтительном варианте осуществления настоящего изобретения фармацевтическую композицию наносят местно. Ее можно вводить в форме геля, крема, повязки или пластыря. Таким образом, в особом варианте фармацевтическая композиция дополнительно включает коллаген, гиалуроновую кислоту, алое вера, фибрин, полимеры carbopol® и производные целлюлозы.
Более того, седьмой объект настоящего изобретения относится к липидной наночастице, определенной в первом, втором и пятом объектах настоящего изобретения, как описано выше в любом абзаце, и предназначенной для ее применения в качестве лекарственного средства. Кроме того, в восьмом объекте предлагается фармацевтическая композиция, определенная в шестом объекте и предназначенная для применения в качестве лекарственного средства.
С учетом описанных выше результатов испытаний in vivo еще один объект настоящего изобретения - девятый объект, относится к липидным наночастицам, определенным в первом, втором и пятом объектах настоящего изобретения, описанных выше в любом абзаце, предназначенных для их применения при ускорении ранозаживления у субъекта. Предпочтительно в этом объекте предлагаются EGF-нагруженные частицы SLN для их применения при ранозаживлении у субъекта, а также EGF-нагруженные частицы NLC для их применения при ранозаживлении у субъекта. Более того, десятый объект настоящего изобретения относится к фармацевтической композиции, определенной в шестом объекте, для ее применения при ранозаживлении у субъекта. Термин «субъект», использованный в данном контексте, относится к любому позвоночному животному, предпочтительно к млекопитающему, и более предпочтительно к человеку. В контексте настоящего изобретения термин «раны» означает хронические раны, труднозаживляемые раны, ишемические раны и ожоги. В особом варианте осуществления настоящего изобретения рану выбирают из группы, включающей хронические раны, ишемические раны, ожоги и их комбинации. Предпочтительные хронические раны выбирают из группы, включающей диабетические язвы стопы, пролежневые язвы, язвы сосудов и их сочетания.
В контексте настоящего изобретения термин «хронические раны» означает раны, в которых не происходит упорядоченный и своевременный репаративный процесс для восстановления анатомической и функциональной целостности в течение периода более трех месяцев. Все типы ран могут превратиться в хронические раны и, таким образом, хронические раны традиционно разделяют по этиологическому принципу на три категории: пролежневые, диабетические и сосудистые язвы (венозные и артериальные язвы). Пролежневая язва означает участок локализованного повреждения кожи и/или расположенной под кожей ткани, обычно над костным выступом, который образуется в результате давления или сдвига. Диабетические язвы стопы являются одними из самых тяжелых осложнений при диабете благодаря значительному влиянию на качество жизни пациента, и они развиваются в результате различных факторов, таких как механические изменения конформации строения костей стопы, периферическая невропатия (поврежденные нервы) и заболевание периферических сосудов (закупорка артерий), причем все эти факторы наблюдаются с высокими частотой и интенсивностью в популяции диабетиков. Сосудистые язвы обычно располагаются на нижних конечностях. Множество сосудистых язв являются хроническими или рецидивирующими. Этот тип язв является причиной значительной заболеваемости среди пациентов с диагнозом заболевания периферических сосудов. Артериальные или ишемические раны вызваны слабой перфузией к нижним конечностям. Ишемия ограничивает поступление питательных веществ и кислорода, что приводит к гибели тканей и образованию в этом участке открытой раны. Сниженный кровоток к участку раны в значительной степени нарушает ответную реакцию заживления, приводя к развитию хронической раны, которая может превратиться в гангрену и таким образом к ампутации. И наконец, труднозаживляемые раны характеризуются постоянным преобладанием воспалительных клеток, разрегулированными синтезом и ремоделированием внеклеточного матрикса, и отсутствием реэпителизации, а ожоги представляют собой повреждение кожи, вызванное действием тепла, огня, радиации, солнечного света, электричества или химических реагентов.
Авторами было неожиданно установлено, что комбинация EGF и противобактериального пептида LL37 - кателицидина, вызывает неожиданно более высокую пролиферацию клеток по сравнению с EGF и LL37 (каждый в свободной форме), соответственно (пример 4, фиг. 7). Пептид LL37 соответствует С-концевому фрагменту противобактериального белка - кателицидина человека (hCAP18), который является компонентом врожденной иммунной системы и обладает широким спектром противобактериальной активности (Heilborn et al., The cathelicidin antimicrobial peptide LL37 is involved in re-epithelization of human skin wounds and is lacking in chronic ulcer epithelium, J. Invest. Dermatol. 120(3): 379-389 (2003)). Таким образом, одиннадцатый объект настоящего изобретения относится к композиции (композиции по настоящему изобретению), включающей липидные наночастицы по первому, второму и пятому объекту настоящего изобретения, и липидные наночастицы, включающие по крайней мере один твердый при комнатной температуре липид, по крайней мере одно неионное ПАВ и пептид LL37. В особом варианте этого объекта композиция включает EGF-нагруженные частицы NLC и LL37-нагруженные частицы NLC. В другом особом варианте композиция включает EGF-нагруженные частицы SLN и LL37-нагруженные частицы SLN. В еще одном особом варианте этого объекта соотношение в композиции нагруженных ростовым фактором, предпочтительно EGF-нагруженных липидных наночастиц и LL37-нагруженных липидных наночастиц находится в интервале от 1:17 до 1:34. В другом особом варианте композиция включает 15 нг/мл EGF-нагруженных липидных наночастиц и от 0,25 до 5 мкг/мл LL37-нагруженных липидных наночастиц.
Двенадцатый объект настоящего изобретения относится к фармацевтической композиции, включающей композицию по одиннадцатому объекту настоящего изобретения, описанному в последнем абзаце, и фармацевтический носитель. В предпочтительном варианте этого объекта фармацевтическую композицию наносят местным способом. Таким образом, в особом варианте осуществления настоящего изобретения фармацевтическая композиция дополнительно включает коллаген, гиалуроновую кислоту, алое вера, фибрин, полимеры carbopol® и производные целлюлозы.
Более того, тринадцатый объект настоящего изобретения относится к фармацевтической композиции по двенадцатому объекту для применения в качестве лекарственного средства.
Четырнадцатый объект настоящего изобретения относится к фармацевтической композиции, определенной в двенадцатом объекте, для применения при ускорении ранозаживления у субъекта.
Пятнадцатый объект настоящего изобретения относится к липидной наночастице, включающей по крайней мере один твердый при комнатной температуре липид, по крайней мере одно неионное ПАВ и пептид LL37. Особые варианты осуществления настоящего изобретения, описанные в первом объекте, можно применять к LL37-нагруженным липидным наночастицам по пятнадцатому объекту, при замене фактора роста или EGF на пептид LL37.
Шестнадцатый объект настоящего изобретения относится к липидной наночастице по пятнадцатому объекту, дополнительно включающей жидкий при комнатной температуре липид. Особые варианты осуществления настоящего изобретения, описанные во втором объекте, можно применять к LL37-нагруженным липидным наночастицам по этому объекту при замене фактора роста или EGF на пептид LL37.
Семнадцатый объект настоящего изобретения относится к способу (далее способ 3) получения липидных наночастиц по пятнадцатому объекту настоящего изобретения, который отличается тем, что включает аналогичные стадии способа 1, описанного в третьем объекте, но в липофильный раствор (ii) вместо фактора роста добавляют пептид LL37. Особые варианты осуществления, описанные для способа 1 в третьем объекте настоящего изобретения, можно применять в способе 3, но при замене фактора роста или EGF на пептид LL37.
Восемнадцатый объект настоящего изобретения относится к способу (далее способ 4) получения липидных наночастиц по шестнадцатому объекту настоящего изобретения, который отличается тем, что включает аналогичные стадии способа 2, описанного в четвертом объекте, но в липофильный раствор (ii) вместо фактора роста добавляют пептид LL37.
Девятнадцатый объект настоящего изобретения относится к липидным наночастицам, полученным способом 3, и к липидным наночастицам, полученным способом 4, описанным в семнадцатом и восемнадцатом объектах, соответственно.
Что касается пептида LL37, то его можно синтезировать в автоматическом пептидном синтезаторе и с использованием стандартных методов пептидного синтеза. Более того, его можно получить в виде коммерческого препарата, выпускаемого, например, на фирме Sigma-Aldrich. Аминокислотная последовательность пептида LL37 соответствует последовательности SEQ ID NO 1 (LLGDFFRKSKEKIGKEFKRIVQRIKDFLRNLVPRTES).
Важный признак LL37-нагруженных липидных наночастиц по настоящему изобретению заключается в том, что они высвобождают нагруженный фактор роста в режиме замедленного высвобождения. LL37-Нагруженные липидные наночастицы обеспечивают профиль высвобождения, который характеризуется фазой начального высвобождения («взрывное» высвобождение), соответствующего процентному содержанию связанного на поверхности пептида, последующей фазой быстрого высвобождения продолжительностью от 4 ч до 24 ч, медленной фазой продолжительностью от 24 ч до 72 ч и конечной фазой высвобождения общего количества пептида LL37 (табл. 4, пример 2).
Неожиданно авторами было установлено, что LL37-нагруженные липидные наночастицы характеризуются неожиданно более высокой скоростью пролиферации фибробластов in vitro по сравнению с пептидом LL37 в свободной форме (пример 3, раздел 3.3, фиг. 6). Таким образом, двадцатый объект настоящего изобретения относится к LL37-нагруженным липидным наночастицам по пятнадцатому, шестнадцатому и девятнадцатому объектам, для их применения в качестве лекарственного средства.
Двадцать первый объект настоящего изобретения относится к LL37-нагруженным липидным наночастицам по пятнадцатому, шестнадцатому и девятнадцатому объектам, для применения при ускорении ранозаживления у субъекта.
Двадцать второй объект настоящего изобретения относится к фармацевтической композиции, включающей LL37-нагруженные липидные наночастицы по пятнадцатому, шестнадцатому и девятнадцатому объектам и фармацевтически приемлемый носитель. В предпочтительном варианте этого объекта фармацевтическую композицию наносят местным способом. Таким образом, фармацевтическая композиция дополнительно содержит коллаген, гиалуроновую кислоту, алое вера, фибрин, полимеры carbopol® и производные целлюлозы.
Двадцать третий объект настоящего изобретения относится также к фармацевтической композиции по двадцать второму объекту для ее применения в качестве лекарственного средства.
Двадцать четвертый объект настоящего изобретения относится к фармацевтической композиции, определенной в двадцать втором объекте, для ее применения при ускорении ранозаживления.
И наконец, двадцать пятый объект настоящего изобретения относится к набору, включающему любую из липидных наночастиц, определенных в первом, втором, пятом, пятнадцатом, шестнадцатом и девятнадцатом объектах, или их смеси. Соответственно, этот объект относится к набору, включающему любую из фармацевтических композиций, описанных в шестом, двенадцатом и двадцать втором объектах настоящего изобретения.
Представленные ниже примеры служат для дополнительной иллюстрации изобретения и для ознакомления специалистов в данной области техники с полным раскрытием и описанием способов получения липидных наночастиц и их оценки, и эти примеры не ограничивают объем настоящего изобретения. Если не указано иное, в примерах указаны количества в массовых процентах, температура в градусах Цельсия или указаны условия при температуре окружающей среды и при атмосферном давлении или при близком к атмосферному давлению.
Примеры
Пример 1
Получение липидных наночастиц
Частицы SLN и NLC получали методом на основе эмульгирования-обработки ультразвуком (Muller et al., 2002; Che et al., 2010 (Effects of lipophilic emulsifiers on the oral administration of lovastatin from nanostructured lipid carriers: Physicochemical characterization and pharmacokinetics. European Journal of Pharmaceutics and Biopharmaceutics 74, 474-482)).
В случае rhEGF-нагруженных SLN: 10 мл 1 об./об. %-ного водного раствора твин 80 добавляли к 2 мл раствора дихлорметана, содержащего 0,1 мас./об. % коммерческого rhEGF и 10 мас./мас. % реагента Precirol® АТО 5. После этого смесь немедленно эмульгировали в течение 20 с при 50 Вт (ультразвуковой дезинтегратор Branson® 250, СТ, США). На этой стадии получали эмульсию масло-вода, которую затем перемешивали в течение 2 ч для экстракции органического растворителя и для отверждения частиц. Затем частицы SLN собирали центрифугированием при 2500 об/мин в течение 10 мин с использованием ячейки с центрифужным фильтром с размером пор 100 кДа (Amicon® Ultra, Millipore, Испания) и промывали три раза водой miliQ. И наконец, в качестве криопротектора добавляли трегалозу в водном растворе, содержащем 15% Precirol® АТО 5.
В случае rhEGF-нагруженных NLC: теплый водный раствор, содержащий 0,67 мас./об. % полоксамера и 1,33 мас./об. % твин 80, нагревали при 40°C в течение 1 мин и выливали в смесь на основе 200 мг расплавленного Precirol® АТО 5, содержащую 2 мг коммерческого rhEGF и 20 мг миглиола, также нагретую при 40°C в течение 1 мин. Затем полученную смесь эмульгировали в течение 15 с при 50 Вт (ультразвуковой дезинтегратор Branson® 250, СТ, США) и хранили в течение 12 ч при 4°C, при этом липид повторно кристаллизуется и формируются частицы NLC. И наконец, частицы собирали, промывали и высушивали лиофильно, как описано ранее. Конечное содержание rhEGF как в частицах SLN, так и в частицах NLC составляло 1 мас./мас. %.
LL37-нагруженные SLN и LL37-нагруженные NLC получали, как описано для rhEGF-нагруженных SLN и rhEGF-нагруженных NLC, соответственно, но при замене rhEGF на синтетический (Sigma-Aldrich 94261) или рекомбинантный пептид LL37.
Пример 2
Характеризация липидной наночастицы
2.1 Средний размер (z-средняя величина) и коэффициент полидисперсности (КП) измеряли методом фотонно-корелляционной спектроскопии. Каждый анализ проводили в трех повторах до и после лиофилизации наночастиц. Zeta-потенциал (ζ) определяли методом допплеровской анемометрии (ЛДА). Все описанные выше измерения проводили с использованием системы Malvern® Zetasizer 3000 instrument (Malvern Instruments, Worcestershire, Великобритания). Внешний вид и морфологию сферы определяли методом сканирующей электронной микроскопии (СЭМ, Jeol® JSM-35 CF) и методом трансмиссионной электронной микроскопии (ТЭМ).
2.2 Эффективность включения (ЭВ) рассчитывали косвенным методом, измеряя количество rhEGF в свободной форме и LL37 в свободной форме, удаляемых методом фильтрации/центрифугирования, который использовали для сбора частиц SLN и NLC. Каждый образец разбавляли в соотношении 1:10000 фосфатно-солевым раствором Дульбекко (DPBS), содержащим 0,05 об./об. % твин 80 и 0,1 мас./мас. % бычьего сывороточного альбумина (БСА). Количество rhEGF в свободной форме и LL37 в свободной форме оценивали с использованием коммерческих наборов для твердофазного иммуноферментного анализа (ИФА) для определения EGF человека (human EGF ELISA development kit, Peprotech) и для определения пептида LL37 человека (Human LL-37 ELISA development kit, Hycult biotech), с использованием инструкций фирмы-производителя. Эффективность включения (ЭВ) рассчитывали по следующему уравнению:
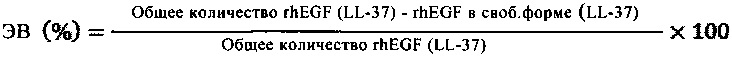
Все анализы проводили в трех повторах и результаты регистрировали в виде средних величин ± СО.
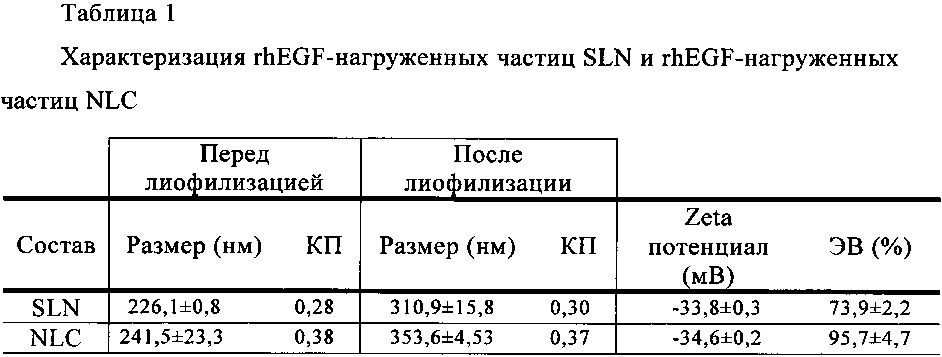
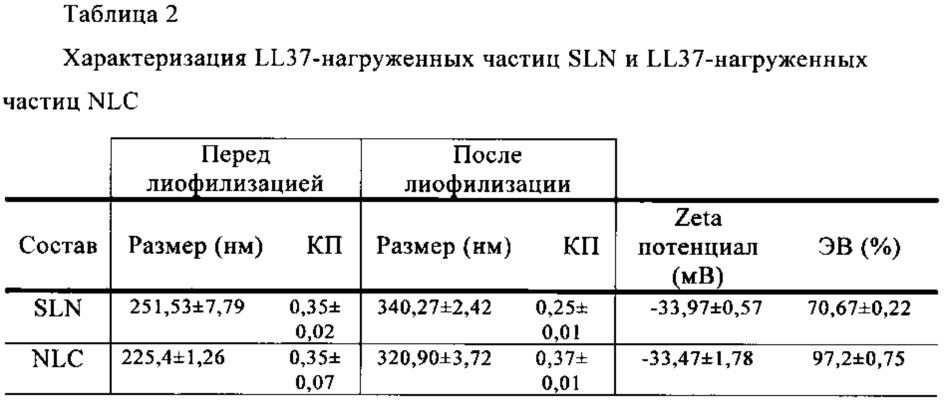
Как показано в табл. 1 и 2, величины КП для всех составов до и после лиофилизации составляли менее 0,5, что подтверждает гомогенное распределение по размеру всех составов во всех случаях. Воссоздание сухих частиц для измерения их размера происходило без затруднений, что свидетельствовало об отсутствии слияния или агрегации частиц, несмотря на увеличение размера. Что касается Zeta потенциала, оба состава характеризуются одинаковым поверхностным зарядом, приблизительно -34 мВ. Кроме того, данные ИФА свидетельствуют о том, что величина ЭВ для NLC несколько выше по сравнению с ЭВ для SLN.
Оба состава характеризуются гладкой поверхностью наночастиц и отсутствием пор на поверхности. Напротив, изображения, полученные как методом СЭМ, так и методом ТЭМ, свидетельствуют о том, что частицы SLN характеризуются более регулярной структурой по сравнению с частицами NLC (данные не показаны).
2.3 Испытания на высвобождение in vitro
Испытания на высвобождение проводили при инкубации 32 мг и 23 мг частиц SLN или NLC (что соответствовало ~200 мкг rhEGF или LL37) в 2 мл 0,02 М фосфатно-солевого буферного раствора (PBS) в течение 3 сут. Через определенные интервалы времени среду, содержащую высвобожденные вещества, удаляли методом фильтрации/центрифугирования и заменяли равным объемом PBS. Количество rhEGF и LL37 определяли методом ИФА по методике, описанной в разделе 2.2.
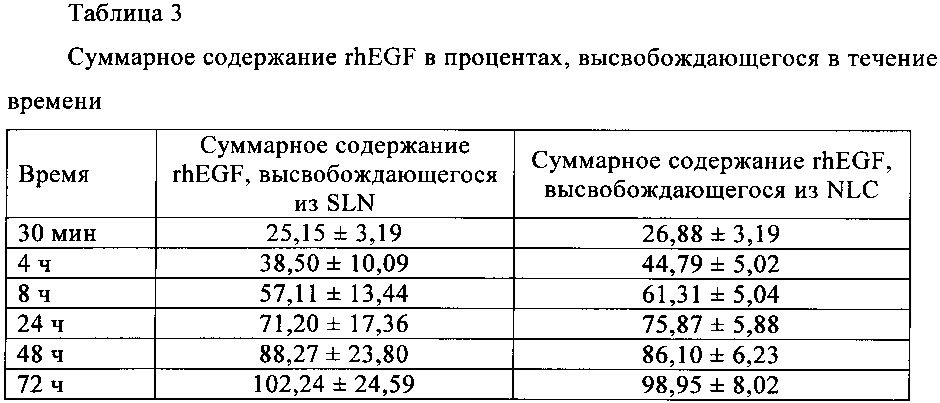

Профили высвобождения rhEGF и LL37 in vitro, представленные в табл. 3 и в табл. 4, соответственно, свидетельствуют о том, что оба состава характеризуются аналогичным характером высвобождения. Во первых, наблюдается фаза начального высвобождения («взрывное» высвобождение) соответствующая процентному содержанию связанного на поверхности белка или пептида, с последующей фазой быстрого высвобождения продолжительностью от 4 ч до 24 ч, и наконец, медленная фаза продолжительностью от 24 ч до 72 ч и конечная фаза высвобождения общего количества rhEGF и LL37.
Пример 3
Клеточная пролиферация, захват клетками и проникновение через кожу наночастиц
3.1 Влияние rhEGF-нагруженных наночастиц на клеточную пролиферацию
Для анализа пролиферации использовали 24-луночный планшет. 35000 фибробластов Balb/C 3Т3 ресуспендировали в 1 мл полной культуральной среды (DMEM, дополненная 10% фетальной телячьей сывороткой (ФТС)) и высеивали в каждую лунку планшета. После инкубации в течение 8 ч среду заменяли на 1 мл среды DMEM, дополненной 0,2% ФТС и лунки инкубировали в течение ночи. Затем среду заменяли на 1 мл следующих препаратов: (i) среда DMEM, дополненная 0,2% ФТС, (ii) 15 нг/мл rhEGF в свободной форме в среде DMEM, дополненной 0,2% ФТС, (iii) ненагруженные SLN в среде DMEM, дополненной 0,2% ФТС, (iv) 15 нг/мл rhEGF-нагруженных SLN (rhEGF-SLN) в среде DMEM, дополненной 0,2% ФТС, (v) ненагруженные NLC в среде DMEM, дополненной 0,2% ФТС, и (vi) 15 нг/мл rhEGF-нагруженных NLC (rhEGF-NLC) в среде DMEM, дополненной 0,2% ФТС.
Клетки культивировали в тех же условиях в течение 24 ч, 48 ч и 72 ч. Эксперименты проводили в трех повторах. Через различные периоды инкубации в каждую лунку добавляли по 100 мкл ССК-8 (Sigma-Aldrich, Saint Louise, США) (Zhou Y., Qian M., Liang Y., Liu Y., Yang X., Jiang Т., Wang Y., Effects of Leukemia Inhibitory Factor on Proliferation and Odontoblastic Differentiation of Human Dental Pulp Cells, J. Endod. 37, 819-824 (2011)). Через 4 ч инкубации в лунках планшета измеряли поглощение при 450 нм и при 650 нм в качестве длины волны сравнения. Поглощение изменялось прямо пропорционально числу живых клеток в культуре.
Анализ пролиферации, который проводили с использованием клеток Balb/C 3Т3, свидетельствует о митогенном эффекте rhEGF. На фиг. 1 показано, что пролиферация клеток возрастает в группах, обработанных rhEGF (rhEGF-NLC, rhEGF-SLN и rhEGF в свободной форме), по сравнению с контролем через 48 ч и 72 ч. Неожиданно было установлено, что rhEGF, включенный в липидные наночастицы (как в случае SLN, так и в случае NLC), оказывает более высокий митогенный эффект на фибробласты Balb/C 3Т3 по сравнению с rhEGF в свободной форме.
3.2 Влияние LL37-нагруженных наночастиц на пролиферацию клеток
Эксперимент проводили, как описано в разделе 3.1, но с использованием эндотелиальных клеток пупочной вены человека (HUVEC, Human Umbilical Vein Endothelial Cells). В эксперименте использовали следующие препараты: (i) среда DMEM, дополненная 0,2% ФТС, (ii) 0,5 и 0,1 мкг/мл LL37 в свободной форме в среде DMEM, дополненной 0,2% ФТС, (iii) ненагруженные SLN в среде DMEM, дополненной 0,2% ФТС, (iv) 0,5 и 0,1 мкг/мл LL37-нагруженных SLN (LL37-SLN) в среде DMEM, дополненной 0,2% ФТС, (v) ненагруженные NLC в среде DMEM, дополненной 0,2% ФТС, и (vi) 0,5 и 0,1 мкг/мл LL37-нагруженных NLC (rhEGF-NLC) в среде DMEM, дополненной 0,2% ФТС, и (vii) 10% ДМСО в качестве отрицательного контроля.
Анализ пролиферации, проведенный с использованием клеток HUVEC, свидетельствует о митогенном эффекте LL37. На фиг. 6 показано, что пролиферация клеток возрастает в группах, обработанных LL37 (LL37-NLC, LL37-SLN и LL37 в свободной форме), по сравнению с контролем для обеих доз через 48 ч.
3.3 Захват клетками составов NileRed-SLN и NileRed-NLC
50000 фибробластов Balb/C 3Т3 и 100000 кератоцитов НаСаТ культивировали каждые в отдельности на покровных стеклах в полной культуральной среде в течение 24 ч. Затем среду заменяли на 1 мл среды для анализа. Исследовали следующие препараты: (i) 25 мкг NileRed-SLN в полной среде DMEM и (ii) 25 мкг NileRed-NLC в полной среде DMEM. Через 1 ч инкубации клетки промывали и фиксировали. Затем ядра окрашивали реагентом DAPI (500 нг/мл) и покровные стекла помещали в слайды для анализа в флуоресцентном микроскопе.
Результаты, полученные при исследовании захвата клетками, показаны на фиг. 2. Цитоплазма клеток окрашивается в красный цвет (белые стрелки на фиг. 2) благодаря интернализации SLN и NLC. На фигуре показана способность NileRed-SLN и NileRed-NLC проникать в клетки. Различие между способностью к захвату для частиц SLN и NLC не наблюдается.
3.4 Одновременный захват составов SLN и NLC
Эксперимент проводили, как описано в статье  et al., Nanoparticles for skin penetration enhancement - A comparison of dendritic core-multishell-nanotransporter and solid lipid nanoparticles, Eur. J. Pharm. Biopharm, 71:243-250 (2009). В качестве материала для обработки и контроля использовали кожу определенных животных. Исследовали следующие препараты (n=3): (i) NileRed-SLN, (ii) NileRed-NLC и (iii) NileRed-нагруженный парафиновый крем, использованный в качестве контроля. Все препараты содержали NileRed в одинаковой концентрации 0,004%. Кожу выдерживали при 32°C в течение 24 ч. Затем кожу отмывали PBS, высушивали и разрезали на вертикальные срезы (от нижней до внешней поверхности) толщиной 20 мкм с использованием замораживающего микротома (Frigocut 2800 N, Leica, Bensheim, Германия). Срезы хранили при -20°C и анализировали в течение 24 ч, а затем облучали видимым и флуоресцентным светом.
et al., Nanoparticles for skin penetration enhancement - A comparison of dendritic core-multishell-nanotransporter and solid lipid nanoparticles, Eur. J. Pharm. Biopharm, 71:243-250 (2009). В качестве материала для обработки и контроля использовали кожу определенных животных. Исследовали следующие препараты (n=3): (i) NileRed-SLN, (ii) NileRed-NLC и (iii) NileRed-нагруженный парафиновый крем, использованный в качестве контроля. Все препараты содержали NileRed в одинаковой концентрации 0,004%. Кожу выдерживали при 32°C в течение 24 ч. Затем кожу отмывали PBS, высушивали и разрезали на вертикальные срезы (от нижней до внешней поверхности) толщиной 20 мкм с использованием замораживающего микротома (Frigocut 2800 N, Leica, Bensheim, Германия). Срезы хранили при -20°C и анализировали в течение 24 ч, а затем облучали видимым и флуоресцентным светом.
Для всех экспериментов корректированные величины яркости пикселей ABU, полученные при захвате красителя, корректировали по данным захвата нагруженного красителем NileRed парафинового крема. Полученный параметр, названный эффектом увеличения проникновения (ЭУП) рассчитывали для всех срезов кожи. Величину для парафинового крема принимали за 1 (Lombardi Borgia S., Regehly M., Sivaramakrishnan R., Mehnert W., Korting H.C., Danker K., Roder В., Kramer K.D., Schafer-Korting M., Lipid nanoparticles for skin penetration enhancement-correlation to drug localization within the particle matrix as determined by fluorescence and parelectric spectroscopy, J. Control. Release 110, 151-163 (2005)).
Величины ЭУП, рассчитанные из корректированных величин яркости пикселей ABU для срезов кожи, представлены на фиг. 5. Величины ЭУП свидетельствуют о том, что для всех срезов кожи проникновение красителя для SLN-NileRed и для NLC-NileRed наблюдается превышение величин ЭУП в четыре раза в роговом слое (4,74 и 4,62, соответственно) и приблизительно в два раза в эпидермисе (2,09 и 2,03, соответственно. Незначительное, но достаточно часто высокое увеличение проникновения наблюдается также в дерме (1,29 и 1,32, соответственно). Иными словами, величины ABU и ЭУП, превышающие 1, указывают на улучшенную способность к проникновению через кожу частиц SLN и NLC по сравнению с парафиновым кремом. Более того, полученные данные отражают также способность этих наночастиц к доставке NileRed в кожу и, следовательно, rhEGF и LL37.
Пример 4
Пролиферация фибробластов in vitro в присутствии rhEGF/LL37/комбинации rhEGF и LL37
Эксперимент проводили, как описано в разделе 3.1. Синергетический эффект LL37 и rhEGF оценивали с использованием фибробластов Balb/C и керацитов HaCat. Для анализа пролиферации использовали 24-луночные планшеты. 35000 фибробластов Balb/C 3Т3, ресуспендированых в 1 мл полной культуральной среды (DMEM, дополненная 10% фетальной телячьей сывороткой (ФТС)), высеивали в каждую лунку планшета. После инкубации в течение 8 ч среду заменяли на 1 мл среды DMEM, дополненной 0,2% ФТС и клетки инкубировали в течение ночи. Затем среду заменяли на 1 мл следующих препаратов: (i) среда DMEM, дополненная 0,2% ФТС, (ii) 15 нг/мл rhEGF в свободной форме, (iii) 5, 0,5 и 0,25 мкг/мл LL37, (iv) 15 нг rhEGF и 5, 0,5 и 0,25 мкг/мл LL37. Клетки культивировали при 37°C и в атмосфере 5% CO2 в течение 24 ч, 48 ч и 72 ч.
Анализ пролиферации с использованием кератоцитов человека НаСаТ и фибробластов Balb/C показал, что через 48 ч в присутствии 10 и 50 нг/мл LL37 и 15 нг/мл rhEGF наблюдается в значительной степени повышенный митоз по сравнению с rhEGF в свободной форме в отдельности (фиг. 7).
Пример 5
Ранозаживление in vivo в присутствии rhEGF-нагруженных SLN и rhEGF-нагруженных NLC
Эффективность ранозаживления rhEGF-нагруженных SLN и rhEGF-нагруженных NLC исследовали в присутствии двух различных rhEGF-содержащих составов: (i) 75 мкг лиофилизированного rhEGF (аналогичен коммерческому препарату Heberprot®) и (ii) 75 мкг rhEGF, включенного в 1 мас./мас. % нагруженные полимерные микрокапсулы (75 мкг rhEGF-MC), полученные в нашей лаборатории с использованием комбинации альгината и сополимера молочной и гликолевой кислот (PLGA) методом двойной эмульсии, как описано в европейском патенте EP 12382476. Краткое описание методики: 2 мл раствора дихлорметан/ацетон 3:1, содержащего 5 мас./об. % PLGA (Resomer RG503), эмульгировали при обработке ультразвуком в течение 15 с при 50 Вт в смеси с 0,2 мл внутренней водной фазы (вода miliQ), содержащей 0,05% мас./об. rhEGF, 2,5% мас./об. сывороточного альбумина человека (ЧСА), 0,25 мас./об. % полиэтиленгликоля 400 (ПЭГ400) и 2,5 мас./об. % альгината натрия MVG (Pronova UP, NovaMatrix FMC BioPolymer, Sandvika, Норвегия). Полученную эмульсию (вода1/масло) выливали в 15 мл водного раствора, содержащего 5% поливинилового спирта (ПВС) и 5% NaCl, и эмульгировали с использованием лопастной мешалки в течение 60 с, при этом получали двойную эмульсию (вода1/масло/вода2). И наконец, добавляли 400 мл водного раствора 5% NaCl и 0,6 мМ хлорида кальция и перемешивали в течение 30 мин. Затем микросферы собирали фильтрацией и высушивали лиофильно.
5.1 Животные
Для испытаний использовали 80 самцов мышей db/db возрастом 8 недель. Генетическую модель мышей db/db с диабетом (BKS.Cg-m+/+Leprdb/J) получали в лаборатории Javier (Saint Berthevin Cedex). Все процедуры выполняли согласно протоколам, утвержденным Комитетом по содержанию и использованию лабораторных животных университета страны Басков.
5.2 Проведение экспериментов
Эксперименты проводили по оптимизированной методике, описанной в статье Michaels et al., db/db Mice exhibit severe wound-healing impairments compared with other murine diabetic strains in a silicone-splinted excisional wound model, Wound Repair and Regeneration 15, 665-670 (2007)). Животных распределяли в 10 следующих групп: (n=8): (i) необработанный контроль, (ii) 75 мкг rhEGF в свободной форме, (iii) ненагруженные МС, (iv) ненагруженные SLN, (v) ненагруженные NLC, (vi) 75 мкг rhEGF-MC, (vii) 10 мкг rhEGF-SLN, (viii) 20 мкг rhEGF-SLN, (ix) 10 мкг rhEGF-NLC и (x) 20 мкг rhEGF-NLC.
Наночастицы, предварительно ресуспендированные в 20 мкл носителя (0,5% карбоксиметилцеллюлоза в 0,9% солевом растворе), вводили микропипеткой местным способом два раза в неделю и позволяли составу распределиться по раневому ложу. rhEGF в свободной форме, ресуспендированый в 0,5 мл носителя, вводили внутриочаговым способом два раза в неделю, протыкая иглу внутрь раны. 75 мкг rhEGF-M, также ресуспендированных в 0,5 млм носителя, вводили внутриочаговым способом однократно в день нанесении раны.
5.3 Оценка ранозаживления
Эффективность лечения в отношении улучшения ранозаживления оценивали при измерении площади раны (см2) в день операции и в дни 4, 8, 11 и 15 после нанесении раны (фиг. 3Б) с использованием цифровой камеры (Lumix FS16, Panasonic®, Испания) и программы анализа изображений (ImageJ®, Biophotonics Facility, Университет McMaster, Канада). Закрытие раны выражали в процентах от начальной площади раны.
Во всех экспериментальных группах (20 и 10 мкг rhEGF-SLN, 20 и 10 мкг rhEGF-NLC и 75 мкг rhEGF-MC), начиная с дня 4 (фиг. 3А) наблюдалось снижение площади раны в большей степени по сравнению с соответствующими контрольными группами (для групп rhEGF-SLN в качестве контролей использовали rhEGF в свободной форме, ненагруженные SLN и необработанный контроль, для групп rhEGF-NLC в качестве контролей использовали rhEGF в свободной форме, ненагруженные NLC и необработанный контроль, а для 75 мкг rhEGF-MC в качестве контроля использовали rhEGF в свободной форме, ненагруженные МС и необработанный контроль). При этом не наблюдалось статистически значимой разницы между обоими типами липидных наночастиц (rhEGF-SLN и rhEGF-NLC), и напротив, наблюдалось закрытие раны в значительно большей степени по сравнению с 75 мкг rhEGF-MC и rhEGF в свободной форме (р<0,001). Что касается контрольных групп, в группе 75 мкг rhEGF-MC также наблюдалось статистически значимое закрытие раны. Во всех экспериментальных группах и их контрольных группах самая значительная разница между закрытиями ран достигалась в день 8. И опять, не наблюдалось статистически значимой разницы между группами rhEGF-SLN, rhEGF-NLC и 75 мкг rhEGF-MC. Интересно отметить, что через 11 дней после нанесении раны у животных, обработанных 20 мкг rhEGF-SLN, наблюдалось закрытие раны в еще большей степени по сравнению с другими экспериментальными группами (р<0,05 для 10 мкг rhEGF-SLN, 20 и 10 мкг rhEGF-NLC и р<0,001 для 75 мкг rhEGF-MC) и их контрольными группами. Однако в других экспериментальных группах также наблюдалось закрытие раны, хотя и в меньшей степени. При завершении испытаний в день 15 в группах, обработанных всеми липидными составами наночастиц, наблюдалось почти полное закрытие ран. Неожиданно было установлено, что при обработке составом 75 мкг rhEGF-MC происходит замедленное закрытие раны (73,16±3,24%) по сравнению с липидными частицами (~95%). Важно также отметить, что при многократном введении rhEGF в свободной форме наблюдалось различие в меньшей степени среди всех контрольных групп по сравнению с составами rhEGF-нагруженных наночастиц.
5.4 Гистологический анализ ранозаживления
В дни 8 и 15 животных умерщвляли с помощью CO2-ингалиции. Раны и окружающие ткани (~1 см) вырезали и фиксировали в 3,7% параформальдегиде в течение 24 ч. Затем фиксированные ткани разрезали пополам, включали в парафин и разрезали на слои толщиной 5 мкм. Для морфологического анализа образцы окрашивали реагентом Н&Е.
Для оценки разрешения фаз излечения воспалительного восстановления ткани (фиг. 4А) и созревания раны использовали шкалу Котрана (Cotran R., Kumar V., Collins Т.,  de los tejidos:
de los tejidos:  celular у fibrosis.
celular у fibrosis.  estructural у funcional: Mc Graw Hill Interamericana, cc. 95-120 (2000)). Показатель для каждой раны определяли по полуколичественной шкале в интервале от 0 до 4 баллов. 0 означает отсутствие воспалительного ответа, 1 - острое воспаление (формирование фибриновых сгустков и гнойной оболочки, миграция лейкоцитов и полиядерных нейтрофилов), 2 - преобладание диффузного острого воспаления (преобладание грануляционной ткани и гнойной оболочки, регенерация сосудов), 3 - преобладание хронического воспаления (пролиферация фибробластов), 4 - разрешение воспаления и заживление раны (снижение или отсутствие хронического воспаления, хотя могут все еще присутствовать эпизодические круглые клетки).
estructural у funcional: Mc Graw Hill Interamericana, cc. 95-120 (2000)). Показатель для каждой раны определяли по полуколичественной шкале в интервале от 0 до 4 баллов. 0 означает отсутствие воспалительного ответа, 1 - острое воспаление (формирование фибриновых сгустков и гнойной оболочки, миграция лейкоцитов и полиядерных нейтрофилов), 2 - преобладание диффузного острого воспаления (преобладание грануляционной ткани и гнойной оболочки, регенерация сосудов), 3 - преобладание хронического воспаления (пролиферация фибробластов), 4 - разрешение воспаления и заживление раны (снижение или отсутствие хронического воспаления, хотя могут все еще присутствовать эпизодические круглые клетки).
Процесс реэпителизации (фиг. 4Б, Г) оценивали в баллах по критериям, установленным Sinha et al. (Sinha U.K., Gallagher L.A., Effects of steel scalpel, ultrasonic scalpel, CO2 laser, and monopolar and bipolar electrosurgery on wound healing in guinea pig oral mucosa, Laryngoscope 113, 228-236 (2003)). 0 означает реэпителизацию на краях раны, 1 - зона реэпителизации покрывает менее половины площади раны, 2 - зона реэпителизации покрывает более половины площади раны, 3 - зона реэпителизации покрывает всю площадь раны с неравномерной толщиной и 4 - зона реэпителизации покрывает всю площадь раны с нормальной толщиной.
5.5 Статистический анализ
Все данные представляли в виде средних величин±стандартное отклонение (СО). На основании результата анализа с использованием критериев однородности дисперсии Левена средние величины сравнивали с использованием t критерия Стьюдента или одностороннего анализа ANOVA для множественных сравнений. Затем использовали ретроспективный post-hoc анализ Бонферрони или Тамхана. Различия считали значимыми при р<0,05. Вычисления проводили с использованием программы SPSS 20.0 (SPSS®, Inc., Чикаго, ИЛ).
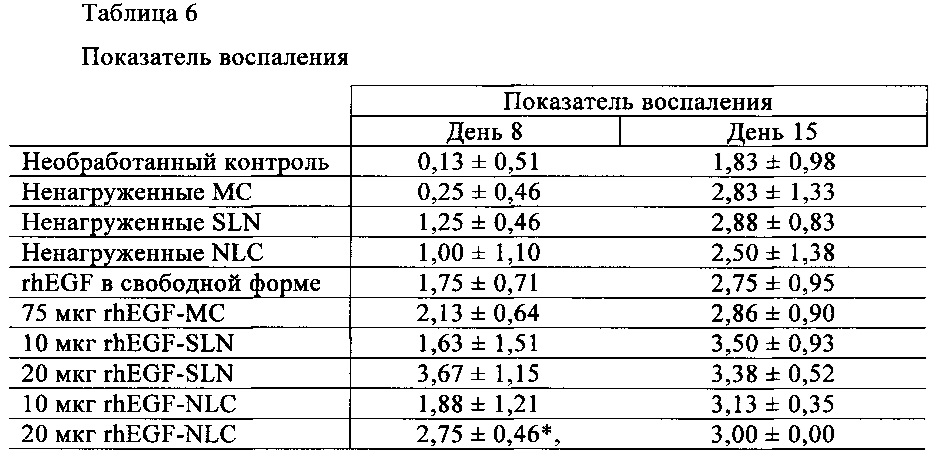
В день 8 только при введении 20 мкг rhEGF-SLN наблюдается состояние хронического воспаления, близкое к полному разрешению, при котором преобладает пролиферация фибробластов (3,67±1,15 баллов) (табл. 6). Животные, обработанные 20 мкг rhEGF-NLC, с почти полным преобладанием состояния острого воспаления, близкого к хроническому состоянию, характеризуются меньшим воспалением в баллах (2,75±0,45). Однако такое различие не является статистически значимым. Кроме того, оба состава обеспечивают восстановление ткани в большей степени по сравнению с их контрольными группами. И наоборот, 10 мкг rhEGF-NLC и 10 мкг rhEGF-NLC не устраняют состояние острого воспаления (<2,00), тем не менее было выявлено различие между этими группами и необработанной контрольной группой, что указывает на отсутствие воспалительного ответа. Состав 10 мкг rhEGF-NLC также отличался (<0,05) от своей контрольной группы (ненагруженные NLC).
Анализ зависимости действия от дозы (20 мкг или 10 мкг) липидных наночастиц показал улучшенное разрешение воспаления только для состава 20 мкг rhEGF-SLN (выше, чем 10 мкг rhEGF-SLN).
Гистопатологический анализ также показал, что в ранах, обработанных rhEGF, преобладает состояние диффузного острого воспаления с параметром воспаления в баллах 2,13±0,64 (значимо выше по сравнению с соответствующими контрольными группами). Эти различия не достигают статистической значимости с любой липидной наносферой (ни с rhEGF-SLN, ни с rhEGF-NLC).
Как было указано выше, через 15 дней после нанесении раны наблюдалась тенденция к снижению различий, которые не достигают статистической значимости между группами и их контролями.
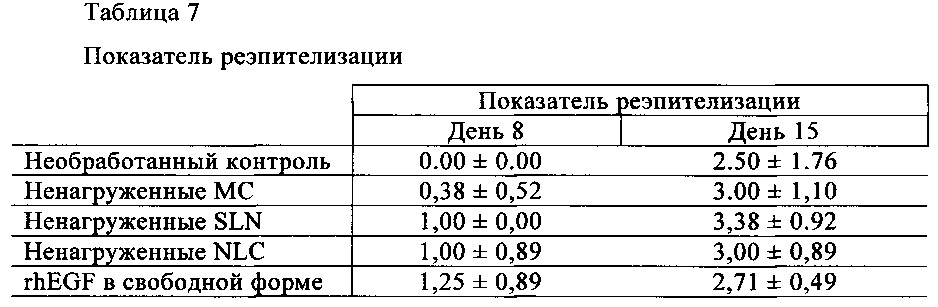
Что касается реэпителизации, данные, полученные в день 8, свидетельствуют о том, что только в группах, обработанных липидными наночастицами в самой высокой дозе (20 мкг), и у животных, обработанных 75 мкг rhEGF-MC, наблюдается новый эпителий, покрывающий более половины площади раны (>2,00 соответственно критериям Sinha U.K. (2003)). Более того, между этими группами и их контрольными группами выявлены статистически значимые различия (rhEGF в свободной форме, ненагруженные SLN и необработанный контроль для 20 мкг rhEGF-SLN, и rhEGF в свободной форме, ненагруженные NLC и необработанный контроль для 20 мкг rhEGF-NLC) (фиг. 5). И наоборот, в группах, обработанных липидными наночастицами с низкой дозой rhEGF (10 мкг rhEGF-SLN и 10 мкг rhEGF-NLC), новый эпителий не покрывает более половины площади раны. Более того, хотя выявлены значительные различия с необработанной группой (р<0,01), наблюдается тенденция снижения статистической значимости для ненагруженных SLN в случае 10 мкг rhEGF-NLC, даже если 10 мкг rhEGF-нагруженных липидных частиц характеризовались более высокими показателями реэпителизации (фиг. 4Б). Что касается 75 мкг rhEGF-MC, в день 8 площадь реэпителизации занимала более половины площади раны, и были выявлены статистически значимые различия между составом 75 мкг rhEGF-MC и контрольными группами (необработанный контроль и необработанные МС).
Таким образом, исследование процесса реэпителизации (табл. 7) показало, что у животных, обработанных 4 дозами по 75 мкг rhEGF в свободной форме, наблюдается более высокий показатель реэпителизации по сравнению с необработанными группами (1,25±0,89 и 0,00±0,00, соответственно). Неожиданно было установлено, что при многократном внутриочаговом введении rhEGF в свободной форме наблюдается улучшение реэпитализации в меньшей степени по сравнению с реэпителизацией после четырех введений местным способом rhEGF-SLN и rhEGF-NLC и однократного внутриочагового введения дозы 75 мкг rhEGF-MC.
Через 15 дней после нанесении раны исследование реэпителизации не выявило различий между группами.

Пример 6
Ранозаживление in vivo у свиней с использованием rhEGF-нагруженных NLC
6.1 Животные
Все использованные протоколы и процедуры были ранее утверждены Комитетом по содержанию и использованию лабораторных животных при хирургическом центре 
 Minimally Invasive Surgery Centre (JUMISC). Шесть самок свиней крупной белой породы со средней массой тела 26,82±2,90 кг в начале испытаний распределяли в индивидуальные загоны размером 2,90 м×1,35 м. Всех экспериментальных животных рандомизировали в помещения для акклиматизации, где поддерживали следующие условия содержания животных: 12-ти часовой цикл свет-темнота, температура от 20 до 25°C, смена воздуха восемь раз в час с использованием вентиляции с фильтром НЕРА, относительная влажность от 50 до 70%. Для обогащения среды в загонах были установлены подвесные цепи и в качестве жевательных элементов - жевательные резиновые игрушки. После акклиматизационного периода животных, включенных в испытания, идентифицировали с помощью метки-кода на ушах.
Minimally Invasive Surgery Centre (JUMISC). Шесть самок свиней крупной белой породы со средней массой тела 26,82±2,90 кг в начале испытаний распределяли в индивидуальные загоны размером 2,90 м×1,35 м. Всех экспериментальных животных рандомизировали в помещения для акклиматизации, где поддерживали следующие условия содержания животных: 12-ти часовой цикл свет-темнота, температура от 20 до 25°C, смена воздуха восемь раз в час с использованием вентиляции с фильтром НЕРА, относительная влажность от 50 до 70%. Для обогащения среды в загонах были установлены подвесные цепи и в качестве жевательных элементов - жевательные резиновые игрушки. После акклиматизационного периода животных, включенных в испытания, идентифицировали с помощью метки-кода на ушах.
6.2 Модель раны и хирургическая процедура
После отсутствия доступа к твердому корму в течение 12 ч и к жидкости в течение 6 ч, животных усыпляли при внутримышечном введении 15 мг/кг кетамина и 0,2 мг/кг диазепама. Затем анестезию индуцировали при введении пропофола (3 мг/кг), что позволяло проводить внутритрахеальную интубацию. Затем животных немедленно подсоединяли к наркозному аппарату, соединенному через замкнутый контур с вентиляционной системой с подачей севофлурана в качестве анестетического агента при концентрации 2,7% в потоке кислорода со скоростью 1 л/мин. В процессе хирургической операции обезболивание обеспечивали при непрерывном внутривенном вливании ремифентанила со скоростью 0,1 мкг/кг/мин.
Каждому животному наносили 6 ран (6 см ×5 см), оставляя минимальное пространство 1,5-2,0 см между язвами и отмечая края язвы с помощью специальной рамки, чтобы постоянно сравнивать размеры язвы с ее начальным размером. Язвы формировали с использованием диатермокоагуляции в режиме коагуляции с образованием ишемических краев раны глубиной 2 мм, не затрагивая жировой слой (panniculus adiposus). Послеоперационное обезболивание проводили при наложении содержащих бупренорфин чрескожных пластырей и систематическом введении антибиотиков амоксициллина/клавулановой кислоты (20 мг/кг) в течение одной недели.
6.3 Экспериментальные группы
Лечение начинали через 24 ч после нанесения раны (день 1 испытаний), для развития первичного гемостаза, адгезии и агрегации тромбоцитов и для активации коагуляционного каскада. Животных рандомизировали в три группы (n=2): (i) ненагруженные NLC, (ii) 20 мкг rhEGF-NLC и (iii) 75 мкг rhEGF в свободной форме. Наночастицы предварительно ресуспендировали в 150 мкл носителя (0,5% карбоксиметилцеллюлоза в 0,9% солевом растворе) и вводили два раза в неделю при распределении их по ложу раны. rhEGF в свободной форме ресуспендировали в 1 мл носителя и вводили внутриочаговым способом два раза в неделю.
В ходе испытаний раны закрывали, чтобы исключить обезвоживание и микробное обсеменение. Более того, повязка предотвращала формирование струпьев и облегчала регистрацию эпителизирующихся краев для измерения площади заживления. К этому моменту каждую рану накрывали неприлипающей сетчатой повязкой, чтобы исключить прилипание повязки, и сверху помещали три стерильных марлевых салфетки из хлопка, которые фиксировали липкой повязкой и лейкопластырем. Повязки меняли два раза в неделю, чтобы непрерывно оценивать состояние и развитие раны, поддерживая все операции на высоко стерильном уровне. Раны промывали чрезвычайно осторожно с использованием стерильных марлевых салфеток и солевого раствора, чтобы снизить количество экссудата и детрита, сохраняя целостность вновь образовавшейся грануляционной ткани.
6.4 Образцы крови
Для мониторинга общего состояния здоровья у животных отбирали образцы крови для контроля гематологических и биохимических показателей в день нанесения раны, в день 15 и в день завершения испытаний (день 43). Исследуемые показатели включали: гематокрит, гемоглобин, средний эритроцитарный объем (MCV), среднее содержание гемоглобина в эритроцитах (MCH), лейкоциты, общие белки и тромбоциты.
Кроме того, у животных, обработанных составами rhEGF-NLC и rhEGF в свободной форме, отбирали образцы плазмы для оценки системной абсорбции rhEGF. Наличие rhEGF определяли методом ИФА (набор для определения hEGF человека методом ELISA, Pepro Tech). Образцы отбирали в периоды, когда в плазме ожидались наиболее высокие уровни rhEGF. Таким образом, образцы отбирали у животных, обработанных составом rhEGF-NLC, в день 1 испытаний (до введения составов), через 4 ч и 24 ч после введения. Образцы плазмы у животных, обработанных rhEGF в свободной форме, отбирали сразу после введения и через 30 мин после введения первой дозы.
6.5 Серийный анализ ранозаживления
Кинетику ранозаживления определяли при измерении закрытия раны (площадь закрытой раны в процентах от начальной площади раны) в дни 1,15, 25, 36 и 43. Площадь раны оценивали стандартным методом, фотографируя рану перпендикулярно к поверхности раны при одном и том же освещении и располагая прозрачную пластиковую стерильную линейку рядом с раной, для использования в качестве точки отсчета для дальнейшей обработки фотографий. Площадь раны рассчитывали с использованием программного обеспечения для анализа изображений ImageJ (см. раздел 5.3). Раны считались заживленными, если закрытие составляло более 95%.
6.6 Гистологическая оценка ранозаживления
Биопсию кожи на полную толщину от центра незаживленной раны до здорового края (2 мм) проводили с помощью стерильного скальпеля. Собранные образцы немедленно фиксировали в 4% формалине, включали в парафин и разрезали на слои толщиной 5 мкм. Для морфологического анализа образцы окрашивали смесью гематоксилин-эозин (НЕ). Образцы биопсии получали в день 15 для ран 1, 2 и 3 и в дни 25 и 43 для всех ран. В день 36 раны фотографировали, но биопсию не проводили, чтобы не замедлять ранозаживление.
Ранозаживление оценивали по показателю реэпителизации при измерении вновь образовавшегося эпителия, а развитие раны и качество заживления - согласно критериям, разработанным Cotran et al. (2000).
6.7 Гематологический анализ
В ходе испытаний гематологический анализ не выявил никаких изменений исследованных параметров. Кроме того, все полученные значения находились в нормальном диапазоне для здоровых свиней (данные не показаны).
У животных, обработанных rhEGF-NLC и rhEGF в свободной форме, отбирали образцы плазмы для оценки абсорбции rhEGF в большом круге кровообращения, когда ожидается более высокая концентрация rhEGF в плазме, так как системное применение rhEGF было ограничено в связи с опасениями аномального роста эпителия. Времена отбора плазмы были выбраны с учетом периода полураспада EGF, способа введения и замедленного высвобождения ростового фактора из нагруженных rhEGF-NLC. В этом отношении, в связи с предположением о более поздней абсорбции rhEGF, включенного в частицы rhEGF-NLC, по сравнению с rhEGF в свободной форме, плазму отбирали в день 1 испытаний, через 4 ч и 24 ч после введения rhEGF-NLC, а не через период 30 мин после введения, через который отбирали плазму у животных, обработанных rhEGF в свободной форме. В связи со значительной схожестью организмов человека и свиньи, ожидалось, что будут наблюдаться аналогичные концентрации rhEGF в плазме. Как показано в табл. 8, концентрация rhEGF в плазме составляет приблизительно 0, явно ниже базальной концентрации EGF человека (0,4 нг/мл). Этот факт является чрезвычайно интересным, так как практически полное отсутствие системной абсорбции, даже если вводить rhEGF в свободной форме напрямую в рану, может свести к минимуму побочные эффекты и, следовательно, улучшить безопасность лечения и обеспечивать местное действие rhEGF в очаге раны.

6.8 Серийный анализ заживленных ран
Повышенное заживление оценивали по числу заживленных ран в каждой испытуемой группе в дни 15, 25, 36 и 43. Наибольшие различия между группами наблюдали в день 25 испытаний. Как показано на фиг. 8, в день 15 ни одна из ран не была полностью закрытой. В день 25 в группе, обработанной составом rhEGF-NLC, наблюдалось значительно больше заживленных ран (в процентах) по сравнению с группой, обработанной ненагруженными NLC. Кроме того, следует отметить, что обработка составом rhEGF-NLC характеризуется немного более высокой эффективностью по сравнению с rhEGF в свободной форме (50% и 40%, соответственно). Хотя в обоих группах наблюдалось аналогичное число заживленных ран (в процентах), эти данные имеют особое значение, так как в раны, обрабатываемые rhEGF-NLC, вводили местным способом по 20 мкг rhEGF два раза в неделю, а в раны, обрабатываемые rhEGF в свободной форме, вводили внутриочаговым способом более высокие дозы (по 75 мкг два раза в неделю). В день 36 практически все раны полностью заживали, при этом раны, обработанные rhEGF (как rhEGF-NLC, так и rhEGF в свободной форме) полностью закрывались, а ранозаживление ран, обработанных ненагруженными NLC, достигало 90%. При завершении испытаний (день 43) все раны полностью заживали.
6.9 Гистологический анализ ранозаживления
6.9.1 Степень реэпителизации
Как показано на фиг. 9А, в день 15 длина нового эпителия значительно возрастает у животных, обработанных 20 мкг rhEGF-NLC местным способом, по сравнению с ранами, обработанными ненагруженными NLC, и ранами, обработанными 75 мкг rhEGF в свободной форме, введенным внутриочаговым способом (р<0,001). Улучшенная эффективность в отношении реэпителизации частиц rhEGF-NLC по сравнению с rhEGF в свободной форме указывает на то, что нано-инкапсуляция защищает ростовой фактор от микроокружения раны и снижает его инактивацию, которая происходит под действием протеаз и окислительного стресса на участке раны. Эта защита может быть связана с повышенной эффективностью rhEGF-NLC, наблюдаемой в ходе испытаний in vivo. Однако различия между группами не достигают статистической значимости в дни 25 и 43 (фиг. 9А), хотя средние значения, полученные в день 25 для животных, обработанных rhEGF (в свободной форме или в включенной форме), возрастали по сравнению с группой, обработанной ненагруженными NLC.
6.9.2 Зрелость раны и качество заживления
Согласно критериям Cotran et al. (2000), благодаря протяженности созданных очагов, в одном и том же гистологическом образце можно наблюдать различные стадии заживления. Как показано на фиг. 10А, в день 15 у животных, обработанных rhEGF-NLC, наблюдается не только статистически значимое снижение распространения воспалительной ткани (2 балла) по сравнению с ранами, обработанными ненагруженными NLC и rhEGF в свободной форме, но также и значительно большее распространение почти полностью заживленного эпидермиса (4 балла) (р<0,001). И наоборот, в ранах, обработанных ненагруженными NLC и rhEGF в свободной форме, в основном наблюдается диффузное острое воспаление с присутствием некоторого числа полиморфноядерных нейтрофилов, образование грануляционной ткани и регенерация сосудов (2 балла).
В день 25 в связи с тем, что процесс заживления продолжался во всех группах, распространение состояния в 2 балла значительно снижалось по сравнению с наблюдаемым в день 15, а распространение состояния в 3 и 4 баллов значительно повышалось (р<0,001). Кроме того, следует отметить, что хотя в день 25 различия длины реэпителизации в группах не наблюдались, различия все еще наблюдались в степени зрелости ран и качества заживления (фиг. 9А и фиг. 10Б). У животных, обработанных rhEGF-NLC, наблюдалась степень заживления, более близкая к полному заживлению, по сравнению с группами, обработанными ненагруженными NLC и rhEGF в свободной форме, и в которых все еще наблюдались хроническое воспаление и грануляционная ткань с множеством новых сосудов и повышенной пролиферацией фибробластов.
Кроме того, как показано на фиг. 9Б и фиг. 10В, в день 43 во всех ранах во всех испытуемых группах наблюдалась некоторая степень хронического воспаления (3 и 4 балла). Однако, в очагах, обработанных rhEGF-NLC, наблюдалось значительное улучшение степени заживления и зрелости раны (р<0,001).