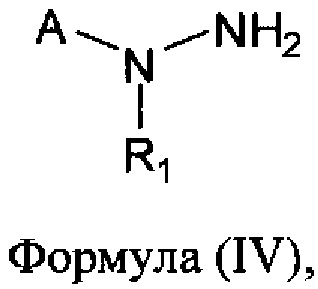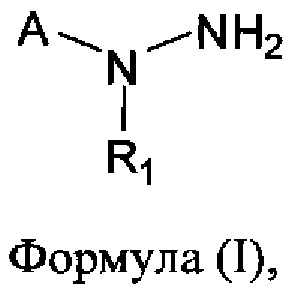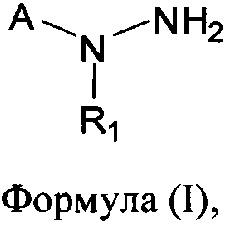ИНГИБИТОРЫ ЦИСТАТИОНИН-γ-ЛИАЗЫ (CSE)
Вид РИД
Изобретение
Перекрестная ссылка на родственную заявку
[0001] Настоящая заявка претендует на положительный эффект заявки на патент США №61/675,754, поданной 25 июля 2012 года, которая вводится в данное изобретение посредством отсылки во всей полноте.
Уровень техники
[0002] Сероводород (H2S) является общепризнанным эндогенным газотрансмиттером, принимающим участие во многих сигнальных путях, которые оказывают влияние на различные аспекты физиологических и патологических процессов. Такие процессы включают, среди прочих, но без ограничения: воспаление, нейродегенеративные нарушения, регуляцию дыхания, респираторные нарушения, повреждения кожных покровов, регуляцию артериального давления, нарушения метаболизма и нарушения со стороны почек и мочевыводящих путей. Цистатионин-γ-лиаза (CSE) представляет собой ключевой фермент, участвующий в образовании H2S, и важную мишень для терапевтического вмешательства в патологии и нарушения, опосредуемые H2S. Соединения, которые могут эффективно модулировать активность CSE, предлагают замечательные возможности терапии нарушений, восприимчивых к продуцированию H2S.
Раскрытие изобретения
[0003] В настоящей заявке описываются ингибиторы цистатионин-γ-лиазы (CSE). Также в настоящей заявке раскрывается способы синтеза таких ингибиторов (CSE) и способы применения таких ингибиторов (CSE) в терапии заболеваний, в которых ингибирование CSE вызывают терапевтический эффект у больного с таким заболеванием. Ниже описываются фармацевтические препараты, которые включают ингибитор CSE.
[0004] В одном аспекте изобретения предусматриваются соединения, имеющие структуру Формулы (I):
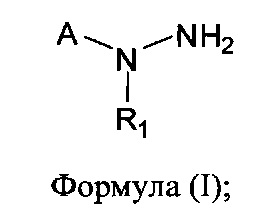
где:
А обозначает изостер карбоновой кислоты;
R1 обозначает замещенный или незамещенный С3-С6алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил; или его фармацевтически приемлемые соль, сольват или пролекарство.
[0005] В другом аспекте предусматриваются соединения, имеющие структуру Формулы (II):
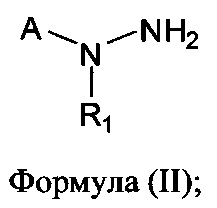
где:
R1 обозначает Н, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил;
А выбран из
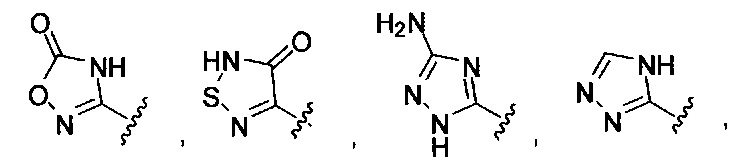
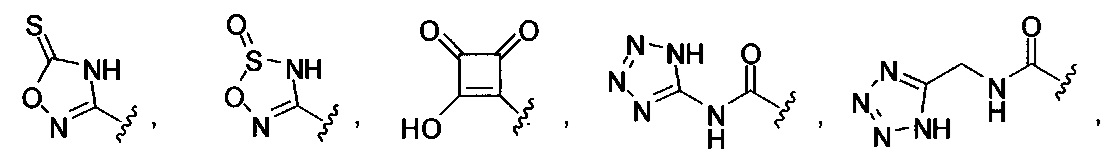
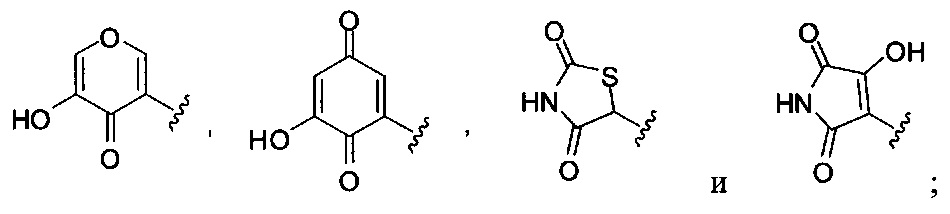
или его фармацевтически приемлемые соль, сольват или пролекарство.
[0006] В другом аспекте предусматриваются соединения, имеющие структуру Формулы (III):
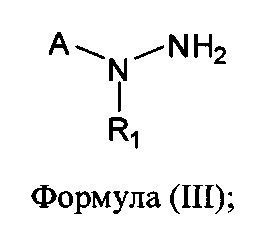
где:
R1 обозначает Н, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил;
А обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -P(O)(OR4)2, -P(O)(P4)(OR4), -CON(R4)2 -CONHNHSO2R4, -CONHSO2R4, -С(R4)2В(OR5)2 и -CON(R4)C(R4)2B(OR5)2; где каждый R4, независимо, обозначает Н, ОН, замещенный или незамещенный алкил или замещенный или незамещенный арил; и R5 обозначает Н или C1-С6алкил; или
его фармацевтически приемлемые соль, сольват или пролекарство.
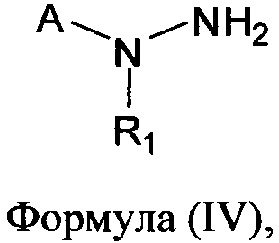
[0007] В другом аспекте предусматриваются соединения, имеющие структуру Формулы (IV):
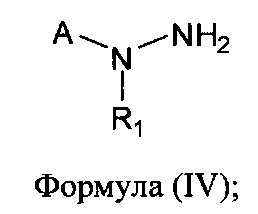
где:
А обозначает 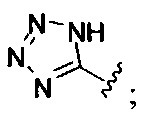
R1 обозначает замещенный или незамещенный С2-С6алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил; или его фармацевтически приемлемые соль, сольват или пролекарство.
[0008] В другом аспекте предусматриваются соединения, имеющие структуру Формулы (V):
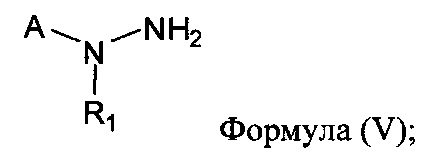
где:
А обозначает 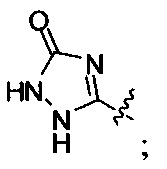
R1 обозначает Н, замещенный или незамещенный С3-С6алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил; или его фармацевтически приемлемые соль, сольват или пролекарство.
[0009] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения или предупреждения или снижения числа случаев (заболеваемости) острой почечной недостаточности (AKI), обусловленной приемом токсического агента (например, цисплатина, аминогликозидов и радиологического контрастного материала), ноцицептивной боли, острой послеоперационной боли, нейропатической боли, невралгии тройничного нерва, диабетической периферической нейропатии, герпетической невралгии, постгерпетической невралгии, воспалительной боли, смешанной нейропатической и воспалительной боли, ревматоидного артрита, воспалительных заболеваний кишечника, синдрома раздраженного кишечника, остеоартрита, острого панкреатита, хронического панкреатита, боли, ассоциируемой с острым панкреатитом, боли, ассоциируемой с хроническим панкреатитом, мигрени, подагры, анкилозирующего спондилоартрита, системной красной волчанки (SLE, СКВ), синдрома системного воспалительного ответа (SIRS), синдрома полиорганной дисфункции (MODS, СПОД), астмы, хронической обструктивной легочной болезни (COPD, ХОБЛ), чувствительной кожи, акне, розацеа (красных угрей), контактного дерматита или боли, ассоциируемой с онкологическим заболеванием (раком), у нуждающихся в этом субъектов, включающие введение терапевтически эффективного количества соединения Формулы (I), (II), (III), (IV), (V) или (VI) нуждающемуся в этом субъекту. Согласно некоторым вариантам боль, ассоциируемая с онкологическим заболеванием (раком), представляет собой боль, ассоциируемую с раком поджелудочной железы. Согласно некоторым вариантам боль, ассоциируемая с раком, представляет собой боль, ассоциируемую с раком легкого. Согласно некоторым вариантам боль, ассоциируемая с раком, представляет собой боль, ассоциируемую с раком предстательной железы. Согласно некоторым вариантам боль, ассоциируемая с раком, представляет собой боль, ассоциируемую с раком молочной железы.
[0010] Согласно некоторым вариантам в настоящем изобретении также предусматриваются способы лечения или предупреждения или снижения числа случаев острой послеоперационной боли, нейропатической боли, невралгии тройничного нерва, диабетической периферической нейропатии, герпетической невралгии, постгерпетической невралгии, воспалительной боли, ревматоидного артрита, остеоартрита или мигрени у нуждающихся в этом субъектов, включающие введение терапевтически эффективного количества соединения Формулы (I), (II), (III), (IV), (V) или (VI) нуждающемуся в этом субъекту.
[0011] Согласно некоторым вариантам в настоящем изобретении также предусматриваются способы лечения или предупреждения или снижения числа случаев (заболеваемости) острой почечной недостаточности (AKI), обусловленной приемом токсического агента (например, цисплатина, аминогликозидов и радиологического контрастного материала), ноцицептивной боли, острой послеоперационной боли, нейропатической боли, невралгии тройничного нерва, диабетической периферической нейропатии, герпетической невралгии, постгерпетической невралгии, воспалительной боли, смешанной нейропатической и воспалительной боли, ревматоидного артрита, воспалительных заболеваний кишечника, синдрома раздраженного кишечника, остеоартрита, острого панкреатита, хронического панкреатита, боли, ассоциируемой с острым панкреатитом, боли, ассоциируемой с хроническим панкреатитом, мигрени, подагры, анкилозирующего спондилоартрита, системной красной волчанки (SLE, СКВ), синдрома системного воспалительного ответа (SIRS), синдрома полиорганной дисфункции (MODS, СПОД), астмы, хронической обструктивной легочной болезни (COPD, ХОБЛ), чувствительной кожи, акне, розацеа (красных угрей), контактного дерматита или боли, ассоциируемой с раком, у нуждающихся в этом субъектов, включающие введение терапевтически эффективного количества гидрохлорида 2-гидразинилуксусной кислоты, 2-(2-(пропан-2-илиден)гидразинил)уксусной кислоты, 4-((2-(1Н-тетразол-5-ил)гидразинил)метил)-N,N-диметиланилина, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)-N,N-диэтиланилина, (Е)-1-((2-(1Н-тетразол-5-ил)гидразоно)метил)нафталин-2-ола, (Е)-5-(2-(бензо[d][1,3]диоксол-5-илметилен)гидразинил)-1Н-тетразола, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)фенола, (Е)-5-(2-(4-нитробензилиден)гидразинил)-1Н-тетразола, (Е)-5-(2-(фуран-2-илметилен)гидразинил)-1Н-тетразола, 5-гидразинил-1Н-тетразола, 5-(1-метилгидразинил)-1Н-тетразола, 5-(1-метилгидразинил)-1Н-1,2,4-триазол-3(2Н)-она, 5-(1-этилгидразинил)-1Н-1,2,4-триазол-3(2Н)-она или 5-(гидразинилметил)-1H-тетразола нуждающемуся в этом субъекту.
[0012] Согласно некоторым вариантам в настоящем изобретении также предусматриваются способы лечения или предупреждения или снижения числа случаев острой послеоперационной боли, нейропатической боли, невралгии тройничного нерва, диабетической периферической нейропатии, герпетической невралгии, постгерпетической невралгии, воспалительной боли, ревматоидного артрита, остеоартрита или мигрени у нуждающихся в этом субъектов, включающие введение терапевтически эффективного количества гидрохлорида 2-гидразинилуксусной кислоты, 2-(2-(пропан-2-илиден)гидразинил)уксусной кислоты, 4-((2-(1Н-тетразол-5-ил)гидразинил)метил)-N,N-диметиланилина, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)-N,N-диэтиланилина, (Е)-1-((2-(1Н-тетразол-5-ил)гидразоно)метил)нафталин-2-ола, (Е)-5-(2-(бензо[d][1,3]диоксол-5-илметилен)гидразинил)-1Н-тетразола, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)фенола, (Е)-5-(2-(4-нитробензилиден)гидразинил)-1Н-тетразола, (Е)-5-(2-(фуран-2-илметилен)гидразинил)-1Н-тетразола, 5-гидразинил-1Н-тетразола, 5-(1-метилгидразинил)-1Н-тетразола, 5-(1-метилгидразинил)-1Н-1,2,4-триазол-3(2Н)-она, 5-(1-этилгидразинил)-1Н-1,2,4-триазол-3(2Н)-она или 5-(гидразинилметил)-1Н-тетразола нуждающемуся в этом субъекту.
[0013] Согласно некоторым вариантам способ включает также введение второго агента, выбранного из ингибиторов карбоангидразы, ингибиторов холинэстеразы, ингибиторов эффектов аденозина, прогестагенных агентов, опиоидных антагонистов, стимуляторов центральной нервной системы, селективных ингибиторов обратного захвата серотонина (SSRIs), двойных ингибиторов обратного захвата 5-HT-NE (SNRI's), антидепрессантов, гипотензивных средств, антагонистов кальциевых каналов, ингибиторов АСЕ, стимуляторов дыхания, альфа-2 адренергических агонистов, агонистов гамма-аминомасляной кислоты, противосудорожных лекарственных средств (антиконвульсантов), НПВС (НПВП, НСПВС, НСПВП, NSAIDs), стероидов и антагонистов глутамата. Согласно некоторым вариантам способ включает также введение второго агента, выбранного из ацетазоламида, теофиллина, прогестерона, донепезила, налоксона, никотина, пароксетина, протриптилина, метопролола, силазаприла, пропранолола, атенолола, гидрохлортиазида, исрадипина, спираприла, доксапрама, клонидина, баклофена, сабелузола, габапентина, прегаблина и дулоксетина.
[0014] Согласно некоторым из вышеуказанных вариантов соединение Формулы (I), (II), (III), (IV), (V) или (VI) ингибирует или частично ингибирует активность цистатионин-γ-лиазы (CSE). Согласно некоторым конкретным вариантам соединение Формулы (I), (II), (III), (IV), (V) или (VI), которое ингибирует или частично ингибирует активность CSE, прямо или опосредованно снижает сенсибилизацию или непосредственную активацию проводимости катионных каналов (например, ионных каналов TRP, CaV, NaV, Katp) у нуждающегося в этом субъекта. Согласно некоторым конкретным вариантам соединение Формулы (I), (II), (III), (IV), (V) или (VI), которое ингибирует или частично ингибирует активность CSE, прямо или опосредованно снижает сенсибилизацию или непосредственную активацию проводимости катионных каналов (например, ионных каналов TRP, CaV, NaV, Katp), уменьшая (улучшая) гипералгезию (повышенную болевую чувствительность) у нуждающегося в этом субъекта. Согласно некоторым конкретным вариантам соединение Формулы (I), (II), (III), (IV), (V) или (VI), которое ингибирует или частично ингибирует активность цистатионин-γ-лиазы (CSE), вводят перорально, подкожно, местно (топически), внутримышечно или внутривенно.
[0015] Согласно некоторым из вышеуказанных вариантов гидрохлорид 2-гидразинилуксусной кислоты, 2-(2-(пропан-2-илиден)гидразинил)уксусная кислота, 4-((2-(1Н-тетразол-5-ил)гидразинил)метил)-N,N-диметиланилин, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)-N,N-диэтиланилин, (Е)-1-((2-(1Н-тетразол-5-ил)гидразоно)метил)нафталин-2-ол, (Е)-5-(2-(бензо[d][1,3]диоксол-5-илметилен)гидразинил)-1Н-тетразол, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)фенол, (Е)-5-(2-(4-нитробензилиден)гидразинил)-1Н-тетразол, (Е)-5-(2-(фуран-2-илметилен)гидразинил)-1Н-тетразол, 5-гидразинил-1Н-тетразол, 5-(1-метилгидразинил)-1Н-тетразол, 5-(1-метилгидразинил)-1Н-1,2,4-триазол-3(2Н)-он, 5-(1-этилгидразинил)-1Н-1,2,4-триазол-3(2Н)-он или 5-(гидразинилметил)-1Н-тетразол ингибирует или частично ингибирует активность цистатионин-γ-лиазы (CSE). Согласно некоторым конкретным вариантам гидрохлорид 2-гидразинилуксусной кислоты, 2-(2-(пропан-2-илиден)гидразинил)уксусная кислота, 4-((2-(1Н-тетразол-5-ил)гидразинил)метил)-N,N-диметиланилин, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)-N,N-диэтиланилин, (Е)-1-((2-(1Н-тетразол-5-ил)гидразоно)метил)нафталин-2-ол, (Е)-5-(2-(бензо[d][1,3]диоксол-5-илметилен)гидразинил)-1Н-тетразол, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)фенол, (Е)-5-(2-(4-нитробензилиден)гидразинил)-1Н-тетразол, (Е)-5-(2-(фуран-2-илметилен)гидразинил)-1Н-тетразол, 5-гидразинил-1Н-тетразол, 5-(1-метилгидразинил)-1Н-тетразол, 5-(1-метилгидразинил)-1Н-1,2,4-триазол-3(2Н)-он, 5-(1-этилгидразинил)-1Н-1,2,4-триазол-3(2Н)-он или 5-(гидразинилметил)-1Н-тетразол прямо или опосредованно уменьшает сенсибилизацию или непосредственную активацию проводимости катионных каналов (например, ионных каналов TRP, CaV, NaV, Katp) у нуждающегося в этом субъекта.
[0016] Согласно некоторым конкретным вариантам гидрохлорид 2-гидразинилуксусной кислоты, 2-(2-(пропан-2-илиден)гидразинил)уксусная кислота, 4-((2-(1Н-тетразол-5-ил)гидразинил)метил)-N,N-диметиланилин, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)-N,N-диэтиланилин, (Е)-1-((2-(1Н-тетразол-5-ил)гидразоно)метил)нафталин-2-ол, (Е)-5-(2-(бензо[d][1,3]диоксол-5-илметилен)гидразинил)-1Н-тетразол, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)фенол, (Е)-5-(2-(4-нитробензилиден)гидразинил)-1Н-тетразол, (Е)-5-(2-(фуран-2-илметилен)гидразинил)-1Н-тетразол, 5-гидразинил-1Н-тетразол, 5-(1-метилгидразинил)-1Н-тетразол, 5-(1-метилгидразинил)-1Н-1,2,4-триазол-3(2Н)-он, 5-(1-этилгидразинил)-1Н-1,2,4-триазол-3(2Н)-он или 5-(гидразинилметил)-1Н-тетразол прямо или опосредованно уменьшает сенсибилизацию или непосредственную активацию проводимости катионных каналов (например, ионных каналов TRP, CaV, NaV, Katp), уменьшая (улучшая) гипералгезию (повышенную болевую чувствительность) у нуждающегося в этом субъекта. Согласно некоторым вариантам гидрохлорид 2-гидразинилуксусной кислоты, 2-(2-(пропан-2-илиден)гидразинил)уксусная кислота, 4-((2-(1Н-тетразол-5-ил)гидразинил)метил)-N,N-диметиланилин, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)-N,N-диэтиланилин, (Е)-1-((2-(1Н-тетразол-5-ил)гидразоно)метил) нафталин-2-ол, (Е)-5-(2-(бензо[d][1,3]диоксол-5-илметилен)гидразинил)-1Н-тетразол, (Е)-4-((2-(1Н-тетразол-5-ил)гидразоно)метил)фенол, (Е)-5-(2-(4-нитробензилиден)гидразинил)-1Н-тетразол, (Е)-5-(2-(фуран-2-илметилен)гидразинил)-1Н-тетразол, 5-гидразинил-1Н-тетразол, 5-(1-метилгидразинил)-1Н-тетразол, 5-(1-метилгидразинил)-1H-1,2,4-триазол-3(2Н)-он, 5-(1-этилгидразинил)-1Н-1,2,4-триазол-3(2Н)-он или 5-(гидразинилметил)-1Н-тетразол вводят перорально, подкожно, местно (топически), внутримышечно или внутривенно.
Краткое описание фигур
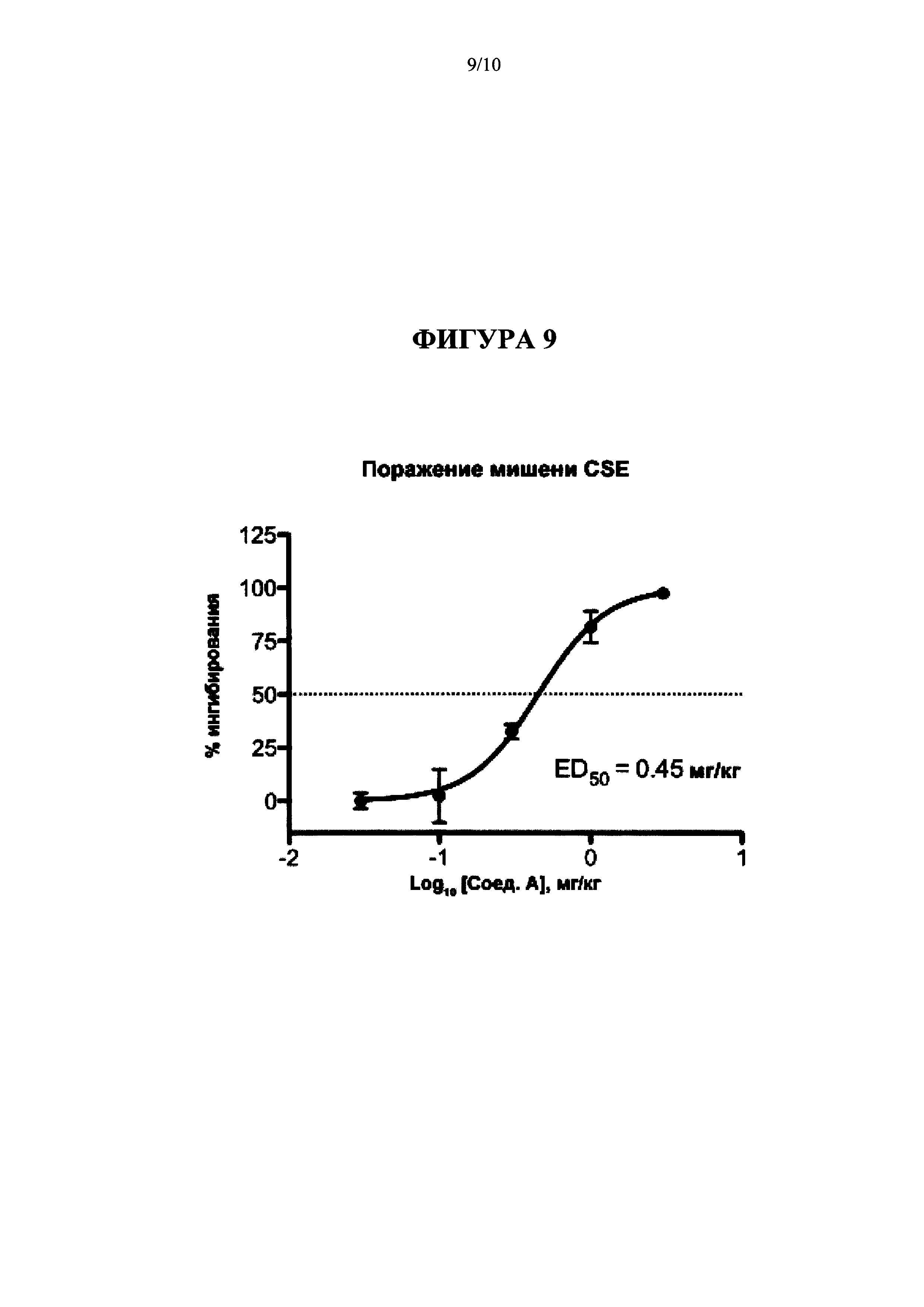
[0017] На Фиг. 1 представлена диаграмма, на которой показаны результаты введения L-пропаргилглицина (L-PAG), 100 мг/кг IP (интраперитонеально, ИП); Соединения A (Cmpd А), 30 мг/кг перорально; и AMG-517, 3 мг/кг перорально на модели CCI тактильной аллодинии (Пример 3а).
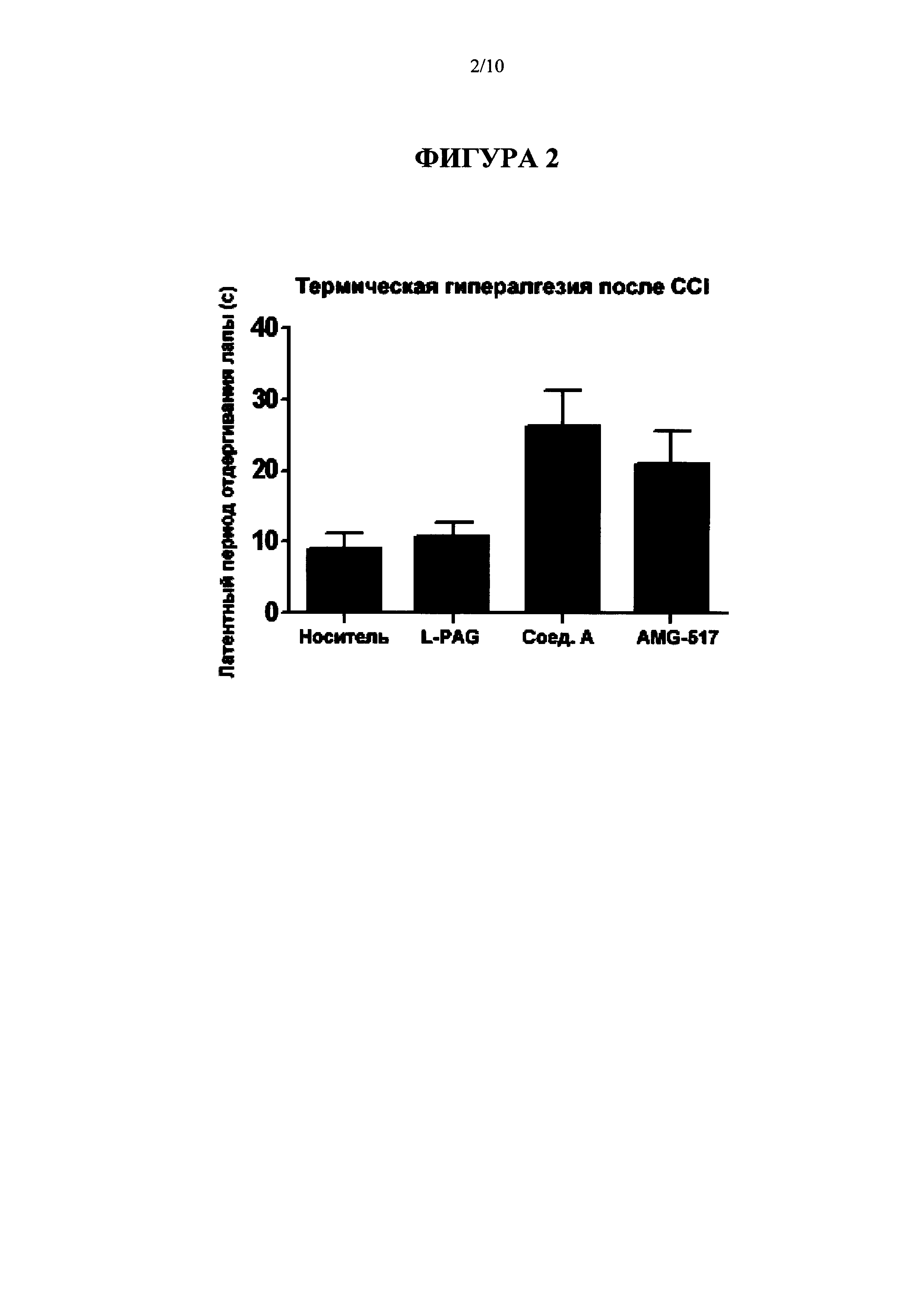
[0018] На Фиг. 2 представлена диаграмма, на которой показаны результаты введения L-PAG, 100 мг/кг IP; Соединения A (Cmpd А), 30 мг/кг перорально; и AMG-517, 3 мг/кг перорально на модели CCI термической гипералгезии (Пример 3а).
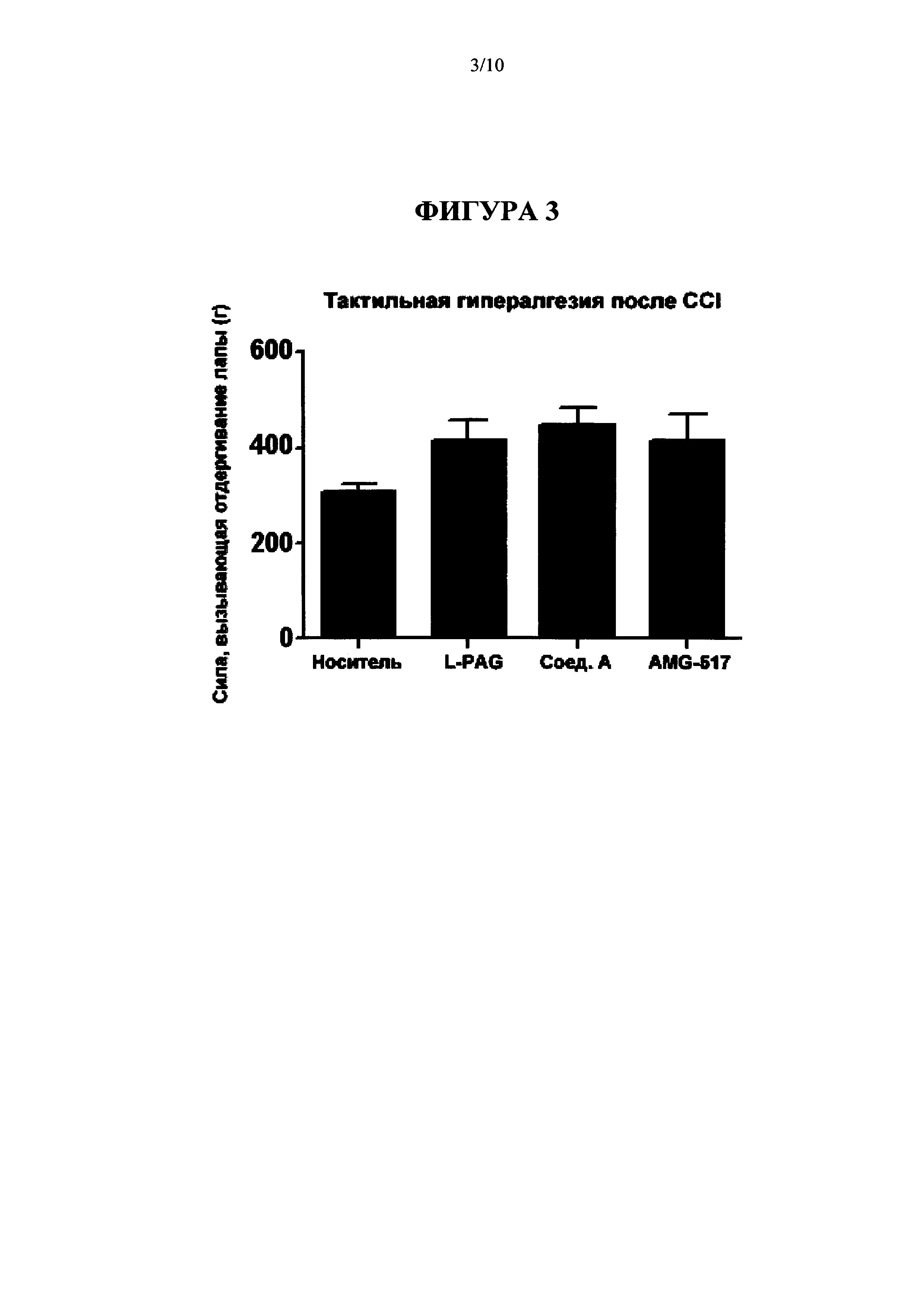
[0019] На Фиг. 3 представлена диаграмма, на которой показаны результаты введения L-PAG, 100 мг/кг IP; Соединения A (Cmpd А), 30 мг/кг перорально; и AMG-517, 3 мг/кг перорально на модели CCI тактильной гипералгезии (Пример 3а).
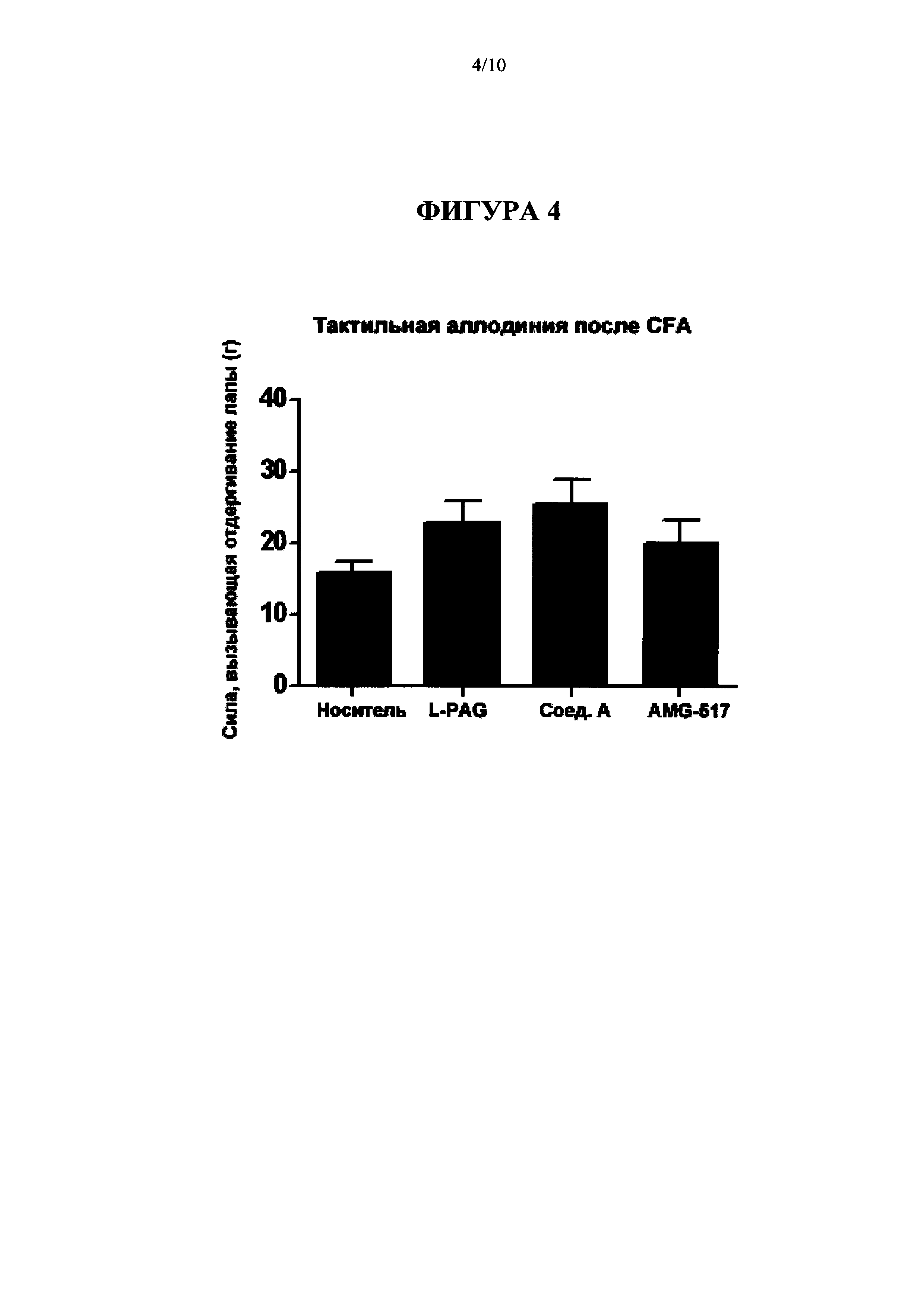
[0020] На Фиг. 4 представлена диаграмма, на которой показаны результаты введения L-PAG, 100 мг/кг IP; Соединения A (Cmpd А), 30 мг/кг перорально; и AMG-517, 3 мг/кг перорально на модели CFA тактильной аллодинии (Пример 4а).
[0021] На Фиг. 5 представлена диаграмма, на которой показаны результаты введения L-PAG, 100 мг/кг IP; Соединения A (Cmpd А), 30 мг/кг перорально; и AMG-517, 3 мг/кг перорально на модели CFA термической гипералгезии (Пример 4а).
[0022] На Фиг. 6 представлена диаграмма, на которой показаны результаты введения Соединения A (Cmpd А), 1, 3, 10 мг/кг перорально; и габапентина, 300 мг/кг перорально на модели CCI тактильной аллодинии (Пример 3b).
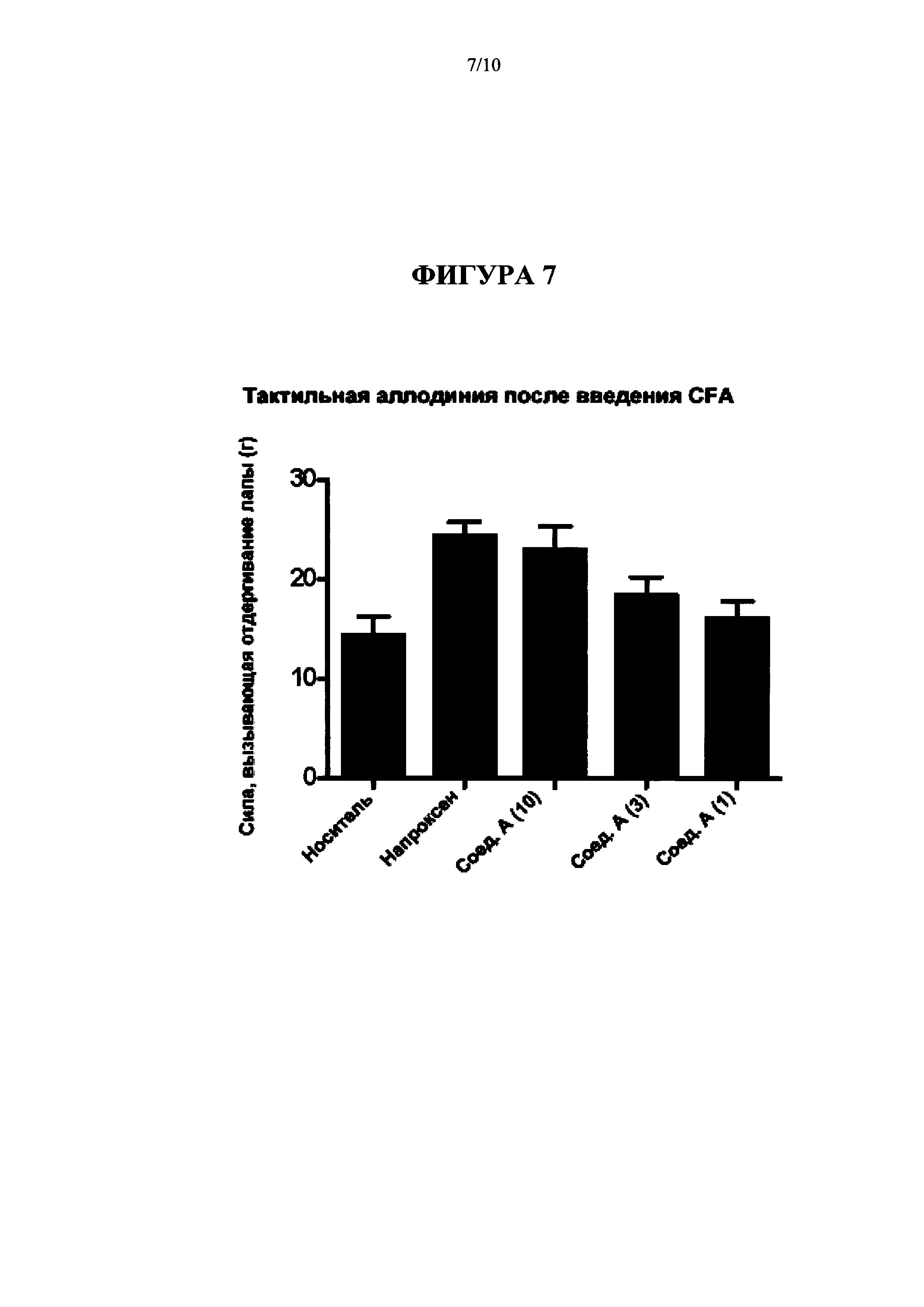
[0023] На Фиг. 7 представлена диаграмма, на которой показаны результаты введения Соединения A (Cmpd А), 1, 3, 10 мг/кг перорально; и напроксена, 30 мг/кг перорально на модели CFA тактильной аллодинии (Пример 4b).
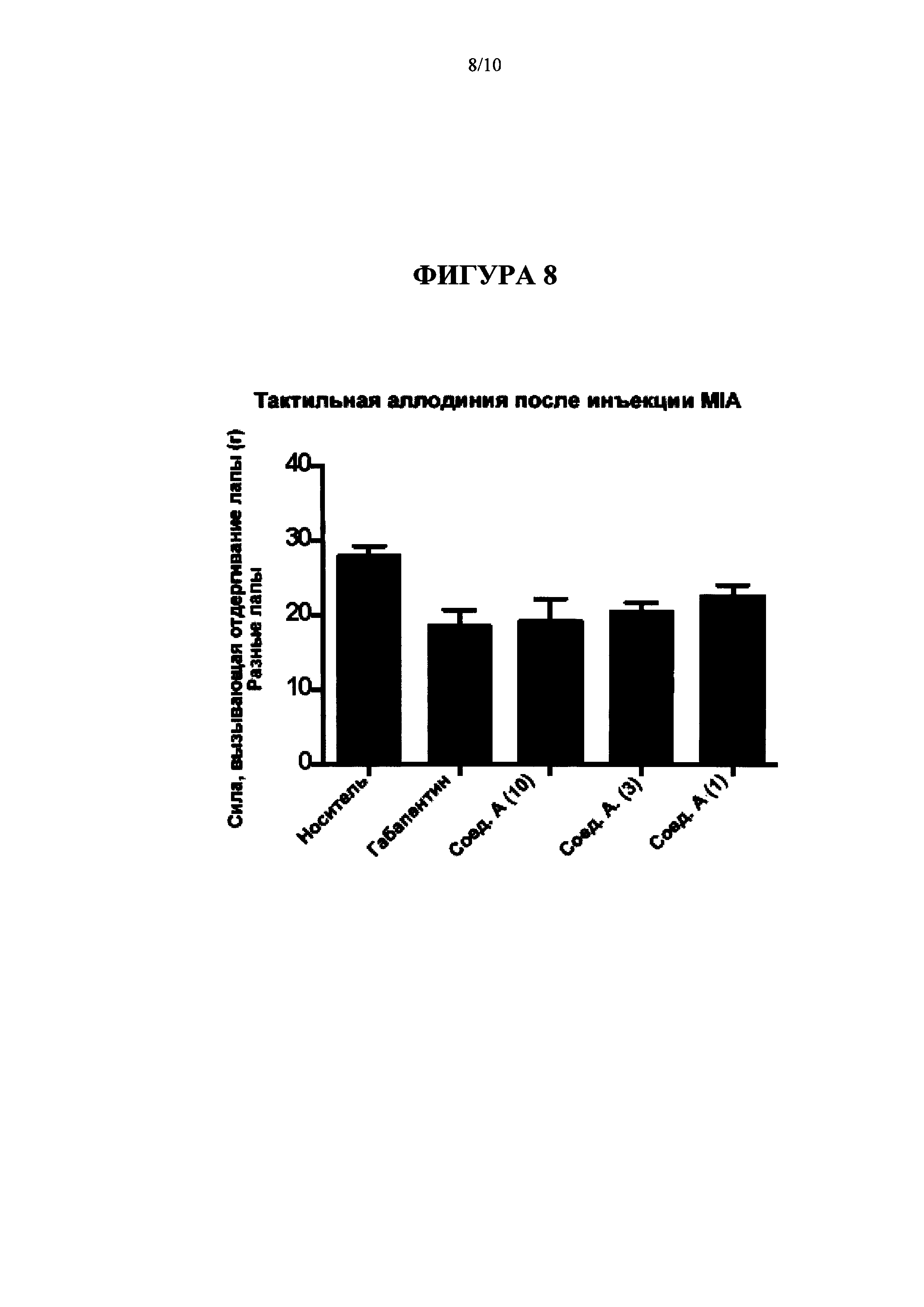
[0024] На Фиг. 8 представлена диаграмма, на которой показаны результаты введения Соединения A (Cmpd А), 1, 3, 10 мг/кг перорально; и габапентина, 300 мг/кг перорально на модели MIA тактильной аллодинии (Пример 5).
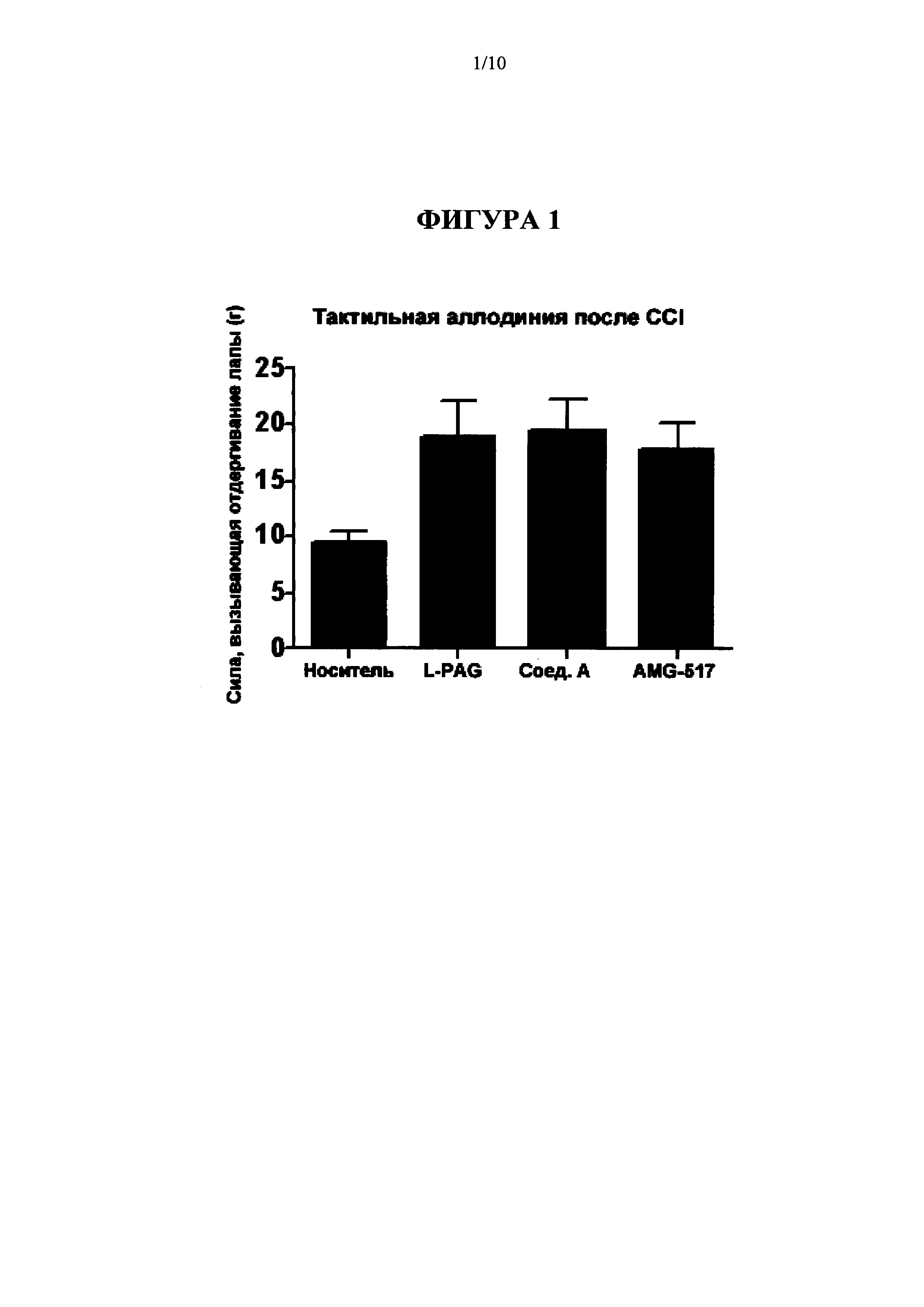
[0025] На Фиг. 9 представлен график взаимодействия с мишенью ("поражения" мишени) Соединения A (Cmpd А), 0.1, 0.3, 1, 3 мг/кг перорально; в анализе ингибирования CSE (Пример 6).
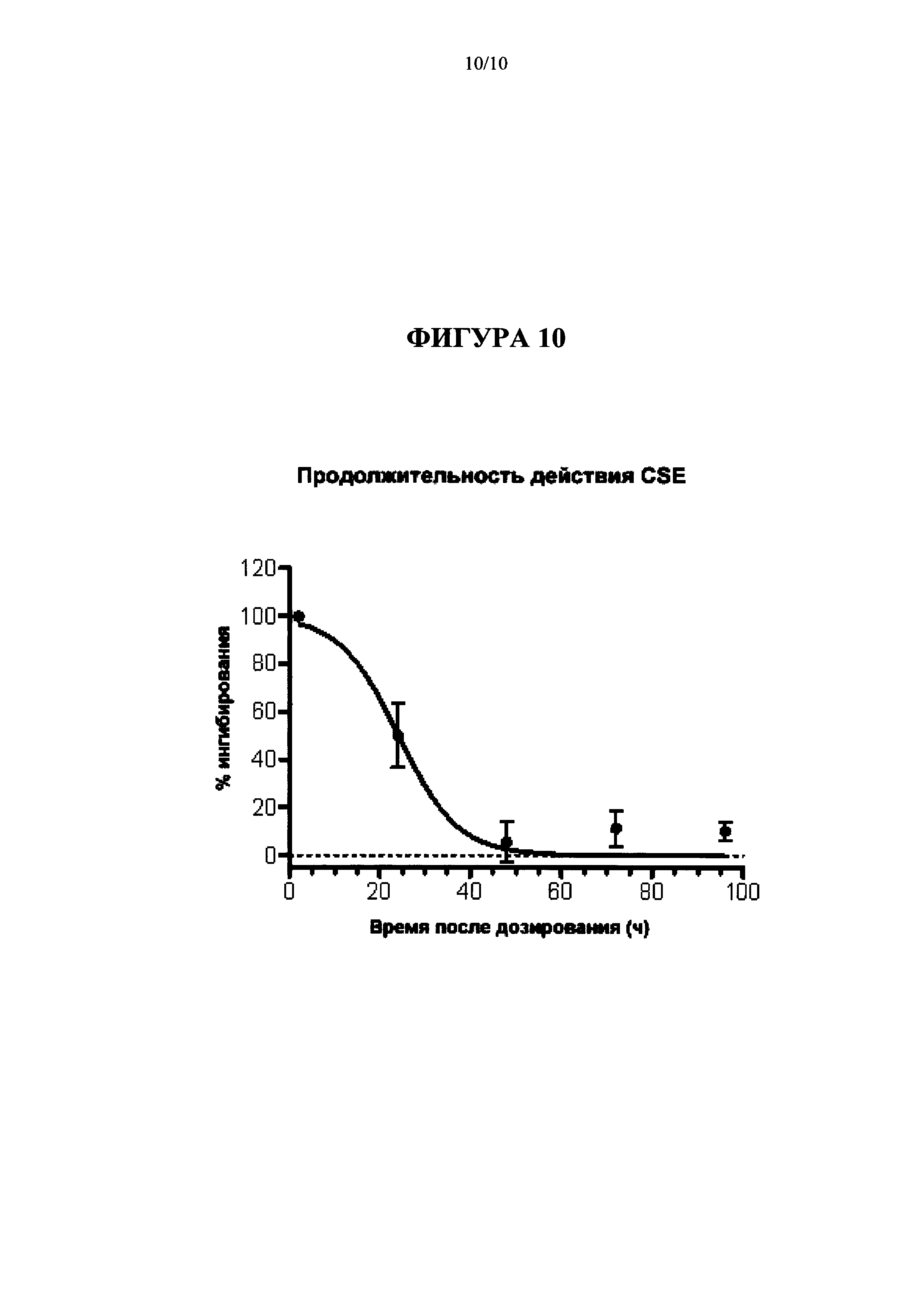
[0026] На Фиг. 10 представлен график продолжительности действия Соединения A (Cmpd А), 3 мг/кг перорально; в анализе ингибирования CSE (Пример 6).
Осуществление изобретения
[0027] Очень серьезной медицинской проблемой в Соединенных Штатах и за границей является неадекватное лечение боли. Боль может быть острой или хронической, и ее можно классифицировать как ноцицептивную, патологическую/нейропатическую и воспалительную боль. В то время как острая боль обычно является кратковременной, хроническая боль не прекращается в течение трех месяцев или более. Треть американцев страдает некоторыми видами хронической боли, и у трети из них боль устойчива к современной лекарственной терапии. Ежегодные затраты на лечение боли составляют примерно 100 миллиардов долларов. Тяжелые болевые синдромы ухудшают качество жизни пациентов, частично вследствие того, что пониженная аналгетическая эффективность при постоянном лечении опиатами (т.е. гипералгезия и переносимость) ведет к повышению доз и вызывает тяжелые побочные эффекты.
[0028] Нейропатическая боль представляет собой определенный тип хронической патологической боли, который имеет сложную и разнообразную этиологию. Часто она представляет собой хроническое состояние, вызываемое полной или частичной перерезкой нерва, травмой или поражением нерва, нервного сплетения или мягкой ткани или другими патологическими состояниями, включая рак, и причинами неясного происхождения. Нейропатическая боль характеризуется гипералгезией (пониженным болевым порогом и повышенным восприятием боли, повышенной чувствительностью к боли) и аллодинией (болью, вызываемой безобидным, слабым механическим или термическим раздражителем). Это состояние по своему характеру является прогрессирующим. Поскольку гиперестетический (обладающий повышенной чувствительностью) компонент нейропатической боли не реагирует на те же фармацевтические препараты, на которые реагирует генерализованная и острая боль, разработка эффективных и перспективных методов была проблематичной.
[0029] Лечение боли имеет в медицине огромное значение. Однако в области предупреждения прогрессирования нейропатической боли, воспалительной боли и гипералгезии наблюдается небольшой прогресс.Поэтому настоятельно требуются новые агенты и способы лечения болевых состояний.
[0030] Эндогенный сероводород образуется в процессе распада L-цистеина с помощью цистатионин-гамма-лиазы (CSE) или цистатионин-бета-синтазы (CBS). Фермент цистатионин-γ-лиаза (CSE) превращает цистатионин в L-цистеин, при этом выделяются пируват, аммиак и сероводород. Сероводород (H2S) представляет собой газотрансмиттер, физиологически регулирующий нейрональную трансмиссию и сосудистый тонус.CBS является основным ферментом, синтезирующим H2S в мозге, тогда как CSE преобладает в периферических тканях.
[0031] Согласно некоторым вариантам известно, что сероводород играет некую роль в ноцицепции (болевом возбуждении нервных волокон) посредством сенсибилизации или непосредственной активации различных ионных каналов (например, TRPV каналов, TRPA1, NaV и CaV катионных каналов), в результате чего способствуют гипералгезии, а также многим другим физиологическим процессам, включающим вазодилатацию (например, релаксацию напряжения гладкой мышцы и/или открытие K каналов гладкой мускулатуры сосудов) и нейромодуляцию (например, индукцию долгосрочного потенцирования в гиппокампе). Исследования показали, что сероводород также связан с воспалением (например, отеком задней лапы), острым панкреатитом, эндотоксемией и сепсисом.
Нейропатическая (невропатическая) боль
[0032] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения нейропатической боли у нуждающегося в этом субъекта. Нейропатическая боль представляет собой сложное хроническое патологическое болевое состояние, которое может сопровождаться, а может и не сопровождаться, активным процессом повреждения тканей. При нейропатической боли сами нервные волокна могут быть травмированными, дисфункциональными или поврежденными. Эти поврежденные нервные волокна посылают некорректные сигналы другим болевым центрам, теоретически, в результате это приводит к изменению функционирования на уровне центральной нервной системы. Воздействие повреждения нервных волокон включает изменение нервной функции как в месте повреждения, так и вокруг места повреждения.
[0033] Примером нейропатической боли является синдром фантомных болей в ампутированных конечностях. Этот синдром наблюдается, когда из-за болезни или травмы рука или нога была удалена, но мозг по-прежнему получает информацию о боли от нервов, которые изначально несли импульсы от отсутствующей конечности. Эти нервы теперь неправильно работают и вызывают боль.
[0034] Другие примеры нейропатической боли включают, но без ограничения, тригеминальную невралгию (невралгию тройничного нерва), болезненную диабетическую периферическую нейропатию, ишиас и постгерпетическую невралгию. Тригеминальная невралгия представляет собой хроническое болевое состояние, затрагивающее тройничный нерв, который передает раздражение от области лица в мозг. При тригеминальной невралгии даже слабое раздражение в лицевой области, например, при чистке зубов зубной щеткой или при нанесении косметики, может повлечь за собой мучительную боль.
[0035] Тригеминальная невралгия может возникать в виде кратковременных слабых приступов, однако, тригеминальная невралгия может также прогрессировать, вызывая более продолжительные, более частые приступы жгучей, раздирающей боли. Тригеминальная невралгия поражает женщин чаще, чем мужчин, и, скорее всего, людей старше 50 лет.
[0036] Лекарственные средства для ослабления или блокирования болевых сигналов, посылаемых в мозг, являются наиболее распространенным начальным средством для лечения тригеминальной невралгии. Для лечения тригеминальной невралгии могут назначаться антиконвульсанты, такие как карбазепин. Карбамазепин (тегретол, карбатрол) является лекарством, которое чаще всего назначают и которое обладает наиболее ярко выраженной эффективностью в отношении тригеминальной невралгии. Другие антиконвульсанты (противосудорожные (противоэпилептические) лекарственные средства), применяемые для лечения тригеминальной невралгии, включают окскарбазепин (трилептал), ламотриджин (ламиктал), фенитоин (дилантин, фенитек) и габапентин (нейронтин).
[0037] Для лечения тригеминальной невралгии можно применять также спазмолитики. Миорелаксанты, такие как баклофен, можно применять самостоятельно или в комбинации с карбамазепином или фенитоином. Побочные эффекты могут включать спутанность сознания, тошноту и сонливость.
[0038] Спиртовые инъекции вызывают временное ослабление боли за счет онемения пораженных областей лица. Как правило, инъекцию спирта вводят в область лица, соответствующую ветви тройничного нерва, служащей причиной боли. Ослабление боли не является долговременным, поэтому в дальнейшем могут потребоваться повторные инъекции или другие процедуры. Побочные эффекты могут включать инфекции в месте инъекции, кровотечение и повреждение соседних нервов.
[0039] Другим возможным способом лечения тригеминальной невралгии является хирургическая операция. Целью хирургической операции в случае тригеминальной невралгии является либо прекратить сдавление (компрессию) тройничного нерва кровеносным сосудом, либо нанести повреждение тройничному нерву, чтобы воспрепятствовать его неправильному функционированию. Повреждение нерва часто вызывает временное или необратимое онемение лица, и при любой хирургической процедуре боль может вернуться через несколько месяцев или лет.
[0040] Варианты хирургического лечения тригеминальной невралгии включают радиохирургию с применением Гамма-ножа (GKR); и микроваскулярную декомпрессию (MVD). GKR включает доставку высокой дозы фокусированной радиации к корешку тройничного нерва. Поскольку эффективность и безопасность метода GKR сравнима с другими хирургическими вариантами лечения тригеминальной невралгии, метод становится широко распространенным и может предлагаться раньше других хирургических процедур.
[0041] В методе радиохирургии с применением Гамма-ножа для повреждения тройничного нерва и для ослабления боли или избавления от нее применяют радиацию (облучение). Ослабление боли происходит постепенно, и до начала ослабления боли может пройти несколько недель. В большинстве случаев GKR является эффективным методом избавления от боли. Если боль возвращается, процедуру можно повторить. Менее чем у 5 процентов пациентов, подвергшихся этой процедуре, наблюдаются побочные эффекты, которые могут включать долговременную потерю чувствительности лица. Процедура является безболезненной и обычно проводится без анестезии.
[0042] Микроваскулярная декомпрессия (MVD) включает смещение или удаление кровеносных сосудов, которые находятся в контакте с корешком тройничного нерва. В процессе MVD врач делает разрезы за ухом на стороне, испытывающей боль. Затем через небольшое отверстие в черепе часть головного мозга приподнимают, чтобы рассмотреть тройничный нерв. Любую артерию, соприкасающуюся с нервным корешком, отводят от нерва, и хирург помещает мягкую прокладку между нервом и артерией. Если нерв сдавливает вена, хирург обычно ее удаляет.
[0043] Метод MVD большею частью позволяет успешно избавляться от боли или ослаблять боль, но у некоторых людей боль может возвращаться. Хотя процент успешных результатов при MVD высок, этот метод также сопряжен с рисками. Существует небольшая вероятность пониженного слуха, слабости лицевых мышц, онемения лица, двойного зрения и даже удара или смерти. У большинства людей, подвергшихся этой процедуре, после нее не наблюдалось никакого онемения лица.
[0044] Следует отметить, что если, как представляется, ни артерия, ни вена не сдавливают нерв, то вместо них отрезают часть нерва. Эту процедуру называют ризотомией.
[0045] В процессе инъекции глицерина игла вводится через лицевую область в отверстие в основании черепа. Иглу направляют в тройничную цистерну, небольшой мешок со спинномозговой жидкостью, которая окружает Гассеров (полулунный) узел (тройничный ганглий), где тройничный нерв разделяется на три ветви, и часть его корешка. За продвижением следят (КТ, МРТ), чтобы удостовериться, что игла находится в нужном месте, а затем вводят небольшое количество стерильного глицерина. Через три или четыре часа глицерин поражает тройничный нерв и блокирует болевые сигналы. Вначале эта процедура ослабляет (успокаивает) боль у большинства людей. Однако, у некоторых из них позднее боль возвращается, и многие испытывают онемение лица или покалывание.
[0046] При баллонной компрессии тройничного нерва полую иглу вводят через (челюстно)-лицевую область и в отверстие в основании черепа. Затем тонкую гибкую трубку (катетер) с баллончиком на конце продевают в иглу. Баллон накачивается воздухом с давлением, достаточным для повреждения нерва и блокирования болевых сигналов. Баллонная компрессия успешно регулирует боль у большинства людей, по меньшей мере на время. Большинство пациентов, подвергшихся этой процедуре, испытывают некоторое онемение лица, а у некоторых наблюдается временная или постоянная слабость жевательных мышц.
[0047] Электрический ток (радиочастотная термическая ризотомия) селективно разрушает нервные волокна, связанные с болью. Полую иглу через (челюстно)-лицевую область вводят в отверстие в черепе. После того, как иглу устанавливают в нужном местоположении, через нее подводят электрод к нервному корешку. Затем электрод нагревают до тех пор, пока он не разрушит нервные волокна, образуя область поражения (участок повреждения). Если боль не исчезает, можно создать другие участки повреждения. Почти всех пациенты, подвергшиеся радиочастотной термической ризотомии, после процедуры испытывают онемение лица.
[0048] Процедура, называемая частичной тригеминальной ризотомией, включает перерезание части тройничного нерва у основания мозга. Через разрез за ухом делают отверстие (размером в одну четвертую разреза) в черепе, чтобы получить доступ к нерву. Так как при частичной тригеминальной ризотомии разрезают нерв в его начале, онемение лица является стойким побочным эффектом.
[0049] Диабетические нейропатии представляют собой нейропатические нарушения, ассоциируемые с сахарным диабетом. Полагают, что эти патологические состояния являются результатом диабетического микроваскулярного поражения, затрагивающего небольшие кровеносные сосуды, которые снабжают нервы (vasa nervorum), помимо макроваскулярных заболеваний, которые могут приводить, в конце концов, к диабетической нейропатии. Довольно обычные патологические состояния (заболевания), которые могут ассоциироваться с диабетической нейропатией, включают паралич третьего черепно-мозгового нерва; мононейропатию; множественную мононейропатию; диабетическую амиотрофию; болезненную полинейропатию; автономную нейропатию; и торакоабдоминальную нейропатию (радикулопатию).
[0050] Несмотря на успехи в понимании метаболических причин нейропатии, методы лечения, направленные на прекращение этих патологических процессов, были ограничены. Так, за исключением жесткого контроля гликемии, лечение предполагает ослабление боли и других симптомов.
[0051] Варианты лекарственных средств для ослабления боли включают трициклические антидепрессанты (TCAs), ингибиторы обратного захвата серотонина (SSRIs), ингибиторы обратного захвата серотонина-норэпинефрина (SNRIs) и противоэпилептические (противосудорожные, антиконвульсанты) (AEDs) лекарственные средства. В систематическом обзоре делается вывод, что «трициклические антидепрессанты и традиционные антиконвульсанты лучше подходят для кратковременного ослабления более, нежели антиконвульсанты нового поколения». Комбинация этих лекарственных средств (габапентин + нортриптилин) также может быть предпочтительнее одного агента.
[0052] Два лекарственных средства, одобренных FDA для терапии диабетической периферической нейропатии, представляют собой антидепрессант дулоксетин и антиконвульсант прегабалин. Некоторые врачи рекомендуют провести лечение локализованной диабетической периферической нейропатии с помощью пластырей с лидокаином перед тем, как начинать системное лекарственное лечение.
[0053] Постгерпетическая невралгия (PHN) представляет собой невралгию, обусловленную повреждением, вызванным вирусом ветряной оспы. Как правило, невралгия ограничена некоей областью дерматома (сегмента кожи) и сопровождает заболевание опоясывающим герпесом (HZ, обычно называемым опоясывающим лишаем) в той же области дерматома. Невралгия обычно начинается, когда везикулы HZ покрывались коркой и начинали рубцеваться, но она может начинаться в отсутствие HZ, в этом случае предполагают опоясывающий лишай без герпеса (см. Опоясывающий герпес).
[0054] Варианты терапии PHN включают антидепрессанты, антиконвульсанты (такие как габапентин или прегабалин) и агенты для местного применения, такие как пластыри с лидокаином или капсаицин в составе лосьона. Во многих случаях может быть уместным также применение опиоидных анальгетиков. Существуют также несколько время от времени успешных экспериментальных методов, таких как ризотомия (отрезание или повреждение пораженного нерва для уменьшения боли) и TENS (разновидность электроимпульсной терапии).
[0055] Часто кажется, что нет очевидных причин нейропатической боли; но некоторые общие причины нейропатической боли включают алкоголизм; проблемы со спиной, ногами и областью бедер; проблемы с лицевым нервом; ВИЧ инфекцию или СПИД; рассеянный склероз; опоясывающий лишай и хирургическую операцию позвоночника.
[0056] Симптомы могут включать стреляющую или жгучую боль; и покалывание и онемение.
[0057] В ряде исследований, посвященных нейропатической боли, предполагается, что применение нестероидных противовоспалительных лекарственных средств, таких как алев (Aleve) или мотрин (Motrin), может облегчить боль. Некоторым субъектам может понадобиться более сильное обезболивающее средство, например, содержащее морфин. По-видимому, в некоторых случаях работают антиконвульсанты и антидепрессанты.
[0058] Что касается других патологических состояний, например, диабета, то лучшая тактика ведения этого заболевания может смягчить боль.
[0059] В случаях, трудно поддающихся лечению, специалист по обезболиванию может применять лечение с помощью инвазивного или имплантируемого устройства с целью эффективно воздействовать на боль. Электростимуляция нервов, принимающих участие в появлении боли, может значительно ослаблять болевые симптомы.
[0060] К сожалению, нейропатическая боль часто слабо реагирует на традиционные средства обезболивания, и иногда со временем вместо улучшения может наступить ухудшение. У некоторых людей это может привести к потере трудоспособности.
[0061] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения нейропатической боли у нуждающегося в этом субъекта. Согласно некоторым вариантам нейропатическая боль представляет собой тригеминальную невралгию (невралгию тройничного нерва). Согласно некоторым вариантам нейропатическая боль представляет собой диабетическую периферическую нейропатию. Согласно некоторым вариантам нейропатическая боль представляет собой невралгию при опоясывающем лишае (герпетическую невралгию). Согласно некоторым вариантам эти способы включают введение CSE. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации со второй схемой лечения. Согласно некоторым вариантам способы включают введение ингибитора CSE до осуществления второй лечебной схемы, одновременно с ее осуществлением или после ее осуществления.
Боль, связанная с заболеванием или патологическим состоянием
[0062] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения боли, ассоциируемой с заболеванием или патологическим состоянием, у нуждающегося в этом субъекта. Согласно некоторым вариантам заболевание или патологическое состояние представляет собой аутоиммунное заболевание. В некоторых случаях аутоиммунное заболевание представляет собой ревматоидный артрит. Согласно некоторым вариантам аутоиммунное заболевание представляет собой волчанку. Согласно некоторым вариантам аутоиммунное заболевание представляет собой системную красную волчанку. Согласно некоторым вариантам заболевание или патологическое состояние представляет собой воспалительное заболевание. В некоторых случаях воспалительное заболевание представляет собой панкреатит, острый панкреатит или хронический панкреатит. Согласно некоторым вариантам воспалительное заболевание представляет собой астму. В некоторых случаях воспалительное заболевание представляет собой артрит. В некоторых случаях воспалительное заболевание представляет собой остеоартрит. В некоторых случаях воспалительное заболевание представляет собой подагру. В некоторых случаях воспалительное заболевание представляет собой ревматоидный артрит. В некоторых случаях воспалительное заболевание представляет собой анкилозирующий спондилоартрит. В некоторых случаях воспалительное заболевание представляет собой воспалительное заболевание кишечника или синдром раздраженного кишечника. Согласно некоторым вариантам заболевание или патологическое состояние представляет собой рак. Согласно некоторым вариантам рак представляет собой карциному, саркому, меланому, лимфому или лейкоз. Согласно некоторым вариантам рак представляет собой рак поджелудочной железы, рак легкого, рак предстательной железы, рак головного мозга, рак желудочно-кишечного тракта, рак горла, колоректальный рак (рак толстой кишки) и рак молочной железы. В некоторых случаях заболевание или патологическое состояние представляет собой легочное заболевание. В некоторых случаях легочное заболевание представляет собой обструктивную болезнь легких. В некоторых случаях легочное заболевание представляет собой хронический бронхит. Согласно некоторым вариантам легочное заболевание представляет собой эмфизему легких. Согласно некоторым вариантам способы включают введение ингибитора CSE. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации со второй схемой лечения. Согласно некоторым вариантам способы включают введение ингибитора CSE до осуществления второй лечебной схемы, одновременно с ее осуществлением или после ее осуществления.
Острая послеоперационная боль
[0063] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы предупреждения или облегчения (ослабления, смягчения) острой послеоперационной боли у нуждающегося в этом субъекта. Послеоперационная боль (в результате хирургической операции) обычно считают нормальной. Однако при плохом контроле боль может вызывать повышенную частоту сердечных сокращений и учащенное дыхание, состояние тревоги, тошноту и рвоту, задержку мочи и повышение уровней адреналина и кортизола или слабый иммунный ответ и повышенный риск инфекции.
[0064] Неконтролируемая боль сходна с неконтролируемым страхом тем, что она стимулирует реакцию «борьбы или бегства» (стрессовую реакцию). Эта реакция способствует замедлению заживления ран и повышает частоту осложнений, включая инфекцию.
[0065] Просвещение относительно характера и метода хирургической операции очень важно для того, чтобы минимизировать страх и тревогу перед операцией.
[0066] Было показано, что все то, что приводится ниже, уменьшает послеоперационную боль и хирургическую инфекцию и ускоряет заживление ран: применение перед операцией нестероидных противовоспалительных препаратов, таких как ибупрофен; инъекция местного анестетика в рану перед ее зашиванием; более свободное назначение анальгетиков после операции; и, при сложных операциях, применение эпидуральной инфузии в процессе и после операции. В многочисленных исследованиях показана также эффективность методов релаксации, таких как гипноз и массаж, для смягчения послеоперационной боли.
[0067] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы предупреждения или ослабления (смягчения) острой послеоперационной боли у нуждающегося в этом субъекта. Согласно некоторым вариантам способы включают введение ингибитора CSE. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации со второй схемой лечения. Согласно некоторым вариантам способы включают введение ингибитора CSE до осуществления второй лечебной схемы, одновременно с ее осуществлением или после ее осуществления. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации с нестероидными противовоспалительными средствами. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации с ибупрофеном. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации с местным анестетиком. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации с эпидуральной инфузией.
Поддержание (лечение) органов субъекта
[0068] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы предупреждения или снижения частоты возникновения острого повреждения почек (AKI, ОПП) в результате применения токсического агента (например, цисплатина, аминогликозидов и радиологического контрастного материала) у нуждающегося в этом субъекта. Согласно некоторым вариантам способы включают введение ингибитора CSE. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации со второй схемой лечения. Согласно некоторым вариантам способы включают введение ингибитора CSE до осуществления второй лечебной схемы, одновременно с ее осуществлением или после ее осуществления.
[0069] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы предупреждения синдрома полиорганной дисфункции (полиорганной недостаточности, MODS). Согласно некоторым вариантам способы включают введение ингибитора CSE. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации со второй схемой лечения. Согласно некоторым вариантам способы включают введение ингибитора CSE до осуществления второй лечебной схемы, одновременно с ее осуществлением или после ее осуществления.
Аутоиммунное заболевание
[0070] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения аутоиммунного заболевания у нуждающегося в этом субъекта. Аутоиммунные заболевания часто обусловлены неадекватным иммунным ответом организма на вещества и ткани, обычно присутствующие в организме. Другими словами иммунная система ошибочно воспринимает некий фрагмент организма как патоген и атакует свои собственные клетки. Эта реакция может быть ограничена некоторыми органами (например, при аутоиммунном тиреоидите) или включает конкретную ткань в различных областях организма (например, болезнь Гудпасчера, которая может поражать базальную мембрану как легких, так и почек). Лечение аутоиммунных заболеваний обычно проводят с помощью иммуносупрессии-лечение лекарствами, которые подавляют иммунный ответ.
[0071] Примеры аутоиммунных заболеваний включают, но без ограничения, острый рассеянный энцефаломиелит (ADEM), болезнь Аддисона, агаммаглобулинемию, гнездную алопецию, амиотрофический боковой (латеральный) склероз, анкилозирующий спондилоартрит, антифосфолипидный синдром, антисинтетазный синдром, атопическую аллергию, атопический дерматит, аутоиммунную апластическую анемию, аутоиммунную кардиомиопатию, аутоиммунную энтеропатию, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунное заболевание внутреннего уха, аутоиммунный лимфопролиферативный синдром, аутоиммунную периферическую нейропатию, аутоиммунный панкреатит, аутоиммунный полиэндокринный синдром, аутоиммунный прогестероновый дерматит, аутоиммунную тромбоцитопеническую пурпуру, аутоиммунную крапивницу, аутоиммунный увеит, болезнь Бало/концентрический склероз Бало, болезнь Бехчета, болезнь Берже, энцефалит Бикерстаффа, синдром Блау, буллезный пемфигоид, болезнь Каслмана, глютеновую болезнь, американский трипаносомоз (болезнь Шагаса), хроническую воспалительную демиелинизирующую полинейропатию, хронический рецидивирующий многоочаговый остеомиелит, хроническую обструктивную болезнь легких, синдром Шурга-Штрауса, рубцующийся пемфигоид, синдром Когана, болезнь Холодовых агглютининов, недостаточность С2 компонентов комплемента, контактный дерматит, гигантоклеточный артериит, CREST-синдром, болезнь Крона (один из двух типов идиопатического воспалительного заболевания кишечника «IBD», «ХВЗК»), синдром Кушинга, кожный лейкоцитокластический васкулит, болезнь Дего, болезнь Деркума, герпетиформный дерматит (болезнь Дюринга), дерматомиозит, сахарный диабет типа 1, диффузный кожный системный склероз, синдром Дресслера, лекарственную волчанку, дискоидную красную волчанку, экзему, эндометриоз, энтезит-ассоциированный артрит, эозинофильный фасциит, эозинофильный гастроэнтерит, приобретенный буллезный эпидермолиз, нодозную эритему, резусную болезнь (гемолитическую желтуху новорожденных), эссенциальную смешанную криоглобулинемию, синдром Эванса, прогрессирующую оссифицирующую фибродисплазию, фиброзирующий альвеолит (или идиопатический фиброз легких), гастрит, пемфигоид желудочно-кишечного тракта, гигантоклеточный артериит, гломерулонефрит, синдром Гудпасчера, болезнь Грейвза, синдром Гийена-Барре (GBS), энцефалопатию Хашимото, тиреоидит Хашимото, пурпуру Геноха-Шенлейна, герпес беременных (гестационный герпес, гестационный пемфигоид), гнойный гидраденит, синдром Хьюза-Стовина, гипогаммаглобулинемию, идиопатические воспалительные демиелинизирующие заболевания, идиопатический легочный фиброз, идиопатическую тромбоцитопеническую пурпуру, IgA-нефропатию, миозит телец включений, хроническую воспалительную демиелинизирующую полинейропатию, интерстициальный цистит, юношеский (ювенильный) идиопатический артрит, называемый также юношеским (ювенильным) ревматоидным артритом, болезнь Кавасаки, миастенический синдром Ламберта-Итона, лейкоцитокластический васкулит, красный плоский лишай, склерозирующий лишай, линеарный IgA-зависимый дерматоз (LAD), болезнь Лу Герига (называемую также боковым амиотрофическим склерозом), волчаночный гепатит (называемый также аутоиммунным гепатитом), красную волчанку, синдром Меджида, болезнь Меньера, микроскопический полиангиит, синдром Миллера-Фишера см. синдром Гийена-Барре, смешанную соединительнотканную болезнь, очаговую склеродермию, болезнь Мухи-Габермана (также известную как парапсориаз лихеноидный или вариолиформный питириаз), рассеянный склероз, тяжелую псевдопаралитическую миастению, миозит, нарколепсию, оптикомиелит (также известный как болезнь Девика), нейромиотонию, глазной рубцовый (рубцующийся) пемфигоид, опсоклонус-миоклонус синдром (синдром пляшущих глаз), тиреоидит Орда, палиндромный ревматизм, PANDAS (детские аутоиммунные нейропсихиатрические нарушения, ассоциированные со стрептококковой инфекцией), паранеопластическую церебеллярную дегенерацию, пароксизмальную ночную гемоглобинурию (PNH), синдром Парри-Ромберга, синдром Парсонаж-Тернера, парспланит, обыкновенную пузырчатку, злокачественную анемию, перивенозный энцефаломиелит, POEMS синдром, нодозный полиартериит, ревматическую полимиалгию, полимиозит, первичный билиарный цирроз, первичный склерозирующий холангит, прогрессирующую воспалительную нейропатию, псориаз, псориатический артрит, гангренозную пиодермию, истинную эритроцитарную аплазию, энцефалит Расмуссена, феномен Рейно, рецидивирующий полихондрит, синдром Рейтера, синдром усталых ног, ретроперитонеальный фиброз, ревматоидный артрит, ревматическую лихорадку, саркоидоз, шизофрению, синдром Шмидта, синдром Шнитцлера, склерит, склеродермию, сывороточную болезнь, синдром Шегрена, спондилоартропатию, болезнь Стилла, синдром скованного человека, подострый бактериальный эндокардит (SBE), синдром Сусака, синдром Свита, хорею Сиденгама, симпатическую офтальмию, системную красную волчанку, артериит Такаясу, височный артериит (также известный как «гигантоклеточный артериит»), тромбоцитопению, синдром Толоза (Толоса, Толосы)-Ханта, поперечный миелит, язвенный колит (один из типов идиопатических воспалительных заболеваний кишечника «ibd»), недифференцированную соединительнотканную дисплазию (болезнь), отличную от смешанной соединительнотканной болезни, недифференцированную спондилоартропатию, уртикарный васкулит, витилиго и гранулематоз Вегенера.
[0072] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения аутоиммунного заболевания у нуждающегося в этом субъекта. В некоторых случаях аутоиммунное заболевание представляет собой артрит. В некоторых случаях аутоиммунное заболевание представляет собой волчанку. Согласно некоторым вариантам аутоиммунное заболевание представляет собой системную красную волчанку. Согласно некоторым вариантам способы включают введение ингибитора CSE. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации со второй схемой лечения. Согласно некоторым вариантам способы включают введение ингибитора CSE до осуществления второй лечебной схемы, одновременно с ее осуществлением или после ее осуществления.
Воспалительное заболевание
[0073] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения воспалительного заболевания у нуждающегося в этом субъекта. Воспаление является частью комплексного биологического ответа тканей сосудов на вредные раздражители, такие как патогены, поврежденные клетки или раздражающие вещества. Воспаление представляет собой попытку организма защититься, чтобы избавиться от вредных раздражителей и начать процесс заживления. Воспаление не является синонимом инфекции, даже в тех случаях, когда воспаление вызвано инфекцией. Хотя инфекция вызывается микроорганизмом, воспаление является одной из реакций организма на патоген. Однако воспаление является стереотипной ответной реакцией организма и, следовательно, рассматривается как механизм врожденного (генетически предетерминированного) иммунитета сравнению с приобретенным иммунитетом, который специфичен для каждого патогена.
[0074] Без воспаления раны и инфекции никогда бы не заживлялись и не излечивались. Аналогично, прогрессирующая деструкция ткани может быть опасной для выживания организма. Однако, хроническое воспаление может также привести к множеству заболеваний, таких как сенная лихорадка, периодонтит, атеросклероз, ревматоидный артрит и даже рак (например, рак желчного пузыря). Именно по этой причине воспаление обычно тщательно регулируется организмом.
[0075] Воспаление может быть охарактеризовано либо как острое, либо как хроническое. Острое воспаление является ответной реакцией организма на вредные раздражители и осуществляется посредством усиленного перемещения плазмы и лейкоцитов (в особенности гранулоцитов) из кровотока в пораженные ткани. Каскад биохимических событий распространяет и совершенствует воспалительную реакцию, включая локальную сердечно-сосудистую систему, иммунную систему и различные клетки пораженной ткани. Продолжительное воспаление, известное как хроническое воспаление, ведет к прогрессирующему изменению типа клеток в области воспаления и характеризуется деструкцией и заживлением ткани, одновременно происходящими в процессе воспаления.
[0076] Воспалительные нарушения представляют собой большую группу нарушений, которые лежат в основе разнообразных человеческих болезней. Иммунная система часто принимает участие в воспалительных нарушениях, наблюдающихся как при аллергических реакциях, так и при некоторых миопатиях, со многими нарушениями иммунной системы, приводящими к аномальному воспалению. Не иммунные заболевания, причиной возникновения которых являются воспалительные процессы, включают рак, атеросклероз и ишемическую болезнь сердца. В процессе воспаления принимает участие целый ряд белков, и любой из них открыт для генетической мутации, которая ослабляет или иным образом нарушает (дисрегулирует) нормальную функцию и экспрессию этого белка.
[0077] Примеры нарушений, ассоциируемых с воспалением, включают, но без ограничения, обыкновенные угри, астму, аутоиммунные заболевания, глютеновую болезнь, хронический простатит, гломерулонефрит, гиперчувствительность, воспалительные заболевания кишечника, воспаление органов таза, первичный или вторичный фиброз легких, хроническую обструктивную болезнь легких, реперфузионное повреждение, ревматоидный артрит, саркоидоз, отторжение трансплантата, васкулит и интерстициальный цистит. Типы воспаления включают, но без ограничения, аппендицит, бурсит, колит, цистит, дерматит, менингит, флебит, ринит, тендонит и тонзиллит.
[0078] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения воспалительного заболевания у нуждающегося в этом субъекта. Согласно некоторым вариантам заболевание или патологическое состояние представляет собой воспалительное заболевание. В некоторых случаях воспалительное заболевание представляет собой панкреатит, острый панкреатит или хронический панкреатит. Согласно некоторым вариантам воспалительное заболевание представляет собой астму. В некоторых случаях воспалительное заболевание представляет собой артрит. В некоторых случаях воспалительное заболевание представляет собой остеоартрит. В некоторых случаях воспалительное заболевание представляет собой подагру. В некоторых случаях воспалительное заболевание представляет собой ревматоидный артрит. В некоторых случаях воспалительное заболевание представляет собой анкилозирующий спондилоартрит. В некоторых случаях воспалительное заболевание представляет собой воспалительное заболевание кишечника или синдром раздраженного кишечника. В некоторых случаях воспалительное заболевание представляет собой синдром системного воспалительного ответа (SIRS). Согласно некоторым вариантам способы включают введение ингибитора CSE. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации со второй схемой лечения. Согласно некоторым вариантам способы включают введение ингибитора CSE до осуществления второй лечебной схемы, одновременно с ее осуществлением или после ее осуществления.
Головная боль
[0079] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения головной боли у нуждающегося в этом субъекта. Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения мигрени у нуждающегося в этом субъекта. Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения простой мигрени (мигрени без ауры) у нуждающегося в этом субъекта. Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения осложненной мигрени у нуждающегося в этом субъекта. Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения тензионной головной боли у нуждающегося в этом субъекта. Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения кластерной головной боли у нуждающегося в этом субъекта. Согласно некоторым вариантам способы включают введение ингибитора CSE. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации со второй схемой лечения. Согласно некоторым вариантам способы включают введение ингибитора CSE до осуществления второй лечебной схемы, одновременно с ее осуществлением или после ее осуществления.
Инсульт (апоплексический удар, удар)
[0080] Инсульт представляет собой быструю утрату функции (функций) головного мозга вследствие нарушения поступления крови в головной мозг. При ишемическом инсульте происходит уменьшение кровоснабжения участка головного мозга, что приводит к мозговой дисфункции в этой области. Современные данные говорят о том, что H2S способствует ишемическому повреждению за счет непосредственного дегенеративного (вырождающего) воздействия на мозговые нейроны, хотя нельзя исключать воздействия на мозговое кровообращение (церебральный кровоток).
[0081] Согласно некоторым вариантам в настоящем изобретении предусматриваются способы лечения инсульта у нуждающегося в этом субъекта. Согласно некоторым вариантам способы включают введение ингибитора CSE. Согласно некоторым вариантам способы включают введение ингибитора CSE в комбинации со второй схемой лечения. Согласно некоторым вариантам способы включают введение ингибитора CSE до осуществления второй лечебной схемы, одновременно с ее осуществлением или после ее осуществления.
Определения
[0082] Термины "лечить", "лечение" или "терапия" в данном контексте включают смягчение, ослабление или уменьшение интенсивности по меньшей мере одного симптома заболевания или патологического состояния, предупреждение новых симптомов, предупреждение прогрессирования патологического состояния, подавление заболевания или патологического состояния, например, прекращение развития заболевания или патологического состояния, облегчение заболевания или патологического состояния, регрессию заболевания или патологического состояния, облегчение состояния, обусловленного заболеванием или патологией, или исключение симптомов заболевания или патологического состояния. Согласно одному варианту лечение означает профилактическое лечение. Согласно другому варианту лечение означает терапевтическое лечение.
[0083] Термин "вводить" ("применять", "принимать") в данном контексте означает предоставлять лечение, например, назначать (прописывать) лечение, принимать лечение или распределять лечение. В некоторых случаях "применять" означает, что медицинский работник прописывает лечение, которое принимает пациент (например, пациент применяет устройство CP АР (СИПАП), принимает перорально лекарственное средство или делает инъекцию лекарственного средства). Предоставление лечения не требует немедленного или постоянного наблюдения медицинского работника.
[0084] Предполагается, что термин "совместное введение" и т.п. в данном контексте означает введение выбранных терапевтических агентов одному пациенту и включает схемы лечения, в которых агенты вводят одним и тем же способом или разными способами или вводят одновременно или в разное время.
[0085] Термины "эффективное количество" или "терапевтически эффективное количество" в данном контексте относятся к количеству вводимого агента или соединения, достаточному для того, чтобы до некоторой степени смягчить, облегчить один или более симптомов заболевания или патологического состояния, подлежащего лечению. Результатом может быть уменьшение и/или облегчение признаков, симптомов или причин заболевания или любое другое изменение биологической системы. Например, "эффективное количество" для терапевтического применения означает количество композиции, содержащей соединение по настоящему изобретению, необходимое для обеспечения клинически значимого уменьшения симптомов заболевания. Соответствующее "эффективное" количество в каждом отдельном случае можно определить, применяя такие методы, как исследование с эскалацией дозы.
[0086] Термин "субъект" или "пациент" включает млекопитающих и не млекопитающих. Примеры млекопитающих включают, но без ограничения, любого члена класса Млекопитающих: человека, отличных от человека приматов, таких как шимпанзе и другие виды приматов и более мелких обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы, свиньи; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки, и т.п. Согласно одному варианту млекопитающим является человек.
[0087] "Ткань" содержит две или более клеток. Две или более клеток могут иметь одинаковую функцию и/или разные функции. Ткань может представлять собой соединительную ткань, эпителиальную ткань, мышечную ткань или нервную ткань. Или же ткань может представлять собой кость, сухожилие (именуемые костно-мышечной тканью, аппаратом), роговицу, кожу, сердечный клапан или вену.
[0088] "Орган" содержит две или более тканей. Две или более тканей могут осуществлять специфическую функцию или группу функций. В некоторых случаях орган представляет собой легкое, рот, нос, паращитовидную железу, шишковидную железу, гипофиз, каротидную железу (каротидный параганглий), слюнную железу, кожу, желчный пузырь, поджелудочную железу, тонкую кишку, желудок, селезенку, позвоночник, вилочковую железу (тимус), щитовидную железу, трахею, матку или червеобразный отросток. Или же орган представляет собой надпочечник, червеобразный отросток (аппендикс), головной мозг, мочевой пузырь, почку, кишечник, толстую кишку, тонкую кишку, печень, сердце или мышцу.
[0089] Термин "ингибитор CSE" охватывает полный или частичный ингибитор ферментативной активности CSE в синтезе сероводорода.
[0090] Выражение "активность каротидной железы" относится к реакции каротидной железы на различные сигналы. Согласно некоторым вариантам такие сигналы включают pCO2 или pO2 в артериальной крови. Согласно некоторым вариантам такие сигналы включают присутствие или отсутствие некоторых газотрансмиттеров, таких как CO или H2S, в каротидной железе или вблизи каротидной железы. Согласно некоторым вариантам такие сигналы включают присутствие или отсутствие некоторых ионов, таких как ионы Ca2+ или K+, в каротидной железе или вблизи каротидной железы. Согласно некоторым вариантам такие сигналы включают потенциалы действия нервов, которые иннервируют каротидную железу.
[0091] "Хемочувствительность" каротидной железы, "чувствительность каротидной железы к химическим раздражителям" относится к интенсивности (величине) реакции на известный уровень стимуляции химическими мессенджерами, включая, но без ограничения, O2, CO2, CO и H2S. Повышенная хемочувствительность определяется как повышенная и несоразмерная реакция по сравнению с реакцией на аналогичные раздражители, которая наблюдается в нормальном физиологическом состоянии.
[0092] Выражение "необязательно замещенный" или "замещенный" означает, что эталонная группа замещена одной или более других (дополнительных) групп. Согласно некоторым вариантам одна или более других групп самостоятельно и независимо выбраны из групп: амидной, сложноэфирной, алкильной, циклоалкильной, гетероалкильной, арильной, гетероарильной, гетероалициклической, гидрокси, алкокси, арилокси, алкилтио, арилтио, алкилсульфоксидной, арилсульфоксидной, алкилсульфоновой, арилсульфоновой, циано, галогена, алкоильной, алкоилоксо, изоцианато, тиоцианато, нитро, галогеналкильной, галогеналкокси, фторалкильной, амино, алкиламино, диалкиламино. Согласно одному варианту эталонная группа замещена одной или более алкильных групп.
[0093] Термин "алкильная" группа относится к алифатической углеводородной группе. Ссылка на алкильную группу включает "насыщенный алкил" и/или "ненасыщенный алкил". Алкильная группа, насыщенная или ненасыщенная, включает разветвленные, линейные или циклические группы. Например, алкил включает метил, этил, пропил, изопропил, н-бутил, изобутил, вт.-бутил, трет.-бутил, пентил, изопентил, неопентил и гексил. Согласно некоторым вариантам алкильные группы включают, но без ограничения, группы: метальную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную, пентильную, гексильную, этенильную, пропенильную, бутенильную, циклопропильную, циклобутильную, циклопентильную, циклогексильную и т.п. Термин "низший алкил" означает C1-С6алкил. "Гетероалкильная группа" означает алкильную группу, в которой какой-либо из углеродных атомов замещен на гетероатом, с которым связано соответствующее число углеродных атомов (например, группа CH2 замещена на NH группу или O группу).
[0094] Термин "алкокси" группа относится к (алкил)O- группе, где алкил имеет значение по определению в данном описании.
[0095] Термин "алкиламин" относится к -N(alkyl)xHy группе, где алкил имеет значение по определению в данном описании, а x и y выбраны из группы x=1, y=1 и x=2, y=0. Когда x=2, алкильные группы совместно с атомом азота, с которым они связаны, необязательно, образуют циклическую систему.
[0096] Термин "амид" означает химическую группу формулы C(O)NHR или NHC(O)R, где R выбран из алкила, циклоалкила, арила, гетероарила (связанного через углеродный атом) и гетероалицилического радикала (связанного через углеродный атом).
[0097] Термин "сложный эфир" относится к химическому радикалу формулы -C(=O)OR, где R выбран из группы, состоящей из алкила, циклоалкила, арила, гетероарила и гетероалицилического радикала.
[0098] Термин "арил" в данном контексте относится к ароматическому циклу, в котором каждый из атомов, образующих цикл, является углеродным атомом. Арильные циклы по настоящему описанию включают циклы, содержащие пять, шесть, семь, восемь, девять или более девяти углеродных атомов. Арильные группы, необязательно, являются замещенными. Примеры арильных групп включают, но без ограничения, фенил и нафталенил.
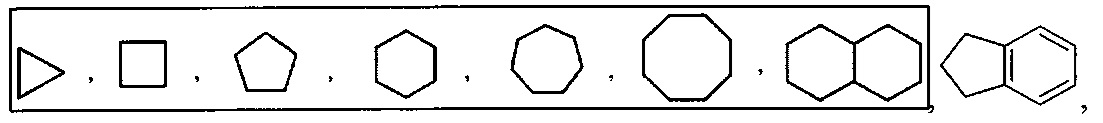
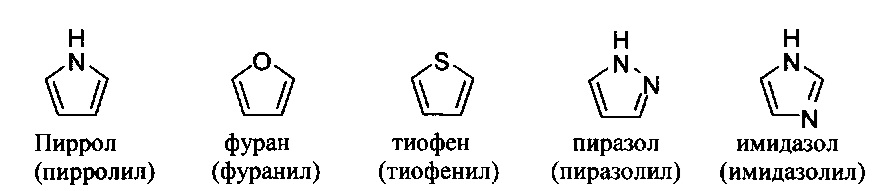
[0099] Термин "циклоалкил" относится к моноциклическому или полициклическому неароматическому радикалу, в котором каждый из атомов, образующих цикл (т.е. скелетных атомов). Согласно различным вариантам изобретения циклоалкилы являются насыщенными или частично ненасыщенными. Согласно некоторым вариантам циклоалкилы конденсированы с ароматическим циклом. Циклоалкильные группы включают группы, содержащие от 3 до 10 циклических атомов. Типичные примеры циклоалкильных групп включают, но без ограничения, следующие группы:

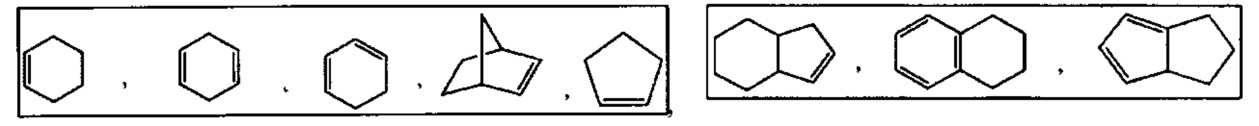 и
и
т.п. Моноциклические циклоалкилы включают, но без ограничения, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Бициклические циклоалкилы включают, но без ограничения, тетрагидронафтил, инданил, тетрагидронафталин и т.п. Полициклические циклоалкилы включают адамантан, норборнан и т.п. Термин циклоалкил включает "ненасыщенную неароматическую карбоциклильную" или "неароматическую ненасыщенную карбоциклильную" группы, каждая из которых относится к неароматическому карбоциклу по определению в данном описании, который содержит по меньшей мере одну углерод-углеродную двойную связь или одну углерод-углеродную тройную связь.
[00100] Термин "гетероцикло" относится к гетероароматическими и гетероалициклическим группам, содержащим от одного до четырех гетероатомов, каждый из которых выбран из атомов O, S и N. В некоторых случаях каждая гетероциклическая группа содержит от 4 до 10 атомов в циклической системе, при условии, что каждый цикл указанной группы не содержит двух прилегающих атомов О или S. Неароматические гетероциклические группы включают группы, содержащие 3 атома в циклической системе, но ароматические гетероциклические группы должны содержать по меньшей мере 5 атомов в циклической системе. Гетероциклические группы включают системы с конденсированными бензольными циклами. Примером 3-членной гетероциклической группы является азиридинил (образованный из азиридина). Примером 4-членной гетероциклической группы является азетидинил (образованный из азетидина). Примером 5-членной гетероциклической группы является пиридил, а примером 10-членной гетероциклической группы является хинолинил. Примеры неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, азиридинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3-пирролинил, индолинил, 2H-пиранил, 4H-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолинил, имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0] гептанил, 3H-индолил и хиназолинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуранил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил.
[00101] Термины "гетероарил" или, в качестве альтернативы, "гетероароматическая" группа относятся к арильной группе, которая включает один или более гетероатомов в циклической системе, выбранных из атомов азота, кислорода и серы. Термины N-содержащая "гетероароматическая" или "гетероарильная" группа относятся к ароматической группе, в которой по меньшей мере один из скелетных атомов в цикле является атомом азота. Согласно некоторым вариантам гетероарильные группы являются моноциклическими или полициклическими. Примеры моноциклических гетероарильных групп включают, но без ограничения:
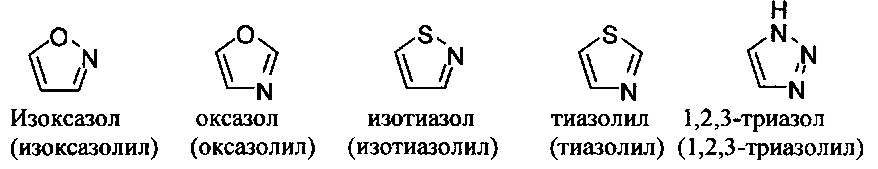
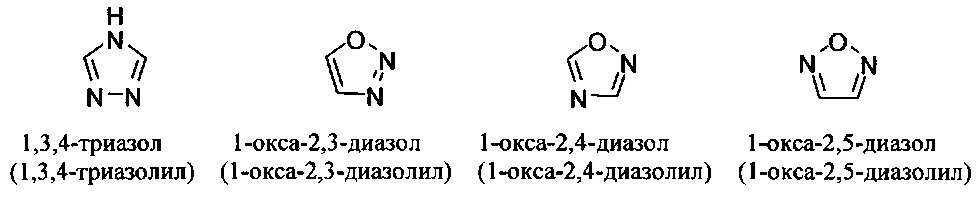

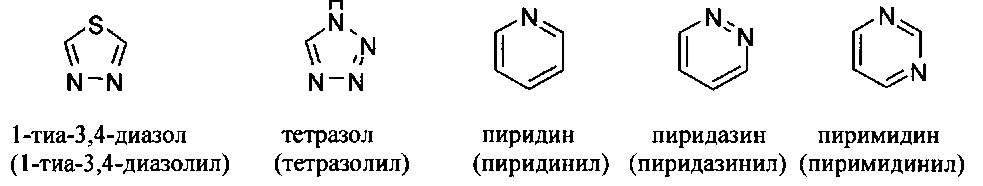
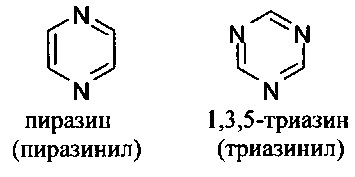
[00102] Примеры бициклических гетероарильных групп включают, но без ограничения:
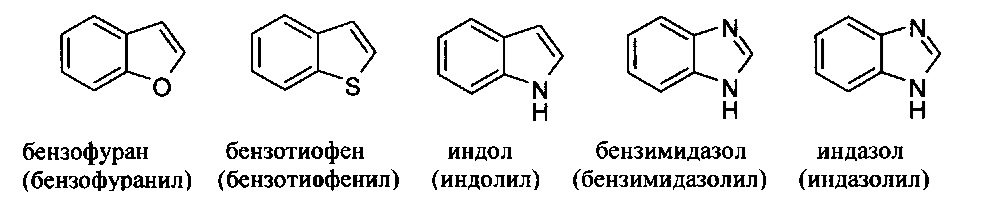
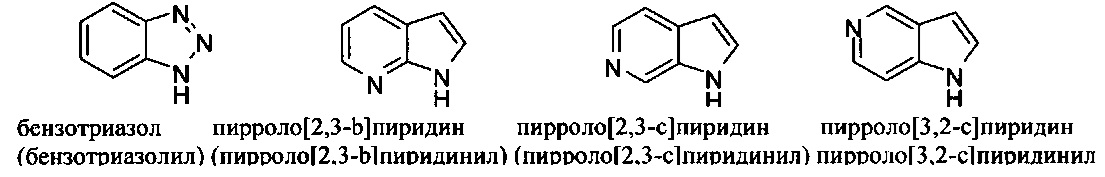
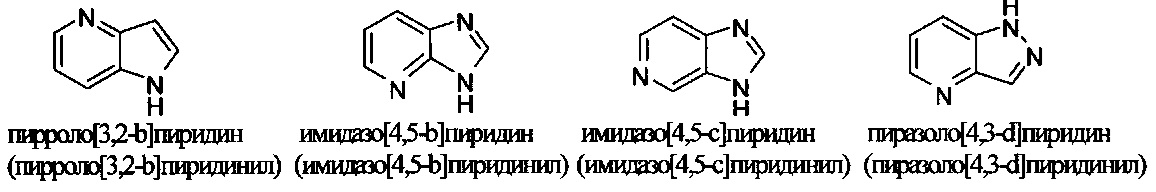
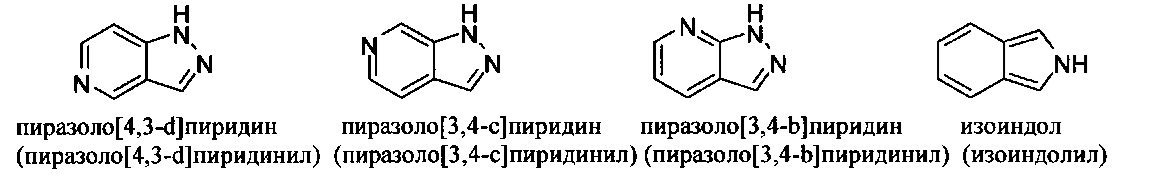
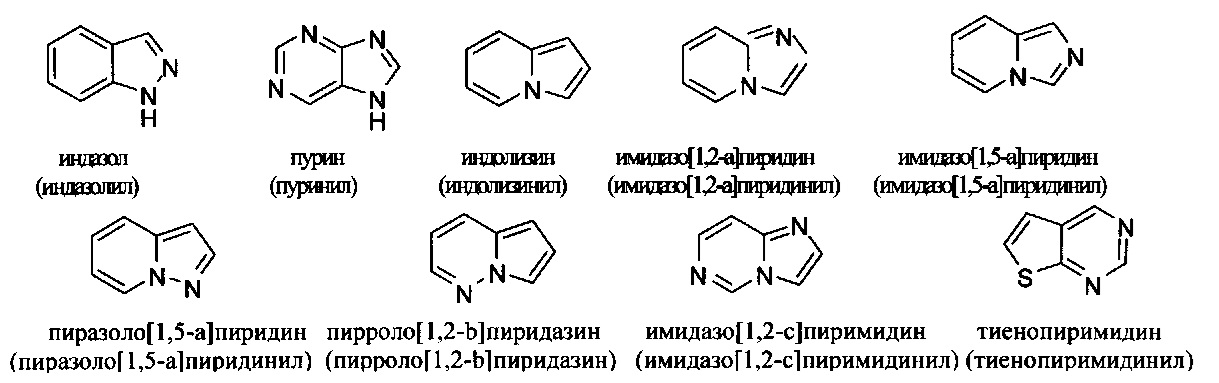
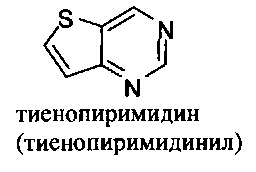
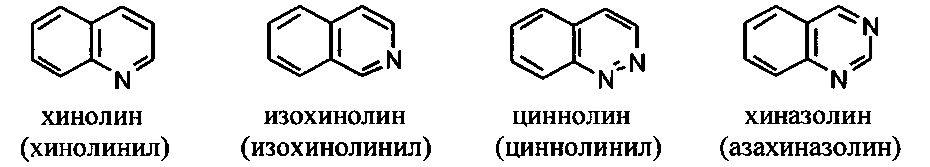
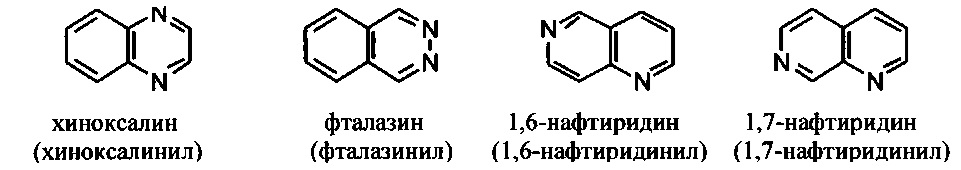
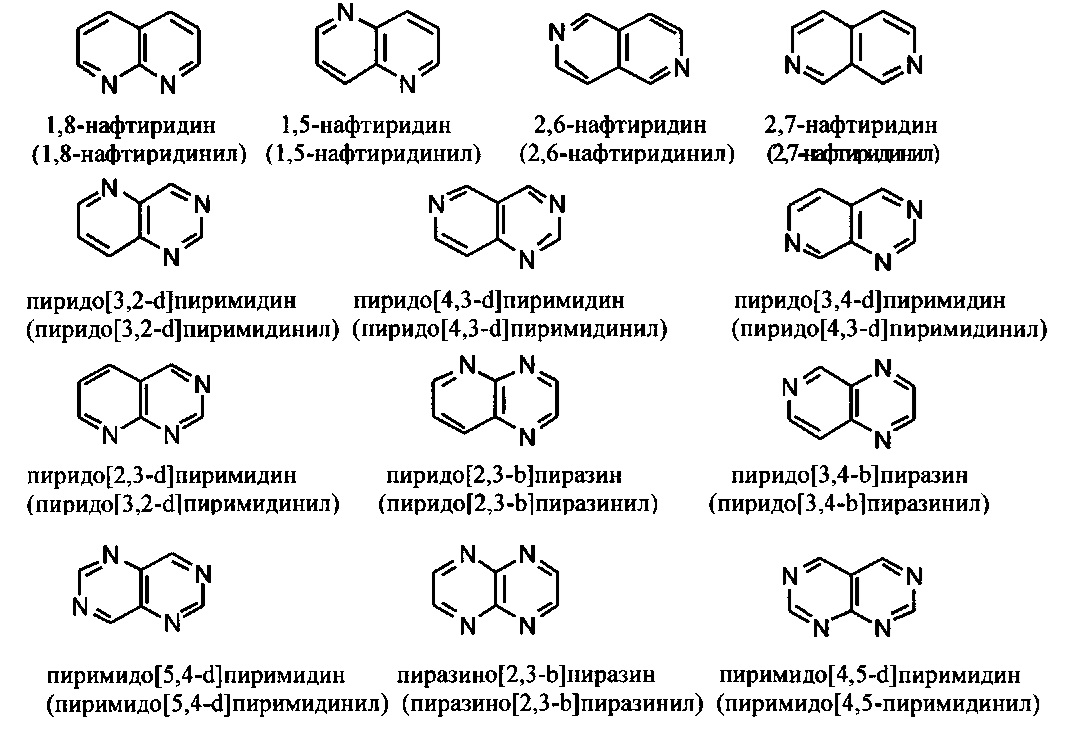 и т.п.
и т.п.
[00103] Термины "гетероалициклическая" группа", "гетероцикло" группа, или "гетероциклоалкильная" группа, или "гетероциклильная" группа относятся к циклоалкильной группе, в которой по меньшей мере один скелетный атом в цикле представляет собой гетероатом, выбранный из азота, кислорода и серы. Согласно различным вариантам гетероциклоалкилы являются насыщенными или частично ненасыщенными. Согласно некоторым вариантам радикалы конденсированы с арилом или гетероарилом. Примеры насыщенных гетероциклоалкильных групп включают:
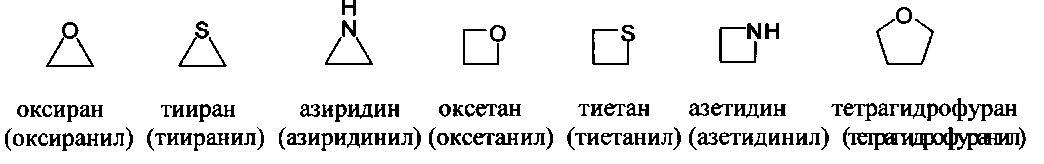
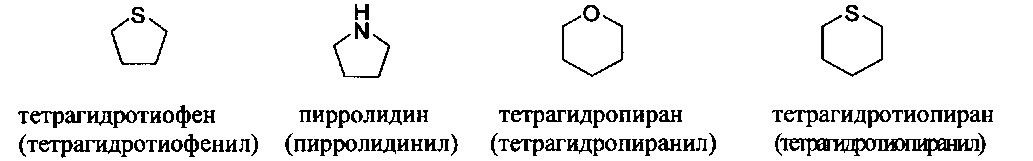
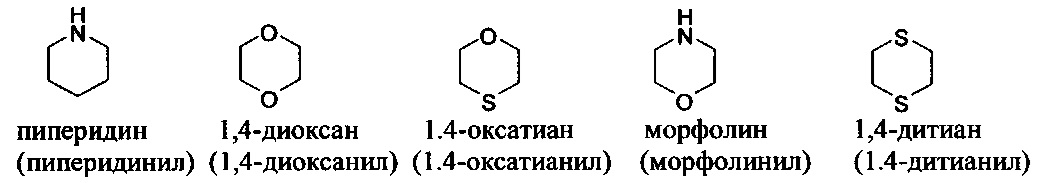
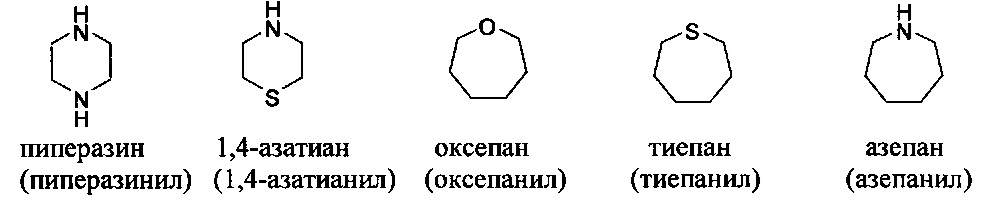
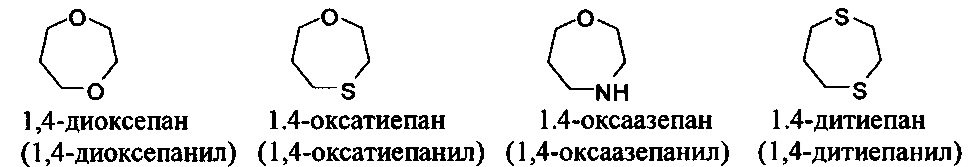
[00104] Примеры частично ненасыщенных гетероциклильных или гетероциклоалкильных групп включают:
[00105] Другие типичные примеры гетероцикло или гетероциклоалкильных групп, также относящихся к неароматическим гетероциклам, включают:
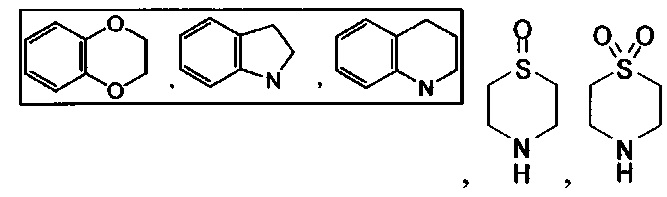 и т.п.
и т.п.
[00106] Термин "гетероалициклический" включает также все циклические формы углеводов, в том числе, но без ограничения, моносахариды, дисахариды и олигосахариды.
[00107] Термин "галоид" или, в качестве альтернативы, "галоген" означает фтор, хлор, бром и иод.
[00108] Термины "галогеналкил" и "галогеналкокси" включают алкильные и алкоксильные структуры, которые в качестве заместителей содержат один или более атомов галогена. Согласно вариантам изобретения, если в группе содержится более одного атома галогена, атомы галогена являются одинаковыми или различными. Термины "фторалкил" и "фторалкокси" включают галогеналкильную и галогеналкоксильную группы, соответственно, в которых галоген представляет собой фтор.
[00109] Термин "гетероалкил" включает необязательно замещенный алкильный, алкенильный и алкинильный радикалы, в скелете (цепи) которых содержится один или более атомов, выбранных из атомов, отличных от углеродного атома, например, кислорода, азота, серы, фосфора, кремния или их комбинаций. Согласно некоторым вариантам гетероатом(ы) находи(я)тся в любом положении внутри гетероалкильной группы. Примеры включают, но без ограничения, -CH2-O-СН3, -CH2-СН2-O-СН3, -CH2-NH-СН3, -CH2-CH2-NH-CH3, -CH2-N(CH3)-CH3, -CH2-CH2-NH-CH3, -СН2-СН2-N(СН3)-СН3, -CH2-S-CH2-CH3, -CH2-CH2-S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3 и -СН=CH-N(СН3)-СН3. Согласно некоторым вариантам до двух гетероатомов могут быть связаны друг с другом (идти последовательно друг за другом), например, -CH2-NH-OCH3 и -CH2-O-Si(CH3)3.
[00110] Термин "циано" группа относится к CN группе.
[00111] Термин "изоцианато" группа относится к NCO группе.
[00112] Термин "тиоцианато" группа относится к CNS группе.
[00113] Термин "изотиоцианато" группа относится к NCS группе.
[00114] Термин "алкоилокси" группа относится к RC(=O)O- группе.
[00115] Термин "алкоил(ьная)" группа относится к RC(=O)- группе.
[00116] "Изостеры" химической группы представляют собой химические группы, имеющие другую молекулярную формулу, но проявляющие такие же или аналогичные свойства. Например, тетразол представляет собой изостер карбоновой кислоты, так как он имитирует (проявляет) свойства карбоновой кислоты, хотя эти тетразол и карбоновая кислота имеют совершенно различные молекулярные формулы. Тетразол представляет собой одну из многих возможных изостерических замен карбоновой кислоты. Другие рассматриваемые изостеры карбоновой кислоты включают SO3H, -SO2NHR4, -P(O)(OR4)2, - P(O)(R4)(OR4), -C(O)NR4, -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2 и -CON(R4)C(R4)2B(OR5)2; где R4, в каждом случае, независимо, обозначает Н, ОН, замещенный или незамещенный алкил, замещенный или незамещенный гетероарил или замещенный или незамещенный арил; и R5 означает Н или C1-С6алкил. Помимо этого, изостеры карбоновой кислоты могут включать 5-7-членные карбоциклы или гетероциклы, содержащие любую комбинацию CH2, О, S или N в любой химически устойчивой степени окисления, причем любой из атомов указанной циклической структуры, необязательно, в одном или нескольких положениях является замещенным. Нижеприведенные структуры представляют собой неограничивающие примеры предпочтительных рассматриваемых карбоциклических и гетероциклических изостеров.
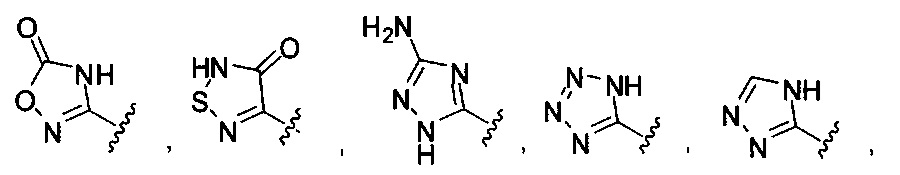
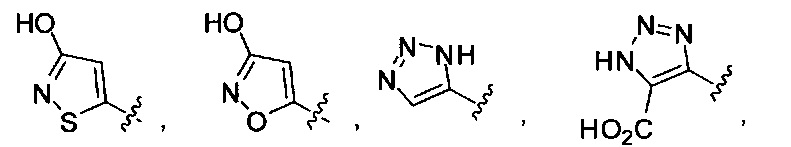
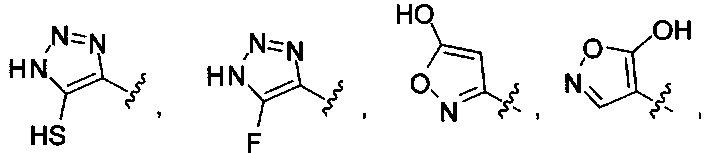
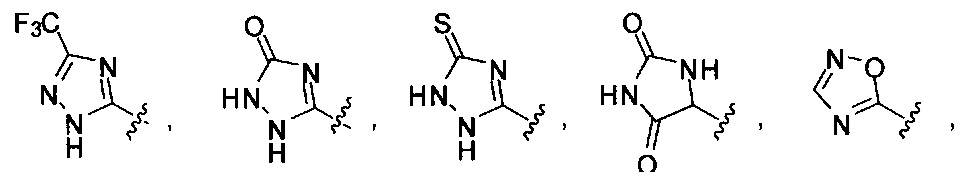
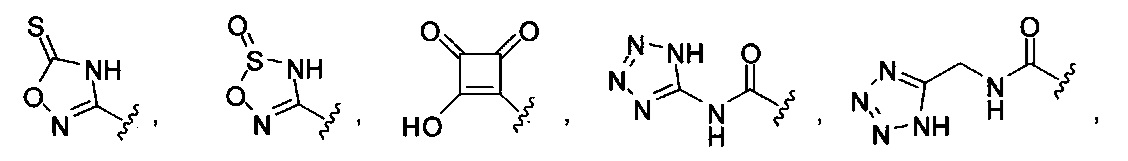
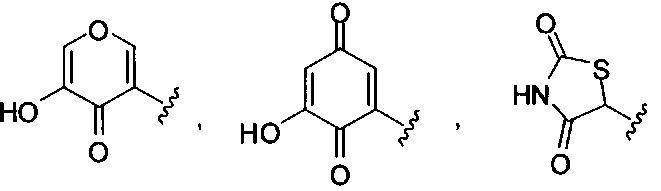 и
и 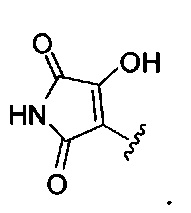
[00117] Также предполагается, что когда в изостеры карбоновой кислоты вводятся химические заместители, соединения по изобретению сохраняют свойства изостера карбоновой кислоты. Также в настоящем изобретении рассматривается, что когда изостер карбоновой кислоты, необязательно, является замещенным, тогда замещение не исключает свойств соединения по изобретению как изостера карбоновой кислоты. Также рассматривается, что введение одного или более заместителей в изостер карбоновой или гетероциклической карбоновой кислоты не представляет собой замещение при одном или более атомов, который(е) обеспечивает (обеспечивают) сохранение изостерических свойств соединения или принимает (принимают) непосредственное участие в изостерических свойствах соединения, как изостера карбоновой кислоты, если этот заместитель (эти заместители) нарушают свойства соединения как изостера карбоновой кислоты.
[00118] Другие изостеры карбоновой кислоты, конкретно не проиллюстрированные или не описанные в данной заявке, также рассматриваются в настоящем изобретении.
Ингибиторы CSE
[00119] В приведенном ниже описании соединений-ингибиторов CSE, пригодных для применения в способах по настоящему изобретению, определения указанных стандартных химических терминов можно найти в справочных изданиях (если в данном описании не указано иное), включая Carey and Sundberg "Advanced Organic Chemistry 4th Ed." Vols. A (2000) and В (2001), Plenum Press, New York. Если не указано иное, применяются обычные методы масс-спектроскопии, ЯМР (NMR), ВЭЖХ (HPLC), химии белка, биохимии, методы рекомбинантных ДНК и фармакологии, известные специалистам в данной области техники. Если приводятся конкретные определения, то используемая в связи с этим номенклатура и описанные лабораторные методики и методы аналитической химии, синтетической органической химии и медицинской и фармацевтической химии представляют собой методики и методы, известные специалистам в данной области техники. Для химических синтезов, химических анализов, приготовления и доставки фармацевтических препаратов и лечения пациентов можно применять стандартные методы.
[00120] В настоящем изобретении описываются соединения любой из Формул (I), (II), (III), (IV), (V) или (VI). Также в настоящем изобретении предусматриваются фармацевтически приемлемые соли, фармацевтически приемлемые сольваты и фармацевтически приемлемые пролекарства этих соединений. Предусматриваются фармацевтические композиции, которые включают по меньшей мере одно такое соединение или фармацевтически приемлемую соль, фармацевтически приемлемый сольват и фармацевтически приемлемое пролекарство этого соединения. Согласно некоторым вариантам также предусматриваются изомеры и химически защищенные формы соединений, имеющих структуру, представленную любой из Формул (I), (II), (III), (IV), (V) ил (VI).
[00121] В одном аспекте изобретения предусматриваются соединения, имеющие структуру Формулы (I):
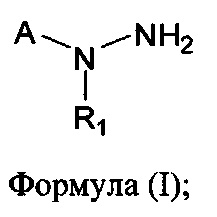
где:
А обозначает изостер карбоновой кислоты;
R1 обозначает замещенный или незамещенный С3-С6алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил; или их фармацевтически приемлемые соль, сольват или пролекарство.
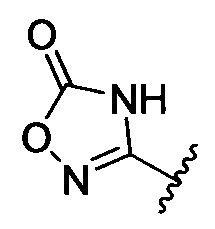
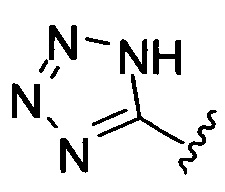
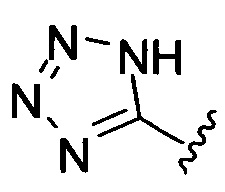
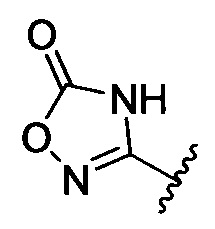
[00122] Согласно некоторым вариантам предусматривается соединение Формулы (I), где А обозначает изостер карбоновой кислоты, выбранный из:
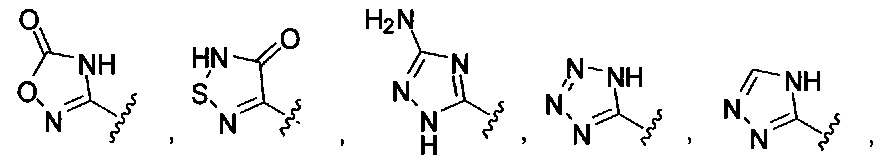
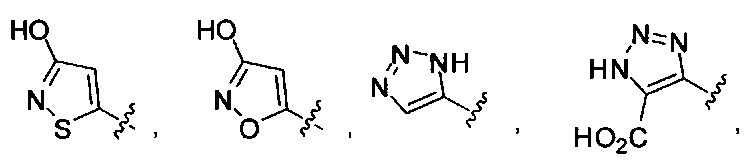
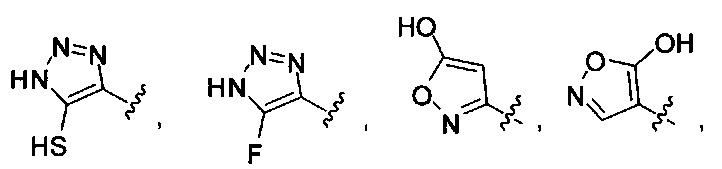
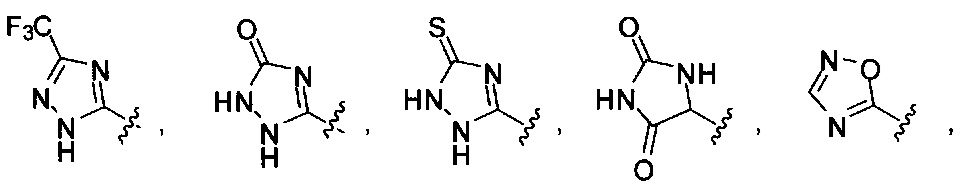
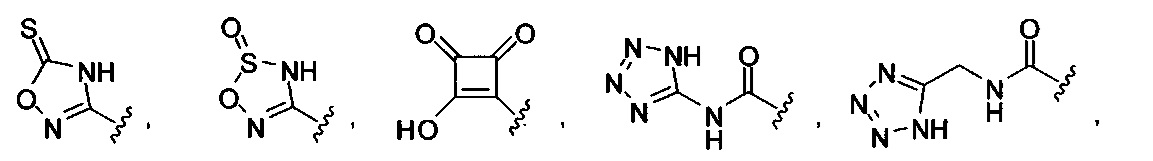
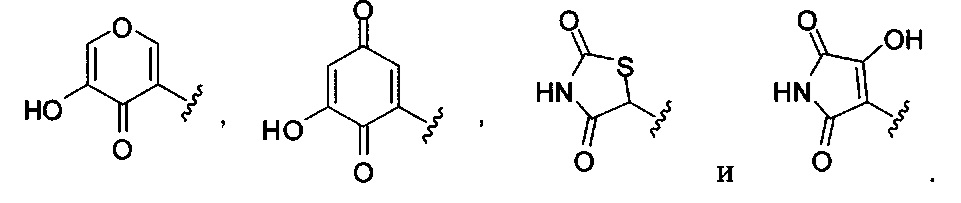
[00123] Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (I), где А обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -Р(O)(OR4)2, -P(O)(R4)(OR4), -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2, и -CON(R4)C(R4)2B(OR5)2; где R4 в каждом случае, независимо, обозначает Н, ОН, замещенный или незамещенный алкил, или замещенный или незамещенный арил; и R5 обозначает Н или C1-С6алкил.
[00124] Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (I), где А обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -Р(O)(OR4)2, -P(O)(R4)(OR4), -C(O)R4, -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2 и -CON(R4)C(R4)2B(OR5)2; где R4 в каждом случае, независимо, обозначает Н, ОН, замещенный или незамещенный алкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил; и R5 обозначает Н или C1-С6алкил.
[00125] Согласно другому варианту в изобретении предусматривается соединение Формулы (I), где R1 обозначает Н, замещенный или незамещенный С3-С6алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (I), где R1 обозначает замещенный или незамещенный С3-С6алкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (I), где R1 обозначает пропил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (I), где R1 обозначает бутил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (I), где R1 обозначает замещенный или незамещенный гетероалкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (I), где R1 обозначает замещенный или незамещенный гетероциклоалкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (I), где R1 обозначает замещенный или незамещенный арил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (I), где R1 обозначает замещенный или незамещенный гетероарил.
[00126] В другом аспекте изобретения предусматриваются соединения Формулы (II):
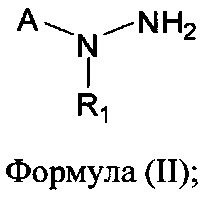
где:
R1 обозначает H, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил;
А выбран из
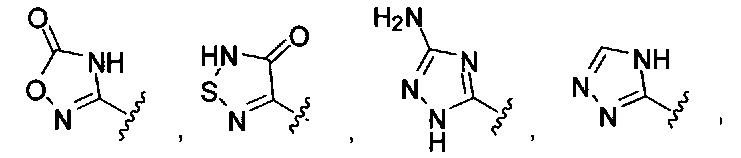
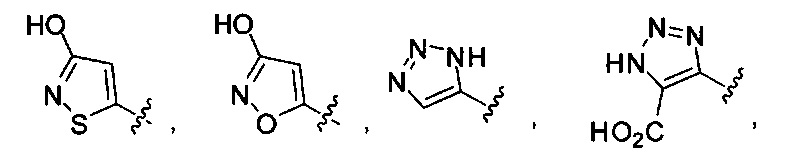
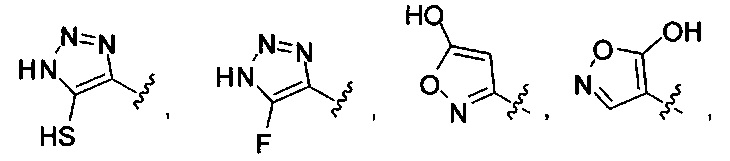
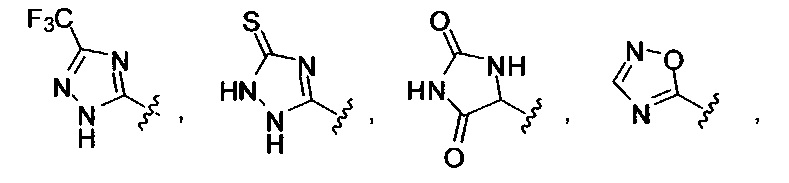
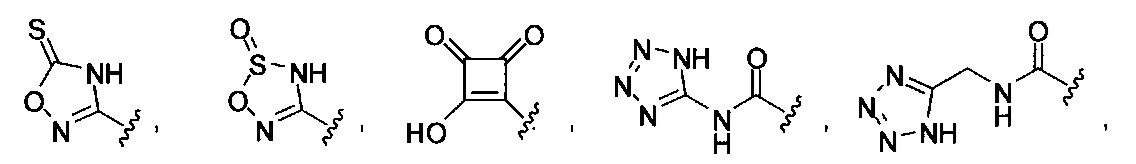
или их фармацевтически приемлемые соль, сольват или пролекарство.
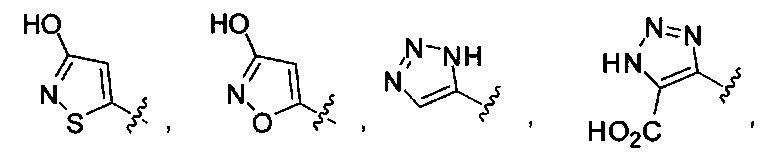
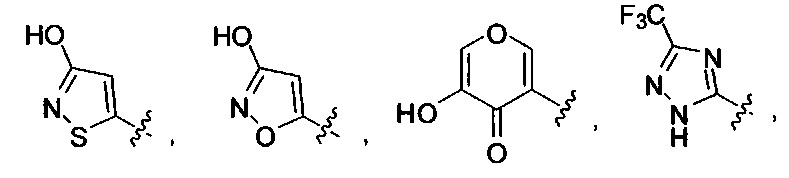
[00127] Согласно некоторым вариантам в изобретении предусматривается соединение
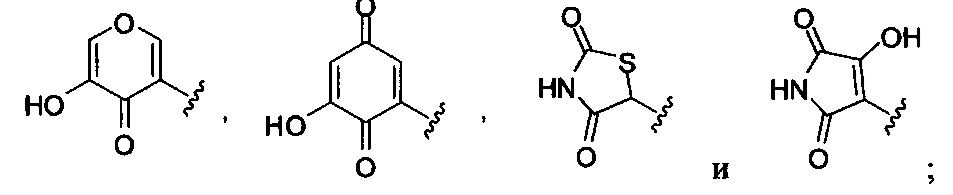
Формулы (II), где А выбран из 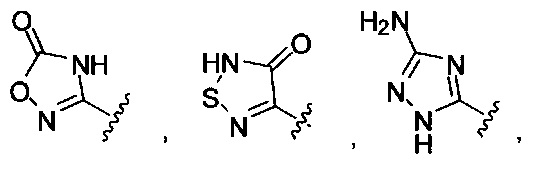
 и
и 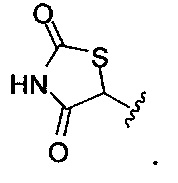
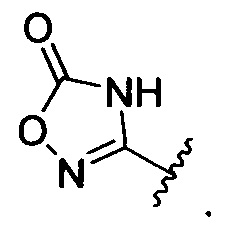
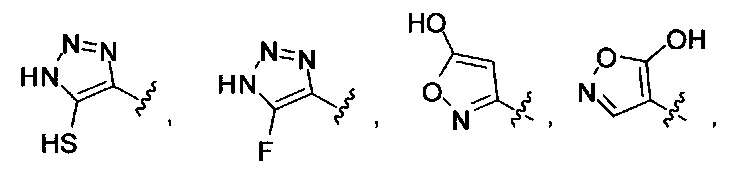
[00128] Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (II), где А обозначает 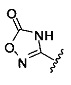 . Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (II), где А обозначает 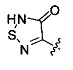 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 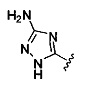 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
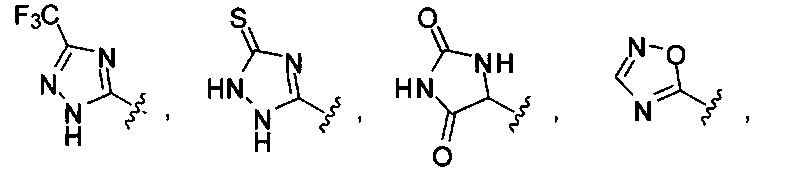
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 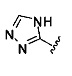 . Согласно некоторым вариантам в предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам в предусматривается соединение Формулы (II), где А обозначает 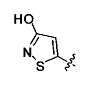 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 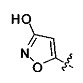 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 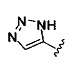 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 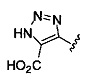 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 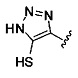 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 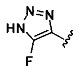 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 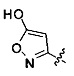 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 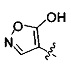 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 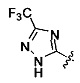 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 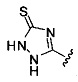 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 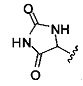 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 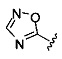 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 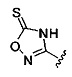 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 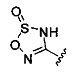 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 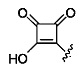 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 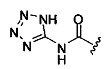 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 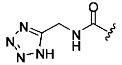 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 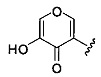 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 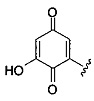 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 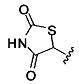 . Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает
. Согласно некоторым вариантам предусматривается соединение Формулы (II), где А обозначает 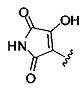 .
.
[00129] Согласно другому варианту в изобретении предусматривается соединение Формулы (II), где R1 обозначает Н, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (II), где R1 обозначает Н. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (II), где R1 обозначает замещенный или незамещенный алкил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (II), где R1 обозначает метил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (II), где R1 обозначает этил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (II), где R1 обозначает пропил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (II), где R1 обозначает бутил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (II), где R1 обозначает замещенный или незамещенный гетероалкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (II), где R1 обозначает замещенный или незамещенный гетероциклоалкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (II), где R1 обозначает замещенный или незамещенный арил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (II), где R1 обозначает замещенный или незамещенный гетероарил.
[00130] В другом аспекте изобретения предусматриваются соединения, имеющие структуру Формулы (III):
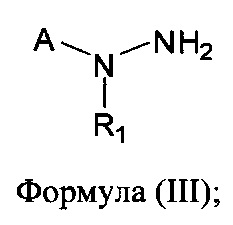
где:
R1 обозначает Н, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил;
А обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -P(O)(OR4)2, -P(O)(R4)(OR4), -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -С(R4)2В(OR5)2 и -CON(R4)C(R4)2B(OR5)2; где R4 в каждом случае, независимо, обозначает Н, ОН, замещенный или незамещенный алкил или замещенный или незамещенный арил; и R5 обозначает Н или C1-С6алкил; или
их фармацевтически приемлемые соль, сольват или пролекарство.
[00131] Согласно другому варианту в изобретении предусматривается соединение Формулы (III), где R1 обозначает Н, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает H. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает замещенный или незамещенный алкил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает метил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает этил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает пропил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает бутил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает замещенный или незамещенный гетероалкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает замещенный или незамещенный гетероциклоалкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает замещенный или незамещенный арил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает замещенный или незамещенный гетероарил.
[00132] Согласно другому варианту в изобретении предусматривается соединение Формулы (III), где R1 обозначает H, а A обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -P(O)(OR4)2, -P(O)(R4)(OR4), -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2 и -CON(R4)C(R4)2B(OR5)2. Согласно другому варианту в изобретении предусматривается соединение Формулы (III), где R1 обозначает замещенный или незамещенный алкил, а A обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -Р(O)(OR4)2, -Р(O)(R4)(OR4), -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2 и -CON(R4)C(R4)2B(OR5)2. Согласно другому варианту в изобретении предусматривается соединение Формулы (III), где R1 обозначает метил, а A обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -Р(O)(OR4)2, -P(O)(R4)(OR4), -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2 и -CON(R4)C(R4)2B(OR5)2. Согласно другому варианту в изобретении предусматривается соединение Формулы (III), где R1 обозначает этил, а A обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -P(O)(OR4)2, -P(O)(R4)(OR4), -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2 и -CON(R4)C(R4)2B(OR5)2. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает замещенный или незамещенный гетероалкил, а A обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -Р(O)(OR4)2, -P(O)(R4)(OR4), -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2 и -CON(R4)C(R4)2B(OR5)2. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает замещенный или незамещенный гетероциклоалкил, а A обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -Р(O)(OR4)2, -P(O)(R4)(OR4), -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2 и -CON(R4)C(R4)2B(OR5)2. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает замещенный или незамещенный арил, а A обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -Р(O)(OR4)2, -Р(O)(R4)(OR4), -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2 и -CON(R4)C(R4)2B(OR5)2. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (III), где R1 обозначает замещенный или незамещенный гетероарил, а A обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -P(O)(OR4)2, -Р(O)(R4)(OR4), -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2 и -CON(R4)С(R4)2В(R5)2. В любом из вышеуказанных вариантов соединения Формулы (III) предусматривается соединение Формулы (III), где А обозначает -SO3H. В любом из вышеуказанных вариантов соединения Формулы (III) предусматривается соединение Формулы (III), где А обозначает -SO2NHR4. В любом из вышеуказанных вариантов соединения Формулы (III) предусматривается соединение Формулы (III), где А обозначает -Р(O)(OR4)2.В любом из вышеуказанных вариантов соединения Формулы (III) предусматривается соединение Формулы (III), где А обозначает -P(O)(R4)(OR4). В любом из вышеуказанных вариантов соединения Формулы (III) предусматривается соединение Формулы (III), где А обозначает -CON(R4)2. В любом из вышеуказанных вариантов соединения Формулы (III) предусматривается соединение Формулы (III), где А обозначает -CONHNHSO2R4. В любом из вышеуказанных вариантов соединения Формулы (III) предусматривается соединение Формулы (III), где А обозначает -CONHSO2R4. В любом из вышеуказанных вариантов соединения Формулы (III) предусматривается соединение Формулы (III), где А обозначает -C(R4)2B(OR5)2. В любом из вышеуказанных вариантов соединения Формулы (III) предусматривается соединение Формулы (III), где А обозначает -CON(R4)C(R4)2B(OR5)2.
[00133] В другом аспекте изобретения предусматриваются соединения, имеющие структуру Формулы (IV):
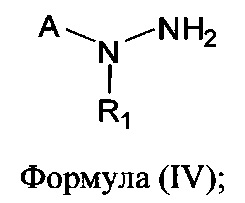
где:
А обозначает 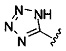 ;
;
R1 обозначает замещенный или незамещенный С2-С6алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил; или их фармацевтически приемлемые соль, сольват или пролекарство.
[00134] Согласно другому варианту в изобретении предусматривается соединение Формулы (IV), где R1 обозначает замещенный или незамещенный С1-С6алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Согласно некоторым вариантам предусматривается соединение Формулы (IV), где R1 обозначает замещенный или незамещенный С2-С6алкил. Согласно другим вариантам предусматривается соединение Формулы (IV), где R1 обозначает этил. Согласно другим вариантам предусматривается соединение Формулы (IV), где R1 обозначает пропил. Согласно другим вариантам предусматривается соединение Формулы (IV), где R1 обозначает бутил. Согласно некоторым вариантам предусматривается соединение Формулы (IV), где R1 обозначает замещенный или незамещенный гетероалкил. Согласно некоторым вариантам предусматривается соединение Формулы (IV), где R1 обозначает замещенный или незамещенный гетероциклоалкил. Согласно некоторым вариантам предусматривается соединение Формулы (IV), где R1 обозначает замещенный или незамещенный арил. Согласно некоторым вариантам предусматривается соединение Формулы (IV), где R1 обозначает замещенный или незамещенный гетероарил.
[00135] В другом аспекте изобретения предусматриваются соединения, имеющие структуру Формулы (V):
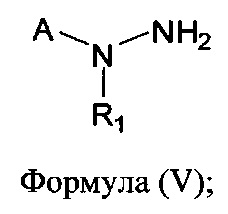
где:
А обозначает 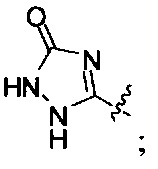
R1 обозначает H, замещенный или незамещенный С3-С6алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил; или их фармацевтически приемлемые соль, сольват или пролекарство.
[00136] Согласно другому варианту в изобретении предусматривается соединение Формулы (V), где R1 обозначает замещенный или незамещенный С3-С6алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (V), где R1 обозначает Н. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (V), где R1 обозначает замещенный или незамещенный С3-С6алкил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (V), где R1 обозначает пропил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (V), где R1 обозначает изопропил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (V), где R1 обозначает бутил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (V), где R1 обозначает замещенный или незамещенный гетероалкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (V), где R1 обозначает замещенный или незамещенный гетероциклоалкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (V), где R1 обозначает замещенный или незамещенный арил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (V), где R1 обозначает замещенный или незамещенный гетероарил.
[00137] В другом аспекте изобретения предусматриваются соединения, имеющие структуру Формулы (VI):
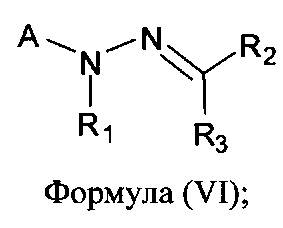
где:
А обозначает изостер карбоновой кислоты;
R1 обозначает H, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил;
R2 обозначает замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или -СН2С(O) (замещенный или незамещенный арил);
R3 обозначает H или замещенный или незамещенный алкил; или
R2 и R3 вместе с углеродным атомом, с которым они связаны, образуют циклоалкильное или гетероциклоалкильное кольцо;
или их фармацевтически приемлемые соль, сольват или пролекарство.
[00138] Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где А обозначает изостер карбоновой кислоты, выбранный из:
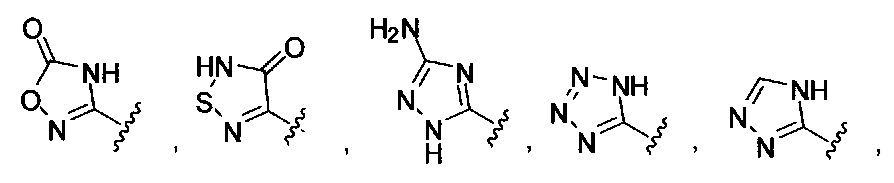
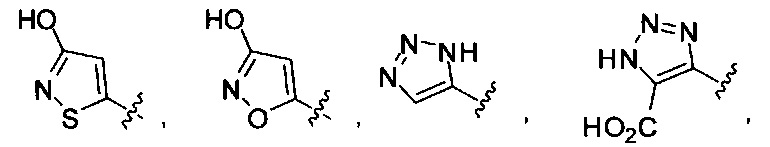
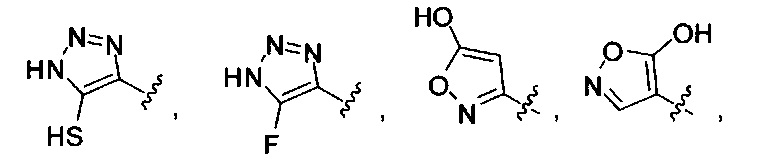
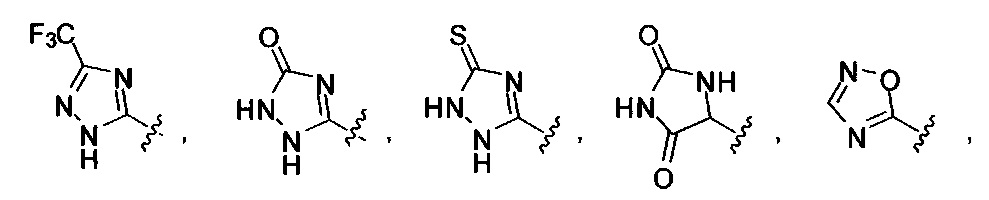
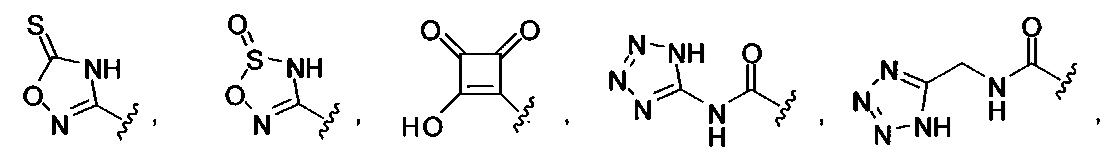
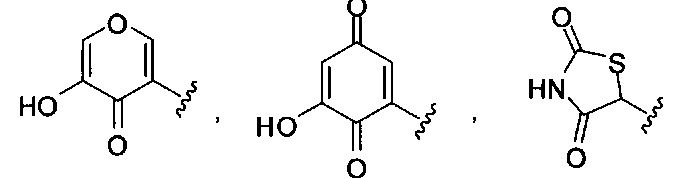 и
и 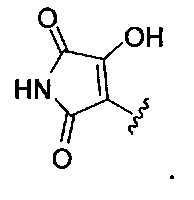
[00139] Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где А обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -Р(O)(OR4)2, -P(O)(R4)(OR4), -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2 и -CON(R4)C(R4)2B(OR5)2; где R4 в каждом случае, независимо, обозначает H, ОН, замещенный или незамещенный алкил или замещенный или незамещенный арил; и R5 обозначает H или С1-С6алкил.
[00140] Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где А обозначает изостер карбоновой кислоты, выбранный из -SO3H, -SO2NHR4, -P(O)(OR4)2, -Р(O)(R4)(OR4), -С(O)R4, -CON(R4)2, -CONHNHSO2R4, -CONHSO2R4, -C(R4)2B(OR5)2, and -CON(R4)C(R4)2B(OR5)2; где R4 в каждом случае, независимо, обозначает H, OH, замещенный или незамещенный алкил, замещенный или незамещенный гетероарил или замещенный или незамещенный арил; и R5 обозначает Н или C1-С6алкил.
[00141] Согласно другому варианту в изобретении предусматривается соединение Формулы (VI), где R1 обозначает замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где R1 обозначает Н. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где R1 обозначает замещенный или незамещенный алкил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (VI), где R1 обозначает метил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (VI), где R1 обозначает этил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (VI), где R1 обозначает пропил. Согласно другим вариантам в изобретении предусматривается соединение Формулы (VI), где R1 обозначает бутил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где R1 обозначает замещенный или незамещенный гетероалкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где R1 обозначает замещенный или незамещенный гетероциклоалкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где R1 обозначает замещенный или незамещенный арил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где R1 обозначает замещенный или незамещенный гетероарил.
[00142] Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где R2 обозначает замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или - СН2С(O)(замещенный или незамещенный арил), a R3 обозначает Н. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где R2 обозначает замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или -СН2С(O)(замещенный или незамещенный арил), a R3 обозначает замещенный или незамещенный алкил. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где R2 и R3 совместно с углеродным атомом, с которым они связаны, образуют циклоалкильное кольцо. Согласно некоторым вариантам в изобретении предусматривается соединение Формулы (VI), где R2 и R3 совместно с углеродным атомом, с которым они связаны, образуют гетероциклоалкильное кольцо.
[00143] Согласно некоторым вариантам в изобретении предусматривается соединение, выбранное из:
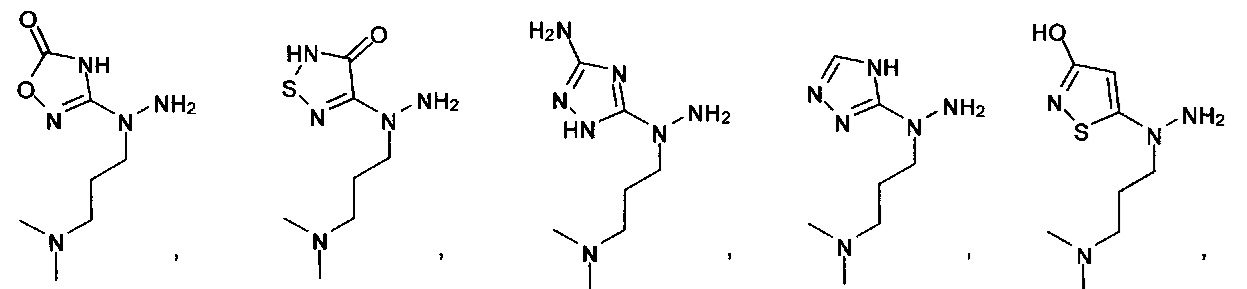
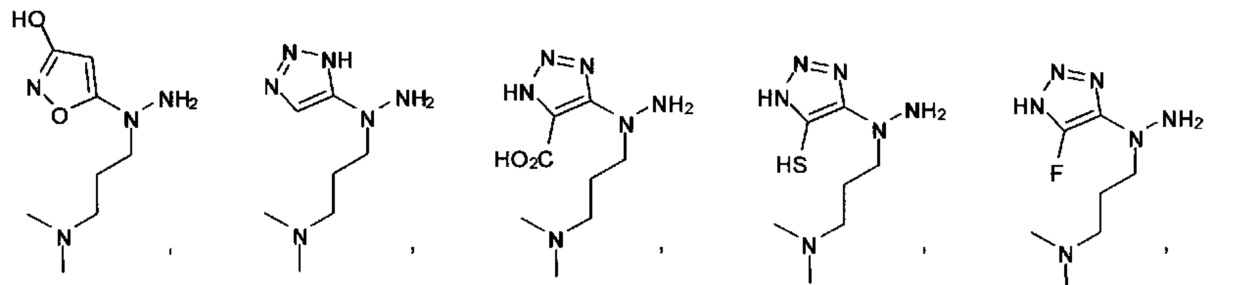
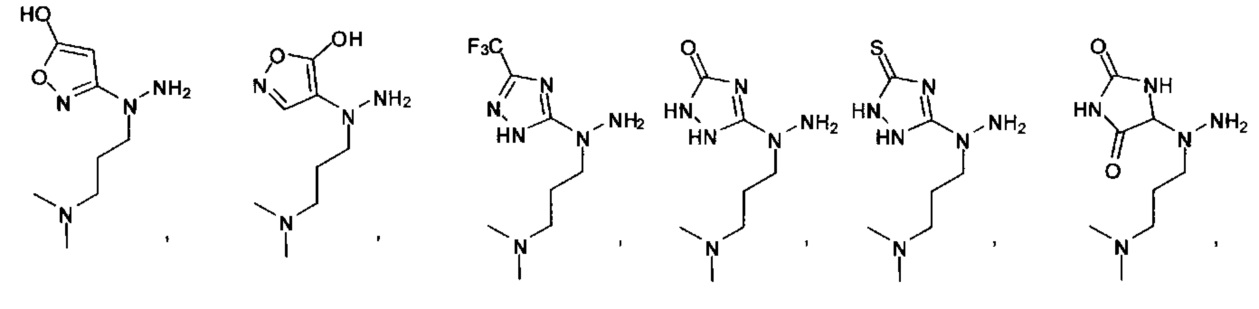
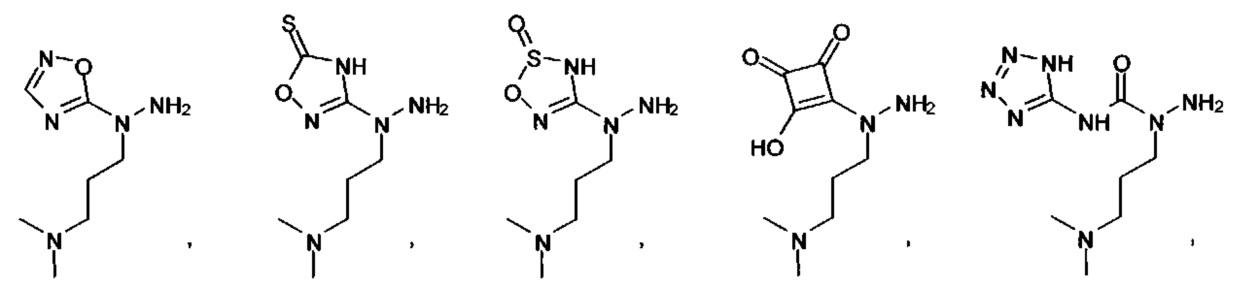
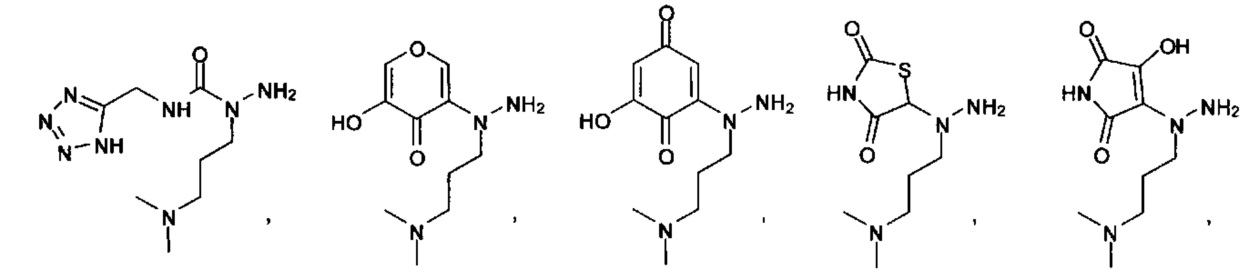
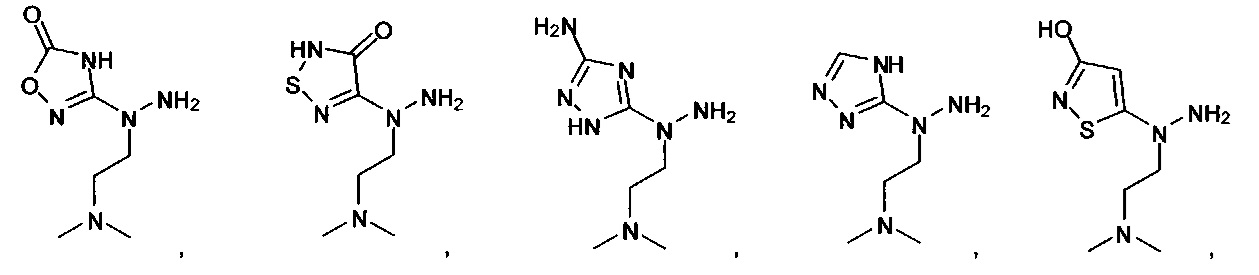
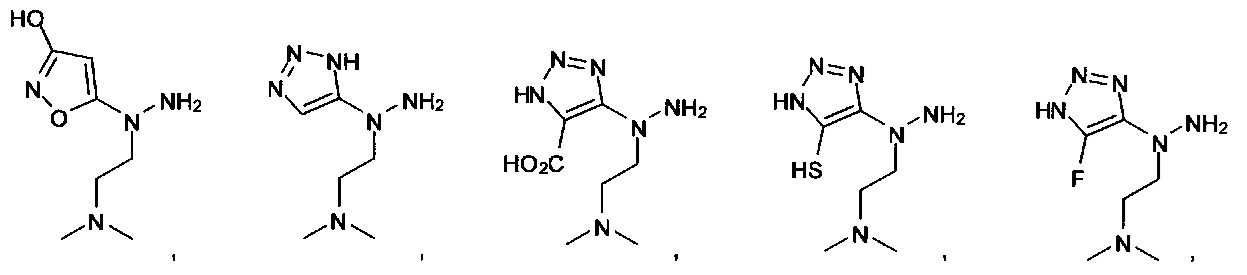
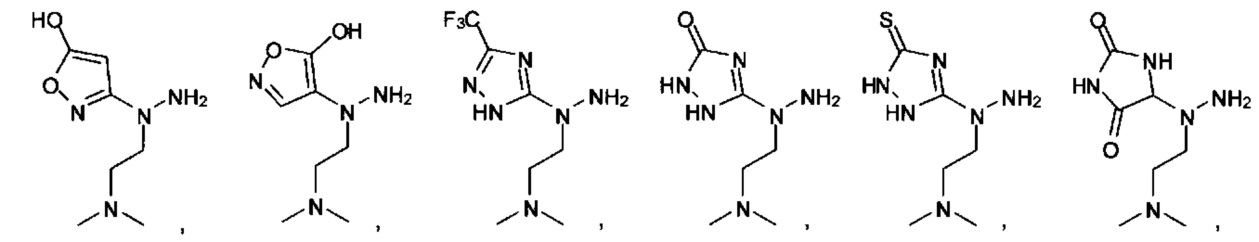
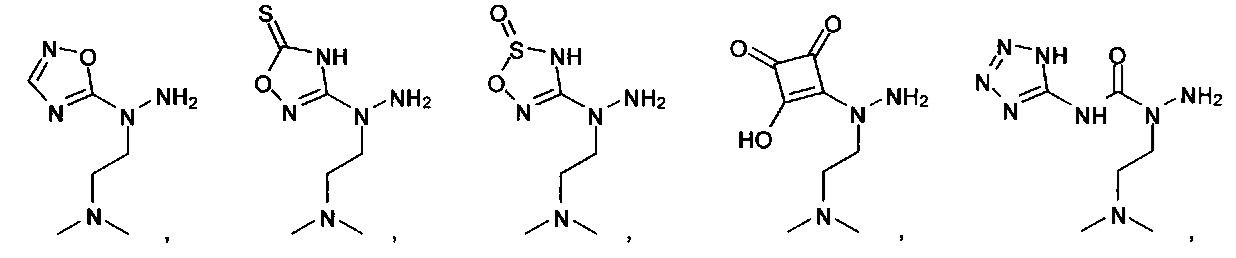
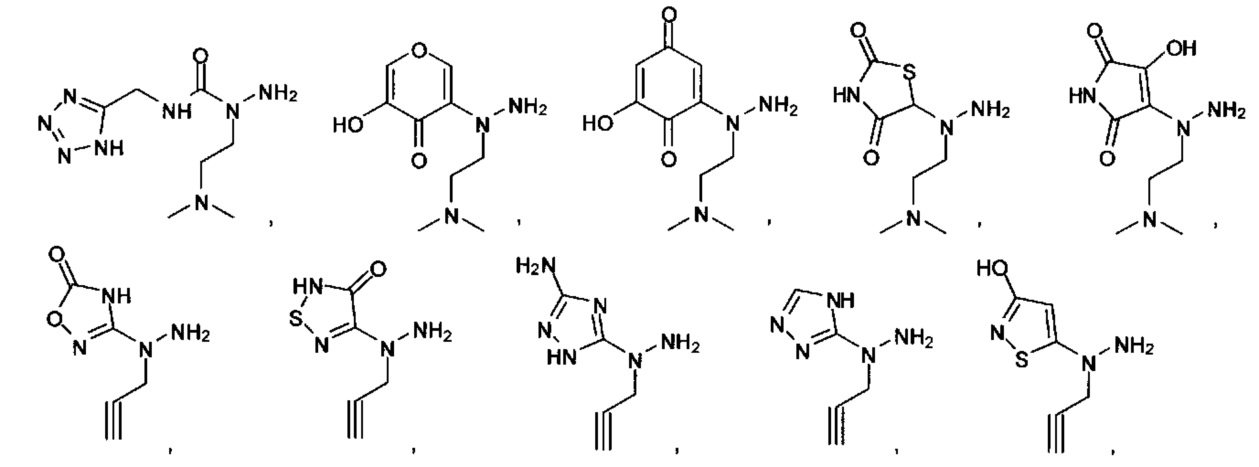
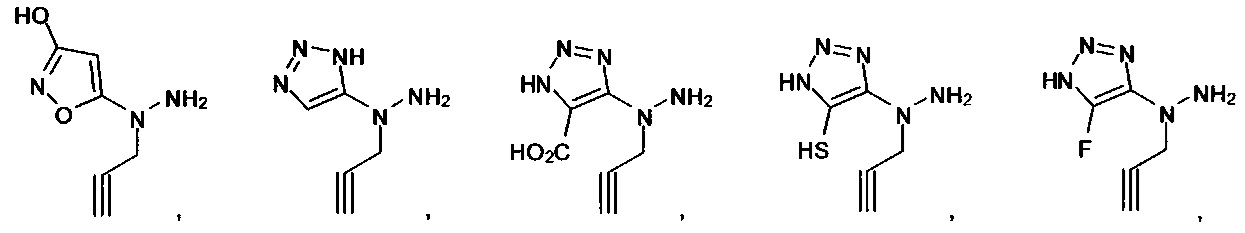
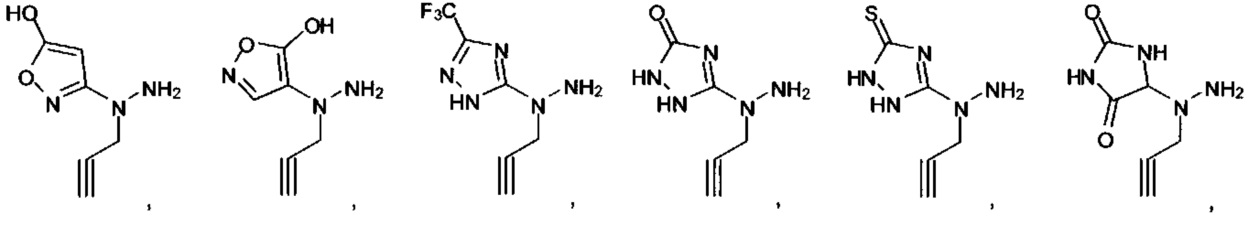
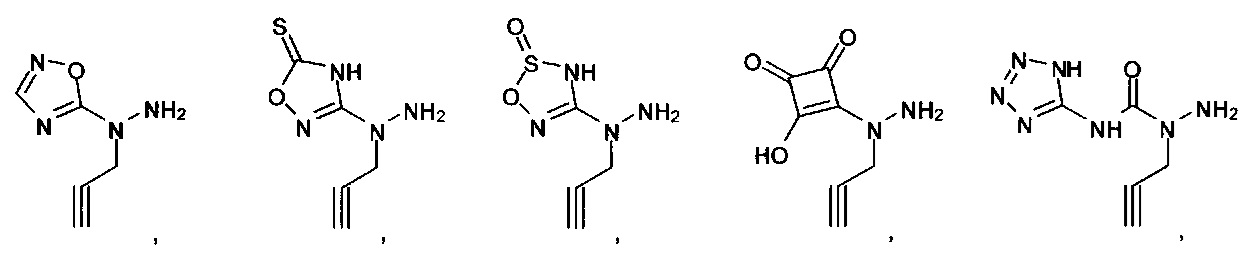
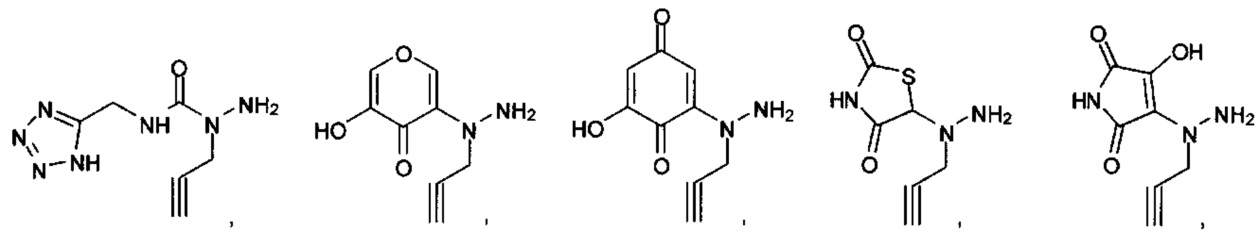
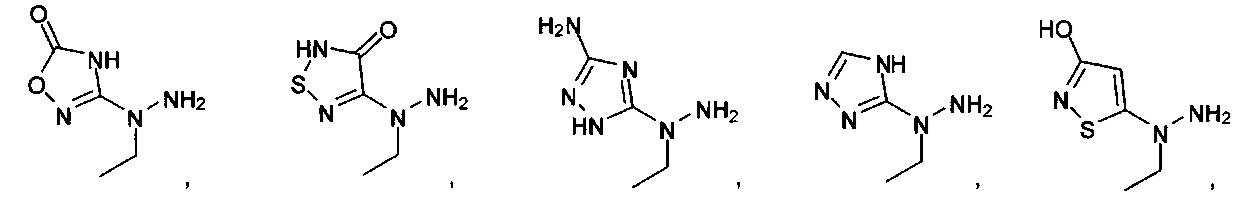
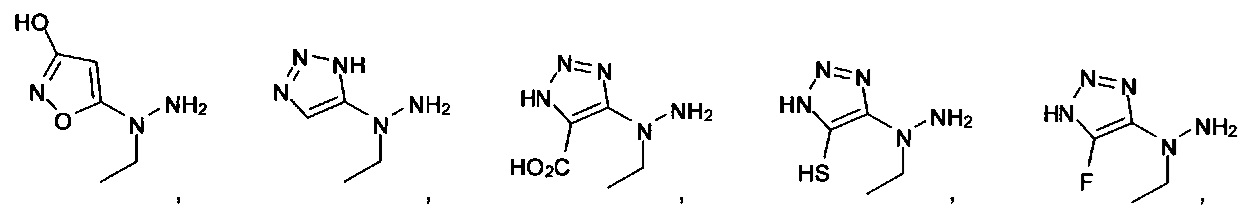
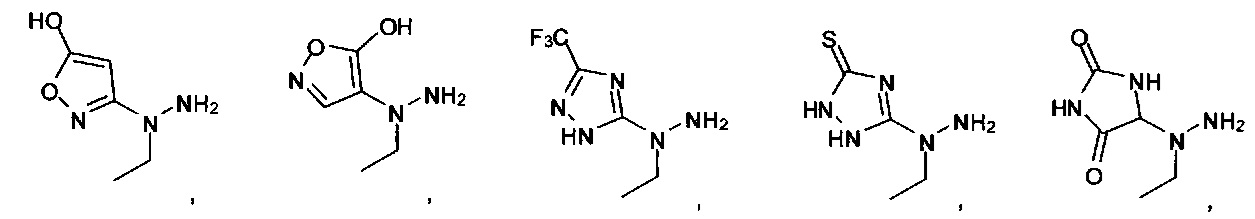
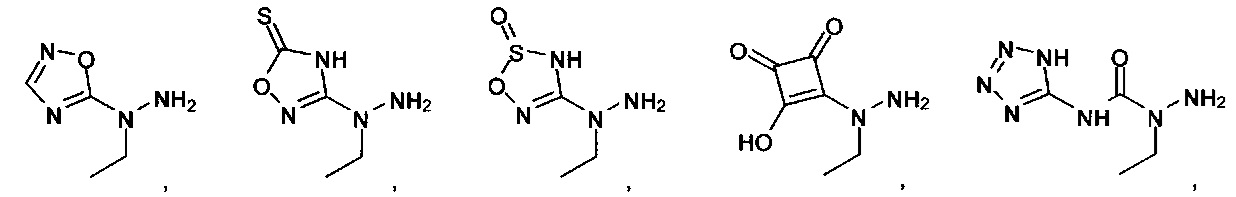
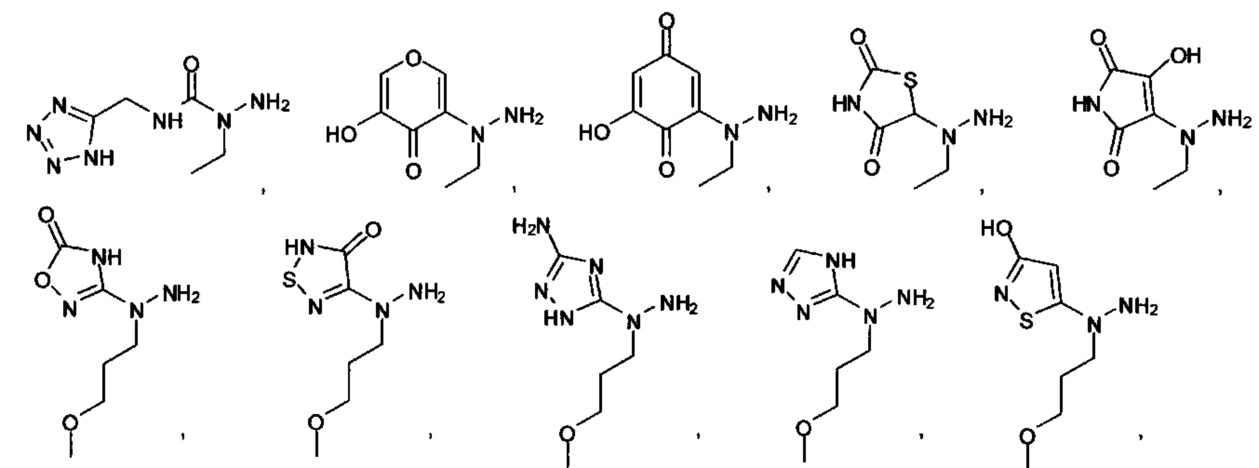
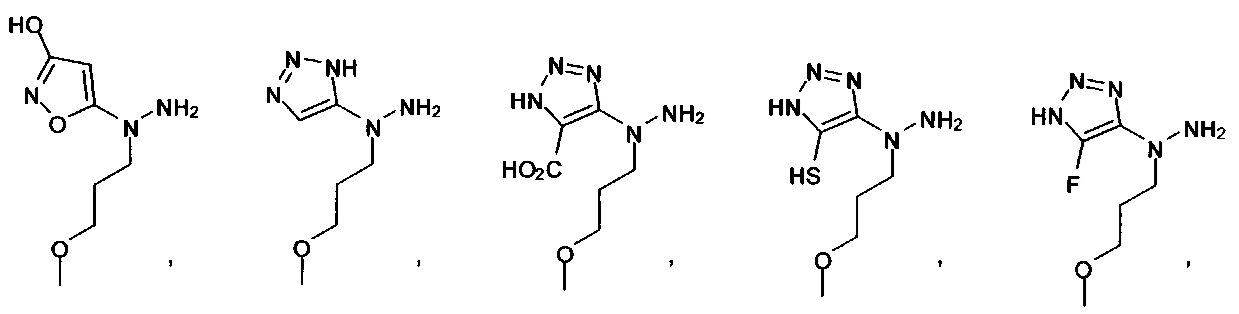
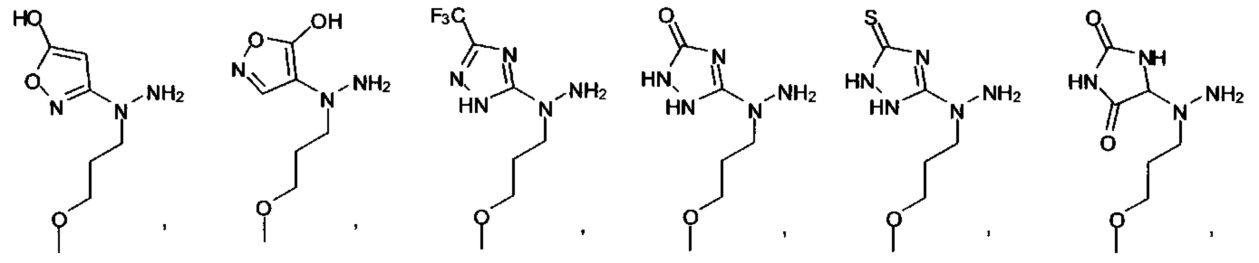
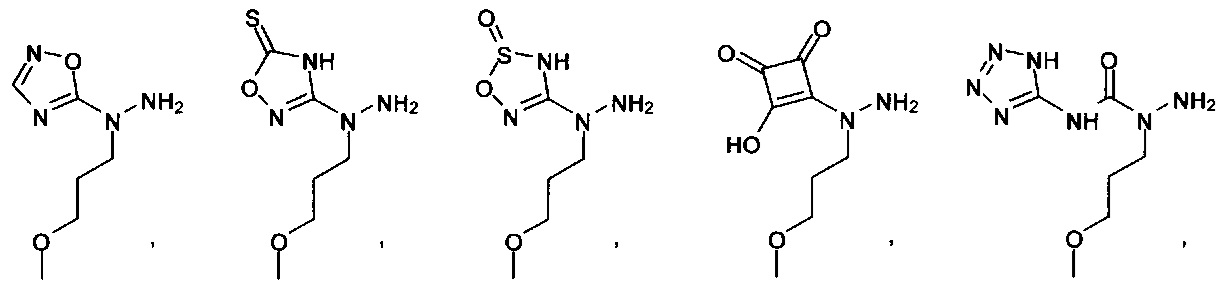
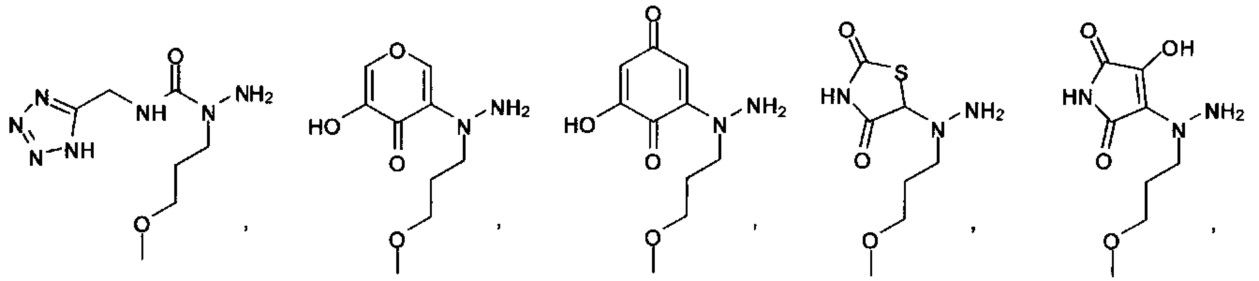
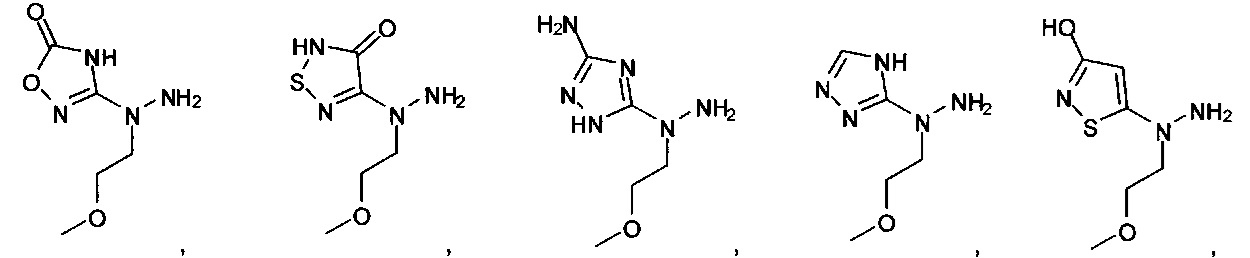
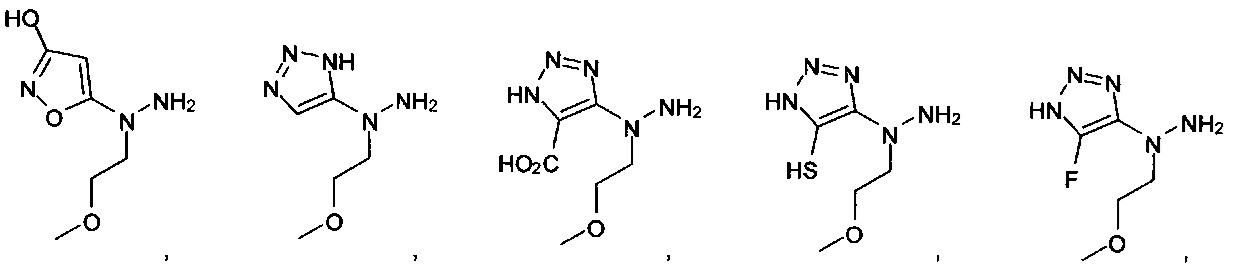
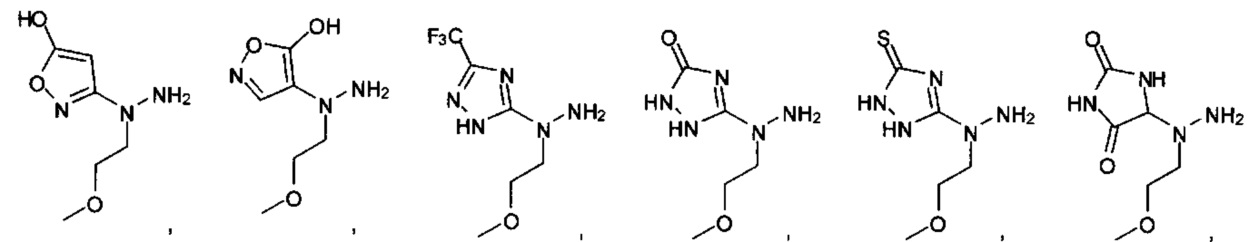
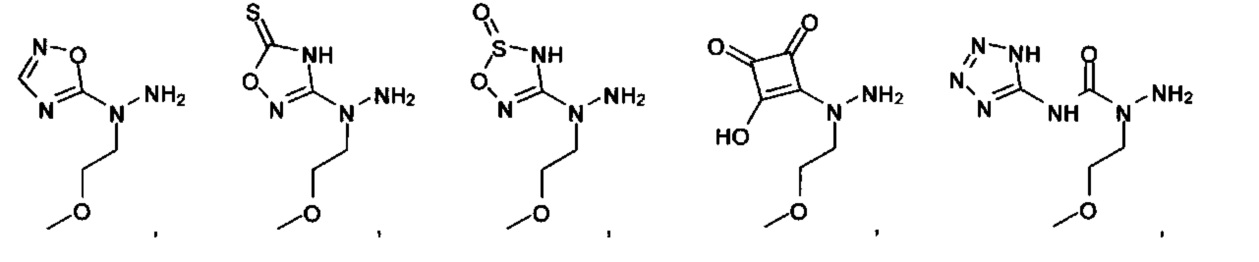
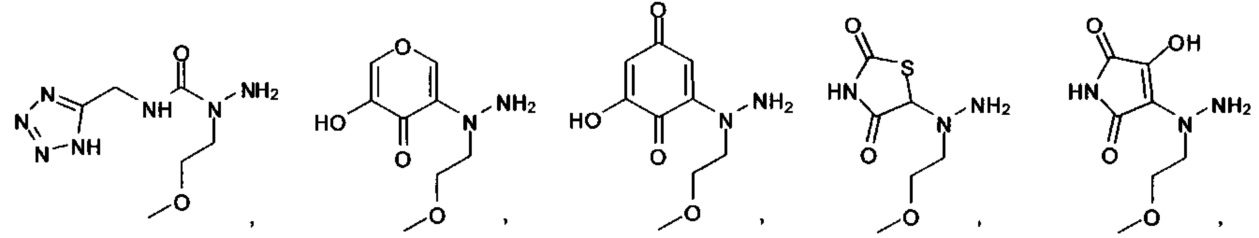
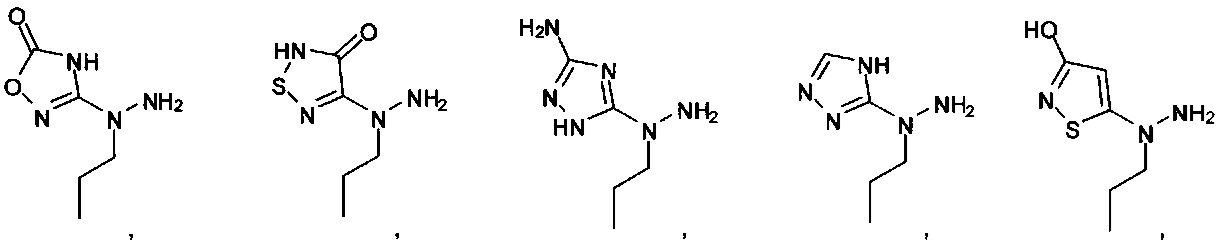
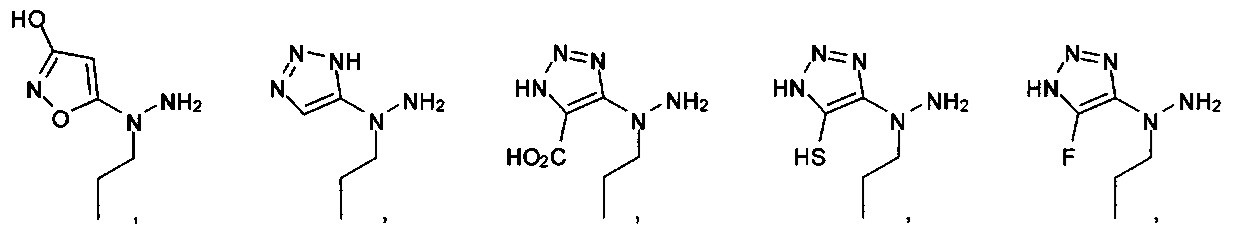
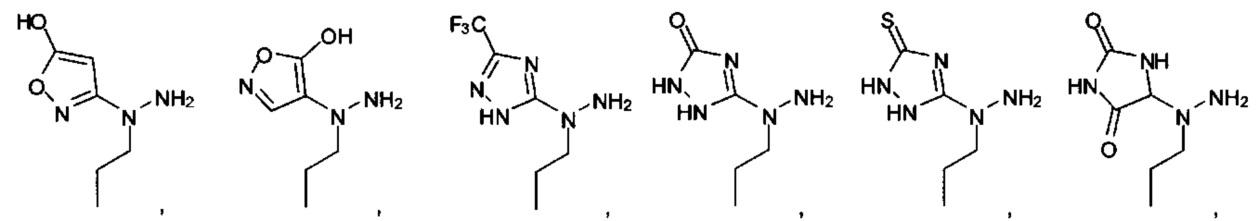
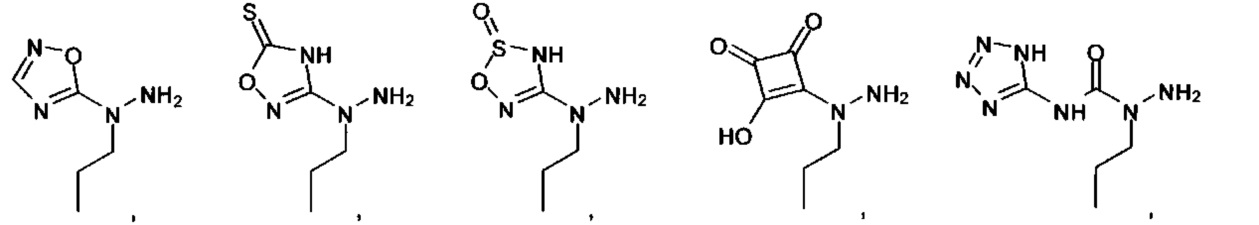
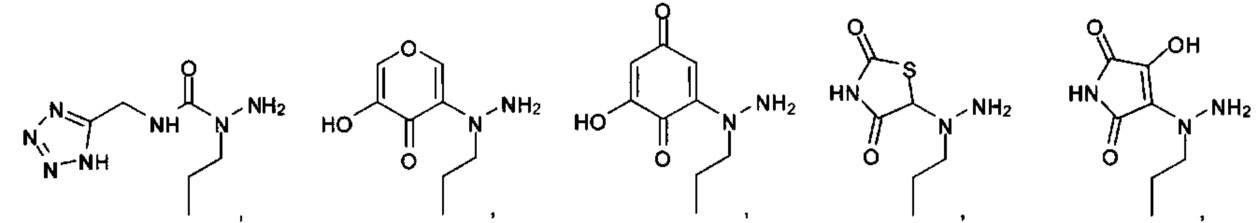
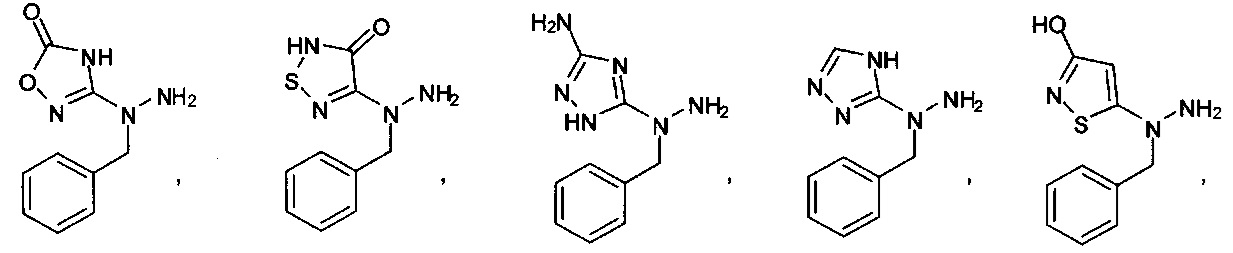
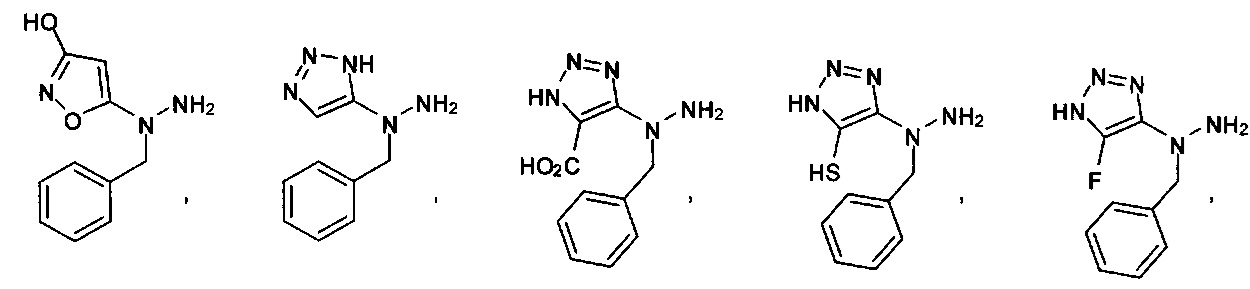
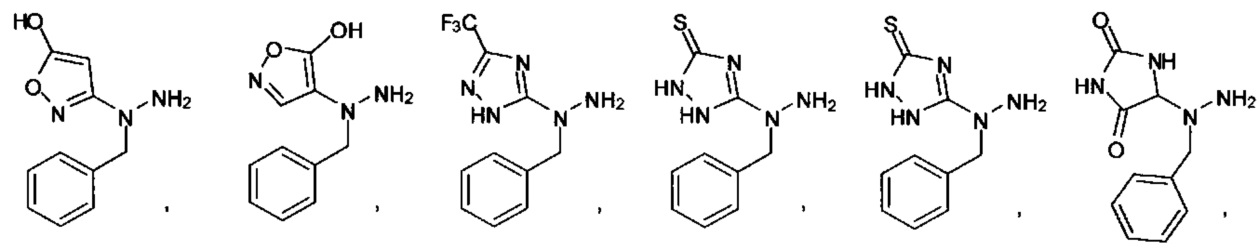
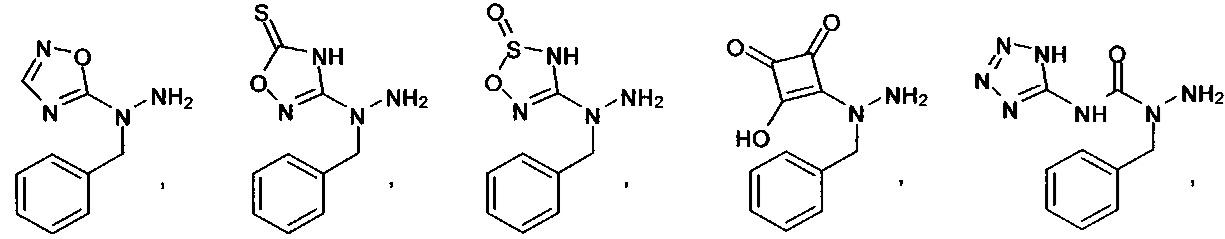
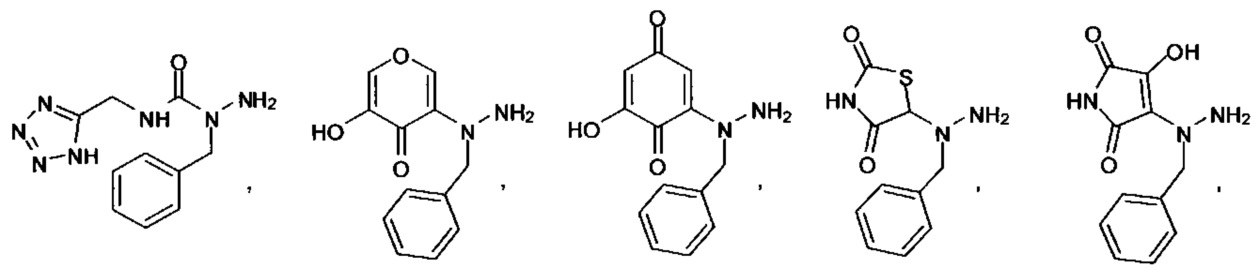
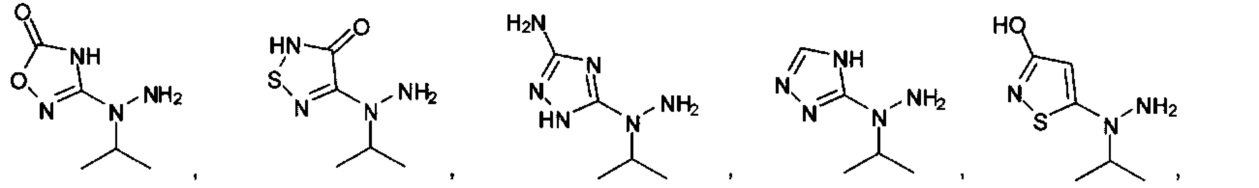
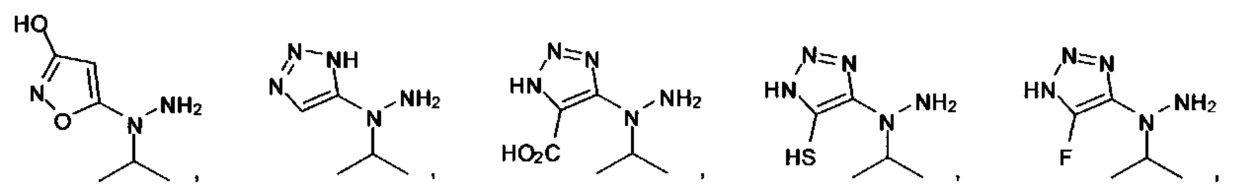
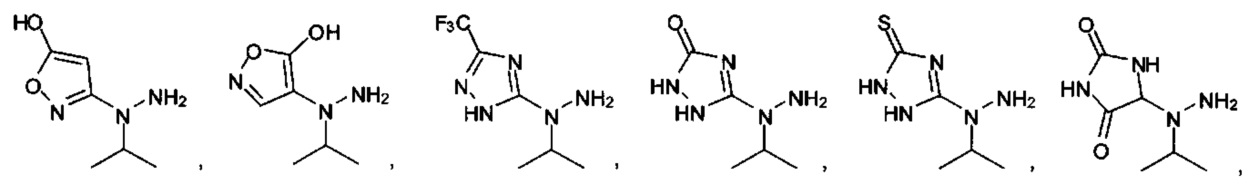
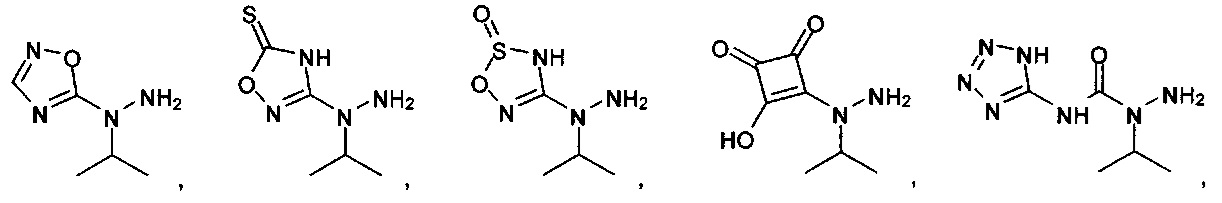
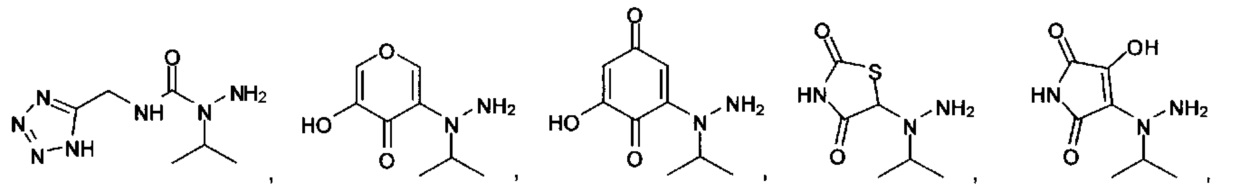
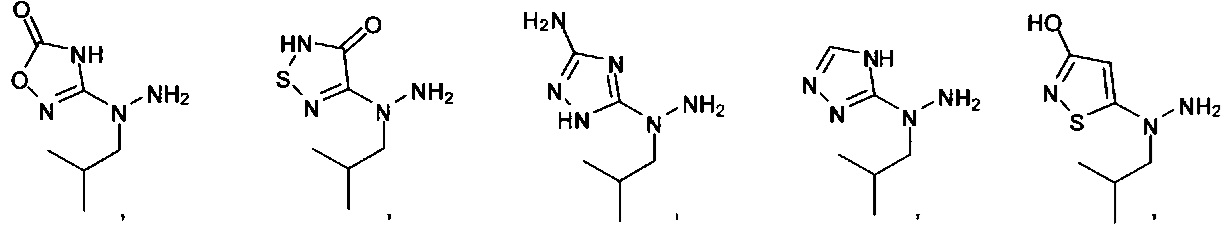
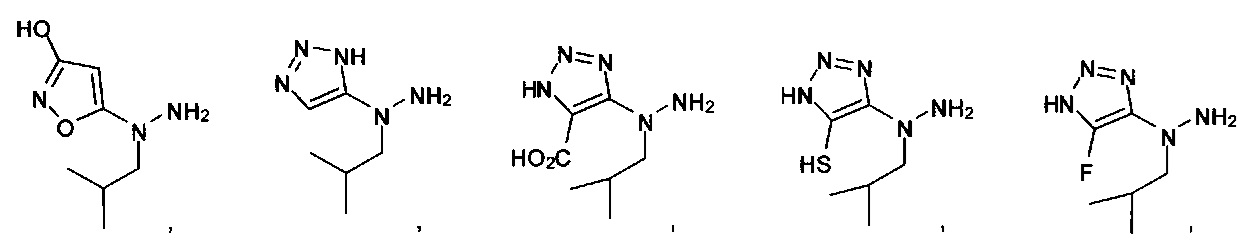
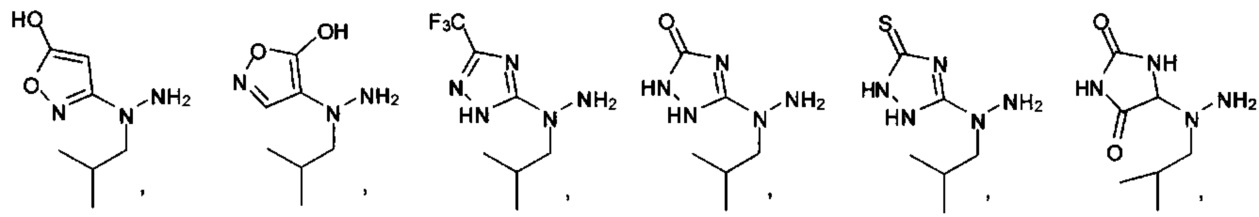
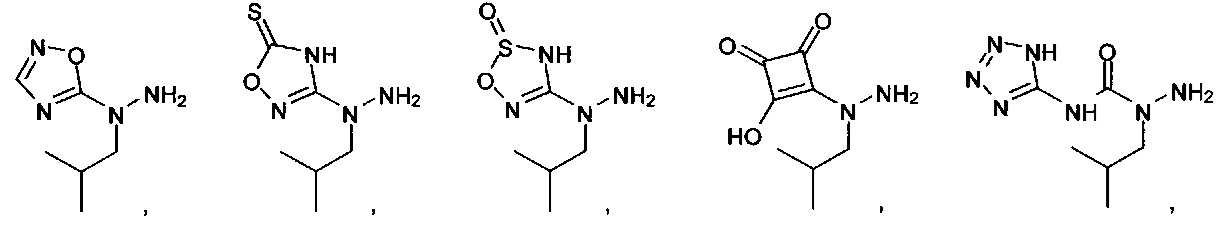
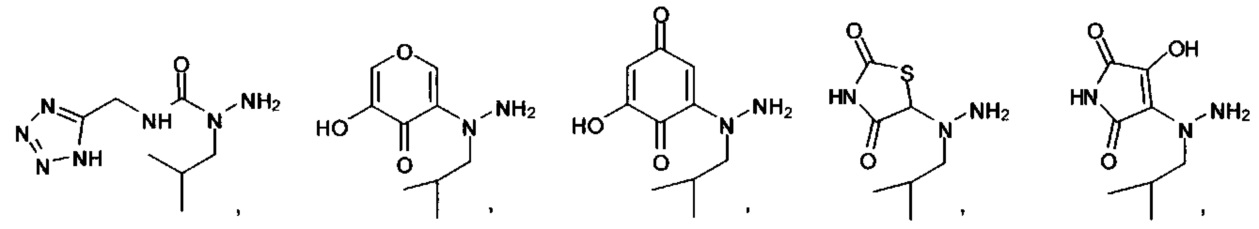
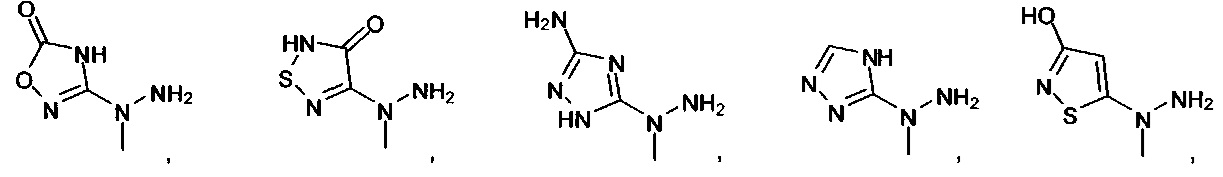
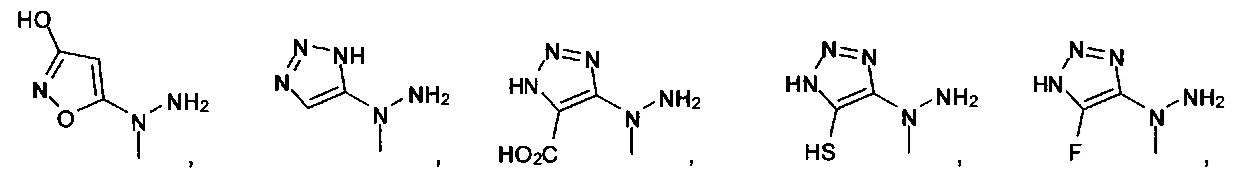
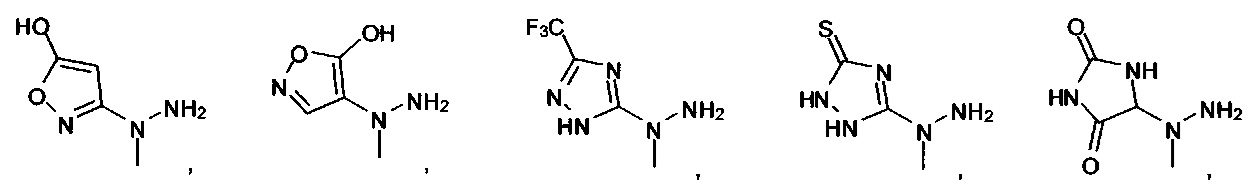
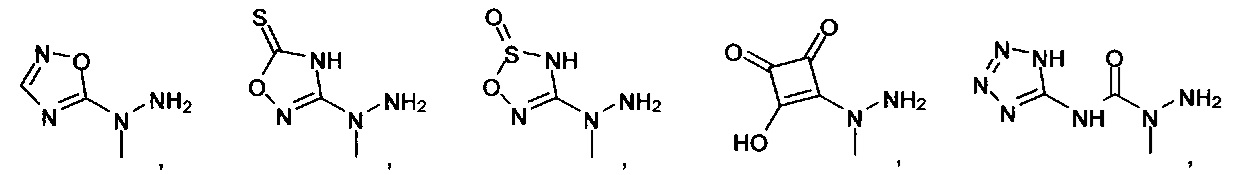
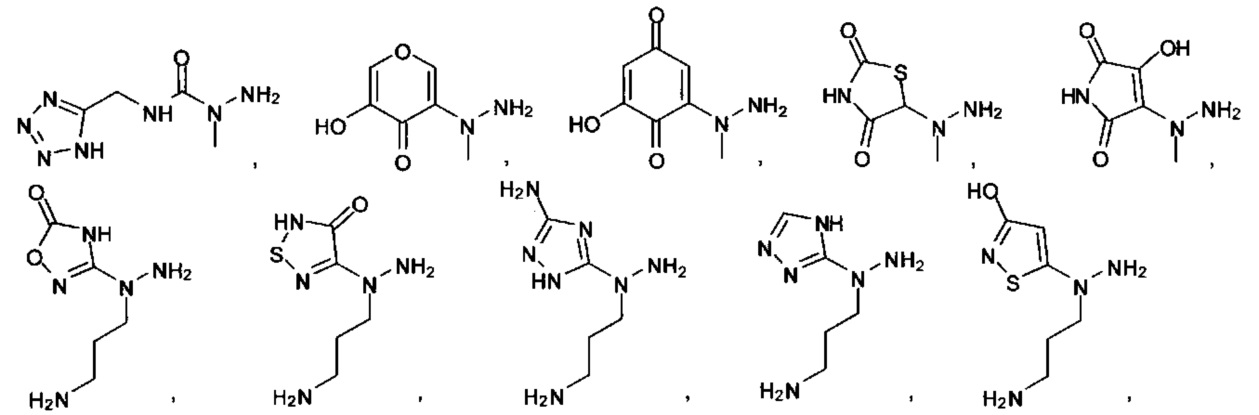
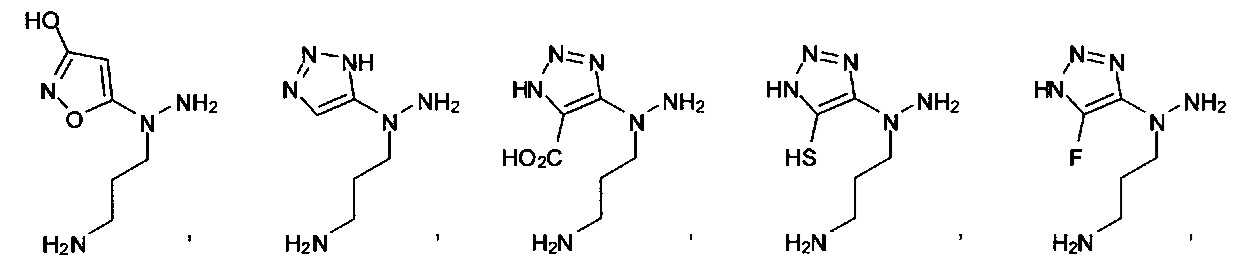
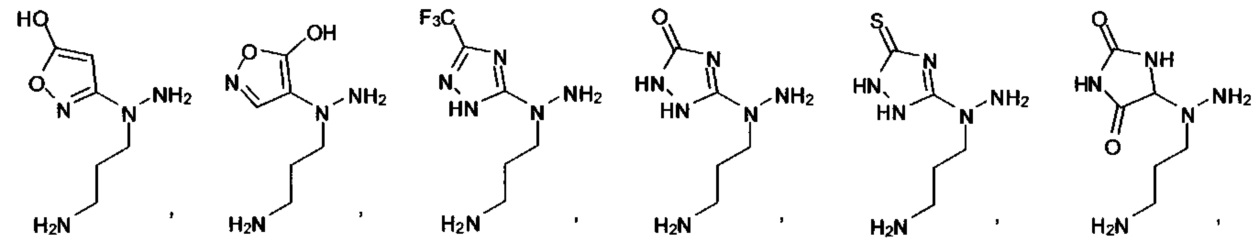
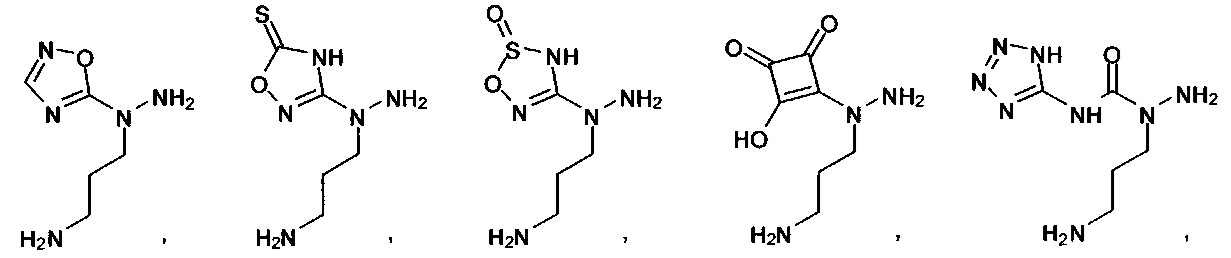
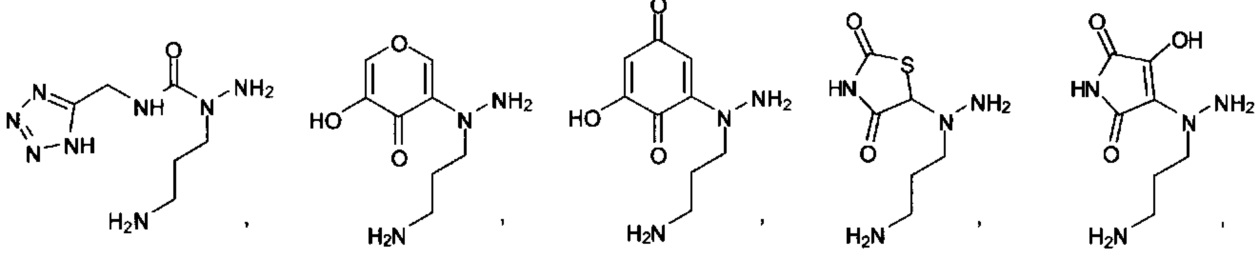
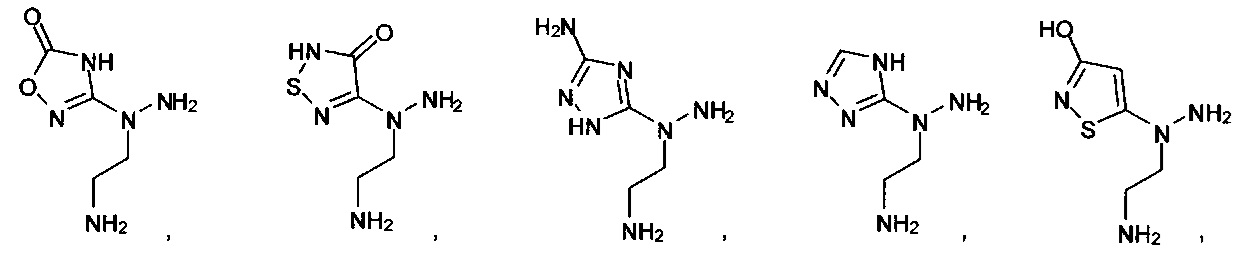
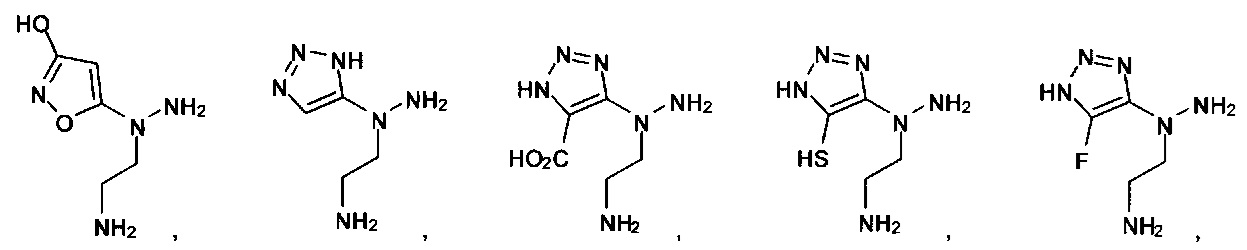
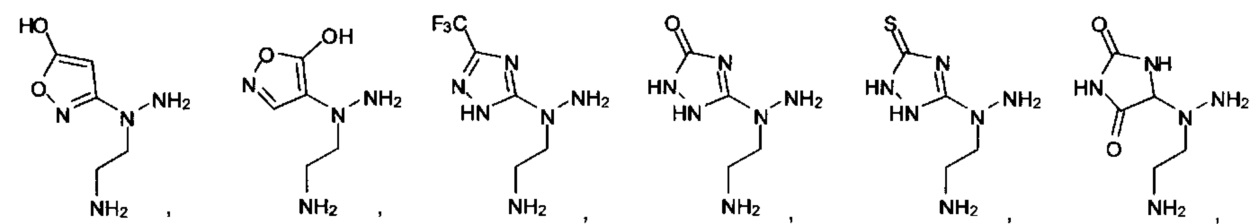
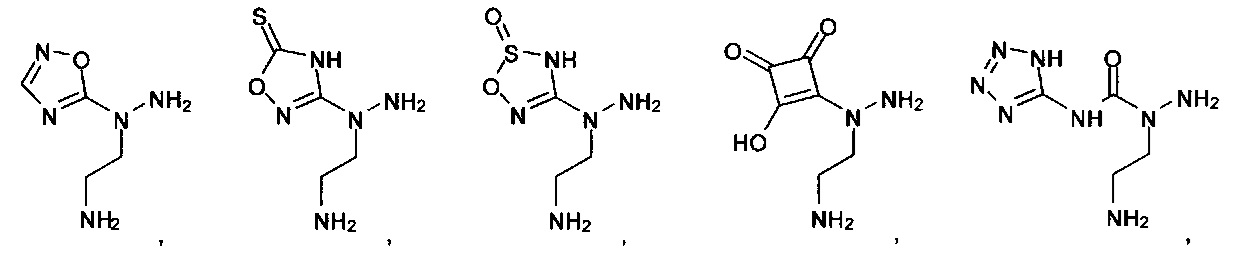
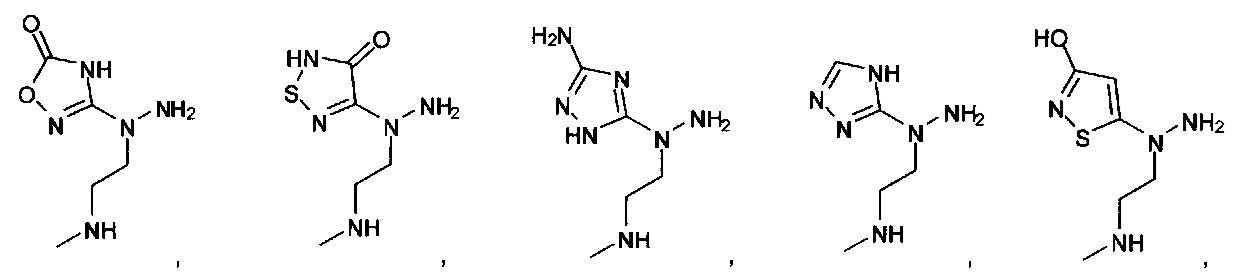
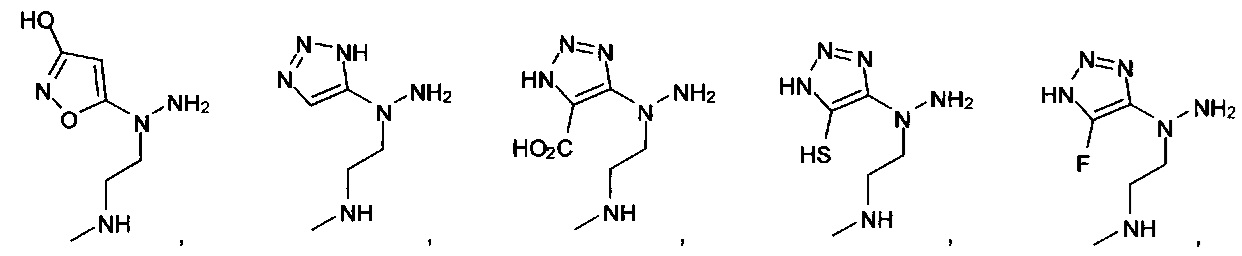
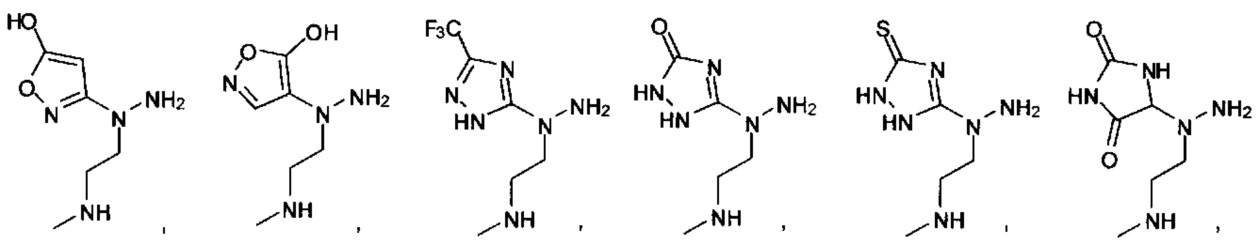
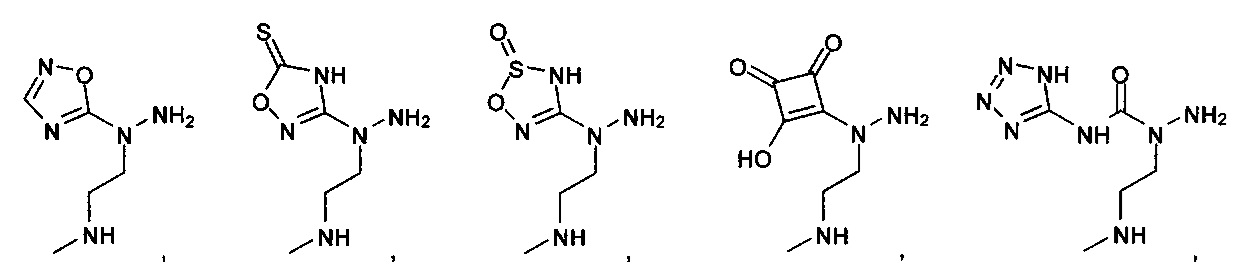
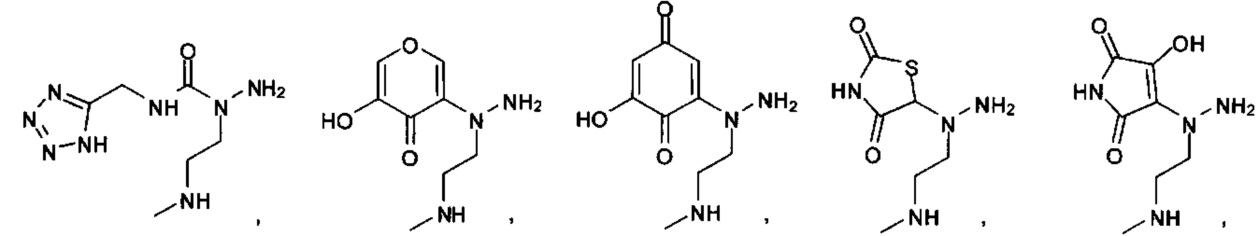
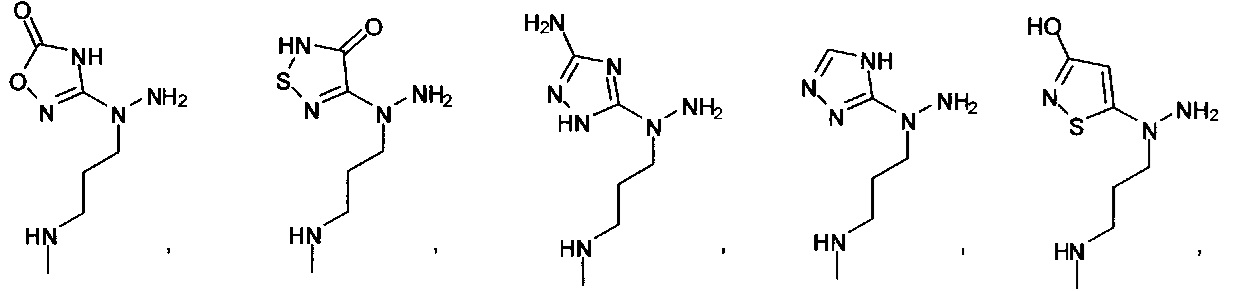
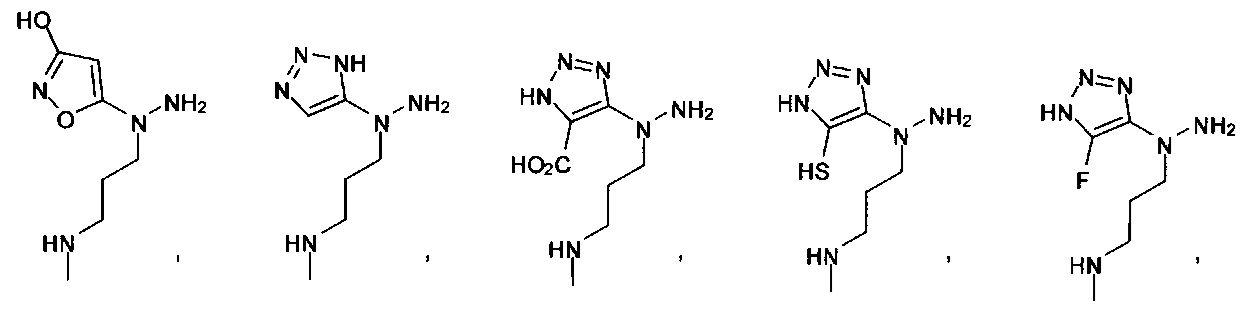
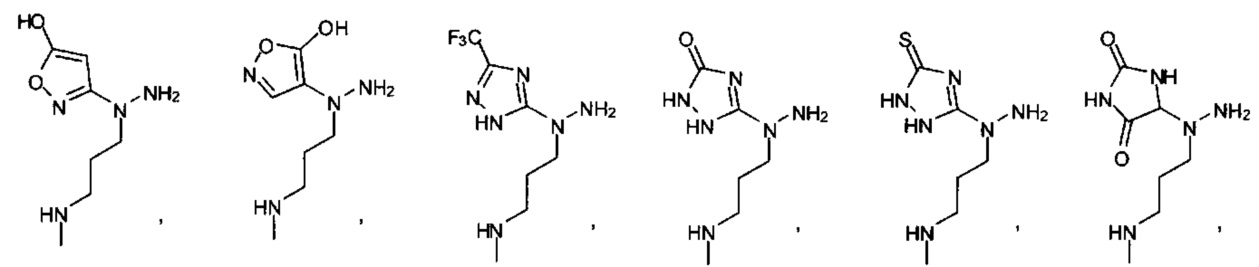
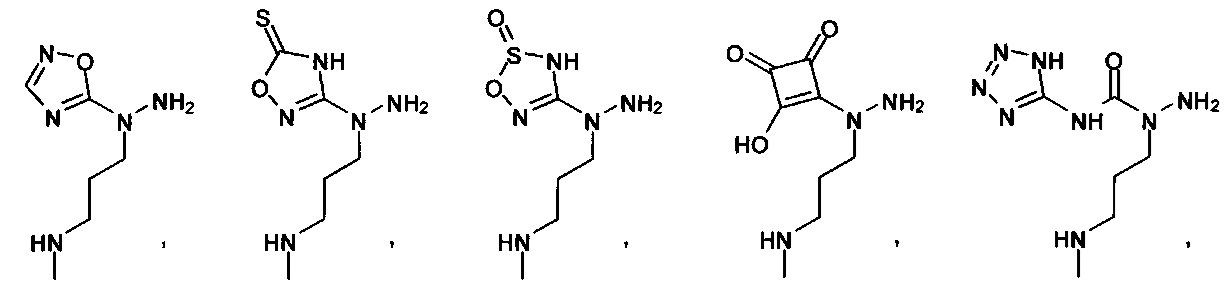
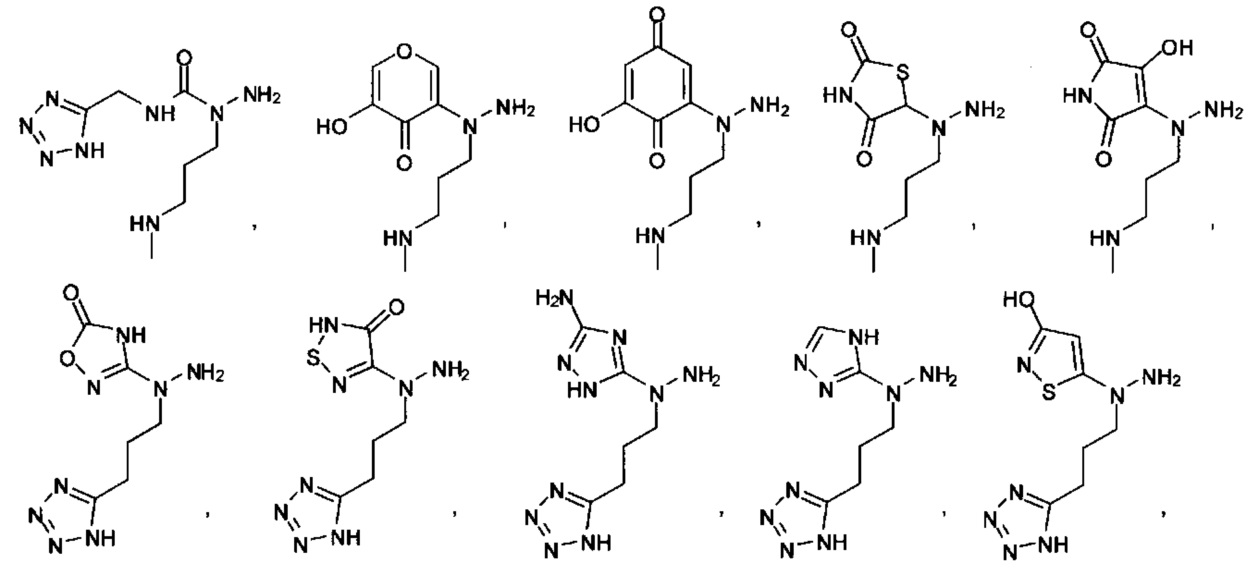
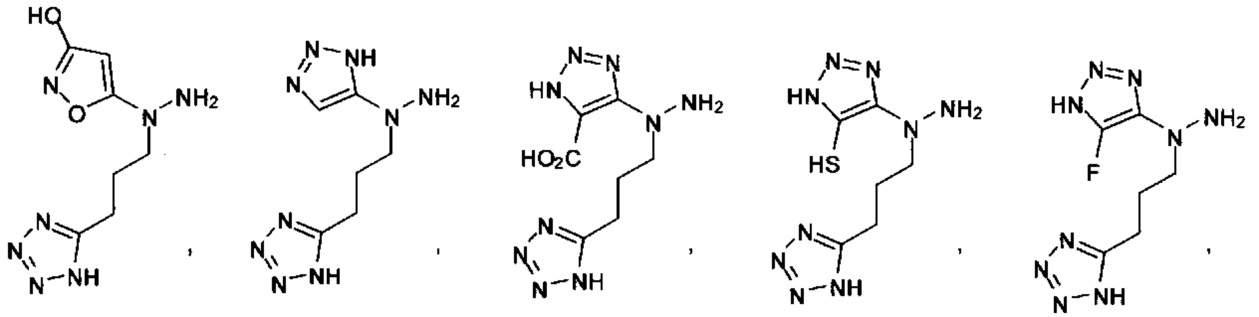
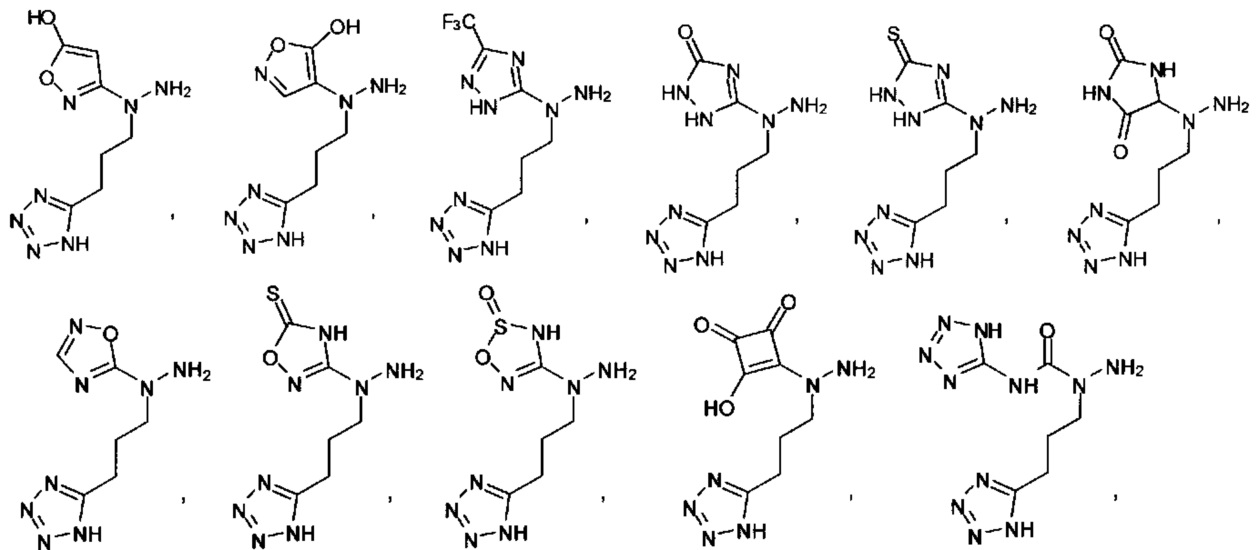
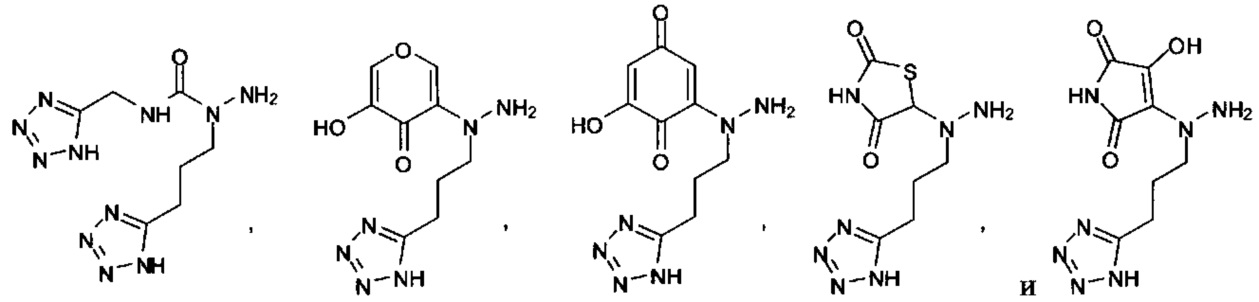 ; или его фармацевтически приемлемые соль, сольват или пролекарство.
; или его фармацевтически приемлемые соль, сольват или пролекарство.
[00144] Согласно некоторым вариантам в изобретении предусматривается соединение, выбранное из:
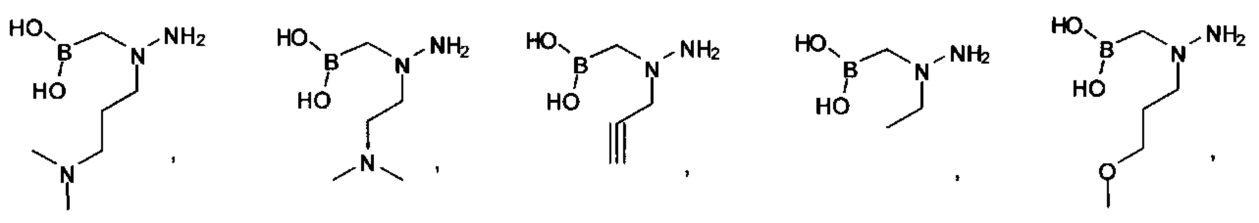
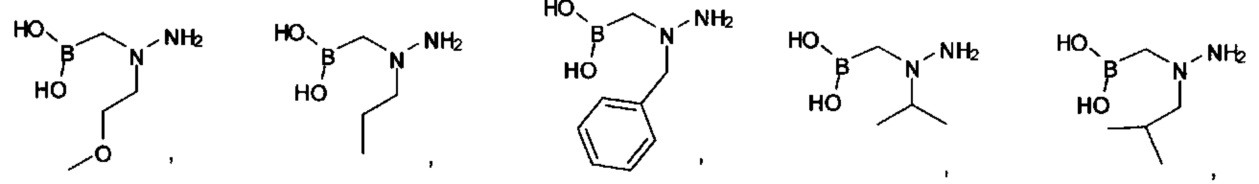
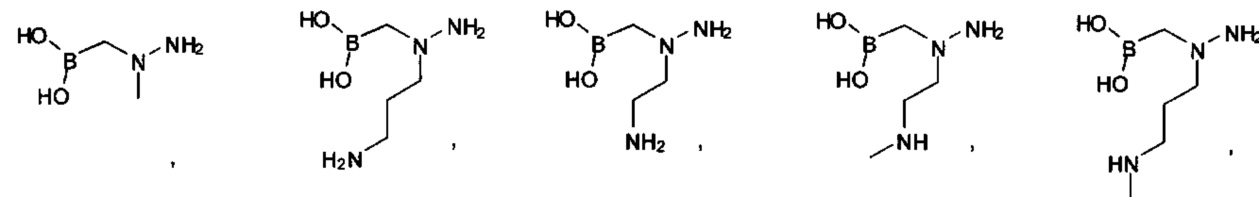 и
и 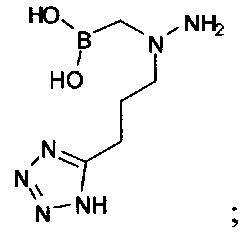 или его фармацевтически приемлемые соль, сольват или пролекарство.
или его фармацевтически приемлемые соль, сольват или пролекарство.
[00145] В настоящем изобретении предусматриваются фармацевтические композиции, содержащие терапевтически эффективное количество соединения Формулы (I), (II), (III), (IV), (V) или (VI), или его фармацевтически приемлемых соли, сольвата или пролекарства, и фармацевтически приемлемый носитель, причем соединение Формулы (I), (II), (III), (IV), (V) или (VI) представляет собой соединение по настоящему изобретению.
Способы введения
[00146] Применимые способы введения включают, но без ограничения, пероральный, внутривенный, в виде аэрозоля, парентеральный, глазной, легочный, чресслизистый, трансдермальный, назальный и местный (топический) способ введения. Кроме этого, парентеральная доставка, включает, например, внутримышечную, подкожную, внутривенную, интрамедуллярную, а также интратекальную, прямую интравентрикулярную, интраперитонеальную, внутрилимфатическую и/или интраназальную инъекции.
[00147] Согласно некоторым вариантам соединение Формулы (I), (II), (III), (IV), (V) или (VI) вводят скорее местно, нежели системно, например, с помощью местного (топического) нанесения соединения непосредственно на кожу, или внутривенно, или подкожно, часто в виде депо-препарата или в виде препарата с пролонгированным высвобождением. Согласно конкретным вариантам препараты длительного действия вводят посредством имплантации (например, подкожно или внутримышечно) или посредством внутримышечной инъекции. Согласно другим вариантам соединение по настоящему изобретению предусматривается в виде препарата с быстрым высвобождением, в виде препарата с замедленным высвобождением или в виде препарата с промежуточным высвобождением. Согласно другим вариантам соединение по настоящему изобретению применяют местно (например, в виде пластыря, мази или в комбинации с раневой повязкой или в виде лосьона или спрея). Согласно альтернативным вариантам препарат вводят системно (например, в виде инъекции или таблетки).
Фармацевтические композиции/Препараты
[00148] Согласно некоторым вариантам соединения по настоящему изобретению готовят в виде фармацевтических композиций. Фармацевтические композиции готовят обычным способом с применением одного или более фармацевтически приемлемых неактивных ингредиентов, позволяющих на основе активных соединений получать препараты, которые можно применять для фармацевтических целей. Соответствующий препарат (рецептура) зависит от выбранного способа введения. Обзор фармацевтических композиций, описанных в настоящей заявке, можно найти, например, в справочниках (учебниках) Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; и Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins 1999), которые включены в настоящее изобретение посредством отсылки.
[00149] В настоящем изобретении предусматриваются фармацевтические композиции, которые включают соединение Формулы (I), (II), (III), (IV), (V) или (VI) и по меньшей мере один фармацевтически приемлемый неактивный ингредиент. Согласно некоторым вариантам соединения по настоящему изобретению вводят в виде фармацевтических композиций, в которых соединения Формулы (I), (II), (III), (IV), (V) или (VI) находятся в виде смеси с другими активными ингредиентами, как в случае комбинированной терапии. Согласно другим вариантам фармацевтические композиции включают другие лекарственные или фармацевтические агенты, носители, адъюванты, консерванты, стабилизирующие, смачивающие агенты или эмульгаторы, агенты, способствующие растворению, соли для регуляции осмотического давления и/или буферы. Согласно другим вариантам фармацевтические композиции включают другие терапевтически полезные вещества.
[00150] Термин "фармацевтическая композиция" в настоящем контексте относится к смеси соединения Формулы (I), (II), (III), (IV), (V) или (VI) с другими химическими компонентами (а именно с фармацевтически приемлемыми неактивными ингредиентами), такими как носители, эксципиенты, связующие, наполнители, суспендирующие агенты, вкусовые агенты и ароматизаторы, подсластители, разрыхлители, диспергирующие вещества, поверхностно-активные вещества, смазывающие вещества (глиданты), красители, разбавители, солюбилизаторы, увлажнители, пластификаторы, стабилизаторы, усилители всасывания, смачивающие агенты, противовспенивающие агенты, антиоксиданты, консерванты или комбинации одного или более таких агентов. Фармацевтическая композиция способствует введению соединения в организм. При практическом использовании способов лечения или применения по настоящему изобретению эффективные количества соединений по настоящему изобретению в виде фармацевтической композиции вводят млекопитающему для лечения такого заболевания, нарушения или патологического состояния. Согласно некоторым вариантам млекопитающим является человек. Терапевтически эффективное количество может меняться в широких пределах в зависимости от тяжести заболевания, возраста и относительного состояния здоровья субъекта, активности применяемого соединения и других факторов. Соединения можно применять индивидуально (самостоятельно) или в комбинации с одним или более терапевтических агентов в качестве компонентов смесей.
[00151] Фармацевтические препараты по настоящему изобретению вводят субъекту соответствующими способами, включая, но без ограничения, пероральный, парентеральный (например, внутривенный, подкожный, внутримышечный), интраназальный, трансбуккальный (защечный), местный или трансдермальный способы введения. Фармацевтические препараты по настоящему изобретению включают, но без ограничения, жидкие водные дисперсии, самоэмульгирующиеся дисперсии, твердые растворы, липосомальные дисперсии, аэрозоли, твердые лекарственные формы, порошки, препараты с мгновенным высвобождением, препараты с контролируемым высвобождением, легкоплавкие препараты, таблетки, капсулы, пилюли, препараты с отсроченным (задержанным) высвобождением, препараты с замедленным высвобождением, препараты с пульсирующим высвобождением, препараты, состоящие из множества частиц (многочастичные), и препараты со смешанным мгновенным/контролируемым высвобождением.
[00152] Фармацевтические композиции, включающие соединение Формулы (I), (II), (III), (IV), (V) или (VI), получают традиционным способом, например, таким как обычные процессы смешения, растворения, грануляции, приготовления драже, растирания в порошок (отмучивания), эмульгирования, инкапсулирования, заключения (захвата) или прессования.
[00153] Фармацевтическая композиция включает по меньшей мере одно соединение Формулы (I), (II), (III), (IV), (V) или (VI) в качестве активного ингредиента в виде свободной кислоты или свободного основания или в виде фармацевтически приемлемой соли. Помимо этого, способы и фармацевтические композиции по настоящему изобретению включают применение N-оксидов (в случае необходимости), кристаллических форм, аморфной фазы, а также активных метаболитов этих соединений, обладающих активностью того же типа.
[00154] Согласно некоторым вариантам соединения Формулы (I), (II), (III), (IV), (V) или (VI) присутствуют в несольватированном виде или в виде сольватов с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. Сольватированные формы соединений Формулы (I), (II), (III), (IV), (V) или (VI) также рассматриваются в настоящем изобретении.
[00155] Согласно некоторым вариантам соединения Формулы (I), (II), (III), (IV), (V) или (VI) существуют в виде таутомеров. Все таутомеры включены в состав соединений по настоящему изобретению. По сути понятно, что соединение Формулы (I), (II), (III), (IV), (V) или (VI) или его соль может проявлять свойство таутомерии, когда два химических соединения способны легко переходить друг в друга за счет обмена атома водорода между двумя атомами, с каждым из которых этот атом водорода образует ковалентную связь. Так как таутомерные соединения существуют в динамическом равновесии друг с другом, их можно рассматривать как разные изомерные формы одного и того же соединения. Понятно, что изображение формулы в данном описании может представлять только одну из возможных таутомерных форм. Однако также следует понять, что настоящее раскрытие охватывает любую таутомерную форму и не ограничивается только какой-либо таутомерной формой, изображенной на рисунках. Изображения формул в настоящем описании могут представлять только одну из возможных таутомерных форм, и следует отдавать отчет, что описание включает все возможные таутомерные формы изображенных соединений, а не только те формы, которые было удобно графически изобразить в данном описании. Например, явление таутомерии может наблюдаться для тетразольной группы или триазольной группы, связанной как показано волнистой линией:

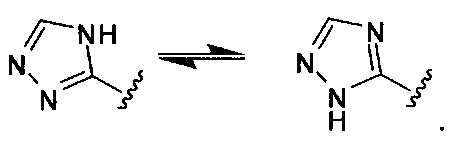
[00156] Согласно некоторым вариантам соединения Формулы (I), (II), (III), (IV), (V) или (VI) существуют в виде энантиомеров, диастереомеров или других стереоизомерных форм. Соединения по настоящему изобретению включают все энантиомерные, диастереомерные и эпимерные формы, а также их смеси.
[00157] Согласно некоторым вариантам соединения по настоящему описанию можно приготовить в виде пролекарств. Термин «пролекарство» относится к веществу, которое превращается в исходное лекарство in vivo. Пролекарства часто применяются, потому что в некоторых случаях их легче вводить, чем исходное лекарство. Например, они могут быть биодоступными при пероральном применении, тогда как исходное лекарство таковым не является. Пролекарство может обладать повышенной солюбильностью в фармацевтических композициях по сравнению с исходным лекарством. Примером пролекарства, но без ограничения, может быть соединение по настоящему изобретению, которое вводят в виде сложного эфира («пролекарства») с целью способствовать переносу через мембрану, где растворимость в воде вредно действует на подвижность, но затем этот сложный эфир гидролизуется в процессе метаболизма, давая активное соединение-карбоновую кислоту сразу после попадания в клетку, где растворимость в воде является полезной. Другим примером пролекарства может являться короткий пептид (полиаминокислота), связанный с кислотной группой, этот пептид метаболизируется, высвобождая активную молекулу. Согласно некоторым вариантам после введения in vivo пролекарство, в результате химических реакций, превращается в биологически, фармацевтически или терапевтически активную форму соединения. Согласно некоторым вариантам пролекарство ферментативно метаболизируется в ходе одной или более стадий или в ходе одного или более процессов в биологически, фармацевтически или терапевтически активную форму соединения.
[00158] Про лекарственные формы соединений по настоящему изобретению, которые метаболизируются in vivo, давая соединение Формулы (I), (II), (III), (IV), (V) или (VI), представленные в настоящей заявке, входят в объем Формулы изобретения. В ряде случаев некоторые из соединений по настоящему изобретению могут представлять собой пролекарства для другого производного или активного соединения. Согласно некоторым вариантам гидразоны по настоящему изобретению метаболизируются in vivo, давая соединение Формулы (I), (II), (III), (IV) или (V). Согласно некоторым вариантам соединения Формулы (VI) метаболизируются in vivo, давая соединение Формулы (I), (II), (III), (IV) или (V).
[00159] Согласно некоторым вариантам композиции по настоящему изобретению включают один или более консервантов для подавления микробиологической активности. Подходящие консерванты включают ртутьсодержащие вещества, такие как мерфен и тиомерсал; стабилизированный диоксид хлора; и четвертичные аммониевые соединения, такие как бензалкония хлорид, цетилтриметиламмония бромид и цетилпиридиния хлорид.
[00160] Согласно некоторым вариантам предпочтительными являются препараты по настоящему изобретению, содержащие антиоксиданты, металл-хелатирующие агенты, тиол-содержащие соединения и другие обычные стабилизирующие агенты. Примеры таких стабилизирующих агентов включают, но без ограничения: (а) примерно от 0.5% примерно до 2% вес/об. глицерина, (б) примерно от 0.1% примерно до 1% вес/об. метионина, (в) примерно от 0.1% примерно до 2% вес/об. монотиоглицерина, (г) примерно от 1 мМ примерно до 10 мМ EDTA, (д) примерно от 0.01% примерно до 2% вес/об. аскорбиновой кислоты, (е) 0.003% примерно до 0.02% вес/об. полисорбата 80, (ж) 0.001% примерно до 0.05% вес/об. полисорбата 20, (з) аргинин, (и) гепарин, (к) сульфат декстрана, (л) циклодекстрины, (м) полисульфат пентозана и другие гепариноиды, (н) двухвалентные катионы, такие как катионы магния и цинка; или (о) их комбинации.
[00161] Фармацевтические композиции по настоящему описанию, которые включают соединение Формулы (I), (II), (III), (IV), (V) или (VI), готовят в виде соответствующей лекарственной формы, включая, но без ограничения, водные пероральные дисперсии, растворы, гели, сиропы, эликсиры, пасты, суспензии, твердые пероральные лекарственные формы, аэрозоли, препараты с контролируемым высвобождением, легкоплавкие препараты, шипучие препараты, лиофилизированные препараты, таблетки, порошки, пилюли, драже, капсулы, препараты с отсроченным высвобождением, препараты с замедленным высвобождением, препараты с пульсирующим высвобождением, препараты состоящие из множества частиц, и смешанные препараты с мгновенным/пульсирующим высвобождением.
Некоторые композиции для местного применения
[00162] Согласно некоторым вариантам соединения Формулы (I), (II), (III), (IV), (V) или (VI) готовят в виде трансдермальных лекарственных форм. Согласно одному варианту трансдермальные препараты по данному описанию включают по меньшей мере три компонента: (1) состав соединения Формулы (I), (II), (III), (IV), (V) или (VI); (2) усилитель всасывания (вещество, способствующее всасыванию); и (3) необязательный водный адьювант. Согласно некоторым вариантам трансдермальные препараты включают дополнительные компоненты, такие, но без ограничения, как гелеобразующие агенты, основу кремов и мазей и т.п. Согласно некоторым вариантам трансдермальный препарат находится в виде пластыря или раневой повязки. Согласно некоторым вариантам трансдермальный препарат включает также тканый или нетканый материал-подложку для повышения всасывания и предупреждения удаления трансдермального препарата с поверхности кожи. Согласно другим вариантам трансдермальные препараты по настоящему изобретению могут поддерживать насыщенное или пересыщенное состояние, чтобы стимулировать диффузию через кожу.
[00163] В одном аспекте изобретения для введения трансдермальных препаратов, содержащих соединения по настоящему изобретению, применяются устройства для трансдермальной доставки и трансдермальные пластыри для доставки, и эти трансдермальные препараты могут представлять собой липофильные эмульсии или буферные водные растворы и/или могут быть диспергированы в полимере или в клеящем (связывающем) составе. В одном аспекте такие пластыри предназначены для непрерывной, пульсирующей доставки или для доставки по мене необходимости. Кроме того, трансдермальную доставку соединений по настоящему изобретению можно осуществлять с помощью ион(т)офоретических пластырей и т.п. В одном аспекте трансдермальные пластыри обеспечивают контролируемую доставку соединения Формулы (I), (II), (III), (IV), (V) или (VI). В одном аспекте трансдермальные устройства имеют форму жгута-пелота (бандажа), включающего подкладку (подложку), резервуар, содержащий соединение, необязательно с носителями, необязательно барьер, регулирующий скорость, для доставки соединения к поверхности кожи хозяина с контролируемой и заданной скоростью в течение продолжительного периода времени и средство для прикрепления устройства к поверхности кожи.
[00164] Согласно другим вариантам препараты для местного применения включают гелевые препараты (например, гелевые пластыри, которые приклеиваются к поверхности кожи). Согласно некоторым таким препаратам гелевая композиция включает любой полимер, который при контакте с поверхностью тела образует гель (например, гелевые препараты, содержащие гиалуроновую кислоту, полимеры плюроники, сополимеры молочной и гликолевой кислот (PLGA)). В некоторых видах композиций препарат содержит низкоплавкий воск, такой, но без ограничения, как смесь глицеридов жирных кислот, необязательно в комбинации с маслом какао, которое плавится первым. Необязательно, препараты содержат также увлажняющий агент.
[00165] Согласно некоторым вариантам в системах доставки фармацевтических соединений могут применяться, например, липосомы и эмульсии. Согласно некоторым вариантам композиции по настоящему изобретению могут также включать мукоадгезивный полимер, выбранный, например, из карбоксиметилцеллюлозы, карбомера (полимера акриловой кислоты), полиметилметакрилата, полиакриламида, поликарбофила, сополимера акриловой кислоты и бутилакрилата, альгината натрия и декстрана.
[00166] Согласно некоторым вариантам соединения по настоящему изобретению можно вводить местно и можно приготовить в виде различных композиций для местного применения, таких как растворы, суспензии, лосьоны, гели, пасты, (липкие) полоски с лекарствами, бальзамы, кремы или мази. Такие фармацевтические препараты могут включать солюбилизирующие вещества, стабилизаторы, агенты, повышающие тоничность, буферы и консерванты.
[00167] Согласно альтернативным вариантам соединение Формулы (I), (II), (III), (IV), (V) или (VI) готовят и предоставляют в виде жидкости для мытья или смывания, которую применяют для промывания (спринцевания) пораженной области. Согласно другим вариантам соединение Формулы (I), (II), (III), (IV), (V) или (VI) готовят и предоставляют в виде спрея, который наносится на пораженную область.
Раневые повязки
[00168] В одном аспекте соединение Формулы (I), (II), (III), (IV), (V) или (VI) предоставляют в виде компонента раневой повязки. Повязки представляет собой способ (средство) для нанесения на рану с целью стимулировать заживление и/или предупредить дальнейшее повреждение. Повязка рассчитана на то, чтобы быть в непосредственном контакте с раной. Согласно некоторым вариантам раневая повязка, содержащая ингибитор CSE по настоящему описанию, обеспечивает контролируемое высвобождение ингибитора CSE. Согласно другим вариантам раневая повязка, содержащая ингибитор CSE по настоящему описанию, обеспечивает пролонгируемое высвобождение ингибитора CSE. Согласно другим вариантам раневая повязка, содержащая ингибитор CSE по настоящему описанию, обеспечивает промежуточное высвобождение ингибитора CSE. Согласно другим вариантам раневая повязка, содержащая ингибитор CSE по настоящему описанию, обеспечивает мгновенное высвобождение ингибитора CSE. Согласно другим вариантам раневая повязка, содержащая ингибитор CSE по настоящему описанию, обеспечивает сочетание пролонгированного, промежуточного и мгновенного высвобождения ингибитора CSE.
[00169] Необязательно, раневая повязка, содержащая ингибитор CSE, содержит частицы ингибитора CSE, предназначенные для контролируемого высвобождения (например, микронизированные частицы, наноразмерные частицы или их смесь, безразмерные частицы, частицы с покрытием для контролируемого и/или пролонгированного высвобождения). Согласно некоторым вариантам раневая повязка представляет собой гелевый пластырь, который приклеивается к поверхности кожи в месте раны или кожного повреждения или заболевания. Согласно некоторым вариантам гелевый пластырь содержит любой подходящий гелеобразующий полимер (например, гиалуронан, полимеры ряда карбомеров, плюроников, PLGA и т.п.). Согласно некоторым вариантам раневая повязка представляет собой материал покрытия, закрепленный с помощью липкой ленты (липучки) (например, бинт или лента с лекарством). Согласно некоторым вариантам раневая повязка представляет собой жидкость, которая образует гель при контакте с поверхностью кожи, и наносится напылением или намазыванием.
[00170] Согласно некоторым другим вариантам ингибитор CSE вводят местно или системно в сочетании с раневой повязкой. Согласно некоторым из таких вариантов раневая повязка не является лекарственной (т.е. не содержит ингибитор CSE). Согласно некоторым другим вариантам раневая повязка содержит ингибиторы CSE, описанные выше.
[00171] Согласно другим вариантам ингибитор CSE вводят местно или системно в сочетании с раневой повязкой и жгутом (бинтом, бандажом).
Некоторые композиции для системного применения
[00172] В одном аспекте соединение Формулы (I), (II), (III), (IV), (V) или (VI) готовят в виде фармацевтической композиции, применимой для внутримышечной, подкожной или внутривенной инъекции. В одном аспекте препараты, применимые для внутримышечной, подкожной или внутривенной инъекции, включают физиологически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии и стерильные порошки для восстановления в стерильные растворы или дисперсии для инъекций. Примеры применимых водных и неводных носителей, разбавителей, растворителей или наполнителей включают вводу, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин, кремофор и т.п.), соответствующие их смеси, растительные масла (такие как оливковое масло) и сложные эфиры органических кислот, пригодные для инъекций, такие как этилолеат. Соответствующую текучесть можно поддерживать, например, вводя эмульгатор, такой как лецитин, сохраняя требуемый размер частиц в случае дисперсий, и применяя поверхностно-активные вещества. Согласно некоторым вариантам препараты для подкожных инъекций также содержат добавки, такие как консерванты, смачивающие агенты, эмульгаторы и диспергирующие вещества. Рост микроорганизмов можно предотвратить с помощью различных антибактериальных и противогрибковых веществ, таких как парабены, хлорбутанол, фенол, сорбиновая кислота и т.п. В некоторых случаях желательно включать изотонические агенты, такие как сахара, хлорид натрия и т.п. Пролонгированное всасывание инъецируемой фармацевтической формы можно осуществлять, применяя агенты, замедляющие всасывание, такие как моностеарат алюминия и желатин.
[00173] Для внутривенных инъекций или капельных внутривенных вливаний (капельных клизм) или инфузий соединения по настоящему изобретению готовят в виде водных растворов, предпочтительно, в физиологически совместимых буферных растворах, таких как раствор Хэнка, раствор Рингера или физиологический солевой (буферный) раствор. Для чресслизистого введения в препарате применяют смачивающие вещества (пенетранты), подходящие для барьера, через который требуется проникнуть. Такие смачивающие вещества обычно известны в уровне техники. Для других парентеральных инъекций подходящие препараты включают водные или неводные растворы, предпочтительно, содержащие физиологически совместимые буферы или эксципиенты. Такие эксципиенты известны.
[00174] Парентеральные инъекции могут включать болюсную инъекцию или непрерывную инфузию. Препараты для инъекций могут быть в виде стандартной (единичной) лекарственной формы, например, в ампулах или в многодозовых контейнерах, с добавлением консерванта. Фармацевтическая композиция по настоящему изобретению может быть в форме, применимой для парентеральной инъекции, в виде стерильных суспензий, растворов или эмульсий в масляных или водных носителях, и может содержать вспомогательные вещества, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. В одном аспекте активный ингредиент находится в виде порошка для восстановления перед употреблением в подходящем носителе, например, в стерильной апирогенной воде.
[00175] Для введения с помощью ингаляции соединение Формулы (I), (II), (III), (IV), (V) или (VI) готовят в виде аэрозоля или порошка. Фармацевтические композиции по настоящему изобретению удобно доставлять в виде спрей-аэрозоля в герметизированных упаковках под давлением или в ингаляторе с соответствующим газом-вытеснителем, например, дихлордифторметаном, трихлорфторметаном, дихлортетрафторэтаном, диоксидом углерода или другим подходящим газом. В случае аэрозоля в герметичной упаковке единицу дозирования (разовую дозу) можно обеспечить, снабдив устройство клапаном для доставки дозированного количества. Для применения в пульверизаторе или инсуфляторе можно приготовить, например, из желатина, капсулы и картриджи (патроны), содержащие порошковую смесь соединения по настоящему изобретению и основы для порошка, например, лактозы или крахмала.
[00176] Типичные интраназальные препараты описаны, например, в патентах США №№4,476,116, 5,116,817 и 6,391,452. Препараты, которые включают соединение Формулы (I), готовят в виде раствора в физиологическом растворе с применением бензилового спирта или других подходящих консервантов, фторуглеродов и/или других солюбилизирующих или диспергирующих агентов, известных в уровне техники. См., например, Ansel, Н.С. et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, Sixth Ed. (1995). Предпочтительно, эти композиции и препараты готовят с применением соответствующих нетоксических фармацевтически приемлемых ингредиентов. Эти ингредиенты известны специалистам в области приготовления назальных лекарственных форм, и некоторые из них можно найти в справочнике REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY, 21st edition, 2005. Выбор подходящих носителей зависит от конкретного вида требуемой назальной лекарственной формы, например, раствора, суспензии, мази или геля. Назальные лекарственные формы помимо активного ингредиента обычно содержат большие количества воды. Необязательно присутствуют минорные количества других ингредиентов, таких как агенты, корректирующие pH, эмульгаторы или диспергирующие агенты, консерванты, поверхностно-активные вещества, гелеобразующие агенты или буферизующие и другие стабилизирующие и солюбилизирующие агенты. Предпочтительно, назальная лекарственная форма должна быть изотонической назальным выделениям.
[00177] Фармацевтические препараты для перорального применения готовят смешением одного или более твердых эксципиентов с одним или более соединений по настоящему изобретению, необязательно измельчением полученной смеси и обработкой смеси гранул, после добавления, при необходимости, соответствующих вспомогательных веществ, с получением таблеток или ядер драже. Соответствующие эксципиенты включают, например, наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, например, такие как кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, камедь трагаканта, метилцеллюлоза, микрокристаллическая целлюлоза, гидроксипропилметилцеллюлоза,
карбоксиметилцеллюлоза натрия; или другие, такие как поливинилпирролидон (PVP или повидон) или фосфат кальция. При необходимости добавляют дезинтегрирующие вещества (разрыхлители), такие как сшитая кроскармеллоза натрия, поливинилпирролидон, агар-агар или альгиновая кислота или ее соль, такая как натрия альгинат. Согласно некоторым вариантам добавляют красители или пигменты для покрытий таблеток и драже с целью идентификации или характеристики различных комбинаций доз активных соединений.
[00178] Согласно некоторым вариантам фармацевтические композиции соединения Формулы (I), (II), (III), (IV), (V) или (VI) имеют форму капсул, включая твердые желатиновые капсулы, а также мягкие капсулы, приготовленные из желатина и пластификатора, такого как глицерин или сорбит. Твердые капсулы содержат активные ингредиенты в смеси с наполнителем, таким как лактоза, связующими веществами, такими как крахмалы, и/или смазывающими веществами (глидантами), такими как тальк или стеарат магния, и, необязательно, стабилизаторами. В мягких капсулах активные соединения растворены или суспендированы в соответствующих растворителях, таких как нелетучие жидкие (жирные) масла, вазелиновое масло или жидкие полиэтиленгликоли. Согласно некоторым вариантам добавляют стабилизаторы. Капсулу можно приготовить, например, насыпая сухую массу препарата вышеописанного соединения в капсулу. Согласно некоторым вариантам препараты (неводные суспензии и растворы) помещают в мягкую желатиновую капсулу. Согласно другим вариантам препараты помещают в обычные (стандартные) желатиновые капсулы или не желатиновые капсулы, такие как капсулы, содержащие НРМС (гипромеллозу). Согласно другим вариантам препарат помещают в капсулу с покрытыми частицами, причем капсулу проглатывают целиком или ее открывают перед приемом пищи и содержимое высыпают на еду.
[00179] Все препараты для перорального введения приготовлены в дозах, пригодных для такого применения.
[00180] В одном аспекте твердые пероральные лекарственные формы готовят смешением соединения Формулы (I), (II), (III), (IV), (V) или (VI) с одним или более нижеприведенных ингредиентов: антиоксидантов, вкусовых ароматизаторов, носителей, таких как связующие вещества, суспендирующие агенты, диспергирующие агенты (разрыхлители), наполнители, поверхностно-активные вещества, солюбилизаторы, стабилизаторы, глиданты (смазывающие вещества), смачивающие вещества и разбавители.
[00181] Согласно некоторым вариантам твердые лекарственные формы по настоящему изобретению приготовлены в виде таблетки (включая суспендируемую таблетку, легкоплавкую таблетку, жевательную таблетку (распадающуюся при жевании), быстро распадающуюся таблетку, шипучую таблетку или каплету), пилюли, порошка, капсулы, твердой дисперсии, твердого раствора, биоразрушаемой (биоразлагаемой) лекарственной формы, препаратов с контролируемым высвобождением, лекарственных форм с пульсирующим высвобождением, лекарственных форм, состоящих из множества частиц, таблеток, полученных из микрогранул, гранул. Согласно другим вариантам фармацевтический препарат приготовлен в виде порошка.
[00182] Прессованные таблетки представляют собой твердые лекарственные формы, получаемые прессованием сухой массы смеси препаратов, описанных выше. Согласно различным вариантам таблетки включают один или более вкусовых ароматизаторов.
[00183] Согласно другим вариантам таблетки имеют пленку, покрывающую готовую прессованную таблетку. Согласно некоторым вариантам пленочное покрытие может обеспечить отсроченное высвобождение соединения Формулы (I), (II), (III), (IV), (V) или (VI) из препарата. Согласно другим вариантам пленочное покрытие способствует приверженности пациента лечению (например пленочное покрытие Opadry® или сахарная оболочка). Пленочное покрытие Opadry® обычно составляет примерно от 1% вес. примерно до 3% вес. от веса таблетки.
[00184] Согласно некоторым вариантам твердые лекарственные формы, например, таблетки, шипучие таблетки и капсулы, готовят смешением частиц соединения с одним или более фармацевтических эксципиентов с образованием композиции в виде сухого порошка. Сухую смесь легко разделить на стандартные разовые лекарственные формы с одинаковой эффективностью, такие как таблетки, пилюли и капсулы. Согласно некоторым вариантам единичные лекарственные формы имеют пленочное покрытие. Эти препараты готовят обычными методами приготовления лекарственных препаратов.
[00185] В другом аспекте лекарственные формы включают микроинкапсулированные препараты. Согласно некоторым вариантам в материале для инкапсулирования присутствуют один или более совместимых материалов. Типичные материалы включают, но без ограничения, модификаторы pH, вещества, содействующие эрозии, противовспенивающие агенты, антиоксиданты, вкусовые ароматизаторы и носители, такие как связующие вещества, суспендирующие агенты, разрыхлители (агенты, способствующие дезинтеграции), наполнители, поверхностно-активные вещества, солюбилизаторы, стабилизаторы, скользящие вещества, смачивающие вещества и разбавители.
[00186] Типичные материалы для инкапсулирования включают, но без ограничения, простые эфиры гидроксипропилцеллюлозы (НРС), такие как клуцел (Klucel®) или Nisso НРС, простые эфиры гидроксипропилцеллюлозы с низкой степенью замещения (L-HPC), простые эфиры гидроксипропилметилцеллюлозы (НРМС), такие как сепифилм (Seppifilm-LC), фармакоат (Pharmacoat®), метолоза (Metolose SR), метоцел (Methocel®-E), Opadry YS, PrimaFlo, Benecel MP824 и Benecel MP843, полимеры метилцеллюлозы, такие как Methocel®-A, ацетат стеарат гидроксипропилметилцеллюлозы Aqoat (HF-LS, HF-LG, HF-MS) и метолозу (Metolose®), этилцеллюлозы (ЕС) и их смеси Е461, этоцел (Ethocel®), Aqualon®- ЕС, Surelease®, поливиниловый спирт (PVA), такой как Opadry АМВ, гидроксиэтилцеллюлозы, например, Natrosol®, карбоксиметилцеллюлозы и соли карбоксиметилцеллюлоз (CMC), например, Aqualon®-CMC, сополимеры поливинилового спирта и полиэтиленгликоля, например, Kollicoat IR®, моноглицериды (миверол, Myverol), триглицериды (KLX), полиэтиленгликолы, модифицированный пищевой крахмал, акриловые полимеры и смеси акриловых полимеров с простыми эфирами целлюлозы, такие как Eudragit® ЕРО, Eudragit® L30D-55, Eudragit® FS 30D Eudragit® L100-55, Eudragit® L100, Eudragit® S100, Eudragit® RD100, Eudragit® E100, Eudragit® L12.5, Eudragit® S12.5, Eudragit® NE30D и Eudragit® NE 40D, ацетат фталат целлюлозы, сепифилмы, такие как смеси НРМС и стеариновой кислоты, циклодекстрины, и смеси этих материалов.
[00187] Жидкие лекарственные формы препаратов для перорального применения, необязательно, представляют собой водные суспензии, выбранные из группы, включающей, но без ограничения, фармацевтически приемлемые пероральные водные дисперсии, эмульсии, растворы, эликсиры, гели и сиропы. См., например, Singh et al., Encyclopedia of Pharmaceutical Technology, 2nd Ed., pp. 754-757 (2002). Помимо ингибитора CSE жидкие лекарственные формы, необязательно, включают добавки, такие как: (а) дезинтегрирующие агенты (разрыхлители); (б) диспергирующие агенты; (в) смачивающие агенты; (г) по меньшей мере один консервант, (д) агенты, повышающие вязкость (загустители), (е) по меньшей мере один подсластитель и (ж) по меньшей мере один вкусовой ароматизатор. Согласно некоторым вариантам водные дисперсии включают также ингибитор кристаллизации.
[00188] Согласно некоторым вариантам фармацевтические препараты по настоящему изобретению представляют собой самоэмульгирующиеся системы доставки лекарственных веществ (SEDDS). Эмульсии представляют собой дисперсии одной несмешивающейся фазы в другой (дисперсии двух несмешивающихся фаз), обычно в форме капелек. Как правило, эмульсии образуются при энергичном механическом диспергировании. SEDDS, в отличие от эмульсий или микроэмульсий, спонтанно (самопроизвольно) образуют эмульсии при добавлении к избытку воды без внешнего механического диспергирования или встряхивания. Преимущество SEDDS заключается в том, что для распределения капелек в растворе требуется лишь осторожное перемешивание. Кроме того, воду или водную фазу, необязательно, добавляют непосредственно перед добавлением (SEDDS), что гарантирует стабильность неустойчивого или гидрофобного активного ингредиента. Следовательно, SEDDS предоставляет эффективную систему для пероральной и парентеральной доставки гидрофобных активных ингредиентов. Согласно некоторым вариантам SEDDS обеспечивает повышение биодоступности гидрофобных активных ингредиентов. Способы получения самоэмульгирующихся лекарственных форм описаны, например, но без ограничения, в патентах США №№5,858,401, 6,667,048 и 6,960,563.
[00189] Трансбуккальные лекарственные формы, которые включают соединение Формулы (I), (II), (III), (IV), (V) или (VI), вводят в виде различных препаратов, известных в уровне техники. Например, такие препараты включают, но без ограничения, препараты, представленные в патентах США №№4,229,447, 4,596,795, 4,755,386 и 5,739,136. Помимо этого трансбуккальные лекарственные формы по настоящему изобретению могут также включать биоразрушаемый (гидролизуемый) полимерный носитель, который также служит для адгезии лекарственной формы к слизистой оболочке щеки. Для трансбуккального или подъязычного (сублингвального) применения композиции могут быть в виде таблеток, лепешек или гелей, приготовленных обычным традиционным способом.
[00190] Для внутривенных инъекций ингибитор CSE, необязательно, готовят в виде водных растворов, предпочтительно, в физиологически совместимых буферных растворах, таких как раствор Хэнка, раствор Рингера или физиологический солевой буферный раствор. Для чресслизистого введения в препарате применяют смачивающие вещества (пенетранты), подходящие для барьера, через который требуется проникнуть. Препараты, применяемые для других парентеральных инъекций, включают водные или неводные растворы, предпочтительно, с физиологически совместимыми буферами или эксципиентами.
[00191] Парентеральные инъекции, необязательно, включают болюсную инъекцию или непрерывную инфузию. Препараты для инъекции, необязательно, представлены в единичной (стандартной) лекарственной форме), например, в ампулах или в многодозовых контейнерах с добавлением консервантов. Согласно некоторым вариантам фармацевтическая композиция по настоящему изобретению находится в форме, пригодной для парентеральной инъекции, в виде стерильных суспензий, растворов или эмульсий в масляных или водных носителях, и содержат вспомогательные вещества, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Фармацевтические препараты для парентерального введения включают водные растворы агента, который модулирует активность каротидной железы в водорастворимом виде. Также, необязательно, готовят суспензии агента, который модулирует активность каротидной железы, например, масляные суспензии для инъекций.
[00192] Обычные способы приготовления препаратов включают, например, один метод или комбинацию методов: (1) сухое смешение, (2) прямое прессование, (3) размол (измельчение), (4) сухую или неводную грануляцию, (5) влажную грануляцию или (6) сплавление. Другие методы включают, например, распылительную сушку, дражирование, грануляцию из расплава, грануляцию, напыление в псевдоожиженном слое (например, распыление по методу Вюрстера), тангенциальное (по касательной) нанесение покрытия, распыление сверху, таблетирование, экструзионное прессование и т.п.
[00193] Носители, подходящие для использования в твердых лекарственных формах, описанных в данной заявке, включают, но без ограничения, смолу акации, желатин, коллоидный диоксид кремния, глицерофосфат кальция, лактат кальция, мальтодекстрин, глицерин, силикат магния, казеинат натрия, соевый лецитин, хлористый натрий, трикальцийфосфат, дикальцийфосфат, стеароиллактилат натрия, каррагинан, моноглицерид, диглицерид, прежелатинизированный крахмал, гидроксипропилметилцеллюлозу, ацетат-стеарат гидроксипропилметилцеллюлозы, сахарозу, микрокристаллическую целлюлозу, лактозу, маннит и т.п.
[00194] Наполнители, подходящие для использования в твердых лекарственных формах, описанных в данной заявке, включают, но без ограничения, лактозу, карбонат кальция, фосфат кальция, двухосновный фосфат кальция, сульфат кальция, микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстрозу, декстраты, декстран, крахмалы, прежелатинизированный крахмал, гидроксипропилметилцеллюлозу (НРМС), фталат гидроксипропилметилцеллюлозы, ацетат-стеарат гидроксипропилметилцеллюлозы (HPMCAS), сахарозу, ксилит, лактитол, маннит, сорбит, хлористый натрий, полиэтиленгликоль и т.п.
[00195] Разрыхлители, подходящие для использования в твердых лекарственных формах, описанных в данной заявке, включают, но без ограничения, природный крахмал, такой как кукурузный крахмал или картофельный крахмал, прежелатинизированный крахмал или карбоксиметилкрахмала натриевую соль, целлюлозу, такую как микрокристаллическая целлюлоза, метилцеллюлоза, кроскармеллоза, или сшитую целлюлозу, такую как сшитая натриевая соль карбоксиметилцеллюлозы, сшитая карбоксиметилцеллюлоза, сшитая кроскармеллоза, сшитый крахмал, такой как сшитая натриевая соль карбоксиметилкрахмала, сшитый полимер, такой как кросповидон, сшитый поливинилпирролидон, альгинат, такой как альгиновая кислота или соль альгиновой кислоты, в том числе, альгинат натрия, смолу, такую как агар-агар, гуаровая смола, смола плодов рожкового дерева, смола карайя, пектин или трагакант, натриевую соль карбоксиметилкрахмала, бентонит, лаурилсульфат натрия, лаурилсульфат натрия в комбинации с крахмалом и т.п.
[00196] Связующие придают связывающую способность твердой лекарственной форме, в случае наполненной порошком капсулы они способствуют образованию вставки, которая заполняет мягкую или твердую оболочку капсулы, и в случае таблеток они обеспечивают целостность таблетки после прессования и способствуют сохранению однородности композиции до прессования или заполнения капсул. Вещества, подходящие для использования в качестве связующих в твердых лекарственных формах, описанных в данной заявке, включают, но без ограничения, карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, ацетат-стеаратгидроксипропилметилцеллюлозы, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, этилцеллюлозу и микрокристаллическую целлюлозу, микрокристаллическую декстрозу, амилозу, алюмосиликат магния, полисахаридные кислоты (должно быть, кислые полисахариды), бентониты, желатин, сополимер винилпирролидона с винилацетатом, кросповидон, повидон, крахмал, прежелатинизированный крахмал, смолу трагаканта, декстрин, сахар, такой как сахароза, глюкоза, декстроза, меласса, маннит, сорбит, ксилит, лактоза, природную или синтетическую смолу, такую как смола акации, смола трагаканта, смола гхатти, гуммиарабик; крахмал, поливинилпирролидон, арабогалактон из древесины лиственницы, полиэтиленгликоль, воски, альгинат натрия и т.п.
[00197] В капсулах, заполненных порошком, содержание связующего составляет 20-70%. Содержание связующих в составе таблеток меняется в зависимости от того, как получали таблетки - прямым прессованием, влажной грануляцией, вальцеванием, а также от того, применяются при получении таблеток другие эксципиенты, такие как наполнители, которые сами по себе могут действовать как связующие, или не применяются. Обычно в составе таблеток содержание связующих составляет до 70%.
[00198] Смазывающие вещества или глиданты, подходящие для использования в твердых лекарственных формах, описанных в данной заявке, включают, но без ограничения, стеариновую кислоту, гидроксид кальция, тальк, кукурузный крахмал, стеарилфумарат натрия, соли щелочных и щелочноземельных металлов, таких как алюминий, кальций, магний, цинк, стеараты натрия, стеарат магния, стеарат цинка, воски, Stearowet®, борную кислоту, бензоат натрия, ацетат натрия, хлористый натрий, лейцин, полиэтиленгликоль или метоксиполиэтиленгликоль, такой как Carbowax™, PEG 4000, PEG 5000, PEG 6000, пропиленгликоль, олеат натрия, глицерилбегенат, глицерилпальмитостеарат, глицерилбензоат, лаурилсульфат магния или натрия и т.п.
[00199] Разбавители, подходящие для использования в твердых лекарственных формах, описанных в данной заявке, включают, но без ограничения, сахара (в том числе, лактозу, сахарозу и декстрозу), полисахариды (включая декстраты и мальтодекстрин), полиолы (включая маннит, ксилит и сорбит), циклодекстрины и т.п.
[00200] Смачивающие агенты, подходящие для использования в твердых лекарственных формах, описанных в данной заявке, включают, например, олеиновую кислоту, глицерилмоностеарат, сорбитана моноолеат, сорбитана монолаурат, триэтаноламина олеат, полиоксиэтиленсорбитана моноолеат, полиоксиэтиленсорбитана монолаурат, четвертичные аммониевые соединения (например, Polyquat 10®), олеат натрия, лаурилсульфат натрия, стеарат магния, докузат натрия, триацетин, токоферилполиэтиленгликоля сукцинат и т.п.
[00201] Поверхностно-активные вещества, подходящие для использования в твердых лекарственных формах, описанных в данной заявке, включают, например, лаурилсульфат натрия, сорбитана моноолеат, полиоксиэтиленсорбитана моноолеат, полисорбаты, полоксамеры, соли желчных кислот, глицерилмоностеарат, сополимеры этиленоксида и пропиленоксида, например, Pluronic® (BASF) и т.п.
[00202] Суспендирующие агенты, подходящие для использования в твердых лекарственных формах, описанных в данной заявке, включают, но без ограничения, поливинилпирролидон, например, поливинилпирролидон К12, поливинилпирролидон К17, поливинилпирролидон К25 или поливинилпирролидон К30, полиэтиленгликоль, например, полиэтиленгликоль может иметь молекулярный вес от примерно 300 до примерно 6000 или от примерно 3350 до примерно 4000, или от примерно 7000 до примерно 5400, сополимер винилпирролидона с винилацетатом (S630), натриевую соль карбоксиметилцеллюлозы, метилцеллюлозу, гидроксипропилметилцеллюлозу, полисорбат-80, гидроксиэтилцеллюлозу, альгинат натрия, смолы, такие как, например, смола трагаканта, смола акации, гуаровая смола, ксантаны, включая ксантановую смолу, сахара, целлюлозы, такие как, например, натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, полисорбат-80, альгинат натрия, полиоксиэтилированный сорбитана монолаурат, повидон и т.п.
[00203] Антиоксиданты, подходящие для использования в твердых лекарственных формах, описанных в данной заявке, включают, например, бутилированный гидрокситолуол (ВНТ), натриевую соль аскорбиновой кислоты и токоферол.
[00204] Следует отметить, что функции добавок, которые используются в составе твердых лекарственных форм, описанных в данной заявке, в значительной степени перекрываются. Таким образом, указанные выше добавки следует рассматривать только как примеры, и при этом неограничительные примеры, добавок, которые могут быть включены в состав твердых лекарственных форм, описанных в данной заявке. Количество таких добавок может быть легко определено средним специалистом в данной области в соответствии с конкретными желательными свойствами.
[00205] В соответствии с различными вариантами настоящего изобретения частицы соединения Формулы (I), (II), (III), (IV), (V) или (VI) и один или более эксципиентов смешивают в сухом виде и прессуют с получением массы в виде таблетки, имеющей твердость, которая является достаточной для получения фармацевтической композиции, таблетка по существу распадается в течение промежутка времени менее 30 мин, менее 35 мин, менее 40 мин, менее 45 мин, менее 50 мин, менее 55 мин или менее 60 мин после перорального введения, при этом в желудочно-кишечной жидкости происходит высвобождение состава.
[00206] В соответствии с другими вариантами порошок, содержащий соединения Формулы (I), (II), (III), (IV), (V) или (VI), включает один или более фармацевтических эксципиентов и вкусовых веществ. Такой порошок получают, например, путем смешения соединения по изобретению и необязательных фармацевтических эксципиентов с получением объемной композиции. Другие варианты изобретения предусматривают также включение суспендирующего агента и/или смачивающего агента. Эта объемная смесь равномерно делится на стандартные (унифицированные) дозы, помещаемые в упаковку, или на совокупность доз, также помещаемых в упаковку.
[00207] Согласно другим вариантам изобретения изготавливают шипучие порошки. Для перорального введения применяют шипучие соли, диспергирующие лекарственный препарат в воде.
Композиции с контролируемым высвобождением
[00208] Согласно некоторым вариантам фармацевтические лекарственные формы получают таким образом, чтобы обеспечить контролируемое высвобождение соединения Формулы (I), (II), (III), (IV), (V) или (VI). Контролируемое высвобождение относится к высвобождению соединения из лекарственной формы, в которую оно введено, в соответствии с желательным профилем в течение длительного промежутка времени. Профили контролируемого высвобождения включают, например, профили медленного высвобождения, пролонгированного высвобождения, пульсирующего высвобождения и отсроченного высвобождения. В противоположность композициям с мгновенным высвобождением композиции с контролируемым высвобождением обеспечивают доставку агента субъекту в течение длительного промежутка времени в соответствии с заданным профилем. Такие скорости высвобождения могут обеспечить более длительный фармакологический ответ при сведении к минимуму побочных эффектов по сравнению с обычными лекарственными формами с быстрым высвобождением. Более длительный фармакологический ответ дает многие преимущества, которые не достигаются при использовании соответствующих препаратов короткого действия с мгновенным высвобождением.
[00209] Согласно некоторым вариантам твердые лекарственные формы, описанные в данной заявке, готовят в виде пероральных лекарственных форм с энтеропокрытиями, которые обеспечивают медленное высвобождение, то есть, в виде пероральной лекарственной формы фармацевтической композиции, например, описанной в данной заявке, в которой энтеропокрытие обеспечивает высвобождение в тонкой кишке или в толстой кишке. В соответствии с одним из аспектов лекарственная форма с энтеропокрытием представляет собой формованную или экструдированную таблетку/формованную гранулу (с покрытием или без покрытия), порошок, таблетки, полученные из микрогранул, шарики или частицы активного ингредиента и/или других компонентов композиции, которые сами содержат покрытие или не содержат такого покрытия. В соответствии с одним из аспектов лекарственная форма с энтеропокрытием представляет собой капсулу, содержащую таблетки из микрогранул, шарики или гранулы, которые включают соединение Формулы (I), (II), (III), (IV), (V) или (VI), и которые могут быть с покрытием или без него.
[00210] Можно использовать любое покрытие достаточной толщины, такое, которое не растворяется в желудочно-кишечных жидкостях при pH ниже примерно 5, но которое растворяется при pH выше примерно 5 или более. Такие покрытия обычно изготавливают из следующих веществ:
[00211] из шеллака, это покрытие растворяется в среде с величиной pH>7; из акриловых полимеров - примеры подходящих акриловых полимеров включают сополимеры метакриловой кислоты и сополимеры метакрилата аммония. Сополимеры группы Eudragit Е, L, S, RL, RS и NE (Rohm Pharma) доступны в виде сополимеров, солюбилизированных в органических растворителях, в виде водной дисперсии или сухих порошков. Сополимеры группы Eudragit RL, NE и RS не растворяются в желудочно-кишечном тракте, но являются проницаемыми и в основном используются для нацеливания на толстую кишку. Сополимеры Е из группы Eudragit растворяются в желудке. Сополимеры L, L-30D и S из группы Eudragit не растворяются в желудке и растворяются в кишечнике; из поливинилацетатфталата (PVAP) - PVAP растворяется при pH>5, он является в меньшей степени проницаемым для водяного пара и желудочных жидкостей.
[00212] Для нанесения покрытий используют обычные методы получения покрытий, такие как распыление или дражирование. Толщина покрытия должна быть достаточной для того, чтобы пероральная лекарственная форма оставалась целой до попадания в желательный участок при местной (топической) доставке в кишечник.
[00213] В соответствии с другими вариантами композиции, описанные в данной заявке, доставляются с применением лекарственных форм с пульсирующим высвобождением. Лекарственная форма с пульсирующим высвобождением способна обеспечить один или более запускающих импульсов немедленного высвобождения в заданные моменты времени после контролируемого латентного периода или в заданных участках. Примеры лекарственных форм с пульсирующим высвобождением и способы их получения описаны в патентах США №№5,011,692, 5,017,381, 5,229,135, 5,840,329 и 5,837,284. Согласно одному из вариантов лекарственная форма с пульсирующим высвобождением включает по меньшей мере две группы частиц (то есть, представляет собой множество отдельных частиц), каждая из которых содержит композицию, описанную в данной заявке. Первая группа частиц обеспечивает немедленное высвобождение дозы соединения Формулы (I) в организме млекопитающего после проглатывания. Частицы в первой группе могут или не содержать покрытия, или включать покрытие и/или герметизирующее вещество, частицы во второй группе содержат покрытие. Покрытие на частицах второй группы обеспечивает задержку высвобождения от примерно 2 ч до примерно 7 ч после проглатывания перед высвобождением второй дозы. Подходящие покрытия для фармацевтических композиций описаны в данной заявке или известны из уровня техники.
[00214] В соответствии с некоторыми вариантами предусмотрены фармацевтические композиции, которые включают частицы соединения Формулы (I), (II), (III), (IV), (V) или (VI) и по меньшей мере один диспергирующий агент или суспендирующий агент для перорального введения субъекту. Композиции могут быть в виде порошка и/или гранул для получения суспензии и после смешения композиции с водой получается практически однородная суспензия.
[00215] В соответствии с некоторыми вариантами изобретения частицы, обеспечивающие контролируемое высвобождение, вводятся в составе геля или пластыря, или раневой повязки.
[00216] В соответствии с одним из аспектов жидкие лекарственные формы для перорального введения и/или для топического введения в виде полоскания получают в виде водных суспензий, выбранных из группы, включающей, но без ограничения, фармацевтически приемлемые водные пероральные дисперсии, эмульсии, растворы, эликсиры, гели, а также сиропы. См., например, Singh et al., Encyclopedia of Pharmaceutical Technology, 2nd Ed., p.p. 754-757 (2002). В дополнение к частицам соединения Формулы (I), (II), (III), (IV), (V) или (VI) жидкие лекарственные формы включают добавки, такие как (а) разрыхляющие вещества; (б) диспергирующие агенты; (в) смачивающие агенты; (г) по меньшей мере один консервант; (д) агенты, повышающие вязкость; (е) по меньшей мере один подсластитель и (ж) по меньшей мере одно вкусовое вещество. В соответствии с некоторыми вариантами жидкие композиции могут также содержать кристаллический ингибитор.
[00217] В соответствии с некоторыми вариантами жидкие композиции могут также содержать инертные разбавители, обычно используемые в данной области, такие как вода или другие растворители, солюбилизирующие агенты и эмульгаторы. Примерами эмульгаторов являются этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, лаурилсульфат натрия, докузат натрия, холестерин, сложные эфиры холестерина, таурохолевая кислота, фосфатидилхолин, масла, такие как хлопковое масло, арахисовое масло, кукурузное масло, оливковое масло, касторовое масло и кунжутное масло, глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли, эфиры жирных кислот и сорбитана или смеси указанных веществ и т.п.
[00218] Кроме того, фармацевтические композиции могут включать один или более регуляторов величины pH или буферных агентов, включая кислоты, такие как уксусная, борная, лимонная, молочная, фосфорная и соляная кислоты; основания, такие как гидроксид натрия, фосфат натрия, борат натрия, цитрат натрия, ацетат натрия, лактат натрия и трис-гидроксиметиламинометан; и буферные вещества, такие как цитрат/декстроза, бикарбонат натрия и хлористый аммоний. Такие кислоты, основания и буферные вещества вводятся в количестве, обеспечивающем поддержание pH композиции в приемлемом интервале.
[00219] Кроме того, фармацевтические композиции могут включать одну или более солей в количестве, которое требуется для получения величины осмоляльности композиции в приемлемом интервале. Такие соли включают соединения, содержащие катионы натрия, калия или аммония и анионы хлорида, цитрата, аскорбата, бората, фосфата, бикарбоната, сульфата, тиосульфата или бисульфита; подходящими солями являются хлористый натрий, хлористый калий, тиосульфат натрия, бисульфит натрия и сульфат аммония.
[00220] Другие фармацевтические композиции могут включать один или более консервантов для ингибирования активности микробов. Подходящие консерванты включают ртутьсодержащие соединения, такие как мерфен и тиомерсал; стабилизированный диоксид хлора; а также соединения четвертичного аммония, такие как бензалкония хлорид, цетилтриметиламмония бромид и цетилпиридиния хлорид.
[00221] В соответствии с одним из вариантов данного изобретения водные суспензии и дисперсии, описанные в данной заявке, находятся в гомогенном состоянии, которое, как определено в USP Pharmacists' Pharmacopeia (Фармакопее США) (2005 edition, chapter 905), сохраняется по меньшей мере 4 ч. Согласно одному из вариантов водную суспензию вновь суспендируют для получения гомогенной суспензии путем физического перемешивания, которое продолжается менее 1 мин. В соответствии с другим вариантом для сохранения гомогенности водной дисперсии перемешивание не требуется.
[00222] Примеры разрыхляющих агентов, подходящих для применения в водных суспензиях и дисперсиях, включают, но без ограничения, например, крахмал, например, природный крахмал, такой как кукурузный крахмал или картофельный крахмал, прежелатинизированный крахмал или натриевую соль крахмалгликолята; целлюлозу, такую как микрокристаллическая целлюлоза, метилцеллюлоза, кроскармеллоза или сшитая целлюлоза, такая как сшитая натриевая соль карбоксиметилцеллюлозы, сшитая карбоксиметилцеллюлоза, сшитая кроскармеллоза; сшитый крахмал, такой как сшитая натриевая соль карбоксиметилкрахмала, сшитый полимер, такой как кросповидон или поливинилпирролидон, крахмал, альгинат, такой как альгиновая кислота или соль альгиновой кислоты, такая как альгинат натрия, смолу, такую как смола агар-агар, гуаровая смола, смола плодов рожкового дерева, смола карайя, пектин, смола трагаканта; натриевую соль крахмалгликолята; бентонит, натуральную губку, поверхностно-активное вещество, смолу, такую как катионообменная смола; цитрусовую пульпу; лаурилсульфат натрия, лаурилсульфат натрия в комбинации с крахмалом и т.п.
[00223] В соответствии с некоторыми вариантами диспергирующие агенты, подходящие для применения в водных суспензиях и дисперсиях, описанных в данной заявке, включают, но без ограничения, например, гидрофильные полимеры, электролиты, Tween® 60 или 80, PEG, поливинилпирролидон и диспергирующие агенты на основе углеводов, такие как, например, гидроксипропилцеллюлоза и простые эфиры гидроксипропилцеллюлозы, гидроксипропилметилцеллюлоза и простые эфиры гидроксипропилметилцеллюлозы, натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, гидроксиэтилцеллюлоза, фталат гидроксипропилметилцеллюлозы, ацетат-стеарат гидроксипропилметилцеллюлозы, некристаллическую целлюлозу; алюмосиликат магния, триэтаноламин, поливиниловый спирт (PVA), сополимер винилпирролидона с винилацетатом, сополимер 4-(1,1,3,3-тетраметилбутил)-фенола с оксидом этилена и формальдегидом (известный также как тилоксапол), полоксамеры; а также полоксамины. В соответствии с другими вариантами диспергирующий агент выбирают из группы, не содержащей один из следующих агентов: гидрофильные полимеры; электролиты; Tween® 60 или 80; PEG; поливинилпирролидон (PVP); гидроксипропилцеллюлоза и простые эфиры гидроксипропилцеллюлозы; гидроксипропилметилцеллюлоза и простые эфиры гидроксипропилметилцеллюлозы; натриевая соль карбоксиметилцеллюлозы; метилцеллюлоза; гидроксиэтилцеллюлоза; фталат гидроксипропилметилцеллюлозы; ацетатстеарат гидроксипропилметилцеллюлозы; некристаллическая целлюлоза; алюмосиликат магния; триэтаноламин; поливиниловый спирт (PVA); полимер 4-(1,1,3,3-тетраметилбутил)-фенола с оксидом этилена и формальдегидом; полоксамеры; а также полоксамины.
[00224] Смачивающие агенты, подходящие для применения в водных суспензиях и дисперсиях, описанных в данной заявке, включают, но без ограничения, например, цетиловый спирт, глицерилмоностеарат, эфиры полиоксиэтиленсорбитана и жирных кислот (например, коммерчески доступные Tweens®, такие как, например, Tween 20® и Tween 80®), и полиэтиленгликоли, олеиновую кислоту, глицерилмоностеарат, сорбитана моноолеат, сорбитана монолаурат, триэтаноламина олеат, полиоксиэтиленсорбитана моноолеат, полиоксиэтиленсорбитана монолаурат, олеат натрия, лаурилсульфат натрия, докузат натрия, триацетин, витамин Е, токоферилполиэтиленгликольсукцинат, таурохолат натрия, симетикон, фосфатидилхолин и т.п.
[00225] Консерванты, подходящие для применения в водных суспензиях и дисперсиях, описанных в данной заявке, включают, например, сорбат калия, парабены (например, метилпарабен и пропилпарабен), бензойную кислоту и ее соли, другие сложные эфиры пара-гидроксибензойной кислоты, такие как бутилпарабен, спирты, такие как этиловый спирт или бензиловый спирт, фенольные соединения, такие как фенол, или четвертичные соединения, такие как бензалконийхлорид. Консерванты, используемые в данной заявке, вводятся в лекарственную форму в количестве, достаточном для ингибирования роста микробов.
[00226] Агенты, повышающие вязкость, подходящие для применения в водных суспензиях и дисперсиях, описанных в данной заявке, включают, но без ограничения, метилцеллюлозу, ксантановую смолу, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, Plasdon® S-630, карбомер, поливиниловый спирт, альгинаты, смолу акации, хитозаны и их комбинации. Концентрация агента, повышающего вязкость, зависит от вида выбранного агента и желательной величины вязкости.
[00227] Примеры подсластителей, подходящих для применения в водных суспензиях и дисперсиях, описанных в данной заявке, включают, например, сироп смолы акации, ацесульфам K, алитам, аспартам, шоколад, корицу, цитрусовые, какао, цикламат, декстрозу, фруктозу, имбирь, глицирретинат, сироп солодки (лакрицы), глицирризинат аммония (MagnaSweet®), мальтол, маннит, ментол, неогесперидин DC, неотам, порошок Prosweet®, сахарин, сорбит, стевию, сукралозу, сахарозу, натриевую соль сахарина, сахарин, аспартам, ацесульфам калия, маннит, сукралозу, тагатозу, тауматин, ванилин, ксилит или любую их комбинацию.
Методы дозирования и схемы лечения
[00228] Способ лечения любых заболеваний и состояний, описанных в данной заявке, у субъекта, нуждающегося в этом, включает введение указанному субъекту фармацевтических композиций, которые содержат в терапевтически эффективных количествах по меньшей мере одно соединение Формулы (I), (II), (III), (IV), (V) или (VI) или его фармацевтически приемлемую соль, фармацевтически приемлемое пролекарство или фармацевтически приемлемый сольват. Согласно другому варианту изобретения соединения Формулы (I), (II), (III), (IV), (V) или (VI) применяют при приготовлении лекарственных веществ для лечения острого повреждения почек (AKI), вызванного токсическим агентом (например, цисплатином, аминогликозидами и радиологическим контрастным вещество), ноцицептивной боли, включая острую боль после операции, нейропатической боли (например, тригеминальной невралгии, диабетической периферической нейропатии и герпетической невралгии), воспалительной боли, смешанной нейропатической боли и состояний при воспалительной боли, ревматоидного артрита, воспаления кишечника, синдрома раздраженного кишечника, остеоартрита, острого панкреатита, хронического панкреатита, боли, связанной с острым панкреатитом, боли, связанной с хроническим панкреатитом, мигрени, подагры, анкилозирующего спондилоартрита, системной эриматозной волчанки (SLE), синдрома системного воспалительного ответа (SIRS), синдрома дисфункции многих органов (MODS), астмы, хронической обструктивной болезни легких (COPD, ХОБЛ), чувствительной кожи (например, акне, розацеа, жжения, покалывания и контактного дерматита) или боли, связанной с раковым заболеванием (например, раком поджелудочной железы, раком легкого, раком простаты и раком молочной железы) или состояний, которые описаны в данной заявке.
[00229] В соответствии с некоторыми вариантами композиции, содержащие соединение (-ия), описанное (-ые) в данной заявке, вводятся для профилактического и/или терапевтического лечения. В случае некоторых терапевтических применений композиции вводят пациенту, уже страдающему от описанной выше болезни или состояния, в количестве, достаточном для лечения или по меньшей мере частичной остановки развития по меньшей мере одного из симптомов болезни или состояния. Количества, эффективные для этой цели, зависят от степени серьезности и течения заболевания или состояния, предыдущей терапии, статуса здоровья пациента, его веса и ответа на лекарства и мнения лечащего врача. Терапевтически эффективные количества можно определить методами, включающими, но без ограничения, клиническое лечение с увеличением дозы.
[00230] В случае профилактического применения композиции, содержащие соединения, описанные в данной заявке, вводятся пациенту, восприимчивому к конкретному заболеванию, расстройству или состоянию, или рискующему заболеть этими заболеваниями, расстройствами или состояниями. Количество композиции называется в этом случае "профилактически эффективным количеством или профилактически эффективной дозой". В таком случае точные количества также зависят от состояния здоровья пациента, его веса и т.п. При использовании для пациента эффективные количества будут зависеть от степени серьезности и течения заболевания или состояния, предыдущей терапии, состояния здоровья пациента, его веса и ответа на лекарства и мнения лечащего врача. Согласно одному из аспектов изобретения профилактическое лечение включает введение млекопитающему, который ранее имел по меньшей мере один симптом заболевания, которое подвергается лечению и находится в стадии ремиссии, фармацевтической композиции, содержащей соединение Формулы (I), (II), (III), (IV), (V) или (VI), для предотвращения возврата симптомов заболевания или состояния.
[00231] В соответствии с некоторыми вариантами, когда состояние пациента не улучшается, по указанию врача введение соединения Формулы (I), (II), (III), (IV), (V) или (VI) осуществляется постоянно, то есть в течение продолжительного времени, включая продолжительность жизни пациента, для ослабления или другого регулирования или ограничения симптомов заболевания или состояния пациента.
[00232] В соответствии с некоторыми вариантами, когда состояние здоровья пациента улучшается, доза вводимого лекарства может быть временно снижена или может не вводиться временно в течение некоторого промежутка времени (то есть, наступают "лекарственные каникулы"). Согласно конкретным вариантам продолжительность лекарственных каникул составляет от 2 дней до 1 года, включая, только например, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 10 дней, 12 дней, 15 дней, 20 дней, 28 дней или более 28 дней. Во время лекарственных каникул доза уменьшается, например, на 10-100%, включая, только например, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% и 100%.
[00233] В соответствии с некоторыми вариантами доза вводимого лекарства может быть временно уменьшена или может временно не вводиться в течение некоторого промежутка времени (то есть, происходит "отклонение от режима приема лекарства"). Согласно конкретным вариантам продолжительность такого отклонения составляет от 2 дней до 1 года, включая, только например, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 10 дней, 12 дней, 15 дней, 20 дней, 28 дней или более 28 дней. Во время такого отклонения от режима приема доза уменьшается, например, на 10-100%, включая, только например, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% и 100%. После желательного перерыва можно возобновить обычный режим введения лекарства.
[00234] В соответствии с некоторыми вариантами данного изобретения, как только происходит улучшение состояния пациента, величина дозы сохраняется, если это необходимо. Затем согласно некоторым вариантам дозировка или частота введения или и то, и другое, уменьшаются в зависимости от симптомов до уровня, при котором сохраняются ослабленные заболевание, расстройство или состояние. Однако согласно некоторым вариантам пациенту требуется интермиттирующая терапия на основе длительного лечения после повторного появления симптомов.
[00235] Количество данного агента, которое соответствует такому количеству, меняется в зависимости от таких факторов как вид конкретного соединения, состояние заболевания и степень его серьезности, характеристика субъекта (его вес, пол) или хозяина, нуждающегося в лечении, но, тем не менее, может быть определено в соответствии с конкретными обстоятельствами в данном случае, включающими, например, вид конкретного применяемого агента, способ его введения, и вид субъекта или хозяина, который подвергается лечению. Однако, в общем, величины доз, применяемых для лечения взрослого человека, обычно находятся в пределах от 0.01 мг до 5000 мг в день. Согласно одному из аспектов величины доз, применяемых для лечения взрослого человека, находятся в пределах от 1 мг до 1000 мг в день. Согласно одному из вариантов желательная доза обычно вводится в виде однократной дозы или в виде разделенных доз, вводимых одновременно (или в течение короткого промежутка времени) или с соответствующими интервалами, например, в виде двух, трех, четырех или более частей дозы в день.
[00236] Согласно некоторым вариантам, когда пациента начали лечить с применением ингибитора CSE, этому пациенту постепенно снижают дозу (например, постадийно уменьшают дозу) с использованием второй схемы лечения (например, при помощи метилксантина)
[00237] Согласно одному из вариантов настоящего изобретения величина дневных доз соединения Формулы (I), (II), (III), (IV), (V) или (VI), описанных в данной заявке, составляет от примерно 0.01 до примерно 10 мг/кг веса субъекта. В соответствии с конкретными вариантами величина дневной дозы для большого млекопитающего, включая, но без ограничения, людей, находится в пределах от примерно 0.5 мг до примерно 1000 мг, обычно применяются дробные дозы, включая, но без ограничения, прием до четырех раз в день. Согласно одному из вариантов дневная доза вводится в виде лекарственной формы с пролонгированным высвобождением. Согласно некоторым вариантам единичные дозы (унифицированные), подходящие для перорального введения, содержат от примерно 1 до примерно 500 мг активного ингредиента. Согласно другим вариантам величины дневных и единичных доз меньше или больше указанных выше величин в зависимости от ряда переменных факторов при определенном для каждого субъекта режиме лечения. Согласно различным вариантам величины дневных и единичных доз меняются в зависимости от ряда переменных, включая, но без ограничения, активность используемого соединения, вид заболевания или состояния, подвергающегося лечению, способа введения, требований к отдельному субъекту, степень серьезности заболевания или состояния, подвергающегося лечению, а также суждений практикующего врача.
[00238] Токсичность и терапевтическая эффективность таких терапевтических средств определяются стандартными фармацевтическими методами в клеточных культурах или на экспериментальных животных, включая, но без ограничения, определение LD50 и ED50. Отношение доз при определении токсического и терапевтического действия представляет собой терапевтический индекс, который выражается как отношение LD50 к ED50. Согласно некоторым вариантам данные, полученные при проведении анализа клеточных культур и исследований на животных, используются для определения интервала величин дневных доз и/или величины терапевтически эффективной единичной дозы для млекопитающих, включая людей. Согласно некоторым вариантам данного изобретения величина дневной дозы соединений, описанных в данной заявке, находится в пределах величин концентраций в циркулирующей крови, которые включают ED50 с минимальной токсичностью. Согласно некоторым вариантам интервал величин дневных доз и/или величина единичной дозы меняются в указанных пределах в зависимости от вида применяемой лекарственной формы и используемого способа ее введения.
Комбинированная терапия
[00239] Согласно одному из вариантов ингибиторы CSE Формулы (I), (II), (III), (IV), (V) или (VI) вводятся субъекту, нуждающемуся в этом, в комбинации с противовоспалительным агентом. Примеры таких противовоспалительных агентов включают, но без ограничения, анальгетики, нестероидные противовоспалительные средства (NSAIDs), ингибиторы СОХ-2 и т.п.
[00240] Согласно другому варианту ингибиторы CSE Формулы (I), (II), (III), (IV), (V) или (VI) вводятся субъекту, нуждающемуся в этом, в комбинации с лекарственным средством от боли. Примеры таких лекарственных средств от боли включают, но без ограничения, парацетамол, габапентин, прегабалин, дулоксетин, нестероидные противовоспалительные средства (NSAIDs), такие как салицилаты, опиоидные средства, такие как морфин и опий, и их аналоги, такие как кодеин, оксикодон и т.п., а также неопиоидные соединения.
[00241] Согласно другим вариантам ингибиторы CSE Формулы (I), (II), (III), (IV), (V) или (VI) вводятся субъекту, нуждающемуся в этом, в комбинации с антисептическим средством (например, с перекисью водорода, йодом, хлоргексидином, борной кислотой, бензалкония хлоридом (ВАС), цетилтриметиламмония бромидом (СТМВ), цетилпиридиния хлоридом (Cetrim, СРС), бензтиония хлоридом (BZT) и т.п..
[00242] Согласно другим вариантам ингибиторы CSE Формулы (I), (II), (III), (IV), (V) или (VI) вводятся субъекту, нуждающемуся в этом, в комбинации с анестезирующим средством (например, бензокаином, лидокаином и т.п.).
[00243] Согласно другим вариантам ингибиторы CSE Формулы (I), (II), (III), (IV), (V) или (VI) вводятся субъекту, нуждающемуся в этом, в комбинации с одним или более агентами, используемыми для лечения аллергии, включая, но без ограничения, комбинации антигистаминного соединения и противоотечного средства (цетиризин и псевдоэфидрин; деслоратадин и псевдоэфедрин ER; фексофенадин и псевдоэфедрин; лоратадин и псевдоэфедрин); антигистаминные средства (назальный спрей азеластина; бромфенирамин; пероральная суспензия бромфенирамина; карбиноксамин; цетиризин; хлорфенирамин; клемастин; деслоратадин; дексхлорфенирамин ER; пероральный сироп дексхлорфенирамина; пероральный дифенирамин; фексофенадин; лоратадин; прометазин); противоотечные средства (псевдоэфедрин); модификаторы лейкотриена (монтелукаст; гранулы монтелукаста); назальные антихолинергические средства (ипратропий); назальные кортикостероиды (беклометазон для назальной ингаляции; будесонид для назальной ингаляции; флунизолид для назальной ингаляции; флутиказон для назальной ингаляции; назальный спрей мометазона; триамцинолон для назальной ингаляции; назальный спрей триамцинолона); назальные противоотечные средства (например, фенилэфрин); стабилизаторы тучных клеток в виде назальных спреев (назальный спрей кромолина) и т.п.
[00244] Согласно другим вариантам изобретения ингибиторы CSE Формулы (I), (II), (III), (IV), (V) или (VI) вводятся субъекту, нуждающемуся в этом, в комбинации с антибиотиками. Согласно еще одному варианту изобретения ингибиторы CSE Формулы (I), (II), (III), (IV), (V) или (VI) вводятся субъекту, нуждающемуся в этом, в сочетании с раневыми повязками.
[00245] Примеры агентов, которые пригодны для проведения комбинированной терапии с агентом, который модулирует активность каротидного параганглия, включают ингибиторы карбоангидразы (например, ацетазоламид), ингибиторы холинэстеразы (например, донепезил), ингибиторы аденозина (например, теофиллин), прогестагенные средства (например, прогестон), опиоидные антагонисты (например, налоксон), стимуляторы центральной нервной системы (например, никотин), серотонинергические агенты (например, пароксетин), включая селективные ингибиторы поглощения серотонина (SSRIs), антидепрессанты (например, протриптилин), включая обычные и/или трициклические антидепрессанты, противогипертонические средства (например, метопролол, цилазаприл, пропранолол, атенолол, гидрохлортиазид), антагонисты кальциевых каналов (например, исрадипин), ингибиторы АСЕ (АПФ) (например, спираприл), стимуляторы дыхания (например, доксапрам), альфа-2 адренергические антагонисты (например, клонидин), агонисты гамма-аминомасляной кислоты (например, баклофен), антагонисты глутаматов (например, сабелузол) или газообразные стимуляторы дыхания, такие как диоксид углерода.
Составы и наборы для комбинированной терапии
[00246] Данное изобретение предусматривает также наборы для терапии, способы которой описаны в данной заявке. Согласно некоторым вариантам набор содержит ингибитор CSE и второй терапевтический агент. Такие наборы обычно содержат один или более активных агентов, например, описанных в данной заявке, и инструкцию для использования этого набора.
[00247] Согласно некоторым вариантам наборы по изобретению включают носитель, упаковку или резервуар, который имеет отделения для помещения одного или более контейнеров, таких как флаконы, трубки и т.п., каждый (-е) такой (-ие) контейнер (-ы) включает (включают) один из отдельных элементов, используемых при осуществлении описанного способа. Подходящие контейнеры включают, например, бутылочки (виалы), флаконы, шприцы и трубки для проведения исследований. Согласно другим вариантам контейнеры изготовлены из различных материалов, таких как стекло или пластик.
[00248] Согласно некоторым вариантам фармацевтические композиции содержатся в упаковке или в распределяющем приспособлении, которое содержит одну или более стандартных лекарственных форм, содержащих ингибитор CSE. Согласно другому варианту упаковка изготовлена, например, из металлической или полимерной фольги, например, это может быть блистерная упаковка.
Методы анализа для определения ингибиторов CSE
[00249] Согласно некоторым вариантам наличие ингибиторов CSE определяют путем проведения анализа in vitro. Например, in vitro определение ферментативной активности CSE описано в публикации Zhong et al. Chinese Medical Journal, 2009, 122, 326-330. Согласно некоторым вариантам in vitro ферментный анализ адаптируют любым подходящим методом для проведения скрининга с высокой пропускной способностью (HTS).
[00250] Согласно некоторым вариантам in vivo анализы используются для определения действия ингибитора CSE. Согласно некоторым вариантам in vivo анализ для определения ингибитора CSE включает:
(а) приготовление гомогенатов органа или ткани из организма подопытного животного, которому вводили испытуемое соединение; и
(б) определение концентрации H2S на основе результатов абсорбции.
При этом уменьшение концентрации H2S свидетельствует о том, что испытуемое соединение представляет собой ингибитор CSE. Согласно некоторым вариантам этого анализа подопытное животное помещают в условия нормоксии, острой гипоксии, хронической интермиттирующей гипоксии, гиперкапнии или в условия их комбинации. Необязательные промежуточные стадии включают:
проведение ферментативной реакции на L-цистеине;
остановку ферментативной реакции при помощи ацетата цинка и трихлоруксусной кислоты;
взаимодействие сульфида цинка с кислым К,М-диметил-п-фенилендиаминсульфатом и хлорным железом и
измерение степени абсорбции анализируемой смесью при помощи ридера для микропланшетов.
[00251] Согласно некоторым вариантам настоящего изобретения in vivo анализ для определения ингибитора CSE включает:
(а) выделение органа или ткани из организма подопытного животного, которому было введено испытуемое соединение;
(б) стимуляцию этого органа или ткани в регистрирующем устройстве их перфузии в этом регистрирующем устройстве различными количествами кислорода и/или диоксида углерода; и
(в) регистрацию потенциалов действия;
При этом снижение потенциала действия показывает, что испытуемое соединение представляет собой ингибитор CSE. Согласно некоторым вариантам описанного выше метода анализа подопытное животное помещают в условия нормоксии, острой гипоксии, хронической интермиттирующей гипоксии, гиперкапнии или в условия их комбинации. Необязательные промежуточные стадии включают:
помещение указанного органа или ткани в регистрирующее устройство, куда подают теплый физиологический раствор.
[00252] Для записи потенциалов действия можно использовать электрод-присоску в устройстве PowerLab/8P.
ПРИМЕРЫ
[00253] Следующие ниже примеры следует рассматривать как иллюстративные и не ограничивающие никоим образом остальную часть данного описания.
[00254] Все реакции синтеза осуществлялись в стандартных лабораторных приборах из стекла, если в примерах не указывается иное. При этом использовали коммерческие реагенты без их обработки.
Пример 1: Синтез 3-(1-(1Н-тетразол-5-ил)гидразинил)-№,М-диметилпропан-1-амина (3)
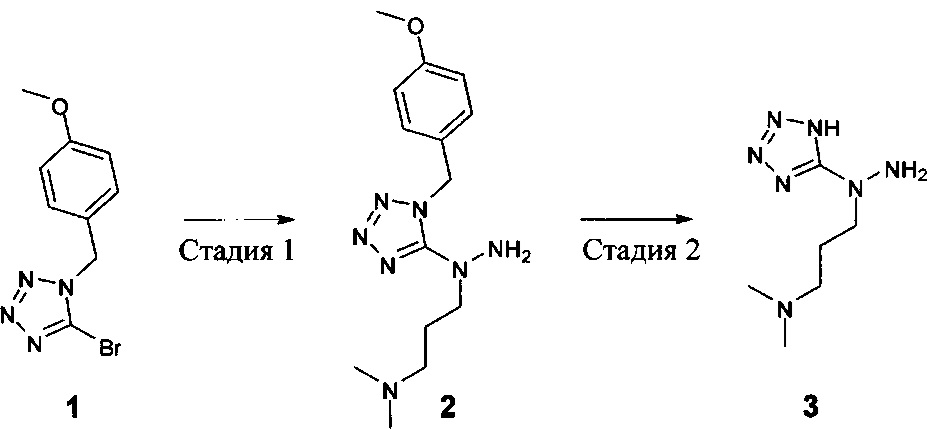
Стадия 1: Синтез 3-(1-(1-(4-метоксибензил)-1Н-тетразол-5-ил)гидразинил)-N,N-диметилпропан-1-амина (2)
[00255] Смесь 5-бром-1-(4-метоксибензил)-1H-тетразола (1) (500 мг, 1.85 ммоль) и (3-гидразинопропил)диметиламина (436 мг, 3.72 ммоль) в 2-пропаноле (5 мл) перемешивали при температуре 80°C в течение 18 ч. Реакционную смесь подвергали выпариванию и полученный остаток растворяли в смеси дихлорметана (20 мл) и рассола (10 мл). Полученные слои разделяли и водный слой экстрагировали дихлорметаном (20 мл). Соединенные органические слои промывали водой (10 мл), высушивали над сульфатом натрия, отфильтровывали и выпаривали. Сырой продукт очищали путем хроматографии на колонке, элюируя смесью дихлорметан:метанол:триэтиламин (100:5:0.5) с получением 3-(1-(1-(4-метоксибензил)-1Н-тетразол-5-ил)гидразинил)-N,N-диметилпропан-1-амина (2) (320 мг, 1.05 ммоль, 57%) в виде масла оранжевого цвета. ESMS m/z 306 (М+Н)+.
Стадия 2: Синтез 3-(1-(1Н-тетразол-5-ил)гидразинил)-N,N-диметилпропан-1-амина (3)
[00256] Смесь (3-{N-[1-(4-метоксибензил)-1H-тетразол-5-ил]гидразино}пропил)-диметиламина (120 мг, 0.39 ммоль) и 6М соляной кислоты (1.2 мл) нагревали под действием микроволнового облучения при температуре 120°C в течение 1.5 ч. Реакционную смесь подвергали выпариванию, и сырой продукт очищали путем хроматографии на колонке, элюируя смесью дихлорметан:метанол:триэтиламин (4:1:0.2÷1:1:0.5). Полученный продукт растирали с метанолом с получением 3-(1-(1Н-тетразол-5-ил)гидразинил)-N,N-диметилпропан-1-амина (3) (10 мг, 0.05 ммоль, 13%) в виде кристаллического твердого вещества белого цвета. ESMS m/z 186 (М+Н)+; 1Н NMR (400 MHz, D2O) δ 3.55 (t, J=6.5 Hz, 2H), 3.16-3.27 (m, 2H), 2.90 (s, 6H), 2.03-2.13 (m, 2H).
Пример 2: Синтез 2-(1-(1Н-тетразол-5-ил)гидразинил)-N,N-диметилэтанамина (4)
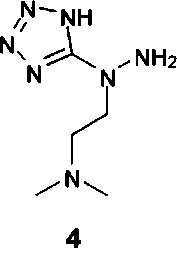
[00257] 2-(1-(1Н-тетразол-5-ил)гидразинил)-N,N-диметилэтанамин (4) был получен способом, похожим на способ, описанный в Примере 1. ESMS m/z 172 (М+Н)+.
Пример 3: Синтез 5-(1-(проп-2-инил)гидразинил)-1Н-тетразола (7)
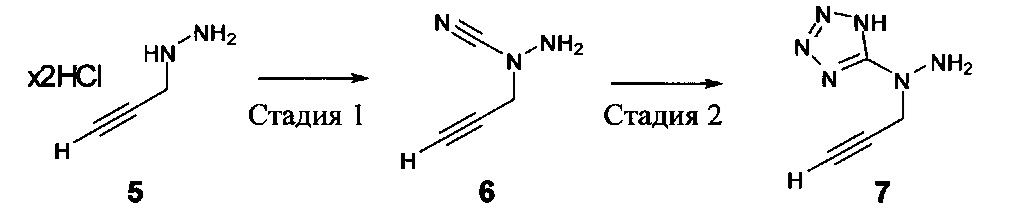
Стадия 1: Синтез 1-(проп-2-инил)гидразина карбонитрила (6)
[00258] К раствору бромистого циана (0.37 г, 3.49 ммоль) в дихлорметане (16.5 мл) добавляли смесь проп-2-инил-гидразина дигидрохлорида (5) (0.50 г, 3.49 ммоль) и карбоната калия (0.97 г, 6.99 ммоль) в воде (10 мл) при температуре 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч. Полученные слои разделяли и водный слой экстрагировали дихлорметаном (2×30 мл). Соединенные органические слои высушивали над сульфатом магния, отфильтровывали и выпаривали. Остаток очищали методом хроматографии на колонке, элюируя смесью дихлорметан: метанол (100:1) с получением 1-(проп-2-инил)гидразина карбонитрила (6) (120 мг, 1.26 ммоль, 36%) в виде масла бледно-желтого цвета. ESMS m/z 96 (М+Н)+; 1Н NMR (500 MHz, CDCl3) δ 4.25 (br. s, 2Н), 3.97 (d, J=2.4 Hz, 2H), 2.53 (t, J=2.4 Hz, 1H).
Стадия 2: Синтез 5-(1-(проп-2-инил)гидразинил)-1Н-тетразола (7)
[00259] Смесь 1-(проп-2-инил) гидразина карбонитрила (6) (145 мг, 1.52 ммоль), азида натрия (119 мг, 1.83 ммоль) и хлорида аммония (98 мг, 1.83 ммоль) в N,N-диметилформамиде (2 мл) перемешивали при температуре 90°С в течение 1 ч. Полученную смесь отфильтровывали и выпаривали. Остаток очищали методом хроматографии на колонке, элюируя смесью дихлорметан: метанол: гидроксид аммония (4:1:0.2) с получением титульного соединения (120 мг, 0.87 ммоль, 57%) в виде смолы бледно-желтого цвета. ESMS m/z 139 (М+Н)+; 1H NMR (500 MHz, DMSO-d6, salt) δ 4.13 (d, J=2.0 Hz, 2H), 3.05 (br. s, 1H).
Примеры 4-11:
[00260] Способом, описанным в Примере 3, получали следующие соединения с использованием функционализированного соответствующим образом гидразина на стадии 1.
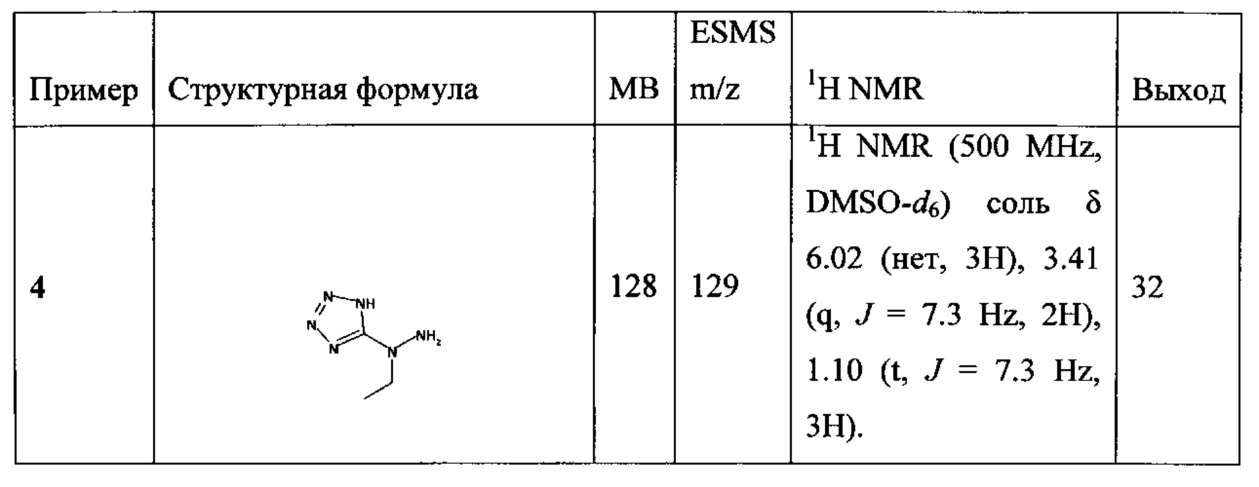

Пример 12: Синтез 3-(1-(1Н-тетразол-5-ил)гидразинил)пропан-1-амина дигидрохлорида (13)
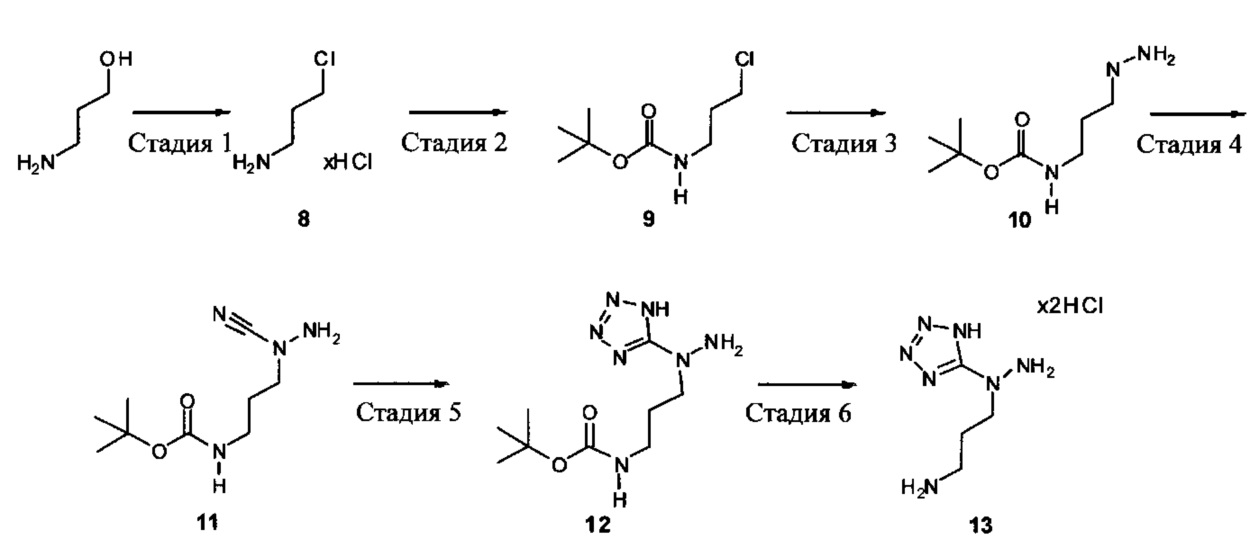
Стадия 1: Синтез 3-хлорпропиламина гидрохлорида (8)
[00261] Раствор тионилхлорида (8.68 г, 1.32 ммоль) в безводном хлороформе (30 мл) по каплям добавляли к 3-аминопропан-1-олу (4.49 г, 59.19 ммоль), поддерживая при этом температуру равную 0-10°C. Смеси давали нагреться до комнатной температуры и затем кипятили (нагревали с обратным холодильником) в течение 3 ч. Затем эту смесь охлаждали до комнатной температуры и собирали остаток полученного 3-хлорпропиламина гидрохлорида (8) (7.07 г, 55.15 ммоль, 93%) в виде твердого вещества зеленого цвета. ESMS m/z 94 (М+Н)+.
Стадия 2: Синтез трет.бутил-3-хлорпропилкарбамата (9)
[00262] Смесь 3-хлорпропиламина гидрохлорида (8) (5.00 г, 38.46 ммоль) и триэтиламина (4.11 г, 40.58 ммоль) в среде дихлорметана перемешивали при комнатной температуре в течение 30 мин. Полученную смесь охлаждали до 0°C и добавляли раствор дитрет.бутилдикарбоната (8.86 г, 40.58 ммоль) в дихлорметане (30 мл). Эту смесь перемешивали при комнатной температуре в течение 2 ч. Затем реакционную смесь промывали 10% водным раствором гидросульфата калия (40 мл) и водой (40 мл). Органический слой высушивали над сульфатом натрия, отфильтровывали и выпаривали с получением трет.бутил-3-хлорпропилкарбамата (9) (7.89 г, 40.77 мол, количественный выход) в виде масла светло-коричневого цвета. Этот сырой продукт использовали на следующей стадии без очистки. ESMS m/z 138 (М+Н-t-Bu)+.
Стадия 3: Синтез трет.бутил-3-гидразинилпропилкарбамата (10)
[00263] К нагревающемуся с обратным холодильником раствору гидразингидрата (6.40 г, 128.00 ммоль) в этаноле (14.5 мл) по каплям добавляли раствор трет.бутил-3-хлорпропилкарбамата (9) (3.80 г, 19.62 ммоль) в этаноле (14.5 млL) в течение 80 мин. Эту смесь кипятили в течение 1 ч. Затем реакционную смесь выпаривали и остаток разбавляли диэтиловым эфиром (60 мл). Разделяли два полученных слоя. Органический слой промывали насыщенным раствором карбоната натрия (17 мл) и выпаривали с получением трет.бутил-3-гидразинилпропилкарбамата (10) (1.60 г, 8.45 ммоль, 43%) в виде масла желтого цвета. Этот сырой продукт использовали на следующей стадии без очистки. ESMS m/z 190 (М+Н)+.
Стадия 4: Синтез трет.бутил-3-(1-цианогидразинил)пропилкарбамата (11)
[00264] Раствор бромистого циана (1.68 г, 15.8 ммоль) в дихлорметане (50 мл) добавляли одновременно к раствору трет.бутил-3-гидразинилпропилкарбамата (10) (3.00 г, 15.85 ммоль) в воде (16 мл) и к раствору карбоната натрия (837 мг, 7.90 ммоль) в воде (16 мл) при температуре 0°C. Реакционную смесь перемешивали при температуре 0°C в течение 1 ч. Затем разделяли два слоя. Органический слой высушивали над сульфатом натрия, отфильтровывали и выпаривали, поддерживая при этом температуру ниже 10°C, с получением трет.бутил-3-(1-цианогидразинил)пропилкарбамата (11) (2.12 г, 9.89 ммоль, 63%) в виде масла желтого цвета. ESMS m/z 159 (М+Н-t-Bu)+.
Стадия 5: Синтез трет.бутил-3-(1-(1Н-тетразол-5-ил)гидразинил)пропилкарбамата (12)
[00265] Смесь трет.бутил-3-(1-цианогидразинил)пропилкарбамата (11) (2.12 г, 9.89 ммоль), азида натрия (780 мг, 12.00 ммоль) и хлористого аммония (642 мг, 12.00 ммоль) в безводном N,N-диметилформамиде (20 мл) перемешивали при температуре 40°C в течение 18 ч. Полученную реакционную смесь отфильтровывали и выпаривали. Остаток очищали методом хроматографии на колонке, элюируя смесью хлороформ: метанол (95:5) с получением трет.бутил-3-(1-(1Н-тетразол-5-ил)гидразинил)пропилкарбамата (12) (1.08 г, 4.20 ммоль, 42%) в виде масла желтого цвета. ESMS m/z 258 (М+Н)+.
Стадия 6: Синтез 3-(1-(1Н-тетразол-5-ил)гидразинил)пропан-1-амина дигидрохлорида (13)
[00266] К трет.бутил-3-(1-(1Н-тетразол-5-ил)гидразинил)пропилкарбамату (12) (134 мг, 0.52 ммоль) добавляли 4.0 М раствор хлористого водорода в метаноле (1.5 мл) и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Собирали полученный остаток и промывали его метанолом (2×0.5 мл) с получением 3-(1-(1Н-тетразол-5-ил)гидразинил)пропан-1-амина дигидрохлорида (13) (59 мг, 0.26 ммоль, 51%) в виде твердого вещества белого цвета. ESMS m/z 158 (М+Н)+; 1Н NMR (500 MHz, D2O) δ 3.73 (t, J=5.0 Hz, 2H), 3.13 (m, 2H), 2.14 (m, 2H).
Примеры 13-15:
[00267] По способу, описанному в Примере 12, получали следующие соединения, используя на стадии 1 функционализированный соответствующим образом амин.
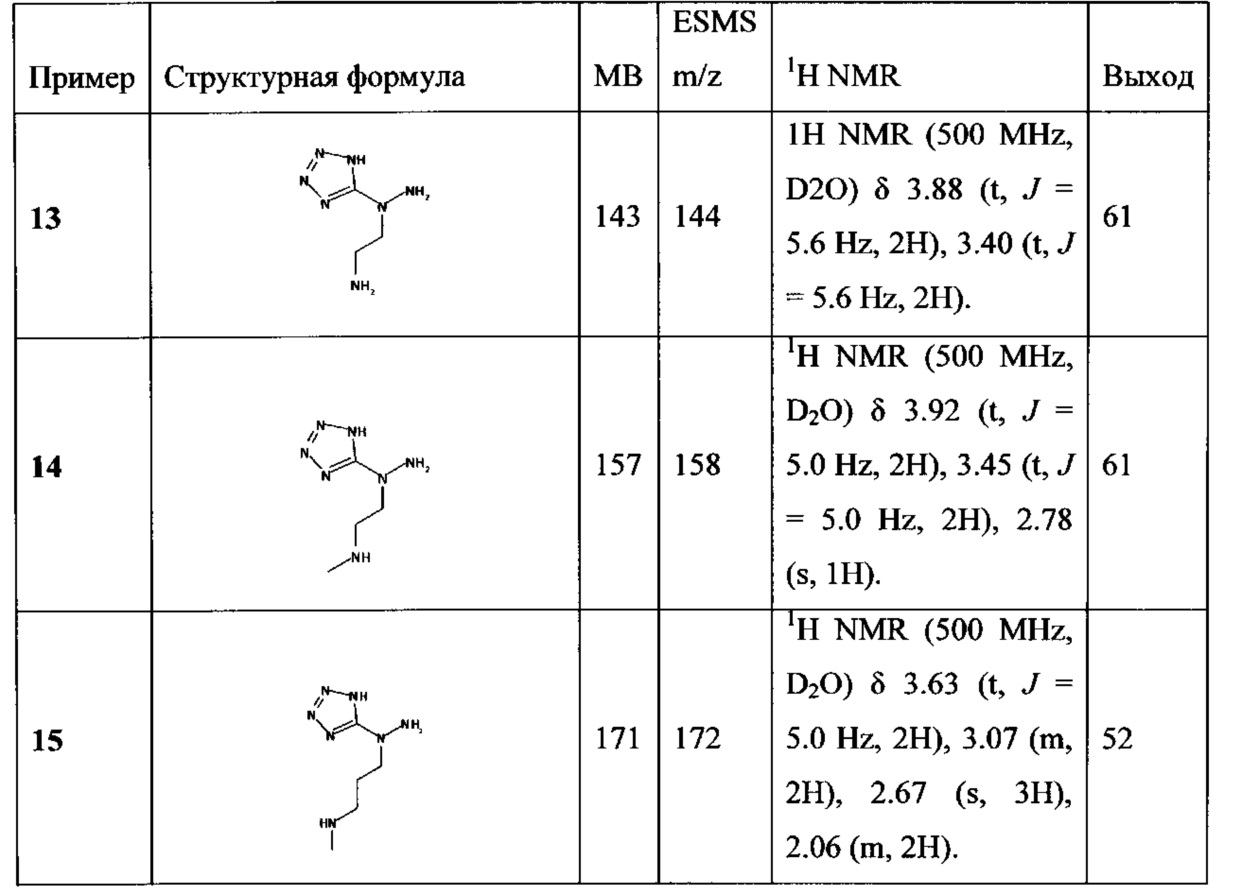
Пример 16: Синтез 5-(3-(1-(1Н-тетразол-5-ил)гидразинил)пропил)-1Н-тетразола (19)
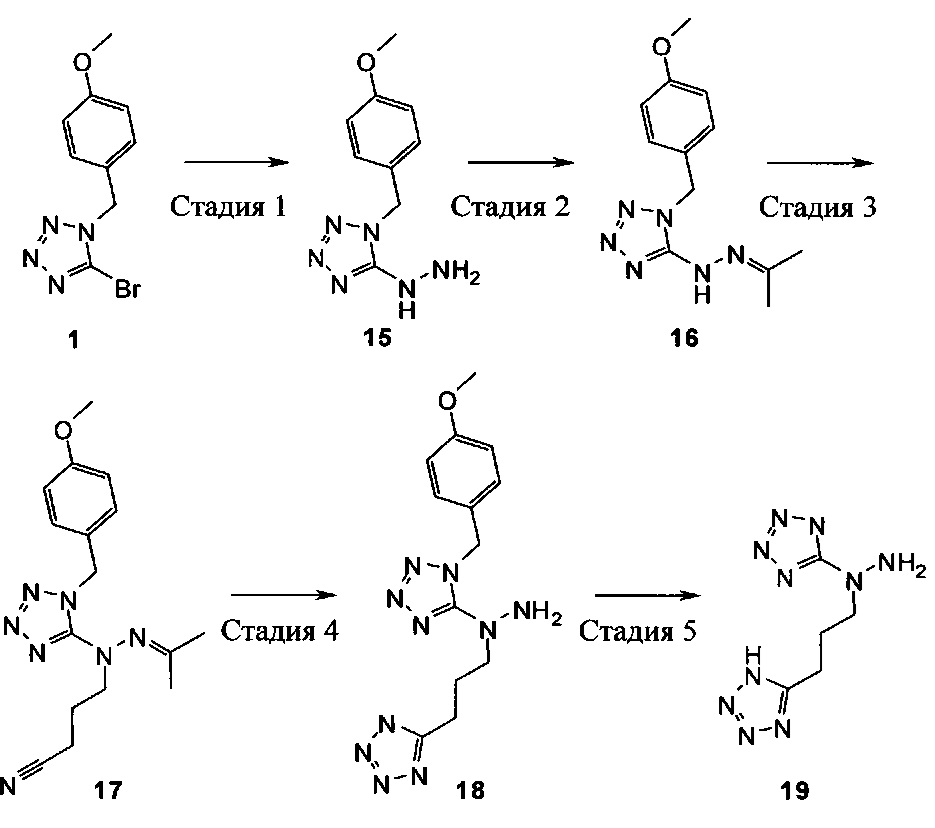
Стадия 1: Синтез 5-гидразинил-1-(4-метоксибензил)-1Н-тетразола (15)
[00268] Смесь 5-бром-1-(4-метоксибензил)-1H-тетразола (1) (3.10 г 11.43 ммоль) и гидразингидрата (2.21 мл, 45.67 ммоль) в 2-пропаноле (25 мл) перемешивали при температуре 60°C в течение 16 ч. 2-пропанол выпаривали, а остаток растирали с водой (20 мл) с получением 5-гидразинил-1-(4-метоксибензил)-1 Н-тетразола (15) (2.04 г, 9.17 ммоль, 80%) в виде кристаллического вещества почти белого цвета. ESMS m/z 221 (М+Н)+.
Стадия 2: Синтез 1-(4-метоксибензил)-5-(2-(пропан-2-илиден)гидразинил)-1Н-тетразола (16)
[00269] Смесь [1-(4-метоксибензил)-1H-тетразол-5-ил]гидразина (15) (1.80 г, 8.17 ммоль), ацетона (18 мл) и 3 капель 4 М соляной кислоты в среде диэтилового эфира перемешивали при комнатной температуре в течение 16 ч. Получали остаток 1-(4-метоксибензил)-5-(2-(пропан-2-илиден)гидразинил)-1 Н-тетразола (16) (1.91 г, 7.33 ммоль, 90%) в виде кристаллического вещества почти белого цвета. ESMS m/z 261 (М+Н)+.
Стадия 3: Синтез 4-(1-(1-(4-метоксибензил)-1Н-тетразол-5-ил)-2-(пропан-2-илиден)гидразинил)бутаннитрила (17)
[00270] Смесь 1-(4-метоксибензил)-5-(2-(пропан-2-илиден)гидразинил)-1Н-тетразола (16) (0.50 г, 1.92 ммоль), гидрида натрия (0.12 г, 3.00 ммоль, в виде 60% дисперсии) и безводного тетрагидрофурана (5 мл) перемешивали при 0°C в течение 0.5 ч. К перемешиваемой смеси при 0°C добавляли 4-бромбутиронитрил (285 мкл, 2.87 ммоль), давали реакционной смеси нагреться до комнатной температуры и перемешивали ее в течение 18 ч. При комнатной температуре добавляли дополнительные порции гидрида натрия (76 мг, 1.90 ммоль, 60%) и 4-бромбутиронитрила (190 мкл, 1.90 ммоль) и перемешивали эту реакционную смесь в течение 24 ч и выпаривали. Остаток растворяли в воде (15 мл) и экстрагировали дихлорметаном (3×15 мл). Соединенные органические слои высушивали над сульфатом натрия, отфильтровывали и выпаривали. Полученный сырой продукт очищали методом хроматографии на колонке, элюируя смесью н-гексан: этилацетат (2:3 об/об) с получением 4-(1-(1-(4-метоксибензил)-1Н-тетразол-5-ил)-2-(пропан-2-илиден)гидразинил)бутаннитрила (17) (492 мг, 1.50 ммоль, 78%) в виде масла желтого цвета. ESMS m/z 328 (М+Н)+.
Стадия 4: Синтез 5-(1-(3-(1Н-тетразол-5-ил)пропил)гидразинил)-1-(4-метоксибензил)-1Н-тетразола (18)
[00271] Смесь 4-(1-(1-(4-метоксибензил)-1Н-тетразол-5-ил)-2-(пропан-2-илиден)-гидразинил)бутаннитрила (17) (490 мг, 1.50 ммоль), азида натрия (117 мг, 1.80 ммоль) и хлористого аммония (96 мг, 1.80 ммоль) в безводном N,N-диметилформамиде (10 мл) перемешивали при температуре 90°C в течение 18 ч. Затем к смеси снова добавляли азид натрия (78 мг, 1.20 ммоль) и хлористый аммоний (64 мг, 1.20 ммоль) и далее перемешивание продолжали при температуре 90°C в течение 18 ч. Дополнительные порции азида натрия (2×78 мг, 1.20 ммоль) и хлористого аммония (2×64 мг, 1.20 ммоль) добавляли к смеси с интервалами в 24 ч и перемешивали реакционную смесь при 90°C. Через 3 дня смесь выпаривали, остаток суспендировали в 2-пропаноле (20 мл) и отфильтровывали. Полученный фильтрат выпаривали, получая 5-(1-(3-(1Н-тетразол-5-ил)пропил)гидразинил)-1-(4-метоксибензил)-1Н-тетразол (18) (320 мг, 0.97 ммоль, 65%) в виде масла желтого цвета. (М+Н)+ 331. Этот сырой продукт использовали на следующей стадии без очистки.
Стадия 5: Синтез 5-(3-(1-(1Н-тетразол-5-ил)гидразинил)пропил)-1Н-тетразола (19)
[00272] Смесь 5-(1-(3-(1Н-тетразол-5-ил)пропил)гидразинил)-1-(4-метоксибензил)-1Н-тетразола (18) (320 мг, 0.97 ммоль) и 6 М соляной кислоты в воде перемешивали при температуре 100°C в течение 3 ч при нагревании микроволновым облучением. Полученную смесь выпаривали и очищали методом хроматографии на колонке, элюируя смесью дихлорметан:метанол:аммиак (4:1:0.2÷3:2:0.5). Полученный продукт перекристаллизовывали из этанола с получением 5-(3-(1-(1Н-тетразол-5-ил)гидразинил)пропил)-1Н-тетразола (19) (15 мг, 0.07 ммоль, 7%) в виде кристаллического вещества почти белого цвета. ESMS m/z 211 (М+Н)+; 1Н NMR (400 MHz, MeOH-d4) δ 3.66 (t, J=6.9 Hz, 2H), 3.03 (t, J=7.4 Hz, 2H), 2.23 (quint, J=7.2 Hz, 2H).
Пример 17: Синтез (Е)-5-(2-бензилиденгидразинил)-1Н-тетразола (21)
[00273] Смесь 5-гидразинил-1 Н-тетразола (20) (10 мг, 0.10 ммоль) и бензальдегида (11 мг, 0.10 ммоль) в 1,4-диоксане (100 мкл) перемешивали при комнатной температуре в течение 18 ч. Получали осадок (Е)-5-(2-бензилиденгидразинил)-1 Н-тетразола (21) (6.5 мг, 0.03 ммоль, 34%) в виде твердого кристаллического вещества белого цвета. ESMS m/z 189 (М+Н)+; 1Н NMR (500 MHz, DMSO-d6) δ 11.79 (s, 1H), 8.04 (s, 1Н), 7.78 (d, J=6.9 Hz, 2H), 7.43 (t, J=7.3 Hz, 2H), 7.36-7.41 (m, 1H).
Примеры 18-25:
[00274] По способу, описанному в Примере 17, используя функционализированные соответствующим образом альдегид иди кетон, получали следующие соединения.
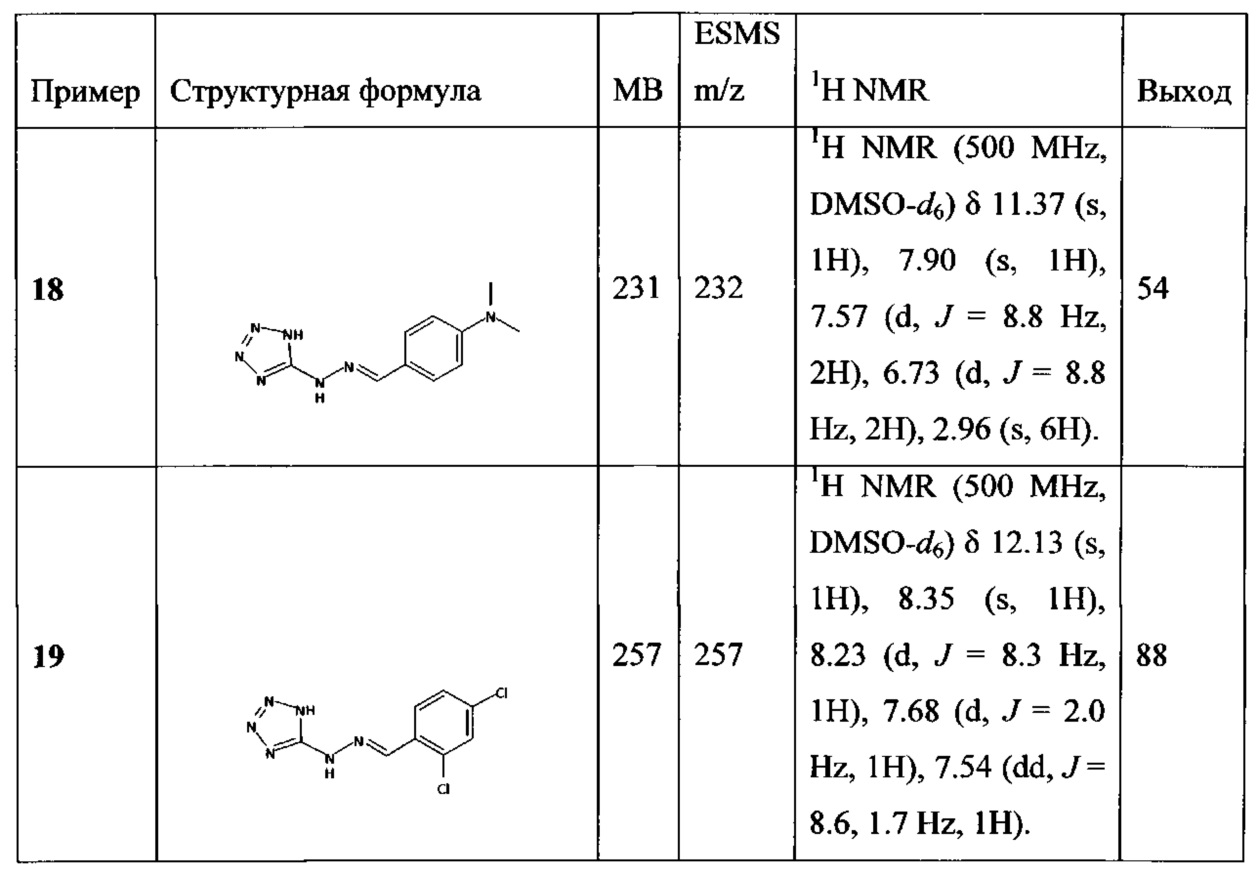
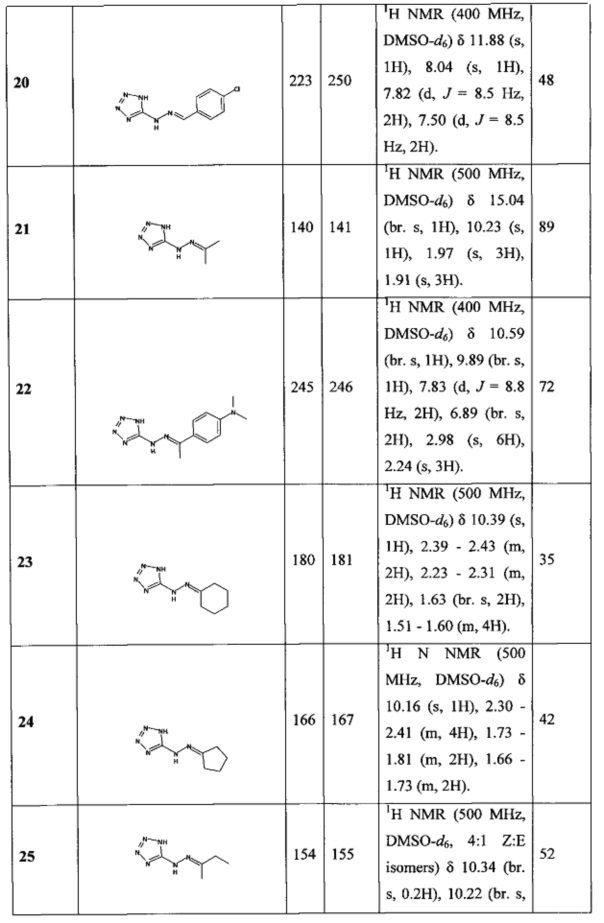

Пример 26: Синтез (Е)-3-(2-(1Н-тетразол-5-ил)гидразоно)-1-(4-(диметиламино)-фенил)пропан-1-она (23)
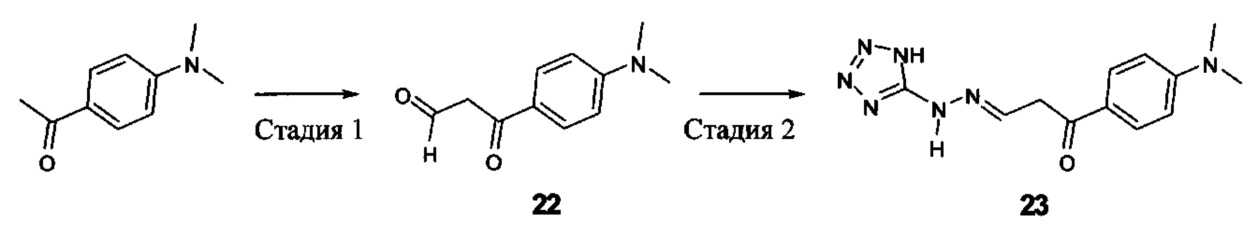
Стадия 1: Синтез 3-(4-(диметиламино)фенил)-3-оксопропаналя (22)
[00275] К смеси 4-диметиламиноацетофенона (1.00 г, 6.13 ммоль) и этилформиата (580 мкл, 7.16 ммоль) в безводном тетрагидрофуране (10 мл) добавляли 25% раствор метоксида натрия в метаноле (1.70 мл, 7.18 ммоль) при температуре 0-5°C. Реакционную смесь перемешивали при указанной температуре в течение 1 ч, затем при комнатной температуре в течение 18 ч. Собирали остаток и промывали его диэтиловым эфиром (10 мл) с получением 3-(4-(диметиламино)фенил)-3-оксопропаналя (22) (0.53 г, 2.48 ммоль, 40%) в виде бледно-желтого кристаллического вещества. ESMS m/z 192 (М+Н)+.
Стадия 2: Синтез (Е)-3-(2-(1Н-тетразол-5-ил)гидразоно)-1-(4-(диметиламино)-фенил)пропан-1-она (23)
[00276] К смеси 3-(4-(диметиламино)фенил)-3-оксопропаналя (22) (50 мг, 0.23 ммоль) и этанола (3 мл) добавляли (1/7-тетразол-5-ил)гидразина гидрохлорид (37 мг, 0.27 ммоль) при температуре 0°C. Реакционную смесь перемешивали при указанной температуре в течение 10 мин. Собирали остаток и промывали его этанолом (1 мл) с получением (Е)-3-(2-(1Н-тетразол-5-ил)гидразоно)-1-(4-(диметиламино)-фенил)пропан-1-она (23) (31 мг, 0.11 ммоль, 48%, 4:1 E:Z) в виде бледно-желтого кристаллического вещества. ESMS m/z 274 (М+Н)+; 1H NMR (500 MHz, DMSO-d6) δ 11.41 (s, 0.8Н), 10.93 (s, 0.2H), 7.80-7.89 (m, 2Н), 7.56 (t, J=5.6 Hz, 0.8H), 7.09 (t, J=5.1 Hz, 0.2H), 6.71-6.78 (m, 2H), 4.10 (d, J=5.4 Hz, 0.4H), 3.93 (d, J=5.9 Hz, 1.6H), 3.04 (s, 1.2H), 3.03 (s, 4.8H).
Пример 27: Синтез (Е)-N,N-диметил-4-((2-метил-2-(1Н-тетразол-5-ил)гидразоно)-метил)анилина (26)
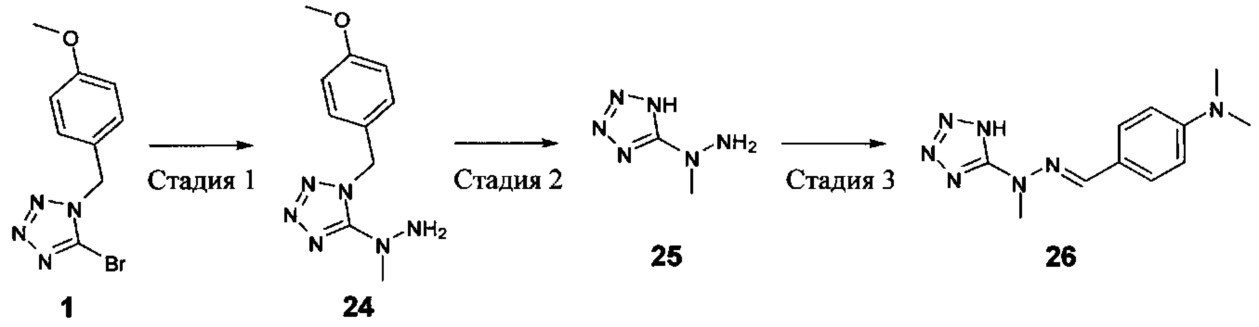
Стадия 1: Синтез 1-(4-метоксибензил)-5-(1-метилгидразинил)-1Н-тетразола (24)
[00277] Смесь 5-бром-1-(4-метоксибензил)-1 Н-тетразола (1) (600 мг, 2.23 ммоль) и метилгидразина (235 мкл, 4.46 ммоль) в 2-пропанола (5.3 мл) нагревали при температуре 60°C в течение 20 ч. Реакционную смесь выпаривали и остаток перекристаллизовывали из 2-пропанола с получением 1-(4-метоксибензил)-5-(1-метилгидразинил)-1Н-тетразола (24) (54 мг, 0.23 ммоль, 10%) в виде кристаллического вещества почти белого цвета. ESMS m/z 235 (М+Н)+.
Стадия 2: Синтез 5-(1-метилгидразинил)-1Н-тетразола (25)
[00278] Смесь 1-(4-метоксибензил)-5-(1-метилгидразинил)-1Н-тетразола (24) (391 мг, 1.67 ммоль) и 10% палладия на угле (195 мг) в метаноле (4 мл) перемешивали в атмосфере водорода в течение 20 ч. Реакционную смесь отфильтровывали через слой целита и выпаривали фильтрат.Полученный сырой продукт перекристаллизовывали из 2-пропанола (3 мл), получали 5-(1-метилгидразинил)-1 Н-тетразол (25) (72 мг, 0.63 ммоль, 38%) в виде кристаллического вещества почти белого цвета. ESMS m/z 114 (М+Н)+; 1Н NMR (500 MHz, DMSO-d6) δ 14.57 (br. s, 1H), 4.94 (br. s, 2H), 3.14 (s, 3H).
Стадия 3: Синтез (Е)-N,N-диметил-4-((2-метил-2-(1Н-тетразол-5-ил)гидразоно)-метил)анилина (26)
[00279] Смесь 5-(1-метилгидразинил)-1Н-тетразола (25) (20 мг, 0.18 ммоль), 4-диметиламинобензальдегида (26 мг, 0.17 ммоль) и одной капли 3.8 М раствора соляной кислоты в 1,4-диоксане (400 мкл) перемешивали при комнатной температуре в течение 18 ч. Полученный остаток представлял собой (Е)-N,N-диметил-4-((2-метил-2-(1Н-тетразол-5-ил)гидразоно)-метил)анилин (26) (17 мг, 0.07 ммоль, 37%) в виде кристаллического вещества белого цвета. ESMS m/z 246 (М+Н)+; 1Н NMR (500 MHz, DMSO-d6) δ 7.84 (s, 1Н), 7.78 (d, J=8.8 Hz, 2H), 6.92 (br. s, 2H), 3.54 (s, 3H), 3.00 (s, 6H).
Пример 28: Синтез 5-(1-метил-2-(пропан-2-илиден)гидразинил)-1 Н-тетразола (27)
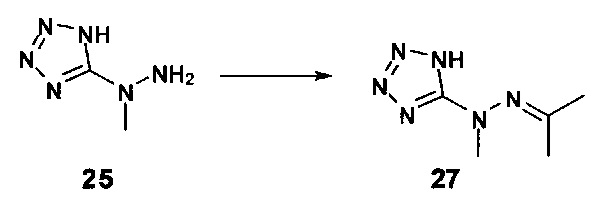
[00280] Смесь 5-(1-метилгидразинил)-1 Н-тетразола (25) (20 мг, 0.18 ммоль) и ацетона (500 мкл) перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь выпаривали с получением 5-(1-метил-2-(пропан-2-илиден)гидразинил)-1Н-тетразола (27) (27 мг, 0.18 ммоль, 100%) в виде масла бледно-желтого цвета. ESMS m/z 155 (М+Н)+; 1Н NMR (500 MHz, CDCl3) δ 3.31 (s, 3Н), 2.13 (s, 3Н), 2.12 (br. s, 3Н).
Пример 29: Синтез 2-метил-5-(1-метилгидразинил)-2Н-тетразола (28)
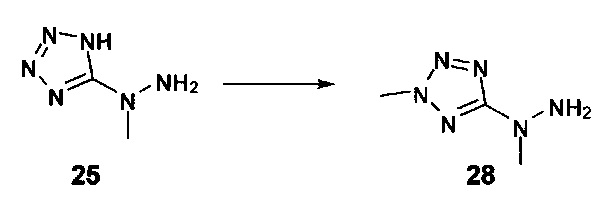
[00281] К смеси 5-(1-метилгидразинил)-1Н-тетразола (25) (100 мг, 0.87 ммоль) и метанола (25 мл) добавляли раствор диазометана (8.76 ммоль) в диэтиловом эфире (60 мл) при температуре 0°C. Реакционную смесь перемешивали в течение 1 ч при температуре 0°C и затем в течение 18 ч при комнатной температуре. Реакционную смесь выпаривали и очищали полученный сырой продукт методом хроматографии на колонки с применением в качестве элюента смеси н-гексан: эти л ацетат (3:2) с получением 2-метил-5-(1-метилгидразинил)-2Н-тетразола (28) (6 мг, 0.04 ммоль, 5%) в виде кристаллического вещества бледно-желтого цвета. ESMS m/z 129 (М+Н)+. 1Н NMR (500 MHz, МеОН-d4) δ 4.18 (s, 3Н), 3.15 (s, 3Н), structure determined by 1H, 15N HMBC.
Пример 30: Синтез 5-(2-(1-этоксициклопропил)гидразинил)-1Н-тетразола (29)
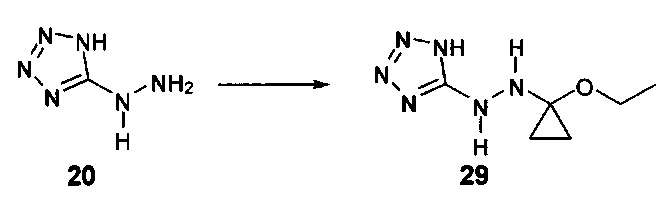
[00282] Смесь 5-гидразинил-1Н-тетразола дигидрохлорида (150 мг, 0.87 ммоль), ацетата натрия (141 мг, 1.72 ммоль) и (1-этоксициклопропокси)триметилсилана (174 мкл, 0.87 ммоль) в этаноле (7.5 мл) перемешивали при температуре 80°C в течение 16 ч. Реакционную смесь выпаривали и остаток растирали с безводным тетрагидрофураном (10 мл). Полученный фильтрат выпаривали и сырой продукт перекристаллизовывали из 2-пропанола (3 мл). Полученный продукт промывали диизопропиловым эфиром (1 мл) с получением 5-(2-(1-этоксициклопропил)гадразинил)-1Н-тетразола (29) (30 мг, 0.16 ммоль, 18%) в виде кристаллического вещества почти белого цвета. ESMS m/z 185 (М+Н)+; 1Н NMR (500 MHz, DMSO-d6) δ 14.47 (br. s, 1H), 8.44 (s, 1H), 6.23 (s, 1H), 3.56 (q, J=6.9 Hz, 2H), 1.03 (t, J=6.9 Hz, 3H), 0.77-0.83 (m, 2H), 0.71-0.77 (m, 2H).
Пример 31: Синтез 5-(1-этилгидразинил)-1Н-1,2,4-триазола гидрохлорида (37)
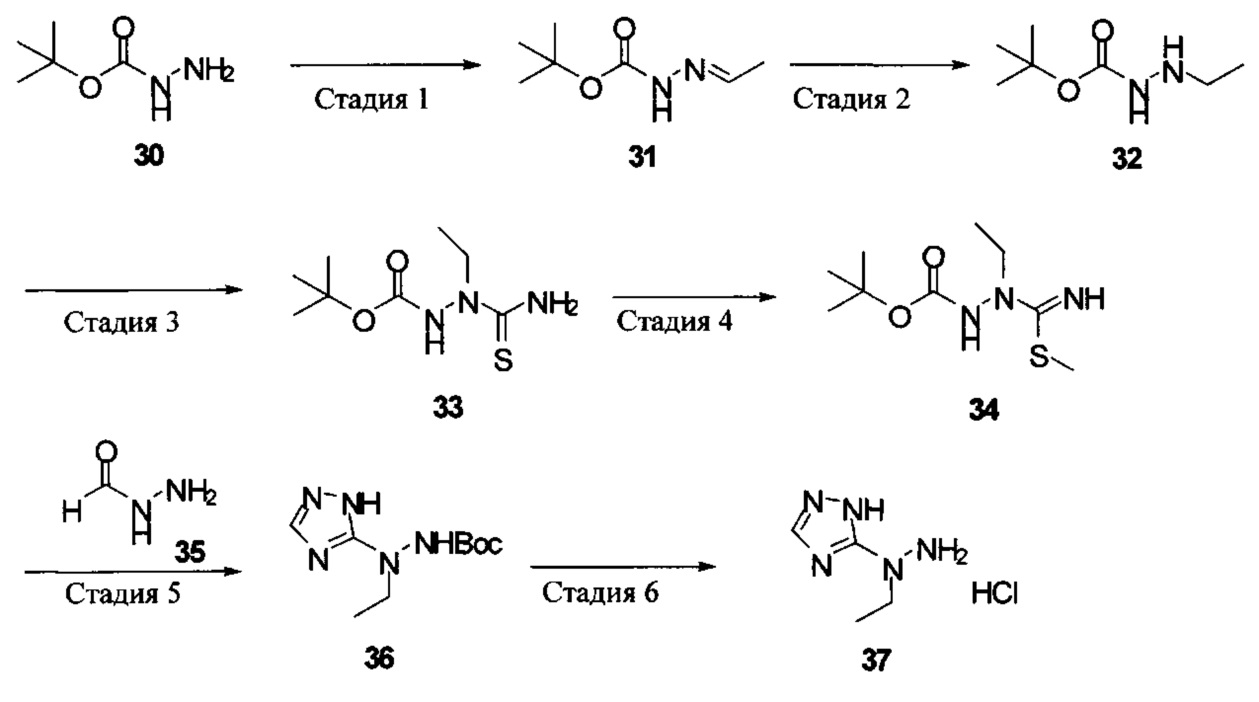
Стадия 1: Синтез (Е)-трет.бутил-2-этилиденгидразинкарбоксилата (31)
[00283] К перемешиваемому раствору трет.бутил-гидразинкарбоксилата 30 (2.0 г, 12.6 ммоль) в толуоле (15 мл) добавляли ацетальдегид (0.7 мл, 13.9 ммоль). Раствор нагревали до температуры 50°C в течение 1 ч и затем перемешивали при комнатной температуре в течение 24 ч. Полученную смесь концентрировали, получая (Е)-трет.бутил-2-этилиденгидразинкарбоксилат (31)в виде бесцветного масла (97.5%). ESMS: 159 (М++1).
Стадия 2: Синтез трет.бутил-2-этилгидразинкарбоксилата (32)
[00284] К перемешиваемому раствору (Е)-трет.бутил-2-этилиденгидразинкарбоксилата (31) (6.6 г, 37.0 ммоль) в THF (50 мл) при температуре -78°C добавляли DIBAL (диизобутилалюминий) (31 мл, 92.6 ммоль) в виде 1.5 М раствора в толуоле. Реакционную смесь выдерживали при температуре -78°C в течение 2 ч и затем при температуре -40°C в течение 2 ч. Затем эту смесь нагревали до комнатной температуры перед добавлением соли Рошелля (водный раствор виннокислого калия-натрия) и затем эту реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем отделяли органическую фазу и водную фазу экстрагировали при помощи Et2O (2×75 мл). Соединенные органические экстракты промывали рассолом, высушивали (Na2SO4), отфильтровывали и концентрировали под вакуумом. Очистка методом флэш-хроматографии на силикагеле привела к получению трет.бутил-2-этилгидразинкарбоксилата (32) в виде бесцветного масла (3.0 г, 49%). ESMS: 183 (М++23).
Стадия 3: Синтез трет.бутил-2-карбамотиоил-2-этилгидразина карбоксилата (33)
[00285] К перемешиваемому раствору трет.бутил-2-этилгидразинкарбоксилата (32) (5.8 г, 36.6 ммоль) в этилацетате (30 мл) добавляли TMSSCN (триметилсилилтиоцианата) (4.8 г, 36.6 ммоль) и кипятили реакционную смесь в течение 5 ч. После завершения реакции растворитель выпаривали при пониженном давлении с получением трет.бутил-2-карбамотиоил-2-этилгидразина карбоксилата (33) с выходом равным 48%. 1Н NMR (400 MHz, CD3OD) δ 1.2 (t, 3Н), 1.5 (s, 9Н), 4.1 (br s, 2Н), 6.2 (br s, 2Н), 6.4 (br s, 1H).
Стадия 4: Синтез трет.бутил-2-этил-2-(имино(метилтио)метил)гидразина карбоксилата (34)
[00286] К перемешиваемому раствору трет.бутил-2-карбамотиоил-2-этилгидразина карбоксилата (33) (3 г, 13.2 ммоль) в ацетонитриле (30 мл) добавляли метилйодид (9.38 г, 66 ммоль) и нагревали реакционную смесь при температуре 60°С в течение 1 ч. После завершения реакции растворитель выпаривали при пониженном давлении и сырой остаток промывали диэтиловым эфиром и высушивали с получением трет.бутил-2-этил-2-имино(метилтио)метил)гидразина карбоксилата (34) с выходом равным 94%. ESMS: 234.1 (М++1).
Стадия 5: Синтез трет.бутил-2-этил-2-(1Н-1,2,4-триазол-5-ил)гидразина карбоксилата (36)
[00287] К перемешиваемому раствору трет.бутил-2-этил-2-имино(метилтио)метил)-гидразина карбоксилата (34) (500 мг, 2.14 ммоль) и формилгидразида (35) (155 мг, 2.57 ммоль) (10 мл) добавляли диизопропилэтиламин (830 мг, 6.43 ммоль) и кипятили реакционную смесь в течение 15 ч. После завершения реакции к реакционной смеси добавляли воду и экстрагировали этилацетатом (2×50 мл). Отделяли органический слой и высушивали его над сульфатом натрия, отфильтровывали и концентрировали при пониженном давлении с получением сырого продукта. Этот сырой продукт очищали методом хроматографии на колонке с силикагелем, получая трет.бутил-2-этил-2-(1Н-1,2,4-триазол-5-ил)гидразина карбоксилат (36) с выходом равным 12%. 1Н NMR (400 MHz, CD3OD) δ 1.2 (t, 3Н), 1.5 (s, 9Н), 3.6 (br s, 2Н), 7.7 (br s, 1H).
Стадия 6: Синтез 5-(1-этилгидразинил)-1Н-1,2,4-триазола гидрохлорида (37)
[00288] К перемешиваемому раствору MeOH⋅HCl (5 мл) добавляли трет.бутил-2-этил-2-(1Н-1,2,4-триазол-5-ил)гидразина карбоксилат (36) (40 мг, 0.17 ммоль) и полученную смесь перемешивали в течение 12 ч при комнатной температуре. После завершения реакции удаляли растворитель при пониженном давлении, промывали продукт два раза простым эфиром и высушивали при пониженном давлении, получая 5-(1-этилгидразинил)-1Н-1,2,4-триазола гидрохлорид (37) с выходом равным 75%. 1Н NMR (400 MHz, CD3OD) δ 1.2 (t, 3Н), 3.6 (q, 2Н), 8.5 (s, 1H), 10.2-10.4 (brs, 2Н). HPLC Степень чистоты: 90.89%; ESMS: 127.85 (М+).
Пример 32: Синтез 3-(1-метилгидразинил)-1,2,4-оксадиазол-5(4Н)-она гидрохлорида (42)
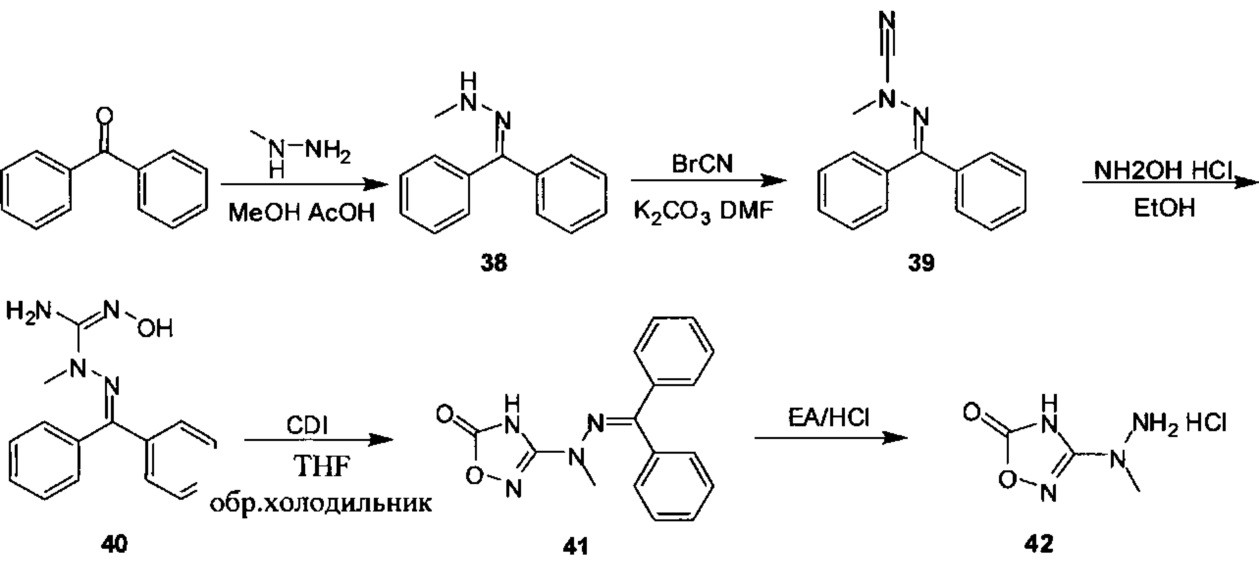
Стадия 1: Синтез 1-(дифенилметилен)-2-метилгидразина (38)
[00289] К раствору бензофенона (18 г, 100 ммоль) в МеОН (200 мл) и АсОН (200 мл) добавляли метилгидразин (12 мл, 100 ммоль) при 20°C. После перемешивания полученной смеси при температуре 70°C в течение 3 ч, смесь концентрировали и разбавляли этилацетатом (10 мл) и водой (15 мл). Затем отделяли органический слой. Водный слой промывали этилацетатом (10 мл × 2). Соединенные органические слои промывали рассолом, высушивали над Na2SO4, отфильтровывали и концентрировали при пониженном давлении с получением 1-(дифенилметилен)-2-метилгидразина (38) в виде масла белого цвета (10.5 г). LCMS (ESI): m/z 211.1 (М+1)+.
Стадия 2: Синтез 2-(дифенилметилен)-1-метилгидразина карбонитрила (39)
[00290] Смесь соединения 38 (10.5 г, 50 ммоль) и BrCN (5.3 г, 50 ммоль) в DMF (100 мл) нагревали до температуры 50°C, затем добавляли K2CO3 и перемешивали при 50°C в течение ночи. Добавляли EtOAc (250 мл) и полученный раствор промывали рассолом (250 мл × 3), высушивали над Na2SO4, отфильтровывали и концентрировали при пониженном давлении с получением остатка, который очищали методом флэш-хроматографии (РЕ/этилацетат = 20:1), получая соединение 39 (5 г) в виде твердого вещества белого цвета. 1Н NMR (400 MHz, CDCl3): δ 3.39 (s, 3 Н), 7.35-7.40 (m, 4 Н), 7.45-7.49 (m, 1 Н), 7.52-7.55 (m, 5 Н). LCMS (ESI): m/z 236 (M+1)+.
Стадия 3: Синтез (Z)-2-(дифенилметилен)-N'-гидрокси-1-метилгидразина карбоксимидамида (40)
[00291] Смесь соединения 39 (5.5 г, 20 ммоль), гидроксиламина гидрохлорида (2.2 г, 30 ммоль) и AcONa (3.2 г, 40 ммоль) в EtOH (80 мл) перемешивали в течение ночи при температуре 25°C. Удаляли растворители при пониженном давлении и добавляли этилацетат (100 мл), промывали водой и рассолом (100 мл), высушивали над Na2SO4 и концентрировали полученный продукт при пониженном давлении, получая соединение 40 (5.5 г) в виде твердого вещества желтого цвета. LCMS (ESI): m/z 269.1 (M+1)+.
Стадия 4: Синтез 3-(2-(дифенилметилен)-1-метилгидразинил)-1,2,4-оксадиазол-5(4Н)-она (41)
[00292] Смесь соединения 40 (5.5 г, 20 ммоль) и CDI (5 г, 30 ммоль) в THF (60 мл) перемешивали с обратным холодильником в течение 5 ч. Затем смесь охлаждали, концентрировали при пониженном давлении и очищали методом флэш-хроматографии (РЕ/этилацетат = 3:1) с получением соединения 41 (4 г) в виде твердого вещества желтого цвета. LCMS (ESI): m/z 295.1 (M+1)+.
Стадия 5: Синтез 3-(1-метилгидразинил)-1,2,4-оксадиазол-5(4Н)-она гидрохлорида (42)
[00293] К раствору соединения 41 (0.9 г, 9 ммоль) в этилацетате (10 мл) добавляли 4 М раствор HCl в этилацетате (15 мл), полученную смесь перемешивали при комнатной температуре в течение ночи. Затем эту смесь отфильтровывали, и твердый осадок промывали этилацетатом и МеОН, получая соль 3-(1-метилгидразинил)-1,2,4-оксадиазол-5(4Н)-она гидрохлорид (42) (0.25 г, 1.5 ммоль) в виде твердого вещества белого цвета. 1Н NMR (400 MHz, DMSC-d6): δ 3.07 (s, 3Н). LCMS (ESI): m/z 131.1 (M+1)+.
Пример 33: Синтез N-этил-1Н-тетразол-5-карбогидразида (46)
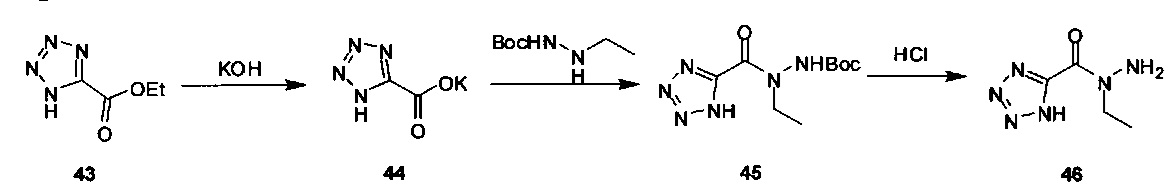
Стадия 1: Синтез 1Н-тетразол-5-карбоксилата калия (44)
[00294] К раствору соединения 43 (500 мг, 3.5 ммоль) в EtOH (10 мл) добавляли KOH (591 мг, 0.1 М). Полученную смесь перемешивали при комнатной температуре в течение 3 мин и затем отфильтровывали. Осадок промывали холодным EtOH и затем высушивали под вакуумом, получая соединение 44 (500 мг) в виде твердого вещества белого цвета. Полученное соединение использовали на следующей стадии без очистки.
Стадия 2: Синтез трет.бутил-2-этил-2-(1Н-тетразол-5-карбонил)гидразина карбоксилата (45)
[00295] К смеси соединения 44 (500 мг, 3.3 ммоль) и трет.бутил-2-этилгидразинилкарбоксилата (631 мг, 3.9 ммоль) в дихлорметане (20 мл) добавляли HOBT (533 мг, 3.9 ммоль) и EDCI (863 мг, 4.9 ммоль). Смесь перемешивали при комнатной температуре в течение 14 ч, промывали водой и затем концентрировали органический слой. Полученный остаток очищали методом HPLC (ВЭЖХ) с получением соединения 45 (220 мг) в виде масла. 1Н NMR (400 MHz, CDCl3): δ 1.32 (t, J=7.2 Hz, 3Н), 1.42 (s, 9Н), 3.84 (q, J=7.2 Hz, 2H), 7.56 (br. s, 1H).
Стадия 3: Синтез N-этил-1Н-тетразол-5-карбогидразида (46)
[00296] Смесь соединения 45 (220 мг) в 4 М смеси HCl/этилацетат (15 мл) перемешивали при комнатной температуре в течение 0.5 ч. Полученный раствор концентрировали, и твердый продукт промывали этилацетатом и отфильтровывали с получением N-этил-1H-тетразол-5-карбогидразида (46) (150 мг) в виде твердого продукта белого цвета. 1Н NMR (400 MHz, DMSO-d6): δ 1.15-1.33 (m, 3 H), 3.63 (m, 1 H), 4.04 (br. s., 1H). LCMS (ESI): m/z 157.1 [M+1]+.
Пример 34: Синтез 1-этил-1N-(1H-тетразол-5-ил)гидразина карбоксамида (49)
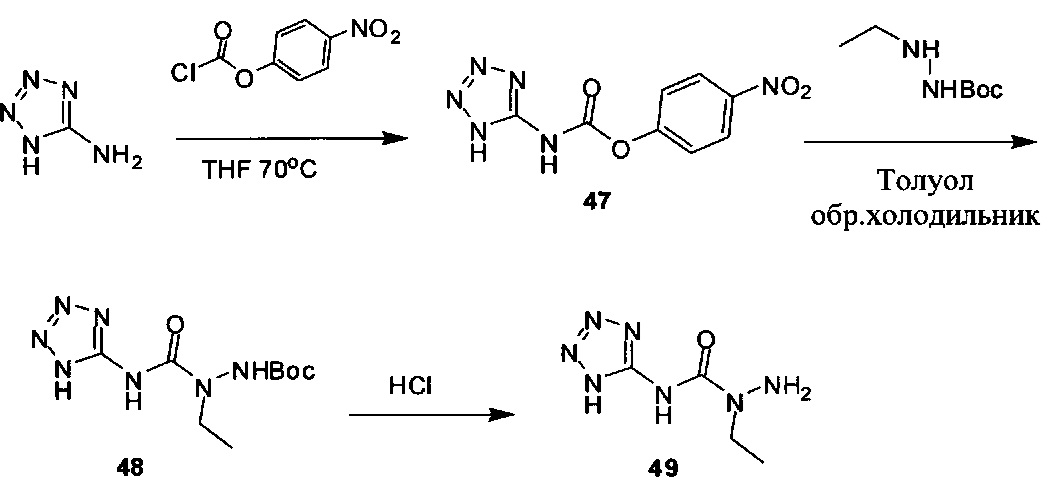
Стадия 1: Синтез 4-нитрофенил-1Н-тетразол-5-илкарбамата (47)
[00297] Смесь 2Н-тетразол-5-амина (100 мг, 1.18 ммоль) и 4-нитрофенилкарбонохлоридата (718.6 мг, 3.54 ммоль) в THF (20 мл) нагревали с обратным холодильником и перемешивали в течение 3 ч. Растворитель выпаривали и остаток очищали на хроматографической колонке с силикагелем (этилацетат/РЕ = 1:10) с получением соединения 47 (330 мг в виде твердого вещества белого цвета.
Стадия 2: Синтез трет.бутил-2-(1Н-тетразол-5-илкарбамоил)-2-этилгидразина карбоксилата (48)
[00298] Смесь соединения 47 (310 мг, 1.24 ммоль) и трет.бутил-2-этилгидразинкарбоксилата (294.1 мг, 1.86 ммоль) в толуоле (20 мл) нагревали и затем кипятили в течение 3 ч. Реакционный раствор охлаждали до комнатной температуры, промывали водой и концентрировали. Полученный остаток очищали методом препаративной ВЭЖХ с получением соединения 48 (193 мг) в виде масла.
Стадия 3: Синтез 1-этил-N-(1H-тетразол-5-ил)гидразина карбоксамида (49)
[00299] Соединение 48 (193 мг) в смеси 4N HCl-этилацетат (15 мл) перемешивали при комнатной температуре в течение 30 мин. Удаляли растворитель. Остаток промывали этилацетатом и отфильтровывали с получением соединения 1-этил-N-(1Н-тетразол-5-ил)гидразина карбоксамида (49) (100 мг) в виде твердого вещества белого цвета. 1Н NMR (400 MHz, D2O): δ 1.07 (t, J=7.2 Hz, 3H), 3.47 (q, J=7.2 Hz, 2H). LCMS (ESI): m/z 172.1 [M+1]+.
Пример 35: Синтез 1-этил-N-(фенилсульфонил)гидразина карбоксамида (54)
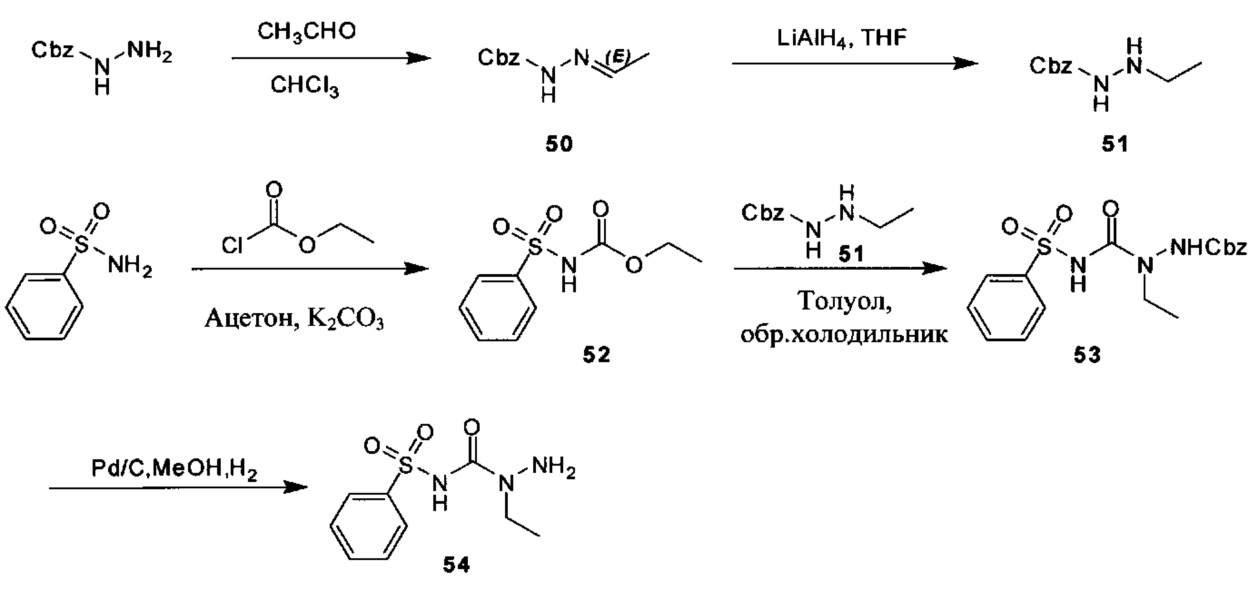
Стадия 1: Синтез (Е)-бензил-2-этилиденгидразина карбоксилата (50)
[00300] К смеси бензилгидразина карбоксилата (5 г, 30.08 ммоль), MgSO4 (5 г) в 30 мл CHCl3 добавляли безводный СН3СНО (2 г, 45.13 ммоль) при температуре 0°C. Эту смесь перемешивали при комнатной температуре в течение 2 ч, затем отфильтровывали и концентрировали, получали соединение 50 (5.9 г) в виде твердого вещества желтого цвета, которое использовали на следующей стадии без очистки.
Step 2: Синтез бензил-2-этилгидразина карбоксилата (51)
[00301] К смеси LiAlH4 (1.37 г, 36 ммоль) в 30 мл THF добавляли соединение 50 (5.9 г, сырой продукт, полученный на предыдущей стадии) в 40 мл THF при температуре 0°C в атмосфере азота, перемешивали в течение 1 ч при 0°C и затем в течение 1 ч при комнатной температуре. Затем по каплям добавляли воду (1.37 мл) с последующим добавлением 10% водного раствора NaOH (1.37 мл). Смесь отфильтровывали, концентрировали и затем остаток очищали методом флэш-хроматографии на силикагеле (элюентом служил 5%-50% РЕ в этилацетате), получали соединение 51 (3.5 г) в виде твердого вещества белого цвета. 1Н NMR (400 MHz, CDCl3): δ 1.08 (t, J=7.2 Hz, 3Н), 2.84-2.98 (m, 2Н), 3.63 (s, 1Н), 5.15 (s, 2Н), 6.60 (br. s, 1H), 7.30-7.44 (m, 5H).
Стадия 3: Синтез этилфенилсульфонилкарбамата (52)
[00302] Смесь соединения 51 (1.0 г, 6.36 ммоль), K2CO3 (2.2 г, 15.92 ммоль) в 50 мл ацетона и этилхлорформиат (4.04 г, 37.2 ммоль) в 5 мл ацетона перемешивали с обратным холодильником в течение 1 ч. Растворитель выпаривали и растворяли остаток в воде, подкисляли концентрированной HCl (pH=1) и два раза экстрагировали этилацетатом. Соединенные органические слои два раза промывали водой и концентрировали с получением соединения 52 (1.1 г) в виде бесцветного масла. 1H NMR (400 MHz, CDCl3): δ 1.23 (t, J=7.2 Hz, 3H), 4.13-4.20 (m, 2H), 7.56-7.62 (m, 2H), 7.64-7.71 (m, 1H), 7.86 (s, 1H), 8.06-8.09 (m, 2 H).
Стадия 4: Синтез бензил-2-этил-2-(фенилсульфонилкарбамоил)гидразина карбоксилата (53)
[00303] Смесь соединения 52 (704 мг, 3.07 ммоль) и соединения 51 (1.2 г, 6.14 ммоль) в 20 мл толуола перемешивали с обратным холодильником в течение ночи. Полученную смесь охлаждали, концентрировали, и остаток очищали методом флэш-хроматографии на колонке (элюент 5%-20% РЕ в этилацетате) с получением соединения 53 (569 мг) в виде твердого вещества белого цвета. 1Н NMR (400 MHz, CDCl3): δ 1.07 (t, J=7.2 Hz, 3H), 3.60 (br. s, 2H), 5.18 (s, 2H), 6.92 (s, 1H), 7.28 - 7.48 (m, 5H), 7.49-7.53 (m, 2H), 7.61-7.65 (m, 1H), 8.04 (d, J=7.6 Hz, 2H), 8.64 (br.s, 1H).
Стадия 5: Синтез 3-(1-метилгидразинил)-1,2,4-оксадиазол-5(4Н)-она гидрохлорида (название неправильное - см. заголовок примера и формулу на схеме) (54)
[00304] Смесь соединения 53 (400 мг, 1.06 ммоль) и Pd/C (0.2 г) в 40 мл МеОН перемешивали при комнатной температуре в течение 2 ч в атмосфере водорода (применяя баллон с водородом). Смесь отфильтровывали, концентрировали, и твердый продукт промывали смесью этилацетат/РЕ (1:1) с получением 1-этил-N-(фенилсульфонил)-гидразина карбоксамида (54) (100 мг) в виде твердого вещества белого цвета. 1Н NMR (400 MHz, DMSO-d6): δ 0.99 (t, J=7.2 Hz, 3Н), 3.25-3.35 (m, 3Н), 6.70 (br.s, 2 Н), 7.53-7.70 (m, 3Н), 7.90-7.95 (d, J=7.2 Hz, 2H). LCMS (ESI): m/z 244.0 [M+1]+.
Биологические эксперименты
[00305] Определение содержания H2S в печени. Содержание H2S в печени определяли следующим образом. Вкратце, этот метод заключается в получении гомогенатов печеночной ткани в 100 мМ калий-фосфатного буфера, рН 7.4, плюс 0.5% TR1ton-X100. Ферментативную реакцию проводили в 96-луночных микропланшетах с глубокими луками квадратной формы со стеклянными вставками объемом 700 мкл (Waters Corporation Cat. #186000349) с герметичными крышками из смеси TFE/силикон MicroMat (Sun-SRI Cat. #400026). Во внешнем отделении содержалась смесь для анализа объемом 200 мкл (конечная концентрация): L-цистеин, (5 мМ); пиридоксаль-5'-фосфат, (50 мкМ); калий-фосфатный буфер, pH 7.4, (100 мМ); и гомогенат ткани (500 мкг белка). Стеклянная вставка содержала 100 мкл щелочного раствора ацетата цинка (1% в 0.1N NaOH) для улавливания образовавшегося H2S. Реакционную смесь инкубировали при температуре 37°C в течение 3 ч и в конце реакции в стеклянную вставку добавляли 100 мкл N,N-диметил-п-фенилендиамина сульфата (20 мкМ в 7N HCl) и 100 мкл хлорного железа (30 мкМ в 1.2N HCl). Степень абсорбции измеряли при длине волны 671 нм, используя ридер для микропланшетов. Для определения концентрации H2S использовали стандартную кривую, отражающую концентрацию Na2S и степень абсорбции, величину концентрации выражали в нм H2S, образовавшегося в час, на мг белка.
Пример 1: In vitro анализ CSE
[00306] Испытуемые соединения (в виде исходных растворов в DMSO) добавляли к 20 мкг/мл (конечные концентрации) раствора фермента (человеческого, мышиного или крысиного рекомбинантного CSE) плюс 50 мкМ PLP в среде буфера для анализов (100 мМ фосфата калия, pH 7.6) в 96-луночных микропланшетах, общий объем раствора составлял 190 мкл. Инкубацию проводили в течение 30 мин при комнатной температуре перед добавлением в каждую лунку 10 мкл 200 мМ (20 × конечная концентрация в буфере для анализа) субстрата DL-гомоцистеина. Затем микропланшеты инкубировали при температуре 37°C в течение 3 часов. В каждую лунку добавляли 50 мкл 20 мМ DMPDA в 7.2N HCl с последующим добавлением 50 мкл 30 мМ FeCl3 в 1.2 N HCl. Микропланшеты инкубировали в течение 10 мин при встряхивании при комнатной температуре и затем определяли степень абсорбции при длине волны 671 нм с помощью ридера для микропланшетов Promega GloMax.
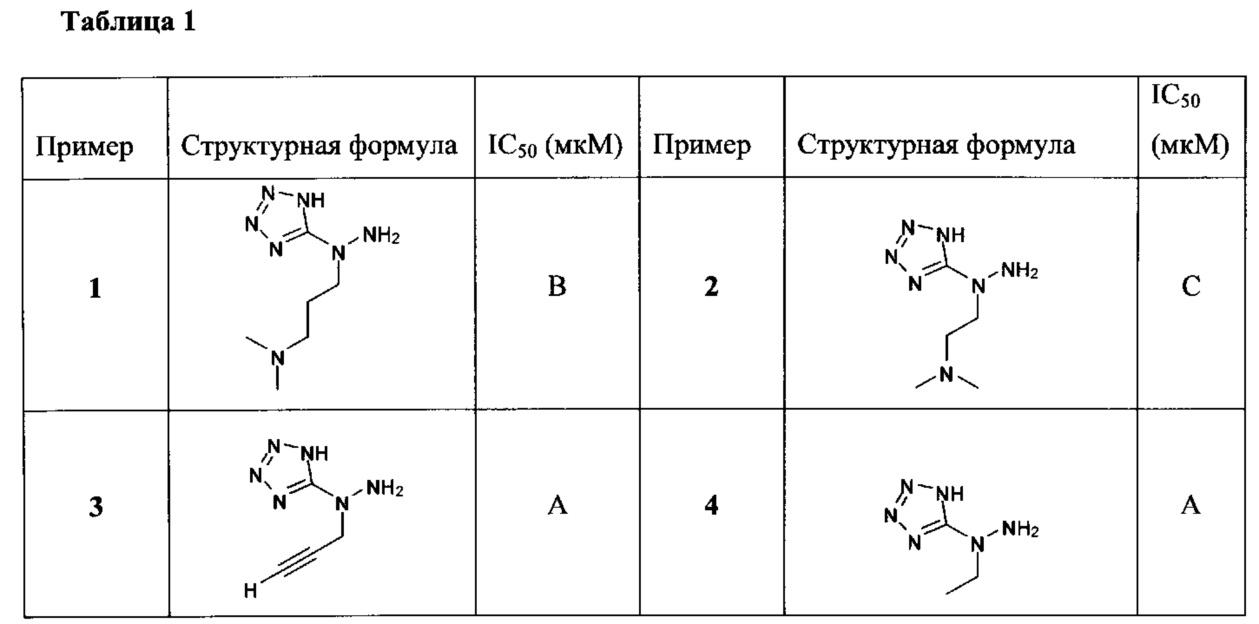
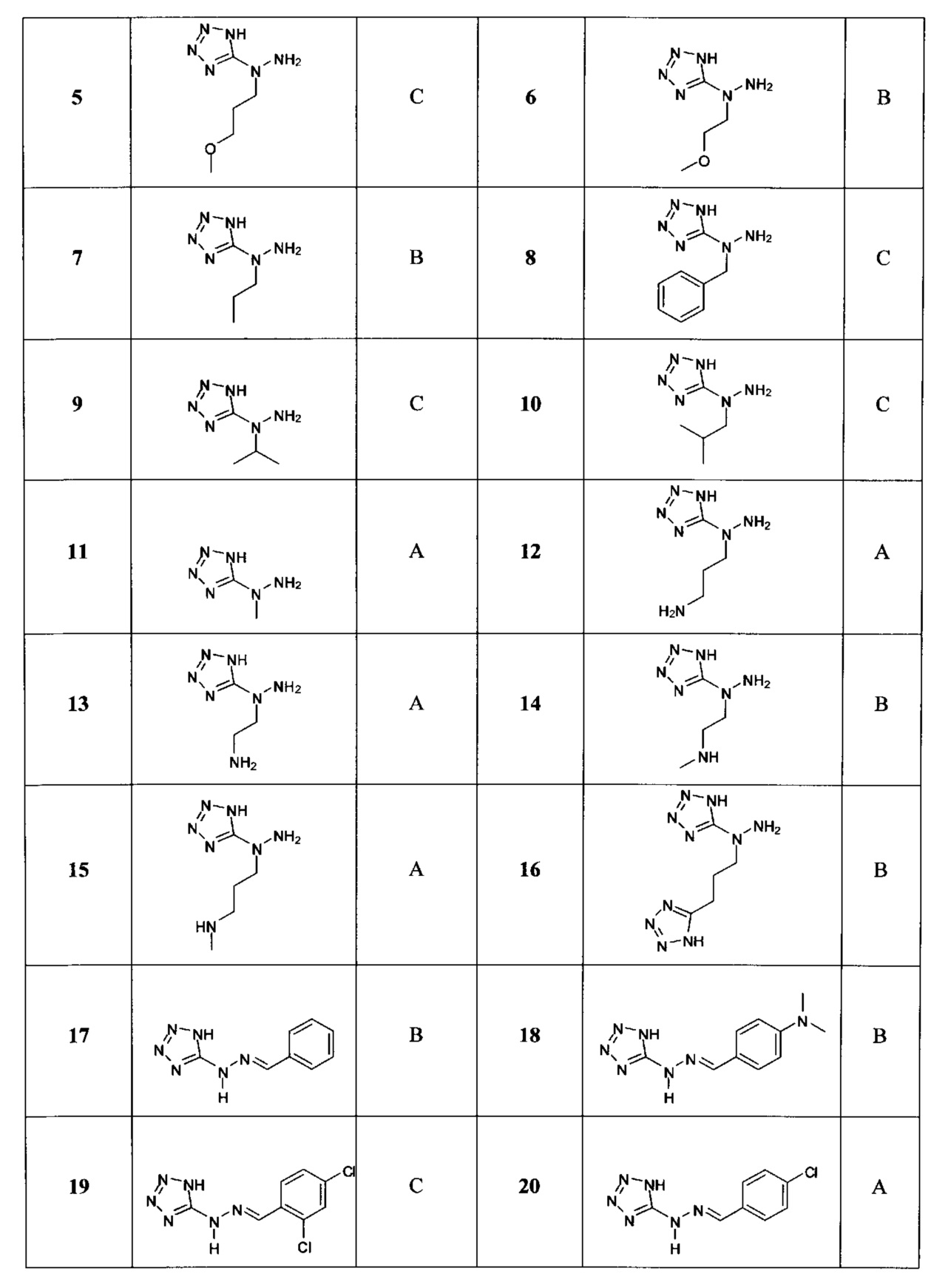
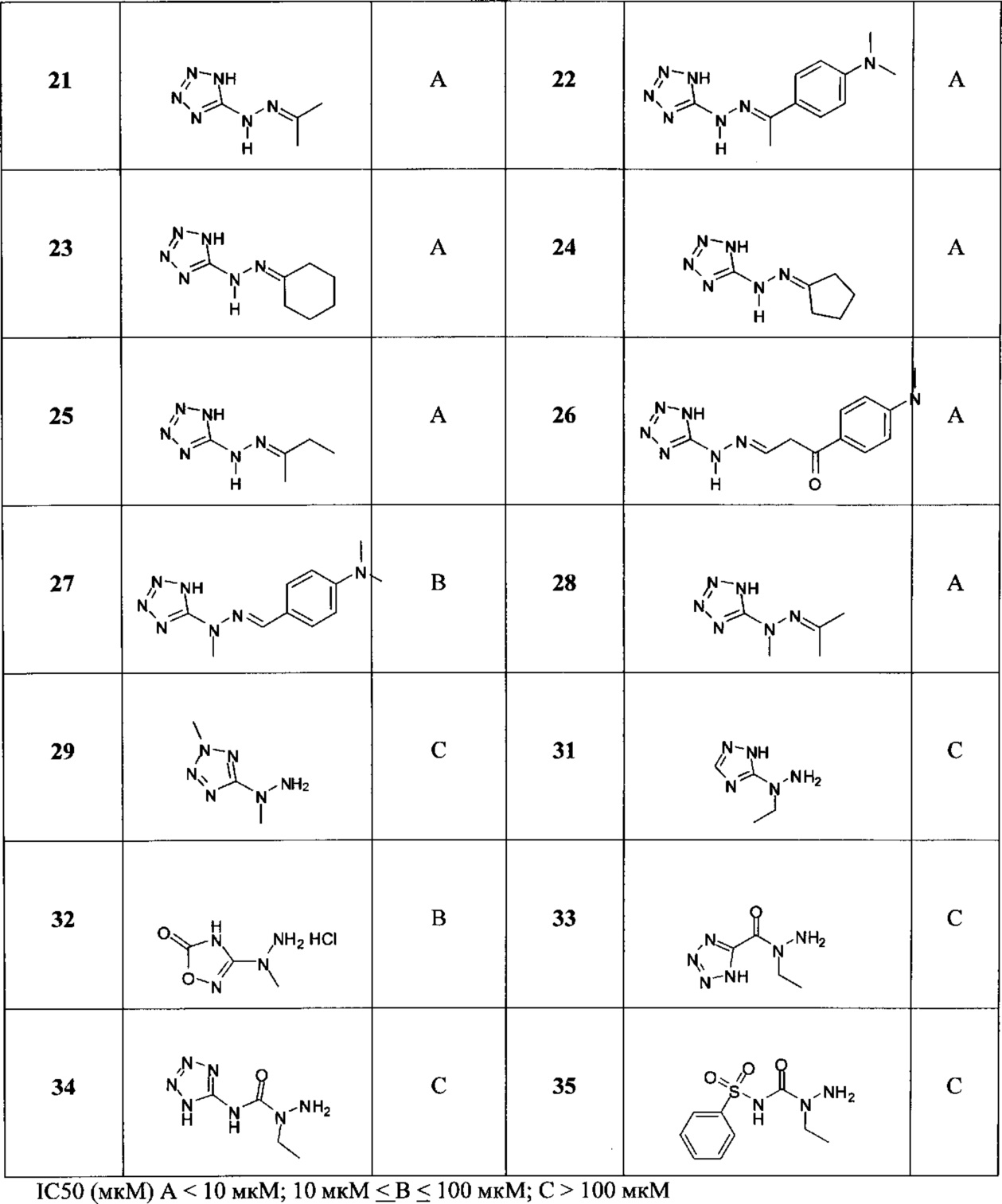

Пример 2: Модель острой постхирургической боли (по Бреннану) у крыс
[00307] Метод, который позволяет определить активность против гипералгезии у крыс с послеоперационной болью, описан в публикации Brennan et al (Pain, 64, 493-501, 1996).
[00308] Иссечение подошвенной стороны задней конечности у крыс связано с проявлениями гипералгезии, аллодинии и спонтанной боли, которая длится 3-4 дня, и, следовательно, представляет собой модель послеоперационной боли у людей. Средства против гипералгезии уменьшают проявление этих признаков гиперчувствительности к острой боли.
[00309] Крыс анестезировали изофураном и делали иссечение длиной 1 см в коже, оболочке мышцы и самой мышце с подошвенной стороны левой задней конечности, затем рану зашивали. После локального нанесения антибиотической помады крыс оставляли восстанавливаться.
[00310] Испытуемые соединения вводили за два часа до оценки боли (L-пропаргилглицин (L-PAG), 100 мг/кг IP (интраперитонеально); Соединение В (Соед. В), 30 мг/кг перорально; AMG-517; 3 мг/кг перорально). Соединение В представляет собой соединение Формулы I-VI. AMG-517 представляет собой N-[4-[[6-[4-(трифторметил)фенил]-4-пиримидинил]окси]-2-бензотиазолил]ацетамид.
Оценка термической гипералгезии: исследование подошвенной области
[00311] Для создания нагрева на приподнятое стеклянное основание помещали устройство (Ugo Basile, Reference: 7371), состоящее из отдельных акриловых боксов (18×11.5×14 см). Под заднюю лапу без иссечения и затем под иссеченную заднюю лапу помещали мобильный источник инфракрасного излучения (96±10 мВ/см2), затем автоматически регистрировали величину латентного периода отдергивания лап. Для предотвращения повреждения ткани источником нагрева, он автоматически выключался через 45 с.
Оценка тактильной гипералгезии: тест с давлением на лапы
[00312] Устройство состоит из пары больших тупых щипцов (длина 15 см; поверхность контакта: 7 мм×1.5 мм с гладкими концами), снабженных 2 тензодатчиками, соединенными с модифицированным электронным динамометром. Наконечники щипцов помещали вокруг задней лапы подопытного животного и рукой увеличивали прикладываемую силу до тех пор, пока крысы не начинали отдергивать лапу. Максимальная величина силы, прикладываемой к поврежденной лапе, записывалась автоматически и регистрировалась динамометром. Для предотвращения повреждения ткани силу ограничивали величиной в 1 кг. Эту процедуру выполняли 3 раза и определяли среднее значение нагрузки на каждую лапу.
Пример 3а: Модель нейропатической боли у крыс в результате хронической травматической компрессии (по Беннету)
[00313] Метод оценки активности против гипералгезии у крыс с нейропатической болью описан в публикации Bennett and Xie (Pain, 33, 87-107, 1988).
[00314] Хроническая травматическая компрессия (CCI) седалищного нерва у крыс связана с проявлениями гипералгезии, аллодинии и спонтанной боли, и, следовательно, является моделью периферической нейропатической боли у людей. Средства против гипералгезии уменьшают проявление этих хронических признаков гиперчувствительности к боли.
[00315] Крыс анестезировали (пентобарбиталом натрия, 40 мг/кг, интраперитонеально (и.п.)) и делали иссечение в середине бедра для обнажения левого седалищного нерва. Проводили свободное наложение четырех лигатур вокруг седалищного нерва на расстоянии 1 мм друг от друга. Затем зашивали рану. Крысам проводили подкожную инъекцию Duphamox LA® и оставляли для адаптации.
[00316] Испытуемые соединения вводили за два часа до оценки боли (L-пропаргилглицин (L-PAG), 100 мг/кг и.п.; Соединение А (Соед. А), 30 мг/кг перорально; AMG-517; 3 мг/кг перорально). Соединение А представляло собой 5-(1-этилгидразинил)-1Н-тетразол.
Оценка тактильной аллодинии: тест с помощью электронной головки фон Фрея
[00317] Для тактильной стимуляции животное помещали под перевернутый акриловый бокс (18×11.5×14 см) на решетчатый настил. Наконечник электронной головки фон Фрея прикладывали с возрастающей силой к поврежденной лапе (2 задние лапы для предварительного теста) и автоматически регистрировали величину силы, которая требуется для индуцирования отдергивания лапы. Эту процедуру выполняли 3 раза и определяли среднее значение нагрузки на каждую лапу (см. Фигуру 1).
Оценка термической гипералгезии: исследование подошвенной области
[00318] Для применения нагрева на приподнятое стеклянное основание помещали устройство, состоящее из отдельных акриловых боксов (18×11.5×14 см). В бокс помещали крысу и оставляли для адаптации на 10 мин. Под иссеченную заднюю лапу помещали мобильный источник инфракрасного излучения, автоматически регистрировали величину латентного периода отдергивания лап.Для предотвращения повреждения ткани источником нагрева, он автоматически выключался через 45 с (см. Фигуру 2).
Оценка тактильной гипералгезии: тест с давлением на лапы
[00319] Устройство состоит из пары больших тупых щипцов (длина 15 см; поверхность контакта: 7 мм×1.5 мм с гладкими концами), снабженных 2 тензодатчиками, соединенными с модифицированным электронным динамометром. Наконечники щипцов помещали вокруг задней лапы подопытного животного и рукой увеличивали прикладываемую силу до тех пор, пока крысы не начинали отдергивать лапу. Максимальная величина силы, прикладываемой к поврежденной лапе, записывалась автоматически и регистрировалась динамометром. Для предотвращения повреждения ткани силу ограничивали величиной в 1 кг. Эту процедуру выполняли 3 раза и определяли среднее значение нагрузки на каждую лапу.
Пример 3б: Модель нейропатической боли у крыс в результате хронической травматической компрессии (по Беннету)
[00320] Метод оценки активности против гипералгезии у крыс с нейропатической болью описан в публикации Bennett and Xie (Pain, 33, 87-107, 1988).
[00321] Хроническая травматическая компрессия (CCI) седалищного нерва у крыс связана с проявлениями гипералгезии, аллодинии и спонтанной боли, и, следовательно, является моделью периферической нейропатической боли у людей. Средства против гипералгезии уменьшают проявление этих хронических признаков гиперчувствительности к боли.
[00322] Крыс анестезировали (при помощи 2,5% изофурана) и делали иссечение в середине бедра для обнажения левого седалищного нерва через бицепсы ямки под бедренной костью. Проводили свободное наложение четырех лигатур из хромированного кетгута вокруг седалищного нерва на расстоянии 1 мм друг от друга. Затем зашивали рану. Крысам проводили подкожную инъекцию амоксициллина и оставляли для адаптации.
[00323] Испытуемые соединения вводили за один или два часа до оценки боли. Вводили Соединение А (Соед. А), 1, 3, 10 мг/кг перорально за 2 ч до теста; габапентин; 300 мг/кг перорально за 1 час до теста). Соединение А представляло собой 5-(1-этилгидразинил)-1Н-тетразол.
Оценка тактильной аллодинии: тест с помощью электронной головки фон Фрея
[00324] Для тактильной стимуляции животное помещали под перевернутый акриловый бокс (18×11.5×14 см) на решетчатый настил. Наконечник электронной головки фон Фрея прикладывали с возрастающей силой к поврежденной лапе и автоматически регистрировали величину силы, которая требуется для индуцирования отдергивания лапы. Эту процедуру выполняли 5 раз и определяли среднее значение нагрузки на каждую лапу (см. Фигуру 6).
Пример 4а: Модель хронической воспалительной боли у крыс (с применением адъювантов по Фрейнду)
[00325] Метод определения обезболивающей/противовоспалительной активности у крыс, страдающих от острого воспаления, описан в публикации Butler et al (Pain, 48, 73-81, 1992).
[00326] Внутриподошвенная инъекция адъювантов Фрейнда крысам приводила к появлению клинических признаков воспаления, сопровождающегося болью.
[00327] За день до тестирования крыс взвешивали и делали им инъекцию суспензии Mycobacterium butyricum (адъювант Фрейнда) в подошвенную область одной задней лапы (0.1 мг в 0.01 мл парафинового масла, 18 мкл). В другую заднюю лапу делали инъекцию соответствующего объема физиологического раствора.
[00328] Испытуемые соединения вводили за 2 ч до начала оценки боли (L-PAG, 100 мг/кг, и.п.; Соединение А (Соед. А), 30 мг/кг, перорально; AMG-517; 3 мг/кг, перорально). Соединение А представляло собой 5-(1-этилгидразинил)-1Н-тетразол.
Оценка тактильной аллодинии: тест с помощью электронной головки фон Фрея
[00329] Для тактильной стимуляции животное помещали под перевернутый акриловый бокс (18×11.5×14 см) на решетчатый настил. Наконечник электронной головки фон Фрея прикладывали с возрастающей силой к поврежденной лапе (к 2 задним лапам для предварительного теста) и автоматически регистрировали величину силы, которая требуется для индуцирования отдергивания лапы. Эту процедуру выполняли 3 раза и определяли среднее значение нагрузки на каждую лапу (см. Фигуру 4).
Оценка термической гипералгезии
[00330] Для применения нагрева на приподнятое стеклянное основание помещали устройство, состоящее из отдельных акриловых боксов (18×11.5×14 см). В бокс помещали крысу и оставляли для адаптации на 10 мин. Помещали мобильный источник инфракрасного излучения сначала под невоспаленную заднюю лапу и затем под воспаленную заднюю лапу и автоматически регистрировали величину латентного периода отдергивания лап. Для предотвращения повреждения ткани источником нагрева, он автоматически выключался через 45 с (см. Фигуру 5).
Пример 4б: Модель хронической воспалительной боли у крыс (с применением адъювантов по Фрейнду)
[00331] Метод определения обезболивающей/противовоспалительной активности у крыс, страдающих от острого воспаления, описан в публикации Butler et al (Pain, 48, 73-81, 1992).
[00332] Внутриподошвенная инъекция адъювантов Фрейнда крысам приводила к появлению клинических признаков воспаления с болью.
[00333] За день до тестирования крыс взвешивали и делали им инъекцию суспензии Mycobacterium butyricum (адъювант Фрейнда) в подошвенную область одной задней лапы (0.1 мг в 0.01 мл парафинового масла, 18 мкл).
[00334] Испытуемые соединения вводили за 2 ч до начала оценки боли. Соединение А (Соед.А), 1, 3, 10 мг/кг перорально; напроксен; 30 мг/кг, перорально). Соединение А представляло собой 5-(1-этилгидразинил)-1Н-тетразол.
Оценка тактильной аллодинии: тест с помощью электронной головки фон Фрея
[00335] Для тактильной стимуляции животное помещали под перевернутый акриловый бокс (18×11.5×14 см) на решетчатый настил. Наконечник электронной головки фон Фрея прикладывали с возрастающей силой к поврежденной лапе (2 задние лапы для предварительного теста) и автоматически регистрировали величину силы, которая требуется для индуцирования отдергивания лапы. Эту процедуру выполняли 3 раза и определяли среднее значение нагрузки на каждую лапу (см. Фигуру 7).
Пример 5: Модель артритной боли у крыс (с применением мононатрия йодацетата (MIA))
[00336] Используемый способ, позволяющий оценить обезболивающую/ противовоспалительную активность у крыс после индукции остеоартрита, описан в публикации Guingamp et al (Arthritis & Rheumatism, 40(9): 1670-9, 1997).
[00337] Внутрисуставная инъекция мононатрия йодацетата крысам приводила к появлению клинических признаков воспалительной боли, вызванной остеоартритом.
[00338] За день до тестирования крыс взвешивали и делали им инъекцию мононатрия йодацетата в суставное пространство одного колена (задней конечности) (2 мг в 0.04 мл физиологического раствора).
[00339] Испытуемые соединения вводили за 2 ч до начала оценки боли. Соединение А (Соед. А), 1, 3, 10 мг/кг перорально; габапентин; 300 мг/кг, перорально). Соединение А представляло собой 5-(1-этилгидразинил)-1Н-тетразол.
Оценка тактильной аллодинии: тест с помощью электронной головки фон Фрея
[00340] Для тактильной стимуляции животное помещали под перевернутый акриловый бокс (18×11.5×14 см) на решетчатый настил. Наконечник электронной головки фон Фрея прикладывали с возрастающей силой к поврежденной лапе и неповрежденной лапе и автоматически регистрировали величину силы, которая требуется для индуцирования отдергивания лапы. Эту процедуру выполняли 3 раза и определяли среднее значение разницы в нагрузке на каждую лапу (см. Фигуру 8).
Пример 6: Определение ингибирования CSE in vivo
Попадание в мишень
[00341] Для оценки in vivo ингибирования CSE самцам крыс Sprague Dawley (весом примерно 300 г) вводили перорально 0.1, 0.3, 1, 3 мг/кг Соединения А (Соединение А представляло собой 5-(1-этилгидразинил)-1Н-тетразол или носитель (20% HPβCD в воде). Через два часа после дозирования животных анестезировали с помощью изофурана и удаляли примерно 1 г печеночной ткани, быстро промывали ее в ледяном физиологическом растворе и гомогенизировали в ледяном буфере для анализа (100 мМ фосфата калия, pH 7.6) плюс 0.5% Triton Х-100 при помощи прибора BioSpec Products Tissue-Tearor. Образцы центрифугировали в течение 30 мин при температуре 4°C со скоростью 20,000×G и удаляли супернатант (надосадочную жидкость). Белок определяли методом ВСА (Pierce) (с применением бицинхониновой кислоты) с помощью BSA (бычьего сывороточного альбумина) в качеств стандарта.
[00342] Наличие ингибирования CSE-опосредованного образования H2S из цистеина определяли путем инкубации 200 мкг белка в гомогенате печени в буфере для анализа (100 мМ фосфата калия, рН 7.6) плюс 10 мМ L-цистеина и 50 мкМ пиридоксаль-5'-фосфата (конечный объем 200 мкл) в течение 3 ч при температуре 37°C во внешнем пространстве 96-луночного микропланшета с глубокими лунками, содержащего стеклянные вставки (Waters #186000349) со 100 мкл улавливающего раствора (1% щелочного ацетата цинка в 0.2 N NaOH) для улавливания выделившегося H2S, герметизацию планшета осуществляли герметизирующей пленкой из TFE/силикона (Sun SRI #400026). Реакцию останавливали и определяли наличие образовавшегося H2S, добавляя 100 мкл 20 мМ N,N-диметил-п-фенилендиамина сульфата в 7.2 N HCl и затем 100 мкл 30 мМ FeCl3•6H2O в 1.2 N HCl. После перемешивания в течение 20 мин при комнатной температуре 200 мкл этого раствора переносили в лунки стандартного 96-луночного прозрачного планшета для анализа с прозрачными лунками и измеряли степень абсорбции при длине волны 671 нм, применяя ридер для микропланшетов SpectraMax (Molecular Devices). Результаты нормализовали до контрольного уровня в отсутствие лизата (см. Фигуру 9).
Продолжительность действия ингибиторов
[00343] Для оценки продолжительности in vivo ингибиторов CSE самцам крыс линии Sprague Dawley (весом около 300 г) вводили перорально 3 мг/кг Соединения А (Соединение А представляло собой 5-(1-этилгидразинил)-1Н-тетразол или носитель (20% раствор HPβCD в воде). Через 2, 24, 48, 72 или 96 часов после дозирования животных анестезировали изофураном и удаляли примерно 1 г печеночной ткани, быстро промывали ее в ледяном физиологическом растворе и гомогенизировали в ледяном буфере для анализа (100 мМ фосфата калия, pH 7.6) плюс 0.5% Triton Х-100, используя прибор BioSpec Products Tissue-Tearor. Затем образцы центрифугировали в течение 30 мин при температуре 4°C и при скорости 20,000×G и удаляли супернатант.Наличие белка определяли методом анализа Pierce BCA (Pierce), использую в качестве стандарта BSA.
[00344] Наличие ингибирования CSE-опосредованного образования H2S из цистеина определяли путем инкубации 200 мкг белка гомогената печени в буфере для анализа (100 мМ фосфата калия, pH 7.6) плюс 10 мМ L-цистеина и 50 мкМ пиридоксаль-5'-фосфата (конечный объем составлял 200 мкл) в течение 3 ч при температуре 37°C во внешнем пространстве 96-луночного микропланшета с глубокими лунками, содержащего стеклянные вставки (Waters #186000349) со 100 мкл улавливающего раствора (1% щелочного ацетата цинка в 0.2 N NaOH) для улавливания выделившегося H2S, герметизацию планшета осуществляли герметизирующей пленкой из TFE/силикона (Sun SRI #400026). Затем останавливали реакцию и определяли наличие образовавшегося H2S, добавляя 100 мкл 20 мМ N,N-диметил-п-фенилендиамина сульфата в 7.2 N HCl и затем 100 мкл 30 мМ FeCl•6H2O в 1.2 N HCl. После перемешивания в течение 20 мин при комнатной температуре, 200 мкл этого раствора переносили в лунки стандартного 96-луночногой планшета для анализа, который имел прозрачное дно, и измеряли степень абсорбции при длине волны 671 нм, применяя ридер для микропланшетов SpectraMax (Molecular Devices). Результаты нормализовали до контрольного уровня в отсутствие лизата (см. Фигуру 10).
Пример 7: Тест для оценки эффективности, безопасности и переносимости Соединения Формулы (I), (II), (III), (IV), (V) или (VI) у пациентов с нейропатической болью (в результате постгерпетической невралгии и посттравматической невралгии)
[00345] Цель данного исследования состояла в оценке безопасности и эффективности ингибитора CSE при лечении нейропатической боли, от умеренной до сильной, у пациентов с диагнозом постгерпетической невралгии и посттравматической невралгии.

[00346] Тип исследования: интервенционный
[00347] План исследования:
[00348] Распределение: рандомизированное
[00349] Классификация ожидаемого результата: безопасность/эффективность
[00350] Модель исследования: в параллельных группах
[00351] Маскирование: двойной слепой метод (субъект, исследователь)
[00352] Основная цель: лечение
[00353] Основные критерии эффективности:
[00354] Вечерняя ежедневная оценка средней интенсивности боли [временной интервал: исходное состояние (за 7 дней до рандомизации) и последние 7 дней 12-недельной фазы лечения]
[Определение вопроса безопасности: нет]
[00355] Вторичные критерии эффективности:
[00356] Самая сильная боль [временной интервал: ежедневно в течение 12 нед]
[Проблема безопасности: нет]
[00357] Краткая оценка боли [временной интервал: до 13 нед (то есть, во время визитов в дни 1, 3, 7, 8, 9)] [Проблема безопасности: нет]
[00358] Оценка симптомов нейропатической боли [временной интервал: до 13 нед (то есть, во время визитов в дни 1, 3, 7, 8, 9)] [Проблема безопасности: нет]
[00359] Общее впечатление пациента об изменениях [временной интервал: до 13 нед (то есть, во время визитов в дни 1, 3, 7, 8, 9)] [Проблема безопасности: нет]

[00360] Подробное описание:
[00361] Настоящее исследование было рандомизированным (испытуемые лекарства назначалось случайно), двойным слепым (ни клиницист, ни пациент не знали названия назначенного лекарства), плацебо-контролируемым с целью определения оптимальной дозы при оценке эффективности, безопасности и переносимости соединения Формулы (I), (II), (III), (IV), (V) или (VI) у пациентов с постгерпетической невралгией и посттравматической невралгией, с последующим двойным слепым продлением открытого исследования (клиницист и пациент знают название испытуемого лекарства). Это исследование проводят для оценки безопасности и эффективности соединения Формулы (I), (II), (III), (IV), (V) или (VI) при лечении пациентов от нейропатической боли, от умеренной до сильной, которая не контролируется со стандартной или без стандартной терапии боли, у которых поставлен диагноз постгерпетической невралгии (PHN) или посттравматической невралгии. Общая продолжительность исследования составляла примерно 130 нед (а именно, включала фазу скрининга, 12-недельную фазу двойного слепого определения эффективности, фазу двойного слепого продления и фазу открытого исследования безопасности). Во время 12-недельного лечения и 40-недельного двойного слепого продленного исследования пациенты с PHN получали плацебо, соединение Формулы (I), (II), (III), (IV), (V) или (VI) в количестве 1, 3 или 10 мг и пациенты с посттравматической невралгией получали плацебо или 10 мг соединения Формулы (I), (II), (III), (IV), (V) или (VI); все дозы были однократными, вводимыми путем подкожной (под кожу) (SC) инъекции в течение 28 дн. Во время 52-недельной фазы открытого продленного исследования все пациенты получали однократную SC (подкожную) инъекцию соединения Формулы (I), (II), (III), (IV), (V) или (VI) с дозой до 10 мг каждые 4, 8 или 12 нед.
[00362] Отбор
[00363] Возраст отобранных для исследования пациентов: от 18 лет до 80 лет
[00364] Пол отобранных пациентов: оба
[00365] Наличие клинически отобранных добровольцев: нет
[00366] Критерии включения:
[00367] Пациенты с диагнозом "постгерпетическая невралгия или посттравматическая невралгия", у которых наблюдалась хроническая нейропатическая боль (устойчивая боль в течение периода >6 мес), которая была от умеренной до сильной; постоянный прием лекарственных веществ, но без адекватного контроля при помощи стандарта лечения или пациенты, не принимавшие к моменту исследования препараты из-за их непереносимости, или не желавшие применять стандарт лечения.
[00368] Критерии исключения:
[00369] Наличие медицинской истории другого болевого состояния (например, при наличии остеоартрита суставов), которое являлось более серьезным, чем боль при наличии PHN или посттравматической невралгии.
[00370] Пациенты с посттравматической невралгией, для которой характерным является комплексный регионарный болевой синдром типа I.
[00371] Пациенты с люмбо-сакральной радикулопатией, у которых не удалась операция на пояснице, или с повреждением опорно-двигательного аппарата.
[00372] Пациенты, у которых ожидалось восстановление после повреждения нерва в результате травмы или прекращение невралгии в течение следующих 4 мес.
[00373] Пациенты, у которых доказано наличие другого вида нейропатической боли не в стадии исследования, такого как боль в результате диабетической болевой нейропатии, сенсорной нейропатии или боли, вызванной облучением, химиотерапией, злоупотреблением алкоголем, наличием ВИЧ.
[00374] Наличие периферической нейропатии, парестезии или дистезии, или любого другого ранее диагностированного неврологического состояния, которое вызывает указанные выше симптомы, которые не связаны с PHN или посттравматической невралгией в стадии исследования.
[00375] Женщины, которые были беременны.
[00376] Наличие медицинской истории другого болевого состояния (например, при наличии остеоартрита суставов), которое являлось более серьезным, чем боль при наличии PHN или посттравматической невралгии; пациенты с посттравматической невралгией, для которой характерным является комплексный регионарный болевой синдром типа I; пациенты с люмбо-сакральной радикулопатией, которым не удалась операция на пояснице, или с повреждением опорно-двигательного аппарата; пациенты, у которых ожидалось восстановление после повреждения нерва в результате травмы или прекращение невралгии в течение следующих 4 мес; пациенты, у которых доказано наличие другого вида нейропатической боли не в стадии исследования, такого как боль в результате диабетической болевой нейропатии, сенсорной нейропатии или боли, вызванной облучением, химиотерапией, злоупотреблением алкоголем, наличия ВИЧ; наличие периферической нейропатии, парестезии или дистезии, или любого другого ранее диагностированного неврологического состояния, которое вызвает указанные выше симптомы, которые не связаны с PHN или посттравматической невралгией в стадии исследования; женщины, которые были беременны или кормили грудью; пациенты с диабетом I или II типов.
Пример 8: Сравнение эффективности и безопасности Соединения Формулы (I), (II), (III), (IV), (V) или (VI) с действием плацебо у пациентов с диабетической нейропатической болью
[00377] Цель исследования: оценка безопасности и эффективности Соединения Формулы (I), (II), (III), (IV), (V) или (VI) по сравнению с действием плацебо у пациентов с диабетической нейропатической болью. У пациентов, больных диабетом, со временем может развиться повреждение нервов во всем организме с такими симптомами как боль, покалывание или онемение (потеря чувствительности) рук, ладоней, ног и ступней.

[00378] Тип исследования: интервенционный
[00379] План исследования:
[00380] Распределение: рандомизированное
[00381] Классификация ожидаемого результата: безопасность/эффективность
[00382] Модель исследования: в параллельных группах
[00383] Маскирование: двойной слепой метод (субъект, лицо, ухаживающее за пациентом, исследователь)
[00384] Основная цель: лечение
[00385] Основные критерии эффективности:
[00386] Оценка по шкале выраженности боли каждые 24 ч [временной интервал: 12 нед] [Проблема безопасности: нет].
[00387] Каждые 24 ч определение среднего значения по количественной 11-балльной шкале боли, которое записывается ежедневно пациентом в опроснике.
[00388] Вторичные критерии эффективности:
[00389] Определение наличия симптомов нейропатической боли [временной интервал: 12 нед] [Проблема безопасности: нет].
[00390] Определение степени серьезности нейропатической боли (жжение, чувство давления, сжимающая боль).
[00391] Общая оценка изменений пациентом [временной интервал: 12 нед] [Проблема безопасности: нет].
[00392] Регистрация оценки пациента (его/ее), общего впечатления от ощущения с момента начала приема препарата.
[00393] Краткая оценка боли [временной интервал: 12 нед] [Проблема безопасности: нет].
[00394] Сбор данных о степени серьезности болевых ощущений и о вмешательстве.
[00395] Влияние нейропатической боли на качество жизни, записываемое в опроснике [временной интервал: 12 нед] [Проблема безопасности: нет].
[00396] Регистрация оценки пациентом степени нейропатической болим и степени ее действия на качество жизни.
[00397] Оценка по опроснику Еврокачества жизни EuroQuality of Life - 5 Dimension -5 Level [временной интервал: 12 нед] [Проблема безопасности: нет].
[00398] Регистрация подвижности, самообслуживания, обычной активности, ощущения боли/дискомфорта и беспокойства/депрессии


[00399] Отбор
[00400] Возраст отобранных для исследования пациентов: от 18 лет до 75 лет
[00401] Пол отобранных пациентов: оба
[00402] Наличие клинически отобранных добровольцев: нет
[00403] Критерии включения
[00404] Пациент в возрасте от 18 до 75 лет, у которого диагностирован сахарный диабет и у которого должны быть диагностированы болезненная дистальная симметричная диабетическая полинейропатия, с наличием постоянной боли вследствие диабетической периферической нейропатии по меньшей мере в течение 6 мес.
[00405] До основного визита субъект должен иметь среднюю величину балла более 4 по 24-часовой шкале боли (баллы от 0 до 10).
[00406] Субъект принимал лекарственное средство от диабетической нейропатической боли в течение последних 3 мес.
[00407] Критерии исключения
[00408] Субъект, который по клинической оценке страдал от симптоматической нейропатической боли, которую нельзя отличить от диабетической нейропатической боли или которая мешает оценке диабетической нейропатической боли.
[00409] Субъект, у которого впервые выявили клинически значимые медицинские нарушения или психические расстройства или который страдает от этих расстройств, что мешает участию в исследовании и помешает оценке диабетической нейропатической боли или других функций.
[00410] Субъект имел клинически значимые аномалии в результатах лабораторных анализов.
[00411] Субъект принимал постоянное наркотик за исключением трамадола в течение последних 3 мес до проведения скрининга.
[00412] Хотя в данной заявке были показаны и описаны предпочтительные варианты настоящего изобретения, специалистам в данной области очевидно, что такие варианты являются только примерами. Специалистам в данной области ясно, что, не выходя за рамки данного изобретения, можно осуществить различные изменения и замены. Следует иметь в виду, что различные альтернативы вариантов данного изобретения, описанных в данной заявке, могут быть применены в практике осуществления настоящего изобретения. Следующая ниже формула изобретения определяет объем настоящего изобретения, и она охватывает способы и соединения в объеме этой формулы изобретения и их эквиваленты.