Результат интеллектуальной деятельности: СПОСОБ РЕГУЛИРОВАНИЯ КЛУБНЕОБРАЗОВАНИЯ И ПРОДУКТИВНОСТИ РАСТЕНИЙ КАРТОФЕЛЯ В УСЛОВИЯХ ГИДРОПОНИКИ
Вид РИД
Изобретение
Изобретение относится к области сельского хозяйства, а именно к картофелеводству и семеноводству, является экологически безопасным биотехнологическим способом повышения клубнеобразования и продуктивности растений картофеля в условиях гидропоники закрытого грунта и может быть использовано при получении оздоровленного семенного материала картофеля.
В последнее время происходит снижение урожайности важнейшей продовольственной культуры – картофеля. Прежде всего, это обусловлено неблагоприятно сложившимися фитопатологическими особенностями регионов возделывания этой культуры и, следовательно, с утратой качественного семенного материала. В связи с чем, получение оздоровленного (освобожденного от инфекции) семенного материала является первостепенной задачей для сельхозпроизводителей. Решение данного вопроса позволит, с одной стороны, увеличить продуктивность почвенной культуры картофеля, с другой стороны, улучшить качество сырья для пищевой, животноводческой и технической сфер. Потребность в таком семенном материале исключительно высока, т.к. получение новых сортов, устойчивых к изменяющимся фитопатогенным условиям, трудоемко и длительно, требует больших финансовых затрат. Экономически выгодным и не требующим больших временных затрат способом является использование эффективных экологически безопасных технологий для повышения продуктивности и урожая растений картофеля.
Одним из широко распространенных способов выращивания картофеля является гидропоника. Преимущество гидропонного культивирования растений перед субстратным неоспоримо, поскольку использование твердого субстрата (почва, торф, ионообменные смолы и др.) при выращивании растений требует в последующем проведения его замены (удаление загрязненного грунта в отвалы или его утилизацию, доставку или производство нового субстрата) или дополнительной его дезинфекцией. Применение химических антисептиков ухудшает качество сельскохозяйственной продукции. В случае гидропоники обновляется только водный питательный раствор, во внешнюю среду удаляется сильно разведенная отработанная питательная среда. Другим преимуществом является то, что гидропонное культивирование позволяет изолировать растения от контакта с почвенными патогенами и обеспечивает защиту получаемого семенного материала от заражения.
Известна индукция цветения и клубнеобразования, которую осуществляют за счет изменения питательной среды, температуры, режима освещения в биотехнологическом модуле «КД-10» (картофельное дерево) селекционно-генетического центра «Дока Джин» (http://dokagene.ru). Модуль имеет полезную площадь 10 м2 и может быть использован как в научных, так и в производственных целях.
Регуляцию клубнеобразования в растительном организме выполняют эндогенные ростовые вещества – фитогормоны. Так, жасмоновая кислота и ее производные стимулируют образование и рост клубней, экзогенная абсцизовая кислота (АБК) стимулирует клубнеобразование и уменьшает длину столонов. Среды, содержащие индолил-3-уксусную кислоту (ИУК), тормозят удлинение столонов и способствуют образованию небольших сидячих клубней. Доказано активное участие цитокининов (ЦК) в процессах, связанных с усилением акцепторной активности клубней в процессе их роста. Совместное действие фитогормонов координирует рост примордиев клубней (1. Ewing, Struik, 1992; 2. Маркаров, Головко, Табаленкова, 2001; 3. Аксенова и др., 2012; 4. Kolachevskaya et al., 2016).
В последнее время повышенный интерес вызывает сравнительно новая группа фитогормонов – брассиностероиды (БР). В настоящее время известно более 70 представителей. Среди активных БР выделяют брассинолид, 24-эпибрассинолид и 28-гомобрассинолид. Известно, что механизм действия стероидных гормонов брассиностероидов заключается в координировании синтеза самим растением других фитогормонов – ауксинов, гиббереллинов, цитокининов, абсцизовой кислоты и этилена, а также регуляции ответных реакций на них (5. Головацкая, Карначук, 2010; 6. Kudryakova et al., 2013; 7. Efimova et al., 2017). Повышенное содержание эндогенных БР в проростках Arabidopsis thaliana (L.) Heynh. экотипа Columbia (Col) в темноте обусловливало значительно большее содержание свободной ИУК и обеих форм АБК и меньшее содержание цитокининов (зеатина и рибозида зеатина) и связанной ИУК по сравнению с мутантом det2 по биосинтезу БР (5. Головацкая, Карначук, 2010; 8. Golovatskaya, 2011). Активность и направленность действия стероидных гормонов растений определяется их химическим строением. Брассинолид, продукт окисления кампестерола, требуется для регулирования роста клеток, пыльцевой трубки и стебля, положения листьев, биосинтеза этилена и пигментов, функционирования протонного насоса, дифференциации ксилемы, мужской плодовитости, а также регуляции экспрессии генов, фотосинтеза, реакций стресса и фотоморфогенеза (9. Хрипач, Лахвич, Жабинский, 1993; 10. Clouse, Sasse, 1998; 11. Головацкая, Никонорова, 2008). Экзогенный 24-эпибрассинолид в темноте стимулирует накопление основных форм цитокининов – зеатина, зеатинрибозида, изопентениладенина, зеатин-О-глюкозида (7. Efimova et al., 2017). Известно, что брассиностероиды изменяют экспрессию генов первичного ответа, активность ферментов, мембранный потенциал, активируют синтез белков и нуклеиновых кислот, меняют состав аминокислот и жирных кислот, вызывают сдвиги в гормональном балансе других эндогенных гормонов. Эти сдвиги, происходящие на клеточном уровне, отражаются на уровне целого растения не только усилением роста и урожайности сельскохозяйственных культур, но и повышением устойчивости растений к неблагоприятным факторам внешней среды: солевой, холодо- и морозоустойчивости, устойчивости к патогенам (12. Будыкина, Шибаева, Титов, 2012; 13. Ефимова и др., 2013).
Известны способы применения брассиностероидов в составе композиций с эпоксициклогексаном (патент US № 5965488, опубл. 12.10.1999; патент RU № 2126396, опубл. 20.02.1999), гидролизатом соевого белка, гептаметилтрисилоксаном и натрий тиосульфатом (патент RU № 2513232, опубл. 20.04.2014).
Известен способ стимулирования естественной защиты и индуцирования устойчивости к болезни, вызываемой Candidatus Liberibacter asiaticus, у цитрусовых растений (Huanglongbing), характеризующийся нанесением на растения соединения брассиностероида или его аналога (патент RU № 2596923, опубл. 10.09.2016). При этом используют раствор с концентрацией 0,01–20 мкМ, или от 1·10-8 до 20·10-6 М.
Среди недостатков известных способов-аналогов следует отметить то, что применение сложных композиций с эпоксициклогексаном, гидролизатом соевого белка и гептаметилтрисилоксаном требуют дополнительных материальных затрат на производство, используемые вещества (эпоксициклогексан и гептаметилтрисилоксан) могут снижать экологическую чистоту сельскохозяйственной продукции, а применение многоразовых нанесений (не реже одного раза в месяц по патенту RU № 2596923) делает способы достаточно затратными.
Другой подход регулирования эффекта брассиностероидов с целью увеличения роста растений связан с использованием ингибиторов передачи сигнала этой группы гормонов (патент RU № 2489424, опубл. 10.08.2013; патент RU № 2126396, опубл. 20.02.1999).
Недостатком этих аналогов является то, что использование брассиностероидов как ингибиторов передачи сигнала, избирательно меняющих процессы в растении, требует четкого согласования с этапами развития растений, что не всегда и не для всех растений можно реализовать на практике.
Наиболее близким техническим решением к заявляемому изобретению является «Способ повышения урожайности картофеля и томатов» по патенту RU № 2243658, опубл. 10.01.2005 (выбрано за прототип).
В патенте раскрыт способ внекорневой подкормки растений водным 10-4 М раствором цитокинина 6-бензиламинопурина (БАП) и выращивание растений до получения урожая. Авторы предлагают проводить трехкратную обработку растений в течение вегетации: в фазу бокового ветвления, в начале формирования хозяйственно ценных органов и сразу после завершения их роста. Надземную часть растения картофеля трижды в течение вегетации опрыскивали водным 10-4 М раствором БАП из расчета 300–400 л/га. Опрыскивание проводят в фазу ветвления, при переходе к цветению и в фазу пожелтения нижних листьев. Техническим результатом является повышение урожайности важнейших овощных культур – томатов и картофеля.
Основной недостаток способа-прототипа – использование высокой концентрации гормона и многократная (трехкратная) обработка препаратом надземной части растений, требующие в промышленном варианте дополнительных затрат времени и средств.
Цель заявленного изобретения заключается в регулировании выхода высококачественного экологически чистого оздоровленного семенного материала картофеля при низких трудовых и финансовых затратах.
Задачей, решаемой изобретением, является разработка экономичного способа повышения продуктивности растений за счет регулирования сроков и увеличения выхода оздоровленного семенного материала картофеля в условиях гидропоники. Сущность изобретения состоит в подборе вида брассиностероидов, действующих концентраций и светового воздействия для регулирования сроков клубнеобразования и величины клубней.
Исследовано влияние брассинолида, 24-эпибрассинолида, 28-гомобрассинолида и промышленного препарата «Эпин-экстра» (ННПП «НЭСТ М», Россия). В основу препарата «Эпин-экстра» положен фитогормон эпибрассинолид – искусственно выведенное подобие фитогормона брассинолида.
Способ повышения клубнеобразования и продуктивности растений картофеля в условиях гидропоники, как и аналоги, предусматривает обработку растений раствором биологически активных веществ. В отличие от прототипа в процессе адаптации к жидкой питательной среде корневую систему растений-регенерантов однократно обрабатывают слабо концентрированным раствором брассинолида или 24-эпибрассинолида, или 28-гомобрассинолида, или препарата «Эпин-экстра» и культивируют в условиях гидропоники при освещении световым потоком 350±50 мкмоль/м2с. В основу биопрепарата положен фитогормон, который относится к стероидам – эпибрассинолид. Эпибрассинолид – это искусственно выведенное подобие фитогормона брассинолида.
Как показали опыты, для повышения клубнеобразования и продуктивности растений картофеля в условиях гидропоники концентрации действующего вещества в диапазоне 1 - 100 пМ (в зависимости от химической структуры соединения) достаточные для изменения морфологии побега, формирования ассимиляционного аппарата, активного накопления фотосинтетических пигментов. Выбор низких концентраций обусловлен высокой чувствительностью корней к гормонам по сравнению с побегом.
Осуществление способа по изобретению поясняется примером.
Исходные оздоровленные материнские микроклоны картофеля Solanum tuberosum L. сорта «Жуковский ранний» получены из проверенных на отсутствие вирусов апикальных регенерантов и культивированы под белым светом в течение 25 суток. Затем они микроклонально размножены в стерильных условиях ламинарного бокса. Экспланты второго порядка – черенки исходных растений – состояли из части стебля с листовым узлом. Для чистоты эксперимента прилегающий к апексу узел исходных растений не использован для получения микроклонов, а сами микроклоны имели одинаковую площадь листовой пластинки и длину стеблевой части.
Микроклональное размножение пробирочных растений S. tuberosum L. осуществляли с помощью метода черенкования и дальнейшим переносом микрочеренков на ½ агаризованную безгормональную питательную среду Мурасиге-Скуга (МС) с добавлением сахарозы (30 г/л) и витаминов (тиамин, пиридоксин и никотиновая кислота в концентрации 0,5 мг/л). Черенки апикальных регенерантов и материнских микроклонов культивировали при температуре 20–22 °С в пробирках на белом свету (люминесцентные лампы фирмы «OSRAM», Германия; 250±50 мкмоль/м2с). Спектральные характеристики ламп получены спектрометром Ava-Spec 20-48-2 (компания «Avantes», Нидерланды).
Для эксперимента были отобраны 414 микроклонов, из которых получены растения-регенеранты и сформировано 9 групп по 46 растений. Перед помещением в гидропонную установку проводили однократную обработку корневой системы растений разными препаратами стероидных гормонов (опытные варианты) и водой (контрольный вариант).
Закладка эксперимента выполнена следующим образом. Контрольные пробирочные оздоровленные растения-регенеранты, выросшие на твердой питательной среде МС с сахарозой, были помещены на 4 дня на ½ МС без сахарозы для адаптации к жидкой среде, а затем на 10 дней – на среду Прянишникова, применяемую в последующем в использованной гидропонной установке «КД-10». Затем отобраны контрольные растения и обработаны отстоянной водопроводной водой в течение 18 ч (вариант 1, контроль). Для этого 46 растений помещены в сосуд с водой объемом 1 л.
Опытные растения-регенеранты обработаны в течение 18 ч растворами, содержащими пикомолярные разведения брассиностероидов (БЛ – брассинолид, ГБЛ – 28-гомобрассинолид, ЭБЛ – 24-эпибрассинолид и препарат «Эпин-экстра») в двух диапазонах концентраций, 1-50 пМ (вариант 2) и 50-100 пМ (вариант 3).
Рабочий раствор для последующей обработки корневой системы растений получен путем разведения матричного раствора. Для получения матричного раствора с концентрацией 1·10-3 М берется навеска препарата (в соответствии с молекулярной массой брассинолида С28H48О6 – 480,68 г/моль; 28-гомобрассинолида С29H50О6 – 494,713 г/моль; 24-эпибрассинолида С28H48О6 – 480,68 г/моль и с указанной производителем концентрацией 0,025 г/л 24-эпибрассинолида для «Эпин-экстра»), и разводится в 96%-ном растворе этилового спирта. Затем готовятся промежуточные разведения препаратов с концентрацией 1·10-6 - 1·10-8 М на дистиллированной воде. Рабочий раствор расчетных концентраций готовят на питательной среде Прянишникова, доводя конечный объем до 1 л.
По 46 растений были помещены на 18 ч в 8 сосудов объемом 1 л, содержащие растворы брассиностероидов, соответственно БЛ, ГБЛ, ЭБЛ или «Эпин-экстра» в более низких (1-50 пМ) и более высоких (50-100 пМ) концентрациях. Затем в течение 30 мин корни отмывали от гормонов многократной заменой отстоянной водопроводной водой в сосудах, и растения разных вариантов высаживали на гидропонную установку «КД-10» в отдельные лотки, рассчитанные на 23 растения. Получение мини-клубней осуществлялось на биотехнологическом комплексе в закрытом помещении с использованием в качестве источника питания водного раствора минеральной среды Прянишникова. Источником искусственного освещения служат лампы «ДНАТ-400» с интенсивностью светового потока на уровне средних ярусов растений 350±50 мкмоль/м2с. Эффективность выбранного режима освещения установлена отдельными опытами.
Продолжительность эксперимента составила 3 месяца. Круглогодичное культивирование позволяет проводить посадку растений в установку 3–4 раза с периодическим снятием клубней, в зависимости от требования практики – сроков сбора основного урожая оздоровленного семенного материала.
В процессе 3-х месячного эксперимента собирали мини-клубни картофеля с интервалом 1–2 суток в зависимости от скорости их образования и роста, проводили их подсчет и взвешивание. Индивидуальная масса мини-клубней составила 5–6 г. В конце эксперимента изучили морфологию побегов, изъятых из установки растений картофеля. Растения фотографировали, проводили измерение ассимилирующей поверхности всех функционирующих на растении листьев с использованием известной программы «Moticam 2300» (Испания). Растения и мини-клубни первого поколения были проверены на отсутствие вирусной и бактериальной инфекции методом полимеразной цепной реакции в реальном времени (прибор фирмы Roche, LightCycler 96, Швейцария), с использованием коммерческого препарата «Фитоскрин_Вирусы картофеля» (тест-системы на вирусы S, A, X, Y, M, L и вироид веретеновидности клубней картофеля) и наборы на бактериальные инфекции – «Бурая гниль картофеля (Ralstonia solanacearum)» и «Кольцевая гниль картофеля (Clavibacter michiganensis subsp. sepedonicus)» (Синтол, Москва).
С помощью прибора Chlorophyll Content Meter CL-01 (Hansatech Instruments, Великобритания) оценивали прижизненное содержание суммы фотосинтетических пигментов хлорофиллов (а+b). Для этого подвижной прищепкой с фотоприемником у спектрофотометрического сенсора Chlorophyll Content Meter CL-01 зажимали исследуемую часть листа и снимали показания прибора.
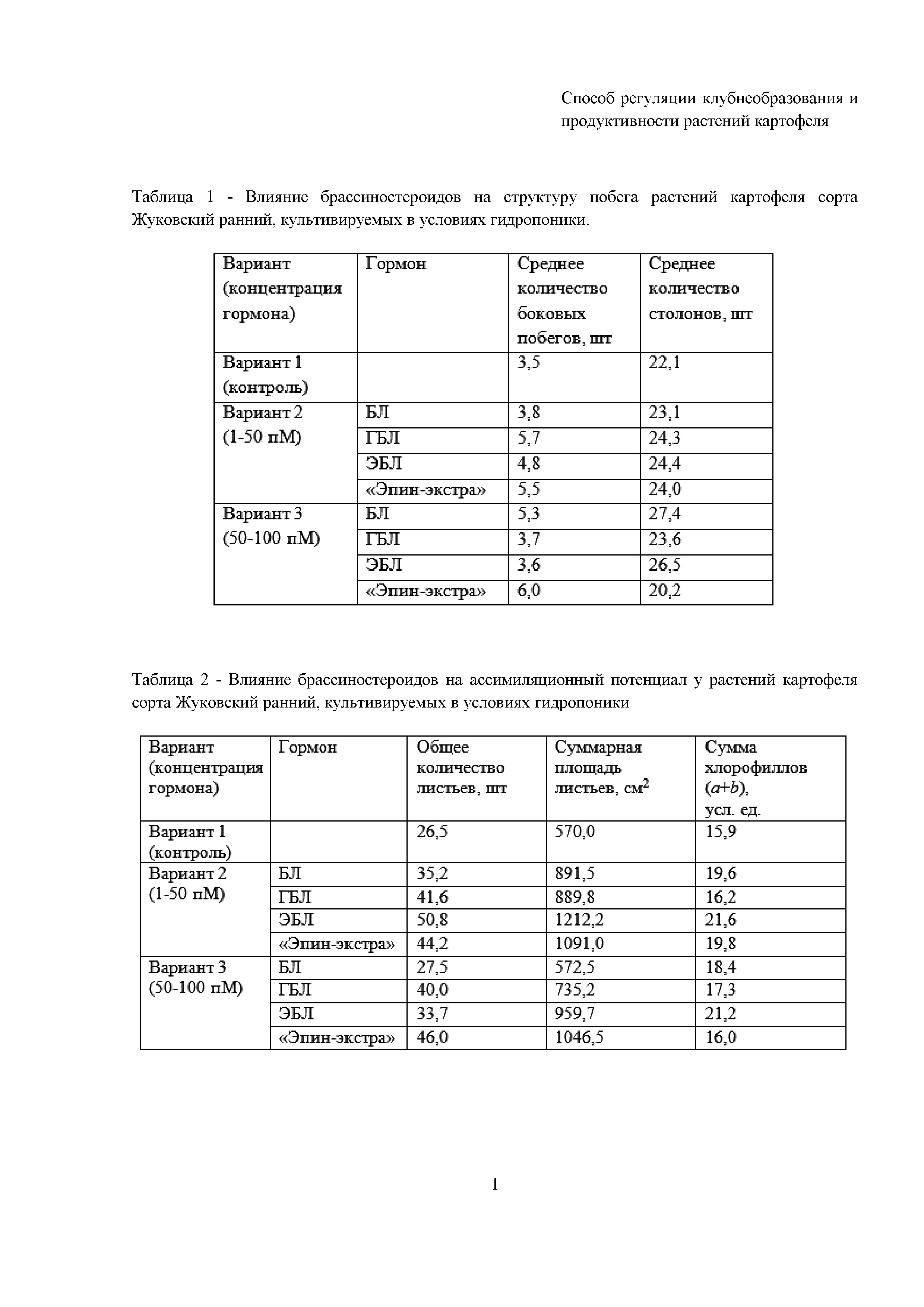
Результаты влияние брассиностероидов на структуру побега и величину ассимилирующей поверхности у растений картофеля сорта Жуковский ранний представлены в таблицах. В таблицах приведены средние арифметические значения. Различия достоверны при уровне значимости р<0,05.
В табл. 1 представлены данные о влиянии различных вариантов на рост растений-регенерантов в условиях гидропоники. Как видно из табл. 1, обработка брассиностероидами способствует усилению ветвления побега картофеля. Существенное увеличение (51–71%) образования боковых фотосинтезирующих побегов отмечается при действии 1-50 пМ ГБЛ в варианте 2 и действии 1-100 пМ «Эпин-экстра» в вариантах 2 и 3. Одновременно увеличивается количество этиолированных побегов (столонов), наибольшее столонообразование отмечено при действии высоких концентраций БЛ и ЭБЛ (50-100 пМ, вариант 3).
На установке «КД-10» показано влияние брассиностероидов на ассимиляционный потенциал растений картофеля сорта «Жуковский ранний» в условиях гидропоники. В табл. 2 и 3 представлены данные о влиянии указанных препаратов на формирование ассимиляционного потенциала (фотосинтетической поверхности листьев и содержание фотосинтетических пигментов) растений-регенерантов картофеля. Скорость нарастания и размеры листовой поверхности являются одной из важных предпосылок накопления хозяйственно полезной биомассы (2 Маркаров, Головко, Табаленкова, 2001), но чрезмерное нарастание листовой поверхности приводит к ухудшению радиационного режима в посеве (1-50 пМ ЭБЛ, вариант 2). С началом клубнеобразования транспорт ассимилятов из листьев ориентирован преимущественно в клубни. Вместе с тем листья используют часть ассимилятов для поддержания и обновления собственных структур. Количество ассимилятов зависит от положения листа в донорно-акцепторной системе растения. Наибольшее количество ассимилированного углерода на собственные нужды потребляют листья средних ярусов.
Для продуктивности посева картофеля определяющее значение имеет продолжительность периода функционирования ассимилирующей поверхности, характеризующейся высоким уровнем фотосинтетических пигментов. На момент завершения 3-х месячного эксперимента в варианте 2 ЭБЛ и «Эпин-экстра» (при меньшей концентрации 1-50 пМ) сохраняется двукратно большая ассимиляционная поверхность листьев (табл. 2) и содержание суммы хлорофиллов а и b в листьях растений на 36 и 24 % по отношению к контрольному варианту. Отток питательных веществ из листьев в клубень часто сопровождает отмиранием стареющих листьев нижних ярусов, что обусловливает снижение площади листьев у растений (вариант 3, БЛ и ЭБЛ), имеющих большую продуктивность клубней.
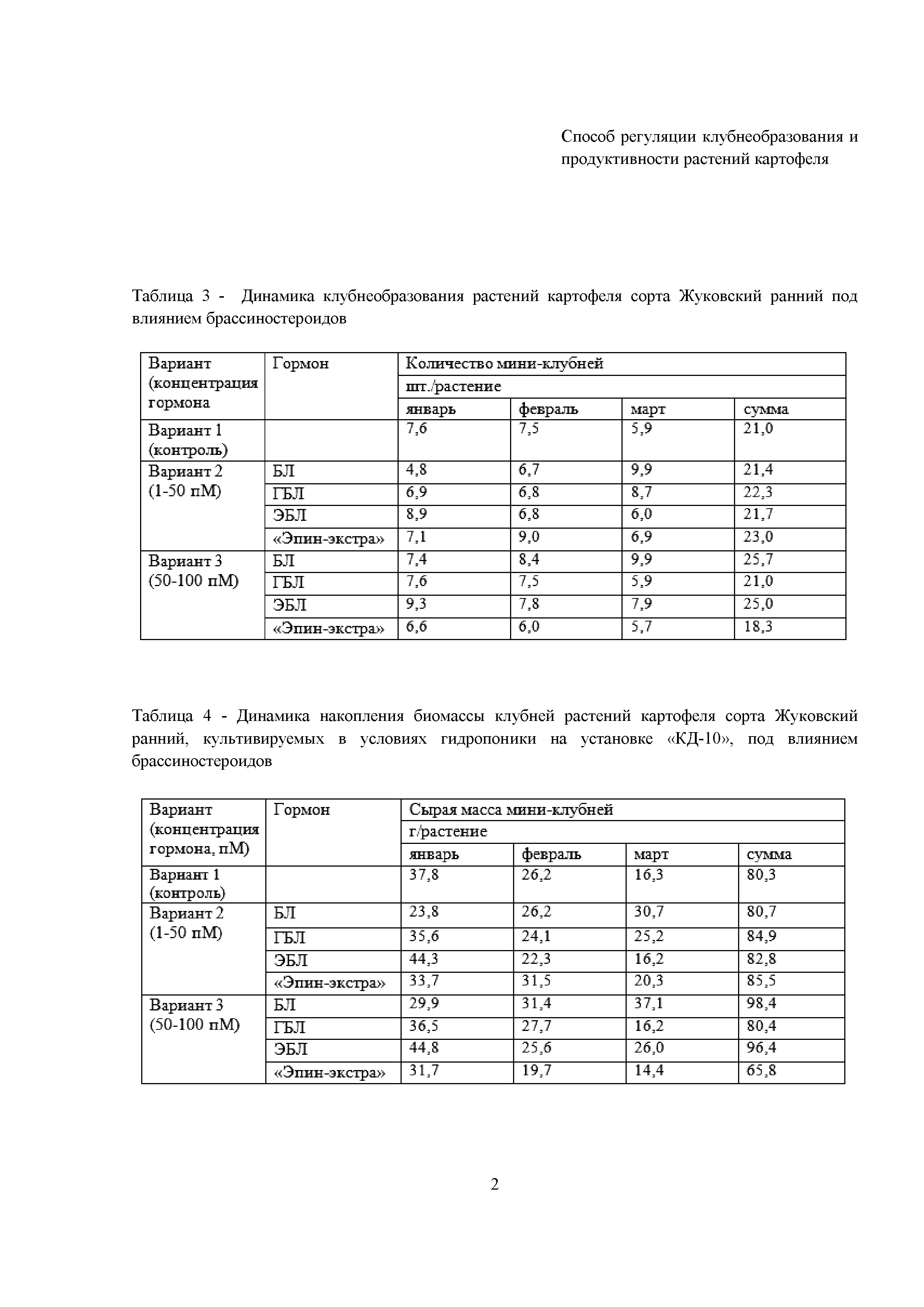
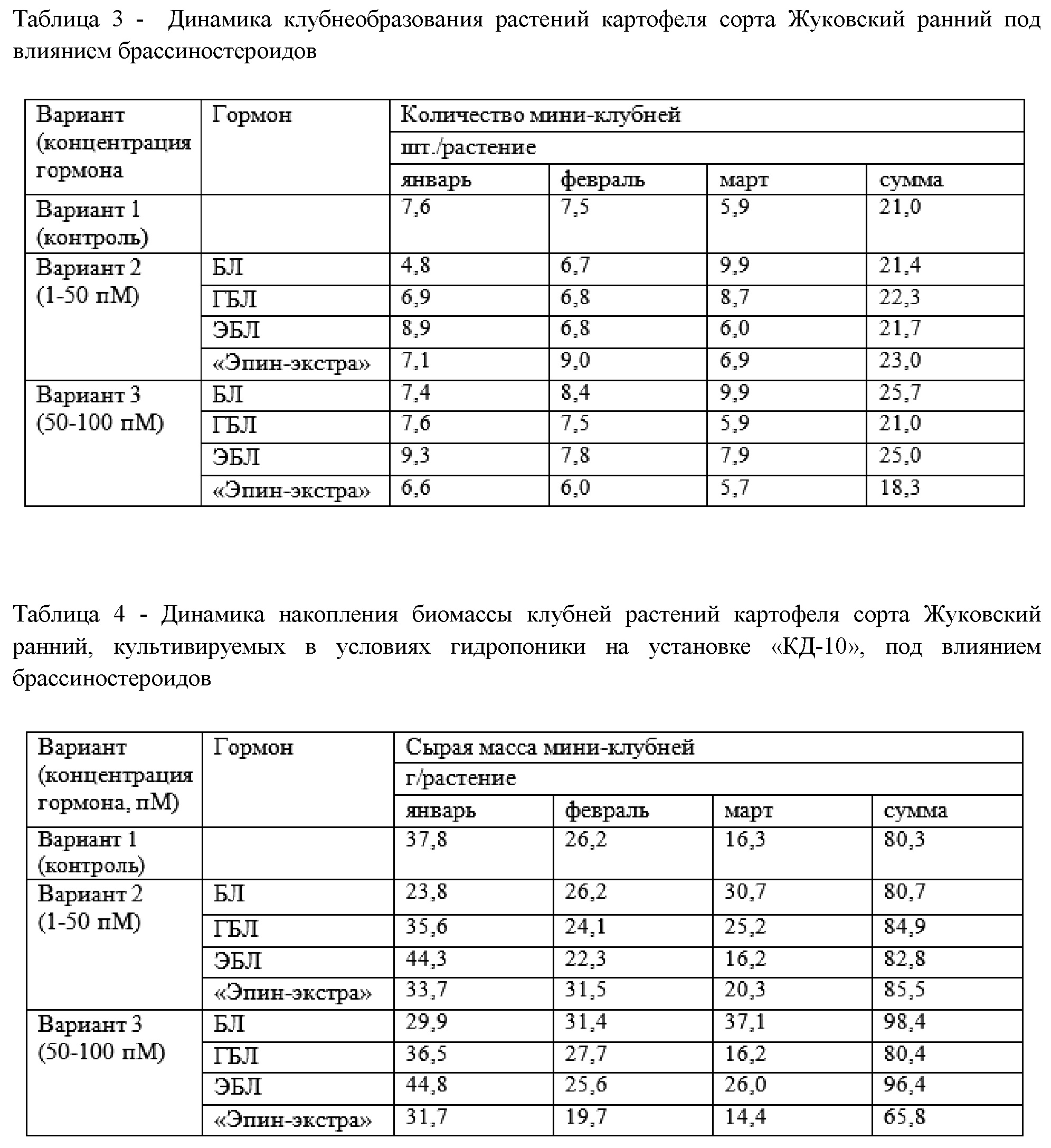
Получены убедительные доказательства о влиянии брассиностероидов на клубнеобразование и выход оздоровленного семенного материала растений картофеля сорта «Жуковский ранний» в условиях гидропоники при заявленных концентрациях. В табл. 3 и 4 представлены данные о влиянии указанных вариантов обработки на формирование клубней и накопления их биомассы у растений-регенерантов по месяцам и за весь период вегетации.
Нами впервые показано, что кратковременная однократная корневая обработка растений картофеля брассиностероидами в зависимости от химической структуры соединения или действующей концентрации вещества, с одной стороны вызывает ускорение клубнеобразования, с другой стороны – приводит к увеличению выхода оздоровленных миниклубней.
В соответствии с данными за весь период вегетации (табл. 3 и 4), ГБЛ и «Эпин-экстра» в варианте 2 (1-50 пМ) повышают количество мини-клубней и их биомассу в среднем на 6 и 10% в расчете на 1 растение, а в варианте 3 (50-100 пМ) применение БЛ и ЭБЛ увеличивает эти параметры на 23 и 15% .
Как видно из табл. 3 и 4, в вариантах 2 и 3 ЭБЛ ускоряет клубнеобразование за счет более ранней закладки дополнительных примордиев клубней (1,3 и 1,7 шт. на 1 растение) и увеличения их биомассы (на 17 и 22%) в первый месяц сбора (в нашем эксперименте – январь) в расчете на каждое растение. Так, ЭБЛ 1-50 пМ дает раннее образование клубней (январь), а БЛ 50-100 пМ даёт увеличение общей суммарной массы за период наблюдения. Это позволяет получить клубни, которые на 2 месяца раньше, чем обычно будут готовы к реализации.
Количество таких клубней в расчете на установку «КД-10» при использовании более низкой концентрации 1-50 пМ ЭБЛ (вариант 2) в первый месяц составляет 418 шт. или 2093 г (1,3 шт. дополнительных клубней или 6,5 г/растение *23 растения в лотке*14 лотков при данной конструкции установки), тогда как при использовании ЭБЛ в максимальной концентрации (50-100 пМ, вариант 3) составляет в среднем 547,4 шт. или 2254 г (1,7 шт. дополнительных клубней или 7 г/растение *23 растения в лотке*14 лотков в установке). Общий выход клубней за 3 месяца в варианте 2 увеличивается на 3% по сравнению с контролем, в то время как в варианте 3 увеличивается на 20% относительно контроля и составляет 1288 клубней или 5184,2 г (4 шт. дополнительных клубней или 16,1 г/растение *23 растения в лотке*14 лотков). Для раннего сбора клубней требуется применение меньшей концентрации ЭБЛ (вариант 2), тогда как для увеличения общего выхода клубней – большей концентрации исследованного диапазона (вариант 3).
Как видно из табл. 3 и 4, другой гормон – БЛ (вариант 2 и 3) смещает клубнеобразование на последний месяц сбора (март – в нашем эксперименте). Это позволяет использовать данный способ обработки для сдвига клубнеобразования на более поздний срок при раннем культивировании растений картофеля, что важно в условиях круглогодичного сбора клубней. При этом общий выход клубней за 3 месяца при использовании 50-100 пМ БЛ увеличивается на 21% по сравнению с вариантом 1 (контроль), что составляет 1513,4 клубней или 5828,2 г (4,7 шт. дополнительных клубней или 18,1 г/растение *23 растения в лотке*14 лотков в одной установке). Обработка 1-50 пМ БЛ (вариант 2) не изменяет общий выход мини-клубней относительно контроля.
В табл. 3 и 4 показано, что использование промышленного препарата «Эпин-экстра» также позволяет получить прибавку общего выхода клубней даже при предельно низких концентрациях 1-50 пМ гормона (вариант 2). Данный прирост составляет 7% по сравнению с контролем и соответствует 644 клубням или 1674,4 г (2 шт. дополнительных клубней или 5,2 г/растение *23 растения в лотке*14 лотков, что реализуется на сравнительно небольшой установке «КД-10»).
Таким образом, обеспечение сбалансированного минерального питания в сочетании с добавлением в среду регуляторов роста брассиностероидов (брассинолида, 28-гомобрассинолида, 24-эпибрассинолида, промышленного препарата «Эпин-экстра») в диапазоне концентраций 1–100 пМ позволило получить у сорта картофеля «Жуковский ранний» до 25 мини-клубней с одного меристемного растения за один оборот. Применение 24-эпибрассинолида (вариант 2) ускоряет формирование клубней, тогда как использование брассинолида (вариант 3) увеличивает инициацию клубней, что в итоге увеличивает общий выход оздоровленных мини-клубней (табл. 3). Применение брассинолида (вариант 3) имеет существенное преимущество перед применением промышленного препарата «Эпин-экстра» по увеличению выхода оздоровленных мини-клубней.
Технический результат: способ, позволяющий регулировать динамику клубнеобразования и увеличить выход экологически чистого оздоровленного семенного материала картофеля высокого качества с минимальными затратами, поскольку проводится легко реализуемая однократная обработка корневой системы с использованием биологически активных веществ в диапазоне концентраций 1–100 пМ, что значительно (в миллионы раз) ниже, чем в способе-прототипе.
Использованные источники:
1. Ewing E.E., Struik P.C. Tuber formation in potato: induction, initiation, and growth // Horticultural Reviews. 1992. Vol. 14. Сh. 3 / Ed. Ju. Janick J. Oxford, UK: Wiley & Sons. Р. 89–100.
2. Морфофизиология клубнеобразующих растений / А. М. Маркаров, Т. К. Головко, Г. Н. Табаленкова; РАН, Уральс. отд-ние, Коми науч. центр, Ин-т биологии [и др.]. – Санкт-Петербург: Наука, 2001. – 207 с.
3. Аксенова Н.П., Константинова Т.Н., Голяновская С.А., Сергеева Л.И., Романов Г.А. Гормональная регуляция клубнеобразования у картофеля // Физиология растений. 2012. Т. 59, № 4. С. 491–508.
4. Kolachevskaya O.O., Sergeeva L.I., Flokova K., Getman I. A., Lomin S.N., Alekseeva V.V., Rukavtsova E.B., Buryanov Y.I., Romanov G.A. Auxin synthesis gene tms1 driven by tuber-specific promoter alters hormonal status of transgenic potato plants and their responses to exogenous phytohormones // Plant Cell Rep., 2016. Springer-Verlag Berlin Heidelberg. DOI 10.1007/s00299-016-2091-y.
5. Головацкая И.Ф., Карначук Р.А. Роль брассинолида в регуляции роста и гормонального баланса растений Arabidopsis thaliana (L.) Heynh на зеленом свету // Вестник Томского государственного университета. Биология. 2010. №1(9). С. 13–19.
6. Kudryakova N.V., Efimova M. V., Danilova M.N., Zubkova N.K., Khripach V. A., Kusnetsov V.V., Kulaeva O.N. Exogenous brassinosteroids activate the expression of the genes of cytokinin signaling pathway in transgenic Arabidopsis thaliana // Plant Growth Regulation. 2013. Vol. 70. P. 61–69.
7. Efimova M.V., Vankova R., Kusnetsov V.V., Litvinovskaya R.P., Zlobin I.E., Dobrev P., Vedenicheva N.P., Savchuk A.L., Karnachuk R.A., Kudryakova N.V., Kuznetsov V.V. Effects of 24-epibrassinolide and green light on plastid gene transcription and cytokinin content of barley leaves // Steroids. 2017. Vol. 120. P. 32–40. DOI 10.1016/j.steroids.2016.12.004.
8. Golovatskaya I.F. Brassinosteroids and light – regulatory factors of growth and development of plants // Brassinosteroids: a class of plant hormone. Eds. S. Hayat and A. Ahmad, Springer. 2011. P.119–143. DOI 10.1007/978-94-007-0189-2_5.
9. Хрипач В.А., Лахвич Ф.А., Жабинский В.Н. Брассиностероиды. Минск: Наука и техника, 1993. 287 с.
10. Clоuse S.D., Sasse J.M. Brassinosteroids: essential regulators of plant growth and development // Annu. Rev. Plant Physiol. Plant Mol. Biol. 1998. Vol. 49. P. 427–451.
11. Головацкая И.Ф., Никонорова Н.М. Рост и продуктивность растений в зависимости от их чувствительности к свету и способа обработки брассинолидом // Агрохимия. 2008. № 1. С. 46–51.
12. Будыкина Н.П., Шибаева Т.Г., Титов А.Ф. Влияние Эпина экстра – синтетического аналога 24-эпибрассинолида на стрессоустойчивость и продуктивность растений огурца (Cucumis sativus L.) // Труды Карельского научного центра РАН. 2012. № 2. С. 47–55.
13. Ефимова М.В., Мануйлова А.В., Малофий М.К., Карташов А.В., Кузнецов Вл.В. Влияние брассиностероидов на формирование защитных реакций проростков рапса в условиях засоления // Вестник Томского государственного университета. Биология. 2013. № 1 (21). С. 118–128.
Способ регуляции клубнеобразования и продуктивности растений картофеля в условиях гидропоники, включающий обработку растений раствором биологически активного вещества, отличающийся тем, что в процессе адаптации к жидкой питательной среде корневую систему растений-регенерантов однократно обрабатывают раствором брассиностероидов низкой концентрации: для регулирования сроков клубнеобразования раствором 24-эпибрассинолида в концентрации 1–100 пМ (раннее клубнеобразование) или раствором брассинолида в концентрации 50–100 пМ (позднее клубнеобразование); для повышения клубнеобразования и продуктивности раствором 24-эпибрассинолида в диапазоне концентраций 1–100 пМ, или раствором 28-гомобрассинолида в диапазоне концентраций 1–50 пМ, или раствором промышленного препарата «Эпин-экстра» в диапазоне концентраций 1–50 пМ, или раствором брассинолида в диапазоне концентраций 50–100 пМ, и культивируют в условиях гидропоники при интенсивности светового потока 350±50 мкмоль/мс.