Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ЛЕЧЕНИЯ МАСТИТОВ
Вид РИД
Изобретение
Отрасль, к которой относится изобретение
Изобретение относится к фармацевтической композиции, которая вводится в молочную железу, и способу лечения или предотвращения мастита у млекопитающего, отличного от человека.
Предпосылки создания изобретения
Мастит у коров представляет собой одно из наиболее распространенных заболеваний у молочного скота. Мастит возникает тогда, когда возникает воспаление вымени. Воспаление может вызываться различными типами повреждения, включая инфекционные агенты и их токсины, физические повреждения или химические раздражители. Многие микроорганизмы или бактерии были идентифицированы как таковые, которые вызывают мастит, но предполагается, что серьезное заболевание маститом в большинстве случаев вызываются одним из следующих патогенов, такими как Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis и E.coli.
Наиболее общие патогены, вызывающие мастит, оказываются или в вымени (контагиозные патогены) или в окружающей среде, где находятся коровы (патогены окружающей среды). Контагиозные патогены, такие, как Streptococcus agalactiae и Staphylococcus aureus, в первую очередь, колонизируют сайты ткани хозяина, такие, как молочные железы, сосковые каналы и повреждения кожи сосков, и в общем случае распространяются с инфицированного вымени на здоровое вымя во время процесса доения. Такое заражение может происходить через загрязненные резервуары для доения, руки доярки, бумажные или тканевые полотенца, используемые для мытья или вытирания вымени больше, чем одной коровы, и, возможно, из-за мух. Патогены окружающей среды, такие, как стрептококки, энтерококки и кишечные палочки, в общем случае присутствуют в среде, в которой находятся коровы, из таких источников, как коровьи экскременты, почва, растительный материал, подстилка или вода; и вызывают заражение путем случайного оппортунистического контакта с животным. Во всех случаях мастита, независимо от микроорганизма, который его вызывает, передача патогена в вымя осуществляется через отверстие соска и сосковый канал.
Мастит вызывает изменения в составе молока, включая увеличение количества соматических клеток (SCC). Молоко от нормальных (неинфицированных) коров обычно содержит меньше 200000 соматических клеток/мл. Повышение уровня SCC выше 300000 соматических клеток/мл является патологическим и служит показателем воспаления вымени. Типы соматических клеток, присутствующих в молоке, меняются в сторону преобладания белых кровяных клеток, которые обеспечивают множество протеолитических и липолитических ферментов в молоке. Кроме того, в молоко просачивается больше сыворотки крови, чем обычно. Нарушение качества молочной продукции в результате мастита является обусловленным ферментативным расщеплением молочного белка и жира. Количество казеина, основного молочного белка высокой пищевой ценности, снижается и увеличивается количество сывороточных белков низкого качества, что негативно влияет на качество получаемых молочных продуктов, к примеру, выход сыра, вкус и качество. Расщепление белка в молоке может происходить в молоке, полученном от коров с клиническим или субклиническим маститом, по причине присутствия протеолитических ферментов. Протеолитическая активность плазмина повышается более чем в 2 раза при мастите.
Плазмин и ферменты, которые происходят от соматических клеток, могут приводить к повреждению казеина в вымени перед выдаиванием молока. Ухудшение качества молочного белка может также происходить во время обработки и хранения молока, полученного от зараженных коров. Другие изменения состава молока включают снижение уровня кальция и калия.
Мастит стоит молочной промышленности США примерно 1,7-2 млрд долларов в год или 11% от общего производства молока в США. Такие потери включают снижение производства молока, отбракованное молоко, замену коров, медикаментозное лечение, трудовые затраты и ветеринарные услуги. В данный момент острый мастит лечится антибиотиками, противовоспалительными агентами и окситоцином. Однако лечение часто является затратным (иногда несколько последовательных введений в молочную железу), дорогим и не вполне эффективным. Таким образом, существует потребность в варианте лечения и фармацевтической композиции, которая улучшает эффективность существующего стандарта или обеспечивает приемлемую эффективность с дополнительными положительными преимуществами, например, снижение потерь молока, сокращение продолжительности лечения и/или возможность осуществления не такого дорогого лечения.
Краткое изложение сущности изобретения
Если крупные популяции бактерий подвергаются воздействию фосфомицина, то небольшая их часть в пределах от 10 до 104 КОЕ все еще будет оставаться способной формировать колонии на агаре. В повторно выросших колониях обнаруживается большое количество новых фокусов, как может быть продемонстрировано для золотистого стафилококка и E.coli. Такие фенотипически адаптированы новые клоны (мутанты) являются вероятной причиной интенсивного повторного роста, который регулярно наблюдается в жидких культурах, поддерживаемых при тех же концентрациях фосфомицина.
Этот процесс адаптации должен быть устранен для того, чтобы получить эффективный контроль над большой популяцией патогена. К большому удивлению, небольшие количества любого из энрофлоксацина, цефазолина, пирлимицина или амоксициллина, например, могут полностью ингибировать этот этап дифференциации в ответ на селективное давление лекарственного средства. Таким образом, бактерицидный компонент действия фосфомицина может разворачиваться оптимальным образом, и клональное размножения сохранившихся вариантов блокируется при клинически достижимых концентрациях лекарственных средств. Такое синергетическое повышение эффективности антибиотика можно было впоследствии наблюдать у животных, сначала в мышиной модели мастита, а после этого в инфицированном вымени коров. Такая антибактериальная активность была создана, сохранена и высвобождена из фармацевтических композиций, которые описаны ниже.
ПОДРОБНОЕ ОПИСАНИЕ ЖЕЛАТЕЛЬНЫХ ВОПЛОЩЕНИЙ
Изобретение является направленным на фармацевтические рецептуры и на применение таких фармацевтических рецептур для предотвращения или лечения мастита у млекопитающих, производящих молоко, которые отличаются от человека.
В соответствии с одним аспектом настоящего изобретения обеспечивается фармацевтическая композиция, которая вводится в молочную железу, для применения в предотвращении и лечении мастита у млекопитающего, отличного от человека, включающая фармацевтическую композицию фосфоновой кислоты и, по крайней мере, один антимикробный агент.
В соответствии с одним воплощением фармацевтической композиции в соответствии с изобретением фосфоновая кислота является выбранной из группы, состоящей из фосфомицина, фосмидомицина и алафосфалина.
В соответствии с преимущественным воплощением фармацевтической композиции в соответствии с изобретением фосфоновая кислота представляет собой фосфомицин.
В соответствии с другим воплощением фармацевтической композиции по изобретению антимикробный агент является выбранным из группы, состоящей из хинолонов, β-лактама и макролид-стрептограмин-линкозамидов.
В соответствии с преимущественным воплощением фармацевтической композиции по изобретению антимикробный агент представляет собой хинолон. В соответствии с наиболее предпочтительным воплощением фармацевтической композиции по изобретению хинолон является выбранным из группы, состоящей из бенофлоксацина, бинфлоксацина, циноксацина, ципрофлоксацина, клинафлоксацина, данофлоксацина, дифлоксацина, эноксацина, энрофлоксацина, флуроксацина, гемифлоксацина, ибафлоксацина, левофлоксацина, ломефлоксацина, марбофлоксацина, моксифлоксацина, норфлоксацина, офлоксацина, орбифлоксацина, пазуфлоксацина, прадофлоксацина, перфлоксацина, темафлоксацина, тозуфлоксацина, сарафлоксацина и спарфлоксацина.
В соответствии с другим предпочтительным воплощением фармацевтической композиции по изобретению антимикробный агент представляет собой фторохинолон. В соответствии с наиболее предпочтительным воплощением фармацевтической композиции по изобретению фторохинолон является выбранным из группы, состоящей из ципрофлоксацина, энрофлоксацина, моксифлоксацина и прадофлоксацина.
В соответствии с еще более предпочтительным воплощением фармацевтической композиции по изобретению хинолон представляет собой энрофлоксацин.
В соответствии с другим предпочтительным воплощением фармацевтической композиции по изобретению антимикробный агент представляет собой β-лактам. В соответствии с наиболее предпочтительным воплощением фармацевтической композиции по изобретению β-лактам является выбранным из группы, состоящей из пенициллина, цефалоспорина, карбапенема и пенема и ингибитора β-лактамазы.
В соответствии с еще более предпочтительным воплощением фармацевтической композиции по изобретению β-лактам представляет собой цефалоспорин. В соответствии с еще одним более предпочтительным воплощением фармацевтической композиции по изобретению цефалоспорин представляет собой цефазолин.
В соответствии с еще более предпочтительным воплощением фармацевтической композиции по изобретению β-лактам представляет собой пенициллин. В соответствии с еще одним более предпочтительным воплощением фармацевтической композиции по изобретению пенициллин представляет собой амоксициллин.
В соответствии с другим предпочтительным воплощением фармацевтической композиции по изобретению антимикробный агент представляет собой макролид-стрептограмин-линкозамид. В соответствии с наиболее предпочтительным воплощением фармацевтической композиции по изобретению макролид-стрептограмин-линкозамид является выбранным из группы, состоящей из макролида, линкомицина, клиндамицина и пирлимицина. В соответствии с еще более предпочтительным воплощением фармацевтической композиции по изобретению макролид-стрептограмин-линкозамид представляет собой пирлимицин.
В соответствии с другим аспектом по изобретению обеспечивается способ для лечения мастита, включающий введение отличному от человека млекопитающему, имеющему мастит, эффективного количества фармацевтической композиции, включающей фосфоновую кислоту и, по крайней мере, один антимикробный агент.
В соответствии с еще одним аспектом данного изобретения обеспечивается способ предотвращения мастита, включающий введение отличному от человека млекопитающему эффективного количества фармацевтической композиции, включающей фосфоновую кислоту и, по крайней мере, один антимикробный агент.
В соответствии с соответствующим воплощением способов по изобретению фосфоновая кислота является такой, как определяется в одном из воплощений фармацевтической композиции, которые упоминаются выше.
В соответствии с другим соответствующим воплощением способов по изобретению антимикробный агент является таким, как определяется в одном из воплощений фармацевтической композиции, которые упоминаются выше.
В соответствии с другим аспектом по изобретению обеспечивается применение фармацевтической композиции фосфоновой кислоты и, по крайней мере, одного антимикробного агента для лечения или предотвращения мастита у млекопитающего, отличного от человека.
В соответствии с другим аспектом по изобретению обеспечивается применение фосфоновой кислоты и, по крайней мере, одного антимикробного агента для производства фармацевтической композиции, которая вводится в молочную железу, для лечения или предотвращения мастита у млекопитающего, отличного от человека. В соответствии с преимущественным воплощением применения для производства используется композиция, преимущественно фармацевтическая композиция фосфоновой кислоты и, по крайней мере, одного антимикробного агента.
В соответствии с соответствующим воплощением применения по изобретению фосфоновая кислота является такой, как определяется в любом из воплощений фармацевтической композиции, которые упоминаются выше.
В соответствии с соответствующим воплощением применения по изобретению антимикробный агент является таким, как определяется в любом из воплощений фармацевтической композиции, которые упоминаются выше.
I. Фармацевтические композиции
а. активные ингредиенты
В соответствии с данным изобретением фармацевтическая композиция, которая используется в этом лечении, включает смесь фосфоновой кислоты в сочетании, по крайней мере, с одним дополнительным активным ингредиентом, который включает антимикробный агент. Приемлемые фосфоновые кислоты включают фосфомицин ([(2R, 3S)-3-метилоксиран-2-ил]фосфоновая кислота), фосмидомицин и алафосфалин. Предпочтительная фосфоновая кислота представляет собой фосфомицин.
Антимикробный агент, который сочетают с фосфомицином, может представлять собой любой антимикробный агент, который является известным в области фармацевтики и является приемлемым для местного лечения мастита (например, для введения в молочную железу и для интрацистернального применения). Антимикробный агент может быть выбран из одного или более из следующих хорошо известных классов антимикробных агентов, включая: хинолоны, желательно антибиотики на основе фторохинолонов, β-лактамы и макролид-стрептограмин-линкозамиды (MLS).
Приемлемые хинолоны включают бенофлоксацин, бинфлоксацин, циноксацин, ципрофлоксацин, клинафлоксацин, данофлоксацин, дифлоксацин, эноксацин, энрофлоксацин, флероксацин, гемифлоксацин, ибафлоксацин, левофлоксацин, ломефлоксацин, марбофлоксацин, моксифлоксацин, норфлоксацин, офлоксацин, орбифлоксацин, пазуфлоксацин, прадофлоксацин, перфлоксацин, темафлоксацин, тозуфлоксацин, сарафлоксацин, гемифлоксацин и спарфлоксацин. Предпочтительные фторохинолоны включают ципрофлоксацин, энрофлоксацин, моксифлоксацин, данофлоксацин и прадофлоксацин. Приемлемые нафтиридоны включают налидиксовую кислоту.
Приемлемые β-лактамы включают пенициллины, такие, как бензатин пенициллин, бензилпенициллин (пенициллин G), феноксиметилпенициллин (пенициллин V), прокаин пенициллин, метициллин, оксациллин, нафциллин, клоксациллин, диклоксациллин, флуклоксациллин, темоциллин, амоксициллин, ампициллин, коамоксиклав (моксициллин и клавулановая кислота), азоциллин, карбенициллин, тикарциллин, мезлоциллин, пиперациллин; цефалоспорины, такие, как цефалоний, цефгалексин, цефазолин, цефапририн, цефхином, цефтиофур, цефгалотин, цефаклор, цефуроксим, цефамандол, дефотетан, цефокситин, цефтриаксон, цефотаксим, цефподоксим, цефиксим, цефтазидим, цефепим, цефпиром; карбапенемы и пенемы, такие, как имипенем, меропенем, эртапенем, фаропенем, дорипенем, монобактамы, такие, как азтреонам (азактам), тигемонам, нокардицин А, табтоксинин-В-лактам; и ингибиторы β-лактамазы, такие, как клавулановая кислота, тазобактам и сульбактам. Предпочтительные β-лактамы включают пенициллины, в частности амоксициллин и цефалоспорины, в частности, цефазолин.
Приемлемые MLS антибиотики включают любой макролид, линкомицин, клиндамицин, пирлимицин. Предпочтительный линкозамид представляет собой пирлимицин.
Другие антимикробные агенты включают 2-пиридоны, тетрациклин, сульфаниламиды, аминогликозиды, триметоприм, диметридазолы, эритромицин, фрамицетин, фуразолидон, разнообразные плейромутилины, такие, как тимулин, валнемулин, разнообразные стрептомицины, клопидол, салиномицин, монензин, галофугинон, наразин, робенидин и другие.
Фосфомицин, фосмидомицин или алафосфалин и антимикробный агент, с которым их объединяют, могут использоваться в своих формах свободной кислоты или основания, а также в форме энантиомера, фармацевтически приемлемой соли или аддукта. Термин "фармацевтически приемлемый" относится к относительно нетоксичной неорганической и органической кислоте и солям присоединения основания и аддуктам. Как используется в данной заявке, тогда, когда делается ссылка на фосфомицин, фосмидомицин или алафосфалин и другие антибиотических активные ингредиенты, то предполагается включение этих фармацевтически приемлемых форм. Характерные соли включают, например, гидробромид, гидрохлорид, сульфат, бисульфат, фосфат, нитрат, ацетат, валерат, олеат, пальмитат, стеарат, лаурат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат и соли лаурилсульфоната и подобные им. Другие такие традиционные нетоксичные соли включают те, которые происходят от неорганических кислот, такие, как соли бромистоводородной, хлористоводородной, серной, сульфамовой, фосфорной, азотной кислоты и подобные им; а также соли, полученные из органических кислот, таких, как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфанильная, 2-ацетоксибензойная, фумаровая, толуолбензойная, метансульфоновая, этандисульфоновая, щавелевая, изотионовая и подобные им. Фосфомицин, фосмидомицин или алафосфалин, а также антимикробный агент содержат одну или более функциональных групп кислоты и, таким образом, являются способными к образованию фармацевтически приемлемых солей с фармацевтически приемлемыми основаниями. Термин "фармацевтически приемлемые соли" в этих случаях относится к относительно нетоксичным неорганическим и органическим солям присоединения основания антимикробных агентов по изобретению. Типичные соли щелочных и щелочноземельных металлов включают соли лития, натрия, калия, кальция, магния и алюминия, а также подобные им. Характерные органические амины, полезные для образования солей присоединения основания, включают этиламин, диэтиламин, этилендиамин, этаноламин, диэтаноламин, трометамол (трис(гидроксиметил)аминометан), пиперазин и подобные им.
Некоторые преимущественные фармацевтически приемлемые соли включают цефазолин натрия, пирлимицин гидрохлорид, фосфомицин (ди)натрия, фосфомицин кальция и фосфомицин трометамол.
Фармацевтическая композиция по изобретению может представлять собой продукт, вводимый в молочную железу, или системный продукт. В одном воплощении фармацевтическая композиция представляет собой продукт для введения в молочную железу, который вводится в отверстие соска, при лечении или предотвращении мастита у млекопитающего, отличного от человека.
В одном воплощении фармацевтическая композиция включает смесь фосфомицина в сочетании, по крайней мере, с одним антимикробным агентом, выбранным из группы, состоящей из энрофлоксацина, цефазолина, пирлимицина, амоксициллина и их комбинаций. В другом варианте фармацевтическая композиция включает смесь фосфомицина и энрофлоксацина. Еще в одном воплощении фармацевтическая композиция включает смесь фосфомицина и цефазолина. В дополнительном воплощении фармацевтическая композиция включает смесь фосфомицина и пирлимицина. Еще в одном воплощении фармацевтическая композиция включает смесь фосфомицина и амоксициллина.
В соответствии с данным изобретением фармацевтическая композиция содержит фармацевтически эффективное количество смеси фосфомицина и, по крайней мере, одного антимикробного агента. Как используется в данной заявке, термин "фармацевтически эффективное количество" относится к дозе, которая является достаточной либо для предотвращения, либо для лечения мастита у субъекта, которому вводится фармацевтическая композиция. Доза зависит от активного(ых) ингредиента(ов), животного, которое подвергают лечению, состояния и тяжести симптомов. Определение этих факторов находится в пределах компетенции квалифицированного специалиста в данной области техники.
В общем случае эффективная доза будет варьировать в зависимости от способа введения. В фармацевтической композиции для введения в молочную железу соотношение фосфомицина к энрофлоксацину составляет от 5:1 до 5:4 на основе свободных кислот. В другом варианте фармацевтической композиции для введения в молочную железу соотношение фосфомицина к цефазолину составляет от 5:1 до 5:4 на основе свободных кислот. Еще в одном воплощении фармацевтической композиции для введения в молочную железу соотношение фосфомицина к пирлимицину составляет от примерно 10:1 до 40:1 на основе свободной кислоты и свободного основания, соответственно.
Изобретение желательно получают в форме мази для введения в молочную железу, суспензии, раствора или геля.
II. Способы
а. Способ лечения
Фармацевтическая композиция по изобретению может использоваться для предотвращения или для лечением мастита у животного. Мастит может быть ассоциирован с некоторыми патогенами, включая Е. coli, Klebsiella spp., Enterobacter spp., Salmonella spp., Citrobacter spp., Serratia spp., Shigella spp., Edwardsiella spp., Hafnia spp., Morganella spp., Providencia spp., Yersinia spp., Staphylococcus aureus, Staphylococcus spp., Pseudomonas spp., Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus spp., Enterococci, Corynebacterium spp., Arcanobacterium spp., Actinomyces spp., Mycobacterium spp., Prototheca spp., Mycoplasma spp.и Erwinia spp., среди прочих.
Фармацевтическая композиция может использоваться для различных применений со способом применения и режимом дозирования, который определяется частотой доения и/или состоянием молочной железы животного.
Фармацевтическая композиция может применяться ко всем животным, которые производят молоко, отличным от человека, которые нуждаются в лечении или предотвращении мастита, таким, как рогатый скот, верблюды, бизоны, козы или овцы, однако она особенно важна для жвачных животных, которые используются для продукции молока для потребления человеком, таких, как рогатый скот, бизоны, козы и овцы.
Лечение мастита является предназначенным для выздоровления или облегчения состояния, обусловленного маститом, то есть, для снижения, по крайней мере, одного симптома мастита. Мастит относится к воспалению молочной железы. Его характеризуют физические, химические и, конечно, бактериологические изменения в молоке и патологические изменения в железистой ткани. Изменения в молочной железе часто приводят к ряду симптоматических признаков, таких, как обесцвечивание молока, присутствие комков твердого вещества и присутствие большого количества лейкоцитов. Клинически мастит проявляется в форме отека, жара, боли и уплотнения в молочной железе, что часто приводит к деформации вымени. Воспаленное вымя можно увидеть или определить путем пальпации вымени. Во многих случаях диагноз субклинических инфекций базируется в значительной степени на опосредованных анализах, которые зависят от содержания лейкоцитов в молоке (комки и хлопья в молоке или серозное молоко), наличии, по крайней мере, 1 бактерии, которая определяется, по крайней мере, в 100 мкл молока из вымени, повышенном количестве соматических клеток (SCC), которое обычно составляет более 300000 клеток/мл и/или электрической проводимости молока, которая становится выше нормальной. Предотвращение мастита означает предотвращения возникновения инфекции. Предотвращение также включает лечение коров, которые не демонстрируют каких-либо признаков мастита, но находятся в присутствии других коров, которые имеют, по крайней мере, один симптом мастита, для минимизации или предотвращения передачи или потенциальной передачи от одной коровы к другой.
Эффективность фармацевтической композиции для лечения мастита у животного количественно оценивается в процентах очищенных молочных желез (т.е. 1 мкл молока свободен от любых бактерий). В одном воплощении фармацевтическая композиция очищает, крайней мере, на 50% молочные железы животного. В другом варианте фармацевтическая композиция очищает молочные железы животного на примерно 50%-90%. Еще в одном воплощении фармацевтическая композиция очищает молочные железы животного примерно на 70%-90%.
Фармацевтическая композиция может вводиться в молочную железу через отверстие соска во внутреннюю полость молочной железы и связанную с ней систему протоков. Фармацевтическая композиция может находиться в форме мази, суспензии, раствора или геля. Альтернативно, фармацевтическая композиция может также вводиться системно с помощью внутривенного, подкожного и внутримышечного введения.
Доза комбинации активных ингредиентов для лечения одной четверти вымени может содержать от примерно 100 до примерно 3000 мг фосфомицина или соли фосфомицина (на основе свободной кислоты), преимущественно в количестве от примерно 500 до примерно 2000 мг в комбинации с примерно 50 - примерно 1000 мг, преимущественно от примерно 200 до примерно 800 мг, антибиотика на основе β-лактама, желательно цефалоспорина, более желательно цефазолина, который рассчитывается как свободная кислота. В другом варианте доза комбинации активных ингредиентов для лечения одной четверти вымени может содержать от примерно 100 до примерно 3000 мг фосфомицина (на основе свободной кислоты), преимущественно в количестве от приблизительно 500 до приблизительно 2000 мг в комбинации с примерно 50 -примерно 1000 мг, преимущественно от примерно 200 до примерно 800 мг, хинолона, желательно фторохинолона, более желательно энрофлоксацина, который рассчитывается как свободная кислота. Еще в одном воплощении доза комбинации активных ингредиентов для лечения одной четверти вымени может содержать от примерно 100 до примерно 3000 мг фосфомицина или соли фосфомицина (в форме свободного основания), преимущественно от примерно 500 до примерно 2000 мг в комбинации с примерно 10-примерно 500 мг, преимущественно от примерно 25 до примерно 100 мг линкозамида, желательно пирлимицина, что рассчитывается как свободное основание.
Доза комбинации активных ингредиентов (для лечения или предотвращения) может вводиться повторно в течение периода времени от двух до восьми дней. В одном воплощении доза может вводиться один или два раза в день в течение периода времени от двух до восьми дней. В другом варианте доза комбинации активных ингредиентов может вводиться один или два раза в день в течение периода времени от четырех до шести дней. При этом предполагается, что точная комбинация дозы и времени будет меняться в широком интервале и большое количество комбинаций, которые являются эффективными в лечении или предотвращении заболевания, могут быть легко установлены средним специалистом в данной области техники, учитывая данное раскрытие изобретения.
Учитывая приведенное выше, можно увидеть, что реализуются некоторые объекты изобретения и достигаются другие преимущественные результаты. Поскольку могут быть внесены некоторые изменения в указанные выше композиции, продукты и процессы без отхода от объема изобретения, предполагается, что все примеры, которые содержатся в приведенном выше описании и представлены в сопроводительных таблицах, будут трактоваться как иллюстративные, а не в ограничительном контексте.
При представлении элементов данного изобретения или его преимущественного(ых) воплощения(воплощений) понятия "любой", "данный" и "указанный" являются предназначенными для понимания, что существует один или более элементов. Термины "включающий", "содержащий" и "имеющий" являются предназначенными для включения и понимание того, что могут существовать дополнительные элементы, которые отличаются от приведенных элементов.
Следующие примеры просто являются предназначенными для дополнительной иллюстрации и объяснения данного изобретения. Таким образом, примеры не должны трактоваться как ограничивающие объем данного изобретения или способ, с помощью которого они могут быть реализованы.
Примеры
Пример 1
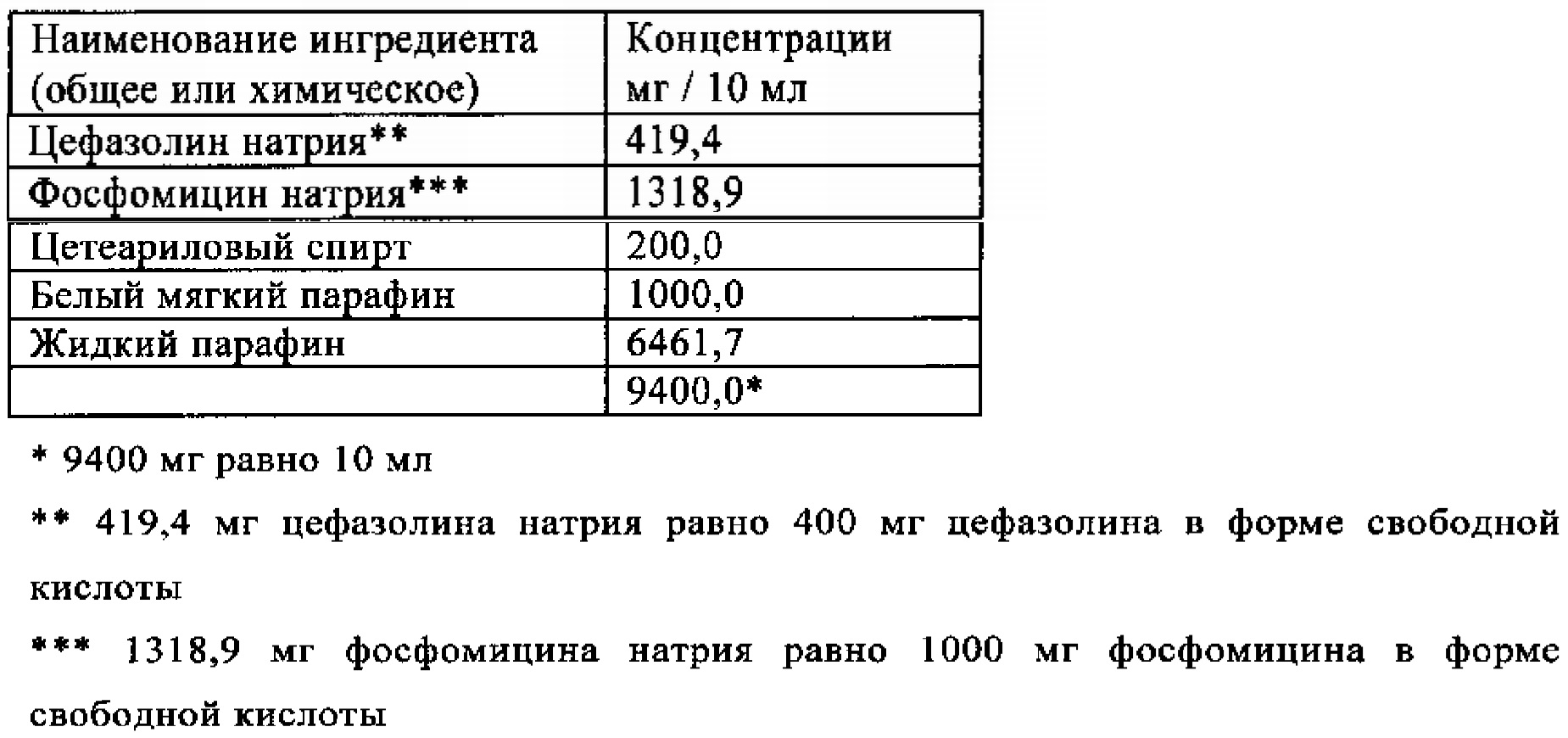
Жидкий парафин, белый мягкий парафин и цетеариловый спирт расплавляли в приемлемой пробирке. Смесь стерилизовали нагреванием наполнителей в течение 120 минут до 160°C. Затем смесь охлаждали до 40-50°C и добавляли стерильный и микронизированный цефазолин натрия и фосфомицин натрия при стерильных условиях. Затем смесь гомогенизировали в течение 15 минут. 10 мл полученной фармацевтической композиции вносили в стерильное устройство для инъекции при стерильных условиях.
Пример 2
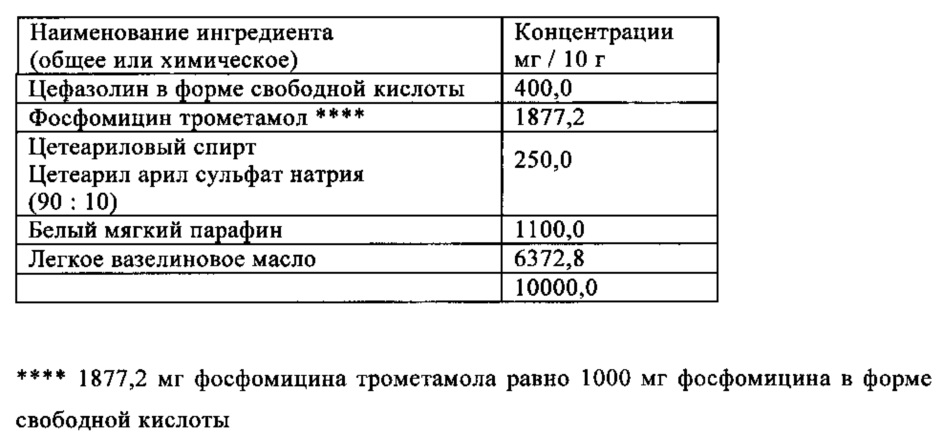
Жидкий парафин, белый мягкий парафин, цетеариловый спирт и цетеарил арил сульфат натрия расплавляли в приемлемой пробирке. Смесь стерилизовали нагреванием наполнителей в течение 120 минут до 160°C. Затем смесь охлаждали до 40-50°C и добавляли стерильный и микронизированный цефазолин натрия и фосфомицин трометамол при стерильных условиях. Затем смесь гомогенизировали в течение 15 минут. 10 г полученной фармацевтической композиции вносили в стерильную устройство для инъекции при стерильных условиях.
Пример 3
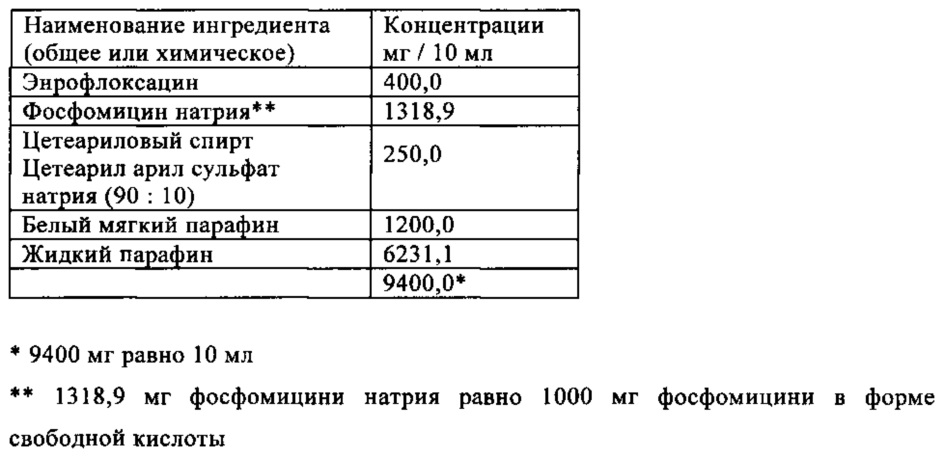
Жидкий парафин, белый мягкий парафин, цетеариловый спирт и цетеарил арил сульфат натрия расплавляли в приемлемой пробирке. Смесь стерилизовали нагреванием наполнителей в течение 120 минут до 160°C. Затем смесь охлаждали до 40-50°C и добавляли стерильный и микронизированный энрофлоксацин и фосфомицин натрия при стерильных условиях. Затем смесь гомогенизировали в течение 15 минут. 10 мл полученной фармацевтической композиции вносили в стерильную устройство для инъекции при стерильных условиях.
Пример 4
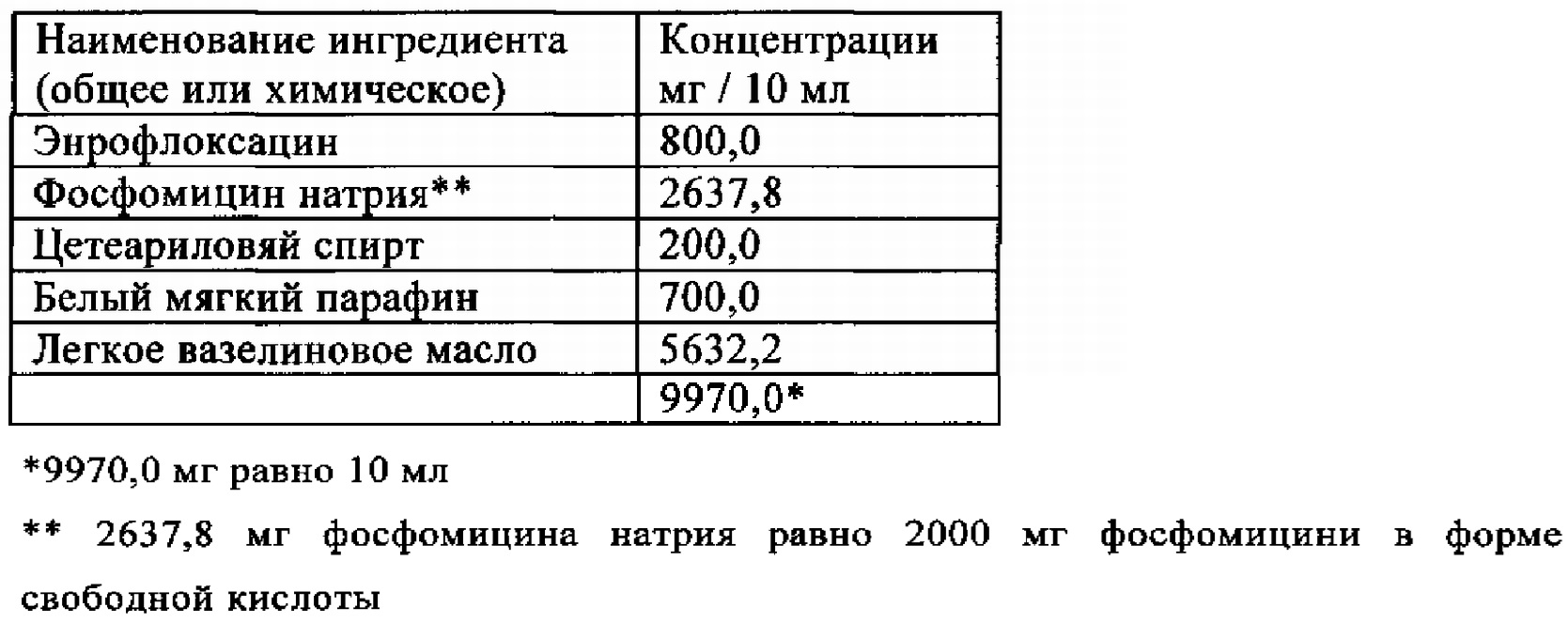
Жидкий парафин, белый мягкий парафини и цетеариловый спирт расплавляли в приемлемой пробирке. Смесь стерилизовали нагреванием наполнителей в течение 30 минут до 180°C. Затем смесь охлаждали до 40-50°C и добавляли стерильный и микронизированный энрофлоксацин и фосфомицин натрия при стерильных условиях. Затем смесь гомогенизировали в течение 15 минут. 10 мл полученной фармацевтической композиции вносили в стерильное устройство для инъекции при стерильных условиях.
Пример 5

Приемлемую пробирку заполняли водой для инъекций. Пирлимицин HCl и фосфомицин натрия растворяли при перемешивании. Значение pH раствора доводили до значения 7,3 с помощью цитрата натрия. Раствор перемешивали в течение дополнительных 15 минут. Затем раствор фильтровали через стерильный фильтр в стерильный резервуар.
10 мл стерильного раствора вносили в стерильное устройство для инъекций при стерильных условиях.
Пример 6 - Данные in vivo, полученные на мышах
Исследования проводились при использовании модели мастита S. aureus (МММ), как принято в Университете Шербрук, Канада (Brouillette и др., 2004), введено в данную заявку в качестве ссылки.
Обе абдоминальные молочные железы (L4 и R4) лактирующих CD-I мышей инфицировали при введении в молочную железу 100 КОЕ (колониеобразующих единиц) Staphylococcus aureus Newbould 305 (АТСС 29740).
Мышей подвергали лечению при введении в молочную железу (IMAM) энрофлоксацина, фосфомицина и комбинации энрофлоксацина и фосфомицина, как подробно приведено в Таблице 1, через четыре часа после инокуляции. Каждая группа лечения состояла, по крайней мере, из 3 мышей (6 желез). Через 14 часов (18 часов после инокуляции) мышей забивали, молочные железы удаляли и оценивали значение КОЕ путем высаживания 10-десятикратных серийных разведений гомогенатов молочных желез. Значение КОЕ выражали как log10. Граница определения составляла 200 КОЕ/г железы. Железы со значением, меньшим 200 КОЕ/г считали свободными от S. aureus (смотри Таблицу 1).
Для каждой группы лечения определяли среднее значение log10 снижения КОЕ путем вычитания среднего значения log10 КОЕ соответствующей группы от среднего значения log10 КОЕ для контрольной группы, которую подвергали лечению.
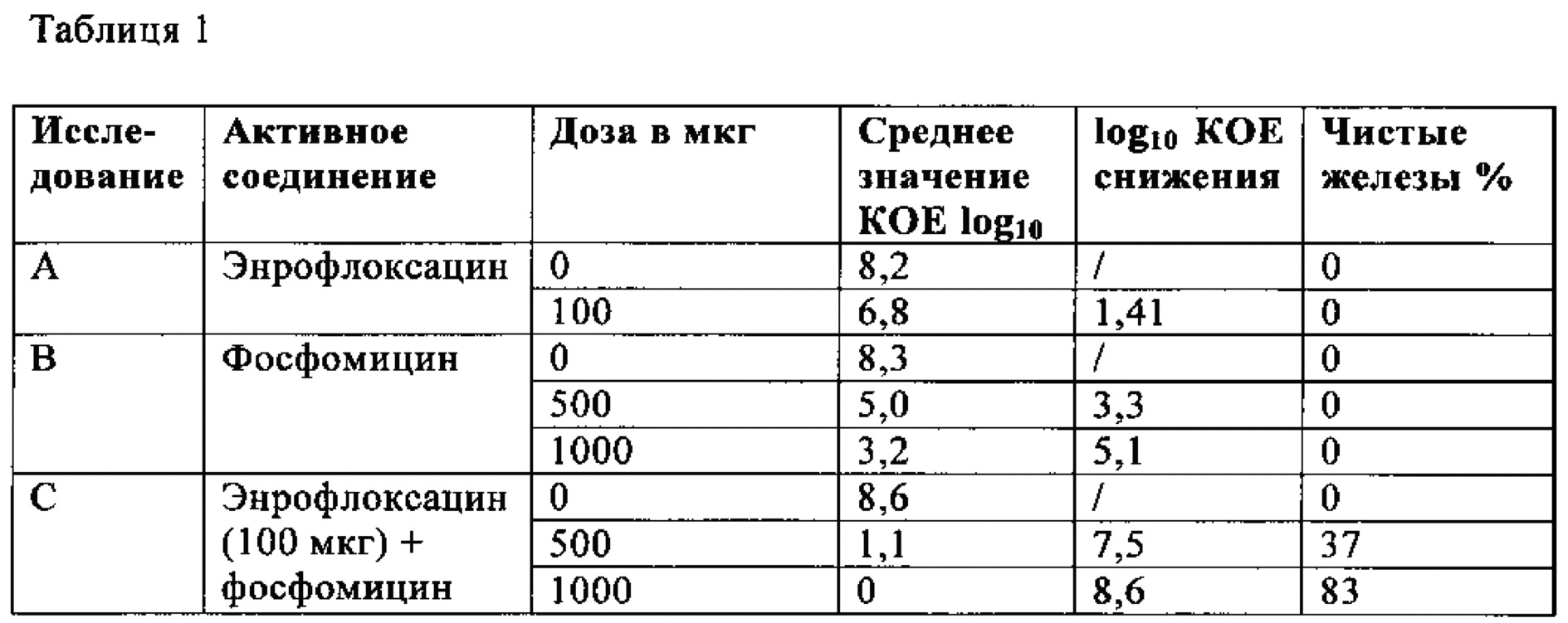
Как видно из Таблицы 1, инсталляция в молочную железу 100 микрограммов энрофлоксацина снижала среднее значение КОЕ на 1,4 log10, но не устраняла инфекцию в инфицированных железах. Кроме того, инсталляция в молочную железу 500 или 1000 микрограммов фосфомицина снижала среднее значение КОЕ на 3,3 или 5,1 log10, но не устраняла инфекцию в инфицированных железах. Однако синергетическая эффективность демонстрируется для комбинированного лечения при использовании энрофлоксацина и фосфомицина в форме инсталляции в молочную железу 500 и 1000 микрограммов фосфомицина одновременно с 100 микрограммами энрофлоксацина, что обеспечивает устранение инфекции в 37% и 83% инфицированных желез, соответственно.
Пример 7 - МРС для энрофлоксацина-фосфомицина, МРС для цефазолина-фосфомицина, МРС для пирлимицина-фосфомицина.
Концентрация, которая предотвращает селекцию мутантных штаммов (МРС), представляет собой концентрацию лекарственного средства, блокирующего рост, по крайней мере, чувствительных мутантов, полученных за один цикл размножения. Выше этой концентрации клеточный рост требует присутствия двух или более чувствительных мутаций. Поскольку две одновременные мутации предусматриваются как такие, которые возникают редко, также предполагается, что чувствительность развивается редко, когда концентрации лекарственных средств поддерживаются выше значения МРС.Для дополнительной информации о МРС можно например, ссылаться на Drlica, К. (2003). Окно селекции мутантов и антимикробная резистентность. Journal of Antimicrobial Chemotherapy, 52 (1), 11-17; и на Blondeau, J. M. (2009). Новые концепции в анализе чувствительности к антимикробным агентам: концентрация, которая предотвращает селекцию мутантных штаммов, и подход окна селекции мутантов. Veterinary dermatology, 20 (5-6), 383-396.
МРС энрофлоксацина против S. aureus составляет 3 мкг/мл, в то время как МРС фосфомицина против S. aureus составляет до 1500 мкг/мл. Синергетическая активность, то есть ингибирование видимого роста S. aureus в течение 14 дней, была продемонстрирована для комбинации энрофлоксацин-фосфомицин, поскольку МРС энрофлоксацина и фосфомицина в комбинации составляет только 0,12 мкг/мл и 100 мкг/мл для энрофлоксацин и фосфомицина, соответственно.
МРС цефазолина против S. aureus составляет 1,25 мкг/мл, в то время как МРС фосфомицина против S. aureus составляет до 1500 мкг/мл. Синергетическая активность, то есть ингибирование видимого роста S. aureus в течение 14 дней, была продемонстрировано для комбинации цефазолин-фосфомицин, поскольку МРС цефазолина и фосфомицина в комбинации составляет только 0,05 мкг/мл и 100 мкг/мл для цефазолина и фосфомицина, соответственно. МРС цефазолина против Е. coli составляет 64 мкг/мл, в то время как МРС фосфомицина против Е. coli составляет до 200 мкг/мл. Синергетическая активность, то есть ингибирование видимого роста Е. coli в течение 14 дней, была продемонстрировано для комбинации цефазолин-фосфомицин, поскольку МРС цефазолина и фосфомицина в комбинации составляет только 0,8 мкг/мл и 5 мкг/мл для цефазолина и фосфомицина, соответственно.
МРС пирлимицина против S. aureus составляет 2 мкг/мл, то время как МРС фосфомицина против S. aureus составляет до 1500 мкг/мл. Синергетическая активность, то есть ингибирование видимого роста S. aureus в течение 14 дней, была продемонстрировано для комбинации пирлимицин-фосфомицин, поскольку МРС пирлимицина и фосфомицина в комбинации составляет только 0,1 мкг/мл и 100 мкг/мл для пирлимицин и фосфомицина, соответственно.
Пример 8 - In-vivo данные на мышах для комбинации цефазолин-фосфомицин
Такой же эксперимент, как в Примере 1, проводили при использовании цефазолина вместо энрофлоксацина.
Инсталляция в молочную железу 50 или 100 микрограммов цефазолина снижала среднее значение КОЕ на 4,5 или 5,1 log10, соответственно, но не устраняла инфекцию в инфицированных железах. Кроме того, инсталляция в молочную железу 100, 500 или 1000 микрограммов фосфомицина снижала среднее значение КОЕ на 2,0, 3,3 или 5,1 log10, но не устраняла инфекцию в инфицированных железах. Однако синергетическая эффективность демонстрируется для комбинированного лечения при использовании цефазолина и фосфомицина в форме инсталляции в молочную железу 250, 500 и 1000 микрограммов фосфомицина одновременно с 100 микрограммами цефазолина, что обеспечивает устранение инфекции в 14, 57 и 100% инфицированных желез соответственно.
Пример 9 - In-vivo данные на мышах для комбинации амоксициллин-фосфомицин
Такой же эксперимент, как в Примере 1, проводили при использовании амоксициллина вместо энрофлоксацина.
Инсталляция в молочную железу 100 микрограммов амоксициллина снижала среднее значение КОЕ на 1,6 log10, но не устраняла инфекцию в инфицированных железах. Кроме того, инсталляция в молочную железу 1000 микрограммов фосфомицина снижала среднее значение КОЕ на 5,1 log10, но не устраняла инфекцию в инфицированных железах. Однако синергетическая эффективность демонстрируется для комбинированного лечения при использовании амоксициллина в форме инсталляции в молочную железу 1000 микрограммов фосфомицина одновременно с 100 микрограммами амоксициллина, что обеспечивает устранение инфекции в 87% инфицированных желез.
Пример 10 - In-vivo данные на мышах для комбинации пирлимицин-фосфомицин
Такой же эксперимент, как в Примере 1, проводили при использовании пирлимицину вместо энрофлоксацина.
Инсталляция 10 микрограммов пирлимицина в молочную железу мышей с маститом, вызванным инфекцией S. aureus, снижала среднее значение КОЕ на 1,6 log10, но не устраняла инфекцию в инфицированных железах. Кроме того, инсталляция в молочную железу 1000 микрограммов фосфомицина снижала среднее значение КОЕ на 3,3 log10, но не устраняла инфекцию в инфицированных железах. Однако синергетическая эффективность демонстрируется для комбинированного лечения при использовании пирлимицина в форме инсталляции в молочную железу 100, 500 и 1000 микрограммов фосфомицина одновременно с 10 микрограммами пирлимицина, что обеспечивает устранение инфекции в 50, 60 и 100% инфицированных желез, соответственно.
Пример 11 - In-vivo данные клинического мастита у крупного рогатого скота при использовании комбинации цефазолин-фосфомицин
В первом исследовании в реальных условиях молочный рогатый скот с клиническим маститом подвергали лечению в полевых условиях либо при использовании цефазолина и фосфомицина, взятых отдельно, либо комбинации обоих соединений. Как только наблюдали клинические симптомы мастита, такие как отек молочных желез, боль в молочной железе и анормальное молоко, соединения, рецептированные в форме мази на основе парафина, случайным образом вводили в 110 больных четвертей молочной железы, или 400 мг цефазолина на четверть (в 35 четвертей), или 1000 мг фосфомицина на четверть (в 37 четвертей), или 400 мг цефазолина вместе с 1000 мг фосфомицина на четверть (в 38 четвертей). Больные четверти подвергали лечению при использовании этой мази последовательно три раза с интервалами 24 часа между каждым применением. Когда образец молока брали из больных четвертей молочной железы перед лечением на диагностику инфекционного мастита, изолировали патогенные бактерии, которые являются типичными для клинического мастита, то есть представляют собой Streptococus uberis, Staphylococus aureus, Escherichia coli, другие стрептококки и смешанные инфекции указанных видов. Образцы молока снова брали через 1 неделю, 2 недели и 3 недели после лечения. Больные четверти вымени считались вылеченными тогда, когда исчезали клинические симптомы мастита в течение одной недели без необходимости проведения нового лечения антибиотиками, и когда патогенная бактерия, которая является причиной мастита, которую выявляли в диагностическом образце молока непосредственно перед лечением, не может быть изолирована от любых образцов, взятых через одну-три недели после лечения. Скорость лечения инфекционного мастита была выше в четвертях вымени, которые подвергали лечению при использовании мази на основе комбинации (цефазолин вместе с фосфомицином, то есть 17/38 (45%), чем в четвертях, которые подвергали лечению при использовании мази, которая содержит только цефазолин (11/35, 31%) или только фосфомицин (13/37, 35%).
Пример 12 - In vivo данные субклинического мастита у крупного рогатого скота при использовании комбинации цефазолин-фосфомицин
В другом исследовании в реальных условиях молочный рогатый скот с субклиническим маститом, то есть персистентными, хроническими инфекциями вымени, вызванными Staphylococcus aureus, подвергали лечению либо при использовании цефазолина, фосфомицина, взятых отдельно, либо комбинации обоих соединений. Лактирующих коров, производящих молоко с повышенным уровнем соматических клеток (SCC выше 300000 клеток на мл), который представляет собой ключевой параметр для воспаления вымени и индикатор снижения качества молока, подвергали скринингу на инфекцию S. aureus. При подтверждении инфекции соединения, рецептированные в форме мази на основе парафина, случайным образом вводили в 132 четверти пораженных молочных желез в количестве или 400 мг цефазолина на четверть (в 43 четверти), или 1000 мг фосфомицина на четверть (в 47 четвертей), или 400 мг цефазолина вместе с 1000 мг фосфомицина на четверть (в 42 четверти). Пораженные четверти подвергали лечению при использовании этой мази последовательно шесть раз с интервалами двенадцать часов между каждым применением. Образцы молока брали примерно через три и четыре недели после лечения. Инфицированные четверти вымени считались вылеченными тогда, когда S. aureus, которые выявляли в диагностическом образце молока непосредственно перед лечением, не может быть изолирован из любых образцов, взятых через 3 и 4 недели после лечения. Скорость лечения инфекции S. aureus была выше в четвертях вымени, которые подвергали лечению при использовании мази на основе комбинации (цефазолин вместе с фосфомицином), то есть 28/42 (67%), чем в четвертях, которые подвергали лечению при использовании мази, которая содержит только цефазолин (20/43, 46%), или только фосфомицин (27/47, 57%). После лечения уровень воспаления вымени, как измеряется при использовании количества соматических клеток в образцах молока после лечения, был ниже в вымени, которое подвергали лечению при использовании комбинации цефазолин-фосфомицин (46% образцов молока с SCC ниже чем 300000 клеток/мл), чем в вымени, которое подвергали лечению при использовании только цефазолина (30% образцов молока с SCC ниже чем 300000 клеток/мл), или при использовании только фосфомицина (24% образцов молока с SCC ниже чем 300000 клеток/мл). Кроме того, среди вылеченных четвертей также было больше четвертей, в которых уровень воспаления молока возвращался к нормальным показателям (SCC ниже чем 300000 клеток на мл) тогда, когда применяли лечения при использовании комбинации цефазолин-фосфомицин (15/42, 36%), по сравнению с лечением при использовании только цефазолина (10/43, 23%) или при использовании только фосфомицина (9/47, 19%).
Таким образом, молочный рогатый скот с клиническим и субклиническим маститом поддается лучшему излечению при использовании комбинации цефазолина и фосфомицина, чем при использовании единичных соединений, взятых в той же дозе, демонстрируя, таким образом, синергетический эффект комбинации по сравнению с единичными соединениями.

