Результат интеллектуальной деятельности: СЛОЖНЫЙ ЭФИР ФИЛЛИГЕНИНА И ИБУПРОФЕНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к области фармацевтической химии и, в частности, настоящее изобретение относится к способу получения сложного эфира филлигенина и ибупрофена; а также к антивирусному, жаропонижающему, противовоспалительному и анальгезирующему фармакологическим эффектам такого соединения.
Предшествующий уровень техники
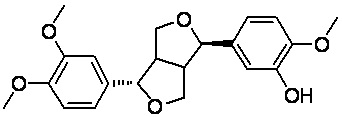
Филлигенин, также обозначаемый как филлигенол, является агликоновой частью филлирина. Он является главным активным ингредиентом растительного вида форзиции пониклой (Forsythia suspense (Thunb. Vahlof) из рода Форзиция (Forsythia) семейства Маслиновые (Oleaceae), структура которого представлена формулой (II). Современные фармакологические исследования показывают, что филлигенин обладает противовирусным, антиоксидантным, антибактериальным, противоопухолевым, противовоспалительным эффектом; способствует снижению уровня липидов в крови, удаляет свободные радикалы и т.п.
|
Молекулы филлигенина являются нестабильными и легко окисляемыми, а молекулярная конфигурация подвержена изменениям в кислой среде. Было установлено, что молекулы филлигенина крайне легко преобразуются в новые метаболиты кишечной флорой, при исследовании метаболизма филлирина, стимулированного кишечными бактериями крыс.
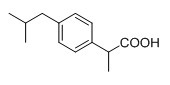
Ибупрофен является нестероидным противовоспалительным и анальгезирующим эффективным медикаментом, структура которого представлена формулой (III), но длительное применение медикамента вызывает такие побочные эффекты, как диспепсия, язва желудка, гепатотоксичность и тому подобное. В 1989 году итальянская компания Angelini разработала и выпустила на рынок сложный эфир ибупрофена и гваякола, синтезированный из ибупрофена и гваякола; при этом ибупрофен-гваяколовый эфир не деградирует в желудочно-кишечном тракте человека, а распадается на ибупрофен и гваякол после поступления в кровь, сохраняя жаропонижающий, анальгезирующий и противовоспалительный эффект ибупрофена in vivo, при этом снижается его раздражающее влияние на желудочно-кишечный тракт и уменьшается гепатотоксичность. В 2004 году Xiuli Zhao из Шэньянского Фармацевтического университета была проведена этерификация ибупрофена эвгенолом для получения фармацевтического соединения эвгенол-ибупрофенового эфира, который также обладает противовирусным, жаропонижающим, анальгезирующим, противовоспалительным эффектом in vivo. Кроме того, фармацевтическое соединение эвгенол-ибупрофеновый эфир обладает улучшенной стабильностью эвгенола (Китайская патентная публикация № CN 1597656A).
До настоящего времени не имеется отчетов и документов о синтезе сложноэфирного соединения филлигенина и его фармакологических эффектах, и таким образом, мы получили филлигенин-ибупрофеновый эфир посредством реакции этерификации филлигенина с ибупрофеном и предполагаем получить новое соединение, являющееся более стабильным и обладающее различными фармакологическими эффектами, такими как противовирусный, жаропонижающий, противовоспалительный и анальгезирующий эффект и т.п.
Cущность изобретения
Целью настоящего изобретения является обеспечение нового противовирусного соединения филлигенин-ибупрофенового эфира, способа его получения и применения, с учетом существующих проблем в предшествующем уровне техники; и филлигенин-ибупрофеновый эфир, обеспеченный настоящим изобретением, обладает противовирусным, жаропонижающим, анальгезирующим и противовоспалительным эффектом, и может применяться для приготовления медикаментов или полезных для здоровья продуктов для лечения с обеспечением противовирусного, жаропонижающего и анальгезирующего эффекта; способ получения филлигенин-ибупрофенового эфира является простым и удобным для выполнения, и пригоден для производства в промышленном масштабе.
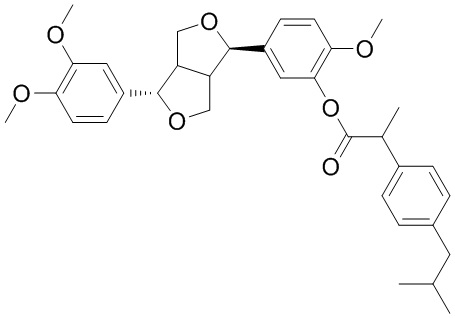
Для достижения цели настоящего изобретения в одном аспекте настоящее изобретение обеспечивает соединение филлигенин-ибупрофеновый эфир с общей структурной формулой, представленной формулой (I):
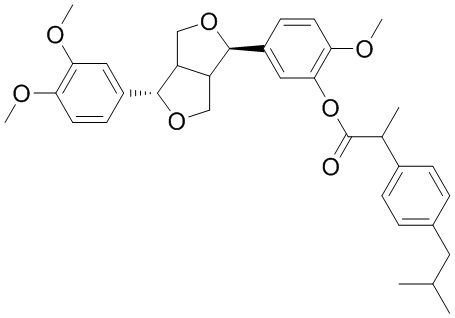 (I)
(I)
В другом аспекте настоящее изобретение обеспечивает способ получения соединения филлигенин-ибупрофенового эфира, включающий этапы, проводимые в следующей последовательности:
(А) Ибупрофен подвергают реакции ацилирования с ацилирующим агентом с получением ибупрофен-ацилхлорида;

и (В) проводят реакцию этерификации между филлигенином и ибупрофен-ацилхлоридом в присутствии катализатора с получением продукта.
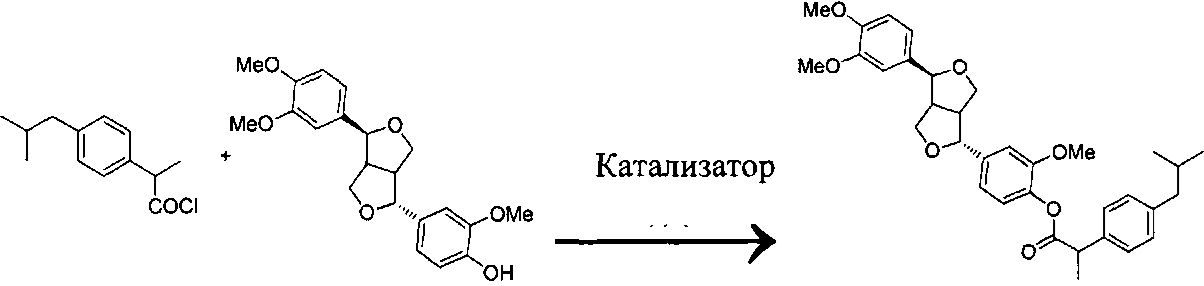
При этом ацилирующий агент на этапе (А) выбран из тионилхлорида, фосфора трихлорида, фосфора пентахлорида, фосфора оксихлорида или фосфора оксипентахлорида.
В частности, температура реакции ацилирования составляет 10-30°С.
В частности, молярное отношение ибупрофена к ацилирующему агенту составляет 1:10-1:12, предпочтительно 1:10.
В частности, время реакции составляет 12-24 часа, предпочтительно 15-24 часа.
В частности, вначале ибупрофен растворяют в органическом растворителе, а затем смешивают с ацилирующим агентом, а затем проводят реакцию ацилирования.
При этом количество используемого органического растворителя является таким, что каждый 1 моль ибупрофена растворяют в 3-4 литрах органического растворителя, предпочтительно 4 литрах органического растворителя.
В частности, органический растворитель выбран из толуола, бензола, ацетона, дихлорметана и трихлорметана, предпочтительно дихлорметана и ацетона, и более предпочтительно дихлорметана.
В частности, способ получения дополнительно включает концентрирование смеси после реакции ацилирования под вакуумом, и удаление органического растворителя для получения ибупрофен-ацилхлорида.
В частности, обработку испарением проводят при пониженном давлении.
В частности, отношение филлигенина к катализатору составляет от 1:1 до 1,2:1, предпочтительно 1:1.
При этом неорганическое основание выбрано из натрия карбоната, калия карбоната, натрия бикарбоната или калия бикарбоната; органическое основание выбрано из пиридина, триэтиламина, N,N-диметилформамида или металла алкоксида.
В частности, металла алкоксид выбран из натрия метанолата или калия трет-бутоксида.
При этом молярное отношение филлигенина на этапе (В) к ибупрофену на этапе (А) составляет от 0,8:1 до 1,2:1, предпочтительно 1:1.
В частности, температура реакции этерификации составляет от 30°C до 70°C, предпочтительно от 40°C до 60°C; время реакции этерификации составляет 12-24 часа, предпочтительно 15-20 часов.
При этом реакцию этерификации на этапе (В) проводят в нагретом состоянии после добавления филлигенина и ибупрофен-ацилхлорида в органический растворитель.
В частности, органический растворитель выбран из толуола, бензола, ацетона, дихлорметана и трихлорметана, предпочтительно, дихлорметана или ацетона.
В частности, вначале филлигенин растворяют в органическом растворителе; затем добавляют катализатор и смесь перемешивают до однородного состояния; затем ибупрофен-ацилхлорид, приготовленный на этапе (А), добавляют в однородную смесь и проводят реакцию этерификации при перемешивании и нагревании.
В частности, органический растворитель выбран из толуола, бензола, ацетона, дихлорметана и трихлорметана, предпочтительно дихлорметана или ацетона.
В частности, количество используемого органического растворителя является таким, что каждый 1 моль филлигенина растворяют в 15-25 литрах органического растворителя, предпочтительно, 20 литрах органического растворителя.
В частности, способ получения дополнительно включает этап (С), где продукт после реакции этерификации подвергают выделению и очистке: (С-1) смесь после реакции этерификации охлаждают, и температура снижается; (С-2) затем смесь подвергают фильтрации, фильтрат подвергают концентрированию, и удаляют растворитель; (С-3) затем твердое вещество после удаления органического растворителя подвергают перекристаллизации для получения филлигенин-ибупрофенового эфира.
При этом смесь после реакции этерификации на этапе (С-1) охлаждают до 20°C-30°C; концентрирование на этапе (С-2) является упариванием охлажденной смеси под вакуумом для удаления органического растворителя; растворителем при перекристаллизации на этапе (С-3) является петролейный эфир или гексан.
Соединением из настоящего изобретения, приготовленным вышеупомянутым способом, является филлигенин-ибупрофеновый эфир, который является твердым белым веществом при комнатной температуре. Структура филлигенин-июбупрофенового эфира была подтверждена и анализирована, как указано ниже.
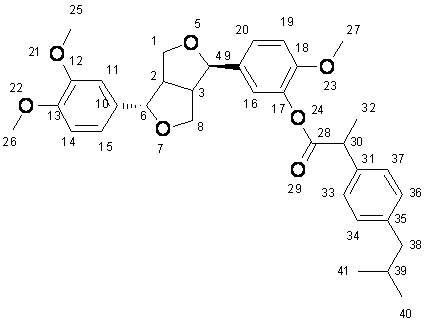
Масс-спектр высокого разрешения: 583,26663; C34H40O7Na+1;
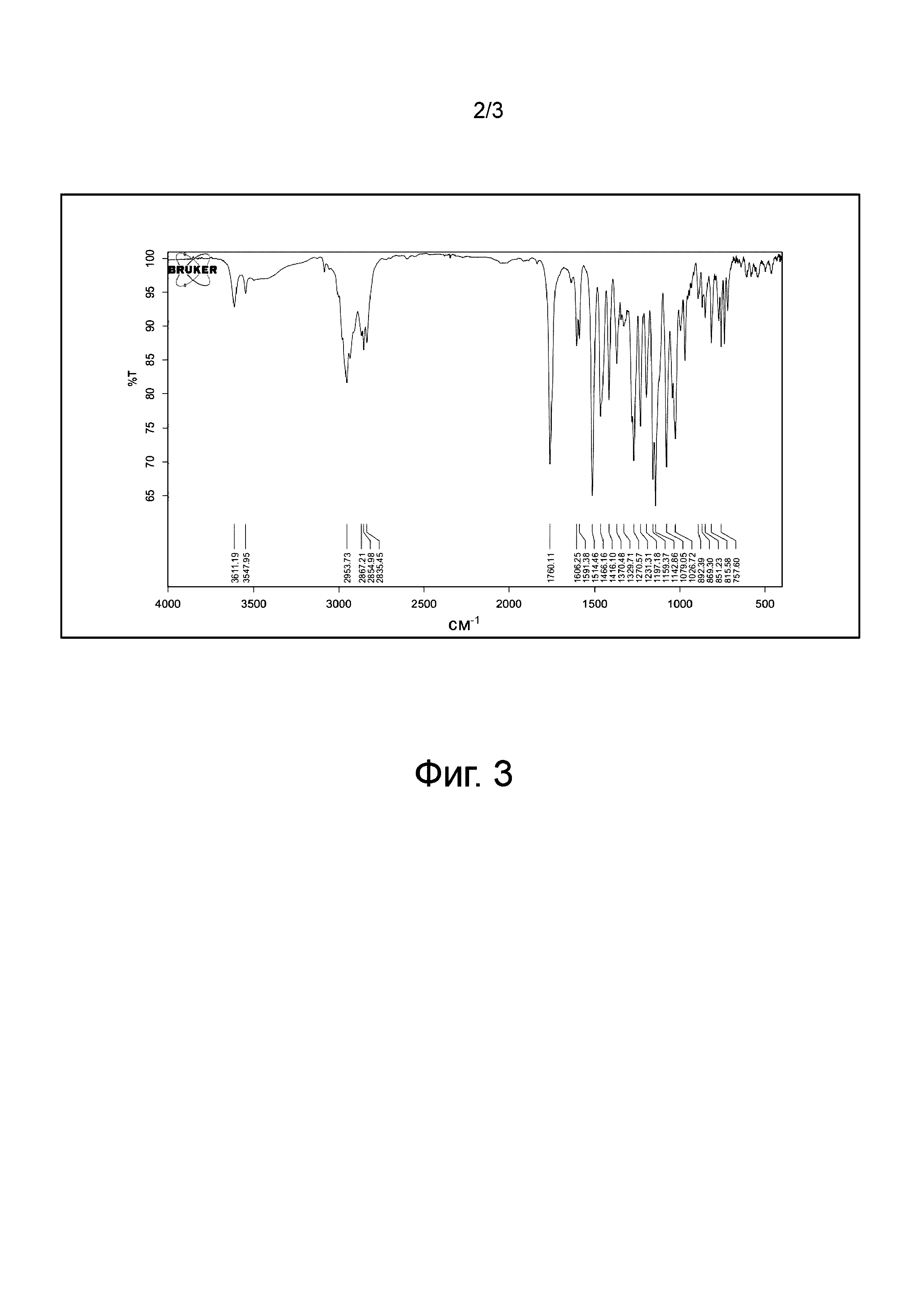
Спектр инфракрасного поглощения: характерный пик поглощения (см-1) 2953,73 (-CH3); 2867,21 (-CH2-); 29835,45 (Ar-OCH3); 1760,11 (C=O); 1606,25, 1591,38, 1514,46 (Ar-CH); и 1270,57, 1042,86 (Ar-O-C).
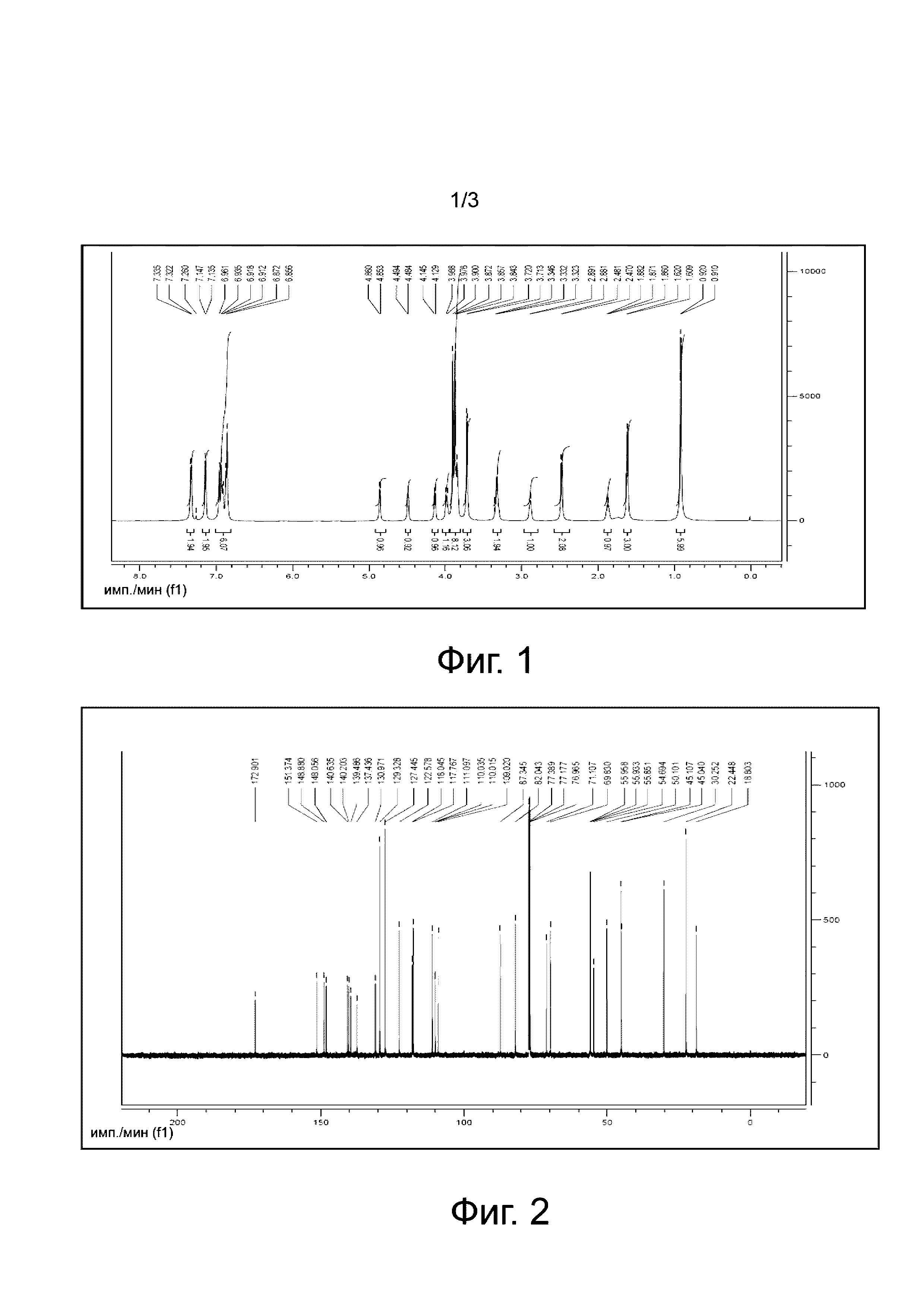
1H-ЯМР: (CDCl3, 600 MHz) δppm: 6,856-6,961 (m, 6H), 7,135-7,145 (m, 2H), 7,322-7,335 (d, 2H, J = 7,8Hz), 4,860-4,853 (d, 1H, J = 4,2 Hz), 4,494-4,484 (d, 1H, J = 6 Hz), 4,145-4,129 (d, 1H, J = 9,6 Hz), 3,988-3,976 (d, 1H, J = 7,2 Hz), 3,900-3,843 (s, 8H), 3,720-3,713 (s, 3H), 3,346-3,323 (s, 2H), 2,891-2,881 (d, 1H, J = 6 Hz), 2,481-2,470 (d, 2H, J = 6,6 Hz), 1,882-1,860 (s, 1H), 1,620-1,609 (d, 3H, J = 6,6 Hz), 0,920-0,910 (s, 6H).
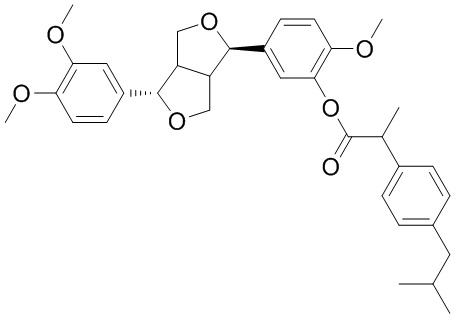
13C-ЯМР: (CDCl3, 125 MHz) δppm: 172,901(C-28), 151,374(C-12), 148,880(C-18), 148,056(C-13), 140,635(C-35), 140,203(C-17), 139,486 (C-10), 137,436(C-9), 130,971(C-31), 129,328(C-33), 127,445(C-36), 127,445(C-37), 122,578(C-34), 118,045(C-20), 117,767(C-16), 111,097(C-15), 110,035(C-14), 110,015(C-19), 109,020(C-11), 87,345(C-6), 82,043(C-4), 71,107(C-1), 69,830(C-8), 55,958(C-OMe), 55,933(C-OMe), 55,851(C-OMe), 54,694(C-2), 50,101(C-3), 45,107(C-38), 45,040(C-30), 30,252(C-39), 22,448(C-40, 41), 18,803(C-32).
В еще одном аспекте настоящее изобретение обеспечивает противовирусное применение филлигенин-ибупрофенового эфира.
В другом аспекте настоящее изобретение обеспечивает применение филлигенин-ибупрофенового эфира в изготовлении противовирусных средств или полезных для здоровья продуктов.
Настоящее изобретение также обеспечивает применение филлигенин-ибупрофенового эфира в изготовлении жаропонижающих, анальгезирующих и противовоспалительных лекарственных средств или средств медицинского назначения.
При этом настоящее изобретение обеспечивает фармацевтическую композицию или композицию медицинского назначения, содержащую филлигенин-ибупрофеновый эфир, обладающий противовирусной, жаропонижающей, анальгезирующей, противовоспалительной эффективностью.
В частности, фармацевтическая композиция включает филлигенин-ибупрофеновый эфир по настоящему изобретению и фармацевтически пригодные вспомогательные вещества.
При этом фармацевтически пригодные вспомогательные вещества означают нетоксичные твердые, полутвердые или жидкие наполнители, разбавители, носители, регуляторы рН, регуляторы ионной силы, агенты для замедленного или контролируемого высвобождения, инкапсулирующие материалы или другие фармацевтические вспомогательные вещества. Используемые носители могут быть приспособлены для соответствующего способа применения, и могут быть включены в инъекционные формы, лиофилизированные порошки (для инъекций), спреи, пероральные растворы, пероральные суспензии, таблетки, капсулы, устойчивые к действию желудочного сока таблетки, пилюли, порошки, гранулы, рецептуры пролонгированного высвобождения или отсроченного высвобождения, и тому подобные, со вспомогательными веществами, хорошо известными специалисту в данной области техники. Предпочтительно, филлигенин-ибупрофеновый эфир из первого аспекта настоящего изобретения применяют посредством инъекции или через пищеварительный тракт, и таким образом, фармацевтическая композиция из настоящего изобретения предпочтительно является составом для инъекций или применения через пищеварительный тракт, т.е. особо предпочтительными являются вспомогательные вещества, приспособленные для составов для применения посредством инъекции или энтерального применения. Таким образом, «применение через пищеварительный тракт» в настоящей заявке означает подход применения медицинских композиций через пищеварительный тракт пациента, включая пероральное применение, внутрижелудочное применение, и ректальное применение и тому подобное, предпочтительно пероральное применение; например, вспомогательные вещества, хорошо известные специалистам в данной области техники, можно применять для получения пероральных растворов, пероральных суспензий, таблеток, капсул, кишечнорастворимых таблеток, пилюль, порошков, гранул, препаратов пролонгированного высвобождения или отсроченного высвобождения, и тому подобного; где препараты для инъекций являются главным образом растворами для инъекций и порошками для инъекций.
Новое соединение филлигенин-ибупрофеновый эфир из настоящего изобретения обладает противовирусной, жаропонижающей, анальгезирующей и противовоспалительной эффективностью, и может применяться для изготовления противовирусных, жаропонижающих, анальгезирующих, противовоспалительных лекарственных средств или средств медицинского назначения; филлигенин-ибупрофеновый эфир готовят путем реакции этерификации, и способ получения имеет преимущества мягких условий реакции, высокого выхода, низкого потребления энергии, безопасности для окружающей среды, легко контролируемых условий процесса, и хорошей контролируемостью качества; и пригоден для производства в промышленных масштабах.
В вышеупомянутой реакции этерификации филлигенин растворяют в подходящем органическом растворителе, и добавляют ибупрофен-ацилхлорид в реакционную систему для проведения реакции этерификации в течение 10-24 часов. После прекращения реакции реакционную смесь промывают водой до нейтрального состояния, добавляют осушитель для итогового удаления влаги, упаривают органический растворитель при пониженном давлении для получения белого твердого вещества и полученное твердое вещество перекристаллизовывают для получения филлигенин-ибупрофенового эфира.
Краткое описание чертежей
Фиг. 1 является 1H-ЯМР спектром филлигенин-ибупрофенового эфира по настоящему изобретению.
Фиг. 2 является 13C-ЯМР спектром филлигенин-ибупрофенового эфира по настоящему изобретению.
Фиг. 3 является спектром инфракрасного (ИК) поглощения филлигенин-ибупрофенового эфира по настоящему изобретению.
Фиг. 4 демонстрирует гистологические срезы легочной ткани экспериментальных мышей, инфицированных вирусом гриппа, вызывающим пневмонию, где (А) является легочной тканью здоровой мыши; (В) является легочной тканью мыши, инфицированной вирусом гриппа, вызывающим пневмонию; (С) является легочной тканью мыши, инфицированной вирусом гриппа, вызывающим пневмонию, после лечения высокой дозой филлигенин-ибупрофенового эфира; (D) является легочной тканью мыши, инфицированной вирусом гриппа, вызывающим пневмонию, после лечения средней дозой филлигенин-ибупрофенового эфира; (Е) является легочной тканью мыши, инфицированной вирусом гриппа, вызывающим пневмонию, после лечения низкой дозой филлигенин-ибупрофенового эфира; и (F) является легочной тканью мыши, инфицированной вирусом гриппа, вызывающим пневмонию, после лечения Тамифлю.
Осуществление изобретения
Настоящее изобретение далее описано более подробно посредством следующих примеров. Однако эти примеры являются иллюстрациями настоящего изобретения и не должны рассматриваться как ограничивающие объем настоящего изобретения. Далее, реагенты и сырьевые материалы в примерах могут быть получены коммерческим путем; если они отсутствуют, можно использовать указания по органическому синтезу, указания по применению лекарств и инструкции от производителей соответствующей аппаратуры и реагентов, и тому подобное.
Пример 1
1. Реакция ацилирования
Ибупрофен (2,06 г, 0,01 моль) вносили в трехгорлую колбу, и растворяли в 40 мл дихлорметана; в трехгорлую колбу добавляли реагент для ацилирования тионилхлорид (11,9 г, 0,1 моль), реакцию проводили при комнатной температуре (20°C) в течение 15 часов, и выпаривали дихлорметан под сниженным давлением (т.е. в условиях вакуума) для получения ибупрофен-ацилхлорида, где молярное отношения ибупрофена к ацилирующему агенту составило 1:10.
2. Этерификация
Филлигенин (3,72 г, 0,01 моль) помещали в трехгорлую колбу, содержащую 200 мл ацетона, и смесь перемешивали до однородного состояния; затем добавляли катализатор калия карбонат (1,5 г, 0,01 моль), и смесь перемешивали до однородного состояния; затем ибупрофена ацилхлорид (2,24 г, 0,01 моль), приготовленный на этапе (1), добавляли по каплям в трехгорлую колбу; смесь нагревали до 60°C при перемешивании, и проводили реакцию этерификации в течение 15 часов при сохранении температуры 60°C.
3. Выделение и очистка
Полученную смесь после реакции этерификации охлаждали до комнатной температуры (20°C-25°C), смесь фильтровали, твердый осадок удаляли, и фильтрат упаривали под сниженным давлением для извлечения ацетонового растворителя и получения твердого осадка. Полученное твердое вещество после удаления растворителя растворяли в дихлорметане, полученный раствор промывали водой до нейтрального состояния и сушили безводным натрия сульфатом, и дихлорметановый растворитель упаривали под вакуумом (т.е. сниженным давлением) для получения белого твердого вещества.
Полученное белое твердое вещество подвергали перекристаллизации петролейным эфиром до получения филлигенин-ибупрофенового эфира (5,49 г) с выходом 98%.
Филлигенин-ибупрофеновый эфир является белым твердым веществом, точка плавления 110°C; растворимость: растворим в метаноле, хлороформе, дихлорметане и тому подобном.
Масс-спектр высокого разрешения: 583,26663 C34H40O7Na+1; молекулярная масса: 561.
Спектр поглощения в инфракрасной области: характерный пик поглощения (см-1) 2953,73 (-CH3); 2867,21 (-CH2-); 29835,45 (Ar-OCH3); 1760,11 (C=O); 1606,25, 1591,38, 1514,46 (Ar-CH); 1270,57, 1042,86 (Ar-O-C), как показано на Фиг. 3.
1H-ЯМР: (CDCl3, 600 MHz) δppm: 6,856-6,961 (m, 6H), 7,135-7,145 (m, 2H), 7,322-7,335 (d, 2H, J = 7,8Hz), 4,860-4,853 (d, 1H, J = 4,2 Hz), 4,494-4,484 (d, 1H, J = 6 Hz), 4,145-4,129 (d, 1H, J = 9,6 Hz), 3,988-3,976 (d, 1H, J = 7,2 Hz), 3,900-3,843 (s, 8H), 3,720-3,713 (s, 3H), 3,346-3,323 (s, 2H), 2,891-2,881 (d, 1H, J = 6 Hz), 2,481-2,470 (d, 2H, J = 6,6 Hz), 1,882-1,860 (s, 1H), 1,620-1,609 (d, 3H, J = 6,6 Hz), 0,920-0,910 (s, 6H), как показано на Фиг.1.
13C-ЯМР: (CDCl3, 125 MHz) δppm: 172,901(C-28), 151,374(C-12), 148,880(C-18), 148,056(C-13), 140,635(C-35), 140,203(C-17), 139,486 (C-10), 137,436(C-9), 130,971(C-31), 129,328(C-33), 127,445(C-36), 127,445(C-37), 122,578(C-34), 118,045(C-20), 117,767(C-16), 111,097(C-15), 110,035(C-14), 110,015(C-19), 109,020(C-11), 87,345(C-6), 82,043(C-4), 71,107(C-1), 69,830(C-8), 55,958(C-OMe), 55,933(C-OMe), 55,851(C-OMe), 54,694(C-2), 50,101(C-3), 45,107(C-38), 45,040(C-30), 30,252(C-39), 22,448(C-40, 41), 18,803(C-32), как показано на фиг. 2.
Пример 2
1. Реакция ацилирования
Ибупрофен (2,06 г, 0,01 моль) вносили в трехгорлую колбу, и растворяли в 40 мл дихлорметана; в трехгорлую колбу добавляли реагент для ацилирования фосфора оксихлорид (15,3 г, 0,1 моль), реакцию проводили при комнатной температуре (30°C) в течение 15 часов и выпаривали дихлорметан под сниженным давлением (т.е. в условиях вакуума) для получения ибупрофен-ацилхлорида, где молярное отношения ибупрофена к ацилирующему агенту составило 1:10.
2. Этерификация
Филлигенин (3,72 г, 0,01 моль) помещали в трехгорлую колбу, содержащую 200 мл растворителя дихлорметана, и смесь перемешивали до однородного состояния; затем добавляли катализатор триэтиламин (1,5 мл, 0,01 моль), и смесь перемешивали до однородного состояния; затем ибупрофена ацилхлорид (2,24 г, 0,01 моль), приготовленный на этапе (1), добавляли по каплям в трехгорлую колбу; смесь нагревали до 40°C при перемешивании и проводили реакцию этерификации в течение 20 часов при сохранении температуры 40°C.
3. Выделение и очистка
Полученную смесь после реакции этерификации охлаждали до комнатной температуры (20°C-25°C), смесь фильтровали, твердый осадок удаляли, и фильтрат упаривали под сниженным давлением для извлечения дихлорметанового растворителя и получения твердого осадка. Полученное твердое вещество после удаления растворителя растворяли в дихлорметане, полученный раствор промывали водой до нейтрального состояния и сушили безводным натрия сульфатом и дихлорметановый растворитель упаривали под вакуумом (т.е. сниженным давлением) для получения белого твердого вещества.
Полученное белое твердое вещество подвергали перекристаллизации петролейным эфиром до получения филлигенин-ибупрофенового эфира (5,44 г) с выходом 97%.
Физико-химические характеристики, спектральные данные и масс-спектральные данные белого твердого вещества, полученного путем рекристаллизации, соответствуют данным филлигенин-ибупрофенового эфира, приготовленного в примере 1.
Пример 3
1. Реакция ацилирования
Ибупрофен (2,06 г, 0,01 моль) вносили в трехгорлую колбу, и растворяли в 40 мл дихлорметана; в трехгорлую колбу добавляли реагент для ацилирования фосфора оксипентахлорид (20,8 г, 0,1 моль), реакцию проводили при комнатной температуре (10°C) в течение 15 часов, и выпаривали дихлорметан под сниженным давлением (т.е. в условиях вакуума) для получения ибупрофен-ацилхлорида, где молярное отношения ибупрофена к ацилирующему агенту составило 1:10.
2. Этерификация
Филлигенин (3,72 г, 0,01 моль) помещали в трехгорлую колбу, содержащую 200 мл растворителя трихлорметана, и смесь перемешивали до однородного состояния; затем добавляли катализатор натрия метоксид (1,5 мл, 0,01 моль), и смесь перемешивали до однородного состояния; затем ибупрофена ацилхлорид (2,24 г, 0,01 моль), приготовленный на этапе (1), добавляли по каплям в трехгорлую колбу; смесь нагревали до 50°C при перемешивании, и проводили реакцию этерификации в течение 17 часов при сохранении температуры 50°C.
3. Выделение и очистка
Полученную смесь после реакции этерификации охлаждали до комнатной температуры (20°C-30°C), смесь фильтровали, твердый осадок удаляли, и фильтрат упаривали под сниженным давлением для извлечения трихлорметанового растворителя и получения твердого осадка. Полученное твердое вещество после удаления растворителя растворяли в дихлорметане, полученный раствор промывали водой до нейтрального состояния и сушили безводным натрия сульфатом, и дихлорметановый растворитель упаривали под вакуумом (т.е. сниженным давлением) для получения белого твердого вещества.
Полученное белое твердое вещество подвергали перекристаллизации петролейным эфиром до получения филлигенин-ибупрофенового эфира (5,49 г) с выходом 98%.
Физико-химические характеристики, спектральные данные и масс-спектральные данные белого твердого вещества, полученного путем рекристаллизации, соответствуют данным филлигенин-ибупрофенового эфира, приготовленного в примере 1.
Опытный пример 1. Анализ противовирусной активности филлигенин-ибупрофенового эфира
1. Анализ противовирусной активности in vitro
1.1. Материалы для анализа
(1) Лекарственные средства
1) Филлигенин-ибупрофеновый эфир: белое твердое вещество (приготовленное в Примере 1), произведенное Dalian Fusheng Natural Drug Development Co., Ltd., и анализированное посредством ВЭЖХ системы, оснащенной УФ детектором и испарительным детектором светорассеяния, с применением способа нормирования площадей пиков; чистота составляет 99,1%.
2) Рибавирин для инъекций: бесцветная прозрачная жидкость, произведенная Henan Runhong Pharmaceutical Co., Ltd., серия №1206261; регистрационное удостоверение №H19993553; 100 мг/мл, использован в качестве лекарственного средства для положительного контроля в этом анализе;
3) Осельтамивир фосфат, поставляемый Национальным институтом контроля фармацевтических и биологических продуктов; серия №101096-200901; 100 мг/дозу, использован в качестве лекарственного средства для положительного контроля в этом анализе.
4) Филлигенин: белый порошок, произведенный Dalian Fusheng Natural Drug Development Co., Ltd., и анализированный посредством ВЭЖХ системы, оснащенной УФ детектором и испарительным детектором светорассеяния, с применением способа нормирования площадей пиков; чистота составляет 99,1%.
5) Ибупрофен: поставляемый Национальным институтом контроля фармацевтических и биологических продуктов; серия №0179-9702.
Вышеупомянутые лекарства растворяли в очищенной воде, фильтровали, стерилизовали, разливали и хранили при 4°C до применения; все лекарства подлежали анализу в настоящем тесте.
(2) Клеточный штамм
Штамм клеток Vero (клетки почки африканской зеленой мартышки) предоставлен Колледжем основных медицинских наук Цзилиньского университета.
(3) Вирусные штаммы
1) Вирус гриппа, вирус парагриппа и респираторно-синцитиальный вирус (РСВ) получены из Института вирусологии Китайской академии профилактической медицины;
2) Вирус Коксаки В3 (CVB3) получен из Уханьского института вирусологии Китайской академии наук;
3) Вирус Коксаки А16 (СохА16) и энтеровирус ЕV71 получены из Сендайского национального госпиталя из Японии;
4) Аденовирус (AdV) был предоставлен Педиатрическим исследовательским отделом Первого госпиталя Медицинского университета Нормана Бетьюна;
5) Вирус простого герпеса I типа (HSV-1) был получен из Национального института контроля фармацевтических и биологических продуктов Министерства здравоохранения.
(4) Основные приборы и реагенты
Кабинет биологической безопасности BHC-1300 II A/B3, AIRTECH
CO2 инкубатор MCO-18AIC, SANYO
Инвертированный микроскоп CKX41, OLYMPUS
Электронные аналитические весы AR1140/C, DHAUS
Среда для культивирования DMEM, HyClone
Эмбриональная телячья сыворотка HyClone
Трипсин Gibco
МТТ Sigma
ДМСО был получен от Tianjin Beilian Fine Chemicals Development Co., Ltd.
1.2. Методы анализа
(1) Приготовление клеток
Клетки Vero культивировали в субкультуре в течение 1-2 суток до формирования слоя и проявления выраженных границ и явной трехмерной ориентации и диоптрии, затем клетки расщепляли панкреатическим ферментом; после появления игольчатых отверстий на клеточной поверхности расщепляющую среду полностью удаляли, затем клетки диспергировали в нескольких миллилитрах культуральной среды, подсчитывали, затем разбавляли примерно до 5×107 клеток/литр с культуральной средой (DMEM, содержащей 10% эмбриональной телячьей сыворотки), и переносили на 96-луночный планшет для культивирования до образования монослоя.
(2) Анализ токсичности лекарства
Анализ цитотоксичности: лекарства разбавляли в соответствии концентрациями, указанными в таблице 1-1 для анализа цитотоксичности.
Таблица 1-1. Справочная таблица по разведениям лекарств (единица: г/л)
|
Вышеуказанные лекарства, разбавленные поддерживающей средой (DMEM, содержащей 2% эмбриональной телячьей сыворотки) до различных концентраций, добавляли по каплям к монослою клеток Vero с 0,2 мл на лунку, и для каждой концентрации лекарства добавляли в шести повторностях в 6 лунок, соответственно. Кроме того, 6 лунок использовали для нормального контроля (без лекарств), а другие 6 лунок использовали в качестве пустого контроля (только среда). Клетки выращивали при 37°C в инкубаторе при 5% CO2. ЦПЭ визуализировали под инвертированным микроскопом и регистрировали ежедневно. Спустя 72 часа добавляли 20 мкл МТТ раствора (5 мг/мл) в каждую лунку, и инкубировали в течение 4 часов. Культуральную среду в каждой лунке удаляли аспирацией, добавляли 100 мкл ДМСО в каждую лунку, встряхивали в течение 5 минут, и измеряли значение ОП при 492 нм для подсчета доли выживших клеток. Долю выживших клеток анализировали с применением пробит-регрессионной модели с применением статистического программного обеспечения SPSS 18.0, и определяли максимальную нетоксичную концентрацию (TC0) и медианную токсичную концентрацию (TC50) лекарств против клеток Vero.
(3) Определение TCID50 для различных вирусов
Проводили 10-кратные серийные разведения для каждого вируса для получения разведений 10-1, 10-2, 10-3, 10-4, 10-5 и 10-6. Каждую из лунок с 6 повторностями на 96-луночном планшете для культивирования, содержащую монослой клеток Vero, инокулировали 100 мкл разбавителя для каждого разведения в последовательности при установке нормального контроля клеток. Планшеты инкубировали в течение 2 часов при 37°C в 5% CO2, затем удаляли раствор вируса, и добавляли 100 мкл среды для культивирования клеток в каждую лунку для последующей инкубации при 37°C в 5% CO2. Цитопатический эффект оценивали под микроскопом от 3 суток, и результаты определяли и регистрировали на 7-8-е сутки. Титр вирусов подсчитывали методом Кербера с максимальным титром разбавления, обеспечивающим положительный цитопатический эффект в 50% лунок с клетками в качестве конечной точки.
Уравнение: LogTCID50=XM+ d-d
d-d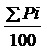
TCID50: доза 50% инфицирования гистиоцитов
ХМ: логарифм наибольшей концентрации разбавления вируса
d: логарифм коэффициента разведения (кратное число)
Σpi: сумма процента цитотоксического эффекта для каждого разведения
(4) Влияние лекарств на вирус-индуцированную цитотоксичность
Культуральную среду в планшетах, покрывающую монослой клеток, удаляли аспирацией, клетки инокулировали агрессивными вирусами в дозе 100TCID50 с последующей инкубацией при 37°C в инкубаторе при 5% CO2 в течение 2 часов, а затем добавляли определенную концентрацию (максимальную нетоксичную концентрацию или около того) каждого лекарственного средства. Каждую концентрацию использовали в 6 повторностях в 6 лунках с 200 мкл на лунку. Рибавирин для инъекций и осельтамивир фосфат служили в качестве групп положительного контроля, в то время как нормальную контрольную группу (без вируса и без лекарства) и группу контроля вирусов (с добавлением вируса, но без лекарства) использовали для оценки эффекта лекарств в отношении вирус-индуцированного цитопатического эффекта (ЦПЭ). Спустя 72 часа определяли значение ОП при длине волны 492 нм с применением МТТ-колориметрического метода, и рассчитывали уровень антивирусного эффекта (ER%) лекарства. Использовали дисперсионный анализ (ANOVA) со статистическим программным обеспечением SPSS 18.0 для определения достоверной разницы антивирусной эффективности лекарств из различных групп.
ER% = (среднее значение ОП в группе с применением лекарств - среднее значение ОП в контрольной группе с вирусом)/(среднее значение ОП в группе контроля клеток - среднее значение ОП в контрольной группе с вирусом)×100%
1.3. Результаты
(1) TCID50 для каждого вируса
Вирус парагриппа: LogTCID50=-2+0,5-
Вирус гриппа: LogTCID50=-2+0,5-
CVB3: LogTCID50=-2+0,5-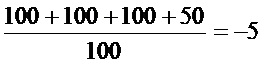
HSV-1: LogTCID50=-2+0,5-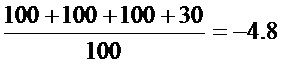
AdV: LogTCID50=-2+0,5-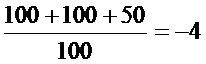
RSV: LogTCID50=-2+0,5-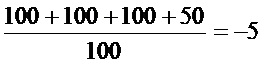
CoxA16: LogTCID50=-2+0,5-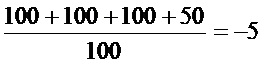
EV71: LogTCID50=-2+0,5-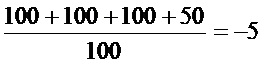
(2) Определение токсичности лекарств
1) Определение цитотоксичности лекарств
Максимальная нецитотоксичная концентрация (TC0), медианная токсичная концентрация (TC50) каждого лекарства против клеток Vero, и концентрации лекарств, используемых в антивирусном анализе, показаны в таблице 1-2.
Таблица 1-2. Результаты анализа цитотоксичности лекарств (единица: г/л)
|
2) Результаты защитного влияния лекарств на вирус-индуцированную цитотоксичность
Результаты анализа антивирусной эффективности лекарств и одностороннего дисперсионного анализа (ANOVA) показаны в таблице 1-3.
Таблица 1-3. Статистические данные антивирусной эффективности лекарств (ЕR%)
|
Примечание: по сравнению с группой вирусного контроля *P<0,05, **P <0,01; по сравнению с филлигенином #P<0,05, ##P<0,01.
Как показано в таблице 1-3, уровень ингибирования и уровень эффективности филлигенин-ибупрофенового эфира в отношении вируса гриппа, вируса парагриппа, вируса простого герпеса I типа (HSV-I) и энтеровируса EV71 были выше 99% с явной разницей, по сравнению с группой вирусного контроля, и различия являются статистически достоверными. Противовирусная эффективность филлигенин-ибупрофенового эфира в отношении ряда вирусов превосходила эффективность филлигенина, рибавирина и осельтамивира фосфата.
2. Анализ противовирусной активности in vivo
2.1. Материалы для анализа
(1) Экспериментальные животные
Куньминские мыши, лабораторные животные №10-5219 были получены из Центра лабораторных животных Исследовательского центра здравоохранения Нормана Бетьюна Цзилиньского университета.
(2) Приборы для детекции и реагенты
|
2.2. Экспериментальные методы
(1) Определение медианной летальной дозы у мышей при инфицировании вирусом гриппа и вирусом парагриппа
Вирус гриппа и вирус парагриппа (клеточный лизат) разбавляли с 10-кратным снижением с получением вирусных жидкостей с концентрациями 10-1, 10-2, 10-3, 10-4 и 10-5. Брали куньминских мышей, 60 из них распределили в группу с вирусом гриппа, остальных 60 - в группу вируса парагриппа, и произвольно распределяли на 6 групп; мышей подвергали легкой анестезии эфиром, и инфицировали назально вирусными жидкостями, содержащими различные разведения, по 0,03 мл на мышь. При этом устанавливали холостую пробу, и вирусную жидкость заменяли солевым раствором. В качестве индексов наблюдения использовали гибель и выживание, и наблюдение проводили каждый день до 14 дня после инфицирования. Мышей, погибших в пределах 24 часов после инфицирования, считали погибшими от неспецифических причин, и не учитывали, а значение LD50 для вирусной жидкости рассчитывали с применением метода Кербера. Формула расчета: LogLD50=XM+ d-d
d-d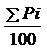 [где: LD50 - медианная летальная доза; XM - логарифм наивысшей концентрации разведения вируса; d - логарифм коэффициента разведения (множитель); Σpi -сумма процента цитопатического эффекта для каждого разведения].
[где: LD50 - медианная летальная доза; XM - логарифм наивысшей концентрации разведения вируса; d - логарифм коэффициента разведения (множитель); Σpi -сумма процента цитопатического эффекта для каждого разведения].
LD50 рассчитывали по методу Кербера. Формула расчета: LogLD50=XM+ d-d
d-d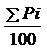 [где: LD50: медианная летальная доза; XM: логарифм наивысшей концентрации разведения вируса; d: логарифм коэффициента разведения (множитель); Σpi: сумма процента цитопатического эффекта для каждого разведения].
[где: LD50: медианная летальная доза; XM: логарифм наивысшей концентрации разведения вируса; d: логарифм коэффициента разведения (множитель); Σpi: сумма процента цитопатического эффекта для каждого разведения].
(2) Исследование противовирусной активности филлигенин-ибупрофенового эфира при пневмонии, индуцированной вирусом гриппа и вирусом парагриппа.
1) Лабораторные животные и разделение на группы
840 куньминских мышей в возрасте 4 недели было взято для выполнения двух анализов. Получали 420 мышей и произвольно распределяли на 21 группу (по 20 в каждой группе) для определения легочного индекса и уровня ингибирования легочного индекса после применения филлигенин-ибупрофенового эфира у мышей, инфицированных вирусом гриппа; эксперимент повторяли 3 раза, по 70 мышей каждый раз. Кроме того, 420 мышей получали и произвольно распределяли на 21 группу (по 20 в каждой группе) для определения титра гемагглютинации вируса в легочной суспензии при применении филлигенин-ибупрофенового эфира; тест повторяли 3 раза, по 70 мышей каждый раз.
2) Способ инфицирования
Кусок адсорбирующей ваты помещали в 200-300 мл стакан, и наливали на него подходящее количество диэтилового эфира (до увлажнения адсорбирующей ваты). Стакан с адсорбирующей ватой переворачивали вверх дном, и помещали в него мышь для анестезии. После проявления у мышей крайнего возбуждения и явной слабости, их помещали на спину и инфицировали назально с 15 LD50 вируса гриппа и вируса парагриппа по 0,03 мл на ноздрю; а в группе нормального контроля суспензию вирусов заменяли физиологическим солевым раствором.
3) Способ применения и применяемые дозы
У каждой мыши применяли внутрижелудочно филлигенин-ибупрофеновый эфир, рибавирин и осельтамивир фосфат за сутки до инфицирования. Филлигенин-ибупрофеновый эфир применяли в наивысшей дозе 13 мг/кг, в средней дозе 8,0 мг/кг, или в низкой дозе 4,0 мг/кг, в то время как доза применения рибавирина составила 58,5 мг/кг, один раз в сутки в течение 5 последовательных дней, а у мышей в группе вирусного контроля применяли физиологический солевой раствор того же самого объема.
4) Индекс наблюдения
1) Определение легочного индекса
На пятые сутки после применения лекарств у мышей предотвращали доступ к питьевой воде, и спустя 8 часов мышей взвешивали, а затем умерщвляли путем обескровливания при энуклеации глаз. Затем извлекали легкие после вскрытия грудины, дважды промывали физиологическим солевым раствором, затем удаляли влагу с поверхности фильтровальной бумагой и взвешивали с применением электронных весов. Легочный индекс и уровень ингибирования легочного индекса рассчитывали с помощью следующих уравнений:
Легочный индекс = Масса легкого мыши/Масса тела мыши × 100%
Уровень ингибирования легочного индекса = (Средний легочный индекс в группе модельной инфекции - Средний в экспериментальной группе)/Средний легочный индекс в группе модельной инфекции × 100%.
(2) Определение титра гемагглютинации вируса в легочной суспензии
Легкие мышей различных групп извлекали на 5 сутки после лечения, и измельчали в гомогенизаторе при низкой температуре; гомогенат разбавляли до 10% суспензии легочной ткани физиологическим солевым раствором; проводили центрифугирование для получения надосадочной жидкости, которую разбавляли в два раза и вносили на планшет для титрования по 0,2 мл на лунку; добавляли 0,2 мл 1% суспензии куриных эритроцитов в каждую лунку; планшет для титрования оставляли при комнатной температуре на 30 минут для наблюдения и регистрации титров гемагглютинации. Конечной точкой была гемагглютинация эритроцитов (++), а титр выражали в кратности разведения суспензии.
(3) Гистоморфологический анализ легких
На 5 сутки после лечения извлекали легкие у мышей разных групп, и наблюдали общие патологические изменения легких невооруженным глазом, и регистрировали. Легкие промывали физиологическим солевым раствором, и удаляли влагу фильтровальной бумагой, и часть легких фиксировали 10% формальдегидом и заливали парафином, и готовили срезы; срезы легочной ткани окрашивали гематоксилином-эозином, затем наблюдали и фотографировали под микроскопом.
2.3. Результаты экспериментов и анализ
(1) Результат определения медианной летальной дозы у мышей при инфицировании вирусом гриппа и вирусом парагриппа
Куньминских мышей в опытных группах инфицировали назально 30 мкл вирусов гриппа и вирусов парагриппа в различных концентрациях; на третьи сутки после инфицирования у всех мышей в первых трех группах (10-1 группе, 10-2 группе и 10-3 группе, на основе концентраций вирусов) проявились различные симптомы разной степени: пиломоторный рефлекс, дрожь, снижение аппетита и тому подобное; на пятые сутки отмечалось нарушение движения; на шестые сутки мыши в группе с наивысшей концентрацией вируса (10-1 группе) начали умирать; гибель отмечалась в остальных группах на седьмые сутки после инфицирования. После завершения наблюдения на 14 сутки подсчитывали смертность мышей в каждой группе, и результаты показаны в таблице 1-4 и таблице 1-5 ниже. При подсчете LD50 вируса гриппа составило разведение 10-2,9, а LD50 вируса парагриппа составило разведение 10-2,5.
Таблица 1-4. Результаты анализа медианной летальной дозы вируса гриппа
|
Значения LD50 вирусов рассчитывали с помощью метода Кербера. Значение LogLD50 вируса гриппа было следующим:
LogLD50=XM+ d-d
d-d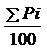 =-1+0,5-(80%+60%+40%+20%+0%+0%)=-2,9
=-1+0,5-(80%+60%+40%+20%+0%+0%)=-2,9
Таблица 1-5. Результаты анализа медианной летальной дозы вируса парагриппа.
|
Значения LD50 вирусов рассчитывали с помощью метода Кербера. Значение LogLD50 вируса парагриппа было следующим:
LogLD50=XM+ d-d
d-d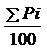 =-1+0,5-(90%+70%+40%+30%+10%+0%)=-2,5
=-1+0,5-(90%+70%+40%+30%+10%+0%)=-2,5
(2) Результаты анализа влияния филлигенин-ибупрофенового эфира на устойчивость к пневмонии, вызванной вирусом гриппа и вирусом парагриппа
1) Определение легочного индекса
После инфицирования мышей вирусом гриппа и вирусом парагриппа средний легочный индекс показал, что по сравнению с группой модели инфекции, филлигенин-ибупрофеновый эфир оказывал определенное защитное влияние в диапазоне концентрации 3,25-13,0 мг/кг/сутки, и все значения легочного индекса явно снижались; терапевтические эффекты в группе с применением высокой дозы филлигенин-ибупрофенового эфира против вируса гриппа и вируса парагриппа были явно лучшими, чем в группе филлигенина (P< 0,05). Результаты можно видеть в таблицах 1-6 и 1-7.
Таблица 1-6. Влияние филлигенин-ибупрофенового эфира на легочный индекс и уровень ингибирования легочного индекса у мышей, инфицированных вирусом гриппа (n=3)
|
По сравнению с группой вирусного контроля: *P<0,05, **P0,01; по сравнению с группой филлигенина: #P<0,05, ##P0,01.
Таблица 1-7. Влияние филлигенин-ибупрофенового эфира на легочный индекс и уровень ингибирования легочного индекса у мышей, инфицированных вирусом парагриппа (n=3)
|
По сравнению с группой вирусного контроля: *P<0,05, **P0,01; по сравнению с группой филлигенина: #P<0,05, ##P0,01.
2) Определение титра вирусной гемагглютинации легочной суспензии
После инфицирования вирусом гриппа и вирусом парагриппа титры вирусной гемагглютинации (InX) легочной ткани в группе модели инфекции составили 32,40 и 33,11, соответственно, после лечения филлигенин-ибупрофеновым эфиром в различных концентрациях в течение 5 суток; титры вирусной гемагглютинации легочной ткани снижались до некоторой степени, и по сравнению с группой модели инфекции, разница была достоверной (P<0,01); при этом титры вирусной гемагглютинации при инфицировании вирусами гриппа и парагриппа при применении высокой дозы и средней дозы филлигенин-ибупрофенового эфира были существенно ниже, чем в модельной группе, а уровни ингибирования были выше, чем в группе филлигенина, с достоверными различиями (P<0,05, p<0,01). Результаты анализа представлены в таблицах 1-8 и 1-9.
Таблица 1-8. Влияние филлигенин-ибупрофенового эфира на титры гемагглютинации легочных суспензий мышей, инфицированных вирусом гриппа
|
По сравнению с группой вирусного контроля: *P<0,05, **P0,01; по сравнению с группой филлигенина: #P<0,05, ##P0,01.
Таблица 1-9. Влияние филлигенин-ибупрофенового эфира на титры гемагглютинации легочных суспензий мышей, инфицированных вирусом парагриппа
|
По сравнению с группой вирусного контроля: *P<0,05, **P0,01; по сравнению с группой филлигенина: #P<0,05, ##P0,01.
3) Результаты гистологического анализа легких
При микроскопическом анализе групп с моделью вирусной пневмонии можно видеть, что интерстициальная ткань легких, такая как бронхи, бронхиолы и стенки альвеол мышей в группах с моделью пневмонии, индуцированной вирусом гриппа и парагриппа, была поражены гиперемией, отеком и лимфоцитарной инфильтрацией, инфильтрацией мононуклеарными клетками, расширением альвеолярной ткани и воспалительной реакцией легочных альвеол. В группах с высокой дозой и средней дозой филлигенин-ибупрофенового эфира поражения легких существенно уменьшались, и морфологическая структура легких отчасти нормализовалась. Патологическую картину можно подробно видеть на фигурах. Результаты микроскопического анализа срезов патологической легочной ткани мышей с моделью пневмонии, вызванной вирусом гриппа, показаны на фигуре 4, на фиг.А показана легочная ткань здоровой мыши; фиг.В демонстрирует легочную ткань мыши с пневмонией, вызванной вирусом гриппа; фиг.С показывает легочную ткань мыши с моделью пневмонии, индуцированной вирусом гриппа, после лечения высокой дозой филлигенин-ибупрофенового эфира; фиг.D показывает легочную ткань мыши с моделью пневмонии, индуцированной вирусом гриппа, после лечения средней дозой филлигенин-ибупрофенового эфира; фиг.Е показывает легочную ткань мыши с моделью пневмонии, индуцированной вирусом гриппа, после лечения низкой дозой филлигенин-ибупрофенового эфира; фиг.F показывает легочную ткань мыши с моделью пневмонии, индуцированной вирусом гриппа, после лечения Тамифлю.
2.4. Выводы
Результаты анализа антивирусной активности in vivo показали, что филлигенин-ибупрофеновый эфир в диапазоне доз 3,25-13 мг/кг/сутки оказывает достоверное ингибирующее влияние на вирус гриппа и вирус парагриппа, а также вирусную пневмонию у мышей в диапазоне доз 3,25 мг/кг/сутки - 13 мг/кг/сутки; позволяет существенно снизить легочный индекс и титр гемагглютинации, также существенно облегчает патологические изменения легочной ткани, и обеспечивает достоверную разницу, по сравнению с контрольной группой; а терапевтические эффекты в группах с применением средней и высокой дозы филлигенин-ибупрофенового эфира были существенно лучше, чем в группе филлигенина (*P<0,05 или **P<0,01), а также показано, что отмечается тенденция к улучшению эффекта, по сравнению с группами рибавирина и осельтамивира фосфата.
Опытный пример 2. Анализ жаропонижающего, анальгезирующего и противовоспалительного эффекта филлигенин-ибупрофенового эфира
1.1. Материалы для анализа
(1) Экспериментальные животные
Крысы Вистар, масса тела 120-250 г, самцы и самки, сертификат лабораторных животных №10-5219; японские белые кролики, самцы, масса тела 1,5-2,0 кг, сертификат лабораторных животных №10-5115, все обеспечены Changchun Gaoxin центром лабораторных животных, корм для животных получен из Отдела лабораторных животных Цзилиньского университета.
(2) Тестируемые лекарственные средства
Филлигенин-ибупрофеновый эфир: белое твердое вещество (приготовленное в Примере 1), произведенное Dalian Fusheng Natural Medicine Development Co., Ltd., имеющее чистоту 99,1% по результатам высокоэффективной жидкостной хроматографии с системой, оснащенной УФ детектором и испарительным светорассеивающим детектором, посредством метода нормализации площади пиков. При использовании для анализа его готовили в необходимой концентрации с 0,5% карбоксиметилцеллюлозой натрия.
1.2. Основные приборы и реагенты
Прибор для измерения отека лап крысы YLS-7A; Отдел оборудования Шаньдунской академии медицинской службы.
Спектрофотометр для анализа в видимой области спектра 722: произведен Shanghai Spectrum Instruments Co., Ltd.
Портативный цифровой термодетектор, модель WSC-411P, 3-й завод Pudong, Шанхай.
Пилокарпин: Тяньцзиньская фармацевтическая фабрика, серия №20130112.
Гистамин: Шанхайский институт биохимии, серия №20130115.
5-гидрокситриптамин: Шанхайский институт биохимии, серия №20130623.
Краситель синий Эванса: Шанхайское отделение заготовки и поставки химических реагентов, серия №20130217.
Хлорфенирамина малеата таблетки: Changchun Economic Development Zone Pharmaceutical Co., серия № 20130801.
Каррагенин: Цзилиньский институт исследования лекарств, серия №20130502.
Парацетамола таблетки: Liaoyuan Baikang Pharmaceutical Co., Ltd., серия №20130512.
Аспирина таблетки: Baicheng Wanda Pharmaceutical Co., Ltd., серия №20130305.
Пивные дрожжи: Beijing AOBOX Biotechnology Co., Ltd., серия №2013020.
Тифозная и паратифозная вакцина: Чанчуньский институт биологических продуктов, серия №20130216.
1.3. Статистический анализ
При статистическом анализе применяли анализ суммы рангов, X2 тест и t-тест с двухсторонним критерием.
2.1. Анализ влияния филлигенин-ибупрофенового эфира на секрецию пота лапой крысы (метод окрашивания)
(1) Материалы и методы
Этот тест разработан для наблюдения изменения секреции пота на основе того, что потовые железы распределены на подушечках лап крысы, а йод и крахмал дают розовое окрашивание при контакте с потом.
Для этого анализа отбирали 350 крыс Вистар с равным количеством самцов и самок с массой тела 120-150 г. Этих крыс произвольно распределяли на 35 групп по массе и полу, в частности, 5 групп для контрольной группы (0,5% карбоксиметилцеллюлозы), 5 групп для каждой дозы 2,5; 5 и 10 мг/кг филлигенин-ибупрофенового эфира, 5 групп для ибупрофена (300 мг/кг), 5 групп для филлигенина (10 мг/кг) и 5 групп для лекарства положительного контроля пилокарпина (35 мг/кг), по 10 крыс на каждую группу. Крыс помещали в самодельную клетку для фиксации, с двумя отверстиями для нижних конечностей. Грязь на правой лапе осторожно вытирали ватным тампоном, смоченным безводным этанолом. Кроме того, применяли подкожную инъекцию для раствора пилокарпина, использовали внутрижелудочное введение для всех других групп. Спустя один час после применения (30 минут после применения в группе пилокарпина) исходный пот на подушечке правой лапы в каждой группе, и пот, выделившийся при борьбе, вначале вытирали сухим ватным тампоном, и наносили на лапу реагент Hetian-Gao Yuan's А (2 г йода, растворенного в 100 мл безводного спирта), а затем, после полного высушивания, наносили тонкий слой реагента Hetian-Gao Yuan's В (однородной смеси 50 г растворимого крахмала и 100 мл касторового масла). Спустя 1, 5, 10, 15 и 20 минут после нанесение реагента В, соответственно, использовали увеличительное стекло для тщательного анализа окраски и числа темно-розовых пятен (т.е. точек выделения пота). При завершении теста проводили статистический анализ в соответствии с двухсторонним анализом суммы рангов, для определения разницы между группами.
(2) Результаты
По сравнению с контрольной группой отмечалось явное влияние в группе филлигенин-ибупрофенового эфира, 10 мг/кг, на секрецию пота лапой крысы после нанесения реагента В на 5, 10, 15 и 20 минут (*P<0,05), и отмечалась характерная стимуляция секреции пота лапой крысы, эквивалентная положительному эффекту пилокарпина; при этом филлигенин-ибупрофеновый эфир в высокой, средней и низкой дозе оказывал достоверное влияние на стимуляцию секреции пота лапой крысы спустя 5-20 минут, 10-20 минут и 20 минут после применения, соответственно; филлигенин-ибупрофеновый эфир в высокой и средней дозе оказывал лучшее терапевтическое влияние на стимуляцию секреции пота спустя 5-20 минут и 10-15 минут после применения, чем филлигенин (#P<0,05), в то время как высокая доза оказывала лучший терапевтический эффект в отношении стимуляции секреции пота спустя 20 минут после применения, чем ибупрофен. См. таблицы 2-1, 2-2, 2-3, 2-4 и 2-5.
Таблица 2-1. Анализ влияния филлигенин-ибупрофенового эфира на секрецию пота лапой крысы (метод окрашивания)
|
Таблица 2-2. Анализ влияния филлигенин-ибупрофенового эфира на секрецию пота лапой крысы (метод окрашивания)
|
Таблица 2-3. Анализ влияния филлигенин-ибупрофенового эфира на секрецию пота нормальной лапой крысы (метод окрашивания)
|
Таблица 2-4. Анализ влияния филлигенин-ибупрофенового эфира на секрецию пота нормальной лапой крысы (метод окрашивания)
|
Таблица 2-5. Анализ влияния филлигенин-ибупрофенового эфира на секрецию пота лапой крысы (метод окрашивания)
|
Стандарт оценки уровня точек секреции пота:
«-» - нет точек секреции пота на поверхности подушечки лапы крысы;
«+» - точки секреции пота изредка наблюдаются на поверхности подушечки лапы крысы, при этом площадь выделения пота составляет менее примерно 10% от поверхности лапы;
«++» - точки секреции пота распределены на поверхности подушечки лапы крысы, при этом площадь выделения пота составляет примерно 11-40% поверхности лапы;
«+++» - точки секреции пота распределены на поверхности подушечки лапы крысы, при этом площадь выделения пота составляет примерно 41-70% поверхности лапы;
«++++» - точки секреции пота равномерно распределены на поверхности подушечки лапы крысы, при этом площадь выделения пота составляет более 70% поверхности лапы.
Сравнение каждой опытной группы и контрольной группы, *P<0,05; сравнение филлигенин-ибупрофенового эфира и филлигенина, #P<0,05. Сравнение филлигенин-ибупрофенового эфира и ибупрофена, ▲P<0,05.
2.2. Анализ влияния филлигенин-ибупрофенового эфира на секрецию пота лапой крысы (метод наблюдения морфологии ткани)
(1) Материал и метод
Этот анализ основан том, что при возбуждении потовой железы крысы в дополнение к повышению секреции пота также меняется морфология эпителиальных клеток потовой железы. Повышение числа и расширение пустых клеток эпителия потовой железы можно наблюдать под оптическим микроскопом. Такая увеличенная вакуоль представляет митохондрии при набухании эпителиальных клеток потовой железы, разрыве, слиянии и увеличении секреторной везикулы под электронным микроскопом; и при морфологическом анализе эпителиальных клеток потовой железы лапы крысы можно изучить секреторную активность потовой железы.
В этом анализе отбирали 70 крыс Вистар с равным числом самцов и самок, с массой тела 120-160 г. Этих крыс распределяли на 7 групп по массе и полу, а именно в группу холостого контроля (0,5% карбоксиметилцеллюлозы), группы 2,5; 5 и 10 мг/кг филлигенин-ибупрофенового эфира, группу ибупрофена (300 мг/кг), группу филлигенина (10 мг/кг), и группу лекарства положительного контроля пилокарпина (35 мг/кг), по 10 крыс на каждую группу. Помимо подкожной инъекции, использованной для раствора пилокарпина, использовали внутрижелудочное применение для всех других групп. Спустя один час после применения филлигенин-ибупрофенового эфира (30 минут после применения пилокарпина) правую нижнюю конечность немедленно отрезали по суставу для немедленного отделения подушечки правой нижней конечности, и помещали в 10% раствор формальдегида, и использовали обычный способ для фиксации, дегидратации, заливки парафином, получения срезов и окрашивания ГЭ. Наблюдали изменение эпителиальных клеток потовых желез подушечки лапы крысы в каждой группе под оптическим микроскопом, главным образом для наблюдения частоты вакуолей (т.е. пустая фракция, процент частоты вакуолей = число вакуолей потовой железы/число наблюдаемых потовых желез ×100%), и определяли разницу между группами с помощью X2 теста для статистического анализа.
(2) Результаты
По сравнению с контрольной группой, наблюдался явный стимулирующий эффект в отношении секреции пота подушечкой лапы крысы в группах филлигенин-ибупрофенового эфира 5 и 10 мг/кг (p<0,01 или p<0,001), см. таблицу 2-6.
Таблица 2-6. Анализ влияния филлигенин-ибупрофенового эфира на секрецию пота подушечкой лапы крысы (метод наблюдения морфологии ткани)
|
По сравнению с контрольной группой - **p<0,01, ***p<0,001; по сравнению с группой филлигенина - #p<0,05, ##p<0,01.
2.3. Влияние филлигенин-ибупрофенового эфира на жар, индуцированный пивными дрожжами, у крыс
(1) Материалы и метод
Отбирали самцов крыс Вистар с массой тела 180-200 г. Перед анализом использовали портативный цифровой термометр WSC-411P для измерения нормальной ректальной температуры дважды (с определенным интервалом каждый раз), и регистрировали среднее значение в качестве нормальной температуры тела крысы. 70 крыс с температурой тела от 36,5°C до 38°C отбирали для произвольного распределения на 7 групп по массе: контрольная (0,5% карбоксиметилцеллюлозы) группа, группы 2,5; 5 и 10 мг/кг филлигенин-ибупрофенового эфира, группа лекарства положительного контроля парацетамола (100 мг/кг), группа ибупрофена (т.е. группа контроля пролекарства, 300 мг/кг), группа филлигенина (100 мг/кг), по 10 крыс на каждую группу. У каждой группы крыс осуществляли подкожную инъекцию в спину 10% свежей суспензии пивных дрожжей по 10 мг/кг для индукции жара. Спустя 6 после применения 10% суспензии свежих пивных дрожжей филлигенин-ибупрофеновый эфир и парацетамол применяли путем внутрижелудочного введения, а в контрольной группе внутрижелудочно вводили равный объем 0,5% карбоксиметилцеллюлозы. Измеряли ректальную температуру спустя 1 час, 2 часа, 3 часа и 4 часа после применения, соответственно. Наблюдали изменения температуры тела, и разницу между группами сравнивали путем t-теста между группами, выражая в проценте жаропонижающего эффекта.
Процент жаропонижающего эффекта = ((Температура тела в определенное время после применения - температура тела спустя 6 часов после индукции жара)/(Температура тела спустя 6 часов после индукции жара)) × 100%
(2) Результаты
Спустя 6 часов после подкожного введения 10% суспензии пивных дрожжей у крыс каждой группы температура тела повышалась примерно на 1,5°C, что существенно отличалось от температуры перед индукцией жара (p<0,001), что указывало, что модель индукции жара пивными дрожжами успешно осуществлена. По сравнению с контрольной группой, в группах средней и высокой дозы (5 и 10 мг/кг) филлигенин-ибупрофенового эфира отмечались значительные эффекты снижения жара спустя 1 час, 2 часа, 3 часа и 4 часа после применения (p<0,05, или p<0,01, P<0,001). По сравнению с группами филлигенина и ибупрофена, группа с высокой дозой (10 мг/кг) филлигенин-ибупрофенового эфира обеспечивала существенное снижение температуры у крыс при индукции жара суспензией пивных дрожжей спустя 1 час, 2 часа, 3 часа и 4 часа после применения, и указанный значительный жаропонижающий эффект был значительно лучше, чем у филлигенина (p<0,01 или P<0,001) и ибупрофена (p<0,05 или p<0,01). Группа со средней дозой (5 мг/кг) филлигенин-ибупрофенового эфира обеспечивала существенное снижение температуры у крыс при индукции жара суспензией пивных дрожжей спустя 1 час, 2 часа, 3 часа и 4 часа после применения, и указанный значительный жаропонижающий эффект был значительно лучше, чем у филлигенина (p<0,05 или p<0,01). Группа со средней дозой (5 мг/кг) филлигенин-ибупрофенового эфира обеспечивала существенное снижение температуры у крыс при индукции жара суспензией пивных дрожжей спустя 2 часа, 3 часа и 4 часа после применения, и указанный значительный жаропонижающий эффект был значительно лучше, чем в группе ибупрофена (p<0,05). Вышеуказанные результаты анализа показали, что снижение жара и жаропонижающий терапевтический эффект соединения филлигенин-ибупрофенового эфира был значительно лучше, чем у его соединений-предшественников филлигенина и ибупрофена. Вышеуказанные результаты можно видеть в таблице 2-7.
2.4. Влияние филлигенин-ибупрофенового эфира на жар, индуцированный тифозной и паратифозной вакциной у кроликов
(1) Материалы и методы
Использовали японских большеухих белых кроликов-самцов с массой тела 1,5-2,0 кг. Перед анализом использовали портативный цифровой термометр WSC-411P для измерения нормальной ректальной температуры дважды (с определенным интервалом каждый раз), и среднее значение использовали в качестве нормальной температуры тела. Затем отбирали 48 японских большеухих белых кроликов с температурой тела 38-39,6°C, и произвольно распределяли в 8 групп по массе; а именно: группа холостого контроля (с введением физиологического солевого раствора), группа модельного контроля (0,5% карбоксиметилцеллюлозы), группа ибупрофена (300 мг/кг), группа филлигенина (10 мг/кг) и группы 1,25; 2,5 и 5 мг/кг филлигенин-ибупрофенового эфира и группа лекарства положительного контроля парацетамола (50 мг/кг). Кроликов фиксировали посредством фиксатора. В группе холостого контроля вводили внутривенно физиологический солевой раствор 1 мл/кг в краевую вену уха. В группе модельного контроля и группах лекарств вводили внутривенно тифозную и паратифозную вакцину по 0,8 мл/кг в краевую вену уха. Когда температура тела кроликов повышалась на более чем 1°C (для этого требовалось примерно 1-1,5 часов, что было ограничено до 1 часа в этом анализе) в группе холостого контроля и модельной группе применяли внутрижелудочно 0,5% карбоксиметилцеллюлозу 1 мл/кг, а в лекарственных группах вводили внутрижелудочно филлигенин-ибупрофеновый эфир и парацетамол. Измеряли ректальную температуру спустя 30, 60, 90, 120, 180 и 240 минут после применения для наблюдения изменения температуры тела, и определяли разницу между группами посредством межгруппового t-теста, выражая результаты в процентах жаропонижающего эффекта.
Процент жаропонижающего эффекта = ((Температура тела в определенное время после применения - температура тела спустя 1 час после индукции жара)/(Температура тела спустя 1 час после индукции жара)) × 100%
(2) Результаты
Спустя 1 час после внутривенного введения тифозной и паратифозной вакцины в краевую вену уха кроликов, температура тела повышалась примерно на 1°C, что указывало, что тифозную и паратифозную вакцину можно применять для модели индукции лихорадки у кроликов. По сравнению с группой холостого контроля, температура тела в модельной группе постоянно увеличивалась во время периода наблюдения 300 минут (p<0,05-p<0,001); по сравнению с модельной группой, в группе с высокой и средней дозой (5 и 10 мг/кг) филлигенин-ибупрофенового эфира после применения в течение 30-240 минут и группе с низкой дозой (5 мг/кг) после применения в течение 60-240 минут отмечался значительный жаропонижающий эффект при лихорадке у кроликов, индуцированной тифозной и паратифозной вакциной (p<0,05-p<0,001), который был существенно лучше, чем в группе соединения-предшественника филлигенина (p<0,05-p<0,001); в группе с высокой и средней дозой (10 мг/кг) филлигенин-ибупрофенового эфира после применения в течение 60-240 минут отмечался значительный жаропонижающий эффект при лихорадке у кроликов, индуцированной тифозной и паратифозной вакциной, который был существенно лучше, чем в группе ибупрофена (p<0,05 или p<0,01). Результаты вышеописанного анализа можно видеть в таблице 2-8.
2.5. Анализ анальгезирующего эффекта филлигенин-ибупрофенового эфира
(1) Материалы и методы
72 куньминских мыши произвольно распределяли на 6 групп, по 12 мышей на группу. (1) - группа холостого контроля (т.е. группа с применением физиологического раствора, 10 мг/кг); (2) группа лекарства положительного контроля аспирина (200 мг/кг); (3) группа ибупрофена (300 мг/кг); (4) группа высокой дозы филлигенин-ибупрофенового эфира (300 мг/кг); (5) группа средней дозы филлигенин-ибупрофенового эфира (150 мг/кг); (6) группа низкой дозы филлигенин-ибупрофенового эфира (75 мг/кг). Спустя 1 час после интрагастрального введения лекарства в каждой группе мышам вводили интраперитонеально 0,7% раствор уксусной кислоты (10 мл/кг). Отмечали корчи у мышей спустя 15 минут после применения. Число корчей учитывали в качестве индекса оценки анальгезирующего эффекта.
(2) Результаты
Анальгезирующий эффект филлигенин-ибупрофенового эфира на боль у мышей, индуцированную уксусной кислотой, можно видеть в Таблице 5. При сравнении групп с низкой, средней и высокой филлигенин-ибупрофенового эфира с группой холостого контроля (физиологического раствора) наблюдалась достоверная разница (P<0,01), что указывало, что во всех группах с разными дозами филлигенин-ибупрофенового эфира отмечается анальгезирующий эффект. При этом анальгезирующий терапевтический эффект высокой дозы филлигенин-ибупрофенового эфира был выдающимся, и превосходил положительные эффекты лекарства положительного контроля аспирина и пролекарства ибупрофена. См. подробности в таблице 2-9.
Таблица 2-9. Влияние филлигенин-ибупрофенового эфира на боль у мышей, индуцированную уксусной кислотой
|
По сравнению с группой холостого контроля - *P<0,01; сравнение групп с различными дозами с ибупрофеном - #P<0,01.
2.6. Влияние филлигенин-ибупрофенового эфира на отек конечностей крысы, индуцированный каррагенином
(1) Материалы и методы
70 крыс-самцов Вистар с массой тела 120-150 г произвольно распределяли в 7 групп по массе, т.е. группу холостого контроля (0,5% карбоксиметилцеллюлозы), группы филлигенин-ибупрофенового эфира 2,5; 5 и 10 мг/кг, группу пролекарства ибупрофена (300 мг/кг), группу филлигенина (10 мг/кг) и группу лекарства положительного контроля аспирина (200 мг/кг), по 10 крыс на каждую группу. В опытных группах проводили применение путем сублингвальной внутривенной инъекции. Перед анализом использовали метод измерения с увеличением капилляров для определения нормального объема правой задней лапы у крыс каждой группы. Чтобы избежать ошибок, участок измерения фиксировали, и операцию проводил один индивидуум до и после применения. Среднее значение по результатам двух измерений брали в качестве нормального объема правой задней лапы у крыс перед применением. После применение немедленно проводили подкожную инъекцию 1% каррагенина 0,1 мл в подушечку правой задней лапы для индукции воспаления. Объем правой лапы измеряли спустя 15, 30, 60, 120, 180, 240, 300 и 360 минут после индукции воспаления. Разницу между группами определяли посредством межгруппового t-теста, анализируя процент разницы (отношение отека) объема лапы до и после индукции воспаления у крыс.
Отношение отека = ((Объем правой задней лапы после индукции воспаления - объем правой задней лапы до применения)/(Объем правой задней лапы перед применением)) × 100%.
Результаты
По сравнению с группой холостого контроля, в группе с высокой дозой филлигенин-ибупрофенового эфира отмечался значительный ингибирующий эффект (p<0,05-p<0,001) в отношении отека лапы крысы, индуцированного каррагенином, в течение 30-360 минут после применения, который был значительно лучше, чем у пролекарства филлигенина (p<0,05-p<0,001); а терапевтический эффект спустя 30 минут после применения был явно лучше, чем у пролекарства ибупрофена (p<0,05). В группе со средней дозой филлигенин-ибупрофенового эфира отмечались значительные ингибирующие эффекты (p<0,05-p<0,01) в отношении отека лапы крысы, индуцированного каррагенином, спустя 30-240 минут после применения; его терапевтический эффект спустя 30-120 минут после применения был явно выше, чем у пролекарства филлигенина, а терапевтический эффект спустя 240 мин после применения был явно лучше, чем у пролекарства ибупрофена. Результаты настоящего теста показали, что филлигенин-ибупрофеновый эфир обладал явным противовоспалительным эффектом, и его терапевтический эффект лучше эффекта пролекарств филлигенина и ибупрофена. См. таблицу 2-10.
Таблица 2-7. Влияние филлигенин-ибупрофенового эфира на лихорадку у крыс, индуцированную пивными дрожжами (
 ±s, n=10)
±s, n=10)
|
По сравнению с нормой (до индукции жара) ###P<0,001; по сравнению с модельной контрольной группой - *P<0,05, **P<0,01, ***P<0,001
Сравнение филлигенин-ибупрофенового эфира и группы ибупрофена ΔP<0,05, ΔΔP<0,01
Сравнение филлигенин-ибупрофенового эфира и группы филлигенина ▲P<0,05, ▲▲P<0,01, ▲▲▲P<0,001
Таблица 2-8. Влияние филлигенин-ибупрофенового эфира на повышение температуры тела кроликов, вызванное тифозной и паратифозной вакциной (
 ±s, n=6)
±s, n=6)
|
По сравнению с группой холостого контроля - #p<0,05, ##p<0,01, ###p<0,001; по сравнению с модельной контрольной группой - *p<0,05, **p<0,01, ***p<0,001; сравнение группы филлигенин-ибупрофенового эфира и ибупрофена - ΔP<0,05; ΔΔP<0,01; сравнение группы филлигенин-ибупрофенового эфира и филлигенина - ▲P<0,05, ▲▲P<0,01, ▲▲▲P<0,001
Таблица 2-10. Ингибирующий эффект филлигенин-ибупрофенового эфира на отек лапы крысы, индуцированный каррагенином (
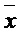 ±s, n=10).
±s, n=10).
|
Сравнение с группой холостого контроля *P<0,05, **P<0,01, ***P<0,001;
Сравнение групп филлигенин-ибупрофенового эфира и ибупрофена: ΔP<0,05, ΔΔP<0,01, ΔΔΔP<0,001
Сравнение групп филлигенин-ибупрофенового эфира и филлигенина: ▲P<0,05, ▲▲P<0,01, ▲▲▲P<0,001

 ±S)
±S)
