АНТИТЕЛА К ИНТЕРЛЕЙКИНУ 6 И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет по предварительном изобретении США на патент №61/716802, поданной 22 октября 2012 г. в соответствии с §119 35 U.S.C. (Свода законов США), полное содержание которой включено в данную заявку посредством отсылки.
УРОВЕНЬ ТЕХНИКИ
Человеческий интерлейкин-6 (IL6), секретируемый гликопротеин, содержащий 184 остатка аминокислот (21 кДа), имеет структуру четырехспирального пучка. IL6 представляет собой многофункциональный цитокин, который действует на различные типы клеток, например В-клетки, Т-клетки, фибробласты, гепатоциты, остеокласты, нейральные клетки, мезангиальные клетки, эпидермальные кератиноциты и гематопоэтические клетки-предшественники, путем связывания с двумя различными рецепторными белками, рецептором IL6 (IL6R) и гликопротеином 130 (gp130). Образование комплекса IL6/IL6R/gp130 преобразует внутриклеточные сигнальные пути, включая те, которые опосредованы (1) фосфатидилинозит-3'-киназой (PI3K), (2) митоген-активированной протеинкиназой (МАК), и (3) Янус-тирозинкиназой (JAK)-трансдуктором сигналов и активатором транскрипции 1 и 3 (STAT1 и STAT3).
IL6 функционирует как иммунный регулятор, фактор клеточного роста, регулятор метаболизма кальция, фактор дифференцировки клеток и индуктор синтеза белков острой фазы, предотвращающих активацию некоторых эффекторных клеток. В печени IL6 индуцирует образование различных белков острой фазы, таких как сывороточный амилоид A (SAA), С-реактивный белок (CRP), гепцидин, фибриноген и гаптоглобин, а также антихимотрипсин. Значение IL6 в патогенезе различных заболеваний было описано в целом ряде исследований, включая исследование хронических воспалительных заболеваний, аутоиммунных болезней (например, ревматоидного артрита, болезни Крона, болезни Каслмана и псориаза), рака (например, множественной миеломы, лейкоза, рака молочной железы, рака поджелудочной железы, рака простаты и других различных видов рака) и кахексии и коронарного заболевания сердца.
Следовательно, создание новых антагонистов IL6 для применения при лечении заболеваний, связанных с сигнальными путями IL6, представляет большой интерес.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на идентификации ряда типичных антител к IL6, например 1-4-62, Ag1-4-6 (известно также как FB704) или HAg1T-3-10, которые неожиданно показали высокую аффинность и специфичность в отношении человеческого IL6 и превосходную активность при ингибировании IL6-индуцированной клеточной пролиферации (например, пролиферации раковых клеток) и продуцирования цитокинов (например, образования воспалительных цитокинов), ангиогенеза, кахексии, индуцированной раковым заболеванием, развития метастазов рака. Такие антитела также значительно повышают противораковую активность других химиотерапевтических агентов, таких как оксалиплатин, гемцитабин и доцетаксел.
В соответствии с вышесказанным один из аспектов данного изобретения относится к выделенному антителу, которое связывается с человеческим интерлейкином 6 (IL6), включающему:
(а) вариабельную область тяжелой цепи (VH), которая содержит гипервариабельную область тяжелой цепи 1 (НС CDR1), имеющую последовательность SEQ ID NO: 2, гипервариабельную область тяжелой цепи 2 (НС CDR2), имеющую последовательность SEQ ID NO: 4, гипервариабельную область тяжелой цепи 3 (НС CDR3), имеющую последовательность SEQ ID NO: 6 или SEQ ID NO: 16; или
(б) вариабельную область легкой цепи (VL), которая содержит гипервариабельную область легкой цепи 1 (LC CDR)1, имеющую последовательность SEQ ID NO: 9, гипервариабельную область легкой цепи 2 (LC CDR2), имеющую последовательность SEQ ID NO: 11, и гипервариабельную область легкой цепи 3 (LC CDR3), имеющую последовательность SEQ ID NO: 13 или SEQ ID NO: 15.
Согласно некоторым вариантам выделенное антитело к IL6 включает (i) VH, которая содержит НС CDR1, имеющую последовательность SEQ ID NO: 2, НС CDR2, имеющую последовательность SEQ ID NO: 4, и НС CDR3, имеющую последовательность SEQ ID NO: 6; или (ii) VH, которая содержит НС CDR1, имеющую последовательность SEQ ID NO: 2, НС CDR2, имеющую последовательность SEQ ID NO: 4, и НС CDR3 последовательности SEQ ID NO: 16. Согласно одному из примеров антитело включает VH, которая содержит аминокислотную последовательность, показанную как SEQ ID NO: 17 или SEQ ID NO: 18.
Согласно другим вариантам выделенное антитело к IL6 включает (i) VL, которая содержит LC CDR1, имеющую последовательность SEQ ID NO: 9, LC CDR2, имеющую последовательность SEQ ID NO: 11, и LC CDR3, имеющую последовательность SEQ ID NO: 13; или (ii) VL, которая содержит LC CDR1, имеющую последовательность SEQ ID NO: 9, LC CDR2, имеющую последовательность SEQ ID NO: 11, и LC CDR3, имеющую последовательность SEQ ID NO: 15. Согласно одному из примеров антитело также включает VL, которая содержит аминокислотную последовательность SEQ ID NO: 19 или SEQ ID NO: 20.
Примеры антител к IL6, описанных в данном изобретении, включают, но без ограничения:
(i) антитело, включающее VH, которая содержит НС CDR1, имеющую последовательность SEQ ID NO: 2, НС CDR2, имеющую последовательность SEQ ID NO: 4 и НС CDR3, имеющую последовательность SEQ ID NO: 6; и VL, которая содержит LC CDR1, имеющую последовательность SEQ ID NO: 9, LC CDR2, имеющую последовательность SEQ ID NO: Ни CDR3, имеющую последовательность SEQ ID NO: 13;
(ii) антитело, включающее VH, которая содержит НС CDR1, имеющую последовательность SEQ ID NO: 2, НС CDR2, имеющую последовательность SEQ ID NO: 4, и НС CDR3, имеющую последовательность SEQ ID NO: 16 и VL, которая содержит LC CDR1, имеющую последовательность SEQ ID NO: 9, LC CDR2, имеющую последовательность SEQ ID NO: 11, и CDR3, имеющую последовательность SEQ ID NO: 13;
(iii) антитело, включающее VH, которая содержит НС CDR1, имеющую последовательность SEQ ID NO: 2, НС CDR2, имеющую последовательность SEQ ID NO: 4, и НС CDR3, имеющую последовательность SEQ ID NO: 6, и VL, которая содержит LC CDR1, имеющую последовательность SEQ ID NO: 9, LC CDR2; имеющую последовательность SEQ ID NO: 11, и CDR3, имеющую последовательность SEQ ID NO: 15;
(iv) антитело, включающее VH, которая содержит НС CDR1, имеющую последовательность SEQ ID NO: 2, НС CDR2, имеющую последовательность SEQ ID NO: 4, и НС CDR3, имеющую последовательность SEQ ID NO: 16, и VL, которая содержит LC CDR1, имеющую последовательность SEQ ID NO: 9, LC CDR2, имеющую последовательность SEQ ID NO: 11, и CDR3, имеющую последовательность SEQ ID NO: 15;
(v) антитело, включающее VH, которая содержит аминокислотную последовательность SEQ ID NO: 17 и VL, которая содержит аминокислотную последовательность SEQ ID NO: 19;
(vi) антитело, включающее VH, которая содержит аминокислотную последовательность SEQ ID NO: 17 и VL, которая содержит аминокислотную последовательность SEQ ID NO: 20; и
(vii) антитело, включающее VH, которая содержит аминокислотную последовательность SEQ ID NO: 18 и VL, которая содержит аминокислотную последовательность SEQ ID NO: 19; и
(viii) антитело, включающее VH, которая содержит аминокислотную последовательность SEQ ID NO: 18, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 20.
Любое из антител, описанных в данном изобретении, может быть полноразмерным антителом или его антигенсвязывающим фрагментом, который может представлять собой Fab или (Fab')2. Альтернативно, антитело к IL6 может быть одноцепочечным антителом, гуманизированным антителом или человеческим антителом.
Согласно другому аспекту настоящего изобретения оно предусматривает нуклеиновую кислоту, включающую нуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи антитела (VH), вариабельную область легкой цепи антитела (VL) или обе указанных области, при этом VH и VL являются областями, описанными в данном изобретении.
Согласно еще одному аспекту данное изобретение предусматривает вектор (например, экспрессионный вектор), содержащий любую из нуклеиновых кислот, описанных в данном изобретении, и клетку-хозяина, включающую такой вектор.
Согласно еще одному аспекту данное изобретение предусматривает способ получения антитела, которое связывается с человеческим IL6, включающий: (i) культивирование клетки-хозяина по пункту 40 в условиях, обеспечивающих экспрессию антитела, и, необязательно, (ii) сбор антитела.
Другой аспект настоящего изобретения относится к композиции (например, к фармацевтической композиции), содержащей (а) любое из антител к IL6, описанных в данном изобретении, любую из нуклеиновых кислот, описанных в данном изобретении, или любой из векторов, описанных в данном изобретении, и (б) носитель, такой как фармацевтически приемлемый носитель.
Согласно другим вариантам любая из композиций, описанных в данном изобретении, содержит также другой противораковый агент или противоревматическое лекарство, меняющее течение болезни (DMARD). Примеры противораковых агентов включают, но без ограничения, доцетаксел, оксалиплатин и гемцитабин. Примеры (DMARD) включают, но тоже без ограничения, метотрексат, азатиоприн, хлорохин, гидроксихлорохин, циклоспорин А и сульфасалазин.
Согласно еще одному аспекту настоящее изобретение предусматривает способ лечения заболевания, ассоциированного с IL6, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества любого из антител к IL6, описанных в данном изобретении, или любой из нуклеиновых кислот, которые кодируют такие антитела к IL6. Примеры заболеваний, ассоциированных с IL6, включают, но без ограничения, воспалительное расстройство, аутоиммунные болезни, ангиогенез и рак.
Согласно некоторым вариантам данного изобретения заболевание, ассоциированное с IL6, представляет собой рак, который может являться множественной миеломой, лейкозом, раком молочной железы, раком поджелудочной железы, раком легкого, раком яичника, раком полости рта и раком простаты. В соответствии с некоторыми примерами количество антитела или кодирующей нуклеиновой кислоты является эффективным для уменьшения метастатических опухолей или кахексии, связанной с наличием рака. Согласно другим примерам способ также включает введение субъекту, нуждающемуся в этом, другого противоракового агента, например доцетаксела, оксалиплатина и гемцитабина.
Согласно другим вариантам заболевание, ассоциированное с IL6, представляет собой аутоиммунное заболевание, например, ревматоидный артрит (RA), болезнь Крона, болезнь Каслмана, рассеянный склероз, анкилозирующий спондилит, псориатический артрит или псориаз. Согласно некоторым примерам способ, описанный в данном изобретении, включает также введение субъекту одного или более модифицирующих болезнь противоревматических средств (DMARDs), например метотрексата, азатиоприна, хлорохина, гидроксихлорохина, циклоспорина А и сульфасалазина.
В объем данного изобретения входят также фармацевтические композиции для применения при лечении заболевания, ассоциированного с IL6, при этом фармацевтическая композиция содержит (а) любое из антител к IL6 или любую (любой) из нуклеиновых кислот/векторов, описанных в данном изобретении; (б) фармацевтически приемлемый носитель и, необязательно, (в) противораковый агент или DMARD, описанные в данном изобретении. Примеры болезней, ассоциированных с IL6 включают, но без ограничения, воспалительное расстройство, аутоиммунные заболевания (например, ревматоидный артрит (RA), болезнь Крона, болезнь Каслмана, рассеянный склероз, анкилозирующий спондилит, псориатический артрит или псориаз), ангиогенез, рак (например, множественную миелому, лейкоз, рак молочной железы, рак поджелудочной железы, рак легкого, рак яичника, рак полости рта и рак простаты), метастазы опухолей, кахексию, связанную с наличием рака.
Кроме того, настоящее изобретение предусматривает применение любого из антител к IL6 или любой из кодирующих нуклеиновых кислот в лекарственном средстве или для приготовления лекарственного средства для лечения заболевания или состояния, ассоциированных с IL6, таких как заболевания, описанные в данном изобретении.
Подробности, касающиеся одного или более вариантов настоящего изобретения, приведены в описании ниже. Другие признаки или преимущества данного изобретения будут очевидны из следующих рисунков и подробного описания некоторых вариантов изобретения, а также из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
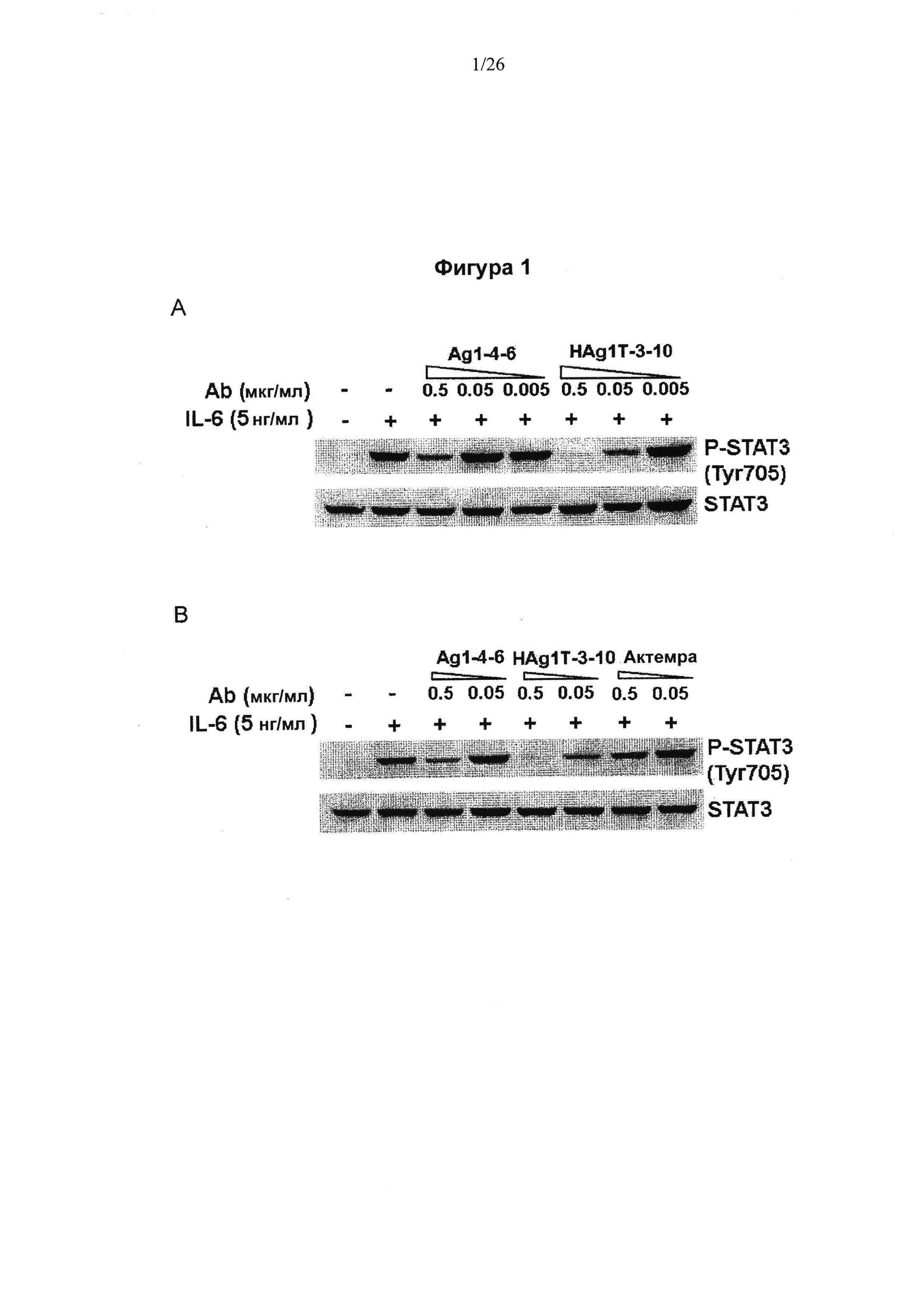
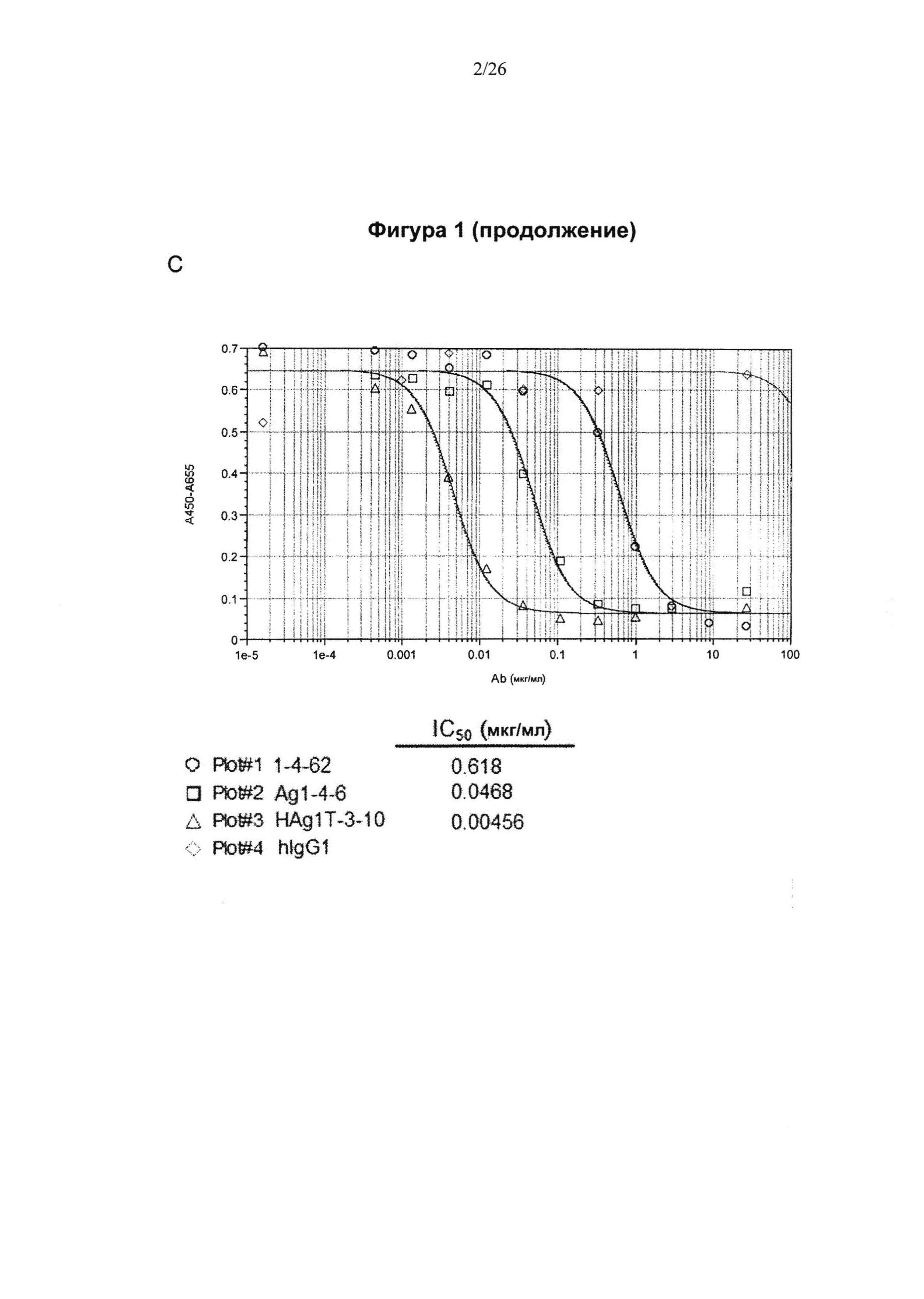
На Фигуре 1 представлена диаграмма, показывающая эффективность действия высокоаффинных антител к IL6 на трансдукцию клеточных сигналов и пролиферацию клеток. (А) активация сигнального пути фосфорилированного STAT3 снижалась антителами к IL6 Ag1-4-6 и HAgT1-3-10 в зависимости от дозы. (В) Антитела к IL6 Ag1-4-6 и HAgT1-3-10 подавляли активацию сигнального пути STAT3 в большей степени, чем контрольное антитело Actemra (актемра). (С) Антитела к IL6 1-4-62, Ag1-4-6 и HAg1T-3-10 ингибировали пролиферацию В9-клеток в зависимости от дозы, и величина IC50 составила 0.618, 0.0468 и 0.00456 мкг/мл, соответственно.
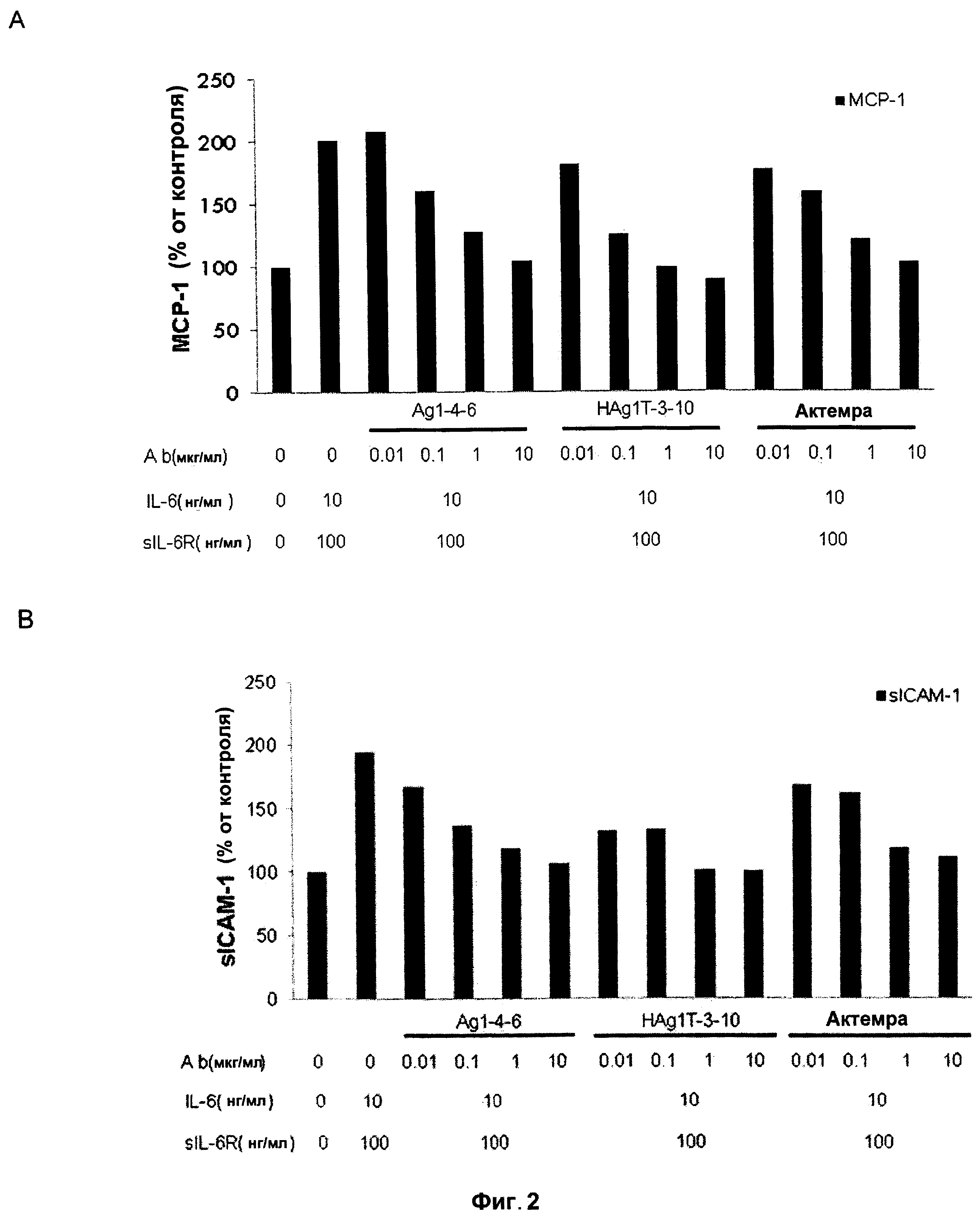
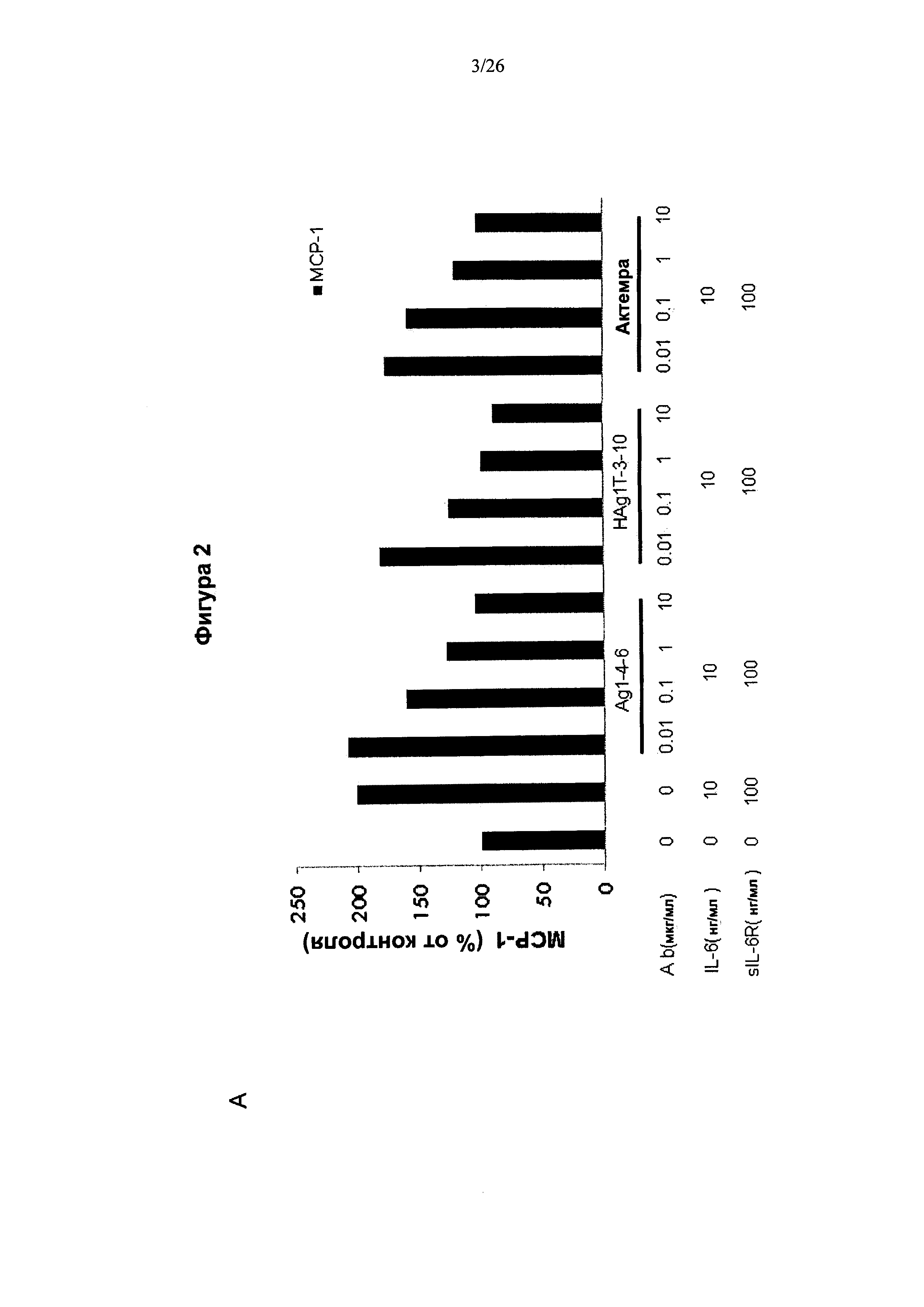
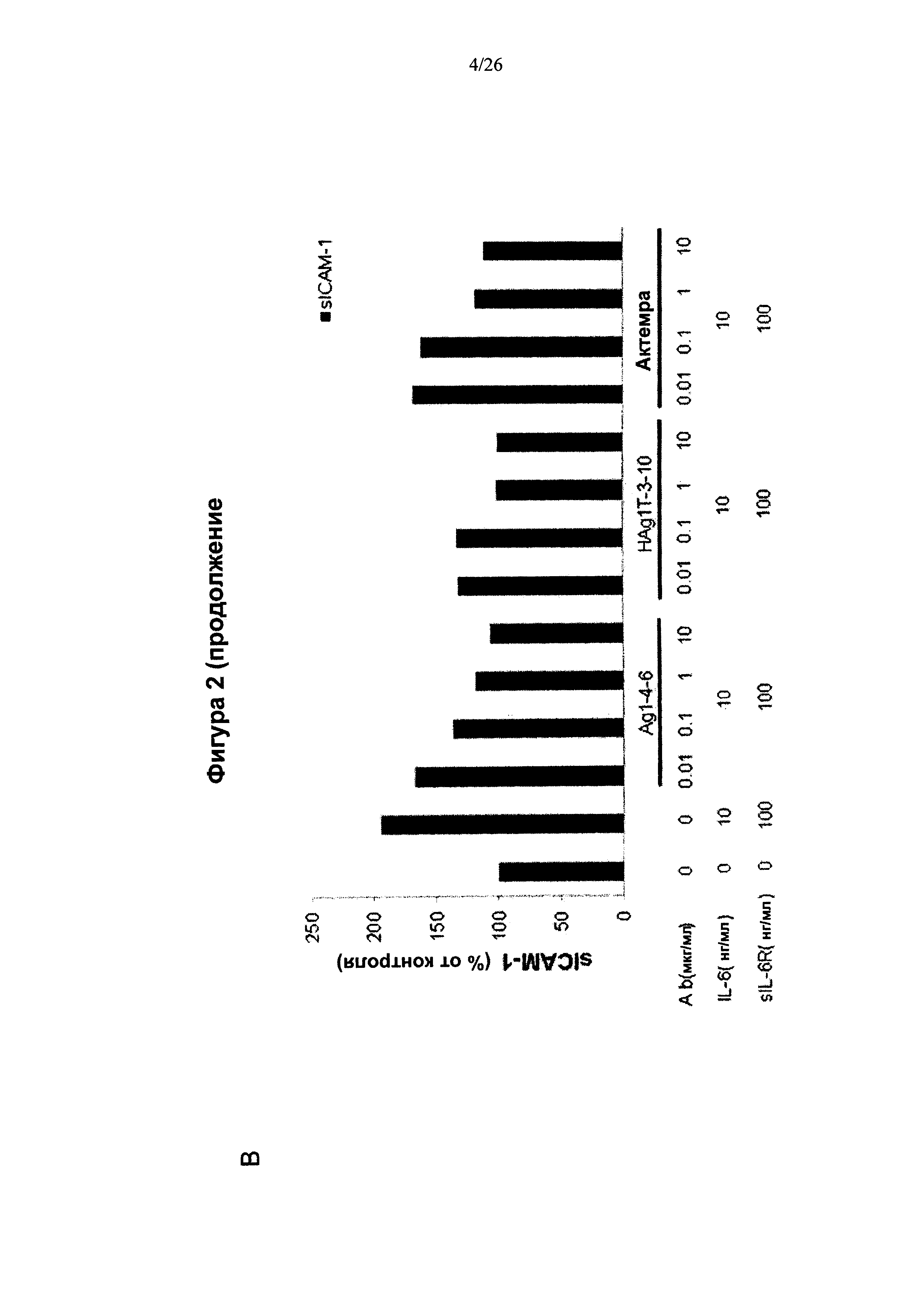
На Фигуре 2 представлена диаграмма, показывающая, что антитела к IL6 подавляли продуцирование хемокинов в клетках HUVEC. HUVECs культивировали с IL6, sIL6R, IL6 и sIL6R или с комбинацией IL6, sIL6R, антителом к IL6 в течение 24 ч. МСР-1 и sICAM-1 в супернатанте культуры определяли методом ELISA. (A) IL6+sIL6R- индуцированная секреция МСР-1 ингибировалась антителами к IL6 Ag1-4-6 и Hag1T-3-10. (В) Антитела Ag1-4-6 и Hag1T-3-10 ингибировали продуцирование sICAM-1 в большей степени, чем Actemra.
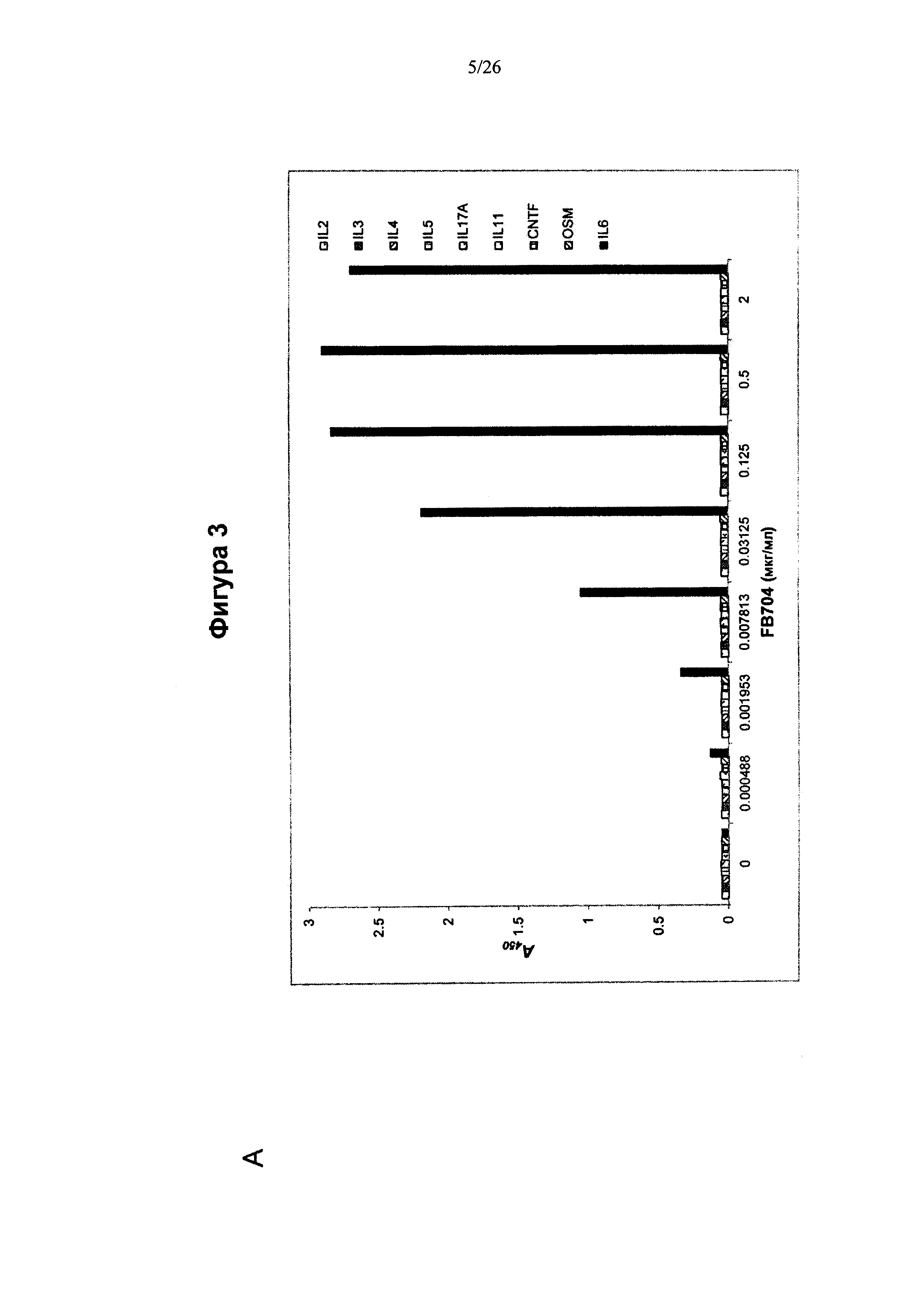
На Фигуре 3 представлена диаграмма, показывающая специфичность связывания типичных антител к IL6, описанных в данном изобретении.
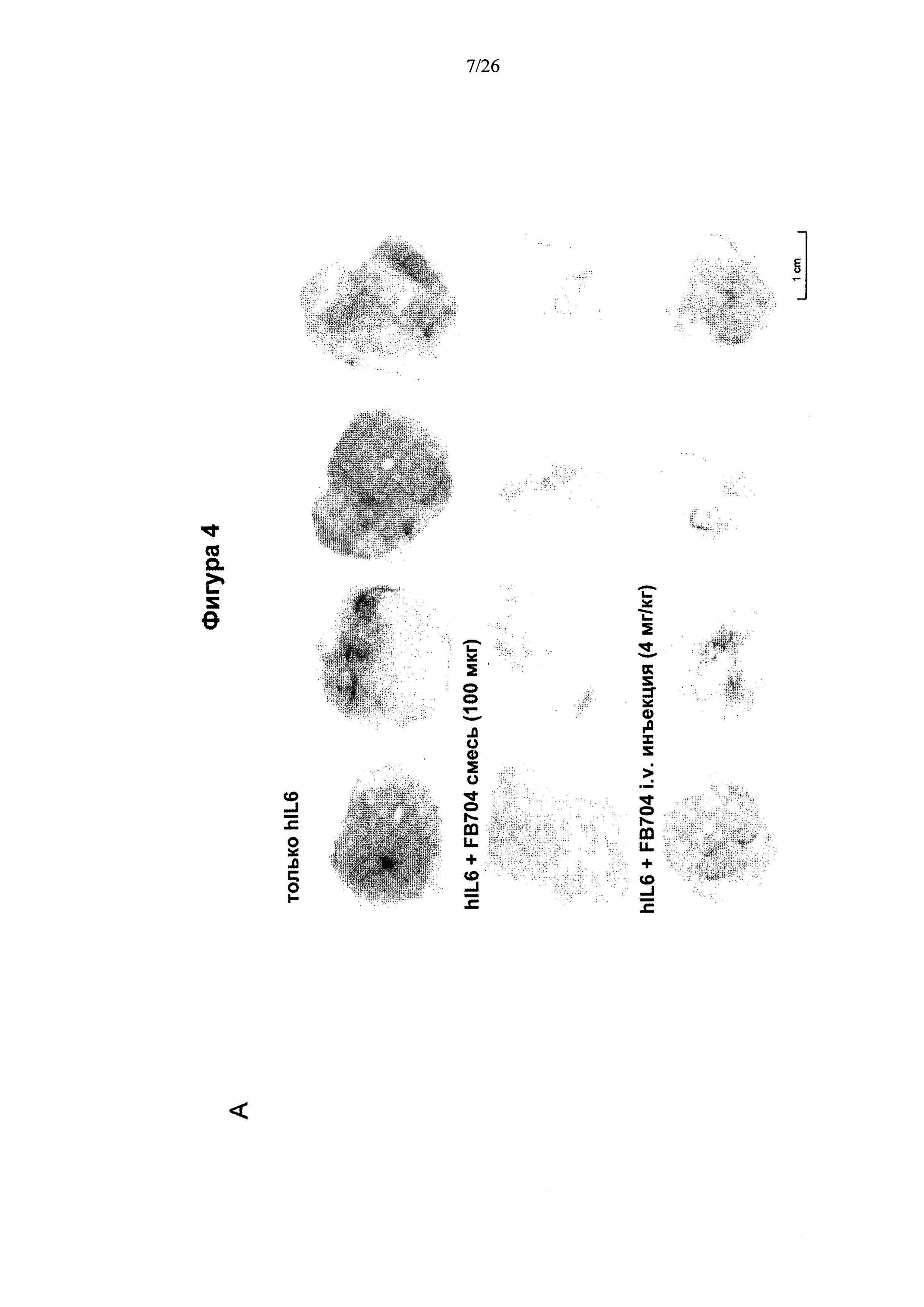
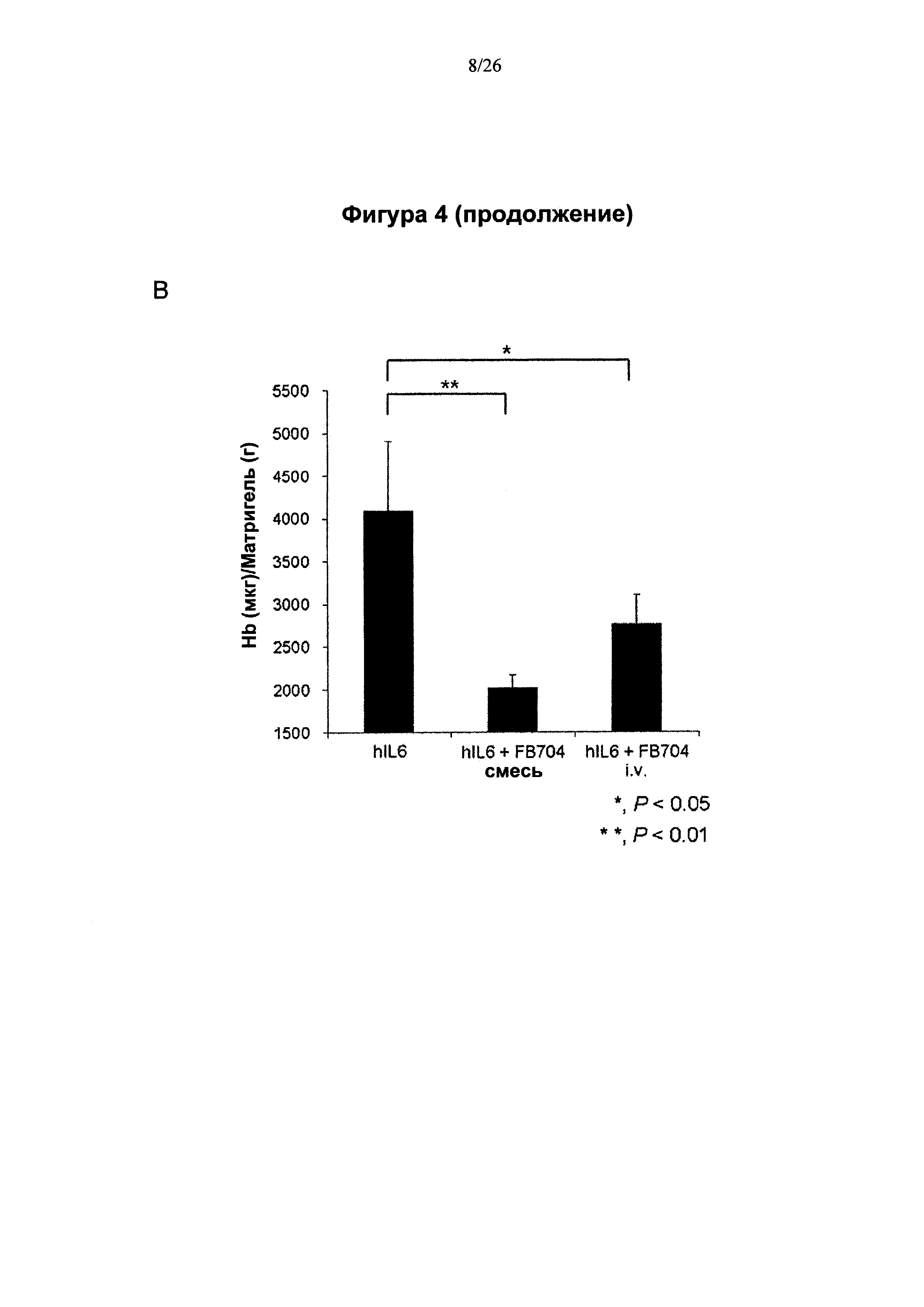
На Фигуре 4 представлена диаграмма, показывающая, что антитело Ag1-4-6 (FB704) ингибировало ангиогенез in vivo. Рекомбинантный белок IL6 добавляли в матригель и вводили инъекцией в два участка на спине мышей. Мышам вводили антитела при помощи внутривенной инъекции или введения предварительно приготовленной смеси. (A) FB704 ингибировало ангиогенез, индуцированный IL6, что наблюдалось через 6 дн после введения антител. (В) Введение антитела FB704 в значительной степени изменяло уровень гемоглобина.
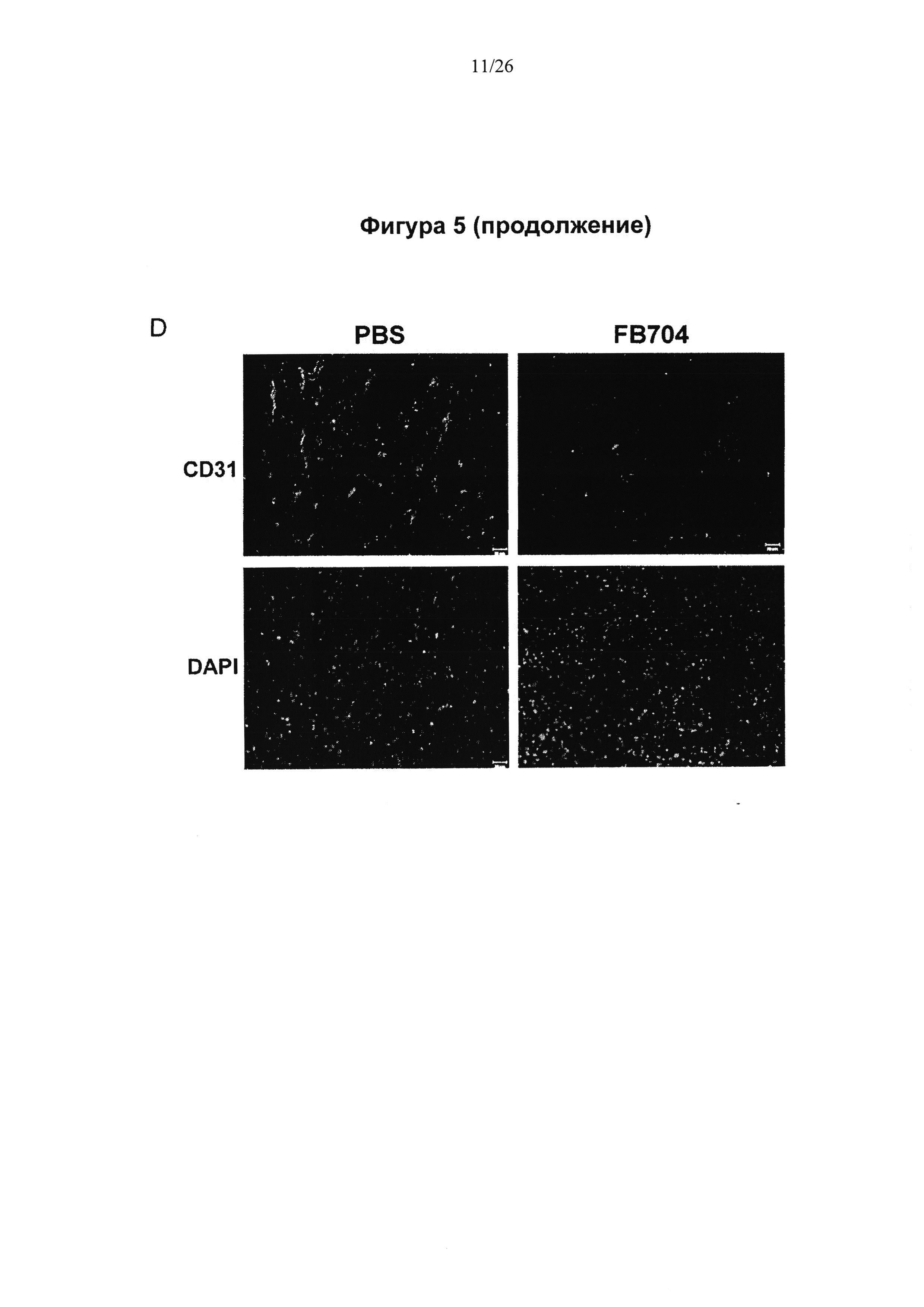
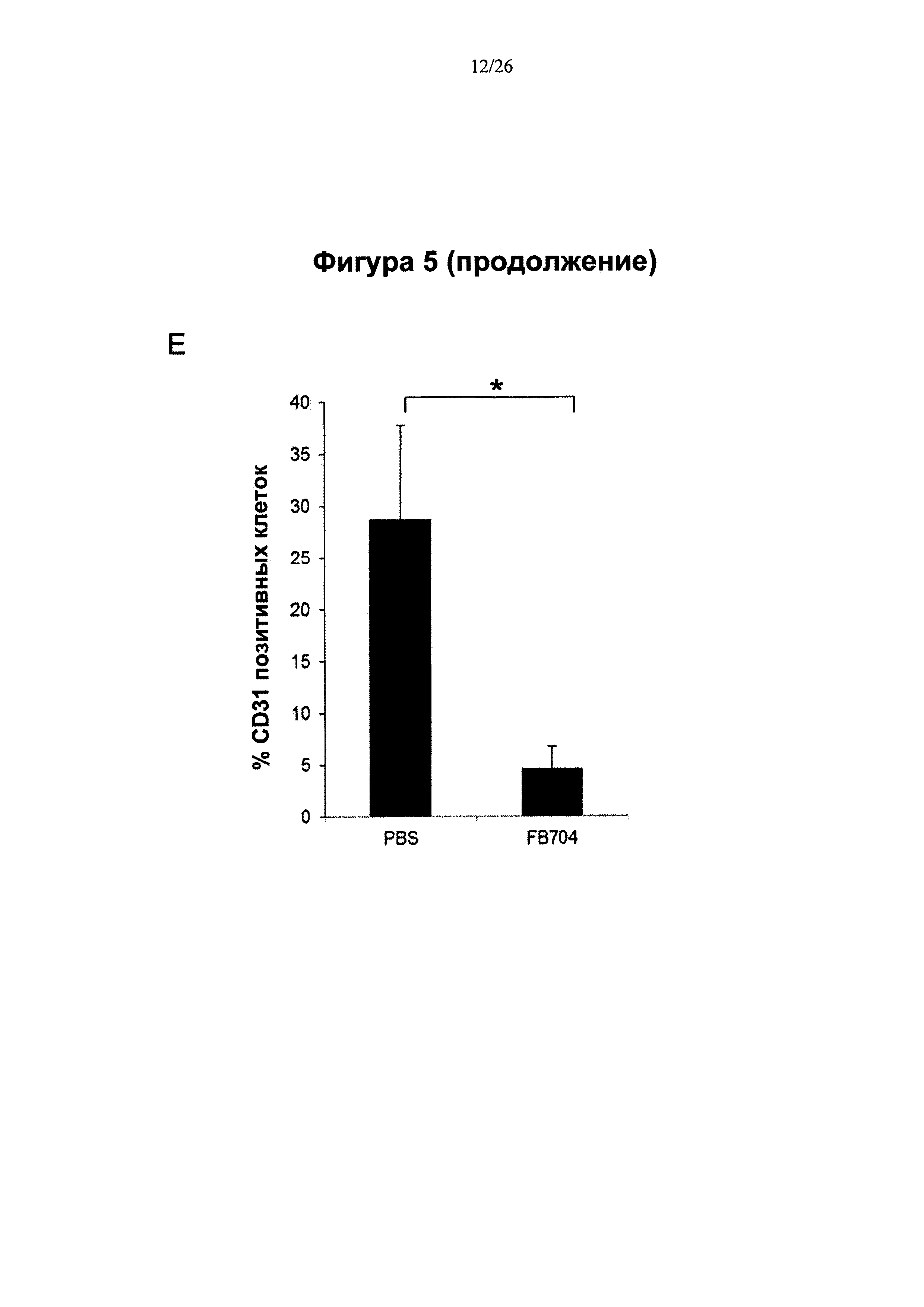
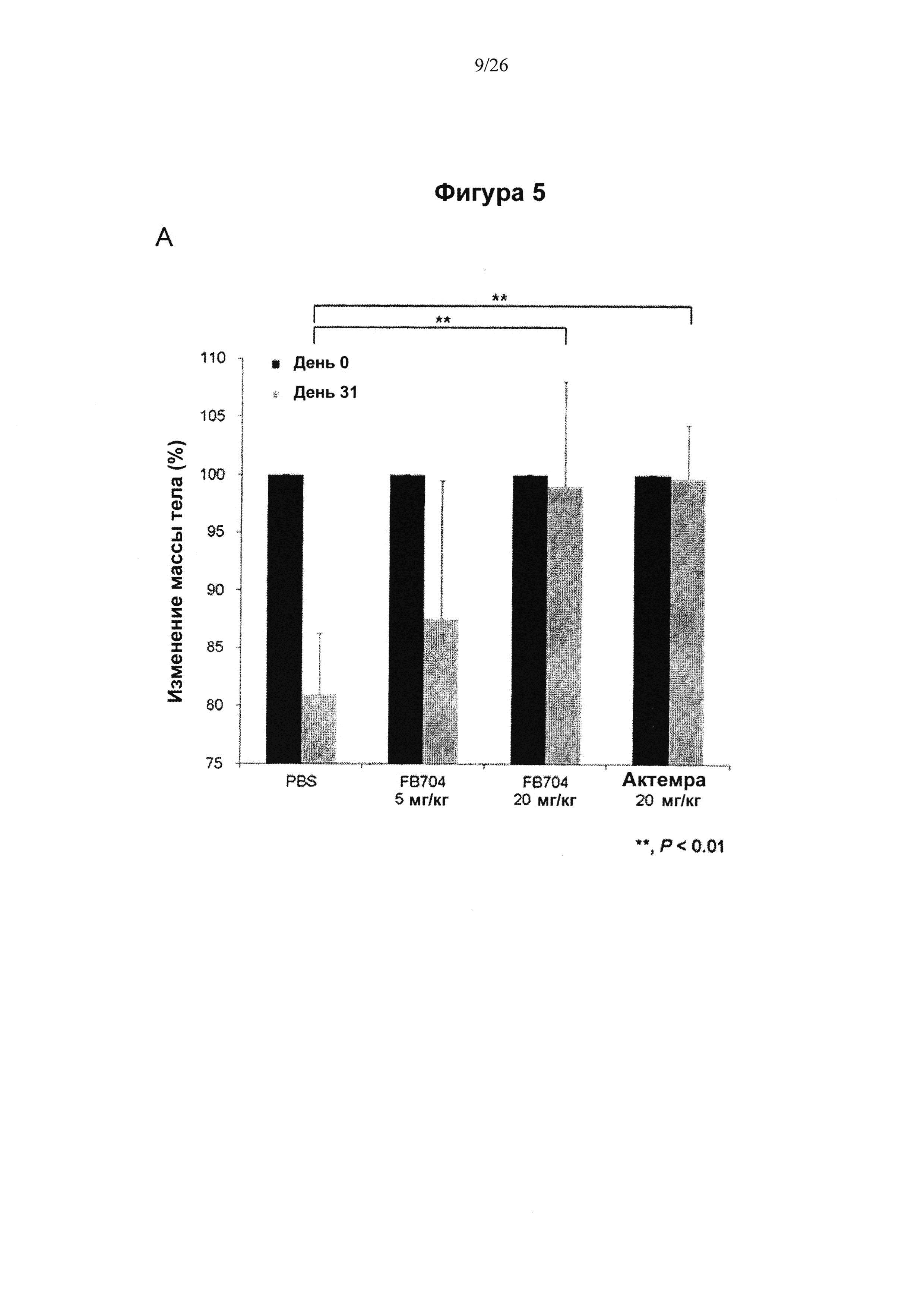
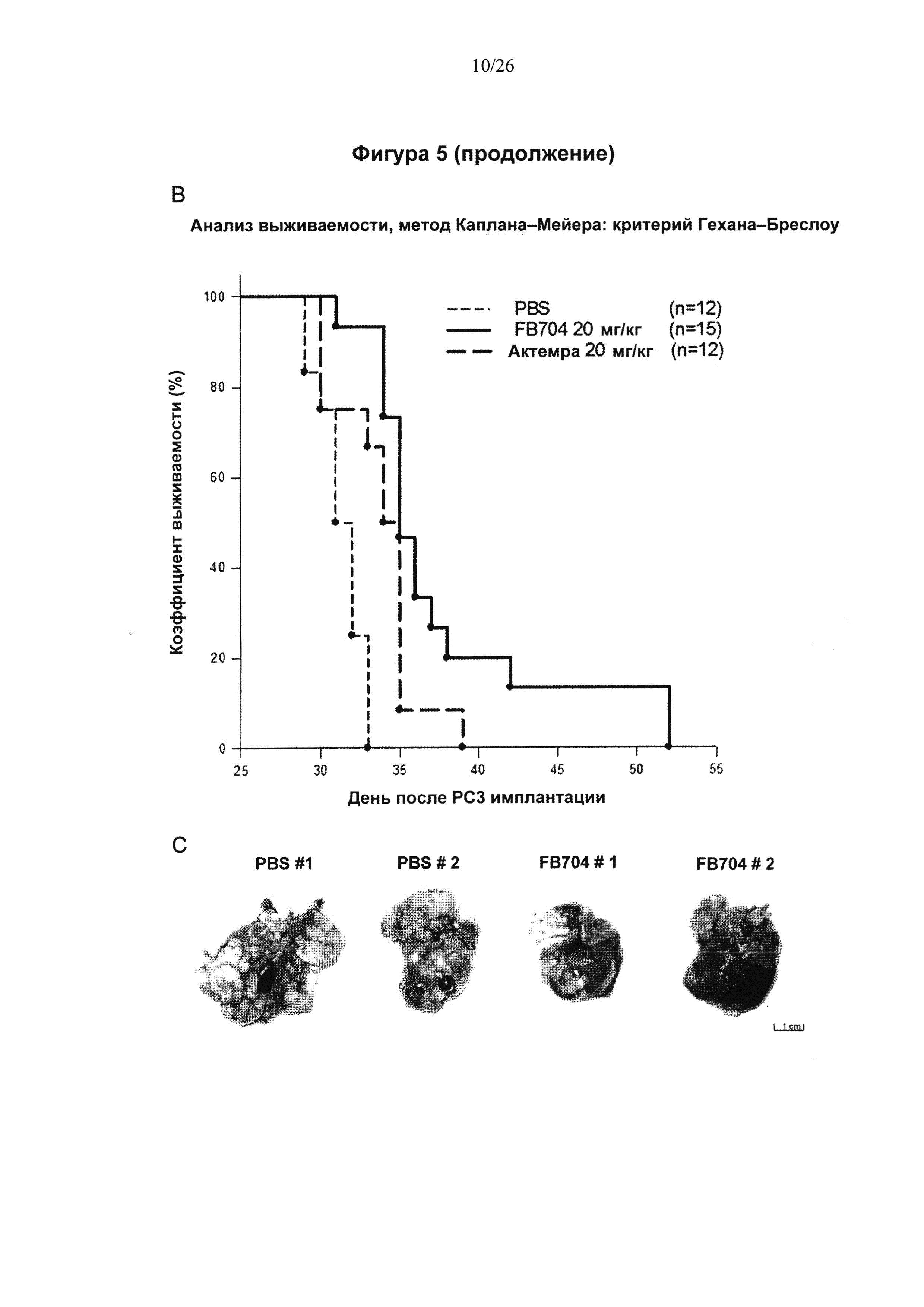
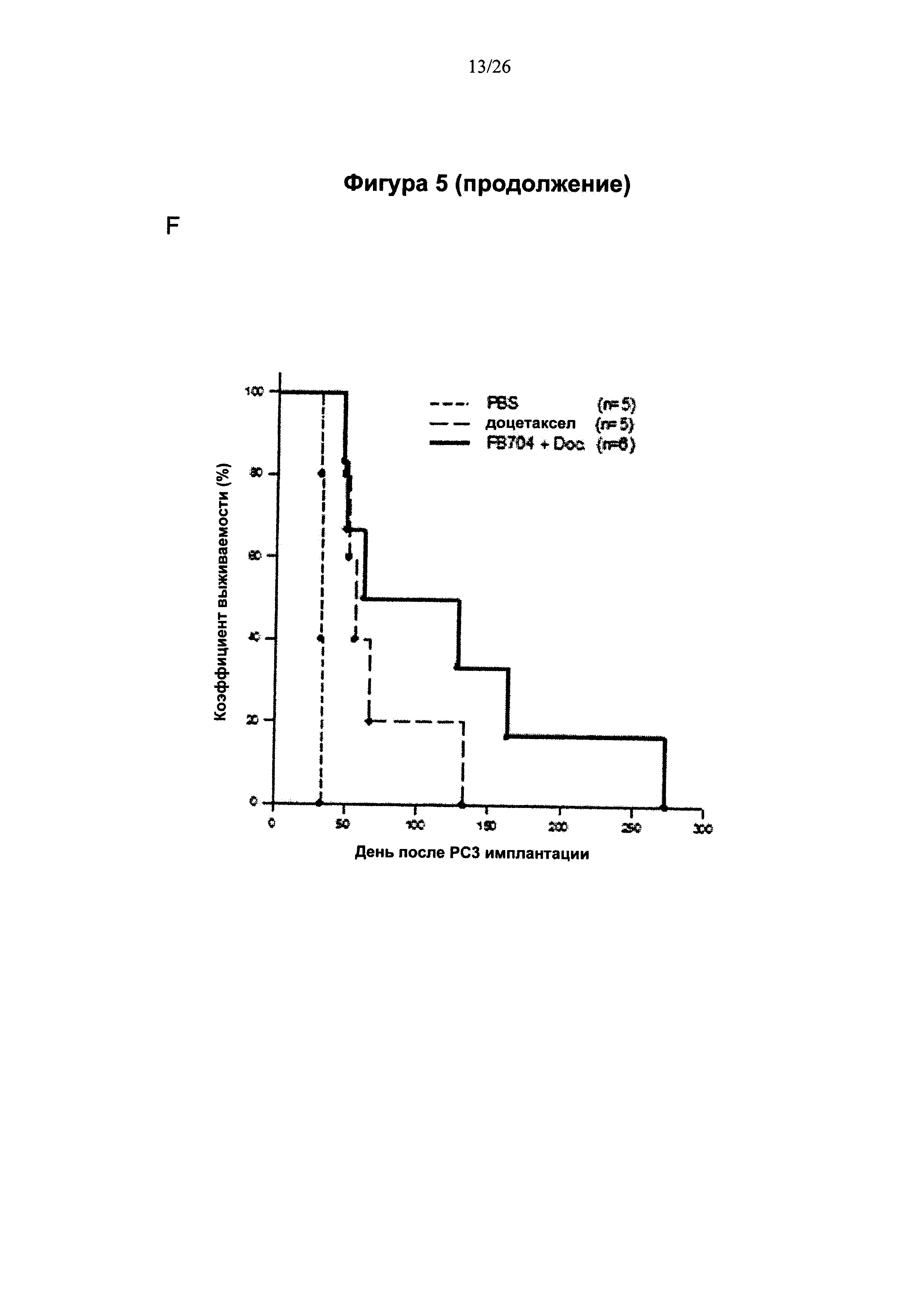
На Фигуре 5 представлена диаграмма, показывающая, что антитело FB704 ингибировало кахексию, индуцированную человеческими клетками РС-3 рака простаты, и метастазы. На 31 день после инъекции опухолевых клеток измеряли массу (вес) мышей. (А) Вес мышей, которым ввели PBS, снизился примерно на 19%. В противоположность этому, вес мышей в группах, которым вводили высокие дозы FB704 и Actemra, оставался стабильным и значительно отличался (Р<0.01). (В) FB704 (n=15; Р=0.00001) и Actemra (n=12; Р=0.024) в значительной степени пролонгировали бессимптомную продолжительность жизни опухоленесущих (РС3) мышей. FB704 оказалось значительно более эффективным, чем Actemra (Р=0.03). (С) Вскрытие мышей из группы, которой вводили PBS, выявило значительное увеличение и инфильтрацию печени опухолевыми клетками. Однако мыши, которым ввели FB704, характеризовались умеренной инфильтрацией опухолевыми клетками и наличием почти 50% нормальных гепатоцитов в левой и средней долях печени. (D) Иммуногистохимия показала, что плотность сосудов уменьшилась после обработки срезов печени антителом FB704. (Е) Полуколичественный анализ окрашивания CD31 выявил значительное его уменьшение обработки антителом FB704 (Р<0.05). (F) Комбинация FB704 и химиотерапевтического лекарства доцетаксела обеспечила повышение общей выживаемости.
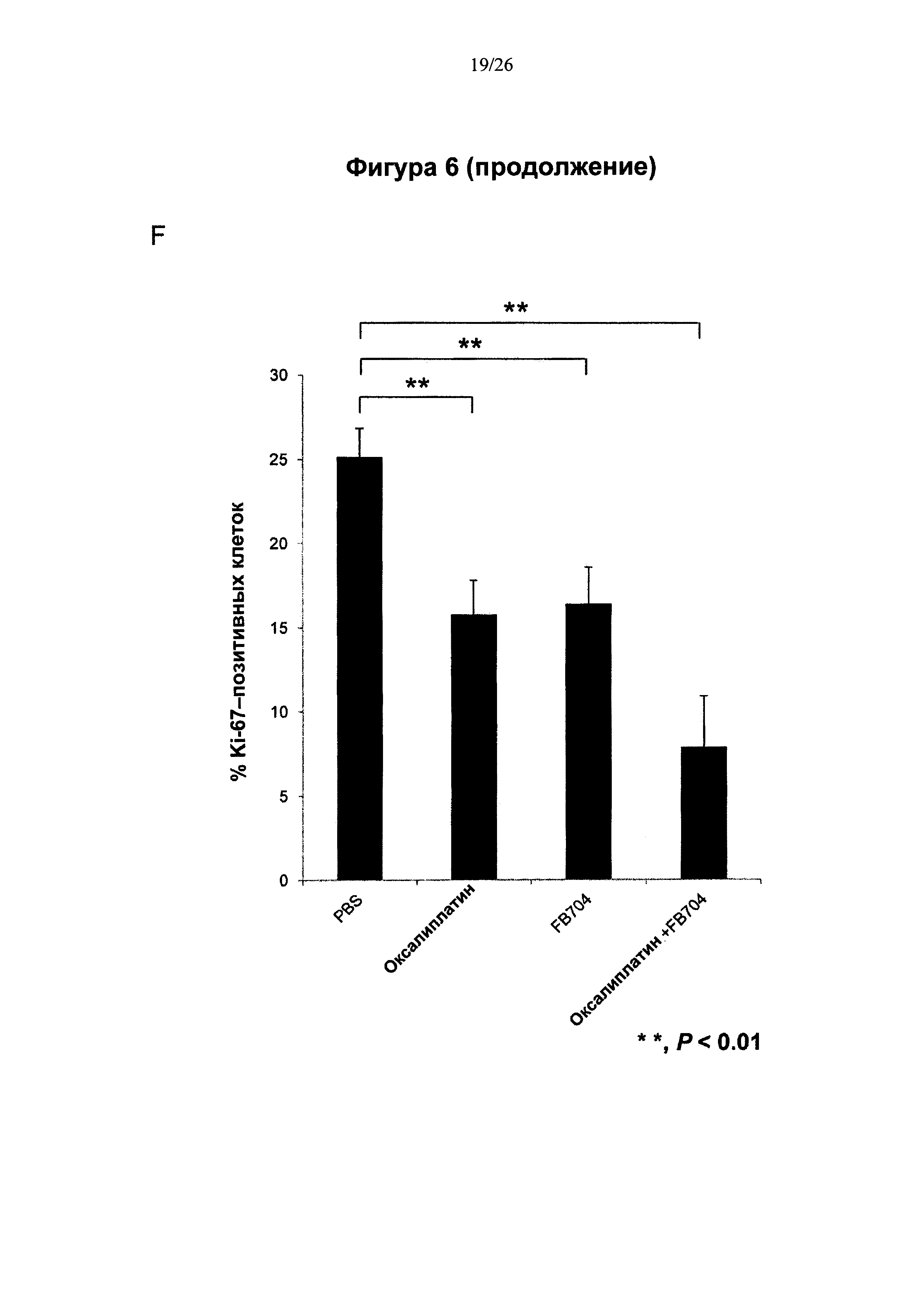
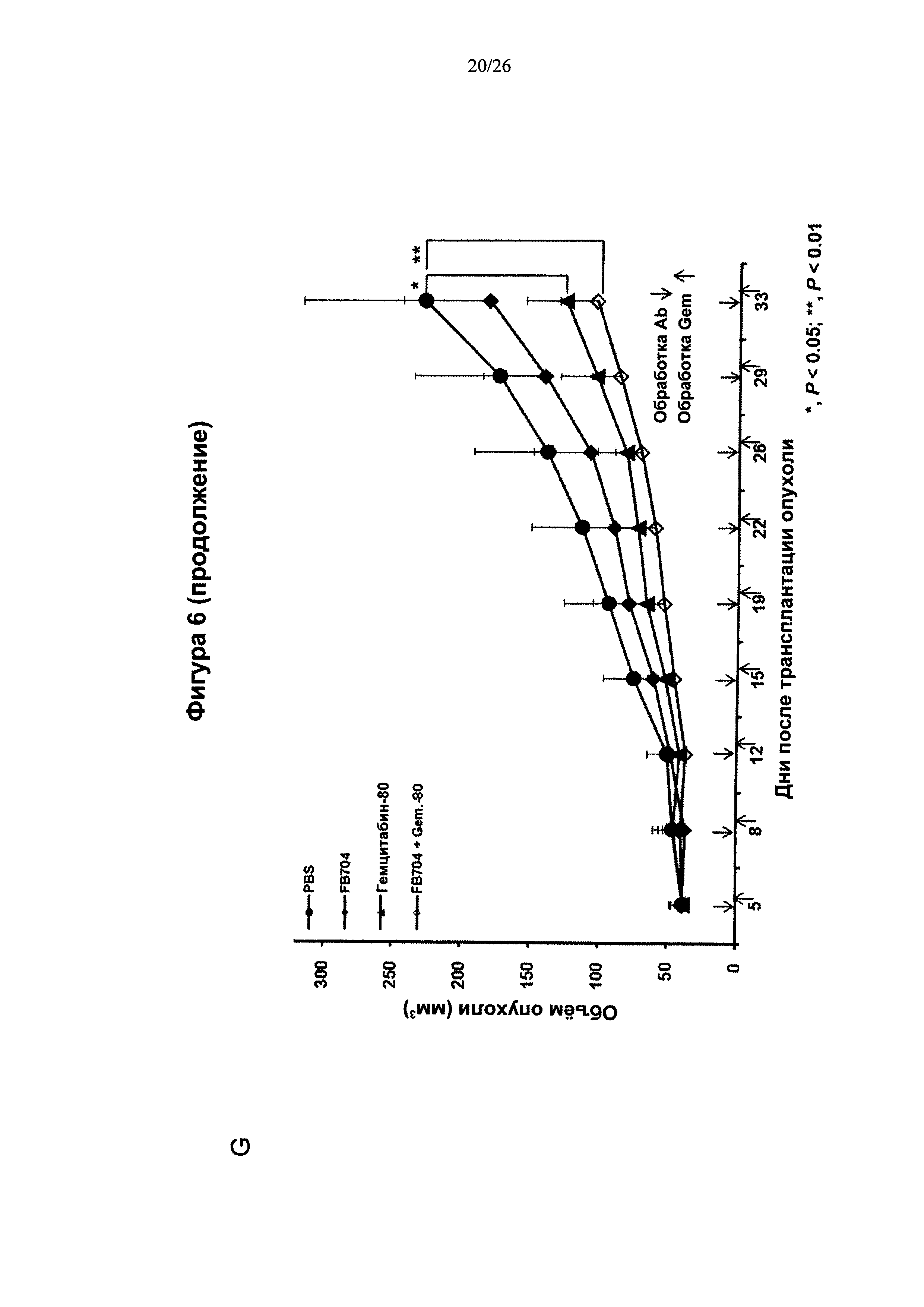
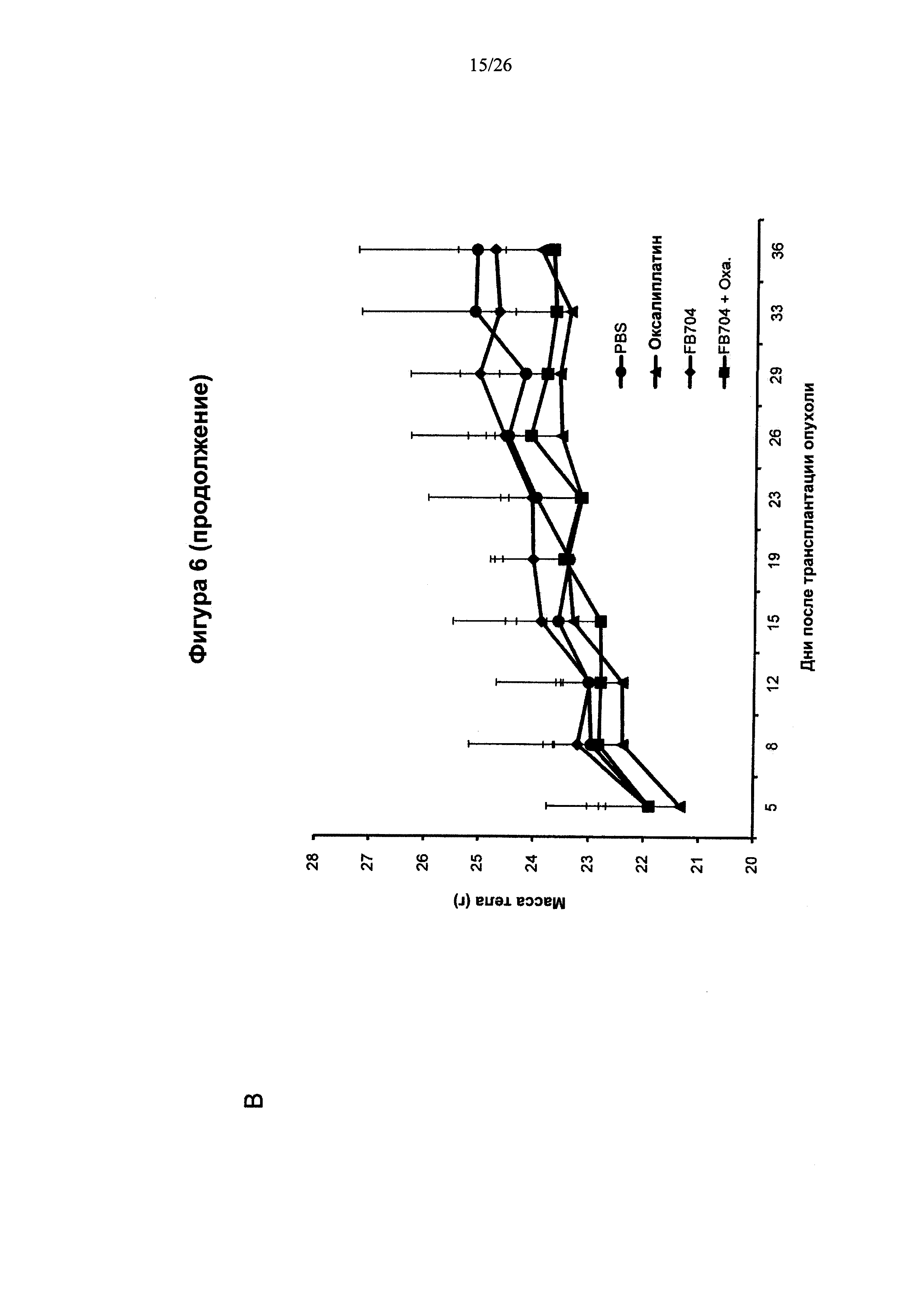
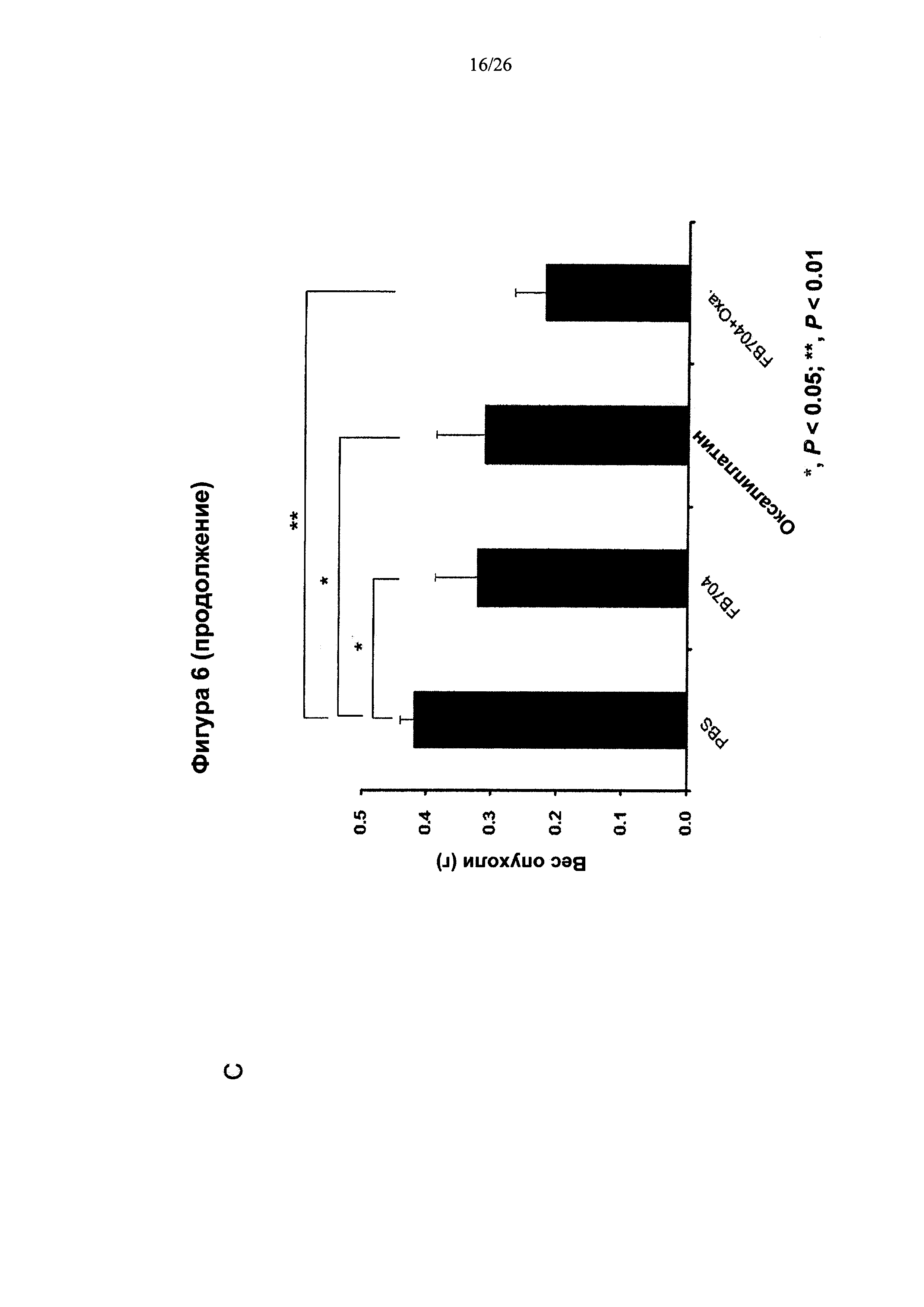
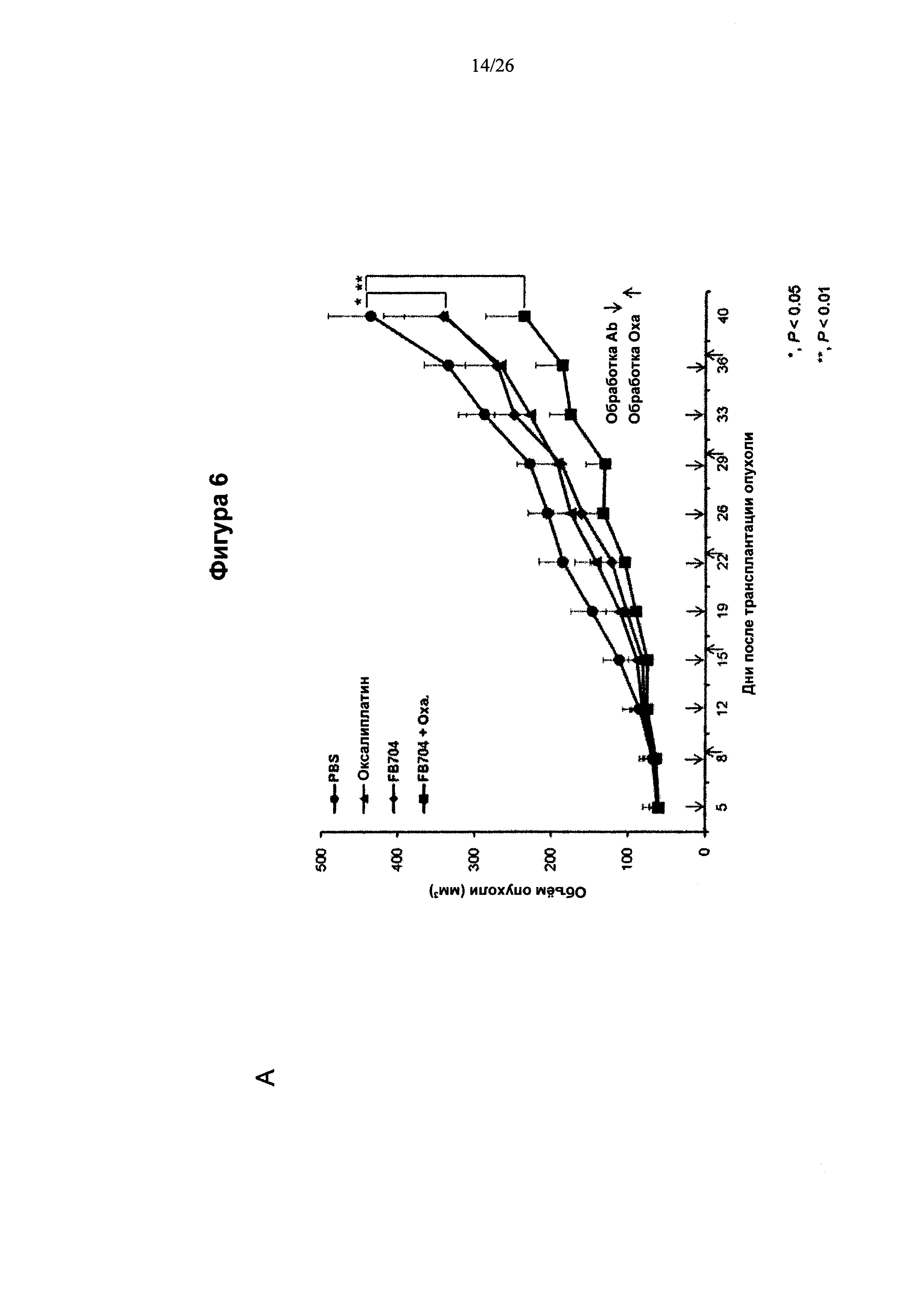
На Фигуре 6 представлена диаграмма, показывающая, что антитело FB704 способствовало повышению противоопухолевой активности оксалиплатина или гемцитабина в ксенотрансплантате карциномы поджелудочной железы. (А) Обработка мышей с опухолевыми клетками ВхРС-3 с помощью 20 мг/кг антитела FB704 два раза в неделю плюс оксалиплатин (3 мг/кг) один раз в неделю привела к статистически значимому ингибированию роста опухолей (на 49% (Р<0.01). (В) Вес мыши во время лечения увеличивался. (С и D) Массы отдельных опухолей определяли после опыта, и оказалось, что они значительно уменьшились после лечения. (Е) Маркер пролиферации опухолевых клеток, Ki-67, был выявлен при различных обработках срезов опухолей. (F) Скорость роста Ki-67-положительных клеток, обработанные PBS, оксалиплатином, FB704 и FB704 вместе с оксалиплатином, была равна 26%, 14%, 16% и 7.5%, соответственно. (G) Обработка опухоленесущих (ВхРС-30) мышей 20 мг/кг антитела FB704 вместе с гемцитабином (80 мг/кг) два раза в неделю привела к статистически значимому ингибированию роста опухолей, равному 60% (Р<0.01).
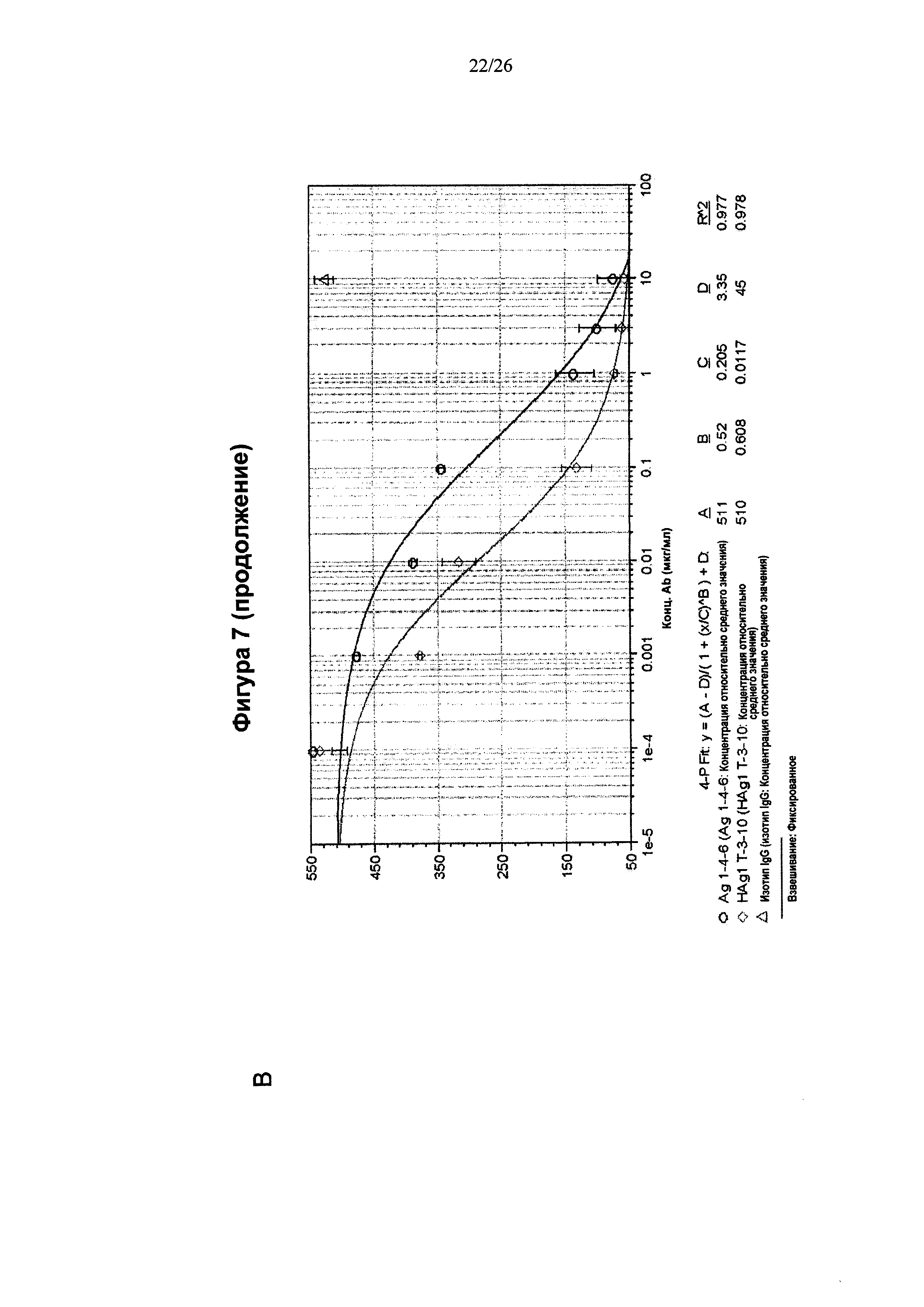
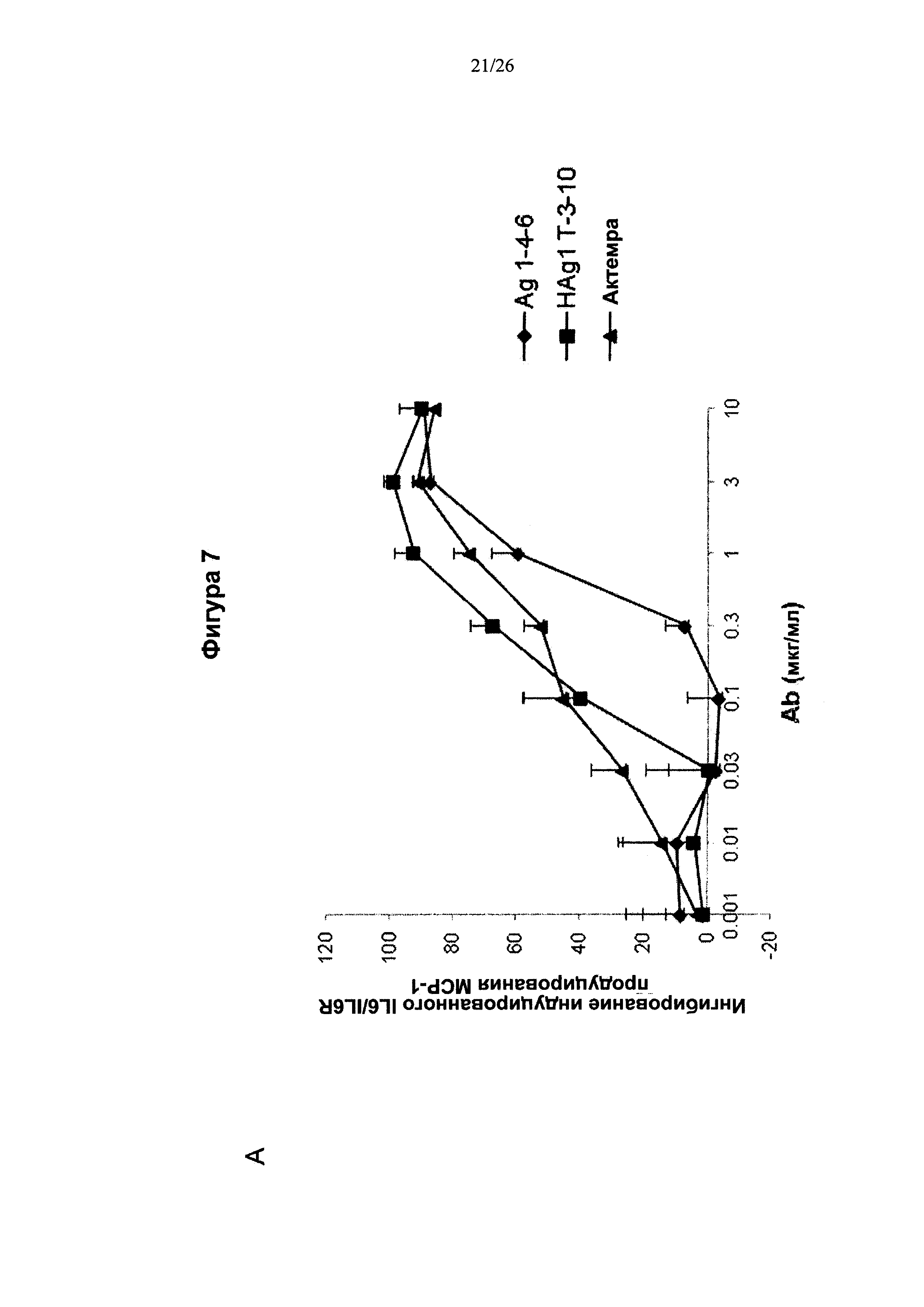
На Фигуре 7 представлена диаграмма, которая показывает, что антитела к IL6, описанные в данном изобретении, подавляли продуцирование МСР-1 на поверхности клеток U937 и человеческих клеток РВМС.(А) Клетки U937 культивировали вместе с IL6 и обрабатывали антителами в течение 24 ч. Количество МСР-1 измеряли при помощи набора ELISA. Антитела по изобретению подавляли продуцирование МСР-1 в зависимости от дозы (n=3). (В) Клетки РВМС культивировали вместе с IL6 и обрабатывали антителами в течение 24 ч. Количество МСР-1 измеряли при помощи набора ELISA. Антитела по изобретению подавляли продуцирование МСР-1 в зависимости от дозы (n=5).
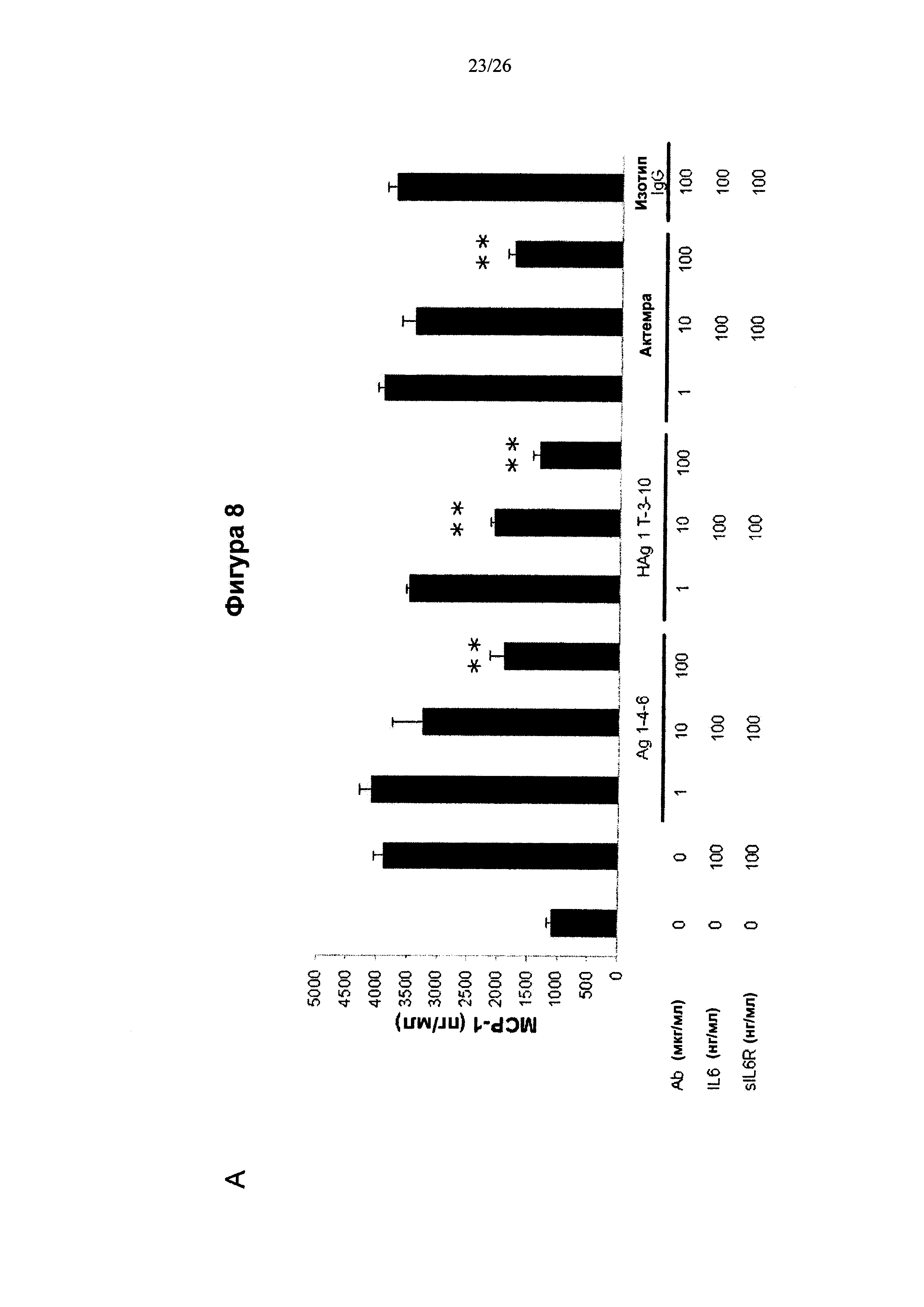
Фигура 8 представляет диаграмму, показывающую ингибирование продуцирования МСР-1 в RA-FLS антителами к IL6, описанными в данном изобретении. (А) Коммерческие клетки RA-FLS и (В) клетки FLS пациентов с RA культивировали с IL6 и sIL6R в присутствии или в отсутствие антител в течение 24 ч. Антитела по изобретению подавляли продуцирование МСР-1 в зависимости от дозы (n=6).
Диаграмма на Фигуре 9 показывает ингибирование продуцирования VEGF в RA-FLS типичными антителами к IL6, описанными в данном изобретении. (А) Коммерческие клетки RA-FLS и (В) клетки FLS пациентов с RA культивировали вместе с IL6, sIL6R и IL1β и обрабатывали антителами в течение 24 ч. Антитела по изобретению подавляли продуцирование VEGF в зависимости от дозы (n=6).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам, которые связываются с человеческим интерлейкином-6 (IL6), которые могут нейтрализовать активность IL6, и к их применению для регулирования IL6-опосредованных сигнальных путей. Антитела к IL6, описанные в данном изобретении, пригодны при лечении IL6-ассоциированных заболеваний или расстройств, таких как воспалительные расстройства, аутоиммунные болезни, ангиогенез, рак, метастазы опухолей и кахексия, связанная с наличием рака. Следующее далее описание предназначено только для иллюстрации различных вариантов данного изобретения. Как таковые, конкретные варианты, описанные в данном изобретении, не следует рассматривать как ограничение объема изобретения. Специалистам в данной области очевидно, что различные изменения или эквиваленты могут быть использованы без выхода за рамки изобретения.
Общие методы
В практике осуществления настоящего изобретения могут быть использованы, если иное не оговорено, стандартные методы молекулярной биологии (включая методы рекомбинантных ДНК), микробиологии, биологии клеток, биохимии и иммунологии, которые известны специалистам в данной области. Такие методы подробно описаны в литературе, например в публикациях Molecular Cloning: А Laboratory Manual, second edition (Sambrook, et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-8) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and С.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel, et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis, et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995).
Определения
Для того чтобы обеспечить четкое и ясное понимание настоящего изобретения, ниже приводятся определения некоторых терминов. Дополнительные термины разъясняются в подробном описании. Если не указано иное, все технические и научные термины, применяющиеся в данном изобретении, имеют то же значение, которое является общепринятым среди специалистов в данной области.
Используемые в единственном числе термины относятся к одному предмету или к более чем одному предмету (то есть по меньшей мере к одному). Например, термин "элемент" означает один элемент или более чем один элемент.
Применяемый в данном изобретении термин "полипептид" относится к полимеру, состоящему из остатков аминокислот, связанных пептидными связями. Термин "белок" обычно относится к сравнительно длинным полипептидам. Термин "пептид" обычно относится к сравнительно коротким полипептидам (например, содержащим до 100, 80, 60, 50, 30 или 20 остатков аминокислот).
Антитело (или во множественном числе антитела) представляет собой молекулу иммуноглобулина, способную специфически связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.п., через по меньшей мере один сайт распознавания антигена, расположенный в вариабельной области молекулы иммуноглобулина. Термин "антитело", используемый в данном изобретении, охватывает не только интактные (то есть полноразмерные) поликлональные или моноклональные антитела, но также их антиген-связывающие фрагменты (такие как Fab, Fab', F(ab')2, Fv), их мутанты, слитые белки, содержащие часть антитела, гуманизированные антитела, химерные антитела, диатела, линейные антитела, одноцепочечные антитела, полиспецифические антитела (например, биспецифические антитела) и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена требуемой специфичности, включая варианты гликозилирования антител, варианты аминокислотных последовательностей антител и ковалентно модифицированные антитела.
Интактное или полноразмерное антитело содержит две тяжелых цепи и две легких цепи. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (VH) и первую, вторую и третью константные области (CH1, CH2 и CH3). Каждая легкая цепь содержит вариабельную область легкой цепи (VL) и константную область (CL). Полноразмерное антитело может быть антителом любого класса, такого как IgD, IgE, IgG, IgA или IgM (или их подкласса), и антитело не обязательно должно относиться к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константной области тяжелых цепей антитела иммуноглобулины относятся к разным классам. Имеются пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них в свою очередь делятся на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, которые соответствуют различным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехразмерные конфигурации различных классов иммуноглобулинов хорошо известны.
Термин "антигенсвязывающий домен" или "антигенсвязывающий фрагмент" относится к части или к области молекулы интактного антитела, которая является ответственной за связывание с антигеном. Антигенсвязывающий домен может включать вариабельную область тяжелой цепи (VH), вариабельную область легкой цепи (VL) или обе этих области. Каждая из областей VH и VL обычно содержит определяющие комплементарность области CDR1, CDR2 и CDR3. К трем CDRs в VH или VL примыкают каркасные области (FR1, FR2, FR3 и FR4).
Примеры антигенсвязывающих фрагментов включают, но без ограничения: (1) фрагмент Fab, который может быть одновалентным фрагментом, содержащим цепь VL-CL и цепь VH-CH1; (2) фрагмент F(ab')2, который может быть двухвалентным фрагментом, содержащим два фрагмента Fab, связанные дисульфидным мостиком в шарнирной области, то есть димером Fab; (3) фрагмент Fv, содержащим домены VL и VH одного плеча антитела; (4) одноцепочечный Fv (scFv), который может быть одной цепью полипептида, состоящей из домена VH и домена VL, соединенных через пептидный линкер; и (5) фрагмент (scFv)2, который может включать два домена VH, связанные пептидным линкером, и два домена VL, которые связаны с двумя доменами VH через дисульфидные мостики.
Термин "человеческое антитело" относится к антителам, содержащим вариабельные и константные области, по существу соответствующие антителам, полученным из организма человека, или полученные из таких антител, например, к кодированным генными последовательностями иммуноглобулинов зародышевой линии человека или их вариантам. Человеческие антитела, описанные в данном изобретении, могут включать один или более аминокислотных остатков, не кодируемых генными последовательностями иммуноглобулинов зародышевой линии человека (например, мутации, введенные путем случайного или сайт-специфического мутагенеза in vitro или путем соматической мутации in vivo). Такие мутации могут быть представлены в одной или более CDRs, или в одной или более FRs. В некоторых примерах человеческие антитела могут содержать одно, два, три, четыре, пять или более положений, замененных остатком аминокислоты, который не кодирован последовательностью гена иммуноглобулина зародышевой линии человека.
Термин "выделенное" вещество означает, что оно было изменено человеком по сравнению с его природным состоянием. Если "выделенное" вещество находится в природе, оно было изменено или удалено из его первоначального окружения или и изменено, и удалено. Например, полипептид, содержащийся в организме живого субъекта, считается не "выделенным", но полипептид является выделенным, если он практически был отделен от сопутствующих материалов в природном состоянии и существует в практически чистом виде.
Термин "специфически связывается" или "специфическое связывание" относится к неслучайной реакции связывания между двумя молекулами, например, к связыванию антитела с эпитопом антигена. Термин антитело, которое "специфически связывается" с мишенью или с эпитопом, является термином, хорошо понятным для специалистов, и способы определения такого специфического связывания также хорошо известны в уровне техники. Говорят, что молекула характеризуется "специфическим связыванием", если она реагирует или связывается более часто, более быстро, с большей продолжительностью и/или с большей аффинностью с конкретным целевым антигеном или эпитопом, чем с другими мишенями/эпитопами. Антитело "специфически связывается" с целевым антигеном, если оно связывается с большей аффинностью, авидностью, более легко и/или с большей продолжительностью, чем оно связывается с другими веществами. Например, антитело, которое специфически (или предпочтительно) связывается с эпитопом IgE, является антителом, которое связывает этот эпитоп IgE с большей аффинностью, авидностью, более легко и/или с большей продолжительностью, чем оно связывается с другими эпитопами IgE или эпитопами не IgE. Из этого определения ясно, что, например, антитело, которое специфически связывается с первым целевым антигеном может или не может специфически или предпочтительно связываться со вторым целевым антигеном. Как таковое, "специфическое связывание" или "предпочтительное связывание" не обязательно требует (хотя оно может включать) исключительного связывания. Вообще, но не необходимо, ссылка на связывание означает предпочтительное связывание.
Термины "субъект," "индивидуум" и "пациент" в данном изобретении используются как взаимозаменяемые и относятся к млекопитающему, который выбирается для проведения лечения и/или подвергается лечению. Такие субъекты могут представлять собой людей, но также включают и других млекопитающих, особенно таких млекопитающих, которые полезны как лабораторные модели для изучения заболеваний людей, например, мышь, крысу, кролика, собаку и т.п.
Термин "проведение лечения" или "лечение" относится к действию, применению или к терапии, при этом субъект, включая человека, которому оказывается медицинская помощь с целью улучшения состояния субъекта, непосредственно или косвенно. Конкретно, этот термин относится к уменьшению возникновения или к ослаблению симптомов, устранению рецидивов, профилактике возникновения заболевания, уменьшению симптомов, улучшению прогноза или согласно некоторым вариантам к их комбинации. Специалисту в данной области очевидно, что это лечение необязательно приводит к полному отсутствию или исчезновению симптомов. Например, в случае ракового заболевания "проведение лечения" или "лечение" может относиться к замедлению роста неопластических образований или злокачественных клеток, пролиферации или метастазов, или к их комбинации.
Термин "эффективное количество" или "эффективная доза" или "терапевтически эффективное количество", относящийся к введению фармакологического агента, используемый в данном изобретении, означает количество лекарства или фармацевтического агента, которое приводит к достижению намеченного фармакологического результата или эффекта при лечении, заживлении, предотвращении или ослаблении болезни, расстройства или побочных эффектов, или снижении скорости развития заболевания или расстройства по сравнению с соответствующим субъектом, который не получил такое количество. Эффективное количество или доза фармакологического агента может зависеть от вида используемого конкретного активного агента, способа введения и возраста, роста и состояния субъекта, подвергающегося лечению. Точное количество фармакологического агента, которое нужно вводить, зависит от суждения практикующего врача и для каждого субъекта подбирается индивидуально.
Термин "IL6-ассоциированные заболевания или состояния" относится к любому заболеванию или состоянию, в котором IL6 играет роль регулятора сигнальных путей, приводящих к развитию этого заболевания или состояния. IL6 является членом семейства цитокинов, которые инициируют клеточные ответы через рецепторный комплекс, состоящий из по меньшей мере одной субъединицы медиатора гликопротеина gp130 и рецептора IL6 (IL6R). IL6 связывается с IL6R, который затем приводит к димеризации gp130, запускающего фосфорилирование остатков тирозина в gp130. По меньшей мере три сигнальных пути участвуют в образовании комплекса IL6/IL6R/gp130: (1) фосфатидилинозит-3'-киназа (PI3K), (2) митоген-активированная протеинкиназа (MAK), и (3) Янус-тирозинкиназа (JAK)-сигнальный трансдуктор и активатор транскрипции 1 и 3 сигнального пути (STAT1 и STAT3). Полагают, что IL6 играет роль в развитии большого круга заболеваний и расстройств, включая, но без ограничения, воспаление, аутоиммунные болезни (например, ревматоидный артрит (RA), болезнь Крона, болезнь Каслмана, рассеянный склероз, анкилозирующий спондилит, псориатический артрит и псориаз), ангиогенез, рак (например, множественная миелома, лейкоз, рак молочной железы, рак поджелудочной железы, рак легкого, рак яичника, рак полости рта, а также рак простаты), метастазы опухолей, кахексию, связанную с наличием рака.
Используемый в данном изобретении термин "ревматоидный артрит" относится к виду аутоиммуной болезни, которая характеризуется воспалением синовиальной сумки в суставе по всему организму. Ранним симптомом этого заболевания является боль в суставах, которая затем прогрессирует, приводя к деформации суставов или к повреждению органов в организме, таких как кровеносные сосуды, сердце, легкие, кожа и мышцы.
Применяемый в данном изобретении термин "ангиогенез" в общем относится к фундаментальному процессу, при котором образуются новые кровеносные сосуды. Ангиогенез может представлять собой нормальный физиологический процесс во время периода роста тканей, например, при увеличении мышечной массы, заживлении раны и беременности, но может быть также связан с болезненным состоянием, когда рост кровеносных сосудов не благоприятен для здоровья, например, в случае рака и диабетической ретинопатии.
Термин "рак", используемый в данном изобретении, относится к медицинскому состоянию, опосредованному группой неопластических или злокачественных клеток, пролиферации или метастатическому состоянию, включая солидные опухоли и несолидные опухоли. Примеры раковых заболеваний включают, но без ограничения, рак легкого, рак почки, рак желудка, рак молочной железы, цервикальный рак (рак шейки матки), рак яичника, рак печени, рак мочевого пузыря, рак мочеполового тракта, рак щитовидной железы, меланому, рак головы и шеи, рак прямой кишки, лейкоз, лимфомы и миеломы.
Термин "кахексия" относится к плохому общему состоянию здоровья и похуданию. Кахексия обычно связана с или индуцирована злокачественными опухолями и характеризуется полной потерей аппетита, резкой потерей веса, особенно безжировой тощей массы тела и мышечной атрофией.
Высокоаффинные антитела к IL6
Настоящее изобретение основано на идентификации ряда высокоаффинных антител к IL6, включая антитела 1-4-62, Ag1-4-6 (известное также как FB704) и HAg1T-3-10. Эти антитела к IL6, как было установлено, связываются с человеческим IL-6 с высокой аффинностью (например, имеют величину kd менее 10-8 М, предпочтительно менее 10-9 М) и с высокой специфичностью, например, связываются с другими членами семейства цитокинов IL6, например, с показанными на Фигуре 3, со значительной меньшей аффинностью по сравнению с человеческим IL6. Кроме того, было обнаружено, что эти антитела значительно снижают IL-6-индуцированную клеточную пролиферацию и фосфорилирование STAT3, ангиогенез и продуцирование гемоглобина. Более того, эти антитела к IL6 успешно подавляют вызванную наличием рака (например, рака простаты) кахексию, рост раковых клеток поджелудочной железы, метастазы, такие как метастазы предстательной железы, значительно повышают противораковое действие других химиотерапевтических агентов, таких как оксалиплатин, гемцитабин и доцетаксел, и снижают продуцирование воспалительного цитокина (например, МСР-1 и sICAM) и/или VEGF клетками HUVEC и РВМС и/или синовиальными фибробластами, например, полученными от пациентов с RA.
Соответственно, в данном изобретении описаны высокоаффинные антитела, способные к связыванию (например, к специфическому связыванию) с человеческим IL6, включая антитела 1-4-62, Ag1-4-6 и HAg1T-3-10 и их функциональные варианты. Аминокислотные последовательности вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL) каждого из антител 1-4-62, Ag1-4-6 и HAg1T-3-10 представлены в Таблице 1 ниже. Функциональный вариант любого из этих антител может включать цепь VH, которая содержит аминокислотную последовательность по меньшей мере на 85% (например, на 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99%) идентичную аминокислотной последовательности VH антитела 1-4-62, Ag1-4-6 или HAg1T-3-10 (SEQ ID NO: 17 или SEQ ID NO: 18), цепь VL, которая содержит аминокислотную последовательность по меньшей мере на 85% (например, на 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99%) идентичную аминокислотной последовательности VL антитела 1-4-62, Ag1-4-6 или HAg1T-3-10 (SEQ ID NO: 19 или SEQ ID NO: 20), или обе этих цепи. Эти варианты способны связываться с человеческим IL6. В некоторых примерах эти варианты обладают похожей антигенсвязывающей аффинностью при сравнении с эталонными антителами, описанными выше (например, имеющими величину kd менее 1×10-8; предпочтительно менее 1×10-9 или 1×10-10 М).
Аффинность характеризуется показателями ka (константа скорости ассоциации), kd (константа скорости диссоциации) или KD (константа равновесия). Обычно термин "специфическое связывание" по отношению к антителу означает, что антитело специфически связывается (распознает) с мишенью (мишенями) с величиной аффинности (KD) менее 10-8 М, например, менее 10-9 М или 10-10 М. Более низкая величина KD характеризует большую аффинность (то есть более сильное связывание), поэтому величина KD равная 10-9 указывает на более высокую аффинность по сравнению с величиной KD равной 10-8.
"Процент идентичности" двух аминокислотных последовательностей определяется с помощью алгоритма, описанного в публикации Karlin and Altschul Proc. Natl. Acad. Sci. USA 87: 2264-68, 1990, измененного в публикации Karlin and Altschul Proc. Natl. Acad. Sci. USA 90: 5873-77, 1993. Такой алгоритм используется в программах NBLAST и XBLAST (версия 2.0) в публикации Altschul, et al. J. Mol. Biol. 215: 403-10, 1990. Поиск белков по программе BLAST может быть осуществлен с помощью программы XBLAST, при значении параметров оценка (score)=50, длина слова (wordlength)=3 с целью получения аминокислотных последовательностей гомологичных молекул белков, представляющих интерес. Если между двумя последовательностями стоят гэпы, можно применить программу Gapped BLAST, как описано в публикации Altschul, et al. Nucleic Acids Res. 25(17): 3389-3402, 1997. Когда используются программы BLAST и Gapped BLAST, могут быть применены параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST).
Антитела, связывающиеся с теми же самыми эпитопами, такие как 1-4-62, Ag1-4-6, и HAg1T-3-10, также входят в объем данного изобретения.
Согласно некоторым вариантам антитело к IL6 включает вариабельную область тяжелой цепи (VH), которая содержит НС CDR3 из MHIDDSNGYXSDAF (SEQ ID NO: 21), где X обозначает остаток ароматической аминокислоты, такой как F, Y, Н или W. В некоторых примерах НС CDR3 представляет собой SEQ ID NO: 6 или SEQ ID NO: 16. Цепь VH такого антитела содержит также НС CDR1 из SEQ ID NO: 2, НС CDR2 из SEQ ID NO: 2 или обе эти области.
Альтернативно или в дополнение, антитело к IL6 содержит вариабельную область легкой цепи (VL), которая содержит LC CDR3 из SEQ ID NO: 13 или SEQ ID NO: 15. Цепь VL такого антитела может также содержать LC CDR1 из SEQ ID NO: 9, LC CDR2 из SEQ ID NO: 11, или обе эти области.
В соответствии с некоторыми вариантами антитела к IL6, описанные в данном изобретении, включают те же самые CDRs тяжелой цепи и легкой цепи, что и антитела 1-4-62, Ag1-4-6 и HAg1T-3-10, как показано в Таблице 1 ниже. В некоторых примерах эти антитела включают те же самые цепи VH и VL, что и антитела 1-4-62, Ag1-4-6 и HAg1T-3-10. Цепи VH и VL могут быть слиты с CH1 тяжелой цепи и CL, соответственно, с образованием фрагментов Fab, Fab' или F(ab')2. Альтернативно, цепи VH и VL могут быть слиты с константной областью тяжелой цепи (например, константной областью человеческого IgG) и константной областью легкой цепи (каппа цепи) с образованием полноразмерных антител. Согласно другим примерам цепи VH и VL могут быть слиты, непосредственно или через линкер с образованием одноцепочечного антитела.
Согласно другим вариантам функциональные варианты, описанные в данном изобретении, могут содержать одну или более мутаций (например, консервативных замен) в областях FRs в VH, VL или в обеих областях по сравнению с областями в антителах 1-4-62, Ag1-4-6 и HAg1T-3-10. Предпочтительно, такие мутации не возникают в остатках, которые прогнозируются как остатки, взаимодействующие с одной или более CDRs. Как известно из уровня техники, мутации в областях FR вряд ли влияют на ангигенсвязывающую активность антител. Согласно некоторым вариантам изменения в одной или более областях CDR антител 1-4-62, Ag1-4-6 и HAg1T-3-10 являются несущественными, то есть практически идентичными эталонной последовательности.
Термин "несущественные" или "практически идентичные" означает, что релевантные аминокислотные последовательности (например, в FRs, CDRs, VH, или VL) варианта незначительно отличаются (например, включая консервативные аминокислотные замены) по сравнению с эталонным антителом, таким образом, что вариант обладает по существу подобной связывающей активностью (например, аффинностью, специфичностью или и тем, и другим) и биоактивностью по сравнению с эталонным антителом. Такой вариант может включать незначительные изменения аминокислот, например, 1 или 2 замены в последовательности из 5 аминокислот в конкретной области. Вообще в областях FR может быть сделано больше изменений в противоположность областям CDR, пока эти изменения не начнут неблагоприятно влиять на функцию связывания антитела (например, происходит снижение аффинности более чем на 50% по сравнению с исходным антителом). Согласно некоторым вариантам идентичность последовательностей между исходным и модифицированным антителами может составлять около 85%, 90%, 95%, 96%, 97%, 98%, 99% или более. В соответствии с некоторыми вариантами модифицированное антитело имеет ту же специфичность связывания и по меньшей мере 50% аффинности исходного антитела. В некоторых примерах вариант антитела включает до 5 аминокислотных замен, таких как консервативные замены (например, 1, 2, 3, 4 или 5) в одной или более областях CDR в VH, VL или в обеих этих областях антител 1-4-62, Ag1-4-6 и HAg1T-3-10.
Консервативные замены приведут к получению молекул, обладающих функциональными и химическими характеристиками, похожими на характеристики молекулы, из которой были получены модифицированные молекулы. Например, "консервативная аминокислотная замена" может включать замену остатка нативной аминокислоты другим остатком, при этом полярность или заряд аминокислотного остатка в этом положении не меняются или меняются незначительно. Желаемые аминокислотные замены (консервативные или неконсервативные) могут быть определены специалистами в данной области. Например, замены аминокислот могут быть использованы для идентификации важных остатков в последовательности молекулы или для увеличения, или для уменьшения аффинности молекул, описанных в данном изобретении. Варианты, содержащие одну или более аминокислотных замен, могут быть получены в соответствии с методами изменения полипептидной последовательности, известными среднему специалисту в данной области, такими как методы, описанные, например, в публикациях Molecular Cloning: A Laboratory Manual. J. Sambrook, et al., eds., Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989, или Current Protocols in Molecular Biology, F.M. Ausubel, et al., eds., John Wiley & Sons, Inc., New York. Консервативные замены аминокислот включают замены среди аминокислот в следующих группах: (а) М, I, L, V; (b) F, Y, W; (с) K, R, Н; (d) A, G; (е) S, Т; (f) Q, N; и (g) Е, D.
Настоящее изобретение предусматривает также варианты антител е улучшенными биологическими свойствами, такими как более высокая аффинность. Варианты аминокислотных последовательностей антитела могут быть получены путем введения соответствующих нуклеотидных изменений в нуклеиновую кислоту, кодирующую антитела, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или инсерции и/или замены остатков в аминокислотных последовательностях антитела. Любая комбинация делеции, инсерции и замены делается для получения конечной конструкции, при условии что эта конечная конструкция обладает желаемыми характеристиками. Молекулы нуклеиновой кислоты, кодирующей варианты аминокислотных последовательностей антитела, могут быть получены различными способами, известными из уровня техники. Эти способы включают, но без ограничения, олигонуклеотид-опосредованный (или сайт-направленный) мутагенез, ПЦР (PCR) мутагенез и кассетный мутагенез ранее полученного варианта или не варианта (природной версии) антитела. Согласно одному из вариантов величина константы диссоциации (KD) антител к IL6 согласно изобретению составляет менее 10-8 М, предпочтительно менее 10-9 М или 10-10 М. Аффинность может быть определена при помощи методов, известных из уровня техники, таких как метод ELISA или метод анализа биоспецифического взаимодействия или другими известными методами.
Примеры антител к IL6, описанных в данном изобретении, включают, но без ограничения:
(i) антитело, включающее (a) VH, содержащую НС CDR1, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 2, НС CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 4, и НС CDR3, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 6 или SEQ ID NO: 16; или (b) VL, содержащую LC CDR1, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 9, LC CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 11, и LC CDR3, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 13 или SEQ ID NO: 15;
(ii) антитело, включающее VH, содержащую НС CDR1, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 2, НС CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 4, и НС CDR3, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 6;
(iii) антитело, включающее VL, содержащую LC CDR1, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 9, LC CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 11, и LC CDR3, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 13;
(iv) антитело, включающее (a) VH, содержащую НС CDR1, которая включает SEQ ID NO: 2, НС CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 4, НС CDR3, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 6, и (b) VL, содержащую LC CDR1, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 9, LC CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 11, и LC CDR3, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 13;
(v) антитело, включающее VL, содержащую LC CDR1, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 9, LC CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 11, и LC CDR3, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 15;
(vi) антитело, включающее (a) VH, содержащую НС CDR1, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 2, НС CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 4, и НС CDR3, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 6, и (b) VL, содержащая LC CDR1, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 9, LC CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 11, и LC CDR3, которая включает аминокислотную последовательность, показанную SEQ ID NO: 15;
(vii) антитело, включающее VH, содержащую НС CDR1, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 2, НС CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 4, и НС CDR3, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 16;
(viii) антитело, включающее VH, содержащую (а) НС CDR1, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 2, HC CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 4, НС CDR3, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 16, и (б) VL, которая содержит LC CDR1, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 9, LC CDR2, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 11, и LC CDR3, которая включает аминокислотную последовательность, показанную как SEQ ID NO: 15. Любое из антител к IL6, описанных в данном изобретении, можно анализировать для определения его свойств, таких как антигенсвязывающая активность, антигенсвязывающая специфичность и биологические функции, применяя обычные методы, например, описанные в примерах, приведенных в данном изобретении.
Любое из антител к IL6, описанных в данном изобретении, можно модифицировать таким образом, чтобы оно содержало небелковые фрагменты, которые известны из уровня техники и легко доступны, например, путем пэгилирования, гипергликозилирования и т.п. Интерес представляют модификации, которые приводят к повышению периода полужизни в сыворотке.
В данном изобретении заявлены также нуклеиновые кислоты, кодирующие любое из антител к IL6, описанных в данном изобретении, векторы, такие как экспрессионные векторы, содержащие эти кислоты, и клетки-хозяева, включающие эти векторы. Согласно одному из примеров последовательности, кодирующие и тяжелую, и легкую цепи (например, последовательности, кодирующие VH и VL, VH-CH1 и VL-CL, или полноразмерную тяжелую цепь и полноразмерную легкую цепь), включаются в один экспрессионный вектор. Согласно другому примеру каждая из тяжелых и легких цепей антитела клонируется в отдельный вектор. В последнем случае экспрессионные векторы, кодирующие тяжелую и легкую цепи, могут быть совместно трансфецированы в одну клетку-хозяина для экспрессии обеих цепей, которые могут быть собраны для образования интактного антитела или in vivo, или in vitro. Альтернативно, экспрессионный вектор, кодирующий тяжелую цепь, и который кодирует легкую цепь, может вводиться в различные клетки-хозяева для экспрессии каждой из тяжелых и легких цепей, которые затем могут быть очищены и собраны с образованием интактных антител in vitro.
Специалистам в данной области известны многочисленные способы получения антител или их антигенсвязывающих фрагментов. Например, антитела могут быть получены с использованием методов рекомбинантных ДНК. Моноклональные антитела могут быть также получены с применением гибридом. Полученные гибридомы затем подвергают скринингу, используя стандартные методы, такие как твердофазный иммуноферментный анализ (ELISA), для идентификации одной или более гибридом, которые продуцируют антитело, которое специфически связывается с определенным антигеном. Кроме того, для скрининга одноцепочечных антител можно использовать системы фагового дисплея.
Альтернативно, любое из антител к IL6 может быть получено обычными методами, например, с применением технологии рекомбинантных ДНК. Полипептидные последовательности, предусмотренные данным изобретением (см. Таблицу 1) для типичных антител, описанных в данном изобретении, могут быть использованы в качестве примера, чтобы получать подходящие кодирующие их последовательности нуклеиновых кислот, и последовательности нуклеиновых кислот можно клонировать в подходящие экспрессионные векторы, используя технологию рекомбинантных ДНК для получения антител в подходящих клетках-хозяевах (например, в бактериальных клетках, клетках дрожжей или в клетках млекопитающих, таких как клетки СНО) рутинными методами. Полученные таким образом антитела могут быть выделены из клеток или клеточных супернатантов и рутинными методами могут быть определены их связывающая способность и биоактивность.
Согласно одному из примеров система фагового дисплея используется для выбора одноцепочечных антител к IL6. После выделения полинуклеотиды, кодирующие специфические scFvs антитела к IL6, можно клонировать в экспрессионные векторы, сконструированные для экспрессии полноразмерных молекул иммуноглобулинов и их фрагментов, обладающих желаемой специфичностью. Вкратце, VH и VL полинуклеотидов одноцепочечного антитела клонируются в каркасную область вектора иммуноглобулина (а именно, IgG), экспрессируются и димеризуются таким образом, чтобы происходило "превращение" одноцепочечного антитела в полноразмерное антитело. Каркасная область иммуноглобулина может быть выбрана из любого из пяти основных классов иммуноглобулинов (IgA, IgD, IgE, IgG и IgM) по необходимости. Методы превращения фрагментов scFvs в интактные молекулы иммуноглобулина хорошо известны, например, они описаны в заявках WO 94/11523, WO 97/9351 или в патенте ЕР 0481790.
Рекомбинантные векторы для экспрессии антител, описанных в данном изобретении, обычно содержат нуклеиновую кислоту, кодирующую аминокислотные последовательности антитела, функционально связанные с промотором, или конститутивным, или индуцибельным. Векторы могут быть подходящими для репликации и интеграции в прокариоты, эукариоты или и в те, и в другие. Типичные векторы содержат терминаторы транскрипции и трансляции, последовательности инициации и промоторы, подходящие для регуляции экспрессии нуклеиновой кислоты, кодирующей антитело. Векторы необязательно содержат общие экспрессионные кассеты, включающие по меньшей мере одну последовательность независимого терминатора, последовательности, способствующие репликации кассеты как в эукариотах, так и в прокариотах, то есть шаттл-векторы (челночные векторы), и маркеры селекции и для систем прокариот, и для систем эукариот.
Рекомбинантные антитела K-IL6, описанные в данном изобретении, могут быть продуцированы в прокариотических и эукариотических экспрессионных системах, таких как клетки бактерий, дрожжей, насекомых и млекопитающих. Не является необходимым, чтобы рекомбинантные антитела в соответствии с данным изобретением были гликозилированными или экспрессировались в клетках эукариот, однако предпочтительной является экспрессия в клетках млекопитающих. Примеры подходящих линий клеток-хозяев, являющихся млекопитающими, включают клетки линии почек эмбриона человека (клетки 293), клеточную линию почки новорожденного хомячка (клетки ВНК), клетки яичника китайского хомячка /- или + DHFR (клетки СНО, CHO-S, CHO-DG44, Flp-in), клеточную линию почки африканской зеленой мартышки (клетки VERO) и клеточную линию печени человека (клетки Hep G2). Клетки-хозяева трансформируются или трансфецируются с помощью векторов (например, методами химической трансфекции или электропорации) и культивируются в типичной питательной среде (или в среде, модифицированной нужным образом) для индуцирования промоторов, селекции трансформантов или амплификации генов, кодирующих желаемые последовательности. Полученный белок-антитело может быть затем выделен или очищен для получения препаратов, которые по существу являются гомогенными, для дальнейших анализов и намеченного применения. Могут быть использованы стандартные методы очистки белков, известные из уровня техники. Например, подходящие методы очистки могут включать фракционирование на иммуноаффинных или ионообменных колонках, осаждение этанолом, высокоэффективную жидкостную хроматографию (HPLC), электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), а также осаждение сульфатом аммония и гель-фильтрацию.
Когда желательно получить полноразмерное антитело, кодирующие последовательности любой из цепей VH и VL антител к IL6, описанных в данном изобретении, можно связывать с кодирующими последовательностями области Fc человеческого иммуноглобулина, и полученный ген, кодирующий тяжелую и легкую цепи полноразмерного антитела, можно экспрессировать и собирать в подходящей клетке- хозяине, например, в клетке растения, клетке млекопитающего, клетке дрожжей или клетке насекомого.
Антигенсвязывающие фрагменты могут быть получены рутинными методами. Например, фрагменты F(ab')2 могут быть получены путем расщепления молекулы полноразмерного антитела пепсином, и фрагменты Fab могут быть получены путем восстановления дисульфидных мостиков фрагментов F(ab')2. Альтернативно, такие фрагменты могут быть получены при помощи рекомбинантной технологии при экспрессии фрагментов тяжелых и легких цепей в подходящих клетках-хозяевах (например, в клетках Е.coli, дрожжей, млекопитающих, растения или насекомого) и собраны с образованием желаемых антигенсвязьшающих фрагментов или in vivo или in vitro.
Одноцепочечное антитело может быть получено с помощью технологии рекомбинантной ДНК путем соединения нуклеотидной последовательности, кодирующей вариабельную область тяжелой цепи и нуклеотидной последовательности, кодирующей вариабельную область легкой цепи. Между двумя вариабельными областями предпочтительно вводить гибкий линкер.
Применение антител к IL6
Было установлено, что антитела к IL6, описанные в данном изобретении, связываются с IL6 и действуют как антагонисты IL6, а также регулируют Независимые сигнальные пути. В частности, было обнаружено, что эти антитела в значительной степени ингибируют IL6-зависимую клеточную пролиферацию (например, рост раковых клеток поджелудочной железы) и трансдукцию сигнала фосфорилированного STAT, снижают IL6-индуцированное образование кровеносных сосудов in vivo и подавляют метастазы опухолей у человека (например, метастазы при раке простаты). Кроме того, эти антитела проявляли синергический эффект, когда использовались совместно с химиотерапевтическим агентом, таким как оксалиплатин, гемцитабин и доцетаксел, на животных моделях опухоли поджелудочной железы человека.
Следовательно, антитела к IL6, описанные в данном изобретении, могут быть использованы при лечении заболевания или состояния, ассоциированного с IL6, включая, но без ограничения, воспалительное расстройство, аутоиммунные болезни (например, ревматоидный артрит (RA), болезнь Крона, болезнь Каслмана, рассеянный склероз, анкилозирующий спондилит, псориатический артрит и псориаз), ангиогенез, рак, такой как солидная опухоль (например, множественная миелома, лейкоз, рак молочной железы, рак поджелудочной железы, ряд легкого, рак яичника, рак полости рта и рак простаты), метастазы опухолей и кахексия, связанная с наличием ракового заболевания.
Для осуществления способов лечения, описанных в данном изобретении, любое из антител к IL6 (например, антитело, содержащее те же самые CDRs или те же самые цепи VH и VL, что и антитела 1-4-62, Ag1-4-6 или HAg1T-3-10), или нуклеиновая(-ые) кислота (кислоты) (например, экспрессионный вектор), кодирующие такое антитело, могут вводиться в состав фармацевтической композиции вместе с одним или более фармацевтическими носителями. Термин "фармацевтически приемлемый", применяемый в данном изобретении, означает, что носитель совместим с активным ингредиентом в композиции, предпочтительно, способен стабилизировать активный ингредиент и не является вредным для субъекта, подвергающегося лечению. Носитель может служить как разбавитель, наполнитель, эксципиент, а также как среда для активного ингредиента. Некоторые примеры подходящих носителей включают физиологически совместимые буферные вещества, такие как раствор Хэнка, раствор Рингера, физиологический раствор, лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, смолу акации, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, стерильную воду, сиропы и метилцеллюлозу. Фармацевтическая композиция может дополнительно включать смазывающие агенты, такие как тальк, стеарат магния и минеральное масло, смачиватели; эмульгирующие и суспендирующие агенты; консерванты, такие как метил- и пропилгидроксибензоаты; подсластители и вкусовые вещества. См., например, Remington's Pharmaceutical Sciences, Edition 16, Mack Publishing Co., Easton, Pa (1980); и Goodman and Gilman's "The Pharmacological Basis of Therapeutics", Tenth Edition, Gilman, J. Hardman and L. Limbird, eds., McGraw-Hill Press, 155-173, 2001.
Фармацевтическая композиция согласно настоящему изобретению может быть в виде таблеток, пилюль, порошков, леденцов, саше, крахмальной облатки, эликсиров, суспензий, эмульсий, растворов, сиропов, мягких и твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекции и порошков в упаковке. Согласно данному изобретению фармацевтическая композиция может быть доставлена любым физиологически приемлемым путем. Способы введения могут включать, но без ограничения, парентеральное введение, системное введение, пероральное введение, назальное введение, ректальное введение, интраперитонеальное (внутрибрюшинное) введение, внутрисосудистое введение, подкожное введение, чрескожное введение, введение путем ингаляции и внутримышечное введение. Термин "парентеральное", используемый в данном изобретении, включает подкожное, внутрикожное, внутривенное, внутримышечное, внутрисуставное, внутриартериальное, внутрисуставное, интрастернальное (внутригрудинное), интратекальное введение, внутриочаговое введение и внутричерепную инъекцию или инфузию.
Фармацевтические композиции для терапевтического применения можно приготовить для хранения в виде лиофилизированных препаратов или водных растворов, посредством смешения агента нужной степени чистоты с фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)). Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными по отношению к реципиенту при всех применяемых дозах и концентрациях и включают буферы, такие как фосфатный, цитратный и буферы других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (например, октадецил диметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензетония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, например метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (содержащие менее, примерно, 10 остатков) полипептиды; белки, например сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, например поливинилпирролидон; аминокислоты, например глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, например EDTA; сахара, например сахарозу, маннит, трегалозу или сорбит; солеобразующие противоионы, например ион натрия; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как Твин (TWEEN™), плюроник (PLURONICS™) или полиэтиленгликоль (PEG).
Согласно некоторым вариантам способ по настоящему изобретению предназначается для лечения рака, такого как рак предстательной железы (простаты). Человек, нуждающийся в таком лечении, может являться пациентом, который болен раком или, возможно, болен раком. В некоторых примерах определенное количество антитела к IL6, описанного в настоящем изобретении, эффективно ингибирует IL6-индуцируемую пролиферацию клеток по меньшей мере на 20%, 30%, 50%, 80%, 100%, 200%, 400% или 500% по сравнению с контрольным (холостым) опытом. Согласно другим вариантам определенное количество антитела к IL6, описанного в настоящем изобретении, эффективно ингибирует фосфорилирование STAT3 по меньшей мере на 20%, 30%, 50%, 80%, 100%, 200%, 400% или 500%. В некоторых примерах определенное количество антитела к IL6, описанного в настоящем изобретении, эффективно ингибирует IL6- индуцированный ангиогенез, вызванную раком кахексию (например, кахексию, вызванную раком простаты), метастазирование рака (метастазирование рака простаты) или их комбинацию.
Согласно другим вариантам способ по настоящему изобретению предназначен для лечения аутоиммунного заболевания, такого как ревматоидный артрит. Согласно другому варианту субъектом является человек, больной или предположительно больной этим заболеванием. В отдельном примере определенное количество антитела к IL6, описанного в настоящем изобретении, является достаточным для снижения продуцирования воспалительных цитокинов, таких как МСР-1 и/или sICAM, например, по меньшей мере на 20%, 30%, 50%, 80%, 100%, 200%, 400% или 500%.
Для лечения целевого заболевания, такого как рак или ревматоидный артрит, эффективное количество фармацевтической композиции, указанной выше, можно вводить субъекту (например, человеку), нуждающемуся в лечении, подходящим способом. Человек, нуждающийся в таком лечении, может быть человеком с повышенным риском нарушения или с подозрением на нарушение, ассоциируемое с IL6. Такого пациента можно определить при обычном медицинском осмотре.
Любое из антител к IL6, описанных в настоящем изобретении, можно применять в комбинации с другим терапевтическим агентом. Выражение "в комбинации" в данном контексте означает, что композицию с антителом и терапевтический агент дают либо одновременно, либо последовательно. Например, комбинированная терапия может включать по меньшей мере одно антитело к IL6, приготовленное совместно и/или вводимое совместно по меньшей мере с одним дополнительным терапевтическим агентом. Согласно одному варианту дополнительный агент представляет собой противораковый химиотерапевтический агент, например, оксалиплатин, гемцитабин, демцитабин, доцетаксел. Согласно другому варианту дополнительный агент может представлять собой болезнь-модифицирующее противоревматическое лекарственное средство (DMARD), например метотрексат, азатиоприн, хлорохин, гидроксихлорохин, циклоспорин А, сульфасалазин для лечения RA. В такой комбинированной терапии могут применяться, преимущественно, более низкие дозы вводимых терапевтических агентов, тем самым предупреждаются возможные токсичность или осложнения, связанные с различными вариантами монотерапии. Дополнительные терапевтические агенты, описанные в настоящем изобретении, могут также воздействовать на метаболические пути в дополнение к IL6/I6R/gp130 метаболическому пути или отличные от IL6/I6R/gp130 метаболического пути и поэтому, предположительно, усиливают эффекты и/или суммируются с эффектами антител к IL6.
Если композиция антитела по настоящему изобретению применяется совместно со вторым терапевтическим агентом, то для лечения субъекта с заболеванием или с повышенным риском развития заболевания или нарушения, ассоциированного с клеточной сигнализацией, опосредуемой IL6, может применяться субтерапевтическая доза либо композиции, либо второго агента, или субтерапевтическая доза обоих. Термин "субтерапевтическая доза" в данном контексте относится к дозе ниже дозы, которая дает терапевтический результат у субъекта при ее введении в отсутствие другого агента или других агентов. Таким образом, субтерапевтическая доза агента представляет собой дозу, которая не дает заданного терапевтического результата у субъекта в отсутствие антитела к IL6 по настоящему изобретению. Терапевтические дозы многих агентов, которые имеют применение в клинической практике, хорошо известны в данной области медицины, а дополнительные терапевтические дозы могут определять специалисты без лишних экспериментов. Определение терапевтических доз подробно описано в таких публикациях, как Remington's Pharmaceutical Sciences, 18th ed., 1990; а также во многих других медицинских источниках, которые используют медики в качестве надежного руководства при лечении заболеваний и нарушений.
Для введения фармацевтической композиции субъекту можно применять обычные методы, известные среднему специалисту-медику, зависящие от типа заболевания, подлежащего лечению, или области заболевания.
Композиции для инъекций могут содержать различные носители, например, растительные масла, диметиллактамид, диметилформамид, этиллактат, этилкарбонат, изопропилмиристат, этанол и полиолы (глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.). Для внутривенного введения водорастворимые антитела можно вводить капельным методом, т.е. инфузией фармацевтической композиции, содержащей антитело и физиологически приемлемый эксципиент. Физиологически приемлемые эксципиенты могут включать, например, 5% декстрозу, 0.9% раствор хлорида натрия, раствор Рингера или другие подходящие эксципиенты. Внутримышечные препараты, например, стерильный препарат подходящей растворимой солевой формы антитела, можно растворить и вводить в фармацевтическом эксципиенте, таком как вода для инъекций, 0.9% раствор хлорида натрия или 5% раствор глюкозы.
Если в качестве терапевтического агента применяе(-ю)тся нуклеиновая(-ые) кислота(-ы), кодирующая(-ие) антитело к IL6, описанное в настоящем изобретении, то нуклеиновую(-ые) кислоту(-ы) или вектор(-ы), экспрессирующую(-ий, -ие) антитело, можно доставлять субъекту такими методами, как методы, описанные в Akhtar, et al., 1992, Trends Cell Bio. 2, 139. Например, их можно вводить в клетки, применяя липосомы, гидрогели, циклодекстрины, биоразрушаемые нанокапсулы или биоадгезивные микросферы. Или же нуклеиновую кислоту или вектор можно доставлять местно в виде непосредственной инъекции или с помощью инфузионного насоса. Другие методы включают применение различных транспортных систем и систем-носителей, например, с использованием конъюгатов или биоразрушаемых полимеров.
Для того чтобы стимулировать доставку, любое антитело к IL6 можно конъюгировать с агентом-шапероном. Термин "конъюгированный" означает, что две структуры ассоциированы, предпочтительно, с достаточной аффинностью, так что в результате ассоциации между двумя структурами достигается терапевтический эффект."Конъюгирование" включает ковалентное или нековалентное связывание, а также другие формы ассоциации, такие как захват одной структуры на поверхности другой или внутрь другой или захват любой структуры или обеих структур на (поверхности) или внутри третьей структуры (например, мицеллы).
Агент-шаперон может представлять собой природное вещество, такое как белок (например, человеческий сывороточный альбумин, липопротеин низкой плотности или глобулин), углевод (например, декстран, пуллулан, хитин, хитозан, инулин, циклодекстрины или гиалуроновая кислота) или липид. Он также может представлять собой рекомбинантную или синтетическую молекулу, например, синтетический полимер, такой как синтетическая полиаминокислота. Примеры полиаминокислот включают полилизин (PLL), поли-L-аспарагиновую кислоту, поли-L-глутаминовую кислоту, сополимер стирола и малеинового ангидрида, сополимер поли(L-лактид-ко-гликолид), сополимер дивинилового эфира с малеиновым ангидридом, сополимер N-(2-гидроксипропил)метакриламида (НМРА), полиэтиленгликоль (PEG), поливиниловый спирт (PVA), полиуретан, поли(2-этилакриловую кислоту), полимеры N-изопропилакриламида и полифосфазин.
В одном примере шаперон представляет собой мицеллу, или микросферу, в которой инкапсулирован(-а) олигонуклеотид/интерферирующая РНК. Методы получения такой мицеллы, липосомы, наночастицы или микросферы хорошо известны из уровня техники. См., например, патенты США №№5108921, 5354844, 5416016 и 5527528.
В другом примере агент-шаперон представляет собой субстрат для связывания одного или более фузогенных (способствующих слиянию) или конденсирующих агентов.
Фузогенный агент реагирует на величину рН на данном участке. Например, при рН в эндосоме он может вызвать физическое изменение в своем ближайшем окружении, например, изменение осмотических свойств, которое разрушает эндосомную мембрану или повышает ее проницаемость, тем самым способствуя высвобождению антисмыслового олигонуклеотида в цитоплазму клетки-хозяина. Предпочтительный фузогенный агент меняет заряд, например, становится протонированным при рН ниже физиологического интервала (например, при рН 4.5-6.5). Фузогенные агенты могут представлять собой молекулы, содержащие аминогруппу, способную изменять заряд (например, протонироваться) в определенном интервале рН. Такие фузогенные агенты включают полимеры, имеющие полиаминные цепи (например, полиэтиленимин), и агенты, разрушающие мембраны (например, меллитин). Другие примеры включают полигистидин, полиимидазол, полипиридин, полипропиленимин и полиацеталь (например, катионный полиацеталь).
Конденсирующий агент А взаимодействует с антисмысловым олигонуклеотидом, побуждая его конденсироваться (например, уменьшать размер олигонуклеотида), тем самым защищая его от расщепления. Предпочтительно, конденсирующий агент включает функциональную группу (например, имеющую заряд функциональную группу), которая взаимодействует с олигонуклеотидом, например, по ионному механизму. Примеры конденсирующих агентов включают полилизин, спермин, спермидин, полиамин или его четвертичную соль, псевдопептид-полиамин, пептидомиметический полиамин, аргинин, амидин, протамин, катионный липид, катионный порфирин и "альфа-спиральный" пептид.
Антитела к IL6, описанные в настоящем изобретении, можно также применять для обнаружения IL6 в биологических образцах. Методы обнаружения на основе антител хорошо известны из уровня техники и включают, например, методы ELISA, иммуноблоттинг (вестерн-блоттинг), радиоиммуноанализы, иммунофлуоресцентный анализ, иммунопреципитацию и другие похожие методы. Антитела могут предоставляться в диагностическом наборе, который включает по меньшей мере еще компонент для обнаружения белка. Набор может также содержать упаковку, инструкции или другой материал, который облегчает обнаружение белка и применение набора.
Антитела можно модифицировать с помощью детектируемых маркеров, включая лиганды (например, биотин), радиоизотопы, флуорофоры или ферменты. Ферменты детектируют по их активности. Например, пероксидазу хрена детектируют по ее способности превращать субстрат, тетраметилбензидин (ТМВ), в синий пигмент, который можно количественно определять на спектрофотометре. Антитела могут также функционально связываться (например, посредством генетического слияния, химической конденсации, нековалентной ассоциации или другим методом) по меньшей мере еще с одной другой молекулой, такой как другое антитело (например, биспецифическое или полиспецифическое антитело), цитотоксические или цитостатические агенты, токсины, радиоизотопы и т.п.
Наборы
В настоящем изобретении предусматриваются также наборы для применения при лечении заболеваний, ассоциированных с IL6. Такие наборы включают один или более контейнеров, содержащих антитело к IL6 (например, 1-4-62, Ag1-4-6 и HAg1T-3-10) или кодирующую его нуклеиновую кислоту.
Согласно некоторым вариантам набор может содержать инструкции по применению в соответствии с любым из способов, описанных в настоящем изобретении. Вложенные инструкции могут содержать описание применения антитела к IL6 для лечения, задержки или облегчения заболевания, ассоциированного с IL6, такого как рак (например, рак простаты) или аутоиммунное заболевание (например, RA), согласно любому из способов, описанных в настоящем изобретении. Набор может также содержать описание отбора субъекта, подходящего для лечения, на основании того, установлено ли у него заболевание. Согласно другим вариантам изобретения инструкции содержат описание введения антитела к IL6 субъекту с повышенным риском развития данного заболевания.
Инструкции, относящиеся к применению антитела к IL6, включают обычно информацию относительно дозы, режима дозирования и способа введения для предполагаемого лечения. Контейнеры могут представлять собой однодозовые упаковки, объемные упаковки (например, многодозовые упаковки) или упаковки, содержащие менее одной дозы. Инструкции, прилагаемые к набору по изобретению, обычно представляют собой письменные инструкции на этикетке или листовке-вкладыше в упаковке (например, бумажном листе, вложенном в набор), но приемлемыми являются также машиночитаемые инструкции (например, инструкции на магнитном или оптическом диске).
На этикетке или в листовке-вкладыше указывается, что композиция применяется для лечения, задержки и/или облегчения, смягчения фиброза или цирроза печени. Могут предоставляться инструкции для осуществления любого из способов по настоящему изобретению.
Наборы по настоящему изобретению находятся в подходящей упаковке. Подходящая упаковка включает, но без ограничения, виалы, флаконы, сосуды, гибкую упаковку (например, герметичную упаковку из полиэфирной пленки или пластиковые мешки) и т.д. Также рассматриваются упаковки для применения в сочетании с конкретным устройством, таким как ингалятор, прибор для назального применения, (например, аэрозольный аппарат) или устройство для инфузии, такое как мининасос (минопомпа). Набор может иметь стерильное входное отверстие (например, контейнер может представлять собой мешок или виалу с внутривенным раствором, с пробкой, которую может проколоть гиподермическая игла для инъекций). Контейнер может иметь стерильное входное отверстие (например, контейнер может представлять собой мешок или виалу с внутривенным раствором, с пробкой, которую может проколоть гиподермическая игла для инъекций). По меньшей мере один активный агент в композиции представляет собой антитело к IL6.
Любой из наборов, описанных в настоящем изобретении, может также включать дополнительный терапевтический агент, например, противораковое лекарственное средство (например, оксалиплатин, гемцитабин или доцетаксел или DMARD (например, метотрексат, азатиоприн, хлорохин, гидроксихлорохин, циклоспорин А или сульфасалазин).
Наборы, необязательно, могут включать дополнительные компоненты, такие как буферы и информацию для интерпретации. Обычно набор содержит контейнер и этикетку или листовку(-и)-вкладыш(-и) на контейнере или прилагаемые к контейнеру. Согласно некоторым вариантам изобретение включает изделия, включающие содержимое вышеописанных наборов.
Полагают, что специалист в данной области техники, без дополнительного исследования, на основе вышеприведенного описания сможет наиболее полно использовать настоящее изобретение. Следовательно, нижеприведенные конкретные варианты следует рассматривать только как иллюстративные и никоим образом не ограничивающие остальную часть раскрытия. Все публикации, цитируемые в настоящем изобретении, включены в настоящее изобретение посредством отсылки для целей или предмета изобретения, указанных в данном контексте.
Пример 1: Идентификация связывания высокоаффинных антител с человеческим IL6
Фаг-дисплейную библиотеку наивных scFv антител человека создавали, как описано ниже, для идентификации высокоаффинных человеческих антител, способных связываться с человеческим IL6.
мРНК выделяли из лимфоцитов периферической крови, взятой у 151 здоровых доноров, и с ее помощью синтезировали кДНК с применением M-MuLV обратной транскриптазы (Fermentas), используя олиго dT праймеры. Гены VH и VL амплифицировали, собирали и лигировали в фагмидный вектор в соответствии со стандартным протоколом с некоторыми модификациями. Лигированные продукты вводили в клетки TGI E-coli методом электропорации. После этого клетки Е.coli извлекали и инкубировали в среде 2YT, содержащей 100 мг/мл ампициллина и 2% глюкозы. В культуру добавляли фаговые частицы хелперного фага М13КO7 для получения scFv в составе фаговых частиц, таким образом создавая библиотеку scFv. Разнообразие библиотеки определяли посредством секвенирования более 1,000 клонов.
Четыре раунда биопэннинга библиотеки scFv проводили как описано ниже. Лунки сенсибилизировали рекомбинантным IL6 в 0.1М NaHCO3 буфере при 4°С в течение ночи, а затем дважды отмывали, используя 300 мкл фосфатно-солевого буфера (PBS). Лунки блокировали с помощью 1% бычьего сывороточного альбумина (BSA) в PBS в течение 1 часа при 37°С; добавляли 100 мкл фаговых частиц (2×1011 БОЕ) в PBS, содержащем 1% BSA и встряхивали 1 час при комнатной температуре (RT). Затем лунки отмывали 6 раз в 300 мкл 0.5% (вес/об.) Tween 20/PBS. Связанные фаги элюировали и амплифицировали, инфицируя с помощью Е coli TG1. Инфицированные клетки "спасали" с помощью M13KO7. Полученные фаговые частицы концентрировали посредством PEG (ПЭГ)- преципитации и использовали для следующего раунда биопэннинга.
В четвертом и пятом раундах биопэннинга фаговые клоны исследовали, проводя скрининг на их антиген-связывающую специфичность с помощью твердофазного иммуноферментного анализа (ELISA). Планшеты ELISA сенсибилизировали рекомбинантным человеческим IL6 или BSA в концентрации 2 мкг/мл в 0.1М NaHCO3 буфере при 4°С в течение ночи. После отмывки в PBS лунки блокировали с помощью 1% (вес/об.) BSA в PBS в течение 1 час при RT. Фаговые клоны и scFv фрагменты добавляли в планшеты, которые инкубировали в течение 1 часа при RT. Планшет отмывали в PBS, содержащем 0.1% (об./об.) Tween 20, а затем обрабатывали HRP-меченным антителом козы к человеческому IgG (KPL), разведенным 1:10,000 в 1% BSA-PBS, в течение 40 мин при RT. Планшет снова отмывали и добавляли раствор субстрата 3,3',5,5'-тетраметилбензидина (ТМВ) для проявления цвета. Затем добавляли стоп-реагент (1М H2SO4) и количественно определяли поглощение при 450 нм на автоматическом фотометре для микропланшетов (Bio-Rad).
После четырех раундов биопэннинга описанным выше методом ELISA более чем у восьмисот фаговых клонов была идентифицирована способность связываться с rhIL6. Для секвенирования с целью определения последовательностей VH и VL, кодирующих антитела к IL6, были выбраны 29 фаговых клонов. Было идентифицировано несколько уникальных клонов; их активность и специфичность связывания определяли сравнительным анализом ELISA.
Исходный фаговый клон, идентифицированный из процессов биопэннинга, описанных выше, клон 1-4-62, был выбран для созревания аффинности с целью получения высокоаффинных антител к IL6 путем создания фаговых библиотек рандомизированных CDR VL/VH антител с помощью сайт-направленного мутагенеза, каждая из которых содержала более 0.9×109 вариантных антител. Библиотеки создавали, используя VL и VH прямые праймеры, содержащие рандомизированные последовательности в CDR областях последовательностей VL и VH клона 1-4-62 в соответствии со стандартными протоколами, представленными ниже. Библиотеки рандомизированных CDR подвергали биопэннингу в очень жестких условиях как описано в настоящем изобретении, и два высокоаффинных клона, Ag1-4-6 (FB704) и Hag1T-3-10, были идентифицированы как проявляющие более высокую активность связывания по сравнению с исходным клоном.
Области, определяющие комплементарность, 1-3 (CDR 1-3), и каркасные области 1-4 (FW1-4) как VH, так и VL доменов для трех антител к IL6, 1-4-62, Ag1-4-6 и Hag1T-3-10, представлены ниже, в Таблице 1:
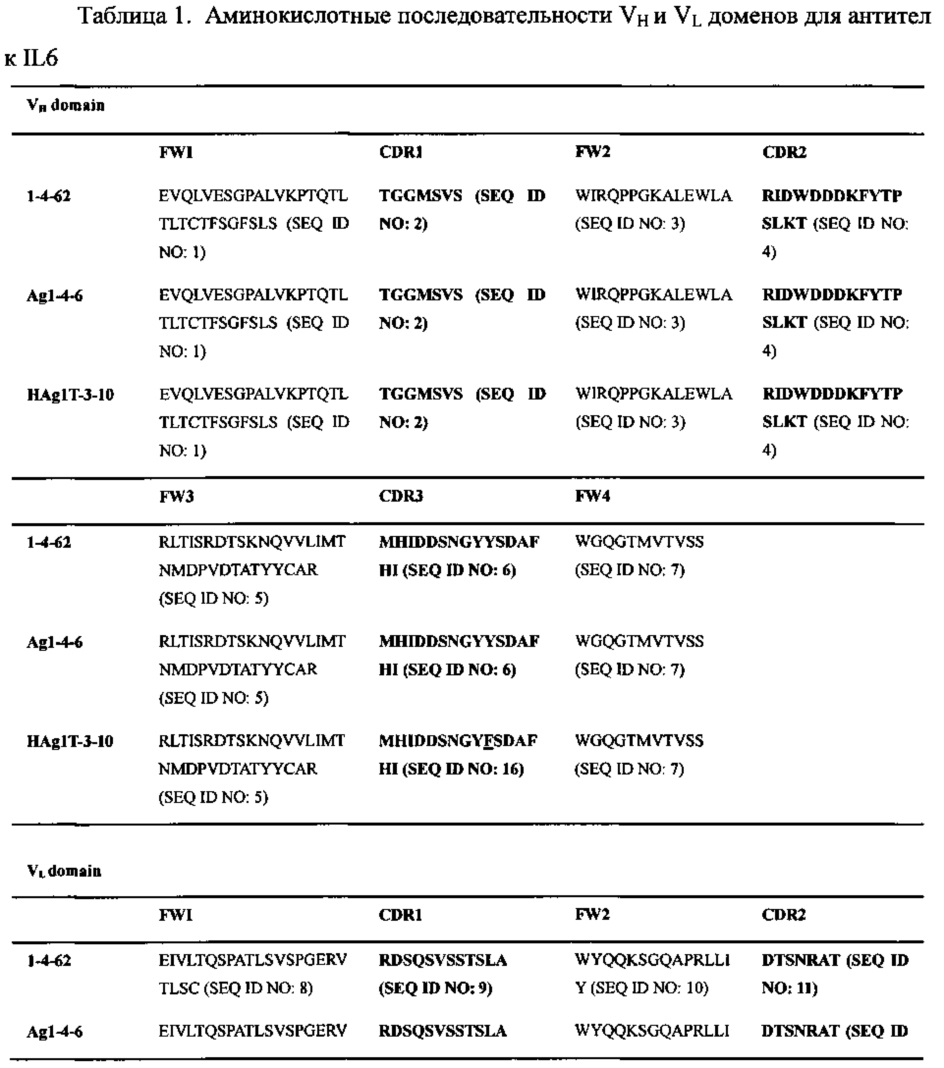
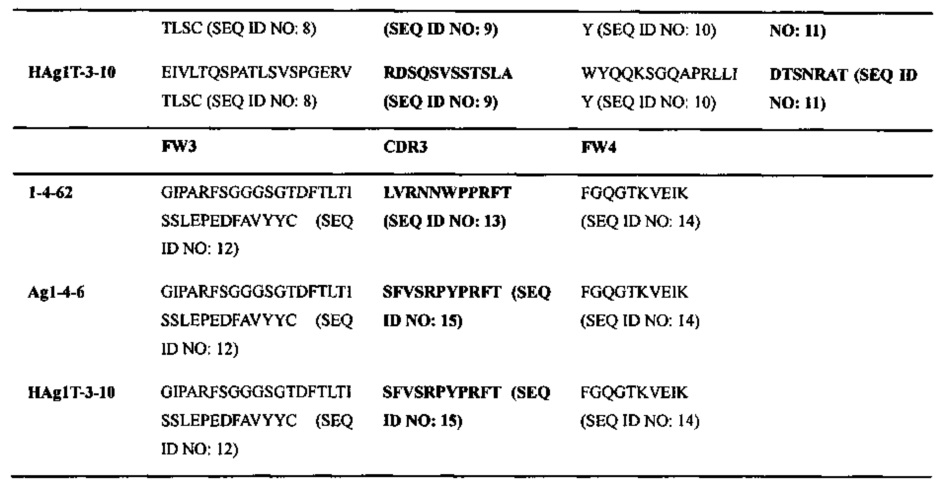
Пример 2: Характеристика связывания высокоаффинных антител к IL6 человека
Материалы и методы
(i) Клеточные линии и антитела
Клетки миеломы человека, линия клеток U266 (BCRC 60437), получали из Коллекции и исследовательского центра биоресурсов (Bioresource Collection and Research Center (BCRC)) на Тайване и выращивали на питательной среде RPMI 1640 (Biowet), дополненной 10% фетальной бычьей сыворотки.
Клетки IL6-зависимой В-клеточной гибридомы, В9, выращивали на среде RPMI 1640, дополненной 5% фетальной бычьей сыворотки плюс 50 пг/мл рекомбинантного человеческого IL6.
Эндотелиальные клетки пупочной вены человека (HUVECs) получали от компании Lonza и выращивали в покрытой желатином чашке Петри на среде EGMTM-2 singleQuots® (Lonza).
Клетки, продуцирующие IgG, клеточной линии FreeStyleTM СНО (Invitrogen), культивировали на среде для экспрессии FreeStyleTM СНО (Invitrogen) плюс 8 мМ L-глутамина.
Клетки СНО линии Flp-in (Invitrogen) выращивали на среде Хэма F12 (Invitrogen) с добавлением 10% фетальной бычьей сыворотки.
Контрольное антитело к IL6, ВЕ8, получали от компании Diaclone. Актемру (Actemra), лекарственное средство на основе антител (антител к IL6), одобренное Управлением по контролю за пищевыми продуктами и лекарственными препаратами США (FDA) для лечения ревматоидного артрита, получали из Universitatsklinikum (Университетской клиники) Heidelberg, Germany. Нуклеотид человеческого IgG1 получали от фирмы Sigma.
(ii) Получение полностью человеческих антител к IL6 IgG1
Для продуцирования человеческого IgG в клетках млекопитающих конструировали четыре экспрессируемых вектора (рА01-каппа, рА02-гамма, интермедиат p2CMV и модифицированный pcDNAFRT). Для продуцирования человеческого IgG в клетках млекопитающих конструировали ген полноразмерной легкой цепи. Ген полноразмерной легкой цепи (содержащей константную область каппа) и ген полноразмерной тяжелой цепи (содержащей константную область гамма), кодирующие предполагаемые антитела к IL6, клонировали по отдельности при помощи pcANTAB5E в рА01-каппа и рА02-гамма для тринзиторной экспрессии антитела. Эти экспрессионные векторы вводили в клетки FreeStyle™ CHO-S с использованием реагента GenJet™ (SignalGen).
Гены полноразмерной легкой цепи и полноразмерной тяжелой цепи сначала клонировали в промежуточный вектор p2CMV, а затем клонировали в модифицированный вектор pcDNAFRT для стабильной экспрессии одиночных антигенов. Вектор pcDNAFRT трансфецировали в клетки СНО с использованием реагента GenJet™ Plus и позитивные клоны отбирали с использованием гигромицина В (Invitrogen) в течение более продолжительного времени экспрессии. Культуральный супернатант собирали и очищали на колонках с MabSelect SuRe и белком A (GE Healthcare).
(iii) Связывание и конкурентный анализ
ELISA и вестерн-блоттинг (иммуноблоттинг) осуществляли с целью изучить связывающую активность человеческих IgG антител к IL6. Коротко говоря, планшеты сенсибилизировали рекомбинантным человеческим IL6 (R&D Systems) в концентрации 2 мкг/мл. После отмывки в PBS лунки блокировали посредством 1% (вес/об.) BSA в PBS в течение 1 час. при RT. Очищенные антитела к IL6 в виде серийных разведений (исходная концентрация 2 мкг/мл) помещали в лунки и инкубировали при RT в течение 1 час. Планшет отмывали в буфере PBS, содержащем 0.1% (вес/об.) Tween 20, а затем обрабатывали HRP-меченным антителом козы к человеческому IgG (KPL), разведенным 1:10,000 в 1% BSA-PBS, в течение 40 мин при RT. Планшет снова отмывали и добавляли раствор субстрата ТМВ для проявления цвета. Затем добавляли стоп-реагент (1М H2SO4) и количественно определяли поглощение при 450 нм на автоматическом фотометре для микропланшетов (Bio-Rad).
Рекомбинантный белок IL6 кипятили в 5Х восстанавливающем буфере для образцов (0.15 М Tris-HCl, рН 6.8, 50% глицерина, 10% SDS, 0.71 М 2-меркаптоэтанола, 0.095% бромфенола синего) в течение 10 мин и подвергали SDS-PAGE (Bio-Rad). Затем белки переносили на нитроцеллюлозную мембрану (Bio-Rad) и подвергали иммуноблоттингу с использованием полностью человеческих антител к IL6 по настоящему описанию. После инкубации с HRP-меченным антителом козы к кроличьему иммуноглобулину (Thermo) или HRP-меченным антителом козы к мышиному иммуноглобулину (KPL) мембраны проявляли посредством усиления хемилюминесцентной меткой (GE Healthcare).
Планшеты покрывали рецептором α для рекомбинантного человеческого IL6 (R&D Systems) в концентрации 2 мкг/мл в буфере 0.1М NaHCO3 при 4°С в течение ночи. После отмывки в буфере PBS лунки блокировали 1% (вес/об.) раствором BSA в PBS в течение 1 час при RT. Очищенные антитела к IL6 в двукратных серийных разведениях с начальной концентрацией 2 мкг/мл предварительно инкубировали с rhIL6 (0.5 мкг/мл) при RT в течение 1 час. Затем смеси помещали в планшет и инкубировали при RT в течение 1 час. Планшет отмывали в PBS, содержащем 0.1% (об./об.) Tween 20, и обрабатывали мышиным антителом IgG2a к человеческому IL-6 (Abeam) в разведении 1:2,000 в 1% BSA-PBS в течение 1 час при RT. Планшет отмывали, а затем "зондировали" HRP-меченным антителом козы к мышиному IgG (Thermo) в разведении 1:10,000 в 1% BSA- PBS в течение 40 мин при RT. Планшет снова отмывали и добавляли раствор субстрата ТМВ для проявления цвета. Затем добавляли стоп-реагент (1М H2SO4) и количественно определяли поглощение при 450 нм на автоматическом фотометре для микропланшетов,
(iv) Анализ сигнальной транедукции (внутриклеточной передачи сигнала)
Клетки U266 (1×106/мл) дважды отмывали в бессывороточной среде RPMI 1640 и культивировали 2 час в отсутствие фетальной бычьей сыворотки и факторов роста. Клетки стимулировали с помощью rhIL6 (5 нг/мл) в течение 30 мин при 37°С, а затем обрабатывали в присутствии и в отсутствие антител к IL6. Клетки отмывали в охлажденном льдом PBS, а заем лизировали в буфере RIP A (Thermo), дополненном ингибитором протеаз и фосфатаз (Roche). Вестерн-блоттинг проводили с использованием антител к pSTAT3 и STAT3 (Cell Signaling Technology). После инкубации с HRP-меченным антителом козы к кроличьему иммуноглобулину (Thermo) или с HRP-меченным антителом козы к мышиному иммуноглобулину (Thermo) мембраны проявляли за счет усиления хемилюминесцентной меткой (GE Healthcare).
(v) Анализ пролиферации клеток
Мышиные клетки В9 (5×104/мл) засевали в 96-луночные планшеты и инкубировали с rhIL6 (10 пг/мл). IL6-рецептор мьппиньгх клеток В9 можно стимулировать с помощью человеческого IL6. Антитела к IL6 в различных концентрациях или контрольные антитела к IgG помещали в лунки. Затем клетки инкубировали при 37°С в течение 72 час. Жизнеспособность клеток определяли анализом с водорастворимой солью тетразолия (WST-1) (Roche) согласно инструкции производителя. Все эксперименты проводили в трех повторностях.
(vi) Анализ на оптическом биосенсоре Biacore
IgG-связывающую аффинность количественно определяли, используя набор с антителами захвата против человеческого IgG (GE healthcare), на системе BIAcore Т200 (GE healthcare). Мышиные антитела к человеческому IgG иммобилизовали на сенсорном чипе СМ5 путем за счет связывания с аминогруппой. Примерно 700 RU очищенного IgG к IL6 в буфере HBS-EP+ улавливали на поверхности с иммобилизованным антителом. Рекомбинантный человеческий IL6 (R&D Systems) с концентрациями в интервале от 25.6 нМ до 0.4 нМ в буфере HBS-EP+ вводили в течение 2 минут при скорости потока 30 мкл/мин. Диссоциацию связанного антигена в потоке буфера HBS-EP+ продолжали в течение 7 минут. IgG на поверхности регенерировали после каждого цикла с помощью регенерирующего раствора (3М MgCl2). Константу диссоциации (KD) рассчитывали как kd/ka.
(vii) Анализ специфичности
Планшеты покрывали рекомбинантными человеческими IL3, IL4, IL5, IL6, IL11, IL17A, CNTF, OSM, IGF-1 (R&D Systems), IL2, FGF (Prospec), VEGF, TNF-α, EGF (Peprotech) с концентрацией 2 мкг/мл в буфере 0.1М NaHCO3 при 4°С в течение ночи. После отмывки в PBS поверхности лунок блокировали 1% (вес/об.) раствором BSA в PBS при RT в течение 1 час. Очищенные антитела к IL6 в четырехкратных серийных разведениях с начальной концентрацией 2 мкг/мл помещали в лунки и инкубировали при RT в течение 1 час. Планшет отмывали в PBS, содержащем 0.1% (вес/об.) Tween 20, а затем "зондировали" HRP-меченным антителом козы к человеческому IgG (KPL) в разведении 1:10,000 в 1% BSA-PBS, в течение 40 мин при RT. Планшет снова отмывали и добавляли раствор субстрата ТМВ для проявления цвета. Затем добавляли стоп-реагент (1М H2SO4) и количественно определяли поглощение при 450 нм на автоматическом ридере для микропланшетов и при использовании программы VERSA max (Molecular Devices). Результаты
(а) Активность связывания IgG антител к IL6
Для изучения специфичности и активности связывания антител к IL6 гены VH и VL, кодирующие выбранные клоны scFv, сливали с генами константных областей каппа и гамма с целью получения полноразмерных человеческих IgG1 антител, описанных в настоящем изобретении. Анализы ELISA и вестерн-блоттинг показали, что эти антитела к IL6 могли связывать человеческий рекомбинантный белок IL6 и проявляли нейтрализующую активность, зависящую от дозы.
Анализ BIAcore показал, что в среднем константы скорости ассоциации (ка) клонов Ag1-4-6 и Hag1T-3-10 повышались от 4.38×10-5 до 2.24×10-6 M-1c-1 по сравнению с начальным клоном 1-4-62. Константы скорости диссоциации (kd) повышались от 1.66×10-3 до 6×10-4 с-1. Равновесные константы диссоциации (KD) корректировались от 3.85 до 0.27 нМ. См. ниже Таблицу 2.
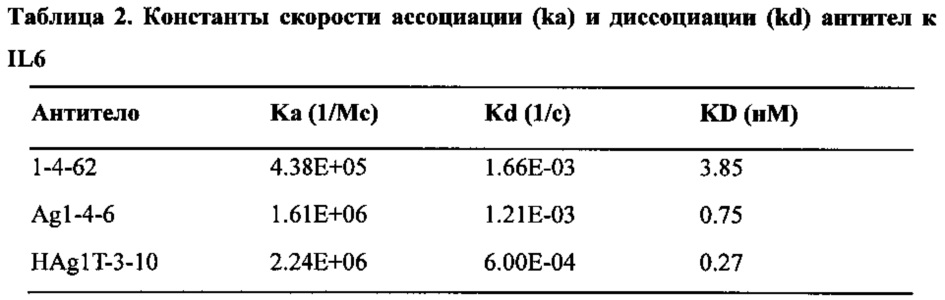
(б) Специфичность связывания антител к IL6
Анализ ELISA, описанный в настоящем изобретении, проводили с целью подтвердить специфичность связывания высокоаффинных антител к IL6 по настоящему изобретению. Коротко говоря, планшеты покрывали различными цитокинами, показанными на Фигуре 3А (цитокинами семейства IL6) и на Фигуре 3В (цитокинами семейств, отличных от семейства IL6), и исследовали активность связывания антител клона FB704 (а именно Ag1-4-6) с этими цитокинами. Антитела клона FB704 проявили высокую активность, обеспечивающую связывание с человеческим белком IL6, но не с другими цитокинами (Фигуры 3А и 3В), что указывает на их специфичность по отношению к человеческому IL6.
(с) Ингибирование IL6-зависимого сигнального пути и клеточной пролиферации антителами к IL6
Клетки U266 множественной миеломы человека использовали для изучения воздействия антител к IL6 на IL6-индуцированный сигнальный каскад. Клетки U266 культивировали в присутствии или в отсутствие антител, совместно с rhIL6. Через 30 минут лизаты целых клеток собирали и проводили вестерн-блоттинг (иммуноблоттинг) с целью изучения фосфорилированного белка STAT3 (P-STAT3), который является основным фактором транскрипции, принимающим участие в IL6 сигнальном пути. Экспрессия P-STAT3 белка подавлялась с помощью высокоаффинных антител к IL6, Ag1-4-6 и HAg1T-3-10, с уровнем, превышающем уровень препарата Актемра, гуманизированное антитело к IL6-рецептору использовали в качестве контроля (Фигуры 1А и 1В). Уровни подавления фосфорилирования STAT3 антителами показаны ниже, в Таблице 3:
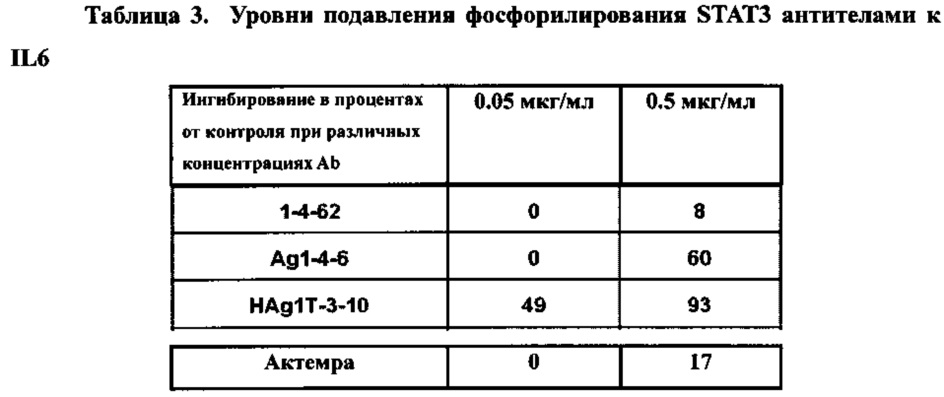
Для изучения воздействия антитела на клеточную пролиферацию клетки Независимой мышиной гибридомы В9 культивировали в присутствии антител к IL6 или к IL6R, а также в присутствии изотипического контрольного антитела, в различных концентрациях. Влияние на пролиферацию клеток оценивали с помощью анализа с WST-1 (Roche) через 72 часа. Как показано на Фигуре 1С, полностью человеческие антитела к IL6 1-4-62, Ag1-4-6 и HAg1T-3-10 ингибировали пролиферацию В9-клеток в зависимости от дозы, а значения IC50 для 1-4-62, Ag1-4-6 и HAg1T-3-10 равны 0.618, 0.0468 и 0.00456 мкг/мл, соответственно.
Пример 3: Эффективность воздействия высокоаффинных антител к IL6 при лечении рака
Материалы и методы
(i) Животные
Для всех экспериментов самцов мышей NOD/SCID (в возрасте 7-8 недель) получали от BioLASCO Taiwan Co., Ltd (Taipei, Taiwan). Перед началом эксперимента мышей выдерживали в стерильных клетках с индивидуальной вентиляцией (IVC) при 20°С и акклиматизировали в условиях проживания по меньшей мере в течение 7.
(ii) Анализ ангиогенеза на модели с имплантом матригеля
Жидкий матригель (BD Biosciences) выдерживали при 4°С. Рекомбинантный белок hIL6 (R&D Systems) добавляли к матригелю до конечной концентрации 100 нг/0.5 мл. Мышей анестезировали авертином (0.2 мл/10 г, для i.p. (и.п.) инъекции) и вводили в двух местах в область спины с 0.5 мл матригеля. Затем мышам вводили внутривенно IgG антитела против IL6 или контрольное IgG антитело. На 6 день мышей умерщвляли с помощью СО2. "Пробки" (импланты) матригеля удаляли, взвешивали и фотографировали. Для определения уровней гемоглобина пробки матригеля лизировали в буфере для лизиса (1% SDS, 0.5% Triton в PBS) в течение ночи при 4°С. Содержание гемоглобина в пробках количественно определяли, используя реагент Драбкина (Sigma). Концентрацию гемоглобина в матригеле определяли по стандартной кривой бычьего гемоглобина (Sigma). Содержание гемоглобина указано в микрограммах гемоглобина на грамм матригеля. Среднее + SD (стандартное отклонение) рассчитывали с использованием непарного t критерия Стьюдента; статистически значимым полагали р<0.05.
(iii) Анализ метастазирования опухоли из клеток РС3 аденокарциномы простаты на модели с внутриселезеночной имплантацией
Мышей анестезировали авертином (0.2 мл/ 10 г) и брили левый бок. Затем мышей клали в положение "лежа на правом боку" и протирали левый бок 75% спиртом. В коже брюшной стенки делали продольный разрез (параллельно позвоночнику) длиной 1 см. Селезенку выводили на поверхность и осторожно стабилизировали. Иглу 30G (инсулиновый шприц) вводили в паренхиму селезенки на 3-4 мм. Медленно вводили 50 мкл суспензии клеток РС-3. Видимая слабая реакция является показателем успешной инъекции. Затем иглу извлекали и на 30 секунд прикладывали небольшой ватный тампон, закрывающий место инъекции, для предупреждения кровотечения и вытекания клеточной суспензии. Селезенку возвращали в брюшную полость. Брюшную стенку зашивали нейлоновой нитью 6-0, а кожу зашивали нейлоновой нитью 4-0.
После имплантации мышей произвольно относили к различным экспериментальным группам (группе, получавшей доцетаксел, группе, получавшей доцетаксел плюс антитело к IL6, и к контрольной группе, получавшей PBS) и многократно вводили дозы антитела к IL6 (в каждом случае дозу 20 мг/кг, дважды в неделю), доцетаксела (в каждом случае 3 мг/кг, раз в неделю) инъекцией в хвостовую вену или интраперитонеальной (i.p) инъекцией. Массу тела этих мышей измеряли дважды в неделю.
Затем всех мышей умерщвляли с помощью СО2 и определяли массу тела. Первичные опухоли в селезенке и печени удаляли хирургическим путем, фотографировали и взвешивали. Индекс органа выражали в миллиграммах (массы) органа на грамм (массы) мыши. Показатель Среднее + SD рассчитывали с использованием t критерия Стьюдента. Для оценки выживаемости использовали анализ Каплана-Майера. Готовили заключенные в парафин или замороженные срезы опухолевой массы и окрашивали антителами к CD31 и Ki-67 плюс краситель гематоксилин для анализа.
(iv) Модель ксенотрансплантата опухоли поджелудочной железы человека
Клетки опухоли поджелудочной железы человека ВхРС-3 и MiaPaCa ресуспендировали в PBS и вводили подкожно (s.c.) (5×106 клеток, общий объем 0.15 мл) мышам в правый бок. Через 10 дней мышей произвольно относили к различным экспериментальным группам (группам, получавшим антитело FB704, оксалиплатин, FB704 плюс оксалиплатин, гемцитабин, и группе, получавшей PBS) и вводили многократно дозы FB704 (в каждом случае 20 мг/кг, дважды в неделю) или оксалиплатина (в каждом случае 3 мг/кг, раз в неделю) или гемцитабина (в каждом случае 80 мг/кг, дважды в неделю) инъекцией в хвостовую вену или интраперитонеальной (i.p.) инъекцией. Дважды в неделю определяли массу тела и размеры опухоли. Размеры опухоли определяли калипером, а объем опухоли рассчитывали как произведение длина × ширина2 × 0.52. После эксперимента всех мышей умерщвляли, отбирали образцы крови и опухолевые массы извлекали и взвешивали. Стандартное отклонение от среднего объема массы и объема опухоли рассчитывали, используя t критерий Стьюдента. Готовили заключенные в парафин или замороженные срезы опухолевой массы и окрашивали антителами к CD31, Ki67 или TUNEL плюс красители Н&Е для анализа.
Результаты
(i) FB704 ингибирует in vivo ангиогенез в матригель-анализе
Антиангиогенную способность клона антител FB704 изучали на in vivo модели с имплантом матригеля, описанной в настоящем изобретении. Через шесть дней после обработки мышей умерщвляли и определяли концентрацию гемоглобина. В группах, пролеченных с помощью FB704 (Фигура 4А), окраска и плотность кровеносных сосудов в извлеченных имплантах матригеля заметно отличались, что указывает на антиангиогенную активность антитела. Лечение с помощью FB704 также значительно снижало концентрацию гемоглобина по сравнению с hIL6 (Фигура 4В).
(ii) FB704 ингибирует кахексию и метастазирование, индуцируемые клетками рака простаты (предстательной железы) человека РС-3
Для подтверждения эффективности воздействия FB704 на вызываемые раком кахексию и метастазирование мышам имплантировали раковые клетки РС-3, клетки рака предстательной железы человека (1.0×106 на мышь), вводя их с помощью внутриселезеночной инъекции. В 1 день мышей произвольно делили на 4 группы (n=12-15). Высокую (20 мг/кг) и низкую (5 мг/кг) дозу FB704, позитивный контроль актемру (20 мг/кг) и PBS вводили с помощью i.v. (внутривенной) инъекции дважды в неделю. На 31 день после имплантации клеток РС-3 общая масса тела у мышей, получавших PBS, снижалась, примерно, на 19%. Напротив, общая масса тела у мышей, получавших высокую дозу FB704 и актемру, оставалась постоянной, что резко отличало этих мышей от контрольных групп (Фигура 5А; Р<0.01).
Кроме того, после латентного (инкубационного) периода у мышей, несущих опухоль РС3, развился паралич левой задней лапы или появились другие симптомы диссеминированного распространения опухоли. Многократные внутрисосудистые инъекции FB704 (Р=0.0001) и актемры (Р=0.024) значительно продлевали период бессимптомного дожития РС3-опухоленесущих мышей, при этом антитело FB704 проявляло значительно более высокую эффективность, чем актемра (Р=0.03) (Фигура 5 В). Полная аутопсия мышей из группы, получавшей PBS, показала значительный рост и инфильтрацию печени опухолевыми клетками. Напротив, у мышей в группе, получавшей FB704, наблюдалась умеренная инфильтрация, и в левой и средней долях печени было более 50% нормальных гепатоцитов (Фигура 5С).
Ангиогенез также играет важную роль в процессе метастазирования опухоли. Для проверки плотности кровеносных сосудов проводили иммуногистохимическое исследование на срезах опухоли. Окрашивание на белок CD31 (маркер ангиогенеза) показало, что ангиогенез в группе, получавшей FB704, был значительно понижен по сравнению с контрольной группой, получавшей PBS (Фигуры 5D и 5Е).
Кроме того, комбинированное лечение с помощью FB704 и химиотерапевтического препарата доцетаксел обеспечивало более высокий общий коэффициент выживаемости (Фигура 5F).
(iii) FB704 повышает противоопухолевую активность оксалиплатина или гемцитабина на модели ксенотрансплантата рака поджелудочной железы
FB704 повышал противоопухолевую активность оксалиплатина или гемцитабина на модели рака поджелудочной железы человека. Введение ВхРС-3 опухоленесущим мышам 20 мг/кг FB704 дважды в неделю плюс оксалиплатин (3 мг/кг) раз в неделю или гемцитабин (80 мг/кг) дважды в неделю дало в результате статистически значимое ингибирование роста опухоли на 49% и 60%, соответственно (Р<0.01) (Фигуры 6А и 6G). Масса тела мышей, как правило, повышалась (Фигура 6В). Вес опухолевой массы после лечения был значительно снижен (Фигуры 6С и 6D).
Для изучения пролиферации опухолевых клеток в каждой группе использовали антитело, специфическое к белку Ki-67, который является маркером клеточной пролиферации. Процентное содержание Ki-67-позитивных клеток в группах, получавших PBS, оксалиплатин, FB704 и FB704 плюс оксалиплатин, составляло 26%, 14%, 16% и 7.5%, соответственно (Фигуры 6Е и 6F), это показывает, что комбинированное введение FB704 и оксалиплатина или гемцитабина обеспечивает более высокую степень ингибирования пролиферации раковых клеток поджелудочной железы in vivo.
На модели панкреатического рака было также показано, что введение FB704 вместе с гемцитабином вызывает синергический эффект. Введение ВхРС-3 опухоленесущим мышам 20 мг/кг FB704 и 80 мг/кг гемцитабина дважды в неделю дало в результате статистически значимое ингибирование (подавление) роста опухоли (Р<0.01) (Фигура 6G).
Пример 4: Эффективность действия высокоаффинных антител к IL6 при лечении ревматоидного артрита
У больного RA в суставах наблюдаются повышенные уровни продуцирования хемокина, например, МСР-1, что говорит об участии этого хемокина в патогенезе RA. Адгезионная молекула sICAM-1 также играет важную роль в инфильтрации пораженной ткани воспалительными клетками. Клетки HUVEC в норме экспрессировали sICAM-1 на клеточной поверхности. Введение IL6 плюс sIL6R индуцировало экспрессию sICAM-1.
(i) Антитела к IL6 ингибировали продуцирование МСР-1 и sICAM-1 в клетках HUVEC
С целью изучения эффективности действия антител к IL6, описанных в настоящем изобретении, при лечении ревматоидного артрита (RA) после обработки антителом количественно определяли секрецию моноцитарного хемотаксического белка-1 (МСР-1) и sICAM-1 эндотелиальными клетками пупочной вены человека (HUVECs), как показано ниже. Клетки HUVEC засевали в 48-луночный планшет при плотности 2×105 клеток/мл. Клетки обрабатывали с помощью комбинации рекомбинантного человеческого IL6, IL6 рецептора-α (R&D systems) в присутствии или в отсутствие антител к IL6 при различных концентрациях контрольного антитела IgG при 37°С в течение 24 час. Бесклеточные культуральные супернатанты собирали и анализировали на МСР-1 и sICAM-1 методом ELISA (RayBiotech)
Этот in vitro анализ показал, что IL6 плюс sIL6Ra индуцировали экспрессию МСР-1 и sICAM-1 в клетках HUVECs. Антитела Ag1-4-6 и HAg1T-3-10 подавляли индуцируемую IL6 плюс sIL6Ra экспрессию МСР-1 (Фигура 2А) и sICAM-1 (Фигура 2В) в зависимости от дозы. Эффективность подавления экспрессии была выше, чем у препарата актемра.
(ii) Антитела к IL6 ингибировали продуцирование МСР-1 как в клетках U937, так и в мононуклеарных клетках периферической крови человека (РВМС)
МСР-1 представляет собой небольшой цитокин, относящийся к семейству СС хемокинов, который рекрутирует моноциты, Т клетки памяти и дендритные клетки в очаг воспаления. Известно, что среди иммунных клеток моноцитарные клетки являются основными клетками, продуцирующими МСР-1. МСР-1 играет главную роль в развитии воспаления и артрита. Кроме того, было показано, что IL6 индуцирует МСР-1 в человеческих моноцитах. Поэтому проводилось испытание антител к IL6, описанных в настоящем изобретении, на их эффективность при подавлении экспрессии МСР-1 в клетках линии U937 промоноцитарных клеток, стимулированных с помощью IL6.
Клетки U937 (2×106 клеток/ лунка) культивировали с IL6 (100 нг/мл) в течение 24 час в культуральных 48-луночных плоскодонных планшетах (Corning, Corning, NY) на среде RPMI1640 в присутствии антител к IL6 в различных концентрациях. Уровни МСР-1 в супернатантах определяли с использованием наборов МСР-1 ELISA kits (е Bioscience). Все in vitro эксперименты проводили в трех повторностях.
Продуцирование МСР-1 в клетках U937 наблюдали после IL6-стимуляции и в зависимости от дозы, а антитела к IL6 ингибировали продуцирование МСР-1 в клетках U937, индуцированное посредством IL6 (Фигура 7А).
Далее из крови пяти здоровых доноров выделяли PBMCs. Клетки (5×105 клеток /250 мкл /лунка) выращивали с IL6 (100 нг/мл) в течение 24 час в 96-луночных культуральных планшетах с U-образным дном (Corning, Corning, NY) на среде RPMI1640 в присутствии антител к IL6 в различных концентрациях. Уровни МСР-1 в супернатантах определяли с использованием наборов МСР-1 ELISA kits (е Bioscience).
После стимуляции посредством IL6 наблюдали продуцирование МСР-1 в клетках РВМС. Присутствие антител Ag1-4-6 и HAg1T-3-10 ингибировало продуцирование МСР-1 в зависимости от дозы, тогда как в присутствии контрольного антитела изотипа IgG1 этот ингибирующий эффект не наблюдался (Фигура 7В).
(iii) Антитела к IL6 ингибировали продуцирование МСР-1 и VEGF в синовиальных фибробластах больных ревматоидным артритом
Свежие синовиальные ткани измельчали и расщепляли в растворе коллагеназы и ДНКазы. Выделенные фибробласты фильтровали через нейлоновые фильтры с диаметром мембраны 70 мм. Клетки выращивали в культуральных пластиковых плашках в атмосфере 95% воздух/5% CO2 на среде RPMI 1640 (Life Technologies), дополненной 20 мМ HEPES и 10% термоинактивированной FBS, 2 мМ глутамина, 100 ЕД/мл пенициллина и 100 мг/мл стрептомицина (рН доводили до 7.6). Более 95% клеток представляли собой фибробласты, как показано с помощью иммунофлуоресцентного окрашивания с использованием антитела, специфического к маркерному белку фибробластов виментину. В экспериментах использовали фибробласты, полученные в результате четырех-девяти пассажей.
Фибробластоподобные синовиоциты пяти больных RA, описанные выше (клетки RA-FLS), культивировали в культуральных 6-луночных плоскодонных планшетах (Corning, Corning, NY; 2×105 клеток/ 2 мл/лунка) в течение 2 дней и стимулировали с использованием как IL6, так и sIL6R. В лунки добавляли антитела в различных концентрациях и планшеты инкубировали с клетками в течение 24 час. Затем определяли уровни МСР-1 с использованием наборов МСР-1 ELISA kits (е Bioscience).
Клетки RA-FLS в норме экспрессируют низкие уровни МСР-1, а предварительная обработка с помощью IL6 и sIL6R могла бы стимулировать продуцирование высоких уровней МСР-1. Антитела к IL6, описанные в настоящем изобретении, показали заметное ингибирование продуцирования МСР-1 в коммерчески доступных клетках RA-FLS (Фигура 8А) и в клетках RA-FLS, полученных от больных RA, описанных выше (Фигура 8В).
Сосудистый эндотелиальный фактор роста (VEGF) играет важную роль в патогенезе RA. Уровни VEGF значительно выше в синовиальной жидкости больных RA. Он также вызывает проницаемость сосудов и опосредует воспаление. Для изучения действия антител к IL6 на продуцирование VEGF в клетках RA-FLS эти клетки обрабатывали антителами к IL6, описанными в настоящем изобретении, в присутствии IL6 (100 нг/мл), sIL6R (100 нг/мл) и IL1β (5 нг/мл), как описано ниже.
Клетки RA-FLS (2×104 клеток/500 мкл/лунка) выращивали в культуральных 48-луночных плоскодонных планшетах (Corning, Corning, NY) в течение 24 часов, а затем стимулировали с использованием как IL6, так и sIL6R и IL-1β. В лунки добавляли антитела в различных концентрациях и инкубировали с клетками в течение 48 часов. Супернатанты собирали и определяли уровни VEGF, используя набор Human VEGF ELISA kit (PreproTech).
Уровни VEGF в супернатантах культур клеток RA-FLS, стимулированных с использованием комбинации IL6, IL6R и IL1β, были в 3-5 раз выше уровней VEGF в супернатантах клеток, не стимулированных цитокинами. Антитела к IL6 значительно снижали уровень продуцирования VEGF как в коммерчески доступных клетках RA-FLS (Фигура 9А), так и в клетках RA-FLS, полученных от больных RA, описанных в настоящем изобретении (Фигура 9В).
ДРУГИЕ ВАРИАНТЫ ИЗОБРЕТЕНИЯ
Все признаки, раскрываемые в данном описании, можно объединять в любых комбинациях. Каждый признак, раскрываемый в данном описании, можно заменить на альтернативный признак, который служит для той же самой, эквивалентной или сходной цели. Таким образом, если специально не указано иное, каждый раскрываемый признак представляет собой лишь пример родовой группы эквивалентных или сходных признаков.
На основании вышеприведенного описания специалист в данной области может легко выявить существенные характеристики настоящего изобретения и, не отступая от его сущности и объема, сможет сделать различные изменения и модификации изобретения, чтобы адаптировать его к различным применениям и условиям. Соответственно, другие варианты также входят в формулу изобретения.