Результат интеллектуальной деятельности: Тетранитратоборат нитрония и способ его получения
Вид РИД
Изобретение
Предлагаемое изобретение относится к области неорганической химии, а именно, к химии бор-неорганических соединений, конкретно к новому, не описанному в литературе, тетранитратоборату нитрония формулы:
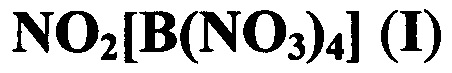
и к способу его получения. Соединение формулы I может найти применение в качестве окислителя в ракетных топливах.
В литературе описано получение для данной цели соли нитрония - тетраперхлоратобората нитрония [С. Сарнер. Химия ракетных топлив. М.: Мир, 1969; Th. Chausse, J.-L. Pascal, A. Potier, J. Potier, Les chloro (perchlorate) bore: BCl2ClO4, BCl(ClO4)2. Le tris (perchlorate) bore: В(ClO4)3. Et les tetrakis (perchlorate) borates d’ammonium et de nitryle: NH4B(ClO4)4 et NO2B(ClO4)4. Synthese, analyse structurale par spectroscopie de vibration et Raman, Nouveau J. Chem., 1981, 5 (4), 261-269] формулы:
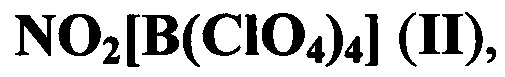
получаемого из перхлората нитрония и BCl3.
Известно комплексное соединение формулы 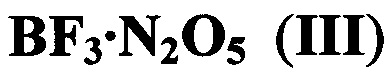 , имеющее, по-видимому, структуру NO2[BF3(NO3)], которое было получено реакцией BF3 с азотным ангидридом [G.В. Bachman, J.L. Dever, The BF3⋅N2O5 Complex. Its Use as a Nitrating Agent, J. Am. Chem. Soc., 1958, 5871-5873].
, имеющее, по-видимому, структуру NO2[BF3(NO3)], которое было получено реакцией BF3 с азотным ангидридом [G.В. Bachman, J.L. Dever, The BF3⋅N2O5 Complex. Its Use as a Nitrating Agent, J. Am. Chem. Soc., 1958, 5871-5873].
Также известны комплексные аммонийные соединения, содержащие тринитрат бора, общей формулы
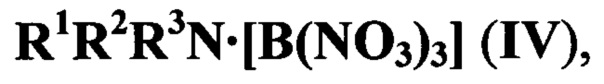
где R1R2R3N - третичный амин, например 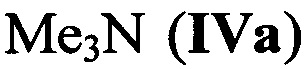 , [О.П. Шитов, Т.Н. Головина, А.В. Калинин. Комплексы тринитратоборана с третичными аминами. Изв. АН СССР. Сер. Хим., 1979, 1883-1884]. Получение соединений IV осуществляли тремя различными способами: реакцией комплекса BBr3⋅амин с N2O4, взаимодействием BBr3 с AgNO3 с последующим добавлением амина и обработкой комплексов BBr3 (или BCl3) с основаниями нитратом серебра.
, [О.П. Шитов, Т.Н. Головина, А.В. Калинин. Комплексы тринитратоборана с третичными аминами. Изв. АН СССР. Сер. Хим., 1979, 1883-1884]. Получение соединений IV осуществляли тремя различными способами: реакцией комплекса BBr3⋅амин с N2O4, взаимодействием BBr3 с AgNO3 с последующим добавлением амина и обработкой комплексов BBr3 (или BCl3) с основаниями нитратом серебра.
В литературе также описаны соединения, содержащие тетранитатратоборат-анион, общей формулы:  , где М=Me4N (Va), Et4N, Bu4N, Rb, Cs. Тетранитратобораты щелочных металлов были получены взаимодействием соответствующих тетрахлоридов бора М[BCl4] с N2O4 [К.В. Титова, В.Я. Росоловский. Нитратобораты рубидия и цезия. Ж. Неорг. Хим., 1971, 16 (5), 1450-1451]. Исследования реакций BCl3 с неорганическими нитратами MNO3 (М=Me4N, Et4N, Bu4N, К, Rb, Cs) показали, что взаимодействие протекает до конца, т.е. с образованием индивидуального тетранитратобората (V), только с нитратами тетраметил- и тетрабутиламмония [К.В. Титова, Введение анионов ClO4-, NO3-, C(NO2)3- в координационную сферу бора прямым взаимодействием солей с галогенидами бора, Ж. Неорг. Хим., 2002, 47 (8), 1236-1245]. В остальных случаях была получена трудноразделимая смесь соединений. Наиболее близким по структуре к соединению I является тетраметиламмониевая соль (Va), получаемая также реакцией Me4N[BCl4] с N2O4 [С.R. Guibert, М.D. Marshall, Synthesis of the Tetranitratoborate Anion, J. Amer. Chem. Soc, 1966, 88, 189-190; К. В. Титова, В.Я. Росоловский. Нитратобораты тетраалкиламмония. Изв. АН СССР. Сер. Хим., 1970, 2670-2675].
, где М=Me4N (Va), Et4N, Bu4N, Rb, Cs. Тетранитратобораты щелочных металлов были получены взаимодействием соответствующих тетрахлоридов бора М[BCl4] с N2O4 [К.В. Титова, В.Я. Росоловский. Нитратобораты рубидия и цезия. Ж. Неорг. Хим., 1971, 16 (5), 1450-1451]. Исследования реакций BCl3 с неорганическими нитратами MNO3 (М=Me4N, Et4N, Bu4N, К, Rb, Cs) показали, что взаимодействие протекает до конца, т.е. с образованием индивидуального тетранитратобората (V), только с нитратами тетраметил- и тетрабутиламмония [К.В. Титова, Введение анионов ClO4-, NO3-, C(NO2)3- в координационную сферу бора прямым взаимодействием солей с галогенидами бора, Ж. Неорг. Хим., 2002, 47 (8), 1236-1245]. В остальных случаях была получена трудноразделимая смесь соединений. Наиболее близким по структуре к соединению I является тетраметиламмониевая соль (Va), получаемая также реакцией Me4N[BCl4] с N2O4 [С.R. Guibert, М.D. Marshall, Synthesis of the Tetranitratoborate Anion, J. Amer. Chem. Soc, 1966, 88, 189-190; К. В. Титова, В.Я. Росоловский. Нитратобораты тетраалкиламмония. Изв. АН СССР. Сер. Хим., 1970, 2670-2675].
Согласно литературным данным [С. Сарнер. Химия ракетных топлив. М.: Мир, 1969] термическая стабильность комплексного перхлората нитрония (II) относительно невысокая. Из-за значительного количества хлора в составе соединения II при сгорании топлива с его участием будет происходить образование газообразного хлороводорода, что экологически вредно. Кроме того, галогенсодержащая струя газов на выходе из сопла резко повышает вероятность обнаружения ракеты средствами противоракетной обороны. Схожие недостатки имеет соединение III, кроме того, оно имеет худший, чем соединение II, кислородный баланс (данные представлены в таблице). Описанные тетранитратобораты солей алкиламмония (V) характеризуются умеренной термической стабильностью (для соединения Va см. таблицу). Тогда как разложение солей рубидия и цезия наблюдается при комнатной температуре (20°С), а наличие катионов щелочных металлов к тому же является балластом, который не участвует в сгорании топливной смеси. Однако алкиламмонийные тетранитратобораты непригодны в качестве окислителей ракетных топлив, поскольку имеют отрицательный кислородный баланс (например, соединение  , см. таблицу). Еще более неудовлетворительный кислородный баланс структур общей формулы
, см. таблицу). Еще более неудовлетворительный кислородный баланс структур общей формулы 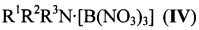 также не позволяет рассматривать их в качестве потенциальных окислителей, расчетные данные для соединения
также не позволяет рассматривать их в качестве потенциальных окислителей, расчетные данные для соединения  представлены в таблице.
представлены в таблице.
Технической задачей предлагаемого изобретения является создание нового окислителя, стабильного при обычных условиях, при этом характеризующегося высоким содержанием кислорода и отсутствием в его составе галогенов, и разработка способа его получения.
Поставленная техническая задача достигается новым, не описанным в литературе, тетранитратоборатом нитрония формулы:

и способом его получения.
Предлагаемое соединение формулы I отличается от известных тетранитратоборатов (V) наличием в одной молекуле как тетранитратоборатаниона, так и катиона нитрония. Данное обстоятельство превращает структуру соединения в симметричную, что за счет резонанса и возможной мультидентатности перераспределяет электронную плотность по всей молекуле и придает ей относительную термическую стабильность. Способ получения предлагаемого тетранитратобората нитрония (I) заключается во взаимодействии борной кислоты с N2O5 при температуре от -10 до 5°C и мольном соотношении борная кислота : N2O5 1:4-6. Процесс протекает по следующей схеме:
В(ОН)3+4N2O5→NO2[B(NO3)4]+3HNO3
Предлагаемое соотношение борная кислота : N2O5 1:4-6 является оптимальным, так как при меньшем соотношении компонентов не достигается получение соединения I, а увеличение избытка азотного ангидрида (N2O5) экономически нецелесообразно.
Для удобства получения соединения I и снижения количества примесей можно использовать добавки азотной кислоты (HNO3) и/или инертного растворителя, например, хлористого метилена (CH2Cl2). Азотная кислота не только выполняет функцию растворителя, но и служит ионизующим агентом, способствующим преобразованию ковалентной формы азотного ангидрида (N2O5) в ионную NO2+[NO3]-, что облегчает проведение реакции.
Получение соединения I возможно и в отсутствие растворителей, однако из-за ухудшения перемешивания возрастает доля побочных соединений типа BO(ONO2) и содержание бора в продукте синтеза увеличивается (пример 3). Указанный диапазон температур является наиболее оптимальным. Проведение синтеза при температурах ниже -10°C сильно замедляет процесс, а при более высокой температуре увеличивается содержание побочных соединений. Так при выполнении синтеза при 20°C доля BO(ONO2) возрастает до 25% (пример 4).
Свойства предложенного соединения формулы I в сравнении с другими соединениями аналогичного назначения приведены в таблице.
Техническим результатом настоящего изобретения является создание и разработка способа получения нового соединения - тетранитратобората нитрония (I), которое значительно превосходит по кислородному балансу такой штатный окислитель, как аммониевую соль динитразовой кислоты (ADN). Соединение формулы I не содержит в своей структуре галогены и имеет более высокую термическую стабильность, чем тетранитратобораты щелочных металлов и аммонийных соединений.
Благодаря сочетанию лучшего кислородного баланса и приемлемой термической стабильности соединение формулы I может найти применение для создания композиционных твердых ракетных топлив (ТРТ) и в качестве компонента жидких ракетных топлив, например, в виде раствора в нитрометане.
Таблица. Характеристики тетранитратобората нитрония (I) в сравнении с "родственными" окислителями на основе бора и со штатным окислителем (аммониевой солью динитразовой кислоты, ADN)

Примечания
Условные обозначения: КБ - кислородный баланс, A - коэффициент избытка окислителя, Tdec - температура начала интенсивного разложения по методу DSC.
Список литературы:
1 Точные данные в литературе отсутствуют.
2 Сведения получены из литературы [О.П. Шитов, Т.Н. Головина, А.В. Калинин, Комплексы тринитратоборана с третичными аминами, Изв. АН СССР. Сер. Хим., 1979, 1883-1884].
3 Данные взяты из литературы [К.В. Титова, В.Я. Росоловский, Нитратобораты тетраалкиламмония, Изв. АН СССР. Сер. Хим., 1970, 2670-2675].
4 Данные взяты из литературы [О.А. Лукьянов, В.А. Тартаковский, Химия динитрамида и его солей. Росс. Хим. Ж., 1997, 41, 5-13].
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1
При температуре от -10 до 5°С (например, при охлаждении льдом или льдом с солью) смешали кристаллический N2O5 (1.64 г, 15.2 ммоля), борную кислоту (0.19 г, 3.0 ммолей), HNO3 (0.1 г, 1.5 ммолей) и 2 мл CH2Cl2 и перемешивали при охлаждении льдом в течение 4 часов. По окончании синтеза отфильтровали осадок, после чего его промыли 5 мл CH2Cl2. Получили 0.74 г (80%) бесцветного кристаллического соединения I.
Найдено, %: В, 3.95. B1N5O14. Вычислено, %: В, 3.55.
ИК спектр, ν, см-1: 3748 (комб. NO2+), 2387, 2373, 2358 (асимм. NO2+); 1609, 1308 (ONO2). КР спектр, ν, см-1: 1652, 1619, 1613, 1599, 1326 (ONO2); 1400 (симм. NO2+). Спектр 14N ЯМР (CD3CN, δ, м.д., 36.14 МГц): -44 (Δν1/2=35 Гц, 4 ONO2); -100 (Δν1/2=155 Гц, NO2+). Спектр 11В ЯМР (CD3CN, δ, м.д., 96.29 МГц): 1.94.
Пример 2
При температуре от -10 до 5°C смешали N2O5 (4.12 г, 38.2 ммоля), борную кислоту (0.47 г, 7.64 ммолей) и HNO3 (0.24 г, 3.86 ммолей) и перемешивали при охлаждении льдом в течение 4 часов. По мере протекания реакции масса меняла консистенцию и вначале становилась более жидкой, затем происходило образование суспензии. По окончании синтеза к смеси добавили CH2Cl2 (3 мл), перемешали, затем для отделения избыточной HNO3 растворитель декантировали. В реакционную массу снова добавили CH2Cl2 (3 мл) и отфильтровали осадок, после чего его 3 раза промыли CH2Cl2 порциями по 2 мл. Получили 2.06 г (88%) бесцветного кристаллического соединения (I). Найдено, %: В, 3.79.
Пример 3
При охлаждении льдом смешали кристаллический N2O5 (1.470 г, 13.6 ммолей) и борную кислоту (0.208 г, 3.4 ммоля), смесь перемешивали при охлаждении льдом в течение 6 часов. По окончании синтеза к реакционной массе добавили CH2Cl2 (2 мл), перемешали, отфильтровали, после чего процедуру повторили и затем осадок промыли 2 мл холодного CH2Cl2. Получили 0.638 г (62%) соединения I. Найдено, %: В, 5.20.
Пример 4
При охлаждении льдом смешали кристаллический N2O5 (1.772 г, 16.4 ммоля), борную кислоту (0.169 г, 2.7 ммоля) и HNO3 (0.086 г, 1.4 ммолей), суспензию перемешивали при охлаждении льдом в течение 0.5 часов. Последующее перемешивание реакционной массы проводили при температуре 20°C в течение 1 ч. Дальнейшая обработка аналогична примеру 2. Получили 0.611 г (73%) соединения I. Найдено, %: В, 5.01.

