Результат интеллектуальной деятельности: АНТИТЕЛО ПРОТИВ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА
Вид РИД
Изобретение
Область техники, к которому относится изобретение
Настоящее изобретение относится к новому антителу против рецептора эпидермального фактора роста (EGFR) или его функциональному фрагменту и их применению. В частности, настоящее изобретение относится к полностью человеческому антителу против EGFR или его функциональному фрагменту. Настоящее изобретение также относится к способу получения указанных антител и использованию указанного антитела при изготовлении лекарственного средства для лечения опухолей.
Предшествующий уровень техники
Антитела используются при лечении злокачественных новообразований и иммунологических или сосудистых заболеваний. Конъюгаты антитело - лекарственное средство позволяют осуществить направленную доставку лекарственной части к опухоли или другой пораженной ткани, а системное введение неконъюгированных фармацевтических агентов может привести к невыносимым уровням токсичности в отношении нормальных клеток.
Основной единицей природных антител является мономер, который состоит из двух идентичных тяжелых цепей и двух идентичных легких цепей, соединенных дисульфидной связью. Есть, по меньшей мере, пять различных типов тяжелых цепей, т.е. γ, α, δ, μ и ε, которые обеспечивают различные эффекторные функции. Тяжелые цепи γ, α и δ имеют три константных домена (CH1, СН2 и СН3), тяжелые цепи μ и ε имеют четыре константных домена (CH1, СН2, СН3 и СН4). Каждая тяжелая цепь также имеет вариабельный домен (VH). Существуют, по меньшей мере, два типа легкой цепи, т.е. λ и κ, при этом каждая легкая цепь содержит константный домен (CL) и вариабельный домен (VL).
В соответствии с аминокислотной последовательностью константного домена тяжелой цепи нативное человеческое антитело может быть классифицировано на пять категорий: IgG, IgA, IgM, IgD и IgE. Некоторые категории этих категорий можно дополнительно разделить на подклассы или изотипы, такие как IgG1, IgG2, IgG3, IgG4, IgA или IgA2. Типичная молекула IgG состоит из двух тяжелых цепей и двух одинаковых легких цепей (λ или κ). Дисульфидные связи связывают легкую цепь и тяжелую цепь и тяжелые цепи друг с другом. Константный домен легкой цепи спаривается с первым константным доменом тяжелой цепи, вариабельный домен легкой цепи (VL) спаривается с вариабельным доменом тяжелой цепи (VH), таким образом, образует сайт распознавания антигена (агретоп).
Изменчивость вариабельных доменов (VL или VH) не равномерна по всему домену, и, как правило, сконцентрирована в трех сегментах, называемых гипервариабельные участки. Более консервативные части вариабельных доменов называются каркасными областями (FR). Каждый вариабельный домен природных тяжелой и легкой цепей содержит четыре FR, FR в основном образуют β-листовые структуры, связанные с тремя гипервариабельными участками, которые формируют соединительную β-листовую структуру, а в некоторых случаях образуют часть кольца β-листовой структуры. Гипервариабельные участки в каждой цепи находятся близко друг к другу и связаны через FR и образуют антигенсвязывающий участок антитела вместе с гипервариабельными участками в другой цепи. См. Kabat et al., SEQUENCES OF PROTEINS OF IMMUNOLOGICAL INTEREST, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991).
Рецептор эпидермального фактора роста (EGFR, HER1, C-ErbB1) является трансмембранным гликопротеином, состоящим из 1186 аминокислотных остатков, с молекулярной массой 170 кДа. EGFR состоит из трех частей: внеклеточной области, трансмембранной области и внутриклеточной области (Jorissen RN, Walker F, Pouliot N, et al., Epidermal growth factor receptor: mechanisms of activation and signaling. Exp Cell Res, 2003; 284: 31-53). EGFR принадлежит к подсемейству тирозинкиназных рецепторов типа I (ErbB 1-4) и обладает активностью тирозинкиназы. EGFR стабильно экспрессируется во многих эпителиальных, мезенхимальных и нейрогенных тканях. EGFR также экспрессируется на высоком уровне в солидных опухолях в различных органах, таких как рак головы и шеи, рак яичников, рака шейки матки, рака мочевого пузыря, рака пищевода и т.п. (Mendelsohn J, Baselga J. Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer. J Clin Oncol, 2003; 21: 2787-2799). Факторы роста, такие как трансформирующий фактор роста альфа (TGFα) и эпидермальный фактор роста (EGF) являются лигандами EGFR. Сочетание этих лигандов с EGFR приводит к димеризации EGFR, что активирует внутриклеточную протеин-тирозинкиназную активность рецептора, С-концевое фосфорилирование специфических остатков тирозина, обеспечивающее участки связывания для внутриклеточного фактора передачи сигнала, посредством чего инициируется множественные пути передачи сигналов, такие как Shc, Grb2, Ras/МАРК, PI 3K и JAK/STAT (Mendelsohn J, Baselga J. Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer. J Clin Oncol, 2003; 21: 2787-2799; and Olayioye MA, Neve RM, Lane HA, et al. The EerbB Signaling network: receptor heterodimerzat ion in development and cancer. The EMBO J, 2000; 19: 3159-3167). EGFR регулирует рост и дифференцировку нормальных клеток, повышает инвазивность опухолевых клеток, стимулирует ангиогенез, ингибирует апоптоз опухолевых клеток, опосредованно воздействуя на эти пути (Castillo L, Etienne-Grimaldi МС, Fischel JL, et al. Pharmacological background of EGFR targeting Ann Oncol, 2004; 15: 1007-1012). Из-за особенностей EGFR, таких как высокая экспрессия в опухолях, и важной роли в росте опухолевых клеток и дифференцировке, EGFR стал перспективным объектом для диагностики и лечения злокачественных новообразований.
В последние годы растет объем доказательств, подтверждающих, что рецептор эпидермального фактора роста (EGFR) имеет отношение к возникновению и развитию многих опухолей. Среди различных солидных опухолей степень экспрессии EGFR при раке головы и шеи является наивысшей, составляя вплоть до 95%-100%. Колоректальный рак является вторым, с уровнем экспрессии 72%-89%. EGFR-положительные опухоли имеют признаки высокой злокачественности и сильной инвазии, а уровни экспрессии EGFR коррелируют с прогнозом. Таким образом, EGFR становится важной мишенью для текущей таргетной молекулярной терапии рака. Существует ряд доказательств, позволяющих убедиться, что HER1/EGFR аномально экспрессируется в солидных опухолях, и его клинические проявления заключаются в передаче, сниженной выживаемости, плохом прогнозе и выраженной устойчивости к химиотерапии и гормональной терапии. После блокирования HER1/EGFR образование опухолей может ингибироваться, при этом вышеуказанное состояние может быть улучшено.
Нацеленные на EGFR лекарственные средства, в настоящее время используемые для лечения рака, можно разделить на две категории: моноклональные антитела против EGFR и низкомолекулярные соединения - антагонисты тирозинкиназ. Антагонист тирозинкиназы представляет собой в основном низкомолекулярное соединение на основе хинолона, которое может конкурентно ингибировать связывание АТФ и внутриклеточный домен тирозинкиназы EGFR, таким образом, влияя на фосфорилирование остатков тирозина и ингибируя передачу сигнала ниже EGFR.
Моноклональное антитело к EGFR конкурентно связывается с эндогенным лигандом EGFR и дает противоопухолевый эффект путем ингибирования активации тирозинкиназы и стимуляции интернализации EGFR. В настоящее время существует три вида анти-EGFR моноклональных антител, доступных на внутреннем рынке и за рубежом. По сравнению с другими химиотерапевтическими лекарственными средствами эти антитела имеют более высокую специфичность и достигают хороших результатов в клинической терапии. EGFR является зрелой мишенью для разработки антительных лекарственных средств. В качестве одного из трех самых популярных зрелых мишеней для разработки лекарственных противоопухолевых антител (HER2, EGFR, VEGF) очень важным является статус лекарственных средств таргетной терапии, относящихся к EGFR-мишени, включая антительные лекарственные средства в терапии рака. Из-за ограничений доступных в настоящее время в продаже лекарственных средств на основе анти-EGFR антител, исследования и разработки новых лекарственных средств на основе анти-EGFR антител с высокой эффективностью и низкой токсичностью находятся в центре внимания международных исследований фармацевтической промышленности.
In vitro анализы и in vivo животные модели, с одной стороны показали, что анти-EGFR моноклональное антитело Эрбитукс (цетуксимаб) связывается с EGFR, блокируя фосфорилирование, ингибируя лиганд-активированную тирозин киназную активность EGFR и стимулируя эндоцитоз и деградацию EGFR, тем самым ингибируя рост опухолевых клеток и вызывая их апоптоз; а с другой стороны показали, что Эрбитукс (цетуксимаб) ингибирует рост опухолевых клеток, рекрутируя на поверхность опухоли клетки, такие как естественные киллеры (NK) и т.д., а также ингибирует рост опухолевых клеток, вызывая цитотоксичность (Bleeker WK, Lammerts van Bueren JJ, van Ojik HH, Gerritsen AF, Pluyter M, Houtkamp M, Halk E, Goldstein J, Schuurman J, van Dijk MA, van de Winkel JG, Parren PW. Dual mode of action of a human anti-epidermal growth factor receptor monoclonal antibody for cancer therapy. J Immunol 2004; 173: 4699-707).
Кроме того, в сводке результатов исследований по молекулам антительных лекарственных средств и механизму их применения во время лечения заболеваний показано, что терапевтическое роль различных анти-EGFR моноклональных антител в организме связана не только с аффинностью к EGFR, но также и с ADCC-активностью. (Patel D, Guo X, Ng S, Melchior M, Balderes P, Burtrum D, Persaud K, Luna X, Ludwig DL, Kang X. IgG isotype, glycosylation, and EGFR expression determine the induction of antibody-dependent cellular cytotoxicity in vitro by cetuximab. Hum Antibodies. 2010; 19: 89-99).
Кроме того, на основе технологии конструирования антител можно добиться преобразования между подтипами антител IgG без изменения трехмерной структуры антитела (Z Steplewski, L K Sun, С W Shearman, J Ghrayeb, Р Daddona, and H Koprowski. Biological Activity of Human-Mouse IgG1, IgG2, IgG3, and IgG4 chimeric monoclonal Antibodies with antitumor specificity. PNAS 1988; 85: 4852-4856).
В настоящее время с развитием технологий терапевтические моноклональные антитела разделены на три вида: химерные антитела, имеющие последовательности на около 70% человеческого происхождения, гуманизированные антитела, имеющие последовательности, гуманизированные на 90-94%, а также полностью гуманизированное антитело, имеющее 100% человеческую последовательность. Соотношение человеческой последовательности предполагает возможность потенциальной иммуногенности, вызываемой при использовании антитела при лечении человека, таким образом, возможность полностью человеческого антитела вызывать иммуногенность ниже, чем у химерных антител, и полностью человеческое антитело лучше химерного антитела и гуманизированного антитела при использовании в качестве терапевтического лекарственного средства.
ADCC (антителозависимая клеточно-опосредованная цитотоксичность) относится к NK-клеткам, макрофагам и нейтрофилам, которые экспрессируют IgG-Fc-рецептор и которые убивают клетки-мишени, посредством связывания с Fc фрагментом IgG-антител, уже связанных с поверхностью клеток-мишеней, таких как инфицированные вирусом клетки и опухолевые клетки. IgG антитела могут опосредовать ADCC-функцию этих клеток, где NK-клетки являются основными клетками, демонстрирующими ADCC. В случае антителоопосредованного ADCC-действия антитело может специфически связываться только с соответствующим эпитопом на клетках-мишенях, при этом эффекторные клетки, такие как NK-клетки, могут убить любые клетки-мишени, связанные с антителами, таким образом связывание антител с антигенами на клетках-мишенях является специфичным, в то время как цитотоксичность NK-клеток и других клеток по отношению к клеткам-мишеням является неспецифичной.
Несколько уже представленных на рынке лекарственных средств на основе анти-EGFR моноклональных антител по-прежнему имеют много недостатков. Например, Эрбитукс является человеческим химерным антителом IgG1, которое имеет значительную степень иммуногенности, подвержено реакции человеческие антитела против мышиных антител, имеет плохие побочные эффекты, что, таким образом, сказывается на его эффективности. Панитумумаб имеет полностью человеческий IgG2-подтип, но при этом утратило связанную с ADCC биологическую активность, обеспечивая исключительно блокирование сигнального пути EGFR, что приводит к ингибировованию роста опухоли, без ингибирования опухоли по ADCC-механизму, в результате чего его противоопухолевый эффект является слабым.
Соответственно, существует потребность в улучшенных с точки зрения ингибирования опухолей анти-EGFR антителах. Авторы настоящего изобретения неожиданно обнаружили, что с помощью технологической платформы конструирования антител, путем изменения панитумумаба с IgG2-подтипа в IgG1-подтип, образуется молекула полностью человеческого анти-EGFR антитела с новой последовательностью, которая имеет те же целевые характеристики связывания, что и панитумумаб, но из-за другого подтипа молекула антитела имеет более сильную ADCC-биологической активность и более сильный противоопухолевый эффект по сравнению с панитумумабом. Кроме того, поскольку антитело представляет собой молекулу полностью человеческого антитела, которое имеет более низкую иммуногенность, чем химерное антитело Эрбитукс, оно имеет более низкий потенциал клинических побочных эффектов. Таким образом, антитела по настоящему изобретению объединяют в себе преимущества известных антител предшествующего уровня техники с получением неожиданного технического эффекта.
Сущность изобретения
В общем, настоящее изобретение относится к новому анти-EGFR антителу или его функциональному фрагменту, которое, с одной стороны, позволяет уменьшить побочные эффекты иммуногенности химерных антител, а с другой стороны, из-за изменения подтипа IgG-антитела имеет улученный эффект подавления опухолей.
До настоящего изобретения ранее никогда не получали анти-EGFR антитело, объединяющее различные преимущества антител предшествующего уровня техники. То есть нельзя было получить полностью человеческие антитела, как с высоким уровнем связывания с EGFR, так и с высокой ADCC-активностью. Авторы настоящего изобретения неожиданно получили анти-EFGR антитела, несущие различные преимущества предыдущих антител, посредством реконструкции тяжелой и легкой цепей панитумумаба, в частности путем изменения подтипа панитумумаба, например путем замены константной области тяжелой цепи антитела IgG2 на константную область IgG1, необязательно с дальнейшей оптимизацией каркасной области тяжелой цепи и/или вариабельной области легкой цепи. В некоторых предпочтительных воплощениях настоящее изобретение относится к антителу с преобразованием подтипа (например, преобразование из IgG2 в IgG1). В других предпочтительных воплощениях настоящее изобретение также относится к антителам с оптимизированными каркасными областями тяжелой цепи и/или вариабельной областью легкой цепи.
В одном аспекте настоящее изобретение обеспечивает антитело, способное связываться с EGFR или его функциональным фрагментом, содержащим тяжелую цепь, и легкую цепь, где
(i) тяжелая цепь содержит вариабельную область тяжелой цепи и константную область тяжелой цепи, где вариабельная область тяжелой цепи имеет аминокислотную последовательность, показанную в SEQ ID NO: 5 или SEQ ID NO: 6, а константнтная область тяжелой цепи представляет собой последовательность константной области тяжелой цепи IgG1 человека; и
(ii) легкая цепь содержит вариабельную область легкой цепи и константную область легкой цепи, где вариабельная область легкой цепи, имеет аминокислотную последовательность, показанную в SEQ ID NO: 9 или SEQ ID NO: 10.
В некоторых воплощениях антитело или его функциональный фрагмент предпочтительно представляет собой полностью человеческое антитело или его функциональный фрагмент.
В других воплощениях константная область легкой цепи представляет собой константную область легкой цепи κ человека, например имеющую аминокислотную последовательность, показанную в SEQ ID NO: 11.
В других воплощениях константная область тяжелой цепи имеет аминокислотную последовательность, показанную в SEQ ID NO: 8.
В других воплощениях тяжелая цепь имеет аминокислотную последовательность, показанную в SEQ ID NO: 1 или 2.
В других воплощениях легкая цепь имеет аминокислотную последовательность, показанную в SEQ ID NO: 3 или 4.
В некоторых воплощениях антитело или его функциональный фрагмент обладает ADCC-активностью.
В других воплощениях антитело или его функциональный фрагмент ингибирует последующее фосфорилирование EGFR.
В других воплощениях антитело или его функциональный фрагмент ингибирует передачу сигнала EGFR.
В другом аспекте настоящее изобретение относится к молекуле нуклеиновой кислоты, кодирующей антитело или его функциональный фрагмент в соответствии с настоящим изобретением. Предпочтительно молекула нуклеиновой кислоты кодирует тяжелую цепь и легкую цепь антитела или функционального фрагмента настоящего раскрытия. В частности, молекула нуклеиновой кислоты является выделенной молекулой нуклеиновой кислоты.
В еще одном аспекте настоящее изобретение обеспечивает комбинацию молекул нуклеиновых кислот, включающую: молекулу нуклеиновой кислоты, кодирующую легкую цепь антитела или ее функциональные фрагменты по любому из предшествующих пунктов, и молекулу нуклеиновую кислоту, кодирующую тяжелой цепи антитела или его функционального фрагмента по любому из предшествующих пунктов. В частности, комбинация молекул нуклеиновых кислот представляет собой комбинацию отдельных молекул нуклеиновых кислот.
В еще одном аспекте настоящее изобретение обеспечивает иммуноконъюгат, содержащий антитело или его функциональный фрагмент по настоящему изобретению, конъюгированный с терапевтическим агентом. В некоторых воплощениях терапевтический агент является токсином, радиоизотопом, лекарственным средством или цитотоксином.
В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей антитело или его функциональный фрагмент в соответствии с настоящим изобретением и/или иммуноконъюгат в соответствии с настоящим изобретением, и фармацевтически приемлемый носитель.
В некоторых аспектах настоящее изобретение относится к способу лечения или профилактике аномальной экспрессии при связанных с EGFR заболеваниях или расстройствах, в том числе к введению субъекту антитела или его функционального фрагмента, иммуноконъюгата или фармацевтической композиции по настоящему описанию. В некоторых воплощениях заболевание или расстройство представляет собой опухолевое заболевание. Предпочтительно, опухолевое заболевание, выбирают из рака желудка, рака пищевода, рака поджелудочной железы, рака легких, рака яичников, рака толстой кишки, рака печени, рака головы и шеи и рака мочевого пузыря.
В других аспектах настоящее изобретение относится к способам ингибирования у субъекта последующего фосфорилирования EGFR, ингибирования передачи сигнала EGFR и/или улучшения ADCC, причем способ включает введение субъекту антитела или его функционального фрагмента, иммуноконъюгата или фармацевтической композиции по настоящему описанию.
В других аспектах настоящее изобретение относится к применению антитела или его функционального фрагмента, молекулы нуклеиновой кислоты, комбинации молекул нуклеиновых кислот, иммуноконъюгата или фармацевтической композиции по настоящему описанию, при производстве лекарственных средств для лечения или профилактики заболеваний или нарушений, связанных с аномальной экспрессией EGFR.
В других аспектах настоящее изобретение относится к применению антитела или его функционального фрагмента в соответствии с настоящим описанием, молекулы нуклеиновой кислоты, комбинации молекул нуклеиновых кислот, иммуноконъюгата или фармацевтической композиции при производстве лекарственных средств для ингибирования последующего фосфорилирования EGFR, ингибирования передачи сигнала EGFR и/или улучшения ADCC у субъекта.
В других аспектах настоящее изобретение обеспечивает антитело или его функциональный фрагмент, молекулу нуклеиновой кислоты, комбинацию молекул нуклеиновых кислот, иммуноконъюгата или фармацевтической композиции для лечения или профилактики заболеваний или нарушений, связанных с аномальной экспрессией EGFR или ингибирования последующего фосфорилирования EGFR, ингибирования передачи сигнала EGFR и/или улучшения ADCC у субъекта.
В некоторых воплощениях антитело или его функциональный фрагмент по настоящему изобретению является выделенным.
Настоящее изобретение также обеспечивает способ получения полностью человеческого антитела и его функционального фрагмента, который включает следующие стадии:
1) конструирование соответствующей последовательности ДНК, по последовательности антитела SEQ ID No.: 1-4;
2) синтез последовательности ДНК может быть проведен путем деления последовательности на несколько частей для того, чтобы синтезировать, а затем соединить их до полных фрагментов; или синтез может быть проведен с помощью ПЦР с использованием различных праймеров;
3) синтетические фрагменты ДНК антитела клонируют в экспрессирующую плазмиду;
4) экспрессирующую плазмиду трансфицируют в клетку-хозяина;
5) трансфицированные клетки-хозяева культивируют для получения надосадочной жидкости культуры клеток, в результате чего после очистки получают требуемое антитело.
Краткое описание чертежей
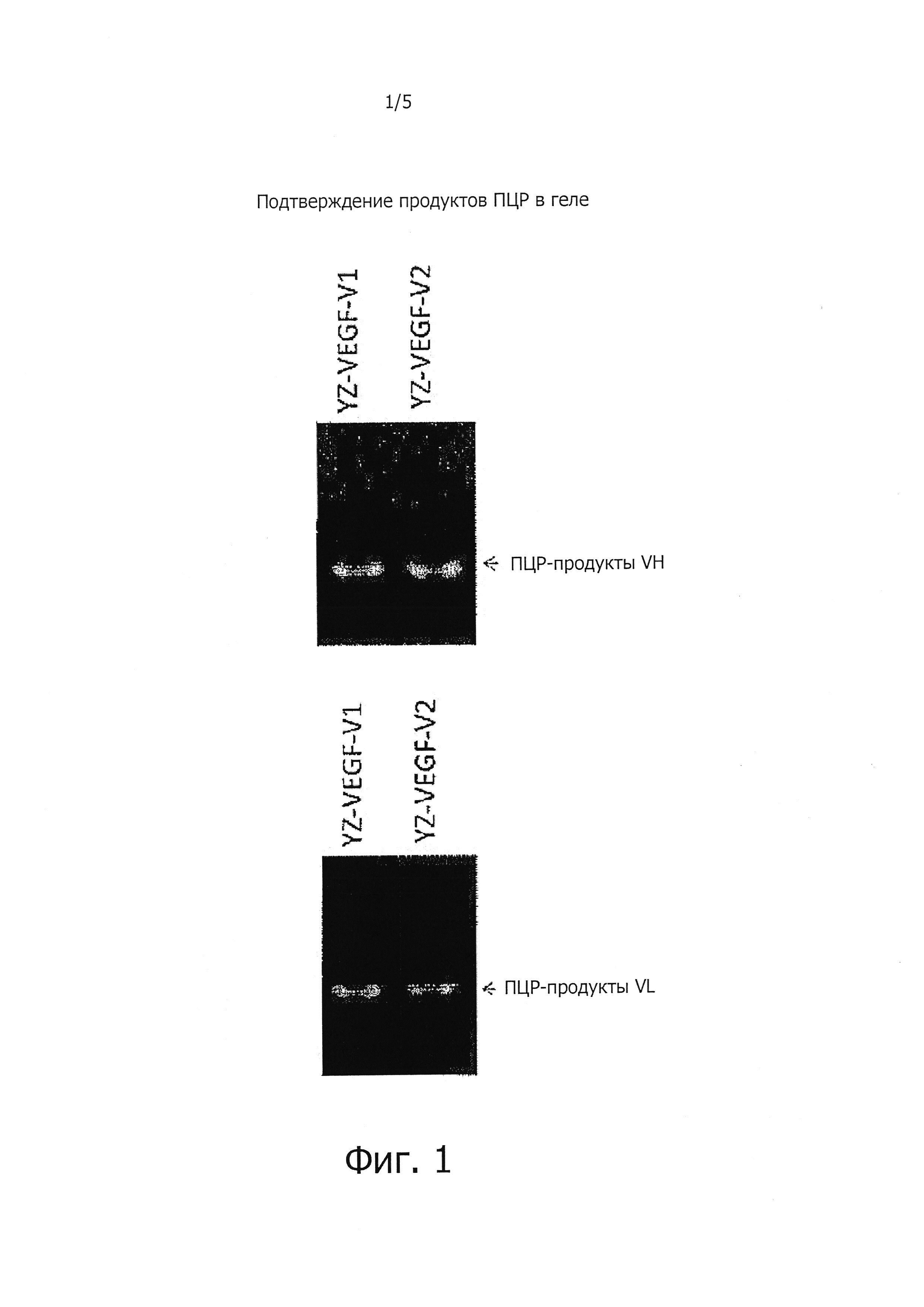
На Фигуре 1 показаны результаты ПЦР для идентификации последовательностей вариабельной области тяжелой и легкой цепей.
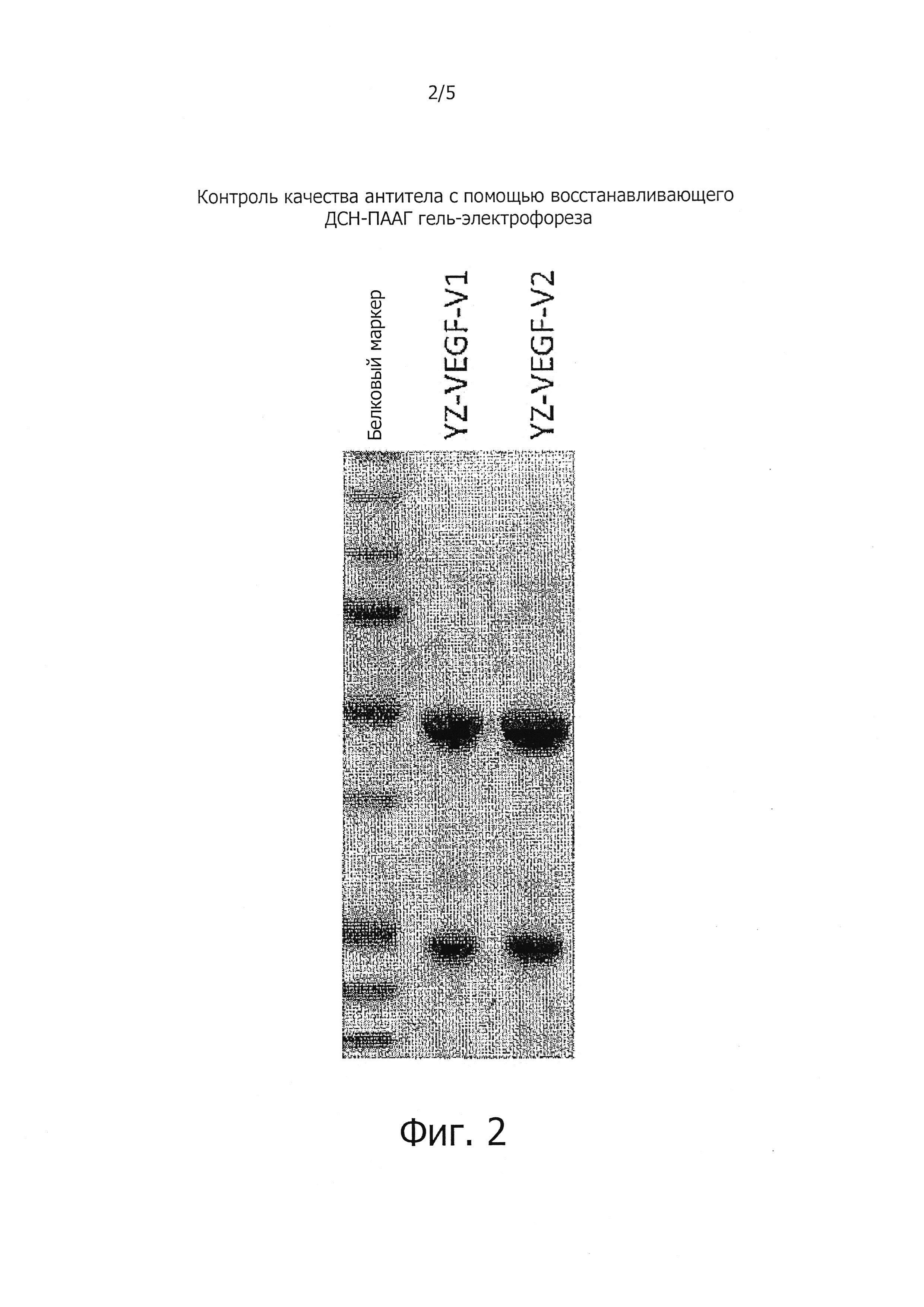
На Фигуре 2 показан ДСН-ПААГ гель-электрофорез белка для определения антитела.
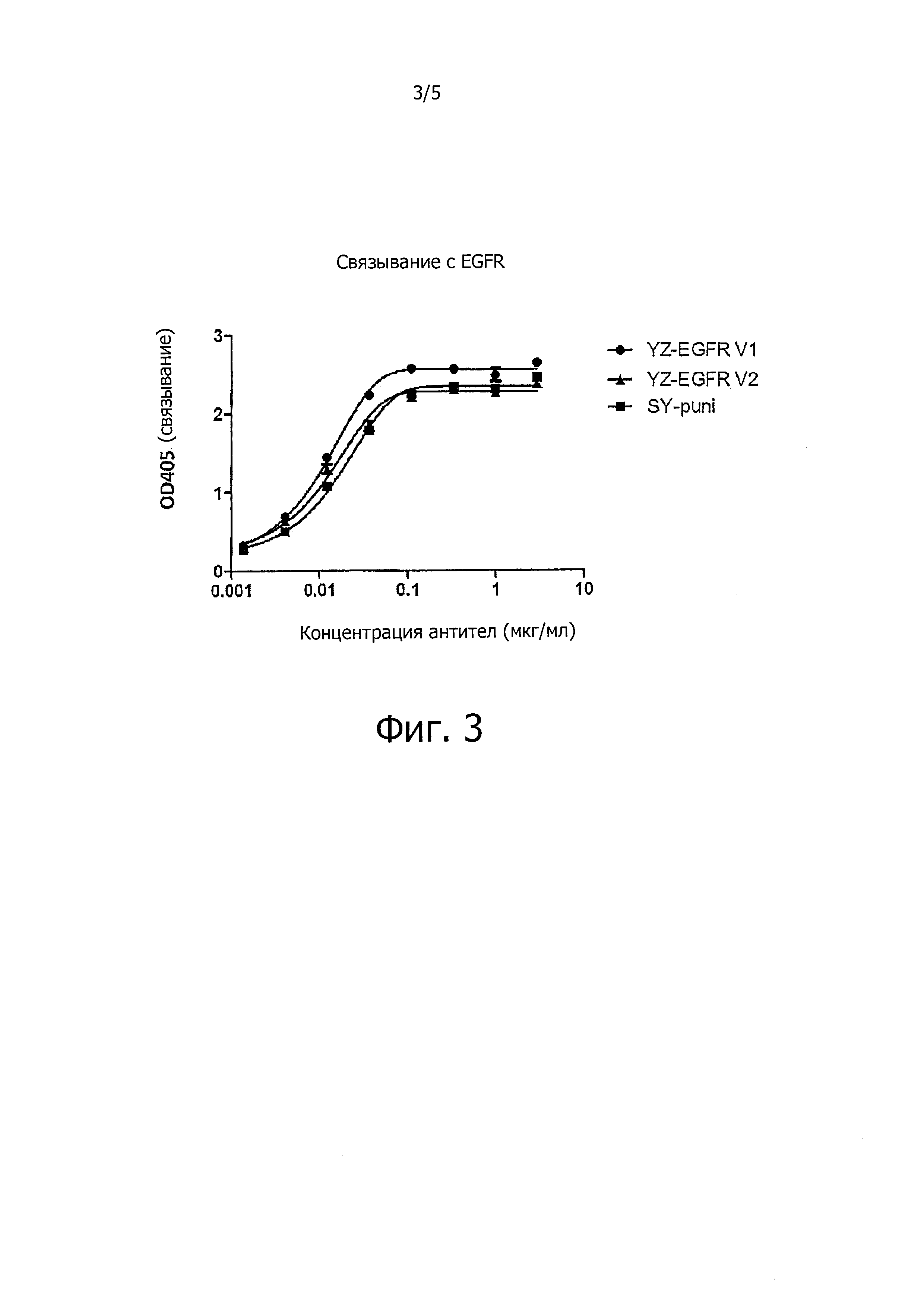
На Фигуре 3 показан схематический вид ELISA для анализа связывания между анти-EGFR антителом YongZhuo (также называемое YZ-EGFR) и EGFR-Fc. Результаты показали, что оба антитела YongZhuo-EGFR 1 и 2 имеют соответствующую активность прямого связывания с EGFR, сходную с активностью панитумумаба (SY-Puni). Показано, что анти-EGFR антитела YongZhuo 1 и 2 могут определить EGFR и имеют сродство, аналогичное сродству панитумумаба.
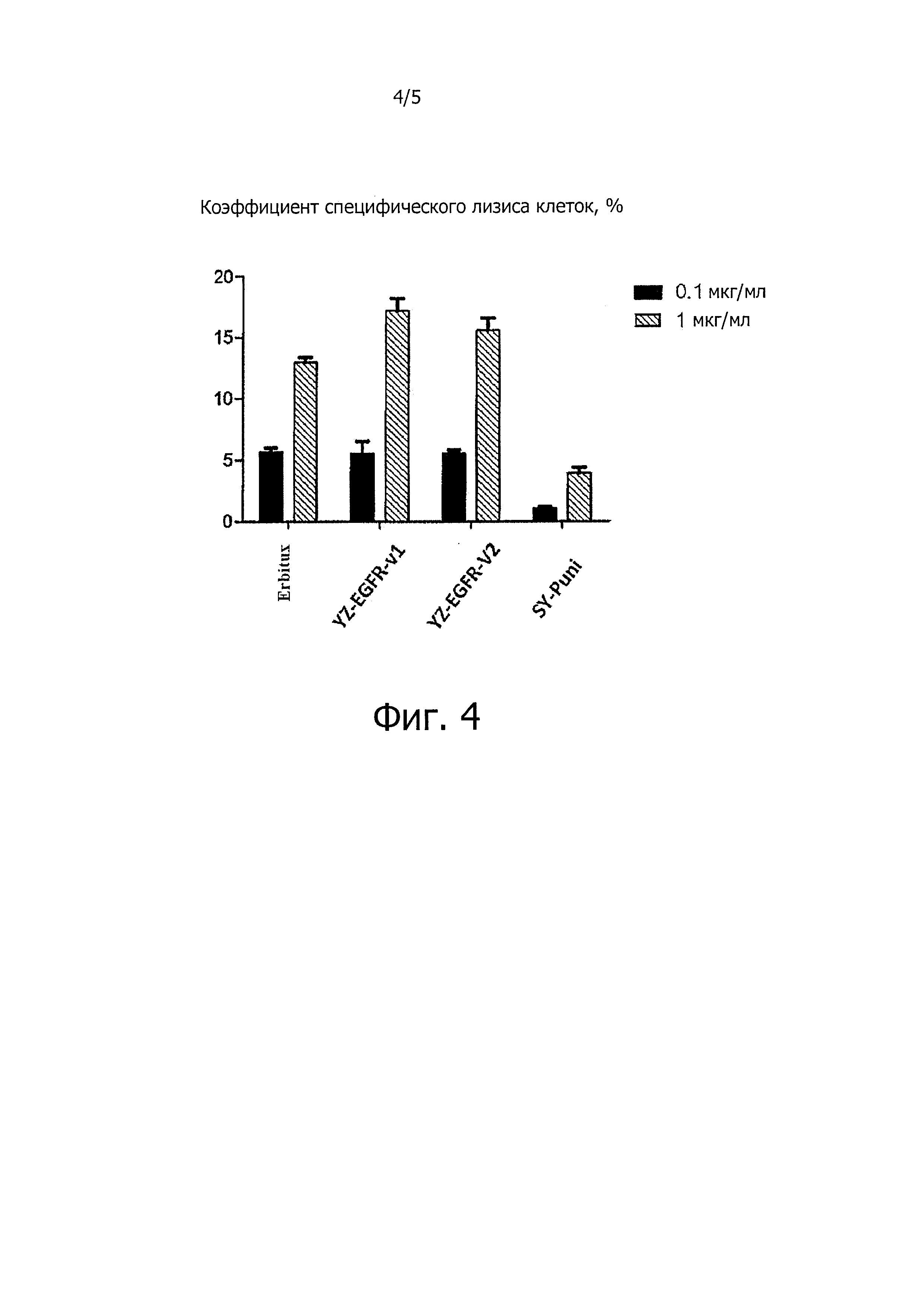
Фигура 4 демонстрирует схематическое представление анализа активности ADCC. Результаты показали, что оба анти-EGFR антитела YongZhuo 1 и 2 имеют активность ADCC-активность, сходную с активностью Erbitux (цетуксимаб), которая значительно выше, чем у панитумумаба.
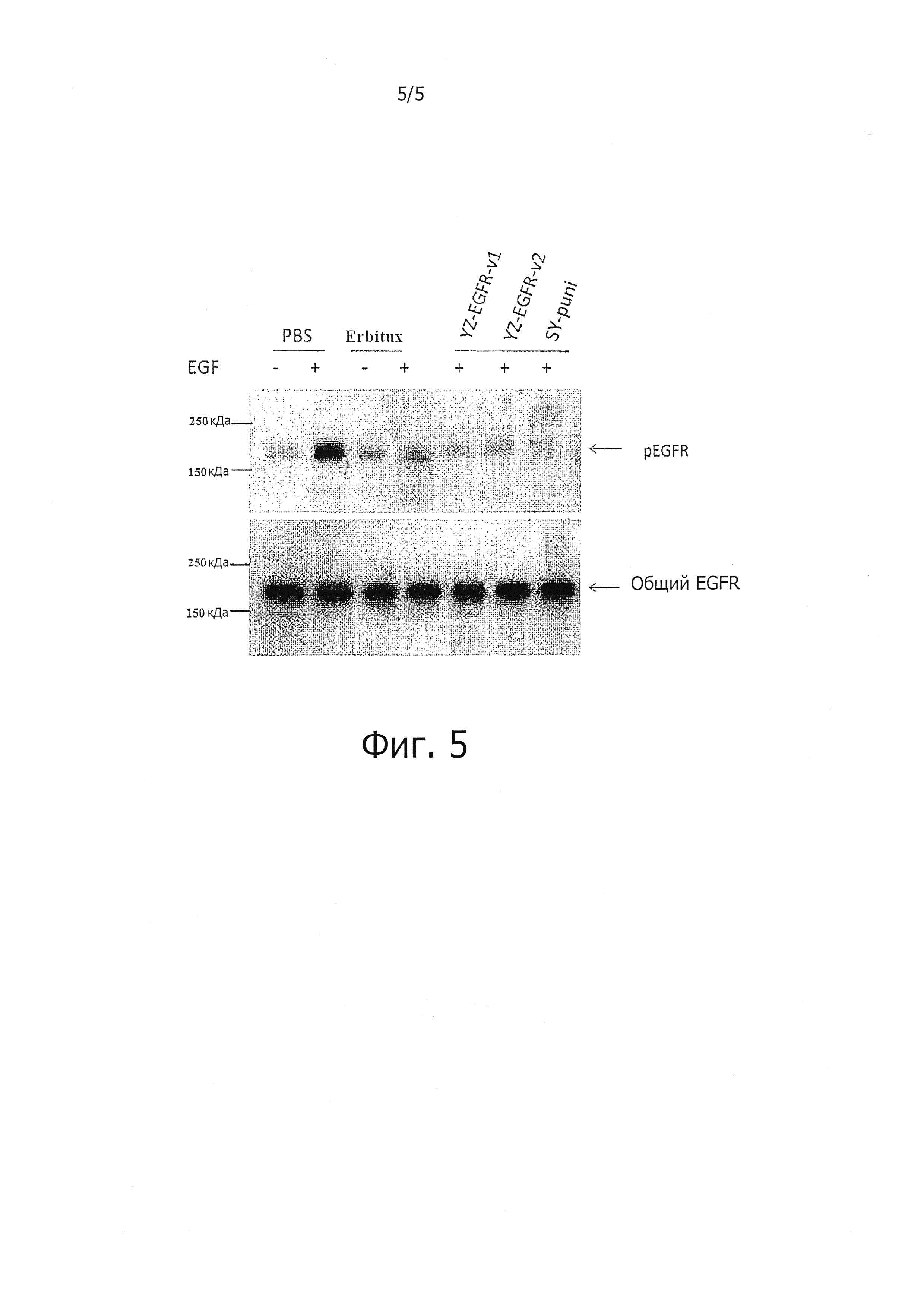
На Фигуре 5 представлен схематический вид ингибирующего эффекта анти-EGFR антитела по отношению к последующему фосфорилированию EGFR. В этом анализе уровни общего EGFR и EGFR после фосфорилирования детектируются с помощью Вестерн-блоттинга. Нижняя часть фигуры показывает общее количество EGFR в «Общий EGFR», в том числе постфосфорилированный EGFR и фосфорилированный EGFR. «pEGFR» в верхней части фигуры показывает количество EGFR после фосфорилирования. Дорожка 1: маркер молекулярной массы; 2: PBS плюс EGF; 3: PBS без EGF (2, 3 для отрицательного контроля PBS); 4: Эрбитукс без EGF; 5: Эрбитукс плюс EGF; 6: добавление анти-EGFR антитела YongZhuo 1; 7: добавление анти-EGFR антитела YongZhuo 2; 8: добавление панитумумаба (SY-puni). Результаты показывают, что в условиях с одинаковым количеством общего EGFR (внизу) все из числа анти-EGFR YongZhuo антител 1 и 2, Эрбитукса (erbitux) и панитумумаба (SY-puni) могут значительно ингибировать последующее фосфорилирование EGFR и таким образом блокировать сигнальный путь, что дополнительно доказывает, что анти-EGFR антитела YongZhuo 1 и 2 имеют эффекты связывания EGFR, ингибирования нисходящих сигнальных путей и потенциального ингибирования опухолевых клеток. Положительный контроль общих антител и отрицательный контроль PBS описывают эффективность эксперимента.
Подробное описание
Определения
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют значение, подразумеваемое обычными специалистами в данной области. Что касается определений и терминов в данной области, то специалисты могут ссылаться на Current Protocols in Molecular Biology (Ausubel) для подробностей. Аббревиатуры аминокислотных остатков, используемых в данном документе, являются стандартными 3-буквенным и/или 1-буквенным кодом для одной из 20 наиболее часто используемых L-аминокислот.
Несмотря на широкую сферу численных диапазонов и параметров аппроксимации, показанных в настоящем описании, в конкретных вариантах и примерах, они описаны как можно более точно. Тем не менее любое значение должно иметь некоторую ошибку, которая является результатом стандартного отклонения при их соответствующем измерении. Кроме того, все диапазоны, описанные в данном документе, следует понимать как охватывающие любые поддиапазоны, входящие в них. Например, описанный объем «1-10» следует рассматривать как включающий любые и все поддиапазоны между минимум 1 и максимум 10 (включая конечные точки), то есть все поддиапазоны, начинающиеся с минимального значения 1 или более, например от 1 до 6,1, и поддиапазоны, заканчивающихся с максимальным значением 10 или менее, например от 5,5 до 10. Кроме того, любые ссылки, называемые «включенный в данный документ», следует понимать как включенные во всей своей полноте.
Следует также отметить, что, при использовании в данном описании, форма единственного объекта должна включать форму множественного числа того же самого, если нет четкого и ясного ограничения одним упомянутым объектом. Термин «или» и термин «и/или» используются как взаимозаменяемые, если в контексте явно не указано иное.
Термины «фармацевтическая композиция», «комбинированное лекарственное средство» и «фармацевтическая комбинация», при использовании в данном документе, используют взаимозаменяемо и описывают комбинацию, по меньшей мере, одного лекарственного и необязательно фармацевтически приемлемого носителя или наполнителей. В некоторых воплощениях фармацевтическая композиция включает комбинации, которые разделены во времени и/или пространстве, поскольку они могут работать вместе для достижения задачи настоящего изобретения. Например, ингредиенты, содержащиеся в фармацевтической композиции (например, антитела, молекулы нуклеиновых кислот, комбинации молекул нуклеиновых кислот и/или иммуноконъюгат согласно настоящему изобретению), могут быть введены субъекту как вместе, так и по отдельности. Когда ингредиенты, содержащиеся в фармацевтической композиции, вводят субъекту по отдельности, ингредиенты могут быть введены субъекту одновременно или последовательно. Предпочтительно, если фармацевтически приемлемый носитель представляет собой воду, водный буферный раствор и изотонический солевой раствор, такой как PBS (фосфатно-солевой буфер), декстрозу, маннит, декстрозу, лактозу, крахмал, стеарат магния, целлюлозу, карбонат магния, 0,3% глицерин, гиалуроновую кислоту, этанол или полиалкиленгликоли, такие как полиэтиленгликоль, триглицериды и тому подобное. Тип используемого фармацевтически приемлемого носителя зависит от условия использования для перорального, назального, внутрикожного, подкожного, внутримышечного, внутривенного введения композиции по настоящему изобретению. Композиция по настоящему изобретению может содержать в качестве добавок смачивающие агенты, эмульгаторы или буферные вещества.
Фармацевтические композиции, вакцина или фармацевтический состав по настоящему изобретению могут быть введены любым подходящим способом, таким как пероральный, назальный, внутрикожный, подкожный, внутримышечный или внутривенный путь введения.
«Терапевтически эффективное количество» или «эффективное количество», при использовании в данном документе, относится к дозе, достаточной для демонстрации пользы субъекту, которому проводится введение. Фактическое вводимое количество, частота и временной курс введения будут зависеть от ситуации и тяжести состояния пациента, подвергаемого лечению. Рецепт (например, решения о дозировке и т.д.) для лечения, в конечном счете, относится к компетенции врачей общей практики и других врачей, на основании которого врачи принимают решения, как правило, с учетом подвергаемой лечению болезни, состояния отдельного пациента, участка доставки, способа введения и других известные для врачей факторов.
Используемый в данном документе термин «заболевание или расстройство, связанные с аномальной экспрессией EGFR» предназначен для обозначения тех заболеваний или расстройств, которые вызываются аномальной экспрессией EGFR или посредством симптомов/характеристик аномальной экспрессии EGFR, и предпочтительно эти заболевания или расстройства включают, без ограничения перечисленным, рак и/или опухоли, такие как рак желудка, рак пищевода, рак поджелудочной железы, рак легких, рак яичников, рак толстой кишки, рак печени, рак головы и шеи и рак мочевого пузыря.
Термин «субъект», используемый в данном документе, относится к млекопитающему, например человеку, но также и к другим животным, таким как дикие животные (например, цапли, аисты, журавли и т.п.), сельскохозяйственные животные (например, утки, гуси и т.п.) или экспериментальные животные (например, приматы, обезьяны, крысы, мыши, кролики, морские свинки, сурки, суслики и т.п.).
При использовании в данном документе, термин «функциональный фрагмент» относится к фрагменту антитела, особенно такому, как Fv, ScFv (SC обозначает одиночную цепь), Fab, F(ab')2, Fab', ScFv-Fc фрагменты или димеры, или любые фрагменты, которые могут увеличить время полужизни химической модификацией или включением в липосомы. Химическая модификация может быть такой модификацией, как химическая модификация добавлением поли(алкилен) гликолей, таких как полиэтиленгликоль («пэгилирование, ПЭГилированный») (называемые Fv-PEG, scFv-PEG, Fab-PEG, F(ab')2-PEG или пегилированные фрагменты Fab'-PEG) («PEG» представляет собой полиэтиленгликоль), и указанные фрагменты имеют активность связывания EGFR. Предпочтительно, если указанные функциональные фрагменты будут образованы или содержать частичную последовательность тяжелой или легкой вариабельной цепи антитела, из которого они получены. Частичная последовательность достаточна для сохранения такой же специфичности связывания, что и у исходного антитела и достаточной аффинности к EGFR, предпочтительно, по меньшей мере, равной 1/100 аффинности исходного антитела, в более предпочтительном варианте, по меньшей мере, равной 1/10. Такой функциональный фрагмент включает, по меньшей мере, пять аминокислот, предпочтительно 10, 15, 25, 50 и 100 смежных аминокислот последовательности исходного антитела.
Следующие примеры приведены для демонстрации и дополнительно объясняют некоторые из предпочтительных воплощений и аспектов и не должны быть истолкованы как ограничивающие их объем.
Пример 1
Дизайн и экспрессия последовательностей антител YZ-EGFR V1 и YZ-EGFR V2:
В настоящем изобретении для получения искомого полностью человеческого антитела применялись хорошо известные специалистам в данной области методы генетической инженерии. В примере описан единственный способ получения антительного образца для анализа и тестирования с помощью временной экспрессии в клетках 293-F. Тем не менее, специалистам в данной области техники будет понятно, что искомое антитело также может быть получено с помощью бактериальных, дрожжевых, вирусных и других эукариотических систем экспрессии, при этом наиболее оптимальная система получения включает разработку и получение полностью человеческого антитела с использованием стабильных клеточных линий клеток яичника китайского хомяка (СНО).
1. Ниже приводится последовательность вариабельной области тяжелой цепи панитумумаба (SEQ ID NO: 5), в которой подчеркнута последовательность каркасной области:
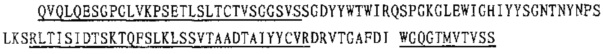
Ниже приводится последовательность константной области тяжелой цепи IgG2 (SEQ ID NO: 7):

Ниже приводится последовательность константной области тяжелой цепи IgG1 (SEQ ID NO: 8):

Последовательность тяжелой цепи антитела YongZhuo-EGFR-1 (YZ-EGFR v1) (SEQ ID NO: 1) формируется путем перехода с константной области оригинальной тяжелой цепи IgG2 (SEQ ID NO: 7) на последовательность константной области IgG1.
Неоптимизированная каркасная последовательность в оригинальной вариабельной области тяжелой цепи заменяется на оптимизированную каркасную последовательность (SEQ ID NO: 6):

Затем она объединяется с последовательностью тяжелой цепью IgG1, образуя последовательность тяжелой цепи антитела YongZhuo-EGFR-2 (YZ-EGFR v2) (SEQ ID NO: 2).
2. Ниже приводится последовательность вариабельной области легкой цепи панитумумаба (SEQ ID NO: 9), в которой подчеркнуты каркасные последовательности:
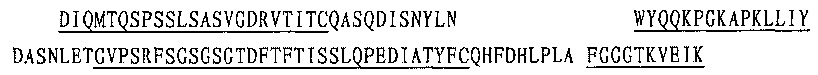
Ниже приводится последовательность константной области легкой цепи CL (κ) (SEQ ID NO: 11):

Последовательность вариабельного участка легкой цепи панитумумаба объединяется с константной областью легкой цепи CL (k), формируя последовательность легкой цепи YZ-EGFR v1 (SEQ ID NO: 3).
He оптимизированная каркасная последовательность в оригинальной вариабельной области легкой цепи заменяется на оптимизированную каркасную последовательность (SEQ ID NO: 10):

Затем ее объединяют с последовательностью константной области легкой цепи CL(κ), с образованием последовательности легкой цепи YZ-EGFR V2 (SEQ ID NO: 4).
3. Получение анти-EGFR антител YZ-EGFR V1 и YZ-EGFR V2
Этот пример описывает способ получения образца антитела для анализа и тестирования временной экспрессией в клетках 293-F. Требуемое антитело может быть также получено с помощью бактериальной, дрожжевой, вирусной и другой эукариотической системы экспрессии, при этом наиболее оптимальная система получения включает разработку и получение полностью человеческих антител с использованием стабильных клеточных линий клеток яичника китайского хомяка (СНО).
В соответствии с последовательностями вариабельной области тяжелой цепи и вариабельной области легкой цепи антител EGFR YZ V1 и YZ-EGFR V2 были разработаны и синтезированы ПЦР-праймеры олигонуклеотидных фрагментов, кодирующих последовательности вариабельных областей тяжелой и легкой цепей. Смежные олигонуклеотидные фрагменты имеют примерно 18 п.н. перекрывающихся пар оснований, а длина олигонуклеотидных фрагментов ПЦР-праймеров в общем составляет около 54 оснований. Равные количества ПЦР-праймеров каждого из фрагментов смешивали для реакции ПЦР с перекрывающимися праймерами.
Нуклеотидная последовательность праймеров фрагментов:
Каждая последовательность антитела имеет восемь (четыре пары) праймерных последовательностей, каждая пара праймеров используется для получения мини-экзона VH и VL антител YZ-EGFR V1 и YZ-EGFR V2.
Тяжелая цепь YZ-EGFR VI (V1-НС):
Праймер А 5':
Праймер В 5':
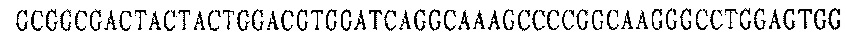
Праймер С 5':

Праймер D 5':
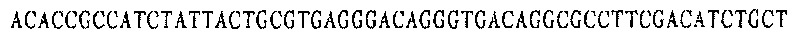
Праймер A 3':

Праймер В 3':

Праймер С 3':
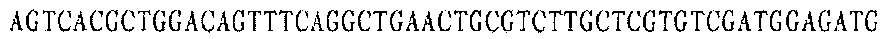
Праймер D 3':

тяжелая цепь YZ-EGFR V2 (V2-HC):
Праймер А 5':

Праймер В 5':
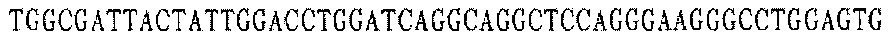
Праймер С 5':

Праймер D 5':

Праймер A 3':
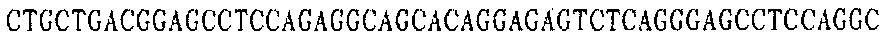
Праймер В 3':
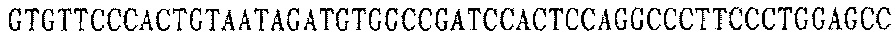
Праймер С 3':
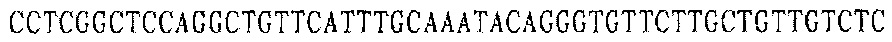
Праймер D 3':
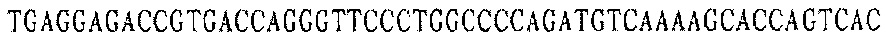
легкая цепь YZ-EGFR V1 (V1-LC):
Праймер А 5':
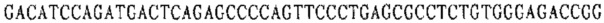
Праймер В 5':
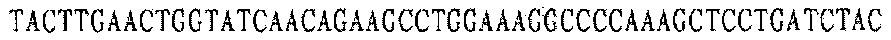
Праймер С 5':

Праймер D 5':

Праймер A 3':
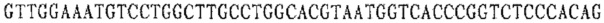
Праймер В 3':
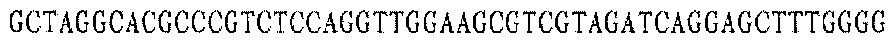
Праймер С 3':
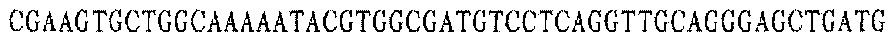
Праймер D 3':

легкая цепь YZ-EGFR V2 (V2-LC):
Праймер А 5':
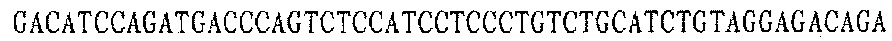
Праймер В 5':

Праймер С 5':
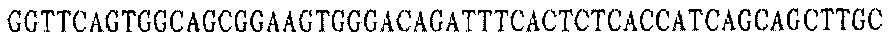
Праймер D 5':
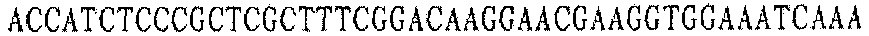
Праймер A 3':
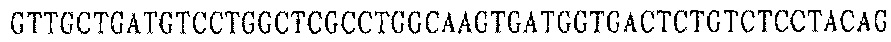
Праймер В 3':

Праймер С 3':
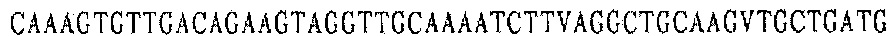
Праймер D 3':
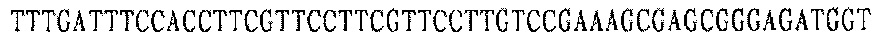
Система реакции ПЦР: 0,2 μМ dNTP (конечная концентрация); каждый ПЦР-праймер: 1 мкл; 10 × буфер: 3 мкл; клонированная pfu (Invitrogen): 1 мкл; воду добавляли до 30 мкл.
Условия реакции ПЦР: начальная денатурация в течение 3 минут при 94°С, денатурация в течение 30 секунд при 94°С, отжиг в течение 30 секунд при 56°С, удлинение в течение 1 минуты при 72°С, 30 циклов, и, наконец, дополнительное удлинение в течение 10 минут при 72°С.
Нужные фрагменты выделяли и очищали из продуктов ПЦР после электрофореза в 1% агарозном геле. После гидролиза с помощью EcoRI фрагменты клонировали в вектор pCR-Bluntll-TOPO (Invitrogen), а затем трансформировали в E. coli TOPO10 (Invitrogen) и проводили скрининг на чашках LB/канамицин. Собирали 10 белых бляшек и инокулировали в жидкую культуральную среду LB, содержащую канамицин. Плазмиды экстрагировали с помощью набора для очистки QIAGEN PCR QIAquick, а их последовательности секвенировали для подтверждения последовательности вариабельной области тяжелой и легкой цепи. Продукты ПЦР показаны на Фигуре 1.
3. Конструирование экспрессирующих векторов
С помощью ПЦР выделяли РНК из нормальных В-клеток человека для получения Fc-фрагмента IgG1 константной области тяжелой цепи IgG1 человека и κ-фрагмента константной области легкой цепи. Фрагменты предварительно создавали в pcDNA3.1 (Invitrogen), экспрессирующем векторе, трансформированного бактериальные клетки DH5α. После выделения плазмид и секвенирования определяли положительные клоны. Вариабельные области тяжелой цепи YZ-EGFR V1 и YZ-EGFR V2 вырезали из положительных клонов pCR-Bluntll-TOPO с помощью Eco47III/NheI (Invitrogen) и лигировали в экспрессирующий вектор pcDNA3.1-Fc. Вариабельные области легкой цепи YZ-EGFR V1 и YZ-EGFR V2 вырезали из положительных клонов pCR-Bluntll-TOPO с помощью AscI/BsiWI (Invitrogen) и лигировали в экспрессирующий вектор pcDNA3.1-κ. После трансформации бактериальных клеток DH5a плазмиды опять экстрагировали и трансформировали, после чего определяли положительные клоны. Результаты секвенирования соответствуют данным по антителу.
4. Экспрессия антител
Для экспрессии рекомбинантных YZ-EGFR V1 и YZ-EGFR V2 плазмиды с тяжелой и легкой цепями YZ-EGFR V1 и YZ-EGFR V2 соответствующим образом трансфецировали в клетки 293-F (с помощью 293fectin от Invitrogen). После трансфекции клетки культивировали в среде для экспрессии FreeStyle 293 (от Invitrogen Corporation) в 100 мл колбах в течение пяти дней, культуральную надосадочную жидкость собирали центрифугированием и фильтровали через 0,22 мкм мембрану. Затем очищали с помощью колонки с протеином А (5 мл предварительно набитая колонка MabSelect от GE Biosciences Inc.). Были проведены следующие конкретные стадии: после того, как колонку уравновесили буфером (20 мМ фосфат, 150 мМ NaCl, pH 7,0), в количестве 10 объемов колонки (10 CV), нанесли на колонку отфильтрованную надосадочную жидкость при скорости потока 2 мл/мин. После промывки с помощью уравновешивающего буфера (20 мМ фосфатный буфер, 150 мМ NaCl, pH 7,0) 10 объемами колонки (10 CV), колонку элюировали 5 объемами колонки элюирующего буфера (10 мм цитрат натрия, pH 3,5). Элюированные антитела нейтрализовали с помощью 1 М Трис HCl pH 8,0, с pH 6,5, а затем очищенное антитело диализовали против PBS. Концентрацию антител измеряли с помощью ультрафиолета (длина волны 280 нм), а степень очистки измеряли с помощью SDS-PAGE (Фиг. 2). Надосадочные жидкости клеточной культуры собирали и очищали двумя очистками с протеином А. Очищенные антитела после диализа против PBS подвергали фильтрации через 0,22 мкм мембрану для последующей исследовательской работы.
Пример 2: Детекция связывания с EGFR с помощью ELISA
Материалы:
Антитело YongZhuo-EGFR-1 (YZ-EGFR V1); антитело YongZhuo-EGFR-2 (YZ-EGFR V2); Панитумумаб (SSY-puni, из компании Amgen); EGFR-FC (из компании Thermo Fisher)
Методы: с использованием прямого ELISA следующим образом.
1. Планшет для ELISA покрывали 1 мкг/мл EGFR-Fc по 50 мкл/лунку и давали осесть при 4°С в течение ночи (около 16 часов).
2. Неспецифические сайты на планшете для ELISA блокировали TBS, содержащим 1% BSA при 37°С в течение 1 часа.
3. Удаляли из планшетов ELISA воду, элюировали 2 × TBST буфером для элюции.
4. Лоток для переноса блокировали раствором 1% BSA/TBS, 200 мкл/лунку при 37°С, 1 час.
5. От начальной концентрации 3 мкг/мл, в качестве исходной точки, получали серии антител в лотке для переноса, блокированном раствором 1% BSA/TBS с градиентом разведения 1:3 для тестовых экспериментов. Каждое антитело получали с 8 градиентами концентраций, и конечный объем составлял 180 мкл/лунку.
6. В планшеты для ELISA, покрытые EGFR-Fc (см. стадии 1-3), добавляли антитела в различных концентрациях (как в способе стадии 5), по 50 мкл/лунку, и инкубировали при 37°С в течение 1 часа, один раз повторяли измерение образца.
7. Удаляли воду из планшета для ELISA, и промывали планшет 4 × TBST.
8. Ослиные вторичные антитела IgG-АР против человеческих антител разбавляли 1% BSA/TBS в соотношении 1:1000, по 50 мкл/лунку, 37°С в течение 1 часа.
9. Планшеты для ELISA сушили и промывали 5 × TBST.
10. Добавляли в планшет по 50 мкл/лунку буфера PNPP, содержащего 0,1% PNPP-субстрат, и инкубировали при 37°С в течение 15 минут. 0,1% PNPP-субстрат в буфере PNPP добавляли по 50 мкл/лунку и инкубировали при 37°С в течение 15 минут.
11. Для подавления реакции добавляли по 50 мкл/лунку 1N гидроксида натрия.
12. Считывали значение оптической плотности при 405 нм с помощью устройства, измеряющего мечение ферментом.
13. Данные записывали и анализировали.
Результаты этого анализа представлены на Фигуре 3. На Фигуре 3 показано, что антитела YongZhuo-EGFR 1 и 2 являются такими же, что и панитумумаб (SY-Puni), имеют соответствующую активность прямого связывания с EGFR, что указывает на то, что антитела YongZhuo-EGFR 1 и 2 могут идентифицировать EGFR и их аффинность к EGFR схожа с аффинностью панитумумаба.
Пример 3: in vitro анализ ADCC-реакции анти-EGFR антитела:
Материалы:
Антитело YongZhuo-EGFR-1 (YZ-EGFR V1); антитело YongZhuo-EGFR-2 (YZ-EGFR V2); Панитумумаб (SY-puni, от Amgen Inc.); Эрбитукс (цетуксимаб, от ImClone); кальцеин -AM (Invitrogen Corporation); круглодонный 96-луночный планшет (BD Science), мононуклеарные клетки периферической крови (РВМС) были приобретены в AllCells Company (здоровые доноры).
Методы:
ADCC детектировали методом высвобождения кальцеина-АМ следующим образом
1. Клетки А431 (человеческий эпидермальный рак) метили кальцеином-АМ (15 мкМ/106 клеток) и промывали в круглодонном 96-луночном планшете с 5×103 клеток/лунку, в трех повторах.
2. Добавляли анти-EGFR антитела (0,1 и 1 мкг/мл) и инкубировали с предварительно мечеными А431 при 4°С в течение 30 минут.
3. После Стадии 2 добавляли эффекторные клетки РВМС из здоровых доноров, конечный эффект представляет собой: в конечном объеме 200 мкл/лунку, соотношение клеток-мишеней (меченных А431) и эффекторных клеток (РВМС) составляло 40:1.
4. Удельное соотношение лизиса = (AFU среднее экспериментальное высвобождение - AFU среднее спонтанное высвобождение)/(AFU среднее максимальное высвобождение - AFU среднее спонтанное высвобождение).
Результаты этого анализа представлены на Фигуре 4. Результаты, приведенные на Фигуре 4, показали, что оба антитела YongZhuo-EGFR 1 и 2 имеют ADCC-активность, сходную с активностью Эрбитукса (цетуксимаб), при этом эта активность была значимо выше, чем у панитумумаба.
Пример 4: фосфорилирование EGFR:
Материалы:
Антитело YongZhuo-EGFR-1 (YZ-EGFR V1); антитело YongZhuo-EGFR-2 (YZ-EGFR V2); Панитумумаб (SY-puni, от Amgen Inc.); Эрбитукс (цетуксимаб, от ImCIone); Клетки А431 (полученные из АТСС: CRL-2592); рекомбинантный человеческий эпидермальный фактор роста (от R & D company); буфер для лизиса клеток (10×) (от Cell Signalling); набор ВСА (от Pierce); анти-pEGFR (pY 1068) и пан-анти-EGFR (от CST Corporation).
Были проведены следующие стадии анализа:
1. Каждый 6-луночный планшет засевали 5×105 клеток А431 и инкубировали в течение ночи в полной среде (DMEM + 10% FBS).
2. Среду заменяли 2 мл DMEM для культивирования и лишали клетки питания на 16-18 часов. Клетки голодали в течение 16-18 часов с 2 мл DMEM.
3. Среду заменяли 1 мл предварительно нагретой свежей среды (без 10% FBS) для культивирования и инкубировали в инкубаторе в течение 1-2 часов.
4. За 30 минут до стимуляции рекомбинантным EGF (эпидермальный фактор роста) добавляли к клеткам А431 10 г/мл анти-EGFR антитела (конечная концентрация).
5. Клетки стимулировали EGF в конечной концентрации 0,5 нг/мл, растворенном в PBS + 0.01% BSA в течение 5 минут.
6. Помещали планшет на лед и промывали холодным 1 × PBS 3 раза.
7. К клеткам добавляли 250 мкл лизирующего раствора для лизиса и соскабливали непосредственно после лизиса, перемешивали или инкубировали на льду в течение 30 минут.
8. Клетки центрифугировали при 14000 об./мин, 4°С, в течение 15 мин.
9. Белок количественно определяли с помощью набора ВСА.
10. Корректировали объем раствора белкового лизата соответствующим объемом буфера для загрузки и варили в течение 5 минут.
11. Заливали 10-луночный гель для вестерн-блоттинга, загружали в каждую лунку по 20 г лизата.
Эксперимент детектирует методом вестерн-блоттинга общий EGFR и фосфорилированный EGFR. В нижней части Фигуры 5, «Общий EGFR», показано общее содержание EGFR, включая нефосфорилированный и фосфорилированный EGFR. «pEGFR» в верхней части Фигуры демонстрирует количество EGFR после фосфорилирования.
Фигура 5 иллюстрирует, что при условии одинакового количества общего EGFR (внизу) все из числа анти-EGFR антител YongZhuo 1 и 2, Эрбитукс (Эрбитукс) и панитумумаба (SY-Puni) могут значительно ингибировать последующее фосфорилирование EGFR, и, таким образом, блокировать сигнальный путь, что дополнительно доказывает, что Анти-EGFR антитела YongZhuo 1 и 2 имеют эффекты связывания EGFR, ингибирование нисходящих сигнальных путей и потенциального ингибирования опухолевых клеток. Положительный контроль общих антител и отрицательный контроль PBS описывают эффективность эксперимента.
Таким образом, приведенные выше примеры показывают, что в настоящем изобретении неожиданно обнаружено, что при реконструировании панитумумаба, удалось получить анти-EGFR антитело, обладающее преимуществами различных антител предшествующего уровня техники.
Приведенное выше описание представляет только лишь предпочтительные воплощения, которые предлагаются для примера и не предназначены для ограничения существенных признаков комбинации, требуемых для реализации данного изобретения. Название не предназначено для ограничения различных воплощений настоящего изобретения. Такие термины, как «включающий», «содержащий» и «охватывающий» не предназначены для ограничения. Кроме того, если не указано иное, отсутствие числового значения означает состояние, включающее множественную форму и «или», «или» означает «и/или». Если не указано иное, все технические и научные термины, используемые в данном документе, имеют значение, подразумеваемое обычными специалистами в данной области.
Все публикации и патенты, упомянутые в настоящей заявке, включены в данных документ посредством ссылки. Без отхода от рамок и сущности настоящего изобретения, различные модификации и вариации способов и композиций по настоящему изобретению являются очевидными для специалистов в данной области. Хотя настоящее изобретение описано введением конкретных предпочтительных воплощений, следует понимать, что заявленный объем не должен быть необоснованно ограничен этими конкретными воплощениями. Фактически, те варианты, которые очевидны для специалистов в данной области, предназначены для включения в объем прилагаемой формулы изобретения.