Результат интеллектуальной деятельности: КОМБИНАЦИЯ ЛЕВОКАБАСТИНА И ФЛУТИКАЗОНА ФУРОАТА ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ И/ИЛИ АЛЛЕРГИЧЕСКИХ СОСТОЯНИЙ
Вид РИД
Изобретение
Настоящее изобретение относится к фармацевтическим композициям, содержащим противовоспалительное глюкокортикоидное соединение андростанового ряда и левокабастин, представляющий собой антагонист H1/противоаллергическое средство. Настоящее изобретение также относится к их терапевтическим применениям, в частности для лечения воспалительных и аллергических состояний, в особенности ринита.
Многие миллионы людей во всем мире страдают от сезонного и круглогодичного аллергического ринита. Симптомы сезонного и круглогодичного аллергического ринита включают зуд в носу, заложенность, насморк, чихание и слезящиеся глаза. Сезонный аллергический ринит обычно известен как «сенная лихорадка». Он вызван аллергенами, которые присутствуют в воздухе в конкретное время года, например, пыльцой деревьев весной и летом. Круглогодичный аллергический ринит вызван аллергенами, которые присутствуют в окружающей среде на протяжение всего года, например, пылевыми клещами, плесневыми грибками, милдью и перхотью домашних животных.
Большинство пациентов с аллергическим ринитом сообщают о назальных симптомах (заложенность, чихание, зуд и ринорея) и глазных симптомах (покраснение, слезящиеся глаза, зуд и жжение), которые влияют на качество жизни и также могут быть ассоциированы с существенными затратами системы здравоохранения (например, обострения синусита и астмы, назальные полипы, ухудшение слуха и т.д.) и другими экономическими последствиями (например, меньшая производительность труда) при отсутствие правильного лечения.
Целью терапии аллергического ринита является контроль острых и хронических проявлений заболевания путем минимизации ассоциированных с ним симптомов и улучшения качества жизни. Для достижения этого современные рекомендации по лечению включают избегание аллергена, иммунотерапию и/или фармакотерапию. Избегания трудно добиваться в отношении большинства обычных аллергенов (например, пыльцы, пылевых клещей). Иммунотерапия является эффективной хронической терапией у некоторых пациентов, но она является времязатратной, неудобной и имеет серьезные потенциальные побочные эффекты (такие как сильные местные реакции и анафилаксия). Современные возможности фармакотерапии включают интраназальные кортикостероиды, пероральные и интраназальные антигистаминные средства (АН), нестероидные противовоспалительные агенты и средства против заложенности носа.
Для приготовления эффективной фармацевтической назальной композиции лекарственное средство должно легко доставляться во все части полостей носа (ткани-мишени), где оно выполняет свою фармакологическую функцию. Кроме того, лекарственное средство должно оставаться в контакте с тканями-мишенями в течение относительно длительных периодов времени. Чем дольше лекарственное средство остается в контакте с тканями-мишенями, тем больше эффективность, и, следовательно, лекарственное средство должно обладать способностью сопротивляться тем силам в носовых ходах, функцией которых является удаление частиц из носа. Такие силы, называемые «мукоцилиарным клиренсом», считаются крайне эффективными в быстром удалении из носа частиц, например, в пределах 10-30 минут с того времени, когда данные частицы попали в нос.
Другими желательными характеристиками назальной композиции являются то, что она не должна содержать ингредиентов, которые вызывают дискомфорт для пользователя, что она имеет удовлетворительную стабильность и свойства хранения, и что она не содержит компонентов, которые считаются вредными для окружающей среды, например, веществ, разрушающих озоновый слой. В случае введения глюкокортикоидов предпочтительно следует минимизировать возможность появления нежелательных побочных эффектов.
Глюкокортикоиды, которые имеют противовоспалительные свойства, известны и широко используются для лечения воспалительных расстройств или заболеваний, таких как астма и ринит.
Ингалируемые кортикостероиды включают сложные эфиры беклометазона (например, 17-пропионатный сложный эфир или 17,21-дипропионатный сложный эфир), флутиказона пропионат, будесонид, флунизолид, сложные эфиры мометазона (например, фуроатный сложный эфир), триамцинолона ацетонид, рофлепонид и циклесонид. Ингалируемые глюкокортикоиды также раскрыты в WO 02/12265, WO 02/12266, WO 05/005452, WO 05/005451 и WO 02/088167.
В WO 02/12265 раскрыт S-фторметиловый эфир 6α,9α-дифтор-17α-[(2-фуранил карбонил)]окси]-11β-гидрокси-16α-метил-3-оксо-андроста-1,4-диен-17β-тиокарбоновой кислоты, известный по непатентованному наименованию как флутиказона фуроат.
Антагонисты H1/противоаллергические средства (также именуемые антигистаминными средствами) известны и могут использоваться в назальных спреях и глазных каплях для лечения связанных с аллергией состояний, таких как сезонный аллергический ринит, и в лечении зуда глаза, ассоциированного с аллергическим конъюнктивитом. К антигистаминным средствам могут относиться антигистаминными средствами первого, второго или третьего поколения.
Антигистаминные средства против H1 первого поколения включают пипероксам, этилендиамины (например, мепирамин (пириламин), антазолин), этаноламины (например, дифенгидрамин, карбиноксамин, доксиламин, клемастин и дименгидринат), алкиламины (например, фенирамин, хлоренамин (хлорфенирамин), дексхлорфенамин, бромфенирамин и трипролидин), пиперазины (например, циклизин, гидроксизин и меклизин) и трициклины (например, прометазин, алимемазин (тримепразин), ципрогептадин и азатадин).
Антигистаминные средства второго поколения включают системные лекарственные средства (например, акривастин, астемизол, цетиризин, лоратадин, мизоластин и терфенадин) и местные лекарственные средства (например, азеластин, левокабастин и олопатидин). Известно, что левокабастин, обычно в виде гидрохлоридной соли, например, как раскрыто в US 3813384, можно вводить в виде назального спрея для лечения таких состояний, как ринит. Имеющиеся в продаже композиции левокабастина типично предназначены для введения дважды в сутки.
Антигистаминные средства третьего поколения включают левоцетиризин, деслоратидин и фексофенадин.
В настоящее время авторы изобретения идентифицировали новые композиции, содержащие кортикостероид и антагонист рецептора H1. Указанные композиции подходят для интраназального введения и могут иметь преимущества перед теми композициями, которые уже известны.
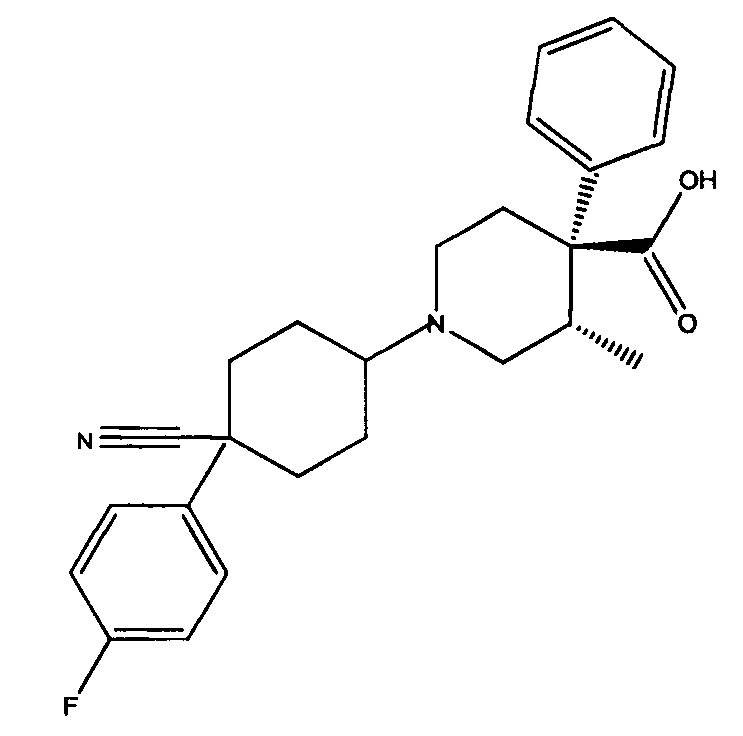
Согласно одному аспекту изобретения предложена фармацевтическая композиция, содержащая левокабастин или его соль и флутиказона фуроат (FF). Левокабастин имеет химическую формулу (I)
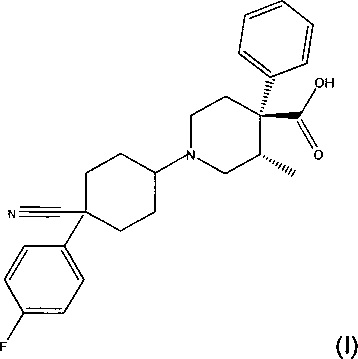
и химическое название (3S,4R)-1-[4-циано-4-(4-фторфенил)циклогексил]-3-метил-4-фенилпиперидин-4-карбоновая кислота.
Флутиказона фуроат имеет химическую формулу (II)
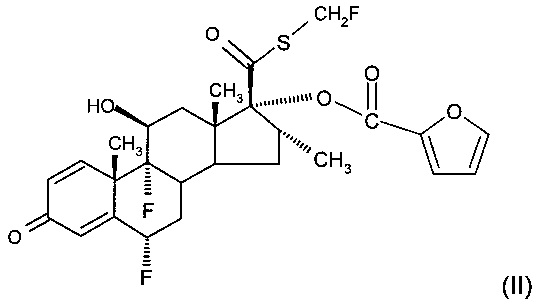
и химическое название S-фторметиловый эфир 6α,9α-дифтор-17α-[(2-фуранилкарбонил)]окси]-11β-гидрокси-16α-метил-3-оксо-андроста-1,4-диен-17β-тиокарбоновой кислоты.
Композиция согласно настоящему изобретению может демонстрировать превосходные противовоспалительные, противоаллергические свойства и свойства переносимости. Композиция также может демонстрировать более быстрое начало действия и улучшенную эффективность по сравнению с интраназальной монотерапией кортикостероидами и может быть пригодной для дозирования один раз в сутки. Кроме того, данная комбинация может обеспечивать использование меньшей суточной дозы одного или обоих компонентов, приводя к лучшему профилю переносимости/нежелательных событий. Композиция может уменьшать или устранять плохой вкус, ассоциированный с другими интраназальными антигистаминными средствами.
Левокабастин может образовать соли с кислотами, например, с неорганической кислотой, такой как галогенводородная кислота, например, соляная или бромистоводородная кислота, и серная кислота, азотная кислота или фосфорная кислота; или с органической кислотой, такой как, например, уксусная, пропионовая, 2-гидроксиуксусная, 2-гидроксипропионовая, 2-оксопропионовая, малоновая, бутандиовая, (Z)-2-бутендиовая, (Е)-2-бутендиовая, 2-гидроксибутандиовая, 2,3-дигидроксибутандиовая, 2-гидрокси-1,2,3-пропантрикарбоновая, бензойная, 3-фенил-2-пропеновая, α-гидроксибензолуксусная, метансульфоновая, этансульфоновая, бензолсульфоновая, 4-метилбензолсульфоновая, циклогексансульфаминовая, 2-гидроксибензойная или 4-амино-2-гидроксибензойная кислота.
В одном воплощении левокабастин используется в виде гидрохлорида.
В одном аспекте изобретения предложена фармацевтическая композиция, в которой флутиказона фуроат и левокабастин или его соль (например, гидрохлорид) присутствуют в виде суспендированных частиц. В одном аспекте изобретения предложена фармацевтическая композиция, которая представляет собой водную фармацевтическую композицию.
В одном аспекте изобретения предложена фармацевтическая композиция, подходящая для интраназальной доставки.
В некоторых воплощениях композиция будет содержать один или более чем один суспендирующий агент.
В некоторых воплощениях композиция будет содержать один или более чем один консервант.
В некоторых воплощениях композиция будет содержать один или более чем один увлажнитель.
В некоторых воплощениях композиция будет содержать один или более чем один агент, обеспечивающий изотоничность.
В некоторых воплощениях композиция будет содержать буфер.
В некоторых воплощениях композиция будет содержать один или более чем один агент, маскирующий вкус.
Будет понятно, что композиции по изобретению могут содержать один или более эксципиентов разных типов.
Согласно одному аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая:
(1) водную суспензию левокабастина или его соли;
(2) водную суспензию флутиказона фуроата;
(3) один или более чем один суспендирующий агент;
(4) один или более чем один консервант;
(5) один или более чем один увлажнитель;
(6) буфер;
(7) один или более чем один агент, обеспечивающий изотоничность; и, возможно,
(8) один или более чем один агент, маскирующий вкус.
В другом аспекте изобретения предложена фармацевтическая композиция, которая не содержит консервант.
Композиции по настоящему изобретению могут быть стабилизированы выбором подходящего pH. Типично pH будет подведен до уровня 3,0-8,0, в одном воплощении до уровня 6,0-8,0, например, около 7.
Примеры фармацевтически приемлемых веществ, которые можно использовать для регулирования pH композиции, если это требуется, включают соляную кислоту и/или гидроксид натрия. Также можно добавлять в композиции буферизующие вещества, такие как лимонную кислоту/натрия гидросульфат, боратный буфер, лимонную кислоту/цитратный буфер, фосфаты, такие как динатрия фосфат или мононатрия фосфат, натрия гидроортофосфат или динатрия гидрофосфат, трометамол или эквивалентные традиционные буферы для того, чтобы отрегулировать значение pH композиции. В одном воплощении буфер содержит фосфатный буфер, например, динатрия фосфат или мононатрия фосфат.
Водный компонент желательно представляет собой высококачественную воду, например, очищенную воду.
Каждый из активных фармацевтических ингредиентов (API)-флутиказона фуроат и левокабастин, подходящим образом, имеет среднемассовый диаметр (MMD) меньше, чем 20 мкм, в одном воплощении - 0,5-10 мкм, например, 1-5 мкм. При необходимости уменьшения размера частиц, это может достигаться, например, такими методиками, как микронизация и/или микрофлюидизация.
В одном воплощении MMD составляют 2-4 мкм.
В некоторых воплощениях, при необходимости, уменьшение размера частиц может достигаться микронизацией.
В других воплощениях уменьшение размера частиц может достигаться микрофлюидизацией.
В одном воплощении частицы будут кристаллическими, полученными, например, способом, включающим смешивание в ячейке с непрерывным током при ультразвуковом облучении протекающего раствора флутиказона фуроата или левокабастина в жидком растворителе с текущим жидким антирастворителем для указанного лекарственного средства (например, как описано в WO 00/38811).
В фармацевтических композициях по изобретению флутиказона фуроат может присутствовать в композиции в количестве от 0,005% до 1% (масс./масс.), в одном воплощении от 0,01% до 0,5% (масс./масс.), например, от 0,05 до 0,1% (масс./масс.) от общей массы композиции. Типично 50 мкл суспензии будет содержать 27,5 мкг флутиказона фуроата.
В фармацевтических композициях по изобретению левокабастин (соединение формулы (I)) или его соль могут присутствовать в композиции в количестве от 0,0005% до 2% (масс./масс.), в одном воплощении от 0,01% до 0,6% (масс./масс.), например, от 0,1 до 0,3% (масс./масс.) от общей массы композиции. Типично 50 мкл суспензии будет содержать 50 мкг левокабастина.
Примеры суспендирующих агентов включают целлюлозу, карбоксиметилцеллюлозу, вигум, трагакантовую камедь, бентонит, метилцеллюлозу, гипромеллозу и полиэтиленгликоли. В одном воплощении суспендирующим агентом будет микрокристаллическая целлюлоза и натрий-карбоксиметилцеллоза, например, используемые в виде брендированного продукта Avicel RC591 (который обычно содержит 87-91% микрокристаллической целлюлозы и 9-13% натрий-карбоксиметилцеллозы) или Avicel CL611. В одном воплощении микрокристаллическая целлюлоза в виде частиц имеет размер частиц в интервале от 1 до 100 мкм. Авторы изобретения считают, что Avicel RC591 действует в качестве суспендирующего агента, придавая композиции тиксотропные свойства, где композиция может стать стабильной суспензией при перемешивании, встряхивании или выведении из состояния покоя иным способом.
В некоторых воплощениях тиксотропная природа суспендирующего агента будет обеспечивать то, что композиция принимает гелеподобный вид в состоянии покоя, в которой по существу однородно диспергировано и суспендировано лекарственное средство в виде частиц, и характеризуется высоким значением вязкости. Как только композиция подвергается сдвигововым усилиям, таким как усилия, вызываемые встряхиванием перед распылением, вязкость композиции будет уменьшаться до такого уровня, чтобы сделать возможным ее легкий ток через распылитель аэрозоля и выход в виде спрея мелких частиц в форме тумана. Данные частицы затем будут иметь способность к проникновению на поверхности слизистой передних областей носа (фронтальных полостей носа), лобной пазухи, гайморовых пазух и носовых раковин, которые лежат над раковинами полостей носа. Сразу после внесения вязкость композиции будет возрастать до достаточного уровня для принятия ею гелеподобной формы и сопротивления выведения из носовых ходов собственными мукоцилиарными силами, которые присутствуют в полостях носа.
Когда композиция по настоящему изобретению содержит суспендирующий агент, его будут желательно добавлять в подходящем количестве для достижения данной функции. В некоторых воплощениях суспендирующий агент будет присутствовать в композиции в количестве от 0,1 до 5% (масс./масс.), например, 1,5% (масс./масс.) от общей массы композиции.
В целях стабильности композицию по настоящему изобретению можно защищать от микробного загрязнения и роста посредством включения консерванта. Примеры фармацевтически приемлемых противомикробных агентов или консервантов, которые можно использовать в данной композиции, включают соединения четвертичного аммония (например, бензалкония хлорид, бензэтония хлорид, цетримид, цетилпиридиния хлорид и миристилпиколиния хлорид), спиртовые агенты (например, хлорбутанол, фенилэтиловый спирт и бензиловый спирт), антибактериальные сложные эфиры (например, сложные эфиры пара-гидроксибензойной кислоты), хелатирующие агенты, такие как динатрия эдетат (EDTA), и другие противомикробные агенты, такие как хлоргексидин (например, в форме ацетата или глюконата), сорбат калия, хлоркрезол, сорбиновая кислота и ее соли, полимиксин, метилпарабен и пропилпарабен.
В некоторых воплощениях консервант может содержать динатрия эдетат (EDTA), который может присутствовать в композиции в количестве от 0,001 до 1% (масс./масс.), например, примерно 0,015% (масс./масс.) от общей массы композиции.
В некоторых воплощениях консервант может содержать бензалкония хлорид (ВKC), который может присутствовать в композиции в количестве от 0,001 до 1% (масс./масс.), например, примерно 0,015% (масс./масс.) от общей массы композиции.
В некоторых воплощениях консервант может содержать динатрия эдетат и бензалкония хлорид или динатрия эдетат и калия сорбат, в одном воплощении хлорид калия и/или динатрия эдетат. В другом воплощении консервант содержит динатрия эдетат и бензалкония хлорид.
Композиции, например, назальные композиции, которые содержат суспендированное лекарственное средство, могут содержать фармацевтически приемлемый увлажнитель, функцией которого является увлажнение частиц лекарственного средства для облегчения их диспергирования в водной фазе композиции. Желательно, чтобы количество используемого увлажнителя не вызывало вспенивания дисперсии во время перемешивания.
Будет понятно, что можно использовать любой агент, который является эффективным в увлажнении частиц, и который является фармацевтически приемлемым. Примерами увлажнителей, которые можно использовать, являются жирные спирты, сложные эфиры и простые эфиры. В одном воплощении увлажнитель представляет собой гидрофильное неионное поверхностно-активное вещество, например, полиоксиэтилен (20) сорбитан моноолеат (поставляемый в виде брендированного продукта полисорбата 80).
Когда композиция по настоящему изобретению содержит увлажнитель, для достижения этой функции его желательно будут добавлять в достаточном количестве. В одном воплощении увлажнитель может присутствовать в композиции в количестве от 0,001 до 0,05% (масс./масс.), например, 0,025% (масс./масс.) от общей массы композиции.
Присутствие агента, обеспечивающего изотоничность, необходимо для достижения изотоничности с жидкостями организма, например, жидкостями полости носа, что приводит к пониженным уровням раздражения, ассоциированного со многими назальными композициями. Примерами подходящих агентов, обеспечивающих изотоничность, являются глюкоза, глицерин, сорбит, хлорид натрия, декстроза и хлорид кальция. В одном воплощении агентом, обеспечивающим изотоничность, может быть декстроза, например, безводная декстроза.
Когда композиция по настоящему изобретению содержит агент, обеспечивающий изотоничность, его желательно будут добавлять в достаточном количестве для достижения данной функции, в одном воплощении агент, обеспечивающий изотоничность, будет присутствовать в композиции в количестве от 0,1 до 10% (масс./масс.), например, 5,0% масс./масс., от общей массы композиции.
Дополнительными вспомогательными веществами, которые, например, можно использовать для композиций по изобретению, являются поливинилпирролидон, сложные эфиры сорбитана с жирными кислотами, такие как сорбитантриолеат, сложный эфир полиэтоксилированного сорбитана с жирными кислотами (например, полиэтоксилированный сорбитантриолеат), сорбимакрогололеат, синтетические амфотензиды (тритоны), этиленоксидные эфиры продуктов конденсации октилфенолформальдегида, фосфатиды, такие как лецитин, полиэтоксилированные жиры, полиэтоксилированные олеотриглицериды и полиэтоксилированные жирные спирты. В данном контексте термин «полиэтоксилированный» означает то, что релевантные вещества содержат цепи полиоксиэтилена, степень полимеризации которых обычно составляет от 2 до 40, в частности, от 10 до 20. Данные вещества обычно используют для улучшения растворимости левокабастинового компонента.
Композиции по настоящему изобретению также могут содержать дополнительные эксципиенты и/или носители, которые уменьшают количество постназального капельного вливания в глотку и/или минимизируют или маскируют горький вкус.
Примеры агентов, маскирующих вкус, включают сукралозу, сахарозу, сахарин или его соль, фруктозу, декстрозу, кукурузный сироп, аспартам, ацесульфам-K, ксилит, сорбит, эритрит, аммония глицирризинат, травматин, неотам, маннит, ментол, эвкалиптовое масло, камфору, природный корригент, искусственный корригент и их комбинации. В одном воплощении агент, маскирующий вкус, представляет собой сукралозу и/или ментол.
Фармацевтическая композиция согласно данному изобретению может дополнительно содержать один или более чем один эксципиент. Подразумевается, что термин «эксципиент» в том виде, как он здесь используется, означает по существу инертные вещества, которые являются нетоксичными и не взаимодействуют с другими компонентами композиции вредным образом, включая, следующие вещества фармацевтической степени чистоты: углеводы, органические и неорганические соли, полимеры, аминокислоты, фосфолипиды, увлажнители, эмульгаторы, поверхностно-активные вещества, полоксамеры, плюроники, ионообменные смолы и их комбинации, но не ограничиваясь ими, неисчерпывающий список примеров которых приведен ниже:
Углеводы, включающие: моносахариды, такие как фруктоза, но не ограничиваясь ей; дисахариды, такие как лактоза и ее комбинации и производные, но не ограничиваясь ими; полисахариды, такие как целлюлоза и ее комбинации и производные, но не ограничиваясь ими; олигосахариды, такие как декстрины и их комбинации и производные, но не ограничивающиеся ими; полиолы, такие как сорбит и его комбинации и производные, но не ограничивающиеся ими;
Органические и неорганические соли, включающие фосфаты натрия или кальция, стеарат магния и их комбинации и производные, но не ограничиваясь ими;
Полимеры, включающие природные биодеградируемые белковые полимеры, включая желатин и его комбинации и производные, но не ограничиваясь ими;
Природные биодеградируемые полисахаридные полимеры, включающие хитин и крахмал, поперечносшитый крахмал и их комбинации и производные, но не ограничиваясь ими;
Полусинтетические биодеградируемые полимеры, включающие производные хитозана, но не ограничиваясь ими;
Синтетические биодеградируемые полимеры, включающие полиэтиленгликоли (PEG), полимолочную кислоту (PLA), синтетические полимеры, включая поливиниловый спирт, и их комбинации и производные, но не ограничиваясь ими;
Аминокислоты, включающие неполярные аминокислоты, такие как лейцин и его комбинации и производные, но не ограничиваясь ими;
Фосфолипиды, включающие лецитины и их комбинации и производные;
Увлажнители/поверхностно-активные вещества/эмульгаторы, включающие аравийскую камедь, холестерин, жирные кислоты, включая их комбинации и производные, но не ограничиваясь ими;
Полоксамеры/плюроники, включающие полоксамер 188, Pluronic® F-108 и их комбинации и производные, но не ограничиваясь ими;
Ионообменные смолы, включающие амберлит IR120 и его комбинации и производные, но не ограничиваясь ими;
а также комбинации указанных эксципиентов.
В фармацевтической композиции по изобретению в одном воплощении суспендирующий агент представляет собой микрокристаллическую целлюлозу и натрий-карбоксиметилцеллюлозу, консервант представляет собой EDTA и сорбат калия, увлажнитель представляет собой полиоксиэтилен (20) сорбитан моноолеат, и агент, обеспечивающий изотоничность, представляет собой декстрозу и/или глюкозу. В другом воплощении суспендирующий агент представляет собой микрокристаллическую целлюлозу и натрий-карбоксиметилцеллюлозу, консервант представляет собой EDTA и бензалкония хлорид, увлажнитель представляет собой полиоксиэтилен (20) сорбитан моноолеат, и агент, обеспечивающий изотоничность, представляет собой декстрозу.
Предпочтительным способом для введения композиции по настоящему изобретению в носовые ходы является применение насоса с предварительным сжатием, такого как VP3, VP7 или модификаций, модели, изготовляемой Valois SA. Преимущества насосов этого типа являются полезными, так как они будут обеспечивать то, что композиция не высвобождается или распыляется до приложения достаточной силы, в противном случае могут наноситься меньшие дозы. Типично данные насосы с предварительным сжатием можно использовать с бутылью (стеклянной или пластмассовой), способной вмещать 8-50 мл композиции. Каждый спрей будет типично доставлять 50-100 мкл такой композиции, следовательно, данное устройство способно обеспечивать по меньшей мере 100 отмеренных доз. Подходящим образом, композиция будет дозироваться из сосуда, оснащенного подходящим насосом с предварительным сжатием и назальным мундштуком, приспособленными для дозирования 50 или 100 мкл на срабатывание, предпочтительно 50 мкл. Следовательно, предложено устройство, приспособленное для интраназальной доставки фармацевтической композиции, содержащей фармацевтическую композицию по настоящему изобретению.
Подходящей схемой дозировки для композиции по настоящему изобретению, при введении в нос, была бы медленная ингаляция пациентом через нос после очистки полости носа. Во время ингаляции композиция наносилась бы в одну ноздрю, в то время как другую зажимают вручную. Данная процедура затем была бы повторена для другой ноздри.
Обычно посредством приведенной выше процедуры вводили бы одну или две ингаляции в ноздрю вплоть до трех раз каждые сутки, возможно дважды в сутки, идеально один раз в сутки. В одном воплощении композицию по настоящему изобретению вводят в нос посредством одной или двух ингаляций в каждую ноздрю один раз в сутки.
Будет понятно, что приведенную выше схему дозировки следует скорректировать согласно возрасту, массе тела пациента и/или тяжести симптомов.
Композиции по настоящему изобретению имеют потенциально полезные противовоспалительные или противоаллергические эффекты, в частности при местном введении в нос. Следовательно, композиции согласно данному изобретению являются полезными в лечении воспалительных и/или аллергических расстройств носа, в особенности при терапии один раз в сутки.
Композиции согласно данному изобретению можно получать объединением ингредиентов в воде. При необходимости на последней стадии можно регулировать pH. Приготовленными таким способом композициями можно затем заполнять резервуар.
Водные композиции по изобретению также можно использовать для ректального, ушного, перорального, местного или парентерального введения или введения посредством ингаляции для лечения других местных воспалительных состояний (например, дерматита, астмы, хронической обструктивной болезни легких (COPD) и тому подобного). Например, композиции по изобретению можно вводить в легкое посредством распыления.
В таких композициях могут использоваться эксципиенты (например, консерванты, буферы и тому подобное), подходящие для пути введения.
Примеры болезненных состояний, при которых полезна композиция по настоящему изобретению, включают воспалительные и/или аллергические состояния носовых ходов, такие как ринит, например, сезонный и круглогодичный ринит. Специалистам в данной области будет понятно, что приведенная здесь ссылка на лечение распространяется на профилактику, а также на лечение установившихся состояний.
Как упомянуто выше, композиции по настоящему изобретению являются полезными в медицине, в частности, в качестве противовоспалительного и противоаллергического агента.
Таким образом, в качестве другого аспекта изобретения предложена фармацевтическая композиция, содержащая левокабастин или его соль и флутиказона фуроат для применения в медицине, в частности в лечении пациентов с воспалительным и/или аллергическим состоянием. В одном воплощении лечение осуществляется один раз в сутки.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая левокабастин или его соль и флутиказона фуроат, для применения в лечении пациентов с аллергическим ринитом, например, сезонным аллергическим ринитом или круглогодичным аллергическим ринитом. В одном воплощении лечение осуществляется один раз в сутки.
Согласно другому аспекту изобретения предложено применение композиции, содержащей левокабастин или его соль и флутиказона фуроат, для изготовления лекарственного средства для лечения пациентов с воспалительным и/или аллергическим состоянием. В одном воплощении лечение осуществляется один раз в сутки.
Согласно другому аспекту изобретения предложено применение композиции, содержащей левокабастин или его соль и флутиказона фуроат, для изготовления лекарственного средства для лечения пациентов с аллергическим ринитом, например, сезонным аллергическим ринитом или круглогодичным аллергическим ринитом. В одном воплощении лечение осуществляется один раз в сутки.
В дополнительном или альтернативном аспекте предложен способ лечения человеческого или животного субъекта с воспалительным и/или аллергическим состоянием, включающий введение указанному человеческому или животному субъекту эффективного количества композиции, содержащей левокабастин или его соль и флутиказона фуроат. В одном воплощении лечение осуществляется один раз в сутки.
В альтернативном аспекте предложен способ лечения аллергического ринита, например, сезонного аллергического ринита или круглогодичного аллергического ринита, включающий введение пациенту фармацевтически приемлемого количества фармацевтической композиции, содержащей левокабастин или его соль и флутиказона фуроат. В одном воплощении введение осуществляется один раз в сутки.
Композиции по настоящему изобретению могут быть композициями длительного действия, следовательно, данную композицию можно вводить один раз в сутки, и дозу можно выбирать так, чтобы соединения имели терапевтический эффект при лечении респираторных расстройств (например, ринита) на протяжении 24 часов или более.
Левокабастин и его соли, в частности гидрохлорид, и флутиказона фуроат являются известными, имеющимися в продаже соединениями. Способы получения данных соединений хорошо известны в данной области, например, из ЕР 034415 и WO 02/12265.
Во всем описании и формуле изобретения, которые следуют ниже, если контекст не требует иного, будет понятно, что слово «содержать» и вариации, такие как «содержит» и «содержащий», подразумевают включение заявленного целого числа или стадии, или группы целых чисел, но не исключение какого-либо другого целого числа или стадии, или группы целых чисел, или стадий.
Следующие неограничивающие примеры иллюстрируют данное изобретение:
ПРИМЕРЫ
Пример 1: Назальная композиция, содержащая флутиказона фуроат и левокабастина гидрохлорид
Композицию для интраназальной доставки можно получать со следующими ингредиентами:
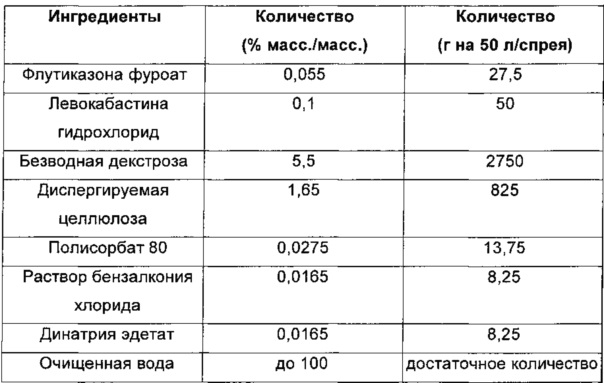
При необходимости можно добавлять соляную кислоту или гидроксид натрия для корректировки pH до 6-8.
Пример 2: Способ получения композиции из Примера 1
Композицию можно получать согласно следующей блок-схеме:
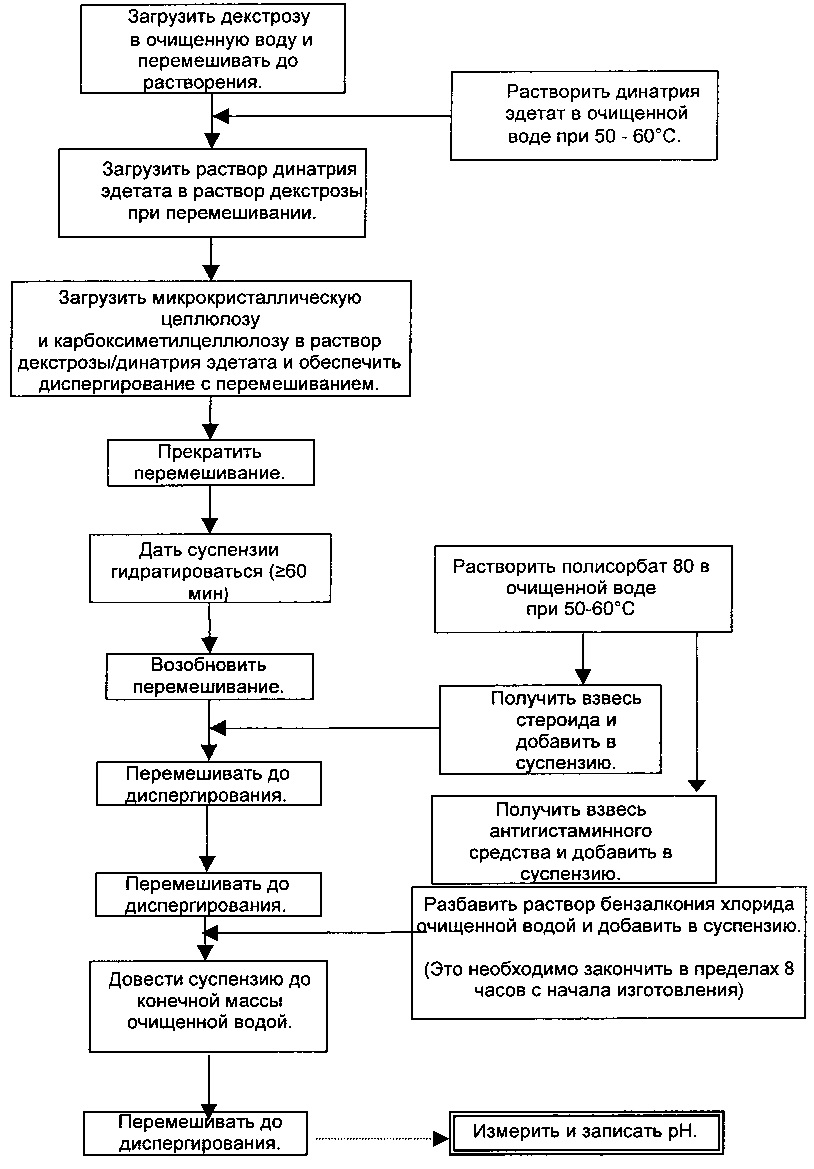
Обнаружили, что HCl соль левокабастина превращается на протяжении получения композиций по изобретению (например, как описано в Примерах 1 и 2) до свободного основания левокабастина. Формы 1 и 2 свободного основания левокабастина наблюдали во время скрининга формы HCl соли и на протяжении исследований растворимости в зависимости от pH. Проведенные эксперименты по конкурентноспособному созреванию свидетельствуют о том, что Форма 1 левокабастина является самой стабильной формой свободного основания. Неожиданно то, что формой свободного основания в конечной композиции, подтвержденной 19F твердотельным ядерным магнитным резонансом (ssNMR), была Форма 3.
Следующее дает информацию по наблюдаемым формам свободного основания левокабастина.
Получение полиморфных форм свободного основания левокабастина
Форма 1 свободного основания левокабастина
Суспензию левокабастина HCl (1,0 г) добавляли в реактор и смешивали со 100 мл 4 мМ натрий-фосфатного буфера (pH 7,5). Данную суспензию титровали 1,0 н. NaOH до доведения pH до значения примерно 7. Затем суспензию нагревали до 60°C и перемешивали в течение ночи. Твердые вещества выделяли вакуумной фильтрацией.
Форма 2 свободного основания левокабастина
Суспензию левокабастина HCl (1,0 г) добавляли в реактор и смешивали со 100 мл 4 мМ натрий-фосфатного буфера (pH 7,5). Данную суспензию титровали 1,0 н. NaOH для доведения pH до значения примерно 7. Твердые вещества выделяли вакуумной фильтрацией при 20°C.
Форма 3 свободного основания левокабастина
Форму 3 получали двумя способами.
Получение №1: левокабастин HCl без затравки (100 мг) растворяли в 5 мл метанола при примерно 40°С. В этот раствор добавляли 2,2 мл 0,1 М NaOH при примерно 30°С. Кристаллизацию наблюдали после добавления примерно 1 мл раствора NaOH. Образующийся раствор медленно добавляли, пока кристаллизация не была завершена. Вещество фильтровали и помещали в сосуд для определения характеристик.
Получение №2: левокабастин HCl с затравкой (2,5 г; 5,47 ммоль) и метанол (125 мл) добавляли в реактор и нагревали до 60°C для растворения всех твердых веществ. Добавляли в смесь затравку в виде препарата 1 и обнаруживали твердые вещества. Добавляли остающийся 0,1 н. NaOH посредством капельной воронки на протяжении 30 мин при 60°C. Охлаждали до 20°C в течение 4 ч и выдерживали в течение ночи. Твердые вещества выделяли вакуумной фильтрацией и сушили на воронке в течение 2 ч. Данную партию дополнительно сушили вакуумной фильтрацией при 40°C под вакуумом в течение 4 часов. Вещество выделяли в виде сухих веществ (2,1 г).
Дифракция рентгеновских лучей на порошке (XRPD)
Данные дифракции рентгеновских лучей на порошке (XRPD) полиморфных форм левокабастина получали на порошковом дифрактометре PANalytical X'Pert Pro, модель PW3040 Pro, с использованием детектора X'Celerator. Условия сбора данных были следующие: излучение: Cu Kα, напряжение генератора: 45 кВ, сила тока генератора: 40 мА; величина шага: 0,017° 2θ; время на шаг: 500 секунд; оптика падающего пучка: оптика зеркала - Cu W/Si (фокусирующий MPD), фиксированная на 1/2 градуса щель расходимости, 0,02 радианные щели Соллера; оптика дифрагирующего пучка: программируемый модуль противорассеивающей щели (модуль X'Celerator) с установленной на фиксированные 1/4 градуса противорассеивающей щелью, 0,02 радианные щели Соллера, температура измерения: 20-25°C. Образец получали путем упаковки в 1 мм капилляр. Положения пиков получали с использованием программы PANalytical X'Pert Highscore Plus. Для каждого пика граница ошибки составляет приблизительно плюс/минус 0,1° 2θ.
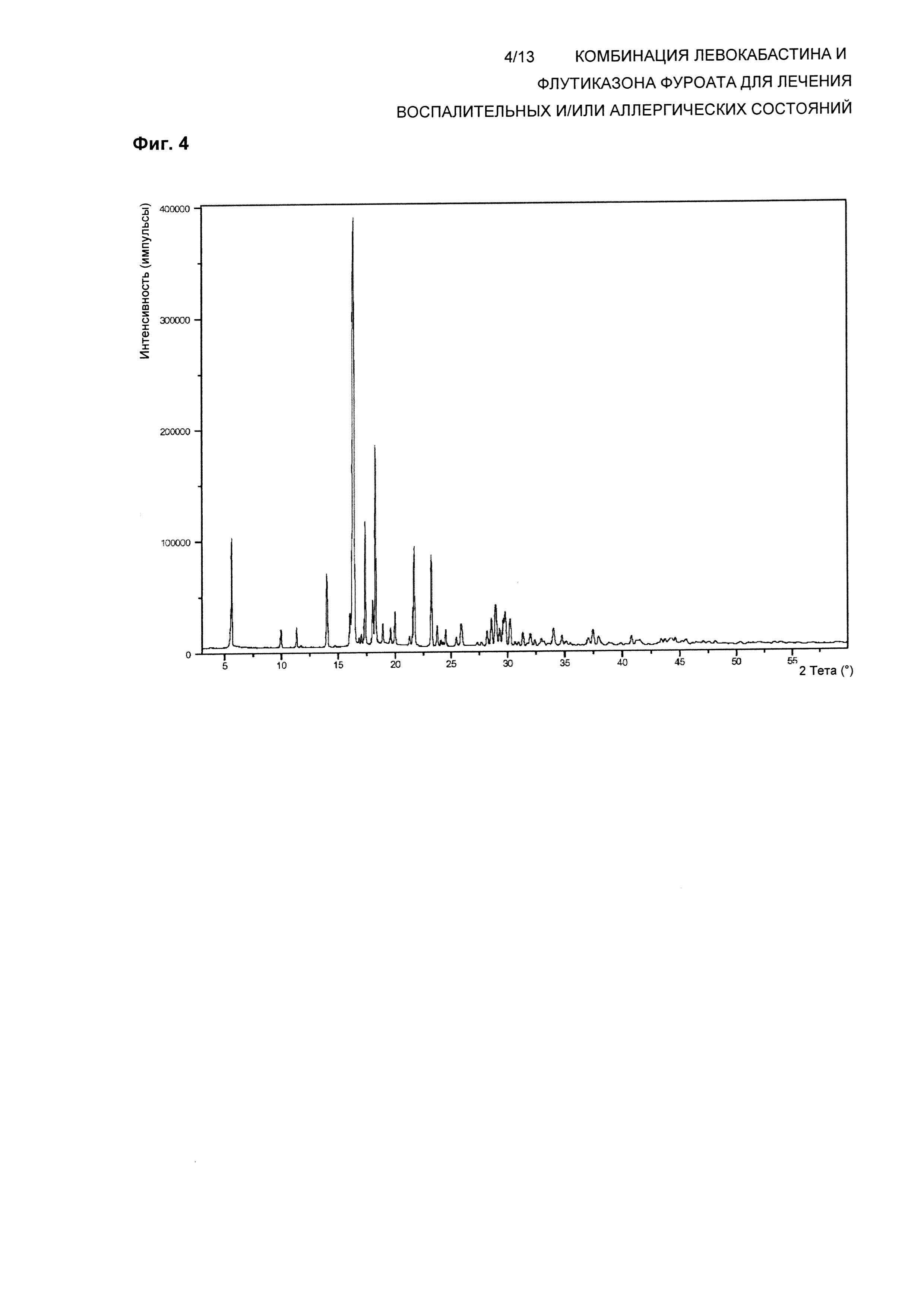
На Фиг. 4 показана XRPD Формы 1 кристаллического ангидрида левокабастина. В одном воплощении композиция по настоящему изобретению обеспечивает левокабастин в полиморфной Форме 1, которая демонстрирует картину дифракции рентгеновских лучей на прошке (XRPD), имеющую характеристические пики, выраженные в градусах 2θ, при примерно 5,6; 14,0; 16,3; 16,4; 17,4; 18,0; 18,3; 21,7; 23,2°±0,1.
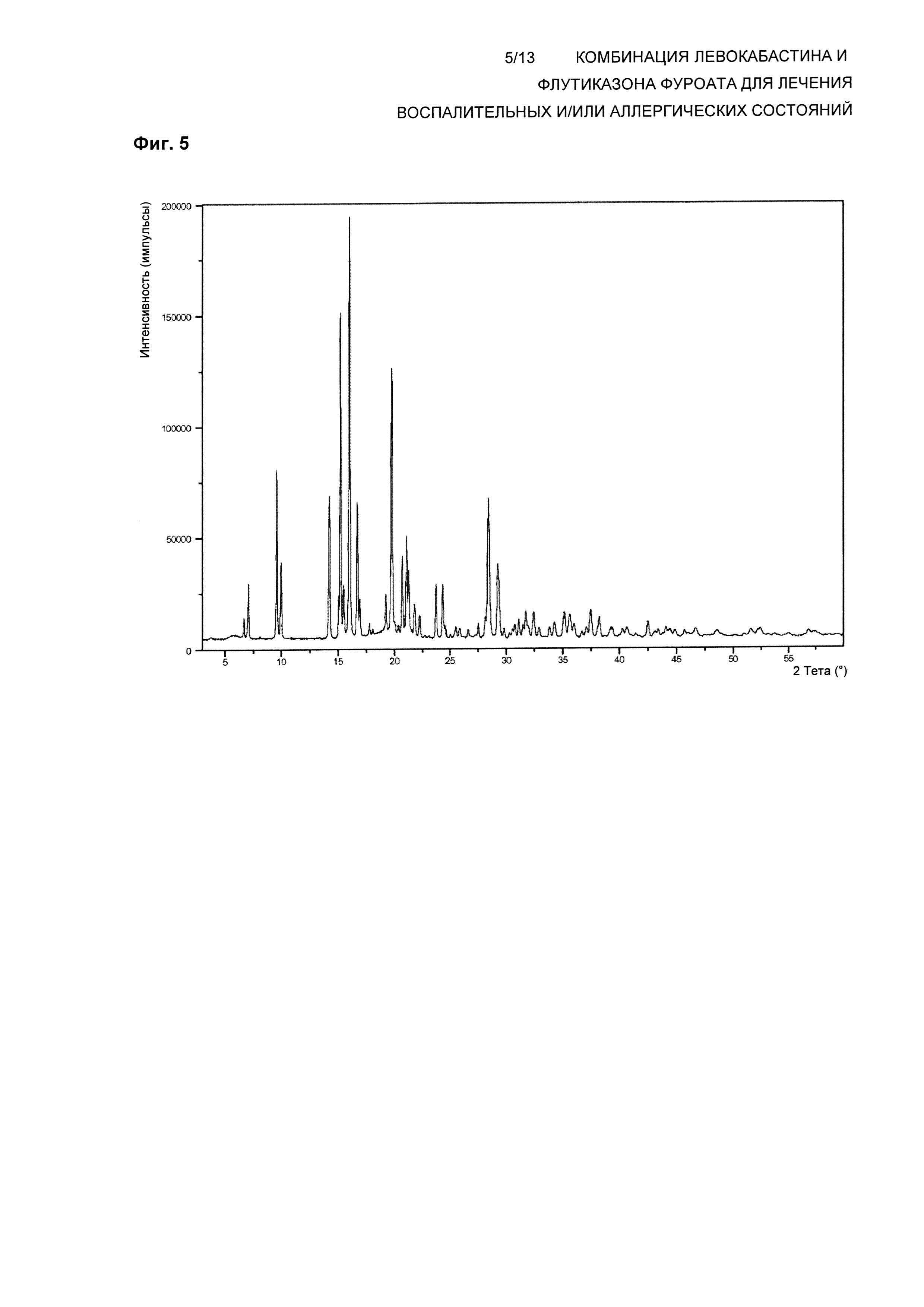
На Фиг. 5 показана XRPD Формы 2 кристаллического ангидрида левокабастина. В одном воплощении композиция по настоящему изобретению обеспечивает левокабастин в полиморфной Форме 2, которая демонстрирует картину дифракции рентгеновских лучей на прошке (XRPD), имеющую характеристические пики, выраженные в градусах 2θ, при примерно 6,7; 7,1; 9,6; 10,0; 14,2; 15,2; 16,0; 16,7; 19,8; 21,1; 28,4°±0,1.
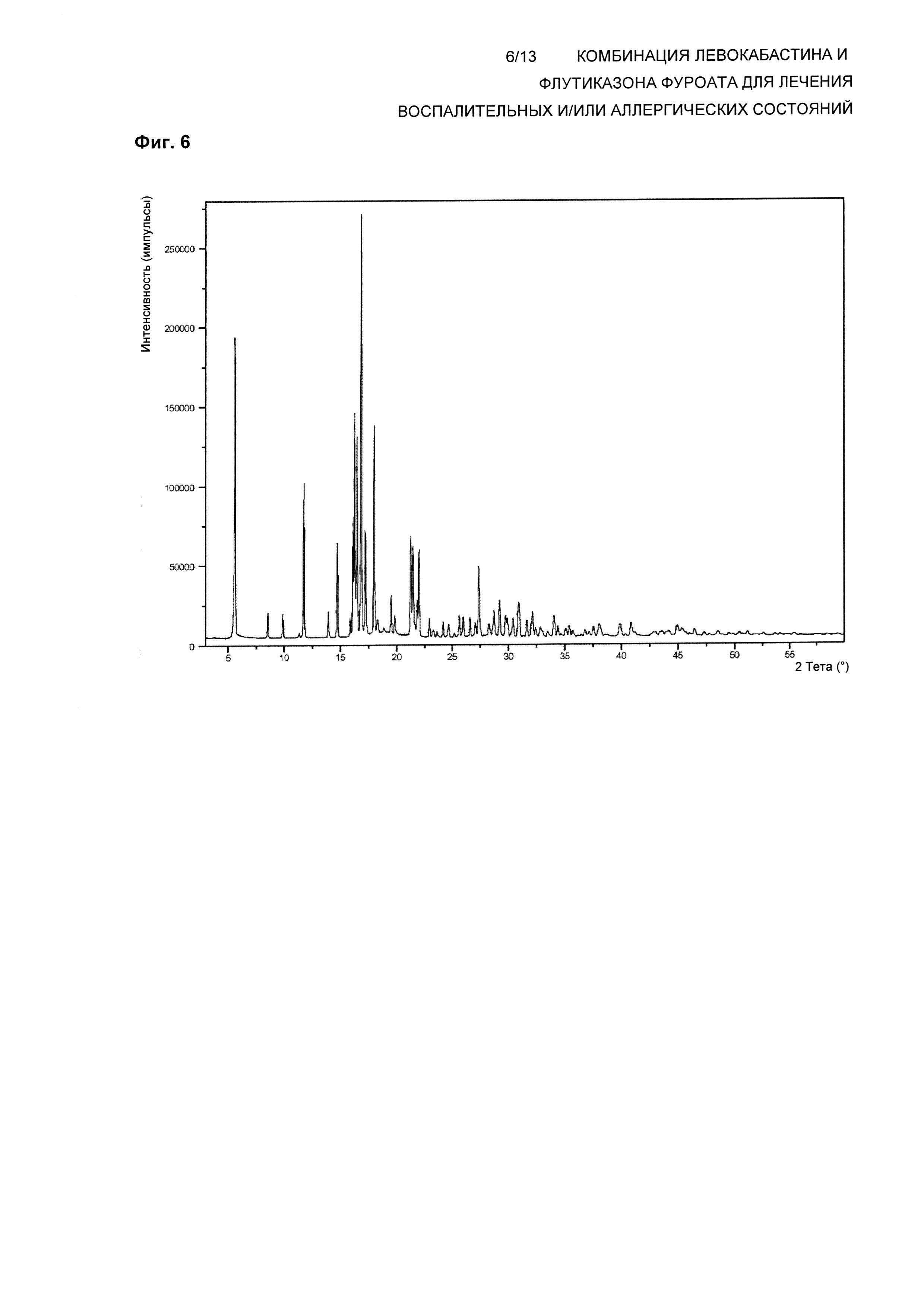
На Фиг. 6 показана XRPD Формы 3 кристаллического ангидрида левокабастина. В одном воплощении композиция по настоящему изобретению обеспечивает левокабастин в полиморфной Форме 3, которая демонстрирует картину дифракции рентгеновских лучей на прошке (XRPD), имеющую характеристические пики, выраженные в градусах 2θ, при примерно 5,6; 8,6; 9,9; 11,7; 14,7; 16,1; 16,3; 16,5; 16,8; 17,2; 18,0; 21,3; 21,5; 22,0; 27,3°±0,1.
Твердотельный NMR (ssNMR)
Данные 13С и 19F твердотельного NMR, представленные на Фиг. 7-13, получали с использованием спектрометра с тройным резонансом Bruker Avance 500, работающего при частоте 1Н 499,98 МГц. Показанные спектры 13С ssNMR были получены с помощью последовательности импульсов с поперечной поляризацией при использовании 4 мм вращающегося под магическим углом зонда для тройного резонанса Bruker с частотой ротора 8 кГц. Для увеличения эффективности поперечной поляризации на канале 1Н использовали линейное изменение мощности от 75 до 90 кГц. Побочные полосы, возникающие в результате вращения, устраняли пятиимпульсной последовательностью импульсов общего подавления побочных полос. Расщепление 1Н получали с использованием последовательности Spinal-64. Показанные спектры 19F ssNMR получали с помощью последовательности импульсов с поперечной поляризацией при использовании 4 мм вращающегося под магическим углом зонда для тройного резонанса Bruker при частоте ротора 12,5 или 13,0 кГц. Характеристические положения пиков 13С и 19F NMR приведены относительно тетраметилсилана, имеющего 0 млн-1 (частей на миллион), и приводятся с точностью плюс/минус 0,2 млн-1 из-за нестабильности показаний установки и калибровки.
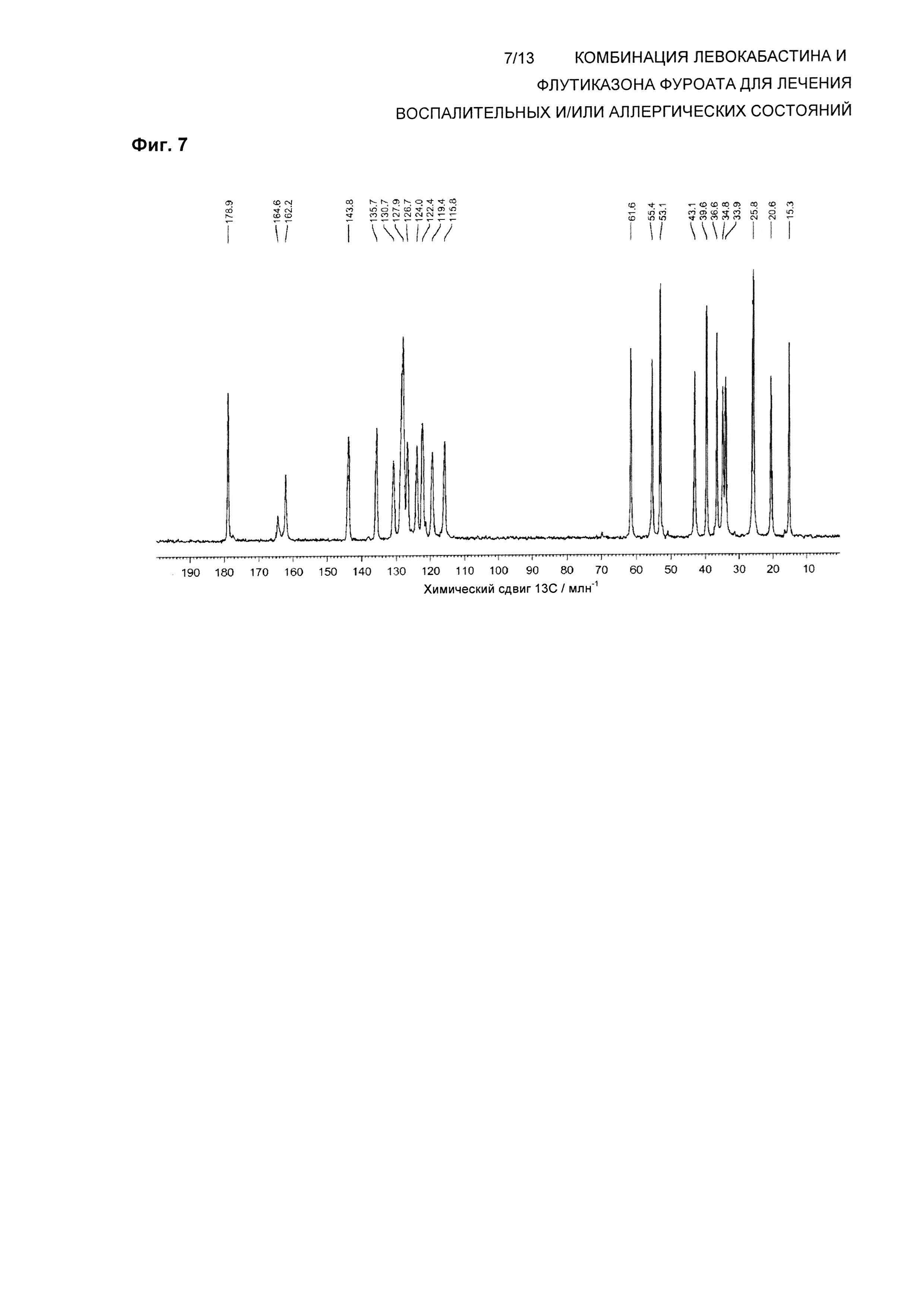
На Фиг. 7 показан спектр 13С твердотельного NMR (ssNMR) левокабастина в Форме 1 кристаллического ангидрида. Спектр твердотельного NMR получали на спектрометре, работающем при частоте 125,73 МГц для наблюдения 13С и со скоростью вращения 8 кГц, согласно описанной здесь методике. Пики малой интенсивности являются результатом малого количества Формы 3, присутствующей в тестируемой партии.
В одном воплощении композиция по настоящему изобретению обеспечивает левокабастин в Форме 1 кристаллического ангидрида, характеризующейся по существу таким же спектром 13С твердотельного ядерного магнитного резонанса (ssNMR), что и на Фиг. 7, где спектр ssNMR был получен на спектрометре, работающем при частоте 125,73 МГц для наблюдения 13С с помощью последовательности импульсов с поперечной поляризацией при использовании 4 мм вращающегося под магическим углом зонда для тройного резонанса Bruker при частоте ротора 8 кГц.
В другом воплощении композиция по настоящему изобретению обеспечивает левокабастин в Форме 1 кристаллического ангидрида, характеризующейся спектром 13С ssNMR, содержащим химические сдвиги при 178,9±0,2, 164,6±0,2, 162,2±0,2, 143,8±0,2, 135,7±0,2, 130,7±0,2, 127,9±0,2, 126,7±0,2, 124,0±0,2, 122,4±0,2, 119,4±0,2, 115,8±0,2, 61,6±0,2, 55,4±0,2, 53,1±0,2, 43,1±0,2, 39,6±0,2, 36,6±0,2, 34,8±0,2, 33,9±0,2, 25,8±0,2, 20,6±0,2 и 15,3±0,2 млн-1.
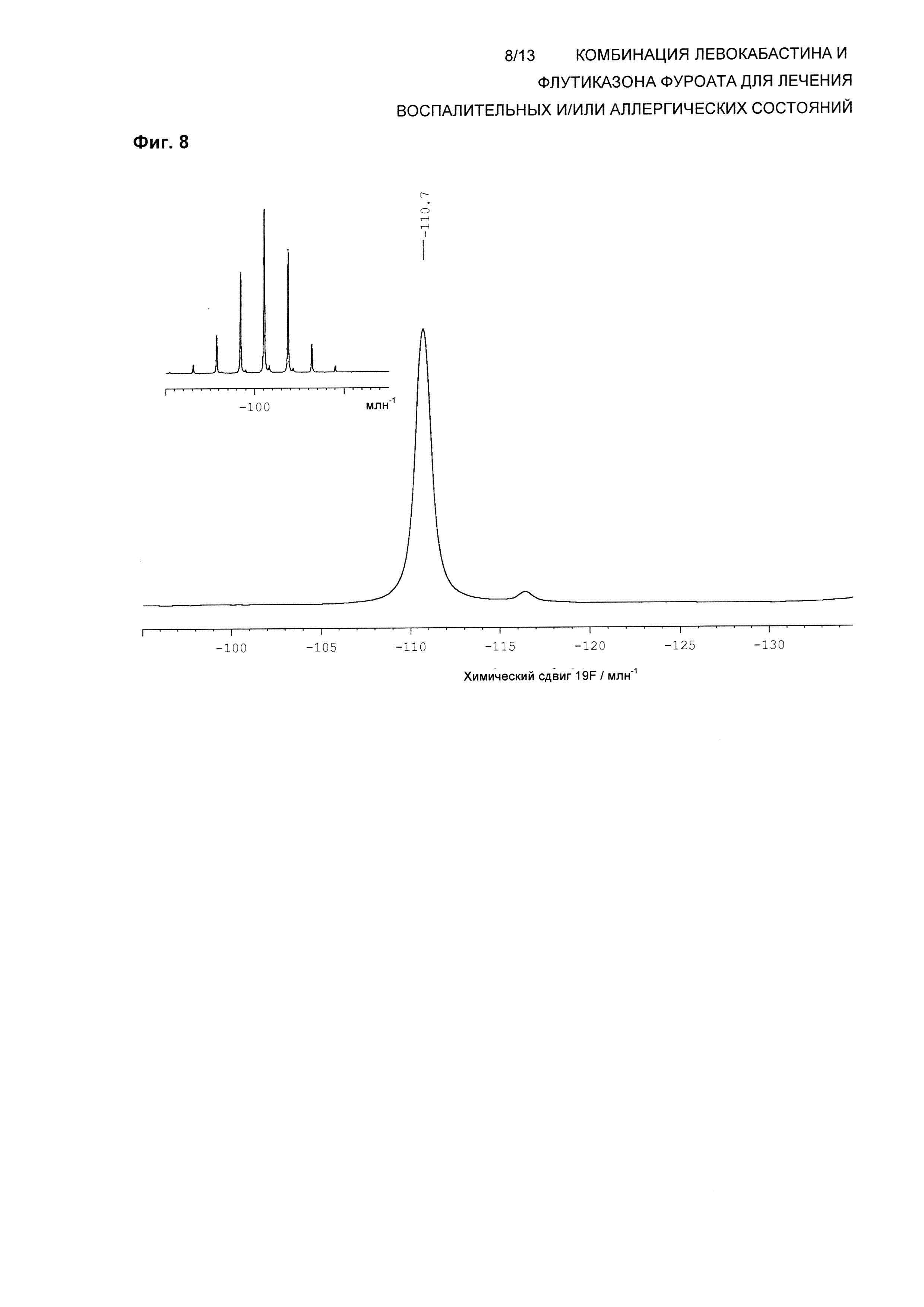
На Фиг. 8 показана изотропная область спектра 19F твердотельного NMR (ssNMR) левокабастина в Форме 1 кристаллического ангидрата. Также приведен (вставка) полный спектр вращения под магическим углом. Спектр твердотельного NMR получали на спектрометре, работающем при частоте 470,40 МГц, для наблюдения 19F и скорости вращения 12,5 кГц, согласно описанной здесь методике. Резонанс 19F при -116,5 млн-1 представляет собой малое количество Формы 3, присутствующее в тестируемой партии.
В одном воплощении композиция по настоящему изобретению обеспечивает левокабастин в Форме 1 кристаллического ангидрата, характеризующийся по существу таким же спектром 19F твердотельного ядерного магнитного резонанса (ssNMR), что и на Фиг. 8, где спектр ssNMR был получен на спектрометре, работающем при частоте 470,40 МГц, для наблюдения 19F с помощью последовательности импульсов с поперечной поляризацией при использовании 4 мм вращающегося под магическим углом зонда для тройного резонанса Bruker при частоте ротора 12,5 кГц.
В другом воплощении композиция по настоящему изобретению дает левокабастин в Форме 1 кристаллического ангидрида, характеризующейся спектром 19F ssNMR, содержащим изотропные химические сдвиги при -110,7±0,2 млн-1.
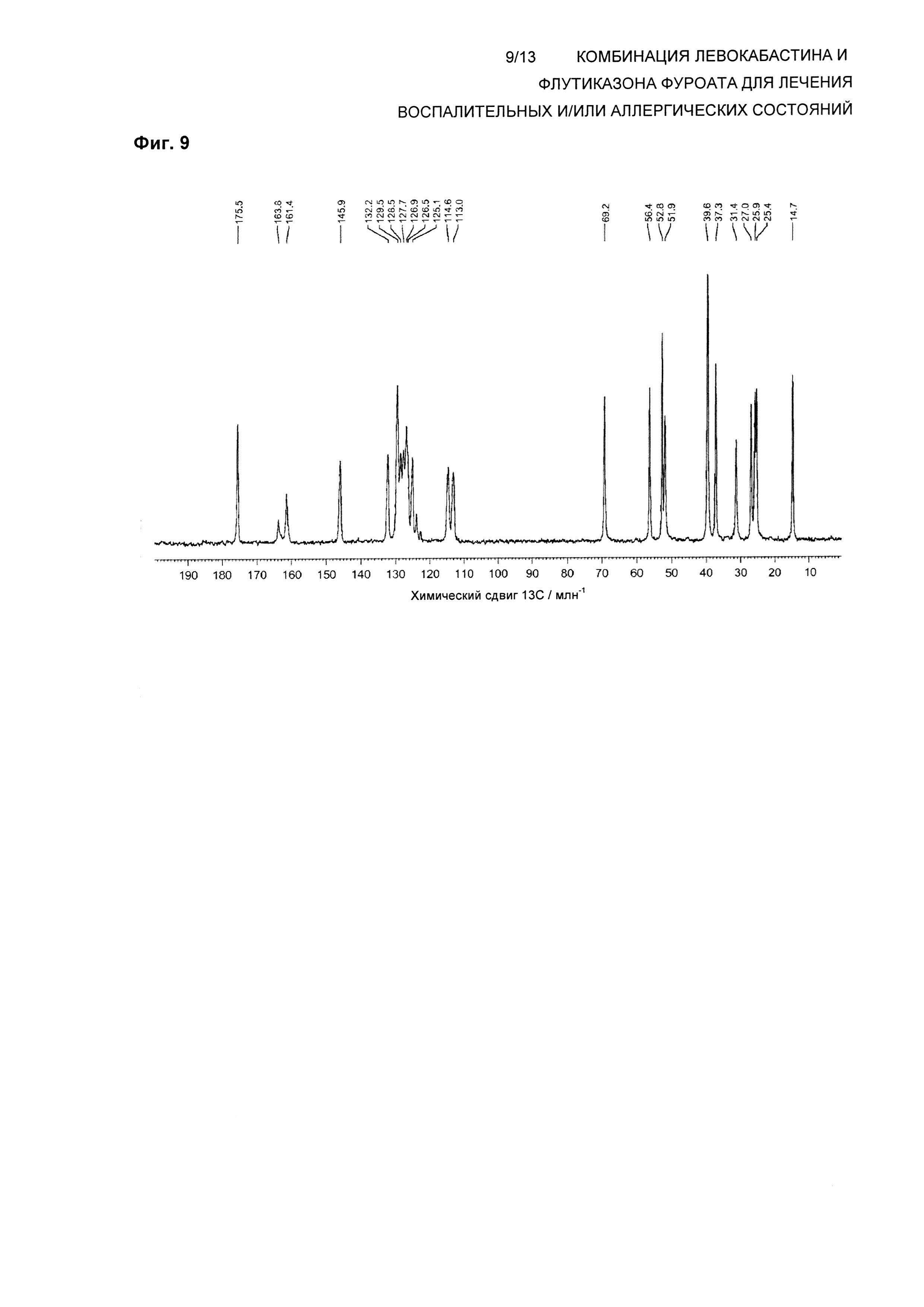
На Фиг. 9 показан спектр 13С твердотельного NMR (ssNMR) левокабастина в Форме 2 кристаллического ангидрида. Спектр твердотельного NMR получали на спектрометре, работающем при частоте 125,73 МГц, для наблюдения 13С и со скоростью вращения 8 кГц, согласно описанной здесь методике.
В одном воплощении композиция по настоящему изобретению обеспечивает левокабастин в Форме 2 кристаллического ангидрида, характеризующейся по существу таким же спектром 13С твердотельного ядерного магнитного резонанса (ssNMR), что и на Фиг. 9, где спектр ssNMR был получен на спектрометре, работающем при частоте 125,73 МГц для наблюдения 13С с помощью последовательности импульсов с поперечной поляризацией при использовании 4 мм вращающегося под магическим углом зонда для тройного резонанса Bruker при частоте ротора 8 кГц.
В другом воплощении композиция по настоящему изобретению обеспечивает левокабастин в Форме 2 кристаллического ангидрида, характеризующейся спектром 13С ssNMR, содержащим химические сдвиги при 175,5±0,2, 163,8±0,2, 161,4±0,2, 145,9±0,2, 132,2±0,2, 129,5±0,2, 128,5±0,2, 127,7±0,2, 126,9±0,2, 125,1±0,2, 114,6±0,2, 113,0±0,2, 69,2±0,2, 56,4±0,2, 52,8±0,2, 51,9±0,2, 39,6±0,2, 37,3±0,2, 31,4±0,2, 27,0±0,2, 25,9±0,2, 25,4±0,2 и 14,7±0,2 млн-1.
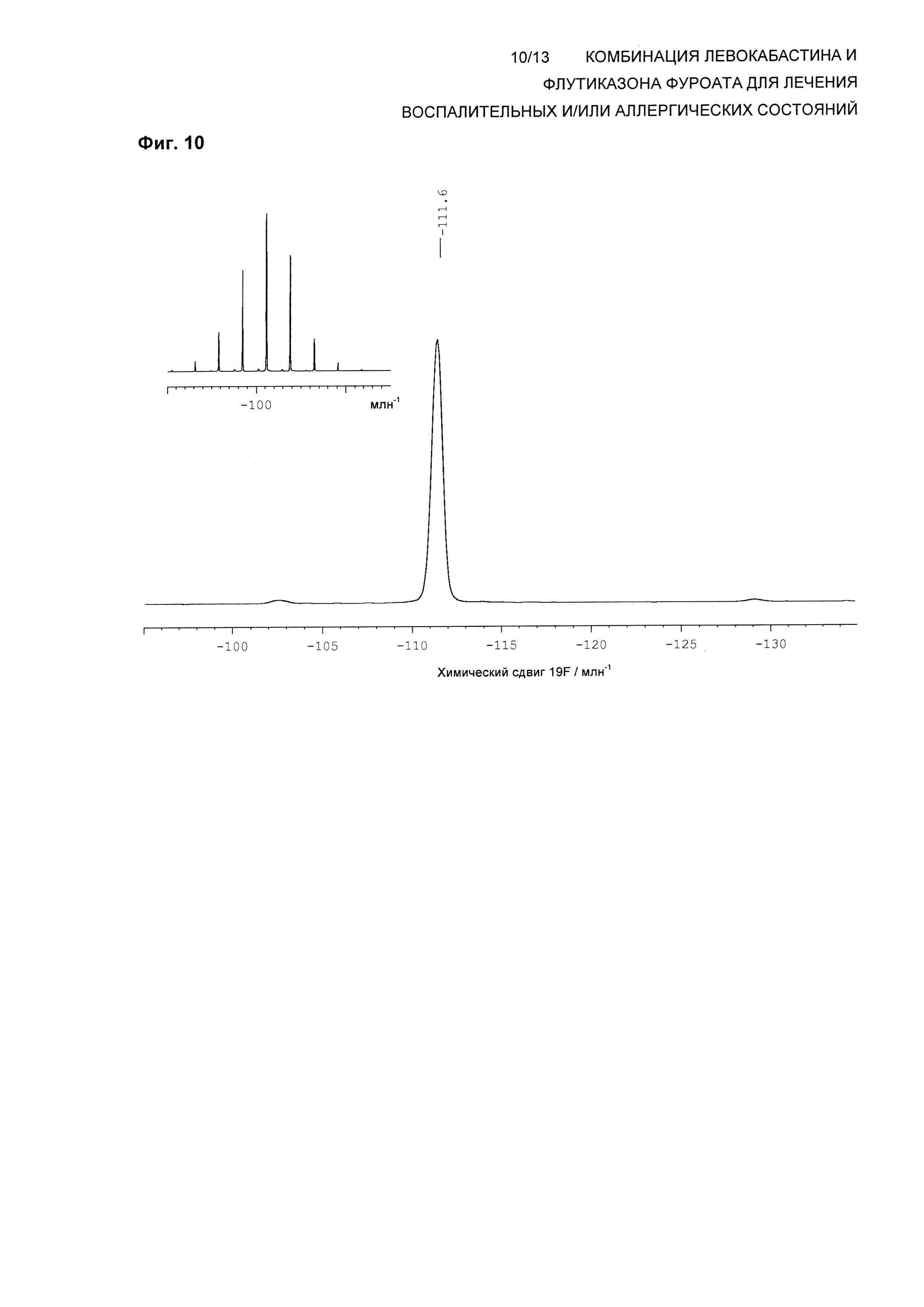
На Фиг. 10 показана изотропная область спектра 19F твердотельного NMR (ТТЯМР) левокабастина в Форме 2 кристаллического ангидрида. Также приведен (вставка) полный спектр при вращении под магическим углом. Спектр твердотельного NMR получали на спектрометре, работающем при частоте 470,40 МГц, для наблюдения 19F и скорости вращения 12,5 кГц, согласно описанным здесь методикам.
В одном воплощении композиция по настоящему изобретению обеспечивает левокабастин в Форме 2 кристаллического ангидрида, характеризующейся по существу таким же спектром 19F твердотельного ядерного магнитного резонанса (ssNMR), что и на Фиг. 10, где спектр ssNMR был получен на спектрометре, работающем при частоте 470,40 МГц, для наблюдения 19F с помощью последовательности импульсов с поперечной поляризацией при использовании 4 мм вращающегося под магическим углом зонда для тройного резонанса Bruker при частоте ротора 12,5 кГц.
В другом воплощении композиция по настоящему изобретению обеспечивает левокабастин в Форме 2 кристаллического ангидрида, характеризующейся спектром 19F ssNMR, содержащим изотропные химические сдвиги при -111,6±0,2 млн-1.
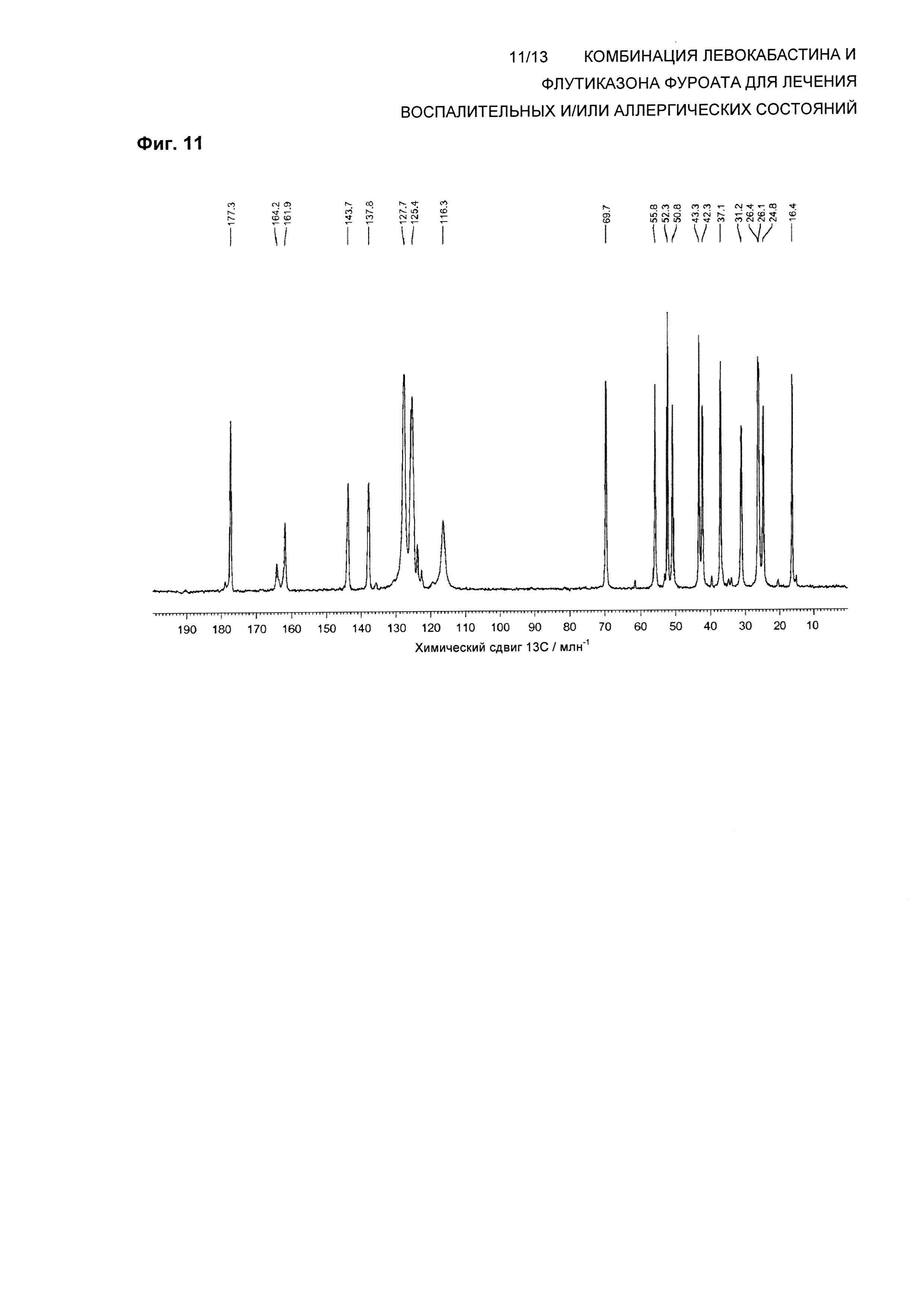
На Фиг. 11 показан спектр 13С твердотельного NMR (ssNMR) левокабастина в Форме 3 кристаллического ангидрата. Спектр твердотельного NMR получали на спектрометре, работающем при частоте 125,73 МГц, для наблюдения 13С и со скоростью вращения 8 кГц, согласно описанной здесь методике. Пики малой интенсивности являются результатом малого количества Формы 1, присутствующей в тестируемой партии.
В одном воплощении композиция по настоящему изобретению обеспечивает левокабастин в Форме 3 кристаллического ангидрида, характеризующейся по существу таким же спектром 13С твердотельного ядерного магнитного резонанса (ssNMR), что и на Фиг. 11, где спектр ssNMR был получен на спектрометре, работающем при частоте 125,73 МГц для наблюдения 13С с помощью последовательности импульсов с поперечной поляризацией при использовании 4 мм вращающегося под магическим углом зонда для тройного резонанса Bruker при частоте ротора 8 кГц.
В другом воплощении композиция по настоящему изобретению обеспечивает левокабастин в Форме 3 кристаллического ангидрида, характеризующейся спектром 13С ssNMR, содержащим химические сдвиги при 177,3±0,2, 164,2±0,2, 161,9±0,2, 143,7±0,2, 137,8±0,2, 127,7±0,2, 125,4±0,2, 116,3±0,2, 69,7±0,2, 55,8±0,2, 52,3±0,2, 50,8±0,2, 43,3±0,2, 42,3±0,2, 37,1±0,2, 31,2±0,2, 26,4±0,2, 26,1±0,2, 24,8±0,2 и 16,4±0,2 млн-1.
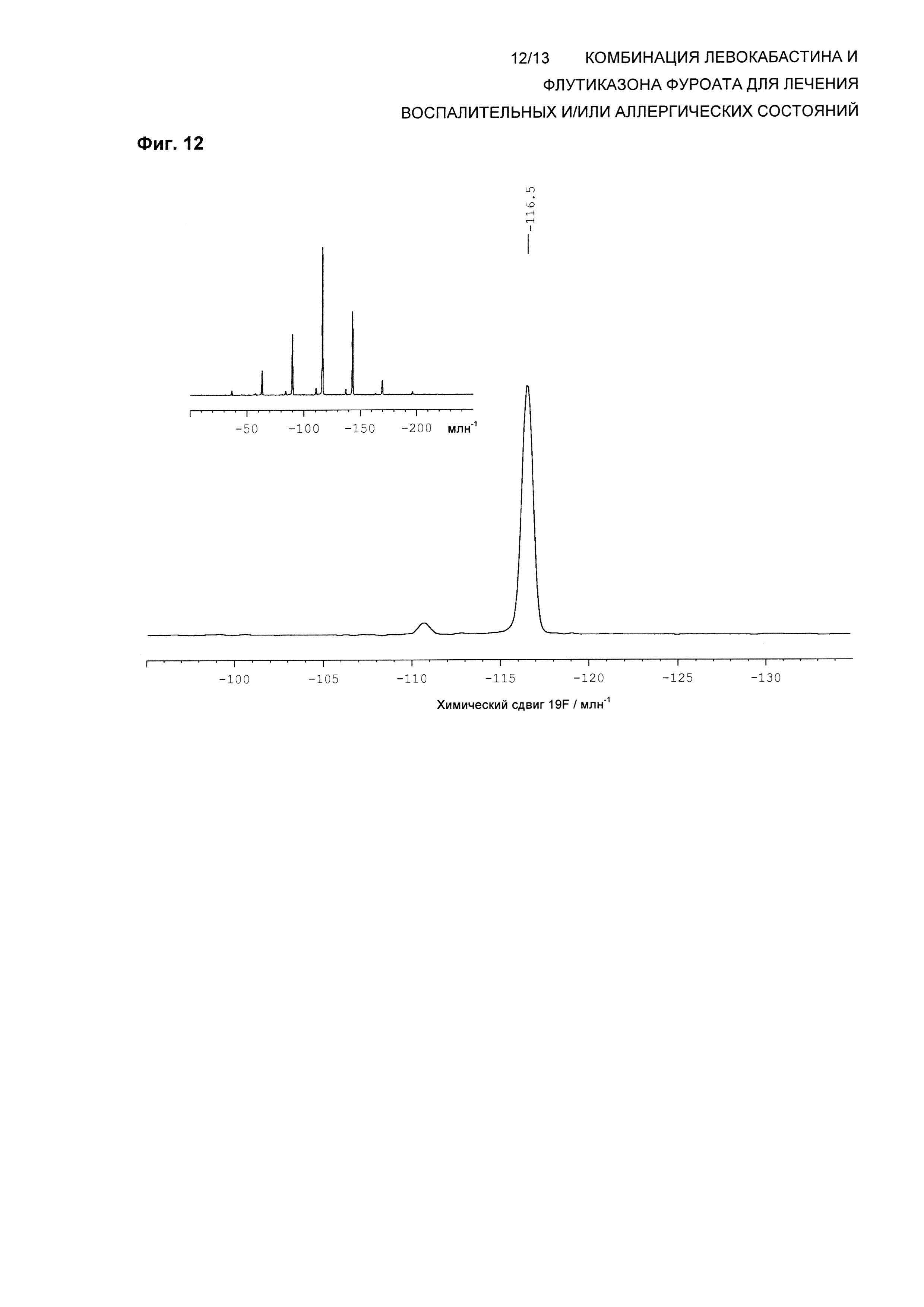
На Фиг. 12 показана изотропная область спектра 19F твердотельного NMR (ssNMR) левокабастина в Форме 3 кристаллического ангидрида согласно настоящему изобретению. Спектр твердотельного NMR получали на спектрометре, работающем при частоте 470,40 МГц, для наблюдения 19F и скорости вращения 12,5 кГц, согласно описанной здесь методике. Резонанс 19F при -110,7 млн-1 представляет собой малое количество Формы 1, присутствующей в тестируемой партии.
В одном воплощении композиция по настоящему изобретению обеспечивает левокабастин в Форме 3 кристаллического ангидрида, характеризующейся по существу таким же спектром 19F твердотельного ядерного магнитного резонанса (ssNMR), что и на Фиг. 12, где спектр ssNMR был получен на спектрометре, работающем при частоте 470,40 МГц, для наблюдения 19F с помощью последовательности импульсов с поперечной поляризацией при использовании 4 мм вращающегося под магическим углом зонда для тройного резонанса Bruker при частоте ротора 12,5 кГц.
В другом воплощении композиция по настоящему изобретению обеспечивает левокабастин в Форме 3 кристаллического ангидрида, характеризующейся спектром 19F ssNMR, содержащим изотропные химические сдвиги при -116,5±0,2 млн-1.
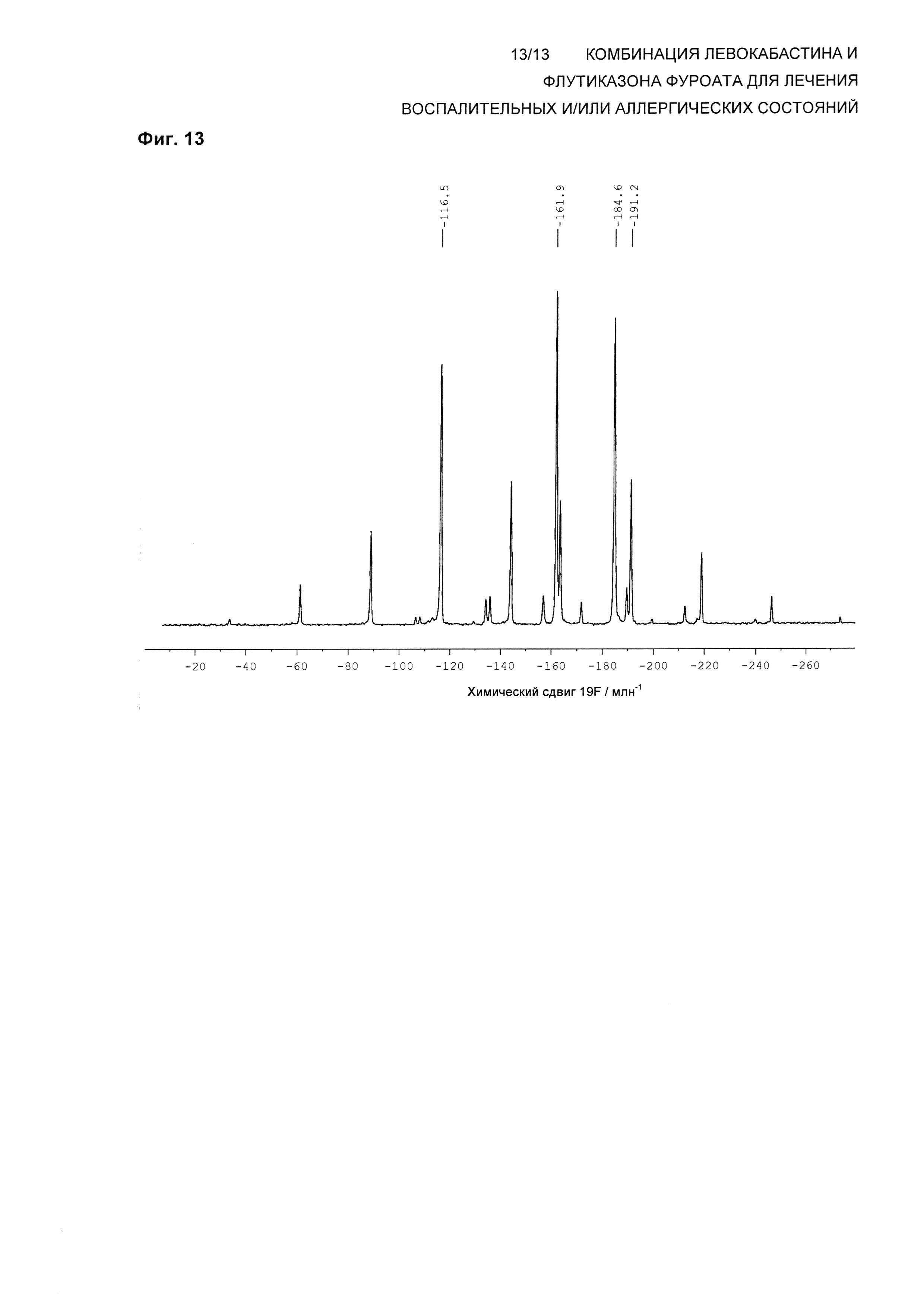
На Фиг. 13 показан спектр 19F твердотельного NMR (ssNMR) композиции согласно настоящему изобретению, содержащей левокабастин и флутиказона фуроат. Спектр твердотельного NMR был получен на спектрометре, работающем при частоте 470,40 МГц, для наблюдения 19F и скорости вращения 13,0 кГц согласно описанным здесь методикам.
В одном воплощении композиция по настоящему изобретению обеспечивает спектр 19F ssNMR, содержащий изотропные химические сдвиги при -116,5±0,2 млн-1 и -161,9±0,2, -184,6±0,2, -191,2±0,2 млн-1. Эти химические сдвиги согласуются со сдвигами Формы 3 свободного основания левокабастина и Формы 1 флутиказона фуроата.
Клинические исследования
Эффект комбинации, содержащей флутиказона фуроат (FF) и левокабастина гидрохлорид, у человеческих субъетов определяется согласно описанным ниже исследованиям.
Исследование 1
Рандомизированное двойное слепое 4-частное 3-факторное перекрестное исследование с неполными блоками с контролем в виде плацебо для оценки эффекта одиночной и повторных доз левокабастина, флутиказона фуроата, плацебо и комбинации фиксированных доз флутиказона фуроата/левокабастина, вводимых субъектам с аллергическим ринитом (AR).
Цели и ожидаемые результаты
Первичная: эффект 8-суточного лечения интраназальным FF/левокабастином на назальные симптомы, вызванные стимуляцией субъектов с аллергическим ринитом в камере с аллергеном, при однократном ежесуточном введении по сравнению с одним FF и левокабастином.
Конечный результат: TNSS (общий бальный показатель назальных симптомов) и TOSS (общий бальный показатель глазных симптомов) на 8 сутки после 8-суточного повторного введения FF/левокабастина по сравнению с 8-суточным повторным введением одного FF,
TNSS и TOSS на 8 сутки после 8-суточного повторяющегося введения FF/левокабастина по сравнению с 8-суточным повторяющимся введением одного левокабастина.
Вторичная: определить время до начала облегчения симптомов после первой дозы FF/левокабастина относительно введения одного FF по отношению к назальным симптомам, вызванным стимуляцией субъектов с аллергическим ринитом в камере с аллергеном.
Конечный результат: начало и величина облегчения симптомов по TNSS, TOSS после однократной дозы FF/левокабастина по сравнению с однократной дозой FF.
Начало и величина облегчения симптомов по TNSS, TOSS после однократной дозы FF/левокабастина по сравнению с однократной дозой левокабастина.
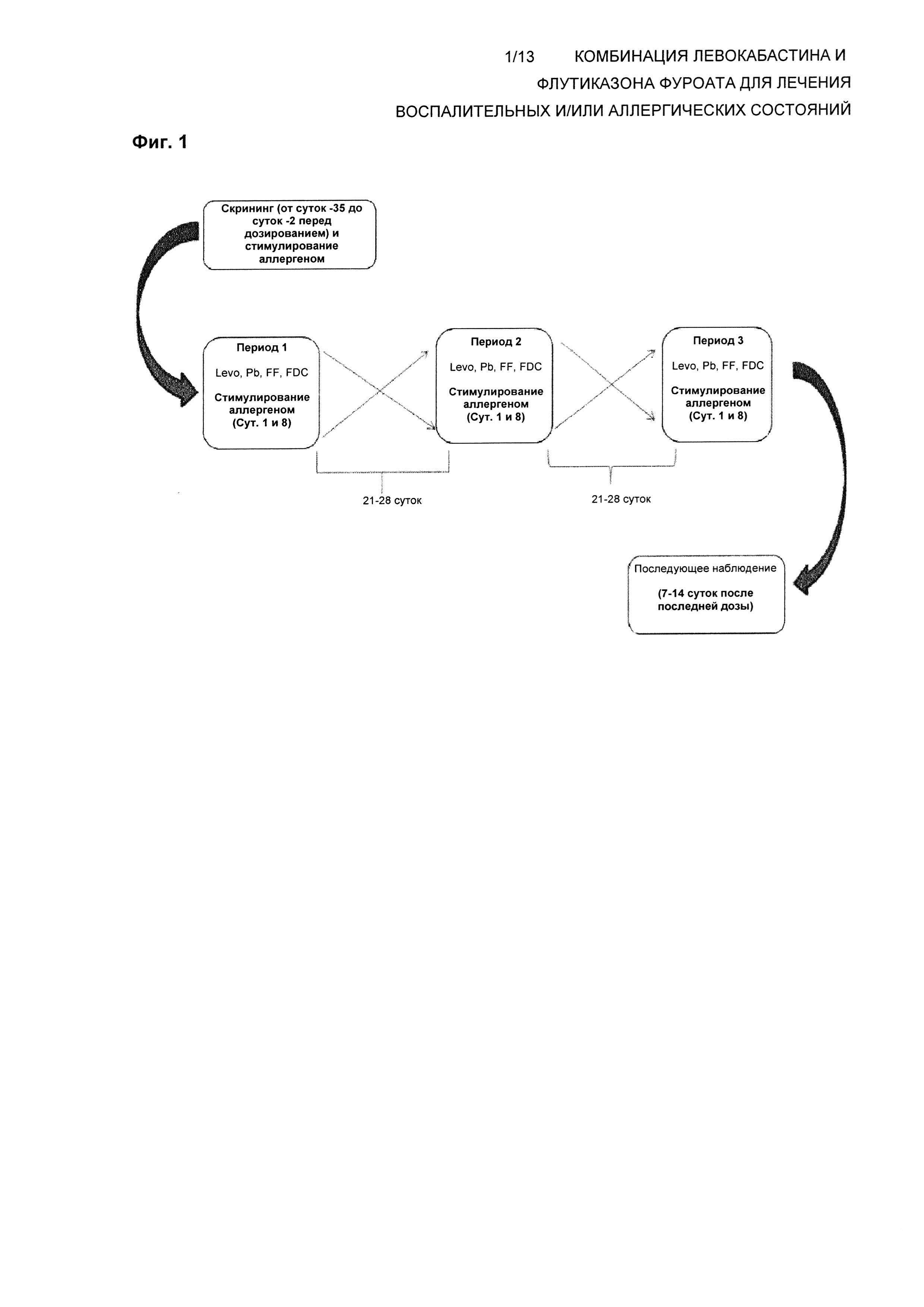
Схема исследования
Все субъекты завершат исследование, как подробно описано на Фиг. 1. Общая ожидаемая продолжительность исследования для каждого индивида, участвующего в данном исследовании будет составлять максимум вплоть до 20 недель (включая скрининг и последующее наблюдение).
Будут зарегистрированы приблизительно 72 субъекта, так что приблизительно 64 субъекта завершат дозирование и критические обследования.
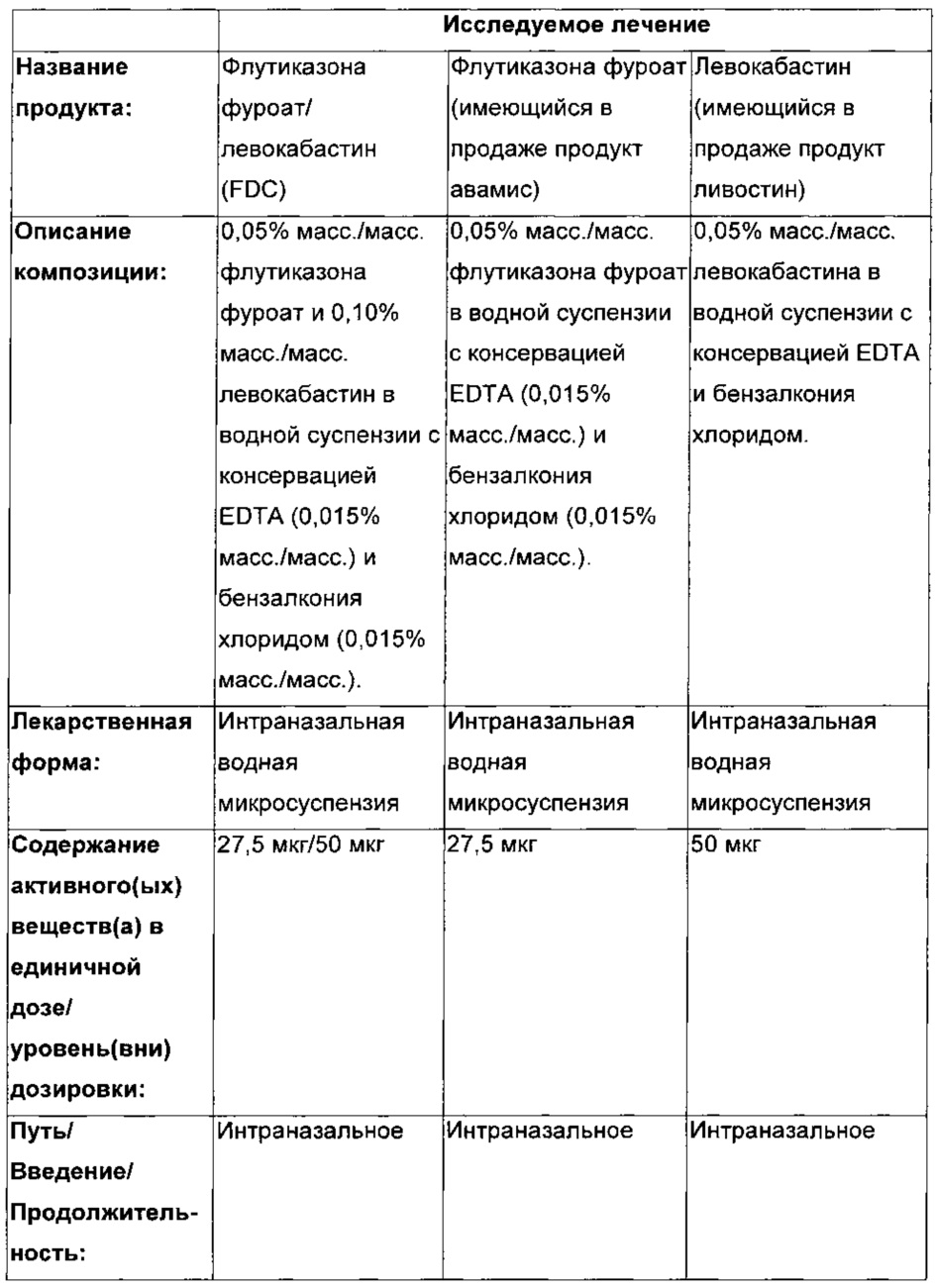
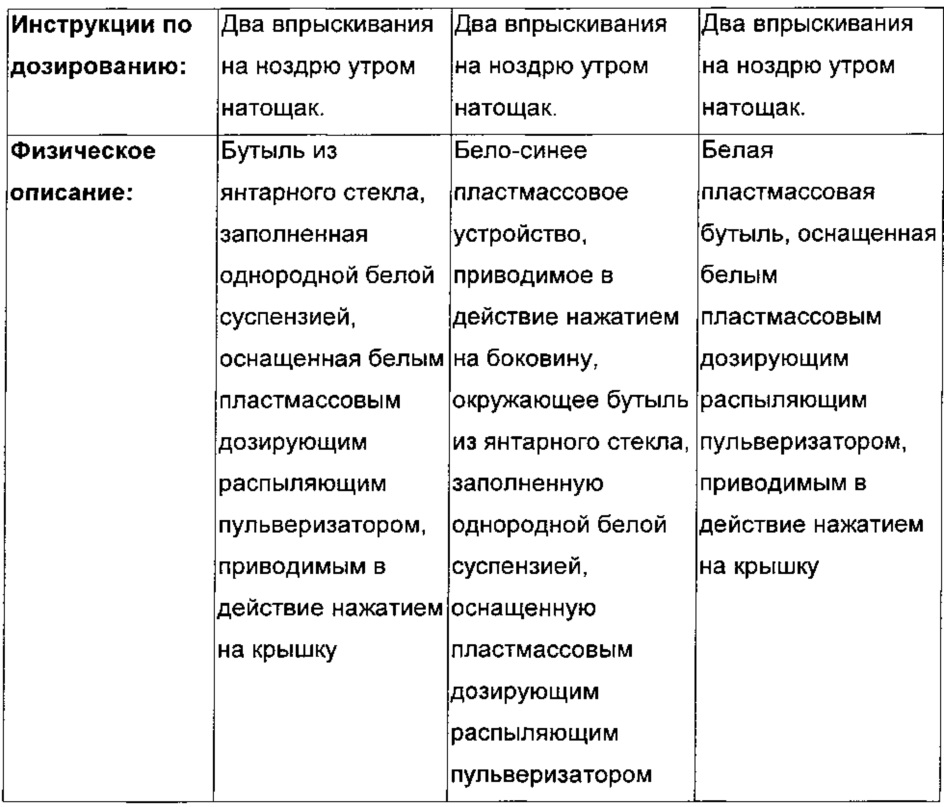
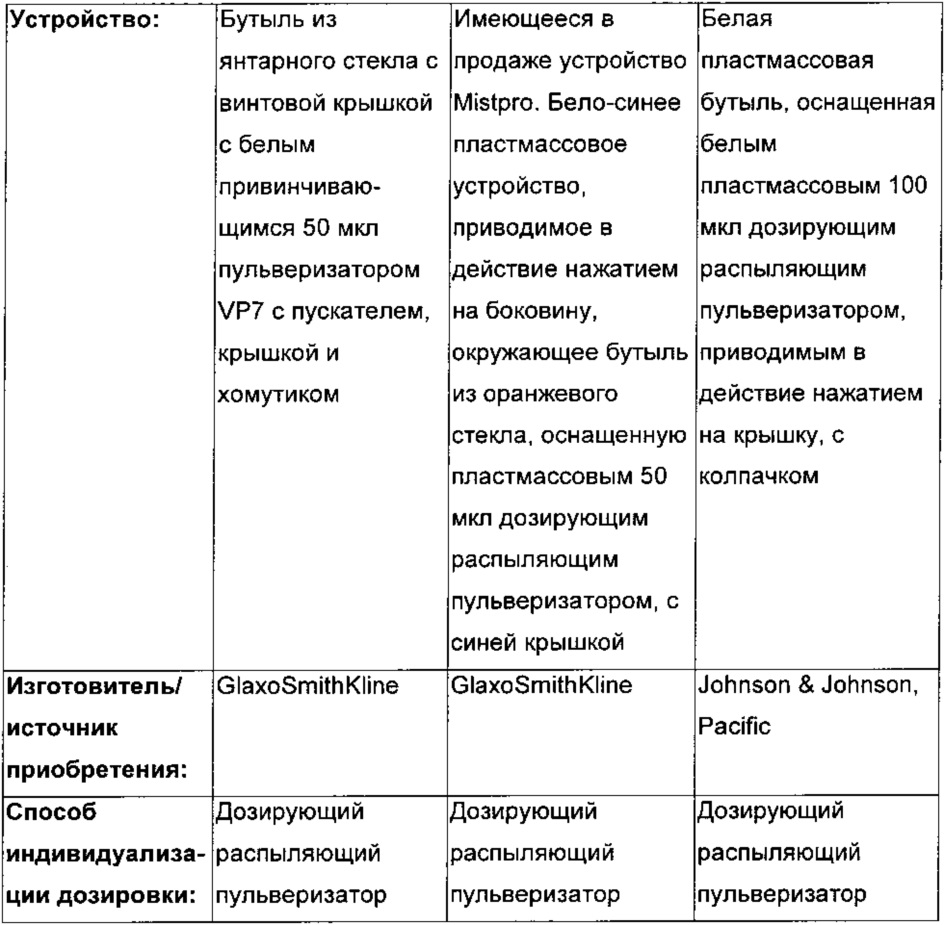
ИССЛЕДУЕМОЕ ЛЕЧЕНИЕ
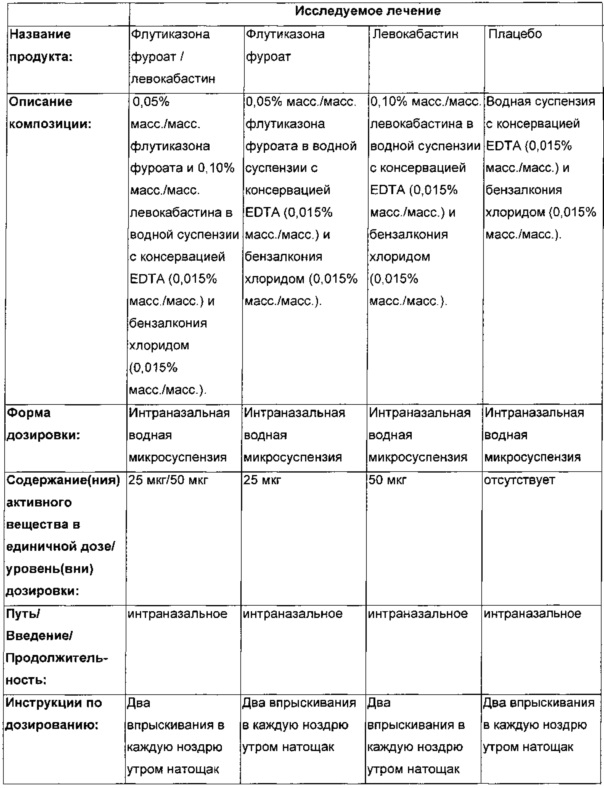
|
Субъектам будет назначена последовательность из трех лечений (например ABC, BCD, ACD) согласно схеме рандомизации, разработанной отделом количественных исследований до начала проведения исследований с использованием проверенного внутреннего программного обеспечения.
Описание каждой схемы приведено ниже:
- А - два 50 мкл впрыска на ноздрю FF, общая доза 100 мкг
- В - два 50 мкл впрыска на ноздрю левокабастина, общая доза 200 мкг
- С - два 50 мкл впрыска на ноздрю FF/левокабастина FDC (комбинация фиксированных доз). Общая суточная доза 110 мкг FF и 200 мкг левокабастина.
- D - два 50 мкл впрыска на ноздрю плацебо.
Каждому субъекту будет присвоен рандомизационный номер перед получением его первой дозы исследуемого лекарственного средства. Рандомизационные номера будут присвоены в последовательном порядке, начиная с наименьшего номера. Как только субъекту присвоят рандомизационный номер, он не может быть переназначен другому субъекту.
Стимуляция аллергеном будет проводиться в запечатанной камере в том виде, в котором она используется в венской камере для вызова реакции (VCC). VCC использовали для оценки традиционных терапий против ринита (включающих антигистаминные и местные кортикостероиды), и она имеет потенциал для различения не только эффективности, но также и начала и продолжительности действия в зависимости от связи между дозировкой и воздействием аллергена [Zieglmayer, 2008].
Стимулирующие агенты, подлежащие применению в камере, поставляются Allergon (Швеция) и представляют собой смесь 4 типов трав (тимофеевка, ежа сборная, плевел многолетний и душистый колосок).
Фармакодинамические анализы
Будут набраны 72 субъекта. В анализ будут включены все субъекты по меньшей мере с одним периодом данных. В отношении отсутствующих данных не будет делаться подстановка. Назальные симптомы (заложенность/блокада носа, зуд, чихание и ринорея) будут подсчитываться по категориальной шкале от 0 до 3. Для каждого субъекта и момента времени будет рассчитан общий бальный показатель назальных симптомов (TNSS) как сумма ответа в отношении заложенности носа, назального зуда, чихания и ринореи. Для групп лечения будут получены графики среднего профиля TNSS (и его индивидуальных компонентов) с течением времени (включая все моменты времени до введения дозы).
Первичный анализ будет представлять собой сравнение взвешенных средних TNSS (0-3) в часы после начала стимуляции в камере в сутки 8 (т.е. в 1-4 часа после дозы), полученных при введении FDC и FF самого по себе, а также при введении FDC и левокабастина самого по себе. Эти два анализа будут сделаны раздельно тем же самым способом, как подробно описано ниже.
Полученный параметр будет проанализирован с использованием анализа модели дисперсии со смешанными эффектами, скорректированной в отношении членов, характеризующих базовый уровень (до стимуляции на 8 сутки), период, лечение, и члена, характеризующего взаимодействие лечения и базового уровня, взятыми в качестве фиксированных эффектов, с субъектом, взятым в качестве случайного эффекта. Оценка сравнения лечений (FDC относительно FF или FDC относительно левокабастина) будет рассчитана между скорректированными средними величинами (предел среднего) вместе с ассоциированным с ними 95%-ным доверительным интервалом. Индивидуальные компоненты балла TNSS будут проанализированы аналогичным способом. При необходимости может быть аппроксимирован член, характеризующий период вымывания. Вторичные анализы будут сделаны на основе следующих сравнений: FF относительно левокабастина, левокабастин относительно плацебо, FF относительно плацебо и FDC относительно плацебо.
Исследование 2
Рандомизированное двойное слепое 3-факторное перекрестное исследование с контролем в виде плацебо у субъектов с аллергическим ринитом будет проведено для оценки эффекта интраназальных повторных доз левокабастина при введении один раз в сутки или два раза в сутки на симптомы ринита в камере для стимуляции аллергеном.
Цели и ожидаемые результаты
Первичные
Провести исследование, демонстрирующее что эффективность 7-суточного лечения левокабастином на назальные симптомы, вызванные стимуляцией в камере с аллергеном (камера для воздействия окружающей среды), у субъектов с аллергическим ринитом при введении один раз в сутки не ниже, чем при введении дважды в сутки.
Ожидаемый результат: TNSS после 7 суток лечения при введении один раз в сутки по сравнению с введением дважды в сутки, измеренная на минимуме фармакокинетической кривой (т.е. приблизительно через 24 часа и 12 часов, соответственно) после последней активной дозы на 7 сутки.
Исследовать преимущество эффекта 7 суток лечения левокабастином (один и два раза в сутки) на назальные симптомы, вызванные стимуляцией в камере с аллергеном (камера для воздействия окружающей среды), у субъектов с аллергическим ринитом по сравнению с плацебо.
Ожидаемый результат: общий бальный показатель назальных симптомов (TNSS) после 7 суток лечения левокабастином по сравнению с плацебо, измеренный на минимальных уровнях РК после последней дозы на 7 сутки.
Вторичные
Исследовать переносимость стационарных интраназальных доз левокабастина самого по себе у здоровых субъектов мужчин и женщин.
Ожидаемый результат: индивидуальные компоненты (заложенность носа, ринорея, назальный зуд и чихание);
Переносимость левокабастина, вводимого интраназально один и два раза в сутки.
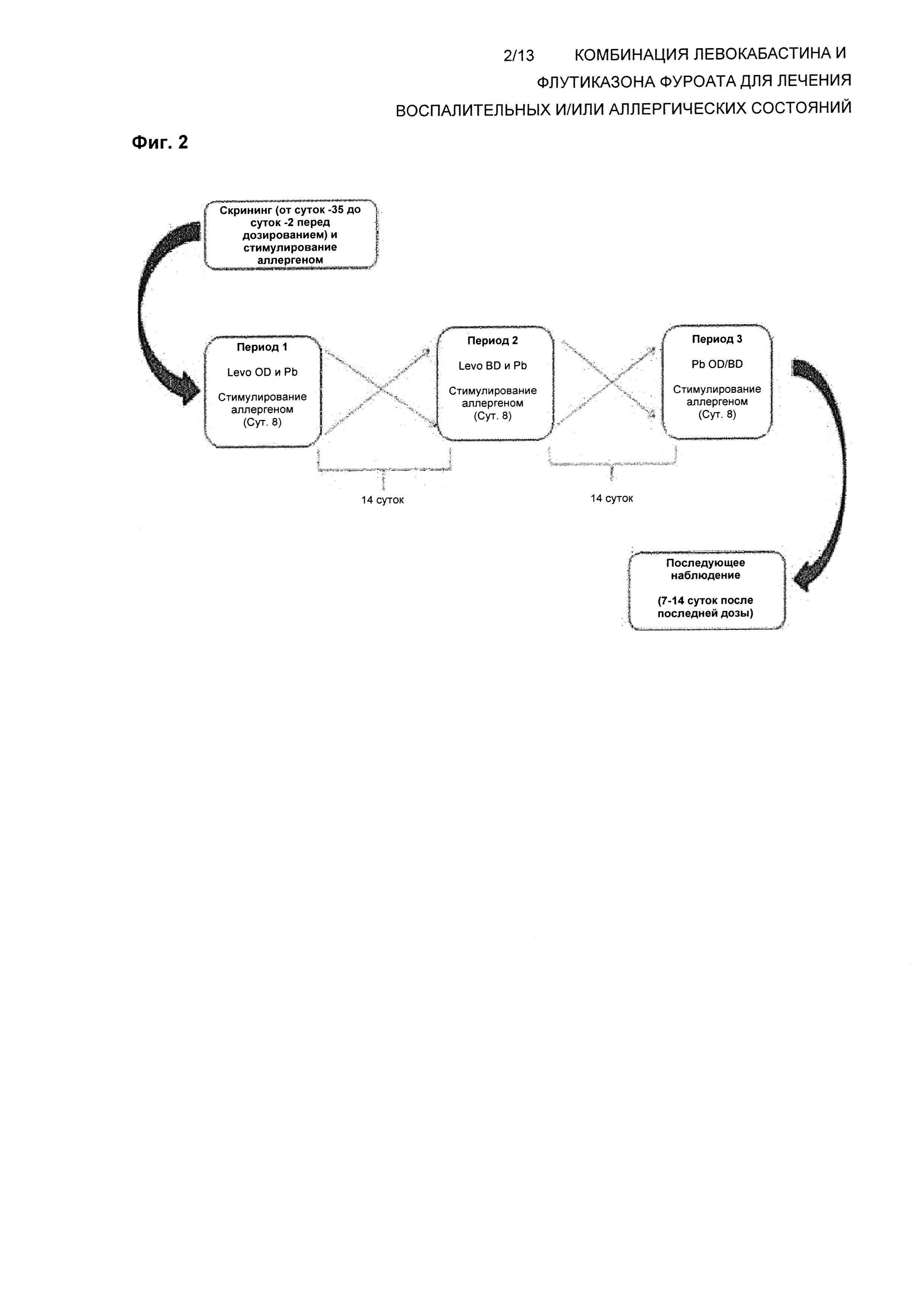
Схема исследования
Схема исследования показана на Фиг. 2.
Все индивиды будут осуществлять визит для скрининга с целью оценки их пригодности для участия в исследовании. Все субъекты будут получать лечение во все три периода, и последовательность будет определяться с использованием кода рандомизации согласно схеме рандомизации.
Все субъекты будут получать лечение во все три периода, и последовательность будет определяться с использованием кода рандомизации. Субъектам будут случайным образом назначены одна из шести последовательностей лечения (ABC, ВСА, CAB, АСВ, ВАС, СВА) согласно схеме рандомизации.
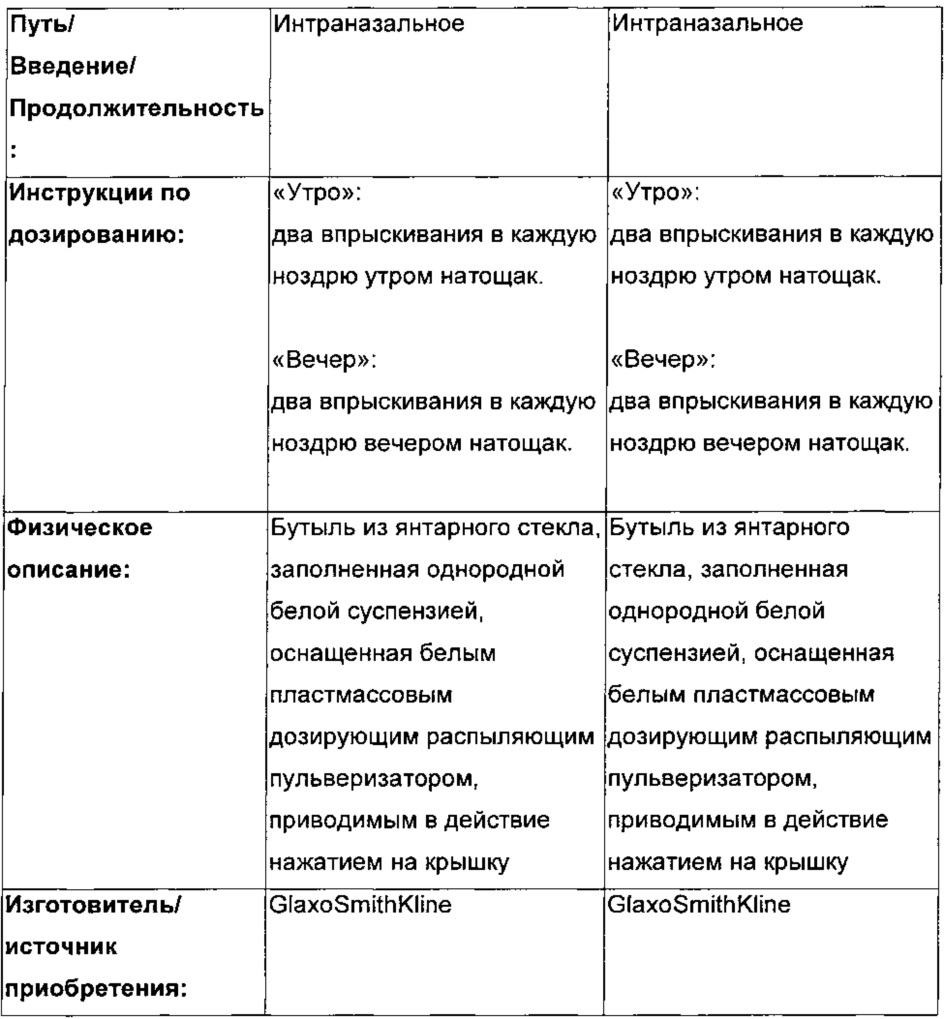
Субъектам будет требоваться введение лекарственного средства с 12-часовыми интервалами (дважды в сутки) при всех трех схемах лечения. Субъектам будут выдавать две бутыли: бутыль «утро» и бутыль «вечер» (помеченные подходящим образом). При рандомизации типа OD (один раз в сутки) бутыль «утро» будет содержать активное вещество, и бутыль «вечер» будет содержать плацебо. При рандомизации типа BD (дважды в сутки) обе бутыли будут содержать активное вещество. При рандомизации типа «плацебо» обе бутыли будут содержать плацебо. Во всех трех схемах введение первой дозы будет происходить утром, если это возможно. Первая и последняя доза будут вводиться в клинике. Все остальные дозы будут вводиться дома. Будет иметь место 14-20-суточный период вымывания между каждым периодом лечения схемы. Требуется, чтобы субъекты оставались в клинике в течение ночи на 7 сутки каждого периода для осуществления стимуляции аллергеном через 12 часов после введения дозы (сутки 8, т.е. приблизительно через 24 часа после дозы в случае OD и 12 часов после дозы активного вещества в случае BD). См. таблицу, приведенную ниже.
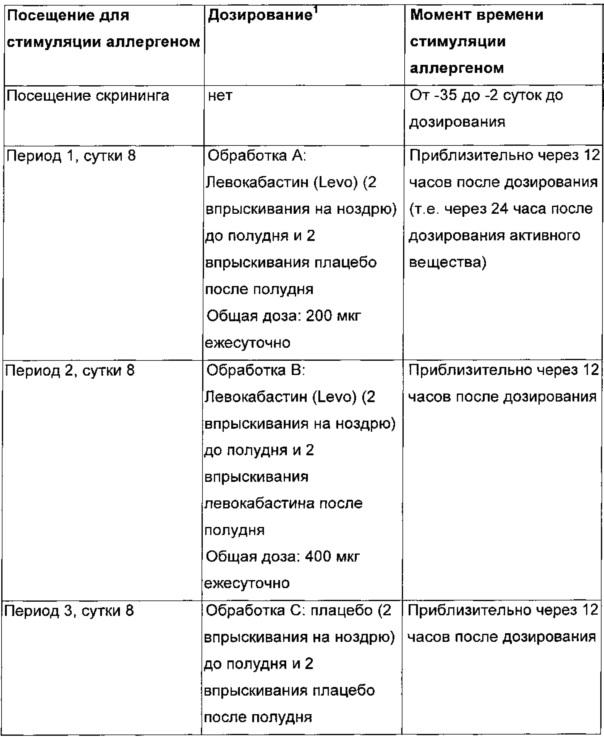
Порядок лечений А, В и С будет рандомизирован на протяжении периодов 1, 2 и 3.
Введение доз будет происходить утром и вечером. На протяжении всего исследования должны предприниматься попытки осуществлять дозирование для каждого субъекта настолько близко во времени, насколько это возможно, и субъектов следует инструктировать по времени дозирования. Стимуляции аллергеном должны проводиться для каждого субъекта в каждый период 8-суточный настолько единообразно, насколько это возможно, по месту согласно приведенной выше таблице и расписанию по времени. Время и дата введения последних 2 доз будут внесены в записи о субъекте. Все субъекты будут возвращаться для последующего наблюдения через 7-14 суток после последней дозы после окончания периода №3.
Последующее наблюдение:
Будет требоваться посещение субъектами медицинского учреждения для последующего наблюдения через 7-14 суток после последней дозы исследуемого лекарственного средства после окончания периода №3. Общая ожидаемая продолжительность исследования для каждого участвующего индивида будет составлять максимум 13 недель, включая скрининг и последующее наблюдение.
ИССЛЕДУЕМОЕ ЛЕЧЕНИЕ
Исследуемый продукт и другие исследуемые лечения
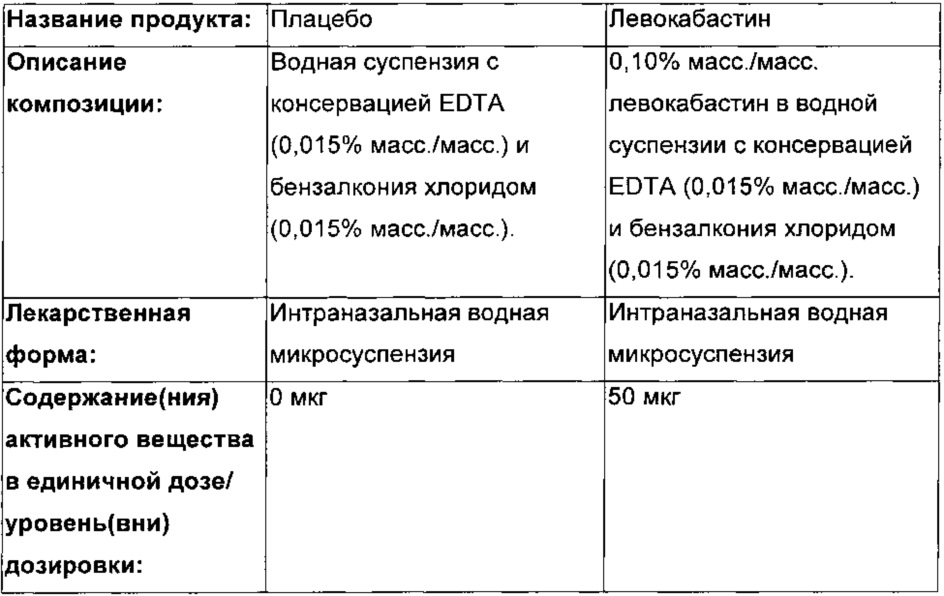
Стимулирующие агенты
Пыльцой, используемой для стимуляции аллергеном в EEC, будет пыльца амброзии (Ambrosia artemisiifolia, полученная из Greer Laboratories, Inc., Lenoir, Каролина). Доза амброзии, переносимой воздухом, составляет в пределах 3500±500 пыльцевых зерен/м3 в EEC.
Фармакодинамические анализы
Назальные симптомы (заложенность/блокада носа, зуд, чихание и ринорея) будут оценены по категориальной шкале от 0 до 3. Для каждого субъекта и момента времени будет рассчитан общий бальный показатель назальных симптомов (TNSS) как сумма ответа в отношении заложенности носа, назального зуда, чихания и ринореи. Для группы лечения будут построены графики среднего профиля TNSS (и его индивидуальных компонентов) относительно времени (включая все моменты времени до дозы).
Первичным анализом будет сравнение между взвешенными средними TNSS групп лечения в (0-4) часа после начала стимуляции в камере на 8 сутки (т.е. приблизительно в 24 или 12 часов после введения дозы активного соединения). Полученный параметр будет проанализирован с использованием анализа модели дисперсии со смешанными эффектами, скорректированной в отношении членов, характеризующих базовый уровень (до стимуляции на 8 сутки), период, лечение, и члена, характеризующего взаимодействие лечения и базового уровня, взятыми в качестве фиксированных эффектов, с субъектом, взятым в качестве случайного эффекта. Оценки попарных различий трех групп лечений (левокабастин BD относительно плацебо, левокабастин OD относительно плацебо и левокабастин OD относительно левокабастин BD В) будут рассчитаны между скорректированными средними (предел среднего) вместе с ассоциированными с ними 95%-ными доверительными интервалами. Данный анализ будет проведен и на ITT (популяция назначенного лечения), и на РР (популяция пациентов, завершивших участие в исследовании в соответствии с протоколом) популяциях.
Индивидуальные компоненты балла TNSS будут проанализированы аналогичным способом. При необходимости может быть аппроксимирован член, характеризующий период вымывания. Также будут построены графики профилей средних, демонстрирующие значение средних величин с 95%-ным доверительным интервалом, по лечению для каждого ожидаемого результата в каждый момент времени на 8 сутки. Для получения оценок графиков профиля на протяжении 0-4 ч в камере для стимуляции аллергеном будет использован анализ модели дисперсии со смешанными эффектами с периодом, временем, лечением и взаимодействием время*лечение, взытыми в качестве фиксированных эффектов, с субъектом, взятым в качестве случайного эффекта, и временем, взятым в качестве повторяющегося эффекта. В качестве независимой переменной в модель могут быть включены исходный уровень (TNSS до стимуляции в сутки 8) и взаимодействие исходный уровень*время.
Также будут проанализированы бальные показатели TNSS индивидуальных симптомов (заложенность/блокада носа, ринорея, зуд и чихание) и представлены так же, как описано выше.
Исследование 3
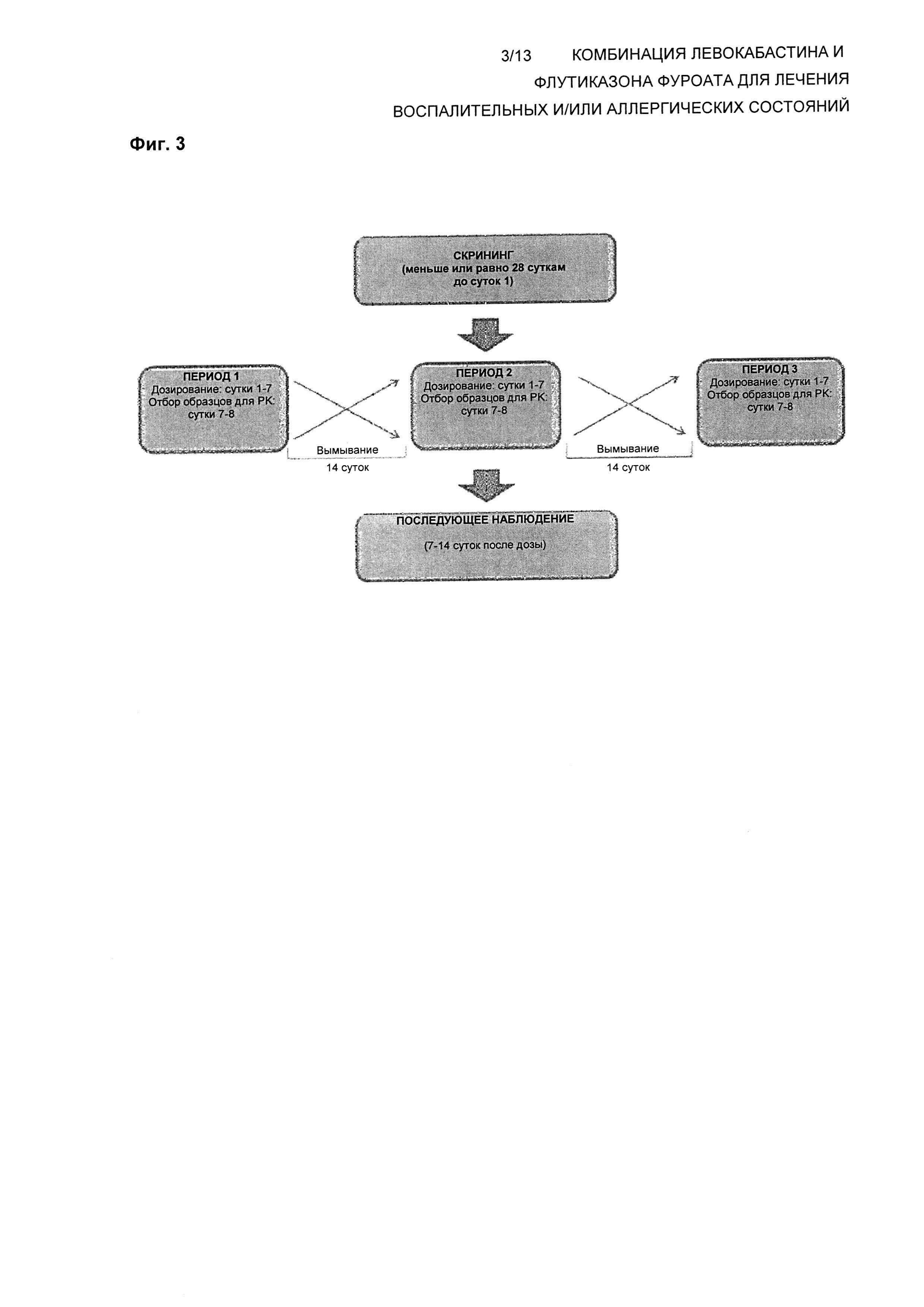
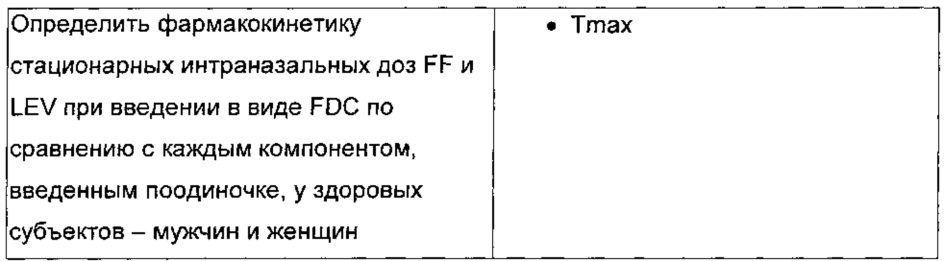
Исследование относительной биодоступности для сравнения фармакокинетики комбинации фиксированных доз флутиказона фуроата и левокабастина с левокабастином и флутиказона фуроатом взятыми сами по себе.
Целью данного исследования является определение биодоступности комбинации фиксированных доз флутиказона фуроата и левокабастина с левокабастином и флутиказона фуроатом взятыми сами по себе у здоровых волонтеров - мужчин и женщин. Это будет открытое рандомизированное трехфакторное перекрестное исследование с повторным дозированием. Субъекты будут получать лечение каждое утро в течение 7 последовательных суток во время каждого из трех периодов лечения, разделенных, как минимум, 14-суточным периодом вымывания. Образцы крови для фармакокинетического анализа будут отбираться с регулярными интервалами после дозирования на 7 сутки каждого периода лечения. Посещение для последующего наблюдения будет происходить через 7-14 суток после введения последней дозы. Будет зарегистрировано минимум 30 пациентов, включая 12 пациентов корейского происхождения.

Задача лечения
Субъектам будет назначена одна из шести схем лечения (ABC, АСВ, ВАС, ВСА, CAB, СВА) согласно схеме рандомизации, разработанной отделом количественных исследований до начала исследования, с использованием проверенной внутренней программы.
Описание каждой схемы приведено ниже:
- А - два 50 мкл впрыскивания на ноздрю (всего 4 впрыскивания) FF/LEV FDC. Общая суточная доза 110 мкг FF и 200 мкг LEV.
- В - два 50 мкл впрыскивания на ноздрю (всего 4 впрыскивания) FF. Общая доза 110 мкг.
- С - два 50 мкл впрыскивания на ноздрю (всего 4 впрыскивания) LEV. Общая доза 200 мкг.
Каждому субъекту будет назначен номер рандомизации перед получением первой дозы исследуемого лекарственного средства. Номера рандомизации будут назначены в последовательном порядке, начиная с наименьшего номера. Как только субъекту назначили номер рандомизации, он не может быть переназначен другому субъекту.
Биодоступность
Данное исследование разработано для оценки относительной биодоступности каждого компонента: FF и LEV при введении в виде FDC относительно FF и LEV при введении поодиночке. Никакие формальные предположения не будут проверяться. Для каждого первичного ожидаемого фармакокинетического результата будут построены точечные оценки и соответствующие 90%-ные доверительные интервалы для отношения среднего геометрического опытного лечения к среднему геометрическому контрольного лечения, μ(опытная)/μ(контрольная).
ИССЛЕДУЕМАЯ ОБРАБОТКА
Лечение с помощью исследуемого продукта и других продуктов