ПРОГНОЗИРОВАНИЕ РИСКА СЕРДЕЧНО-СОСУДИСТОГО СОБЫТИЯ И ЕГО ПРИМЕНЕНИЕ
Вид РИД
Изобретение
СВЯЗИ ИЗОБРЕТЕНИЯ
[0001] Рассматриваемая заявка испрашивает преимущество приоритета одновременно рассматриваемой заявки США № 61/541828, поданной 30 сентября 2011 года, которая включена в данный документ во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Представленная заявка в общем относится к выявлению биомаркеров и способу оценки риска будущего сердечно-сосудистого события у индивида, а более конкретно, к одному или более биомаркерам, способам, устройствам, реагентам, системам и наборам, используемым для оценки прогнозирования риска развития сердечно-сосудистого (CV) события у индивида в течение 5-летнего периода. Подобные события включают, но без ограничения, инфаркт миокарда, инсульт, застойную сердечную недостаточность либо смерть.
УРОВЕНЬ ТЕХНИКИ
[0003] Следующее описание предоставляет краткое изложение информации, имеющей отношение к представленной заявке, и не является признанием, что любая предоставленная информация или публикации, на которые в данном документе делается ссылка, является предыдущим уровнем техники по отношению к представленной заявке.
[0004] Сердечно-сосудистое заболевание является основной причиной смертности в США. Имеются ряд существующих и важных прогностических факторов риска первичных событий (D'Agostino, R с соавт. «General Cardiovascular Risk Profile for Use in Primary Care: Framingham Heart Study» Circulation 117:743-53 (2008); и Ridker, P. с соавт. «Development and Validation of Improved Algorithms for the Assessment of Global Cardiovascular Risk in Women» JAMA 297(6):611-619 (2007)) и вторичных событий (Shlipak, M. с соавт. «Biomarkers to Predict Reccurent Cardiovascular Disease: The Heart & Soul Study» Am. J. Med. 121:50-57 (2008)), которые широко используются в клинической практике и терапевтических испытаниях. К несчастью, рабочие характеристические кривые, соотношения рисков и коэффициент соответствия показывают, что эффективность существующих факторов риска и биомаркеров является невысокой (площади под кривой, равные -0,75, означают, что данные факторы находятся только на полпути между подбрасыванием монеты и совершенством). В дополнение к потребности в улучшенной диагностической эффективности, имеется потребность в продукте оценки риска, который и относится к близкому будущему, и является индивидуально чувствительным у индивидов к полезным (и пагубным) вмешательствам и изменениям образа жизни. Широко используемое Фрамингемское уравнение имеет три основных проблемы. Во-первых, оно рассчитано на слишком долгий срок: оно дает 10-летние расчеты риска, но люди преуменьшают риски в будущем и неохотно делают на основании их изменения в поведении и образе жизни. Во-вторых, оно не очень чувствительно к вмешательствам: самым сильным его повышающим коэффициентом является хронологический возраст, который не может уменьшаться. В-третьих, внутри популяции с высоким риском, предусмотренной в этом случае, Фрамингемские факторы не в состоянии хорошо распознавать между высоким и низким риском: отношение рисков между высокими и низкими квартилями составляет только 2.
[0005] Факторы риска для сердечно-сосудистого заболевания широко используются для управления интенсивностью и сущностью медицинского лечения, и их использование, несомненно, вносит вклад в снижение сердечно-сосудистой заболеваемости и смертности, которые наблюдаются на протяжении двух прошедших десятилетий. Данные факторы обычно объединяли в алгоритмы, но, к несчастью, они не охватывают весь риск (наиболее общим изначальным представлением о сердечном заболевании все-таки является смерть). В действительности, они возможно охватывают только половину риска. Площадь под рабочей характеристической кривой, составляющая ~0,76, является обычной для подобных факторов риска, и снова составляет только приблизительно половину между подбрасыванием монеты с 0,5 и совершенством с 1,0.
[0006] Добавление новых биомаркеров к шкалам клинического риска вызвало разочарование. Например, в Фрамингемском исследовании (Wang с соавт. «Multiple Biomarkers for the Prediction of First Major Cardiovascular Events and Death» N. Eng. J. Med. 355:2631-2637 (2006)) на 3209 людях, добавление 10 биомаркеров (С-реактивный белок, мозговой натрийуретический пептид, N-терминальный фрагмент предшественника мозгового натрийуретического пептида, альдостерон, ренин, фибриноген, D-димер, ингибитор активатора плазминогена 1 типа, гомоцистеин и соотношение альбумин/креатинин в моче), не улучшало значительно площадь под кривой при добавлении к существующим факторам риска: площадь под кривой для событий 0-5 лет составляла 0,76 с возрастом, полом и общепринятыми факторами риска и 0,77 с наилучшей комбинацией биомаркеров, добавленной к смеси.
[0007] Ранняя идентификация пациентов с повышенным риском сердечно-сосудистого события в пределах 1-10 летнего диапазона важна, потому что более интенсивная терапия индивидов с повышенным риском может улучшать результат. Соответственно, оптимальное управление требует интенсивного вмешательства для снижения риска сердечно-сосудистого события у тех пациентов, у которых, как считается, имеется повышенный риск, в то время как пациенты с более низким риском сердечно-сосудистого события могут быть избавлены от дорогих и потенциально агрессивных видов лечения, которые, вероятно, не вызывают благоприятный результат у пациента.
[0008] Выбор биомаркеров для прогнозирования риска наличия стадии конкретного заболевания или состояния в пределах определенного периода времени включает, во-первых, идентификацию маркеров, которые имеют измеряемое и статистически значимое отличие в популяциях, в которых событие встречалось или не встречалось в течение периода времени для конкретного медицинского применения. Биомаркеры могут представлять собой секретируемые или выделяемые молекулы, которые появляются параллельно развитию или прогрессированию заболевания или состояния и легко диффундируют в кровоток из сердечно-сосудистой ткани или из окружающих тканей и из циркулирующих в периферической крови клеток в ответ на сердечно-сосудистое событие. В общем, клинически подтверждено или показано, что биомаркер или набор идентифицированных биомаркеров являются надежным индикатором для исходного предназначенного использования, для которого он был выбран. Биомаркеры могут представлять собой микромолекулы, пептиды, белки и нуклеиновые кислоты. Некоторые из ключевых проблем, которые влияют на идентификацию биомаркеров, включают чрезмерно близкую подгонку доступных данных и смещение данных.
[0009] В попытке идентифицирования биомаркеров и диагностики или прогнозирования риска наличия заболевания или состояния было использовано множество способов. Для белковых маркеров к ним относятся методы двумерного электрофореза, масс-спектрометрии и иммуноанализа. Для нуклеиновокислотных маркеров к ним относятся профили экспрессии мРНК, профили микроРНК, FISH, серийный анализ генной экспрессии (SAGE), крупноразмерные массивы генной экспрессии, генетическое секвенирование и генотипирование (ОНП или маловариантный анализ).
[0010] Применение двумерного электрофореза ограничено чувствительностью с низким обнаружением; проблемами с растворимостью, зарядом и гидрофобностью белков; воспроизводимостью геля и возможностью единственного пятна, отображающего множество белков. Для масс-спектрометрии, в зависимости от используемого формата, ограничения сконцентрированы вокруг обработки и разделения образцов, чувствительности к малораспространенным белкам, обсуждений соотношения сигнала и шума и неспособности к немедленной идентификации выявленного белка. Ограничения подходов иммуноанализа к исследованию биомаркеров сосредоточены на неспособности основанных на антителах мультиплексных анализах измерять большое количество анализируемых веществ. Можно просто распечатать массив высококачественных антител и, без сэндвичей, измерять аналиты, связанные с данными антителами. (Это было бы формальным эквивалентом использования целого генома нуклеиновокислотных последовательностей для измерения посредством гибридизации всех последовательностей ДНК или РНК в организме или клетке. Гибридизационный эксперимент работает потому, что гибридизация может быть строгим критерием идентичности. Даже очень хорошие антитела не являются достаточно точными в выборе своих моделей связывания, чтобы действовать в контексте экстрактов крови или даже клеток, потому что белковая группа в данных матрицах имеет чрезвычайно различное распространение). Соответственно, необходимо использовать подход к исследованию биомаркеров, отличающийся от основанных на иммуноанализе подходов - нужно было бы использовать мультиплексные анализы ELISA (то есть, сэндвичи) для получения достаточной точности для измерения одновременно множества аналитов чтобы решить, какие аналиты на самом деле являются биомаркерами. Сэндвич-иммуноанализы не соразмерны по многим параметрам, и соответственно исследование биомаркеров с использованием строгих сэндвич-иммуноанализов не возможно при использовании форматов стандартных массивов. И наконец, антитела-реагенты ограничены существенной долей изменчивости и нестабильности реагентов. Настоящая основа для исследования биомаркеров белков преодолевает данную проблему.
[0011] Множество данных способов требуют или основаны на своего рода фракционировании образцов перед анализом. Соответственно, приготовление образцов, требующееся для проведения достаточно мощного исследования, разработанного для идентификации и обнаружения статистически релевантных биомаркеров в сериях вполне определенных популяций образцов, является чрезвычайно трудным, дорогостоящим и времязатратным. В процессе фракционирования, различным образцам может быть придан широкий диапазон изменчивости. Например, потенциальный маркер может быть нестабильным при обработке, концентрация маркера может изменяться, может возникать неуместная агрегация или дезагрегация, и может возникать ненамеренное загрязнение образцов, которое соответственно скрывает незаметные изменения, ожидаемые при предшествующем заболевании.
[0012] Повсеместно признано, что способы выявления и обнаружения биомаркеров с использованием данных технологий имеют серьезные ограничения для идентификации диагностических или прогнозирующих биомаркеров. Данные ограничения включают неспособность выявления слабораспространенных биомаркеров, неспособность постоянно охватывать весь динамический диапазон протеома, невоспроизводимость при обработке и фракционировании образцов и общую невоспроизводимость и недостаток надежности способа. Кроме того, данные исследования вводят смещения в данные и неадекватно справляются с комплексностью популяций образцов, включая соответствующие контроли, в показателях распределения и рандомизации, требующихся для идентификации и подтверждения биомаркеров в пределах популяции выделенного заболевания.
[0013] Хотя усилия, направленные на обнаружение новых и эффективных биомаркеров, продолжались в течение нескольких десятилетий, усилия были в основном неудачными. Биомаркеры для различных заболеваний обычно идентифицировали в академических лабораториях, обычно с помощью случайных открытий, во время проведения фундаментальных исследований течения некоторых заболеваний. На основании открытия и с небольшими количествами клинических данных, публиковались документы, которые предлагали идентификацию нового биомаркера. однако, большинство данных предложенных биомаркеров не находили подтверждения в качестве реальных или полезных биомаркеров, в первую очередь потому, что небольшое количество протестированных клинических образцов обеспечивает только слабое статистическое доказательство, что в действительности был обнаружен эффективный биомаркер, то есть первоначальная идентификация не была точной в отношении базовых элементов статистики. Поиск научной литературы показывает, что ежегодно с 1994 по 2003 были опубликованы тысячи ссылок, направленных на биомаркеры. Однако, в течение того же самого промежутка времени, Управление по контролю за пищевыми продуктами и лекарственными средствами подтверждало для диагностического применения, самое большее, три новых белковых биомаркера в год, и за несколько лет не было подтверждено ни одного нового белкового биомаркера.
[0014] На основании истории неудачных усилий поиска биомаркеров были предложены теории, которые продвигают дальше общее понимание, что биомаркеры для постановки диагноза, прогноза или прогнозирования риска развития заболеваний и состояний являются редкими и их трудно обнаружить. Поиск биомаркеров на основании двумерной гель- или масс-спектрометрии поддерживает данные представления. С помощью данных подходов было идентифицировано очень немного подходящих биомаркеров. Однако, обычно упускают из виду, что двумерная гель- и масс-спектрометрия измеряют белки, которые присутствуют в крови в концентрациях, составляющих приблизительно 1 нМ и выше, и что наименее вероятно, что данная группа белков вполне может изменяться с заболеванием или развитием конкретного состояния. В отличие от настоящей платформы для разработки биомаркеров, не существуют протеомические платформы для разработки биомаркеров, которые в состоянии точно измерять уровни экспрессии белков с намного более низкими концентрациями.
[0015] О биохимических путях для комплексной биологии человека известно много. Много биохимических путей завершаются или начинаются с секретируемых белков, которые действуют локально при патологии; например, при патологии факторы роста секретируются для стимулирования репликации других клеток, а другие факторы секретируются, чтобы блокировать иммунную систему, и так далее. В то время как множество данных секретируемых белков действуют паракринным образом, некоторые работают дистально в организме. Квалифицированный специалист в данной области с базовым пониманием биохимических путей должен понять, что множество специфических для патологии белков должны существовать в крови в концентрациях ниже (даже существенно ниже) пределов обнаружения двумерной гель и масс-спектрометрии. Идентификации данного относительно распространенного количества биомаркеров заболевания должна предшествовать протеомическая платформа, которая может анализировать белки в концентрациях ниже, чем концентрации, обнаруживаемые двумерной гель или масс-спектрометрией.
[0016] Как обсуждается выше, сердечно-сосудистым событиям может предшествовать интенсивная терапия, если можно точно определить предрасположенность к подобным событиям. Существующие многомаркерные тесты либо требуют сбора многочисленных образцов индивида, либо требуют, чтобы образец был разделен между множеством анализов. Оптимально, усовершенствованный тест должен требовать только единственный образец крови, мочи или другой образец и единственный анализ. Соответственно, существует потребность в биомаркерах, способах, устройствах, реагентах, системах и наборах, которые предоставляют возможность прогнозирования сердечно-сосудистых событий в пределах 5-летнего периода.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0017] Представленная заявка содержит биомаркеры, способы, реагенты, устройства, системы и наборы для прогнозирования риска наличия сердечно-сосудистого (CV) события в пределах 5-летнего периода. Биомаркеры представленной заявки идентифицировали с использованием мультиплексного основанного на анализе SOMAmer, который подробно описан в Примерах 1 и 2. За счет использования основанного на SOMAmer метода идентификации биомаркеров, описанного в данном документе, данная заявка описывает неожиданно большое количество биомаркеров сердечно-сосудистых событий, которые используются для прогнозирования сердечно-сосудистых событий. Популяция образцов, используемая для обнаружения биомаркеров, связанных с риском сердечно-сосудистого события, была получена из Heart & Soul Study, проспективного когортного обследования, исследующего развитие заболевания коронарных артерий в популяции с предшествующим сердечно-сосудистым заболеванием, включая предшествующий инфаркт миокарда, признак стеноза более чем 50% в 1 или более коронарных сосудов, ишемию, вызванную нагрузкой при тредмил- или ядерном стресс-тесте, или предшествующую коронарную реваскуляризацию. Участники были набраны из San Francisco Bay Area. В Таблице 4 показаны тип и время сердечно-сосудистого события для обследуемой популяции. При идентификации данных биомаркеров сердечно-сосудистых событий было измерено свыше 1000 белков из образцов свыше 900 индивидов, некоторые из которых находились в концентрациях в низком фемтомолярном диапазоне. Его величина приблизительно на четыре порядка ниже, чем у экспериментов по обнаружению биомаркеров, проводимых с помощью двумерной гель и/или масс-спектрометрии.
[0018] В то время как некоторые из описанных биомаркеров сердечно-сосудистых событий используются по отдельности для прогнозирования риска наличия сердечно-сосудистого события, в данном документе описаны способы для группировки множества подгрупп биомаркеров сердечно-сосудистых событий, которые используются в виде панели биомаркеров. После того, как биомаркер или подгруппа биомаркеров индивида были идентифицированы, прогноз риска сердечно-сосудистого события у индивида может быть выполнен с использованием любой платформы или формата анализа, который допускает измерение различий уровней выбранного биомаркера или биомаркеров в биологическом образце.
[0019] Однако, только за счет использования основанного на SOMAmer метода идентификации биомаркеров, описанного в данном документе, в котором свыше 1000 отдельных потенциальных значений биомаркеров были индивидуально отобраны у большого числа индивидов, которые были ранее диагностированы либо как имеющие, либо не имеющие сердечно-сосудистое событие в пределах 5-летнего промежутка времени, было возможно идентифицировать биомаркеры сердечно-сосудистых событий, раскрытые в данном документе. Данный исследовательский подход находится в резком контрасте с исследованием биомаркеров в образцах тканей, кондиционированных средах или лизированных клетках, так как он запрашивает более соответствующую пациенту систему, которая не требует обращения к патологии индивида. Кроме того, данная форма измерения на основе крови куда более применима клинически.
[0020] Соответственно, в одном аспекте настоящей заявки, предоставлены один или более биомаркеров для использования либо по отдельности, либо в различных комбинациях для прогнозирования риска возникновения сердечно-сосудистого события в пределах 5-летнего промежутка времени. Иллюстративные варианты осуществления включают биомаркеры, предоставленные в Таблице 1, столбце 7, «ПУБЛИЧНОЕ НАЗВАНИЕ», которые, как замечено выше, идентифицировали с использованием мультиплексного основанного на SOMAmer анализе, как описано в общем в Примере 1, а более конкретно в Примере 2. Маркеры, предоставленные в Таблице 1, используются при прогнозировании риска наличия сердечно-сосудистого события в пределах 5-летнего периода времени. Биомаркеры из таблицы 2 и таблицы 3, соответственно, демонстрируют уменьшение 155 биомаркеров из таблицы 1 до более маленького количества, которое выполняет ту же задачу с меньшей технической сложностью и стоимостью; однако, из таблицы 1 можно составить другие комбинации с аналогичной эффективностью.
[0021] В то время как некоторые из описанных биомаркеров риска сердечно-сосудистого события для прогнозирования риска сердечно-сосудистого события используются по отдельности в пределах 5 лет, в данном документе также описаны способы группировки множества подгрупп биомаркеров риска сердечно-сосудистого события, каждая из которых используется в виде панели из двух или более биомаркеров. Соответственно, различные варианты осуществления настоящей заявки предоставляют комбинации, содержащие N биомаркеров, где N составляет по меньшей мере два биомаркера. В других вариантах осуществления, N выбирают как любое количество из 2-155 биомаркеров.
[0022] В других вариантах осуществления, N выбирают как любое количество из 2-7, 2-10, 2-15, 2-20, 2-25, 2-30, 2-35, 2-40, 2-45, 2-50, 2-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 2-155. В других вариантах осуществления, N выбирают как любое количество из 3-7, 3-10, 3-15, 3-20, 3-25, 3-30, 3-35, 3-40, 3-45, 3-50, 3-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 3-155. В других вариантах осуществления, N выбирают как любое количество из 4-7, 4-10, 4-15, 4-20, 4-25, 4-30, 4-35, 4-40, 4-45, 4-50, 4-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 4-155. В других вариантах осуществления, N выбирают как любое количество из 5-7, 5-10, 5-15, 5-20, 5-25, 5-30, 5-35, 5-40, 5-45, 5-50, 5-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 5-155. В других вариантах осуществления, N выбирают как любое количество из 6-10, 6-15, 6-20, 6-25, 6-30, 6-35, 6-40, 6-45, 6-50, 6-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 6-155. В других вариантах осуществления, N выбирают как любое количество из 7-10, 7-15, 7-20, 7-25, 7-30, 7-35, 7-40, 7-45, 7-50, 7-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 7-155. В других вариантах осуществления, N выбирают как любое количество из 8-10, 8-15, 8-20, 8-25, 8-30, 8-35, 8-40, 8-45, 8-50, 8-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 8-155. В других вариантах осуществления, N выбирают как любое количество из 9-15, 9-20, 9-25, 9-30, 9-35, 9-40, 9-45, 9-50, 9-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 9-155. В других вариантах осуществления, N выбирают как любое количество из 10-15, 10-20, 10-25, 10-30, 10-35, 10-40, 10-45, 10-50, 10-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 10-155. Необходимо учитывать, что N может быть выбрано для охвата аналогичных диапазонов, но более высокого порядка.
[0023] Как обсуждалось выше, сердечно-сосудистых событий можно избежать с помощью интенсивной терапии, если может быть точно определена предрасположенность к подобным событиям. Многомаркерные тесты предыдущего уровня техники либо требуют сбора многочисленных образцов у индивида, либо требуют, чтобы образец был разделен между многочисленными анализами. Было бы предпочтительно предоставить прогностический анализ, который вместо многочисленных образцов для различных типов анализируемых веществ (липиды, белки, метаболиты) или панелей анализируемых веществ потребовал бы только единственный биологический образец, измеренный в единственном анализе. Основной пользой в тесте с единственным образцом является простота в момент применения, поскольку тест со сборами множества образцов является более сложным для совершения, и это создает препятствие для принятия. Дополнительное преимущество происходит в результате использования этого единственного образца в единственном анализе для многочисленных белков. Единственный анализ должен уменьшить нежелательное отклонение вследствие проверки вместе множества результатов анализов. Тестом, который образует основу для данной заявки, является подобный тест с «единственным образцом, единственным анализом». Данная комбинация единственного образца и единственного анализа представляет собой новую особенность данного теста на риск сердечно-сосудистого события, который решает логистическую сложность сбора многочисленных образцов и проблем и опасностей для живых индивидов, вовлеченных в разделение образцов на множество аликвот для множества независимых аналитических процедур.
[0024] Известно, что сердечно-сосудистое заболевание вовлекает множество биологических процессов и тканей. Хорошо известными примерами биологических систем и процессов, связанных с сердечно-сосудистым заболеванием, являются воспаление, тромбоз, связанный с заболеванием ангиогенез, активация тромбоцитов, активация макрофагов, острый печеночный ответ, ремоделирование экстрацеллюлярного матрикса и почечная функция. Данные процессы могут наблюдаться в качестве половой функции, состояния менопаузы и возраста, и соответствовать состоянию коагуляции и функции сосудов. Поскольку данные системы частично взаимодействуют через основанные на белках сигнальные системы, а в единственном образце крови может быть измерено множество белков, изобретение предоставляет основанный на множестве белков тест с единственным образцом и единственным анализом, сосредоточенный на белках из конкретных биологических систем и процессов, вовлеченных в сердечно-сосудистое заболевание.
[0025] Как обсуждается в данном документе, одной из основных функций измерения риска сердечно-сосудистого события является возможность оценки прогресса в ответ на лечение и изменения поведения, например, рациона и нагрузки. Существующие способы прогнозирования риска, такие как Фрамингемское уравнение, включают информацию, четко коррелирующую с клиническими ковариантами, самым крупным подобным фактором является возраст больного. Это делает Фрамингемское уравнение менее пригодным для мониторинга изменения риска индивида, хотя оно может быть точным для популяции. Новая особенность данного тестирования риска сердечно-сосудистого события состоит в том, что оно не нуждается в возрасте в качестве части прогностической модели. Рассматриваемое изобретение основано на предпосылке, что, в пределах природы старения, имеются причинные факторы, которые являются переменными и соответственно более хорошо используемыми для оценки риска. Изобретение основывается на убеждении, что сам возраст не является причинным фактором заболевания, и что возраст выступает в качестве суррогата или посредника для базовой биологии. В то время как возраст на самом деле является прогностическим признаком сердечно-сосудистых событий, он не может быть использован для оценки индивидуального улучшения, и эффект возраста предположительно опосредован через биологическую функцию. Данный эффект может быть более хорошо определен через измерение соответствующей биологии. В данном изобретении, белки, которые являются мишенью, вовлечены в биологию заболевания. Соответственно, изобретение собирает биологическую информацию, которая отражается в соотношении между возрастом и риском сердечно-сосудистого события. В действительности, добавление фактора возраста в настоящую модель риска на основании белков не улучшает эффективность при прогнозировании событий.
[0026] Стратегия идентификации белков из множества процессов, вовлеченных в сердечно-сосудистое заболевание, вызвала необходимость выбора параметров, которые предоставляли широкий диапазон/разнообразие пациентов с сердечно-сосудистым заболеванием, с наблюдаемым множеством событий или симптомов. События, обусловленные сердечно-сосудистым заболеванием, являются неоднородными, с включением двух основных классов событий: тромботических событий и событий, связанных с застойной сердечной недостаточностью. У некоторых наблюдаемых событий может отсутствовать конкретная диагностическая информация (например, смерть дома). Принимая во внимание данные характеристики сердечно-сосудистого заболевания, было разработано тестирование изобретения посредством измерения белков, вовлеченных в биологические процессы, связанные с сердечно-сосудистым заболеванием, в образцах крови в широком диапазоне событий. Результатом данной стратегии было включение информации о множестве процессов, вовлеченных в заболевание (например, ангиогенез, активация тромбоцитов, активация макрофагов, острый печеночный ответ, другое лимфоцитарное воспаление, ремоделирование экстрацеллюлярного матрикса и почечная функция). Для того, чтобы разработать основанный на множестве белков прогностический тест с единственным образцом для сердечно-сосудистого заболевания, выбранной обследуемой популяцией была группа больных с высоким риском из исследования «Heart & Soul». За счет выбора данного набора больных с высокой нормой сердечно-сосудистых событий, было возможно определить риск, связанный с измерением белков, более точно было бы возможно в общей популяции (внутри которой события являются более редкими). Разработка рассматриваемого теста на данной группе с высоким риском допускала идентификацию комбинаций биомаркеров белков, которые можно было бы обобщить вследствие общей биологии. В результате, тест и биомаркеры рассматриваемого изобретения, вероятно, должны быть эффективными за пределами прогнозирования событий в более крупной популяции, чем те индивиды, которые соответствуют входным критериям исследования «Heart & Soul».
[0027] Как упоминалось выше, сердечно-сосудистое заболевание включает систему свертывания крови, воспалительные белые клетки крови и активацию тромбоцитов. Сигналы активации данных систем в организме могут заглушаться вследствие общих ошибок при подготовке образца, которые приводят к тому, что тромбоциты и белые клетки крови только частично осаждаются из образцов плазмы. Если данные клетки осаждаются не полностью, они могут лизироваться в результате замораживания и оттаивания, когда образцы поставляют и анализируют. В ходе идентификации рассматриваемых биомаркеров становится очевидным, что после замораживания и оттаивания по меньшей мере в некоторых случаях, приготовленные обычным способом образцы содержат целые клетки и тромбоциты. Во время последующего протеомического анализа, любые целые клетки будут лизироваться и мешать определению белков, характеризующих процессы заболевания активации in vivo тромбоцитов и моноцитов. Соответственно, в одном варианте осуществления рассматриваемого изобретения, перед анализом проводят дополнительную стадию повторного центрифугирования образцов после оттаивания. Данная дополнительная стадия центрифугирования может удалять тромбоциты и моноциты, которые в противном случае препятствовали бы идентификации биомаркеров, связанных с активацией тромбоцитов и моноцитов. Дополнительная стадия удаления из образцов нерастворимых и клеточных компонентов (посредством центрифугирования или фильтрования) представляет улучшение тестирования риска сердечно-сосудистого события, которое, как считается, не было описано в предыдущем уровне техники.
[0028] Несмотря на то, что имеются конкретные белки, которые, как известно из литературы, являются прогностическими для сердечно-сосудистых событий, такие как аполипопротеин B, аполипопротеин A-1, BNP и с-реактивный белок, и которые имеют известные связи с сердечно-сосудистым заболеванием, не было ясно, что конкретный набор измерений белков можно объединить для оптимального выполнения в показателях эффективности прогнозирования вследствие общей биологической информации, отображаемой множеством измерений белков. Конкретный пример того, как комбинации белков, по наблюдениям, изменяющихся в процессе сердечно-сосудистого заболевания, не могут обеспечить оптимальную эффективность прогнозирования, включает множество небольших белков сыворотки, выводимых в моче, которые связаны с почечной функцией, которую измеряют с помощью скорости клубочковой фильтрации (GFR). Слабая почечная функция, которую показывает низкая GFR, связана с сердечно-сосудистым риском. Соответственно, множество небольших белков, связанных с низкой GFR, похоже, связано с сердечно-сосудистым заболеванием, но не независимо. В процессе разработки рассматриваемого теста, были сделаны корректировки измерений белков для расчетной GFR для того, чтобы определить, какие белки предоставляли дополнительное прогностическое значение за пределами GFR.
[0029] Измерение GFR является безусловно полезным при прогнозировании риска сердечно-сосудистого события. Однако, клиническое измерение GFR включает сбор мочи на протяжении 24 часов, что не соответствует рассматриваемому стандарту теста с «единственным образцом, единственным анализом». Другие оценки GFR являются менее обременительными; однако, в достижении цели прогностического теста с «единственным образцом», стратегия, лежащая в основе рассматриваемого изобретения, с целью анализа риска стремилась использовать сами измерения белков для предоставления информации о GFR. Например, в модели из десяти маркеров Таблицы 3, белок ESAM надежно прогнозирует риск сердечно-сосудистого события вследствие его корреляции с GFR. После корректировки измерений белка ESAM для удаления корреляции с расчетной GFR, ESAM больше не прогнозирует риск. Данное использование белка, такого как ESAM, для передачи биологического сигнала, связанного с GFR в «единственном образце, единственном анализе» представляет новое улучшение прогнозирования сердечно-сосудистого события.
[0030] Идентификация биомаркеров таблицы 3 включала отбор белков, которые могли бы работать вместе при прогнозировании сердечно-сосудистого события. Исследования, такие как у Wang, T. с соавторами (2006) N. Eng. J. Med. 355:2631-9, показали, что комбинации биомаркеров часто не в состоянии обеспечить дополнительную эффективность сверх простых расчетов риска с использованием общей клинической информации, такой как возраст и уровни липидов. Для того, чтобы избежать специальной комбинации биомаркеров, рассматриваемое изобретение предоставляет процедуру статистического анализа, в котором белки были отобраны как за свою индивидуальную прогностическую силу, так и, самое главное, за способность белков синергетически действовать вместе для улучшения прогностического значения комбинации. Множество независимых биологических процессов представлены в модели из десяти маркерных белков Таблицы 3, предоставленной в данном документе.
[0031] В одном варианте осуществления, изобретение содержит способ оценки риска будущего сердечно-сосудистого (CV) события в пределах 5-летнего периода времени в популяции. Данный способ включает определение, в биологическом образце индивида популяции, значений биомаркеров, каждое из которых соответствует одному из по меньшей мере N биомаркеров, выбранных из таблицы 1, где риск для индивида сердечно-сосудистого события оценивают на основании значений биомаркеров, и где N=2-155. В еще одном варианте осуществления, биомаркеры выбирают из таблицы 2, а N=2-46. В еще одном варианте осуществления, биомаркеры выбирают из таблицы 3, а N=2-10.
[0032] В одном варианте осуществления, отбор популяции происходит таким образом, чтобы популяция характеризовалась тем, что не имеет предшествующего анамнеза сердечно-сосудистого заболевания. В альтернативе, популяция может быть выбрана таким образом, чтобы она характеризовалась тем, что имеет предшествующий анамнез сердечно-сосудистого заболевания.
[0033] Предшествующий анамнез может включать предшествующий инфаркт миокарда, ангиографические данные о стенозе более чем 50% в 1 или более коронарных сосудов, вызванную нагрузкой ишемию при тредмил- или ядерном стресс-тесте или предшествующую коронарную реваскуляризацию.
[0034] Кроме того, популяция может быть выбрана таким образом, чтобы она характеризовалась генетическими факторами риска, включая мутации, одиночные нуклеотидные полиморфизмы и вставки/делеции. Подобные генетические факторы риска могут быть использованы для дополнения оценки риска.
[0035] Оценка риска сердечно-сосудистого события может быть измерена по динамической шкале, которая реагирует на изменение с течением времени в ответ на вмешательства, включая терапевтические средства, программы питания, добавки, изменение образа жизни, программы прекращения курения и протоколы управления заболеванием.
[0036] Вышеупомянутые способы, связанные с оценкой риска сердечно-сосудистого события в течение 5-летнего периода, могут быть использованы для подразделения индивидов по программам управления прогрессирующим или регрессирующим заболеванием, на основании значений их биомаркеров. Способ также может быть использован для стратификации индивидов по группам с различными рисками, связанным со страховым покрытием по страхованию жизни в зависимости от указанного значения биомаркера. Также, они могут быть использованы для оценки риска сердечно-сосудистого события для того, чтобы стратифицировать индивидов по группам с различными рисками, связанным с покрытием медицинской страховки в зависимости от указанного значения биомаркера. Кроме того, они могут быть использованы для оценки потенциальных кандидатов для партнерства в зависимости от значения биомаркеров.
[0037] Кроме того, вышеупомянутые способы прогнозирования риска сердечно-сосудистых событий могут быть использованы для: прогнозирования потребления медицинских ресурсов популяции на основании значений биомаркеров; использования значения биомаркера индивида в качестве входного критерия для клинических испытаний сердечно-сосудистых терапевтических средств; прогнозирования эффективности результатов клинических испытаний на основании значения указанного биомаркера; использования значения биомаркера для наблюдения за сердечно-сосудистой безопасностью сердечно-сосудистого терапевтического средства или любого терапевтического агента; использования значения биомаркера в качестве суррогатной конечной точки эффективности сердечно-сосудистых терапевтических средств; и/или отслеживания соблюдения любого вмешательства, пищевого или терапевтического протокола на основании значения указанного биомаркера. Что касается наблюдения за безопасностью для сердечно-сосудистой системы сердечно-сосудистого терапевтического средства или любого терапевтического агента, подобное наблюдение важно в больших, дорогостоящих, требующих фазы 3 исследованиях безопасности для сердечно-сосудистой системы сердечно-сосудистого терапевтического средства и не являющихся сердечно-сосудистыми лекарственных средств практически для каждого длительного применения.
[0038] Рассматриваемый способ оценки риска сердечно-сосудистого события также может быть использован для выбора или направления индивида к другим диагностическим процедурам на основании значения указанного биомаркера. Кроме того, рассматриваемый способ может быть использован для выбора сердечно-сосудистого терапевтического средства на основании значения биомаркера.
[0039] В рассматриваемом способе оценки риска сердечно-сосудистого события, значения биомаркеров могут быть выявлены посредством проведения анализа in vitro. Анализ in vitro может включать по меньшей мере один захватывающий реагент, соответствующий каждому из биомаркеров и, дополнительно может содержать по меньшей мере один захватывающий реагент из группы, состоящей из SOMAmer, антител и зонда на основе нуклеиновой кислоты. В предпочтительном варианте осуществления, захватывающий реагент представляет собой SOMAmer.
[0040] В еще одном варианте осуществления, анализ in vitro может быть выбран из группы, состоящей из иммуноанализа, основанного на анализе SOMAmer, гистологического или цитологического анализа и анализа уровня экспрессии мРНК.
[0041] В рассматриваемых способах, биологическим образцом может быть цельная кровь, плазма, сыворотка, моча и тому подобное. В предпочтительном варианте осуществления, биологическим образцом является сыворотка, плазма или моча.
[0042] Кроме того, предусмотрено, что в рассматриваемых способах индивидом может быть млекопитающее и, в частности, человек.
[0043] В альтернативных вариантах осуществления рассматриваемых способов, N=3-10; N=3-15; N=2-10; N=4-10; или N=5-10.
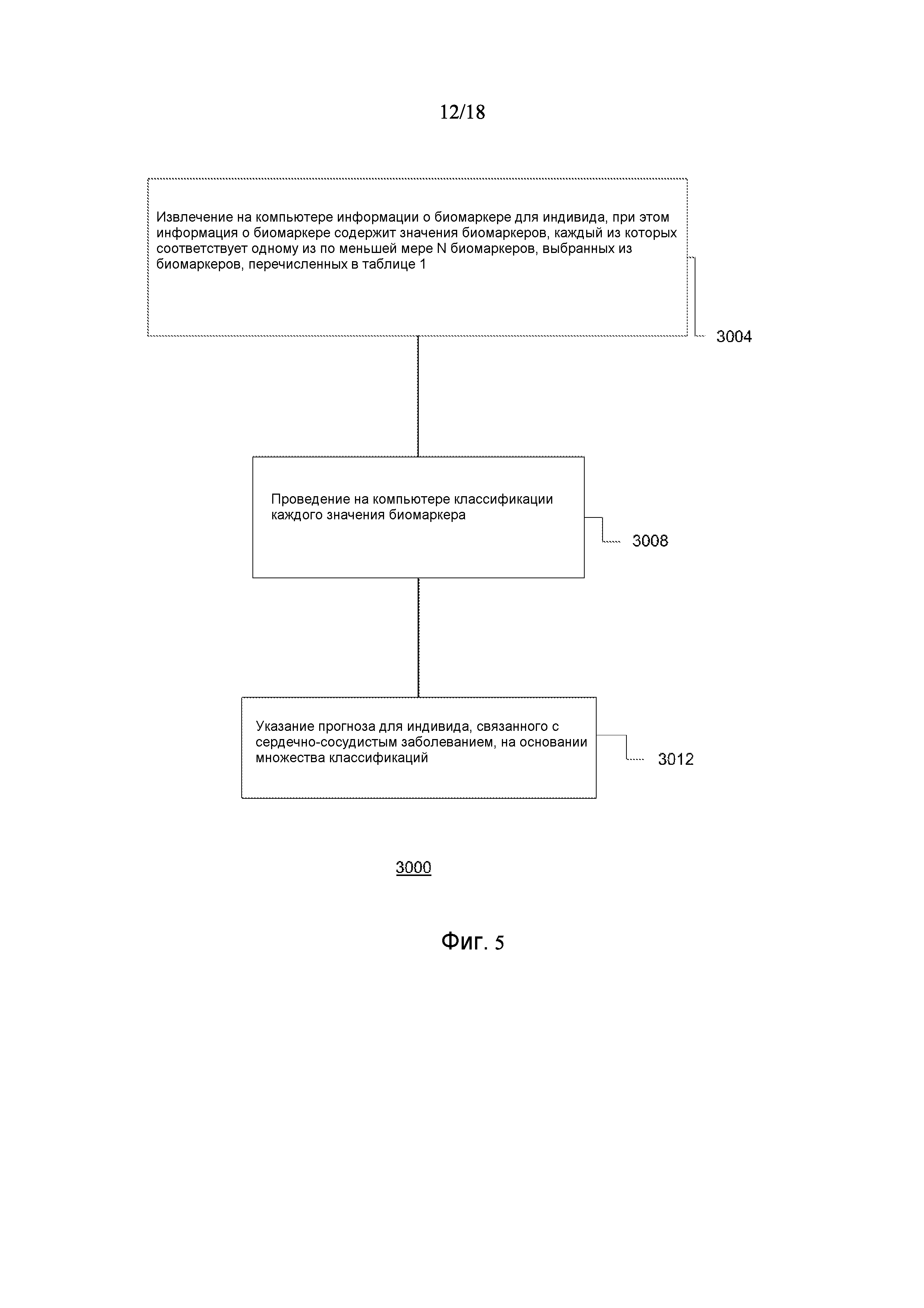
[0044] В еще одном варианте осуществления, изобретение предусматривает основанный на применении компьютеров способ оценки риска сердечно-сосудистого (CV) события. Данный способ может включать извлечение компьютерной информации о биомаркере для индивида, где информация о биомаркере содержит значения биомаркеров, каждое из которых соответствует одному из по меньшей мере N биомаркеров, выбранных из таблицы 1; выполнение с помощью компьютера классификации каждого из значений биомаркеров; и показ результата оценки риска для сердечно-сосудистого события для указанного индивида на основании множества классификаций, и где N=2-155. В альтернативных вариантах осуществления данного способа, биомаркеры могут быть выбраны из таблицы 2 (с N=2-46) или Таблицы 3 (с N=2-10).
[0045] Результат оценки риска сердечно-сосудистого события для индивида может быть выведен на компьютерный дисплей.
[0046] В еще одном варианте осуществления, изобретение содержит компьютерный программный продукт для оценки риска сердечно-сосудистого события. Компьютерный программный продукт может содержать машиночитаемый носитель, реализующий программный код, выполняемый процессором вычислительного устройства или системы, где программный код содержит: код, который извлекает данные, относящиеся к биологическому образцу индивида, где данные содержат значения биомаркеров, каждое из которых соответствует одному из по меньшей мере N биомаркеров, выбранных из таблицы 1, где биомаркеры были обнаружены в биологическом образце; и код, который осуществляет способ классификации, который показывает результат оценки риска для сердечно-сосудистого события индивида в качестве функции указанных значений биомаркеров. Когда биомаркеры выбирают из таблицы 1, столбец 7, N=2-155. В других вариантах осуществления, биомаркеры могут быть выбраны из таблицы 2 (с N=2-46) или из таблицы 3 (с N=2-10).
[0047] Способ классификации может использовать непрерывный счет или измерение или меру риска. Способ классификации также может использовать два или более классов.
[0048] Рассматриваемое изобретение дополнительно содержит способ скрининга индивида для оценки риска сердечно-сосудистого события. Данный способ включает определение, в биологическом образце индивида, значений биомаркеров, каждое из которых соответствует одному из по меньшей мере N биомаркеров, выбранных из таблицы 1, где индивид оценивается по риску сердечно-сосудистого события на основании указанных значений биомаркеров, и где N=2-155. В других вариантах осуществления биомаркеры могут быть выбраны из таблицы 2 (с N=2-46) или из таблицы 3 (с N=2-10), соответственно.
[0049] В рассматриваемых способах, определение значений биомаркеров может быть проделано в анализе in vitro. Подобный анализ in vitro может содержать по меньшей мере один захватывающий реагент, соответствующий каждому из биомаркеров, и дополнительно может включать выбор по меньшей мере одного захватывающего реагента из группы, состоящей из SOMAmer, антител и зонда на основе нуклеиновой кислоты. Предпочтительно, по меньшей мере один захватывающий реагент представляет собой SOMAmer. Анализ in vitro может быть выбран из иммуноанализа, основанного на анализе SOMAmer, гистологического или цитологического анализа и анализа уровня экспрессии мРНК.
[0050] Биологический образец может быть выбран из цельной крови, плазмы, сыворотки, мочи и тому подобного. Предпочтительно, биологическим образцом является сыворотка, плазма или моча. В рассматриваемом способе, индивидом может быть млекопитающее, а предпочтительно человек.
[0051] В одном из вариантов осуществления рассматриваемого изобретения предусмотрено, что индивид оценивается по риску сердечно-сосудистого события, на основании указанных значений биомаркеров и по меньшей мере одного пункта дополнительной биомедицинской информации, соответствующей указанному индивиду. По меньшей мере один пункт дополнительной биомедицинской информации может включать, но без ограничения, любое из следующего: (a) информацию, соответствующую наличию факторов риска сердечно-сосудистых заболеваний, включая одно или более из предшествующего инфаркта миокарда, ангиографических данных о стенозе в одном или более коронарных сосудах более чем 50%, вызванной нагрузкой ишемии при тредмил- или ядерном стресс-тесте или предшествующей коронарной реваскуляризации; (b) информацию, соответствующую физическим дескрипторам указанного индивида; (c) информацию, соответствующую изменению массы указанного индивида; (d) информацию, соответствующую этнической принадлежности указанного индивида; (e) информацию, соответствующую полу указанного индивида; (f) информацию, соответствующую анамнезу курения указанного индивида; (g) информацию, соответствующую анамнезу потребления алкоголя указанного индивида; (h) информацию, соответствующую профессиональному анамнезу указанного индивида; (i) информацию, соответствующую семейному анамнезу сердечно-сосудистого заболевания или другим состояниям сердечно-сосудистой системы указанного индивида; j) информацию, соответствующую наличию или отсутствию у указанного индивида по меньшей мере одного генетического маркера, коррелирующего с повышенным риском сердечно-сосудистого заболевания у указанного индивида или члена семьи указанного индивида; (k) информацию, соответствующую клиническим симптомам индивида; (l) информацию, соответствующую другим лабораторным испытаниям; (m) информацию, соответствующую значениям генной экспрессии индивида; (n) информацию, соответствующую употреблению указанным индивидом известных факторов риска сердечно-сосудистых заболеваний, таких как рацион с высоким содержанием насыщенных жиров, с высоким содержанием соли; (o) информацию, соответствующую исследованиям визуализации индивида, включая электрокардиограмму, электрокардиографию, ультразвуковое исследование сонных артерий на толщину интимы-медии, поток-опосредованное расширение, скорость распространения пульсовой волны, лодыжечно-плечевой индекс, стресс-эхокардиографию, визуализацию перфузии миокарда, КТ-диагностику коронарного кальциноза, КТ-ангиографию высокого разрешения, магниторезонансную визуализацию и другие методы медицинской визуализации; и (p) информацию о медикаментозном лечении.
[0052] Изобретение дополнительно содержит панель биомаркеров для оценки риска сердечно-сосудистого события в будущем в пределах пятилетнего периода времени, где панель содержит N биомаркеров, выбранных из группы, состоящей из биомаркеров таблицы 1, где N=2-155. В альтернативных вариантах осуществления, биомаркеры выбирают из таблицы 2, где N=2-46 или из таблицы 3, где N=2-10.
[0053] В еще одном аспекте, изобретение содержит способ скрининга индивида в популяции посредством оценки или прогнозирования риска сердечно-сосудистого события в будущем в пределах 5-летнего периода, посредством выявления, в биологическом образце индивида, значения биомаркера для ангиопоэтина-2, и определения риска сердечно-сосудистого события в будущем на основании значения биомаркера ангиопоэтина-2. Значение биомаркера может быть выражено, как показание измерения или классификация в одну из множества классификаций.
[0054] В варианте способа скрининга с использованием ангиопоэтина-2, рассматриваемое изобретение также включает добавление к способу, перед стадией определения, стадии, содержащей предоставление информации, касающейся применения индивидом статина. Соответственно, определение риска сердечно-сосудистого события в будущем основано на значении биомаркера ангиопоэтина-2 и информации о статине.
[0055] Ангиопоэтин-2 неожиданно подходит для прогнозирования вторичного сердечно-сосудистого события для индивидов, принимающих статины. В предыдущем уровне техники сообщалось, что статины не только снижают риск вторичного сердечно-сосудистого события, но также вызывают увеличение ангиопоэтина-2. Можно было бы ожидать, что данное повышение ангиопоэтина-2 сведет на нет его использование в качестве биомаркера. Неожиданно, ангиопоэтин-2 продемонстрировал, что он является хорошим маркером для прогнозирования вторичных сердечно-сосудистых событий у индивидов с высоким риском.
[0056] Способ определения значения биомаркера ангиопоэтина-2 дополнительно может включать стадию: определения в биологическом образце значений биомаркера для одного или более из биомаркеров MMP7, CHRDL1, MATN2, PSA-ACT или их комбинации. Способ дополнительно может включать определение, в биологическом образце, значений биомаркеров, каждое из которых соответствует N биомаркерам, выбранным из биомаркеров таблицы 3, где N=2-10.
[0057] В еще одном аспекте, изобретение предоставляет панель биомаркеров для скрининга индивида в популяции посредством оценки или прогнозирования риска сердечно-сосудистого события в будущем в пределах 5-летнего периода. Панель содержит по меньшей мере биомаркер ангиопоэтин-2. Данная панель дополнительно может содержать один или более из биомаркеров MMP7, CHRDL1, MATN2, PSA-ACT или любую их комбинацию. В дополнение, панель может содержать один или более биомаркеров, выбранных из таблицы 3, где N=2-10.
[0058] В еще одном варианте осуществления, изобретение обеспечивает способ скрининга индивида посредством оценки риска сердечно-сосудистого события в будущем в пределах 5-летнего периода, где оценка включает дифференциальный прогноз тромботического события или события застойной сердечной недостаточности (CHF). Данный способ включает: определение в биологическом образце индивида популяции, значений биомаркеров, каждое из которых соответствует биомаркеру GPVI для прогнозирования тромботического события, и биомаркеру MATN2 для прогнозирования события CHF. Способ может дополнительно включать стадию определения в биологическом образце значений биомаркеров для N биомаркеров, выбранных из группы биомаркеров, приведенных в Таблице 3, где N=3-10. Тромботическое событие может включать любое из инфаркта миокарда (MI), транзиторной ишемической атаки (TIA), инсульта, острого коронарного синдрома и необходимости коронарной реваскуляризации.
[0059] Дополнительно предоставлена панель биомаркеров для скрининга индивида в популяции посредством оценки или прогнозирования риска сердечно-сосудистого события в будущем в пределах 5-летнего периода, где панель содержит биомаркер GPVI и биомаркер MATN2. Панель дополнительно может содержать по меньшей мере один из N биомаркеров, выбранных из группы, состоящей из биомаркеров, приведенных в Таблице 3.
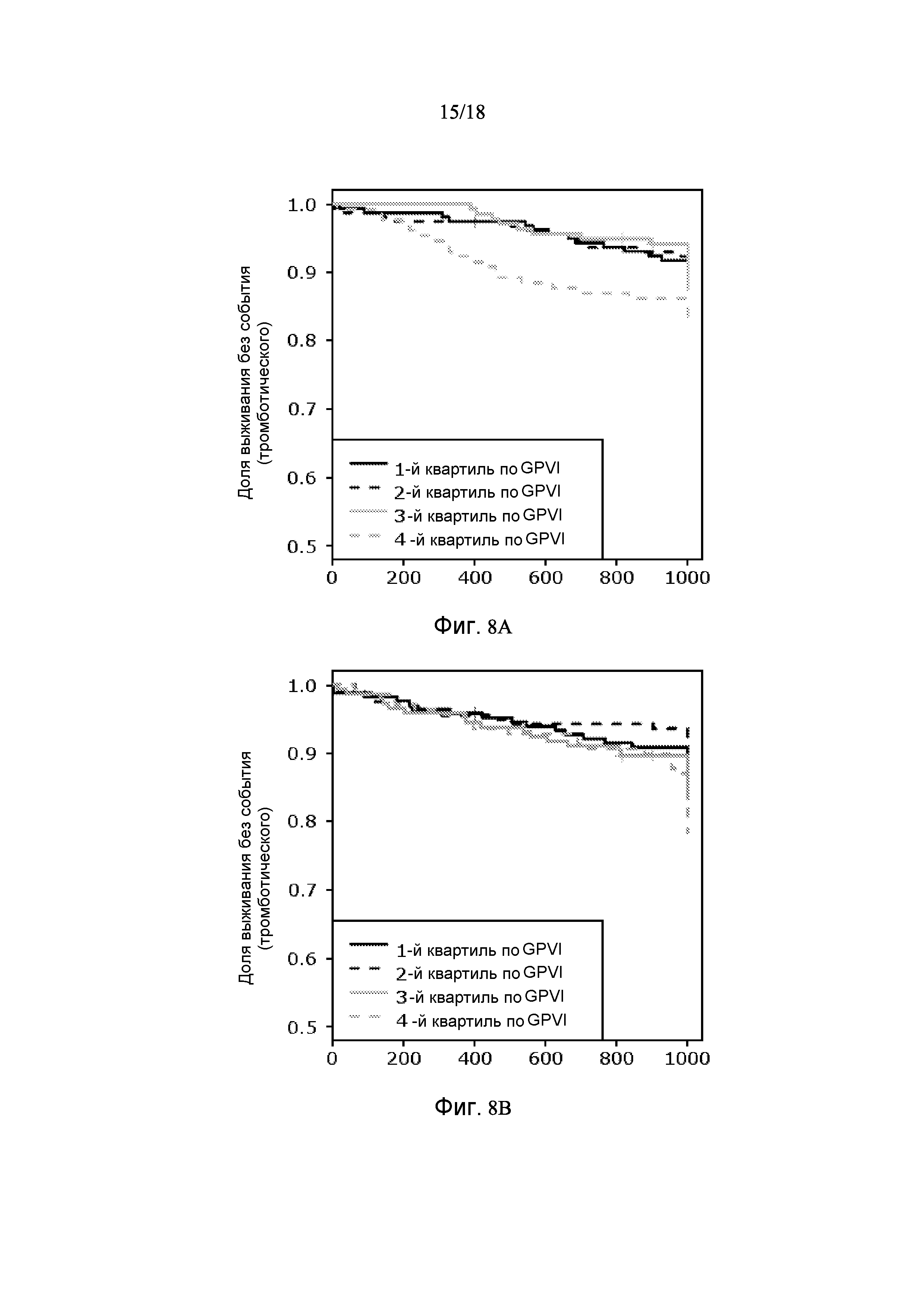
[0060] Доступно множество классов лечения для сердечно-сосудистого заболевания, отражая множество вовлеченных биологических систем. Например, при лечении сердечно-сосудистого заболевания используют антитромботическое средство, ингибитор тромбоцитов, средства для лечения липидного обмена, водно-солевого баланса и бета-блокаторы. Для того, чтобы направлять лечение, полезно идентифицировать не только общий риск, но также выделить класс события, обусловленный биологией. Вышеупомянутый способ с использованием MATN2 и GPVI обеспечивает возможность выделения возможных классов событий из тромботических событий и событий CHF. GPVI является более специфическим к развитию тромботического события, и MATN2 является более специфическим к событиям CHF. Специфичность GPVI к тромботическим событиям продемонстрирована на фигурах 8A и 8B. Специфичность MATN2 для прогнозирования CHF проиллюстрирована на фигурах 9A и 9B. Данные различия можно интерпретировать в показателях связанных биологических процессов. Вследствие этого, данный основанный на множестве белков тест может предоставить пациенту информацию для выделения риска развития CHF против риска тромботических событий. Это является значительной и важной особенностью изобретения, о которой есть основания полагать, что она не была описана в предыдущем уровне техники.
[0061] В дополнение к предоставлению прогноза риска сердечно-сосудистого события на основании измерения белков по отдельности, рассматриваемый способ также обеспечивает преимущество более полной картины, получаемой в результате учета простой информации, такой как пол, медикаментозное лечение, другие маркеры, такие как холестерин ЛПНП, холестерин ЛПВП, общий холестерин и другие состояния, такие как диабет. Подобные модели можно строить на основании существующей модели десяти белков Таблицы 3, представленной в данном описании.
[0062] Кроме того, в данном документе предоставлен набор для скрининга индивида в популяции посредством оценки или прогнозирования риска сердечно-сосудистого события в будущем в пределах 5-летнего периода. Набор содержит следующие компоненты: по меньшей мере один из биомаркеров, приведенных в Таблице 1; по меньшей мере один соответствующий захватывающий реагент, где каждый из соответствующих захватывающих реагентов является специфическим к выбранным биомаркерам; и генерирующий сигнал материал, где указанный материал является специфическим к выбранным соответствующим биомаркерам и/или соответствующим захватывающим реагентам, причем каждый сигнал активируется при соединении каждого захватывающего реагента с соответствующим биомаркером.
[0063] В еще одном аспекте, набор может содержать один или более биомаркеров, выбранных из группы, состоящей из: биомаркера ангиопоэтина-2; биомаркера ангиопоэтина-2 и любого биомаркера, выбранного из группы, состоящей из MMP7, CHRDL1, MATN2, PSA-ACT и любой их комбинации; биомаркера, выбранного из группы, состоящей из биомаркера GPVI, биомаркера MATN2 и любой их комбинации; N биомаркеров, выбранных из группы биомаркеров, приведенных в Таблице 3, где N=2-10; и любой их комбинации.
[0064] Захватывающими реагентами наборов может быть любой один или более из SOMAmer, антител и зондов для нуклеиновых кислот или их комбинаций. Набор также может содержать инструкции или одну или более программ или компьютерных программных продуктов для классификации индивида, у которого был получен биологический образец, как либо имеющего, либо не имеющего повышенный риск сердечно-сосудистого события.
[0065] В еще одном варианте осуществления, рассматриваемое изобретение содержит классификатор, содержащий биомаркеры таблицы 1, столбец 7, Таблицы 2 или Таблицы 3.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
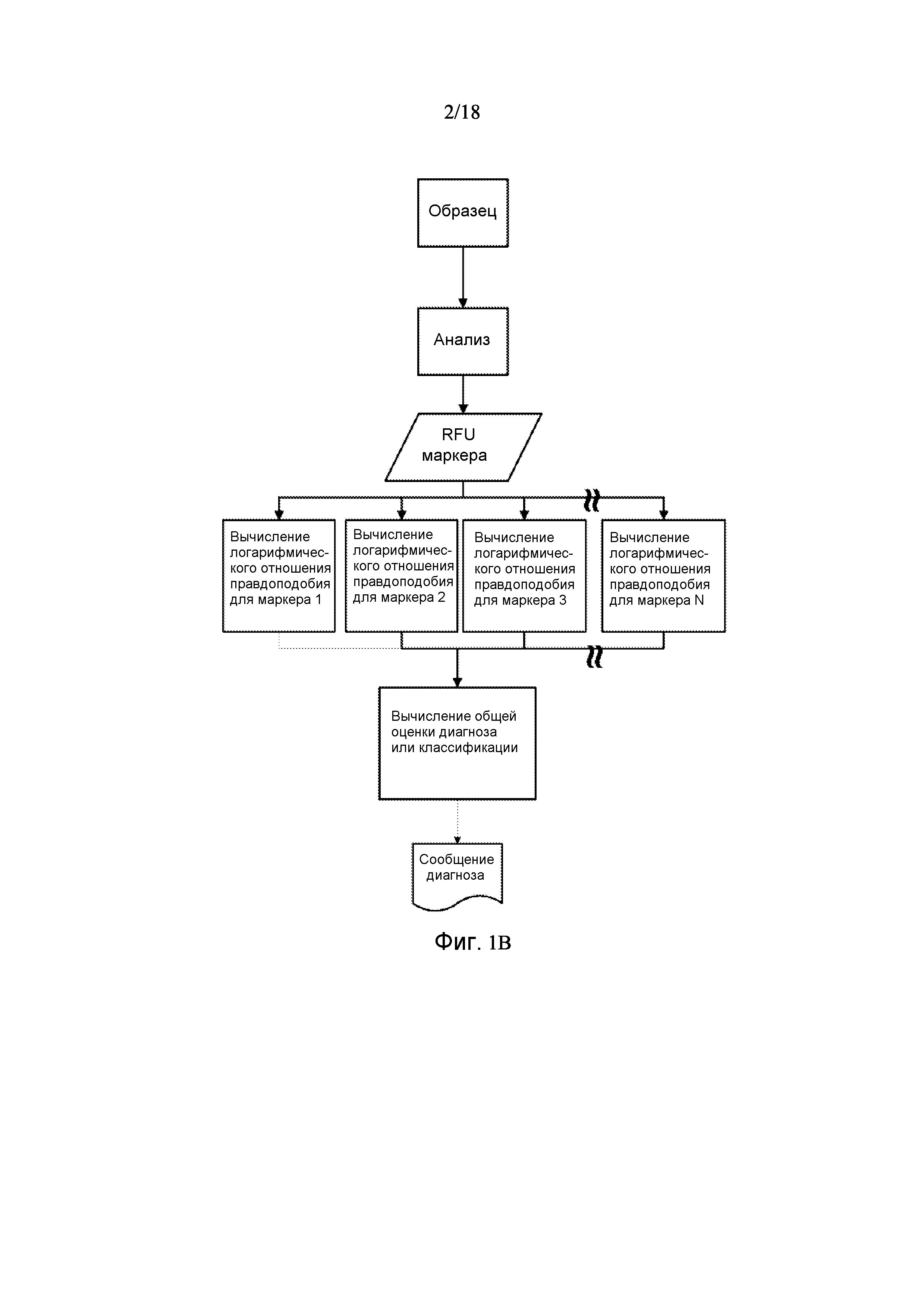
[0066] Фигура 1A представляет собой блок-схему иллюстративного способа прогнозирования сердечно-сосудистого события в биологическом образце. Фигура 1B представляет собой блок-схему иллюстративного способа прогнозирования сердечно-сосудистого события в биологическом образце с использованием примитивного метода классификации Байеса.
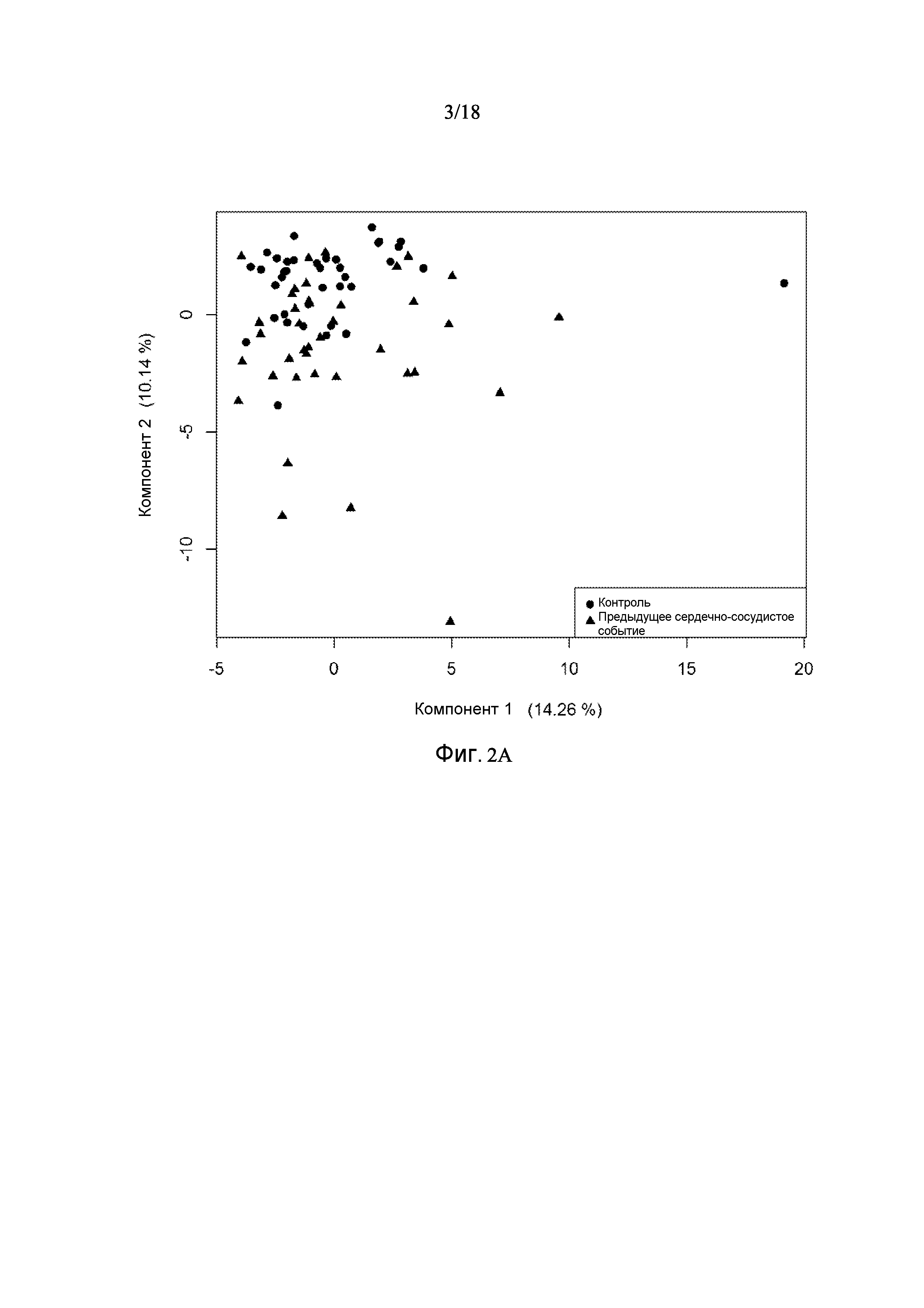
[0067] Фигура 2A показывает анализ главных компонентов для подгруппы случаев с событиями и контрольные группы без сердечно-сосудистых событий в пределах 6 месяцев. Случаи с событиями частично отделены от контрольных групп вдоль вертикальной оси.
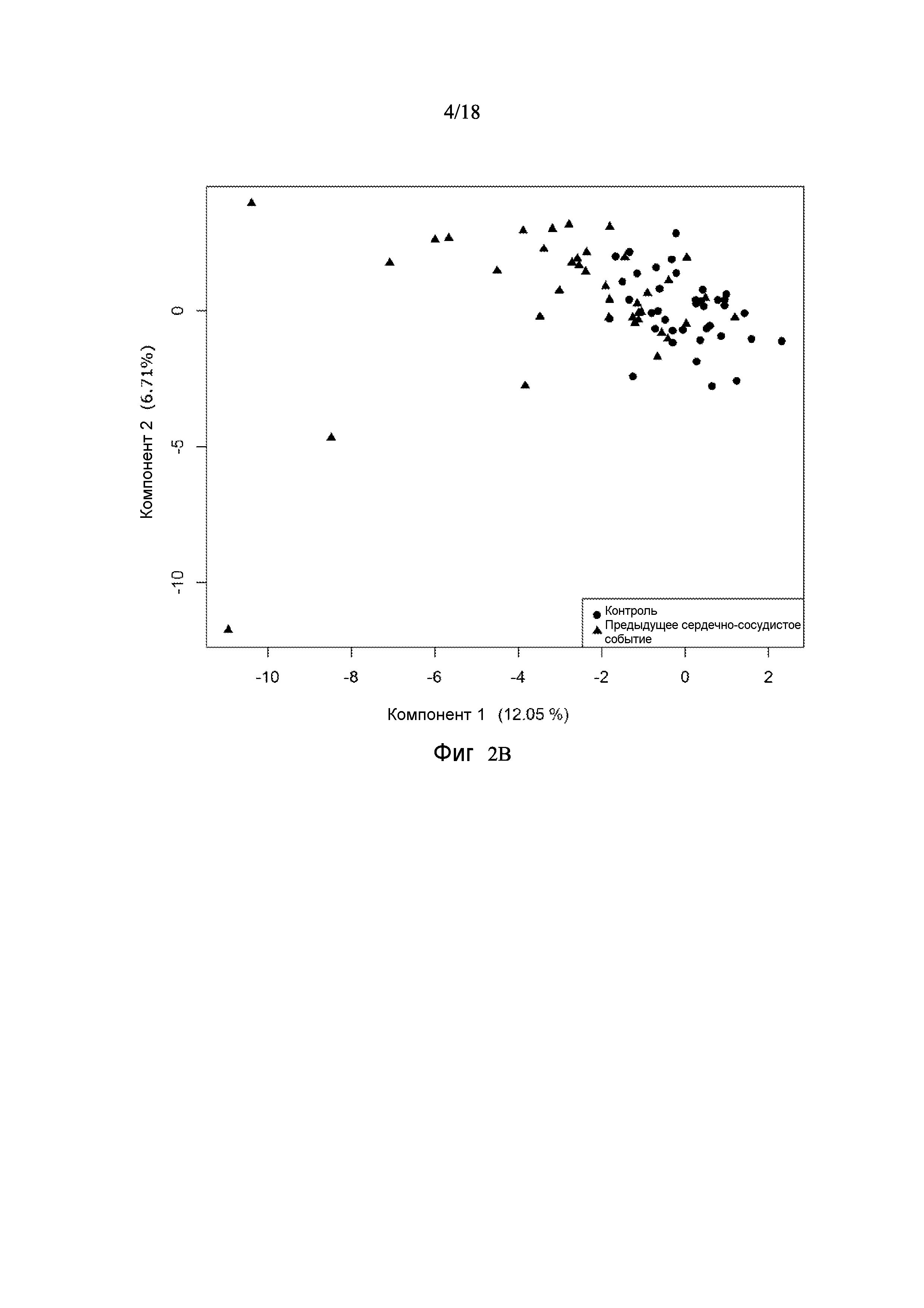
[0068] Фигура 2B показывает анализ DSGA для подгруппы случаев с событиями и контрольные группы без сердечно-сосудистых событий в пределах 6 месяцев. Случаи с событиями частично отделены от контрольных групп вдоль горизонтальной оси.
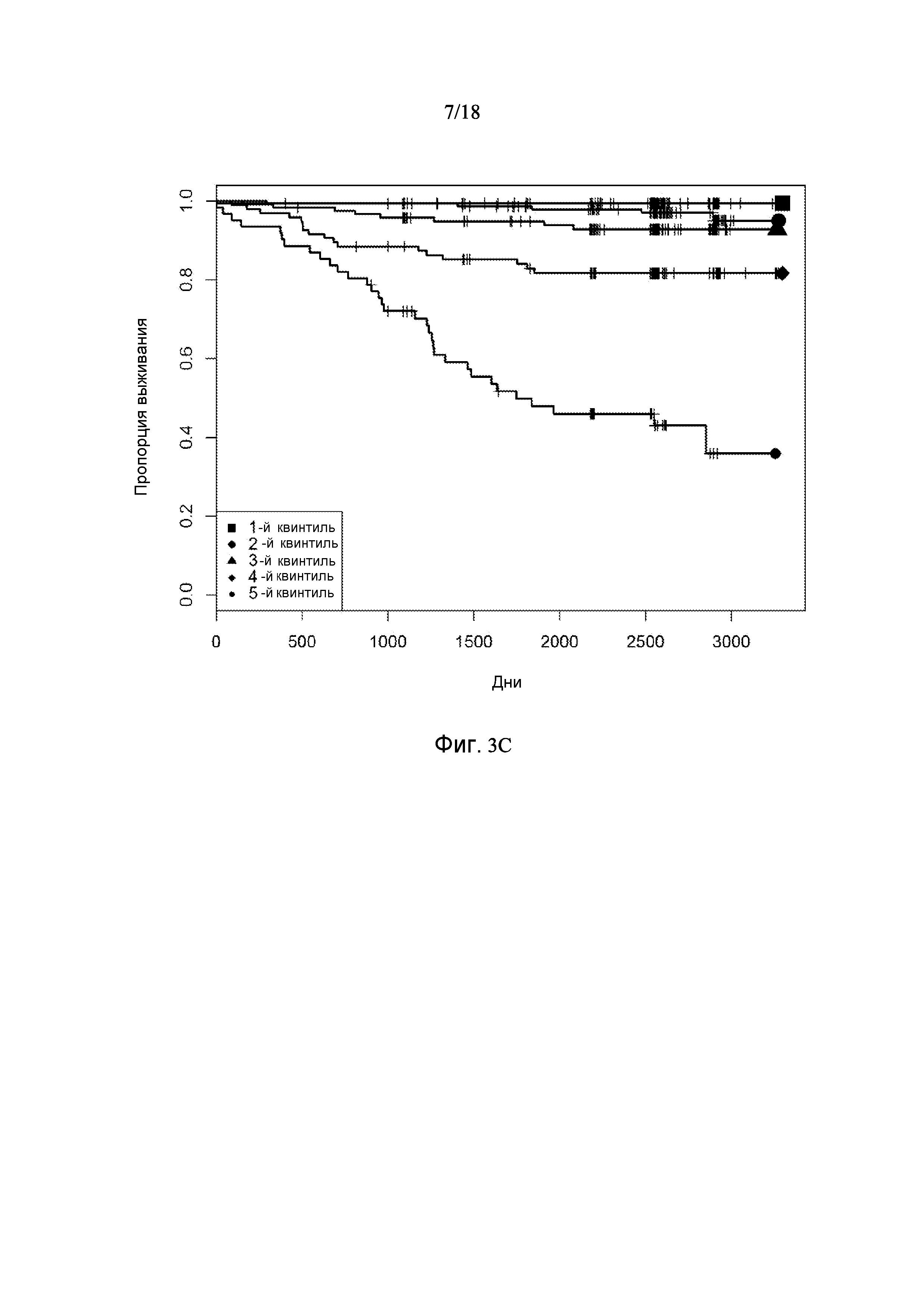
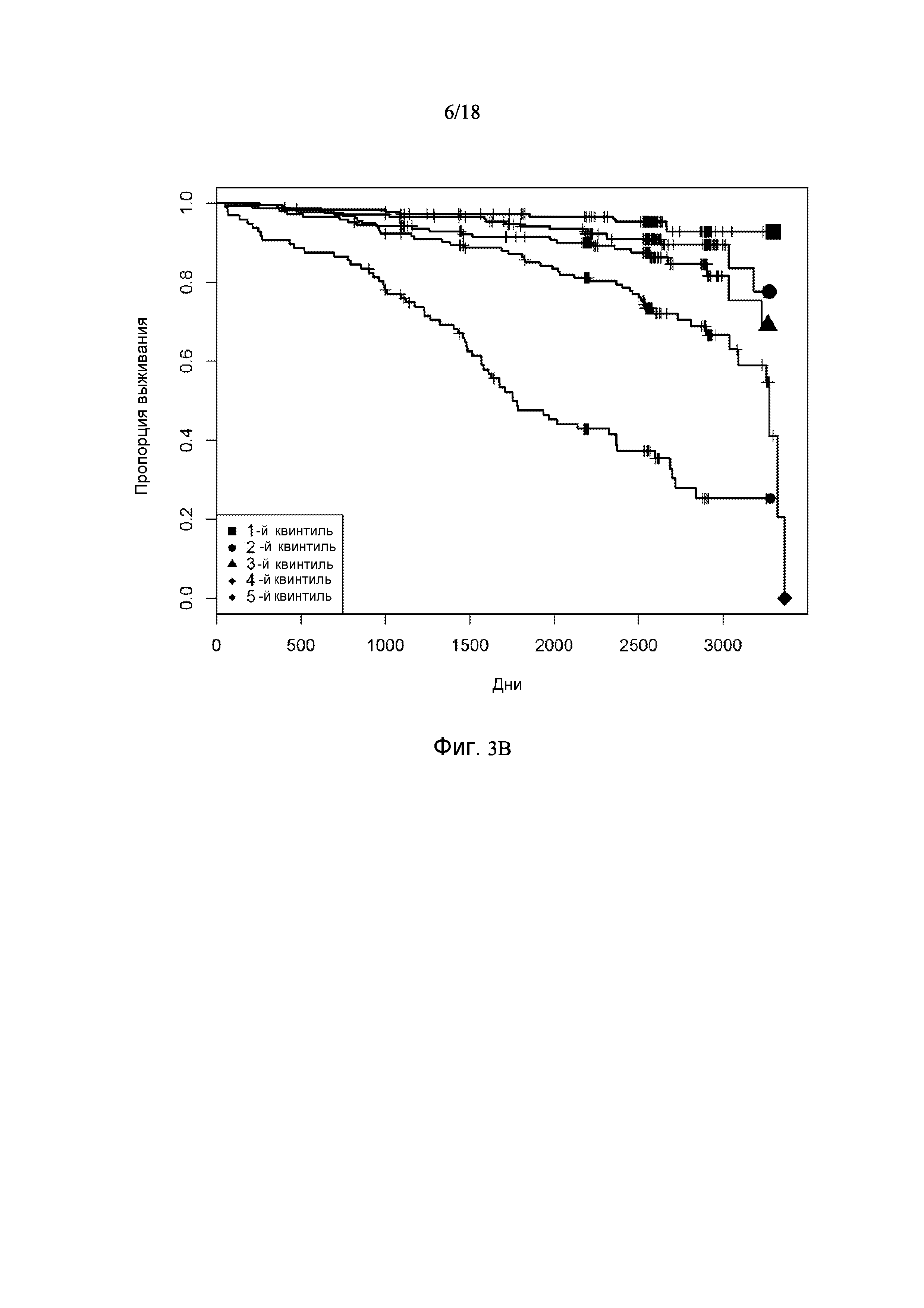
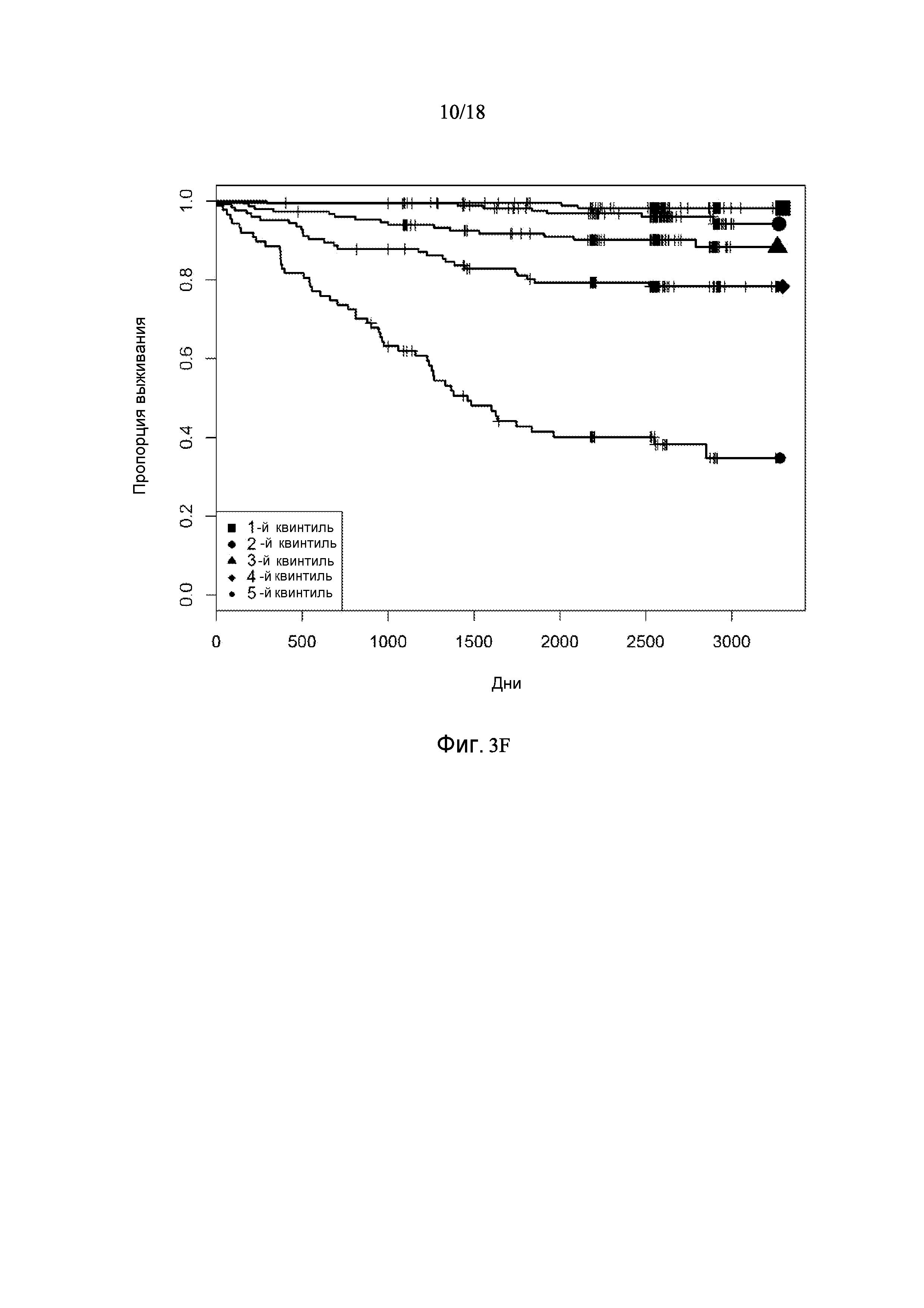
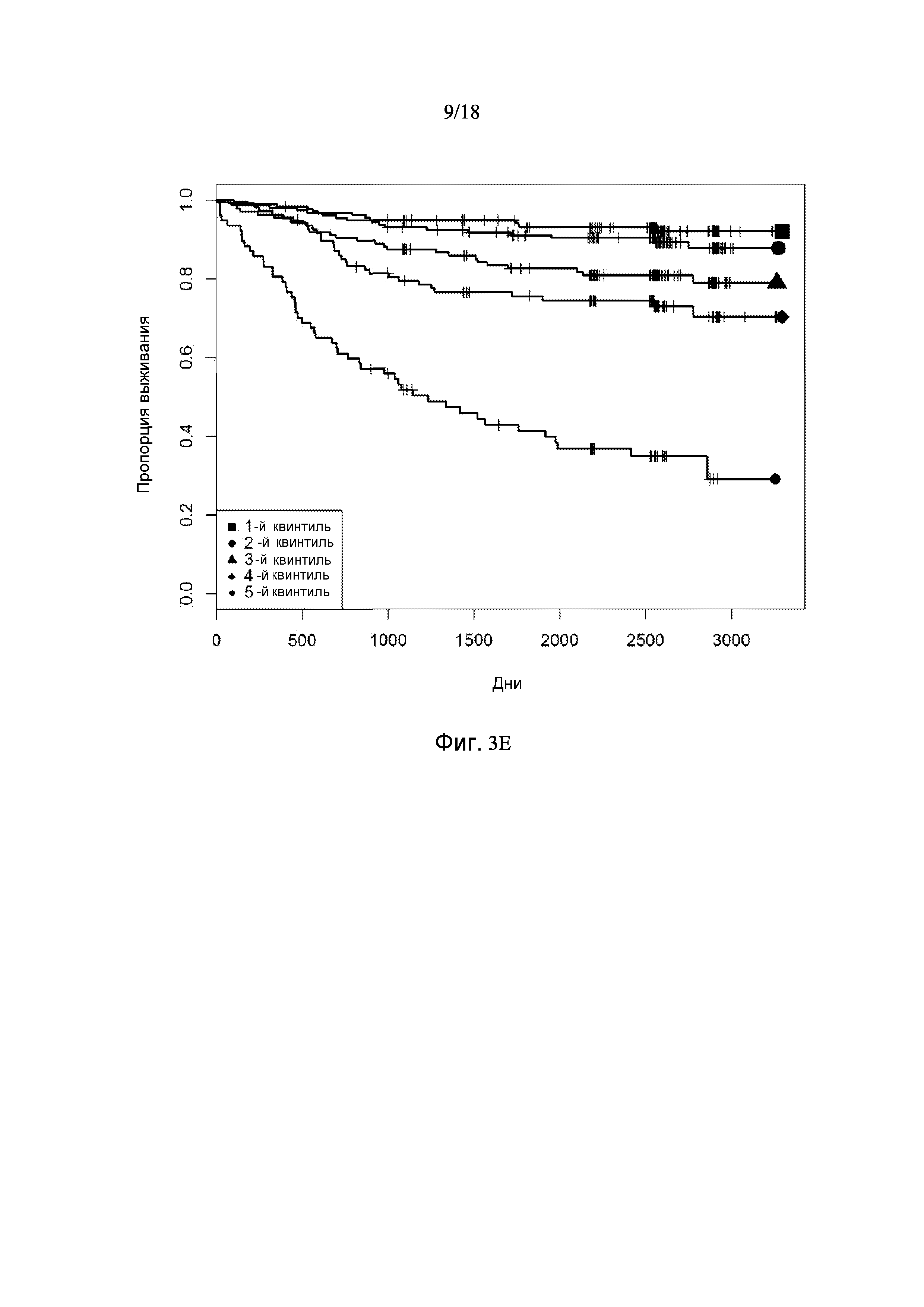
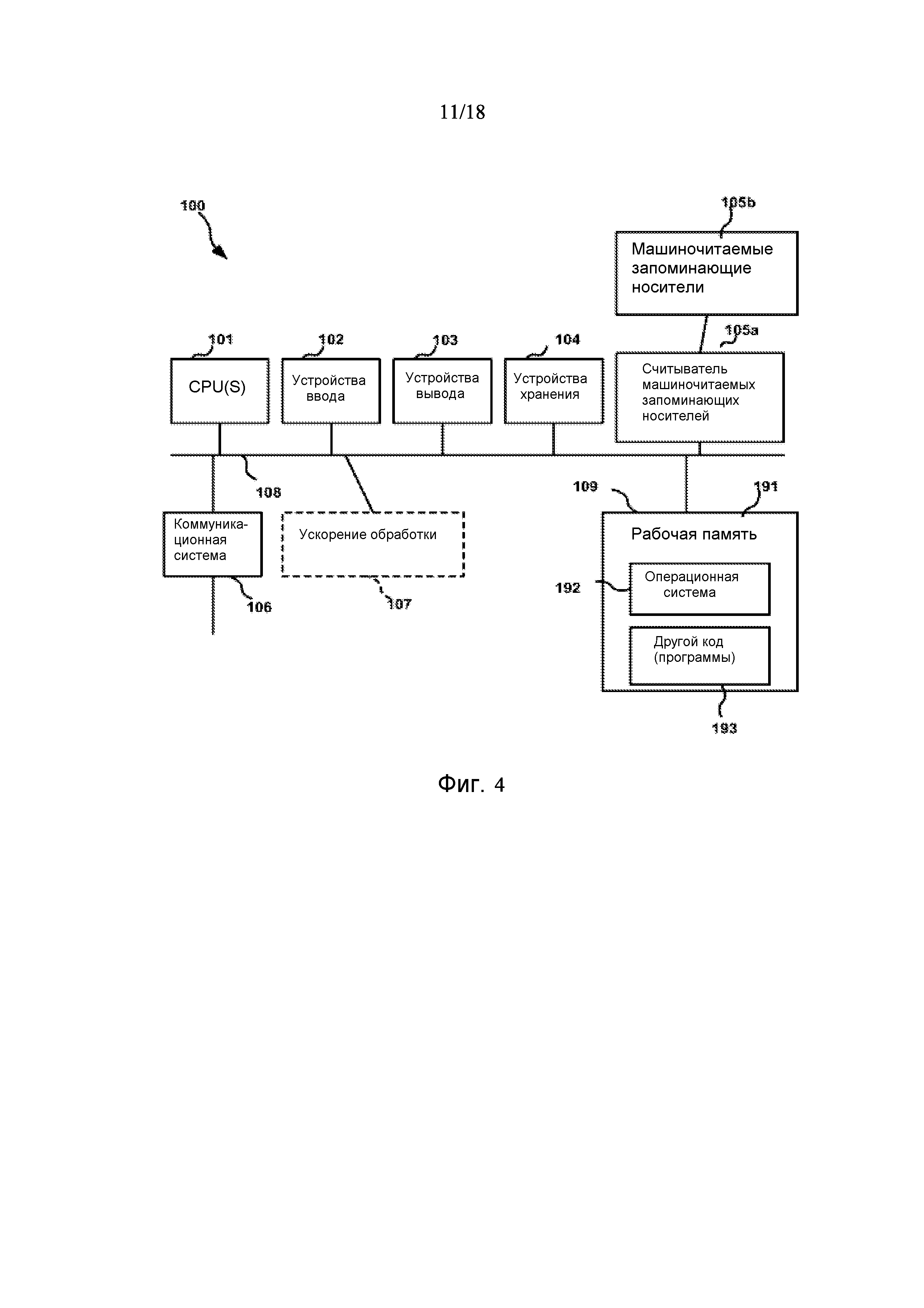
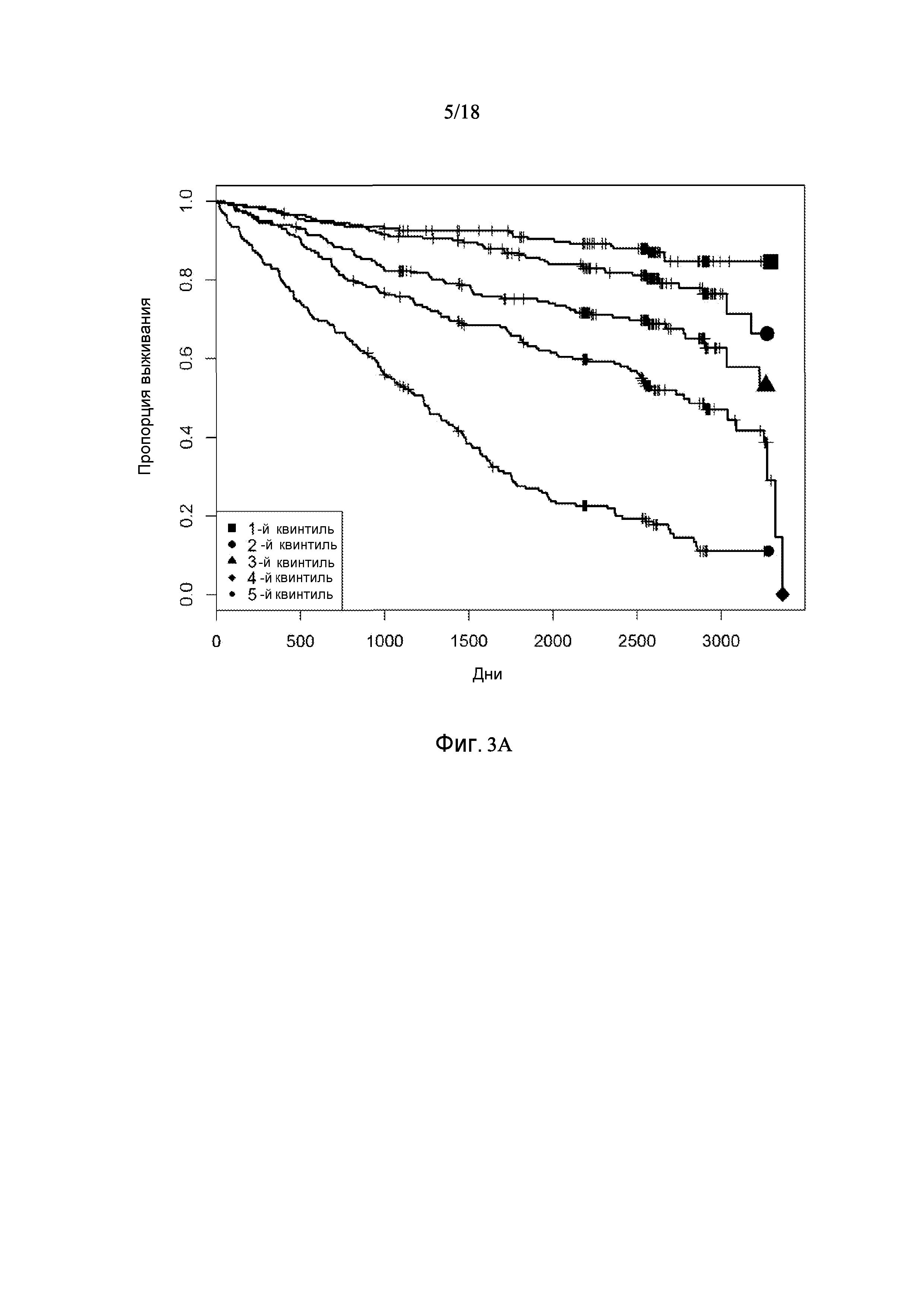
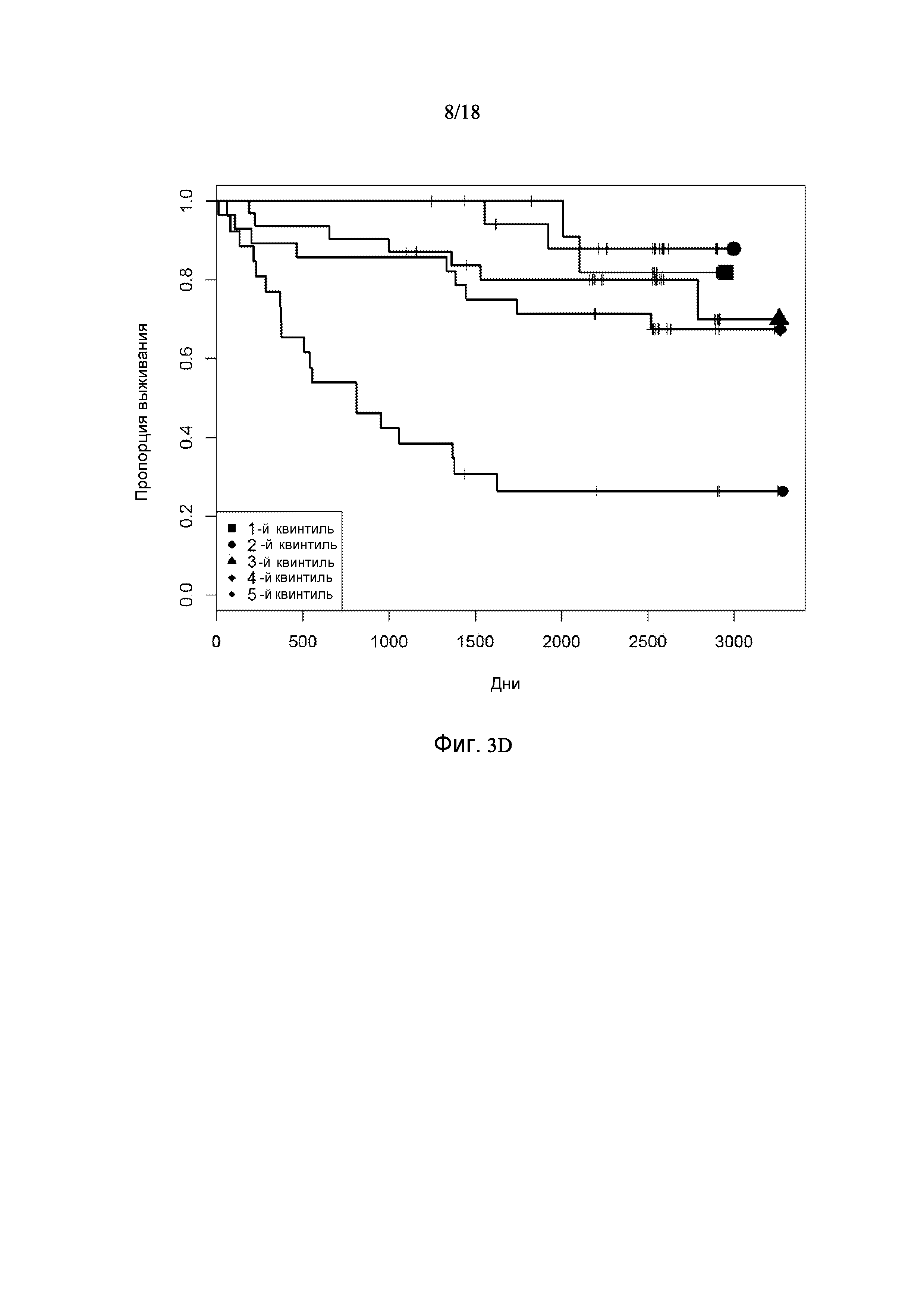
[0069] Фигура 3 предоставляет анализ шкалы риска для обследуемой популяции. Данную шкалу рассчитывали посредством построения простой модели пропорциональных рисков Кокса с использованием логарифма измерений десяти белков в Таблице 3. На основании данной шкалы популяцию разделили на квинтили. Графики Каплана-Майера на фигуре 3 демонстрируют, как данные квинтили отличаются по пропорции индивидуального опыта сердечно-сосудистого события или смерти для различных типов событий.
[0070] Фигура 3A показывает графики Каплана-Майера всех смертей и сердечно-сосудистых событий обследуемой популяции с разделением популяции на квинтили на основании показателей белков в таблице 3.
[0071] Фигура 3B показывает графики Каплана-Майера для случаев сердечно-сосудистых событий:
неклассифицированные смерти, то есть смерти без известной ближайшей причины, такой как MI или CHF (застойная сердечная недостаточность), с разделением популяции на квинтили на основании показателей белков в таблице 3.
[0072] Фигура 3C показывает графики Каплана-Майера для случаев сердечно-сосудистых событий: эпизод CHF с разделением популяции на квинтили на основании показателей белков в таблице 3.
[0073] Фигура 3D показывает графики Каплана-Майера для случаев сердечно-сосудистых событий: рецидив CHF для пациентов с хронической CHF (пациенты с предшествующим диагнозом CHF) с разделением популяции на квинтили на основании показателей белков в таблице 3.
[0074] Фигура 3E показывает графики Каплана-Майера для случаев сердечно-сосудистых событий: тромботическое событие (MI + инсульт) с разделением популяции на квинтили на основании показателей белков в таблице 3.
[0075] Фигура 3F показывает графики Каплана-Майера для случаев сердечно-сосудистых событий: все CHF с разделением популяции на квинтили на основании показателей белков в таблице 3.
[0076] Фигура 4 показывает иллюстративную компьютерную систему для использования с различными основанными на применении компьютеров способами, описанными в данном документе.
[0077] Фигура 5 представляет собой блок-схему для способа показа оценки риска сердечно-сосудистого события в соответствии с одним вариантом осуществления.
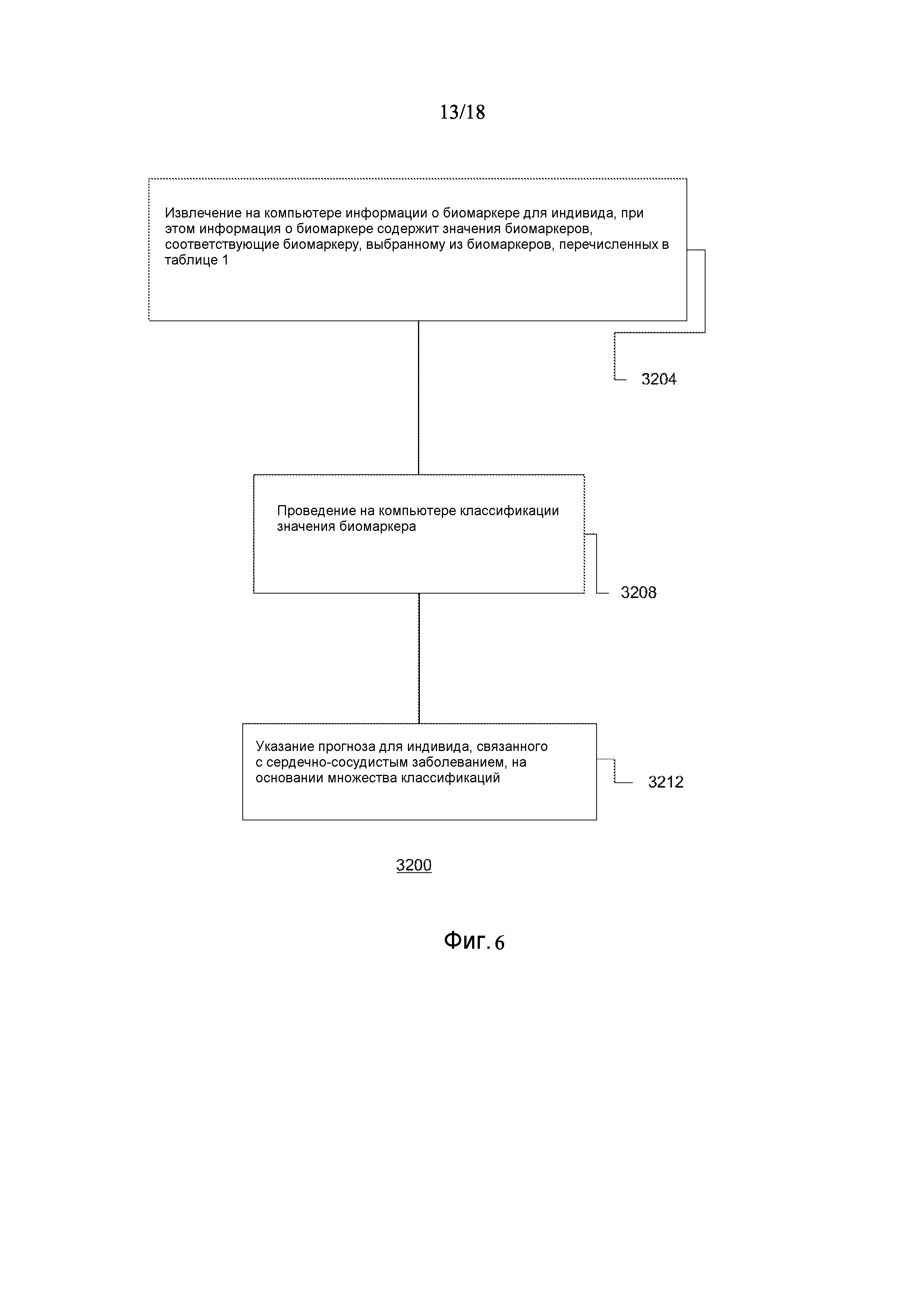
[0078] Фигура 6 представляет собой блок-схему для способа оценки риска сердечно-сосудистого события в соответствии с одним вариантом осуществления.
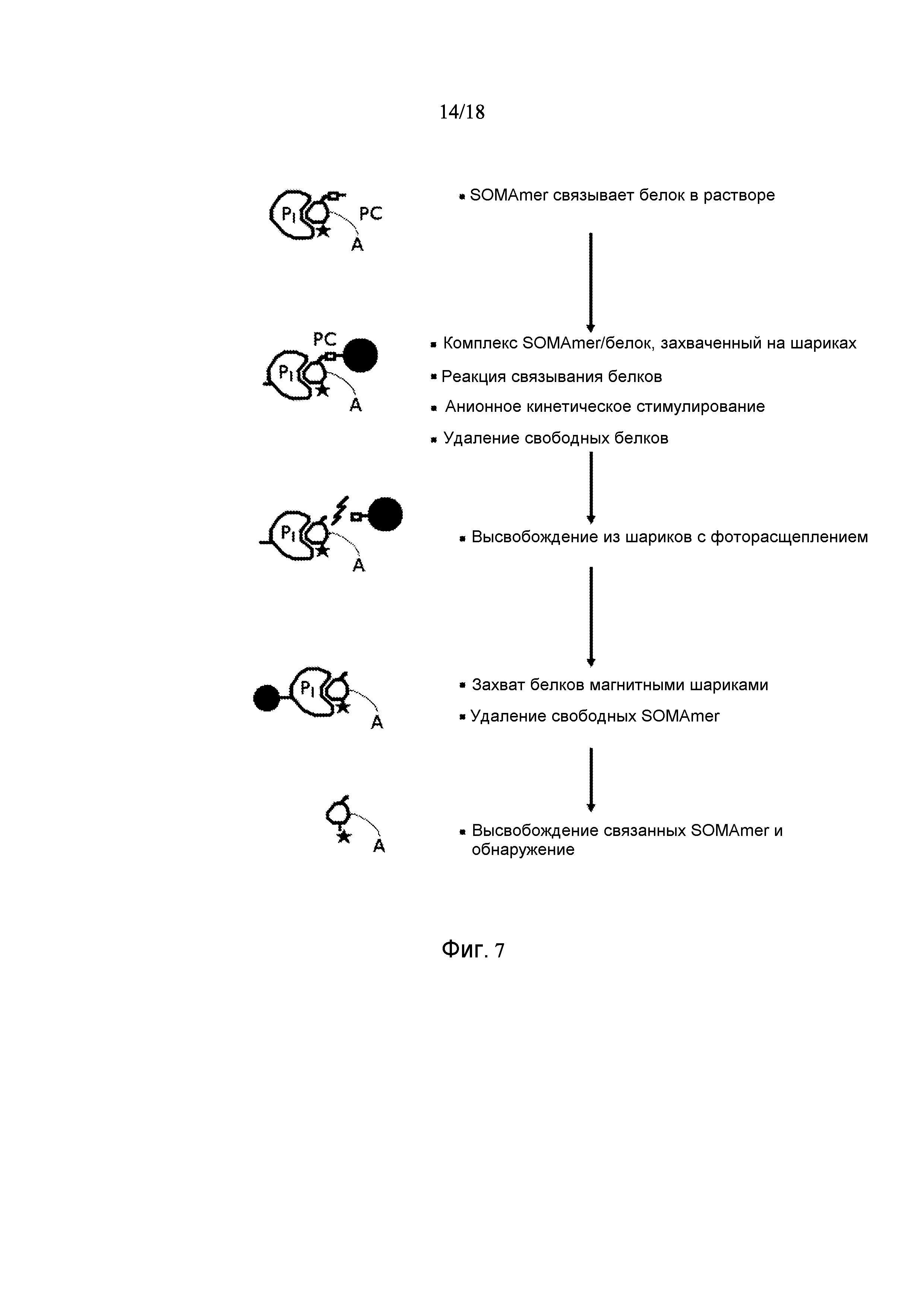
[0079] Фигура 7 показывает иллюстративный аптамерный анализ, который может быть использован для выявления одного или более биомаркеров сердечно-сосудистых событий в биологическом образце.
[0080] Фигура 8 показывает графики Каплана-Майера на основании GPVI, одном из десяти белков в Таблице 3, демонстрирующие, что данный белок проводит различие между тромботическими событиями и событиями CHF. Популяцию делят на квартили GPVI. Фигура 8A показывает, что самый верхний квартиль GPVI является прогностическим для тромботических сердечно-сосудистых событий. Фигура 8B показывает, что квартили GPVI не имеют или имеют слабую дифферинцирующую способность прогнозировать события CHF.
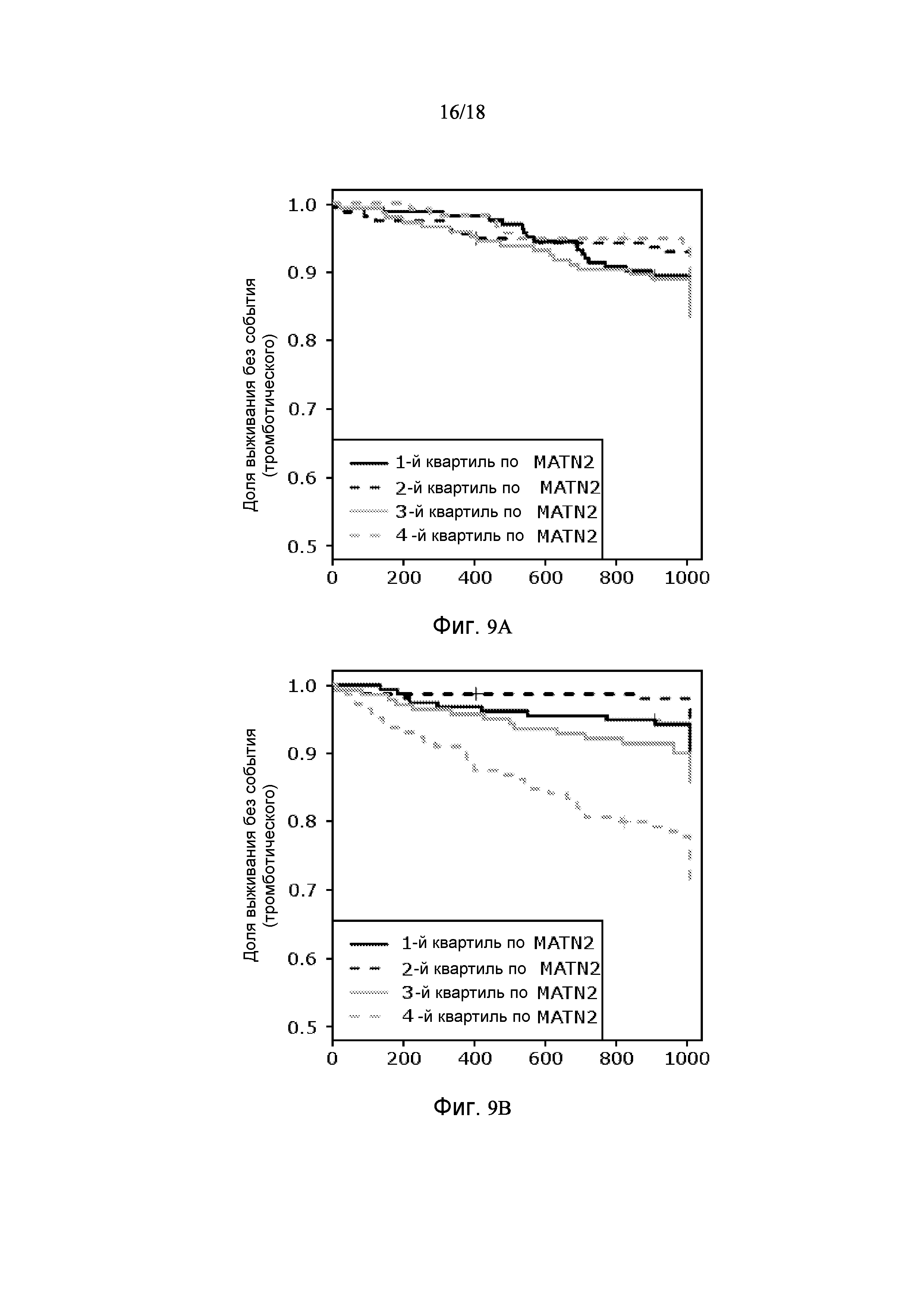
[0081] Фигура 9 показывает графики Каплана-Майера на основании MATN2, одного из десяти белков в Таблице 3, демонстрирующие, что данный белок проводит различие между тромботическими событиями и событиями CHF. Популяцию делят на квартили MATN2. Фигура 9A показывает, что квартили MATN2 не являются прогностическими для тромботических сердечно-сосудистых событий. Фигура 9B показывает, что индивиды из самого верхнего квартиля MATN2 имеют увеличенную степень событий CHF.
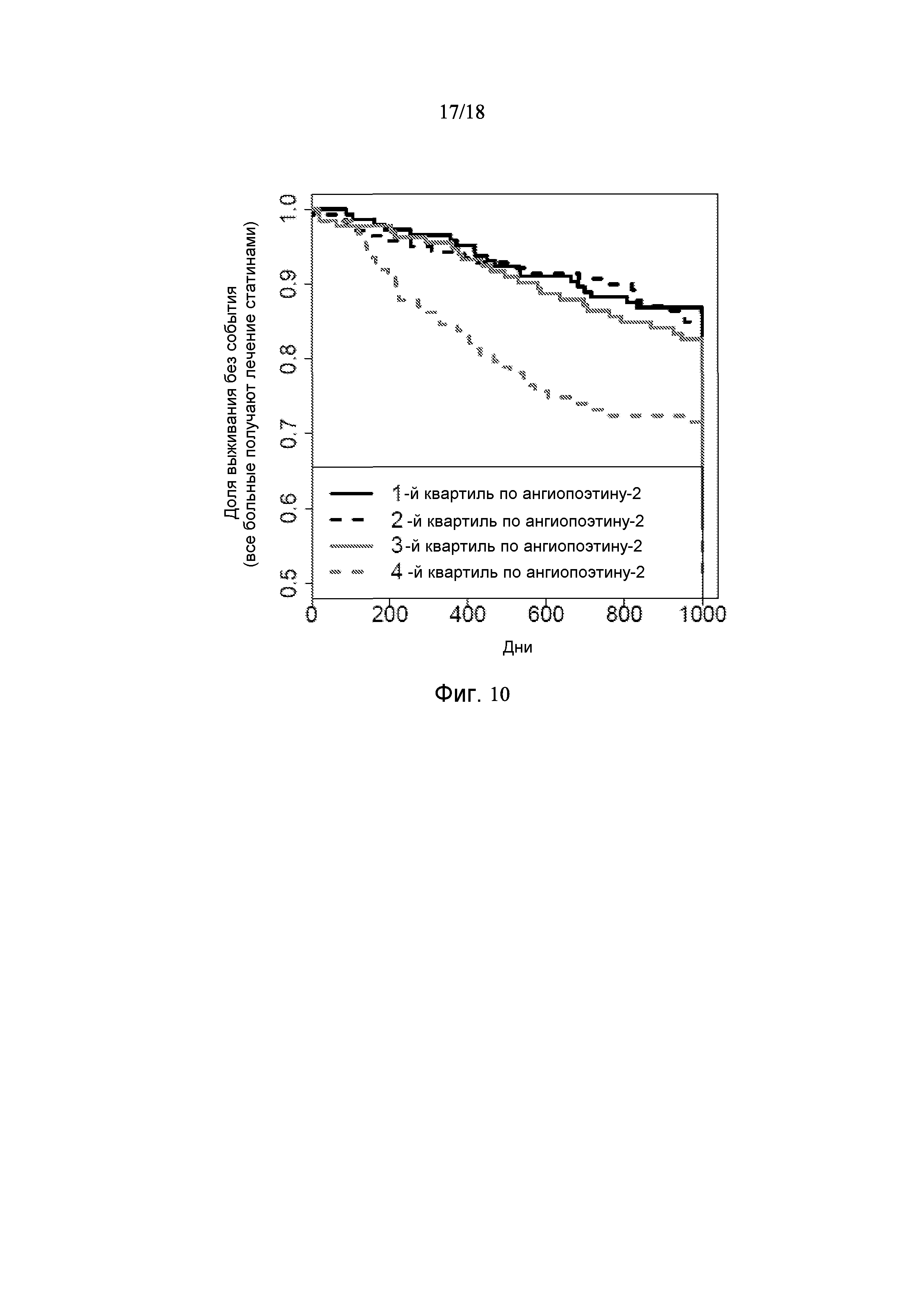
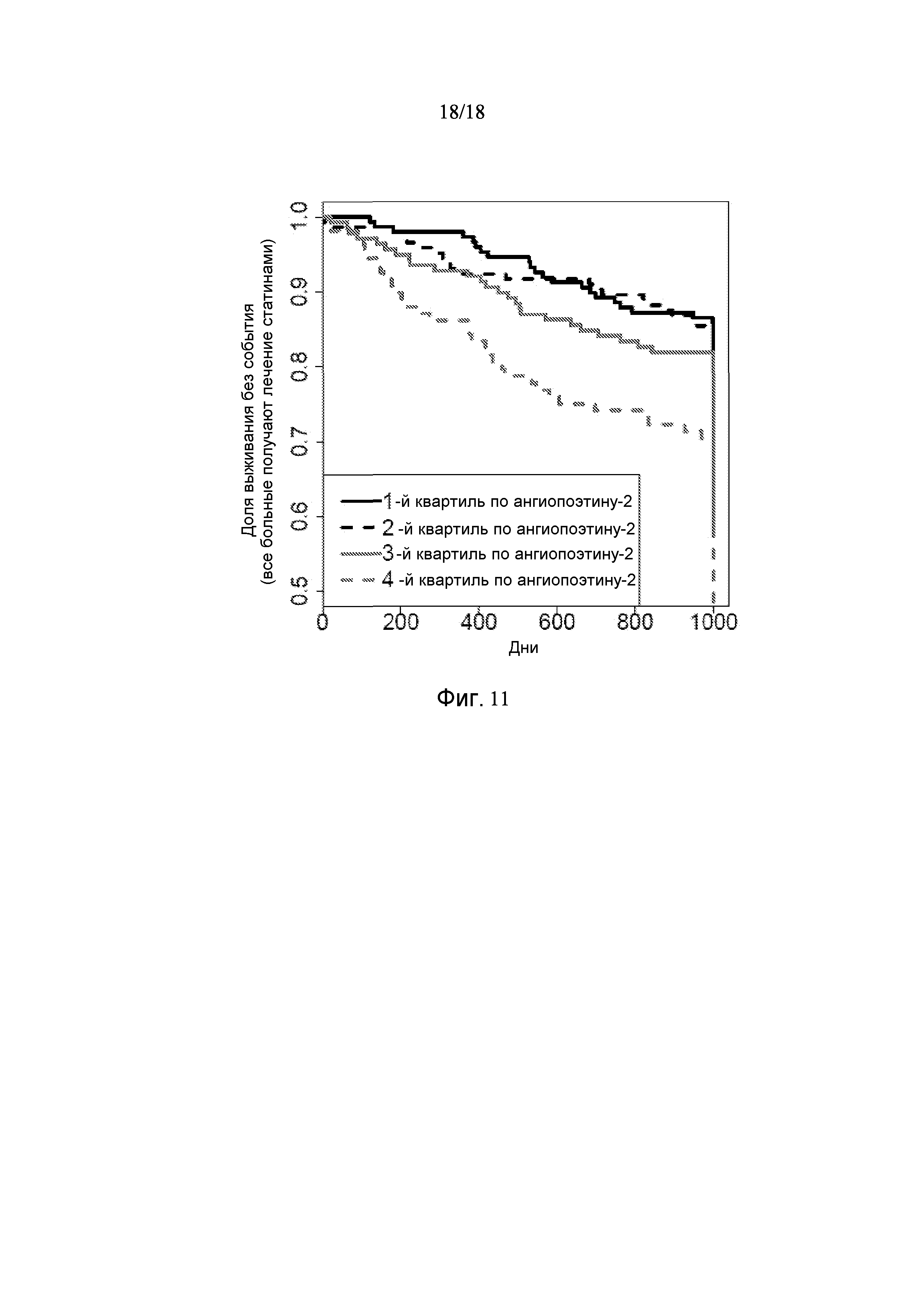
[0082] Фигура 10 показывает графики Каплана-Майера всех 538 больных, получающих медикаментозное лечение статином, показывающие, что индивиды в 4-ой квартили распределения популяции по ангиопоэтину-2 страдают от сердечно-сосудистых событий в повышенной степени по сравнению с индивидами не из 4-ой квартили по ангиопоэтину-2. Соответственно, несмотря на результаты лечения статинами, ангиопоэтин-2 является пригодным биомаркером риска сердечно-сосудистых событий.
[0083] Фигура 11 показывает графики Каплана-Майера всех 538 больных, получающих медикаментозное лечение статином, показывающие, что CHRDL1 связан с безсобытийной выживаемостью сердечно-сосудистых событий у индивидов, получавших лечение статином. Соответственно, несмотря на результаты лечения статинами, CHRDL1 является пригодным биомаркером риска сердечно-сосудистых событий.
ПОДРОБНОЕ ОПИСАНИЕ
[0084] Далее будет сделана подробная ссылка на репрезентативные варианты осуществления изобретения. Несмотря на то, что изобретение будет описано в сочетании с приведенными вариантами осуществления, следует понимать, что изобретение не предполагает ограничение данными вариантами осуществления. Наоборот, изобретение предполагает охват всех альтернатив, модификаций и эквивалентов, которые могут быть включены в пределы объема правовых притязаний представленного изобретения, который ограничен формулой изобретения.
[0085] Квалифицированный специалист в данной области в состоянии узнать множество способов и материалов, аналогичных или эквивалентных способам и материалам, описанным в данном документе, которые можно было бы использовать и которые находятся в рамках практического применения представленного изобретение. Представленное изобретение никоим образом не ограничено описанными способами и материалами.
[0086] Если не указано иное, технические и научные термины, используемые в данном документе, имеют такое же значение, которое широко понятно рядовому специалисту в области, к которой относится данное изобретение. Хотя при практическом применении или тестировании изобретения могут быть использованы любые способы, устройства и материалы, аналогичные или эквивалентные способам, устройствам и материалам, описанным в данном документе, далее описаны предпочтительные способы, устройства и материалы.
[0087] Все публикации, опубликованные патентные документы и патентные заявки, цитируемые в данной заявке, свидетельствуют об уровне технике в области (областях), к которой относится заявка. Все публикации, опубликованные патентные документы и патентные заявки, цитируемые в данном документе, настоящим включены посредством ссылки в той же самой степени, как если бы каждая отдельная публикация, опубликованный патентный документ или патентная заявка была конкретно и индивидуально указана включенной посредством ссылки.
[0088] Как используется в данной заявке, включая приложенную формулу изобретения, единственные формы «a», «an» и «the» включают множественные ссылки, если содержание не трактует четко иное, и используются взаимозаменяемо с «по меньшей мере один» и «один или более». Соответственно, ссылка на «SOMAmer» включает смеси SOMAmer, ссылка на «зонд» включает смеси зондов и тому подобное.
[0089] Как используется в данном документе, термин «приблизительно» представляет незначительное изменение или отклонение от числового значения, так что основная функция пункта, к которому относится числовое значение, остается неизменной.
[0090] Как используется в данном документе, термины «содержит», «содержащий», «включает», «включающий», «заключает», «заключающий» и любые их варианты, предполагают охват неисключительного включения, так чтобы процесс, способ, изделие, характеризуемое способом его получения, или химическое соединение, которое содержит, включает или заключает элемент или список элементов, содержит не только элементы данных, но может содержать другие элементы, не перечисленные специально или присущие данному процессу, способу, изделию, характеризуемому способом его получения, или химическому соединению.
[0091] Представленная заявка включает биомаркеры, способы, устройства, реагенты, системы и наборы для прогнозирования риска сердечно-сосудистых событий в пределах ограниченного периода времени, например, 5 лет.
[0092] «Сердечно-сосудистое событие» означает недостаточность или сбой любой части сердечно-сосудистой системы. В одном варианте осуществления, «сердечно-сосудистое событие» означает инсульт, транзиторную ишемическую атаку (TIA), инфаркт миокарда (MI), неожиданную смерть, могущую быть приписанной сбою сердечно-сосудистой системы, и/или сердечной недостаточности. В еще одном варианте осуществления, «сердечно-сосудистое событие» означает любой из вышеупомянутых сбоев и/или нестабильную стенокардию, необходимость стентирования или пластической операции на сосудах и тому подобное.
[0093] Сердечно-сосудистые события включают «застойную сердечную недостаточность» или «CHF» и «тромботические события». Тромботические события включают MI, транзиторные ишемические атаки (TIA), инсульт, острый коронарный синдром и необходимость коронарной реваскуляризации.
[0094] В одном аспекте, один или более биомаркеров предоставлены для использования либо по отдельности, либо в различных комбинациях для оценки риска сердечно-сосудистого события в будущем в пределах 5-летнего периода времени, где сердечно-сосудистые события определяют как инфаркт миокарда, инсульт, смерть и застойная сердечная недостаточность. Тромботические события (Фигура 3e) состоят из комбинированных инфаркта миокарда и инсульта. Как описано подробно ниже, иллюстративные варианты осуществления включают биомаркеры, предоставленные в Таблице 1, столбце 7, которые идентифицировали с использованием мультиплексного основанного на анализе SOMAmer, который в общем описан в Примере 1, а более конкретно в Примере 2.
[0095] Таблица 1, столбец 7, излагает открытия, полученные при анализе сотен индивидуальных образцов крови у пациентов, которые имели сердечно-сосудистое событие в пределах 6 месячного - 10 летнего промежутка времени (позитивное событие) после первоначального взятия крови (временная точка 1), и сотен эквивалентных индивидуальных образцов крови индивидов, которые не имели сердечно-сосудистое событие в пределах данного промежутка времени (негативное событие). Потенциальные биомаркеры были измерены в индивидуальных образцах вместо объединения образцов крови события Позитивного и события Негативного; это позволило лучше понять индивидуальные и групповые колебания в фенотипах, связанных с наличием и отсутствием сердечно-сосудистого события. Поскольку на каждом образце было сделано свыше 1000 измерений белков и было индивидуально измерено несколько сотен образцов из каждой из популяций с позитивным событием и негативным событием, биомаркеры, приведенные в Таблице 1, столбце 7, получены в результате анализа необычайно большого комплекса данных. Измерения анализировали с использованием способов, описанных в разделе, «Классификация биомаркеров и Расчет Шкалы риска» в данном документе. Таблица 1, столбец 7 приводит список 155 биомаркеров, у которых была обнаружена пригодность для стратификации популяции индивидов согласно их предрасположенности выявлять сердечно-сосудистое событие в будущем в период 0-5 лет после взятия образца крови. Кривые Каплана-Майера на фигурах 3A-3F показывают сильную зависимость риска события от квинтиля показателя, определенного небольшой подгруппой подобных биомаркеров, которые перечислены в Таблице 3.
[0096] Несмотря на то, что некоторые из описанных биомаркеров сердечно-сосудистых событий для оценки риска сердечно-сосудистого события используются по отдельности, также в данном документе описаны способы группировки множества подгрупп биомаркеров сердечно-сосудистых событий, где каждая группировка или выбор подгруппы используется в виде панели из трех или более биомаркеров, взаимозаменяемо упоминаемых в данном документе как «панель биомаркеров» и панель. Соответственно, различные варианты осуществления настоящей заявки предоставляют комбинации, содержащие N биомаркеров, где N составляет по меньшей мере два биомаркера. В других вариантах осуществления, N выбирают из 2-155 биомаркеров.
[0097] В других вариантах осуществления, N выбирают как любое количество из 2-7, 2-10, 2-15, 2-20, 2-25, 2-30, 2-35, 2-40, 2-45, 2-50, 2-55 или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 2-155. В других вариантах осуществления, N выбирают как любое количество из 3-7, 3-10, 3-15, 3-20, 3-25, 3-30, 3-35, 3-40, 3-45, 3-50, 3-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 3-155. В других вариантах осуществления, N выбирают как любое количество из 4-7, 4-10, 4-15, 4-20, 4-25, 4-30, 4-35, 4-40, 4-45, 4-50, 4-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 4-155. В других вариантах осуществления, N выбирают как любое количество из 5-7, 5-10, 5-15, 5-20, 5-25, 5-30, 5-35, 5-40, 5-45, 5-50, 5-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 5-155. В других вариантах осуществления, N выбирают как любое количество из 6-10, 6-15, 6-20, 6-25, 6-30, 6-35, 6-40, 6-45, 6-50, 6-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 6-155. В других вариантах осуществления, N выбирают как любое количество из 7-10, 7-15, 7-20, 7-25, 7-30, 7-35, 7-40, 7-45, 7-50, 7-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 7-155. В других вариантах осуществления, N выбирают как любое количество из 8-10, 8-15, 8-20, 8-25, 8-30, 8-35, 8-40, 8-45, 8-50, 8-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 8-155. В других вариантах осуществления, N выбирают как любое количество из 9-15, 9-20, 9-25, 9-30, 9-35, 9-40, 9-45, 9-50, 9-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 9-155. В других вариантах осуществления, N выбирают как любое количество из 10-15, 10-20, 10-25, 10-30, 10-35, 10-40, 10-45, 10-50, 10-55, или с последовательными шагами, равными 5, для верхнего предела диапазона, до и включительно 10-155. Необходимо учитывать, что N может быть выбрано для охвата аналогичных диапазонов, но более высокого порядка.
[0098] В одном варианте осуществления, количество биомаркеров, подходящих для подгруппы биомаркеров или панели, основано на значении чувствительности и специфичности для конкретной комбинации значений биомаркеров. Термины «чувствительность» и «специфичность» используют в данном документе по отношению к способности корректно классифицировать индивидов на основании одного или более значений биомаркеров, выявленных в их биологическом образце, как имеющих повышенный риск наличия сердечно-сосудистого события в пределах 5 лет или не имеющих повышенного риска наличия сердечно-сосудистого события в пределах того же самого периода времени. «Чувствительность» показывает эффективность биомаркера (биомаркеров) относительно корректной классификации индивидов, которые имеют повышенный риск сердечно-сосудистого события. «Специфичность» показывает эффективность биомаркера (биомаркеров) относительно корректной классификации индивидов, которые не имеют повышенного риска сердечно-сосудистого события. Например, специфичность 85% и чувствительность 90% для панели маркеров, используемых для тестирования набора образцов с негативным событием и образцов с позитивным событием показывает, что 85% контрольных образцов были корректно классифицированы панелью как образцы с негативным событием, и 90% образцов с позитивным событием были корректно классифицированы панелью как образцы с позитивным событием.
[0099] В альтернативном способе, показатели могут быть приведены в непрерывном диапазоне значений с пороговым значением высокого, промежуточного или низкого риска сердечно-сосудистого события, причем пороговые значения определяют на основании клинической картины.
[00100] Биомаркеры риска сердечно-сосудистого события, идентифицированные в данном документе, представляют чрезвычайно большое количество выборов подгрупп или панелей биомаркеров, которые могут быть использованы для прогнозирования риска сердечно-сосудистого события. Выбор требуемого количества подобных биомаркеров зависит от конкретной комбинации выбранных биомаркеров. Важно запомнить, что панели биомаркеров для прогнозирования риска сердечно-сосудистого события также могут содержать биомаркеры, не найденные в Таблице 1, столбце 7, и что включение дополнительных биомаркеров, не найденных в Таблице 1, столбце 7, может снижать количество биомаркеров в конкретной подгруппе или панели, которые выбирают из таблицы 1, столбец 7. Количество биомаркеров из таблицы 1, столбец 7, используемых в подгруппе или панели, также может быть уменьшено, если используется дополнительная биомедицинская информация в сочетании со значениями биомаркеров для установки приемлемых пороговых значений для заданного анализа.
[00101] Еще одним фактором, который может влиять на количество биомаркеров, подлежащих использованию в подгруппе или панели биомаркеров, являются процедуры, используемые для получения биологических образцов индивидов, которые проходят оценку риска сердечно-сосудистого события. В тщательно регулируемых условиях получения образцов, количество биомаркеров, необходимых для соответствия требуемой чувствительности и специфичности и/или пороговым значениям, будет ниже, чем в ситуации, где может быть больше отклонение при сборе, обработке и хранении образцов.
[00102] Один аспект настоящей заявки может быть описан в общем со ссылкой на фигуры 1A и 1В. Биологический образец получают у интересующего индивида или индивидов. Затем биологический образец анализируют для выявления наличия одного или более (N) интересующих биомаркеров и определения значения биомаркера для каждого из указанных N биомаркеров (упоминаемых на фигуре 1В как маркер RFU). После того, как биомаркер был выявлен, а каждый маркер с присвоенным значением биомаркера рассчитан или классифицирован, как подробно описано в данном документе, показатели маркеров затем объединяют для предоставления общего диагностического показателя, который показывает вероятность, что индивид, у которого был получен образец, имеет высокий, средний или низкий риск сердечно-сосудистого события, особенно, когда они приводятся в непрерывном диапазоне.
[00103] «Биологический образец», «образец» и «тестовый образец» в данном документе используют взаимозаменяемо для ссылки на любой материал, биологическую текучую среду, ткань или клетку, полученные или иным образом взятые от индивида. Сюда включены кровь (включая цельную кровь, лейкоциты, мононуклеарные клетки периферической крови, лейкоцитарную пленку, плазму и сыворотку), сухие капли крови (например, полученные у младенцев), мокрота, слезы, слизь, смыв из носа, носовой аспират, выдыхаемый воздух, моча, семенная жидкость, слюна, перитонеальные промывные воды, асцитическая жидкость, содержимое кисты, менингеальная жидкость, околоплодная жидкость, жидкость желез, панкреатическая жидкость, лимфатическая жидкость, плевральная жидкость, аспират из соска, бронхиальный аспират, бронхиальный соскоб, синовиальная жидкость, суставной аспират, секреты органов, клетки, клеточный экстракт и цереброспинальная жидкость. Он также включает экспериментально выделенные фракции всего предшествующего. Например, образец крови может быть фракционирован на сыворотку, плазму или во фракции, содержащие отдельные типы кровяных клеток, таких как красные кровяные тельца или белые кровяные тельца (лейкоциты). Если необходимо, образец может представлять собой комбинацию образцов индивида, таких как комбинация образцов тканей и текучих сред. Термин «биологический образец» также включает материалы, содержащие гомогенизированный твердый материал, например, из образца кала, образца ткани или, например, из биоптата ткани. Термин «биологический образец» также включает материалы, происходящие из тканевой культуры или клеточной культуры. Для получения биологического образца могут быть использованы любые подходящие способы; иллюстративные способы, например, включают флеботомию, мазок (например, мазок изо рта) и методику тонкоигольной аспирационной биопсии. Иллюстративные ткани, подвергаемые тонкоигольной аспирационной биопсии, включают лимфатический узел, легкое, легочные смывы, БАЛ (бронхоальвеолярные выделения), щитовидную железу, молочную железу, поджелудочную железу и печень. Образцы также можно собирать, например, посредством микродиссекции (например, лазерной связывающей микродиссекции (LCM) или лазерной микродиссекции (LMD)), промывания мочевого пузыря, мазка (например, мазка по Папаниколау) или протокового лаважа. «Биологический образец», полученный или происходящий от индивида, включает любой такой образец, который был обработан любым подходящим образом после получения от индивида.
[00104] Кроме того, необходимо отдавать себе отчет, что биологический образец может быть получен посредством взятия биологических образцов у ряда индивидов и объединения их или объединения аликвоты каждого биологического образца индивида. Объединенный образец можно обрабатывать как образец от единственного индивида, и если в объединенном образце установлен повышенный или пониженный риск сердечно-сосудистого события, то биологический образец каждого индивида может быть подвергнут повторному тестированию для определения, какой индивид/индивиды имеют повышенный или уменьшенный риск сердечно-сосудистого события.
[00105] Как упоминалось выше, биологическим образцом может быть моча. Образцы мочи обеспечивают некоторые преимущества перед образцами крови или сыворотки. Сбор образцов крови или плазмы посредством венепункции является более сложным, чем желательным, может доставлять изменяющиеся объемы, может причинять беспокойство для пациента и включает некоторый (небольшой) риск инфекции. Также, флебэктамия требует квалифицированного персонала. Простота сбора образцов мочи может приводить к более повсеместному применению рассматриваемых способов.
[00106] Для того, чтобы определить пригодность использования мочи в качестве образца, подобные образцы у здоровых субъектов оценивали по качеству и количеству каждого белка, и данную информацию при прогнозировании сердечно-сосудистого риска объединяли с качеством биомаркеров таблиц 1-3. Вследствие того, что моча является ультрафильтратом плазмы, количество конкретного белка, выводимого в моче, пропорционально концентрации белка в крови. Если качественные биомаркеры любой из таблиц 1-3 доступны в достаточном количестве в моче, то они подходят для использования в способе скрининга индивида с целью оценки риска сердечно-сосудистого события. Биомаркеры, прогнозирующие сердечно-сосудистые события, которые были обнаружены в моче, включают ESAM, MMP7 и GP6, которые демонстрируют сильный сигнал. Данные биомаркеры являются более малыми и свободно фильтруются почкой в мочу. В дополнение, было обнаружено, что PSA-ACT и плазминоген демонстрируют изменчивость в моче между индивидами. Это показывает, что количественное определение данных биомаркеров в моче также может быть пригодным в способе скрининга индивида по риску сердечно-сосудистого события. Соответственно, данные пять белков предусматривают простой основанный на моче тест, который может быть использован в рассматриваемых способах скрининга индивидов по риску сердечно-сосудистого события.
[00107] Для целей данного описания, фраза «данные, относящиеся к биологическому образцу индивида» предполагает значение, что данные в некотором виде получены от индивида, или они были генерированы с использованием его биологического образца. После того как они были сгенерированы, данные могут быть переформатированы, пересмотрены или математически изменены до некоторой степени, например, посредством преобразования из единиц одной системы измерения в единицы другой системы измерения; но понятно, что данные должны происходить из биологического образца или быть сгенерированы с его использованием.
[00108] «Мишень», «молекула-мишень» и «аналит» в данном документе используются взаимозаменяемо для ссылки на любую интересующую молекулу, которая может быть представлена в биологическом образце. «Интересующая молекула» включает любое небольшое изменение конкретной молекулы, например, в случае белка, например, небольшие отклонения в аминокислотной последовательности, образование дисульфидных связей, гликолизация, липидизация, ацетилирование, фосфорилирование или любое другое манипулирование или модификация, такие как конъюгирование с метящим компонентом, который не существенно меняет идентичность молекулы. «Молекула-мишень», «мишень» или «аналит» представляет собой набор копий одного типа или вида молекулы или мультимолекулярной структуры. «Молекулы-мишени», «мишени» и «аналиты» относятся к более чем одному подобному набору молекул. Иллюстративные молекулы-мишени включают белки, полипептиды, нуклеиновые кислоты, углеводы, липиды, полисахариды, гликобелки, гормоны, рецепторы, антигены, антитела, аффибоди, антитела-миметики, вирусы, патогены, токсичные вещества, субстраты, метаболиты, аналоги переходного состояния, кофакторы, ингибиторы, лекарственные средства, красители, питательные вещества, факторы роста, клетки, ткани и любой фрагмент или часть любого из вышеупомянутого.
[00109] Как используется в данном документе, «полипептид», «пептид» и «белок» в данном документе используются взаимозаменяемо для ссылки на полимеры аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и он может прерываться не аминокислотами. Термины также охватывают аминокислотный полимер, который был модифицирован естественным образом или посредством вмешательства; например, посредством образования дисульфидных связей, гликолизации, липидизации, ацетилирования, фосфорилирования или любого другого манипулирования или модификации, такой как конъюгирование с метящим компонентом. Также в определение включены, например, полипептиды, содержащие один или более аналогов аминокислоты (включая, например, ненатуральные аминокислоты и т.д.), а также другие модификации, известные в данной области. Полипептиды могут иметь единственные цепи или ассоциированные цепи. Также в определение включены белки-предшественники и нативные зрелые белки; пептиды или полипептиды, происходящие от зрелого белка; фрагменты белка; сплайс-варианты; рекомбинантные формы белка; варианты белков с аминокислотными модификациями, делециями или замещениями; гидролизаты; и посттрансляционные модификации, такие как гликолизация, ацетилирование, фосфорилирование и тому подобное.
[00110] Как используется в данном документе, «маркер» и «биомаркер» используют взаимозаменяемо для ссылки на молекулу-мишень, которая показывает или является указателем нормального или патологического процесса у индивида или заболевания или другого состояния у индивида. Более конкретно, «маркер» или «биомаркер» представляет собой анатомический, физиологический, биохимический или молекулярный параметр, связанный с наличием конкретного физиологического состояния или процесса, нормального или патологического, и если патологического, хронического или острого. Биомаркеры могут быть выявлены и измерены множеством способов, включая лабораторные анализы и медицинскую визуализацию. Когда биомаркером является белок, также возможно использовать экспрессию соответствующего гена в качестве суррогатной меры количества или наличия или отсутствия соответствующих биомаркеров белков в биологическом образце или состояние метилирования гена, кодирующего биомаркер или белки, которые управляют экспрессией биомаркера.
[00111] Как используется в данном документе, «значение биомаркера», «значение», «уровень биомаркера» и «уровень» используют взаимозаменяемо для ссылки на измерение, которое проводят с использованием любого аналитического способа определения биомаркера в биологическом образце и которое показывает наличие, отсутствие, абсолютное количество или концентрацию, относительное количество или концентрацию, титр, уровень, уровень экспрессии, соотношение измеренных уровней и тому подобное, соответствующего, для соответствующего или в соответствии с биомаркером в биологическом образце. Точный смысл «значения» или «уровня» зависит от конкретной конструкции и составных элементов конкретного аналитического способа, используемого для выявления биомаркера.
[00112] Когда биомаркер показывает или является указателем патологического процесса или заболевания или другого состояния у индивида, данный биомаркер в общем описывают либо как сверхэкспрессированный, либо слабо экспрессированный по сравнению с уровнем экспрессии или значением биомаркера, который показывает или является указателем нормального процесса или отсутствия заболевания или другого состояния у индивида. «Повышающая регуляция», «повышающее регулированный», «сверхэкспрессия», «сверхэкспрессированный» и любые их варианты используются взаимозаменяемо для ссылки на значение или уровень биомаркера в биологическом образце, который больше, чем значение или уровень (или диапазон значений или уровней) биомаркера, который обычно выявляется в аналогичных биологических образцах у здоровых, или нормальных, индивидов. Термины также могут относиться к значению или уровню биомаркера в биологическом образце, который составляет более чем значение или уровень (или диапазон значений или уровней) биомаркера, который может быть выявлен на другой стадии конкретного заболевания.
[00113] «Понижающая регуляция», «понижающе регулируемый», «слабая экспрессия», «слабо экспрессированный» и любые их варианты взаимозаменяемо используют для ссылки на значение или уровень биомаркера в биологическом образце, который составляет менее чем значение или уровень (или диапазон значений или уровней) биомаркера, который обычно выявляют в аналогичных биологических образцах у здоровых, или нормальных, индивидов. Термины также могут относиться к значению или уровню биомаркера в биологическом образце, который составляет менее чем значение или уровень (или диапазон значений или уровней) биомаркера, который может быть выявлен на другой стадии конкретного заболевания.
[00114] Кроме того, биомаркер, который является либо сверхэкспрессированным, либо слабо экспрессированным, также может упоминаться как «дифференциально экспрессируемый» или как имеющий «дифференциальный уровень» или «дифференциальное значение» по сравнению с «нормальным» уровнем экспрессии или значением биомаркера, которое показывает или является указателем нормального процесса или отсутствия заболевания или другого состояния у индивида. Соответственно, «дифференциальная экспрессия» биомаркера также может упоминаться в качестве отклонения у «нормального» уровня экспрессии биомаркера.
[00115] Термин «дифференциальная генная экспрессия» и «дифференциальная экспрессия» взаимозаменяемо используют для ссылки на ген (или продукт экспрессии его соответствующего белка), экспрессия которого активируется до более высокого или более низкого уровня у больного, страдающего от конкретного заболевания или состояния, относительно его экспрессии у нормального или контрольного объекта. Термины также включают гены (или соответствующие продукты экспрессии белков), экспрессия которых активируется до более высокого или более низкого уровня на других стадиях одного и того же заболевания или состояния. Также понятно, что дифференциально экспрессируемый ген может либо активироваться, либо ингибироваться при уровне нуклеиновой кислоты или уровне белка, или может подвергаться альтернативному сплайсингу, результатом которого является другой полипептидный продукт. Подобные отличия могут подтверждаться множеством изменений, включая уровни мРНК, поверхностную экспрессию, секрецию или другие разделения полипептида. Дифференциальная генная экспрессия может включать сравнение экспрессии между двумя или более генами или их генными продуктами; или сравнение соотношений экспрессии между двумя или более генами или их генными продуктами; или даже сравнение двух дифференциально процессированных продуктов одного и тот же гена, которые отличаются между нормальными объектами и больными, страдающими заболеванием; или между различными стадиями одного и того же заболевания. Дифференциальная экспрессия включает как количественные, так и качественные различия в паттерне временной или клеточной экспрессии в гене или среди продуктов его экспрессии, например, нормальных и заболевших клеток, или среди клеток, которые подвергались различным событиям заболевания или стадиям заболевания.
[00116] Как используется в данном документе, «индивид» относится к тестовому объекту или пациенту. Индивидом может быть млекопитающее или не млекопитающее. В различных вариантах осуществления, индивидом является млекопитающее. Индивидом-млекопитающим может быть человек или не человек. В различных вариантах осуществления, индивидом является человек. Здоровым или нормальным индивидом является индивид, у которого интересующее заболевание или состояние (включая, например, сердечно-сосудистые события, такие как инфаркт миокарда, инсульт и застойная сердечная недостаточность) не выявляется общепринятыми диагностическими способами.
[00117] «Диагноз», «диагностирование», «постановка диагноза» и их варианты относятся к выявлению, определению или распознаванию статуса или состояния здоровья индивида на основании одного или более признаков, симптомов, данных или другой информации, относящейся к данному индивиду. Статус здоровья индивида может быть диагностирован как здоровое/нормальное (т.е. постановка диагноза отсутствия заболевания или состояния) или диагностирован как больное/патологическое (т.е. постановка диагноза наличия, или оценка характеристик, заболевания или состояния). Термины «диагноз», «диагностирование», «постановка диагноза» и т.д. охватывают, относительно конкретного заболевания или состояния, первоначальное выявление заболевания; характеризацию или классификацию заболевания; определение прогрессирования, ремиссии или рецидива заболевания; и выявление болезненной реакции после проведения лечения или терапии для индивида. Прогноз риска сердечно-сосудистого события включает отделение индивидов, которые имеют повышенный риск сердечно-сосудистого события, от индивидов, которые не имеют.
[00118] «Прогнозировать», «прогнозирование», «прогноз» и их варианты относятся к прогнозированию протекания заболевания или состояния в будущем у индивида, который имеет заболевание или состояние (например, прогнозирование выживания пациента), и подобные термины охватывают оценку ответа индивида на заболевания или состояние индивида после проведения лечения или терапии.
[00119] «Оценивать», «оценивание», «оценка» и их варианты охватывают как «диагностировать», так и «прогнозировать», а также охватывают определения или прогнозы о протекании заболевания или состояния в будущем у индивида, который не имеет заболевания, а также определения или прогнозы, касающиеся риска, что заболевание или состояние будет рецидировать у индивида, который, по-видимому, излечился от заболевания или имеет коррегированное состояние. Термин «оценивать» также охватывает оценку ответа индивида на терапию, такую как, например, прогнозирование, ответит ли индивид вероятно благоприятно на терапевтический агент или вряд ли ответит на терапевтический агент (или будет испытывать, например, токсические или другие нежелательные побочные эффекты), выбор терапевтического агента для введения индивиду или мониторинг или определение ответа индивида на терапию, которая была проведена для индивида. Соответственно, «оценка» риска сердечно-сосудистого события может включать, например, любое из следующего: прогнозирование риска сердечно-сосудистого события у индивида в будущем; прогнозирование риска сердечно-сосудистого события у индивида, который, по-видимому, не имеет сердечно-сосудистых проблем; или определение или прогнозирование ответа индивида на сердечно-сосудистое лечение или выбор сердечно-сосудистого лечения с целью проведения для индивида на основании определения значений биомаркеров, происходящих из биологического образца индивида. Оценка риска сердечно-сосудистого события может включать варианты осуществления, такие как оценка риска сердечно-сосудистого события по непрерывной шкале, или классификация риска сердечно-сосудистого события по возрастающим классификациям. Классификация риска включает, например, классификацию на две или более классификаций, таких как «Нет повышенного риска сердечно-сосудистого события» и «Повышенный риск сердечно-сосудистого события». Оценка риска сердечно-сосудистого события происходит в течение ограниченного периода; подобный период может составлять, например, 5 лет.
[00120] Как используется в данном документе, «дополнительная биомедицинская информация» относится к одной или более оценкам индивида, не являющихся использованием какого-либо из биомаркеров, описанных в данном документе, которые связаны с сердечно-сосудистым риском или, более конкретно, с риском сердечно-сосудистого события. «Дополнительная биомедицинская информация» включает любое из следующего: физические характеристики индивида, включая рост и/или вес индивида; возраст индивида; пол индивида; изменение массы; этническую принадлежность индивида; профессиональный анамнез; семейный анамнез сердечно-сосудистого заболевания (или других расстройств сердечно-сосудистой системы); наличие генетического маркера (маркеров), коррелирующего с повышенным риском сердечно-сосудистого заболевания (или другими расстройствами сердечно-сосудистой системы) у индивида или с изменением толщины интимы сонной артерии у члена семьи; клинические симптомы, такие как боль в груди, значения генной экспрессии набора или потери веса; физические характеристики индивида, включая физические характеристики, наблюдаемые при радиологической визуализации; статус курильщика; анамнез потребления алкоголя; профессиональный анамнез; пищевые привычки - потребление соли, насыщенных жиров и холестерина; потребление кофеина и визуализирующая информация, такая как электрокардиограмма, электрокардиография, ультразвуковое исследование сонных артерий на толщину интимы-медии, поток-опосредованное расширение, скорость распространения пульсовой волны, лодыжечно-плечевой индекс, стресс-эхокардиография, визуализация перфузии миокарда, КТ-диагностика коронарного кальциноза, КТ-ангиография высокого разрешения, магниторезонансная визуализация и другие методы медицинской визуализации; и медикаментозное лечение индивида. Тестирование уровней биомаркеров в комбинации с оценкой любой дополнительной биомедицинской информации, включая другие лабораторные испытания (например, исследование ЛПВП, ЛПНП, уровни сРБ, исследование N-терминального фрагмента предшественника мозгового натрийуретического пептида, исследование альбумина в сыворотке, исследование креатина), может, например, повышать чувствительность, специфичность и/или площадь под кривой для прогнозирования сердечно-сосудистых событий по сравнению с тестированием биомаркеров по отдельности или оценкой любого конкретного пункта дополнительной биомедицинской информации по отдельности (например, визуализации отдельно толщины интимы сонной артерии). Дополнительная биомедицинская информация может быть получена у индивида с использованием стандартных методик, известных в данной области, например, у самого индивида посредством использования стандартного опросника пациента или опросника истории болезни и т.д. или у медицинского работника и т.д. Тестирование уровней биомаркеров в комбинации с оценкой любой дополнительной биомедицинской информации может, например, улучшать чувствительность, специфичность и/или пороговые значения для прогнозирования сердечно-сосудистых событий (или других вариантов, связанных с сердечно-сосудистым применением) по сравнению с тестированием биомаркеров по отдельности или оценкой любого конкретного пункта дополнительной биомедицинской информации по отдельности (например, отдельной КТ-визуализацией).
[00121] Как используется в данном документе, «выявление» или «определение» относительно значения биомаркера включает использование как инструмента, требующегося для наблюдения и регистрирования сигнала, соответствующего значению биомаркера, так и материала/материалов, требующихся для генерирования данного сигнала. В различных вариантах осуществления, значение биомаркера определяют с использованием любого подходящего способа, включая флюоресценцию, хемилюминисценцию, поверхностный плазмонный резонанс, поверхностные акустические волны, масс-спектрометрию, инфракрасную спектроскопию, рамановскую спектроскопию, атомно-силовую микроскопию, сканирующую туннельную микроскопию, электрохимические способы выявления, ядерно-магнитный резонанс, квантовые точки и тому подобное.
[00122] «Твердая подложка» относится в данном документе к любому субстрату, имеющему поверхность, к которой могут присоединяться молекулы, непосредственно или опосредованно, либо через ковалентные или нековалентные связи. «Твердая подложка» может иметь множество физических форматов, которые могут включать, например, мембрану; чип (например, белковый чип); стекло (например, предметное стекло или покровное стекло); колонку; полую, твердую, полутвердую, содержащую поры или полости частицу, такую как, например, шарик; гель; волокно, содержащее волоконнооптический материал; матрицу; и пробоприемник. Иллюстративные пробоприемники включают лунки для пробы, пробирки, капилляры, пузырьки и любой другой сосуд, желобок или выемку, способную содержать образец. Пробоприемник может содержаться на платформе для множества образцов, такой как пластина микротитратора, стекло, микрофлюидное устройство и тому подобное. Подложка может состоять из натурального или синтетического материала, органического или неорганического материала. Состав твердой подложки, на которой зафиксированы захватывающие реагенты, в общем зависит от способа присоединения (например, ковалентного присоединения). Другие иллюстративные приемники включают микрокапельные и микрофлюидные регулируемые или неразделенные масляные/водные эмульсии, анализы и связанные манипулирования которых могут происходить. Подходящие твердые подложки содержат, например, пластмассы, смолы, полисахариды, кремний или кремниевые материалы, функционализированное стекло, модифицированный кремний, углерод, металлы, неорганические стекла, мембраны, нейлон, натуральные волокна (такие как, например, шелк, шерсть и хлопок), полимеры и тому подобное. Материал, составляющий твердую подложку, может содержать функциональные группы, такие как, например, карбокси-, амино- или гидроксильные группы, которые используют для прикрепления захватывающих реагентов. Полимерные твердые подложки могут включать, например, полистирол, полиэтиленгликоль тетрафталат, поливинилацетат, поливинилхлорид, поливинилпирролидон, полиакрилонитрил, полиметилметакрилат, политетрафторэтилен, бутилкаучук, стиролбутадиенкаучук, натуральный каучук, полиэтилен, полипропилен, (поли)тетрафторэтилен, (поли)винилиденфторид, поликарбонат и полиметилпентен. Подходящие частицы твердой подложки, которые могут быть использованы, включают, например, некодированные частицы, такие как некодированные частицы типа Luminex®, магнитные частицы и стеклянные частицы.
Иллюстративные варианты применения биомаркеров
[00123] В различных иллюстративных вариантах осуществления, предоставлены способы оценки риска сердечно-сосудистого события у индивида посредством определения одного или более значений биомаркеров, соответствующих одному или более биомаркерам, которые присутствуют в кровотоке индивида, например, в сыворотке или плазме, с помощью любого количества аналитических способов, включая любые из аналитических способов, описанных в данном документе. Данные биомаркеры, например, дифференциально экспрессируются у индивидов с повышенным риском сердечно-сосудистого события по сравнению с индивидами без повышенного риска сердечно-сосудистого события. Выявление дифференциальной экспрессии биомаркера у индивида может быть использовано, например, для предоставления возможности прогнозирования риска сердечно-сосудистого события в пределах 5-летнего промежутка времени.
[00124] В дополнение к тестированию уровней биомаркеров в качестве независимого диагностического теста, уровни биомаркеров также могут быть созданы в сочетании с определением ОНП или других генетических патологических изменений или изменчивости, которые свидетельствуют о повышенном риске предрасположенности к заболеванию или состоянию. (См., например, Amos с соавторами Nature Genetics 40, 616-622 (2009)).
[00125] В дополнение к тестированию уровней биомаркеров в качестве независимого диагностического теста, уровни биомаркеров также могут быть использованы в сочетании с радиологическим скринингом. Уровни биомаркеров также могут быть использованы в сочетании с соответствующими симптомами или генетическим тестированием. Выявление любого из биомаркеров, описанных в данном документе, может быть полезно после того, как был оценен риск сердечно-сосудистого события для направления соответствующего клинического лечения индивида, включая усиление до более интенсивных уровней лечения индивидов с высоким риском после определения риска сердечно-сосудистого события. В дополнение к тестированию уровней биомаркеров в сочетании с соответствующими симптомами или факторами риска, также может быть оценена информация, касающаяся биомаркеров, в сочетании с другими типами данных, особенно данных, которые показывают риск для индивида сердечно-сосудистых событий (например, клинического анамнеза пациента, симптомов, семейного анамнеза сердечно-сосудистого заболевания, курения или употребления алкоголя в анамнезе, факторов риска, таких как наличие генетического маркера (маркеров) и/или статуса других биомаркеров и т.д.). Эти различные данные можно оценивать с помощью автоматизированных методов, таких как компьютерная программа/программное обеспечение, которое может быть реализовано в компьютере или другом аппарате/устройстве.
[00126] В дополнение к тестированию уровней биомаркеров в сочетании с радиологическим скринингом у индивидов с высоким риском (например, оценкой уровней биомаркеров в сочетании с блоком, выявленным на коронарограмме), также может быть оценена информация, касающаяся биомаркеров, в сочетании с другими типами данных, в частности с данными, которые указывают на риск наличия сердечно-сосудистого события у индивида (например, историей болезни пациента, симптомами, семейным анамнезом сердечно-сосудистого заболевания, факторами риска, такими как курит индивид или нет, потребляет ли много спиртного, и/или статусом других биомаркеров и т.д.). Эти различные данные можно оценивать с помощью автоматизированных способов, таких как компьютерная программа/программное обеспечение, которое может быть реализовано в компьютере или другом аппарате/устройстве.
[00127] Тестирование биомаркеров также может быть связано с принципами и алгоритмами сердечно-сосудистого риска, применяемыми в настоящее время в клинической практике. Например, Фрамингемская шкала риска использует следующие факторы риска, результатом которых является шкала риска: сосудистый тонус, уровни холестерина ЛПНП и холестерина ЛПВП, нарушенные уровни глюкозы, курение, систолическое кровяное давление и диабет. С возрастом частота пациентов с высоким риском увеличивается, а мужчины имеют более большую долю пациентов с высоким риском, чем женщины.
[00128] Любой из описанных биомаркеров также может быть использован в тестах визуализации. Например, визуализирующий агент может соединяться с любым из описанных биомаркеров, что, среди других вариантов применения, может быть использовано для помощи при прогнозировании риска сердечно-сосудистого события, для мониторинга реакции на терапевтические вмешательства, для выбора целевых популяций в клиническом испытании.
Выявление и определение биомаркеров и значений биомаркеров
[00129] Значение биомаркера для биомаркеров, описанных в данном документе, может быть определено с использованием любого из множества известных аналитических способов. В одном варианте осуществления, значение биомаркера определяют с использованием захватывающего реагента. Как используется в данном документе, «захватывающий агент» или «захватывающий реагент» относится к молекуле, которая способна специфически связываться с биомаркером. В различных вариантах осуществления, захватывающий реагент может подвергаться воздействию биомаркера в растворе или может подвергаться воздействию биомаркера в то время, как захватывающий реагент иммобилизован на твердой подложке. В других вариантах осуществления, захватывающий реагент содержит признак, который дает реакцию с вторичным признаком на твердой подложке. В данных вариантах осуществления, захватывающий реагент может подвергаться воздействию биомаркера в растворе, а затем признак на захватывающем реагенте может быть использован в сочетании с вторичным признаком на твердой подложке для иммобилизации биомаркера на твердой подложке. Захватывающий реагент выбирают на основании типа анализа, который должен быть проведен. Захватывающие реагенты включают, но без ограничения, SOMAmer, антитела, аднектины, анкирины, другие имитаторы антител и другие белковые каркасы, аутоантитела, химеры, микромолекулы, фрагмент F(ab')2, фрагмент антитела с единственной цепью, Fv-фрагмент, Fv-фрагмент с единственной цепью, нуклеиновую кислоту, лектин, лигандсвязывающий рецептор, аффибоди, нанотела, импринтированные полимеры, авимеры, пептидомиметики, рецептор гормона, рецептор цитокина и синтетические рецепторы и их модификации и фрагменты.
[00130] В некоторых вариантах осуществления, значение биомаркера определяют с использованием комплекса биомаркер/захватывающий реагент.
[00131] В других вариантах осуществления, значение биомаркера происходит из комплекса биомаркер/захватывающий реагент и выявляется опосредованно, как например, в результате реакции, которая следует за взаимодействием биомаркера/захватывающего реагента, но зависит от образования комплекса биомаркер/захватывающий реагент.
[00132] В некоторых вариантах осуществления, значение биомаркера определяют непосредственно из биомаркера в биологическом образце.
[00133] В одном варианте осуществления, биомаркеры выявляют с использованием мультиплексного формата, который обеспечивает возможность одновременного выявления двух или более биомаркеров в биологическом образце. В одном варианте осуществления мультиплексного формата, захватывающие реагенты иммобилизуют, непосредственно или опосредованно, ковалентно или нековалентно, в отдельных местах на твердой подложке. В еще одном варианте осуществления, мультиплексный формат использует отдельные твердые подложки, где каждая твердая подложка имеет уникальный захватывающий реагент, связанный с данной твердой подложкой, такой как, например квантовые точки. В еще одном варианте осуществления для выявления каждого из множества биомаркеров, подлежащих выявлению в биологическом образце, используется индивидуальное устройство. Индивидуальные устройства могут быть выполнены с возможностью обеспечения одновременной обработки каждого биомаркера в биологическом образце. Например, пластина микротитратора может быть использована таким образом, чтобы каждая лунка в пластине использовалась для уникального анализа одного из множества биомаркеров, подлежащих выявлению в биологическом образце.
[00134] В одном или более из вышеупомянутых вариантов осуществления, чтобы обеспечить возможность определения значения биомаркера, может быть использована флуоресцентная метка для мечения компонента комплекса биомаркер/захватный реагент. В различных вариантах осуществления, флуоресцентная метка может быть конъюгирована с захватывающим реагентом, специфическим к любому из биомаркеров, описанных в данном документе, с использованием известных методик, а затем флуоресцентная метка может быть использована для определения соответствующего значения биомаркера. Подходящие флуоресцентные метки включают редкоземельные хелаты, флюоресцеин и его производные, родамин и его производные, дансил, аллофикоцианин, PBXL-3, Qdot 605, лиссамин, фикоэритрин, техасский красный и другие подобные соединения.
[00135] В одном варианте осуществления, флуоресцентная метка представляет собой молекулу флуоресцентного красителя. В некоторых вариантах осуществления, молекула флуоресцентного красителя содержит по меньшей мере одну систему с замещенным индольным кольцом, в котором заместитель на 3-м атоме углерода индольного кольца содержит химически функциональную группу или конъюгированное вещество. В некоторых вариантах осуществления, молекула красителя включает молекулу AlexFluor, такую как, например, AlexaFluor 488, AlexaFluor 532, AlexaFluor 647, AlexaFluor 680 или AlexaFluor 700. В других вариантах осуществления, молекула красителя включает молекулу красителя первого типа и второго типа, такие как, например, две различные молекулы AlexaFluor. В других вариантах осуществления, молекула красителя включает молекулу красителя первого типа и второго типа, причем две молекулы красителя имеют различные спектры излучения.
[00136] Флуоресценция может быть измерена посредством множества инструментов, совместимых с широким диапазоном форматов анализа. Например, были разработаны спектрофлуориметры для анализа пластин микротитратора, микропрепаратов, печатных массивов, кювет и т.д. См. Principles of Fluorescence Spectroscopy, by J.R. Lakowicz, Springer Science + Business Media, Inc. 2004. См. Bioluminescence & Chemiluminescence: Progress & Current Applications; Philip E. Stanley and Larry J. Kricka editors, World Scientific Publishing Company, January 2002.
[00137] В одном или более из вышеупомянутых вариантов осуществления, для обеспечения определения значения биомаркера необязательно может быть использована хемилюминисцентная метка для мечения компонента комплекса биомаркер/захватывающий реагент. Подходящие хемилюминисцентные материалы включают любое из оксалилхлорида, родамина 6G, Ru(bipy)32+, TMAE (тетракис(диметиламин)этилена), пирогаллол(1,2,3-тригидроксибензена), люцигенина, пероксиоксалатов, арилоксалатов, сложных эфиров акридиния, диоксетанов и других.
[00138] В других вариантах осуществления, способ выявления включает комбинацию фермент/субстрат, которая генерирует обнаруживаемый сигнал, который соответствует значению биомаркера. В общем, фермент катализирует химическое изменение хромогенного субстрата, которое может быть измерено с использованием различных методик, включая спектрофотометрию, флуоресценцию и хемилюминисценцию. Подходящие ферменты включают, например, люциферазы, люциферин, малатдегидрогеназу, уреазу, пероксидазу хрена (HRPO), щелочную фосфатазу, бета-галактозидазу, глюкоамилазу, лизоцим, глюкооксидазу, галактозоксидазу и глюкозо-6-фосфат-дегидрогеназу, уриказу, ксантиноксидазу, лактопероксидазу, микропероксидазу и тому подобное.
[00139] В других вариантах осуществления, способом обнаружения может быть комбинация флуоресценции, хемилюминисценции, комбинации радионуклид или фермент/субстрат, которые генерируют измеряемый сигнал. Мультимодальная сигнальная система может иметь уникальные и предпочтительные характеристики в форматах анализа биомаркеров.
[00140] Более конкретно, значения биомаркеров для биомаркеров, описанных в данном документе, могут быть определены с использованием известных аналитических способов, включая, одноплексные анализы SOMAmer, мультиплексные анализы SOMAmer, одноплексные или мультиплексные иммуноанализы, построение профиля экспрессии мРНК, построение профиля экспрессии миРНК, масс-спектрометрический анализ, гистологические/цитологические способы и т.д., как подробно изложено ниже.
Определение значений биомаркеров с использованием анализов, основанных на SOMAmer
[00141] Анализы, направленные на выявление и количественное определение физиологически значимых молекул в биологических образцах и других образцах, являются важными инструментами в научных изысканиях и в области заботы о здоровье. Один класс подобных анализов включает использование микроматрицы, которая содержит один или более аптамеров, иммобилизованных на твердой подложке. Каждый из аптамеров способен связываться с молекулой-мишенью высоко специфическим образом и с очень высокой аффинностью. См., например, Патент США №5475096, озаглавленный «Nucleic Acid Ligands»; см. также, например, Патент США №6242246, Патент США №6458543 и Патент США №6503715, каждый из которых озаглавленный «Nucleic Acid Ligand Diagnostic Biochip». После того, как микроматрица контактирует с образцом, аптамеры связываются со своими соответствующими молекулами-мишенями, имеющимися в образце, и тем самым предоставляют возможность определения значения соответствующего биомаркеру.
[00142] Как используется в данном документе, «аптамер» относится к нуклеиновой кислоте, которая имеет сродство к специфическому связыванию для молекулы-мишени. Следует признать, что аффинные взаимодействия являются вопросом степени; однако, в данном контексте, «сродство к специфическому связыванию» аптамера для его мишени означает, что аптамер связывается со своей мишенью в общем со значительно более высокой степенью сродства, чем он связывается с другими составными элементами в тестовом образце. «Аптамер» представляет собой набор копий молекулы нуклеиновой кислоты одного типа или вида, которая имеет конкретную нуклеотидную последовательность. Аптамер может содержать любое подходящее количество нуклеотидов, включая любое количество химически модифицированных нуклеотидов. «Аптамеры» относятся более чем к одному подобному набору молекул. Различные аптамеры могут иметь либо один и тот же, либо различные количества нуклеотидов. Аптамеры могут представлять собой ДНК или РНК или химически модифицированные нуклеиновые кислоты и могут быть односпиральные, двухспиральные или содержать двухспиральные области, и могут содержать структуры с более высокой упорядоченностью. Аптамер также может представлять собой фотоаптамер, где в аптамер включена фотореактивная или химически реактивная функциональная группа, предоставляя возможность его ковалентного связывания со своей соответствующей мишенью. Любой из аптамерных способов, раскрытых в данном документе, может включать использование двух или более аптамеров, которые специфически связывают одну и ту же молекулу-мишень. Как дополнительно описано ниже, аптамер может содержать метку. Если аптамер содержит метку, нет необходимости, чтобы все копии аптамера имели одну и ту же метку. Более того, если каждый из разных аптамеров содержит метку, данные различные аптамеры могут иметь либо одну и ту же метку, либо иную метку.
[00143] Аптамер может быть идентифицирован с использованием любого известного способа, включая процесс SELEX. После идентификации, аптамер может быть получен или синтезирован в соответствии с любым известным способом, включая способы химического синтеза и способы ферментного синтеза.
[00144] Как используется в данном документе, «SOMAmer» или Модифицированный Аптамер с Низкой Скоростью Диссоциации относится к аптамеру, имеющему улучшенные характеристики скорости диссоциации. SOMAmer могут быть созданы с использованием улучшенных способов SELEX, описанных в Публикации США №2009/0004667, озаглавленной «Способ создания Аптамеров с Улучшенными скоростями диссоциации».
[00145] Термины «SELEX» и «процесс SELEX» используются в данном документе взаимозаменяемо для обозначения в общем комбинации (1) выбора аптамеров, которые взаимодействуют с молекулой-мишенью желательным образом, например, связываясь с высокой аффинностью с белком, с (2) амплификацией данных выбранных нуклеиновых кислот. Процесс SELEX может быть использован для идентификации аптамеров с высокой аффинностью с конкретной мишенью или биомаркером.
[00146] SELEX в общем включает получение кандидатной смеси нуклеиновых кислот, связывание кандидатной смеси с требуемой молекулой-мишенью с образованием аффинного комплекса, отделение аффинных комплексов от несвязанных кандидатных нуклеиновых кислот, отделение и изолирование нуклеиновой кислоты от аффинного комплекса, очистку нуклеиновой кислоты и идентификацию специфической аптамерной последовательности. Процесс может включать множество кругов для дальнейшей аффинной очистки выбранного аптамера. Процесс может включать стадии амплификации в одной или более точках процесса. См., например, Патент США №5475096, озаглавленный «Nucleic Acids Ligands». Процесс SELEX может быть использован для генерирования аптамера, который ковалентно связывает свою мишень, а также аптамер, который нековалентно связывает свою мишень. См., например, Патент США №5705337 озаглавленный «Systematic Evolution of Nucleic Acids Ligands by Exponential Enrichment: Chemi-SELEX».
[00147] Процесс SELEX может быть использован для идентификации высокоаффинных аптамеров, содержащих модифицированные нуклеотиды, которые придают аптамеру улучшенные характеристики, такие как, например, улучшенная стабильность in vivo или улучшенные характеристики доставки. Примеры подобных модификаций включают химические замещения в позициях рибозы и/или фосфата, и/или основания. Идентифицированные в процессе SELEX аптамеры, содержащие модифицированные нуклеотиды, описаны в Патенте США №5660985, озаглавленном «High Affinity Nucleic Acids Ligands Containing Modified Nucleotides», который описывает олигонуклеотиды, содержащие нуклеотидные производные, химически модифицированные в 5'- и 2'-положениях пиримидинов. Патент США №5580737, см. выше, описывает высоко специфические аптамеры, содержащие один или более нуклеотидов, модифицированных 2'-амино (2'-NH2), 2'-фтор (2'-F) и/или 2'-О-метил (2'-OMe). См. также, Публикацию Патентной Заявки США 20090098549, озаглавленную «SELEX and PHOTOSELEX», которая описывает библиотеки нуклеиновых кислот, имеющих расширенные физические и химические свойства, и их использование в SELEX и photoSELEX.
[00148] SELEX также может быть использован для идентификации аптамеров, которые имеют желательные характеристики скорости диссоциации. См. Публикацию Патентной Заявки США 20090004667, озаглавленную «Method for Generating Aptamers with Improved Off-Rates», которая описывает улучшенные способы SELEX для генерирования аптамеров, которые могут связываться с молекулами-мишенями. Как упоминалось выше, данные аптамеры с медленной скоростью диссоциации известны, как «SOMAmer». Описаны способы создания аптамеров или SOMAmer и фотоаптамеров или SOMAmer, имеющих более низкие скорости диссоциации по сравнению со своими соответствующими молекулами-мишенями. Способы включают контакт кандидатной смеси с молекулой-мишенью, обеспечивая возможность возникновения образования комплексов нуклеиновая кислота-мишень, и проведение процесса обогащения с медленной скоростью диссоциации, где комплексы нуклеиновая кислота-мишень с быстрыми скоростями диссоциации будут диссоциировать, а не преобразовываться, тогда как комплексы с медленными скоростями диссоциации будут оставаться неизменными. Кроме того, способы включают использование модифицированных нуклеотидов при создании смесей кандидатных нуклеиновых кислот для генерирования аптамеров или SOMAmer с улучшенной эффективностью скорости диссоциации.
[00149] В варианте данного анализа используются аптамеры, которые содержат фотореактивные функциональные группы, которые предоставляют возможность ковалентного связывания или «фотосшивания» аптамеров со своими молекулами-мишенями. См., например, Патент США №6544776, озаглавленный «Nucleic Acids Ligands Diagnostic Biochip». Данные фотореактивные аптамеры также упоминаются, как фотоаптамеры. См., например, Патент США №5763177, Патент США №6001577 и Патент США №6291184, каждый из которых озаглавлен «Systemic Evolution of Nucleic Acids Ligands by Exponential Enrichment: Photoselection of Nucleic Acids Ligands and Solution SELEX»; см. также, например, Патент США №6458539, озаглавленный «Photoselection of Nucleic Acids Ligands». После того, как микроматрица контактирует с образцом, а фотоаптамеры имели возможность связаться со своими молекулами-мишенями, фотоаптамеры фотоактивируются, а твердую подложку промывают для удаления всяких неспецифически связанных молекул. Могут быть использованы агрессивные условия промывания, поскольку молекулы-мишени, которые связаны с фотоаптамерами, в общем не удаляются благодаря ковалентным связям, создаваемым фотоактивированной функциональной группой (группами) на фотоаптамерах. Таким образом, анализ предоставляет возможность определения значений биомаркеров, соответствующих биомаркеру в тестовом образце.
[00150] В обоих данных форматах анализа, аптамеры или SOMAmer иммобилизуются на твердой подложке перед контактом с образцом. Однако, в некоторых обстоятельствах, иммобилизация аптамеров или SOMAmer перед контактом с образцом не может обеспечить оптимальный анализ. Например, результатом предварительной иммобилизации аптамеров или SOMAmer может быть неэффективное перемешивание аптамеров или SOMAmer с молекулами-мишенями на поверхности твердой подложки, может быть приводящее к растянутому времени реакции и, вследствие этого, к продленным периодам инкубирования, обеспечивая возможность эффективного связывания аптамеров или SOMAmer со своими молекулами-мишенями. Кроме того, когда в анализе используют фотоаптамеры или фотоSOMAmer и в зависимости от материала, используемого в качестве твердой подложки, твердая подложка может иметь тенденцию к рассеиванию или поглощению света, используемого, чтобы вызвать образование ковалентных связей между фотоаптамерами или фотоSOMAmer и их молекулами-мишенями. Более того, в зависимости от используемого способа, выявление молекул-мишеней, связанных со своими аптамерами или фотоSOMAmer, может быть объектом неточности, поскольку поверхность твердой подложки также может подвергаться воздействию и влиянию любых используемых метящих агентов. В заключение, иммобилизация аптамеров или SOMAmer на твердой подложке в общем включает стадию получения аптамеров или SOMAmer (т.е. иммобилизацию) перед воздействием на аптамеры или SOMAmer образца, и данная стадия получения может влиять на активность или функциональность аптамеров или SOMAmer.
[00151] Также были описаны анализы SOMAmer, которые обеспечивают возможность SOMAmer захватывать свою мишень в растворе, а затем используют стадии разделения, которые разработаны для удаления конкретных компонентов смеси SOMAmer-мишень перед обнаружением (см. Публикацию Патентной Заявки США 20090042206, озаглавленный «Multiplexed Analyses of Test Samples»). Описанные способы анализа SOMAmer предоставляют возможность выявления и количественного определения ненуклеиновокислотной мишени (например, белка-мишени) в тестовом образце посредством выявления и количественного определения нуклеиновой кислоты (т.е. SOMAmer). Описанные способы создают имитатор нуклеиновой кислоты (т.е. SOMAmer) для выявления и количественного определения ненуклеиновокислотной мишени, соответственно, обеспечивая возможность применения большого множества нуклеиновокислотных технологий, включая амплификацию, к более широкому диапазону необходимых мишеней, включая белки-мишени.
[00152] SOMAmer могут быть сконструированы для облегчения отделения компонентов анализа от комплекса SOMAmer-биомаркер (или ковалентного комплекса фотоSOMAmer-биомаркер) и допускают изоляцию SOMAmer для выявления и/или количественного определения. В одном варианте осуществления, данные конструкции могут содержать расщепляемый или высвобождаемый элемент внутри последовательности SOMAmer. В других вариантах осуществления, в SOMAmer может быть введена дополнительная функциональная группа, например, меченый или выявляемый компонент, спейсерный компонент или метка специфического связывания, или иммобилизирующий элемент. Например, SOMAmer может содержать метку, соединенную с SOMAmer посредством расщепляемого фрагмента, меченый атом, спейсерный компонент, разделяющей метку и расщепляемый фрагмент. В одном варианте осуществления, расщепляемый элемент представляет собой фоторасщепляемый линкер. Фоторасщепляемый линкер может быть прикреплен к биотиновому фрагменту и спейсерному участку, может содержать группу NHS для дериватизации аминов и может быть использован для введения биотиновой группы в SOMAmer, обеспечивая тем самым возможность высвобождения SOMAmer позже в способе анализа.
[00153] Однородные анализы, проводимые со всеми компонентами анализа в растворе, не требуют разделения образца и реагентов перед обнаружением сигнала. Данные способы являются быстрыми и легкими для применения. Данные способы генерируют сигнал на основании молекулярного захвата или захватывающего реагента, который вступает в реакцию со своей специфической мишенью. Для прогнозирования сердечно-сосудистых событий, молекулярным захватывающим реагентом должен быть SOMAmer или антитело и тому подобное, а специфической мишенью должен быть биомаркер сердечно-сосудистого события таблицы 1, столбец 7.
[00154] В одном варианте осуществления, способ генерирования сигнала использует изменение анизотропного сигнала вследствие взаимодействия меченого флуорофором захватывающего реагента со своим специфическим биомаркером-мишенью. Когда меченый захватывающий реагент вступает в реакцию со своей мишенью, увеличенная молекулярная масса вызывает вращательное движение флуорофора, соединенного с комплексом, где значение анизотропности изменяется значительно медленнее. За счет мониторинга изменения анизотропности, события связывания могут быть использованы для количественного измерения биомаркеров в растворах. Другие способы включают поляризационные флуоресцентные анализы, способы молекулярного маяка, гашение разрешенной во времени флуоресценции, хемилюминисценцию, резонансный перенос энергии флуоресценции и тому подобное.
[00155] Иллюстративный анализ SOMAmer в растворе, который может быть использован для определения значения биомаркера, соответствующего биомаркеру в биологическом образце, включает следующее: (a) получение смеси за счет контакта биологического образца с SOMAmer, который содержит первую метку и имеет специфическое сродство для биомаркера, где аффинный комплекс с SOMAmer образуется, когда в образце имеется биомаркер; (b) выдерживание смеси на первой твердой подложке, содержащей первый связывающий элемент, и предоставление возможности связывания первой метки с первым связывающим элементом; (c) удаление из смеси любых компонентов, не связанных с первой твердой подложкой; (d) присоединение второй метки к биомаркерному компоненту аффинного комплекса с SOMAmer; (e) освобождение аффинного комплекса с SOMAmer от первой твердой подложки; (f) выдерживание высвобожденного аффинного комплекса с SOMAmer на второй твердой подложке, которая содержит второй связывающий элемент, обеспечивая возможность связывания второй метки со вторым связывающим элементом; (g) удаление из смеси всякого не вошедшего в комплекс SOMAmer посредством отделения не вошедшего в комплекс SOMAmer от аффинного комплекса с SOMAmer; (h) элюирование SOMAmer с твердой подложки; и (i) выявление биомаркера посредством выявления компонента SOMAmer аффинного комплекса с SOMAmer.
[00156] Для определения значения биомаркера посредством выявления компонента SOMAmer аффинного комплекса с SOMAmer может быть использовано любое средство, известное в данной области. Для выявления компонента SOMAmer аффинного комплекса может быть использован ряд различных способов выявления, таких как, например, гибридизационные анализы, масс-спектроскопия или количественная ПЦР. В некоторых вариантах осуществления, для выявления компонента SOMAmer аффинного комплекса с SOMAmer и тем самым определения значения биомаркера может быть использован метод секвенирования нуклеиновых кислот. Если коротко, тестовый образец может быть подвергнут любому типу метода секвенирования нуклеиновых кислот для идентификации и количественного определения последовательности или последовательностей одного или более SOMAmer, присутствующих в тестовом образце. В некоторых вариантах осуществления, последовательность содержит целую молекулу SOMAmer или любую часть молекулы, которая может быть использована для уникальной идентификации молекулы. В других вариантах осуществления, идентифицирующее секвенирование представляет собой специфическую последовательность, добавленную к SOMAmer; подобную последовательность часто называют «метки», «штрихкоды» или «зипкоды». В некоторых вариантах осуществления, метод секвенирования включает ферментные стадии для амплификации последовательности SOMAmer или для преобразования любого типа нуклеиновой кислоты, включая РНК и ДНК, которые содержат химические модификации, в любом положении, в любой другой тип нуклеиновой кислоты, подходящий для определения последовательности.
[00157] В некоторых вариантах осуществления, метод секвенирования включает одну или более стадий клонирования. В других вариантах осуществления метод секвенирования включает метод прямого секвенирования без клонирования.
[00158] В некоторых вариантах осуществления, метод секвенирования включает направленный подход со специфическими праймерами, которые выделяют один или более SOMAmer в тестовом образце. В других вариантах осуществления, метод секвенирования включает подход широкого охвата, который выделяет все SOMAmer в тестовом образце.
[00159] В некоторых вариантах осуществления, метод секвенирования включает ферментные стадии для амплификации молекулы, выделенной для определения последовательности. В других вариантах осуществления, метод секвенирования прямо секвенирует единичные молекулы. Иллюстративный метод, основанный на секвенировании нуклеиновых кислот, который может быть использован для определения значения биомаркера, соответствующего биомаркеру в биологическом образце, включает следующее: (a) преобразование смеси SOMAmer, которые содержат химически модифицированные нуклеотиды в немодифицированные нуклеиновые кислоты с помощью ферментных стадий; (b) секвенирование широкого охвата получившихся в результате немодифицированных нуклеиновых кислот с помощью платформы для массивно-параллельного секвенирования, такой как например, система секвенирования 454 (454 Life Sciences/Roche), система секвенирования Illumina (Illumina), система секвенирования ABI Solid (Applied Biosystems), секвенсор Единичных Молекул HeliScope (Helicos Biosciences) или система секвенирования Единичных молекул в реальном времени Pacific Biosciences (Pacific Biosciences) или система секвенирования Polonator G (Dover Systems); и (c) идентификацию и количественное определение SOMAmer, присутствующих в смеси, посредством подсчета специфической последовательности и последовательности.
Определение значений биомаркеров с использованием иммуноанализов
[00160] Методы иммуноанализа основаны на реакции антитела на свою соответствующую мишень или аналит и могут выявлять аналит в образце в зависимости от конкретного формата анализа. Для улучшения специфичности и чувствительности метода анализа, основанного на иммунореактивности, часто используют моноклональные антитела по причине их специфического распознавания эпитопов. Поликлональные антитела также успешно использовали в различных иммуноанализах по причине их повышенного сродство с мишенью по сравнению с моноклональными антителами. Иммуноанализы конструировали для использования с широким диапазоном матриц биологических образцов. Форматы иммуноанализов разрабатывали для обеспечения качественных, полуколичественных и количественных результатов.
[00161] Количественные результаты генерируют за счет использования стандартной кривой, создаваемой с известными концентрациями конкретного аналита, подлежащего выявлению. Ответ или сигнал от неизвестного образца наносят на стандартную кривую, и устанавливают количество или значение, соответствующее мишени в неизвестном образце.
[00162] Было разработано множество форматов иммуноанализа. ELISA или EIA могут быть количественными для выявления аналита. Данный способ основан на присоединении меченого атома либо к аналиту, либо к антителу, и меченый компонент содержит либо непосредственно, либо опосредованно фермент. Тесты ELISA могут быть отформатированы для прямого, непрямого, конкурентного выявления аналита или выявления по сэндвич-методу. Другие способы основаны на меченых атомах, таких как, например, радиоизотопы (1125), или флуоресценции. Дополнительные методики включают, например, агглютинацию, нефелометрию, измерение мутности, Вестерн-блот, иммуноосаждение, иммуноцитохимию, иммуногистохимию, проточную цитометрию, анализ Luminex и другие (см. ImmunoAssay: A Practical Guide, edited by Brian Law, published by Taylor & Francis, Ltd. 2005 edition).
[00163] Иллюстративные форматы анализа включают фермент-связанное иммуносорбентное исследование (ELISA), радиоиммуноанализ, флуоресценцию, хемилюминисценцию и иммуноанализы с резонансным переносом энергии флуоресценции (FRET) или с разрешенным во времени-FRET (TR-FRET). Примеры методик выявления биомаркеров включают иммуноосаждение биомаркеров, за которым следуют количественные способы, которые обеспечивают возможность распознавания размеров и уровней пептидов, такие как гельэлектрофорез, капиллярный электрофорез, плоскостную электрохроматографию и тому подобное.
[00164] Способы выявления и/или количественного определения выявляемой метки или генерирующего сигнал материала зависят от природы метки. Продукты реакций, катализируемые соответствующими ферментами (где выявляемой меткой является фермент; см. выше), могут быть, без ограничения, флуоресцентными, люминисцентными или радиоактивными или они могут поглощать видимый или ультрафиолетовый свет. Примеры детекторов, подходящих для выявления подобных выявляемых меток, включают, без ограничения, рентгеновскую пленку, счетчики радиоактивного излучения, сцинтилляционные счетчики, спектрофотометры, колориметры, флуорометры, люминометры и денситометры.
[00165] Любой из способов выявления может быть выполнен в любом формате, который обеспечивает возможность любой подходящей подготовки, обработки и анализа реакций. Это может быть, например, в многолуночных аналитических планшетах (например, 96 луночных или 384 луночных) или с использованием любой подходящей матрицы или микроматрицы. Маточные растворы для различных агентов можно готовить вручную или автоматизированно, и все последующее пипетирование, разбавление, перемешивание, распределение, промывание, инкубирование, считывание образцов, сбор и анализ данных может быть проделано автоматизированно с использованием коммерчески доступного программного обеспечения для анализа, робототехники и измерительной аппаратуры для детектирования, способной обнаруживать выявляемую метку.
Определению значений биомаркеров с использованием построения профилей генной экспрессии
[00166] Измерение мРНК в биологическом образце может быть использовано в качестве имитатора выявления уровня соответствующего белка в биологическом образце. Соответственно, любой из биомаркеров или панелей биомаркеров, описанных в данном документе, также может быть выявлен посредством выявления соответствующей РНК.
[00167] Уровни экспрессии мРНК измеряют посредством полимеразной цепной реакции с обратной транскриптазой (RT-ПЦР с последующей количественной ПЦР). RT-ПЦР используется для создания кДНК из мРНК. КДНК может быть использована в анализе количественной ПЦР для создания флуоресценции по мере прохождения процесса амплификации ДНК. За счет сравнения со стандартной кривой, количественная ПЦР может производить абсолютное измерение, например, количества копий мРНК на клетку. Нозерн-блоттинг, микроматрицы, Invader анализы и RT-ПЦР, объединенная с капиллярным электрофорезом, - все используется для измерения уровней экспрессии мРНК в образце. См. Gene Expression Profiling: Methos and Protocols, Richard A. Shimkets, editor, Humana Press, 2004.
[00168] Молекулы микроРНК представляют собой небольшие РНК, которые не кодируют, но могут регулировать генную экспрессию. Любой из способов, подходящих для измерения уровней экспрессии мРНК, также может быть использован для соответствующей микроРНК. В настоящее время множество лабораторий изучают использование микроРНК в качестве биомаркеров заболевания. Множество заболеваний включает широко распространенную регуляцию транскрипции, и не удивительно, что микроРНК могут занять место в качестве биомаркеров. Связь между концентрациями микроРНК и заболеванием часто еще меньше понятна, чем связи между уровнями белков и заболеванием, хотя значение биомаркеров микроРНК может быть существенным. Конечно, как и с любой РНК, экспрессируемой дифференциально в процессе заболевания, проблемы, связанные с разработкой диагностического продукта in vitro, будут включать требование, чтобы микроРНК выживали в пораженных клетках и легко экстрактировались для анализа, или чтобы микроРНК высвобождались в кровь или другие матрицы, где они должны выживать достаточно долго для измерения. Белковые биомаркеры имеют аналогичные требования, хотя множество потенциальных белковых биомаркеров секретируют умышленно в месте патологии и функционируют, в процессе заболевания, паракринным образом. Разработано множество потенциальных белковых биомаркеров для функционирования за пределами клеток, внутри которых синтезируются данные белки.
Определение биомаркеров с использованием технологий молекулярной визуализации In Vivo
[00169] Любой из описанных биомаркеров (см. таблицу 1, столбец 7) также может быть использован в тестах молекулярной визуализации. Например, визуализирующий агент может соединяться с любым из описанных биомаркеров, который может быть использован для помощи при прогнозировании риска сердечно-сосудистых событий в пределах 5 лет, среди других вариантов применения для мониторинга ответа на терапевтические вмешательства, для выбора популяция для клинических испытаний.
[00170] Технологии визуализации in vivo предоставляют не инвазивные способы определения стадии конкретного заболевания или состояния в организме индивида. Например, все части организма, или даже весь организм, можно увидеть в виде трехмерного изображения, обеспечивая тем самым ценную информацию, касающуюся морфологии и структур организма. Подобные технологии можно объединить с обнаружением биомаркеров, описанным в данном документе, для предоставления информации, касающейся сердечно-сосудистого состояния индивида.
[00171] Использование технологий молекулярной визуализации in vivo расширяется благодаря различным усовершенствованиям технологии. Данные усовершенствования включают разработку новых контрастных веществ или меток, таких как радиоактивные метки и/или флуоресцентные метки, которые могут обеспечить сильные сигналы внутри организма; и разработку новой мощной технологии визуализации, которая может обнаруживать и анализировать данные сигналы за пределами организма, с достаточной чувствительностью и точностью для предоставления пригодной информации. Контрастное вещество может быть визуализировано в подходящей системе визуализации, предоставляя посредством этого изображение части или частей организма, в котором находится контрастное вещество. Контрастное вещество может быть связано или ассоциировано с захватывающим реагентом, таким как SOMAmer или, например, антитело, и/или с пептидом, или белком, или с олигонуклеотидом (например, для выявления генной экспрессии), или с комплексом, содержащим любой из них, с одной или более макромолекулами и/или другими формами частиц.
[00172] Контрастное вещество также может иметь отличительный признак в виде радиоактивного атома, который используется при визуализации. Подходящие радиоактивные атомы включают технеций-99m или йод-123 для сцинтиграфических исследований. Другие легко обнаруживаемые фрагменты включают, например, спиновые метки для магниторезонансной визуализации (MRI), такие как, например, снова йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо. Подобные метки хорошо известны в данной области и могут быть легко выбраны рядовым специалистом в данной области.
[00173] Стандартные методики визуализации включают, но без ограничения, магниторезонансную визуализацию, компьютерное томографическое сканирование (коронарный кальциевый индекс), позитронно-эмиссионную томографию (PET), однофотонную эмиссионную компьютерную томографию (SPECT), компьютерную томографическую ангиографию и тому подобное. Для диагностической визуализации in vivo, вид доступного инструмента обнаружения является главным фактором при выборе указанного контрастного вещества, такого как указанный радионуклид, и конкретный биомаркер, который используется в мишени (белке, мРНК и тому подобное). Обычно выбираемый радионуклид имеет тип распада, который обнаруживается с помощью данного типа инструмента. Также, при выборе радионуклида для постановки диагноза in vivo, его период полураспада должен быть достаточно долгим, чтобы обеспечить возможность выявления за время максимального поглощения мишенью-тканью, но достаточно коротким, чтобы минимизировать вредное облучение хозяина.
[00174] Иллюстративные методики визуализации включают, но без ограничения, PET и SPECT, которые являются методиками визуализации, в которых индивиду искусственно или местно вводят радионуклид. Последующее поглощение радиоактивного индикатора измеряют во времени и используют для получения информации о намеченной ткани и биомаркере. По причине высокоинтенсивных излучений (гамма-излучение) используемых конкретных изотопов и чувствительности и изощренности инструментов, используемых для их обнаружения, о двумерном распределении радиоактивности можно делать заключение из-за пределов организма.
[00175] Широко используемые позитронно-активные нуклиды в PET включают, например, углерод-11, азот-13, кислород-15 и фтор-18. Изотопы, которые распадаются за счет захвата электронов и/или гамма излучения, используются в SPECT и включают, например, йод-123 и технеций-99m. Иллюстративным способом мечения аминокислот технецием-99m является восстановление ионов пертехнетата в присутствии хелирующего предшественника с образованием неустойчивого комплекса предшественника технеция-99m, который, в свою очередь, вступает в реакцию со связывающей металлы группой бифункционально модифицированного хемотаксического пептида с образованием конъюгата хемотаксического пептида технеция-99m.
[00176] Антитела часто используют для подобных диагностических способов визуализации in vivo. Приготовление и использование антител для постановки диагноза in vivo хорошо известно в данной области. Меченые антитела, которые специфично связывают любой из биомаркеров в Таблице 1, столбце 7, можно инъецировать индивиду, у которого подозревается наличие повышенного риска сердечно-сосудистого события, обнаруживаемого согласно конкретному биомаркеру, используемому с целью диагностирования или оценки статуса заболевания или состояния индивида. Используемую метку необходимо выбирать в соответствии с методикой визуализации, которая должна быть использована, как описано ранее. Локализация метки обеспечивает возможность определения повреждения тканей или других показателей, связанных с риском сердечно-сосудистого события. Величина метки внутри органа или ткани также обеспечивает возможность определения вовлеченности биомаркеров сердечно-сосудистых событий вследствие риска сердечно-сосудистого события в данном органе или ткани.
[00177] Аналогичным образом, SOMAmer могут быть использованы для подобных диагностических способов визуализации in vivo. Например, SOMAmer, который использован для идентификации конкретного биомаркера, описанного в Таблице 1, столбце 7 (и вследствие этого специфически связывается с данным конкретным биомаркером), может быть должным образом помечен и инъецирован индивиду, у которого подозревается наличие сердечно-сосудистого события, обнаруживаемого согласно конкретному биомаркеру, с целью диагностирования или оценки уровней повреждения ткани, атеросклеротических бляшек, компонентов воспалительной реакции и других факторов, связанных с риском сердечно-сосудистого события у индивида. Используемую метку необходимо выбирать в соответствии с методикой визуализации, которая должна быть использована, как описано ранее. Локализация метки обеспечивает возможность определения участка процессов, приводящих к повышенному риску. Величина метки внутри органа или ткани также обеспечивает возможность определения инфильтрации патологического процесса в данном органе или ткани. Направленные на SOMAmer визуализирующие агенты могут иметь уникальные и предпочтительные характеристики, связанные с проникновением в ткань, распределением в ткани, кинетикой, элиминацией, эффективностью и селективностью по сравнению с другими визуализирующими агентами.
[00178] Подобные методики также необязательно могут быть выполнены с мечеными олигонуклеотидами, например, для выявления генной экспрессии посредством визуализации с антисмысловыми олигонуклеотидами. Данные способы используют для гибридизации in situ, например, с флуоресцентными молекулами или радионуклидами в качестве меток. Другие способы выявления генной экспрессии включают, например, выявление активности гена-репортера.
[00179] Еще одним общим типом технологии визуализации является оптическая визуализация, в которой флуоресцентные сигналы внутри объекта выявляют с помощью оптического устройства, которое находится за пределами объекта. Данные сигналы могут возникать благодаря фактической флуоресценции и/или биолюминесценции. Улучшения чувствительности оптических устройств обнаружения повышают применимость оптической визуализации для диагностических анализов in vivo.
[00180] Использование визуализации молекулярных биомаркеров in vivo увеличивается, в том числе для клинических испытаний, например, для более быстрого измерения клинической эффективности в испытаниях для новых видов лечения заболевания или состояния и/или с целью избежать продолжительного лечения placebo для данных заболеваний, таких как рассеянный склероз, в котором подобное продолжительное лечение может рассматриваться этически сомнительным.
[00181] Для обзора других методик, см. N. Blow, Nature Methods, 6, 465-469, 2009.
Определение значений биомаркеров с использованием масс-спектрометрических методов
[00182] Для определения значений биомаркеров может быть использовано множество конфигураций масс-спектрометров. Несколько типов масс-спектрометров доступны или могут производиться с различными конфигурациями. В общем, масс-спектрометр имеет следующие главные составные элементы: впуск для образцов, источник ионов, масс-анализатор, детектор, вакуумную систему и систему управления приборами и систему обработки данных. Отличие во впуске для образцов, источнике ионов и масс-анализаторе в общем определяет тип инструмента и его возможности. Например, впуском может быть капиллярный жидкостной хроматографический источник или может быть прямой зонд или столик, такой как используется при лазерной десорбции из матрицы. Обычными источниками ионов являются, например, электроспрей, включая наноспрей и микроспрей или лазерная десорбция из матрицы. Обычные масс-анализаторы включают квадрупольный масс-фильтр, масс-анализатор с ионной ловушкой и времяпролетный масс-анализатор. Дополнительные масс-спектрометрические методы хорошо известны в данной области (см. Burlingame с соавторами Anal. Chem. 70:647 R-716R (1998); Kinter and Sherman, New York (2000)).
[00183] Белковые биомаркеры и значения биомаркеров могут быть выявлены и измерены посредством любого из следующего: масс-спектрометрии с ионизацией электрораспылением (ESI-MS), ESI-MS/MS, ESI-MS/(MS)n, времяпролетной масс-спектрометрии с лазерной ионизацией и десорбцией из жидкой матрицы (MALDI-TOF-MS), времяпролетной масс-спектрометрии с усиленной поверхностью лазерной ионизацией и десорбцией (SELDI-TOF-MS), десорбции/ионизации на силиконе (DIOS), вторичной ионной масс-спектрометрии (SIMS), квадрупольной времяпролетной (Q-TOF), тандемной времяпролетной (TOF/TOF) технологии, под названием Ultraflex III TOF/TOF, масс-спектрометрии с химической ионизацией при атмосферном давлении (APCI-MS), APCI-MS/MS, APCI-(MS)N, масс-спектрометрии с фотоионизацией при атмосферном давлении (APPI-MS), APPI-MS/MS и APPI-(MS)N, квадрупольной масс-спектрометрии, масс-спектрометрии с Фурье-преобразованием (FTMS), количественной масс-спектрометрии и масс-спектрометрии с захватом ионов.
[00184] Стратегии приготовления образцов используют для мечения и обогащения образцов перед масс-спектроскопической характеризацией биомаркеров белков и определением значений биомаркеров. Способы мечения включают, но без ограничения, изобарные метки для относительного и абсолютного количественного анализа (iTRAQ) и метка стабильными изотопами аминокислот в клеточной культуре (SILAC). Захватывающие реагенты, используемые для избирательного обогащения образцов для кандидатных биомаркерных белков перед масс-спектроскопическим анализом, включают, но без ограничения, SOMAmer, антитела, зонды для нуклеиновых кислот, химеры, микромолекулы, F(ab')2-фрагмент, фрагмент антитела с одиночной цепью, Fv-фрагмент, Fv-фрагмент с одиночной цепью, нуклеиновую кислоту, лектин, лигандсвязывающий рецептор, аффибоди, нанотела, анкирины, доменные антитела, альтернативные каркасы антител (например, диабоди и т.д.) импринтированные полимеры, авимеры, пептидомиметики, пептоиды, пептидные нуклеиновые кислоты, треозную нуклеиновую кислоту, рецептор гормона, рецептор цитокина и синтетические рецепторы и их модификации и фрагменты.
Определение значений биомаркеров с использованием метода близкого лигирования
[00185] Метод близкого лигирования может быть использован для определения значений биомаркеров. Если коротко, тестовый образец вводят в контакт с парой аффинных зондов, которыми может быть пара антител или пара SOMAmer, причем каждый элемент пары продолжается олигонуклеотидом. Мишенями для пары аффинных зондов могут быть два различных подлежащих идентификации вещества на одном белке или одно подлежащее идентификации вещество на каждом из двух различных белков, которые могут существовать в виде гомо- или гетеро-мультимерных комплексов. Когда зонды связываются с намеченными веществами, подлежащими идентификации, свободные концы олигонуклеотидных продолжений входят в достаточно близкий контакт для совместной гибридизации. Гибридизация олигонуклеотидных продолжений облегчается за счет общего связующего олигонуклеотида, который служит для соединения вместе олигонуклеотидных продолжений, когда они располагаются в непосредственной близости. После того, как олигонуклеотидные продолжения зондов гибридизируются, концы продолжений соединяются вместе посредством ферментного лигирования ДНК.
[00186] Каждое олигонуклеотидное продолжение содержит праймерный сайт для ПЦР-амплификации. После того, как олигонуклеотидные продолжения сшивают вместе, олигонуклеотиды образуют непрерывную последовательность ДНК, которая, посредством ПЦР-амплификации, выявляет информацию, касающуюся идентичности и количества белка-мишени, а также, информацию, касающуюся взаимодействий белков с белками, где намеченные вещества, подлежащие идентификации, находятся на двух различных белках. Близкое лигирование может обеспечить высоко чувствительный и специфичный анализ информации о концентрации и взаимодействии белков в реальном времени посредством использования ПЦР в реальном времени. Зонды, которые не связывают интересующие вещества, подлежащие идентификации, не имеют соответствующих олигонуклеотидных продолжений, приближающихся друг к другу, где лигирование или ПЦР-амплификация не может происходить, в результате чего не возникает сигнал.
[00187] Вышеупомянутые анализы предоставляют возможность определения значений биомаркеров, которые используются в способах прогнозирования риска сердечно-сосудистых событий, где способы включают определение, в биологическом образце индивида, значений по меньшей мере N биомаркеров, каждое из которых соответствует биомаркеру, выбранному из группы, состоящей из биомаркеров, предоставленных в Таблице 1, столбце 7, где классификация, которая описана подробно ниже, с использованием значений биомаркеров, показывает, имеет ли индивид повышенный риск появления сердечно-сосудистого события в пределах 5-летнего периода времени. Несмотря на то, что некоторые из описанных биомаркеров сердечно-сосудистых событий для прогнозирования риска сердечно-сосудистого события используются по отдельности, в данном документе также описаны способы группировки множества подгрупп биомаркеров сердечно-сосудистых событий, каждая из которых используется в виде панели из трех или более биомаркеров. Соответственно, различные варианты осуществления настоящей заявки предоставляют комбинации, содержащие N биомаркеров, где N составляет по меньшей мере три биомаркера. В других вариантах осуществления, N выбирают как любое количество из 2-155 биомаркеров. Необходимо учитывать, что N может быть выбрано таким образом, чтобы составлять любое количество из любого из описанных выше диапазонов, а также аналогичных диапазонов, но более высокого порядка. В соответствии с любым из способов, описанных в данном документе, значения биомаркеров могут быть определены и классифицированы по отдельности или они могут быть определены и классифицированы совместно, например, как в формате мультиплексного анализа.
[00188] «Сигнатура» биомаркера для данного диагностического или прогностического теста содержит комплект маркеров, причем каждый маркер имеет различные уровни в интересующих популяциях. Различные уровни, в данном контексте, могут относиться к различным значениям уровней маркеров для индивидов в двух или более группах, или к различным отклонениям в двух или более группах, или к комбинации и того и другого. Для наиболее простой формы диагностического теста, данные маркеры могут быть использованы для распределения неизвестного образца индивида в одну из двух групп, либо с повышенным риском сердечно-сосудистого события, либо нет. Распределение образца в одну из двух или более групп известно, как классификация, а процедура, используемая для осуществления данного распределения, известна как классификатор или способ классификации. Способ классификации также может упоминаться, как способы подсчета. Имеется множество способов классификации, которые могут быть использованы для построения диагностического классификатора из набора значений биомаркеров. В общем, способы классификации наиболее легко выполнить, используя идеи управляемого обучения, когда накапливают набор данных с использованием образцов, полученных у индивидов внутри двух (или более, для множества положений по классификации) различных групп, которые необходимо разделить. Поскольку класс (группа или популяция), к которой относится каждый образец, для каждого образца известен заранее, способ классификации может быть подготовлен, чтобы выдавать требуемый ответ по классификации. Также возможно использовать методики управляемого обучения для создания диагностического классификатора.
[00189] Общие подходы для разработки диагностических классификаторов включают решающие деревья; алгоритмы bagging, boosting, forests и random forests; обучение, основанное на правилах выводов; окна Парзена; линейные модели; логистику; методы нейронной сети; неконтролируемое выделение кластеров; метод k-средних; иерархическое восхождение/снижение; полуконтролируемое обучение; методы прототипов; ближайшую соседнюю запись; ядерную оценку плотности; методы опорных векторов; скрытые Марковские модели; обучение Больцмана; и классификаторы можно объединить либо просто, либо способами, которые минимизируют конкретные целевые функции. Для обзора, см., например, Pattern Classification, R.O. Duda, с соавт. editors, John Wiley & Sons, 2nd edition, 2001; см. также, The Elements of Statistical Learning - Data Mining, Inference, and Prediction, T. Hastie, с соавторами editors, Springer Science+Business Media, LLC, 2nd edition, 2009; каждое из которых включено посредством ссылки во всей своей полноте.
[00190] Для создания классификатора с использованием методик контролируемого обучения, получают набор образцов, называемых данные тренинга. В контексте диагностических тестов, данные тренинга содержат образцы из различных групп (классов), к которым будут позже приписаны неизвестные образцы. Например, образцы, собранные у индивидов в контрольной популяции и у индивидов в популяции с конкретным заболеванием, состоянием или событием, могут составлять данные тренинга для разработки классификатора, который может классифицировать неизвестные образцы (или, более конкретно, индивидов, у которых были получены образцы) как-либо имеющих заболевание, состояние или повышенный риск события, либо не имеющих заболевание, состояние или повышенный риск события. Разработка классификатора из данных тренинга известна как тренинг классификатора. Конкретные подробности по тренингу классификаторов зависят от сути методики контролируемого обучения (см., например, Pattern Classification, R.O. Duda, с соавторами editors, John Wiley & Sons, 2nd edition, 2001; см. также, The Elements of Statistical Learning - Data Mining, Inference, and Prediction, T. Hastie, с соавт. editors, Springer Science+Business Media, LLC, 2nd edition, 2009).
[00191] Поскольку обычно имеется значительно больше потенциальных значений биомаркеров, чем образцов в тренировочном наборе, необходимо тщательно следить за тем, чтобы избегать чрезмерно близкой подгонки. Чрезмерно близкая подгонка возникает, когда статистическая модель описывает случайную ошибку или шум вместо лежащей в основе связи. Чрезмерно близкой подгонки можно избежать множеством способов, включая, например, ограничение количества маркеров, используемых при разработке классификатора, предположение, что ответы маркеров не зависят друг от друга, ограничение сложности лежащей в основе используемой статистической модели, и обеспечение, чтобы лежащая в основе статистическая модель подтверждала данные.
[00192] Для того, чтобы идентифицировать набор биомаркеров, связанных с возникновением событий, комбинированный набор контрольных образцов и образцов с предшествующими событиями анализировали с использованием анализа главных компонентов (PCA). PCA показывает образцы относительно осей, образованных наиболее сильными отклонениями между всеми образцами, безотносительно к исходу случая или контроля, соответственно уменьшая риск чрезмерно близкой подгонки различия между случаем или контролем. Поскольку возникновение серьезных тромботических событий имеет сильную составляющую вовлеченной случайности, требуя сообщения об отрыве нестабильных бляшек в жизненно важных сосудах, нельзя ожидать увидеть четкого разделения между наборами образцов контроля и события. Несмотря на то, что наблюдаемое разделение между случаем и контролем не большое, оно возникает во втором главном компоненте, соответствуя приблизительно 10% общего отклонения в данном наборе образцов, которое показывает, что лежащая в основе биологическая изменчивость является относительно простой для количественного определения (Фигура 2A).
[00193] В следующем наборе анализов, биомаркеры можно проанализировать по тем компонентам отличия между образцами, которые были специфическими к разделению между контрольными образцами и образцами предшествующих событий. Одним способом, который может быть использован, является использование DSGA (Bair, E. and Tibshirani, R. (2004) Semi-supervised methods to predict patient survival from gene expression data. PLOS Biol., 2, 511-522) для удаления (перерасчета) направлений отклонения первых трех главных компонентов между образцами в контрольном наборе. Хотя для обнаружения в контрольном наборе выполняют понижение размерности, как образцы в контроле, так и образцы из образцов с предшествующими событиями пропускают через PCA. Разделение случаев от предшествующих событий можно наблюдать вдоль горизонтальной оси (Фигура 2B).
Отбор с перекрестной проверкой белков, имеющих отношение к сердечно-сосудистому риску
[00194] Для того, чтобы избежать чрезмерно близкой подгонки способности прогнозирования белков по специфическим признакам конкретного отбора образцов, предприняли подход с перекрестной проверкой и понижение размерности. Перекрестная проверка включает множественный отбор наборов образцов для определения связи риска белка, объединенный с использованием неотобранных образцов для мониторинга возможности применения способа к образцам, которые не были использованы при создании модели риска (The Elements of Statistical Learning - Data Mining, Inference, and Prediction, T. Hastie, с соавторами editors, Springer Science+Business Media, LLC, 2nd edition, 2009). Авторы применили метод контролируемого PCА Tibshirani с соавторами (Bair,E. and Tibshirani,R. (2004) Semi-supervised methods to predict patient survival from gene expression data. PLOS Biol. 2, 511-522.), который применим к высокоразмерным наборам данных при моделировании риска события. Метод контролируемого PCA (SPCA) включает отбор по одному признаку набора белков, статистически связанных с опасностью наблюдаемых событий в данных, и определение коррелированного компонента, который объединяет информацию от всех данных белков. Данное определение коррелированного компонента является стадией понижения размерности, которая не только объединяет информацию по всем белкам, но также уменьшает вероятность чрезмерно близкой подгонки за счет уменьшения количества независимых переменных из полного перечня белков свыше 1000 белков до нескольких главных компонентов (в данной работе, авторы рассмотрели только первый главный компонент). Метод SPCA Tibshirani с соавторами. Применяет перекрестную проверку к отбору белков для того, чтобы определить количество белков, которые являются действительно прогнозирующими в скрытых наборах тестов с перекрестной проверкой. Данные белки используют для создания коррелированного компонента вариации белков, связанных с риском события. Используя SPCA авторы обнаружили список из 155 белков, которые были статистически связаны с риском события, при использовании данной методики перекрестной проверки со снижением размерности. При данном применении SPCA, авторы также допускали сигналы тестовых белков, соответствующие случайным последовательностям SOMAmer, а также сигналы, соответствующие нечеловеческим белкам, которые не были представлены в образцах. Ни один из данных 10-20 известных небиологических сигналов не был выбран в 155 белках с помощью SPCA (Таблица 1). Данная стадия с использованием подхода SPCA с перекрестной проверкой является важной для скринирования против ложных положительных связей белковых маркеров. Подход у Tibshirani с соавторами особенно защищен против ложного обнаружения за счет использования подтверждающего способа перекрестной проверки и снижения размерности, присущего PCA. Список из 155 белков из SPCA был использован для проверки последующих анализов с использованием различных методик выявления ложного обнаружения белковых маркеров, не включенных в список из 155 белков из SPCA.
Однофакторный анализ и многофакторный анализ взаимосвязи белков индивидов со временем события
[00195] Модель пропорциональных рисков Кокса (Cox, David R (1972). «Regression Models and Life-Tables». Journal of Royal Statistic Society. Series B (Methodological) 34 (2): 187-220.)) широко используется в медицинской статистике. Регрессия Кокса избегает подгонки конкретной функции времени к совокупной выживаемости, и вместо этого использует модель относительного риска, называемого базовая функция риска (которая может варьировать со временем). Базовая функция риска описывает общую форму распределения времени жизни для всех индивидов, тогда как относительный риск дает уровень риска для набора значений ковариантов (например, единственный индивид или группа), в качестве множества базового риска. В модели Кокса относительный риск является константой во времени.
[00196] Авторы вставили 1092 простых однофакторных модели Кокса во все сигналы. 46 белков (Таблица 2) имеют P-значения (Wald test, (Wald, Abraham. (1943). A Method of Estimating PЛВСe Vulnerability Based on Damage of Survivors. Statistical Research Group, Columbia University) лучше, чем 10-14. Все эти 46 белков были включены в список из 155 белков, выбранных с использованием SPCA (выше, Таблица 1). Большое количество высоко значимых белков поначалу удивительно, однако включение почки в сердечно-сосудистое заболевание накладывает изменения на GFR (Скорость клубочковой фильтрации). Уменьшения в GFR будут увеличивать все белки с ненулевым почечным клиренсом, концентрация белка в крови снижается за счет потери белка в мочу через почку (клиренс), уменьшенная почечная фильтрация, которую измеряют посредством GFR, соответственно связана с повышенной концентрацией тех белков в крови, которые частично фильтруются почкой.
[00197] Подходящая модель была бы более скромной, чем полный список из 46 белков. Также как видно в PCA многие белки вероятно должны иметь большую корреляцию, эффективная модель должна это учитывать. Авторы в два этапа отфильтровали список из 46 высоко значимых белков до 10 белков. Во-первых, авторы ограничили список до 20 белков, которые дали коэффициент с величиной больше, чем 0,37 (эквивалентно 30% изменению риска для дублирования белкового сигнала), данную стадию взяли в единую многофакторную модель Кокса с использованием всех 46 белков. (Натуральный логарифм измерений белков был сделан перед подгонкой модели Кокса, вследствие этого экспоненциал коэффициента Кокса соответствует отношению рисков e-кратного (2,71) изменения измерения белка.)
[00198] На следующей стадии отфильтровали 20 белков до десяти за счет требования, что p-значение должно быть более значимым, чем 0,01. На данной стадии исключаются ковариантные белки и предоставляется возможность участия независимых белков. Итоговая корректировка в выборе биомаркеров была сделана в том, что подача сигнала C9, элемента мембраноатакующего комплекса в заключительном общем пути системы комплемента, была оценена, как слишком неспецифичная, вопрос, который не может быть решен только из данного исследования, поскольку исследование создано продемонстрировать исключительно сердечно-сосудистый риск. C9 удаляли, а все остальные белки оценивали на своем месте. Белки-заместители ранжировали по улучшению количественного показателя Вальда, а KLK3.SerpinA3 был близок по эффективности к C9.
[00199] На фигурах 3A-3E показаны кривые выживания Каплана-Майера для данной модели сердечно-сосудистого риска из десяти маркеров.
[00200] Таблица 1 идентифицирует 155 биомаркеров, которые используются для оценки риска сердечно-сосудистого события у индивида в будущем. Это неожиданно большее количество, чем ожидалось при сравнении с количеством, которое обычно обнаруживается во время усилий по обнаружению биомаркеров и может приписываться масштабу описанного исследования, которое охватывало свыше 1000 белков, измеренных в образцах сотен индивидов, в некоторых случаях в концентрациях в низком фемтомолярном диапазоне. Предположительно, большое количество обнаруженных биомаркеров отражает разнообразие биохимических путей, вовлеченных в биологию, ведущих к сердечно-сосудистому событию, и реакцию организма на сердечно-сосудистое событие; где каждый путь и процесс включает много белков. Результаты показывают, что нет единственного белка из небольшой группы белков, имеющего уникальную информацию о подобных сложных процессах; скорее, что в соответствующие процессы, такие как, например, GFR, атеросклероз, воспаление и гормональная CV регуляция, вовлечено множество белков.
[00201] Результаты из Примера 2 предлагают некоторые возможные заключения: во-первых, идентификация большого количества биомаркеров предоставляет возможность их соединения в огромное количество классификаторов, которые предлагают аналогично высокую эффективность. Во-вторых, классификаторы могут быть выполнены таким образом, что конкретные биомаркеры могут быть замещены другими биомаркерами способом, который отражает излишки, которые безусловно пронизывают сложности лежащих в основе процессов заболевания, состояния или события. То есть, информация о заболевании, состоянии или событии, привносимая любым индивидуальным биомаркером, идентифицированным в Таблице 1, перекрывается информацией, привносимой другими биомаркерами, так что может быть, что в любой классификатор не следует включать конкретный биомаркер или небольшую группу биомаркеров в Таблице 1.
Наборы
[00202] Любая комбинация биомаркеров таблицы 1, столбец 7 может быть выявлена с использованием подходящего набора, такого как для использования при выполнении способов, раскрытых в данном документе. Кроме того, любой набор может содержать одну или более обнаруживаемых меток, которые описаны в данном документе, таких как флуоресцентный фрагмент и т.д.
[00203] В одном варианте осуществления, набор содержит (a) один или более захватывающих реагентов (таких как, например, по меньшей мере один SOMAmer или антитело) для выявления одного или более биомаркеров в биологическом образце, где биомаркеры содержат любой из биомаркеров, приведенных в Таблице 1, столбце 7, и необязательно (b) одну или более программ или компьютерных программных продуктов для классификации индивида, у которого был получен биологический образец, как либо имеющего, либо не имеющего повышенный риск сердечно-сосудистого события или для определения вероятности, что индивид имеет повышенный риск сердечно-сосудистого события, как дальше описано в данном документе. В качестве альтернативы, вместо одного или более компьютерных программных продуктов, может быть предоставлена одна или более команд для выполнения человеком вручную приведенных выше стадий.
[00204] Комбинация твердой подложки с соответствующим захватывающим реагентом, имеющим генерирующий сигнал материал, упоминается в данном документе, как «устройство обнаружения» или «набор». Набор также может содержать инструкции для использования устройств и реагентов, обработки образца и анализа данных. Кроме того набор может быть использован с компьютерной системой или программным обеспечением для анализа и сообщения результата анализа биологического образца.
[00205] Наборы также могут содержать один или более реагентов (например, повышающие растворимость буферы, детергенты, моющие средства или буферы) для обработки биологического образца. Любой из наборов, описанных в данном документе, также может содержать, например, буферы, блокирующие агенты, масс-спектрометрические матричные материалы, связывающие антитела агенты, позитивные контрольные образцы, негативные контрольные образцы, программное обеспечение и информацию, такую как протоколы, руководство и справочную информацию.
[00206] В одном аспекте, изобретение предоставляет наборы для анализа статуса риска сердечно-сосудистого события. Наборы содержат ПЦР праймеры для одного или более SOMAmer, специфические к биомаркерам, выбранным из таблицы 1, столбец 7. Дополнительно набор может содержать инструкции для использования и корреляции биомаркеров с прогнозированием риска сердечно-сосудистого события. Набор также может содержать матрицу ДНК, содержащую комплемент одного или более из Somamer, специфических к биомаркерам, выбранным из таблицы 1, столбец 7, реагенты и/или ферменты для амплификации или изолирования образца ДНК. Наборы могут содержать реагенты для ПЦР в реальном времени, например, зонды TaqMan и/или праймеры и ферменты.
[00207] Например, набор может содержать (a) реагенты, содержащие по меньшей мере захватывающий реагент для количественного определения одного или более биомаркеров в тестовом образце, где указанные биомаркеры содержат биомаркеры, приведенные в Таблице 1, столбце 7, или любые другие биомаркеры или панели биомаркеров, описанные в данном документе, и необязательно (b) один или более алгоритмов или компьютерных программ для проведения стадий сравнения количества каждого биомаркера, количественно определенного в тестовом образце, с одним или более предварительно заданными пороговыми значениями и присвоения показателя для каждого биомаркера, количественно определенного на основании указанного сравнения, объединение присвоенных показателей для каждого количественно определенного биомаркера для получения общего показателя, сравнения общего показателя с предварительно заданным показателем, и использования указанного сравнения для определения, имеет ли индивид повышенный риск сердечно-сосудистого события. В качестве альтернативы, вместо одного или более алгоритмов или компьютерных программ, может быть предоставлена одна или более команд для выполнения человеком вручную приведенных выше стадий.
Компьютерные методы и программное обеспечение
[00208] После того, как выбирают биомаркер или панель биомаркеров, способ диагностирования индивида может включать следующее: 1) сбор биологического образца или его получение иным образом; 2) выполнение аналитического способа для выявления и измерения биомаркера или биомаркеров в панели в биологическом образце; 3) выполнение нормирования или стандартизации любых данных, требующихся для способа, используемого для сбора значений биомаркеров; 4) расчет показателей маркеров; 5) объединение показателей маркеров для получения общего диагностического или прогнозирующего показателя; и 6) сообщение диагностического или прогнозирующего показателя индивида. В данном подходе, диагностическим или прогнозирующим показателем может быть единственное число, определенное из суммы всех расчетов маркеров, которое сравнивают с предварительно заданным пороговым значением, которое является индикатором наличия или отсутствия заболевания. Или диагностическим, или прогнозирующим показателем может быть серия полос, каждая из которых представляет значение биомаркера, и картину ответов можно сравнить с предварительно заданной картиной для определения наличия или отсутствия заболевания, состояния или повышенного риска (или нет) события.
[00209] По меньшей мере некоторые варианты осуществления способов, описанных в данном документе, могут быть осуществлены с использованием компьютера. Пример компьютерной системы 100 показан на фигуре 4. Со ссылкой на фигуру 4, показано, что система 100 состоит из аппаратных элементов, которые электрически соединены посредством шины 108, содержит процессор 101, устройство 102 ввода, устройство 103 вывода, устройство 104 хранения, устройство 105a считывания машиночитаемых носителей информации, коммуникационную систему 106, ускорение 107 обработки (например, процессор обработки сигналов или специализированные процессоры) и память 109. Устройство 105a считывания машиночитаемых носителей информации дополнительно соединено с машиночитаемыми носителями 105b информации, комбинацией всесторонне представленных удаленных, локальных, фиксированных и/или съемных устройств хранения плюс носителей информации, памяти и т.д. Для временного и/или более долгого содержания машиночитаемой информации, которая может включать устройство 104 хранения, память 109 и/или любой другой подобный доступный ресурс системы 100. Система 100 также содержит элементы программного обеспечения (показанные с текущим расположением в рабочей памяти 191) включая операционную систему 192 и другой код 193, например, программы, данные и тому подобное.
[00210] Относительно Фигуры 4, система 100 имеет широкую гибкость и конфигурируемость. Соответственно, например, для осуществления одного или более серверов может быть использована единая архитектура, которая дополнительно может быть выполнена в соответствии с необходимыми в настоящее время протоколами, вариантами протоколов, расширениями и т.д. Однако, квалифицированным специалистам в данной области должно быть очевидно, что в соответствии с более конкретными требованиями к применению также могут быть использованы варианты осуществления. Например, один или более элементов системы может быть осуществлен в виде подэлементов внутри составного элемента системы 100 (например, внутри коммуникационной системы 106). Также может быть использовано индивидуальное аппаратное обеспечение и/или конкретные элементы могут быть осуществлены в аппаратном обеспечении, программном обеспечении или и том, и другом. Кроме того, несмотря на то, что может быть использована связь с другими компьютерными устройствами, такими как сетевые устройства ввода/вывода (не показано), должно быть понятно, что также может быть использована проводная, беспроводная, модемная и/или другая связь или связи с другими компьютерными устройствами.
[00211] В одном аспекте, система может содержать базу данных, содержащую признаки характеристики биомаркеров прогнозирования риска сердечно-сосудистого события. Данные о биомаркерах (или информация о биомаркерах) могут быть использованы в виде ввода в компьютер для использования в качестве части способа, основанного на использовании компьютерных средств. Данные о биомаркерах могут включать данные, которые описаны в данном документе.
[00212] В одном аспекте, система дополнительно содержит одно или более устройств для обеспечения ввода данных в один или более процессоров.
[00213] Система дополнительно содержит память для хранения набора ранжированных элементов данных.
[00214] В еще одном аспекте, устройство обеспечения ввода данных содержит детектор для определения характеристики элемента данных, например, такой как масс-спектрометр или устройство считывания генного чипа.
[00215] Система может дополнительно содержать систему управления базой данных. Требования или запросы пользователя могут быть отформатированы на соответствующем языке, понятном для системы управления базой данных, которая обрабатывает запрос на извлечение соответствующей информации из базы данных обучающих наборов.
[00216] Система может быть связана с сетью, с которой соединены сетевой сервер и один или более клиентов. Сетью может быть локальная вычислительная сеть (ЛВС) или глобальная вычислительная сеть (ГВС), которые известны в данной области. Предпочтительно, сервер содержит аппаратное обеспечение, необходимое для эксплуатации компьютерных программных продуктов (например, программного обеспечения) для доступа к данным базы данных для обработки требований пользователя.
[00217] Система может содержать операционную систему (например, UNIX или Linux) для выполнения команд из системы управления базой данных. В одном аспекте, операционная система может работать в глобальной сети связи, такой как Интернет, и для соединения с подобной сетью использовать сетевой сервер глобальной связи.
[00218] Система может содержать одно или более устройств, которые содержат интерфейс графического дисплея, содержащий интерфейсные элементы, такие как кнопки, выпадающие меню, полосы прокрутки, поля для ввода текста и тому подобное, которые обычно имеются в графических пользовательских интерфейсах, известных в данной области. Требования, вводимые на пользовательском интерфейсе, могут передаваться в прикладную программу в системе для форматирования для поиска соответствующей информации в одной или более баз данных системы. Требования или запросы, вводимые пользователем, могут быть сконструированы на любом подходящем языке базы данных.
[00219] Графический пользовательский интерфейс может генерироваться с помощью кода графического пользовательского интерфейса в качестве части операционной системы и может использоваться для ввода данных и/или для отображения вводимых данных. Результат обработанных данных может выводиться в интерфейсе, распечатываться на принтере в сообщении с системой, сохраняться в запоминающем устройстве и/или передаваться по сети или может предоставляться в форме машиночитаемого носителя.
[00220] Система может находиться в сообщении с устройством ввода для предоставления в систему данных, касающихся элементов данных (например, значений экспрессии). В одном аспекте, устройство ввода может содержать систему построения профиля генной экспрессии, включая, например, масс-спектрометр, устройство считывания генетического чипа или матрицы и тому подобное.
[00221] Способы и устройство для анализа информации о биомаркере для прогнозирования риска сердечно-сосудистого события согласно различным вариантам осуществления могут быть осуществлены любым подходящим образом, например, с использованием компьютерной программы, работающей на компьютерной системе. Может быть использована общепринятая компьютерная система, содержащая процессор и оперативное запоминающее устройство, такое как находящийся в удаленном доступе сервер прикладных программ, сетевой сервер, персональный компьютер или рабочая станция. Дополнительные составные элементы компьютерной системы могут содержать запоминающие устройства или системы хранения информации, такие как система хранения данных большой емкости и пользовательский интерфейс, например, общепринятый монитор, клавиатуру и отслеживающее устройство. Компьютерной системой может быть независимая система или часть сети компьютеров, содержащей сервер и одну или более баз данных.
[00222] Система анализа биомаркеров прогнозирования рисков сердечно-сосудистых событий может обеспечить функции и операции для выполнения анализа данных, например, сбора, обработки, анализа, сообщения данных и/или постановку диагноза. Например, в одном варианте осуществления, компьютерная система может выполнять компьютерную программу, которая может принимать, сохранять, искать, анализировать и сообщать информацию, связанную с биомаркерами прогнозирования рисков сердечно-сосудистых событий. Компьютерная программа может содержать множество модулей, выполняющих различные функции или операции, таких как модуль обработки для обработки исходных данных и генерирования дополнительных данных и модуль анализа для анализа исходных данных и дополнительных данных для генерирования статуса прогнозирования риска сердечно-сосудистого события и/или постановки диагноза или расчета риска. Вычисление статуса риска для сердечно-сосудистого события необязательно может включать генерирование или сбор любой другой информации, включая дополнительную биомедицинскую информацию, касающуюся состояния индивида относительно заболевания, состояния или события, идентификацию, могут ли быть необходимы дополнительные тесты, или в противном случае оценку статуса здоровья индивида.
[00223] Далее со ссылкой на Фигуру 5 можно увидеть пример способа применения компьютера в соответствии с принципами раскрытого варианта осуществления. На фигуре 5 показана блок-схема 3000. В блоке 3004 может извлекаться информация о биомаркере для индивида. Информация о биомаркере может извлекаться из компьютерной базы данных, например, после проведения тестирования биологического образца индивида. Информация о биомаркерах может содержать значения биомаркеров, каждое из которых соответствует одному из по меньшей мере N биомаркеров, выбранных из группы, состоящей из биомаркеров, предоставленных в Таблице 1, столбце 7, где N=2-155. В блоке 3008 компьютер может использоваться для классификации каждого из значений биомаркеров. А в блоке 3012 может быть проведено определение вероятности, что индивид имеет повышенный риск сердечно-сосудистого события на основании множества классификаций. Показание может быть выведено на дисплей или другое показывающее устройство, таким образом чтобы оно было видно человеку. Соответственно, например, оно может быть выведено на экран дисплея компьютера или другое устройство вывода.
[00224] Далее со ссылкой на Фигуру 6, посредством блок-схемы 3200 может быть проиллюстрирован альтернативный способ применения компьютера в соответствии с еще одним вариантом осуществления. В блоке 3204 компьютер может быть использован для извлечения информации о биомаркере для индивида. Информация о биомаркере содержит значение биомаркера, соответствующего биомаркеру, выбранному из группы биомаркеров, предоставленных в Таблице 1, столбец 7. В блоке 3208 компьютером может быть выполнена классификация значений биомаркеров. А в блоке 3212 может быть сделано указание по поводу вероятности, что индивид имеет повышенный риск сердечно-сосудистого события на основании классификации. Показание может быть выведено на дисплей или другое показывающее устройство таким образом, чтобы оно было видно человеку. Соответственно, например, оно может быть выведено на экран дисплея компьютера или другое устройство вывода.
[00225] Некоторые варианты осуществления, описанные в данном документе, могут быть осуществлены таким образом, чтобы содержать компьютерный программный продукт. Компьютерный программный продукт может содержать машиночитаемый носитель, имеющий машиночитаемый программный код, выполненный в виде среды, чтобы вызвать на компьютере с базой данных выполнение прикладной программы.
[00226] Как используется в данном документе, «компьютерный программный продукт» относится к организованному набору команд в виде операторов естественного языка или языка программирования, которые заключены в физической среде любой природы (например, письменные, электронные, магнитные, оптические или иные) и которые могут быть использованы с компьютером или другой автоматизированной системой обработки данных. Подобные операторы языка программирования, при выполнении компьютером или системой обработки данных, заставляют компьютер или систему обработки данных действовать в соответствии с конкретным содержанием операторов. Компьютерные программные продукты содержат без ограничения: программы в источнике и объектную программу и/или тест или библиотеки данных, встроенные в машиночитаемый носитель. Кроме того, компьютерный программный продукт, который предоставляет возможность компьютерной системе или устройству из оборудования для обработки данных действовать предварительно выбранным образом, может быть предоставлен во множестве форм, включая, но без ограничения, оригинальную исходную программу, ассемблерный код, объектную программу, машинный язык, зашифрованные или сжатые версии упомянутого выше и любые и все эквиваленты.
[00227] В одном аспекте, компьютерный программный продукт предоставлен для оценки риска сердечно-сосудистого события. Компьютерный программный продукт содержит машиночитаемый носитель, реализующий программный код, выполняемый процессором вычислительного устройства или системы, где программный код содержит: код, который извлекает данные, относящиеся к биологическому образцу индивида, где данные содержат значения биомаркеров, каждое из которых соответствует одному из по меньшей мере N биомаркеров в биологическом образце, выбранных из группы биомаркеров, предоставленных в Таблице 1, столбце 7, где N=2-155; и код, который осуществляет способ классификации, который в качестве функции значений биомаркеров показывает статус риска сердечно-сосудистого события индивида.
[00228] В еще одном аспекте, компьютерный программный продукт предоставлен для показа вероятности риска сердечно-сосудистого события. Компьютерный программный продукт содержит машиночитаемый носитель, реализующий программный код, выполняемый процессором вычислительного устройства или системы, где программный код содержит: код, который извлекает данные, относящиеся к биологическому образцу индивида, где данные содержат значение биомаркера, соответствующего биомаркеру в биологическом образце, выбранному из группы биомаркеров, предоставленных в Таблице 1, столбце 7; и код, который осуществляет способ классификации, который в качестве функции значения биомаркера показывает статус риска сердечно-сосудистого события индивида.
[00229] Несмотря на то, что различные варианты осуществления были описаны в виде способов или устройств, должно быть понятно, что варианты осуществления могут быть осуществлены посредством кода, связанного с компьютером, например, кода, постоянно находящегося на компьютере или доступного компьютеру. Например, для осуществления множества способов, обсуждавшихся выше, можно было бы использовать программное обеспечение и базы данных. Соответственно, в дополнение к вариантам осуществления, выполняемым с помощью аппаратных средств, необходимо заметить, что данные варианты осуществления можно было бы выполнять посредством использования промышленного изделия, состоящего из используемого компьютером носителя, имеющего воплощенный в нем машиночитаемый программный код, который вызывает реализацию функций, раскрытых в данном описании. Вследствие этого, желательно, чтобы варианты осуществления также считались защищенными данным патентом также в значениях их программного кода. Кроме того, варианты осуществления могут быть реализованы в виде кода, хранящегося в машиночитаемой памяти практически любого типа, включая, но без ограничения, ОЗУ, ПЗУ, магнитный носитель, оптический носитель или магнитно-оптический носитель. Еще в более общем виде, варианты осуществления можно было бы осуществить в виде программного обеспечения или в виде аппаратного обеспечения, или любой их комбинации, включая, но без ограничения, выполнение программного обеспечения на многоцелевом процессоре, микрокод, программируемые логические матрицы или микросхемы ASIC.
[00230] Также предусматривается, что варианты осуществления можно было бы осуществить в виде компьютерных сигналов, реализованных в виде модулированной волны, а также сигналов (например, электрических и оптических), распространяемых через среду распространения. Соответственно, различные типы информации, обсуждавшиеся выше, можно было бы форматировать в структуре, такой как структура данных, и передавать в виде электрического сигнала через среду распространения или сохранять на машиночитаемом носителе.
[00231] Необходимо заметить, что множество конструкций, материалов и действий, перечисленных в данном документе, может быть приведено в качестве средства выполнения функции или стадии выполнения функции. Вследствие этого, должно быть понятно, что подобный язык имеет право охватывать все те конструкции, материалы или действия, которые раскрыты в пределах данного описания, и их эквиваленты, включая материал, включенный посредством ссылки.
[00232] Процесс идентификации биомаркеров, применение биомаркеров, раскрытых в данном документе, и различные способы определения значений биомаркеров описаны подробно выше относительно оценки риска сердечно-сосудистого события. Однако, применение способа, использование идентифицированных биомаркеров и способы определения значений биомаркеров полностью применимы к другим конкретным типам сердечно-сосудистых состояний, к любому другому заболеванию или медицинскому состоянию или к идентификации индивидов, которые могут получать или могут не получать пользу от вспомогательного медицинского лечения.
ПРИМЕРЫ
[00233] Следующие примеры предоставлены только для иллюстративных целей и предназначены для ограничения объема правовых притязаний заявки, который определен в приложенной формуле изобретения. Все примеры, описанные в данном документе, проводили с использованием стандартных методик, которые хорошо известны и являются обычными для квалифицированных специалистов в данной области. Шаблонные методики молекулярной биологии, описанные в следующих примерах, можно осуществлять, как описано в стандартных лабораторных руководствах, например, как у Sambrook с соавторами Molecular Cloning: A Laboratory Manual, 3rd. ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001).
Пример 1. Мультиплексный аптамерный анализ образцов
[00234] Данный пример описывает мультиплексный аптамерный анализ, используемый для анализа образцов и контроля для идентификации биомаркеров, приведенных в Таблице 1. На Фигурах 1A и 1В проиллюстрирован общий протокол для анализа образца. Обычно в медицинских исследованиях данных выживания, для создания шкалы риска из множества ковариантов патологического состояния используется модель пропорциональных рисков Кокса. В данной работе, авторы использовали данный простой и хорошо известный подход для разработки модели из популяционных данных в исследовании Heart and Soul, например, подходящей для приложения к индивидуальным образцам согласно данной гибкой и широко используемой формальной системе пропорциональных рисков Кокса. Значения биомаркеров объединяют, как показано на фигуре 1В, беря логарифмическое соотношение измерений биомаркеров по отношению к нормальным уровням. Модель Кокса использует экспоненциал взвешенной суммы данных логарифмических соотношений для создания оценки отношения рисков для нормальной популяции.
[00235] В данном способе, наконечники для пипетки меняли для каждого добавления раствора.
[00236] Также, если не указано иное, для большинства переносов растворов и добавлений промывки использовали головку Beckman Biomek FxP на 96 лунок. Если не указано иное, на стадиях способа с ручным отмериванием пипеткой использовали двенадцатикальную P200 Pipetteman (Rainin Instruments, LLC, Oakland, CA). Получали внутрифирменный сделанный на заказ буфер, упоминаемый как SB17, содержащий 40 мМ HEPES, 100 мМ NaCl, 5 мМ KCl, 5 мМ MgCl2, 1 мМ EDTA с pH 7,5. Если не указано иное, все стадии проводили при комнатной температуре.
1. Приготовление аптамерного стокового раствора
[00237] Приготовляемые на заказ стоковые аптамерные растворы для 5%, 0,316% и 0,01% сыворотки получали в 2x концентрации в 1х SB17, 0,05% Tween-20. Данные растворы хранили при -20°C до использования. В день анализа каждую аптамерную смесь оттаивали при 37°C в течение 10 минут, держали в кипящей водяной бане в течение 10 минут и предоставляли возможность охлаждения до 25°C в течение 20 минут при интенсивном перемешивании между каждой стадией нагревания. После нагревания-охлаждения, 55 мкл каждой 2x аптамерной смеси вручную отмеряли пипеткой в 96-луночный планшет Hybaid и герметично закрывали планшетной фольгой. В конечном итоге получали три, 96-луночных, герметично закрытых фольгой планшета Hybaid с 5%, 0,316% или 0,01% аптамерными смесями. Индивидуальная аптамерная концентрация составляла 2x итог или 1 нМ.
2. Приготовление образцов для анализа
[00238] Замороженные аликвоты 100% сыворотки, хранили при -80°C, помещали в водяную баню при 25°C в течение 10 минут. Оттаявшие образцы помещали на лед, мягко встряхивали (регулировка 4) в течение 8 секунд, а затем перемещали на лед.
[00239] 10% раствор образца (2x итог) получали посредством переноса 8 мкл образца с использованием 50 мкл 8-канального перекрывающего пипеточного дозатора в 96-луночные планшеты Hybaid, где каждая лунка содержала 72 мкл соответствующего разбавителя образца при 4°C (1x SB17, 0,06% Tween-20, 11,1 мкМ Z-блок_2, 0,44 мМ MgCl2, 2,2 мМ AEBSF, 1,1 мМ EGTA, 55,6 мкМ EDTA для сыворотки). Данный планшет хранили на льду до начала следующих стадий разбавления образца на роботе Biomek FxP.
[00240] Для начала уравновешивания образца и аптамера, планшет с 10% образцом недолго центрифугировали и помещали на Biomek FxP, где его перемешивали посредством переливания пипеткой вверх и вниз с помощью 96-луночного пипеточного дозатора. Затем готовили планшет с -0,632% образцом (2x итог) посредством переноса 6 мкл 10% образца с планшета в 89 мкл lxSB17, 0,05% Tween-20 с 2 мМ AEBSF. Вслед за разбавлением 6 мкл полученного в результате 0,632% образца в 184 мкл lxSB17, 0,05% Tween-20 получали планшет с 0,02% образцом (2x итог). Разбавления проводили на Beckman Biomek FxP. После каждого переноса, растворы перемешивали посредством переливания пипеткой вверх и вниз. Затем 3 планшета для разбавления образца переносили в их соответствующие аптамерные растворы посредством добавления 55 мкл образца в 55 мкл соответствующей 2x аптамерной смеси. Образец и аптамерные растворы перемешивали на роботе посредством переливания пипеткой вверх и вниз.
3. Уравновешивающее связывание образцов
[00241] Планшеты с образцом/аптамером герметично закрывали силиконовыми матами с колпачками и помещали в 37°C инкубатор в течение 3,5 часов перед переходом к 1 стадии захвата.
4. Приготовление планшета с шариками для 2 захвата
[00242] 11 мл аликвоты MyOne (Invitrogen Corp. Carlsbad, CA) со стрептовидиновыми C1 шариками промывали 2 раза равными объемами 20 мм NaOH (5 минутное инкубирование для каждого промыва), 3 раза равными объемами 1х SB17, 0,05% Tween-20 и ресуспендировали в 11 мл 1х SB17, 0,05% Tween-20. Используя 12-канальный пипеточный дозатор, 50 мкл данного раствора вручную отмеряли пипеткой в каждую лунку 96-луночного планшета Hybaid. Затем планшет закрывали фольгой и хранили при 4°C для использования в анализе.
5. Приготовление планшетов с шариками для 1 захвата
[00243] Три 0,45 мкм планшета Millipore HV (мембрана Durapore, Cat# MAHVN4550) уравновешивали 100 мкл 1х SB17, 0,05% Tween-20 в течение по меньшей мере 10 минут. Затем уравновешивающий буфер фильтровали через планшет и 133,3 мкл 7,5% суспензия со стрептовидиновыми агарозными шариками (в 1х SB17, 0,05% Tween-20) добавляли в каждую лунку. Для удерживания стрептовидиновых агарозных шариков в суспензии при переносе их в фильтровальный планшет, раствор шариков вручную перемешивали с помощью 200 мкл, 12-канального пипеточного дозатора, по меньшей мере 6 раз между процессами переливания пипеткой. После того, как шарики были распределены по всем 3 фильтровальным планшетам, для удаления супернатанта с шариками применяли разрежение. В заключение, шарики промывали в фильтровальных планшетах 200 мкл 1х SB17, 0,05% Tween-20, а затем ресуспендировали в 200 мкл 1х SB17, 0,05% Tween-20. Дно фильтровальных планшетов блотировали, а планшеты сохраняли для использования в анализе.
6. Загрузка Cytomat
[00244] В Cytomat загружали все наконечники, планшеты, все реагенты в лотках (за исключением реагента NHS-биотин, который получали свежим прямо перед добавлением в планшеты), 3 подготовленных фильтровальных планшета для 1 захвата и 1 подготовленный планшет MyOne.
7. 1 Захват
[00245] После 3,5 часового периода уравновешивания, планшеты с образцом/аптамером извлекали из инкубатора, центрифугировали в течение приблизительно 1 минуты, удаляли покрышки из матов с колпачками и помещали на дно Beckman Biomek FxP. Запускали программу Beckman Biomek FxP. Если не указано иное, все последующие стадии Захвата 1 проводили роботом Beckman Biomek FxP. В рамках программы, для удаления супернатанта с шариками, к фильтровальным планшетам для 1 захвата подавали разрежение. Сто микролитров каждого из 5%, 0,316% и 0,01% уравновешивающих связывание реагентов добавляли в их соответствующие фильтровальные планшеты для 1 захвата, и каждый планшет перемешивали с использованием находящегося на дне орбитального встряхивателя при 800 об/мин в течение 10 минут.
[00246] Несвязанный раствор удаляли посредством вакуумной фильтрации. Шарики для 1 захвата промывали 190 мкл 100 мкМ биотина в 1х SB17, 0,05% Tween-20 с последующим 5x 190 мкл 1х SB17, 0,05% Tween-20 посредством дозирования раствора и немедленным вакуумным вытягиванием раствора в фильтр через планшет.
8. Введение метки
[00247] 100 мМ аликвоты NHS-PE04-биотина в безводном DMSO (хранили при -20°C) оттаивали при 37°C в течение 6 минут, а затем разбавляли 1:100 метящим буфером (SB17 с pH=7,25, 0,05% Tween-20), немедленно перед дополнением вручную в расположенный на полу лоток посредством чего робот распределял 100 мкл NHS-PE04-биотина в каждую лунку каждого фильтровального планшета 1 захвата. Данному раствору обеспечивали возможность инкубирования с шариками для 1 захвата, встряхивая при 800 об/мин в течение 5 минут на орбитальных шейкерах.
9. Кинетическое стимулирование и фоторасщепление
[00248] Вводящий метку реагент удаляли посредством вакуумной фильтрации, а реакцию гасили посредством добавления 150 мкл 20 мм глицина в 1х SB17, 0,05% Tween-20 в планшеты для 1 захвата, раствор глицина удаляли посредством вакуумной фильтрации, и еще 1500 мкл 20 мм глицина (в 1х SB17, 0,05% Tween-20) добавляли в каждый планшет и инкубировали в течение 1 минуты на орбитальных шейкерах при 800 об/мин перед удалением посредством вакуумной фильтрации.
[00249] Лунки планшетов для 1 захвата впоследствии промывали посредством добавления 190 мкл 1х SB17, 0,05% Tween-20, с немедленной последующей вакуумной фильтрацией, а затем добавлением 190 мкл 1х SB17, 0,05% Tween-20 с встряхиванием в течение 1 минуты при 800 об/мин перед вакуумной фильтрацией. Данные две стадии промыва повторяли еще два раза за исключением того, что последний промыв не удаляли вакуумной фильтрацией. После последнего промывания планшеты помещали поверх 1 мл планшета с глубокими лунками и удаляли с пола в течение центрифугирования при 1000 об/мин в течение 1 минуты для удаления такого же поступившего извне объема от агарозных шариков перед элюированием по мере возможности.
[00250] Планшеты снова помещали на Beckman Biomek FxP, и 85 мкл 10 мм DxS04 в 1х SB17, 0,05% Tween-20 добавляли в каждую лунку фильтровальных планшетов.
[00251] Фильтровальные планшеты извлекали с пола, помещали на Variomag Thermoshaker (Thermo Fisher Scientific, Inc., Waltham, MA) под световыми источниками BlackRay (Ted Pella, Inc. Redding, CA) и облучали в течение 5 минут при встряхивании при 800 об/мин. После 5-минутного инкубирования планшеты поворачивали на 180 градусов и облучали со встряхиванием в течение еще 5 минут.
[00252] Фоторасщепляющие растворы последовательно элюировали из каждого планшета 1 захвата в общий планшет с глубокими лунками посредством помещения сперва 5% фильтровального планшета 1 захвата поверх 1 мл планшета с глубокими лунками и центрифугирования при 1000 об/мин в течение 1 минуты. Затем 0,316% и 0,01% планшеты 1 захвата последовательно центрифугировали в один и тот же планшет с глубокими лунками.
10. Улавливание шариком 2 захвата
[00253] 1 мл кубик с глубокими лунками, содержащий комбинированные элюаты 1 захвата, помещали на дно Beckman Biomek FxP для 2 захвата.
[00254] Робот переносил весь фоторасщепленный элюат из 1 мл планшета с глубокими лунками на планшет Hybaid, содержащий ранее подготовленные магнитные шарики 2 захвата MyOne (после удаления буфера MyOne посредством магнитного разделения).
[00255] Раствор инкубировали с одновременным встряхиванием при 1350 об/мин в течение 5 минут при 25°C на Variomag Thermoshaker (Thermo Fisher Scientific, Inc. Waltham, MA).
[00256] Робот переносил планшет на пол магнитной станции разделения. Планшет инкубировали на магните в течение 90 секунд перед удалением и выбрасыванием супернатанта.
11. Промывания 30% глицерином при 37°C
[00257] Планшет 2 захвата перемещали на расположенный на полу тепловой шюттль-аппарат и 75 мкл 1х SB17, 0,05% Tween-20 переносили в каждую лунку. Планшет перемешивали в течение 1 минуты при 1350 об/мин и 37°C для ресуспендирования и нагревания шариков. В каждую лунку планшета 2 захвата переносили 75 мкл 60% глицерина при 37°C, и планшет продолжали перемешивать в течение еще одной минуты при 1350 об/мин и 3°C. Робот переносил планшет на магнитный сепаратор при 37°C, где его инкубировали на магните в течение 2 минут, а затем робот удалял и выбрасывал супернатант. Данные промывания повторяли еще два раза.
[00258] После удаления третьего промыва 30% глицерином с шариков 2 захвата, 150 мкл 1х SB17, 0,05% Tween-20 добавляли в каждую лунку и инкубировали при 37°C, встряхивая при 1350 об/мин в течение 1 минуты, перед удалением посредством магнитного разделения на магните при 37°C.
[00259] Шарики 2 захвата промывали последний раз с использованием 150 мкл 1х SB19, 0,05% Tween-20 с инкубированием в течение 1 минуты со встряхиванием при 1350 об/мин, перед магнитным разделением.
12. Элюирование и нейтрализация шариков 2 захвата
[00260] Аптамеры элюировали с шариков 2 захвата посредством добавления в каждую лунку 105 мкл 100 мМ CAPSO с 1 M NaCl, 0,05% Tween-20. Шарики инкубировали с данным раствором со встряхиванием при 1300 об/мин в течение 5 минут.
[00261] Затем планшет 2 захвата помещали на магнитный сепаратор в течение 90 секунд перед переносом 63 мкл элюата в новый 96-луночный планшет, содержащий 7 мкл 500 мМ HCl, 500 мм HEPES, 0,05% Tween-20 в каждой лунке. После переноса, раствор перемешивали с помощью робота посредством переливания пипеткой 60 мкл вверх и вниз пять раз.
13. Гибридизация
[00262] Beckman Biomek FxP переносил 20 мкл нейтрализованного элюата 2 захват на свежий планшет Hybaid, и 6 мкл l0x Agilent Block, содержащего 10x проверочную пробу гибридизированного контроля, добавляли в каждую лунку. Затем, 30 мкл 2x гибридизационного буфера Agilent вручную отмеряли пипеткой в каждую лунку планшета, содержащего нейтрализованные образцы и блокирующий буфер, и раствор перемешивали посредством ручного переливания пипеткой 25 мкл вверх и вниз 15 раз медленно, чтобы избежать обширного образования пузырьков. Планшет центрифугировали при 1000 об/мин в течение 1 минуты.
[00263] Сделанные на заказ стекла для микроматриц Agilent (Agilent Technologies, Inc. Santa Clara, CA) были выполнены с возможностью содержания зондов комплементaрно случайной области аптамера плюс некоторой области праймера. Для большинства аптамеров, оптимальная длина комплементaрной последовательности определяется эмпирически и колеблется между 40-50 нуклеотидами. Для более поздних аптамеров 46-мерную комплементaрную область выбирали по умолчанию. Зонды связывали с поверхностью стекла поли-T линкером для общей длины зонда, равной 60 нуклеотидам.
[00264] Стекло с уплотнением помещали в гибридизационную камеру Agilent, и 40 мкл каждого из образцов, содержащего гибридизационный и блокирующий раствор, вручную отмеряли пипеткой в каждое уплотнение. 8-канальный изменяющийся перекрывающий пипеточный дозатор использовали способом, предполагающим минимизацию образования пузырьков. затем сделанные на заказ стекла Agilent, со штрихкодом, обращенным вверх, медленно опускали на стекла с уплотнением (для подробного описания см. руководство Agilent).
[00265] Верхнюю часть гибридизационных камер помещали на сэндвич стекло/заднее стекло, и поверх всего узла помещали зажимные кронштейны. Данные узлы плотно зажимали за счет надежного поворота винтов.
[00266] Каждый сэндвич стекло/заднее стекло визуально осматривали, чтобы убедиться, что пузырек раствора может свободно двигаться внутри образца. Если пузырек не двигался свободно узел гибридизационной камеры мягко постукивали, чтобы высвободить пузырьки, застрявшие около уплотнения.
[00267] Собранные гибридизационные камеры инкубировали в гибридизационной печи Agilent в течение 19 часов при 60°C, вращая с 20 об/мин.
14. Промывание после гибридизации
[00268] Приблизительно 400 мл промывочного буфера 1 Agilent помещали в каждую из двух отдельных стеклянных ванночек для окрашивания. Одну из ванночек для окрашивания помещали на магнитную пластину для смешивания, и скользящую подставку и магнитный мешальник помещали в буфер.
[00269] Готовили ванночку для окрашивания для 2 промыва Agilent, помещая магнитный мешальник в пустую стеклянную ванночку для окрашивания.
[00270] Четвертую стеклянную ванночку для окрашивания откладывали для заключительной ацетонитриловой промывки.
[00271] Каждую из шести гибридизационных камер разбирали. Поочередно, сэндвич стекло/заднее стекло извлекали из его гибридизационной камеры и погружали в ванночку для окрашивания, содержащую 1 промывку. Сэндвич стекло/заднее стекло разжимали с использованием пары пинцетов, погружая в то же время стекло с микроматрицами. Стекло быстро переносили в скользящую подставку в ванночке для окрашивания 1 промыва на магнитной пластине для смешивания.
[00272] Скользящую подставку плавно поднимали и опускали 5 раз. Магнитную мешалку поворачивали на низкой установке и стекла инкубировали в течение 5 минут.
[00273] Когда для 1 промыва оставалась одна минута, во вторую подготовленную ванночку для окрашивания добавляли 2 промывочный буфер, предварительно нагретый до 37°C в инкубаторе. Скользящую подставку быстро переносили во 2 промывочный буфер и всякий лишний буфер на дне подставки удаляли, выскабливая его поверх ванночки для окрашивания. Скользящую подставку плавно поднимали и опускали 5 раз. Магнитную мешалку поворачивали на низкой установке, и стекла инкубировали в течение 5 минут. Скользящую подставку медленно вытаскивали из промывки 2, занимая приблизительно 15 секунд для извлечения стекол из раствора.
[00274] При одной минуте, оставшейся во 2 промывке, в четвертую ванночку для окрашивания добавляли ацетонитрил (ACN). Скользящую подставку переносили в ацетонитриловую ванночку для окрашивания. Скользящую подставку плавно поднимали и опускали 5 раз. Магнитную мешалку поворачивали на низкой установке, и стекла инкубировали в течение 5 минут.
[00275] Скользящую подставку медленно вытаскивали из ACN ванночки для окрашивания и помещали на впитывающее полотенце. Нижние кромки стекол быстро высушивали, и стекло помещали в чистую стеклянную коробку.
15. Микроматрица визуализации
[00276] Стекла с микроматрицами помещали на держатели стекол сканера Agilent и загружали в микроматричный сканер Agilent согласно инструкциям производителя.
[00277] Стекла отображали в Cy3-канале с 5 мкм разрешением с 100% установкой PMT и с рентгенодифракционной опцией, включенной на 0,05. Получившиеся в результате изображения tiff обрабатывали с использованием программного обеспечения выделения характеристик Agilent, версия 10,5.
Пример 2. Идентификация биомаркеров
[00278] Идентификацию биомаркеров потенциальных сердечно-сосудистых событий проводили для прогнозирования риска сердечно-сосудистого события в популяции индивидов в области залива San Francisco. Участники должны соответствовать одному из следующих критериев отбора для данного исследования: предшествующий инфаркт миокарда, ангиографические данные о стенозе более чем 50% в 1 или более коронарных сосудов, вызванная нагрузкой ишемия при тредмил- или ядерном стресс-тесте или предшествующая коронарная реваскуляризация. Критерии невключения включали текущий инфаркт миокарда, неспособность ходить вокруг 1 квартала и планы переезда. Образцы крови собирали натощак, а аликвоты сыворотки и плазмы хранили при -70°C. Мультиплексный анализ аффинности SOMAmer, который описан в Примере 1, использовали для измерения и сообщения значения RFU для 1034 аналиты в каждом из данных 987 образцов.
[00279] Для того, чтобы идентифицировать набор биомаркеров, связанных с возникновением событий, комбинированный набор образцов контроля и предшествующих событий анализировали с использованием PCA. PCA показывает образцы относительно осей, образованных наиболее сильными отклонениями между всеми образцами, безотносительно к исходу случая или контроля, соответственно уменьшая риск чрезмерно близкой подгонки различия между случаем или контролем. («Контроль» относится к индивидам, которые соответствуют по меньшей мере одному из критериев включения, но которые не имели сердечно-сосудистого события в ходе исследования; «случай» относится к индивидам, которые соответствуют по меньшей мере одному из критериев включения, но которые имели сердечно-сосудистое событие в ходе исследования.) Несмотря на то, что наблюдаемое разделение между случаем и контролем не большое, оно возникает во втором главном компоненте, соответствуя приблизительно 10% общего отклонения в данном наборе образцов, которое показывает, что лежащая в основе биологическая изменчивость является относительно простой для количественного определения (Фигура 2A).
[00280] В следующем наборе анализов, биомаркеры можно анализировать для данных компонентов различия между образцами, которые были специфическими к разделению между контрольными образцами и образцами предыдущего события. Хотя понижение размерности выполняют только на контрольном наборе, для определения многофакторного многомерного пространства изменений, заполненного различиями между контрольными образцами, как образцы в контрольном наборе, так и образцы в наборе предшествующего события перерассчитывают на пространство изменений, определенное между контрольными образцами, остаточное изменение в данных компонентах расширяют, отделяя случай от контроля. Это известно, как метод DSGА. Отделение случаев от предшествующих событий может наблюдаться вдоль горизонтальной оси (Фигура 2B) (Nicolau M, Tibshirani R, Borresen-Dale AL, Jeffrey SS. Disease-specific genomic analysis: Identifying the signature of pathologic biology. Bioinformatics. 2007;23:957-965.)
[00281] Для того, чтобы избежать чрезмерно близкой подгонки способности прогнозирования белков по специфическим признакам конкретного отбора образцов, предприняли подход с перекрестной проверкой и понижение размерности. Данное определение коррелированного компонента является стадией понижения размерности, которая не только объединяет информацию по всем белкам, но также уменьшает вероятность чрезмерно близкой подгонки за счет уменьшения количества независимых переменных из полного перечня белков свыше 1000 белков до нескольких главных компонентов (в данной работе, авторы рассмотрели только первый главный компонент). Данные белки используют для создания коррелированного компонента вариации белков, связанных с риском события. Используя SPCA (анализ главных компонентов, ориентированный на проверку гипотезы) авторы обнаружили список из 155 белков, которые были статистически связаны с риском события, при использовании данной методики перекрестной проверки со снижением размерности. При данном применении SPCA, авторы также допускали сигналы тестовых белков, соответствующие случайным последовательностям SOMAmer, а также сигналы, соответствующие нечеловеческим белкам, которые не были представлены в образцах. Ни один из данных 10-20 известных небиологических сигналов не был выбран в 155 белках с помощью SPCA (Таблица 1). Данная стадия с использованием подхода SPCA с перекрестной проверкой является важной для скринирования против ложных положительных связей белковых маркеров. Подход у Tibshirani с соавторами (Bair, E. And Tibshirani, R. (2004) Semi-supervised methods to predict patient survival from gene expression data. PLOS Biol., 2, 511-522) особенно защищен против ложного обнаружения за счет использования подтверждающего способа перекрестной проверки и снижения размерности, присущего PCA. Список из 155 белков из SPCA был использован для проверки последующих анализов с использованием различных методик выявления ложного обнаружения белковых маркеров, не включенных в список из 155 белков из SPCA.
Пример 3. Однофакторный анализ взаимосвязи белков индивидов c временем сердечно-сосудистого события
[00282] Модель пропорциональных рисков Кокса (Cox, David R (1972). «Regression Models and Life-Tables». Journal of Royal Statistic Society. Series B (Methodological) 34 (2): 187-220.)) широко используется в медицинской статистике. Регрессия Кокса избегает подгонки конкретной функции времени к совокупной выживаемости, и вместо этого использует модель относительного риска, называемого базовая функция риска (которая может варьировать со временем). Базовая функция риска описывает общую форму распределения времени жизни для всех индивидов, тогда как относительный риск дает уровень риска для набора значений коварианты (например, единственный индивид или группа), в качестве множества базового риска. В модели Кокса относительный риск является константой во времени.
[00283] Способ включал подгонку 1092 простых однофакторных моделей Кокса ко всем сигналам. Сорок шесть белков имеют P-значения (Wald, Abraham. (1943). A Method of Estimating PЛВСe Vulnerability Based on Damage of Survivors. Statistical Research Group, Columbia University) лучше, чем 10-14. Большое количество высоко значимых белков поначалу удивительно, однако включение почки в сердечно-сосудистое заболевание накладывает изменения на GFR (Скорость клубочковой фильтрации). Уменьшения в GFR будут увеличивать все белки с ненулевым почечным клиренсом.
[00284] Подходящая модель (в показателях технической сложности и стоимости в лаборатории) была бы более скромной, чем полный список из 46 белков, показанных в Таблице 2. Также как видно в PCA многие белки вероятно должны иметь большую корреляцию, эффективная модель должна это учитывать. Список из 46 высоко значимых белков в два этапа отфильтровали до 10 белков, как показано в таблице 3. Во-первых, авторы ограничили список до 20 белков, которые дали коэффициент с величиной больше, чем 0,37 (эквивалентно 30% изменению риска для дублирования белкового сигнала). Данную стадию взяли в единую многофакторную модель Кокса с использованием всех 46 белков. (Натуральный логарифм измерений белков был сделан перед подгонкой модели Кокса. Вследствие этого экспоненциал коэффициента Кокса соответствует отношению рисков e-кратного (2,71) изменения измерения белка.)
[00285] На следующей стадии отфильтровали 20 белков до десяти за счет требования, что p-значение должно быть более значимым, чем 0,01. На данной стадии исключаются ковариантные белки и предоставляется возможность участия независимых белков. Итоговая корректировка в выборе биомаркеров была сделана в том, что подача сигнала C9, элемента мембраноатакующего комплекса в заключительном общем пути системы комплемента, была оценена, как слишком неспецифичная, вопрос, который не может быть решен только из данного исследования, поскольку исследование создано продемонстрировать исключительно сердечно-сосудистый риск. C9 был удален, а все остальные белки оценивали на своем месте. Белки-заместители ранжировали по улучшению количественного показателя Вальда, а KLK3.SerpinA3 был близок по эффективности к C9.
[00286] На Фигурах 3A-4F для данной модели из десяти маркеров сердечно-сосудистого риска (Таблица 3) показаны кривые выживания Каплана-Майера.
Пример 4. Однофакторный анализ взаимосвязи индивидуальных белков с конкретным типом сердечно-сосудистого события
[00287] Сердечно-сосудистые события в значительной степени попадают в два класса: тромботический и CHF. Различие между тромботическим и CHF риском имеет медицинское применение при назначении лечения, при выборе между антитромботическим и мочегонным медикаментозным лечением, например. Хотя большая часть биологии разделяется между тромботическим и CHF классами событий, тромботические события конкретно включают биологию свертывания крови (как следует из названия тромботический). С использованием десяти белков из таблицы 3, идентифицированных в модели пропорциональных рисков Кокса (Пример 3), было возможно найти сигналы, связанные со свертыванием, и сигналы, связанные с ремоделированием ткани. Для определения любого дифференциального сигнала между CHF и тромботическими событиями, соответствующие кривые Каплана-Майера были построены отдельно для CHF и тромботических событий.
[00288] Тромбоциты, или пластинки, являются ключевым звеном в биологии свертывания. GPVI представляет собой гликобелок мембраны тромбоцитов, и для данного белка, на фигуре 8 провели анализ связи с безсобытийной выживаемостью как для CHF, так и для тромботических событий. Фигура 8A показывает сильную связь тромботической безсобытийной выживаемости с уровнем GPVI, построенную в виде квартилей распределения популяции. Фигура 8B показывает, что квартили GPVI не связаны с безсобытийной выживаемостью для события CHF.
[00289] В отличие от GPVI, MATN2 (матрилин 2) представляет собой белок, связанный с экстрацеллюлярным матриксом. Фигура 9A показывает, что квартили MATN2 не связаны с риском тромботических событий, тогда как Фигура 9B показывает сильную связь между MATN2 и событиями CHF. Безсобытийная выживаемость для индивидов с MATN2 в 4-ой квартили популяции значительно хуже, чем первые три квартили.
[00290] Взятые вместе, результаты данного примера демонстрируют, что десять белковых маркеров авторов изобретения могут различать между тромботическими событиями и событиями CHF в показателях риска в течение нескольких лет после взятия образцов крови.
Пример 5. Пригодность ангиопоэтина-2 и CHRDL1 у индивидов, получающих лечение статинами
[00291] Много индивидов получают лечение статинами, с известным сердечно-сосудистым заболеванием, и много без конкретных сердечно-сосудистых состояний, например, те, кто имеют высокий холестерин ЛПНП. Данные мощные лекарственные средства меняют способность многих биомаркеров различать тех, кто имеет риск от тех, кто не имеет риска. Для биомаркеров ценно функционировать в данной популяции.
[00292] Фигура 10 показывает, что у тех больных, которые принимают статины, ангиопоэтин-2 все-таки сильно подходит для прогнозирования сердечно-сосудистого события у индивидов с высоким риском. Фигура 10 показывает графики Каплана-Майера всех 538 больных, получающих медикаментозное лечение статином, и иллюстрирует, что индивиды в 4-ой квартили распределения популяции для ангиопоэтина-2 страдают от сердечно-сосудистых событий с повышенной нормой по сравнению с индивидами не в 4-ой квартили для ангиопоэтина-2. Соответственно, несмотря на результаты лечения статинами, ангиопоэтин-2 является пригодным биомаркером риска сердечно-сосудистых событий.
[00293] Фигура 11 показывает, что у больных, принимающих статины, CHRDL1 также связан с риском сердечно-сосудистых событий в данной популяции высокого риска. Фигура 11 показывает графики Каплана-Майера всех 538 больных, получающих медикаментозное лечение статином. Она иллюстрирует, что CHRDL1 связан с безсобытийной выживаемостью сердечно-сосудистых событий у индивидов, получавших лечение лекарственным препаратом статином. Соответственно, несмотря на результаты лечения статинами, CHRDL1 является пригодным биомаркером риска сердечно-сосудистых событий.
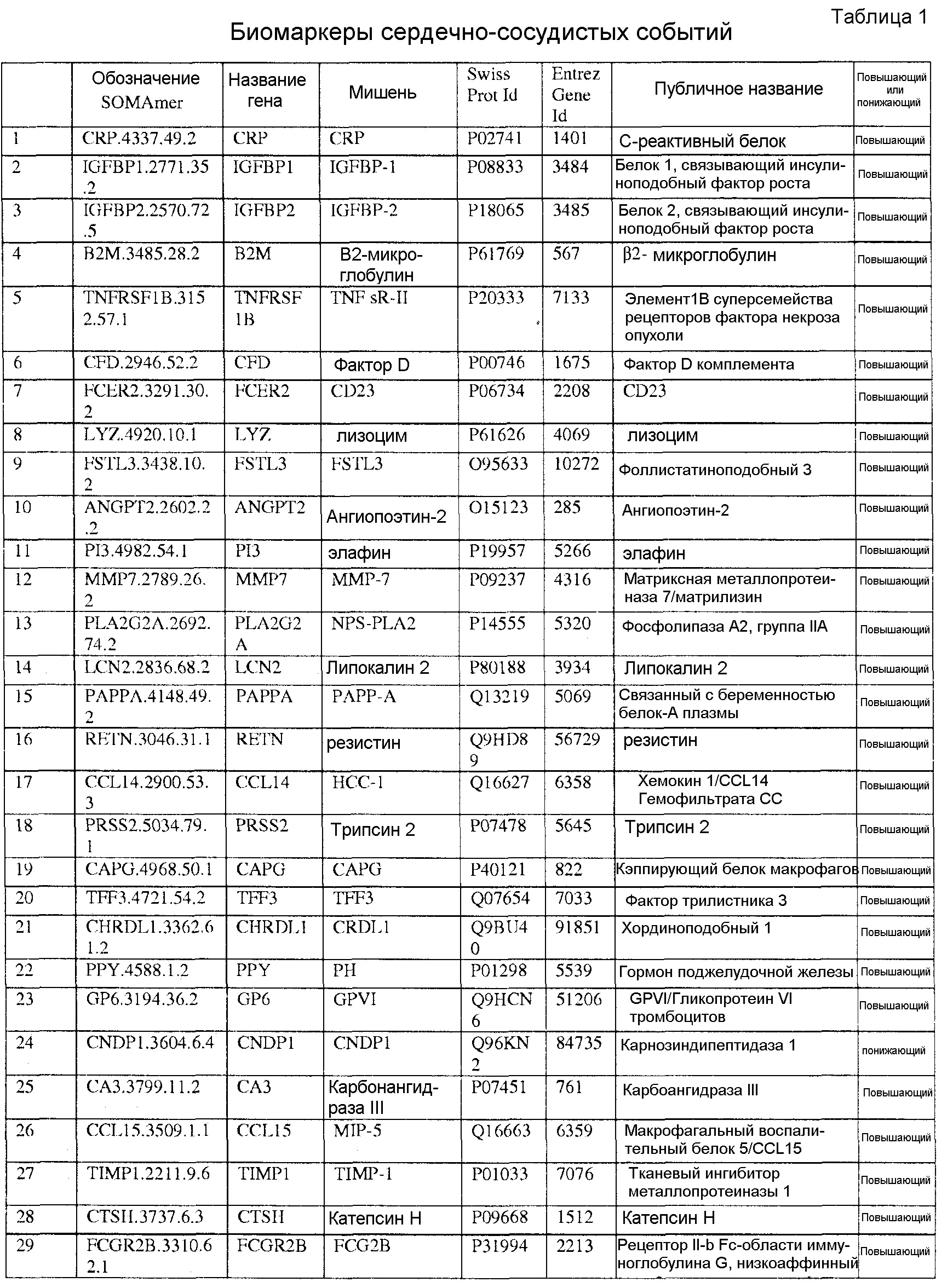
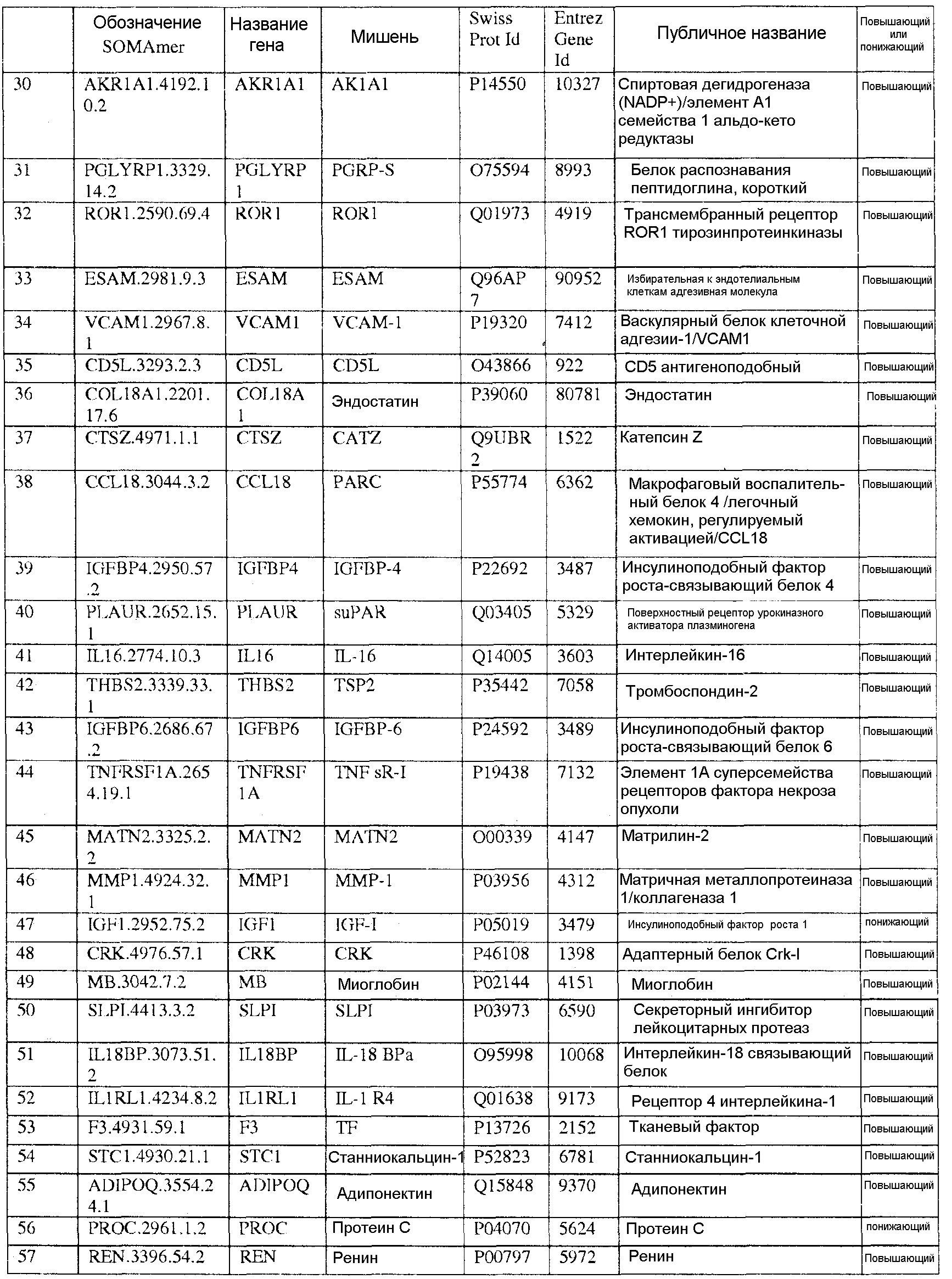
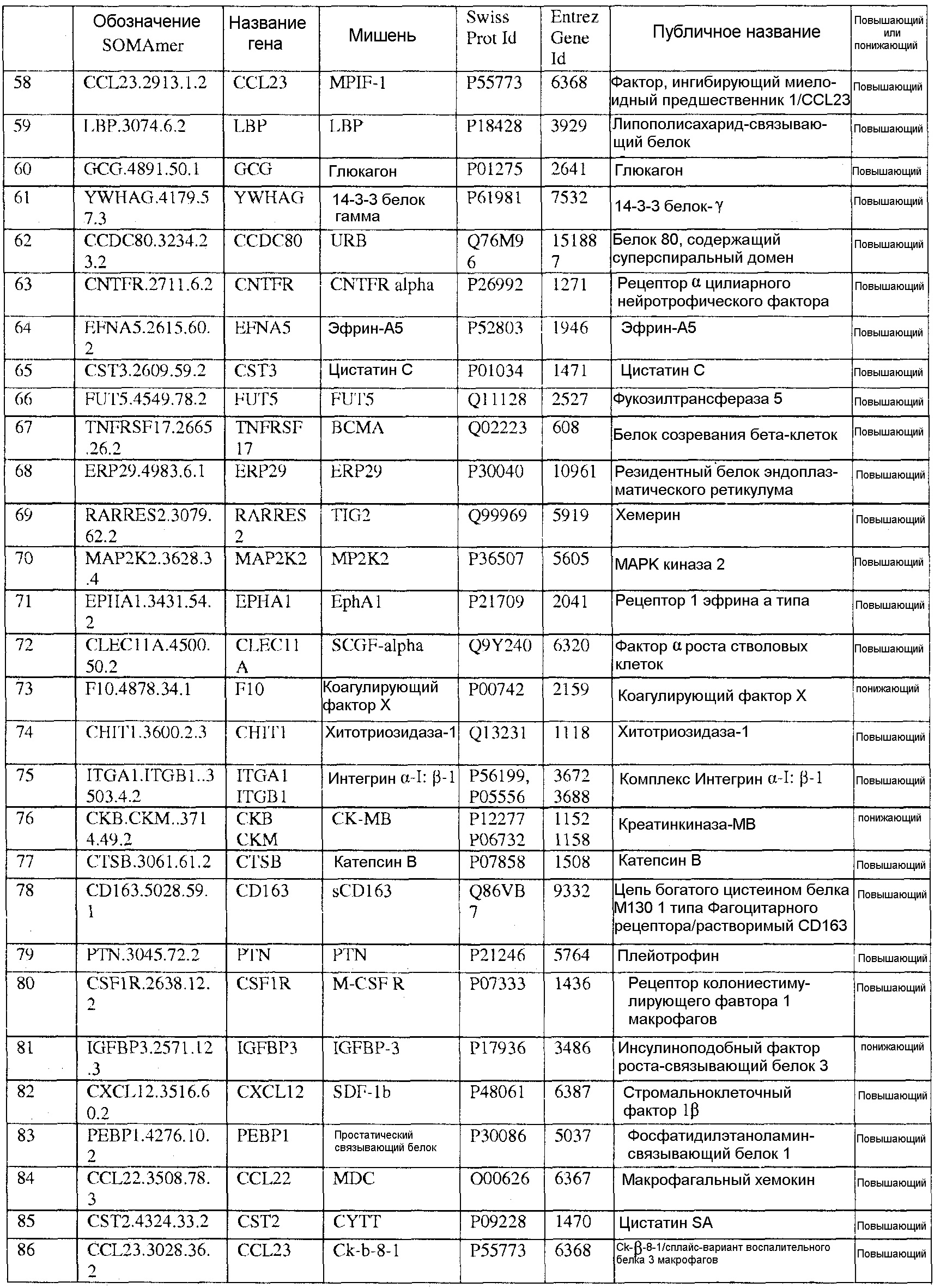
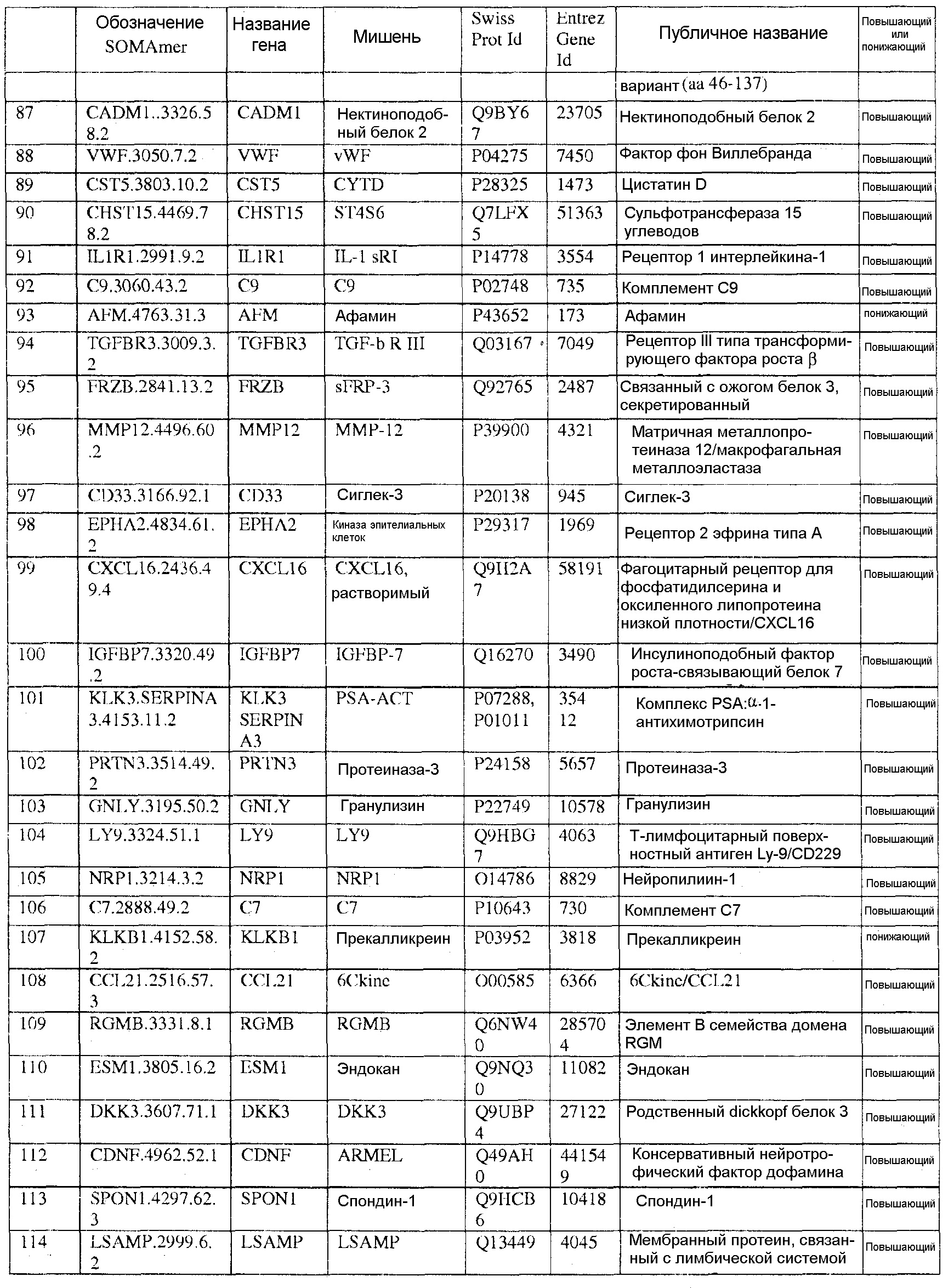
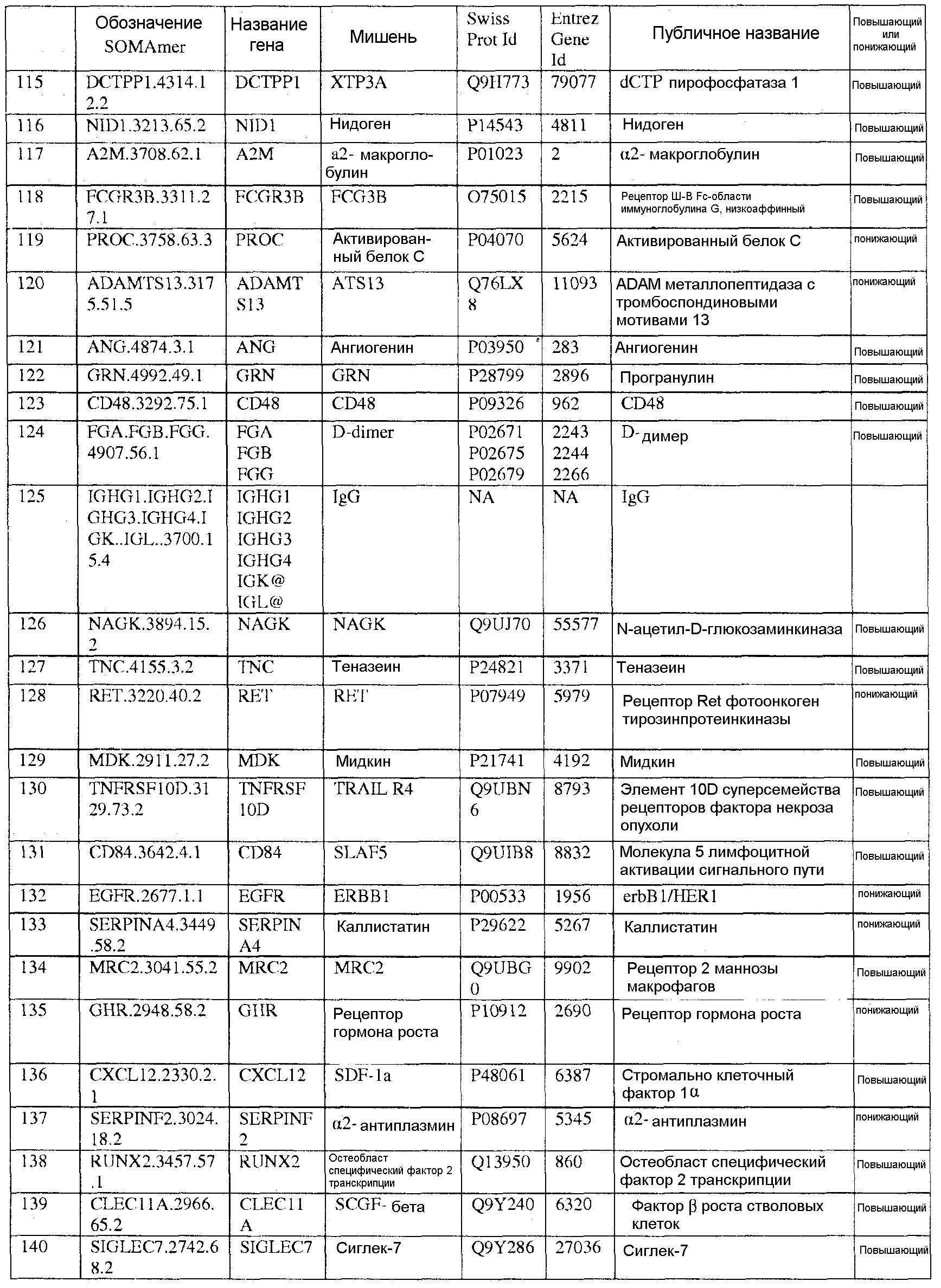
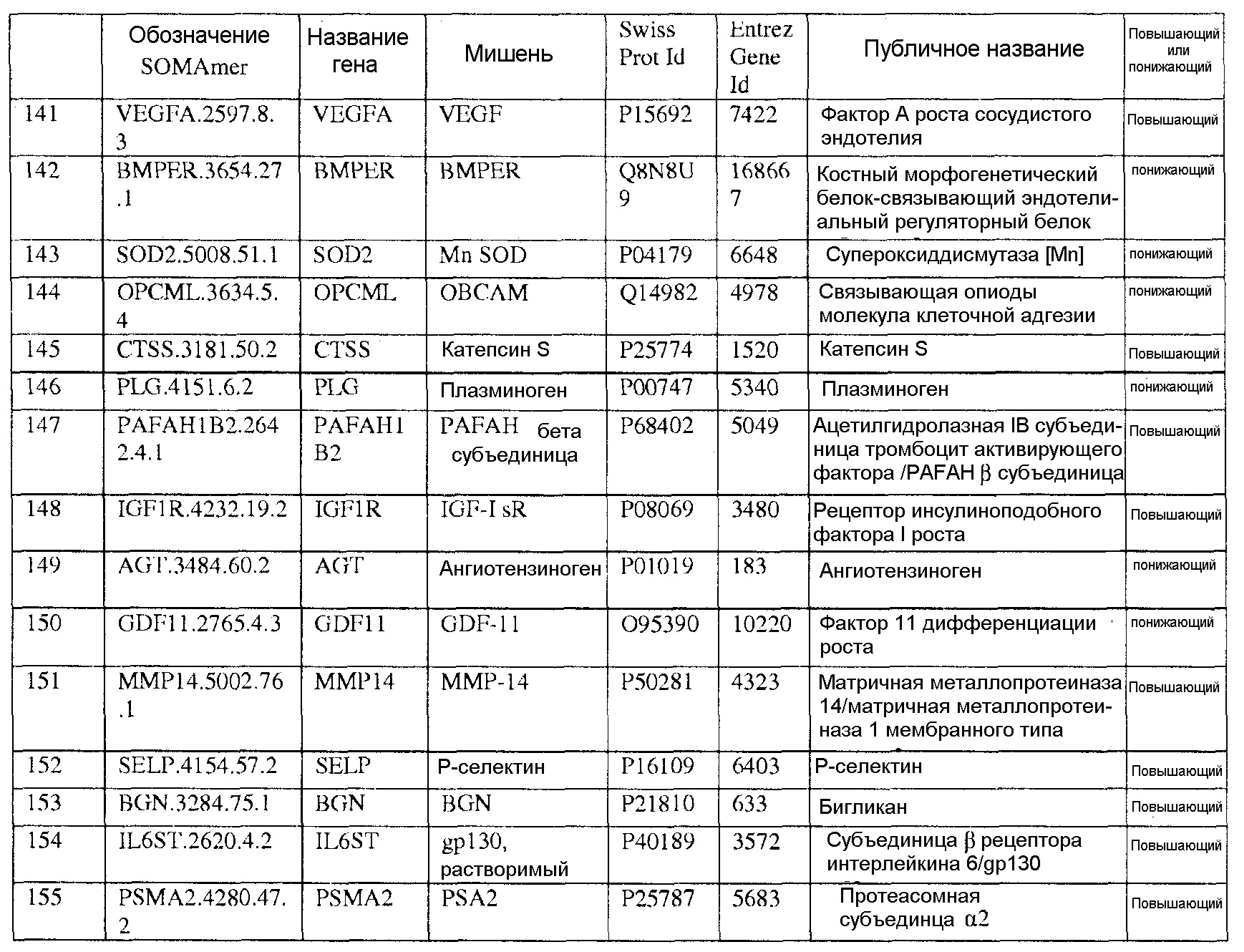
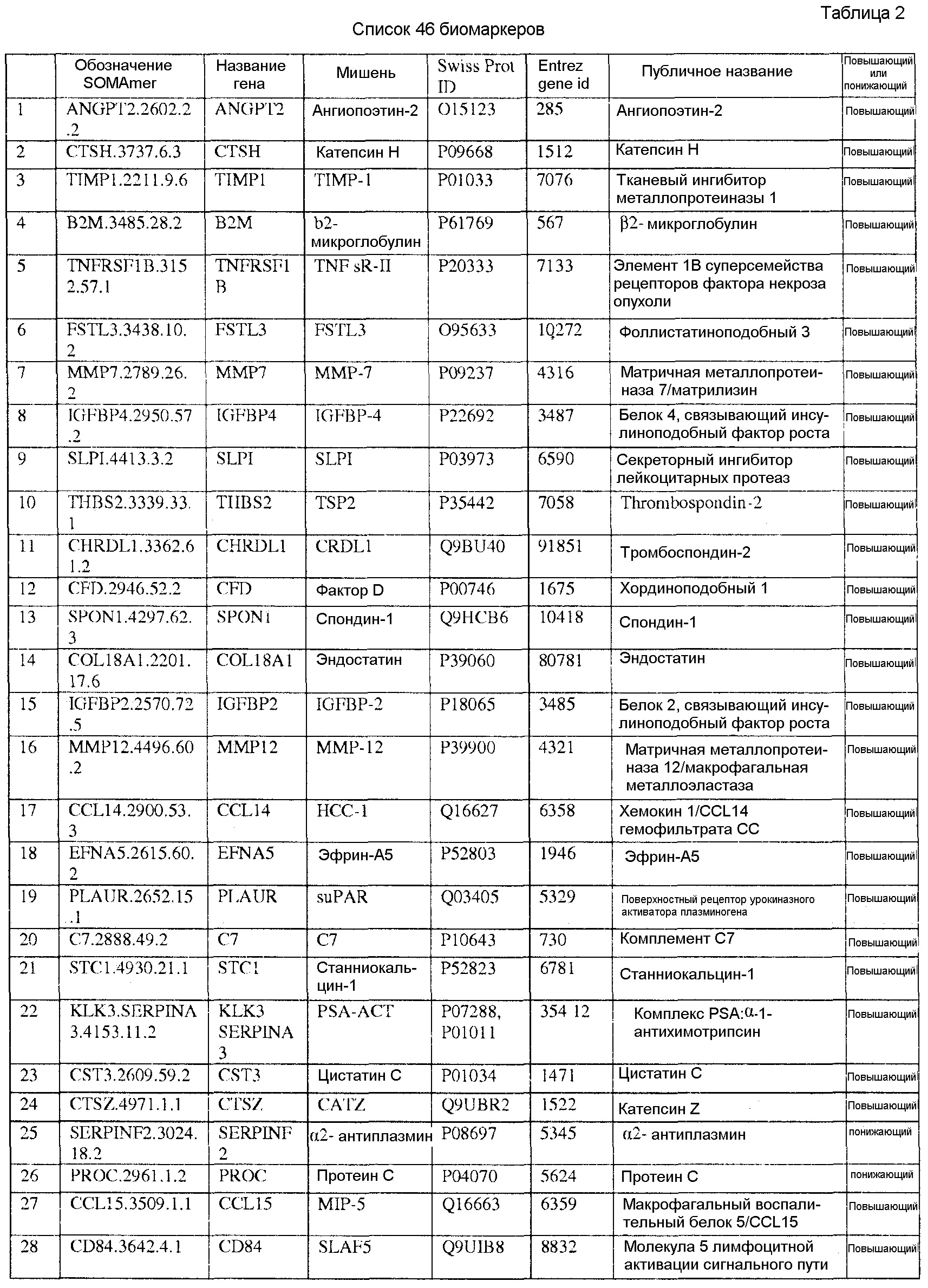
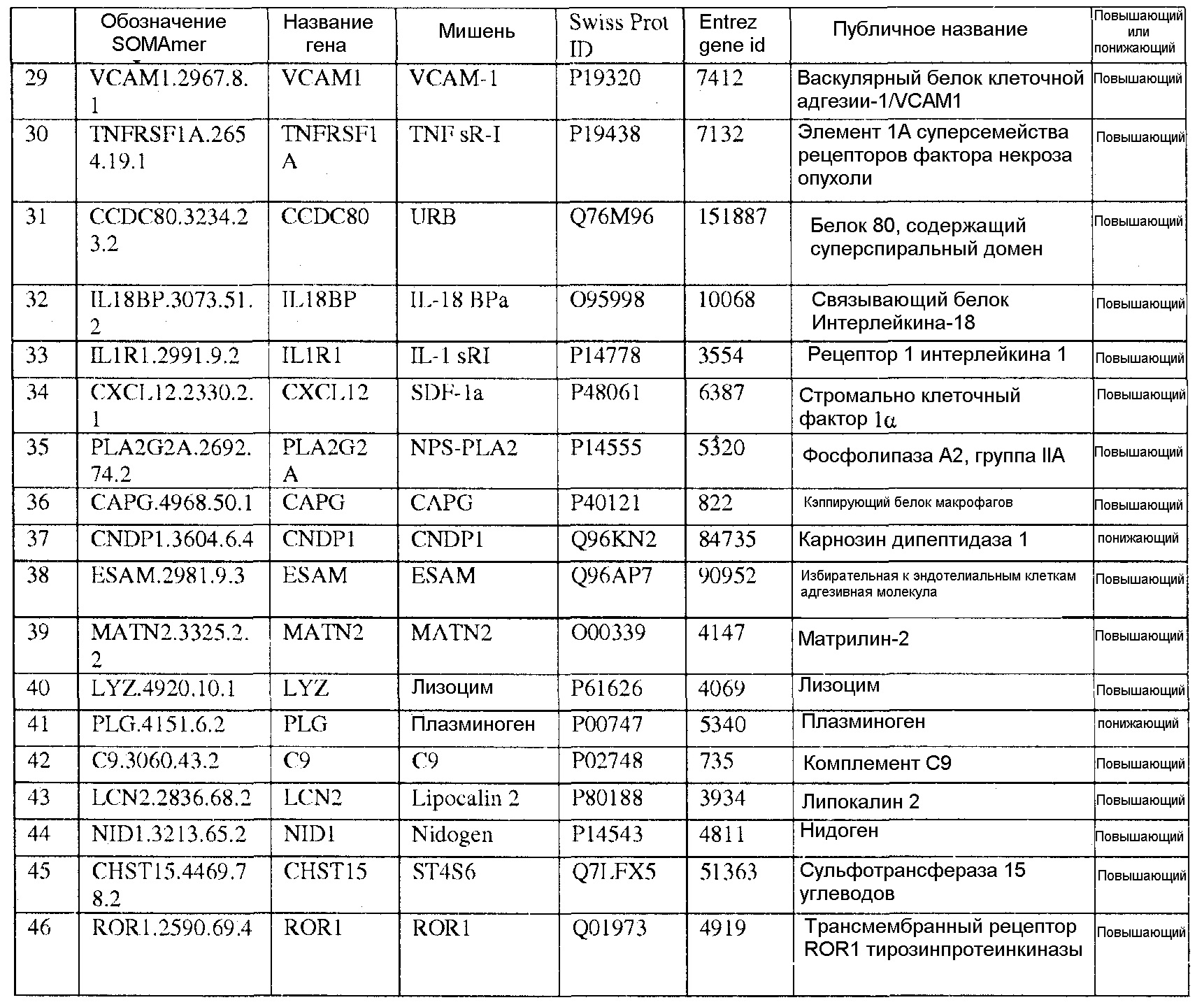
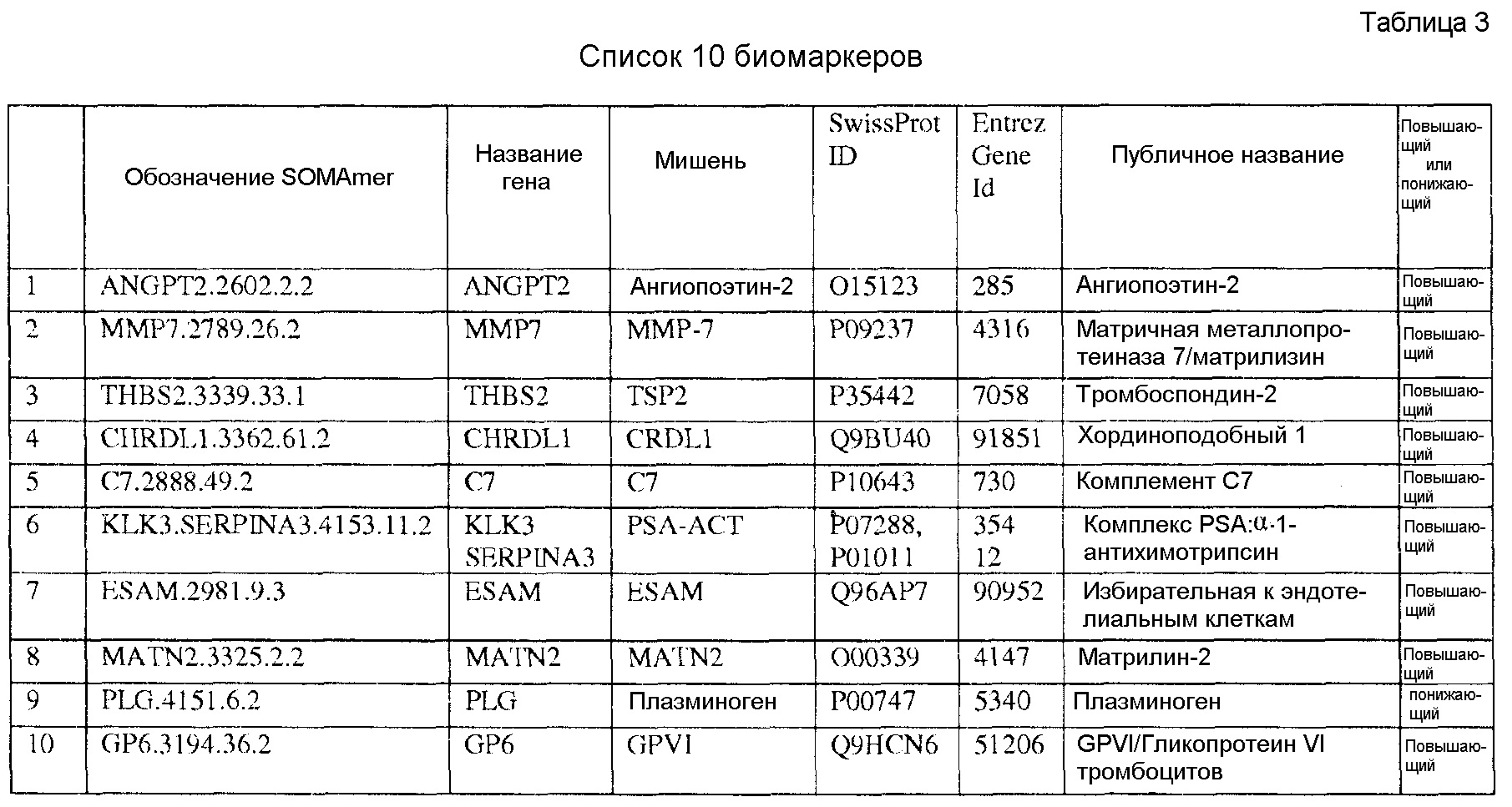
|