Результат интеллектуальной деятельности: Способ изоляции микровезикул из крови
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к биотехнологии и диагностической медицине может использоваться для изоляции, а также исследования микровезикул крови в различных целях, в том числе и диагностических.
Уровень техники
Экзосомы представляют собой микровезикулы размером 20-100 нм, активно секретируемые через каскад экзоцитоза. Экзосомы секретируются в определенных физиологических условиях из различных типов клеток организма и предназначены для межклеточных взаимодействий (см. Гусаченко О.Н., Зенкова М.А., Власов В.В. Нуклеиновые кислоты экзосом: маркеры заболеваний и молекулы межклеточной коммуникации // Биохимия. 2013. Т. 78. №1. С. 5-13). Экзосомы переносят биомаркеры состояния продуцирующих их клеток, служат для ранней диагностики, определения стадии и факта прогрессии различных заболеваний, в том числе онкологической патологии, что поможет оказать своевременное лечение и оценить его эффективность (См. Medvedeva, N.V. Nanobiotechnology and nanomedicine. / N.V. Medvedeva, О.M. Ipatova, D. IvanovIu // Biomed Khim. - 2006. - T 52. - №6. - C. 529-546). Для повышения доступности данного метода диагностики необходимо создание новых способов получения микровезикул, не требующих дорогостоящих реактивов и оборудования, а также сократить трудоемкость процесса.
Известен способ выделения микровезикул эритроцитов из надосадочной жидкости, который включает забор крови, промывание эритроцитов, инкубацию отмытых клеток в присутствии кальция и ионофора А 23187, центрифугирование при 1000 g в течение 10 мин для получения супернатанта, ультрацентрифугирование супернатанта при 100000 g в течение 60 мин, получение осадка, содержащего микровезикулы (см. Allan D, Thomas P, Limbrick AR:The isolation and characterization of 60 nm vesicles ('nanovesicles') produced during ionophore A23187-induced budding of human erythrocytes. Biochem J 1980, 188: 881-887).
Недостатками способа являются длительность и трудоемкость выделения экзосом, низкий выход микровезикул, выделенных из крови.
Известен способ получения экзосом из плазмы крови, заключающийся в следующем. Образцы плазмы фильтровали через фильтры с диаметром пор 0,220 мкм для удаления клеточного дебриса и более крупных частиц и разделяли компоненты плазмы при помощи белковой жидкостной хроматографии. Фракции объединяли и концентрировали путем центрифугирования с помощью 3 кДа-отсекающих фильтров (Millipore). Затем сконцентрированный препарат наносили на сахарозный градиент (0.2-2.5 М в 20 мМ трис, pH 8.0) и ультрацентрифугировали (175000 g, 16 ч). Частицы, находящиеся в диапазоне концентрации сахарозы 1.08-1.15 г/мл, объединяли, отмывали раствором PBS (10 мМ фосфатный буфер, 0,15 М NaCl, pH 7,5) и осаждали при помощи ультрацентрифугирования (175000 g, 2 ч) (см. Looze С, Yui D., Leung L., Ingham M, Kaler M., Yao X., Wu W.W., Shen R.-F., Daniels M.P., Levine S.J. Proteomic profiling of human plasma exosomes identifies PPAR as an exosome-associated protein // Biochem. Biophys. Res. Commun. 2009. V. 378. P. 433-438).
Недостатками способа являются недостаточная чистота целевого продукта (примесь микрочастиц диаметром 100-220 нм), трудоемкость и длительность выделения экзосом (более 23 ч), а также необходимость использования дорогостоящего оборудования, что затрудняет воспроизводство данной методики в широкой лабораторно-диагностической практике.
Известен способ получения экзосом из плазмы крови, заключающийся в следующем. Клетки и дебрис удаляли путем последовательного центрифугирования периферической крови, супернатант фильтровали через фильтры с диаметром пор 0,2 мкм. Экзосомы плазмы крови выделяли с помощью коммерческого набора ExoQuick™ Exosome Precipitation Solution (System Biosciences Inc., Mountain View, CA, USA) (см. Ge Q., Zhou Y., Lu J., Bai Y., Xie X., Lu Z. miRNA in plasma exosome is stable under different storage conditions // Molecules. 2014. V. 19. P. 1568-1575).
Недостатками способа являются недостаточная чистота целевого продукта (примесь микрочастиц диаметром 100-200 нм), длительность выделения экзосом (более 10 ч), высокая стоимость коммерческого набора для выделения экзосом, что затрудняет воспроизводство данной методики в широкой лабораторно-диагностической практике.
Известен способ получения экзосом из крови, заключающийся в следующем. Кровь разделяют на плазму и клеточную фракцию путем центрифугирования при 300 g в течение 10 мин. Далее клеточную фракцию крови подвергают последовательной двухстадийной обработке сначала буферным раствором PBS, содержащим 5 мМ ЭДТА, с последующим инкубированием в течение 5 мин. Клетки осаждают центрифугированием в течение 20 мин при 300 g и собирают супернатант №1. Затем клетки обрабатывают равным объемом 0,15% раствора трипсина в PBS, добавляют ингибитор трипсина, перемешивают, клетки осаждают центрифугированием в течение 20 мин при 300 g и собирают супернатант №2. Плазму, супернатант №1 и супернатант №2 объединяют и используют в качестве исходного материала для получения суммарного пула экзосом крови. Для этого из объединенного образца удаляют клеточный дебрис и частицы неэкзосомального происхождения центрифугированием при 20000 g в течение 10 мин с последующей фильтрацией через фильтры с диаметром пор 0,1 мкм, а экзосомы осаждают ультрацентрифугированием при 160000 g в течение 60 минут (см. пат. RU 2556825, МПК. C12N 5/00 (2006.01), опубл. 20.07.2015 г.).
Недостатком данного способа является длительность, сложность воспроизводства, необходимость использования дорогостоящего оборудования, что затрудняет воспроизводство данной методики в широкой лабораторно-диагностической практике.
Наиболее близким к заявленному способу прототипом является способ получения экзосом из крови, заключающийся в следующем. Разделяют кровь на бесклеточную и клеточную фракции с помощью центрифугирования, затем плазму фильтруют через фильтры с диаметром пор 100 нм и проводят два раунда ультрацентрифугирования при 100000 g в течение 1,5 ч (О.С. Тутанов, С.Н. Тамкович, А.Е. Григорьева, Е.И. Рябчикова, Т.Г. Дужак, П.П. Лактионов // Сибирский онкологический журнал, 2015. Приложение №1. С. 82-83).
Недостатком данного способа является длительность и необходимость использования дорогостоящего оборудования, что затрудняет воспроизводство данной методики в широкой лабораторно-диагностической практике.
Раскрытие изобретения
Задачей предлагаемого изобретения является разработка способа изоляции микровезикул из крови, обладающего сокращением длительности и снижением трудоемкости способа, а также увеличением выхода экзосом.
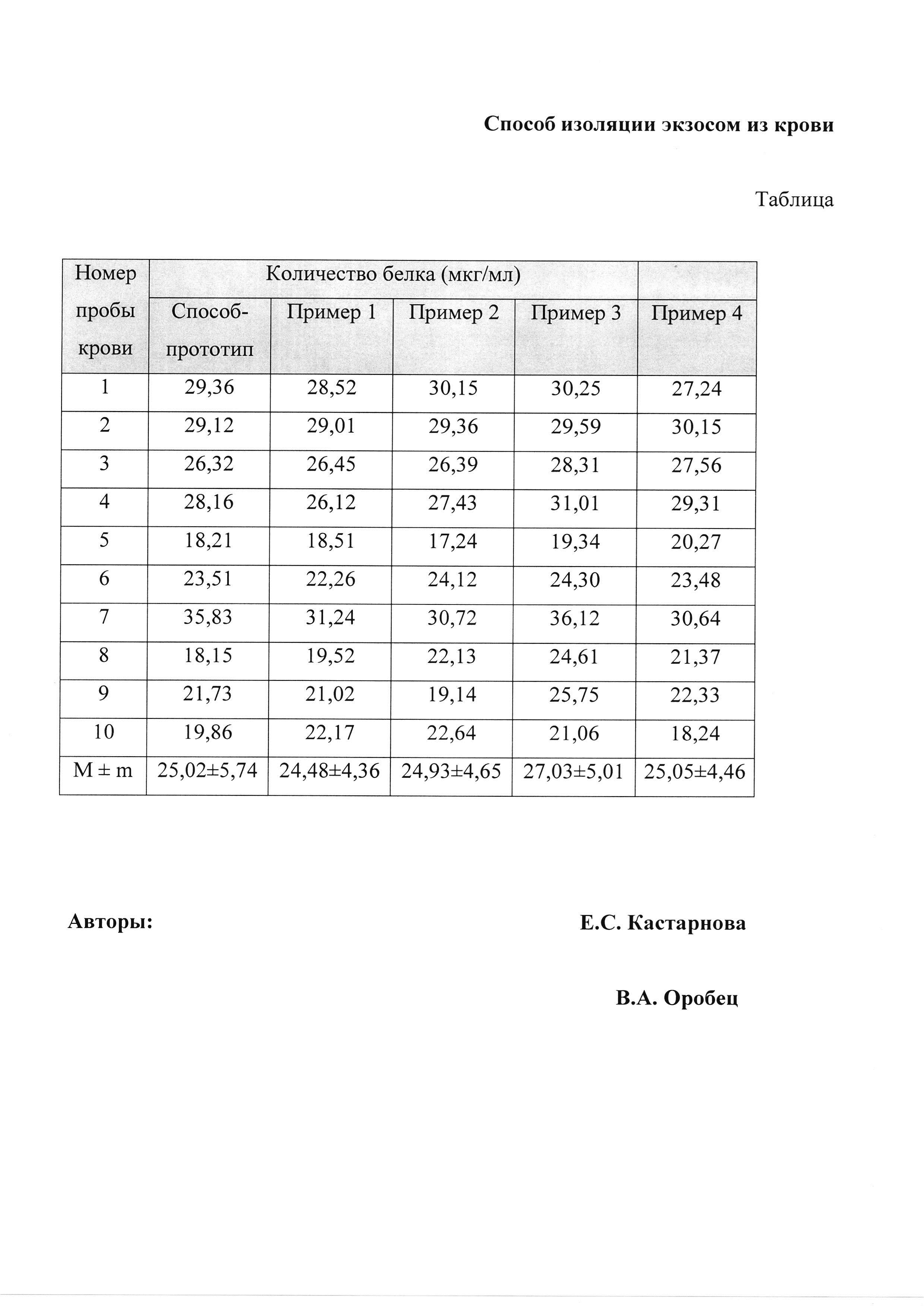
Технический результат, который может быть получен с помощью предлагаемого изобретения, сводится к увеличению выхода экзосом до 27,03±5,01 мкг/мл (пример 3) против 25,02±5,74 мкг/мл по прототипу.
Технический результат достигается с помощью способа изоляции микровезикул из крови, включающий разделение крови на бесклеточную и клеточную фракции с помощью центрифугирования с последующим получением экзосом путем ультрафильтрации, отличающийся тем, что разделения исходного образца крови на плазму и клеточную фракцию проводят путем центрифугирования при 300 g, затем клеточную фракцию крови подвергают последовательной обработке буферным раствором PBS, с последующим центрифугированием в течение 20 мин при 400 g, затем производят удаление клеточного дебриса посредством ультрафильтрации через ультрафильтрационную ячейку с мембраной МФ АС-ОС-1 под давлением 2 атм, причем полученный фильтрат подвергают повторной ультрафильтрации через мембрану УПМ-50 под давлением 2 атм.
Таким образом, способ изоляции экзосом из крови, включающего разделение крови на плазму и клеточную фракцию с помощью центрифугирования при 300 g в течение 15 мин, последовательную обработку клеточной фракции крови буферным раствором PBS, сбор супернатанта №1, затем встряхивание пробирки посредством встряхивателя V3 типа «Vortex» (скорость вращения 2000 об/мин) с последующим центрифугированием 25 мин при 400 g, сбор супернатанта №2, с последующим получением пула экзосом 27,03±5,01 мкг/мл путем последовательной ультрафильтрации через мембрану МФ АС-ОС-1 (диаметр пор 0,220 мкм) и УПМ-50 (диаметр пор 0,05 мкм) под давлением 2 атм.
В результате получают суммарный пул экзосом крови, который включает экзосомы плазмы и экзосомы, связанные с поверхностью клеток крови, что позволяет повысить выход целевого продукта и в последующем повысить чувствительность диагностических систем путем увеличения количества диагностического материала в анализе.
Определяющим отличием предлагаемого способа, по сравнению с прототипом, является то, что разделение исходного образца крови на плазму и клеточную фракцию проводят путем центрифугирования при 300 g. Клеточную фракцию крови подвергают последовательной обработке буферным раствором PBS, с последующим центрифугированием 25 мин при 400 g, удаление клеточного дебриса посредством ультрафильтрации через ультрафильтрационную ячейку (8200, 200 мл, Millipore) с мембраной МФ АС-ОС-1 (диаметр пор 0,220 мкм) под давлением 2 атм. В качестве источника давления используют закись азота. Полученный фильтрат подвергают повторной ультрафильтрации через мембрану УПМ-50 (диаметр пор 0,05 мкм) под давлением 2 атм.
Сущность способа изоляции микровезикул из крови заключается в следующем. Производят сбор крови в вакутейнер с антикоагулянтом. Кровь разделяют на плазму и клеточную фракцию путем центрифугирования при 300 g в течение 15 мин, затем клеточную фракцию крови подвергают последовательной обработке буферным раствором PBS (5-мин инкубация с последующим центрифугированием 25 мин при 400 g), сбор супернатанта №1; затем встряхивание пробирки с последующим центрифугированием 25 минут при 400 g, сбор супернатанта №2, затем плазму и полученные супернатанты из клеточной фракции, содержащие экзосомы, связанные с поверхностью форменных элементов, объединяют и используют в качестве исходного материала для получения суммарного пула экзосом крови, затем из полученного образца удаляют клеточный дебрис посредством ультрафильтрации через ультрафильтрационную ячейку (8200, 200 мл, Millipore) с мембраной МФ АС-ОС-1 (диаметр пор 0,220 мкм) под давлением 2 атм. В качестве источника давления используют закись азота, затем полученный фильтрат подвергают повторной ультрафильтрации через мембрану УПМ-50 (диаметр пор 0,05 мкм) под давлением 2 атм.
Способ изоляции микровезикул из крови поясняется таблицей, в которой приведены результаты определения концентрации белка в полученных фильтратах (см. в конце описания).
Осуществление изобретения
Примеры конкретного выполнения способа изоляции микровезикул из крови.
Пример 1.
Проводят сбор крови в вакутейнер с антикоагулянтом. Кровь разделяют на плазму и клеточную фракцию путем центрифугирования при 500 g в течение 10 мин. Клеточную фракцию крови подвергают последовательной обработке буферным раствором PBS (5-мин инкубация с последующим центрифугированием 15 мин при 600 g), сбор супернатанта №1; затем резкое встряхивание пробирки с последующим центрифугированием 20 мин при 400 g, сбор супернатанта №2. Плазму и полученные супернатанты из клеточной фракции, содержащие экзосомы, связанные с поверхностью форменных элементов, объединяют и используют в качестве исходного материала для получения суммарного пула экзосом крови.
Затем из полученного образца удаляют клеточный дебрис посредством ультрафильтрации через ультрафильтрационную ячейку (8200, 200 мл, Millipore) с мембраной МФ АС-ОС-1 (диаметр пор 0,220 мкм) под давлением 2 атм. В качестве источника давления используют закись азота.
Полученный фильтрат подвергают повторной ультрафильтрации через мембрану УПМ-50 (диаметр пор 0,05 мкм) под давлением 1 атм.
Для оценки количества выделенных экзосом с использованием способа-прототипа и предлагаемого способа была измерена концентрация белка в 1 мл анализируемого вещества с использованием коммерческого набора NanoOrange Quantification Kit (Invitrogen, США) по протоколу, рекомендованному производителем.
В примере 1 получают невысокий суммарный пул экзосом крови, который включает экзосомы плазмы и экзосомы, связанные с поверхностью клеток крови, что не позволяет сохранить выход целевого продукта.
Пример 2.
Проводят сбор крови в вакутейнер с антикоагулянтом. Кровь разделяют на плазму и клеточную фракцию путем центрифугирования при 400 g в течение 10 мин. Клеточную фракцию крови подвергают последовательной обработке буферным раствором PBS (10-мин инкубация с последующим центрифугированием 20 мин при 500 g), сбор супернатанта №1; затем резкое встряхивание пробирки с последующим центрифугированием 20 мин при 400 g, сбор супернатанта №2. Плазму и полученные супернатанты из клеточной фракции, содержащие экзосомы, связанные с поверхностью форменных элементов, объединяют и используют в качестве исходного материала для получения суммарного пула экзосом крови.
Затем из полученного образца удаляют клеточный дебрис посредством ультрафильтрации через ультрафильтрационную ячейку (8200, 200 мл, Millipore) с мембраной МФ АС-ОС-1 (диаметр пор 0,220 мкм) под давлением 1 атм. В качестве источника давления используют закись азота.
Полученный фильтрат подвергают повторной ультрафильтрации через мембрану УПМ-50 (диаметр пор 0,05 мкм) под давлением 2 атм.
Для оценки количества выделенных экзосом с использованием способа-прототипа и предлагаемого способа была измерена концентрация белка в 1 мл анализируемого вещества с использованием коммерческого набора NanoOrange Quantification Kit (Invitrogen, США) по протоколу, рекомендованному производителем. Результаты исследования представлены в таблице (см. пример 2).
В результате получают высокий суммарный пул экзосом крови, который включает экзосомы плазмы и экзосомы, связанные с поверхностью клеток крови, что позволяет сохранить выход целевого продукта, а также сократить трудовые и финансовые затраты.
Пример 3.
Проводят сбор крови в вакутейнер с антикоагулянтом. Кровь разделяют на плазму и клеточную фракцию путем центрифугирования при 300 g в течение 15 мин. Клеточную фракцию крови подвергают последовательной обработке буферным раствором PBS (5-мин инкубация с последующим центрифугированием 25 мин при 400 g), сбор супернатанта №1; затем резкое встряхивание пробирки с последующим центрифугированием 20 мин при 400 g, сбор супернатанта №2. Плазму и полученные супернатанты из клеточной фракции, содержащие экзосомы, связанные с поверхностью форменных элементов, объединяют и используют в качестве исходного материала для получения суммарного пула экзосом крови.
Затем из полученного образца удаляют клеточный дебрис посредством ультрафильтрации через ультрафильтрационную ячейку (8200, 200 мл, Millipore) с мембраной МФ АС-ОС-1 (диаметр пор 0,220 мкм) под давлением 2 атм. В качестве источника давления используют закись азота.
Полученный фильтрат подвергают повторной ультрафильтрации через мембрану УПМ-50 (диаметр пор 0,05 мкм) под давлением 2 атм.
Для оценки количества выделенных экзосом с использованием способа-прототипа и предлагаемого способа была измерена концентрация белка в 1 мл анализируемого вещества с использованием коммерческого набора NanoOrange Quantification Kit (Invitrogen, США) по протоколу, рекомендованному производителем. Результаты исследования представлены в таблице (см. пример 3).
В результате получают высокий суммарный пул экзосом крови, который включает экзосомы плазмы и экзосомы, связанные с поверхностью клеток крови, что позволяет повысить выход целевого продукта, а также сократить трудовые и финансовые затраты.
Пример 4
Проводят сбор крови в вакутейнер с антикоагулянтом. Кровь разделяют на плазму и клеточную фракцию путем центрифугирования при 400 g в течение 10 мин. Клеточную фракцию крови подвергают последовательной обработке буферным раствором PBS (5-мин инкубация с последующим центрифугированием 15 мин при 600 g), сбор супернатанта №1; затем резкое встряхивание пробирки с последующим центрифугированием 20 минут при 400 g, сбор супернатанта №2. Плазму и полученные супернатанты из клеточной фракции, содержащие экзосомы, связанные с поверхностью форменных элементов, объединяют и используют в качестве исходного материала для получения суммарного пула экзосом крови.
Затем из полученного образца удаляют клеточный дебрис посредством ультрафильтрации через ультрафильтрационную ячейку (8200, 200 мл, Millipore) с мембраной МФ АС-ОС-1 (диаметр пор 0,220 мкм) под давлением 2 атм. В качестве источника давления используют закись азота.
Полученный фильтрат подвергают повторной ультрафильтрации через мембрану УПМ-50 (диаметр пор 0,05 мкм) под давлением 1 атм.
Для оценки количества выделенных экзосом с использованием способа-прототипа и предлагаемого способа была измерена концентрация белка в 1 мл анализируемого вещества с использованием коммерческого набора NanoOrange Quantification Kit (Invitrogen, США) по протоколу, рекомендованному производителем.
В результате, получают суммарный пул экзосом крови, который включает экзосомы плазмы и экзосомы, связанные с поверхностью клеток крови, что позволяет сохранить выход целевого продукта, а также сократить трудовые и финансовые затраты.
Таким образом, наиболее оптимальным является пример 3, причем реализация предлагаемого способа позволяет сохранить эффективность изоляции экзосом из крови (см. таблица), при этом сокращаются трудоемкость, стоимость используемых реактивов и оборудования, а также длительность проведения методики (время на проведение изоляции экзосом) с 4-х до 2,5 часов.
Предлагаемый способ имеет следующие преимущества по сравнению с прототипом:
- позволяет снизить финансовые затраты на получение экзосом из крови;
- позволяет обеспечить доступность диагностических исследований на основе анализа экзосом для небольших лабораторий;
- позволяет уменьшить длительность способа с 4-х часов до 2,5 часов.
Способ изоляции микровезикул из крови, включающий разделение крови на бесклеточную и клеточную фракции с помощью центрифугирования с последующим получением экзосом путем ультрафильтрации, отличающийся тем, что разделения исходного образца крови на плазму и клеточную фракцию проводят путем центрифугирования при 300 g, затем клеточную фракцию крови подвергают последовательной обработке буферным раствором PBS с последующим центрифугированием в течение 20 мин при 400 g, затем проводят удаление клеточного дебриса посредством ультрафильтрации через ультрафильтрационную ячейку с мембраной МФАС-ОС-1 под давлением 2 атм, причем полученный фильтрат подвергают повторной ультрафильтрации через мембрану УПМ-50 под давлением 2 атм.