Результат интеллектуальной деятельности: Штамм бактерий Serratia species, обладающий противовирусной активностью
Вид РИД
Изобретение
Изобретение относится к штамму бактерий Serratia species К-57, являющемуся продуцентом внеклеточных рибонуклеазы и дезоксирибонуклеазы, обладающих противовирусной активностью, и может быть использовано в микробиологии и биотехнологии для производства противовирусных препаратов.
В настоящее время при разработке средств профилактики и терапии вирусных инфекций все большее внимание уделяется изучению нуклеаз - ферментов, деполимеризующих нуклеиновые кислоты.
К списку нуклеаз, проявляющих противовирусные свойства на моделях in vitro, относят панкреатические РНКазы, ДНКазы. Установлено, что рибонуклеазы обладают выраженной противовирусной активностью в отношении таких РНК-содержащих вирусов, как вирусы гриппа, полиомиелита, клещевого энцефалита. (Чижов Н.П. Противовирусное действие нуклеаз и гистонов. // Вопросы вирусологии. - 1974. - №6. - С. 647-652.) [1].
Известно, что наиболее активными в отношении синтеза внеклеточной щелочной рибонуклеазы являются разные штаммы рода Bacillus (Юсупова О.И. // Ферменты микроорганизмов. М.: Наука. - 1973. - 163 с.; Биосинтез микроорганизмами нуклеаз и протеаз. М.: Наука, 1979, с. 7) [2, 3].
Одним из наиболее изученных энзимов этого класса является секретируемая эндонуклеаза из штамма Serratia marcescens (Sma nuc). Штаммы рода Serratia широко известны как продуценты различного рода препаратов. В качестве продуцента нуклеазы, обладающей РНКазной и ДНКазной активностями, наиболее изучен штамм Serratia marcescens В-10 М-1 (Биосинтез микроорганизмами нуклеаз и протеаз. М.: Наука, 1979, с. 7. Нуклеазы микроорганизмов и их практическое использование. Рига, 1989, с. 3. Биосинтез микроорганизмами нуклеаз и протеаз. М.: Наука, 1979, с. 7; патент РФ №2038776, опубл. 1995 г.) [4-6].
Известен штамм BACTERIUM PRODIGIOSUM (SERRATIA MARCESCENS) В-10, М-2 - продуцент неспецифической эндонуклеазы - препарат для борьбы с вирусными инфекциями животных и насекомых (авторское свидетельство СССР №928794, МПК C12N 1/20, опубл. 15.11.1993) [7].
Однако в описании к авторскому свидетельству не приведены данные о противовирусной активности продуцируемой штаммом SERRATIA MARCESCENS неспецифической эндонуклеазы.
Известны штаммы бактерий Serratia plymuthica, обладающие противовирусной активностью в отношении вирусов гриппа типа А и депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор»» под регистрационным номером В-1285, В-1288, В-1296, В-1297 (патент РФ №2551316, МПК C12N 1/20, опубл. 30.12.2013 г.) [8].
Однако указанные штаммы обладает противовирусной активностью только в отношении вирусов гриппа типа А.
Наиболее близким аналогом (прототипом) является штамм бактерий Serratia species, являющийся продуцентом внеклеточных рибонуклеазы и дезоксирибонуклеазы, обладающих противовирусной активностью в отношении вирусов птичьего гриппа A/chickenKurgan/05/2005 (H5N1) и вируса гриппа человека A/Aichi/2/68 (H3N2), и депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером В-1287 (Патент РФ №2528064, МПК C12N 1/20, опубл. 10.09.2014 г.) [9].
Однако указанный штамм обладают противовирусной активностью только в отношении вирусов гриппа типа А.
Техническим результатом заявляемого изобретения является получение нового бактериального штамма, обладающего ингибирующей активностью в отношении вируса гриппа человека A/Aichi/2/68(H3N2), вируса осповакцины (ВОВ), вируса простого герпеса - 2-го типа (ВПГ-2) и вируса оспы мышей (ВОМ).
Указанный технический результат достигается тем, что получен штамм бактерий Serratia species, обладающий РНКазной и ДНКазной активностью, депонированный в Коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора» под регистрационным номером В-1289, обладающий противовирусной активностью в отношении вируса гриппа человека A/Aichi/2/68 (H3N2), вируса осповакцины (ВОВ), вируса оспы мышей (ВОМ), вируса простого герпеса 2-го типа (ВПГ-2). Справка о депонировании штамма прилагается.
Заявляемый штамм (авторское название К-57) выделен из образца грунта кальдеры Узон (Камчатка) с последующим клонированием.
Определение таксономической принадлежности.
Для определения таксономической принадлежности штамма бактерий Serratia species К-57 № В-1289 стандартными методами исследовали фенотипические признаки и определяли нуклеотидные последовательности продуктов ПЦР, соответствующие гену 16S рРНК. Определение до вида проводили по определителю Бердже ("Bergey’s Manual of Systematic Bacteriology". 8th ed. / Ed. John G. Holt. - Baltimore-London, Williams and Wilkins, 1986. - V. 1-2. - 1105 p.) [10].
Для получения геномных характеристик выделяли суммарную ДНК из чистой культуры и проводили ПЦР с универсальными праймерами, соответствующими гену 16S рРНК эубактерий: 5'-AGAGTTTGATCCTGGCTCAG-3' и 5'-CGGCTACCTTGTTACGACTT-3'. Нуклеотидные последовательности продуктов ПЦР определяли с использованием BigDye 3,1 Terminator Cycle Sequencing Kit и автоматического анализатора ДНК модели ABI 3130x1 (Applied Biosystems, США), в Межинститутском Центре секвенирования ДНК СО РАН (г. Новосибирск). Филогенетический анализ выполняли с использованием программы MEGA версии 4 для нуклеотидных последовательностей гена 16S рРНК, определенных в данной работе, и близкородственных видов из базы данных GenBank (http://www.ncbi.nlm.nih.gov).
Штамм бактерий Serratia sp. К-57 №В-1289 имеет следующие морфологические и физиологические признаки.
Морфологические признаки. Величина клеток односуточной культуры на мясо-пептонном агаре 0,6-0,8×1,0-2,0 мкм. Клетки палочковидные, в основном одиночные, реже соединяются в короткие цепочки, подвижные, перитрихи, грамотрицательные. На мясо-пептонном агаре штамм образует гладкие, округлые, блестящие, белесые, влажные, непрозрачные, колонии с ровным краем, пигмент отсутствует. Старые культуры формируют матовые, слегка шероховатые, плоские колонии, легко снимающиеся с агара петлей.
Физиологические признаки. Аэроб, максимум роста при 30-37°C, штамм отрицателен по уреазе, коагулазе, в тестах на индол, сероводород, амилазу; образует РНКазу и ДНКазу, гидролизует желатин, утилизирует цитрат с образованием кислоты, гидролизует сахарозу, манит, мальтозу, глюкозу, но не лактозу; восстанавливает нитраты, отрицателен в реакции MR и в реакции FP.
Штамм устойчив к ампициллину, клиндамицину, рифампицину, эритромицину, оксациллину.
Хранение штамма. Субкультуры штамма хранят периодическими пересевами на агаризованную среду РПА или LA, в 15%-ном растворе глицерина при низкотемпературном замораживании (минус 65°C) и в лиофильно-высушенном состоянии.
Посевной материал получали при выращивании штаммов на жидких или агаризованных средах: LB (0,25% LB "Difco", 1,7% агара) и среде А (0,7% пептона "Difco", 0,4% рыбного гидролизата, 0,5% NaCl, 1,7% агара). Значение рН 7,0-7,2.
Для получения образцов культуральной жидкости (КЖ) штаммы культивировали в среде «S» (Пептон, NaCl, MgCl2×6 Н2О, Трис-гидроксиметиламинометан, рН 8.0) или "LB" (дрожжевой экстракт, пептон, NaCl, рН 7,2) "Difco" в течение 18 час при 30-37°C с последующим центрифугированием 20 мин при 8000 об/мин. Полученные образцы КЖ и биомассы хранили в замороженном состоянии при - 20°C.
Для получения клеточных экстрактов (КЭ) бактериальные клетки лизировали лизоцимом (05,мг/мл) с добавлением тритона Х-100 (0,1%) в TN-буфере (0,01М Трис рН 7,5; 0,5М NaCl, H2O деионизованная) или разрушали ультразвуком (1 г биомассы в 4-х мл H2O) на дезинтеграторе "MSE" (Великобритания).
Для выделения бактерий-продуцентов нуклеолитических ферментов была применена методика отбора колоний на селективных средах. Использовали среду, содержащую ДНК (Методы общей бактериологии / под ред. Ф. Герхарда и др. - М.: Мир, 1983. - Т. 1. - 536 с.; 1984. Т. 3. 264 с.) [11]. Из большого разнообразия штаммов было выделено несколько штаммов для последующего анализа на содержание ферментов нуклеолитического типа, в их числе - штамм Serratia sp. К-57 № В-1289.
Количественное определение РНКазной и ДНКазной активности проводили по превращению субстратных нуклеиновых кислот: суммарной дрожжевой РНК (НИКТИ БАВ ГНЦ ВБ «Вектор») и ДНК из молок лосося (Медиген, Новосибирск) во фрагменты, которые растворимы в 4%-ной HClO4, с появлением кислоторастворимого материала с адсорбцией при 260 нм. (Лещинская И.Б., Балабан Н.П., Капранова М.Н., Голубенко И.А. // Современные методы изучения нуклеиновых кислот и нуклеаз микроорганизмов. - Казань. - 1980. - С. 53-60) [12].
При лабораторной проверке активности выделенных штаммов оказалось, что штамм Serratia sp. К-57 № В-1289 обладает РНКазной и ДНКазной активностями.
Ниже приведены данные по исследованию КЖ штамма Serratia sp. К-57 № В-1289 на ДНКазную активность (фиг. 1, 2). ДНКазную активность определяли по методу гидролиза фаговых ДНК (Т7 или λ) в агарозном геле (Материалы X научно-практической конференции, 17-25 февраля 2014 г., т. 38. Биология София. «Бял ГРАД-БГ» ООД - С. 46-49) [13].
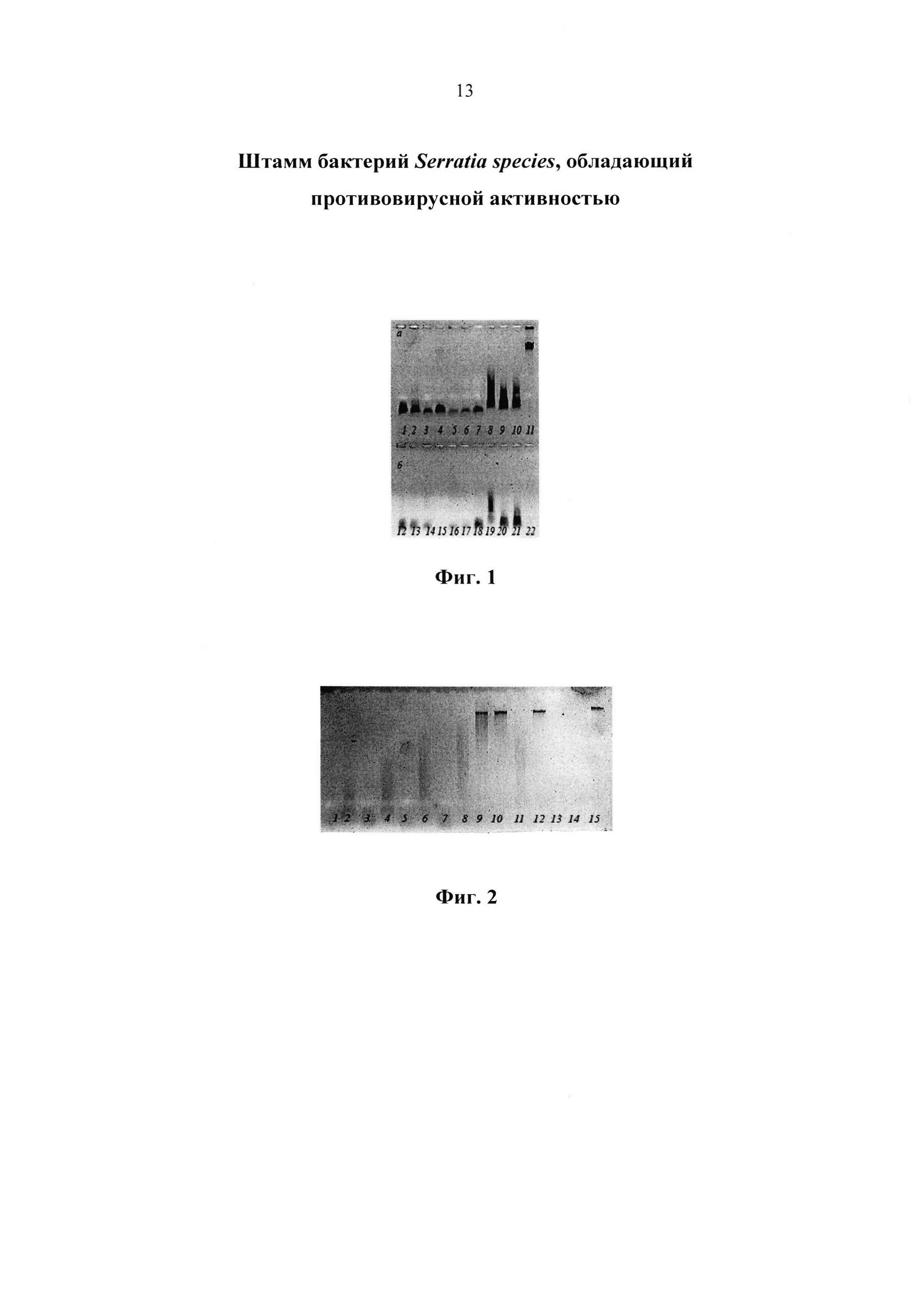
Изобретение иллюстрируется следующими графическими материалами. На фиг. 1 представлен сравнительный анализ КЖ и КЭ отдельных штаммов Serratia sp. К-57 № В-1289 и Dg 98, на наличие нуклеаз. а) КЖ, б) КЭ, (дорожки 1-7, 12-18) - клоны штамма К-57 № В-1289, (дорожки 8-10, 19-21) клоны Dg 98. Дорожка 11 - к ДНК фага T7/w, дорожка 22 - к КЖ S.m.
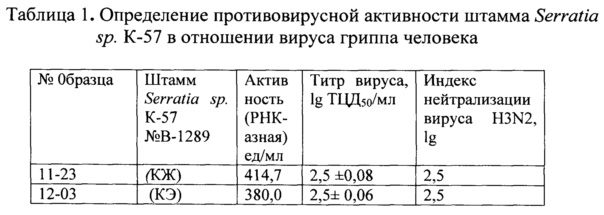
На фиг. 2 приведен анализ образцов КЖ на ДНК фага λ/w: дорожки 1-4 - штамм Serratia sp. К-57 № В-1289; дорожки 5-8 - штамм Dg-98; дорожки 9-12 - штамм Gi-20; дорожки 13, 14 - контроль (КЖ Serratia marcescens); дорожка 15 - к ДНК фага λ/w. Разведение - 1:10 (дорожки 1, 3, 5, 7, 9, 11, 13) и 1:100 (дорожки 2, 4, 6, 8, 10, 12, 14).
Штамм бактерии Serratia sp. К-57 № В-1289 обладает ДНКазной активностью и гидролизует не только ДНК фага Т7 (фиг. 1) и ДНК фага λ (фиг. 2), но и ДНК из молок лосося. На фигурах 1, 2 видно, что КЖ штамма К-57 гидролизует субстратные ДНК при 10 и 100 кратном разведении.
Подготовка к тестированию штаммов вируса гриппа и культуры клеток. Для оценки противовирусной эффективности полученных препаратов использовали вирус гриппа человека A/Aichi/2/68, (H3N2) из коллекции ФБУН ГНЦ ВБ «Вектор, наработанный на 10-суточных развивающихся куриных эмбрионах (РКЭ) с титром 102,5 lg ТЦД50/мл вирусаллантоисной жидкости (ВАЖ)). Для тестирования токсичности и противовирусной активности препаратов использовали перевиваемую культуру клеток MDCK. Для определения противовирусной активности препаратов использовали максимально переносимые концентрации (МПК).
Определение противовирусной активности препаратов. Для определения противовирусной активности препаратов в отношении вируса гриппа человека готовили десятикратные разведения ВАЖ от 1 до 8 с использованием среды Axcevir-MDCK, содержащей 2 мкг/мл трипсина. В монослой культуры клеток MDCK вносили по 50 мкл выбранного разведения препарата и 100 мкл от 1 до 8 разведения ВАЖ. Клетки инкубировали 2 суток при температуре 37°C в атмосфере 5% CO2 в термостате ТС-1/80 СПУ (Россия). Через 2 суток в каждой лунке с помощью инвертированного микроскопа регистрировали ЦПД в монослое клеток и определяли наличие вируса в среде культивирования по реакции гемагглютинации (РГА) с 1% эритроцитами петуха.
Для тестирования токсичности и противовирусной активности бактериальных метаболитов относительно ортопоксвирусов и вируса простого герпеса 2-го типа (ВПГ-2) использовали перевиваемую культуру клеток Vero, полученную из «Коллекции культур клеток ФБУН ГНЦ ВБ «Вектор». Суспензию клеток с концентрацией 1×105 кл./мл питательной среды DMEM, содержащей 10% сыворотки крови плодов коровы фирмы «Gibco», вносили в объеме 100 мкл/лунку 96-луночного планшета. Планшеты с клетками помещали в термостат на 4 суток до образования монослоя при температуре 37°C, 5% CO2 и 100% влажности.
Изобретение подтверждено следующими примерами практического применения.
Пример 1. Получение препарата (образца) на основе культуральной жидкости (КЖ) штамма Serratia sp. К-57 № В-1289 (препарат 11-23).
Суспензию клеток готовили с использованием культуры штамма Serratia sp. К-57 №В-1289 наработанного на агаризованной среде в течение 18 часов при температуре 28-30°C. Суспензию вносили в количестве 1% в колбы с 50 мл среды LB и культивировали в течение 24 часов на термостатированной качалке (КТ 104, Россия). Для приготовления препарата на основе культуральной жидкости КЖ штамма центрифугировали при 10000 об/мин в течение 30 мин на центрифуге JA-21. Надосадочную жидкость стерилизовали ультрафильтрацией через Whatman фильтр с размерами пор 0,2 мкм и использовали для испытания в качестве противовирусного препарата. Хранили препарат до использования при температуре минус 20°C.
Пример 2. Испытание противовирусного действия препарата 11-23, приготовленного на основе КЖ штамма Serratia sp. К-57 №В-1289 по примеру 1 (в профилактической схеме). Для испытания препарат развели в 10 раз и внесли на клетки MDCK в объеме 50 мкл на лунку 96-луночного планшета. Инкубация 2 часа. Удалили препарат, затем в лунки внесли среду RPMI-1640 без сыворотки и без трипсина. Добавили вирус A/H3N2 по 50 мкл на лунку. Планшеты с обработанными клетками и вирусом помещали в термостат при температуре 37°C, 5% CO2 и 100% влажности на 2-3 суток до образования монослоя. Препарат нейтрализовал 2,5 lg вируса гриппа человека, т.е. индекс нейтрализации составил 2,5 lg (таблица 1).
Пример 3. Получение препарата (образца), на основе экстракта клеток (КЭ) штамма Serratia sp. К-57 № В-1289 (препарат 12-03).
Осадок клеток штамма, полученный после центрифугирования и освобождения от надосадочной жидкости в примере 1 ресуспендировали в 4 мл дистиллированной Н2О и обрабатывали 4 раза по 30 сек с интервалом 30 сек, на ультразвуковом (УЗ)-дезинтеграторе. После УЗ-обработки разрушенные клетки осаждали центрифугированием при 10000 об/мин на микроцентрифуге "Eppendorf, КЭ отбирали и стерилизовали ультрафильтрацией через Whatman фильтр с размерами пор 0,2 мкм. Полученный препарат хранили до использования при температуре минус 20°C.
Пример 4. Проверка образца 12-03 (КЭ) штамма в профилактической схеме на противовирусную активность как в примере 2. Концентрация вируса составила 102,5 lg ТЦД50/мл. Препарат нейтрализовал вирус гриппа A/H3N2 с титром 102,5 lg ТЦД50/мл (табл. 1). Индекс нейтрализации составил 2,5 lg.
Пример 5. Получение препарата (образца) 11-31 на основе КЖ Serratia sp. К-57 № В-1289
Клетки штамма Serratia sp. К-57 выращивали, как описано в примере 1. За исключением того, что использовали среду "S". Полученный препарат хранили до использования при температуре минус 20°C.
Пример 6. Образец 11-31 разводили в 10 раз и использовали для испытания на противовирусное действие по отношению к вирусу ВОМ. Индекс нейтрализации составил 2,41 lg - контроль вируса - 104,6 lg ТЦД50/мл (таблица 2).
Пример 7. Образец 11-31 разводили в 10 раз и использовали для испытания на противовирусное действие на вирусе ВОВ. Индекс нейтрализации составил 2,00 lg - (контроль вируса, титр 104,47 lg ТЦД50/мл (таблица 2).
Пример 8. Образец 11-31 разводили в 10 раз и использовали для испытания на противовирусное действие на вирусе ВПГ-2. Индекс нейтрализации составил 2,00 lg - (контроль вируса, титр 104,47 lg ТЦД50/мл (таблица 2).
Изучение противовирусной активности (табл. 1) показало, что образцы КЖ и КЭ, полученные после культивирования штамма Serratia sp. К-57, вызывают инактивацию вируса A/H3N2 в профилактической схеме анализа.
Определение наличия нуклеолитической и противовирусной активности штамма Serratia species К-57 № В-1289 относительно гриппа человека A/Aichi/2/68 и вирусов ВОВ, ВПГ-2 и ВОМ проводится впервые, в связи с чем можно сделать вывод о соответствии предлагаемого штамма критериям изобретения «новизна» и «изобретательский уровень».
Штамм бактерий Serratia species, обладающий РНКазной и ДНКазной активностью, депонированный в Коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора» под регистрационным номером В-1289, обладающий противовирусной активностью в отношении вируса гриппа человека A/Aichi/2/68 (H3N2), вируса осповакцины (ВОВ), вируса оспы мышей (ВОМ), вируса простого герпеса 2-го типа (ВПГ-2).