Результат интеллектуальной деятельности: Способ масс-спектрометрического секвенирования пептида с преимущественным образованием b-ионов
Вид РИД
Изобретение
Предлагаемое изобретение относится к области масс-спектрометрии пептидов и может найти широкое применение при решении задач органической и биоорганической химии, иммунологии и медицины, диагностики заболеваний, любого биохимического исследования, основанного на определении аминокислотной последовательности белков и их фрагментов.
Процесс определения последовательности аминокислот в полипептиде (секвенирование) в зависимости от целей определения последовательности может быть основан на биохимических реакциях (Polypeptide sequencing with dipeptidyl peptidases, H.C. Krutzsch, Methods in enzymology, v. 91, pp. 511-524, 1983), или на химических принципах (постадийное отщепление аминокислот, начиная либо с первой (N-концевой) аминокислоты (High sensitivity sequencing with a gas phase sequenator, M.W. Hunkapiller, R.M. Hewick, W.J. Dreyer, L.E. Hood, Methods in Enzymology, v. 91, p.p. 399-413, 1983), либо с последней (С-концевой) (Практическая химия белка, под ред. А. Дарбре, Москва, изд. Мир", 1989, стр. 481).
Известен способ определения С-концевой аминокислоты с использованием ферментативного гидролиза. Полипептид (т.е. пептид или белок) обрабатывается карбоксипептидазой, которая разрывает пептидную связь последней аминокислоты пептида с предпоследней, что приводит к освобождению С-концевой аминокислоты, природа которой может быть установлена различными методами хроматографии, электрофореза или масс-спектрометрии [B. Thiede, B. Wittman-Liebold, M. Biernet, E. Krause, FEBS Lett., 1995, 357, p.p. 65-69]. Недостатком данного способа является ограниченность числа определяемых отщепленных С-концевых аминокислот, дороговизна высокоочищенных препаратов и трудоемкость в исполнении.
Известен масс-спектрометрический способ определения аминокислотной последовательности, три варианта которого выбраны в качестве аналогов [Wells J.M., McLuckey S.A., Biol. Mass. Spectrom., 402, 148-185, (2005), D. Betovski. MS/MS Approaches for the analysis of inviromental Poollutants, In Comprehensive Enviromental Mass Spectrometry, Ed. by A.T. Lebedev, ILM Publications, UK, 2012, p.5 28, Метод масс-спектрометрического секвенирования пептидов и определения их аминокислотных последовательностей, патент РФ RU 2498443 С2 от 31.08.2011].
Способ масс-спектрометрического MS-MS секвенирования пептидов заключается в том, что раствор исследуемого пептида поступает в источник ионов, из которого заряженные частицы, в том числе и молекулярный ион пептида, поступают в масс-фильтр, в котором молекулярный ион пептида выделяется и попадает в столкновительную ячейку, где и происходит его фрагментация. При этом получаются набор многочисленных фрагментов, содержащих не только продукты расщепления по скелетной амидной связи пептида, но и вторичные ионы-продукты внутренней фрагментации каждой аминокислоты, входящей в состав данного пептида.
Наиболее информативными являются ионы, содержащие заряд либо на N-конца фрагмента (b-ионы), либо на С-конце (у-ионы). Образовавшиеся фрагменты молекулярного иона пептида поступают в масс-спектрометрический детектор для регистрации. Ввиду особенностей механизма распада молекулярного иона пептида в камере столкновения в фрагментных масс-спектрах преобладают у-ионы. Известные из литературы (S.G. Summerfield, M.S. Bolgar, S.J. Gaakell. Intern. J. MassSpectrom., 1997, 32, 225-231) попытки повышения числа b-ионов (особенно в области низких масс - b1, b2, ключевых для идентификации ионов b-серии) и увеличения их интенсивности оказываются малоэффективными, в частности, для широко используемой ионизации электрораспылением (А.Т. Лебедев, К.А. Артеменко, Т.Ю. Самгина, Основы масс-спектрометрии белков и пептидов, Москва, Техносфера, 2012, стр. 116).
Недостатками описанных выше известных способов являются следующие:
- во-первых, для увеличения достоверности определения последовательности обычно требуется многократный выбор фрагментного иона (из совокупности фрагментов молекулярного иона) для последующей его фрагментации (тандемная масс-спектрометрия), что требует сложного и, следовательно, дорогостоящего оборудования;
- во-вторых, интенсивность образующихся b-ионов очень мала (особенно в области низкомолекулярных фрагментов) и близка к интенсивности фоновых ионов масс-спектра, что затрудняет однозначную интерпретацию масс-спектра;
в-третьих, во всех известных способах масс-спектрометрической фрагментации линейных пептидов, приводящей к образованию коротких пептидов, т.е. пептидов, содержащих 2-5 аминокислотных остатков, происходит образование циклических пептидов из исходных линейных за счет взаимодействия N-концевой аминогруппы пептида с другими структурными компонентами того же пептида [A.G. Harrison, A.B. Yang, C. Bleiholder. S. Suhai, B. Paizs. J.AmChem.Soc., 2006, 128, p.p. 10364-10365, А.Т. Лебедев, К.А. Артеменко, Т.Ю. Самгина, Основы масс-спектрометрии белков и пептидов, Москва, Техносфера, 2012, стр. 56, стр. 108-116].
Циклизация пептидов резко снижает интенсивность как у-, так и b-ионов, а фрагментация образующихся циклических пептидов дает большой набор малоинтенсивных пиков, что заметно осложняет интерпретацию масс-спектров даже при использовании специальных компьютерных программ.
Известен более простой в приборном и методическом исполнении способ масс-спектрометрического секвенирования пептидов и получения их аминокислотных последовательностей, выбранный в качестве прототипа (Метод масс-спектрометрического секвенирования пептидов и определения их аминокислотных последовательностей, патент РФ RU 2498443 С2 от 31.08.2011) и заключающийся в том, что определение аминокислотной последовательности пептида основано на масс-спектрометрической фрагментации молекулярного иона пептида, происходящей в области между соплом и скиммером источника ионов под воздействием электрического поля управляемой величины. Данный подход позволяет получать информативные у-ионы, по интенсивности в 5-100 раз превышающие уровень фона, что позволяет определять последовательность пептида, содержащего 10-15 аминокислот, и проводить сравнение полученной аминокислотной последовательности с существующими базами первичных структур белков и пептидов.
Недостатком способа-прототипа является то, что при его применении в масс-спектрах регистрируются преимущественно фрагменты молекулярного иона пептида с отщепленными N-концевыми аминокислотами, т.е. надежно регистрируются только у-ионы, а b-ионы регистрируются гораздо хуже или не регистрируются вообще.
Задачей предлагаемого изобретения является создание способа определения аминокислотной последовательности исследуемого пептида с регистрацией b-ионов всех образующихся фрагментов пептида. Поставленная задача решается за счет химической модификации исходного пептида 5-диметиламино-1-нафталинсульфонилхлоридом (дансилхлоридом) и последующей управляемой фрагментацией дансилированного пептида при нескольких дискретных значениях напряженности электрического поля в диапазоне 102-104 В/м и давлении остаточного газа в диапазоне 100-2000 Па.
Наличие защитной дансильной группы на N-концевой аминокислоте пептида позволяет, во-первых, избежать циклизации укороченных пептидов и получать высокоинтенсивные пики низкомолекулярных фрагментных ионов.
Во-вторых, из-за того, что энергия сульфамидной связи между дансильным радикалом и NН2-группой пептида значительно сильнее энергии амидных связей между аминокислотами (3-5 эВ), входящими в состав пептида, происходит преимущественное расщепление дансилированных фрагментов исходного пептида по амидным связям основной цепи пептида с сохранением дансильного радикала в структуре всех без исключения фрагментов исходного пептида, что приводит к преимущественному образованию в спектре ионов b-фрагментов.
В-третьих, за счет присутствия в структуре дансильного радикала остатка хорошо протонируемой третичной диметиламино-группы удается получить интенсивные пики b-ионов, доминирующие в масс-спектрах, и избежать циклизации коротких фрагментов пептида.
Технический результат заключается в получении преимущественно высокоинтенсивных b-ионов всех фрагментов пептида, что значительно упрощает процесс интерпретации масс-спектров, повышает надежность определения полной аминокислотной последовательности исследуемых пептидов.
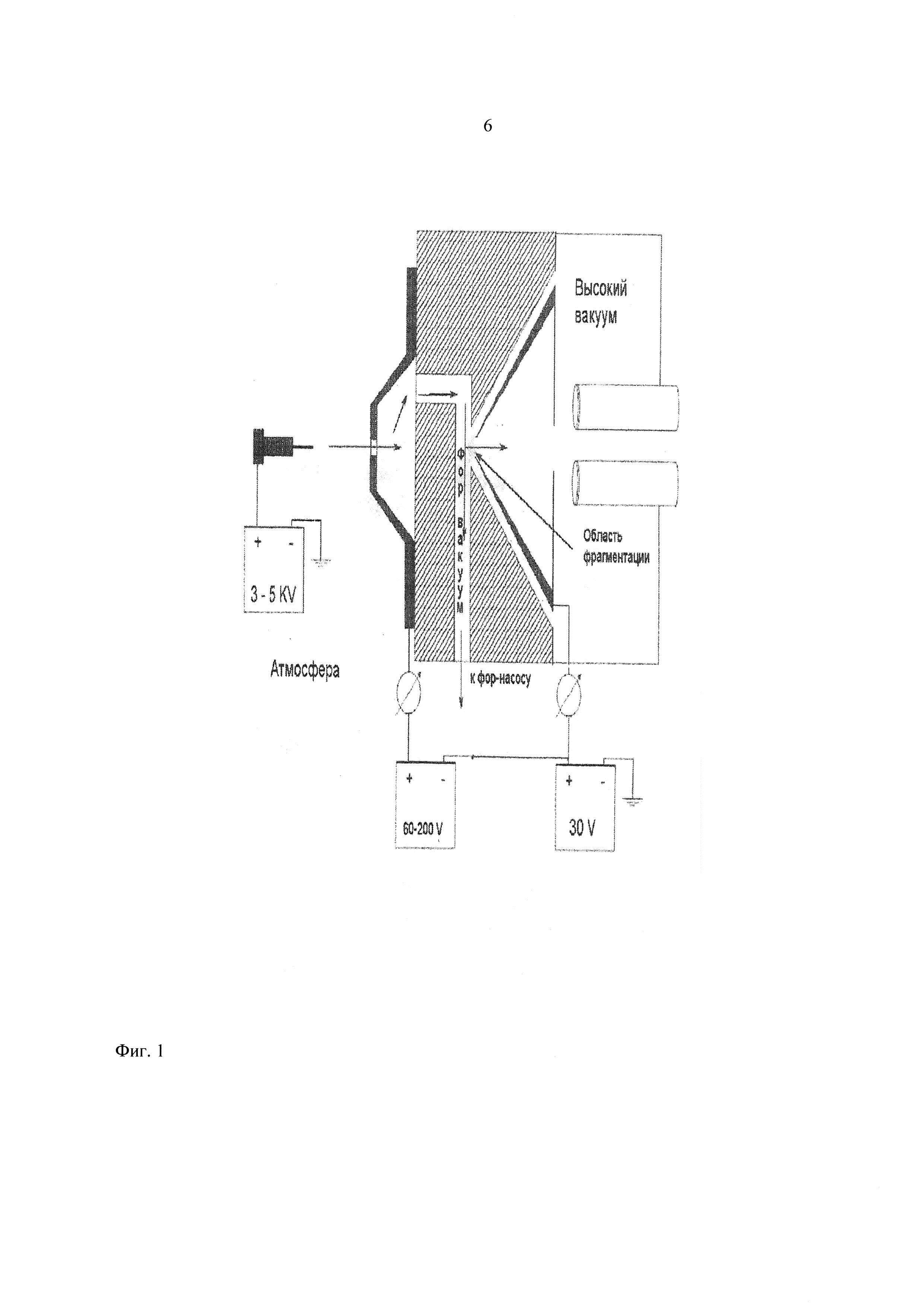
Реализация предлагаемого способа происходит следующим образом. Раствор исходного пептида химически модифицируют дансилхлоридом, подают в источник ионов, электрогазодинамическая система транспортировки которого позволяет управлять степенью фрагментации молекулярного иона при помощи изменения электрического поля между соплом и скиммером масс-спектрометра. Усредненные значения параметров фрагментации - напряжение на капилляре - 3400 В, на сопле 90-180 В, на скиммере - 60-90 В (значения этих параметров меняются в зависимости от природы и числа аминокислот, входящих в состав пептида). Далее ионы разделяют в масс-анализаторе и направляют в детектор, где осуществляют регистрацию масс-спектра пептида и его фрагментов с различной глубиной фрагментации одновременно в одном масс-спектре. Фрагментные масс-спектры пептида, полученные при различных значениях напряженности электрического поля, обрабатывают системой регистрации, анализируют, в результате чего определяют аминокислотную последовательность исходного пептида.
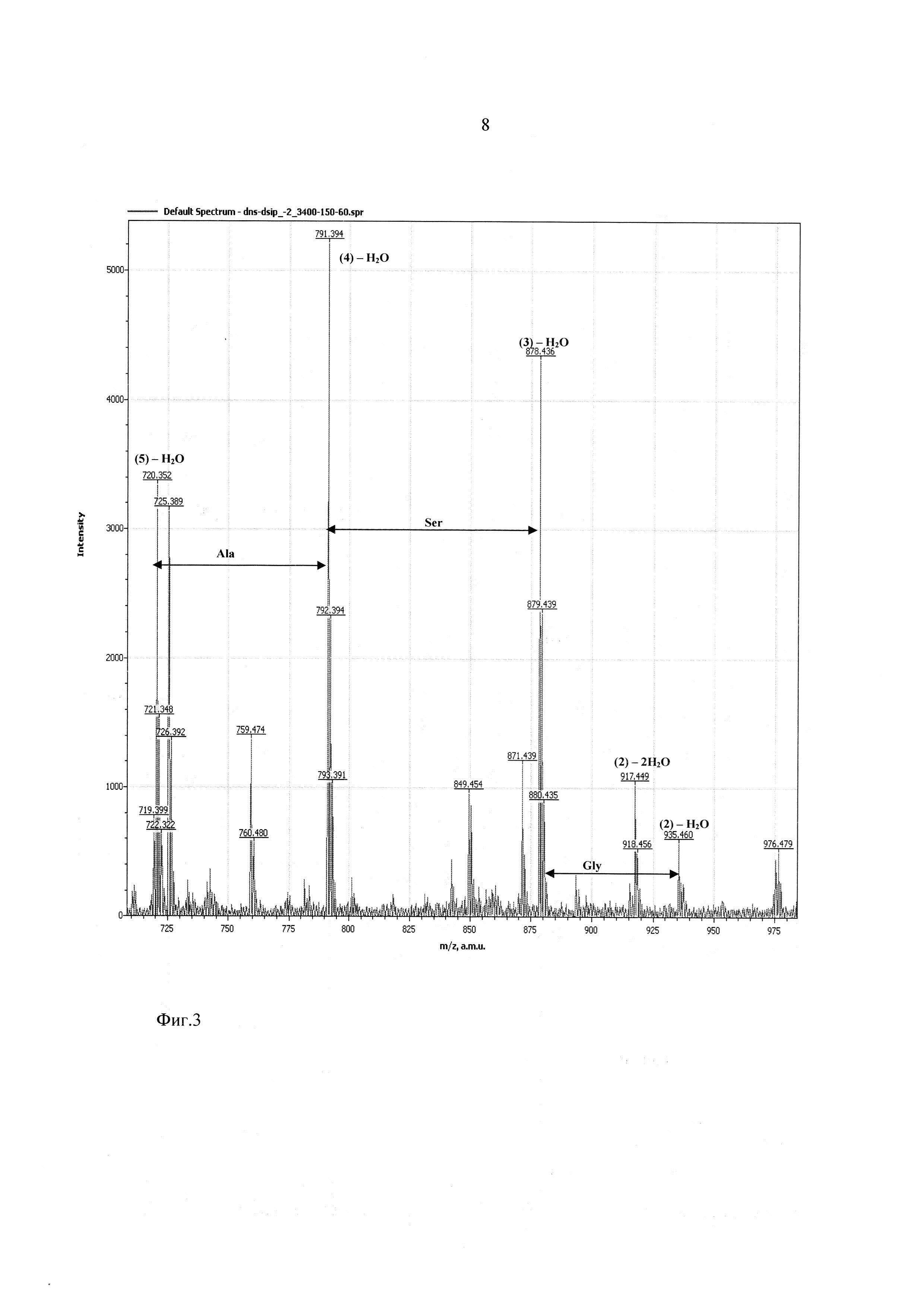
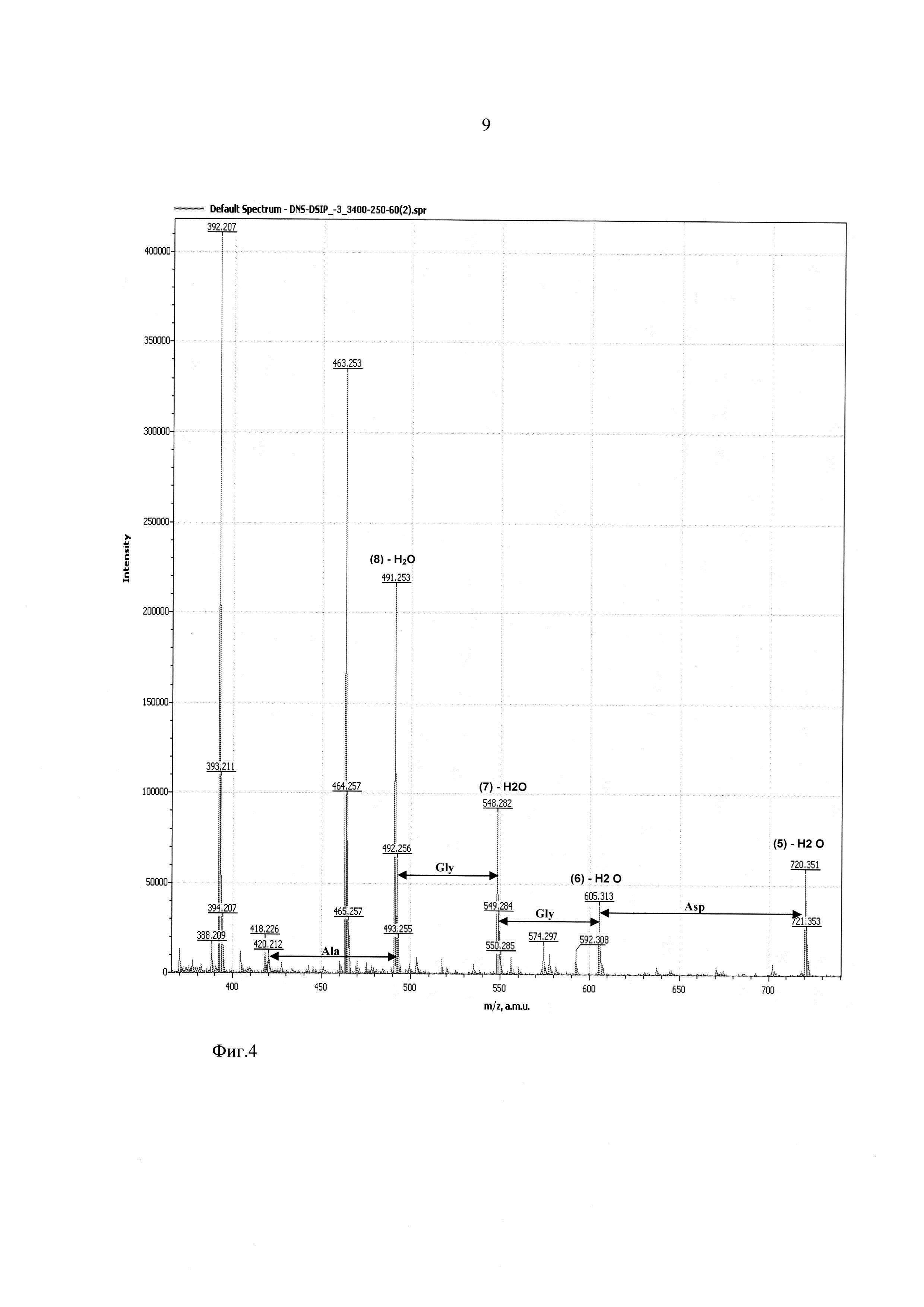
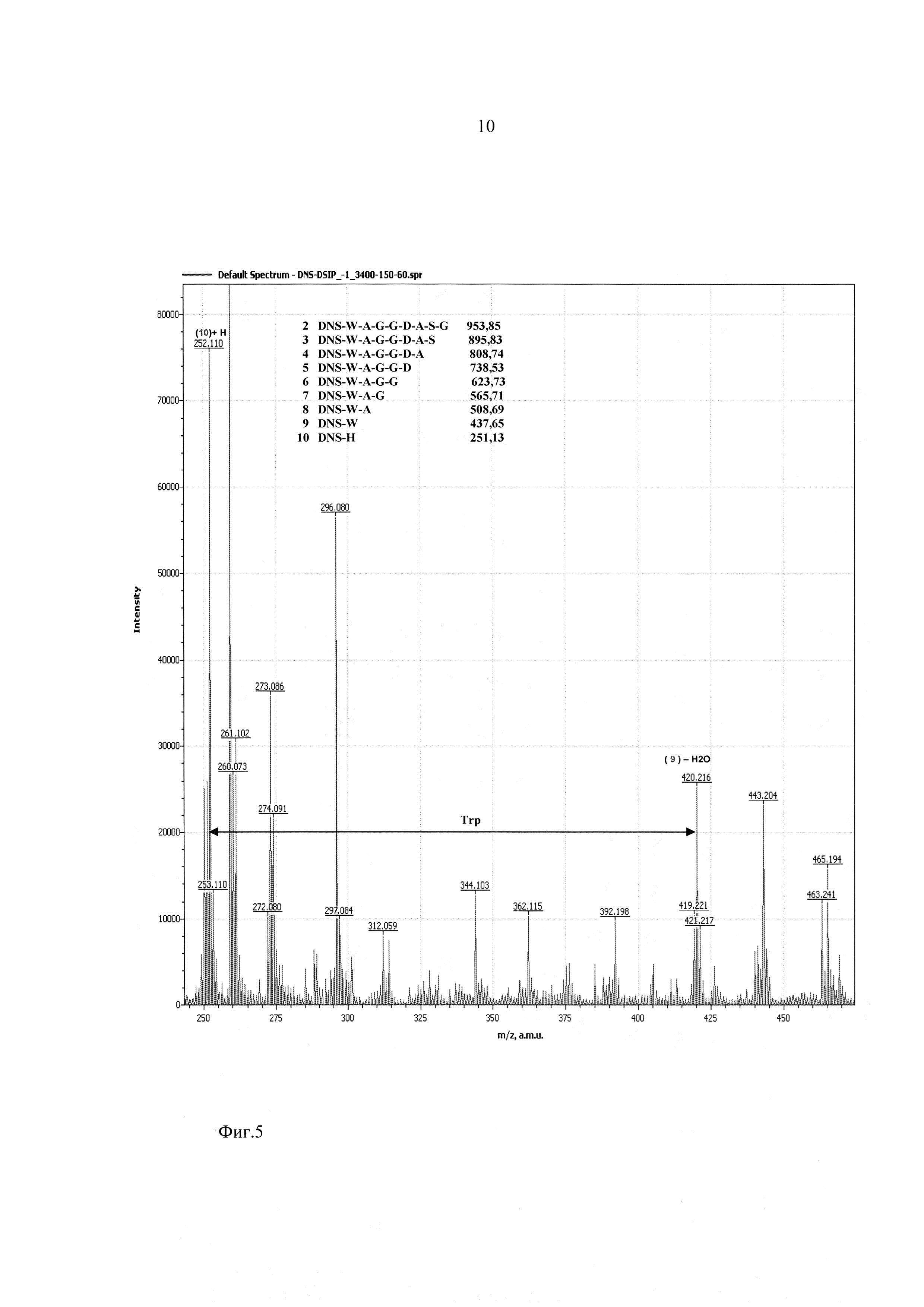
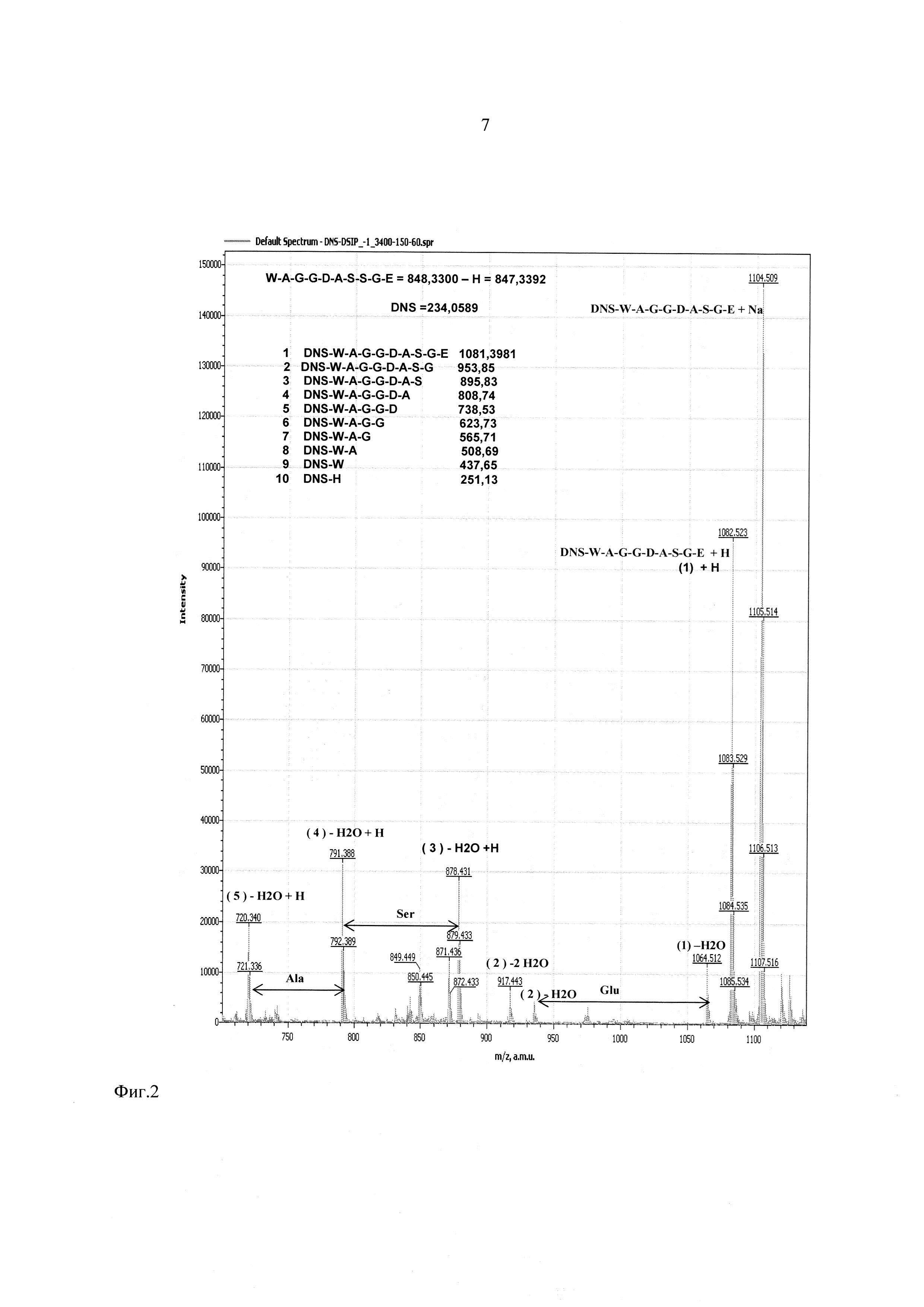
На фиг. 2-4 показаны результаты фрагментации дансилированного пептида ДСИП. Масс спектры сняты в диапазоне молекулярных масс 100-1100 Да и напряжениях на сопле - 90 В, на скиммере - 60 В.
Предлагаемое изобретение иллюстрируют следующие фигуры, на которых представлены результаты анализа последовательности аминокислот пептида Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu, или, в однобуквенном коде, W-A-G-G-D-A-S-G-E (пептид, стимулирующий дельта фазу сна, ДСИП).
Фиг. 1 - схема источника ионизации образца с указанием зоны фрагментации пептида.
Фиг. 2 - участок масс-спектра фрагментации дансилированного пептида ДСИП в диапазоне 700-1130 Да.
Фиг. 3 - участок масс-спектра фрагментации дансилированного пептида ДСИП в диапазоне 710-980 Да.
Фиг. 4 - участок масс-спектра фрагментации дансилированного пептида ДСИП в диапазоне 370-730 Да.
Фиг. 5 - участок масс-спектра фрагментации дансилированного пептида ДСИП в диапазоне 245-470 Да.
Способ масс-спектрометрического секвенирования с преимущественным образованием b-ионов фрагментов пептида, включающий прямое введение раствора пептида в источник ионов с последующей фрагментацией молекулярного иона пептида в области между соплом и скиммером источника ионов воздействием электрического поля при нескольких дискретных значениях напряженности электрического поля в диапазоне 10-10 В/м и давлении остаточного газа в диапазоне 100-2000 Па, регистрацию полученных фрагментов в масс-спектрометрическом детекторе, анализ полученных масс-спектров системой регистрации и определение аминокислотной последовательности пептида, отличающийся тем, перед фрагментацией пептид химически модифицируют дансилхлоридом.