Результат интеллектуальной деятельности: Способ прогнозирования риска прогрессирования первичных В-клеточных неходжкинских лимфом с поражением костного мозга
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к онкологии и гематологии, и может быть использовано для прогнозирования риска прогрессирования первичных B-клеточных неходжкинских лимфом с поражением костного мозга при планировании тактики лечения и мониторинга ремиссии больных.
В течение последнего десятилетия заболеваемость злокачественными лимфомами имеет неуклонную тенденцию к росту во всем мире. В возрасте до 30 лет среди больных злокачественными образованиями лимфомы прочно занимают 1-е место, составляя 32%. В России с 2003 по 2013 гг. уровень заболеваемости вырос на 20,93%. Среднегодовой прирост заболеваемости в стране достигает 1,88%. Стандартизованный показатель заболеваемости в США и странах Евросоюза в 2014 году составил 19,7 на 100,000 населения, а смертности - 6,3, что было значительно выше показателей заболеваемости и смертности в России, 5,6 на 100,000 населения и 2,3 на 100,000 населения. Однако общая 5-летняя выживаемость в России была ниже и составляла 55.2% по сравнению с показателями в США и Европе (69,3%).
В последние годы активно обсуждается концепция персонифицированной или предикативной медицины, которая способна существенно повысить не только качество лечения, но и улучшить показатели общей и беспрогрессивной выживаемости больных. Индивидуализированная диагностика патологического процесса в настоящее время реализуется путем поиска дополнительных критериев прогнозирования опухолевой прогрессии и множественной лекарственной устойчивости.
Доказано, что эффективность проводимого лечения зависит не только и не столько от применяемых терапевтических подходов, сколько от особенностей организма пациента, которые обусловливают большую или меньшую чувствительность к лечению. При планировании тактики ведения обычно начинают с менее интенсивных протоколов, предназначенных для данного вида неходжкинских лимфом. Однако в ряде случаев лечение не приносит должного результата, а пациентом потеряно время на неэффективное лечение. Более того, в случае неэффективности стартового курса терапии возникает множественная лекарственная устойчивость.
Все описанное выше обусловливает актуальность поиска дополнительных, точных и универсальных способов прогнозирования течения заболевания при неходжкинских лимфомах.
Для неходжкинских лимфом разработано большое количество клинических и лабораторных прогностических моделей: международный прогностический индекс с поправкой на возраст IPI (с уточнениями для фолликулярной лимфомы - Follicular Lymphoma International Prognostic Index - FLIPI и FLIPI-2; для лимфомы из клеток мантии - MIPI), прогностические критерии, разработанные группой BFM (см. Berlin-Frankfurt-Munster Group, 1995) (см. Таблица №4).
IPI (см. International prognostic index, IPI, Shipp M.A., Harrington D.P., Andersen J. et al. International Non-Hodgkin’s lymphoma prognostic factors project. A predictive model for aggressive non-Hodgkin’s lymphoma / N. Engl. J. Med. 1993; 329: 987-94; см. Поддубная И.В. Клиническая онкогематология / Под ред. М.А. Волковой. - Москва: «Медицина», 2007 г., с. 344-345) (см. Таблица №1), международный прогностический индекс применяется в прогнозировании течения заболевания при агрессивных неходжкинских лимфомах. Совокупность факторов коррелирует со следующими группами риска: низкий риск (0 факторов) - 5-летняя выживаемость 83%, низкий или средний риск (1 фактор) - 5-летняя выживаемость 69%, высокий промежуточный риск (2 фактора) - 5-летняя выживаемость 46%, высокий риск (3 фактора) - 5-летняя выживаемость 32%.
FLIPI (см. Solal-Celigny et al. Follicular lymphoma international prognostic index. Blood 2004; 104(5):1258-1265.) (см. Таблица №2) является прогностическим индексом только для фолликулярной лимфомы. К группе низкого риска относятся пациенты с 0-1 фактором, промежуточного - 2 факторами, высокого - 3-5 факторами.
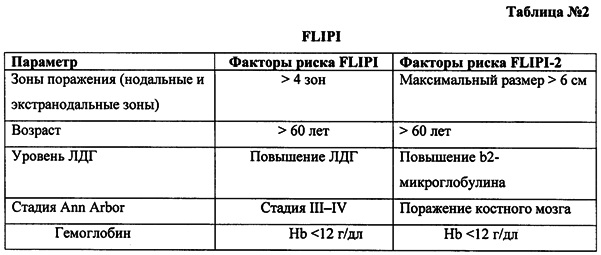
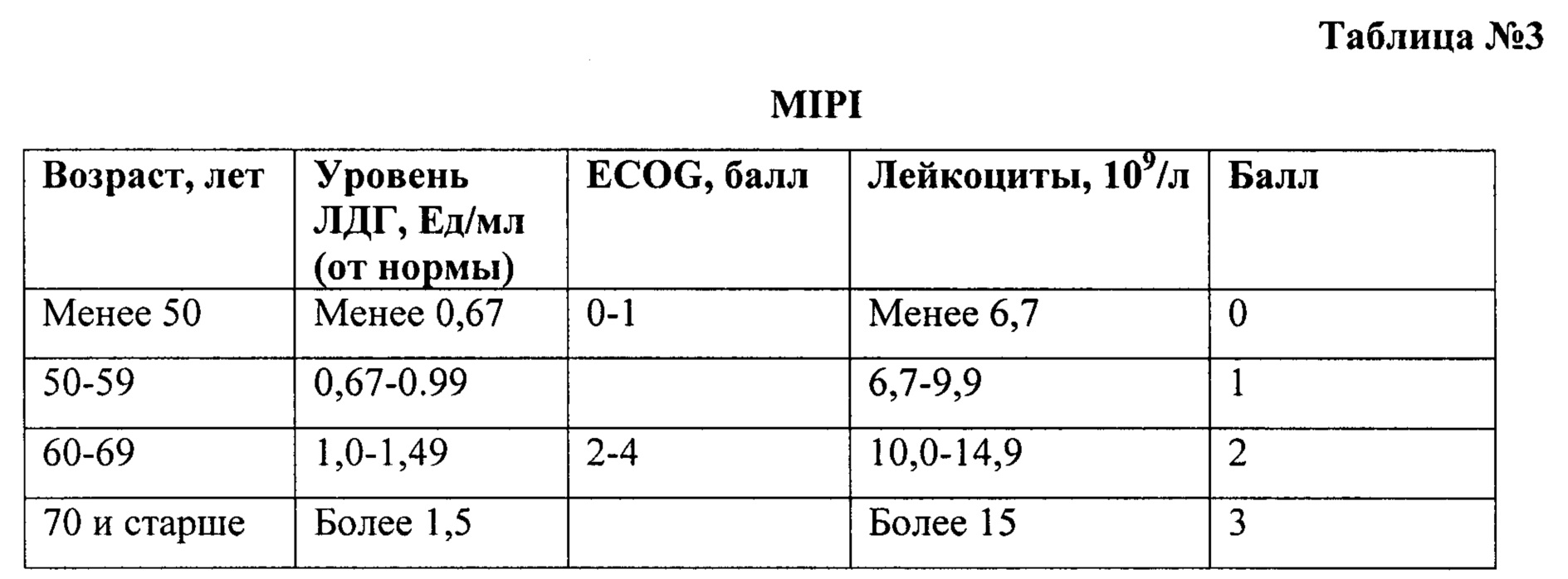
MIPI (см. Hoster et al. A new prognostic index (MIPI) for patients with advanced-stage mantle cell lymphoma. Blood 2008; 111(2): 558-565) (см. Таблица №3) является прогностическим индексом только для мантийноклеточных лимфом и не применим к другим вариантам неходжкинских лимфом. Низкий риск - 0-3 балла, промежуточный - 4-5, высокий - 6-11.

К доказанным лабораторным маркерам неблагоприятного прогноза течения заболевания также относятся следующие:
- уровень экспрессии опухолевыми клетками маркера пролиферативной активности Ki-67, который определяется иммуногистохимической окраской (см. Role and prognostic significance of the Ki-67 index in non-Hodgkin’s lymphoma. Broyde A, Boycov O, Strenov Y, Okon E, Shpilberg O, Bairey O. Am J. Hematol. 2009 Jun; 84(6): 338-43). Повышение его уровня при диффузной В-крупноклеточной лимфоме позволяет разграничить пациентов с благоприятным и неблагоприятным прогнозом (уровень экспрессии лимфомными клетками антигена Ki-67 более 70% выживаемость статистически значимо ниже, чем у лиц с уровнем экспрессии Ki-67 менее 70%). Установленных данных применения маркера пролиферативной активности при других вариантах неходжкинских лимфом не описано;
- концентрация сывороточного бета2-микроглобулина, лактатдегидрогеназы и тимидинкиназы (см. Risk classification for large cell lymphoma using lactate dehydrogenase, beta-2 microglobulin, and thymidine kinase. Suki S, Swan F Jr, Tucker S, Fritsche HA, Redman JR, Rodriguez MA, McLaughlin P, Romaguera J, Hagemeister FB, Velasquez WS, et al. Leuk Lymphoma. 1995 Jun; 18(1-2): 87-92). Нормальный уровень всех показателей соответствует низкому риску (трехлетняя выживаемость 91%), повышение концентрации одного или двух показателей - среднему риску (трехлетняя выживаемость 36%), а повышение концентрации трех показателей - высокому риску (трехлетняя выживаемость 0%);
- уровень бета2-микроглобулина, определяемый методом иммунопреципитации. К основному недостатку данного маркера является низкая специфичность (повышение его концентрации может происходить не только при неходжкинских лимфомах, но и при различных аутоиммунных заболеваниях).
Также, из литературных источников известны следующие способы прогнозирования течения лимфопролиферативных заболеваний.
«Способ прогнозирования варианта течения неходжкинских лимфом», предложенный Левитаном Н.В., Лосевой М.И. (см. патент RU №2082976 от 27.06.1997). Сущность изобретения заключалась в определении в периферической крови больного процентного содержания лимфоидных клеток с повышенным уровнем активности нуклеолярного аппарата и находящихся в стадии S/G2 клеточного цикла, причем определение уровня активности нуклеолярного аппарата лимфоидных клеток крови осуществлялось по наличию в ядрышках этих клеток нуклеолярного липидного компонента. Стандартные мазки крови окрашивались бензоапиреном по известной методике и с помощью люминесцентного микроскопа подсчитывалось процентное содержание клеток с флуоресциирующими ядрышками. При отсутствии таких клеток определяли безрецидивный вариант течения неходжкинских лимфом. При обнаружении лимфоидных клеток с флуоресциирующими ядрышками проводили второй этап исследования, при котором другой мазок крови больного окрашивали по Фельгену и определяли долю клеток в стадиях S/G2 клеточного цикла. Отрицательное значение этого теста определяли как рецидивирующее медленно прогрессирующее течение неходжкинских лимфом, положительное - как быстропрогрессирующее течение. Однако при применении данного способа отмечено отсутствие точности индивидуального прогнозирования вероятности течения процесса с учетом клинико-морфологических особенностей образования, углубленного изучения ДНК - плоидности клеток, а также использование в качестве биологического материала только периферической крови. Также с помощью этого метода невозможна ранняя и привентивная диагностика.
Известен «Способ ультразвукового прогнозирования лечения неходжкинских лимфом» (см. патент RU 2211665, 2003 г.), основанный на ультразвуковом исследовании лимфоузлов. Недостатком данного способа является поздняя диагностика, которая проходит уже в разгар заболевания, и невозможность оценить клетки происхождения опухоли.
Известен «Способ прогнозирования течения неходжкинских лимфом», предложенный Бакировым А.Б. и соавт. (см. патент RU №2490641 от 20.08.2013), включающий выделение ДНК из лимфоцитов периферической венозной крови с последующими ПЦР и рестрикцией продуктов амплификации, отличающийся тем, что проводят генотипирование полиморфного локуса 309T>G гена MDM2 и при выявлении у больного генотипа ТТ прогнозируют индолентную форму неходжкинских лимфом, генотипа TG - агрессивную форму неходжкинских лимфом, генотипа GG - высокоагрессивную форму неходжкинских лимфом. Основными недостатками данного способа является трудоемкость, длительность, необходимость специализированных кадров и аппаратуры.
Известен «Способ прогнозирования течения острых лейкозов», предложенный Хаматдиновой З.Р. (см. патент RU №2416795 от 27.01.2010). Проводят забор периферической крови в количестве 5 мл утром натощак. Определяют плоидность клеток периферической крови методом проточной цитометрии. При выявлении анеуплоидии и индекса ДНК<1,19 (маркер, характеризующий агрессивность течения заболевания) прогнозируют неблагоприятный исход. Прогностически благоприятным является диплоидный тип гистограмм. Помимо того, что данный способ не применим к неходжкинским лимфомам, он не дает возможности установить исходный кинетический потенциал опухолевых клеток костного мозга.
На основе анализа уровня науки и техники можно резюмировать, что существующие способы имеют те или иные ограничения:
1. Предназначены для отдельных гистологических вариантов неходжкинских лимфом (только агрессивные в целом, только лимфобластные, только мантийноклеточная, только диффузная В-крупноклеточная и т.п.) или даже для лимфом определенной локализации (средостение, центральная нервная система).
2. Трудоемкость, длительность и сложность.
3. Прогноз вышерассмотренных способов и моделей основан на анализе только частоты достижения ремиссии, либо только общей выживаемости пациентов, без возможности прогнозирования рецидивов.
По сравнению с аналогами предлагаемый нами способ прогнозирования риска прогрессирования первичных В-клеточных неходжкинских лимфом с поражением костного мозга:
- эффективен в отношении различных морфологических вариантов неходжкинских лимфом с поражением костного мозга;
- дает возможность получить более полную картину прогноза риска развития прогрессирования заболевания у пациентов с неходжкинскими лимфомами с поражением костного мозга;
- осуществление способа не требует длительных временных интервалов от момента забора материала для исследования до получения результата анализа;
- предлагаемый способ дает возможность прогнозирования риска развития прогрессирования заболевания до начала специфической терапии и своевременной смены линии.
Применение данного метода обеспечивает точность диагностики и позволяет проводить индивидуализированную, эффективную профилактику возникновения рецидива лимфом.
Задачей изобретения является разработка прогностического алгоритма, включающего параметры плоидности и кинетики клеточного цикла мононуклеаров костного мозга с опухолевой экспансией, а также содержания бластных клеток в периферической крови, позволяющего выделить группу повышенного риска прогрессирования заболевания у первичных пациентов с первичными В-клеточными неходжкинскими лимфомами с поражением костного мозга, что обеспечивает персонифицированный подход к выбору терапии первой линии.
Технический результат настоящего изобретения заключается в упрощении и ускорении прогнозирования течения первичных В-клеточных неходжкинских лимфом с поражением костного мозга за счет использования косвенных признаков.
Технический результат достигается тем, что на этапе планирования тактики терапии больному проводят ДНК-цитометрию костного мозга с определением цитокинетического индекса, определением плоидности и процентного содержания бластных клеток в периферической крови, затем рассчитывают риск прогрессирования первичных В-клеточных неходжкинских лимфом с поражением костного мозга по формуле
Р=(1+2,72-(-3,09 + 0,19×ЦКИ + 3,18×БК + 1,55×А))-1, где P - вероятность возникновения прогрессирования заболевания, принимающая значение в диапазоне от 0 до 1; ЦКИ - цитоцинетический индекс S+G2M/G0-1; БК составляет «1» при повышении процента бластных клеток в периферической крови более 5,0%, БК составляет «0» при проценте бластных клеток в периферической крови менее 5,0%; А - анеуплоидия «1» - наличие, «0» - отсутствие клона в костном мозге, при Р<0,6 прогнозируют низкий риск прогрессирования первичных В-клеточных неходжкинских лимфом с поражением костного мозга, при 0,6≤Р≤0,7 - прогнозируют средний риск прогрессирования, при Р>0,7 прогнозируют высокий риск.
Сущность изобретения поясняется чертежами.
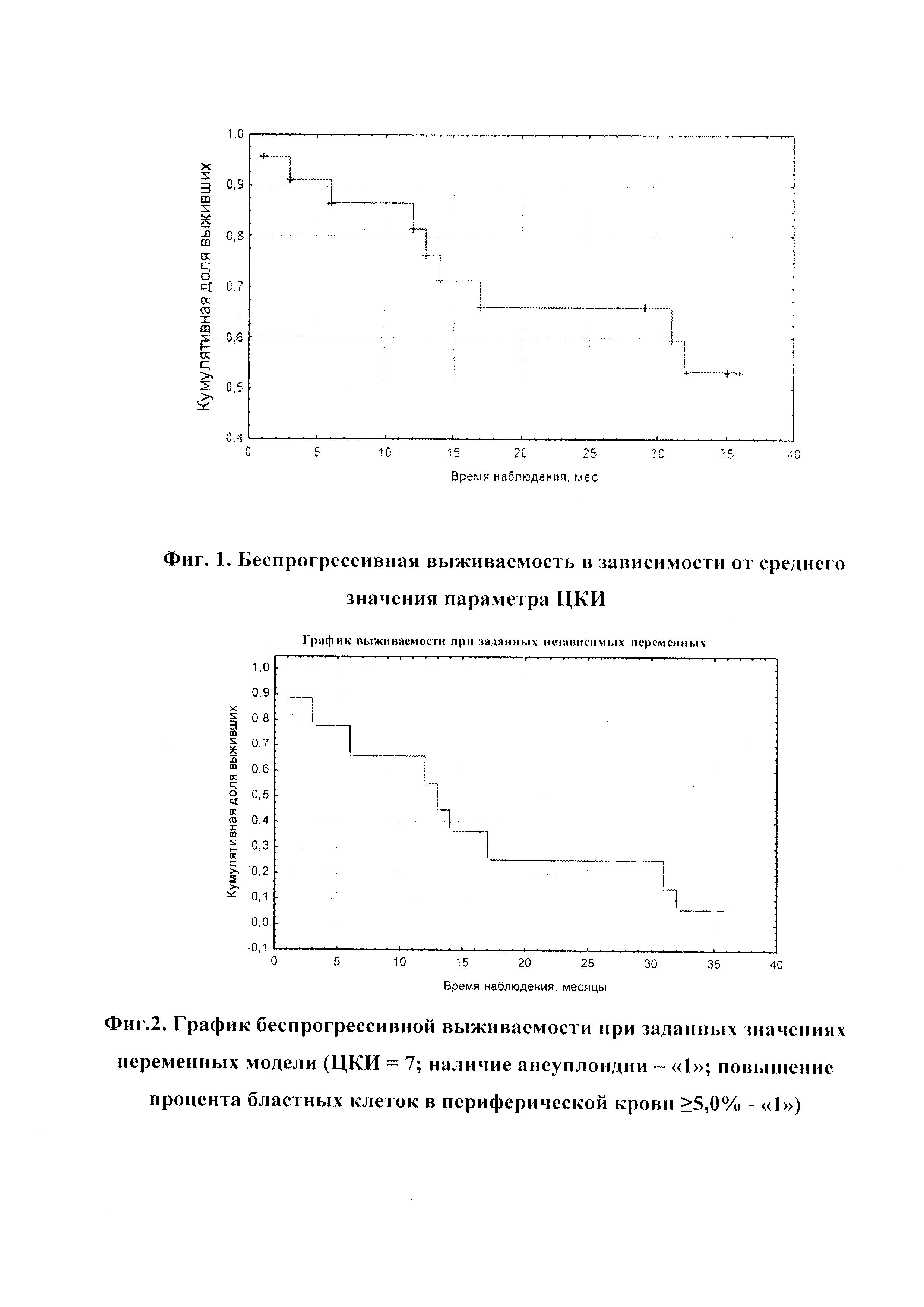
На фиг. 1 изображены данные о беспрогрессивной выживаемости в зависимости от среднего значения параметра ЦКИ.
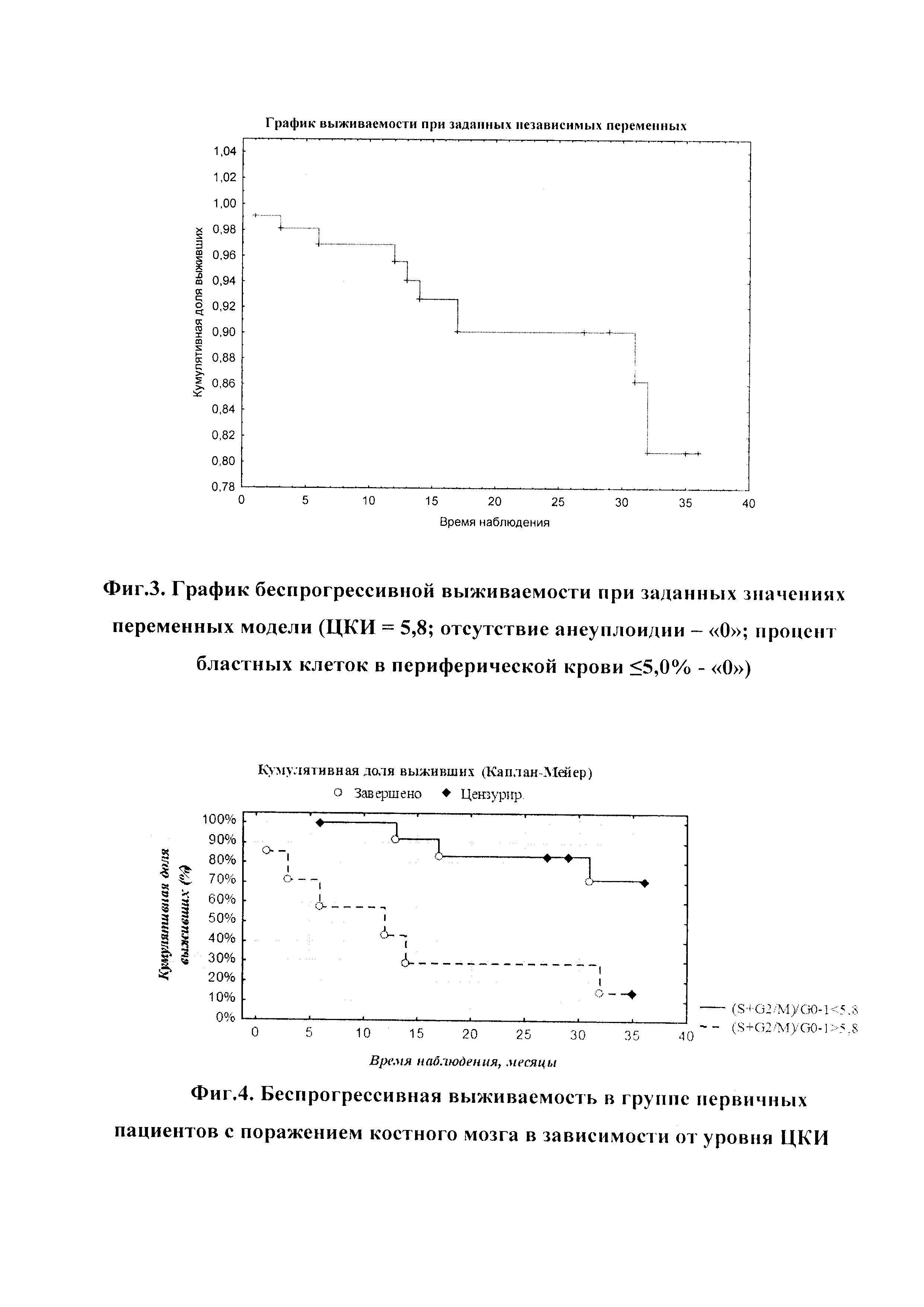
На фиг. 2 изображен график беспрогрессивной выживаемости при заданных значениях переменных модели (ЦКИ=7; наличие анеуплоидии - «1»; повышение процента бластных клеток в периферической крови >5,0% - «1»).
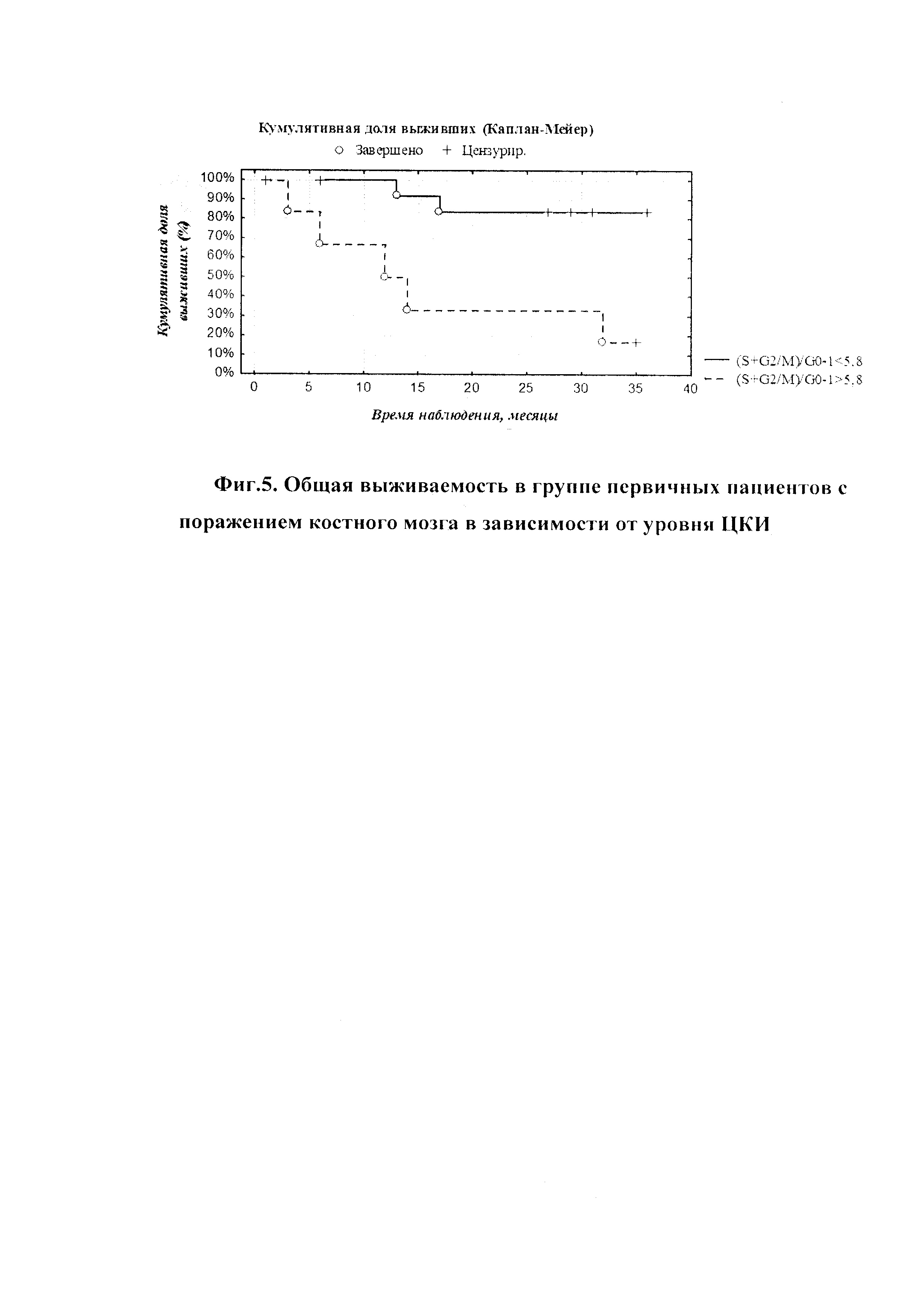
На фиг. 3 изображен график беспрогрессивной выживаемости при заданных значениях переменных модели (ЦКИ=5,8; отсутствие анеуплоидии - «0»; процент бластных клеток в периферической крови <5,0% - «0»).
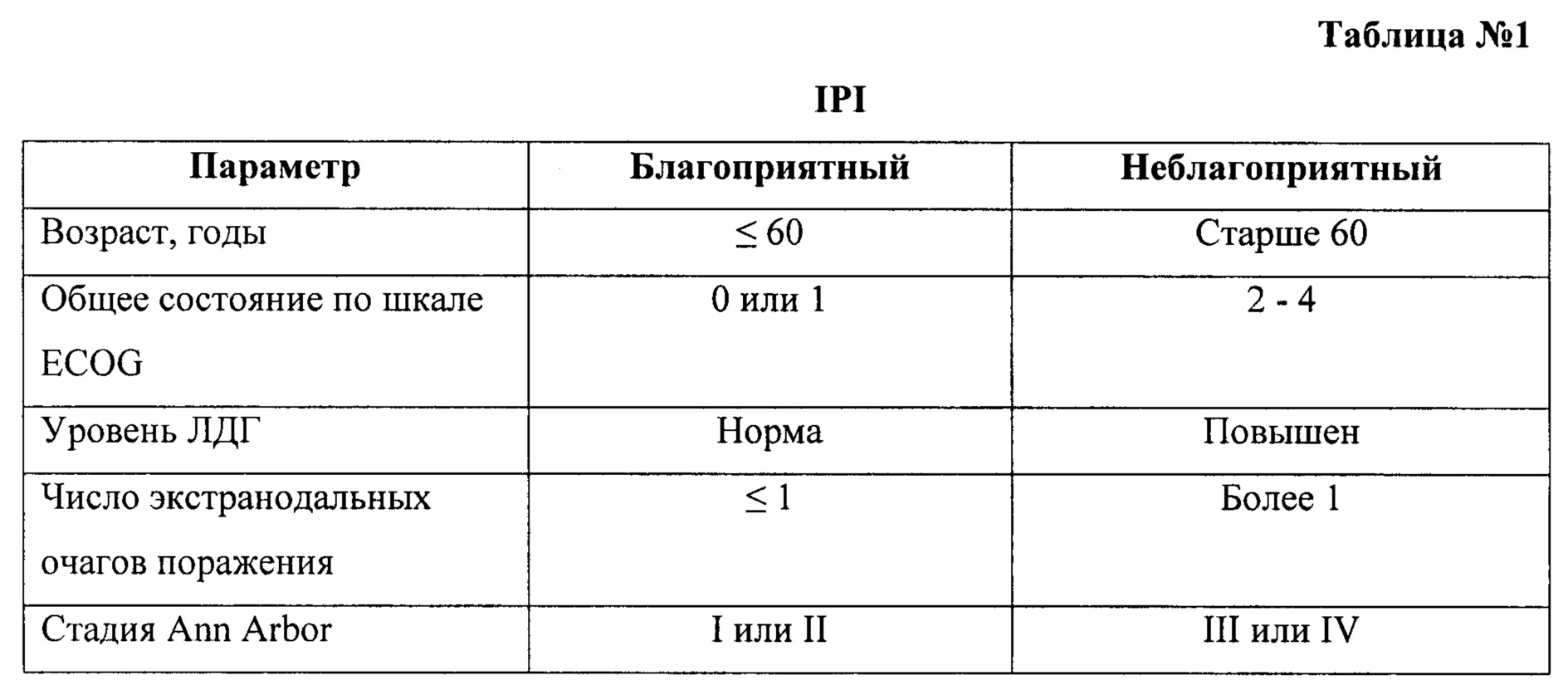
На фиг. 4 изображены данные о беспрогрессивной выживаемости в группе первичных пациентов с поражением костного мозга в зависимости от уровня ЦКИ.
На фиг. 5 изображены данные об общей выживаемости в группе первичных пациентов с поражением костного мозга в зависимости от уровня ЦКИ.
Способ осуществляется следующим образом.
При помощи флюоресцентно меченных моноклональных антител на основе реакции «антиген-антитело» определяли тип и функциональное состояние клеток костного мозга по наличию определенного набора клеточных маркеров, кластеров дифференцировки (cluster of differentiation antigens, CD) на поверхности или внутри клетки.
Флюоресцентную метку обнаруживали с помощью проточного цитофлюориметра FACS CantoII (Becton Dickinson, USA). Мониторинг стабильности работы прибора осуществлялся с помощью калибровочной системы 7-color Setup Beads (Becton Dickinson, USA). Доля клеток, положительных по тому или иному маркеру, вычислялась в процентах от общего числа.
Для проведения иммунофенотипирования костного мозга больных лимфомами костный мозг в количестве 0,5-1 мл забирался в пробирки Vacutainer (BD, USA) с сухим ЭДТА. Подготовка проб была осуществлена по методике окрашивание - лизис - отмывка с использованием прибора Lyse - Washassistant. Кроме диагностической для лимфом панели антител, включающей маркеры основных линий дифференцировки, были использованы маркеры апоптоза и пролиферативной активности (Ki67 и Bcl2), анализ плоидности и распределения клеток в фазах G0-1, S и G2+M.
Для оценки ДНК использовали CycleTESTTMPLUS DNA Reagent Kit (кат. №340242, Becton Dickinson). После центрифугирования суспензии клеток 5 минут при 250g, концентрацию доводили до миллиона клеток в миллилитре. Образцы (не менее 50000 клеток) после окрашивания пропидиум йодидом (PI) анализировались на проточном цитофлуориметре BD FACS CantoII, оборудованном модулем дискриминации дуплетов. Для тестирования и подтверждения оптимальной работы проточного цитометра использовали универсальные биологические частицы DNA QC Particles (BD, кат. №349523).
Полученные данные обрабатывались с помощью компьютерной программы ModFit LT, позволяющей анализировать плоидность и распределение клеток в фазах S и G2+M.
Долю клеток с различным содержанием ДНК на гистограмме вычисляли как процент от общего числа исследованных клеток. Диплоидными опухолями считали те, у которых пик G0/1 находился в пределах контрольного пика диплоидных стандартов (был равен 1,0).
В анеуплоидных клетках он был больше или меньше 1,0. Долю клеток в разных фазах клеточного цикла выражали в процентах. Степень анеуплоидии клеток костного мозга характеризовали, используя индекс ДНК, который вычисляли как отношение интенсивности флуоресценции пика анеуплоидных клеток (номер канала) к диплоидному пику.
С помощью автоматических гематологических анализаторов - Beckman Coulter LH - 500 (США); Cobas Integra 400 plus (Швеция) проводили исследование показателей периферической крови, в процентных и/или абсолютных цифрах. В рамках исследования производили подсчет процентного содержания бластных клеток в периферической крови.
Наиболее важной и объективной характеристикой значимости медико-биологического параметра, несомненно, является его непосредственное влияние на показатели продолжительности жизни пациентов и сопряженность с риском возникновения какого-либо «отрицательного» события (например, прогрессирования или рецидива заболевания).
Для определения связи между классическими клинико-морфологических факторами прогноза и показателями уровня апоптотической, пролиферативной и цитокинетической активности мононуклеаров костного мозга больных лимфомами был проведен корреляционный анализ. Предметом корреляционного анализа являлось выявление корреляционной связи между признаками, при этом учитывалось не только наличие этой связи, но ее форма и теснота. Теснота связи оценивалась по шкале Чеддока и считалась заметной при значениях коэффициента корреляции от 0,5 до 0,7, высокой - от 0,7 до 0,9 и весьма высокой при значении коэффициента корреляции от 0,9 до 0,99.
Поскольку для проведения комплексного статистического анализа использовались и атрибутивные признаки, и количественные признаки, распределенные как по нормальному закону, так и с распределением, отличным от нормального, при выборе статистического метода исследования было отдано предпочтение непараметрическим методам корреляционного анализа (Спирмена, гамма, Тау Кендала). Проводилась стратификация по принципу возникновения или отсутствия «отрицательного» события на момент проведения статистического анализа.
Под «отрицательным» событием понимали прогрессирование или рецидив основного заболевания. Из переменных, влияющих на функцию выживания с большей значимостью, выбраны предикторы, обладающие наименьшей автокорреляцией между собой: (S+G2M)/G0-1 (цитокинетический индекс - ЦКИ), анеуплоидия мононуклеаров костного мозга и доля бластных клеток в периферической крови.
Для оценки влияния ЦКИ, анеуплоидии мононуклеаров костного мозга и доли бластных клеток в периферической крови на выживаемость пациентов с поражением костного мозга выполнен регрессионный анализ Кокса (Model: Proportional hazard (Сох) regression). Регрессия Кокса, или модель пропорциональных рисков (Model: Proportional hazard (Сох) regression), выбрана с учетом возможности определения риска наступления события (прогрессирования) и оценки влияния независимых переменных (предикторов) на этот риск. Риск рассматривался как функция, зависящая от времени. В качестве события рассматривали прогрессирование или рецидив заболевания. Время от момента начала исследования (когда объект попал под наблюдение) до момента, когда для объекта наступило событие (прогрессирование или рецидив заболевания) измерялось в месяцах.
Вклад отдельных предикторов выражали величиной статистики Вальда (Wald Chi - Square). Ниже представлен список критических значений наиболее значимых предикторов риска прогрессирования заболевания: бластоз в периферической крови (%) WS 6,02 р=0,01; наличие анеуплоидного клона (1 - наличие анеуплоидии; 2 - отсутствие) WS 3,34 р=0,05; S+G2M/G0-1 - 5,8% WS 3,21 р=0,05.
Графический пример зависимости беспрогрессивной выживаемости от цитокинетического индекса - ЦКИ (S+G2M/G0-1) представлен ниже (см. График 1). Вероятность того, что больной с показателем критического значения цитокинетического индекса равным 5,8 сможет прожить без прогрессирования заболевания более 5 месяцев равна ≈0,9, более 32 месяцев ≈0,6.
Используя модель пропорциональных рисков Кокса (см. Таблица 5), проанализирована вероятность развития прогрессирования патологического процесса под влиянием нескольких независимых переменных: ЦКИ S+G2M/G0-1, бластоз в периферической крови и наличие/отсутствие анеуплоидии в костном мозге (см. Графики 2 и 3).
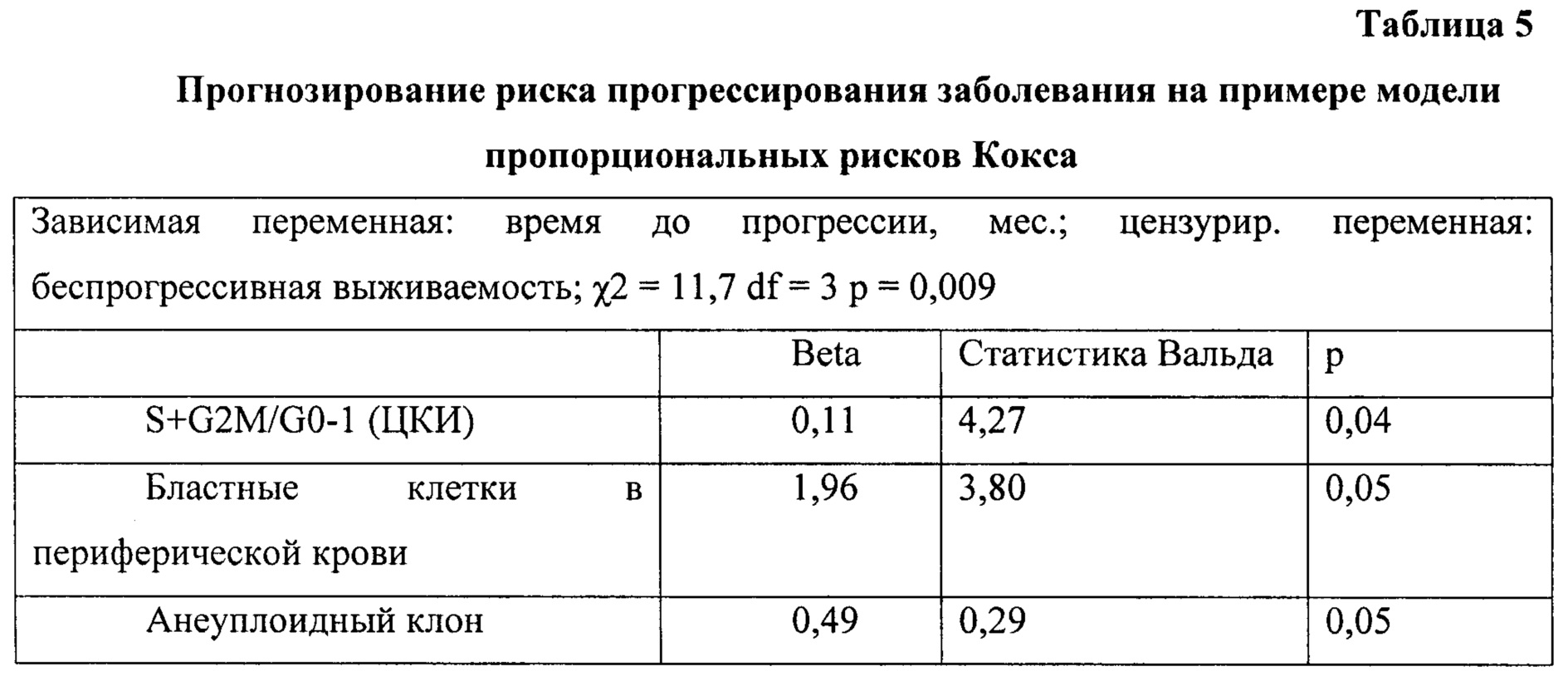
Анализ показал, что вероятность того, что пациент, у которого при обследовании выявлено наличие анеуплоидии в костном мозге, бластоза в периферической крови более 5%, с уровнем ЦКИ, равным 7%, проживет без прогрессирования заболевания более 35 месяцев, равна около 0,09. При отсутствии анеуплоидии, с наличием бластов в периферической крови, не превышающим 5% и показателем ЦКИ ≤5,8, вероятность прожить без прогрессирования составляла около 0.8.
Для каждого из факторов на основании критерия χ2 было сформировано пороговое значение признака, что позволило рассчитать беспрогрессивную и общую выживаемость по методу Каплана-Майера соответственно найденным пороговым значениям.
При оценке зависимости выживаемости от уровня ЦКИ выявлено статистически значимое увеличение общей и беспрогрессивной выживаемости пациентов с показателями G2M+S/G0-1≤5,8, p<0,05 (см. График 4 и 5).
Адекватным методом многомерного математико-статистического анализа и моделирования сложных медицинских систем, основной характеристикой состояния которых служит качественный (дихотомический) признак, является множественная логистическая регрессия.
Наиболее значимые факторы - предикторы (Xi) отбирались с соблюдением следующих условий:
1. Выбор предикторов должен основываться на соответствующих клинических данных;
2. Связь между результативным признаком (возникновение «отрицательного» события) и предикторами должна быть выше связи между предикторами;
3. Связь между предикторами должна быть не более 0.5, если эта связь превышала указанное значение, с целью предотвращения мультиколлинеарности эти факторы исключались и таким образом отбирались факторы - предикторы с меньшим коэффициентом корреляции между собой.
4. В модель включались количественно измеримые факторы и факторы, несущие качественный характер. Если фактор имел качественный характер, то ему присваивали количественную определенность (например, фактору «повышение лейкоцитов более 15×109/л» при его наличии присваивали значение «1», отсутствии - «0»).
Формулы для расчета риска наступления события:
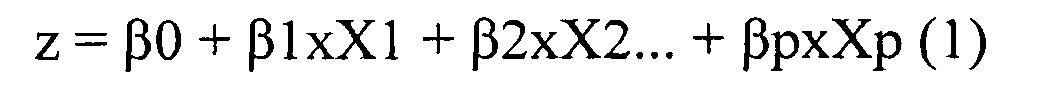
где β1, …, βp - коэффициенты, определяющие влияние на функцию риска; X1-Xn - предикторы, z - коэффициент регрессии.
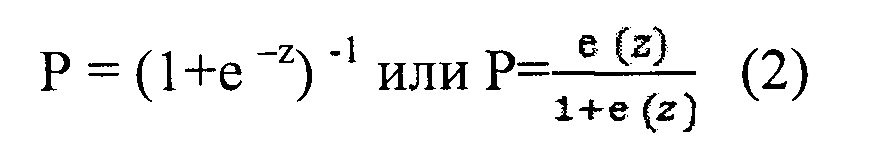
где Р - вероятность возникновения «отрицательного» события, принимающая значение в диапазоне от 0 до 1, е - основание натуральных логарифмов, е=2,72, z - коэффициент регрессии.
Оценивание каждого в отдельности и суммарного влияния отобранных предикторов на результативный признак производили с помощью метода максимального правдоподобия (Log-Likelihood). Сравнение правдоподобия L0 нулевой модели (Log-Likelihood of Null model), где все параметры наклона равны нулю, с правдоподобием L1 разработанной модели (Log-Likelihood of final solution) выполнялось с использованием статистики хи-квадрат (χ2).
Если р-уровень, соответствующий значению χ2, являлся значимым (р<0,05), то считали параметры регрессии статистически значимыми.
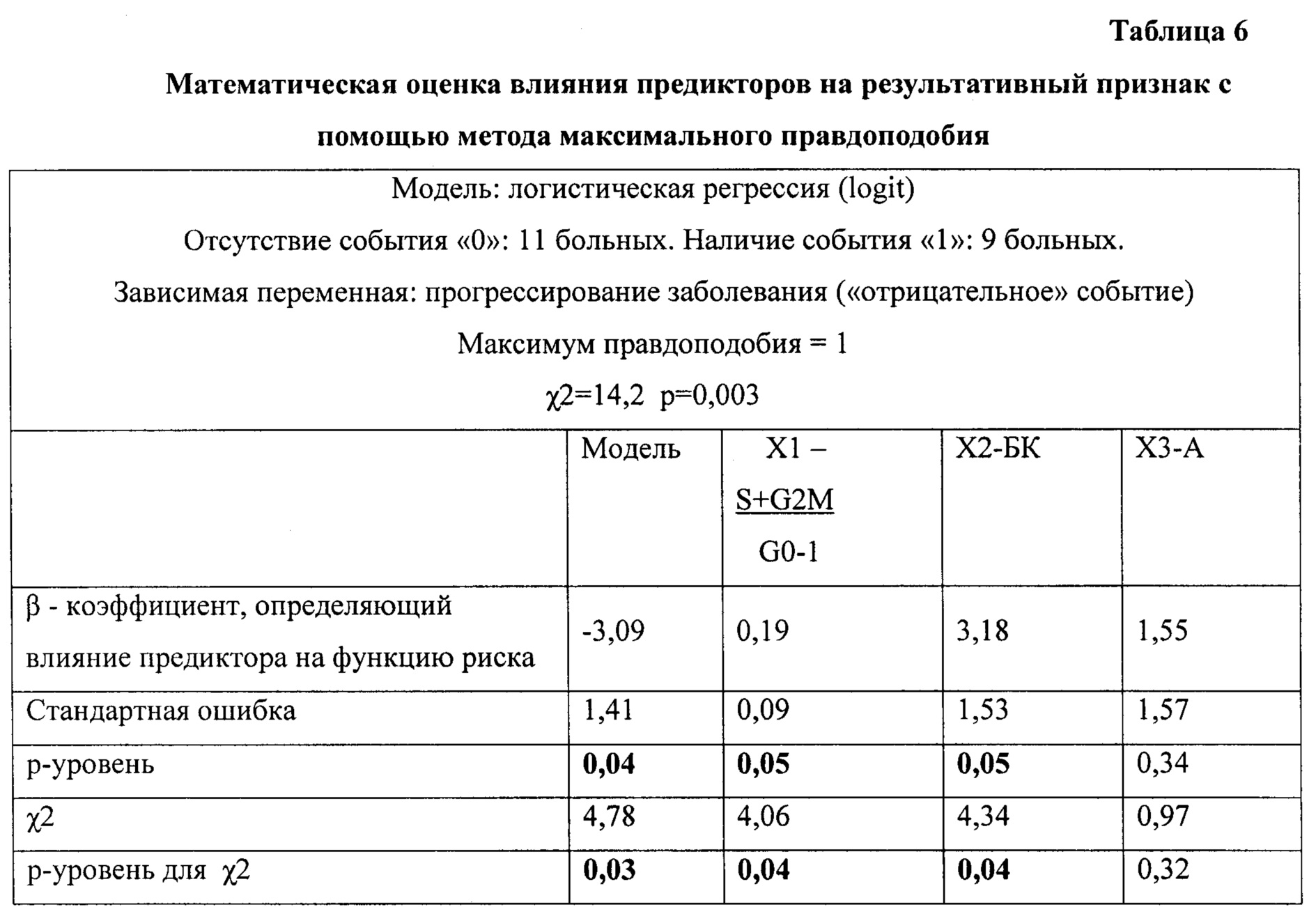
Был создан алгоритм прогнозирования риска прогрессирования первичных В-клеточных неходжкинских лимфом с поражением костного мозга (см. Таблица 6):
Z=-3,09 + 0,19×ЦКИ + 3,18×БК + 1,55×А
P=(1+2,72-(-3,09 + 0,19×ЦКИ + 3,18×БК + 1,55×А))-1
где ЦКИ - цитоцинетический индекс (S+G2M/G0-1); БК - значение, присвоенное в зависимости от процента бластных клеток в периферической крови (0<5%<1); А - анеуплоидия (1 - наличие, 0 - отсутствие клона в костном мозге).
Оценку точности, чувствительности и специфичности алгоритма оценивали с помощью ROC-анализа (Receiver Operator Characteristic). В нашем случае точность прогностического алгоритма составил 85% (см. Таблица 7). Чувствительность равна 89%, специфичность - 82%.

Для расчета риска прогрессирования первичных В-клеточных неходжкинских лимфом с поражением костного мозга индивидуальные значения факторов, входящих в алгоритм (ЦКИ - цитокинетический индекс (S+G2M/G0-1); БК - процент бластных клеток в периферической крови (0<5%<1); А - анеуплоидия) необходимо подставить в формулу модели (1 и 2) и определить вероятность:
Р<0,6 соответствует низкому риску прогрессирования первичных В-клеточных неходжкинских лимфом
0,6≤Р≤0,7 - средний риск прогрессирования первичных В-клеточных неходжкинских лимфом
Р>0,7 определяется высокий риск прогрессирования первичных В-клеточных неходжкинских лимфом.
При определении высокого риска прогрессирования заболевания (Р>0,7) пациент нуждался в интенсификации терапии первой линии.
Обращает на себя внимание высокая специфичность, чувствительность и диагностическая точность вышеперечисленных признаков, что соответствует целесообразности применения их результатов для пациентов, находящихся на обследовании и лечении в стационарах онкологического и/или онкогематологического профиля с целью планирования тактики ведения и мониторинга ремиссии. Применение данного алгоритма позволяет использовать показатели ДНК-плоидности и кинетики мононуклеаров костного мозга как дополнительные точные критерии прогноза риска прогрессирования опухолевого процесса. Таким образом, заявляемое изобретение соответствует критерию «изобретательский уровень».
В доступных источниках информации России и зарубежных стран не обнаружено аналогичного предлагаемому способу прогнозирования риска прогрессирования первичных В-клеточных неходжкинских лимфом с поражением костного мозга.
Приводим клинические примеры применения способа.
Клинический пример 1.
Больная X., 58 лет, проходила обследование и лечение в отделении гематологии с диагнозом: Диффузная В-крупноклеточная лимфома с поражением периферических лимфоузлов всех групп, внутригрудных лимфоузлов, забрюшинных лимфоузлов, костного мозга. Стадия IV В. Кл. гр. 2. ГА: Неходжкинская лимфома, необходимо ИГХ.
ИГХ от 01.02.2011 - диффузная В-крупноклеточная лимфома, негерминогенный вариант (MuM1+/BCL-6-). Больная прошла общеклиническое обследование, включающее все общепринятые методы диагностики онкогематологических заболеваний. Миелограмма от 01.02.11: материал беден клеточными элементами, нормальные ростки кроветворения угнетены, обнаружено до 14,0% НБК, повышено количество лимфоцитов до 19,4%. До лечения больная обследована по предлагаемой методике. При исследовании гистограмм костного мозга и периферической крови больной выявлено наличие анеуплоидии, которая составила 48,60%, количество клеток в G1 фазе составило 99,35%, G2M фазе - 0,28%, S фазе - 0,37%, ЦКИ=0,7. В периферической крови содержание бластных клеток 7%. Согласно формуле
Р=(1+2,72-(-3,09 + 0,19×0,7 + 3,18×1 + 1,55×1))-1=(1+2,72-1,8)-1=(1+0,2)-1=0,83
Р=0,83. Установлен высокий риск прогрессирования заболевания. С февраля 2011 года больной проведено 6 курсов полихимиотерапии в стандартном режиме, препаратами доксорубицин, циклофосфамид, винкристин, преднизолон. Достигнута стабилизация процесса, однако с июня 2011 года отмечается прогрессирующее течение заболевания.
Клинический пример 2.
Больная Ю., 55 лет, проходила обследование и лечение в отделении гематологии ФГБУ «РНИОИ Минздравсоцразвития РФ» с диагнозом: диффузная В-крупноклеточная лимфома CD20+ с поражением периферических лимфоузлов (шейно-надключичных, подчелюстных с 2-х сторон), в/грудных л/у, щитовидной железы, костного мозга. Стадия 4В. Кл. гр 2. Г.А. - диффузная пролимфоцитарная неходжкинская лимфома.
ИГХ - Морфоиммуногистохимическая картина соответствует диффузной В-крупноклеточной лимфоме (СД 20+). Больная обследована. Миелограмма от 01.02.2011 г: костномозговой пунктат беден клеточными элементами, эритроидный росток резко сужен, в гранулоцитарном ростке преобладают зрелые формы, лимфоциты 20,4%, НБК не определяются. До лечения больная обследована по предлагаемой методике. При исследовании гистограмм костного мозга больной выявлено отсутствие анеуплоидии, количество клеток в G1 фазе составило 99,05%, G2M фазе - 0,41%, S фазе - 0,54%, ЦКИ=0,96. В периферической крови содержание бластных клеток 0%. Согласно формуле
P=(1+2,72-(-3,09 + 0,19×0,96 + 3,18×0 + 1,55×0))-1=(1+2,72-(-2,9))-1=0,5
Р=0,5. Установлен низкий риск прогрессирования заболевания. Проведено 6 курсов химиотерапии препаратами доксорубицин, циклофосфамид, винкристин, этопозид, преднизолон. Достигнута ремиссия. Больная находится под наблюдением, признаков активации процесса не выявлено.
Данным способом был рассчитан прогноз для 20 больных первичными В-клеточными неходжкинскими лимфомами с поражением костного мозга.
Технико-экономическая эффективность способа заключается в том, что на основе методов логистической регрессии разработан прогностический алгоритм расчета риска прогрессирования заболевания у больных В-клеточными неходжкинскими лимфомами с поражением костного мозга по данным плоидности и кинетики клеточного цикла мононуклеаров костного мозга, а так же по содержанию бластных клеток в периферической крови, что, в свою очередь, позволяет упростить и ускорить прогнозирование риска прогрессирования заболевания.
Заявленное изобретение является промышленно применимым, так как может быть многократно повторено и использовано при прогнозировании риска прогрессирования первичных В-клеточных неходжкинских лимфом с поражением костного мозга и воспроизведено в различных лечебно-профилактических, научных, медицинских учреждениях в онкологии.
Способ прогнозирования риска прогрессирования первичных В-клеточных неходжкинских лимфом с поражением костного мозга, включающий исследование плоидности и кинетики клеточного цикла методом проточной цитометрии, а также определение процентного содержания бластных клеток в гемограмме, отличающийся тем, что на этапе планирования тактики терапии больному проводят ДНК-цитометрию костного мозга с определением цитокинетического индекса, определением плоидности и процентного содержания бластных клеток в периферической крови, затем рассчитывают риск прогрессирования первичных В-клеточных неходжкинских лимфом с поражением костного мозга по формуле Р=(1+2,72), где P - вероятность возникновения прогрессирования заболевания, принимающая значение в диапазоне от 0 до 1; ЦКИ - цитокинетический индекс S+G2M/G0-1; БК составляет «1» при повышении процента бластных клеток в периферической крови более 5,0%, БК составляет «0» при проценте бластных клеток в периферической крови менее 5,0%; А - анеуплоидия «1» - наличие, «0» - отсутствие клона в костном мозге, при Р<0,6 прогнозируют низкий риск прогрессирования первичных В-клеточных неходжкинских лимфом с поражением костного мозга, при 0,6≤Р≤0,7 прогнозируют средний риск прогрессирования, при Р>0,7 прогнозируют высокий риск прогрессирования первичных В-клеточных неходжкинских лимфом.