Результат интеллектуальной деятельности: Хиральные монотерпеновые сульфинамиды
Вид РИД
Изобретение
Изобретение относится к синтезу новых терпеновых сульфинамидов карановой, ментановой и пинановой структур, как содержащих гидроксогруппу, так и без гидроксогруппы, которые могут быть использованы в органическом асимметрическом синтезе, фармацевтической промышленности, в качестве хиральных индукторов для получения широкого спектра лекарственных препаратов.
Ценные органические синтоны биологически активных веществ, такие как: α- и β-аминокислоты, α-аминоальдегиды и кетоны, β-аминокетоны, α-аминофосфонаты, азиридин-2-карбоксилаты, азиридин-2-фосфонаты, син- и анти-1,2- или 1,3-аминоспирты, α-замещенные и α,α-дизамещенные амины - получают в настоящее время с использованием: (1) энантиомерно чистого трет-бутансульфинамида Эллмана [Robak, М.Т.; Herbage, М.A.; Ellman, J.A. Synthesis and Applications of tert-Butanesulfinamide. Chemical Reviews 2010, 110 (6), 3600-3740; Ellman, J.A.; Owens, T.D.; Tang, T.P. N-Tert-Butanesulfinyl Imines: Versatile Intermediates for the Asymmetric Synthesis of Amines. Accounts of Chemical Research 2002, 35 (11), 984-995] либо (2) n-толуолсульфинамида Девиса [Davis, F.A. Adventures in Sulfur-Nitrogen Chemistry. The Journal of Organic Chemistry 2006, 71 (24), 8993-9003; Zhou, P.; Chen, B.-C.; Davis, F.A. Recent Advances in Asymmetric Reactions Using Sulfinimines (N-Sulfinyl Imines). Tetrahedron 2004, 60 (37), 8003-8030; Fanelli, D.L.; Szewczyk, J.M.; Zhang, Y.; Reddy, G.V.; Burns, D.M.; Davis, F.A. Sulfinimines (thiooximine s-oxides): asymmetric synthesis of methyl (R)-(+)-β-phenylalanate from (S)-(+)-N-(benzylidene)-p-toluenesulfinamide. Organic Syntheses 2000, 77, 50]. В литературе также встречается несколько примеров использования монотерпеновых сульфинамидов, применяемых в качестве интермедиатов в асимметрическом синтезе [ , R. Facile Synthesis of Homochiral Derivatives of 10-Bornane Sulfonates, Sulfinamides and Sulfinimines. Tetrahedron: Asymmetry 1999, 10 (21), 4183-4190,
, R. Facile Synthesis of Homochiral Derivatives of 10-Bornane Sulfonates, Sulfinamides and Sulfinimines. Tetrahedron: Asymmetry 1999, 10 (21), 4183-4190,  , R. New, Recoverable and Highly Effective Sulfinyl Chiral Auxiliary. Tetrahedron: Asymmetry 2003, 14 (18), 2827-2832].
, R. New, Recoverable and Highly Effective Sulfinyl Chiral Auxiliary. Tetrahedron: Asymmetry 2003, 14 (18), 2827-2832].
Известный хиральный индуктор трет-бутансульфинамид был получен Дж. А. Эллманом, 1997 [Liu, G.; Cogan, D.A.; Ellman, J.A. Catalytic Asymmetric Synthesis of tert-Butanesulfinamide. Application to the Asymmetric Synthesis of Amines. Journal of the American Chemical Society 1997, 119 (41), 9913-9914], путем асимметрического окисления ди-трет-бутилдисульфида перекисью водорода с использованием каталитической системы Больма VO(acac)2-H2O2-L*, с использованием лигандов саленовых оснований Шиффа на основе трет-лейцинола и цис-1-амино-2-инданола до тиосульфинатов с ее 86-88%, с последующим добавлением амида лития при температуре -78°С. Реакция проходит с изменением конфигурации на атоме серы, образуются трет-бутансульфинамиды с ее до 90%, последующая двукратная кристаллизация дает продукт с 98-99% ее. Недостатком этого способа является сложность и емкость процесса, использование нескольких стадий и дорогостоящих хиральных лигандов.
Другими широко используемыми сульфинамидами, применяемыми как синтоны в асимметрическом синтезе, являются обе энантиомерные формы n-толуолсульфинамидов, которые получаются по реакции ментил-n-толуолсульфинатов с бис(триметилсилил)амидом лития (LiHMDS). После выделения и кристаллизации образуются n-толуолсульфинамиды с ее больше 99%. Метод требует инертной атмосферы проведения, сухих растворителей, пониженных температур, дорогостоящих ментил-n-толуолсульфинатов и LiHMDS [Fanelli, D.L.; Szewczyk, J.M.; Zhang, Y.; Reddy, G.V.; Burns, D.M.; Davis, F.A. Sulfinimines (thiooximine S-oxides): asymmetric synthesis of methyl (R)-(+)-β-phenylalanate from (S)-(+)-N-(benzylidene)-p-toluenesulfinamide. Organic Syntheses 2000, 77, 50].
Терпены представляют интерес как источники хиральности, поскольку природные монотерпены доступны в высокой энантиомерной чистоте.
Известны терпеновые сульфинамиды борнановой структуры, полученные из камфорсульфинил хлорида восстановлением сульфитом натрия и боргидридом натрия до неустойчивой сульфиновой кислоты, которая циклизуется до диастереомерных сультинов, которые эпимеризуются в кислой среде до одного из диастереомеров с псевдоаксиальным расположением сульфинильной группы [ , R. Facile Synthesis of Homochiral Derivatives of 10-Bornane Sulfinates, Sulfinamides and Sulfinimines. Tetrahedron: Asymmetry 1999, 10 (21), 4183-4190]. Взаимодействие сультина с амидом лития в жидком аммиаке или с LiHMDS приводит к образованию 10-изоборнилсульфинамида. В этом же источнике оба диастереомерных сульфинамида получают восстановлением камфорсульфинил хлорида в присутствии соляной кислоты до 10-камфорсульфинил хлорида, который после обработки аммиаком приводит к диастереомерным 10-камфорсульфинил амидам, выделяемым методом кристаллизации. Восстановление последних борогидридом натрия приводит к образованию 10-изоборнилсульфинамидов. Недостатком является многостадийность получения.
, R. Facile Synthesis of Homochiral Derivatives of 10-Bornane Sulfinates, Sulfinamides and Sulfinimines. Tetrahedron: Asymmetry 1999, 10 (21), 4183-4190]. Взаимодействие сультина с амидом лития в жидком аммиаке или с LiHMDS приводит к образованию 10-изоборнилсульфинамида. В этом же источнике оба диастереомерных сульфинамида получают восстановлением камфорсульфинил хлорида в присутствии соляной кислоты до 10-камфорсульфинил хлорида, который после обработки аммиаком приводит к диастереомерным 10-камфорсульфинил амидам, выделяемым методом кристаллизации. Восстановление последних борогидридом натрия приводит к образованию 10-изоборнилсульфинамидов. Недостатком является многостадийность получения.
Известны сульфинамиды ментановой структуры, полученные из циклического 10-ментилсульфината взаимодействием с амидом лития в жидком аммиаке [ , R. New, Recoverable and Highly Effective Sulfinyl Chiral Auxiliary. Tetrahedron: Asymmetry 2003, 14 (18), 2827-2832]. Этот способ получения 10-ментилсульфинамидов отличает многостадийность и предварительный синтез промежуточных соединений с многочисленными кристаллизациями и низкими выходами. Недостатком является многостадийность получения.
, R. New, Recoverable and Highly Effective Sulfinyl Chiral Auxiliary. Tetrahedron: Asymmetry 2003, 14 (18), 2827-2832]. Этот способ получения 10-ментилсульфинамидов отличает многостадийность и предварительный синтез промежуточных соединений с многочисленными кристаллизациями и низкими выходами. Недостатком является многостадийность получения.
Наиболее близким аналогом являются диастереомерные неоментансульфинамиды [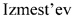 , Е.S.; Sudarikov, D.V.; Rubtsova, S.А.; Slepukhin, P.A.; Kuchin, A.V. Asymmetric Synthesis of New Optically Active Sulfinamides of Menthane Series and Their Derivatives. Russian Journal of Organic Chemistry 2012, 48 (2), 184-192], полученные амидированием соответствующих тиосульфинатов. Недостатком является многостадийность получения.
, Е.S.; Sudarikov, D.V.; Rubtsova, S.А.; Slepukhin, P.A.; Kuchin, A.V. Asymmetric Synthesis of New Optically Active Sulfinamides of Menthane Series and Their Derivatives. Russian Journal of Organic Chemistry 2012, 48 (2), 184-192], полученные амидированием соответствующих тиосульфинатов. Недостатком является многостадийность получения.
Технический результат состоит в получении новых ранее неизвестных хиральных монотерпеновых сульфинамидов, расширяющих арсенал соединений, применяемых в органическом асимметрическом синтезе, фармацевтической промышленности, в качестве хиральных индукторов для получения широкого спектра лекарственных препаратов.
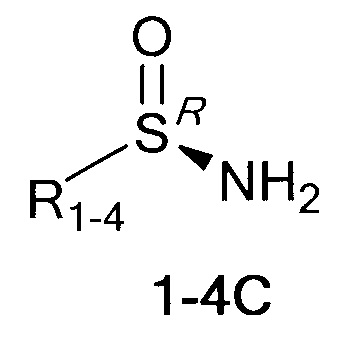
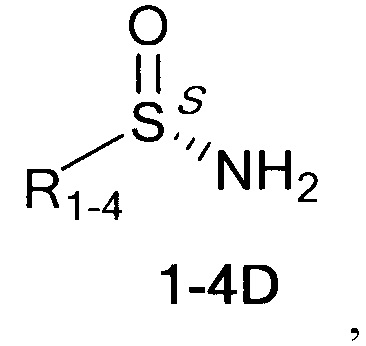
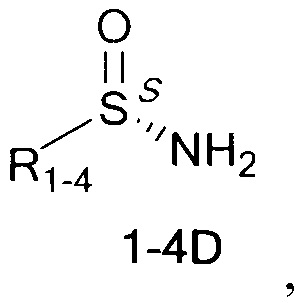
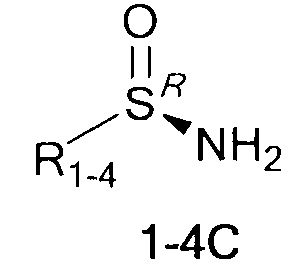
Технический результат достигается тем, что хиральные монотерпеновые сульфинамиды получены в виде новых индивидуальных диастереомеров с общей формулой С или D
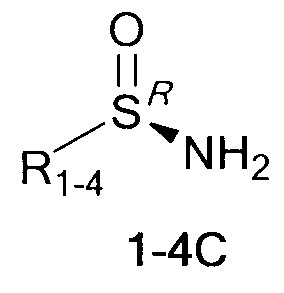
 ,
,
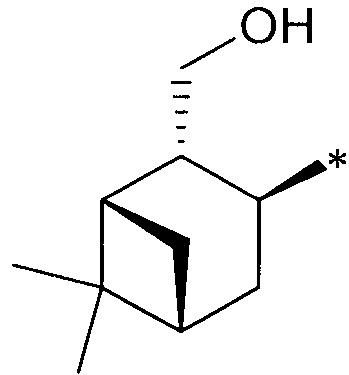
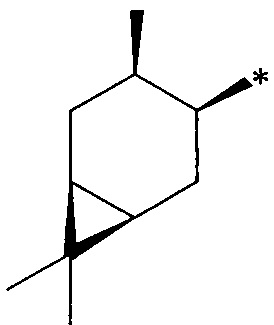
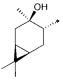
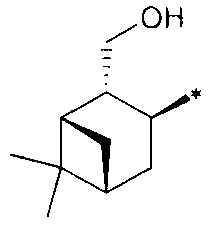
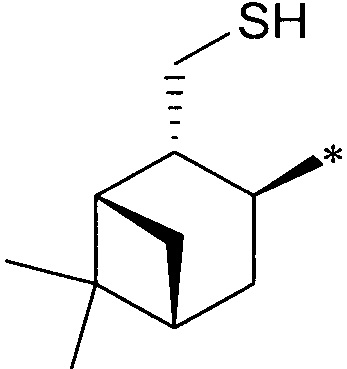
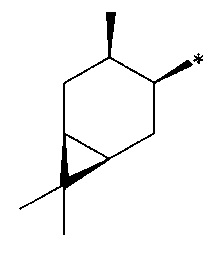
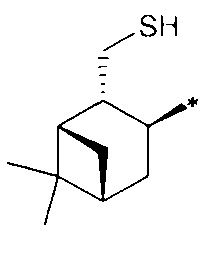
где R1 - радикал 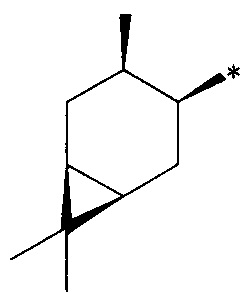 ; R2 - радикал
; R2 - радикал 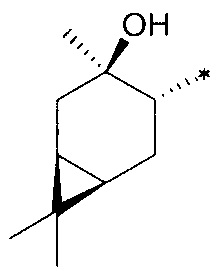 ;
;
R3 - радикал 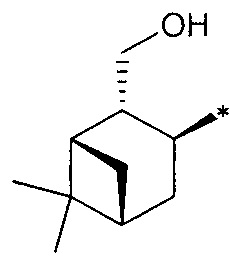 ; R4 - радикал
; R4 - радикал 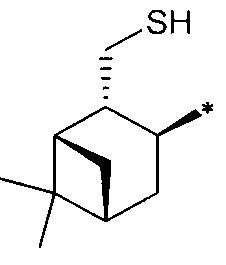 ,
,
где (*) звездочкой обозначена связь, через которую осуществляется присоединение к сульфинамидной группе формулы (С) и (D).
Группа соединений представлена как:
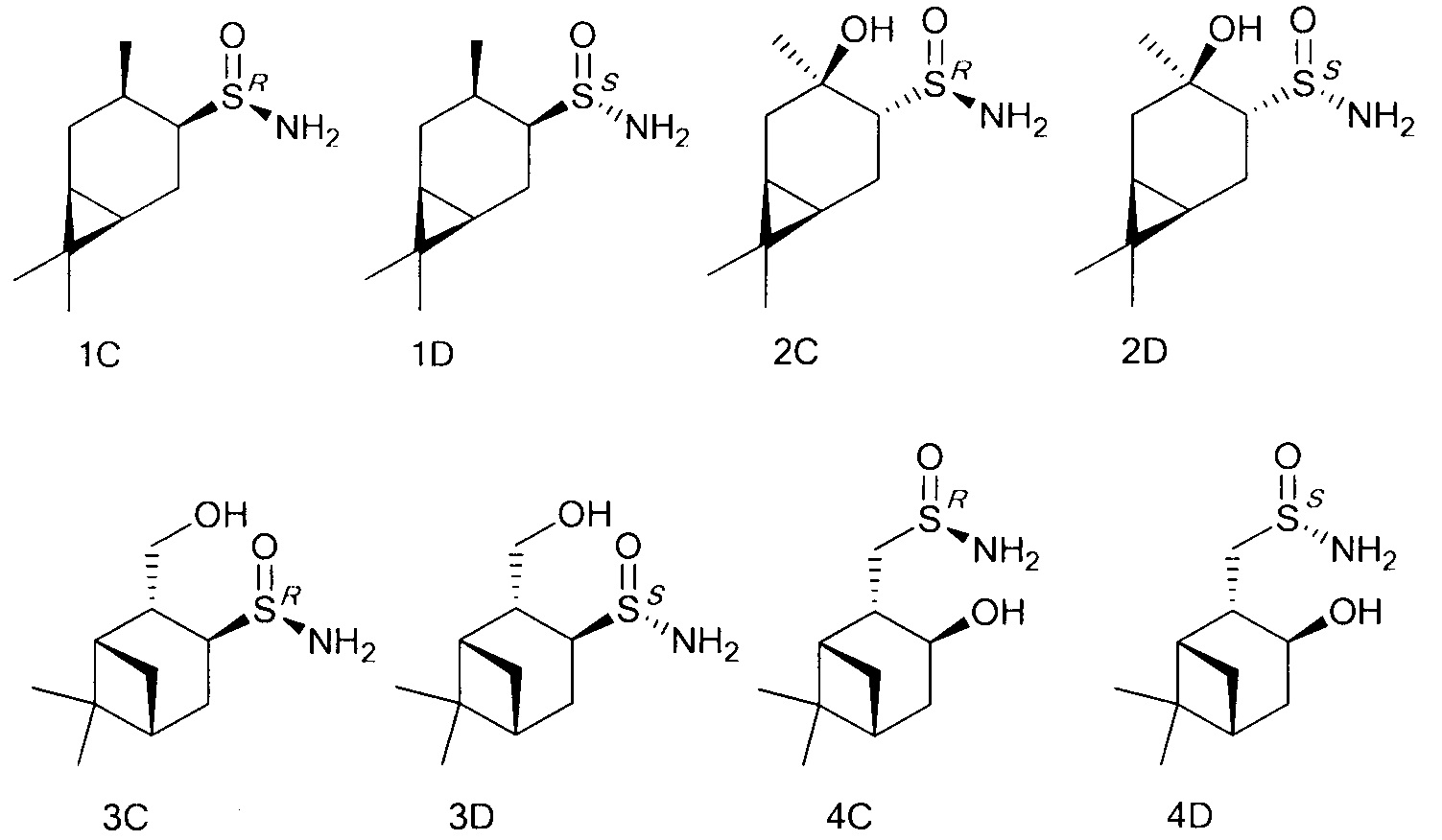
Являясь удобными прекурсорами для различных асимметрических органических синтезов, а также ключевыми соединениями для синтеза сульфиниминов, аминов и аминокислот, которые присутствуют в большинстве препаратов и лекарственных средств, терпеновые сульфинамиды становятся более доступными и открытыми к производству новых фармацевтических агентов.
Способ осуществляется следующим образом.
В U-образную трубку, охлажденную на ацетоновой бане до -35 - -75°С сконденсировали 5-20 мл сухого жидкого аммиака. Поддерживая температуру бани, осторожно добавили NCS (1.1 ммоль), перемешивали 5 минут, затем прибавили тиол (1 ммоль) в 5 мл CH2Cl2. Продолжали перемешивание в течение 1 ч, поддерживая температуру -65°. После этого прикапали m-СРВА (1.1 ммоль) в 5 мл CH2Cl2, постепенно поднимая температуру до комнатной и добавляя CH2Cl2 (10-50 мл). Перемешивали 12 ч до окончания реакции, ход реакции контролировали методом ТСХ. Далее реакционную смесь фильтровали на фильтре Шотта, промывали CH2Cl2, фильтрат промывали насыщенным раствором NaCl и сушили над Na2SO4, затем фильтровали и отгоняли.
Таким образом, для заявленного способа в том виде, в каком он охарактеризован в описании, подтверждена возможность его осуществления в одну стадию.
Для подбора оптимальных условий реакции варьировали такие параметры, как температура охлаждающей ацетоновой бани, объем сухого жидкого аммиака, объем добавляемого CH2Cl2, используемого в качестве растворителя. Было замечено, что при более высоких температурах идет большее образование побочных продуктов. Более низкие температуры увеличивают выход, как промежуточного продукта - сульфенамида, так и конечного - сульфинамида. Варьирование объемов сухого жидкого аммиака и CH2Cl2 дало более приемлемые условия для проведения реакции (в частности, нормальное перемешивание в реакционной колбе, обеспечение гомогенности при выпадении осадка).
Описываемый способ демонстрируется следующими примерами.
Пример 1.
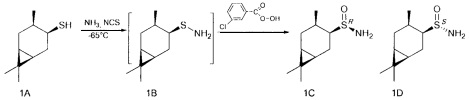
В U-образную трубку, охлажденную на ацетоновой бане до -35 - -75°С, сконденсировали 5-20 мл сухого жидкого аммиака. Поддерживая температуру бани, осторожно добавили NCS (0.147 г, 1.1 ммоль), перемешивали 5 минут, затем прибавили тиол (0.170 г, 1 ммоль) в 4 мл CH2Cl2. Продолжали перемешивание в течение 1 ч, поддерживая температуру -65°. После этого по каплям добавили m-СРВА (0.229 г (75%), 1 ммоль) в 10 мл CH2Cl2, постепенно поднимая температуру до комнатной и добавляя CH2Cl2 (10-50 мл). Перемешивали 12 ч до окончания реакции, ход реакции контролировали методом ТСХ. Далее реакционную смесь фильтровали на фильтре Шотта, промывали CH2Cl2, фильтрат промывали насыщенным раствором NaCl и сушили над Na2SO4, затем фильтровали и отгоняли. Остаток разделяли методом колоночной хроматографии на силикагеле, используя элюенты: петролейный эфир:этилацетат, 2:1; этилацетат.
(RS,1R,3S,4R,6S)-4,7,7-триметилбицикло[4.1.0]гептан-3-сульфинамид (1С), мажорный диастереомер. Общий выход диастереомеров 64%; de 12%; желтоват. порошок.; т.пл. 96.6°С, 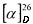 +60.6° (с 1.0, CHCl3); Rƒ 0.191 (EtOAc). ИК-спектр (KBr, ν, см-1): 1001 (S=O), 3238 (NH2). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.56-0.70 (2Н, м, Н-6, Н-1), 0.81-0.93 (1Н, м, Н-2α), 1.01 (6Н, с, СН3-8, CH3-9), 1.11 (3Н, д, J=7.2, СН3-10), 1.38 (1H, ддд, J=14.0, 11.6, 7.4, Н-5α), 1.38 (1H, дт, J=14.3, 7.2, Н-2β), 2.01-2.18 (2Н, м, Н-3, Н-5β), 2.64 (1Н, дт, J=11.1, 7.1, Н-4), 4.11 (2H, уш.с, NH2). Спектр ЯМР 13С (75 МГц, CDCl3, δ, м.д.): 13.5 (С-5), 15.2 (С-9), 17.9 (С-10), 18.5 (С-7), 19.8 (С-6), 21.1 (С-1), 26.1 (С-2), 28.3 (С-8), 38.7 (С-3), 63.4 (С-4).
+60.6° (с 1.0, CHCl3); Rƒ 0.191 (EtOAc). ИК-спектр (KBr, ν, см-1): 1001 (S=O), 3238 (NH2). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.56-0.70 (2Н, м, Н-6, Н-1), 0.81-0.93 (1Н, м, Н-2α), 1.01 (6Н, с, СН3-8, CH3-9), 1.11 (3Н, д, J=7.2, СН3-10), 1.38 (1H, ддд, J=14.0, 11.6, 7.4, Н-5α), 1.38 (1H, дт, J=14.3, 7.2, Н-2β), 2.01-2.18 (2Н, м, Н-3, Н-5β), 2.64 (1Н, дт, J=11.1, 7.1, Н-4), 4.11 (2H, уш.с, NH2). Спектр ЯМР 13С (75 МГц, CDCl3, δ, м.д.): 13.5 (С-5), 15.2 (С-9), 17.9 (С-10), 18.5 (С-7), 19.8 (С-6), 21.1 (С-1), 26.1 (С-2), 28.3 (С-8), 38.7 (С-3), 63.4 (С-4).
(SS,1R,3S,4R,6S)-4,7,7-триметилбицикло[4.1.0]гептан-3-сульфинамид (1D), минорный диастереомер. Общий выход диастереомеров 64%; de 12%; бежев. порошок.; т.пл. 131.5°С, 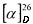 -48.3° (с 1.0, CHCl3); Rƒ 0.122 (EtOAc). ИК-спектр (KBr, ν, см-1): 997 (S=O), 3242 (NH2). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.54 (1Н, тд, J=8.9, 6.3, Н-6), 0.76 (1Н, т, J=8.8, Н-1), 0.84-1.05 (2Н, м, Н-2α, Н-5α), 0.96 (3Н, с, СН3-9), 1.00 (3Н, с, СН3-9), 1.09 (3Н, д, J=7.2, СН3-10), 2.05-2.17 (2Н, м, Н-2β, Н-5β), 2.32 (1Н, дк, J=14.6, 7.2, Н-3), 2.62 (1Н, ддд, J=12.5, 7.3, 3.9, H-4), 4.18 (2H, уш.с, NH2). Спектр ЯМР 13С (75 МГц, CDCl3, δ, м.д.): 15.4 (С-9), 16.3 (С-5), 17.4 (С-10), 18.1 (С-7), 19.2 (С-6), 22.4 (С-1), 26.0 (С-3), 26.4 (С-2), 28.4 (С-8), 66.7 (С-4).
-48.3° (с 1.0, CHCl3); Rƒ 0.122 (EtOAc). ИК-спектр (KBr, ν, см-1): 997 (S=O), 3242 (NH2). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.54 (1Н, тд, J=8.9, 6.3, Н-6), 0.76 (1Н, т, J=8.8, Н-1), 0.84-1.05 (2Н, м, Н-2α, Н-5α), 0.96 (3Н, с, СН3-9), 1.00 (3Н, с, СН3-9), 1.09 (3Н, д, J=7.2, СН3-10), 2.05-2.17 (2Н, м, Н-2β, Н-5β), 2.32 (1Н, дк, J=14.6, 7.2, Н-3), 2.62 (1Н, ддд, J=12.5, 7.3, 3.9, H-4), 4.18 (2H, уш.с, NH2). Спектр ЯМР 13С (75 МГц, CDCl3, δ, м.д.): 15.4 (С-9), 16.3 (С-5), 17.4 (С-10), 18.1 (С-7), 19.2 (С-6), 22.4 (С-1), 26.0 (С-3), 26.4 (С-2), 28.4 (С-8), 66.7 (С-4).
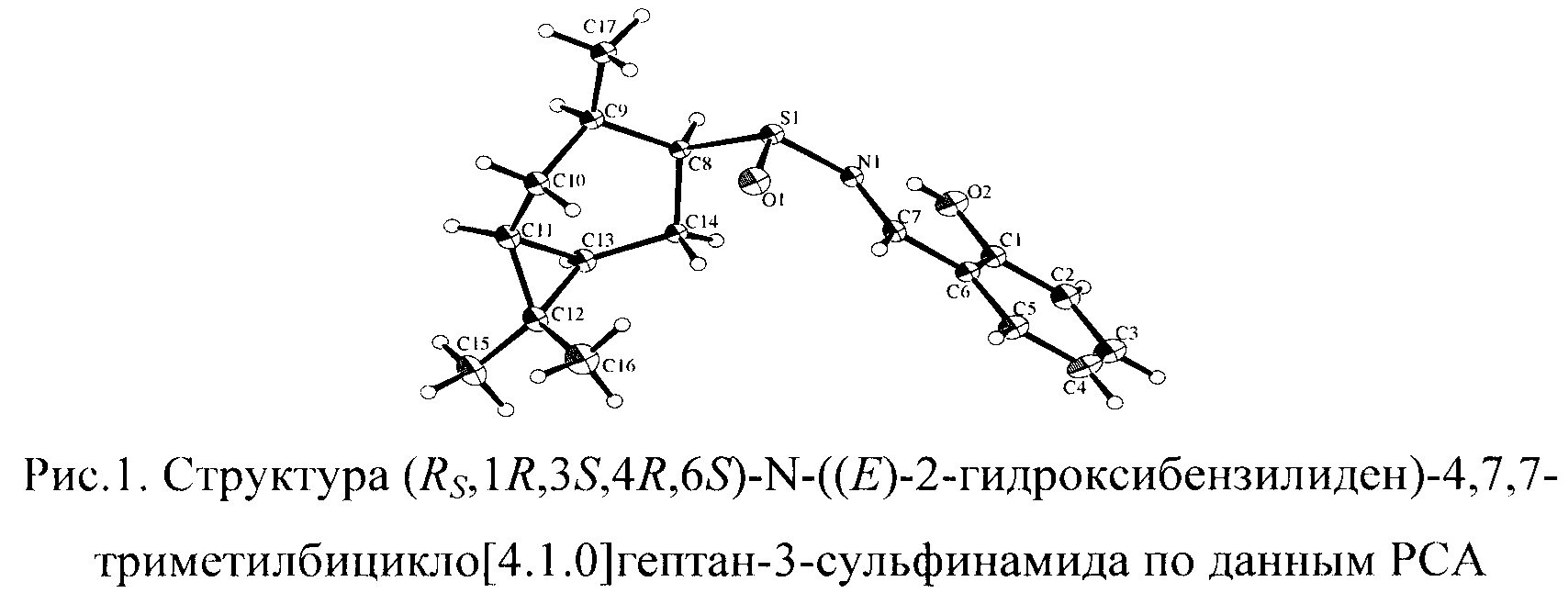
Абсолютную конфигурацию конфигурацию стереоцентров определяли исходя из рентгеноструктурных данных сульфинимина (рис. 1), полученного на основе (Rs,1R,3S,4R,6S)-4,7,7-триметилбицикло[4.1.0]гептан-3-сульфинамида 1С.
Пример 2.
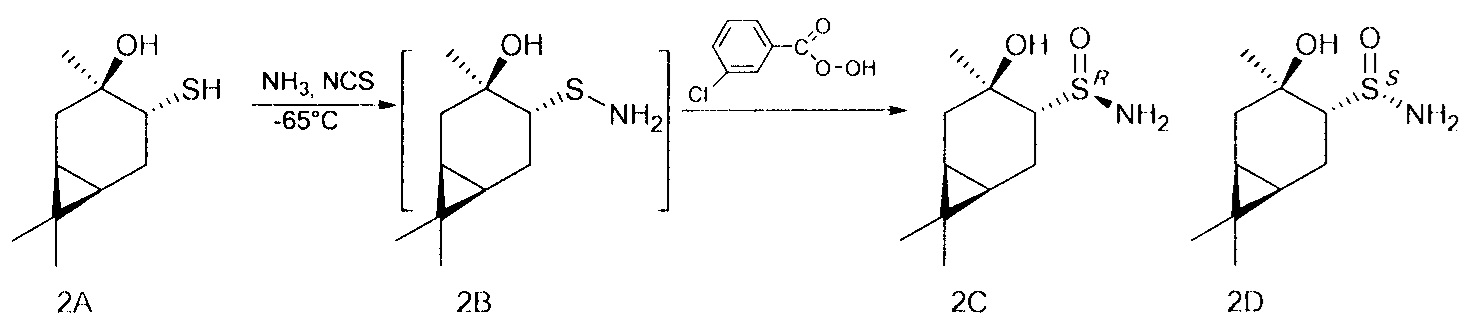
В U-образную трубку, охлажденную на ацетоновой бане до -35 - -75°С, сконденсировали 5-20 мл сухого жидкого аммиака. Поддерживая температуру бани, осторожно добавили NCS (0.147 г, 1.1 ммоль), перемешивали 5 минут, затем прибавили тиол (0.186 г, 1 ммоль) в 4 мл CH2Cl2. Продолжали перемешивание в течение 1 ч, поддерживая температуру -65°. После этого по каплям добавили m-СРВА (0.229 г (75%), 1 ммоль) в 10 мл CH2Cl2, постепенно поднимая температуру до комнатной и добавляя CH2Cl2 (10-50 мл). Перемешивали 12 ч до окончания реакции, ход реакции контролировали методом ТСХ. Далее реакционную смесь фильтровали на фильтре Шотта, промывали CH2Cl2, фильтрат промывали насыщенным раствором NaCl и сушили над Na2SO4, затем фильтровали и отгоняли. Твердый остаток разделяли методом колоночной хроматографии на силикагеле, используя элюент этилацетат.
(RS,1R,3R,4R,6S)-4-гидрокси-4,7,7-триметилбицикло[4.1.0]гептан-3-сульфинамид (2С), мажорный диастереомер. Общий выход диастереомеров 65%, de 30%, желт. кристаллы; т.пл. 139,1°С; 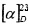 -40.9° (с 1.0, СНСl3); Rƒ 0.12 (EtOAc). ИК-спектр (KBr, ν, см-1): 3273 (ОН), 3224 (NH2), 1018 (S=O). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.62 (1Н, т, J=9.0, Н-6), 0.81 (1Н, тд, J=9.0, 5.6, Н-1), 0.96 (3Н, с, СН3-8), 1.01 (3Н, с, СН3-9), 1.26 (1Н, дд, J=14.7, 5.3, Н-2α), 1.45 (3Н, с, СН3-10), 1.74 (1Н, м, H-5α), 1.86-2.00 (2Н, м, Н-2β, Н-5β), 2.37 (1Н, дд, J=10.9, 8.5, Н-4), 4.36 (2Н, уш.с, NH2), 5.31 (1H, уш.с, ОН). Спектр ЯМР 13С (75 МГц, CDCl3, δ, м.д.): 15.5 (С-8), 18.0 (С-6), 18.0 (С-7), 19.5 (С-1), 20.4 (С-5), 23.0 (С-10), 28.2 (С-9), 35.0 (С-2), 68.4 (С-4), 71.8 (С-3).
-40.9° (с 1.0, СНСl3); Rƒ 0.12 (EtOAc). ИК-спектр (KBr, ν, см-1): 3273 (ОН), 3224 (NH2), 1018 (S=O). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.62 (1Н, т, J=9.0, Н-6), 0.81 (1Н, тд, J=9.0, 5.6, Н-1), 0.96 (3Н, с, СН3-8), 1.01 (3Н, с, СН3-9), 1.26 (1Н, дд, J=14.7, 5.3, Н-2α), 1.45 (3Н, с, СН3-10), 1.74 (1Н, м, H-5α), 1.86-2.00 (2Н, м, Н-2β, Н-5β), 2.37 (1Н, дд, J=10.9, 8.5, Н-4), 4.36 (2Н, уш.с, NH2), 5.31 (1H, уш.с, ОН). Спектр ЯМР 13С (75 МГц, CDCl3, δ, м.д.): 15.5 (С-8), 18.0 (С-6), 18.0 (С-7), 19.5 (С-1), 20.4 (С-5), 23.0 (С-10), 28.2 (С-9), 35.0 (С-2), 68.4 (С-4), 71.8 (С-3).
(SS,1R,3R,4R,6S)-4-гидрокси-4,7,7-триметилбицикло[4.1.0]гептан-3-сульфинамид (2D), минорный диастереомер. Общий выход диастереомеров 65%, de 30%, желт. кристаллы; Т.пл. 113,4°C; 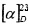 -97.5° (с 0.9, СНСl3); Rƒ 0.30 (EtOAc). ИК-спектр (KBr, ν, см-1): 3246 (ОН), 3225 (NH2), 1033 (S=O). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.70 (1H, т, J=9.0, Н-6), 0.81 (1H, тд, J=9.0, 5.6, Н-1), 0.97 (3Н, с, СН3-8), 1.02 (3Н, с, СН3-9), 1.24 (1H, дд, J=14.2, 5.0, Н-2α), 1.32 (3Н, с, СН3-10), 1.96 (1Н, дд, J=14.2, 9.0, Н-2β), 2.05 (1Н, дд, J=15.0, 8.2, Н-5α), 2.19 (1Н, ддд, J=15.0, 11.5, 8.2, Н-5β), 2.41 (1H, дд, J=11.5, 8.2, Н-4), 4.05 (1Н, уш.с, ОН), 4.57 (2Н, уш.с, NH2). Спектр ЯМР 13С (75 МГц, CDCl3, δ, м.д.): 15.4 (С-8), 18.0 (С-5), 18.0 (С-6), 18.1 (С-7), 19.9 (С-1), 23.0 (С-10), 28.4 (С-9), 36.0 (С-2), 69.4 (С-4), 71.1 (С-3).
-97.5° (с 0.9, СНСl3); Rƒ 0.30 (EtOAc). ИК-спектр (KBr, ν, см-1): 3246 (ОН), 3225 (NH2), 1033 (S=O). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.70 (1H, т, J=9.0, Н-6), 0.81 (1H, тд, J=9.0, 5.6, Н-1), 0.97 (3Н, с, СН3-8), 1.02 (3Н, с, СН3-9), 1.24 (1H, дд, J=14.2, 5.0, Н-2α), 1.32 (3Н, с, СН3-10), 1.96 (1Н, дд, J=14.2, 9.0, Н-2β), 2.05 (1Н, дд, J=15.0, 8.2, Н-5α), 2.19 (1Н, ддд, J=15.0, 11.5, 8.2, Н-5β), 2.41 (1H, дд, J=11.5, 8.2, Н-4), 4.05 (1Н, уш.с, ОН), 4.57 (2Н, уш.с, NH2). Спектр ЯМР 13С (75 МГц, CDCl3, δ, м.д.): 15.4 (С-8), 18.0 (С-5), 18.0 (С-6), 18.1 (С-7), 19.9 (С-1), 23.0 (С-10), 28.4 (С-9), 36.0 (С-2), 69.4 (С-4), 71.1 (С-3).
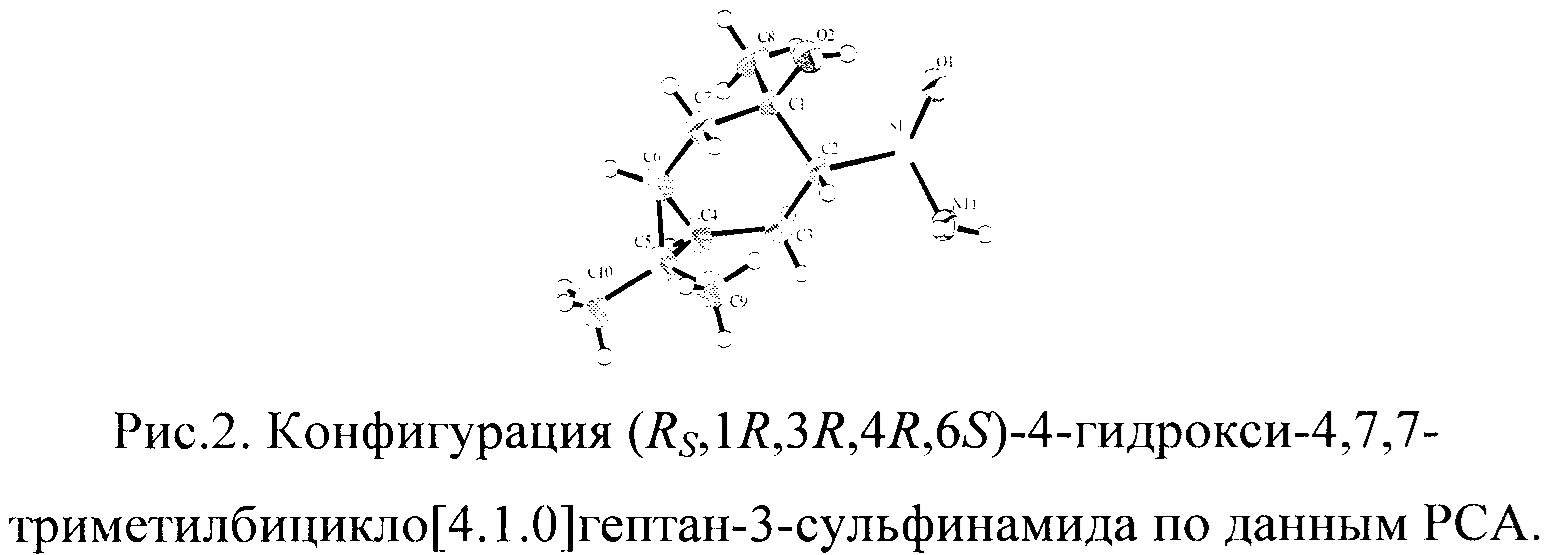
Конфигурация (RS,1R,3R,4R,6S)-4-гидрокси-4,7,7-триметилбицикло[4.1.0]гептан-3-сульфинамида 2С установлена методом РСА.
Пример 3.
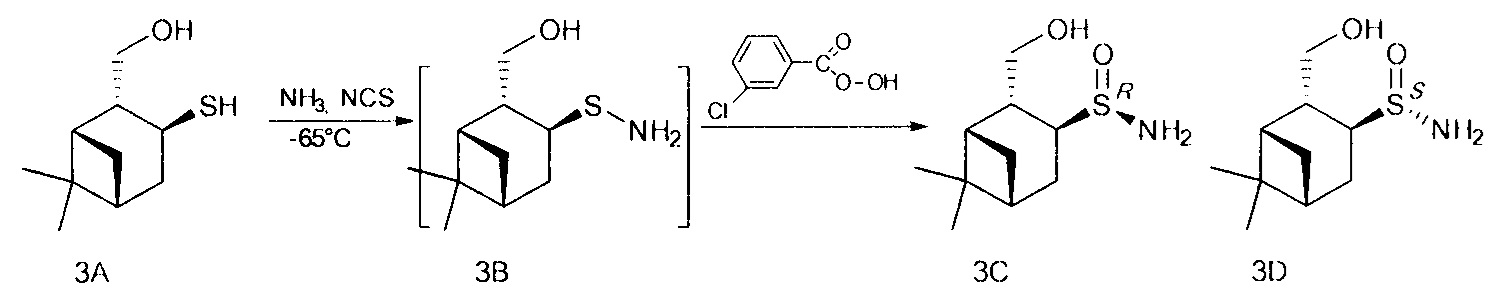
В U-образную трубку, охлажденную на ацетоновой бане до -35 - -75°С, сконденсировали 5-20 мл сухого жидкого аммиака. Поддерживая температуру бани, осторожно добавили NCS (0.147 г, 1.1 ммоль), перемешивали 5 минут, затем прибавили тиол (0.172 г, 1 ммоль) в 4 мл СН2Cl2. Продолжали перемешивание в течение 1 ч, поддерживая температуру -65°. После этого по каплям добавили m-СРВА (0.229 г (75%), 1 ммоль) в 10 мл CH2Cl2, постепенно поднимая температуру до комнатной и добавляя CH2Cl2 (10-50 мл). Перемешивали 12 ч до окончания реакции, ход реакции контролировали методом ТСХ. Далее реакционную смесь фильтровали на фильтре Шотта, промывали CH2Cl2, фильтрат промывали насыщенным раствором NaCl и сушили над Na2SO4, затем фильтровали и отгоняли. Твердый остаток разделяли методом колоночной хроматографии на силикагеле, используя элюент этилацетат.
(RS,1S,2R,3S,5R)-2-(гидроксиметил)-6,6-диметилбицикло[3.1.1]гептил-3-сульфинамид (3С), мажорный диастереомер. Общий выход диастереомеров 65%, de 51%, желтый порошок, т.пл. 143.3°С, Rf 0.14 (EtOAc:i-PrOH, 20:1), 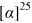 =+15.6 (с 0.9, CHCl3). 1Н ЯМР-спектр (CDCl3): δ 0.94 (д, 1Н, J=10.0 Hz, H-7ax), 0.96 (с, 3Н, Ме-8), 1.21 (с, 3Н, Ме-9), 1.93-2.02 (м, 3Н, Н-5, Н-1, Н-4ах), 2.29 (м, 1Н, H-4eq), 2.41 (дт, 1Н, J=10.9, 5.7 Hz, H-7eq), 2.67 (м, 1H, Н-2), 3.27 (дт, 1Н, J=10.1, 5.2 Hz, Н-3), 3.58-3.70 (м, 2Н, Н-10а, Н-10b), 4.20 (ш.с, 1Н, ОН), 4.47 (ш.с, 2H, NH2). 13С ЯМР-спектр (CDCl3): 23.3 (С-8), 26.0 (С-9), 29.0 (С-4), 31.8 (С-7), 38.6 (С-6), 40.7 (С-5), 43.5 (С-1), 44.5 (С-2), 59.4 (С-3), 65.9 (С-10). ИК-спектр (KBr) 1051 (S=O), 3254 (ОН) 3254 (NH2) см-1.
=+15.6 (с 0.9, CHCl3). 1Н ЯМР-спектр (CDCl3): δ 0.94 (д, 1Н, J=10.0 Hz, H-7ax), 0.96 (с, 3Н, Ме-8), 1.21 (с, 3Н, Ме-9), 1.93-2.02 (м, 3Н, Н-5, Н-1, Н-4ах), 2.29 (м, 1Н, H-4eq), 2.41 (дт, 1Н, J=10.9, 5.7 Hz, H-7eq), 2.67 (м, 1H, Н-2), 3.27 (дт, 1Н, J=10.1, 5.2 Hz, Н-3), 3.58-3.70 (м, 2Н, Н-10а, Н-10b), 4.20 (ш.с, 1Н, ОН), 4.47 (ш.с, 2H, NH2). 13С ЯМР-спектр (CDCl3): 23.3 (С-8), 26.0 (С-9), 29.0 (С-4), 31.8 (С-7), 38.6 (С-6), 40.7 (С-5), 43.5 (С-1), 44.5 (С-2), 59.4 (С-3), 65.9 (С-10). ИК-спектр (KBr) 1051 (S=O), 3254 (ОН) 3254 (NH2) см-1.
(SS,1S,2R,3S,5R)-2-(гидроксиметил)-6,6-диметилбицикло[3.1.1]гептил-3-сульфинамид (3D), минорный диастереомер. Общий выход диастереомеров 65%, de 51%, желт. масл. жидк., Rf 0.12 (EtOAc:i-PrOH, 20:1), 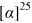 =+12.1 (с 1.9, СНСl3). 1Н ЯМР-спектр (CDCl3): δ 0.95 (с, 3Н, Ме-8), 1.06 (д, 1Н, J=10.0 Hz, Н-7ах), 1.22 (с, 3Н, Ме-9), 1.97-2.06 (м, 2Н, Н-5, Н-1), 2.15-2.26 (м, 2Н, H-4eq, Н-4ах), 2.31-2.46 (м, 2Н, H-7eq, Н-2), 3.21 (дт, 1Н, J=9.4, 6.2 Hz, Н-3), 3.54-3.73 (м, 2Н, Н-10a, Н-10b), 3.96 (ш.с, 1Н, ОН), 4.52 (ш.с, 2Н, NH2). 13С ЯМР-спектр (CDCl3): 23.2 (С-8), 26.0 (С-4), 27.1 (С-9), 30.7 (С-7), 38.8 (С-6), 40.3 (С-5), 43.2 (С-1), 44.3 (С-2), 58.3 (С-3), 66.2 (С-10). ИК-спектр (KBr) 1045 (S=O), 3244 (ОН) 3325 (NH2) см-1.
=+12.1 (с 1.9, СНСl3). 1Н ЯМР-спектр (CDCl3): δ 0.95 (с, 3Н, Ме-8), 1.06 (д, 1Н, J=10.0 Hz, Н-7ах), 1.22 (с, 3Н, Ме-9), 1.97-2.06 (м, 2Н, Н-5, Н-1), 2.15-2.26 (м, 2Н, H-4eq, Н-4ах), 2.31-2.46 (м, 2Н, H-7eq, Н-2), 3.21 (дт, 1Н, J=9.4, 6.2 Hz, Н-3), 3.54-3.73 (м, 2Н, Н-10a, Н-10b), 3.96 (ш.с, 1Н, ОН), 4.52 (ш.с, 2Н, NH2). 13С ЯМР-спектр (CDCl3): 23.2 (С-8), 26.0 (С-4), 27.1 (С-9), 30.7 (С-7), 38.8 (С-6), 40.3 (С-5), 43.2 (С-1), 44.3 (С-2), 58.3 (С-3), 66.2 (С-10). ИК-спектр (KBr) 1045 (S=O), 3244 (ОН) 3325 (NH2) см-1.
Абсолютную конфигурацию стереоцентров определяли по данным 1Н ЯМР спектроскопии. В спектре 1Н-1Н NOESY (SS,1S,2R,3S,5R)-2-(гидроксиметил)-6,6-диметилбицикло[3.1.1]гептил-3-сульфинамида 3D имеются кросс-пик между NH2 и Н-3 протонами, тогда как (SS,1S,2R,3S,5R)-2-(гидроксиметил)-6,6-диметилбицикло[3.1.1]гептил-3-сульфинамида 3С такое взаимодействие отсутствует.
Пример 5.
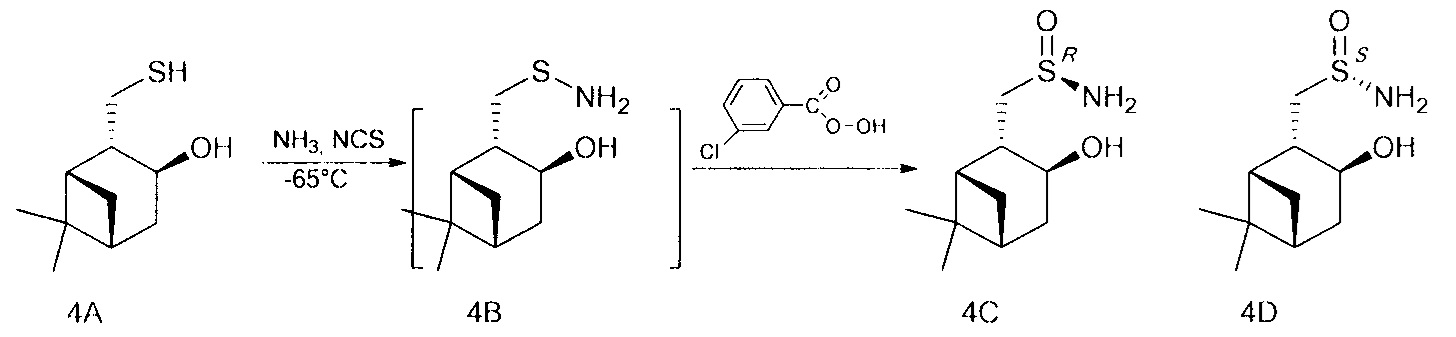
В U-образную трубку, охлажденную на ацетоновой бане до -35 - -75°С, сконденсировали 5-20 мл сухого жидкого аммиака. Поддерживая температуру бани, осторожно добавили NCS (0.147 г, 1.1 ммоль), перемешивали 5 минут, затем прибавили тиол (0.172 г, 1 ммоль) в 4 мл СН2Сl2. Продолжали перемешивание в течение 1 ч, поддерживая температуру -65°. После этого по каплям добавили m-СРВА (0.229 г (75%), 1 ммоль) в 10 мл СН2Сl2, постепенно поднимая температуру до комнатной и добавляя СН2Сl2 (10-50 мл). Перемешивали 12 ч до окончания реакции, ход реакции контролировали методом ТСХ. Далее реакционную смесь фильтровали на фильтре Шотта, промывали СН2Сl2, фильтрат промывали насыщенным раствором NaCl и сушили над Na2SO4, затем фильтровали и отгоняли. Твердый остаток разделяли методом колоночной хроматографии на силикагеле, используя элюент этилацетат:изопропиловый спирт, 5:1.
((RS,1S,2S,3S,5R)-3-гидрокси-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфинамид (4С) минорный диастереомер. Общий выход диастереомеров 67%; de 62%; бел. порошок, Rf 0.3 (EtOAc:i-PrOH, 5:1), 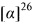 =+47.4 (с=0.8, МеОН). ИК-спектр (KBr, ν, см-1): 3302 (ОН), 3208 (NH2), 1051 (S=O). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.91 (с, 3Н, Ме-8), 1.19 (д, 1Н, J-10.0 Hz, Н-7ах), 1.22 (с, 3Н, Ме-9), 1.81 (дд, 1Н, J=13.8, 3.8 Hz, Н-4ах), 1.96-1.98 (м, 2Н, Н-1, Н-5), 2.39 (м, 1Н, H-7eq), 2.47-2.56 (м, 2Н, H-4eq, Н-2), 2.86 (дд, 1Н, J=12.9, 5.9 Hz, Н-10а), 3.10 (дд, 1Н, J=13.5, 7.6 Hz, H-10b), 4.21 (ддд, 1Н, J=9.2, 4.6, 4.4 Hz, Н-3), 4.35 (ш.с, 1Н, ОН), 5.02 (ш.с, 2Н, NH2). 13С ЯМР-спектр (CDCl3): 23.8 (С-8), 27.3 (С-9), 33.5 (С-7), 37.8 (С-4), 38.0 (С-6), 41.3 (С-5), 47.0 (С-1), 47.2 (С-2), 62.8 (С-10), 69.4 (С-3).
=+47.4 (с=0.8, МеОН). ИК-спектр (KBr, ν, см-1): 3302 (ОН), 3208 (NH2), 1051 (S=O). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.91 (с, 3Н, Ме-8), 1.19 (д, 1Н, J-10.0 Hz, Н-7ах), 1.22 (с, 3Н, Ме-9), 1.81 (дд, 1Н, J=13.8, 3.8 Hz, Н-4ах), 1.96-1.98 (м, 2Н, Н-1, Н-5), 2.39 (м, 1Н, H-7eq), 2.47-2.56 (м, 2Н, H-4eq, Н-2), 2.86 (дд, 1Н, J=12.9, 5.9 Hz, Н-10а), 3.10 (дд, 1Н, J=13.5, 7.6 Hz, H-10b), 4.21 (ддд, 1Н, J=9.2, 4.6, 4.4 Hz, Н-3), 4.35 (ш.с, 1Н, ОН), 5.02 (ш.с, 2Н, NH2). 13С ЯМР-спектр (CDCl3): 23.8 (С-8), 27.3 (С-9), 33.5 (С-7), 37.8 (С-4), 38.0 (С-6), 41.3 (С-5), 47.0 (С-1), 47.2 (С-2), 62.8 (С-10), 69.4 (С-3).
((SS,1S,2S,3S,5R)-3-гидрокси-6,6-диметилбицикло[3.1.1гептан-2-ил)метансульфинамид (4D) мажорный диастереомер. Общий выход диастереомеров 67%; de 62%; желт. масл. жидк., Rf 0.25 (ПЭ:EtOAc, 2:1), 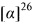 =+19.0 (с=1.5, МеОН). ИК-спектр (KBr, ν, см-1): 3323 (ОН), 3246 (NH2), 1040 (S=O). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.91 (с, 3Н, Ме-8), 1.15 (д, 1Н, J=9.4 Hz, H-7ax), 1.21 (с, 3Н, Ме-9), 1.79 (м, 1Н, Н-4ах), 1.87-1.98 (м, 2Н, Н-1, Н-5), 2.34-2.51 (м, 3Н, H-4eq, Н-2, H-7eq), 2.78 (дд, 1H, J=13.5, 5.3 Hz, Н-10а), 3.12 (дд, 1Н, J=12.9, 8.8 Hz, H-10b), 4.23 (ддд, 1H, J=9.0, 4.7, 4.5 Hz, H-3), 4.54 (ш.с, 1H, OH), 5.08 (ш.с, 2H, NH2). 13C ЯМР-спектр (CDCl3): 23.7 (C-8), 27.3 (C-9), 33.7 (C-7), 37.6 (C-4), 38.0 (C-6), 41.3 (C-5), 46.9 (C-1), 47.1 (C-2), 62.1 (C-10), 68.8 (C-3).
=+19.0 (с=1.5, МеОН). ИК-спектр (KBr, ν, см-1): 3323 (ОН), 3246 (NH2), 1040 (S=O). Спектр ПМР (300 МГц, CDCl3, δ, м.д., J/Гц): 0.91 (с, 3Н, Ме-8), 1.15 (д, 1Н, J=9.4 Hz, H-7ax), 1.21 (с, 3Н, Ме-9), 1.79 (м, 1Н, Н-4ах), 1.87-1.98 (м, 2Н, Н-1, Н-5), 2.34-2.51 (м, 3Н, H-4eq, Н-2, H-7eq), 2.78 (дд, 1H, J=13.5, 5.3 Hz, Н-10а), 3.12 (дд, 1Н, J=12.9, 8.8 Hz, H-10b), 4.23 (ддд, 1H, J=9.0, 4.7, 4.5 Hz, H-3), 4.54 (ш.с, 1H, OH), 5.08 (ш.с, 2H, NH2). 13C ЯМР-спектр (CDCl3): 23.7 (C-8), 27.3 (C-9), 33.7 (C-7), 37.6 (C-4), 38.0 (C-6), 41.3 (C-5), 46.9 (C-1), 47.1 (C-2), 62.1 (C-10), 68.8 (C-3).
Абсолютную конфигурацию конфигурацию стереоцентров определяли по данным 1Н ЯМР спектроскопии. В спектре 1H-1H NOESY ((Rs,1S,2S,3S,5R)-3-гидрокси-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфинамида 4С имеются кросс-пик между NH2 и Н-3 протонами, тогда как ((Ss,1S,2S,3S,5R)-3-гидрокси-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфинамида 4D такое взаимодействие отсутствует.
Таким образом, получены новые индивидуальные диастереорные монотерпеновые сульфинамиды, используемые для синтеза ценных органических синтонов биологически активных веществ, таких как: α- и β-аминокислоты, α-аминоальдегиды и кетоны, β-аминокетоны, α-аминофосфонаты, азиридин-2-карбоксилаты, азиридин-2-фосфонаты, син- и анти- 1,2- или 1,3-аминоспирты, α-замещенные и α,α-дизамещенные амины; которые могут быть использованы в органическом асимметрическом синтезе, фармацевтической промышленности, в качестве хиральных индукторов для получения широкого спектра лекарственных препаратов.