КОМБИНАЦИЯ ФАКТОРОВ РОСТА, ЦИТОКИНОВ, АНТИБАКТЕРИАЛЬНЫХ/АНТИВИРУСНЫХ ФАКТОРОВ, ФАКТОРОВ СТВОЛОВЫХ КЛЕТОК, БЕЛКОВ КОМПЛЕМЕНТА С3А/С4А И ХЕМОТАКСИЧЕСКИХ ФАКТОРОВ
Вид РИД
Изобретение
Заявленное изобретение относится к комбинации факторов роста, цитокинов, антибактериальных/антивирусных факторов, факторов стволовых клеток, белков комплемента С3а/С4а и хемотаксических факторов. Изобретение также относится к процессу получения упомянутой комбинации из сыворотки, плаценты или молозива, и к композиции, содержащей упомянутую комбинацию, для применения в лечении заболеваний, требующих восстановления и регенерации тканей, а также заместительной терапии стволовыми клетками.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В соответствии с данными из современной научной литературы, лечебное воздействие стволовых клеток может объясняться двумя механизмами: дифференциацией стволовых клеток в резидентные и высвобождением регенеративных трофических факторов стволовыми клетками. Соответствующие эффекты данных двух механизмов еще нуждаются в объяснении, хотя было выдвинуто предположение, что стволовые клетки не развиваются в зрелые клетки поврежденной ткани, но, скорее, доставляют жизненные факторы в данную ткань, которые затем могут пролиферировать и дифференцироваться, восстанавливая сами себя (AI Caplan and JE Denni, Mesenchymal Stem Cells as Trophic Mediators. Bioch J. Cell 98: 1076-1084, 2006).
Лечение стволовыми клетками имеет множество проблем, относящихся не только к ценовому параметру и технико-практическим трудностям, но также к вопросам этического и религиозного характера.
Лечение стволовыми клетками возможно только путем инъекций или, в некоторых случаях, местным введением, но не перорально. Супернатант культивированных стволовых клеток содержит факторы роста, цитокины, хемотаксические факторы и т.п., которые, как считается, отвечают за благоприятное воздействие лечения стволовыми клетками на рост и/или регенерацию ткани.
Использование жизненных факторов, изолируемых от супернатанта стволовых клеток, имеет, тем не менее, не только те же самые этические проблемы, присущие применению стволовых клеток, но и также очень высокую стоимость.
Известно, что некоторые ткани и биологические жидкости млекопитающих, а именно сыворотка, плацента и молозиво, содержат цитокины, факторы роста, хемотаксические факторы и прочие компоненты, как правило, присутствующие в супернатанте культур стволовых клеток. В прошлом были раскрыты некоторые лечебные техники, основанные на применении чистого молозива или его экстракта или фракций, а также экстракта плаценты.
Например, обзор клинических практик применения молозива можно найти в Alternative Medicine Review 8(4), 2003, page 378 и в Int. J. Clin. Pharmacol and Therap., 46(5), 2008, 211-225, а также в International Dairy Journal, 16, 2006, 1415-1420.
Терапевтическое применение молозива или его фракций также можно найти в заявках ЕР 743060, WO 98/51316, WO 94/16675, WO 98/36759, WO 95/00155, WO 2007/000648, FR 2487676, WO 98/14473, WO 99/64022, WO 2008/103023 и WO 2006/029494. Последняя раскрывает экстрагирование (выделение) факторов роста и дифференцировки из молозива, но сам раскрываемый процесс обязательно предусматривает потерю важных компонентов чистого молозива.
Ни один из документов, относящихся к предшествующему уровню техники, не раскрывает композиции, полученные из легкодоступных исходных материалов млекопитающих, содержащих большинство, если не все, компонентов супернатанта культур стволовых клеток, в качестве заменителя лечения стволовыми клетками.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Было обнаружено, что комбинация факторов роста, цитокинов, антибактериальных/антивирусных факторов, факторов стволовых клеток, белков комплемента С3а/С4а и хемотаксических факторов особенно эффективна в лечении целого ряда патологий, благодаря наличию многофункционального воздействия на различные биологические цели.
Комбинация согласно заявленному изобретению характеризуется содержанием: цитокинов: от примерно 50 до примерно 500 пкг/мг, предпочтительно от 71.46 до 340.76; факторов роста: от примерно 1000 до примерно 7000 пкг/мг, предпочтительно от 1321.80 до 6494.40; хемотаксических факторов: от примерно 5 до 50 пкг/мг, предпочтительно от 6 до 24; факторов стволовых клеток: от примерно 100 до 1500 пкг/мг, предпочтительно от 191 до 1105; антибактериальных/антивирусных факторов: от примерно 15 до 80 мкг/мг, предпочтительно от 18 до 75; белков комплемента С3а/С4а: от примерно 1 до 5 пкг/мг, предпочтительно от 1.10 до 2.70.
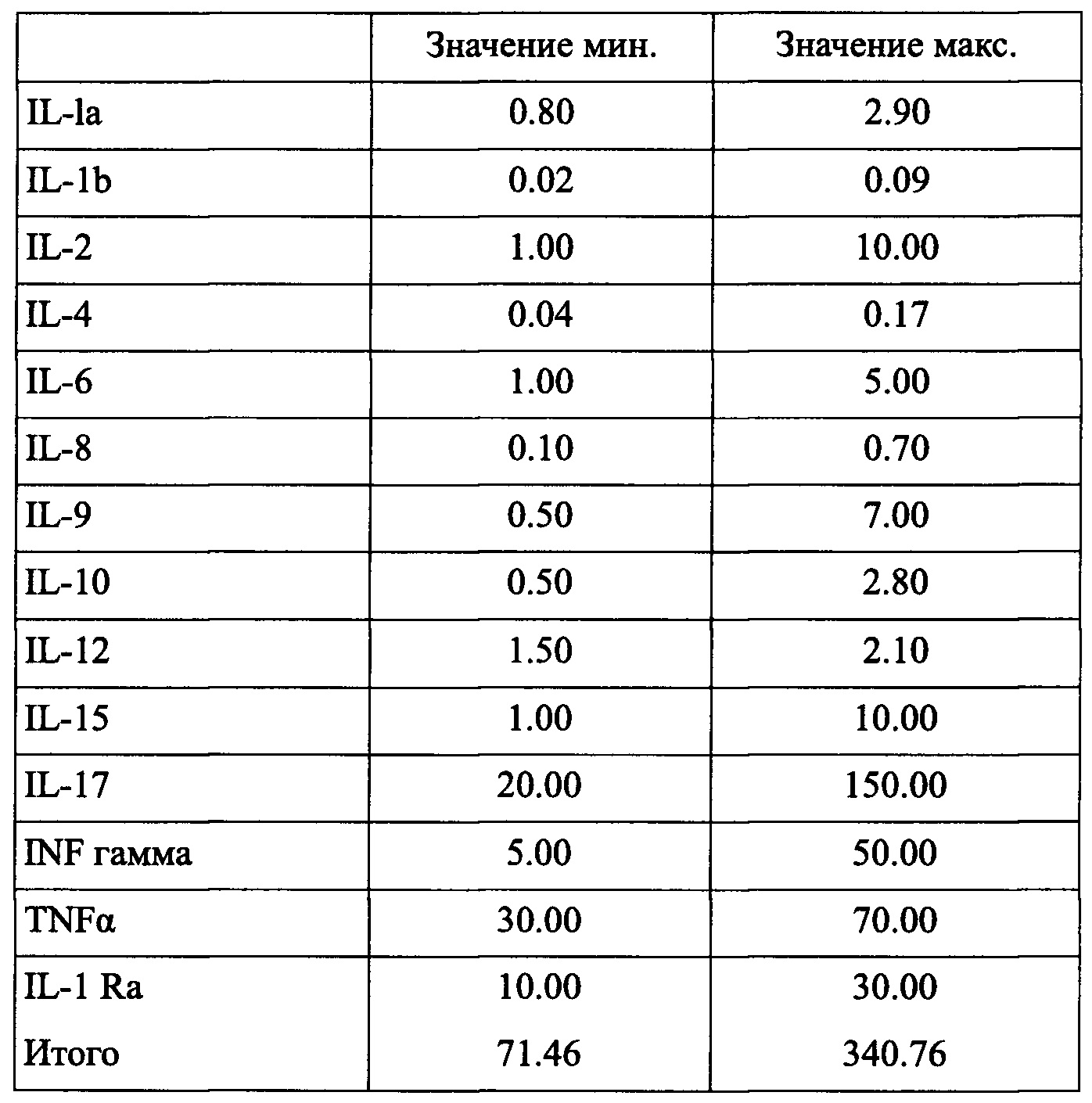
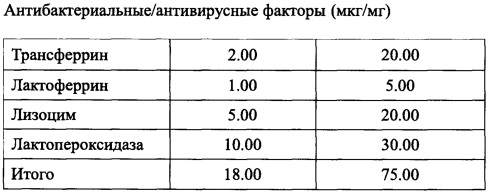
Цитокины, присутствующие в комбинации согласно заявленному изобретению, далее именуемые как PMF (мастер-файл на плазму), приведены в таблице 1:
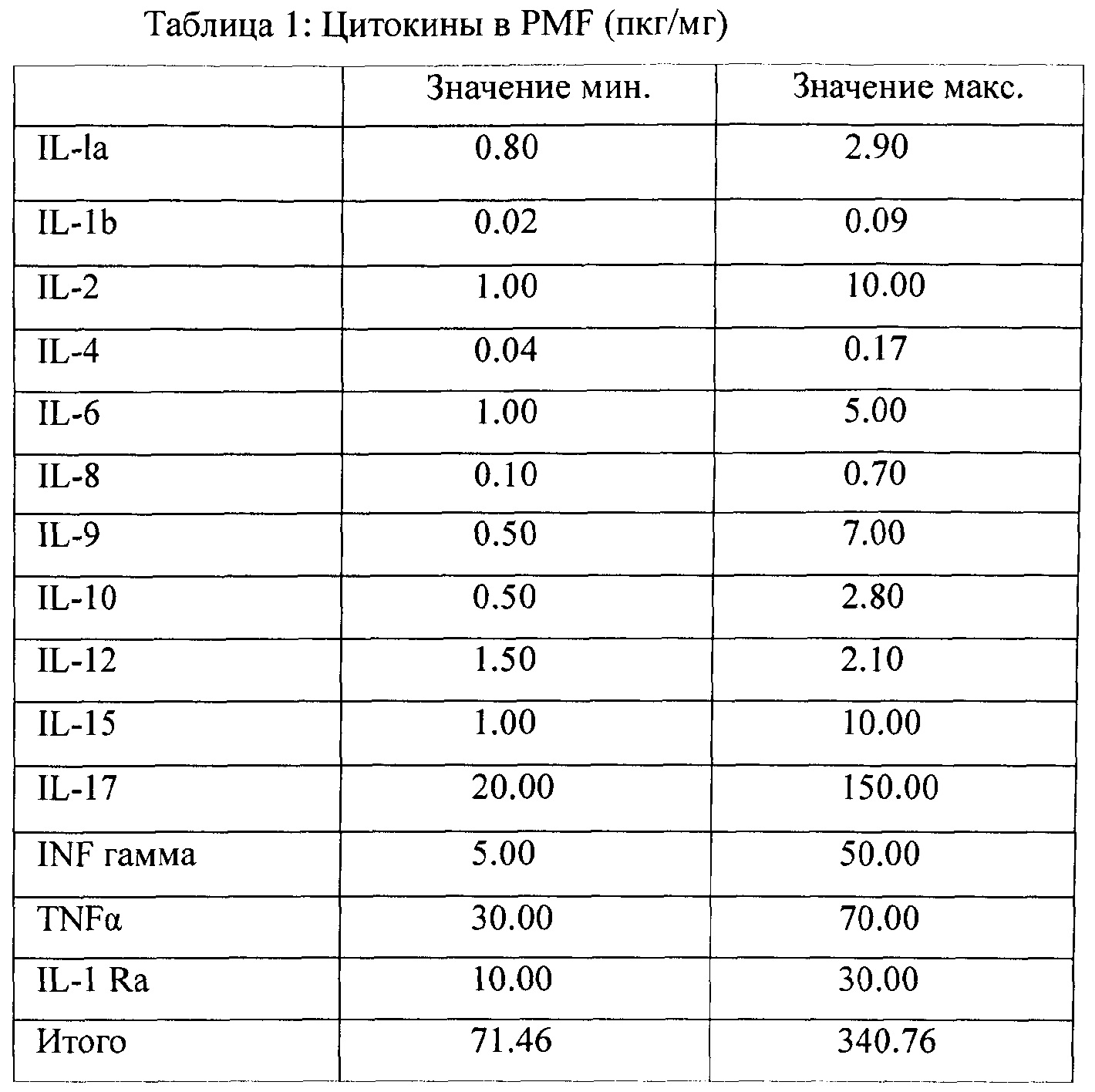
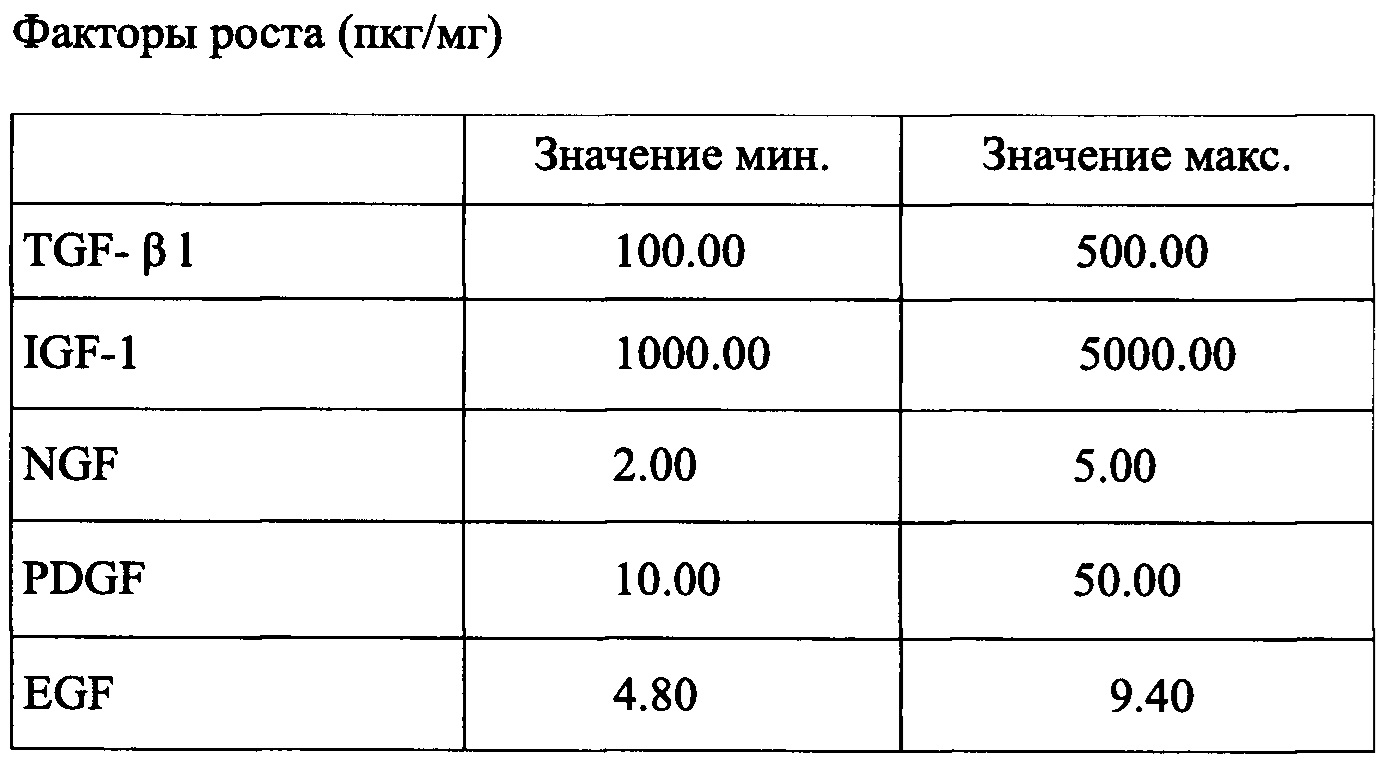
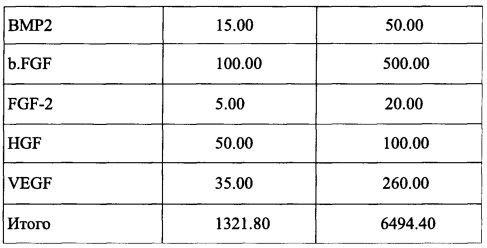
Факторы роста, присутствующие в комбинации согласно заявленному изобретению, приведены в таблице 2:
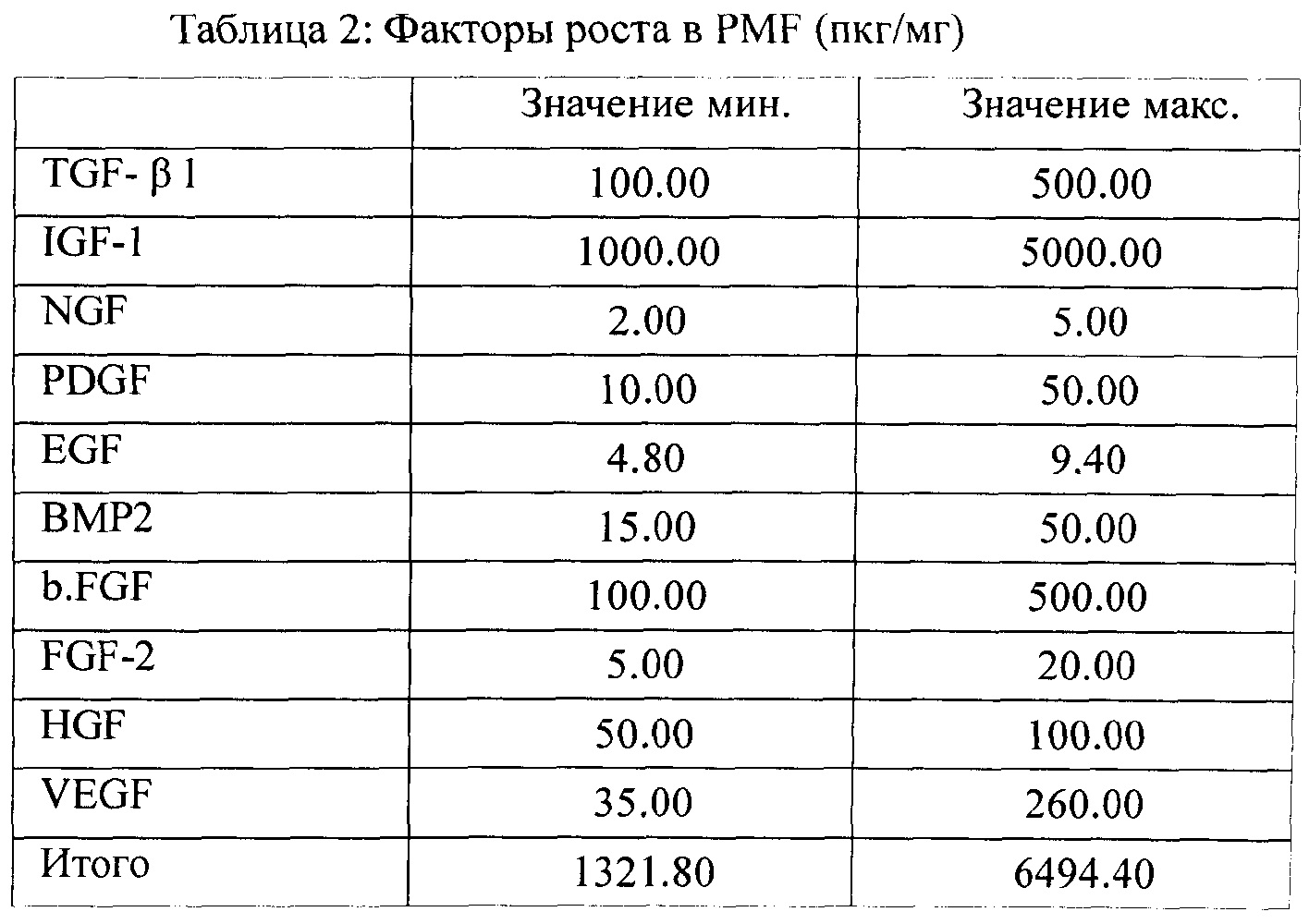
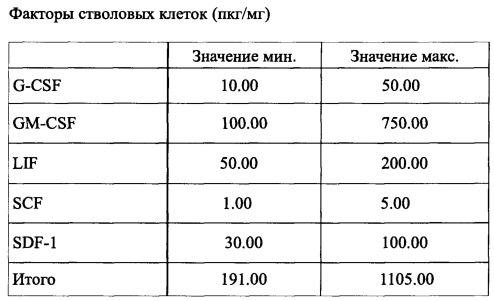
Факторы стволовых клеток, присутствующие в комбинации согласно заявленному изобретению, приведены в таблице 3:
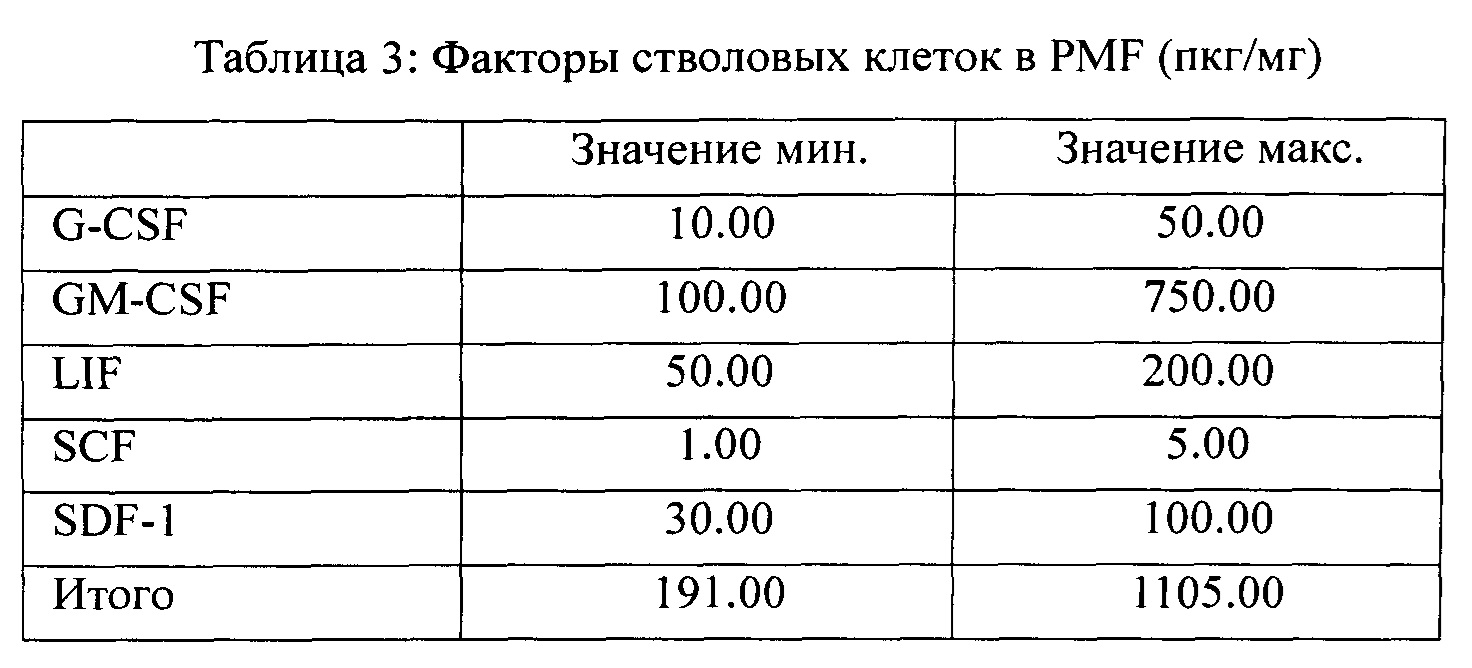
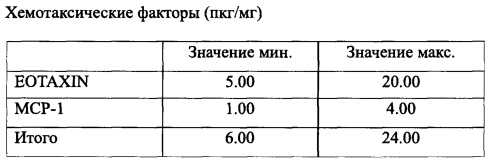
Хемотаксические факторы, присутствующие в комбинации согласно заявленному изобретению, приведены в таблице 4:

Антибактериальные/антивирусные факторы, присутствующие в комбинации согласно заявленному изобретению, приведены в таблице 5:

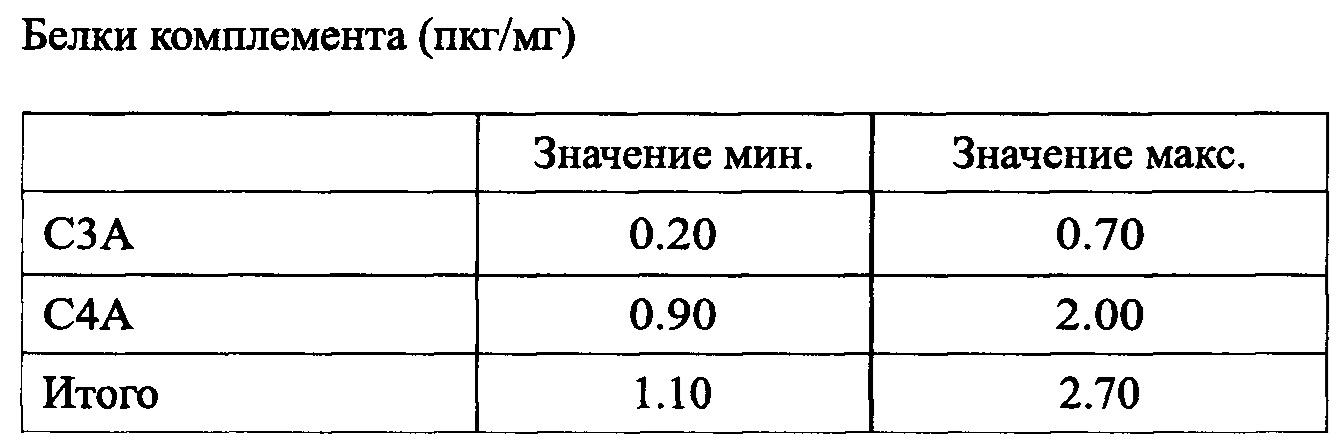
Белки комплемента С3а С4а, присутствующие в комбинации согласно заявленному изобретению, приведены в таблице 6:

Данные, приведенные в табл. 1-6, получены при помощи коммерчески доступного твердофазного иммуноферментного анализа, специально предназначенного для бычьих молекул и гибких Bio-Plex® систем (Bio-Rad Lab., Hercules, CA, USA). Термин «примерно» означает отклонение ±10%, предпочтительно ±5% от приведенного значения.
Основные физиологические функции компонентов комбинации приведены далее по тексту.
БЕЛКИ КОМПЛЕМЕНТА С3/С4: комплемент состоит из циркулирующих белков, обладающих способностью взаимодействия с биологическими мембранами и специфическими рецепторами, расположенными на поверхности различных типов клеток, которые индуцируют воспалительные реакции, помогающие бороться с инфекциями.
ФАКТОРЫ РОСТА
TGF-1 - ТРАНСФОРМИРУЮЩИЙ ФАКТОР РОСТА: стимулирует выработку иммуноглобулинов класса А, ответственных за иммунную защиту в слизистых. Модулирует клеточную пролиферацию и стимулирует накопление внеклеточного матрикса.
EGF - ЭПИДЕРМАЛЬНЫЙ ФАКТОР РОСТА: регулирует развитие слизистых. Способствует формированию эпителиальных клеток.
IGF1 - ИНСУЛИНОПОДОБНЫЙ ФАКТОР РОСТА: модулирует клеточную пролиферацию, адгезию и миграцию и индуцирует созревание слизистых.
VEGF - ФАКТОР РОСТА СОСУДИСТОГО ЭНДОТЕЛИЯ: стимулирует выработку кровеносных сосудов. Представляет митогенную активность и активирует сосудистую проницаемость.
FGF-b - ФАКТОР РОСТА ФИБРОБЛАСТОВ - основной: стимулирует пролиферацию клеток мезенхимального происхождения, например, фибробластов, эндотелиальных клеток, астроцитов и кератиноцитов. Также действует как хемотаксический фактор.
ОН - ГОРМОН РОСТА: общий фактор роста всех тканей.
GHRF - ФАКТОР, ВЫСВОБОЖДАЮЩИЙ ГОРМОН РОСТА: стимулирует высвобождение ОН, необходимого для нормального постнатального развития, роста костей, регуляторных эффектов на белки, углеводород, и жировой метаболизм.
NGF - ФАКТОР РОСТА НЕРВНОЙ ТКАНИ: стимулирует активность и регулирует рост и дифференцировку симпатической системы.
PDGF - ФАКТОР РОСТА ТРОМБОЦИТОВ: рост дифференцировки клеток мезодермального происхождения.
BMP-2 - КОСТНЫЙ МОРФОГЕНЕТИЧЕСКИЙ БЕЛОК 2: рост костей и хрящей, дифференцировка клеток сердечной мышцы.
ХЕМОТАКСИЧЕСКИЕ ФАКТОРЫ
ЭОТАКСИН: связывается с рецепторами хемокина для направления эозинофилов в воспаленные ткани.
МСР-1: Моноцитарный хемотаксический фактор-1: способствует агрегации моноцитов в воспаленные ткани.
ЦИТОКИНЫ
IL-1Ra ингибирует активность интерлейкина 1 альфа и интерлейкина 1-beta, модулируя совокупность связанных с IL 1 иммунных и воспалительных ответов.
IL-2 индуцирует пролиферацию Т лимфоцитов.
IL-4 обладает противовоспалительной способностью.
IL-6 стимулирует врожденный и приобретенный иммунитет.
IL-9 является регулятором гемопоэтических клеток, стимулирует пролиферацию клеток и предотвращает апоптоз.
IL-17 регулирует активность NF-KB и увеличивает выработку оксида азота (NO).
IL-10 оказывает плейотропный эффект на иммунорегуляцию и воспаление. Улучшает выживаемость клеток В и, соответственно, выработку антител. Исследования, проведенные на нокаут-мышах, показали, что данный белок является незаменимым в иммунорегуляции слизистых.
IL-12 стимулирует Т клетки и естественные клетки-киллеры.
IL-15 регулирует активацию и пролиферацию Т-клеток и естественных клеток-киллеров.
Интерферон-гамма обладает признанными антивирусными, противоопухолевыми и иммунорегуляторными свойствами. Является мощным активатором макрофагов и активирует клеточно-опосредованную активность в отношении бактерий и вирусов.
TNF-α - фактор некроза опухоли альфа стимулирует миграцию нейтрофилов и моноцитов к месту инфекции.
ФАКТОРЫ СТВОЛОВЫХ КЛЕТОК
GM-CSF-гранулоцитарный колониестимулирующий фактор: 1s участвует в стимуляции и периферическом высвобождении иммунных предшественников из костного мозга.
LIF - фактор, ингибирующий лейкемию: плейотропный цитокин с активностью в различных системах участвует, например, в индукции гематопоэтической дифференцировки в нормальных клетках и клетках, пораженных миелоидной лейкемией, индукции дифференцировки нейронных клеток, регулятор мезенхимально-эпителиальной конверсии во время развития почки.
SCF - фактор стволовых клеток: действует в утробе и гаметах и участвует в развитии нейронных клеток и гематопоэзисе.
SDF - 1-стромальный производный фактор-I: действует как хемотаксический фактор предшественников стволовых клеток, экспрессируя лиганд CXCR4.
АНТИБАКТЕРИАЛЬНЫЕ КОМПОНЕНТЫ
Трансферрин: доставляет железо в красные кровяные тельца и предотвращает связывание железа с бактериями и вирусами.
Лактоферрин: удаляет железо из бактерий и вирусов, необходимое для их роста.
Лизоцим: обладает антибактериальными свойствами в аспекте энзимной активности и, как следствие, катионных и гидрофобных свойств.
Лактопероксидаза: блокирует бактериальный метаболизм путем оксидации групп жизненных белков SH.
Комбинацию согласно заявленному изобретению возможно приготовить путем экстрагирования молозива, сыворотки, полученной от млекопитающих в предродовой период, или плаценты в соответствии со способами, описанными далее по тексту.
Сыворотка имеет самый высокий пик факторов в дни, непосредственно предшествующие родам, молозиво в первые часы после родов и не позднее 6-го часа. После 12 часов после родов факторы в молозиве значительно снижаются, а после 24 часов многие из них более не определяются.
Данные факторы генетически запрограммированы в различных родах, и, таким образом, возможно использование факторов, изолированных из других млекопитающих, например домашнего скота, лошадей, верблюдов, морских млекопитающих и пр.
Факторы контролируются анализом ELISA, специфичны для каждого вида, даже при наличии ярко выраженной кросс-реакции, поскольку факторы филогенетически очень консервированы и, соответственно, поддаются качественному учету также при помощи ELISA, используемого для различных видов (например, человеко-бычий, и наоборот).
Экстрагирование из сыворотки млекопитающих
Сыворотка беременных особей млекопитающих имеет самый высокий пик компонентов согласно заявленному изобретению в дни, непосредственно предшествующие родам, молозиво в первые часы после родов или отела, как правило в последние 5-15 дней.
Описана типичная процедура приготовления комбинации согласно заявленному изобретению.
1 литр крови забирают в течение 4 дней для общего количества образцов 4 для предотвращения повреждения животным, предпочтительно коров или лошадей.
Сыворотку отделяют от крови при комнатной температуре в течение 24 ч и затем центрифугируют для сжатия сгустков.
Сыворотку восстанавливают (примерно 30/40% от общего объема) и добавляют в качестве антисептических агентов феноксиэтанол 2.5% и диазолидинил мочевину 1%. Сыворотку затем подвергают следующим этапам обработки.
Ультрафильтрация 300,000 Да:
Образец сыворотки (замороженной при -20°С), полученной коагуляцией и центрифугированием из крови млекопитающих, разморозили при комнатной температуре и разбавили с 2 объемами деионизированной воды. Полученный раствор подвергли ультрафильтрации через плоскую мембрану тангенциального потока Millipore Biomax Pellicon 300,000 Да в полиэтерсульфоне при Pi от 0.5 до 1 бар, в холодном помещении при 4°С.
Ретентат и фракцию, соответствующую примерно 1:10 пермеата, помещают в диализную трубку 1000 Да производства Spectrum SpectraPor в регенерированной целлюлозе и подвергают диализу в деионизированной воде.
Ультрафильтрация 5.000 Да:
Оставшийся пермеат ультрафильтруют через мембрану 5000 Да.
Пермеат от ультрафильтрации 300,000 Да концентрируют на плоской мембране тангенциального потока 5000 Да производства Millipore Biomax Pellicon в полиэтерсульфоне при Pi от 0.5 до 1 бар, в холодном помещении при 4°С.
Ретентат помещают в диализную трубку 1,000 Да в регенерированной целлюлозе производства Spectrum SpectraPor и подвергают диализу в деионизированной воде (данный диализ также удаляет консерванты). Затем продукт немедленно лиофилизируют.
Экстрагирование из плаценты
Предпочтительно используют бычью, лошадиную или свиную плаценту.
Гомогенизация
Плаценту (замороженную при -20°С) разморозили при комнатной температуре, нарезали на мелкие кусочки, промыли обильным количеством холодного (4°С) физиологического раствора (NaCl 0.9%) и гомогенизировали с использованием комплекса Siramm в лизисном буфере после получения данной композиции: Tris/HCl 50 мМ, EDTA 25 мМ, triton X-100 0.001% при рН 7.4. NaCl до концентрации 0.9% добавили к полученной суспензии. Суспензию перемешали в магнитной мешалке в течение 2 часов и продержали в статическом состоянии в течение ночи в холодном помещении при 4°С.
Центрифугирование
Суспензию центрифугировали при 13,000 оборотах в минуту с использованием Sorvall RC6 и ротора SLA 15000 в течение 45 мин при 4°С. Супернатант от центрифугирования восстановили, подвергли предварительной фильтрации на Dicalite и регенерированных целлюлозных фильтрах от 0.45 мкм до 0.22 мкм.
Ультрафильтрация 300,000 Да
Продукт фильтруют и ультрафильтруют через плоскую мембрану тангенциального потока 300.000 Да производства Millipore Biomax Pellicon при Pi от 0.5 до 1 бар, в холодном помещении при 4°С.
Ультрафильтрация 5.000 Да
Пермеат от ультрафильтрации 300,000 Да концентрируют на плоской мембране тангенциального потока 5000 Да производства Millipore Biomax Pellicon в полиэтерсульфоне при Pi от 0.5 до 1 бар, в холодном помещении при 4°С. Ретентат помещают в диализную трубку 1,000 Да производства Spectrum SpectraPor в регенерированной целлюлозе и диализуют в деионизированной воде. Затем продукт немедленно лиофилизируют.
Экстрагирование из молозива
Предпочтительно бычье молозиво, в частности от коров пород Holstein (Friesian) и Guernsey. Было доказано, что коровы данной породы вырабатывают молозиво с самым высоким содержанием факторов роста, иммунных модуляторов, хемотаксических факторов и антибактериальных/антивирусных факторов. Предпочтительно, данные коровы имеют второй или третий отел. Молозиво предпочтительно собирают не позднее 5-6 часов после отела, наиболее предпочтительно - в течение одного часа после отела, поскольку самая высокая концентрация активных веществ наблюдается в течение упомянутого периода, в то время как после шестого часа и позднее содержание активных факторов резко падает (только 20% присутствуют в течение 24 часов после отела).
Собранное молозиво проверяют на отсутствие туберкулеза, цитотоксичность на клеточных культурах, микоплазму, прионовые инфекции и вирусы человека и лошадей.
Молозиво из цистерны вымени практически стерильно, но после сцеживания, несмотря на все предосторожности, вследствие высокой концентрации факторов роста, количество бактерий в нем резко увеличивается во время замораживания и размораживания, причем это занимает достаточно долгое время из-за высокой плотности молозива в первые несколько часов.
Концентрации консервантов, дозволенных к употреблению в диетическом питании и при парентеральном и внутривенном введении, не является достаточным для прекращения роста бактерий. Использование гамма-лучей позволяет получить стерильное молозиво только при уровне радиации, превышающем 10 кГр, что разрушает большую часть активных факторов, и в любом случае, данный способ не предотвращает образование пирогенов, внутривенное и/или местное применение которых запрещено в участках в контакте с кровью и лимфоузлами. С этой целью, была разработана инновационная система сбора для получения стерильного, свободного от аллергенов соединения, без консервантов или пирогенов.
Антисептические вещества в достаточных количествах для обеспечения стерильности и отсутствия пирогенов добавляют к молозиву, собранному в стерильные емкости (стерилизация в пустом виде при 25 Kgy). Сорбат калия и бензоат натрия предпочтительно используют, каждый в концентрации 12.5% (намного более высокая концентрация, чем обычно, а именно 0.2%), или, альтернативно, феноксиэтанол в концентрации 2.5% или диазолидинил мочевины в концентрации 1%.
Молозиво в такой обработке не нуждается в заморозке для хранения до экстрагирования активного фактора, результатом чего является очевидная экономия расходов.
Молозиво затем разбавляют физраствором: данный раствор не только обеспечивает улучшенную фильтрацию без закупоривания пор фильтра, но прежде всего позволяет высвободить активные факторы, связанные с жирами и казеином. Разбавленное таким методом молозиво подвергается тангенциальному микрофильтрованию (керамические мембраны с пороговым значением / размером пор от 2 до 6 мкм, температура 5/20°С, трансмембранное давление от 0.2 до 2 бар), которое можно повторить, для получения опалесцирующего раствора без жировой матрицы, казеина и молочных белков. Все данные вещества содержат более 90% аллергического содержания молозива и коровьего молока. Затем данный раствор пропускают через мембраны, или альтернативно через молекулярное сито с пороговым значением при 300,000 дальтон (Да), для последующей очистки активных факторов, все весом менее 200,000 дальтон.
Раствор затем диализуют при помощи ультрафильтрации (пороговое значение 1000/2000 дальтон) при высоком давлении, и затем немедленно высушивают заморозкой. В результате получают стерильный, без консервантов, безаллергенный порошок (казеин и лактоальбумин вызывают более 95% случаев аллергии на коровье молоко) с очень высокой растворимостью, с максимально высокой возможной концентрацией активных факторов.
Получение иммуноглобулинов
Иммуноглобулины IgG, IgA и IgM количественно вырабатывают из фракций, полученных ранее описанными способами экстрагирования, при помощи способа, включающего следующие этапы: 1) выработка IgG при помощи аффинной хроматографии; 2) выработка IgA и IgM при помощи фильтрации в тангенциальном потоке и с использованием мембран с пороговым значением 100 кДa; 3) обессоливание и концентрирование при помощи диафильтрации с использованием мембран с пороговым значением 3 кДа; 4) лиофилизация.
Выработка IgG при помощи аффинной хроматографии.
Наиболее популярные способы, используемые в настоящее время для очищения антител, основаны на аффинной хроматографии с использованием высокоспецифичных иммуноглобулин-связывающих белков (IBP), изолируемых из поверхности бактерий, как, например, белок А из золотистого стрептококка и белок G из стрептококков. Такие белки обычно иммобилизуют в подготовительных хроматографических колонках и улавливают иммуноглобулины с высокой степенью очистки и восстановления всего лишь в один этап. Наиболее приемлемые бычьи IBP, отличающиеся самой высокой аффинностью в отношении IgG, выбрали и поместили HiTrap колонки с 5 мл белка А или G, иммобилизовали на сефарозе. Путем измерения выработки IgG при помощи электрофореза и ELISA, обнаружили, что белок G является наиболее подходящим IBP для бычьего IgG, достигая выработки выше 95%. Предпочтительно использование колонки HiScale ТМ 50, с 400 мл белка G сефарозы 4 Fast Flow (GE Healthcare), содержащей рекомбинантный белок G, иммобилизованный на сефарозе с использованием бромида цианогена (CNBr), который может связать 23 мг IgG на мл, с общим объемом примерно 1 г. Мобильную фазу элюируют с использованием системы FPLC (AKTAprime plus, GE Health care) и контролируют детектором УФ при 280 нм, датчиком пропускания (0.001-999.9 мс/см) и рН-метром.
Способ аффинной хроматографии состоит из следующих этапов: 1) связывание; 2) элюирование; 3) регенерация колонки. Этап связывания состоит из эквилибрирования колонки с 5 объемами связывающего буфера (фосфатный буфер, 20 мМ рН 7) при скорости потока 20 мл/мин и не превышая противодавление 0.1 мПа. Образец экстракта затем загружают в колонку и элюируют со связывающим буфером. Во время данного этапа, иммуноглобулины связываются со стационарной фазой, в то время как другие белки элюируют из колонки. Сбор элюированных белков, выработанных из IgG, автоматически контролируется путем мониторинга УФ элюата. Следующий этап состоит из элюирования иммуноглобулина путем использования кислой мобильной фазы при рН 2.5 (Glycine-HCl), установленными на скорости потока 20 мл/мин. После этапа элюирования необходимо впрыснуть этанол (20%) в колонку для ее корректной регенерации и хранения.
Выработка IgA и IgM при помощи фильтрования тангенциальным потоком. Сепарация подклассов IgM и IgA основана на их более высокой молекулярной массе по сравнению с протеомой полученных фракций. В частности, бычий секрет IgA (SigA) из бычьего молозива (мол. масса примерно 410,000) состоит из четырех альфа-цепочек (мол. масса 61,000), четырех легких цепочек (мол. масса 23,000) и одной молекулы гликопротеина-а (мол. масса 70,000-86,000). IgM образует полимеры, в которых множественные иммуноглобулины ковалентно связаны вместе дисульфидными связями, в большинстве случаев, как пентамер, но также и как гексамер; таким образом, IgM отличается наличием молекулярной массы как минимум 970 кДа (в форме пентамера). Выработку данных двух классов lg осуществляют при помощи системы тангенциального фильтрования, основанной на применении пористых мембран с пороговым значением 100 кДа. В частности, система основана на использовании картриджей из губчатых волокон для фильтрации перекрестным потоком, содержащих входное отверстие, отверстие для ретентата, два отверстия для пермеата и перистальтический насос для бережной рециркуляции биологических жидкостей.
Обессоливание и концентрирование диафильтрацией и 4) лиофилизация. Протеом, выработанный из иммуноглобулинов, затем диафильтруют через мембраны с пороговым значением 3-5 кДа для обессоливания и концентрирования. Полученный раствор затем фильтруют через мембраны с пороговым значением 0.2 микрона в стерильных условиях и окончательно лиофилизуют.
Лиофилизация:
Ретентат ультрафильтрации из 5000 Да фильтруют под вакуумом на фильтрах Millipore, сделанных из целлюлозы, регенерируют из 0.2 мкм, замораживают при -20°С и лиофилизуют.
Продукты, полученные из сыворотки, плаценты или молозива, могут использовать отдельно либо вместе в комбинации. Продукты, в любом случае, будут соответствовать качественным параметрам, указанным в табл. 1-6.
Комбинацию согласно заявленному изобретению преимущественно применяют парентерально либо локально, в лечении заболеваний, требующих восстановления и регенерации тканей, для замещения терапии стволовыми клетками. В частности, комбинация согласно заявленному изобретению, содержащая аналогичные компоненты супернатанта культур стволовых клеток, приемлема для лечения патологий костной системы травматического и дегенеративного происхождения, в качестве фильтров для использования в дерматологии, пластической и эстетической хирургии, возможно, в сочетании с биоматериалом, например коллагеном, гиалуроновой кислотой, матригелем, гидроколлоидами, полилактидами, полигликолидами, поликапролактонами и т.п. Объем комбинации для введения согласно заявленному изобретению может варьироваться от 0.1 до 10 г. Комбинацию согласно заявленному изобретению можно использовать для импрегнирования каркасов, цементирующих приспособлений, суппортов, имплантатов или протезов, для включения материалов, содержащих сочетание согласно заявленному изобретению в концентрации от 1 до 10%, приемлемое для лечения метастатических очагов в костях, атрофии нижне- или верхнечелюстного альвеолярного отростка и для сращения костных переломов. Концентрация, очевидно, зависит от степени проявления и типа очага, которое необходимо обработать PMF-содержащим материалом.
Для парентерального введения, комбинацию согласно заявленному изобретению можно дополнить приемлемыми носителями и эксципиентами в достаточной дозировке, например, стерильными растворами.
Комбинация также может применяться в качестве восстанавливающего материала в пустотах в терапии кариеса и воспаления пульпы. С данной целью, комбинации по изобретению могут выпускаться в форме каркасов, цементирующих приспособлений, суппортов, реабсорбируемых или нереабсорбируемых имплантатов.
Дневная доза комбинации зависит от типа и степени тяжести заболевания, а также состояния пациента, возраста и пола. Обычно, в диапазоне от 1 до 10 г ежедневно, в один или более приемов, как правило, от двух до трех приемов.
Для местного применения приемлемые формы включают кремы, мази, гели, порошки, лосьоны, жидкости для полоскания рта, пластыри, обычно содержащие от 10 до 20% по весу комбинации согласно заявленному изобретению. Комбинация согласно заявленному изобретению, полученная из молозива, сыворотки или плаценты, при необходимости, может покрываться оболочкой для специального применения, например, в формах контролируемого высвобождения, предпочтительно в микросферах.
Композиции могут содержать прочие ингредиенты, полезные для специального применения.
Изобретение будет описано в подробностях в ниже приведенном экспериментальном разделе, в качестве примеров.
Пример 1 - Лечение заболеваний костной системы
Испытания IN VITRO
Ex novo остеогенез
Воздействие PMF на остеогенез исследовали in vitro путем пролиферации и дифференциации стволовых клеток (предшественников костей) костной мезенхимы человека и мышей. In vivo, исследовали остеогенезную активность PMF на модели subcutaneous инъекции матригеля, аморфной матрицы, содержащей PMF и гидроксиапатит.
Пролиферация
Воздействие PMF на клеточную пролиферацию исследовали с использованием остеобластов человека (Saos-2 и MG-63) и мезенхимальных стволовых клеток, в качестве модели прекурсоров остеобластов (стволовые клетки, полученные из жировых тканей человека, hASC).
Изолировали ASC (Zuk PA et al. Tissue Eng, 2001, 7: 211-28) забором от 6 добровольцев-доноров и поместили в контрольную среду (DMEM с добавлением пирувата натрия, 10% FCS, 100 U/ml пенициллина, 100 мг/мл стрептомицина и 250 нг/мл амфотерицина В). Остеобласты Saos-2 (АТСС номер: НТВ-85) и MG-63 (АТСС номер: CRL-1427) закупили в компании АТСС. Saos-2 и MG-63 содержали, соответственно, в McCoy' SA (Gibco, Life Technologies) с 15% FBS, и в DMEM с 10% FCS.
Клетки засеяли в 96-луночные планшеты и подвергли тесту МТТ на 1, 3, 5 и 7 дни, содержали во влажной атмосфере с 5% CO2 при 37°С. PMF показали потенциальный дозозависимый пролиферативный эффект на все исследуемые линии, максимально выраженный в концентрации 5 мг/мл.
Миграция
Исследовали способность PMF задействовать мезенхимальные предшественники (ASC) и остеобласты человека (MG-63 and SAOS) при помощи анализа заживления раны, признанного как ключевой тест при исследовании способности индуцировать подвижность клеток. PMF в обозначенной концентрации (5 мг/мл) способствует подвижности клеток путем, сопоставимым с состоянием положительного контроля (10% FBS) для ASC и MG-63 и с меньшей выраженностью, хоть всегда и статистически значимой, для Saos.
Функционализация титановых поверхностей при помощи PMF
Цилиндры из гладкого титана, обычно используемые для тестирования in vitro поверхностей зубных протезов, покрыли тонкими полиакрилатными пленками для функционализации PMF. Введение карбоксильных групп на поверхность позволяет, по сути, протекать образованию ковалентных связей с аминогруппами, присутствующими в аминокислотных остатках факторов роста, содержащихся в PMF. Остеобласты человека Saos-2 засеяли на образцы, зафиксировали через 3 и 6 часов и подготовили для иммуноцитохимического анализа. По истечении ровно 3 часов возможно заметить обширное распределение клеток на обработанных поверхностях в сравнении с необработанными, в то время как после 6 часов после засева распределение одинаково в двух случаях, но количество клеток значительно больше на функционализированных поверхностях.
Испытания In Vivo
Модель остеогенеза In vivo в матригеле.
Остеогенезную активность PMF исследовали путем подкожного внедрения матригеля в Balb-C в присутствии или отсутствие 100 мкг/мл PMF. Изучение PMF-содержащей матрицы показало рекрутинг воспалительных клеток в течение 10-15 дней после внедрения.
Последующие исследования провели в присутствии гидроксиапатита, добавляемого к матригелю с или без содержания PMF. Через 10 дней после внедрения, макрофаги и реактивные гигантские клетки рекрутировали в присутствии PMF вокруг кристаллов гидроксиапатита. Иммуногистохимический анализ показал осаждение остеокальцина. Через 60 дней стало очевидно наличие зон кальцификации, окруженных реактивной стромой, что является положительным признаком осаждения при окрашивании Von Kossa.
Из вышеупомянутого очевидно, что PMF оказывает влияние на улучшение остеогенеза, в случае если растворимые остеоиндуктивные факторы доставляют в культурной среде или каркасах из гидроксиапатита, in vivo. Таким образом, PMF можно удобно применять в составе материалов - заместителей костей в ортопедии и стоматологии. Помимо этого, PMF обладает способностью положительного хемотаксиса на тестируемых клетках и может применяться для функционализирования поверхностей имплантатов. Влияние на пролиферацию предшественников и миграцию остебластов обусловлено присутствием в PMF различных хемокинов и факторов роста.
Переломы костей у собак
Каркасы, содержащие от 3 до 15 г PMF, расположили между зоной костного перелома и некрозом у пяти собак с переломами длинных костей с высокой вероятностью несрастания или задержки срастания.
Наблюдали повышение костной массы по сравнению с нелеченными контрольными собаками. В частности, образование новой костной трабекулы наблюдали благодаря воздействию физиологических остеобластов, стимулированному специфическими факторами роста, содержащимися в PMF. Более быстрое срастание разрывов и минерализацию bone callus наблюдали вдвое раньше обычного срока, требуемого при переломах такого рода. Среднее время срастания перелома уменьшилось с 30 недель у нелеченных животных до 16 недель у животных, которым вводили PMF.
Полученные результаты показали, что PMF делает возможной активацию регенерации костей. Упомянутые результаты весьма обнадеживают с точки зрения клиники и физиологии в плане использования для лечения переломов с высоким риском несрастания.
Пример 2 - Терапия проникающего кариеса зубов и воспаления пульпы
Повреждение пульпы In vivo
Десять крыс породы Sprague-Dawley, трех месяцев отроду, использовали для моделирования повреждения дентальной коронки и последующего заполнения согласно протоколу Garber SE et al., (J. Endod. 35 (2009), 60-64). В самом начале, выполнили отверстия на правой мезиальной поверхности моляров, и в полости заложили заполнители с гидроксидом кальция или 200 мкг PMF. Два зуба оставили открытыми в качестве положительного контроля воспаления пульпы.
Результаты
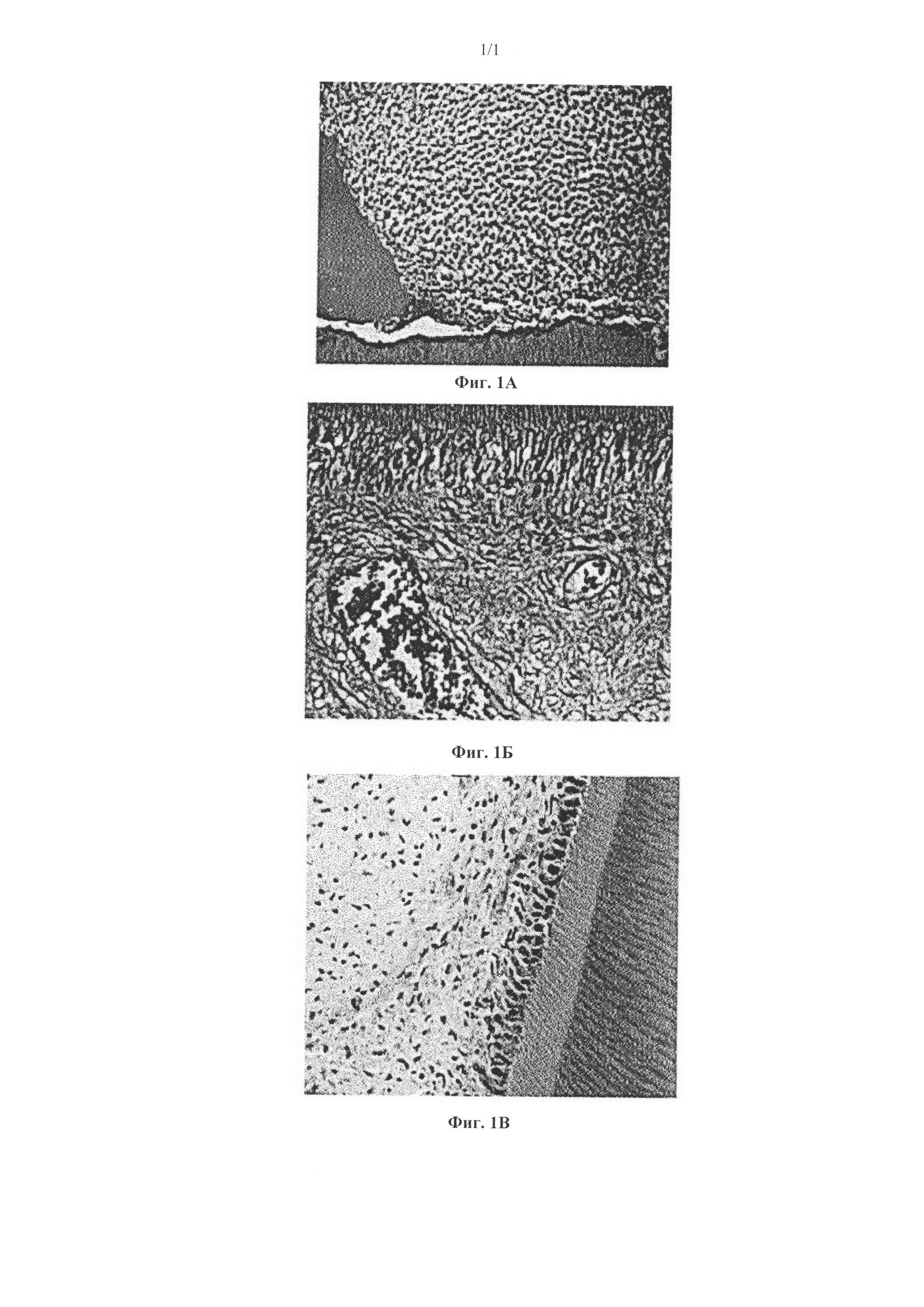
Положительный контроль показал маркированный воспалительный инфильтрат (фиг. 1А), в то время, как зубы, обработанные гидроксидом кальция, показали наличие пульпита с гиперемией и эдемой (фиг. 1Б). Заполнители с PMF сохраняли свойства нормальной пульпы (фиг.1В).
Пример 3 - Дермальная регенерация
Испытания In vitro
PMF значительно увеличивают (>100%) пролиферативную способность мезенхимальных стволовых клеток, полученных из жировых тканей человека (hASCs), по сравнению с контролем (10% FBS). PMF, используемые в двух различных концентрациях (5 мг/мл и лмг/мл), в культурной среде, имеют дозозависимый и зависимый от времени инкубации эффект.
Испытания In vivo
PMF (100 у) смешали с 1 мл некросслинковой гиалуроновой кислоты.
Гиалуроновая кислота или другие носители, например матригель, предназначены для высвобождения PMF в течение 15-20 дней, для обеспечения возможности регенерации дермы и коллагена, с пролонгацией во времени.
Клеточная пролиферация In vivo
Смесь PMF, матригеля или гиалуроновой кислоты вводят подкожно мышам. Через 7 дней наблюдают за пролиферацией васкулярных клеток и состоянием периферии аморфного суппорта. Через 20 дней аморфный суппорт полностью заселен клетками. Еще через 30 дней наблюдают значительное образование коллагена.
Механическая травма хвоста свиньи: интрадермальная терапия
Лигатура свиных хвостов приводит к образованию некроза вниз по хвосту.
Экспериментальная модель включает проведение инъекций вверх по току: 1) физраствора, 2) физраствора + PMF, 3) гиалуроновой кислоты + PMF.
После инъекции физраствора, вверх по току расположения очага, хвост отпадает через 24 часа. Через 15 дней после инъекции, вверх по току от очага, физраствора + PMF, хвосты не отпадают, а начинают расти при менее, чем оптимальных условиях; особенно, в дистальных участках по отношению к очагу метастаза можно заметить некроз и отсутствие роста щетинок. Через 15 дней после инъекции гиалуроновой кислоты + PMF вверх по току от очага, хвосты имеют обычный вид.
Гистологическое исследование показывает, что не происходит изменений в нервах и мышцах животных, проходящих лечение, кожа и сосудистая система которых приходит в нормальное физиологическое состояние. Хвостовые отделы туловища животных без лечения, помимо диаметра примерно наполовину аналогичного отдела животных, проходящих лечение, показывает наличие экстенсивного склероза, с общей атрофией нейронно-мышечной, сосудистой и кожной систем. Артерии полностью заблокированы интимальными бляшками.
Пример 4 - Восстановление сердечной мышцы
Повреждение сердечной мышцы инъекционной иглой предотвратили извлечением из самой иглы матригелем + 100 мкг PMF. Вначале происходит заполнение повреждений мышечными клетками, с последующим полным восстановлением.