КАТАЛИТИЧЕСКИЕ КОМПЛЕКСЫ С КАРБЕНОВЫМ ЛИГАНДОМ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В РЕАКЦИИ МЕТАТЕЗИСА
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к метатезису олефинов, более конкретно, к катализирующим метатезис соединениям, к их синтезу и способам их применения в реакции метатезиса.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
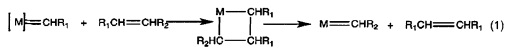
Метатезис олефинов является каталитическим процессом, предусматривающим в качестве ключевой стадии реакцию между первым олефином и первым алкилиденовым комплексом переходного металла с получением таким образом нестабильного промежуточного металлциклобутанового кольца, которое затем подвергается превращению во второй олефин и второй алкилиденовый комплекс переходного металла согласно нижеприведенному уравнению (1). Реакции этого вида являются обратимыми и конкурирующими друг с другом так, что общий результат в значительной степени зависит от их соответствующих скоростей, и, если происходит образование летучих или нерастворимых продуктов, равновесие смещается.
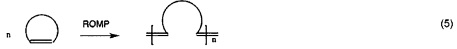
Реакции метатезиса широко применяются в области химических реакций, например, метатезис с замыканием кольца (RCM), кросс-метатезис (СМ), метатезис с раскрытием кольца (ROM), метатезисная полимеризация с раскрытием кольца (ROMP), метатезис ациклических диенов (ADMET), самометатезис, превращение олефинов с алкинами (ениновый метатезис), полимеризация алкинов и т.д.
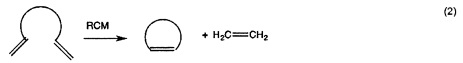

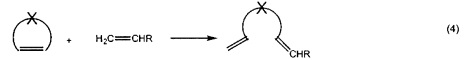
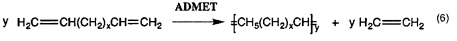
Типичными применениями метатезиса олефинов являются без ограничения реакционное инжекционное формование (RIM) дициклопентадиена (DCPD), которое является примером метатезисной полимеризации с раскрытием кольца; ROMP норборненовых производных; этенолиз, химический процесс, при котором внутренние олефины разрушаются при применении этилена в качестве реагента. Реакция является примером перекрестного метатезиса; СМ этена с 2-бутеном; деполимеризации ненасыщенных полимеров.
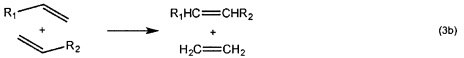
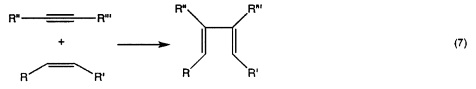
Потенциально больший интерес по сравнению с гомо-сочетанием (уравнение 3а) представляет кросс-сочетание двух различных терминальных олефинов (уравнение 3b). Реакции сочетания, вовлекающие диены, дают линейные и циклические димеры, олигомеры и, прежде всего, линейные или циклические полимеры (уравнение 6). Как правило, последнюю реакцию предпочтительно осуществлять в высококонцентрированных растворах или в объеме, тогда как циклизацию предпочтительно осуществлять при низких концентрациях. Если происходит внутримолекулярное сочетание диена с получением циклического алкена, то процесс называется метатезисом с замыканием кольца (уравнение 2). Циклические олефины могут быть открыты и олигомеризованы или полимеризованы (метатезисная полимеризация с раскрытием кольца, показанная в уравнении 5). Если алкилиденовый катализатор быстрее реагирует с циклическим олефином (например, норборненом или циклобутеном) чем с двойной связью углерод-углерод в растущей полимерной цепи, то может происходить "живая метатезисная полимеризация с раскрытием кольца", т.е. имеет место небольшое ограничение до или после реакции полимеризации. Деформированные кольца могут быть открыты с использованием алкилиденового катализатора со вторым алкеном согласно механизмам кросс-метатезиса. Движущей силой является облегчение деформирования кольца. Поскольку продукты содержат концевые винильные группы, может происходить множество дополнительных реакций кросс-метатезиса. Поэтому, условия реакции (время, концентрации, и.д.) должны быть оптимизированы для обеспечения желаемого продукта (уравнение 4). Ениновый метатезис представляет собой катализируемую металлкарбеном реакцию перегруппировки связи между алкинами и алкенами с получением 1,3-диенов. Межмолекулярный процесс называют перекрестным ениновым метатезисом (7), тогда как внутримолекулярные реакции называют ениновым метатезисом с замыканием кольца (RCEYM).
Большое коммерческое значение имеет кросс-метатезис двух реактантных олефинов, при этом каждый реактантный олефин содержит по меньшей мере один ненасыщенный участок, для получения новых олефинов, которые отличаются от реактантных олефинов. Один или несколько каталитических металлов, обычно один или несколько переходных металлов, как правило, катализируют реакцию кросс-метатезиса.
Одним таким коммерчески значимым применением является кросс-метатезис этилена и внутренних олефинов с получением альфа-олефинов, который обычно называют этенолиз. Более конкретно, кросс-метатезис этилена и внутреннего олефина с получением линейных α-олефинов представляет особую коммерческую ценность. Линейные α-олефины применимы в качестве мономеров или сомономеров в некоторых (со)полимерных поли-α-олефинах и/или в качестве промежуточных соединений при получении эпоксидов, аминов, оксоспиртов, синтетических смазок, синтетических жирных кислот и алкилированных ароматических соединений. Olefins Conversion Technology™, основанный на процессе "Триолефин" от Phillips (Phillips Triolefin Process), является примером реакции этенолиза, с превращением этилена и 2-бутена в пропилен. В этих процессах применяют гетерогенные катализаторы на основе вольфрама и оксидов рения, которые не зарекомендовали себя как эффективные для внутренних олефинов, содержащих функциональные группы, такие как цис-метилолеат, сложный метиловый эфир жирной кислоты.
1-Децен является побочным продуктом, как правило, полученным при кросс-метатезисе этилена и метилолеата. Алкилолеаты представляют собой сложные эфиры жирной кислоты, которые могут быть главными компонентами биодизеля, полученного переэтерификацией спирта и растительных масел. Растительные масла, содержащие по меньшей мере один участок ненасыщенности, включают в себя каноловое, соевое, пальмовое, арахисовое, горчичное, подсолнечное, тунговое, талловое, перилловое, масло виноградных косточек, рапсовое, льняное, сафлоровое, тыквенное, кукурузное и многие другие масла, экстрагированные из семян растений. Подобным образом, алкилэрукаты являются сложными эфирами жирной кислоты, которые могут быть главными компонентами в биодизеле. Применимыми биодизельными композициями являются те, которые, как правило, характеризуются высокими концентрациями олеата и сложных эфиров эруката. Такие сложные эфиры жирной кислоты предпочтительно характеризуются одним участком ненасыщенности так, что кросс-метатезис с этиленом дает 1-децен в качестве побочного продукта.
Растительные масла, используемые в приготовлении пищи (жарки мяса, овощей, и т.д.), могут быть рекуперированы, а после очищения, превращены с применением, например, этенолиза в применимые продукты, используемые в биодизеле.
Биодизель представляет собой топливо, полученное из возобновляемых источников, таких как растительные масла или животные жиры. Для получения биодизеля триацилглицериды, основные соединения растительных масел и животных жиров, превращают в алкиловые сложные эфиры жирной кислоты (т.е. биодизель) и глицерин путем реакции со спиртом в присутствии основного, кислотного или ферментативного катализатора. Биодизельное топливо может быть использовано в дизельных двигателях, либо отдельно, либо в смеси с дизелем на нефтяной основе, или может быть дополнительно модифицировано для получения других химических продуктов.
Известны некоторые металл-карбеновые комплексы для метатезиса олефинов, однако, различие между этими структурами может заключаться в карбеновой части. Патентные документы WO-A-96/04289 и WO-A-97/06185 являются примерами катализаторов метатезиса с общей структурой,
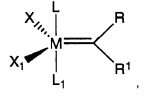
где
М представляет собой Os или Ru, R и R1 представляют собой органические части из карбенового фрагмента, который характеризуется большой структурной вариабельностью, X и X1 представляют собой анионные лиганды, a L и L1 представляют собой нейтральные доноры электронов. "Анионные лиганды" согласно литературе из области катализаторов метатезиса олефинов представляют собой лиганды, которые отрицательно заряжены и, таким образом, несут полную электронную оболочку, когда отделяются от металлического центра.
Хорошо известным примером этого класса соединений являются катализаторы Граббса 1-го поколения.
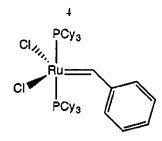
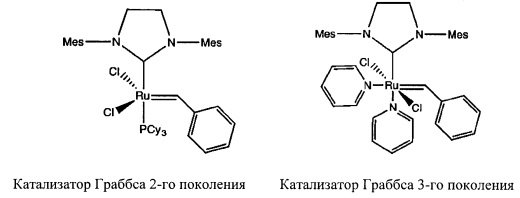
Другим хорошо известным примером этого класса соединений является катализатор Граббса 2-го поколения, который описан в WO-A-0071554, и гекса-координированный катализатор Граббса 3-го поколения, который описан в WO-А03/011455.
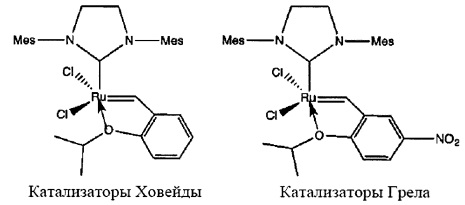
Существуют некоторые другие хорошо известные катализаторы, описанные в литературных источниках, которые особенно применимы в области метатезиса олефинов и которые служат общей информацией для такого применения. Такие катализаторы описываются в US 2002/0107138 А1 и WO-A-2004/035596 и известны, соответственно, как "катализаторы Ховейды" и "катализатор Грела".
Кроме того, известны другие катализаторы, в которых оба атома углерода карбенового фрагмента соединены мостиком, и некоторые из них представлены.
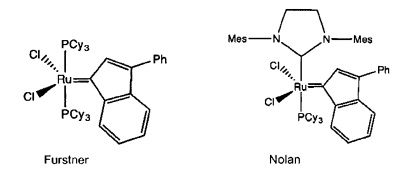
Мостиковый карбеновый фрагмент был впервые синтезирован Hill et al. (K.J. Harlow, A.F. Hill, J.D.E.T. Wilton-Ety, J. Chem. Soc. Dalton Trans. 1999, 285-291), однако, структура была описана неверно. Furstner et al. откорректировали это несоответствие (J. Org. Chem. 1999, 64, 8275-8280) и описали полную характеристику. Следовательно, происходит реорганизация, в результате чего атомы углерода карбенового фрагмента соединяются мостиком, и в этом конкретном случае образуется "3-фенил-инденилиденкарбен" (Chem. Eur. J. 2001, 7, No 22, 4811-4820). Аналоги этого катализатора, несущие один NHC-лиганд и один фосфиновый лиганд, были описаны Nolan в WO-A-00/15339. Эти типы соединений не только являются катализаторами метатезиса олефинов; но они также могут быть использованы как исходный продукт при получении других рутений-карбеновых соединений путем кросс-метатезиса (WO-A-2004/112951).
Более того, в US-A-2003/0100776 на странице 8, абзац [0087], описаны катализаторы, в которых атомы углерода карбеновой части соединены мостиком, и тем самым вновь образованная циклическая группа может быть алифатической или ароматической и может нести заместители или гетероатомы. Кроме того, указывается, что образовавшаяся кольцевая структура состоит из 4-12, а предпочтительно содержит 5-8 атомов. Однако не описываются или не приводятся точные кольцевые структуры или примеры.
В PCT/US 2010/059703 (WO 2011/100022 А2) описывается инденилиденовый катализатор, в котором один фосфиновый лиганд замещен нейтральным донорным лигандом, который связан с инденилиденкарбеном. Полученный в результате катализатор представляет собой 3-фенилинденилиденовый аналог катализатора Ховейды.
В PCT/US 2011/029690 (WO 2011/119778 А2) заявляется гекса-координированный катализатор, однако, в этом документе не были выделены катализаторы, раскрывается способ синтеза in-situ поколения катализаторов метатезиса олефинов, поскольку согласно Schrodi синтез таких комплексов является относительно трудоемким. Синтез, как правило, предусматривает более чем одну стадию и требует выделения катализаторов для удаления ингибирующих катализатор побочных продуктов, таких как выделившиеся фосфины. Все полученные in-situ образовавшиеся катализаторы являются фенилинденилиденовыми аналогами катализатора Ховейды.
До сих пор не известны другие катализаторы, характеризующиеся инденилиденовой структурой, в которых атомы углерода карбеновой части соединены мостиком.
Несмотря на успехи, достигнутые в получении и разработке катализаторов метатезиса олефинов, сохраняется потребность в новых улучшенных способах синтеза и в новых катализаторах. Особенный интерес представляют способы, которые обеспечивают получение новых катализаторов, которые могут быть легко получены в промышленном масштабе.
Кроме того, катализирующие метатезис соединения в соответствии с настоящим изобретением обеспечивают как мягкий и коммерчески экономичный, так и "атом-экономичный" путь для требуемых олефинов, которые в свою очередь могут быть применимыми в получении линейных альфа-олефинов, ненасыщенных полимеров, циклических олефинов и т.д.
Синтез RuCl2(РСу3)2(3-фенилинденилен) оказался применимым в обеспечении легкого пути получения рутений-алкилиденов, который позволяет избежать затратного получения диазосоединений (Platinum Metals Rev. 2005, 49, 33).
Для получения экономически конкурентного процесса в производстве линейных α-олефинов (например, 1-децена) путем кросс-метатезиса этилена и биодизеля (такого как животные или растительные масла), должны быть разработаны более высокоактивные катализаторы или более стабильные катализаторы. Более того, сохраняется потребность в разработке катализаторов с эквивалентными или более высокими эксплуатационными характеристиками, но синтезируемых непосредственно из менее дорогих и легко доступных исходных материалов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
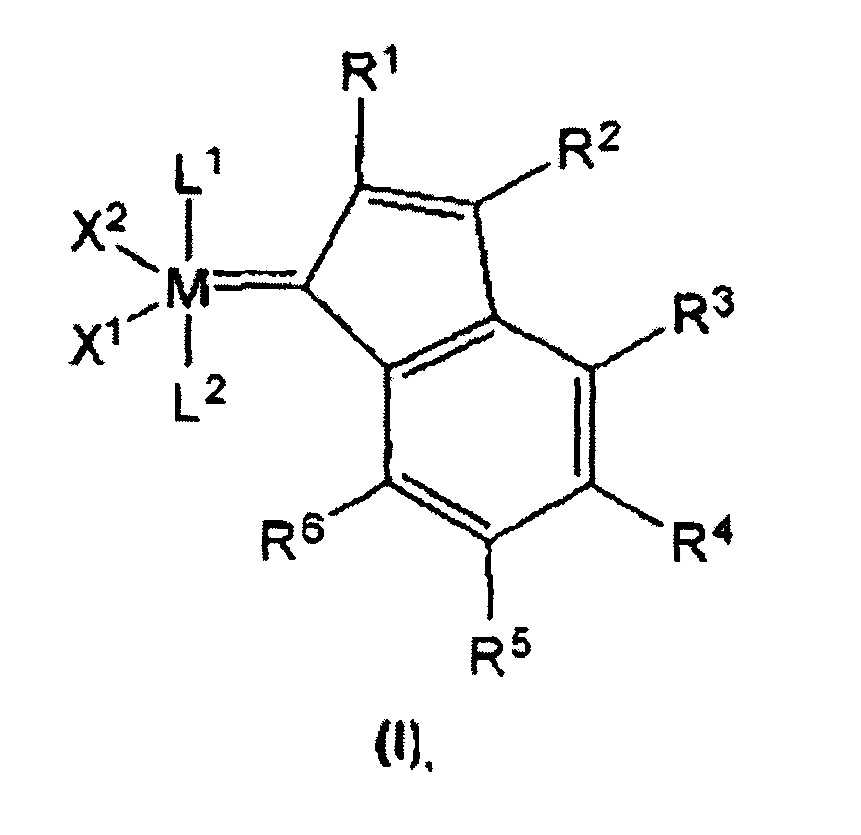
Настоящее изобретение направлено на решение одной или нескольких из вышеупомянутых проблем. Настоящее изобретение основывается на неожиданном открытии того, что улучшенные катализаторы метатезиса олефинов с общей структурой формулы (I) могут быть получены путем модификации алкилиденовой части катализаторов группы 8 из уровня техники. Настоящее изобретение также основано на неожиданном открытии того, что время синтеза металлорганических соединений формулы (I) может быть уменьшено до одного часа или менее при сохранении высоких выходов.
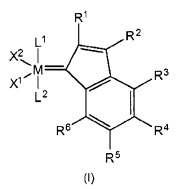
Металлорганическое каталитическое соединение в соответствии с настоящим изобретением может быть получено путем контакта содержащего металл группы 8 соединения-предшественника с ацетиленовым соединением, которое, в качестве альтернативы, может нести хелатирующий фрагмент,
где
М представляет собой металл группы 8, предпочтительно рутений или осмий,
R1-R6 являются идентичными или разными и выбраны из гидрокарбила, замещенного гидрокарбила, содержащего гетероатом гидрокарбила, замещенного содержащего гетероатом гидрокарбила и функциональных групп,
где, в качестве альтернативы, в каждом случае два непосредственно смежных радикала из группы R1-R6, в том числе атомы углерода в кольце, к которым они присоединены посредством циклической образующей мостик группы, образуют одну или несколько циклических структур, в том числе ароматических структур,
где, в качестве альтернативы, R6 необязательно соединен мостиком с другим лигандом катализатора на основе комплекса металл-карбен,
X1 и X2 являются идентичными или разными и представляют собой два лиганда, предпочтительно анионных лиганда.
L1 и X1 могут быть соединены с образованием мультидентатной моноанионной группы и могут формировать отдельное кольцо, содержащее до 30 отличных от водорода атомов, или многоядерную кольцевую систему, содержащую до 30 отличных от водорода атомов;
L1 и L2 являются идентичными или разными лигандами, предпочтительно представляющими собой нейтральные доноры электронов, где L2 может быть соединен мостиком, в качестве альтернативы, посредством радикала R6.
В другом аспекте настоящее изобретение относится к новым металл органическим соединениям вышеприведенной структуры.
В следующем аспекте в настоящем изобретении предусматривают способ синтеза указанного катализатора с карбеновым лигандом, предусматривающий обеспечение контакта соединения-предшественника формулы (X1X2ML3) или (X1X2ML4) с ацетиленовым соединением, необязательно содержащим хелатирующий фрагмент, где для соединения-предшественника
М представляет собой переходный металл группы 8;
X1 и X2 являются идентичными или разными и представляют собой два лиганда, предпочтительно анионных лиганда; и
L представляет собой нейтральные лиганды-доноры электронов.
В еще одном аспекте в настоящем изобретении указанный способ включает: смешивание соединения-предшественника формулы (X1X2ML3) или (X1X2ML4) с ацетиленовым соединением в растворе кислотного/полярного растворителя; нагревание раствора от 40°С до 200°С, предпочтительно от 50°С до 150°С, более предпочтительно от 60°С до 100°С, при этом раствор нагревали менее 10 часов, предпочтительно менее 8 часов, более предпочтительно менее 5 часов, наиболее предпочтительно менее 3 часов; удаление полярного растворителя и добавление неполярного растворителя; фильтрование и промывку полученной в результате суспензии с использованием того же неполярного растворителя; где молярное отношение соединения-предшественника к ацетиленовому соединению составляет 0,66.
В еще одном аспекте настоящее изобретение относится к применению указанного катализатора в реакциях метатезиса олефинов, в частности, метатезиса с замыканием кольца (RCM), кросс-метатезиса (СМ), метатезиса с раскрытием кольца (ROM), метатезисной полимеризации с раскрытием кольца (ROMP), метатезиса ациклических диенов (ADMET), самометатезиса, реакции алкенов с алкинами (ениновых реакциях), полимеризации алкинов и олефинирования карбонилов.
В контексте настоящего изобретения все вышеупомянутые и нижеупомянутые определения, параметры или пояснения в общих или предпочтительных диапазонах по отношению друг к другу, а также в соответствующих диапазонах и предпочтительных диапазонах могут быть комбинированы любым способом.
В контексте настоящего изобретения в отношении различных типов метатезисных катализаторов термин "замещенный" означает, что атом водорода или атом замещен определенной группой или атомом, и валентность указанного атома не превышается, и замещение приводит к стабильному соединению.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
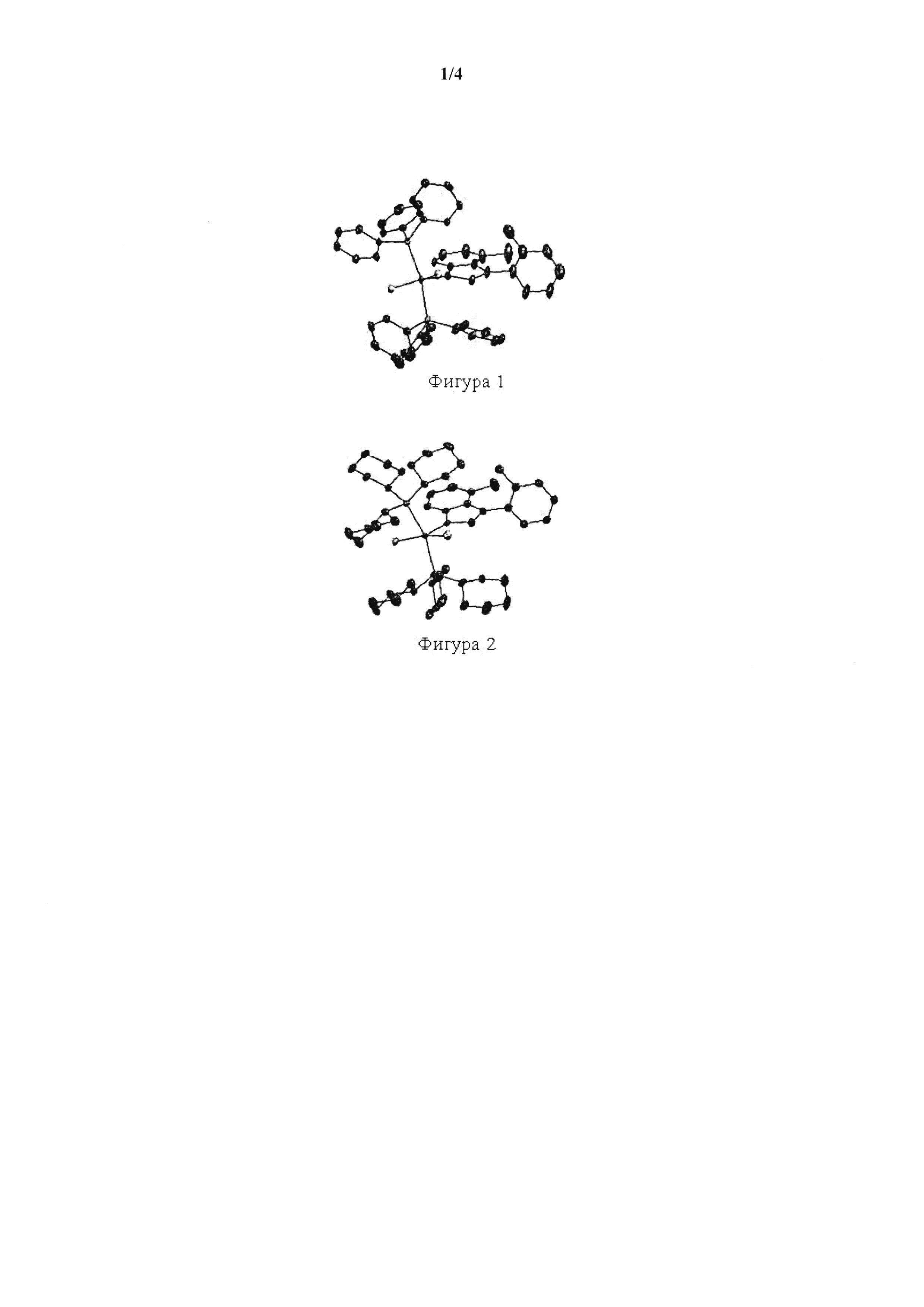
На фигуре 1 представлена кристаллическая структура (PPh3)2Cl2Ru(3-2-метилфенил-5-метилинден-1-илидена) (1D).
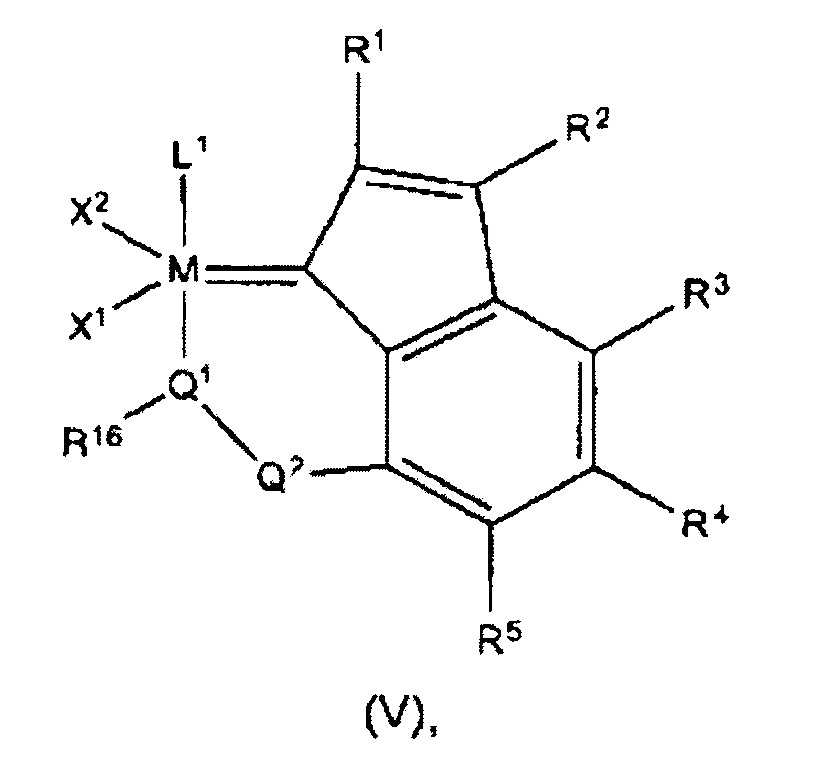
На фигуре 2 представлена кристаллическая структура (РСу3)2Cl2Ru(3-2-метилфенил-5-метилинден-1-илидена) (8).
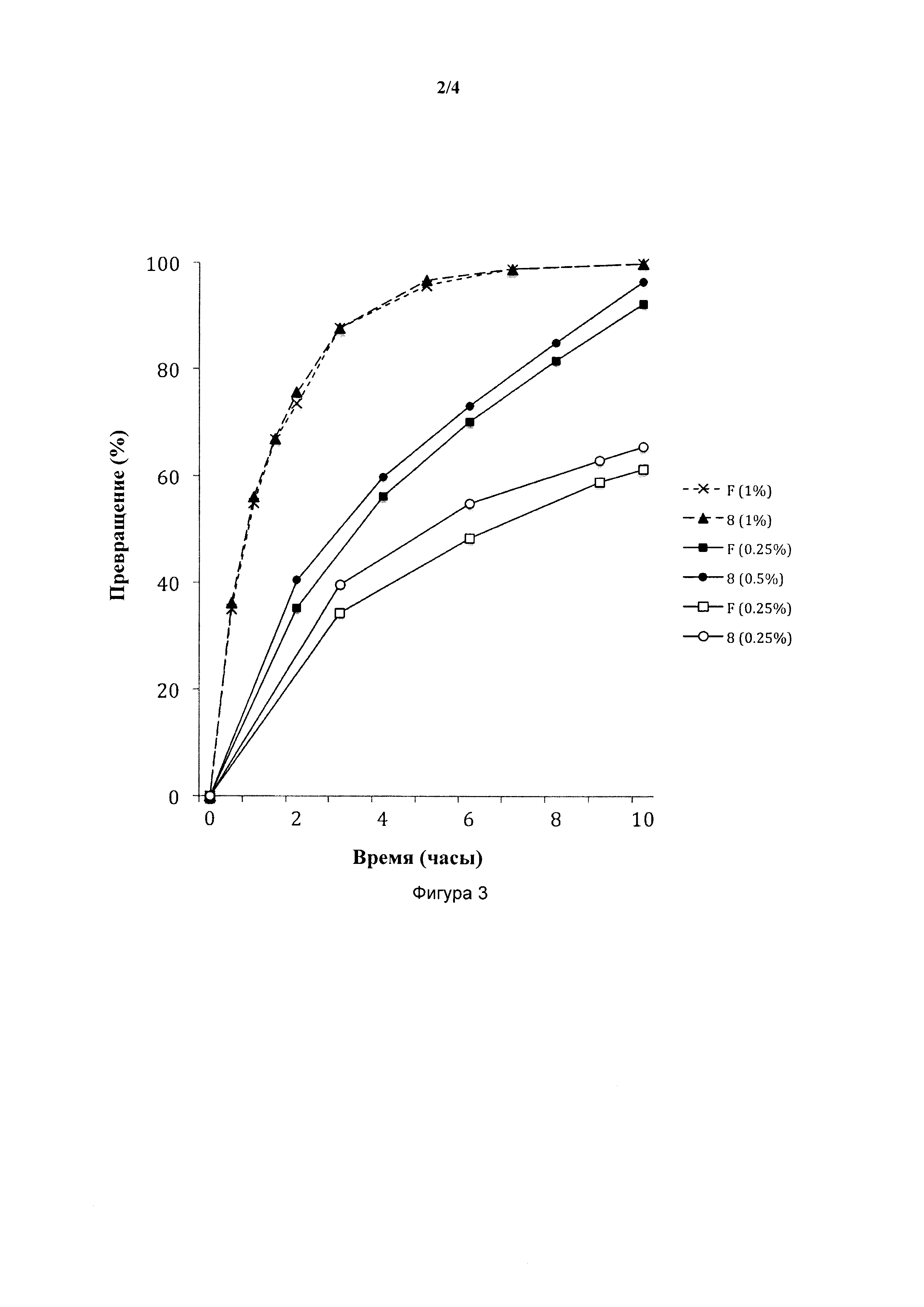
На фигуре 3 представлен RCM диэтил-2-аллил-2-(2-метилаллил)малоната с использованием катализаторов F и 8 (0,25-1 мол. %) в CH2Cl2 при 38°С.
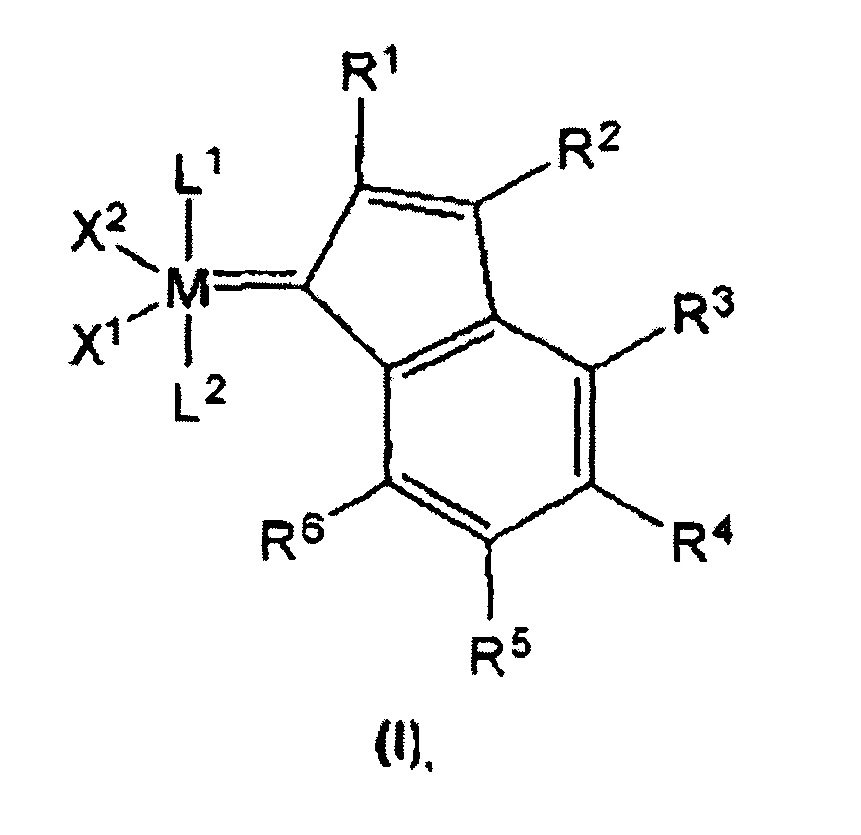
На фигуре 4 представлен RCM диэтил-2-аллил-2-(2-метилаллил)малоната с использованием 0,15 мол. % катализаторов F, 8, 11, 13 и 17.
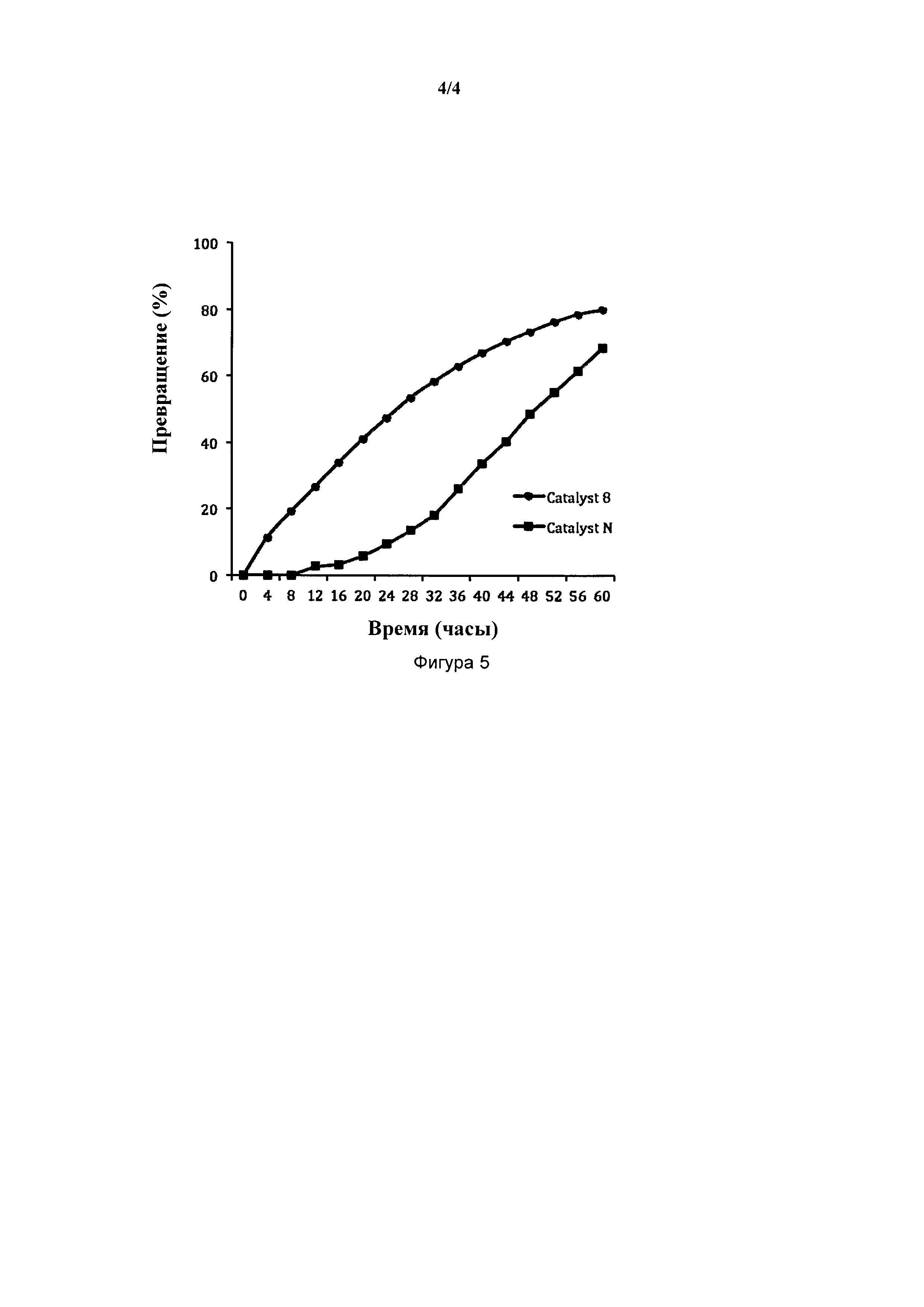
На фигуре 5 представлен ROMP цикло-октадиена с использованием катализаторов (PCy3)2Cl2Ru(3-2-метилфенил-5-метилинден-1-илидена (8) и (PCy3)(SIMes)Cl2Ru(фенилинден-1-илидена) (N).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Терминология и определения
Если не упоминается иное, настоящее изобретение не ограничивается специфическими реагентами, заместителями, катализаторами, условиями реакции, или подобным, которые по сути могут варьировать. Также следует понимать, что терминология используется в настоящем документе исключительно с целью описания конкретных вариантов осуществления и не предназначена для ограничения.
В настоящем описании и в следующей формуле изобретения упоминается ряд терминов, которые определяются следующими значениями.
Используемый в настоящем документе термин "алкил" относится к линейной, разветвленной или циклической насыщенной углеводородной группе, как правило, хотя не обязательно, содержащей от 1 до приблизительно 24 атомов углерода, предпочтительно от 1 до приблизительно 12 атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, октил, децил и т.д., а также циклоалкильным группам, таким как циклопентил, циклогексил и т.д. Как правило, хотя опять таки не обязательно, алкильные группы в настоящем документе содержат от 1 до приблизительно 12 атомов углерода. Термин "С1-С6-алкил" означает алкильную группу из 1-6 атомов углерода, а специальный термин "циклоалкил" означает циклическую алкильную группу, как правило, содержащую 3-8 атомов углерода.
Термин "замещенный алкил" относится к алкилу, замещенному одной или несколькими группами-заместителями, а термины "содержащий гетероатом алкил" и "гетероалкил" относятся к алкилу, у которого по меньшей мере один атом углерода замещен гетероатомом. Если не указано иное, термин "алкил" включает в себя линейный, разветвленный, циклический, незамещенный, замещенный и/или содержащий гетероатом алкил.
Используемый в настоящем документе термин "алкилен" относится к бифункциональной линейной, разветвленной или циклической алкильной группе, при этом "алкил" определен выше.
Используемый в настоящем документе термин "алкенил" относится к линейной, разветвленной или циклической углеводородной группе, содержащей от 2 до приблизительно 24 атомов углерода, содержащей по меньшей мере одну двойную связь, такой как этенил, н-пропенил, изопропенил, н-бутенил, изобутенил, октенил, деценил, тетрадеценил, гексадеценил, эйкозенил и т.д. Предпочтительные алкенильные группы по настоящему документу содержат от 2 до приблизительно 12 атомов углерода. Термин "циклоалкенил" означает циклическую алкенильную группу, предпочтительно содержащую 5-8 атомов углерода. Термин "замещенный алкенил" относится к алкенилу, замещенному одной или несколькими группами-заместителями, а термины "содержащий гетероатом алкенил" и "гетероалкенил" относятся к алкенилу, в котором по меньшей мере один атом углерода замещен гетероатомом. Если не указано иное, термин "алкенил" включает в себя линейный, разветвленный, циклический, незамещенный, замещенный и/или содержащий гетероатом алкенил.
Используемый в настоящем документе термин "алкенилен" относится к бифункциональной линейной, разветвленной или циклической алкенильной группе, при этом "алкенил" определен выше.
Используемый в настоящем документе термин "алкинил" относится к линейной или разветвленной углеводородной группе, содержащей от 2 до приблизительно 24 атомов углерода и содержащей по меньшей мере одну тройную связь, такой как этинил, н-пропинил и т.д. Предпочтительные алкинильные группы по настоящему документу содержат от 2 до приблизительно 12 атомов углерода. Термин "замещенный алкинил" относится к алкинилу, замещенному одной или несколькими группами-заместителями, а термины "содержащий гетероатом алкинил" и "гетероалкинил" относятся к алкинилу, в котором по меньшей мере один атом углерода замещен гетероатомом. Если не указано иное, термин "алкинил" включает в себя линейный, разветвленный, незамещенный, замещенный и/или содержащий гетероатом алкинил, соответственно.
Используемый в настоящем документе термин "алкокси" означает алкильную группу, соединенную с помощью одинарной концевой эфирной связи; то есть "алкокси"-группа может быть представлена как -О-алкил, где алкил определен выше. Аналогичным образом, "алкенилокси" относится к алкенильной группе, соединенной с помощью одинарной концевой эфирной связи, а "алкинилокси" относится к алкинильной группе, соединенной с помощью одинарной концевой эфирной связи.
Используемый в настоящем документе термин "арил", если не указано иное, относится к ароматическому заместителю, содержащему отдельное ароматическое кольцо или несколько ароматических колец, которые конденсированы вместе, непосредственно связаны или опосредованно связаны (так, что разные ароматические кольца связаны с общей группой, такой как метиленовый или этиленовый фрагмент). Предпочтительные арильные группы содержат 5-24 атомов углерода, а особенно предпочтительные арильные группы содержат 5-14 атомов углерода. Иллюстративные арильные группы содержат одно ароматическое кольцо или два конденсированных или связанных ароматических кольца, например, фенил, нафтил, бифенил, дифениловый эфир, дифениламин, бензофенон и т.д. "Замещенный арил" относится к арильному фрагменту, замещенному одной или несколькими группами-заместителями, а термины "содержащий гетероатом арил" и "гетероарил" относятся к арильным заместителям, у которых по меньшей мере один атом углерода замещен гетероатомом, как будет более подробно описано infra.
Используемый в настоящем документе термин "арилокси" относится к арильной группе, соединенной с помощью одинарной концевой эфирной связи, где "арил" определен выше. Группа "арилокси" может быть представлена как -О-арил, где арил определен выше. Предпочтительные арилоксигруппы содержат 5-24 атомов углерода, а особенно предпочтительные арилоксигруппы содержат 5-14 атомов углерода. Примеры арилоксигрупп включают в себя без ограничения фенокси, о-галоген-фенокси, м-галоген-фенокси, п-галоген-фенокси, о-метокси-фенокси, м-метокси-фенокси, п-метокси-фенокси, 2,4-диметокси-фенокси, 3,4,5-триметокси-фенокси и т.д.
Термин "алкарил" относится к арильной группе с алкильным заместителем, а термин "аралкил" относится к алкильной группе с арильным заместителем, где "арил" и "алкил" определены выше. Предпочтительные алкарильные и аралкильные группы содержат 6-24 атомов углерода. Алкарильные группы включают в себя без ограничения, например, п-метилфенил, 2,4-диметилфенил, п-циклогексилфенил, 2,7-диметилнафтил, 7-циклооктилнафтил, 3-этил-циклопента-1,4-диен и т.д. Примеры аралкильных групп включают в себя без ограничения бензил, 2-фенил-этил, 3-фенил-пропил, 4-фенил-бутил, 5-фенил-пентил, 4-фенилциклогексил, 4-бензилциклогексил, 4-фенилциклогексилметил, 4-бензилциклогексилметил и т.д. Термины "алкарилокси" и "аралкилокси" относятся к заместителям формулы -OR, где R представляет собой алкарил или аралкил, соответственно, как уже определено.
Термин "ацил" относится к заместителям формулы -(СО)-алкил, -(СО)-арил или -(СО)-аралкил, а термин "ацилокси" относится к заместителям формулы -О(СО)-алкил, -O(СО)арил или -O(СО)-аралкил, где "алкил", "арил" и "аралкил" определены выше.
Термины "циклическая" и "кольцевая" относятся к алициклическим или ароматическим группам, которые могут быть или могут не быть замещены и/или содержат гетероатом и которые могут быть моноциклическими, бициклическими или полициклическими. Используемый в традиционном смысле термин "алициклический" относится к алифатическому циклическому фрагменту, в противоположность ароматическому циклическому фрагменту, и может быть моноциклическим, бициклическим или полициклическим.
Используемый в традиционном смысле термины "галоген" и "галогеновый" относятся к заместителю хлору, брому, фтору или йоду.
"Гидрокарбил" относится к одновалентным гидрокарбильным радикалам, содержащим от 1 до приблизительно 30 атомов углерода, предпочтительно от 1 до приблизительно 24 атомов углерода, наиболее предпочтительно от 1 до приблизительно 12 атомов углерода, в том числе линейные, разветвленные, циклические, насыщенные и ненасыщенные части молекулы, такие как алкильные группы, алкенильные группы, арильные группы и т.д. Термин "гидрокарбилен" означает двухвалентный гидрокарбильный фрагмент, содержащий от 1 до приблизительно 30 атомов углерода, предпочтительно от 1 до приблизительно 24 атомов углерода, наиболее предпочтительно от 1 до приблизительно 12 атомов углерода, в том числе линейные, разветвленные, циклические, насыщенные и ненасыщенные части молекулы. "Замещенный гидрокарбил" относится к гидрокарбилу, замещенному одной или несколькими группами-заместителями, а термины "содержащий гетероатом гидрокарбил" и "гетерогидрокарбил" относятся к гидрокарбилу, в котором по меньшей мере один атом углерода замещен гетероатомом. Подобным образом, "замещенный гидрокарбилен" относится к гидрокарбилену, замещенному одной или несколькими группами-заместителями, а термины "содержащий гетероатом гидрокарбилен" и "гетерогидрокарбилен" относятся к гидрокарбилену, в котором по меньшей мере один атом углерода замещен гетероатомом. Если не указано иное, термины "гидрокарбил" и "гидрокарбилен" следует понимать как замещенные и/или содержащие гетероатом гидрокарбильные и гидрокарбиленовые фрагменты, соответственно.
Термин "содержащий гетероатом" как в "содержащей гетероатом гидрокарбильной группе" относится к углеводородной молекуле или к гидрокарбильному молекулярному фрагменту, в котором один или несколько атомов углерода замещены атомом, отличным от углерода, например, азотом, кислородом, серой, фосфором или кремнием, как правило, азотом, кислородом или серой. Подобным образом, термин "гетероалкил" относится к алкильному заместителю, который содержит гетероатом, термин "гетероциклический" относится к циклическому заместителю, который содержит гетероатом, термины "гетероарил" и "гетероароматический", соответственно относятся к "арильным" и "ароматическим" заместителям, которые содержат гетероатом и т.д. Следует отметить, что "гетероциклические" группа или соединение могут быть или могут не быть ароматическими, а также что "гетероциклы" могут быть моноциклическими, бициклическими или полициклическими, как описано выше в отношении термина "арил." Примеры гетероалкильных групп включают в себя алкоксиалкил, замещенный алкилсульфанилом алкил, н-алкилированный аминоалкил и т.д. Примеры гетероарильных заместителей включают в себя пирролил, пирролидинил, пиридинил, хинолинил, индолил, пиримидинил, имидазолил, 1,2,4-триазолил, тетразолил и т.д., а примерами содержащих гетероатом алициклических групп являются пирролидино, морфолино, пиперазино, пиперидино и т.д.
"Замещенный" как в "замещенном гидрокарбиле", "замещенном алкиле", "замещенном ариле" и т.д., как указано в некоторых вышеупомянутых определениях, означает, что в гидрокарбиле, алкиле, ариле или другом фрагменте по меньшей мере один атом водорода, связанный с атомом углерода (или другим), замещен одним или несколькими отличными от водорода заместителями. Примеры таких заместителей включают в себя без ограничения функциональные группы, такие как галоген, гидроксил, сульфгидрил, С1-С24алкокси, С2-С24алкенилокси, С2-С24алкинилокси, С5-С24арилокси, С6-С24аралкилокси, С6-С24алкарилокси, ацил (в том числе С2-С24алкилкарбонил (-СО-алкил) и С6-С24арилкарбонил (-СО-арил)), ацилокси (-О-ацил, в том числе С2-С24алкилкарбонилокси (-О-СО-алкил) и С6-С24арилкарбонилокси (-O-СО-арил)), С2-С24алкоксикарбонил (-(СО)-О-алкил), С6-С24арилоксикарбонил (-(СО)-О-арил), галогенкарбонил (-СО)Х, где X представляет собой галоген), С2-С24алкилкарбонато (-О-(СО)-О-алкил), С6-С24арилкарбонато (-О-(СО)-О-арил), карбокси (-СООН), карбоксилато (-СОО-), карбамоил (-(CO)-NH2), моно-(С1-С24алкил)замещенный карбамоил (-(СО)-NH(С1-С24алкил)), ди-(С1-С24алкил)-замещенный карбамоил (-(СО)N(С1-С24алкил)2), моно-(С5-С24арил)-замещенный карбамоил (-(СО)-NH-арил), ди-(С5-С24арил)-замещенный карбамоил (-(СО)-N(C5-С24арил)2), N((С1-С24алкил)(С5-С24арил))-замещенный карбамоил, тиокарбамоил(-(CS)-NH2), моно-(С1-С24алкил)-замещенный тиокарбамоил (-(CS)NH(С1-С24алкил)), ди-(С1-С24алкил)-замещенный тиокарбамоил (-(CS)-N(С1С24алкил)2), моно-(С5-С24арил)-замещенный тиокарбамоил (-(CS)-NH-арил), ди-(С5-С24арил)-замещенный тиокарбамоил ((CS)-N(С5-С24арил)2), N-(C1-С24алкил) N-(С5-С24арил)-замещенный тиокарбамоил, карбамидо (NH-(CO)-NH2), циано (-C=N), цианато (-O-C=N), тиоцианато (-S-C=N), формил (-(СО)-Н), тиоформил (-(CS)-H), амино (-NH2), моно-(С1-С24алкил)-замещенный амино, ди-(С1-С24алкил)-замещенный амино, моно-(С5-С24арил)-замещенный амино, ди-(С5-С24арил)-замещенный амино, С2-С24алкиламидо (-NH-(СО)-алкил), С6-С24ариламидо (-NH-(СО)-арил), имино (-CR=NH, где R = водород, С1-С24алкил, С5-С24арил, С6-С24алкарил, С6-С24аралкил и т.д.), С2-С20алкилимино (-CR=N(алкил), где R = водород, С1-С24алкил, С5-С24арил, С6-С24алкарил, С6-С24аралкил и т.д.), арилимино (-CR=N(арил), где R = водород, С1-С20алкил, С5-С24арил, С6-С24алкарил, С6-С24аралкил и т.д.), нитро (-NO2), нитрозо (-NO), сульфо (-SO2-OH), сульфонато (-SO2-O-), С1-С24алкилсульфанил (-S-алкил; также называемый "алкилтио"), С5-С24арилсульфанил (-S-арил; также называемый "арилтио"), С1-С24алкилсульфинил (-(SO)-алкил), С5-С24арилсульфинил (-(SO)-арил), С1-С24алкилсульфонил (-SO2-алкил), С5-С24арилсульфонил (-SO2-арил), борил (-ВН2), бороно (-В(ОН)2), боронато (-B(OR)2), где R представляет собой алкил или другой гидрокарбил), фосфоно (-Р(O)(ОН)2), фосфонато (-Р(O)(O-)2), фосфинато (-Р(O)(O-)), фосфо (-PO2) и фосфино (-РН2); и гидрокарбильные фрагменты: С1-С24алкил (предпочтительно С1-С12алкил, более предпочтительно С1-С6алкил), С2-С24алкенил (предпочтительно С2-С12алкенил, более предпочтительно С2-С6алкенил), С2-С24алкинил (предпочтительно С2-С12алкинил, более предпочтительно С2-С6алкинил), С5-С24арил (предпочтительно С5-С24арил), С6-С24алкарил (предпочтительно С6-С16алкарил) и С6-С24аралкил (предпочтительно С6-С16аралкил).
"Функционализированный", например, "функционализированный гидрокарбил", "функционализированный алкил", "функционализированный олефин", "функционализированный циклический олефин" и т.д., означает, что в гидрокарбиле, алкиле, олефине, циклическом олефине или в другом фрагменте по меньшей мере один атом водорода, связанный с атомом углерода (или другим), замещен одной или несколькими функциональными группами, такими как описанные выше.
Кроме того, вышеупомянутые функциональные группы, если позволяет конкретная группа, могут быть дополнительно замещены одной или несколькими дополнительными функциональными группами или одним или несколькими гидрокарбильными фрагментами, такими как специально приведенные выше. Аналогичным образом, вышеупомянутые гидрокарбильные фрагменты могут быть дополнительно замещены одной или несколькими функциональными группами или дополнительными гидрокарбильными фрагментами, такими как специально упомянутые.
Настоящее изобретение предусматривает новое семейство катализирующих метатезис соединений, применимых для различных типов реакций метатезиса олефинов, в том числе без ограничения метатезиса с замыканием кольца (RCM), кросс-метатезиса (СМ), метатезиса с раскрытием кольца (ROM), метатезисной полимеризации с раскрытием кольца (ROMP), метатезиса ациклических диенов (ADMET), самометатезиса, превращения олефинов с алкинами (енинового метатезиса), полимеризации алкинов, этиленового кросс-метатезиса и т.д.,
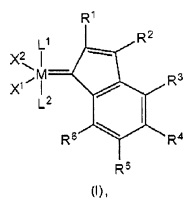
и где
М представляет собой металл группы 8, предпочтительно рутений или осмий,
R1-R6 являются идентичными или разными и представляют собой водород, галоген, гидроксил, альдегид, кето, тиол, CF3, нитро, нитрозо, циано, тиоциано, изоцианаты, карбодиимид, карбамат, тиокарбамат, дитиокарбамат, амино, амидо, имино, аммоний, силил, сульфонат (-SO3-), -OSO3-, -РО3- или -ОРО3-, ацил, ацилокси или представляют собой алкил, циклоалкил, алкенил, циклоалкенил, замещенный алкенил, гетероалкенил, содержащий гетероатом алкинил, алкенилен, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, карбоксилат, алкокси, алкенилокси, алкинилокси, арилокси, алкарил, аралкил, алкарилокси, аралкилокси, алкоксикарбонил, алкиламино-, алкилтио-, арилтио, алкилсульфонил, алкилсульфинил, диалкиламино, алкиламмоний, алкилсилил или алкоксисилил, при этом каждый из этих радикалов необязательно может быть замещен одной или несколькими вышеупомянутыми группами, определенными для R1-R6,
или, в качестве альтернативы, в каждом случае два непосредственно смежных радикала из группы R1-R6, в том числе атомы углерода в кольце, к которым они присоединены посредством циклической образующей мостик группы, образуют одну или несколько циклических структур, в том числе ароматических структур, или, в качестве альтернативы, R6 необязательно соединен мостиком с другим лигандом, основанным на комплексе металл-карбен катализатора,
С1-С6алкил представляет собой без ограничения, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутип, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, неопентил, 1-этилпропил и н-гексил.
С3-С8циклоалкил включает в себя без ограничения циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил.
С6-С24арил включает в себя ароматический радикал с 6-24 скелетными атомами углерода. Предпочтительные моно-, би- или трициклические карбоциклические ароматические радикалы содержат 6-10 скелетных атомов углерода, например, без ограничения фенил, бифенил, нафтил, фенантренил или антраценил.
X1 и X2 являются идентичными или разными и представляют собой два лиганда, предпочтительно анионных лиганда.
В общих формулах X1 и X2 могут представлять собой, например, водород, галоген, псевдогалоген, неразветвленный или разветвленный С1-С30алкил, С6-С24арил, С1-С20алкокси, С6-С24арилокси, С3-С20алкилдикетонат, С6-С24арилдикетонат, С1-С20карбоксилат, С1-С20алкилсульфонат, С6-С24арилсульфонат, С1-С20алкилтиол, С6-С24арилтиол, С1-С20алкилсульфонильный или С1-С20алкилсульфинильный радикалы.
Вышеупомянутые радикалы X1 и X2, кроме того, могут быть замещены одним или несколькими дополнительными остатками, например, галогеном, предпочтительно фтором, С1-С20алкилом, С1-С20алкокси или С6-С24арилом, при этом эти группы необязательно могут быть, в свою очередь, замещены одним или несколькими заместителями из группы, содержащей галоген, предпочтительно фтор, С1-С5алкил, С1-С5алкокси и фенил.
X1 и X2 могут быть соединены с образованием дианионной группы и могут формировать отдельное кольцо, содержащее до 30 отличных от водорода атомов, или многоядерную кольцевую систему, содержащую до 30 отличных от водорода атомов.
L1 и X1 могут быть соединены с образованием мультидентатной моноанионной группы и могут формировать отдельное кольцо, содержащее до 30 отличных от водорода атомов, или многоядерную кольцевую систему, содержащую до 30 отличных от водорода атомов;
В предпочтительном варианте осуществления X1 и X2 являются идентичными или разными и обозначают галоген, в частности, фтор, хлор, бром или йод, бензоат, С1-С5карбоксилат, С1-С5алкил, фенокси, С1-С5алкокси, С1-С5алкилтиол, С6-С24арилтиол, С6-С24арил или С1-С5алкилсульфонат.
В особенно предпочтительном варианте осуществления X1 и X2 являются идентичными и представляют собой хлор, CF3COO, СН3СОО, CFH2COO, (СН3)3СО, (CF3)2(CH3)CO, (CF3)(CH3)2CO, PhO (фенокси), C6F5O (пентафторфенокси), МеО (метокси), EtO (этокси), тозилат (п-СН3-C6H4-SO3), мезилат (2,4,6-триметилфенил) или CF3SO3 (трифторметансульфонат).
L1 и L2 являются идентичными или разными лигандами, предпочтительно представляющими собой нейтральные доноры электронов, где L2 может быть соединен мостиком, в качестве альтернативы, посредством радикала R6.
Два лиганда L1 и L2 могут быть, например, идентичными друг другу и представляют собой фосфин, сульфонированный фосфин, фосфат, фосфинит, фосфонит, фосфит, арсин, стибин, эфир, амин, амид, сульфоксид, карбоксил, нитрозил, пиридин, замещенного пиридин, пиразин, тиокарбонил, тиоэфир, н-гетероциклический карбен ("NHC"), замещенный NHC или циклический алкиламинокарбен (СААС) или замещенный СААС.
Предпочтительно два лиганда L1 и L2 независимо друг от друга представляют собой фосфиновый лиганд формулы P(L3)3, при этом L3 являются идентичными или разными и представляют собой алкил, предпочтительно С1-С10алкил, более предпочтительно С1-С5-алкил, циклоалкил, предпочтительно С3-С20циклоалкил, более предпочтительно С3-С8циклоалкил, предпочтительно циклопентил, циклогексил и неопентил, арил, предпочтительно С6-С24арил, более предпочтительно фенил или толуил, С1-С10алкилфосфабициклононан, С3-С20циклоалкилфосфабициклононан, сульфонированный фосфиновый лиганд формулы P(L4)3, где L4 представляет собой моно- или полисульфонированный L3-лиганд; С6-С24арил- или С1-С10алкилфосфинитный лиганд, С6-С24арил- или С1-С10алкилфосфонитный лиганд, С6-С24арил- или С1-С10алкилфосфитный лиганд, С6-С24арил- или С1-С10алкиларсиновый лиганд, С6-С24арил- или C1-С10алкиламинные лиганды, пиридиновый лиганд, С6-С24арил- или С1-С10алкилсульфоксидный лиганд, С6-С24арил- или С1-С10алкилэфирый лиганд или С6-С24арил- или C1-С10алкиламидные лиганды, все из которых могут быть многократно замещенными, например, фенильной группой, где эти заместители, в свою очередь, необязательно замещены одним или несколькими из галогена, С1-С5алкил- или С1-С5алкоксирадикалов.
Термин "фосфин" включает в себя, например, PPh3, Р(п-Tol)3, P(o-Tol), PPh(CH3)2, P(CF3)3, P(п-FC6H4)3, P(п-CF3C6H4)3, P(C6H4-SO3Na)3, P(CH2C6H4-SO3Na)3, Р(изопропил)3, Р(СНСН3(СН2СН3))3, Р(циклопентил)3, Р(циклогексил)3, Р(неопентил)3 и циклогексил-фосфабициклононан.
Термин "фосфинит" включает в себя, например, трифенилфосфинит, трициклогексилфосфинит, триизопропилфосфинит и метилдифенилфосфинит.
Термин "фосфит" включает в себя, например, трифенилфосфит, трициклогексилфосфит, три-трет-бутилфосфит, триизопропилфосфит и метилдифенилфосфит.
Термин "стибин" включает в себя, например, трифенилстибин, трициклогексилстибин и триметилстибин.
Термин "сульфонат" включает в себя, например, трифторметансульфонат, тозилат и мезилат.
Термин "сульфоксид" включает в себя, например, CH3S(=O)CH3 и (С6Н5)2SO.
Термин "тиоэфир" включает в себя, например, CH3SCH3, C6H5SCH3, CH3OCH2CH2SCH3 и тетрагидротиофен.
Термин "пиридин" в настоящей заявке является общим термином и включает в себя без ограничения все содержащие азот лиганды, описанные Grubbs в WO-A-03/011455. Примерами являются пиридин, пиколины (α-, β- и γ-пиколин), лутидины (2,3-, 2,4-, 2,5-, 2,6-, 3,4- и 3,5-лутидин), коллидин (2,4,6-триметилпиридин), трифторметилпиридин, фенилпиридин, 4-(диметиламино)пиридин, хлорпиридины (2-, 3- и 4-хлорпиридин), бромпиридины (2-, 3- и 4-бромпиридин), нитропиридины (2-, 3- и 4-нитропиридин), хинолин, пиримидин, пиррол, имидазол и фенилимидазол.
N-гетероциклический карбен (NHC), как правило, характеризуется структурой формул (IIa) или (IIb):
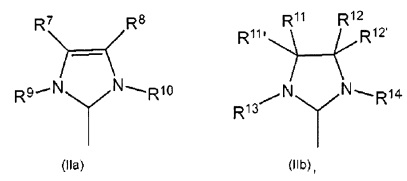
в которых R7-R14, R11', R12' являются идентичными или разными и представляют собой водород, галоген, гидроксил, альдегид, кето, тиол, CF3, нитро, нитрозо, циано, тиоциано, изоцианаты, карбодиимид, карбамат, тиокарбамат, дитиокарбамат, амино, амидо, имино, аммоний, силил, сульфонат (-SO3-), -OSO3-, -PO3- или -OPO3-, ацил, ацилокси или представляет собой алкил, циклоалкил, алкенил, циклоалкенил, замещенный алкенил, гетероалкенил, содержащий гетероатом алкинил, алкенилен, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, карбоксилат, алкокси, алкенилокси, алкинилокси, арилокси, алкарил, аралкил, алкарилокси, аралкилокси, алкоксикарбонил, алкиламмоний, алкиламино-, алкилтио-, арилтио, алкилсульфонил, алкилсульфинил, диалкиламино, алкилсилил или алкоксисилил, при этом каждый из этих радикалов необязательно может быть замещен одной или несколькими вышеупомянутыми группами, определенными для R1-R6. Необязательно один или несколько из радикалов R7-R14, R11', R12' независимо друг от друга могут быть замещены одним или несколькими заместителями, предпочтительно неразветвленным или разветвленным С1-С10алкилом, С3-С8циклоалкилом, С1-С10алкокси или С6-С24арилом, при этом эти вышеупомянутые заместители, в свою очередь, могут быть замещены одним или несколькими радикалами, предпочтительно выбранными из группы, содержащей галоген, особенно хлор или бром, С1-С5алкил, С1-С5алкокси и фенил.
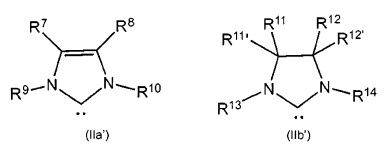
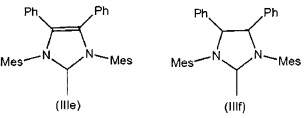
В качестве уточнения, изображаемые структуры N-гетероциклического карбена в общих формулах (IIa) и (IIb) сравнимы с N-гетероциклическими карбенами, описанными в литературе, где часто используются структуры (IIa') и (IIb'), которые демонстрируют карбеновый характер N-гетероциклического карбена. Это также применимо к соответствующим предпочтительным показанным ниже структурам (IIIa)-(IIIf).
В предпочтительном варианте осуществления катализаторы общих формул (IIa) и (IIb) R7, R8, R11, R11', R12 и R12' независимо друг от друга обозначают водород, С6-С24арил, особенно предпочтительно фенил, неразветвленный или разветвленный С1-С10алкил, особенно предпочтительно пропил или бутил, или вместе с включением атомов углерода, к которым они присоединены, образуют циклоалкил или арильный радикал, где все вышеупомянутые радикалы необязательно являются замещенными, могут быть замещены одним или несколькими дополнительными радикалами, выбранными из группы, содержащей неразветвленный или разветвленный С1-С10алкил, С1-С10алкокси, С6-С24арил, и функциональная группа выбрана из группы, состоящей из гидрокси, тиола, тиоэфира, кетона, альдегида, сложного эфира, простого эфира, амина, имина, амида, нитро, карбоновой кислоты, дисульфида, карбоната, изоцианата, карбодиимида, карбоалкокси, карбамата и галогена.
В особенно предпочтительном варианте осуществления катализаторы общих формул (IIa) и (IIb) содержат один или два N-гетероциклических карбена (NHC) в качестве лигандов L1 и L2, где радикалы R9, R10, R13 и R14 являются идентичными или разными и представляют собой неразветвленный или разветвленный С1-С10алкил, особенно предпочтительно изопропил или неопентил, С3-С10циклоалкил, предпочтительно адамантил, С6-С24арил, особенно предпочтительно фенил, C1-С10алкилсульфонат, особенно предпочтительно метансульфонат, С1-С10арилсульфонат, особенно предпочтительно п-толуолсульфонат.
При необходимости вышеупомянутые остатки являются замещенными, как значения R9, R10, R13 и R14, одним или несколькими дополнительными радикалами, выбранными из группы, содержащей неразветвленный или разветвленный С1-С5алкил, в частности, метил, С1-С5алкокси, арил, и функциональной группой, выбранной из группы, состоящей из гидрокси, тиола, тиоэфира, кетона, альдегида, сложного эфира, простого эфира, амина, имина, амида, нитро, карбоновой кислоты, дисульфида, карбоната, изоцианата, карбодиимида, карбоалкокси, карбамата и галогена.
В частности, радикалы R9, R10, R13 и R14 могут быть идентичными или разными и обозначают изопропил, неопентил, адамантил, мезитил или 2,6-диизопропилфенил.
Особенно предпочтительные N-гетероциклические карбены (NHC) характеризуются следующими структурами (IIIa)-(IIIf), при этом измерения для каждого из них приведены для 2,4,6-триметилфенильного радикала или, в качестве альтернативы, во всех случаях для 2,6-диизопропилфенильного радикала.
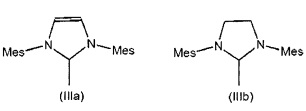
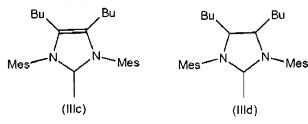
В других применимых вариантах осуществления одна из N-групп, связанных с карбеном в формуле (IIa) или (IIb), замещена другим гетероатомом, предпочтительно S, О или Р, предпочтительно гетероатомом S. Другие применимые N-гетероциклические карбены включают в себя соединения, описанные в Hermann, W A. Chem. Eur. J 1996, 2, 772 и 1627; Enders, D. et al., Angew. Chem. Int. Ed. 1995, 34, 1021; Alder R.W., Angew. Chem. Int. Ed. 1996, 35, 1121; и Bertrand, G. et al., Chem. Rev. 2000, 100, 39.
Для целей настоящего изобретения и его формулы изобретения "циклические алкиламинокарбены" (СААС) представлены формулой (IV):
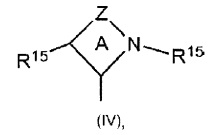
где кольцо А представляет собой 4-, 5-, 6- или 7-членное кольцо, a Z представляет собой связывающую группу, содержащую один - четыре связанных вершинных атома, выбранных из группы, содержащей С, О, N, В, Al, Р, S и Si, при этом доступные валентности необязательно заняты водородом, оксо или R-заместителями, где R независимо выбран из группы, содержащей С1-С12гидрокарбильные группы, замещенные С1-С12гидрокарбильные группы и галогениды, и каждый R15 независимо представляет собой гидрокарбильную группу или замещенную гидрокарбильную группу с 1-40 атомами углерода, предпочтительно метил, этил, пропил, бутил (в том числе изобутил и н-бутил), пентил, циклопентил, гексил, циклогексил, октил, циклооктил, нонил, децил, циклодецил, додецил, циклододецил, мезитил, адамантил, фенил, бензил, толуил, хлорфенил, фенол или замещенный фенол.
Некоторые особенно применимые СААС включают в себя:
Другие применимые СААС включают в себя соединения, описанные в патенте США №7312331 и в Bertrand et al, Angew. Chem. Int. Ed. 2005, 44, 7236-7239.
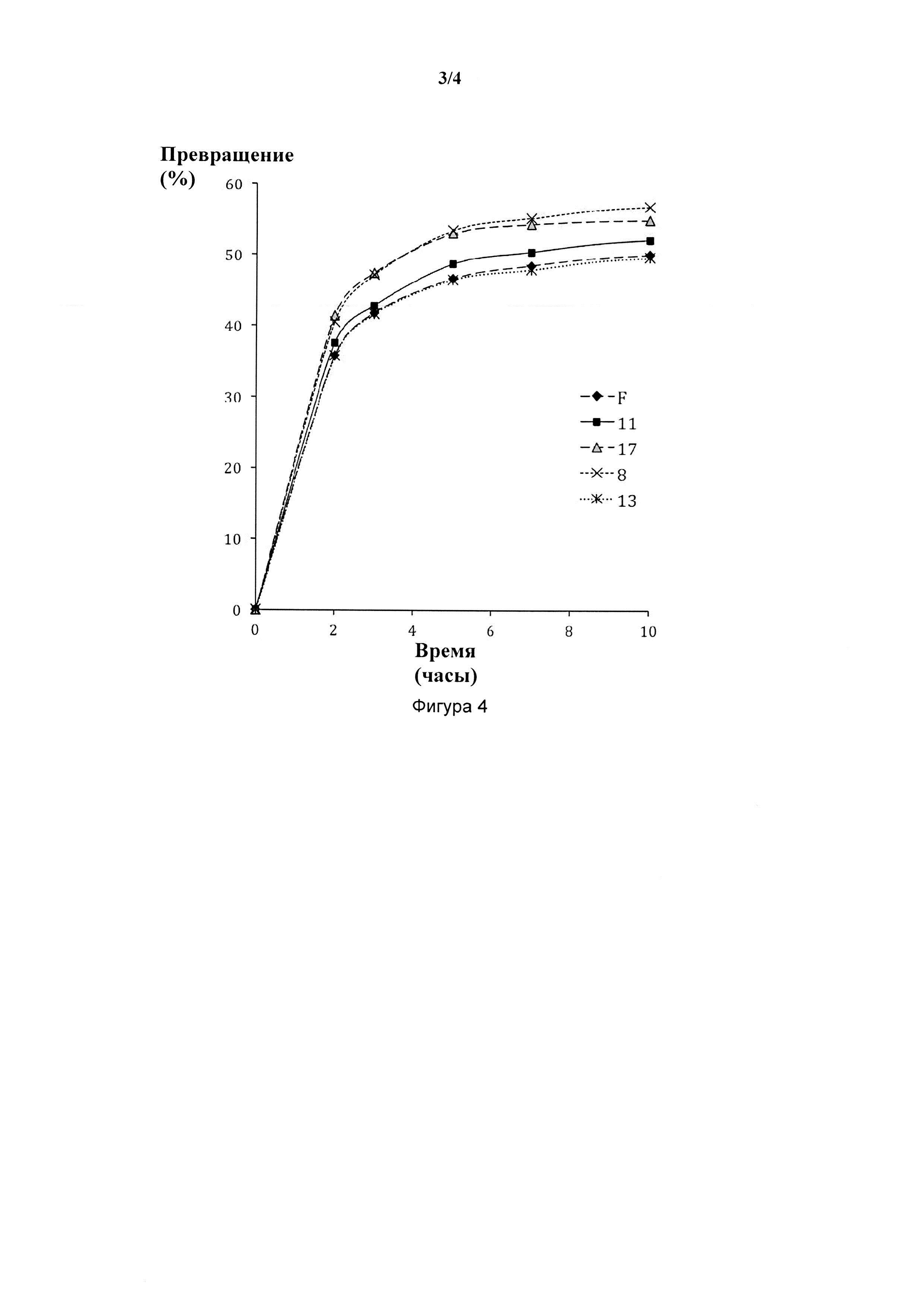
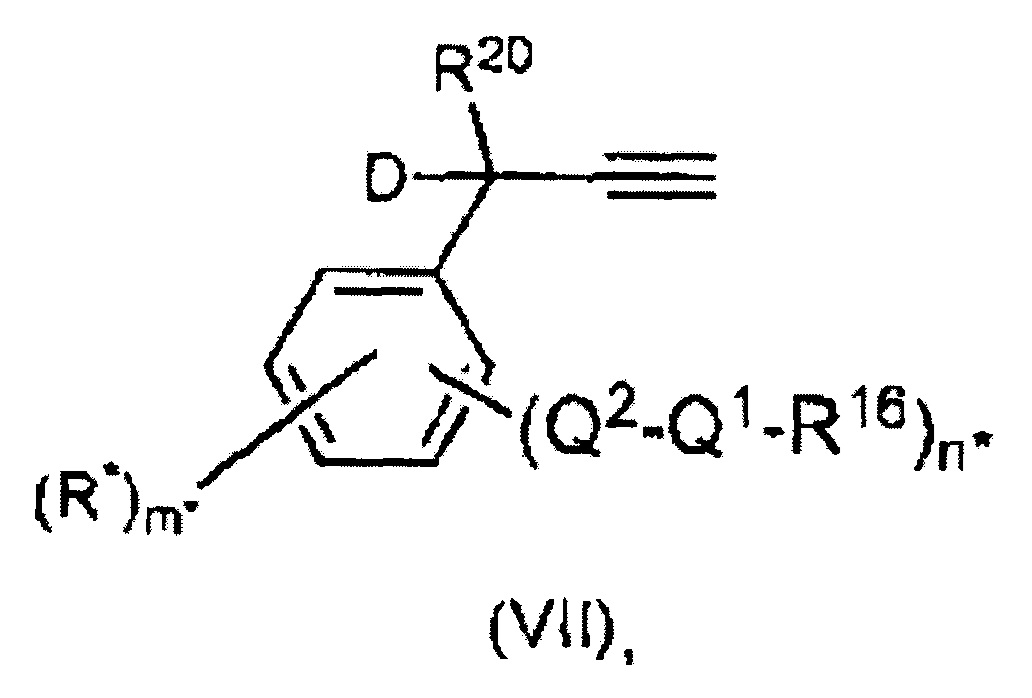
Для случая, когда радикал R6 соединен мостиком с другим лигандом катализатора в соответствии с настоящим изобретением с общей формулой (I), могут быть представлены следующие примеры со структурами общей формулы (V).
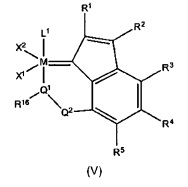
Q1 представляет собой кислород, серу, радикал N-R17 или P-R17, где R17 имеет следующее значение,
R16 и R17, одинаковые или разные, могут представлять собой алкил, циклоалкил, алкенил, алкинил, арил, алкокси, алкенилокси, алкинилокси, арилокси, алкоксикарбонил, алкиламин, алкиламмоний, алкилтио, арилтио, алкилсульфонильный или алкилсульфинильный радикал, все из которых необязательно могут быть замещены одним или несколькими из алкильного, галогенового, алкокси-, арильного или гетероарильного радикалов. R16 и R17 могут быть связаны вместе с образованием циклических структур.
Q2 представляет собой -(СН2)r-, при этом r = 1, 2 или 3, -С(=O)-СН2-, -С(=O)-, -N=CH-, -N(H)-C(=O)-,
-(CHR18)-, -(CR18R19)- или, в качестве альтернативы, полная структурная единица "Q1(R16)-Q2" представляет собой одну из следующих групп (-N(R16)=CH-CH2-), (-N(R16,R17)=CH-CH2-), и
где R18 и R19 имеют те же значения, что и R16 и R17. Кроме того, два или несколько R-радикалов, выбранных из R16, R17, R18 или R19, могут быть соединены вместе с образованием циклических структур, где М, X1, X2, L1, R1-R5 имеют те же значения, что и в общей формуле (I).
В качестве примеров катализаторов в соответствии с настоящим изобретением могут быть упомянуты следующие структуры:
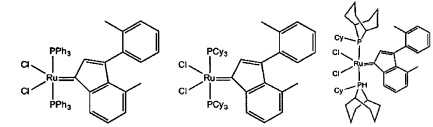
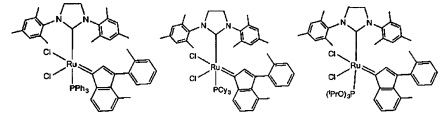
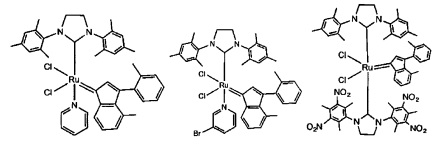
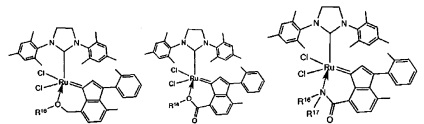
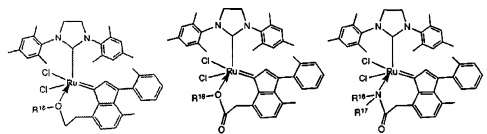
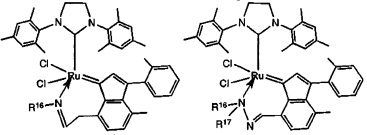
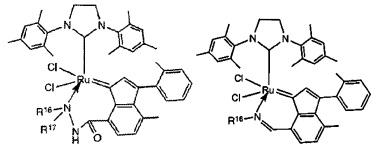
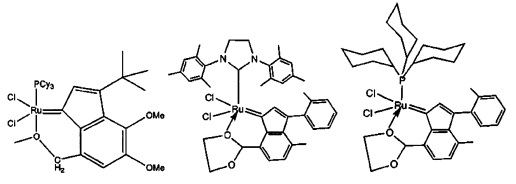
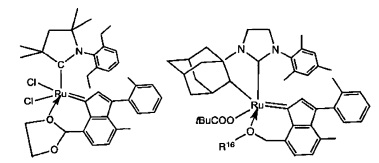
В определенных вариантах осуществления каталитическое соединение, используемое в процессах метатезиса олефинов, может быть связано с твердой подложкой катализатора или осаждены на ней. Твердая подложка катализатора обеспечит гетерогенность каталитического соединения, что упростит восстановление катализатора. Кроме того, подложка катализатора может повысить силу и устойчивость к износу катализатора. Приемлемые подложки катализатора включают в себя без ограничения кремнеземные, глиноземные, кремнезем-глиноземные, алюмосиликатные, в том числе цеолиты и другие кристаллические пористые алюмосиликаты; а также оксид титана, циркония, магния, содержащие углерод и сшитые сетчатые полимерные смолы, такие как функционализированные сшитые полистиролы, например, хлорметил-функционализированные сшитые полистиролы. Каталитическое соединение может быть осаждено на подложку любым способом, известным специалистам в данной области, в том числе, например, пропитыванием, ионообменным, осаждением-отложением и осаждением из паровой фазы. В качестве альтернативы, каталитическое соединение может быть химически связанным с подложкой посредством одной или нескольких ковалентных химических связей, например, каталитическое соединение может быть иммобилизовано одной или несколькими ковалентными связями с одним или несколькими заместителями инденилиденового лиганда, или непосредственно связано посредством одной или нескольких химических связей с металлом группы 8 путем замещения одного или нескольких анионных лигандов, или иммобилизовано посредством одной или нескольких химических связей между лигандом L1 и подложкой.
Если используется подложка катализатора, то каталитическое соединение может быть загружено на подложку катализатора в любом количестве, при условии, что процесс метатезиса протекает до получения необходимых продуктов метатезиса. Как правило, каталитическое соединение загружают на подложку в количестве, которое больше приблизительно 0,01 вес. % металла группы 8 от общего веса каталитического соединения с подложкой. Как правило, каталитическое соединение загружают на подложку в количестве, которое составляет менее приблизительно 20 вес. % металла группы 8 от общего веса каталитического соединения с подложкой.
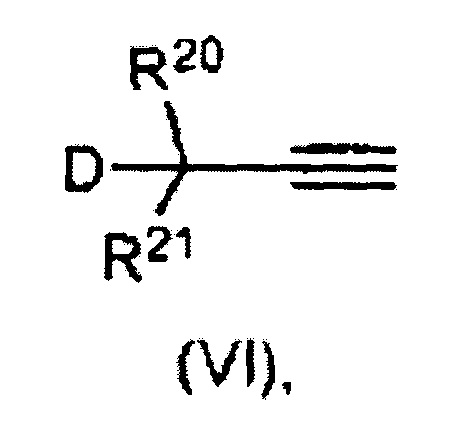
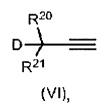
В целом, ацетиленовые соединения, применимые в соответствии с настоящим изобретением, могут содержать хелатирующий фрагмент формулы (VI),
где
D представляет собой уходящую группу;
R20-R21 определены ниже и могут содержать R16-Q1-Q2;
R20 выбран из водорода, галогена, алкила, алкенила, алкинила, арила, гетероалкила, содержащего гетероатом алкенила, гетероалкенила, гетероарила, алкокси, алкенилокси, арилокси, алкоксикарбонила, карбонила, алкиламино, алкилтио, аминосульфонила, моноалкиламиносульфонила, диалкиламиносульфонила, алкилсульфонила, нитрила, нитро, алкилсульфинила, тригалогеналкила, перфторалкила, карбоновой кислоты, кетона, альдегида, нитрата, циано, изоцианата, гидроксила, сложного эфира, простого эфира, амина, имина, амида, замещенного галогеном амида, трифторамида, сульфида, дисульфида, сульфоната, карбамата, силана, силоксана, фосфина, фосфата или бората, и где, если R20 представляет собой арил, полиарил или гетероарил, то R20 может быть замещен любой комбинацией из R1, R2, R3, R4, R5 и R6 и может быть связан с любым из R1, R2, R3, R4, R5 и R6 с образованием одной или нескольких циклических ароматических или неароматических групп.
R21 выбран из аннуленов общей формулы CnHn (если n представляет собой четное число) или CnHn+1 (если n представляет собой нечетное число). Хорошо известными типичными соединениями аннуленов без ограничения являются циклобутадиен, бензол и циклооктатетраен. Аннулены могут быть ароматическими или антиароматическими. Каждый атом Н в аннуленовом фрагменте может быть замещен галогеном, алкилом, алкенилом, алкинилом, арилом, гетероалкилом, содержащим гетероатом алкенилом, гетероалкенилом, гетероарилом, алкокси, алкенилокси, арилокси, алкоксикарбонилом, карбонилом, алкиламино, алкилтио, аминосульфонилом, моноалкиламиносульфонилом, диалкиламиносульфонилом, алкилсульфонилом, нитрилом, нитро, алкилсульфинилом, тригалогеналкилом, перфторалкилом, карбоновой кислотой, кетоном, альдегидом, нитратом, циано, изоцианатом, гидроксилом, сложным эфиром, простым эфиром, амином, имином, амидом, галоген-замещенным амидом, трифторамидом, сульфидом, дисульфидом, сульфонатом, карбаматом, силаном, силоксаном, фосфином, фосфатом или боратом, и при этом, если R21 представляет собой арил, полиарил или гетероарил, то R21 может быть замещен любой комбинацией из R1, R2, R3, R4, R5 и может быть связан с любым из R1, R2, R3, R4, R5 и R6 с образованием одной или нескольких циклических ароматических или неароматических групп.
Примеры приемлемых уходящих групп включают в себя без ограничения гидроксил, галогенид, сложный эфир, пергалогенированный фенил, ацетат, бензоат, С2-С6ацил, С2-С6алкоксикарбонил, С1-С6алкил, фенокси, С1-С6алкокси, С1-С6алкилсульфанил, арил или С1-С6алкилсульфонил. В еще более предпочтительных вариантах осуществления D выбран из гидроксила, галогенида, CF3CO2, CH3CO2, CFH2CO2, (СН3)3СО, (CF3)2(CH3)CO, (CF3)(CH3)2CO, PhO, МеО, EtO, тозилата, мезилата или трифторметан-сульфоната. В конкретных вариантах осуществления D преимущественно представляет собой гидроксил (ОН).
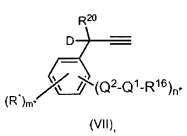
Предпочтительные органические ацетиленовые соединения характеризуются формулой (VII),
где
Q1, Q2 и R16 определены выше;
n* представляет собой целое число от 0 до 5;
m* представляет собой целое число от 1 до 5; и m*=5-n*;
R* выбран из R1, R2, R3, R4, R5 и R6 или их комбинаций, определенных выше. D и R20 определены выше.
Предпочтительные органические ацетиленовые соединения включают в себя:
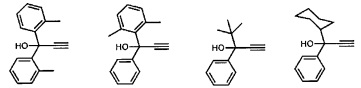
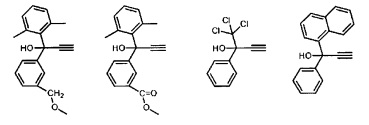
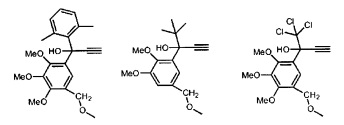
Синтез катализирующих метатезис соединений
Каталитические соединения, описываемые в настоящем изобретении, могут быть синтезированы любыми способами, известными специалистам в данной области.
Типичные типы способов синтеза содержащего элемент из группы 8 каталитического соединения, описываемого в настоящем документе, включают в себя, например, обработку раствора лиганда в приемлемом растворителе, таком как диоксан, реактантным комплексом металла группы 8, таким как дихлорбис(трифенилфосфин)рутений(II), и хлороводородом (в диоксане). Реакционная смесь может быть нагрета в течение периода времени, необходимого для получения желаемого модифицированного инденилиденового каталитического соединения. Как правило, удаление летучих соединений и промывка гексаном обеспечивают содержащее элемент группы 8 модифицированное инденилиденовое каталитическое соединение с высоким выходом.
Затем, при необходимости, может быть добавлен фосфиновый лиганд, такой как трициклогексилфосфин, циклогексил-фосфабициклононан, фосфинит или фосфинит. Реакционные условия, как правило, включают в себя смешивание содержащего элемент группы 8 реактантного каталитического соединения и предпочтительного фосфинового лиганда в приемлемом растворителе, например, дихлорметане, в течение времени, достаточного для выполнения обмена фосфиновых лигандов, при приемлемой температуре, как правило, температуре окружающей среды.
В случае обмена фосфиновых лигандов будут приведены характеристические значения ЯМР для атома Н при С8 и для Р новых соединений.
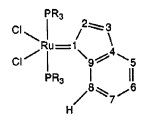
Несмотря на то, что в настоящем изобретении описывается ряд комплексов переходных металлов, применимых в катализе реакций метатезиса, следует понимать, что такие комплексы могут быть образованы in situ. Следовательно, могут быть добавлены дополнительные лиганды в реакционный раствор в виде отдельных соединений или могут быть образованы комплексы с металлическим центром с образованием металл-лигандного комплекса до введения в реакцию.
Далее приводятся протоколы синтеза для типичных 1,1-замещенных проп-2-ин-1-оловых лигандов и соответствующих рутений-алкилиденовых комплексов. Другие замещенные проп-2-ин-1-оловые лиганды и их соответствующие металлические комплексы могут быть получены аналогичным образом.
Пример 1: Синтез (PPh3)2Cl2Ru(3-2-метилфенил-5-метилинден-1-илидена)
Схема 1: Синтез (PPh3)2Cl2Ru(3-2-метилфенил-5-метилинден-1-илидена)
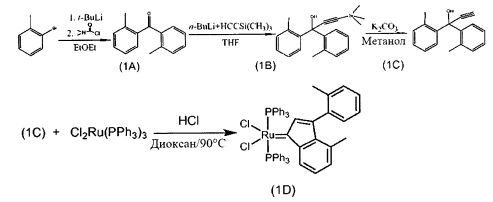
Стадия 1: Бис(2-метилфенилметанон (1А)
В раствор 2-бромтолуола (2 экв., 2,6 мл, 21,79 ммоля) в 26 мл диэтилового эфира при -90°С каплями добавляли трет-BuLi (1,9 М в пентане) (3 экв., 32,7 ммоля, 17,2 мл). Раствор перемешивали в течение 30 минут при комнатной температуре, а затем каплями добавляли N,N-диметилкарбамоилхлорид (1 экв., 1 мл, 10,9 ммоля), реакционную смесь перемешивали еще 3 часа. Неочищенную реакционную смесь гасили с использованием 35 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу промывали водой и водную фазу дважды экстрагировали диэтиловым эфиром, а затем эфирные фракции объединяли и сушили безводным MgSO4. Удаляли MgSO4 фильтрацией, а затем очищали с использованием колоночной флэш-хроматографии (силикагель, гексан в качестве растворителя) и окончательно выпаривали растворитель и получали белое твердое вещество 0,93 г (40,6%).
1Н ЯМР (300 МГц, CDCl3, TMS): δ 7,38 (td, 2Н), 7,29 (td, 4Н), 7,20 (td, 2Н), 2,44 (s, 6Н).
13С ЯМР (75 МГц, CDCl3): δ 200,79, 139,01, 138,17, 131,43, 131,07, 130,31, 125,42, 20,67.
Стадия 2: 1,1-Бис-метилфенил-3-(триметилсилил)проп-2-ин-1-ол (1B)
Каплями добавляли n-BuLi (2,5 М в гексанах) (1,5 экв., 5,7 мл, 14,28 ммоля) в перемешиваемый раствор триметилсилилацетилена (1,5 экв., 2 мл, 14,28 ммоля) в безводном THF (17 мл) при -90°С в атмосфере аргона. После добавления полученный в результате раствор перемешивали еще 5 минут в холодной бане, а затем перемешивали в течение 30 минут при комнатной температуре. Затем в раствор медленно добавляли бис(2-метилфенил)метанон (9,52 ммоля, 2 г) в 17 мл безводного THF при -90°С и обеспечивали нагревание полученной в результате смеси и нагревали с обратным холодильником в течение 30 минут. Неочищенную реакционную смесь гасили с использованием 15 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу промывали водой, водную фазу объединяли и дважды экстрагировали простым эфиром, после чего эфирные фракции объединяли и сушили безводным MgSO4. После удаления MgSO4 фильтрацией и выпаривания растворителя получали желтую жидкость в количественном выходе. Полученный продукт использовали без дополнительной очистки.
1Н ЯМР (300 МГц, CDCl3, TMS): δ 7,95 (dd, 2Н), 7,27 (dd, 4Н), 7,15 (dd, 2Н) 2,75 (s, 1Н) 2,14 (s, 6Н), 0,27(d, 9Н).
13С ЯМР (75 МГц, CDCl3): δ 141,01, 136,76, 132,37, 128,13, 127,45, 125,58, 107,10, 92,44, 75,01,21,40, 0,00.
Стадия 3: 1,1-Бис-2-метилфенил-проп-2-ин-1-ол (1С):
Раствор 1,1-бис-метилфенил-3-(триметилсилил)проп-2-ин-1-ола, полученный на предыдущей стадии, и K2CO3 (1 экв., 1,3 г, 9,52 ммоля) в безводном метаноле (10 мл) перемешивали при комнатной температуре в течение 3 часов. Необработанную реакционную смесь гасили с использованием 20 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу промывали водой и водную фазу дважды экстрагировали диэтиловым эфиром, а затем эфирные фракции объединяли и сушили безводным MgSO4. Удалением MgSO4 фильтрацией, а затем очисткой с использованием колоночной флэш-хроматографии (силикагель, гексан/EtOA = 30/1) и окончательным выпариванием растворителя получали желтоватое твердое вещество (2,06 г, 92% выход для стадий 2+3).
1Н ЯМР (300 МГц, CDCl3, TMS): δ 7,95 (m, 2Н), 7,23 (m, 4Н), 7,09 (m, 2Н) 2,89 (s, 1Н) 2,67 (s, 1Н),2,02 (s, 6Н).
13С ЯМР (75 МГц, CDCl3): δ 140,60, 136,33, 132,30, 128,19, 127,24, 125,58, 85,52, 76,80, 74,75, 21,16.
ESI [М-ОН]: 219,1, рассчитанный: 219,1.
Стадия 4: (PPh3)2Cl2Ru(3-2-метилфенил-5-метилфенил-инден-1-илиден) (1D)
(PPh3)3RuCl2 (1 экв., 0,575 г, 0,6 ммоля) и 1,1-бис-2-метилфенил-проп-2-ин-1-ол (соединение С, 1,5 экв., 0,213 г, 0,9 ммоля) добавляли в 4 мл раствора HCl/диоксана (0,15 моля/л). Раствор нагревали до 90°С в течение 3 часов, после чего растворитель удаляли под вакуумом. В колбу добавляли гексан (20 мл) и твердое вещество удаляли со стенок с помощью ультразвука.
Полученную в результате суспензию фильтровали и дважды промывали с использованием гексана (5 мл). Оставшийся растворитель выпаривали с получением красно-коричневого порошка; 0,52 г (выход: 95%). Продукт характеризовали с помощью ЯМР спектров 1Н и 31Р.
1Н ЯМР (300 МГц, CDCl3, TMS): δ 7,56 (dd, 11Н), 7,37 (t, 6Н), 7,21-7,31 (m, 13Н), 7,09 (тетра, 3Н), 6,95 (t, 3Н), 6,47 (t, 1H), 6,14 (s, 1H), 2,20 (s, 3Н), 1,66 (s, 3Н).
31Р ЯМР (121,49 МГц, CDCl3): δ 29,33.
Пример 2: Синтез (PPh3)2Cl2Ru(3-2-метоксифенил-5-метоксиинден-1-илидена)
Схема 2: Синтез (PPh3)2Cl2Ru(3-2-метоксифенил-5-метоксиинден-1-илидена) (2D)
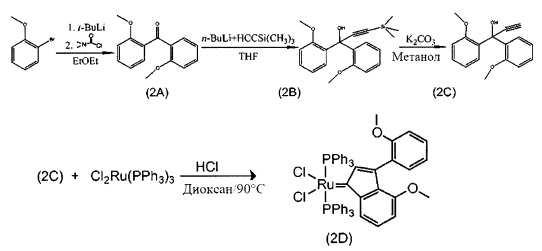
Стадия 1: Бис(2-метоксифенил)метанон (2А)
В суспензию 2-броманизола (2 экв., 6,61 г, 35,4 ммоля) в 42 мл безводного диэтилового эфира при -90°С каплями добавляли раствор t-BuLi (1,9 М в пентане) (2,6 экв., 24,2 мл, 46,0 ммоля). Обеспечивали нагревание раствора до комнатной температуры. Через полчаса каплями добавляли N,N-диметилкарбамоилхлорид (1 экв., 1,9 г, 17,7 ммоля) и реакционную смесь перемешивали еще 3 часа. Неочищенную реакционную смесь гасили с использованием 50 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу промывали водой и водную фазу дважды экстрагировали эфиром, а затем эфирные фракции объединяли и сушили безводным MgSO4. Неочищенный продукт очищали с помощью колоночной флэш-хроматографии (силикагель, гексан/EtOAc = 8:1) с получением 4,11 г белого твердого вещества (выход: 96,0%).
1Н ЯМР (300 МГц, CDCl3): δ 7,51 (dd, 2Н), 7,41 (m, 2Н), 6,97 (td, 2Н), 6,90 (d, 2Н), 3,64 (s, 6Н).
13С ЯМР: δ 195,35, 158,32, 132,64, 130,38, 120,34, 111,49, 55,68.
Стадия 2: 1,1-Бис(2-метоксифенил-3-(триметилсилил)проп-2-ин-1-ол (2В)
Каплями добавляли n-BuLi (2,5 М в гексанах) (1,5 экв., 6,6 мл, 16,6 ммоля) в перемешиваемый раствор триметилсилилацетилена (1,1 экв., 2 мл, 14 ммоль) в безводном THF (23 мл) при -90°С в инертной атмосфере. После добавления полученный в результате раствор перемешивали в течение 5 минут в холодной бане и 30 минут при комнатной температуре. Затем медленно добавляли бис(2-метоксифенил)метанон (1 экв., 3,1 г, 12,7 ммоля) в 23 мл безводного THF в раствор триметилсилилацетилена при - 90°С и обеспечивали нагревание полученной в результате смеси и нагревали с обратным холодильником в течение 30 минут. Неочищенную реакционную смесь гасили 17 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу промывали водой, водную фазу объединяли и дважды экстрагировали эфиром, после чего эфирные фракции объединяли и сушили безводным MgSO4.
После удаления MgSO4 фильтрацией и выпаривания растворителя получали маслянистую жидкость в количественном выходе. Полученный продукт использовали без дополнительной очистки.
Стадия 3: 1,1-Бис-2-метоксифенил-проп-2-ин-1-ол (2С)
Раствор 1,1-бис(2-метоксифенил)-3-(триметилсилил)проп-2-ин-1-ола (полученного на предыдущей стадии) и K2CO3 (1 экв., 1,75 г, 12,7 ммоля) в безводном метаноле (14 мл) перемешивали при комнатной температуре в течение 3 часов. После завершения реакции (контролированной с использованием TLC) метанол удаляли и добавляли 150 мл диэтилового эфира и 30 мл воды. После разделения 2 фаз, водную фазу три раза экстрагировали 50 мл диэтилового эфира. Затем эфирные фракции объединяли, концентрировали, а затем добавляли 30 мл ацетона и сушили на безводном MgSO4. Удалением MgSO4 фильтрацией, а затем очисткой с использованием колоночной флэш-хроматографии (силикагель, гексан/EtOAc = 3:1) и окончательным выпариванием растворителя получали белое твердое вещество (2,8 г, выход 82,1% для стадий 2+3).
1Н ЯМР (300 МГц, CDCl3): δ 7,67 (dd, 2Н), 7,27 (m, 2Н), 6,98 (td, 2Н), 6,88 (dd, 2Н), 5,09 (s, 1H), 3,66 (s, 6Н), 2,73 (s, 1H).
13С ЯМР: δ 156,66, 131,55, 129,07, 128,05, 120,50, 112,43, 86,23, 73,28, 72,93, 55,76.
Стадия 4: (PPh3)2Cl2Ru(3-2-метоксифенил-5-метоксифенил-инден-1-илиден) (2D)
(PPh3)3RuCl2 (1 экв., 0,575 г, 0,6 ммоля) и 1,1-бис-2-метоксифенил-проп-2-ин-1-ол (соединение С, 1,5 экв., 0,241 г, 0,9 ммоля) добавляли в 4 мл раствора HCl/диоксана (0,15 моля/л). Раствор нагревали до 90°С в течение 3 часов, после чего растворитель удаляли под вакуумом. В колбу добавляли гексан (20 мл) и твердое вещество удаляли со стенок с помощью ультразвука. Полученную в результате суспензию фильтровали и дважды промывали с использованием гексана (5 мл). Оставшийся растворитель выпаривали с получением красно-коричневого порошка; 0,53 г (выход: 93%). Продукт характеризовали с помощью ЯМР спектра 31Р.
31Р ЯМР (121,49 МГц, CDCl3): δ 28,76.
Пример 3: Синтез (PPh3)2Cl2Ru(3-трет-бутил-инден-1-илидена)
Схема 3: Синтез (PPh3)2Cl2Ru(3-трет-бутил-инден-1-илидена) (3С)
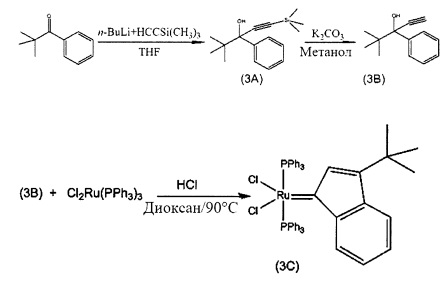
Стадия 1: 1-Трет-бутил-1-фенил-3-(триметилсилил)проп-2-ин-1-ол (3A)
Каплями добавляли n-BuLi (2,5 М в гексане) (1,2 экв., 2,96 мл, 7,4 ммоля) в холодный раствор (-90°С) триметилсилилацетилена (1,2 экв., 1,1 мл, 7,4 ммоля) в безводном THF (21 мл) в атмосфере аргона. После добавления полученный в результате раствор перемешивали еще 5 минут в холодной бане и 30 минут при комнатной температуре. Затем медленно добавляли 2,2-диметил-1-фенилпропан-1-он (1 экв., 1 г, 6,17 ммоля) в 21 мл безводного THF в раствор триметилсилилацетилена при -90°С и обеспечивали нагревание полученной в результате смеси и нагревали с обратным холодильником в течение 30 минут. Неочищенную реакционную смесь гасили с использованием 10 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу промывали водой, водную фазу объединяли и дважды экстрагировали эфиром, после чего эфирные фракции объединяли и сушили безводным MgSO4. После удаления MgSO4 фильтрацией и выпаривания растворителя получали маслянистую жидкость в количественном выходе. Полученный продукт использовали без дополнительной очистки.
Стадия 2: 1-Трет-бутил-1-фенил-проп-2-ин-1-ол (3В)
Раствор 1-трет-бутил-1-фенил-3-(триметилсилил)проп-2-ин-1-ола (полученного на предыдущей стадии) и K2CO3 (1 экв., 6,17 ммоля, 0,85 г) в безводном метаноле (7 мл) перемешивали при комнатной температуре в течение 3 часов. Затем неочищенную реакционную смесь гасили с использованием 15 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу отделяли и промывали водой, водные фазы объединяли и дважды экстрагировали эфиром, один раз CH2Cl2. Затем органические фракции объединяли и сушили с помощью MgSO4. Удаляли MgSO4 фильтрацией, растворитель выпаривали и получали 1,06 г масла с высокой чистотой (выход 91,3%, стадии 1+2).
1Н ЯМР (300 МГц, CDCl3, TMS): δ 7,62 (m, 2Н), 7,31 (m, 3Н), 7,09 (m, 2Н), 2,63 (s, 1Н), 2,30 (s, 1Н), 1,02 (s, 9Н).
13С ЯМР (75 МГц, CDCl3): δ 141,64, 127,583, 127,49, 127,10, 86,80, 78,88, 73,99, 39,27, 25,31.
Стадия 3: (PPh3)2Cl2R(3-трет-бутил-инден-1-илиден) (3С)
(PPh3)3RuCl2 (1 экв., 0,575 г, 0,6 ммоля) и 1-трет-бутил-1-фенил-проп-2-ин-1-ол (соединение В, 1,5 экв., 0,17 г, 0,9 ммоля) добавляли в 4 мл раствора HCl/диоксана (0,15 моля/л). Раствор нагревали до 90°С в течение 3 часов, после чего растворитель удаляли под вакуумом. В колбу добавляли гексан (20 мл) и твердое вещество удаляли со стенок с помощью ультразвука. Полученную в результате суспензию фильтровали и дважды промывали с использованием гексана (5 мл). Оставшийся растворитель выпаривали с получением 0,48 г красно-коричневого порошка (выход: 92%). Продукт характеризовали с помощью ЯМР спектров 31Р.
31Р ЯМР (121,49 МГц, CDCl3): δ 28,76.
Пример 4: Синтез (PPh3)2Cl2Ru(3-нафтил-инден-1-илидена)
Схема 4: Синтез (PPh3)2Cl2Ru(3-нафтил-инден-1-илидена) (4С)
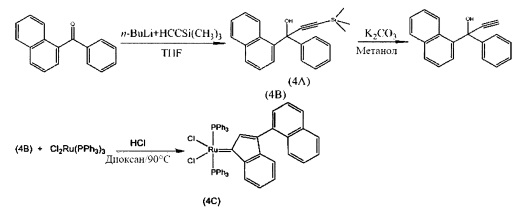
Стадия 1: 1-Нафтил-1-фенил-3-(триметилсилил)проп-2-ин-1-ол (4А)
n-BuLi (2,5 М в гексане)(1,3 экв., 1,90 мл, 4,76 ммоля) каплями добавляли в холодный раствор (-90°С) триметилсилилацетилена (1,3 экв., 0,68 мл, 4,76 ммоля) в безводном THF (7 мл) в атмосфере аргона. После добавления полученный в результате раствор перемешивали еще 5 минут в холодной бане и 30 минут при комнатной температуре. Затем медленно добавляли 1-нафтил-1-фенилметанон (1,0 экв., 0,85 г, 3,66 ммоля) в 7 мл безводного THF в раствор триметилсилилацетилена при -90°С и обеспечивали нагревание полученной в результате смеси и нагревали с обратным холодильником в течение 3 часов. Неочищенную реакционную смесь гасили с использованием 5 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу промывали водой и водную фазу дважды экстрагировали диэтиловым эфиром, а затем эфирные фракции объединяли и сушили с помощью безводного MgSO4. После удаления MgSO4 фильтрацией и выпаривания растворителя получали маслянистую жидкость в количественном выходе. Полученный продукт использовали без дополнительной очистки.
Стадия 2: 1-Нафтил-1-фенил-проп-2-ин-1-ол (4В)
Раствор 1-нафтил-1-фенил-3-(триметилсилил)проп-2-ин-1-ола (полученного на предыдущей стадии) и K2CO3 (1 экв., 0,5 г, 3,58 ммоля) в безводном метаноле (5 мл) перемешивали при комнатной температуре в течение 3 часов. Потом метанол удаляли с последующим добавлением 40 мл диэтилового эфира и 10 мл воды. Потом неочищенную реакционную смесь гасили с использованием 15 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу отделяли и промывали водой; водные фазы объединяли и три раза экстрагировали 20 мл диэтилового эфира. Затем органические фракции объединяли и сушили с помощью MgSO4. Удалением MgSO4 фильтрацией, колоночной хроматографией (силикагель, гексан/EtOAc = 30:1), выпариванием растворителя получали белый липкий материал (0,8 г, выход 84,7% для стадий 1+2).
1Н ЯМР (300 МГц, CDCl3, TMS): δ 8,13 (dd, 1Н), 8,07 (d, 1Н), 7,85 (t, 2Н), 7,56-7,59 (m, 2Н), 7,52 (t, 1Н), 7,39 (td, 1Н), 7,28-7,39 (m, 4Н), 2,94 (s, 1Н), 2,92 (s, 1Н).
13С ЯМР (75 МГц, CDCl3): δ 144,11, 138,11, 134,65, 129,88, 129,67, 128,68, 128,56, 128,15, 126,75, 126,33, 125,50, 125,40, 124,80, 124,73, 86,19, 76,72, 74,45.
Стадия 3: (PPh3)2Cl2Ru(3-нафтил-инден-1-илиден) (4С)
(PPh3)3RuCl2 (1 экв., 0,575 г, 0,6 ммоля) и 1-нафтил-1-фенил-проп-2-ин-1-ол (соединение В, 1,5 экв., 0,23 г, 0,9 ммоля) добавляли в 4 мл раствора HCl/диоксана (0,15 моля/л). Раствор нагревали до 90°С в течение 3 часов, после чего растворитель удаляли под вакуумом. В колбу добавляли гексан (20 мл) и твердое вещество удаляли со стенок с помощью ультразвука. Полученную в результате суспензию фильтровали и дважды промывали с использованием гексана (5 мл). Оставшийся растворитель выпаривали с получением красно-коричневого порошка; 0,51 г (выход: 90%). Продукт характеризовали с помощью ЯМР спектров 31Р.
31Р ЯМР (121,49 МГц, CDCl3): δ 28,75.
Пример 5: Синтез (PPh3)2Cl2Ru(3-с-гексил-инден-1-илидена)
Схема 5: Синтез (PPh3)2Cl2Ru(3-с-гексил-инден-1-илидена) (5В)
Стадия 1: 1-С-гексил-1-фенил-проп-2-ин-1-ол (5А)
Бромид этинилмагния (1,2 экв., 12,7 ммоля, 25,4 мл) (0,5 М в THF) добавляли в цикло-гексил(фенил)метанон (1 экв., 10,6 ммоля, 2 г) в безводном THF (7 мл). Обеспечивали нагревание полученного в результате раствора с обратным холодильником в течение ночи. Неочищенную смесь гасили добавлением 1 N HCl (15 мл) и разбавляли диэтиловым эфиром. Органический слой отделяли, водный слой дважды экстрагировали диэтиловым эфиром. Органические слои объединяли, сушили безводным MgSO4, фильтровали и концентрировали под вакуумом. Полученный продукт после колоночной хроматографии (гексан: EtOAc 9:1) представлял собой 2,01 г желтой жидкости, выход 88,6%.
1Н ЯМР (300 МГц, CDCl3): 1,03-1,28 (m, 5Н), 1,48 (d, 1Н), 1,61-1,79 (m, 4Н), 1,95 (m, 1Н), 2,37 (s, 1Н), 2,67 (s, 1Н), 7,33 (m, 3Н), 7,60 (dd, 2Н).
13С ЯМР (100 МГц, CDCl3): d 26,17, 26,23, 27,29, 27,74, 49,8, 74,83, 76,56, 85,52, 126,14, 127,69, 127,9, 143,33.
Стадия 2: (PPh3)2Cl2Ru(3-с-гексил-инден-1-илиден) (5В)
(PPh3)3RuCl2 (1 экв., 0,575 г, 0,6 ммоля) и 1-с-гексил-1-фенил-проп-2-ин-1-ол (соединение Е, 1,5 экв., 0,19 г, 0,9 ммоля) добавляли в 4 мл раствора HCl/диоксана (0,15 моля/л). Раствор нагревали до 90°С в течение 3 часов, после чего растворитель удаляли под вакуумом. В колбу добавляли гексан (20 мл) и твердое вещество удаляли со стенок с помощью ультразвука. Полученную в результате суспензию фильтровали и дважды промывали с использованием гексана (5 мл). Оставшийся растворитель выпаривали с получением красно-коричневого порошка; 0,51 г (выход: 95%). Продукт характеризовали с помощью ЯМР спектров 31Р.
31Р ЯМР (121,49 МГц, CDCl3): δ 29,64.
Пример 6: Синтез (PPh3)2Cl2Ru(3-2,6-диметилфенил-инден-1-илидена)
Схема 6: Синтез (PPh3)2Cl2Ru(3-2,6-диметилфенил-инден-1-илидена) (6Е)
Стадия 1: 1-2,6-Диметилфенил-3-(триметилсилил)проп-2-ин-1-ол (6А)
n-BuLi (2,5 М в гексане) (1,5 экв., 16,2 ммоля, 6,5 мл) добавляли в раствор триметилсилилацетилена (1,5 экв., 16,2 ммоля, 2,3 мл) в 45 мл безводного THF при -90°С. После добавления реакционную смесь нагревали до комнатной температуры и перемешивали в течение 30 минут. Добавляли 2,6-диметилбензальдегид (1 экв., 1,46 г, 10,8 ммоля) в безводном THF (10 мл) и полученную в результате смесь перемешивали в течение 1 часа при -90°С и обеспечивали нагревание до комнатной температуры в течение 20 часов. Неочищенную смесь гасили с использованием 20 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу промывали водой и водную фазу дважды экстрагировали диэтиловым эфиром, а затем эфирные фракции объединяли и сушили безводным MgSO4. Удалением MgSO4 фильтрацией, а затем очисткой с использованием колоночной флэш-хроматографии (силикагель, н-гексан/EtOAc = 15/1) получали желтое масло; 2,34 г (выход: 93,3%).
1Н ЯМР (300 МГц, CDCl3, TMS): δ 7,11 (t, 1Н), 7,03 (d, 2Н), 5,90 (s, 1H), 2,53 (s, 6Н), 0,17 (тетра, 9Н);
13С ЯМР (75 МГц, CDCl3): δ 137,01, 136,35, 129.42, 128,36, 104,94, 91,09, 61,10, 20,61, 0,00.
Стадия 2: 1-2,6-Диметилфенил-3-(триметилсилил)проп-2-ин-1-он (6В)
Раствор дигидрата натрия дихромата (1 экв., 2,88 г, 9,6 ммоля) и концентрированной серной кислоты (2 экв., 1,04 мл, 19,2 ммоля) в ледяной уксусной кислоте (20 мл) каплями добавляли в раствор 1-(2,6-диметилфенил)-3-(триметилсилил)проп-2-ин-1-ола (1 экв., 2,24 г, 9,6 ммоля) в ледяной уксусной кислоте (20 мл) при 0°С. Смесь перемешивали при комнатной температуре в течение 1 часа, после чего избыток окислителя разлагали добавлением 2-пропанола (3 мл). Через 10 минут добавляли насыщенный раствор NaCl (50 мл) и смесь экстрагировали с помощью CH2Cl2 (2×30 мл). Органические фракции объединяли, промывали 5% раствором NaHCO3 (24 мл) и окончательно промывали насыщенным раствором NaCl (24 мл). Органическую фазу отделяли и сушили над безводным MgSO4, фильтровали и выпаривали. Полученный таким образом неочищенный продукт очищали флэш-хроматографией с использованием гексан: EtOAC (30:1) в качестве подвижной фазы с получением требуемого продукта в виде желтой жидкости (2,1 г, выход: 92,2%).
1Н ЯМР (300 МГц, CDCl3, TMS): δ 7,20 (t, 1Н), 7,04 (d, 2Н), 2,37 (s, 6Н), 0,24 (s, 9Н).
13С ЯМР (75 МГц, CDCl3): δ 184,96, 140,57, 135,83, 130,58, 129,07, 103,96, 101,93, 20,56, 0,00.
Стадия 3: 1,1-2,6-Диметилфенил-фенил-3-(триметилсилил)проп-2-ин-1-ол (6С)
Каплями добавляли трет-BuLi (2,5 М в гексане) (2 экв., 7,9 мл, 15 ммолей) в раствор бромбензола (1 экв., 0,78 г, 7,5 ммоля) в 50 мл безводном диэтиловом эфире при -90°С в инертной атмосфере. Полученный в результате раствор перемешивали еще 30 минут при комнатной температуре, а потом медленно добавляли 1-(2,6-диметилфенил)-3-(триметилсилил)проп-2-ин-1-он (1,1 экв., 1,9 г, 8,25 ммоля), растворенный в безводном диэтиловом эфире. Полученную в результате смесь перемешивали в течение ночи при комнатной температуре, а затем гасили с использованием 10 мл насыщенного NH4Cl и разбавляли диэтиловым эфиром. Органическую фазу промывали водой, водную фазу объединяли и дважды экстрагировали эфиром, после чего эфирные фракции объединяли и сушили безводным MgSO4. После удаления MgSO4 фильтрацией и выпаривания растворителя получали маслянистую жидкость в количественном выходе.
Стадия 4: 1-2,6-Диметилфенил-1-фенил-проп-2-ин-1-ол (6D)
Раствор 1-2,6-диметилфенил-1-фенил-проп-2-ин-1-ола (полученного на предыдущей стадии) и K2CO3 (1 экв., 1 г, 7,5 ммоля) в безводном метаноле (8 мл) перемешивали при комнатной температуре течение 3 часов. Затем удаляли метанол, а потом добавляли 20 мл диэтилового эфира и 10 мл воды, разбавляли диэтиловым эфиром (20 мл) и промывали с помощью 15 мл IN HCl. Органический слой отделяли, а водный слой дважды экстрагировали диэтиловым эфиром. Затем органические фракции объединяли и сушили с помощью MgSO4. Удаление MgSO4 фильтрацией, колоночной хроматографией (силикагель, гексан/EtOAc = 60/1) и выпариванием растворителя получали 1-(2,6-диметилфенил)-1-фенил-проп-2-ин-1-ол (1,42 г, выход 80%).
1Н ЯМР (300 МГц, CDCl3): δ 7,52 (d, 2Н), 7,28-7,35 (m, 3Н), 7,09 (t, 1Н), 7,00 (d, 2Н), 2,85 (s, 1Н), 2,53 (m, 1Н), 2,36 (s, 6Н).
13С ЯМР (75 МГц, CDCl3): δ 144,87, 139,08, 137,04, 130,79, 128,59, 128,08, 127,27, 126,25, 86,12, 76,65, 75,69, 24,09.
ESI [М-ОН]: 219,1, рассчитанный: 219,1.
Стадия 5: (PPh3)2Cl2Ru(3-2,6-диметилфенил-инден-1-илиден) (6Е)
(PPh3)3RuCl2 (1 экв., 0,575 г, 0,6 ммоля) и 1-2,6-диметилфенил-1-фенил-проп-2-ин-1-ол (соединение D, 1,5 экв., 0,213 г, 0,9 ммоля) добавляли в 4 мл раствора HCl/диоксана (0,15 моля/л). Раствор нагревали до 90°С в течение 3 часов, после чего растворитель удаляли под вакуумом. В колбу добавляли гексан (20 мл) и твердое вещество удаляли со стенок с помощью ультразвука. Полученную в результате суспензию фильтровали и дважды промывали с использованием гексана (5 мл). Оставшийся растворитель выпаривали с получением красно-коричневого порошка; 0,50 г (выход: 90%). Продукт характеризовали с помощью ЯМР спектров 31Р.
31Р ЯМР (121,49 МГц, CDCl3): δ 29,64.
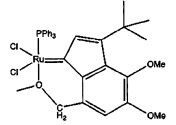
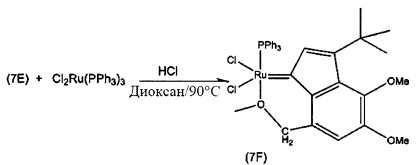
Пример 7: Синтез (PPh3)Cl2Ru(3-трет-бутил-5,6-метокси-8-метоксиметилен)-инден-1-илидена
Схема 7: Синтез (PPh3)Cl2Ru(3-трет-бутил-5,6-метокси-8-метоксиметилен)-инден-1-илидена (7F)
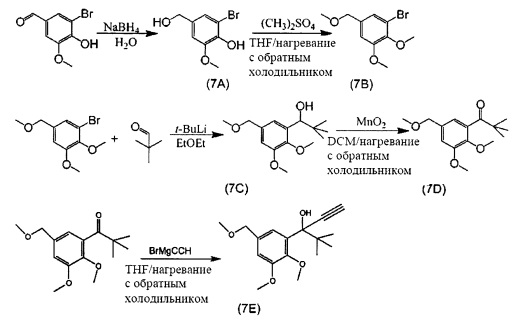
Стадия 1: 2-Бром-4-(гидроксиметил)-6-метоксифенол (7А)
5-Бромванилин (1 экв., 5 г, 21,8 ммоля) добавляли в раствор NaOH (1,5 экв., 1,3 г, 32,7 ммоля) в воде (80 мл), а затем добавляли водный раствор NaBH4 (1,1 экв., 0,9 г, 24 ммоля) при 0°С. Реакционную смесь энергично перемешивали в течение 1 часа при 0°С и еще 2 часа при комнатной температуре. После завершения (контролировали с помощью TLC) раствор подкисляли до рН 2 с использованием 6 N HCl и добавляли 400 мл этилацетата (EtOAc). Затем фракцию EtOAc отделяли, дважды промывали водой и сушили над Na2SO4. Удаляли Na2SO4 фильтрацией, фильтрат концентрировали с получением 4,7 г белого твердого вещества (выход: 92,9%).
1Н ЯМР (300 МГц, DMSO-d6): δ 9,23 (s, 1H), 7,00 (s, 1H), 6,90 (s, 1H), 5,13 (t, 1H), 4,38 (d, 2H), 3,80 (s, 3H);
13C ЯМР (75 МГц, DMSO-d6): δ 148,22, 142,26, 134,57, 122,01, 109,57, 108,86, 62,20, 56,02.
Стадия 2: 1-Бром-2,3-диметокси-5-(метоксиметил)бензол (7B)
Диметилсульфат (3 экв., 3,3 г, 25,9 ммоля) добавляли в раствор 2-бром-4-(гидроксиметил)-6-метоксифенола (1 экв., 2 г, 8,6 ммоля) и KOH (4 экв., 1,9 г, 34,5 ммоля) в THF (16 мл) при комнатной температуре. После добавления раствор нагревали с обратным холодильником течение 3 часов, а затем 12 часов при 60°С. Затем добавляли 35 мл 1 N HCl и 40 мл диэтилового эфира. После отделения органической фазы водную фазу экстрагировали 3 раза с помощью 10 мл диэтилового эфира. Органические фракции объединяли и сушили с помощью MgSO4. Удаляли MgSO4 фильтрацией, фильтрат концентрировали с получением 2,23 г бесцветного масла (выход: 99,5%).
1Н ЯМР (300 МГц, CDCl3, TMS): δ 7,10 (dt, 1Н), 6,86 (d, 1H), 4,37 (s, 2Н), 3,88 (s, 3Н), 3,84 (s, 3Н), 3,39 (s, 3Н);
13С ЯМР (75 МГц, CDCl3): δ 153,76, 145,87, 135,42, 123,79, 117,46, 110,89, 73,84, 60,58, 58,24, 56,08.
Стадия 3: 1-(2,3-Диметокси-5-(метоксиметил)фенил-2,2-диметилпропан-1-ол (7С)
Трет-BuLi (2,5 М в гексане) (1,5 экв., 9,2 мл, 17,4 ммоля) добавляли в раствор 1-бром-2,3-диметокси-5-(метоксиметил)бензола (1 экв., 3,02 г, 11,6 ммоля) в 20 мл безводного диэтилового эфира при -90°С. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 30 минут. Смесь охлаждали до -90°С, добавляли пивалевый альдегид (1,5 экв., 1,5 г, 17,4 ммоля) и перемешивали в течение 1 часа. Обеспечивали нагревание смеси до комнатной температуры, далее смесь перемешивали в течение 12 часов и гасили с использованием 1 N HCl (20 мл). После добавления диэтилового эфира органический слой отделяли от водного слоя. Последний дважды экстрагировали диэтиловым эфиром, все органические слои объединяли и сушили с использованием безводного MgSO4. Удаляли MgSO4 фильтрацией, затем очищали с использованием колоночной флэш-хроматографии (силикагель, гексан/этилацетат = 20:1) и окончательно выпаривали растворитель с получением белого твердого вещества, 2,63 г (выход: 84,5%).
1Н ЯМР (300 МГц, CDCl3, TMS): δ 6,90 (d, 1Н), 6,86 (d, 1H), 4,75 (s, 1H), 4,40 (s, 2H), 3,87 (s, 3H), 3,83 (s, 3H), 3,39 (s, 3H), 2,29 (b, 1H);
13С ЯМР (75 МГц, CDCl3): δ 152,25, 146,33, 134,92, 133,05, 120,01, 110,51, 76,69, 74,78, 60,64, 58,09, 55,70, 36,47, 26,01.
Стадия 4: 1-(2,3-Диметокси-5-(метоксиметил)фенил)-2,2-диметилпропан-1-он (7D)
Раствор 1-(2,3-Диметокси-5-(метоксиметил)фенил)-2,2-диметилпропан-1-ола (1 экв., 2,16 г, 8,1 ммоля) и MnO2 (10 экв., 7,0 г, 81 ммоль) в безводном CH2Cl2 (60 мл) подвергали нагреванию с обратным холодильником. После завершения реакции (контролировали с помощью TLC) MnO2 отфильтровывали с использованием прокладки целита. Выпариванием растворителя получали желтоватый продукт в количественном выходе. Полученный продукт использовали без дополнительной очистки.
1Н ЯМР (300 МГц, CDCl3, TMS): 6,93 (d, 1Н), 6,59 (d, 1Н), 4,39 (s, 2Н), 3,89 (s, 3Н), 3,77 (s, 3Н), 3,39 (s, 3Н), 1,21 (s, 9Н).
Стадия 5: 3-(2,3-Диметокси-5-(метоксиметил)фенил)-4,4-диметилпент-1-ин-3-ол (7E)
Бромид этинилмагния (0,5 М в THF) (1,2 экв., 19,4 мл, 9,7 ммоля) добавляли в 1-(2,3-диметокси-5-(метоксиметил)фенил)-2,2-диметилпропан-1-он (1 экв., 2,15 г, 8,1 ммоля) в безводном THF (11 мл). Обеспечивали нагревание полученного в результате раствора с обратным холодильником в течение ночи. Неочищенную смесь гасили добавлением 1 N HCl (10 мл) и разбавляли диэтиловым эфиром. Органический слой отделяли, водный слой дважды экстрагировали диэтиловым эфиром. Органические слои объединяли, сушили безводным MgSO4, фильтровали и концентрировали под вакуумом. Полученный продукт после колоночной хроматографии (гексан/EtOAc = 15:1) представлял желтую жидкость 1,99 г (выход: 84%).
1Н ЯМР (300 МГц, CDCl3, TMS): 7,15 (d, 1Н), 6,91 (d, 1Н), 5,31 (bs, 1H) 4,41 (s, 2Н), 3,93 (s, 3Н), 3,88 (s, 3Н), 3,38 (s, 3Н), 2,63 (s, 1Н), 1,03 (s, 9Н).
Стадия 6: (PPh3)Cl2Ru(3-трет-бутил-5,6,7-метокси-8-(СН2-O-Ме)-инден-1-илиден) (7F)
(PPh3)3RuCl2 (1 экв., 0,575 г, 0,6 ммоля) и 3-(2,3-диметокси-5-(метоксиметил)фенил)-4,4-диметилпент-1-ин-3-ол (1,5 экв., 0,263 г, 0,9 ммоля) добавляли в 4 мл раствора HCl/диоксана (0,15 моля/л). Раствор нагревали до 90°С в течение 3 часов, после чего растворитель удаляли под вакуумом. В колбу добавляли гексан (20 мл) и твердое вещество удаляли со стенок с помощью ультразвука. Полученную в результате суспензию фильтровали и дважды промывали с использованием гексана (5 мл). Оставшийся растворитель выпаривали с получением оранжевого порошка; 0,31 г (выход: 80%).
Продукт характеризовали с помощью ЯМР спектров 31Р.
31Р ЯМР (121,49 МГц, CDCl3): δ 52,09.
Пример 8: Синтез (РСу3)2Cl2Ru(3-2-метилфенил-5-метил-инден-1-илидена)
Схема 8: Синтез (PCy3)2Cl2Ru(3-2-метилфенил-5-метил-инден-1-илидена (8)
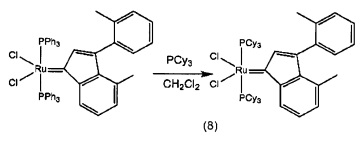
25 мл сосуд заполняли (PPh3)2Cl2Ru(3-2-метилфенил-5-метил-инден-1-илиденом) (1 экв., 0,4574 г, 0,5 ммоля), трициклогексилфосфином (3 экв., 0,42 г, 1,5 ммоля) и дихлорметаном (10 мл). После завершения реакции (1 час) полученную в результате взвесь сушили под вакуумом и добавляли 20 мл изопропанола. Фильтрацией получали красно-коричневый порошок, который после промывания 5 мл изопропанола (2 х) и сушки под вакуумом давал 0,44 г катализатора (выход: 93%). Продукт характеризовали с помощью ЯМР спектров 1Н и 31Р.
1Н ЯМР (300 МГц, CDCl3, TMS): δ 8,54 (d, 1Н), 7,24-7,29 (m, 1Н), 7,10-7,17 (m, 4Н), 7,07 (s, 1Н), 7,02 (d, 1Н), 2,61 (d, 6Н), 2,22 (s, 3Н), 1,18-1,96 (m, 63Н).
31Р ЯМР (121,49 МГц, CDCl3): δ 31,75, 31,56.
Характеристические значения 1Н и 31Р: Н-С8: 8,54 ppm (d, 1Н) и Р: 31,75 и 31,56 ppm.
Пример 9: Синтез (РСу3)2Cl2Ru(3-2-метоксифенил-5-метоксифенил-инден-1-илидена)
Схема 9: Синтез (РСу3)2Cl2Ru(3-2-метоксифенил-5-метоксифенил-инден-1-илидена (9)
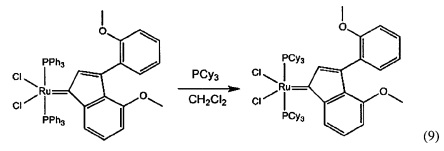
25 мл сосуд заполняли (PPh3)2Cl2Ru(3-2-метоксифенил-5-метоксифенил-инден-1-илиденом) (1 экв., 0,4734 г, 0,5 ммоля), трициклогексилфосфином (3 экв., 0,42 г, 1,5 ммоля) и дихлорметаном (10 мл). После завершения реакции (1 час) полученную в результате взвесь сушили под вакуумом и добавляли 20 мл изопропанола. Фильтрацией получали красно-коричневый порошок, который после промывания 5 мл изопропанола (2 х) и сушки под вакуумом давал 0,44 г катализатора (выход: 89%). Продукт характеризовали с помощью ЯМР спектров 1Н и 31Р.
Характеристические значения 1Н и 31Р: Н-С8: 8,32 ppm (d, 1Н) и Р: 30,56 ppm.
Пример 10: Синтез (РСу3)2Cl2Ru(3-трет-бутил-инден-1-илидена)
Схема 10: Синтез (РСу3)2Cl2Ru(3-трет-бутил-инден-1-илидена) (10)
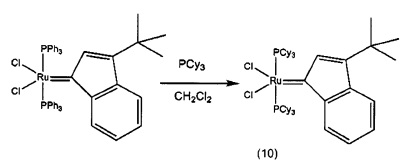
25 мл сосуд заполняли (PPh3)2Cl2Ru(3-трет-бутил-инден-1-илиденом) (1 экв., 0,4334 г, 0,5 ммоля), трициклогексилфосфином (3 экв., 0,42 г, 1,5 ммоля) и дихлорметаном (10 мл). После завершения реакции (1 час) полученную в результате взвесь сушили под вакуумом и добавляли 20 мл изопропанола. Фильтрацией получали красно-коричневый порошок, который после промывания 5 мл изопропанола (2 х) и сушки под вакуумом давал 0,41 г катализатора (выход: 90%). Продукт характеризовали с помощью ЯМР спектров 1Н и 31Р.
Характеристические значения 1Н и 31Р: Н-С8: 8,60 ppm (d, 1Н) и Р: 31,29 ppm.
Пример 11: Синтез (РСу3)1Cl2Ru(3-нафтил-инден-1-илидена)
Схема 11: Синтез (РСу3)2Cl2Ru(3-нафтил-инден-1-илидена) (11)
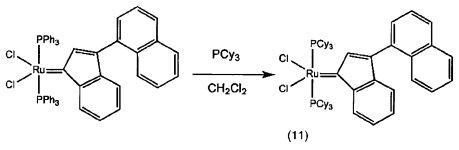
25 мл сосуд заполняли (PPh3)2Cl2Ru(3-нафтил-инден-1-илиденом) (1 экв., 0,4684 г, 0,5 ммоля), трициклогексилфосфином (3 экв., 0,42 г, 1,5 ммоля) и дихлорметаном (10 мл). После завершения реакции (1 час) полученную в результате взвесь сушили под вакуумом и добавляли 20 мл изопропанола. Фильтрацией получали красно-коричневый порошок, который после промывания 5 мл изопропанола (2 х) и сушки под вакуумом давал 0,43 г катализатора (выход: 88%). Продукт характеризовали с помощью ЯМР спектров 1Н и 31P.
Характеристические значения 1Н и 31Р: Н-С8: 8,71 ppm (d, 1Н) и Р: 32,06 ppm.
Пример 12: Синтез (РСу3)2Cl2Ru(3-с-гексил-инден-1-илидена)
Схема 12: Синтез (РСу3)2Cl2Ru(3-с-гексил-инден-1-илидена) (12)
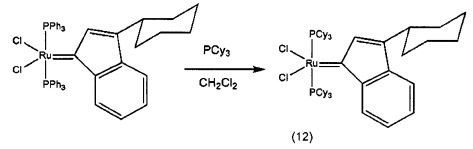
25 мл сосуд заполняли (PPn3)2Cl2Ru(3-с-гексил-инден-1-илиденом) (1 экв., 0,4464 г, 0,5 ммоля), трициклогексилфосфином (3 экв., 0,42 г, 1,5 ммоля) и дихлорметаном (10 мл). После завершения реакции (1 час) полученную в результате взвесь сушили под вакуумом и добавляли 20 мл изопропанола. Фильтрацией получали красно-коричневый порошок, который после промывания 5 мл изопропанола (2 х) и сушки под вакуумом давал 0,42 г катализатора (выход: 90%). Продукт характеризовали с помощью ЯМР спектров 1H и 31P.
Характеристические значения 1Н и 31Р: Н-С8: 8,50 ppm (d, 1Н) и Р: 31,40 ppm.
Пример 13: Синтез (РСу3)2Cl2Ru(3-2,6-диметилфенил-инден-1-илидена)
Схема 13: Синтез (РСу3)2Cl2Ru(3-2,6-диметилфенил-инден-1-илидена) (13)
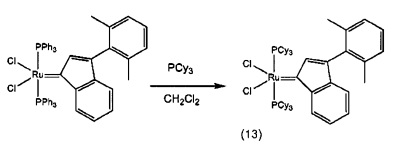
25 мл сосуд заполняли (PPh3)2Cl2Ru(3-2,6-диметилфенил-инден-1-илиденом) (1 экв., 0,4574 г, 0,5 ммоля), трициклогексилфосфином (3 экв., 0,42 г, 1,5 ммоля) и дихлорметаном (10 мл). После завершения реакции (1 час) полученную в результате взвесь сушили под вакуумом и добавляли 20 мл изопропанола. Фильтрацией получали красно-коричневый порошок, который после промывания 5 мл изопропанола (2 х) и сушки под вакуумом давал 0,43 г катализатора (выход: 88%). Продукт характеризовали с помощью ЯМР спектров 1Н и 31Р.
Характеристические значения 1Н и 31Р: Н-С8: 8,71 ppm (d, 1Н) и Р: 32,93 ppm.
Пример 14: Синтез (S-IMes)(РСу3)Cl2Ru(3-2-метилфенил-5-метил-инден-1-илидена)
Схема 14: Синтез (S-IMes)(РСу3)Cl2Ru(3-2-метилфенил-5-метил-инден-1-илидена) (14)
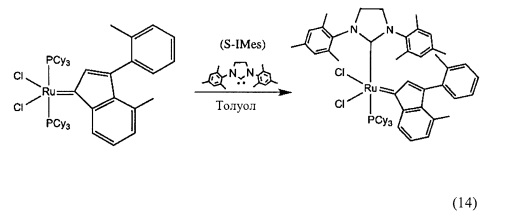
S-IMes = насыщенный 1,3-бис(мезитил)-имидазолидин-2-илиден (1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден)
10 мл сосуд заполняли (РСу3)2Cl2Ru(3-2-метилфенил-5-метил-инден-1-илиденом) (1 экв., 0,3804 г, 0,4 ммоля) и S-IMes (1,1 экв., 0,134 г, 0,44 ммоля). Добавляли безводный толуол (3 мл) в инертной атмосфере. Смесь энергично перемешивали при 50°С в течение 30 минут и сушили под вакуумом, а затем добавляли 10 мл изопропанола. После фильтрации и промывания (два раза 5 мл изопропанола) получали оранжевый порошок; 0,33 г (выход: 84%). Продукт характеризовали с помощью ЯМР спектров 1Н, 13С и 31Р.
1Н ЯМР (300 МГц, CDCl3, TMS): δ 8,47 (d, 1Н), 7,44 (dd, 1Н), 7,20-7,28 (m, 2Н), 7,047-7,11 (m, 3Н), 6,99 (d, 1Н), 6,93 (s, 1Н), 6,88 (d, 1Н), 6,81 (s, 1Н), 6,05 (s, 1Н), 3,70-4,07 (m, 4Н), 2,74 (s, 3Н), 2,68 (s, 3Н), 2,38 (s, 3Н), 2,33 (s, 3Н), 2,14 (s, 3Н), 2,02 (s, 3Н), 1,87 (s, 3Н), 0,86-1,83 (m, 36Н).
13С ЯМР (75 МГц, CDCl3): δ 294,06, 293,96, 217,16, 216,19, 143,91, 140,11, 139,79, 139,52, 139,39, 138,77, 138,29, 136,94, 136,85, 136,27, 135,69, 134,04, 130,70, 130,01, 129,88, 129,57, 128,94, 128,58, 128,14, 127,25, 127,13, 126,27, 125,30, 125,05, 52,68, 52,64, 52,29, 52,26, 33,09, 32,87, 29,47, 29,24, 27,70, 27,57, 26,20, 21,18, 20,91, 20,32, 20,15, 19,36, 18,97, 18,92, 18,44.
31Р ЯМР(121,49 МГц, CDCl3): δ 26,75.
Пример 15: Синтез (S-IMes)(пиридин)Cl2Ru(3-2-метилфенил-5-метил-инден-1-илидена)
Схема 15: Синтез (S-IMes)(пиридин)Cl2Ru(3-2-метилфенил-5-метил-инден-1-илидена) (15)
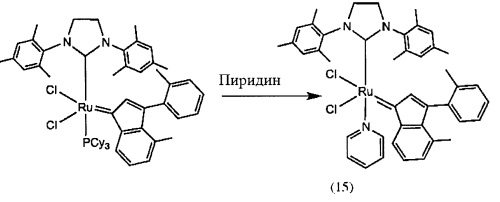
(S-IMes)(РСу3)Cl2Ru(3-2-метилфенил-5-метил-инден-1-илиден) (1 экв., 0,25 г, 0,256 ммоля) растворяли в пиридине (0,21 мл) и перемешивали при комнатной температуре в течение 24 часов. Получали оранжево-коричневый осадок при добавлении н-гексана (10 мл) и последующем охлаждении до -40°С. Фильтрацией осадка, промыванием 3 раза н-гексаном (по 5 мл каждый) и сушкой in vacuo получали 0,14 г (выход: 70%) оранжевого порошка. Продукт характеризовали с помощью ЯМР спектров 1Н.
1Н ЯМР (300 МГц, CDCl3, TMS): δ 8,21 (d, 1Н), 7,89 (d, 2Н), 6,80-7,47 (m, 13Н), 6,29 (s, 1Н), 4,24 (m, 2Н), 3,99 (m, 2Н), 2,79 (s, 3Н), 2,68 (s, 3Н), 2,37 (s, 3Н), 2,29 (s, 3Н), 2,15 (s, 3Н), 2,07 (s, 3Н), 1,98 (s, 3Н), 1,57 (s, 3Н).
Пример 16: Синтез (PPh3)2Cl2Ru(3-4-фторфенил-инден-1-илидена) (16В)
Схема 16: Синтез (PPh3)2Cl2Ru(3-4-фторфенил-инден-1-илидена) (16В)
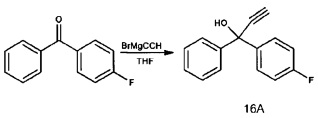
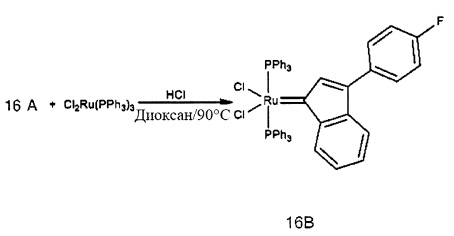
Стадия 1: 1-(4-Фторфенил)-1-фенилпроп-2-ин-1-ол (16А)
Бромид этинилмагния (1,2 экв., 12,7 ммоля, 25,4 мл) (0,5 М в THF) добавляли в (4-фторфенил)(фенил)метанон (1 экв., 10,6 ммоля, 2,12 г) в безводном THF (7 мл). Обеспечивали нагревание полученного в результате раствора с обратным холодильником в течение ночи. Неочищенную смесь гасили добавлением 1 N HCl (15 мл) и разбавляли диэтиловым эфиром. Органический слой отделяли, водный слой дважды экстрагировали диэтиловым эфиром. Органические слои объединяли, сушили безводным MgSO4, фильтровали и концентрировали под вакуумом. Полученный продукт после колоночной хроматографии (гексан: EtOAc 10:1) представлял собой 1,94 г желтой жидкости, выход 81%.
1Н ЯМР (300 МГц, CDCl3, TMS): δ 7,52-7,59 (m, 1Н), 7,24-7,36 (m, 3Н), 6,99 (t, 2Н), 2,90 (s, 1Н), 2,87 (s, 1Н).
13С ЯМР (75 МГц, CDCl3): δ 163,98, 160,71, 144,29, 140,36, 140,32, 128,45, 128,07, 128,03, 127,92, 125,98, 115,28, 114,99, 86,23, 75,86, 73,90.
Стадия 2: (PPh3)2Cl2Ru(3-4фторфенил-инден-1-илиден) (16В)
(PPh3)3RuCl2 (1 экв., 0,575 г, 0,6 ммоля) и 1-(4-фторфенил)-1-фенилпроп-2-ин-1-ол (соединение 16А, 1,5 экв., 0,20 г, 0,9 ммоля) добавляли в 4 мл раствора HCl/диоксана (0,15 моля/л). Раствор нагревали до 90°С в течение 3 часов, после чего растворитель удаляли под вакуумом. В колбу добавляли гексан (20 мл) и твердое вещество удаляли со стенок с помощью ультразвука. Полученную в результате суспензию фильтровали и дважды промывали с использованием гексана (5 мл). Оставшийся растворитель выпаривали с получением красно-коричневого порошка; 0,49 г (выход: 90%). Продукт характеризовали с помощью ЯМР спектров 31Р.
31Р ЯМР (121,49 МГц, CDCl3): δ 28,26.
Пример 17: Синтез (РСу3)2Cl2Ru(3-4-фторфенил-инден-1-илидена) (17)
Схема 17: Синтез (РСу3)2Cl2Ru(3-4-фторфенил-инден-1-илидена) (17)
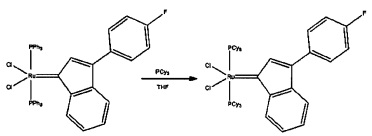
25 мл сосуд заполняли (PPh3)2Cl2Ru(3-4-фторфенил-инден-1-илиденом) (1 экв., 0,4520 г, 0,5 ммоля), трициклогексилфосфином (3 экв., 0,42 г, 1,5 ммоля) и дихлорметаном (10 мл). После завершения реакции (1 час) полученную в результате взвесь сушили под вакуумом и добавляли 20 мл изопропанола. Фильтрацией получали красно-коричневый порошок, который после промывания 5 мл изопропанола (2 х) и сушки под вакуумом давал 0,40 г катализатора (выход: 85%). Продукт характеризовали с помощью 1Н и 31Р ЯМР.
Характеристические значения 1Н и 31Р: Н-С8: 8,67 ppm (d, 1Н) и Р: 32,33 ppm.
Пример 18: Синтез (PPh3)2Cl2Ru(3-изо-пропил-инден-1-илидена) (18В)
Схема 18: Синтез (PPh3)2Cl2Ru(3-изо-пропил-инден-1-илидена) (18В)
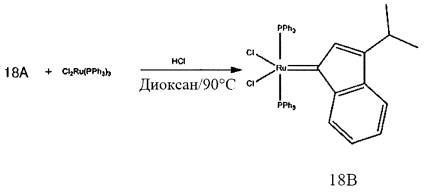
Стадия 1: 1-Изо-пропил-1-фенил-проп-2-ин-1-ол (18А)
Бромид этинилмагния (1,2 экв., 12,7 ммоля, 25,4 мл) (0,5 М в THF) добавляли в (изопропил)(фенил)метанон (1 экв., 10,6 ммоля, 1,57 г) в безводном THF (7 мл). Обеспечивали нагревание полученного в результате раствора с обратным холодильником в течение ночи. Неочищенную смесь гасили добавлением 1 N HCl (15 мл) и разбавляли диэтиловым эфиром. Органический слой отделяли, водный слой дважды экстрагировали диэтиловым эфиром. Органические слои объединяли, сушили безводным MgSO4, фильтровали и концентрировали под вакуумом. Полученный продукт после колоночной хроматографии (гексан: EtOAc 20:1) представлял собой 1,75 г желтой жидкости, выход 95%.
1Н ЯМР (300 МГц, CDCl3): δ 7,61 (dt, 2Н), 7,22-7,36 (m, 3Н), 2,66 (s, 1Н), 2,50 (s, 1H), 2,09 (септ., 1Н), 1,06 (d, 3Н), 0,81 (d, 3Н).
13С ЯМР (75 МГц, CDCl3): δ 143,42, 127,95, 127,74, 126,14, 85,03, 77,07, 74,99, 40,16, 17,90, 17,38.
Стадия 2: (PPh3)2Cl2Ru-(3-изо-пропил-инден-1-илиден) (18В)
(PPh3)3RuCl2 (1 экв., 0,575 г, 0,6 ммоля) и 1-(изо-пропил)-1-фенилпроп-2-ин-1-ол (соединение 18А, 1,5 экв., 0,144 г, 0,9 ммоля) добавляли в 4 мл раствора HCl/диоксана (0,15 моля/л). Раствор нагревали до 90°С в течение 3 часов, после чего растворитель удаляли под вакуумом. В колбу добавляли гексан (20 мл) и твердое вещество удаляли со стенок с помощью ультразвука. Полученную в результате суспензию фильтровали и дважды промывали с использованием гексана (5 мл). Оставшийся растворитель выпаривали с получением красно-коричневого порошка; 0,48 г (выход: 93%). Продукт характеризовали с помощью ЯМР спектров 31Р.
31Р ЯМР (121,49 МГц, CDCl3): δ 29,55.
Пример 19: Синтез (РСу3)2Cl2Ru(3-изопропил-инден-1-илидена) (19)
Схема 19: Синтез (РСу3)2Cl2Ru(3-изопропил-инден-1-илидена) (19)
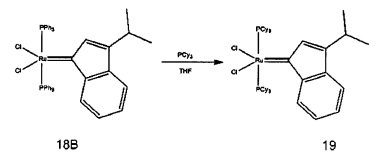
25 мл сосуд заполняли (PPh3)2Cl2Ru(3-изо-пропил-инден-1-илиденом) (1 экв., 0,4260 г, 0,5 ммоля), трициклогексилфосфином (3 экв., 0,42 г, 1,5 ммоля) и дихлорметаном (10 мл). После завершения реакции (1 час) полученную в результате взвесь сушили под вакуумом и добавляли 20 мл изопропанола. Фильтрацией получали красно-коричневый порошок, который после промывания 5 мл изопропанола (2 х) и сушки под вакуумом давал 0,40 г катализатора (выход: 90%). Продукт характеризовали с помощью ЯМР спектров 1Н и 31Р.
Характеристические значения 1Н и 31Р: Н-С8: 8,57 ppm (d, 1Н) и Р: 31,44 ppm.
Реакции метатезиса
В нижеприведенных примерах представлены типичные экспериментальные протоколы для реакций метатезиса с замыканием кольца (RCM).
Перечень катализаторов, используемых в примерах

Перечень подложек, используемых в примерах

Пример 20: Эффект загрузки катализатора, сравнение коммерчески доступного катализатора  (F) с впервые разработанным катализатором 8
(F) с впервые разработанным катализатором 8
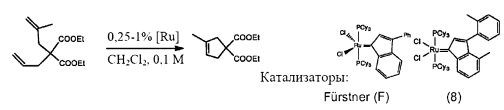
RCM для DE1 использовали для определения активности катализатора 8 и катализатора F с различными загрузками катализатора (1%, 0,5% и 0,25).
Готовили исходный раствор подложки DE1 путем растворения DE1 (2,54 г, 10 ммоль) и додекана в качестве внутреннего стандарта (1,7 г, 10 ммоль) в 50 мл безводном дихлорметане для получения концентрации подложки 0,2 ммоля/мл.
Готовили исходные растворы катализатора путем растворения катализатора 8 (0,038 г, 0,04 ммоля) и катализатора F (0,037 г, 0,04 ммоля) в 20 мл безводного дихлорметана, соответственно, для получения концентрации катализатора 0,002 ммоля/мл.
Для экспериментов с 1% загрузкой катализатора: 5 мл исходного раствора DE1 и 5 мл исходного раствора катализатора переносили в колбу Шленка, а затем помещали в масляную баню при 38°С.
Для экспериментов с 0,5% загрузкой катализатора: 5 мл исходного раствора DE1, 2,5 мл исходного раствора катализатора и 2,5 мл безводного дихлорметана переносили в колбу Шленка, а затем помещали в масляную баню при 38°С.
Для экспериментов с 0,25% загрузкой катализатора: 5 мл исходного раствора DE1, 1,25 мл исходного раствора катализатора и 3,75 мл безводного дихлорметана переносили в колбу Шленка, а затем помещали в масляную баню при 38°С.
Отбирали 0,1 мл реакционной смеси как образец для анализа с GC (0,1 мл образца растворяли в 0,4 мл дихлорметана и из этого раствора отбирали необходимое количество для введения в газовый хроматограф).
Результаты показаны на фигуре 3.
Пример 21: Сравнение различных катализаторов RCM для DE1.
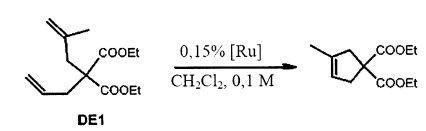
Готовили исходный раствор подложки DE1 путем растворения DE1 (2,54 г, 10 ммоль) и додекана в качестве внутреннего стандарта (1,77 г, 10 ммоль) в 100 мл безводном дихлорметане для получения концентрации DE1 0,1 ммоля/мл.
Эксперименты выполняли с использованием 0,15% загрузки катализатора. 15 мл исходного раствора DE1 и необходимое количество катализатора переносили в колбу Шленка и помещали в масляную баню при 40°С [катализатор 8: 1,43 мг, 1,5 ммоля; катализатор 17: 1,41 мг, 1,5 ммоля; катализатор 11: 1,46 мг, 1,5 ммоля; катализатор F: 1,38 мг, 1,5 ммоля; катализатор 13: 1,43 мг, 1,5 ммоля].
Отбирали 0,1 мл реакционной смеси как образец для анализа с GC (0,1 мл образца растворяли в 0,4 мл дихлорметана и из этого раствора брали необходимое количество для введения в газовый хроматограф).
Результаты показаны на фигуре 4.
Пример 22: RCM различных подложек с использованием другого катализатора
Исходные растворы различных подложек с концентрацией 0,1 ммоля/мл получали путем переноса 10 ммоль подложки и додекана в качестве внутреннего стандарта (1,7 г, 10 ммоль) в 100 мл безводного дихлорметана [подложка DE: 2,4 г; подложка DE4: 2,54 г; подложка DE5: 2,5468 г; подложка DA: 2,51 г; подложка DA1: 2,65 г; подложка DA4: 2,65 г; подложка DA5: 2,79 г]. Эксперименты выполняли с использованием 0,25% загрузки катализатора. 10 мл раствора подложки и необходимое количество катализатора (2,5 ммоля) переносили в колбу Шленка и помещали в масляную баню при 40°С [катализатор 8: 2,38 мг; катализатор 17: 2,35 мг; катализатор 11: 2,43 мг; катализатор 13: 2,38 мг; катализатор 10: 2,26 мг; катализатор 12: 2,32 мг; катализатор 19: 2,22 мг].
Отбирали 0,1 мл реакционной смеси как образец для анализа с GC (0,1 мл образца растворяли в 0,4 мл дихлорметана и из этого раствора брали необходимое количество для введения в газовый хроматограф).
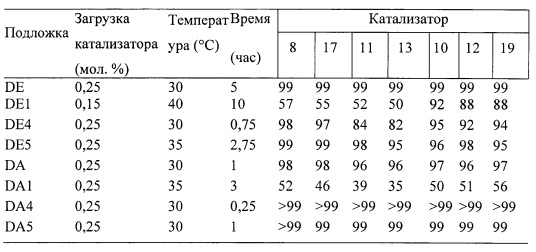
Пример 23: Контролирование метатезисной полимеризации с раскрытием кольца (ROMP) для циклооктадиена (COD)
После заполнения ампулы для ЯМР соответствующим количеством катализатора, растворенного в дейтерированном растворителе (CDCl3), добавляли COD. Реакцию полимеризации контролировали как функцию времени при 20°С путем интегрирования 1H-сигналов олефинов образованного полимера (5,38-4,44 ppm) и расходуемого мономера (5,58 ppm). Катализатор/COD: 1/300, концентрация катализатора: 0,452 мМ.

Результаты показаны на фигуре 5.