Результат интеллектуальной деятельности: СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФЕНИБУТА В МИКРОКАПСУЛАХ МЕТОДОМ КАПИЛЛЯРНОГО ЭЛЕКТРОФОРЕЗА
Вид РИД
Изобретение
Изобретение относится к области медицины и может быть использовано в контрольно-аналитических лабораториях для стандартизации и контроля качества лекарственных средств, а именно для количественного определения фенибута методом капиллярного электрофореза.
Действующая система контроля качества лекарственных средств требует от фармацевтической науки постоянного повышения эффективности имеющихся методов анализа. Среди современных методов фармацевтического анализа важное место занимает метод капиллярного электрофореза, который широко применяется как для целей количественного определения, так и для контроля чистоты и идентификации лекарственных средств.
В настоящее время известно несколько методов количественного определения фенибута в лекарственных формах.
Так, известно, что субстанцию фенибута количественно определяют методом неводного титрования (ФС 42-00380051-00), а в лекарственных формах (таблетки) - прямого спектрофотометрического определения в УФ-области (ФС 42-1768-96).
Известен способ по патенту РФ 2167410 (МПК G01N 21/78, опубл. 20.05.2001) определения количественного определения алифатических аминокислот, пригодный для количественного определения фенибута в таблетках путем обработки анализируемой пробы цветореагентом при нагревании с последующим спектрофотометрированием полученного окрашенного раствора; пробу обрабатывают 1%-ным спиртовым раствором нингидрина в среде фосфатного буферного раствора с рН=6,4-7,6, в присутствии 1 мг аскорбиновой кислоты, разбавляют полученный окрашенный раствор водой, а оптическую плотность измеряют при длине волны 568 нм.
Известные методы анализа фенибута в лекарственных формах являются трудоемкими, требуют специфических подходов при определении действующего вещества.
Для анализа алифатических аминокислот в биологических жидкостях, лекарственных препаратах, продуктах питания широко используются методы капиллярного электрофореза, основанные на разделении компонентов сложной смеси в кварцевом капилляре под действием приложенного электрического поля. С целью повышения специфичности и чувствительности метода капиллярного электрофореза для анализа отдельных алифатических аминокислот используют их предварительную дериватизацию с последующим разделением в кварцевом капилляре и спектрофотометрическим определением продуктов реакции. Так, в качестве дериватизирующих агентов используют 9-флуоренилметилформиат, 9-(2-карбазол)-этил-хлорформиат-цианиновый краситель. (О.В. Тринеева. Методы контроля качества аминокислот в фармацевтическом анализе (обзор)/ Научно-производственный рецензируемый журнал «Разработка и регистрация лекарственных средств». - №11. - май 2015)
Известен способ анализа на системе капиллярного электрофореза общего фосфора по патенту РФ 2499989 (МПК G01N 27/26, опубл. 27.11.2013), где анализ проводился в кварцевом капилляре, эффективной длиной 0,5 м, внутренним диаметром 75 мкм, для проведения анализа используют водный раствор ведущего электролита, содержащий 0,2% хромата калия и 0,6% уротропина при отрицательной полярности напряжения и длине волны детектирования - 254 нм.
Методом экструзии получены микрокапсулы фенибута. Проведено количественное определение фенибута в микрокапсулах спектрофотометрически при длинах волн 257 и 278 нм. Валидация методики показала следующие значения параметров: правильность (RSD=5,898%), прецизионность (RSD=5,298%). Целесообразным является разработка способа определения фенибута в микрокапсулах, обладающего достаточной чувствительностью, точностью и селективностью.
Техническим результатом является разработка способа количественного определения фенибута в микрокапсулах методом капиллярного электрофореза, обеспечивающего высокую чувствительность анализа, воспроизводимость результатов определения, уменьшение погрешности количественного определения фенибута в микрокапсулах.
Технический результат достигается тем, что в способе количественного определения фенибута в микрокапсулах методом капиллярного электрофореза, включающем выполнение анализа в системе капиллярного электрофореза в кварцевом капилляре эффективной длиной 0,5 м, внутренним диаметром 75 мкм, под действие электрического поля с использованием раствора ведущего электролита, с последующим спектрофотометрическим определением продуктов реакции, согласно изобретению в качестве ведущего электролита используется 10 мМ раствор натрия тетраборнокислого 10-водного с рН 9,2, анализ проводился при напряжении +20 кВ, температуре 30°С и длине волны детектирования 193 нм.
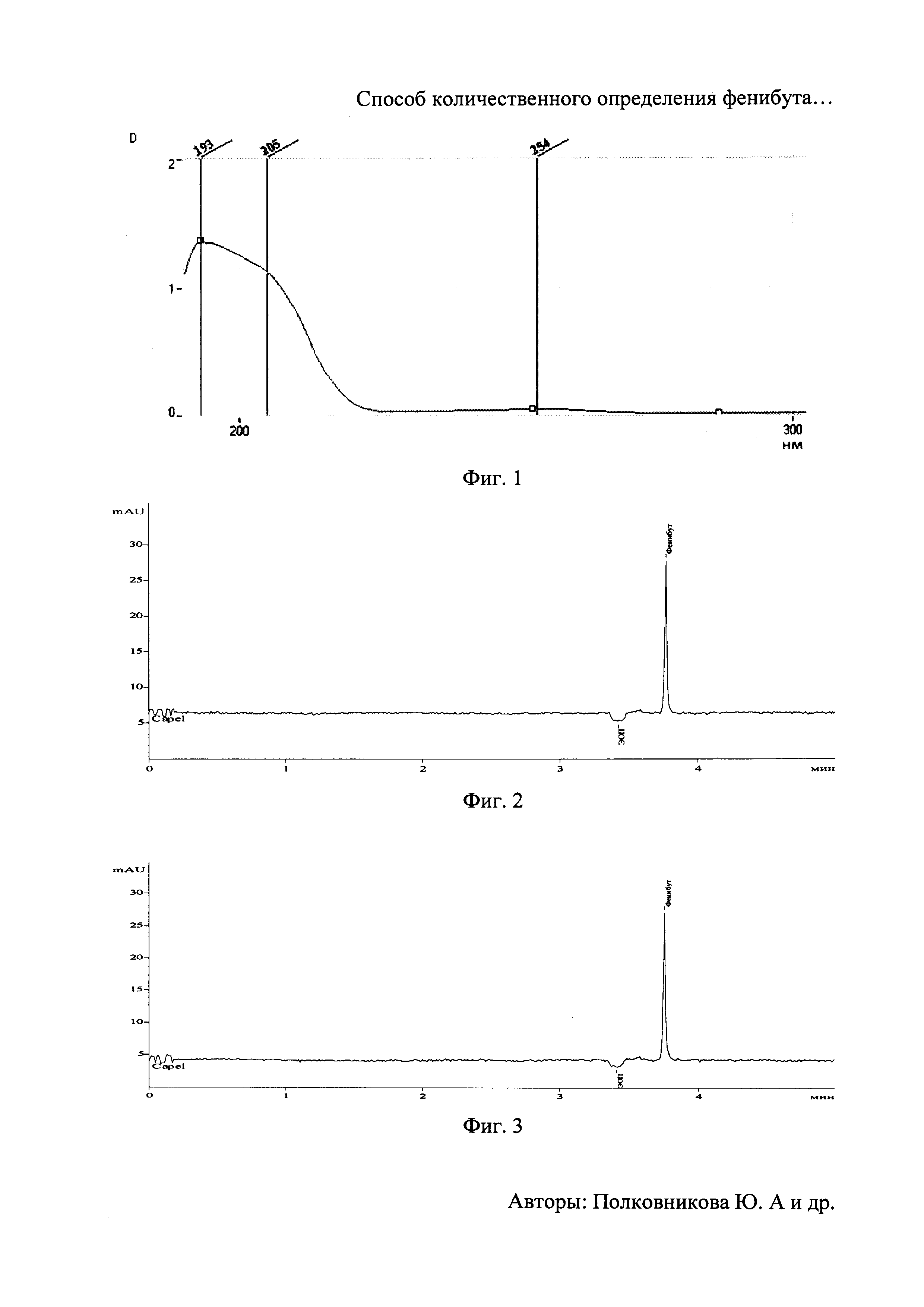
На фиг. 1 изображен спектр поглощения фенибута в 10 мМ растворе натрия тетраборнокислого 10-водного с и рН 9,2.
На фиг. 2 - ЭФГ водного раствора СО фенибута с концентрацией 30 мкг/мл (λ=193 нм, Т=30°С, ведущий электролит: 10 мМ раствор натрия тетраборнокислого 10-водного с рН 9,2).
На фиг. 3 - ЭФГ извлечения микрокапсул фенибута.
На фиг. 4 - ЭФГ извлечения микрокапсул плацебо.
На фиг. 5 приведена Таблица 1 значений количественного определения фенибута в микрокапсулах в зависимости от рН экстрагента (n=3, Р=95%).
На фиг. 6 приведена Таблица 2 значений количественное определение фенибута в микрокапсулах в зависимости от температуры эксперимента (n=3, Р=95%).
На фиг. 7 приведена Таблица 3 значений количественное определение фенибута в микрокапсулах в зависимости от времени экстракции (n=3, Р=95%).
Определение проводится в кварцевом капилляре (диаметр 75 мкм, Lобщ/Lэф=60/50 см). Детектирование при 193 нм, напряжение +20 кВ, температура 30°С. Ввод пробы осуществляется гидродинамически в режиме 150 мбар×с. Ведущий электролит: 10 мМ раствор натрия тетраборнокислого 10-водного с рН 9,2.
Исследования методом капиллярного электрофореза проводились с использованием системы капиллярного электрофореза Капель 105 (группа компаний Люмэкс, Россия) с жидкостной системой охлаждения капилляра, автосамплером и спектрофотометрическим детектором, охватывающим рабочий диапазон длин волн в области от 190 до 400 нм.
Пример 1
Приготовление раствора стандартного образца (СО) фенибута. Около 15 мг (точная навеска) фенибута помещали в мерную колбу, вместимостью 250 мл, растворяли в 100 мл воды, доводили до метки тем же растворителем и перемешивали (раствор А). Далее 0,5 мл раствора А переносили при помощи микропипетки в пробирку по типу Эппендорф, объемом 1,5 мл, прибавляли также с использование микропипетки 0,5 мл воды и перемешивали (раствор Б). Полученный раствор центрифугировали 3 мин при 8000 мин-1 и подвергали анализу в указанных условиях.
Методика анализа. Извлечение фенибута из испытуемых образцов проводили следующим образом: около 0,1 г (точная навеска) микрокапсул помещали в мерную колбу вместимостью 100 мл и прибавляли 50 мл воды. Далее колбу с образцом устанавливали на устройство перемешивающее и проводили встряхивание образца в течение 30 минут при 200 мин-1. Температура комнатная. По истечении указанного времени объем полученного раствора доводили водой до метки и перемешивали (раствор А). Из раствора А готовили раствор Б по схеме, приведенной для раствора СО фенибута. Полученный раствор Б центрифугировали 3 мин при 8000 мин-1 и подвергали анализу в указанных условиях. Расчет фенибута в микрокапсулах проводили с использованием раствора СО по формуле:
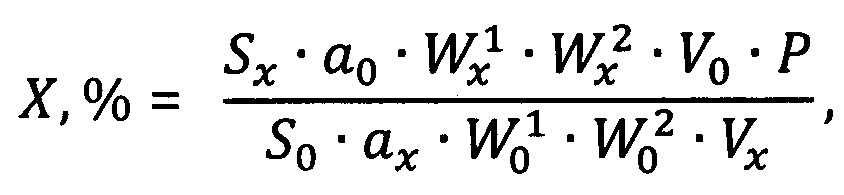
где
Sx и S0 - площади пика фенибута на электрофореграмме (ЭФГ) раствора испытуемого образца и СО соответственно;
ах - навеска микрокапсул, г;
а0 - навеска СО фенибута, г;
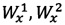 и
и 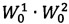 - объемы мерных колб, используемые для разведения извлечения микрокапсул и СО фенибута, соответственно, мл;
- объемы мерных колб, используемые для разведения извлечения микрокапсул и СО фенибута, соответственно, мл;
V0 и Vx - аликвоты, используемые для разведения извлечения микрокапсул и СО фенибута, соответственно, мл;
Р - содержание фенибута в СО, %.
Методика апробирована на образцах микрокапсул фенибута.
Пример 2
Количественное определение фенибута в микрокапсулах с оболочкой натрия альгинат (соотношение ядро : оболочка 1:1)
Для выбора аналитической длины волны измеряли спектр поглощения раствора фенибута. В качестве растворителя использовался раствор ведущего электролита. На фиг. 1 представлен полученный спектр поглощения раствора фенибута. Полученный спектр свидетельствует, что в данном растворителе максимум поглощения фенибута наблюдается при 193 нм, в результате чего данная длина волны и была выбрана в качестве аналитической.
На фиг. 2 представлена типичная электрофореграмма (ЭФГ) раствора СО фенибута. Из полученных результатов следует, что время анализа составляет не более 5 мин, при этом эффективность (N) по пику фенибута составляет около 200000 кажущихся теоретических тарелок (т.т.), а его разрешение (Rs) с сигналом электроосмотического потока (ЭОП) находится на уровне 3. Данные характеристики электрофоретического поведения фенибута позволяют использовать выбранные условия для дальнейших исследований.
Для установления возможного влияния сопутствующих компонентов микрокапсул на определение фенибута готовили извлечение, как из микрокапсул, содержащих фенибут, так и микрокапсул, не содержащих фенибут (плацебо). Извлечение проводили согласно приведенной процедуре в описании методики анализа.
На фиг. 3 и 4 ЭФГ представлены извлечений микрокапсул и микрокапсул плацебо. В результате показано, что сопутствующие компоненты микрокапсул не оказывают влияние на определение фенибута, при этом на ЭФГ извлечения микрокапсул обнаруживается только один пик, соответствующий как по времени миграции, так и по эффективности и разрешению, пику фенибута на ЭФГ раствора СО. Таким образом, выбранные условия позволяют вести определение фенибута в микрокапсулах.
При выборе оптимальных условий экстракции фенибута из микрокапсул переменными условиями были следующие: рН экстрагента, время и температура экстракции. Помимо этого, оценивалось влияние процесса разрушения микрокапсул на извлечение фенибута.
В качестве экстрагентов для извлечения фенибута из микрокапсул использовали воду, 10 мМ боратный буферный раствор с рН 8 и 10 мМ боратный буферный раствор с рН 9,2. Данный эксперимент может быть также полезен и для дальнейших фармацевтико-технологических испытаний разрабатываемого лекарственного средства.
В таблице 1 представлены результаты количественного определения фенибута в микрокапсулах в зависимости от экстрагента. В результате установлено, что на извлечение фенибута из микрокапсул значение рН экстрагента не оказывает достоверного влияния. В связи с этим в дальнейших исследованиях для экстракции фенибута из микрокапсул использовалась вода.
На следующем этапе оценивалось влияние температуры на высвобождаемость фенибута из микрокапсул. В опытах использовалось три температурных режимах: комнатная температура 37°С и 50°С (температурный режим устанавливался на устройстве перемешивающем ЛАБ-ПУ-01).
В таблице 2 представлены результаты количественного определения фенибута в микрокапсулах в зависимости от температуры эксперимента.
В ходе эксперимента установлено, что температура экстрагента также не оказывает достоверного влияния на извлечение фенибута из микрокапсул, что обуславливает использование для данного процесса комнатной температуры.
В таблице 3 представлены результаты количественного определения фенибута в микрокапсулах в зависимости от времени экстракции.
По результатам проведенных испытаний можно заключить, что увеличение времени экстракции от 15 до 60 минут не оказывает достоверного влияния на извлечение фенибута из микрокапсул. Однако в целях минимизации возможных потерь при использовании 15-минутной экстракции, при составлении методики было принято решение указывать время экстракции с некоторым запасом, т.е. 30 минут.
С целью изучения влияния разрушения микрокапсул на высвобождаемость фенибута около 0,1 г (точная навеска) микрокапсул помещали в ступку и интенсивно растирали с 5-6 мл воды. Полученную суспензию количественно переносили в мерную колбу вместимостью 100 мл, доводили водой до метки и тщательно перемешивали (раствор А). Дальнейшую пробоподготовку проводили согласно приведенной процедуре.
В результате было установлено, что количественное содержание фенибута в микрокапсулах составляет 5,67%±0,22. В сравнении с результатами (6,17%±0,31), полученными в соответствии с предложенной методикой, наблюдается отсутствие достоверного влияния процесса разрушения микрокапсул на высвобождение фенибута. Поэтому в процессе извлечения фенибута из микрокапсул необходимость предварительного их разрушения отсутствует.
Методика количественного определения фенибута в микрокапсулах была подвергнута валидационной оценке по показателям: специфичность, аналитическая область, линейность, правильность и прецизионность. В результате установлено, что методика является специфичной, а по показателям аналитическая область и линейность соответствует требованиям ГФ XIII издания. Кроме того, показано, что методика дает результаты, свободные от систематической погрешности (правильность методики), а прецизионность составляет (2,84%±0,08).
Для разработанной и валидированной методики были установлены параметры пригодности системы по показателям:
- число теоретических тарелок пика фенибута не менее 200000;
- разрешение пика фенибута и сигнала ЭОП не менее 3,0;
- фактор симметричности пика фенибута не менее 0,5 и не более 0,9.
Предложенный нами способ отвечает вышеперечисленным критериям и может быть рекомендован для работы контрольно-аналитических лабораторий, фармацевтических заводов, НИИ, на кафедрах фармацевтических ВУЗов и факультетов медицинских ВУЗов.
Способ количественного определения фенибута в микрокапсулах методом капиллярного электрофореза, включающий выполнение анализа в системе капиллярного электрофореза в кварцевом капилляре эффективной длиной 0,5 м, внутренним диаметром 75 мкм, под действие электрического поля с использованием раствора ведущего электролита, с последующим спектрофотометрическим определением продуктов реакции, отличающийся тем, что в качестве ведущего электролита используется 10 мМ раствор натрия тетраборнокислого 10-водного с рН 9,2, анализ проводился при напряжении +20 кВ, температуре 30°C и длине волны детектирования 193 нм.