Результат интеллектуальной деятельности: СПОСОБ ИДЕНТИФИКАЦИИ ДНК МИКОБАКТЕРИЙ ЛЕПРЫ С ПОМОЩЬЮ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к лабораторной диагностике лепры и может быть использовано, в частности, для выявления лиц, инфицированных микобактериями лепры. Сущность изобретения скринингового обследования населения на лепру состоит в том, что со слизистой оболочки полости носа берут соскоб и далее посредством проведения полимеразной цепной реакции (ПЦР) с использованием внешних и внутренних праймеров: 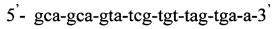 и
и 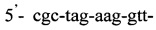
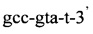 и флуоресцентного зонда
и флуоресцентного зонда 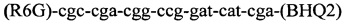 проводят идентификацию возбудителя лепры. Способ позволяет подтвердить факт носительства и/или инфицированности микобактериями лепры. Данный способ может применяться в диагностических лабораториях, в противолепрозных учреждениях, в лечебных учреждениях для обследования мигрантов.
проводят идентификацию возбудителя лепры. Способ позволяет подтвердить факт носительства и/или инфицированности микобактериями лепры. Данный способ может применяться в диагностических лабораториях, в противолепрозных учреждениях, в лечебных учреждениях для обследования мигрантов.
Несмотря на значительное снижение распространенности лепры после внедрения комбинированной химиотерапии, частота выявления новых случаев заболевания лепрой в мире остается высокой. В последние годы в нашей стране отмечается значительное увеличение потока мигрантов из эндемичных по лепре стран. В этой связи, на основании постановления Правительства РФ от 3 апреля 2003 г. №168 все лица, въезжающие в Россию, должны обследоваться, в том числе и на лепру. В настоящее время данное обследование включает клинический осмотр, и только при подозрении на лепру, проводят бактериоскопические исследования, предварительно окрашенных по Циль-Нильсену мазков с соскобов из носа и скарификатов с кожи.
Однако недостатками бактериоскопического метода являются:
- субъективизм оценки;
- малая чувствительность (в мазке должно быть 104 и более бактерий/мл);
- невозможность провести под микроскопом идентификацию видов микобактерий.
Учитывая, что основной путь передачи инфекции воздушно-капельный, и у многих контактных с больными лепрой лиц, особенно проживающих в эндемичных регионах, в назальном секрете обнаруживаются M.leprae без явных симптомов болезни [1], т.е. они могут являться потенциальным источником распространения заболевания, существует необходимость совершенствования скринингового обследования населения на лепру. Причем для такого обследования актуальным остается неинвазивный способ идентификации M.leprae с высокой чувствительностью и специфичностью.
Из практики медицины известен «Способ диагностики лепры» (заявка на изобретение №2000123326/14, 07.09.2000, опубл. 10.08.2001). Сущность способа заключается в том, что в слюне методом иммуноферментного анализа определяют антитела к IgM, IgG M.leprae с помощью антигенов M.lufu и по показателям оптической плотности диагностируют лепру.
Существенным недостатком данного способа является использование в качестве антигенов - M.lufu, не являющейся аналогом M.leprae. Обнаружение антител к M.lufu может только косвенно свидетельствовать о наличии антител к M.leprae. Это не дает возможности получить конкретный технический результат - повышение эффективности способа.
С развитием амплификационных методов, в частности полимеразноцепной реакции (ПЦР), появились широкие возможности в диагностике инфекционных заболеваний, особенно тех, где возбудителя трудно или невозможно культивировать. Помимо основных достоинств ПЦР - высокой чувствительности и специфичности, применение ПЦР позволяет значительно снизить время детекции возбудителя. В основе данного метода, состоящего из трех стадий (денатурация, отжиг, синтез), лежит амплификация (многократная репликация) специфического участка ДНК. Выбор подходящей ДНК-мишени для амплификации очень важен для создания высокоспецифичного ПЦР-теста. Правильно подобранные праймеры к соответствующим участкам ДНК-мишени обеспечивают специфичность и чувствительность тест-системы. Однако на результаты определения может повлиять ряд факторов, связанных с особенностями анализируемого клинического материала, т.е. создание высокоспецифичного и высокочувствительного ПЦР-теста связано с методами экстракции ДНК M.leprae в зависимости от источника биологического образца (сыворотка крови, биоптат, скарификаты с кожи, соскобы со слизистой оболочки носа). Основной задачей на этом этапе является получение максимального количества ДНК возбудителя с наименьшими экономическими затратами.
Изложенное определяет актуальность предлагаемого изобретения и необходимость разработки скринингового обследования населения на лепру с помощью полимеразной цепной реакции.
Известен способ по выявлению M.leprae в носовой полости авторами Klaster P.R., van Beers S., Madjit В. et al. (Detection of Mycobacterium leprae nasal carriers in population for which leprosy endemic // J. Clin. Microbiol. 1993, 2947-2951), проводившими обследование населения в эндемичном по лепре регионе. Используя праймеры к 531-bp фрагменту pra гена M.leprae, детекцию продуктов амплификации проводили либо в агарозном геле, либо в дальнейшей гибридизации, либо в ELISA. Показано, что в 2,9% случаев при использовании данных праймеров идентифицировать M.leprae не представлялось возможным.
Недостатком этого способа является отсутствие возможности идентифицировать M.leprae в некоторых образцах при проведении ПЦР, для чего требовалась постановка или повторной реакции, или проведение гибридизации, или иммуноферментного анализа. Кроме того, недостатком известного способа является использование в качестве детекции продуктов амплификации электрофореза, что может способствовать контаминации образцов. Эти недостатки не позволяют получить конкретный технический результат - повышение эффективности способа.
Известен способ идентификации Mycobacterium leprae с помощью теста GenoType Leprae DR, основанный на DNA-стрип технологии фирмы Hain Lifescience (Германия). Для идентификации используют мультиплексную амплификацию с биотинилированными праймерами и реверс-гибридизацией.
Недостатком данного метода является необходимость использования специализированного дорогостоящего оборудования и реактивов, совместимых только с данным оборудованием и, как следствие этого, высокая стоимость анализа, что не обеспечивает возможности получения конкретного технического результата - повышение эффективности способа.
С целью обнаружения ДНК M.leprae применяют праймеры к различным участкам ДНК. Одним из видов таких праймеров являются, так называемые, RLEP праймеры. Хромосома Mycobacterium leprae содержит семейство из 29 мультикопийных повторов (RLEP) с переменной структурой и неизвестной функцией [2], каждая из которых содержит инвариантный фрагмент в 545 bp, фланкирующих в некоторых случаях дополнительные фрагменты от 44 до 100 bp. Использование RLEP в качестве ДНК-мишеней для ПЦР имеет преимущество по чувствительности по сравнению с другими мишенями ДНК, поскольку они присутствуют в нескольких местах геномной ДНК [3].
Известен способ идентификации M.leprae в носовой полости с использованием праймеров к 372 bp фрагменту RLEP M.leprae (Patrocinio L.G., Goulart I.M.B., Goulart L.R. et al. Detection of Mycobacterium leprae nasal mucosa biopsies by the polymerase chain reaction // FEMS Immunol, and Med Microbiol. 2005, 44: 311-316) и к 455-bp фрагменту RLEP (Jadhav R.S., Macdonald M, Bjune L. et al. Simplified PCR detection method for nasal Mycobacterium leprae // Int. J. Lepr. 2001, 4: 299-307) с хорошей степенью чувствительности.
Недостатками этого способа являются - инвазивность метода (взятие биопсии со слизистой поверхности носа, а не соскоба), что подразумевает особые условия для взятия анализа и не может быть использовано при скрининговом обследовании. Кроме того, этот метод был применен только у больных лепрой и не проверялся на здоровых лицах. Эти недостатки не обеспечивают возможности получения конкретного технического результата - повышение эффективности способа.
Известен способ идентификации M.leprae, разработанный Truman R.W., Andrews Р.K., Robins N.Y. et al. (Enumeration of Mycobacterium leprae using realtime PCR // PLOS Negl. Trop.Dis., 2008, 2(11), doi:10.1371/joumail.pntd.0000328), где в качестве праймеров и зонда использовали сиквенс из 1, 2, 3 и 4 RLEP M.leprae. Недостатком данного способа является использование данных праймеров только для обнаружения Mycobacterium leprae в экспериментальной модели лепрозной инфекции на мышах.
В качестве прототипа изобретения взят способ, предложенный Martinez N.A., Lahiri R., Pittman L.T. et al. (Molecular determination of Mycobacterium leprae viability by use of real-time PCR // J. Clin. Microbiol. 2009, 47: 2124-2130), при котором для обнаружения M.leprae применяется метод ПЦР с обратной транскрипцией с использованием в качестве праймеров sodA mRNA, 16S rRNA и RLEP M.leprae.
Общим существенным признаком является то, что в обоих способах в качестве одного из праймеров используются последовательности RLEP M.leprae и амплификация проходит в режиме реального времени (Real time) в течение 40 циклов.
Сущность способа по прототипу состоит в обнаружении в биоптатах больных лепрой жизнеспособной ДНК M.leprae при использовании двух пар праймеров, а именно sodA/RLEP и 16SrRNA/ RLEP.
Недостатками известного способа являются:
- длительность метода выделения, состоящего из многих этапов с использованием дорогостоящих готовых зарубежных наборов реагентов, включающих гомогенизацию на льду, обработку реагентом TRIzol, осаждение ДНК изоамиловым спиртом, многократные отмывки;
- проведение экстракции ДНК и РНК только из биоптатов и скарификатов кожи больных лепрой и из подушечек лап атимусных мышей, зараженных M.leprae по методу Shepard и McRae [4]. Авторы не проводили экстракцию ДНК, полученной из соскобов со слизистой носа как от больных лепрой, так и контактных лиц, что необходимо при создании скринингового теста;
- применение только для диагностирования клинических проявлений болезни и для контроля эффективности лечения у больных лепрой;
- выявление преимущественно жизнеспособных M.leprae, что не является определяющим при скрининговом обследовании;
- использование несколько пар праймеров.
Таким образом, перечисленные недостатки не обеспечивают повышение точности, скорости, информативности, неинвазивности и удешевления способа, т.е. эффективности способа.
Целью изобретения является повышение скорости, точности, информативности, неинвазивности, а также удешевление способа идентификации ДНК микобактерий лепры с помощью полимеразной цепной реакции в режиме реального времени.
Цель достигается путем обнаружения Mycobacterium leprae в носовой полости обследуемых лиц с помощью неинвазивного способа взятия материала, простотой и сокращением времени выделения ДНК, использованием одной пары праймеров с применением отечественного оборудования и реактивов.
Сущность способа состоит в следующем:
Соскоб со слизистой оболочки полости носа проводят с помощью стерильных одноразовых зондов. Зонд переносят в пластиковую пробирку объемом 1,5 мл со стерильным физиологическим раствором (300 мкл), аккуратно перемешивают, извлекают зонд, прижимая к стенке пробирки и отжимая избыток жидкости. Пробирку плотно закрывают, центрифугируют при 13000 об/мин в течение 10 мин и удаляют надосадочную жидкость, оставив в пробирке примерно 100 мкл (осадок + жидкая фракция). К 100 мкл исследуемого образца добавляют 100 мкл физиологического раствора и 40 мкл 5% раствора сывороточного бычьего альбумина (СБА), пробирка встряхивается, образец отстаивается в течение 2-5 мин и затем инкубируется при температуре 95° 1 мин и охлаждается 1 мин при температуре -20°С. Эту процедуру повторяют 4 раза. После чего образец термостатируют 20 мин при 95°С и центрифугируют 1 мин при 13000 об/мин. Далее 5 мкл выделенной ДНК отбирают на дальнейшую постановку ПЦР, оставшийся материал хранят при температуре -20°С.
Выделенные 5 мкл ДНК добавляют в амплификационную смесь (25 мкл). Состав амплификационной смеси: 50 мМ KCl, 10 мМ Трис HCl (pH 8,8), 6,25 мМ MgCl2, Taq-полимераза (5 ед/мкл), смесь dNTP, концентрация каждого нуклеотида 25 мМ, глицерол, Tween 20, по 10 пкмоль/мкл каждого праймера и флуоресцентного зонда, 25 мМ MgCl2 и деионизированная вода. Затем вносят в пробирку 20 мкл минерального масла.
В каждой постановке, помимо пробирок с исследуемыми образцами, ставят 3 пробирки для проверки этапов пробоподготовки и постановки ПЦР: 1 пробирка - отрицательный контрольный образец (ОКО), прошедший все этапы пробоподготовки; 2 - отрицательный контроль «К-», в который добавляется 5 мкл стерильной дистиллированной воды; 3 - положительный контроль «К+» - 5 мкл положительного контрольного образца.
Последовательность праймеров и зондов к RLEP M.leprae:
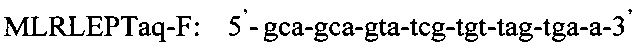
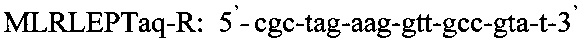
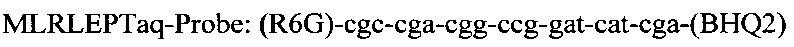
Использование в предлагаемом способе флуоресцентного зонда позволяет проводить ПЦР в реальном времени и избежать контаминации, что возможно при детекции результатов с помощью электрофореза. Отработка условий амплификации включает в себя: отработку времени и температуры денатурации при 94°-95°С от 1 мин до 10 мин, температуры отжига праймеров - 60°, 62°, 64°С, концентрации ионов Mg++ от 0,8 до 10,5 мМ, время циклов каждой стадии амплификации от 1 минуты до 15 сек и, наконец, количество циклов от 30 до 45. Критерием правильности режима для каждого этапа проводимой реакции служит показатель результата - наличие ДНК M.leprae из заведомо положительного биоптата кожи больного лепрой. Отработанный режим амплификации представляет из себя следующее:

Амплификацию и учет результатов проводят на термоциклере «ДТ-96 Real time» («НПФ ДНК-Технология», Россия).
Таким образом, способ идентификации микобактерий лепры, включающий применение ПЦР «Real time» с использованием внешних и внутренних праймеров: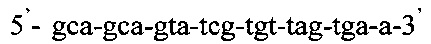 и
и 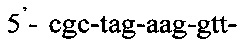
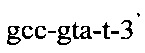 и флуоресцентного зонда
и флуоресцентного зонда 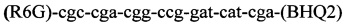 , заключается в том, что ДНК выделяют из соскоба со слизистой оболочки полости носа в 5% растворе СБА, с использованием режима амплификации: 95°С - 5 мин и 60°С - 50 сек - 1 цикл и 95°С - 15 сек и 62°С - 40 сек - 40 циклов в Трис HCl буфере с KCl, 6,25 мМ MgCl2, твином и глицеролом.
, заключается в том, что ДНК выделяют из соскоба со слизистой оболочки полости носа в 5% растворе СБА, с использованием режима амплификации: 95°С - 5 мин и 60°С - 50 сек - 1 цикл и 95°С - 15 сек и 62°С - 40 сек - 40 циклов в Трис HCl буфере с KCl, 6,25 мМ MgCl2, твином и глицеролом.
Проверку специфичности проводили на кожных биоптатах, полученных от больных лепрой. Во всех биоптатах M.leprae обнаружены как с помощью ПЦР-анализа, так и при гистологическом исследовании. Кроме того, специфичность оценивалась на музейных штаммах микобактерий: M.avium, M.kansasii, M.scrofulaceum, M.marinum, M.vaccae, M.intracellulare, M.clegg, M.duvalii, M.phlei, M.gastri, M.gordonae, M.lufu, M.smegmatis, M.bovis, M.paratuberculosis, M. Кедровский. Все изоляты исследовались в пределах 100 клеток в образце. Ни один из изолятов не показал реактивности в ПЦР.
В качестве примеров своевременного выявления микобактерий лепры приводятся выписки из карт больных.
Пример 1. Больной М-в Н.А. 1950 г.р., житель Астраханской области, проходил обследование в «НИИЛ» в марте 2012 г. Предположительный диагноз: Экзема распространенная. Лепра?
При обследовании у пациента взят соскоб со слизистой оболочки полости носа и скарификат кожи для проведения бактериоскопического исследования и постановки ПЦР. При бактериоскопическом исследовании Mycobacterium leprae не обнаружены. Для проведения ПЦР анализа у обследуемого стерильным зондом взят соскоб со слизистой носа, затем зонд помещен в пластиковую пробирку объемом 1,5 мл и аккуратно перемешан со стерильным физиологическим раствором (300 мкл), после чего, прижимая зонд к стенке пробирки и отжимая избыток жидкости, зонд извлечен. Пробирку плотно закрывают, центрифугируют при 13000 об/мин в течение 10 мин и удаляют надосадочную жидкость, оставляя в пробирке примерно 100 мкл. Затем в пробирку добавляют 100 мкл физиологического раствора и 40 мкл 5% раствора СБА, пробирку встряхивают на вортексе, отставляют пробирку на 5 мин и затем инкубируют при температуре 95°С 1 мин и охлаждают 1 мин при температуре - 20°С. Эту процедуру повторяют 4 раза. После чего пробирку термостатируют 20 мин при 95°С и центрифугируют 1 мин при 13000 об/мин. Далее, 5 мкл выделенной ДНК отбирают и добавляют в пробирку с 25 мкл амплификационной смеси, содержащей: 50 мМ KCl, 10 мМ Трис HCl (pH 8,8), 6,25 мМ MgCl2, Taq - полимеразу (5 ед/мкл), смесь dNTP, концентрация каждого нуклеотида 25 мМ, глицерол, Tween 20, 10 пкмоль/мкл каждого праймера и 10 пкмоль/мкл флуоресцентного зонда, 25 мМ MgCl2 и деионизированную воду. После этого вносят в пробирку 20 мкл минерального масла. В другую пробирку («К-») с амплификационной смесью вносят 5 мкл стерильной дистиллированной воды, а в третью пробирку («К+») - 5 мкл положительного контрольного образца. Затем образцы ставят в амплификатор ДТ-96, где заложена необходимая программа (95°С - 5 мин, 60°С - 50 сек - один цикл и 95°С - 15 сек и 62°С - 40 сек - 40 циклов). В положительном контрольном образце (биопсия от больного) кривая флуоресценции начинает подниматься с 22 цикла и через 5 циклов начинает подниматься кривая из обследуемого образца. В отрицательном контрольном образце флуоресценции не наблюдается. По результатам ПЦР исследования пациенту решено провести никотиновую пробу, позволяющую выявить невидимые на коже инфильтрации или пятна, после чего взят биоптат с кожи для гистологического исследования. При гистологическом исследовании у пациента обнаружен характерный инфильтрат с наличием Mycobacterium leprae. Таким образом, через 5 часов у больного выявлены микобактерии лепры на слизистой оболочке полости носа, что позволило провести дальнейшее обследование и поставить диагноз - лепра.
Пример 2. Больной Ш-в К.Б. 1981 г.р., житель Таджикистана, проходил консультативное обследование в «НИИЛ» в июле 2013 г. Предположительный диагноз: Лепра?
При обследовании у пациента взят соскоб со слизистой оболочки полости носа для проведения бактериоскопического исследования и постановки ПЦР. При бактериоскопическом исследовании Mycobacterium leprae в соскобе со слизистой носа не обнаружены. В результате ПЦР исследования, проведение которого описано выше, у больного в соскобе со слизистой оболочки носа выявлены микобактерии лепры. В дальнейшем расширенное обследование больного с привлечением бактериоскопических исследований скарификатов кожи и гистологического анализа кожных биоптатов подтвердило эти результаты. Больному поставлен диагноз многобациллярной лепры, являющейся наиболее контагиозной формой заболевания. Данный больной, проживавший в эндемичном по лепре регионе, длительное время обращался в различные медицинские учреждения по поводу трофической язвы стопы. Проведение скринингового обследования на лепру, по предлагаемому нами способу, позволило бы своевременно установить правильный диагноз и вовремя начать специфическое лечение, тем самым прервать эпидемиологическую цепочку болезни, снизив риск инфицирования M.leprae лиц, с которыми больной контактировал.
Для характеристики чувствительности предлагаемой тест-системы проведено сравнительное изучение выявления микобактерий лепры с помощью предлагаемого способа и с использованием теста GenoType Leprae DR фирмы Hain Lifescience (Германия). Результаты представлены в таблице:
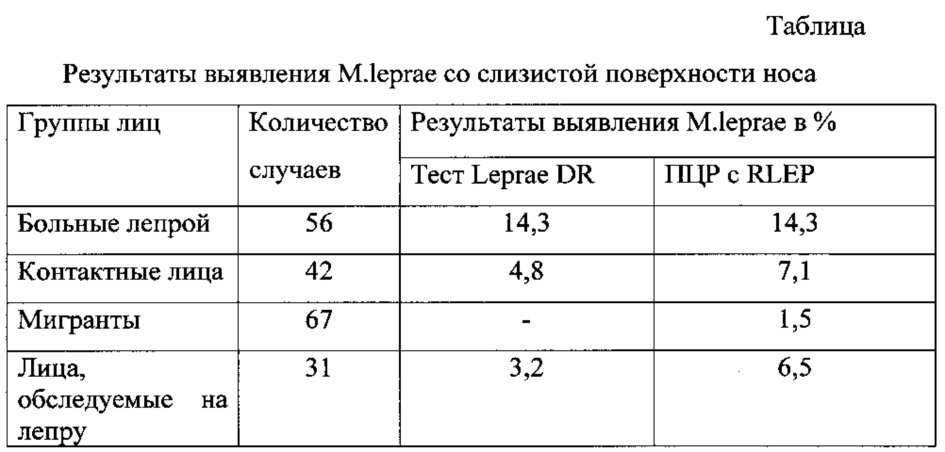
Полученные результаты подтверждают, что предлагаемый способ идентификации микобактерий лепры прост в исполнении, неинвазивен, информативен и значительно дешевле импортных тест-систем, выполняется на отечественном оборудовании и отличается повышенной чувствительностью, точностью и скоростью выполнения.
Приведенные примеры применения предлагаемого способа показывают его полезность для выявления инфицированных микобактериями лепры лиц, на основании чего проводится дальнейшее обследование с целью установления диагноза лепры. Таким образом, применение данного способа способствует выявлению заболевания на ранней стадии, когда лечение наиболее эффективно, проводится с наименьшими экономическими затратами и с наименьшим ущербом для здоровья пациентов. Предлагаемое изобретение удовлетворяет критериям новизны т.к. при определении уровня исследований по данному вопросу не обнаружено способа, которому присущи признаки, идентичные всем признакам, перечисленным в формуле изобретения, включая характеристику назначения.
Способ идентификации микобактерий лепры имеет изобретательский уровень, поскольку не выявлены технические решения, имеющие признаки, совпадающие с отличительными признаками предлагаемого изобретения.
Таким образом, предлагаемое изобретение решает основную задачу - повышение эффективности способа, а именно точности, скорости, информативности, неинвазивности, а также удешевление процедуры идентификации ДНК микобактерий лепры, что немаловажно при массовом обследовании, в частности мигрантов.
Авторами предложен новый, никем ранее незаявленный способ идентификации микобактерий лепры со слизистой оболочки носа при обследовании населения на лепру.
Предлагаемый способ может быть рекомендован к клиническому использованию в противолепрозных учреждениях, в диагностических лабораториях, в лечебных учреждениях для обследования населения на лепру.
Использованные источники
1. Rupendra S., Macdonald М., Bjune L. et al. Simplified PCR detection method for nasal Mycobacterium leprae // Int. J. Lepr., 2001, 69: 299-308.
2. Woods S.A., Cole S.T. A family of dispersed repeats of Mycobacterium leprae // Mol. Microbiol., 1990, 4: 1745-1751.
3. Kang T.J., Kim S.K., Lee S.B. et al. Comparison of two different PCR amplification products (the 18-kDA protein gene vs. RLEP repetitive sequence) in the diagnosis of Mycobacterium leprae // Clin. Exp. Dermatol., 2003, 28: 420-424.
4. Shepard S.S., McRae D.H. A method for counting acid-fast bacteria // Int. J. Lepr., 1968, 36: 78-82.
Способ идентификации Mycobacterium leprae, включающий применение полимеразной цепной реакции в режиме реального времени «Real time» с использованием внешних и внутренних праймеров: 5'-gca-gca-gta-tcg-tgt-tag-tga-a-3' и 5'-cgc-tag-aag-gtt-gcc-gta-t-3' и флуоресцентного зонда (R6G)-cgc-cga-cgg-ccg-gat-cat-cga-(BHQ2), отличающийся тем, что ДНК выделяют из соскоба со слизистой оболочки полости носа в 5% растворе сывороточного бычьего альбумина с использованием режима амплификации: 95°C - 5 мин и 60°C - 50 сек - один цикл, и 95°C - 15 сек и 62°C - 40 сек - 40 циклов.
