Результат интеллектуальной деятельности: ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ СОЕДИНЕНИЙ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к применению соединений. В частности, изобретение относится к применению соединений для лечения или профилактики заболеваний или биомедицинских состояний, таких как, расстройства, связанные с судорогами, биполярные расстройства, мания, депрессия, мигрень, синдром дефицита внимания и гиперактивности, латентная ВИЧ-инфекция, болезнь Альцгеймера, хорея и шизофрения, ишемия, рак и фатальная кровопотеря.
Уровень техники
Эпилепсия является широко распространенным серьезным нейрологическим состоянием, вызывающим существенные личные, социальные и экономические проблемы. Эпилепсией поражено 0,5-1% населения, у 30% из которого эпилепсия адекватно не лечится существующими антиэпилептическими лекарствами (Bialer и White 2010). У этих пациентов высок уровень смертности и заболеваемости. Клеточные и молекулярные аспекты, приводящие к эпилептическим припадкам, не ясны, хотя проводимые исследования сфокусированы на определении молекулярных путей, что необходимо для развития и разработки новых методов лечения для контроля припадков.
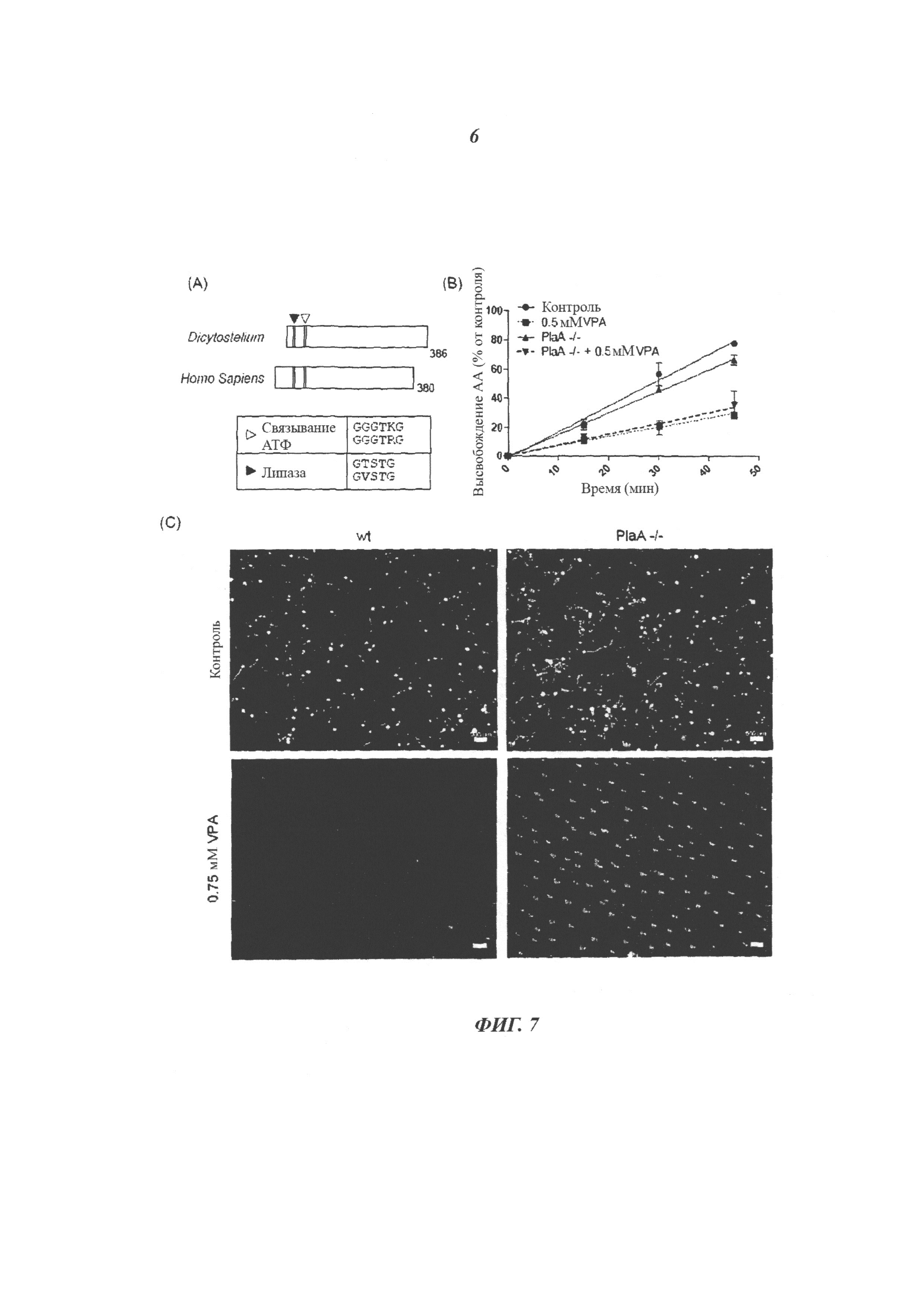
Вальпроевая кислота (VPA; 2-пропилпентановая кислота; Epilim®), жирная кислота с короткой разветвленной цепью, является наиболее распространенным, широко используемым в мире антиэпилептическим лекарственным средством, однако механизм ее действия при контроле припадков остается довольно неясным в течение более 40 лет (Lagace et al., 2005; Perucca, 2002). После того как было неожиданно обнаружено, что VPA эффективна для контроля припадков (Carraz G., 1967), она сейчас также используется для лечения биполярных расстройств и мигрени, дополнительно к разнообразным новым терапиям, включая рак и ВИЧ. Ранее было показано, что VPA обладает длительным эффектом при контроле дефицита инозитола (Williams et al., 2006; Williams, 2005), и этот длительный эффект вероятно обусловлен ее эффективностью в отношении биполярных расстройств.
Что касается лечения эпилепсии, предполагают, что терапевтические эффекты VPA основаны на прямом усилении выработки гамма-аминомасляной кислоты (ГАМК) (Lagace et al., 2005) и ингибировании активности натриевых каналов (Costa et al., 2006). Ключевым аспектом в механизме действия VPA при лечении эпилепсии является то, что она быстро блокирует активность припадка - в течение 30 минут после введения, что соответствует пиковой концентрации VPA в мозге после внутривенной инъекции (Aly и bdel-Latif, 1980). Кроме такого быстрого действия, предполагающего прямое воздействие на каналы или биохимическую (а не транскрипционную) мишень эпилепсии, были обнаружены некоторые быстрые эффекты VPA (Lagace et al., 2005), которые обуславливают большое терапевтическое значение быстрых VPA-катализируемых эффектов. Такие эффекты VPA были недавно проанализированы с использованием простой модели Dictyostelium (Xu et al., 2007). Было продемонстрировано, что VPA вызывает ингибирование продукции фосфатидилинозитол-(3,4,5)-трифосфата (PIP3) и снижение фосфорилирования фосфатидилинозитол-монофосфата (PIP) и фосфатидилинозитол-дифосфата (PIP2).
Посмертные образцы мозга с биполярным расстройством также показали измененные уровни ферментов, связанные с метаболизмом жирных кислот (Kim et al., 2009), а также измененные жирные кислоты в клеточных мембранах (Chiu et al., 2003). Большое количество исследований показало повышение высвобождения арахидоновой кислоты (АА) после припадка, катализированного повышенной активностью PLA2 (фосфолипазы A2) (Siesjo et al., 1982, Rintala et al., 1999, Bazan et al., 2002, Basselin et al., 2003), а ослабление этого процесса может улучшить контроль припадков и эпилептогенез (Rapoport и Bosetti, 2002).
Было показано, что VPA снижает метаболизм AA в мозге, но механизм этого процесса неизвестен (Chang et al., 2001). AA является незаменимой жирной кислотой, которая является основной полиненасыщенной жирной кислотой в большинстве мембранных фосфолипидов (Svennerholm, 1968) и играет центральную роль в передаче сигналов воспаления (Yedgar et al., 2006). Осталось неясным, связан ли эффект VPA на метаболизм AA с особыми состояниями, которые лечат с помощью VPA. Например, этот эффект может относится к профилактике биполярного расстройства (Rapoport, 2008b), поскольку аналогичное снижение передачи сигнала AA также наблюдали при лечении других структурно независимых биполярных расстройств, таких как чувствительные к литию (Basselin et al., 2005) и карбамазепину (Bazinet et al., 2006a).
Хотя VPA используется для лечения множества заболеваний, она имеет ряд нежелательных побочных эффектов, включая тератогенность и гепатотоксичность. Поэтому имеется срочная потребность в более сильных антиэпилептических лекарствах со сниженными побочными эффектами.
В международной заявке WO 99/02485 описано семейство аналогов VPA для лечения эпилепсии, мигрени, биполярных расстройств и боли. Конкретные соединения, раскрытые в WO 99/02485, включают 2-пропилгептилуксусную кислоту, 2-пропилдеканилуксусную кислоту и I-O-стеароил-2-пропилгептилацетоил-sn-глицеро-3-фосфотидилхолин.
С использованием биомедицинской модели Dictyostelium, авторы изобретения обнаружили, что эффект VPA заключается в том, что она вызывает быстрое снижение метаболизма фосфоинозитида, и этот эффект не основан на прямом ингибировании активности фосфатидилинозитол-3-киназы (PI3K) и не вызывается регуляцией рециклинга инозитола. Она также обнаружили, что VPA индуцирует как снижение высвобождения, так и повышение накопления радиомеченых AA и пальмитиновой кислоты (насыщенной жирной кислоты с длинной цепью). Этот эффект, катализируемый VPA, не вызван снижением активации жирных кислот.
Кроме того, исследования зависимости активности от структуры (SAR) показали высокую структурную специфичность этих механизмов действия. Это позволило определить группу соединений, демонстрирующих терапевтический потенциал, аналогичный VPA, но со сниженными побочными эффектами и/или с повышенной терапевтической эффективностью.
Раскрытие изобретения
В соответствии с первым аспектом изобретения предложено соединение формулы
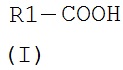
где R1 представляет собой алкильную или алкенильную группу, имеющую основную цепь из 7-11 атомов углерода, возможно разветвленную в любом положении атома углерода в основной цепи, где разветвление представляет собой боковую C1-6 алкильную группу, причем алкильная или алкенильная группы основной цепи и/или боковые алкильные группы возможно содержат один или более гетероатомов,
при условии, что, когда R1 представляет собой алкильную группу, имеющую основную цепь из 7 атомов углерода, разветвление не состоит только из гексильной группы у α-атома углерода R1, или только из метильной группы у γ-атома углерода R1, или только из единственных метильных групп у обоих β и ω-1 атомов углерода R1, и при условии, что, когда R1 представляет собой алкильную группу, имеющую основную цепь из 8 или 11 атомов углерода, разветвление не состоит только из пропильной группы у α-атома углерода R1,
или его фармацевтически приемлемая соль, амид или эфир,
для применения в лечении или профилактике заболевания или биомедицинского состояния, выбранного из расстройств, связанных с судорогами, биполярных расстройств, мании, депрессии, мигрени, синдрома дефицита внимания и гиперактивности, латентной ВИЧ-инфекции, болезни Альцгеймера, хореи, шизофрении, ишемии, рака и фатальной кровопотери, при условии, что когда соединение представляет собой 2-метил-2-пентеновую кислоту, заболевание или состояние не является биполярным расстройством или эпилепсией.
Было обнаружено, что соединения, описанные в данной заявке, вызывают быстрое снижение метаболизма фосфоинозитола и/или снижение метаболизма жирных кислот. Поскольку было определено, что снижение метаболизма фосфоинозитола и жирных кислот является механизмом действия VPA, эти соединения могут потенциально использоваться для лечения или профилактики состояний, которые лечатся VPA, таких как расстройства, связанные с судорогами, биполярные расстройства, мания, депрессия, мигрень, синдром дефицита внимания и гиперактивности, латентная ВИЧ-инфекция, болезнь Альцгеймера, хорея и шизофрения, в частности, эпилепсия, биполярные расстройства и мигрень.
В варианте осуществления изобретения, когда R1 представляет собой алкильную группу, имеющую основную цепь из 7 атомов углерода, разветвление не состоит только из метильной группы у ω-1-атома углерода R1, и предпочтительно не содержит метильную группу у ω-1-атома углерода R1.
Соединения, которые могут использоваться для целей изобретения, включают нонановую кислоту, декановую кислоту, 4-этилоктановую кислоту, 2-пропилоктановую кислоту, 2-бутилоктановую кислоту, 4-метилнонановую кислоту, 8-метилнонановую кислоту, 3-метилнонановую кислоту и 3-метилундекановую кислоту, но не ограничены ими.
Термин «алкильная группа, имеющая основную цепь из x-y атомов углерода», использованный в данном описании, относится к линейной насыщенной углеводородной группе, содержащей от x до y атомов углерода. Например, алкильная группа, имеющая основную цепь из 1-4 атомов углерода, означает неразветвленную насыщенную углеводородную группу, содержащую 1-4 атома углерода. Примеры алкильной группы, имеющей основную цепь из 1-4 атомов углерода, включают метил, этил, пропил и бутил.
Термин «алкенильная группа, имеющая основную цепь из x-y атомов углерода», использованный в данном описании, относится линейной ненасыщенной углеводородной группе, содержащей от x до y атомов углерода и по меньшей мере одну (например, 1, 2, 3 или 4) двойную связь. Например, алкенильная группа, имеющая основную цепь из 3-5 атомов углерода, означает неразветвленную ненасыщенную углеводородную группу, содержащую 3-5 атомов углерода. Примеры алкенильной группы, имеющей основную цепь из 3-5 атомов углерода, включают пропилен, бутилен и пентилен.
Термины «α-атом углерода R1», «β-атом углерода R1» и «γ-атом углерода R1» относятся соответственно к первому, второму и третьему атому углерода в цепи атомов углерода, образующих R1, считая от, но не включая группу COOH в формуле (I). Термин ʺω-1-атом углерода R1ʺ относится к предпоследнему атому углерода в цепи атомов углерода, образующих R1, также считая от группы COOH в формуле (I). Другими словами, ʺω-1-атом углерода R1ʺ - это атом углерода рядом с концевой метильной или метиленовой группой в R1.
Термин «Cx-y алкильная группа», использованный в данном описании, относится к разветвленной или неразветвленной насыщенной углеводородной группе, содержащей от x до y атомов углерода. Например, C1-4 алкильная группа относится к разветвленной или неразветвленной насыщенной углеводородной группе, содержащей 1-4 атома углерода. Примеры C1-4 алкильной группы включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
Понятие «фармацевтически приемлемая соль» соединения согласно настоящему изобретению включает соли с неорганическими основаниями, соли с органическими основаниями, соли с неорганическими кислотами, соли с органическими кислотами и соли с основными и кислотными аминокислотами. Соли с основаниями могут быть, в частности, использованы в различных формах. Соединение согласно настоящему изобретению может быть либо в гидратированной, либо негидратированной форме.
Понятие «фармацевтически приемлемые амиды» соединений согласно настоящему изобретению означает производные, в которых карбоксил (т.е. группы -C(O)OH) указанных соединений) модифицирован реакцией с амином -NHR1'R2' с получением групп -C(O)NR1'R2', где R1' и R2' могут быть независимо выбраны из H, C1-8 алкила (н-р C1-6 алкила), арила, гетероарила и C3-8 циклоалкила.
Понятие «фармацевтически приемлемые эфиры» соединений согласно настоящему изобретению означает производные, в которых карбоксил (т.е. группы -C(O)OH) указанных соединений) модифицирован реакцией со спиртовой группой W-OH с получением группы -C(O)OW, где W может представлять собой C1-18 алкил (н-р C1-6 алкил), арил, гетероарил или C3-8 циклоалкил.
Общие способы получения солей, амидов и эфиров хорошо известны специалистам. Фармацевтическая приемлемость солей, амидов и эфиров будет зависеть от множества факторов, включая характеристики обрабатываемости композиций и поведение in vivo, и специалист способен оценить такие факторы с учетом настоящего раскрытия.
Когда соединения согласно изобретению существуют в различных энантиомерных и/или диастереомерных формах (включая геометрическую изомерию относительно двойных связей), эти соединения можно получить в виде смесей изомеров или рацематов, хотя изобретение относится ко всем таким энантиомерам или изомерам, независимо от того, присутствуют они в оптически чистой форме или в виде смесей с другими изомерами. Индивидуальные энантиомеры или изомеры можно получить известными способами, такими как оптическое разделение конечных продуктов или промежуточных продуктов (например, хиральное храматографическое разделение (н-р, хиральная ВЭЖХ)), или энантиомерный синтез. Аналогично, когда соединения согласно изобретению могут существовать в виде альтернативных таутомерных форм, изобретение относится к индивидуальным таутомерам и к смесям таутомеров в любом соотношении.
В некоторых вариантах осуществления изобретения R1 представляет собой алкильную группу.
В некоторых вариантах осуществления изобретения R1 представляет собой алкильную группу, имеющую основную цепь из 7-10 атомов углерода.
В некоторых вариантах осуществления изобретения R1 представляет собой алкильную группу, имеющую по меньшей мере одну точку разветвления, например одну, две или три точки разветвления.
В некоторых вариантах осуществления изобретения R1 представляет собой алкенильную группу, имеющую основную цепь из 7-10 атомов углерода, имеющую разветвление в любом положении основной цепи, предпочтительно у α, β, γ или ω-1 атома углерода R1.
В некоторых вариантах осуществления изобретения разветвление представляет собой C1-4 алкильную группу, такую как метил, этил, пропил или бутил, предпочтительно метил, этил или пропил.
В некоторых вариантах осуществления изобретения R1 представляет собой алкильную группу, имеющую основную цепь из 7 атомов углерода, имеющую разветвление в виде этила, пропила или бутила.
В некоторых вариантах осуществления изобретения R1 представляет собой алкильную группу, имеющую основную цепь из 8 атомов углерода, имеющую разветвление в виде метила.
В некоторых вариантах осуществления изобретения R1 является неразветвленной алкильной группой.
В некоторых вариантах осуществления изобретения R1 представляет собой C8-9 неразветвленную алкильную группу.
В некоторых вариантах осуществления изобретения один или более гетероатомов в алкильных или алкенильных группах выбран из группы, состоящей из кислорода, серы и азота. Предпочтительно, одним или более гетероатомами является кислород.
В некоторых вариантах осуществления изобретения соединение, используемое для изобретения, назначают отдельно, одновременно или последовательно в комбинации с другим фармацевтически приемлемым агентом, который известен как полезный в лечении или профилактике заболевания или биомедицинского состояния, выбранного из расстройств, связанных с судорогами, биполярных расстройств, мании, депрессии, мигрени, синдрома дефицита внимания и гиперактивности, латентной ВИЧ-инфекции, болезни Альцгеймера, хореи, шизофрении, ишемии, рака и фатальной кровопотери, или их сочетания.
В некоторых вариантах осуществления изобретения два или более соединений, используемых согласно первому аспекту изобретения, могут быть использованы отдельно, одновременно или последовательно в комбинации.
Согласно второму аспекту изобретения предложен способ лечения или профилактики заболевания или биомедицинского состояния, выбранного из расстройств, связанных с судорогами, биполярных расстройств, мании, депрессии, мигрени, синдрома дефицита внимания и гиперактивности, латентной ВИЧ-инфекции, болезни Альцгеймера, хореи, шизофрении, ишемии, рака и фатальной кровопотери, в частности, эпилепсии, биполярных расстройств и мигрени, где способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения согласно первому аспекту изобретения.
Соединение можно вводить с одним или более обычными нетоксичными фармацевтически приемлемыми носителями, адъювантами или наполнителями. Фармацевтически приемлемыми носителями, адъювантами и наполнителями, которые можно использовать в изобретении, являются обычно используемые в фармацевтических композициях и включают сахара, сахарные спирты, крахмалы, ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицерин, сорбиновую кислоту, сорбат калия, смеси частичных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протамин сульфат, динатрий гидрофосфат, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрийкарбоксиметилцеллюлозу, полиакрилаты, воски, полиэтилен-полиоксипропиленовые блоксополимеры, полиэтиленгликоль и ланолин, но не ограничены указанными веществами. Соединение можно вводить перорально, парентерально, путем ингаляции, ректально, назально, буккально, вагинально или из имлантированного резервуара. Используемый в данном описании термин «парентерально» включает подкожное, внутрикожное, внутривенное, внутримышечное, интраартикулярное, внутрисуставное, интрастернальное, внутриоболочечное, внутриочаговое и внутричерепное введение посредством инъекции или инфузии.
Соединение, используемое в изобретении, можно вводить в форме стерильного инъецируемого препарата, например, в виде стерильной инъецируемой водной или масляной суспензии. Такая суспензия может быть приготовлена известными методами с использованием подходящих диспергирующих или смачивающих агентов (таких как, например, Tween 80) и суспендирующих агентов. Стерильный инъецируемый препарат также может быть стерильным инъецируемым раствором или суспензией в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых наполнителей и растворителей можно использовать маннит, воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла. Для этой цели можно использовать любые мягкие нелетучие масла, включая моно- и диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицериды, пригодны для получения инъецируемых препаратов, также как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированной форме. Такие масляные растворы или суспензии также могут содержать длинноцепочечный спирт в качестве разбавителя или диспергента, такой как описано в Фармакопее Швейцарии, или другой аналогичный спирт.
Соединение, используемое в изобретении, можно вводить перорально в любой перорально пригодной лекарственной форме, включая капсулы, таблетки, порошки, гранулы и водные суспензии и эмульсии, но не ограничиваясь этим. Эти лекарственные формы готовят известными способами для приготовления фармацевтических препаратов. Для таблеток для перорального введения носители, которые обычно используют, включают лактозу и кукурузный крахмал. Также обычно добавляют смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсул пригодные носители включают лактозу и сухой кукурузный крахмал. Когда водные суспензии вводят перорально, активный ингредиент объединяют с эмульгирующими и суспендирующими агентами. При необходимости, можно добавлять определенные подсластители и/или корригенты, и/или красители.
Соединение, используемое в изобретении, можно вводить в форме суппозиториев для ректального введения. Для этой цели соединение можно смешивать с пригодным нераздражающим эксципиентом, который является твердым при комнатной температуре и жидким при ректальной температуре, поэтому он плавится в прямой кишке и высвобождает активные компоненты. Подходящие материалы включают масло какао, пчелиный воск и полиэтиленгликоли, но не ограничены этим.
Соединение, используемое в изобретении, можно вводить в форме назального аэрозоля или ингаляции. Для этой цели соединение можно приготовить известными методами для получения фармацевтических препаратов в виде раствора в физиологическом растворе с использованием бензилового спирта или других пригодных консервантов, промоторов абсорбции для усиления биодоступности, фтороуглеродов и/или других солюбилизирующих или диспергирующих агентов, известных из уровня техники.
Соединение, используемое в изобретении, можно вводить в количестве от примерно 1 до примерно 20000 мкг/кг на дозу, в зависимости от состояния, которое требуется лечить или предупреждать, и характеристик субъекта, которому вводят соединение. Во многих случаях это количество может быть от примерно 1 до примерно 1500 мкг/кг на дозу. Режим дозирования может быть легко определен специалистом на основании настоящего раскрытия.
В соответствии с третьим аспектом изобретения предложено применение соединения согласно первому аспекту изобретения для получения лекарственного средства для лечения или профилактики заболевания или биомедицинского состояния, выбранного из расстройств, связанных с судорогами, биполярных расстройств, мании, депрессии, мигрени, синдрома дефицита внимания и гиперактивности, латентной ВИЧ-инфекции, болезни Альцгеймера, хореи, шизофрении, ишемии, рака и фатальной кровопотери.
Краткое описание графических материалов
Далее изобретение описано более подробно посредством примеров со ссылками на фигуры, описанные ниже.
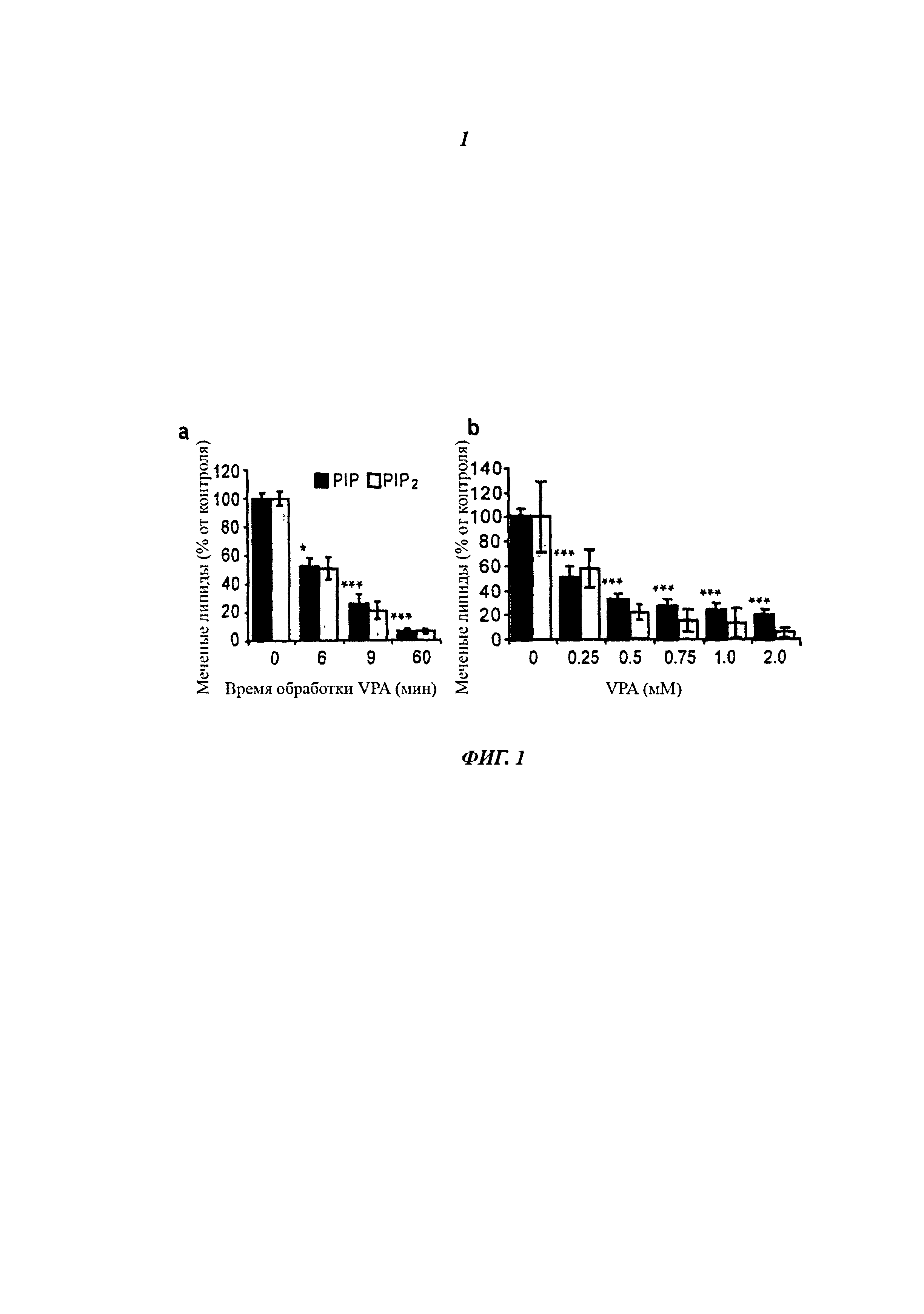
На фиг.1 показан время- и дозо-зависимый эффект VPA на ослабление передачи сигнала фосфоинозитидом на модели Dictyostelium. Определение меченого фосфоинозитида осуществляли путем введения радиоактивного фосфата во вновь образованные липиды, после которого проводили экстракцию, разделение тонкослойной хроматографией (ТСХ) и количественное определение с использованием прибора Phosphorimager Typhoon (Pawolleck & Williams 2009). (a) Анализ метаболизма PIP и PIP2 в клетках, обработанных VPA (0,5 мМ), для указанного времени. (b) Анализ метаболизма PIP и PIP2 в клетках, обработанных 9 минут различными концентрациями VPA. Представлены результаты из трехкратных опытов с двумя образцами ± SD (среднеквадратическое отклонение), где *P<0,05; **P<0,01; ***P<0,001 для уровней PIP.
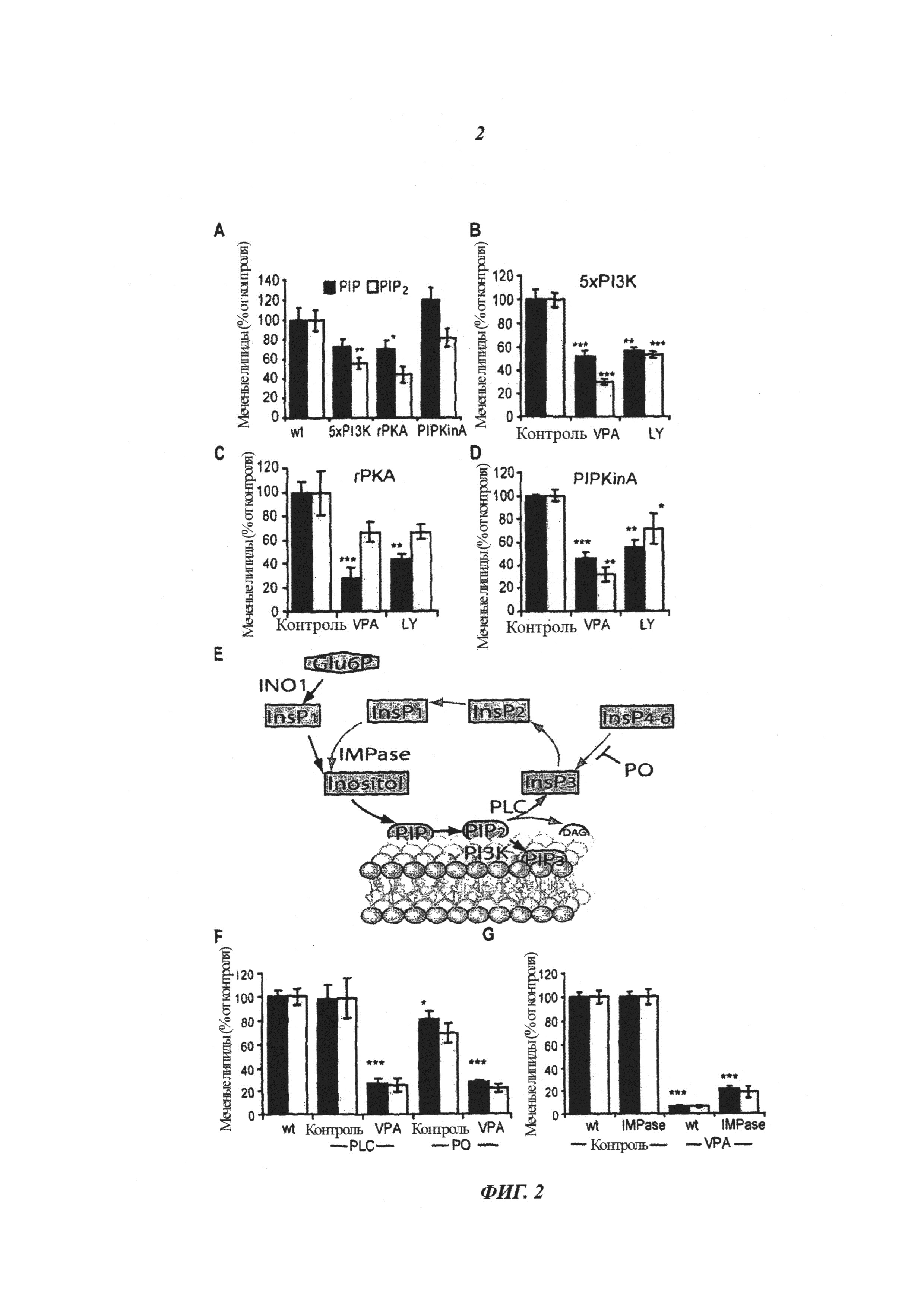
На фиг.2 представлены данные, демонстрирующие участие фосфоинозитида в передаче сигнала и чувствительность к VPA у особей дикого типа (wt) и нокаутных (в «выключенным» геном) мутантах, у которых отсутствовала фосфолипидкиназа и ферменты, участвующие в рециклинге инозитола, обработанных в течение 9 минут VPA (0,5 мМ), или без такой обработки. (a) Сравнение уровней фосфоинозитида у необработанных изогенных мутантных линий, у которых отсутствовала активность фосфолипидкиназы: пять генов 1-фосфатидилинозитол-3-киназы (5xPI3K; DBS0252654); ген фосфатидилинозитол-4-фосфат-5-киназы (rPKA; DDB0191443); и ген фосфатидилинозитол-4-фосфат-5-киназы (PIPKinA; DDB0185056). Чувствительность к VPA и ингибитору PI3K определяли с использованием 0,5 мМ VPA или 50 мкМ LY2946004 соответственно для: (b) 5xPI3K мутанта; (c) rPKA мутанта и (d) PIPKinA мутанта. (e) Схематическое изображение фосфоинозитидной сигнализации, где показана роль фосфолипазы C (PLC), пролилолигопептидазы (РО), инозитол-монофосфатазы (IMPase) и миоинозитолсинтазы (INO1) в генерации и рециклинге фосфоинозитидов. (f) Удаление генов PLC и РО не изменяло VPA-аттенуированную PIP и PIP2 сигнализацию (g) пролонгированная обработка с помощью VPA (60 мин, 0,5 мМ) дополнительно снижала фосфоинозитидную сигнализацию, причем этот эффект не изменялся последующей сверхэкспрессией инозитол-монофосфатазы. Представлены результаты из трехкратных опытов с двумя образцами ± SD, где *P<0,05; **P<0,01; ***P<0,001 для уровней PIP.
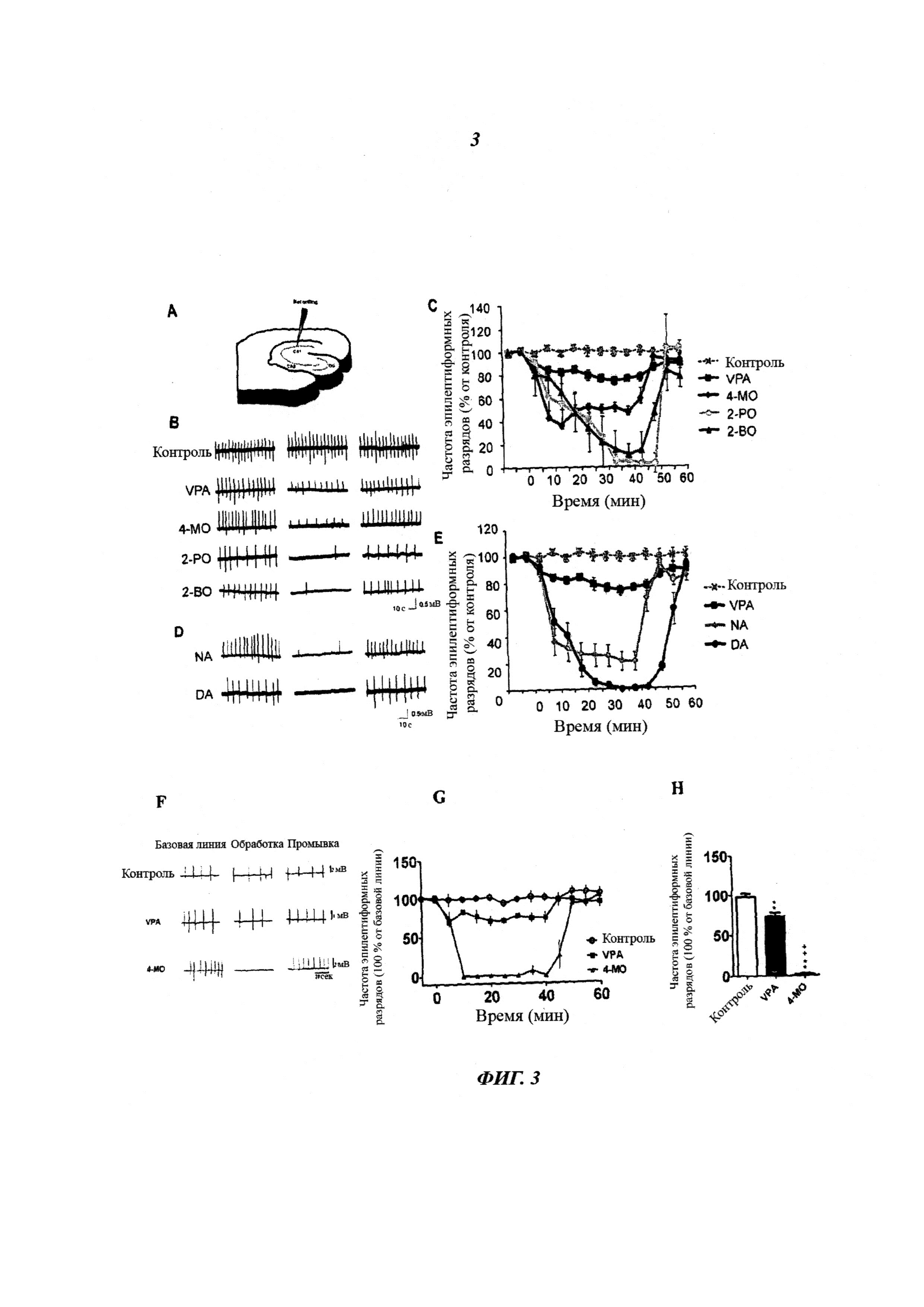
На фиг.3 показаны данные, касающиеся контроля судорог с помощью VPA и фосфоинозитид-аттенуирующих соединений с использованием модели острой судорожной активности, вызванной введением пентилентетразола (PTZ) in vitro, и модели с низким содержанием магния. (a) Объединенный препарат среза энторинальной области коры и гиппокампа помещали в погруженную регистрирующую камеру и осуществляли перфузию искусственной цереброспинальной жидкостью с высоким содержанием [K+] и PTZ для индуцирования эпилептиформной активности перед добавлением VPA или новых соединений с концентрацией 1 мМ. (b) Иллюстрация следов эпилептиформных разрядов после применения VPA, 4-метилоктановой кислоты (4-МО), 2-пропилоктановой кислоты (2-РО) и 2-бутилоктановой кислоты (2-ВО)). (c) Частота эпилептиформных разрядов после применения лекарств в зависимости от времени. Лекарства применяли в течение времени от 0 до 40 минут. (d) Образцы следов и (e) частота эпилептиформных разрядов после применения нонановой кислоты (NA) и декановой кислоты (DA) с более длинными прямыми цепями. (f) Иллюстрация образцов следов эпилептиформных разрядов, индуцированных низкой концентрацией магния, после применения VPA (1 мМ), 4-метилоктановой кислоты (4-МО, 1 мМ). (g) Частота эпилептиформных разрядов, индуцированных низкой концентрацией магния, после применения лекарств (VPA 1 мМ, n=5; 4-МО 1 мМ, n=5). Частота эпилептиформных разрядов, индуцированных низкой концентрацией магния, изображена в зависимости от времени. Лекарства применяли в течение времени от 0 до 40 минут. Применение VPA существенно снижало частоту эпилептиформных разрядов (72,7±3,6% от базовой линии, n=5, 30-40 минут после применения, эффект супрессии обратим после промывки), а применение 4-МО устраняло эпилептиформные разряды (1,6±3,1% от базовой линии, n=5, p<0,01 по сравнению с контролем; P<0,01 по сравнению с VPA). Эпилептиформная активность в обоих случаях обработки восстанавливалась после вымывания лекарства (n=5 для каждого лекарства). (h) Сравнение средней частоты эпилептиформных разрядов, индуцированных низкой концентрацией Mg2+ за последние 10 минут в течение применения лекарства при различных обработках, которое демонстрирует значительный эффект всех соединений, снижающий судорожную активность. *P<0,05, **P<0,01 по сравнению с контролем; +P<0,05, ++P<0,01, по сравнению с группой, обработанной VPA. Данные представлены в виде среднего ± SEM (стандартная погрешность средней величины).
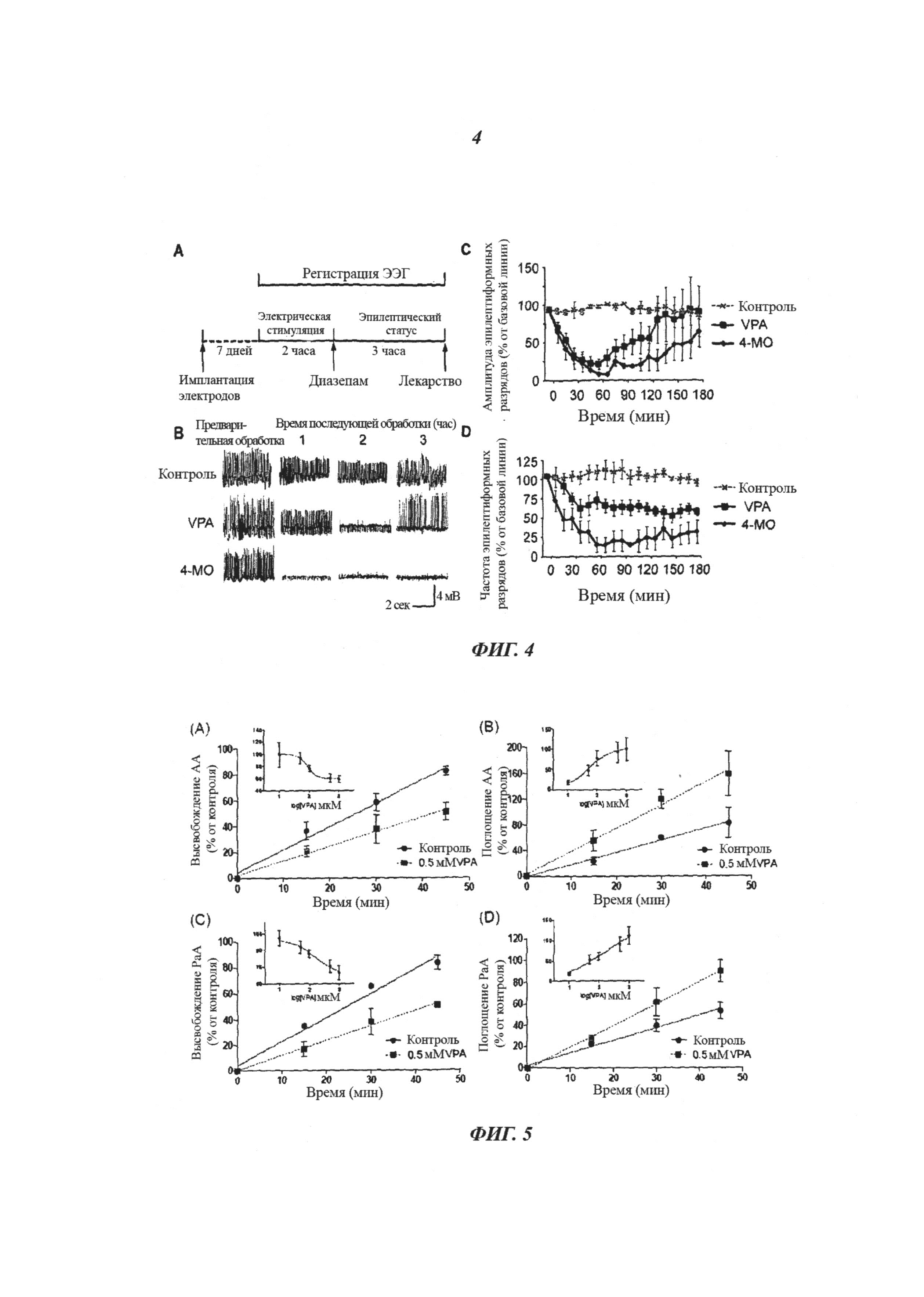
На фиг.4 показаны данные, касающиеся контроля судорог с помощью фосфоинозитид-аттенуирующих соединений с использованием модели судорожной активности in vitro. (a) краткое описание процедуры: электрическая индукция самоподдерживающегося эпилептического статуса (status epilepticus) (SSSE). Крыс стимулировали через перфорирующий путь электрическим током 4-5 мА, монополярными импульсами по 50 мкс с частотой 20 Гц в течение 2 часов для индукции SSSE через 7 дней после имплантации электродов. Через три дня после индукции SSSE крысам вводили диазепам (10 мг/кг) интраперитониальной инъекцией (i.p.) для прекращения судорожной активности. (b) Иллюстративные образцы ЭЭГ у животных с эпилептическим статусом. Введение VPA (400 мг/кг) или 4-метилоктановой кислоты (400 мг/кг) привело к ослаблению судорожной активности, а диметилсульфоксид (DMSO) не имел эффекта. (c) Временная зависимость эффектов введения DMSO (n=5), VPA (n=7) и 4-МО (n=7) на амплитуду пиков. (d) Временная зависимость эффектов введения DMSO (n=5), VPA (n=7) и 4-МО (n=7) на частоту повторения спонтанных пиков.
На фиг.5 продемонстрировано, что VPA вызывает изменения в поглощении и высвобождении жирных кислот время- и дозозависимым образом. Клетки Dictyostelium дикого типа (Ах2) предварительно инкубировали в меченых 3H арахидоновой кислоты (AA) или пальмитиновой кислоты - РаА (С), и высвобождение метки 3H во внешний буфер показано в присутствии/отсутствии VPA. Поглощение жирных кислот было измерено путем инкубации клеток в присутствии или отсутствии VPA и 3H AA (B) или пальмитиновой кислоты (D) одновременно. Показано поглощение 3H осадком клеток Dictyostelium. Все результаты выражены в виде % от контроля за период 60 минут. Графики на вставках показывают кривые доза-ответ. Статистические кривые и кривые доза-ответ были рассчитаны с использованием программного обеспечения Graphpad Prizm™. Все данные являются результатами по меньшей мере трех независимых опытов и выражены как среднее ± SEM.
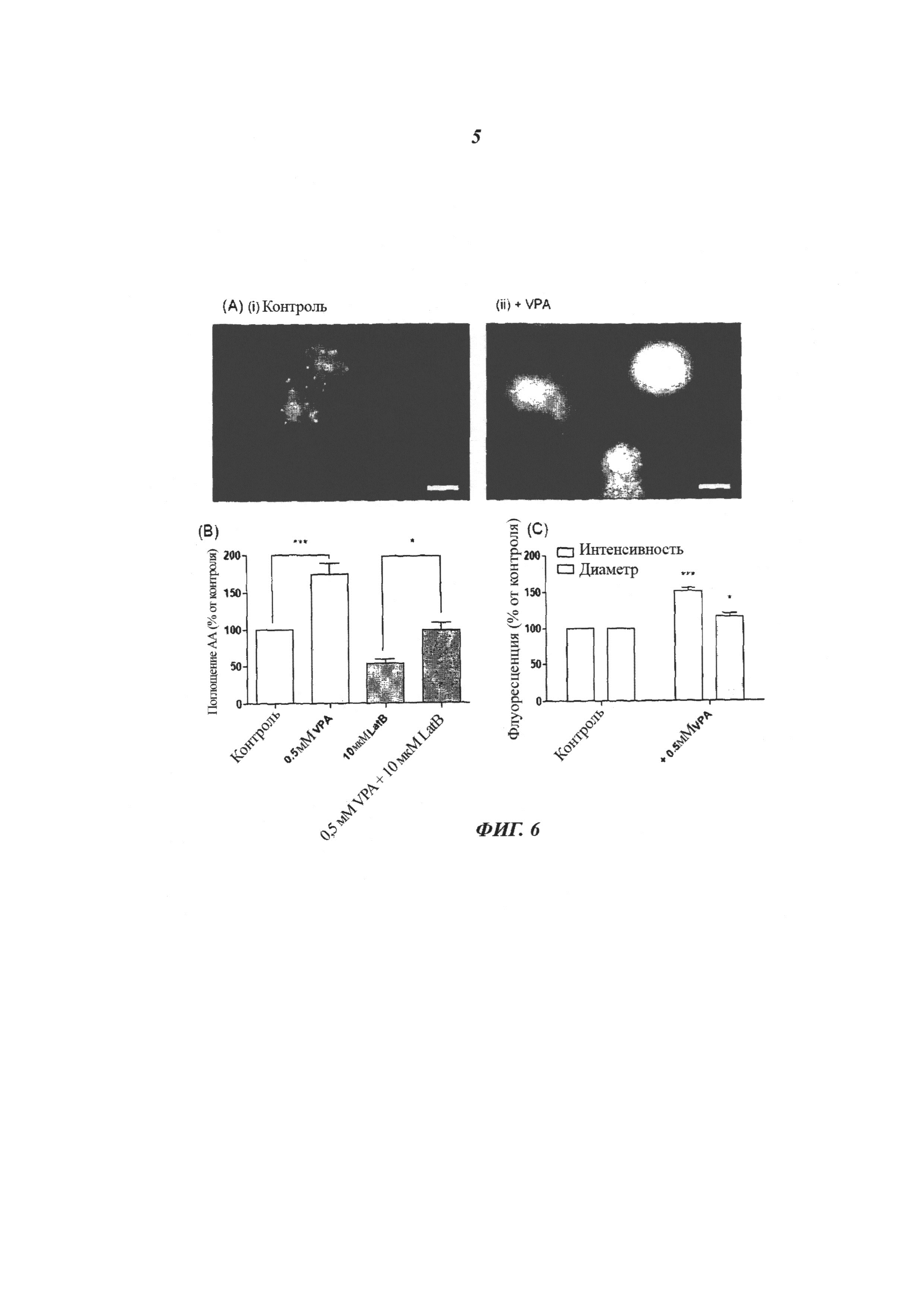
На фиг.6 продемонстрировано, что VPA вызывает эндоцитоз-независимое накопление капель липидов, меченых бор-дипиррометеном (bodipy), в клетках Dictyostelium. (а) Снимки, демонстрирующие накопление жирных кислот, меченых bodipy, в клетках Dictyostelium при отсутствии (i) или в присутствии (ii) 0,5 мМ VPA. VPA значительно повысила яркость и средний диаметр капель липидов по сравнению с контролем; (b) (метод Стьюдента, ***p<0,001, *p<0,05). Латрункулин (LatB), ингибитор актиновой полимеризации, в количестве 10 мкМ полностью не ингибировал индуцированное VPA повышение поглощения 3H арахидоновой кислоты. Все данные являются результатами по меньшей мере трех независимых опытов и выражены как среднее ± SEM.
Фиг.7 демонстрирует, что нокаутные клетки PlaA защищены от индуцированного VPA замедления развития. (A) Выравнивание белковой последовательности PlaA от Dictyostelium discoideum (XP_642421.1) и белковой последовательности iPLA2 от Homo sapiens (AAD08847). Эти последовательности показали сохраненную гомологию сайтов связывания АТФ и липазных сайтов. Выравнивание проводили с использованием программного обеспечения BLAST. (В) Высвобождение радиоактивной метки из клеток дикого типа (wt) и клеток PlaA показали аналогичное снижение высвобождения в присутствии VPA. (C) Снимки, показывающие развитие клеток Dictyostelium дикого типа (Ах2) или клеток PlaA через 30 часов при отсутствии и в присутствии 1 мМ VPA (как указано). Отрезки, указывающие масштаб, отражают длину 500 мкм.
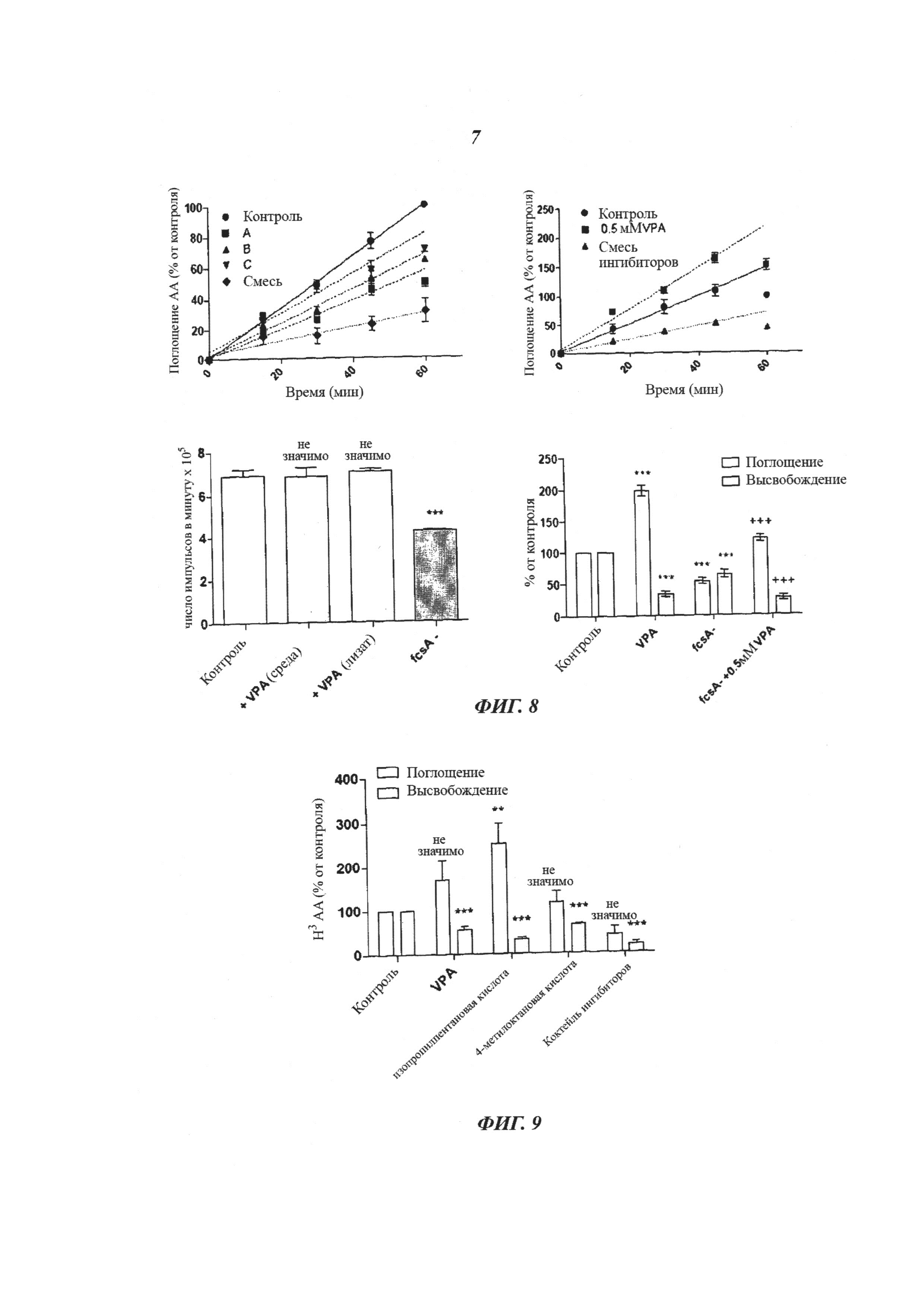
Фиг.8 демонстрирует, что ингибиторы PLA2 фенокопируют индуцированное VPA 3H высвобождение из клеток с мечеными жирными кислотами. (A) Компетентные клетки Dictyostelium дикого типа (Ах2) были предварительно инкубированы с 3H AA, показано высвобождение 3H во внешний буфер в присутствии и при отсутствии ингибиторов PLA2. Ингибитор x=80 мкМ BEL, Са2+ - ингибитор PLA2, y=20 мкМ ВРВ, общий ингибитор PLA2 и z=50 мкМ MAFP, а Са2+ - зависимый и Са2+ - независимый цитозольный ингибитор PLA2. Смесь = смесь всех ингибиторов. (В) Ингибиторы PLA2 не имитируют VPA-зависимое поглощение жирных кислот. Клетки инкубировали в присутствии VPA и смеси ингибиторов PLA2 (см. Методы). Показано поглощение 3H в клетках Dictyostelium. (C) VPA-индуцированное поглощение 3H арахидоновой кислоты не зависит от активации коэнзима A (СоА). Количественное определение СоА-активинованной пальмитиновой кислоты в клетках дикого типа, клетки дикого типа +0,5 мМ VPA или fcsA -/- Dictyostelium (однофакторный дисперсионный анализ (one way ANOVA), Апостериорный анализ Дуннета (Dunnet's post hoc) ***p<0,001). (D) Поглощение 3H арахидоновой кислоты в клетках дикого типа fcsA -/- или fcsB -/- при отсутствии или в присутствии of 0,5 мМ VPA (однофакторный дисперсионный анализ, Апостериорный анализ Бонферрони (Bonferroni post hoc), ***p<0,001).
На Фиг.9 показан эффект аналогов VPA на поглощение и высвобождение 3H арахидоновой кислоты. VPA индуцировала параллельное повышенное поглощение и сниженное высвобождение радиоактивной метки, эти эффекты были усилены 2-изопропилпентановой кислотой (PIA) и снижены 4-метилоктановой кислотой. Коктейль ингибиторов PLA2 ингибировал как поглощение, так и высвобождение радиоактивной метки (однофакторный дисперсионный анализ, Апостериорный анализ Бонферрони, ns = не значимо, ***p<0,001).
Осуществление изобретения 1.
Материалы и методы
1.1 Реактивы и мутанты
Все реактивы были получены у компании Sigma UK Ltd. Препараты вальпроевой кислоты были предоставлены компаниями Sigma Aldrich UK, Alfa Aesar/Avocado, ChemSampCo, ChemCo, The NCI/DTP Open Chemical Repository (http://dtp.cancer.gov) или TCI europe. Радиомеченая АТФ (аденозинтрифосфорная кислота) была предоставлена компанией Perkin Elmer Ltd. Мутанты Dictyostelium были предоставлены компанией Dictybase.org, кроме пятикратного нокаутного штамма PI3K (и PTEN) и rPKA, которые были любезно предоставлены господами R.Kay (Cambridge, UK) и A.Noegel (Koeln, Germany). Среда Dictyostelium (аксеническая) была получена у компании Formedium (Norfolk, UK). 3Н арахидоновая кислота была куплена у Hartmann analytic (Germany) и 3Н пальмитиновая кислота - у Perkin Elmer (Cambridge, UK).
1.2 Клетки и выращивание культуры
Клетки Dictyostelium были выращены в аксенической среде или на планшетах со средой Sussmans вместе с Raoultella planticola (Drancourt et al., 2001). Для всех культур использовали встряхивание (120 об/мин) при 22°C, и для развития клеток добавляли цАМФ (циклический аденозинмонофосфат) (до конечной концентрации 25 нМ) каждые 6 минут в течение 4 часов при 2,5×106 клеток/мл в фосфатном буфере (16,5 мМ KH2PO4, 3,8 мМ K2HPO4 pH 6,2),как было описано ранее (Boeckeler et al., 2006).
1.3 Введение метки в фосфолипиды Dictyostelium и анализ инозитола
Для этих опытов с Dictyostelium был принят протокол пермеабилизации клеток на основе сапонина (Pawolleck & Williams, 2009). Клетки Dictyostelium АХ2 выращивали 5 часов, как описано ранее (Boeckeler et al., 2006) (добавление цАМР до достижения концентрации 25 нМ), переносили в чашки (2,5 см), оставляли осаждаться до получения конфлюэнтного монослоя в КК2 (20 мМ буфер фосфата калия, pH 6,1) и предварительно обрабатывали соединением (0,5 мМ VPA или соответствующим соединением, или 50 мкМ LY294002) в течение 3 минут. Через равные промежутки времени буфер замещали метящим раствором (139 мМ глутамата натрия, 5 мМ глюкозы, 5 мМ ЭДТА, 20 мМ PIPES pH 6,6, 1 мМ MgSO4.2H2O, 0,25% (масс./об.) сапонина, 1х фосфатаза-ингибиторных коктейлей 1 и 2 (Roche Ltd), и 1 мкКи/мл γ[32Р]АТФ), в котором содержались соединения при заданных концентрациях.
После 6-минутной инкубации метящий раствор удаляли, клетки лизировали в подкисленном метаноле, фосфолипиды отделяли, как описано ранее (Williams et al., 1999). Количество меченых фосфолипидов оценивали с использованием прибора Phosphor-lmager Typhoon. Равномерность загрузки определяли путем окрашивания липидов сульфатом меди. Уровни инозитола измеряли в клетках после 5-часового развития (аналогично введению метки в фосфолипиды), после лиофилизации, как описано ранее (Maslanski & Busa, 1990).
1.4 Модель эпилепсии in vitro
После умерщвления интраперитониальной инъекцией высокой дозой пентобарбитона (500 мг/кг) у крыс (р21) отделяли головы. Головной мозг извлекали, помещали в ледяной раствор сахарозы (в мМ): NaCl 87, KCl 2,5, MgCl2 7, CaCl2 0,5, NaH2PO4 1,25, сахароза 75, глюкоза 25, уравновешенный газом 95% O2/5% CO2 (pH 7,4). Горизонтальные объединенные срезы энторинальной области коры и гиппокампа (350 мкм) готовили с использованием вибратома Leica (Leica VT1200S) и помещали в камеру, содержащую раствор искусственной цереброспинальной жидкости (aCSF), содержащий в мМ: NaCl 119, KCl 2,5, MgSO4 4, CaCl2 4, NaHCO3 26,2, NaH2PO4 1, глюкозу 11, и продутый газом 95% O2/5% CO2. Через 1 час выдерживания образцы переносили в регистрационную камеру, которую постоянно промывали карбонизированным раствором aCSF для регистрации. Измерение потенциала поля проводили путем помещения стеклянных микроэлектродов (~1-2 МОм), заполненных раствором aCSF в stratum radiatum СА1. Для подтверждения жизнеспособности срезов биполярные стимулирующие электроды помещали на пути коллатераль Шеффера/ комиссуральные волокна в stratum radiatum. В PTZ модели острых судорог, PTZ (2 мМ) добавляли к перфузату и увеличивали концентрацию [K+] до 6 мМ для индукции эпилептиформной активности (Armand et al., 1998). В модели острых судорог, индуцированных низким Mg2+, для генерации ритмичных коротких рекуррентных разрядов использовали Mg2+, не содержащий aCSF. После того, как частота и амплитуда эпилептиформных разрядов стала стабильной в течение 10 минут, добавляли новые противосудорожные средства. Противосудорожные эффекты оценивали путем измерения изменений частоты разрядов каждую минуту. Эти данные, собранные за 30-40 минут после применения новых противосудорожных средств, сравнивали методом ANOVA, после которого проводили апостериорный анализ с использованием теста Tukey, с использованием статистического анализа (SPSS).
1.5 Эпилептический статус in vivo
Этот метод описан подробно ранее (Walker et al., 1999). Кратко, самцы крыс Sprague Dawley (300-400 мг) были анестезированы 1-2% изофлурана в O2. Заземляющий электрод вводили подкожно, однополярный регистрирующий электрод имплантировали стереотактично в правую долю гиппокампа (координаты: 2,5 мм сбоку и 4 мм снизу от брегмы). Биполярный стимулирующий электрод имплантировали в правое полушарие и протягивали в угловой пучок (координаты: 4,4 мм сбоку и 8,1 мм снизу от брегмы) для стимуляции перфорирующего пути. Глубина установки электродов была подобрана для максимизации наклона потенциала поля гранулярных клеток зубчатой извилины (Guo et al., 1999). Электроды удерживались на месте с помощью зубчатых акриловых и черепных винтов. Животным давали возможность выйти из состояния анестезии. Через семь дней перфорирующий путь стимулировали электрическим током 4-5 мА однополярными импульсами по 50 мксек с частотой 20 Гц в течение 2 часов; это вызывало самоподдерживающийся эпилептический статус (status epilepticus). Через 10 минут самоподдерживающегося status epilepticus, вводили соединение или носитель и проводили мониторинг поведенческих судорог и ЭЭГ в течение 3 часов. После этого всем животным вводили диазепам (10 мг/кг) для остановки status epilepticus. Группы сравнивали методом ANOVA, после которого проводили тест апостериорный анализ с использованием теста Tukey, с использованием SPSS.
1.6 Поглощение и высвобождение жирных кислот
Клетки Dictyostelium метили тритированными жирными кислотами путем двухкратной обработки встряхиваемой клеточной культуры при концентрации 1,5×106 клеток/мл с активностью 0,5 мкКю 3Н меченых жирных кислот в 0,5% BSA (бычий сывороточный альбумин) (BSA не содержал жирных кислот). Образцы отбирали в указанные моменты времени путем отбора 4,5×106 клеток, однократной промывки в фосфатном буфере и ресуспендирования в фосфатном буфере перед сцинтилляционными измерениями. Для опытов по высвобождению жирных кислот клетки подвергали импульсам тока, как описано выше, в течение 4 часов, затем клетки ресуспендировали в фосфатном буфере с BSA, не содержащим жирных кислот (0,5%), при концентрации 1,5×106 клеток/мл, моменты времени выбирали в течение часа. Клетки (4,5×106 в момент времени) были промыты для удаления несвязанного радиоактивного вещества и в указанные моменты времени, супернатант подвергали сцинтилляционным измерениям. Результаты обрабатывали с использованием программного обеспечения Graphpad Prism. Подвергнутые импульсам тока в течение 4 часов клетки метили бор-дипиррометеном (bodipy), инкубировали с флуоресцентными жирными кислотами (Invitrogen) 30 минут в присутствии или отсутствии VPA (0,5 мМ), изображения, полученные с помощью микроскопа с инвертированной флуоресценцией Olympus IX 71, регистрировали камерой Retiga FastA 1394 и анализировали с использованием программного обеспечения ImagePro™.
1.7 Выделение, рекапитуляция и рост мутантов
Скрининг библиотеки методом REMI (от англ. restriction enzyme mediated integration) проводили, как описано ранее (Kuspa & Loomis, 2006), с использованием фона Ах2, и выбирали VPA-устойчивые мутанты на основании их способности развиваться в присутствии 1 мМ VPA на R. planticola. Идентификация вырезанного гена, обеспечивающего рекапитуляцию идентифицированного PLAa (DDB_G0278525), с использованием гомологичной рекомбинации нокаутной кассеты. В качестве праймеров для амплификации области в открытой рамке считывания гена, использовали (5' ATGGGAGATAATAAAAAAGAAAATATCAG и 3' TAAGAATTCATGGGAGATAA TAAAAAAGAAAATATCAG, клонированные pCR2.1 ТОРО (Invitrogen Ltd)), который клонировали в pUC19 с использованием расщепления EcoR1, и расщепленный фрагмент Smal от pBLPblp (Faix et al, 2004) был введен в сайт EcoRV вставки. Отсутствие гена было подтверждено ПЦР-анализом. Устойчивость роста к VPA оценивалась путем заселения клеток (1×106) на 47 мм нитроцеллюлозные фильтры (Millipore), пропитанные фосфатным буфером, содержащим либо 1 мМ VPA, либо контроль, рост клеток регистрировали через 30 часов, если не указано иное. Выращенные культуры наблюдали в микроскоп Leica CLS 150Х, изображения культур регистрировали с использованием камеры QICAM FAST 1394.
Активацию жирных кислот определяли методом, описанным авторами Wilson et al. (Wilson et al, 1982) с небольшими изменениями. Кратко, экстракты готовили путем седиментации 1×107 клеток, выращенных в аксенной культуре, их промывки в 10 мл предварительно охлажденного раствора 1 М Tris-HCl (pH 7,5) и их лизирования в течение 30 минут в 100 мкл раствора 1 М Tris-HCl (pH 7,5), содержащего 1% Тритона и коктейля протеазного ингибитора (Р8340, Sigma-Aldrich, Germany) при 4°C. Разбавляли 20 мкг белкового экстракта в 140 мкл в 400 мкл буфера, содержащего 250 мМ Tris-HCl (pH 7,5), 10 мМ MgCl2, 3 мМ АТФ, 0,6 мМ ЭДТА, 0,25% Тритона, и 2,5 мМ DTT. В качестве субстрата использовали 40 мкл немеченой пальмитиновой кислоты (Р9767, Sigma-Aldrich, Germany) из 100 мкМ метанольного маточного раствора и 5 мкл 3Н-пальмитиновой кислоты (20 мкМ, 1 мКю/мл). Реакция была инициирована добавлением 20 мкл 10 мМ раствора коэнзима А (СоА) и инкубирована при 35°C. Для прекращения реакции через 10 минут добавляли 500 мкл среды Dole (0,4 мл изопропанола, 0,1 мл н-гептана, 10 мкл H2SO4). Разделение фаз осуществляли путем центрифугирования в течение 30 сек при 14000 об/мин в настольной центрифуге. Органическую фазу отделяли, а водную фазу промывали 6 раз 300 мкл н-гептана для удаления неактивированных жирных кислот перед измерением радиоактивности ацил-СоА тиоэфира, оставшегося в водной фазе, с использованием 2 мл жидкости Lumasafe™ Plus (Lumac LSC, Groningen, Нидерланды) в сцинтилляционном счетчике.
2. Результаты
2.1 VPA ослабляет фосфоинозитидную сигнализацию
Поскольку ранее не был охарактеризован быстрый эффект VPA на фосфоинозитидную сигнализацию, авторы изобретения сначала исследовали зависимость действия лекарства от времени и концентрации на модели Dictyostelium (фиг.1). Наблюдали быстрое снижение фосфорилирования фосфоинозитида после обработки 0,5 мМ VPA, причем 49%-ное снижение метаболизма обоих радиомеченых PIP и PIP2 наступало через 6 минут после обработки VPA, которое увеличивалось до 94%-ного снижения метаболизма каждого фосфоинозитидного соединения через 60 минут после обработки (фиг.1а). Эти значения указывают на комбинацию процессов синтеза и разрушения внутри клетки, т.е. отражают метаболизм фосфоинозитида, хотя активность фосфатазы была блокирована коктейлем ингибиторов. Этот эффект имеет острую природу и происходит с такой же скоростью, как и контроль судорог после внутривенного введения VPA на мышиной модели судорог (Honack & Loscher, 1992). Снижение фосфоинозитидной сигнализации также зависело от концентрации - наблюдали 25% и 42% ингибирование метаболизма PIP и PIP2 соответственно при концентрации 0,25 мМ VPA через 9 минут после обработки, которое увеличивалось до 68% и 79%-ного снижения при концентрации 0,5 мМ VPA соответственно (фиг.1b) - эти концентрации были определены при терапевтическом применении VPA (0,4-0,7 мМ в плазме) (DSM IV, 2000). При этих условиях такой ингибирующий эффект VPA дает ЕС50=154 мкМ и не зависит от поглощения (поскольку клетки пермеабилизованы сапонином). Быстрое, сильное ингибирование фосфоинозитидной сигнализации, вызванное VPA, имеет потенциальное терапевтическое значение.
Сначала считали, что быстрое снижение фосфорилирования фосфоинозитида происходит благодаря ингибированию неопределенной липидкиназной активности. Традиционно анализ липидкиназ включает использование фармакологического ингибирования соединениями, специфичными к определенному классу ферментов, однако такие исследования являются сложными из-за большого количества фосфатидилинозитолкиназ и наложения эффектов разных ингибиторов. Поскольку предыдущие исследования предположили роль VPA в ослаблении фосфатидилинозитол-3-киназного (PI3K) сигнального пути (Xu et al., 2007), изобретатели проанализировали эффект удаления генов пяти различных типов 1 PI3K в одной клеточной линии (Hoeller & Kay, 2007) на фосфоинозитидную сигнализацию (фиг.2а). Эти клетки показали 28% и 44%-ное снижение образования PIP и PIP2 соответственно по сравнению с клетками дикого типа, что предполагает основную роль этих ферментов в пути фосфоинозитидной сигнализации. Для тестирования VPA-катализируемого снижения фосфоинозитида в зависимости от PI3K к клеткам добавляли VPA (0,5 мМ). Было обнаружено, что через 9 минут после обработки VPA снижала продукцию PIP и PIP2 на 48% и 70% соответственно по сравнению с необработанными клетками (фиг.2b), что означает, что эти пять аблированных ферментов не являются мишенью для VPA в снижении метаболизма фосфоинозитида.
Для исследования роли других липидкиназ в VPA-катализируемом снижении метаболизма фосфоинозитида изобретатели проанализировали две другие неродственные фосфатидилинозитолкиназы: нокаутный мутант rPKA, не содержащий эндосомальный рецептор, сопряженный с G-белком, содержащий домен фосфатидилинозитол-5-киназы (PIP5K) (Bakthavatsalam et al., 2006); и мутант PIPKinA, не обладающий активностью ядерной фосфатидилинозитол-4/5-киназы (Guo et al., 2001). Удаление rPKA (фиг.2а) показало 30% и 54%-ное снижение продукции PIP и PIP2 соответственно по сравнению с клетками дикого типа, причем обработка VPA вызвала дополнительное 72% и 33%-ное снижение по сравнению с необработанными клетками (фиг.2с). Удаление PIPKinA показало значительное изменение в продукции PIP и PIP2 (фиг.2а), причем обработка вызвала 54% и 68%-ное снижение синтеза PIP и PIP2 соответственно по сравнению с необработанными клетками (фиг.2d). Все три клеточные линии остались чувствительными к фармакологическому ингибированию активности PI3K (с использованием 50 мкМ LY294006 - ингибитора активности PI3K), что подтверждает, что эти варианты имеют отношение к сниженному метаболизму фосфоинозитида (фиг.2b-d). Сниженная чувствительность всех трех липидкиназных мутантов предполагает общий механизм действия VPA, не зависящий от специфичной активности фосфатидилинозитолкиназ.
Поскольку другой механизм регуляции фосфоинозитидной сигнализации - это рециклинг фосфатидилинозитола через инозитолфосфаты (фиг.2е), изобретатели проанализировали метаболизм фосфоинозитида в изогенных мутантах, в которых путь рециклинга был блокирован или активирован. Клетки, не содержащие одного гена фосфолипазы C (Drayer et al., 1994) не показали существенного снижения метаболизма PIP и PIP2 по сравнению с клетками дикого типа (фиг.2f), и показали VPA-катализируемое снижение PIP и PIP2 сигнализации, близкое клеткам дикого типа (73 и 75% для PIP и PIP2 соответственно). Клетки, имеющие почти в 3 раза большее содержание инозитолтрифосфата (InsP3), вызванного удалением пролилолигопептидазы (РО; Williams et al., 1999, Williams et al., 2002), показали слабое уменьшение уровней PIP в необработанных клетках (и отсутствие существенных изменений уровней PIP2), и VPA-катализируемое снижение сигнализации PIP и PIP2, составляющее 66% и 68% соответственно. Более того, изобретатели ранее показали, что ингибирование активности инозитолмонофосфатазы (IMPase), вызванное 10 мМ лития, не снижает фосфоинозитидную сигнализацию после быстрой обработки (9 мин) (King et al., 2009), однако длительная обработка литием (60 мин) снизила уровни PIP и PIP2, и этот эффект был подавлен сверхэкспрессией IMPase (King et al., 2009). Для сравнения, сверхэкспрессия IMPase не подавляет эффект длительной обработки VPA (60 мин; 0,5 мМ) (фиг.2g). Эти результаты предполагают, что повышение и снижение рециклинга инозитола через инозитолфосфатный сигнальный путь не играет основной регуляторной роли в быстрой продукции фосфоинозитида и не подавляет VPA-катализируемое быстрое снижение фосфоинозитидной сигнализации в этой модели. Таким образом, эти результаты являются серьезным доказательством механизма действия VPA, независящим от снижения уровней инозитола, на фосфоинозитидную сигнализацию.
2.2 Идентификация новых соединений, демонстрирующих повышенное снижение метаболизма фосфоинозитида
Выявление быстрого эффекта VPA на снижение фосфоинозитидной сигнализации сделало возможным исследование структурных требований для обеспечения этого эффекта. Эффект соединений, протестированных на предмет снижение метаболизма фосфоинозитида для целей изобретения, обобщен ниже в Таблице 1.
|
|
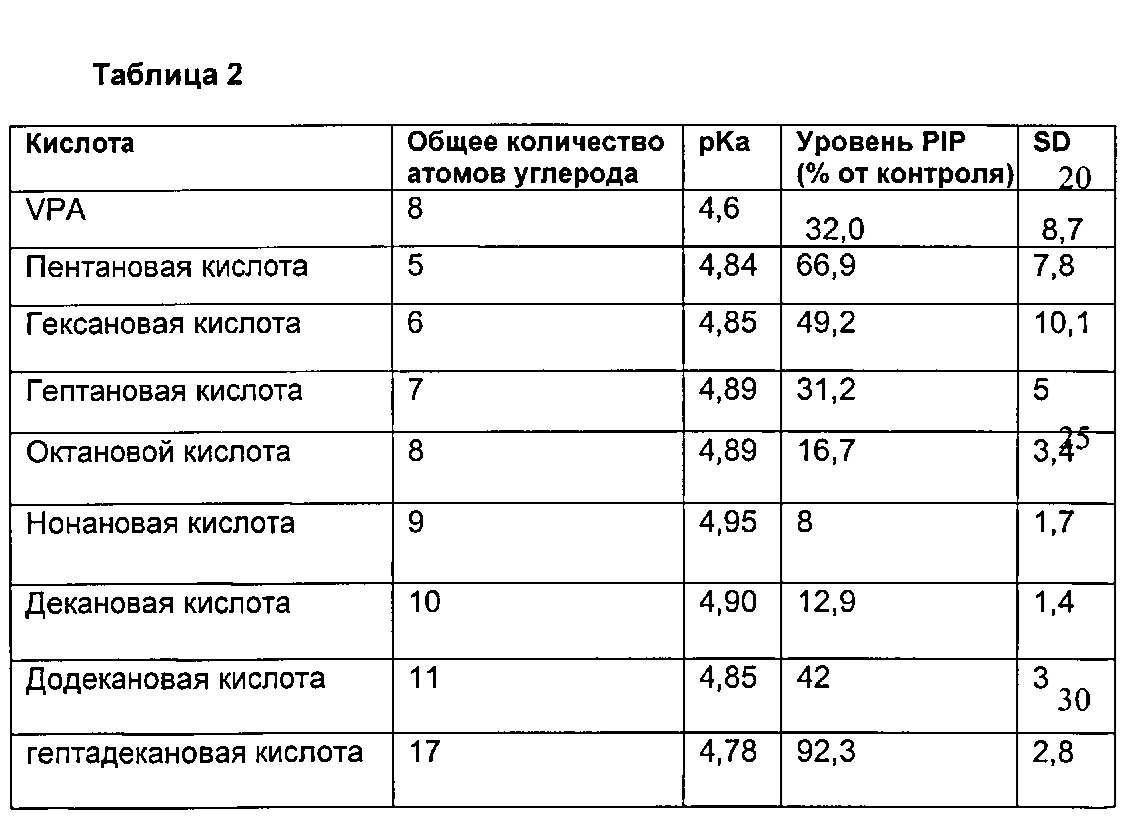
Хотя большая часть проанализованных соединений показала некоторый ингибирующий эффект на метаболизм фосфоинозитида (Таблица 1), ряд структур показал значительно более сильное ингибирование фосфоинозитидной сигнализации, чем эффект VPA. Эти высоко активные соединения разделены на две структурные группы: первая группа включает разветвленные жирные кислоты со структурой грубо напоминающей структуру VPA; вторая группа включает новые соединения, содержащие или не содержащие боковые цепи в различных положениях основной цепи. В этой последней группе жирные кислоты показали сильную зависимость от длины цепи, где кислоты с основной цепью из 8-10 атомов углерода являются высоко активными (н-р, 4-метилоктановая кислота снижает PIP и PIP2 сигнализацию на 88% и 93% соответственно, и нонановая кислота - на 92% и 93% соответственно; Таблица 1), более длинная или более короткая основная цепь снижает активность. Все высоко активные кислоты этой группы являются нетератогенными жирными кислотами (Eickholt et al., 2005) и демонстрируют положительную связь с липофильностью. Этот эффект также не зависит от силы кислоты, поскольку показана отличающаяся активность у кислот с прямой цепью, имеющих эквивалентную кислотность (pKa в Таблице 2, где показано сравнение снижения метаболизма фосфоинозитида и значений pKA для VPA и кислот с прямой цепью на модели Dictyostelium). Эти структурные отличия обеспечивают особенности соединений, родственных VPA, влияющие на снижение метаболизма фосфоинозитида. Интересно, что ранее была показана высокая структурная специфичность жирных кислот как в отношении противосудорожной активности, так и в отношении противоаллодинической активности (Kaufmann et al., 2009). Предварительные исследования поведения на животных моделях одного из исследуемых соединений не предполагают сильного седативного эффекта.
Было обнаружено, что VPA является ингибитором биосинтеза инозитола, косвенно блокируя продукцию инозитол-1-фосфата из глюкозо-6-фосфата (Shaltiel et al., 2004, Shaltiel et al., 2007а, Vaden et al., 2001). Роль VPA в снижении участия инозитола в передаче сигнала была широко показана на моделях от дрожжей (Vaden et al, 2001) и Dictyostelium (Williams et al., 1999, Williams 2002) до Caenorhabditis elegans (Tokuoka et al., 2008), крыс и человека (Shaltiel et al., 2007a, Shaltiel ef al., 2007b). Чтобы показать снижение уровней инозитола, использовали измерение уровней инозитола и трифосфата инозитола (InsP3) и инозитол-зависимого расширения конуса роста млекопитающих. Поскольку было не ясно, может ли VPA-индуцированное снижение уровней инозитола привести к быстрому ингибированию фосфоинозитидной сигнализации, продемонстрированному в данной заявке, изобретатели проанализировали метаболизм фосфоинозитида с использованием соединений, родственных VPA, для которых была показана их активность на снижение уровней инозитола. Соединения, показавшие сильное снижение уровней InsP3 на модели Dictyostelium с одновременным расширением конусов роста млекопитающих, зависимым от снижения уровней инозитола, включают 2-метил-2-пентеновую кислоту (Eickholt et al., 2005), причем это соединение показало более сильное снижение уровня фосфоинозитида, чем VPA. Интересно, что замещение карбоксильной группы в соединениях, показавших высокое снижение уровня фосфоинозитида (VPA), карбоксамидной группой (с получением соответствующего амида (VPD)) снижает ингибирующий эффект на метаболизм фосфоинозитида и снижает расширение конуса роста млекопитающих, причем VPD показал слабое ингибирование человеческой мио-инозитол-синтазы, предложенной в качестве мишени для VPA при снижении уровней инозитола (MIP синтазы (Shaltiel et al., 2004, Shaltiel et at., 2007a)). Эти соединения, снижающие уровни инозитола и фосфоинозитида, находятся, в основном, в первой структурной группе соединений (описанной выше), и также включают ряд потенциальных противосудорожных средств второго поколения относительно VPA, которые в настоящее время исследуются (Bialer & Yagen, 2007). Ни одно из соединений нового семейства с длинной основной цепью, идентифицированных в этом исследовании, не было проанализировано в отношении влияния на снижение уровней инозитола.
Поскольку снижение уровней инозитола может обеспечивать механизм этих соединений на снижение метаболизма фосфоинозитида, изобретатели проанализировали уровни инозитола в обработанных клетках Dictyostelium с использованием ряда соединений из обеих структурных групп, демонстрирующих различное снижение метаболизма фосфоинозитида. В этих опытах VPA не показала значительного снижения уровней инозитола за период времени, в течение которого происходит снижение метаболизма фосфоинозитида (9 мин), как же как и другие протестированные соединения, следовательно, отсутствует корреляция между снижением метаболизма фосфоинозитида и снижением уровней инозитола. Этот вывод находится в соответствии с ранее полученными данными на модели Dictyostelium, показывающими, что быстрое ингибирование инозитол-монофосфатазы (литием) не усиливает снижение метаболизма фосфоинозитида (King et al., 2009), и снижение уровней трифосфата инозитола в этой модели с VPA требует 6-ти часовой обработки (Williams et al., 1999), что значительно дольше, чем периоды времени, использованные в этой работе. Следовательно, эти исследования предполагают, что снижение метаболизма фосфоинозитида обусловливает новый эффект VPA на модели Dictyostelium и выявляют группу соединений, имеющих повышенную эффективность этого эффекта. Поскольку повышенные уровни PIP и PIP2 наблюдали в течение судорог на животных моделях (Van Rooijen et al., 1986), изобретатели открыли новое семейство соединений, вызывающих такой эффект.
2.3 Новые соединения показали повышенную эффективность на эпилептиформных моделях in vitro
Поскольку невозможно повторить опыты с радиоактивной меткой на животных моделях in vivo, чтобы подтвердить обнаруженные изобретателями механизмы на моделях более высокого порядка, изобретатели проанализировали эффективность нового семейства соединений в отношении контроля судорог. Для этих опытов они использовали VPA-чувствительную модель эпилептиформной активности in vitro, вызванной введением пентилентетразола (PTZ) (Armand et al., 1998), для анализа трех соединений из нового семейства (Fig 3a, b), имеющих основную цепь из 8 атомов углерода с боковыми цепями различной длины в различных положениях. VPA значительно снижала частоту эпилептиформных разрядов (Armand et al., 1998; фиг.3b; VPA: 75,1±1,7%). Применение эквимолярных концентраций каждого из соединений, имеющих основную цепь из 8 атомов углерода, также сильно снижало частоту разрядов со значительно большей эффективностью, чем VPA (фиг.3b, 3c). Применение всех трех новых соединений значительно снижало частоту судорог (4-метилоктановая кислота - 49,1±4,4%, 2-пропилоктановая кислота - 5,3±3,3 и 2-бутилоктановая кислота - 5,2±5,0%, для всех Р=0,005 по сравнению с VPA). Изобретатели также расширили круг соединений, чтобы показать аналогичную эффективность для соединений, имеющих прямую основную цепь из 9-10 атомов углерода (нонановая кислота, 20,9±7,5%, Р=2×10-6 по сравнению с VPA; декановая кислота 0,23±0,23%, Р=2×10-6 по сравнению с VPA фиг.3d, е). Такая активность не наблюдалась для соединений с более короткими основными цепями (н-р, для пентановой кислоты, у которой цепь содержит 5 атомов углерода - данные не показаны). Эти высоко активные соединения ранее не ассоциировались с контролем судорог и для них не были предсказаны тератогенные эффекты (Guo et al., 1999).
Чтобы показать, что эффект этих соединений не является специфичным к модели судорог, изобретатели дополнительно исследовали эффект одного из этих соединений in vitro на модели судорог, вызванных низким Mg2+ (фиг.3f, g, h). Изобретатели выбрали 4-метилоктановую кислоту, поскольку она является эндогенной в животных системах (Johnson et al., 1977). VPA (1 мМ) слабо снижала частоту рекуррентных коротких разрядов в этой модели. Применение 4-метилоктановой кислоты почти прекратило рекуррентные короткие разряды через 30-40 минут после обработки. Таким образом, эти данные показывают более высокую активность 4-метилоктановой кислоты по сравнению с VPA в различных моделях эпилептиформной активности in vitro.
2.4 Новые соединения продемонстрировали улучшенный контроль эпилептического статуса (status epilepticus)
Чтобы показать дополнительную эффективность этих соединений на животных моделях судорог, изобретатели протестировали 4-метилоктановую кислоту на модели status epilepticus in vivo (фиг.4). Для этого исследования status epilepticus индуцировали стимуляцией перфорирующего пути у бодрствующих, свободно движущихся крыс, как описано ранее (Holtkamp et al., 2001, Walker et al., 1999; фиг.4a). Изобретатели ранее обнаружили, что VPA эффективна на этой модели в высокой дозе (400 мг/кг). Поэтому изобретатели сравнили эффективность 4-метилоктановой кислоты (400 мг/кг) по сравнению с VPA (400 мг/кг). 4-метилоктановая кислота имеет более высокую молекулярную массу (MW=158), чем VPA (MW=144), поэтому эта доза представляет немного более низкую молярную дозу 4-метилоктановой кислоты. VPA сильно снижала судороги в этой модели через 2 часа после обработки, причем эффективность снижалась через 3 часа после обработки (фиг.4b), а 4-метилоктановая кислота защитила от судорог в течение всего периода исследования. Оба соединения снизили амплитуду и частоту пиков (Fig 4): VPA снизила амплитуду пиков (75,2±9,2% через первый час; 61,1±8,3% через второй час; 55,1±6,6% через третий час) (фиг.4e, f). В сравнении, 4-метилоктановая кислота показала значительно более лучший контроль, что выразилось в снижении средней частоты пиков 39,3±11,3% через первый час (значительно лучше, чем VPA p<0,05); 18,1±10,3% через второй час (p<0,05 по сравнению с VPA) и 26,9±12,3% через третий час (фиг.4e, f). 4-метилоктановая кислота прекратила status epilepticus (что определяется как частота пиков менее 1 Гц) у всех животных со status epilepticus. Кроме того, 4-метилоктановая кислота полностью остановила судороги у всех 7 животных через 2 часа, a VPA снизила силу судорог, но не остановила их (P=0,0003, тест Фишера), причем этот эффект сохранялся у пяти из семи животных, которым давали 4-метилоктановую кислоту, в течение 3 часов (P=0,01, тест Фишера).
2.5 VPA регулирует поглощение и высвобождение жирных кислот
Для анализа роли арахидоновой кислоты в регуляции высвобождения, опосредованного VPA, на модели Dictyostelium изобретатели разработали методику, основанную на высвобождении со временем радиоактивной метки из клеток, содержащих тритированные жирные кислоты. С использованием этой методики изобретатели показали, что после мечения клеток 3Н-АА, высвобождение радиоактивной метки в среду было линейным в течение 45 минут (фиг.5А). Эффект VPA на высвобождение радиоактивной метки из АА-меченых клеток был быстрым и дозо-зависимым, причем VPA индуцировала снижение высвобождения с IC50, составляющей 89 мкМ. Этот эффект не был специфичным в отношении АА, поскольку высвобождение тритированной пальмитиновой кислоты также замедлялось в присутствии VPA с IC50, составляющей 163 мкМ (фиг.5С). Быстрота этого эффекта продемонстрирована значительным ингибированием через 30 минут воздействия (p<0,05).
Поскольку сниженное высвобождение меченых жирных кислот может быть вызвано их включением в липиды, изобретатели также измерили поглощение жирных кислот путем измерения меченых жирных кислот в клетках. Подобно высвобождению жирных кислот, включение тритированной АА было линейным в течение 30 минут (фиг.5В), однако, VPA вызвала дозо-зависимое повышение поглощения АА с ЕС50, составляющей 47 мкМ. Этот эффект также наблюдался при использовании пальмитиновой кислоты с ЕС50, составляющей 160 мкМ (фиг.5D), и был значительным в через 30 минут после обработки (p<0,05).
Для проверки того, происходят ли описанные эффекты из-за простого включения жирных кислот в мембрану, изобретатели визуализировали поглощение жирных кислот с использованием соединения, содержащего цепь жирной кислоты с 12 атомами углерода, связанную с флуоресцентной меткой (bodipy; фиг.6А) (Worsfold et al., 2004). После инкубации клеток и липида, меченого bodipy, 0,5 мМ VPA вызвала повышение интенсивности и диаметра капель флуоресцентных липидов в клетках по сравнению с необработанными клетками (фиг.6В). Эти результаты показывают, что VPA также повышает поглощение этих жирных кислот, и что лекарство повышает удерживание жирных кислот в каплях липидов.
2.6 VPA-индуцированное поглощение жирных кислот происходит независимо от динамики актина
Поглощение (и высвобождение) соединений в модели Dictyostelium, вероятно, регулируется клеточными механизмами, контролирующими макропиноцитоз, поэтому изменения включения жирных кислот могут быть результатом простой регуляции этого процесса. Чтобы это проверить, и поскольку макропиноцитоз зависит от полимеризации актина, изобретатели использовали латрункулин (10 мкМ), ингибитор полимеризации актина (de Oliveira и Mantovani, 1988), для наблюдения эффектов на поглощение жирных кислот. Ингибирование полимеризации актина снизило поглощение в контрольных клетках. Однако, латрункулин не снизил VPA-индуцированное поглощение АА, что предполагает, что VPA-индуцированная регуляция жирных кислот не зависит от динамики визикул (фиг.6С).
2.7 Генетическая абляция активности PLA2 не восстанавливает нарушение метаболизма жирных кислот
Для обнаружения особых генов, контролирующих влияние VPA в этой модели, изобретатели провели скрининг мутантов, полученных способом опосредованной рестриктазами интеграции (REMI), чтобы идентифицировать локусы, контролирующие эффект VPA в процессе развития (Kuspa и Loomis, 2006). VPA ингибирует развитие Dictyostelium при концентрациях, обнаруженных в плазме пациентов, принимающих лечение VPA (0,28-0,7 мМ; (Silva et al., 2008)) (фиг.7В). Один мутант, выделенный в этом скрининге, содержал ген без PLA2 (van Haastert et al., 2007), с кодированным белком, схожим с Са2+ - независимыми ферментами и содержащим сохраненную АТФазу и фрагменты липазы (фиг.7А), этот мутант показал частичную устойчивость к VPA в процессе развития (фиг.7В). Однако, ноуаутная клеточная линия не снижала высвобождение радиоактивной метки из клеток (фиг.7С), что предполагает, что хотя нарушение PLA2 гена привело к частичной устойчивости к VPA в процессе развития, она не была достаточной, чтобы полностью предотвратить VPA-индуцированное высвобождение жирных кислот.
2.8 VPA-регуляция передачи сигнала жирными кислотами не фенокопируется ингибированием PLA2
Поскольку предполагают, что VPA регулирует передачу сигнала, опосредованную фосфолипазой A2 (PLA2) (Rao et al., 2008), и поскольку удаление одного PLA2 гена обеспечило только частичную устойчивость к VPA в процессе развития и отсутствие эффекта на полное высвобождение или поглощение меченых жирных кислот (фиг.7), изобретатели оценили роль фармакологического ингибирования PLA2 на регуляцию АА. Химические ингибиторы, специфичные к различным классам PLA2 (BEL [80 мкМ], Са2+ - независимый PLA2 ингибитор (Ackermann et al., 1995); MAFP [50 мкМ], Ca2+ - зависимый и Са2+ - независимый ингибитор цитозольной PLA2 (Balsinde и Dennis, 1996, Lio et al., 1996); и BPB [20 мкМ], ингибитор фосфолипазы А2 (Mitchell et al., 1976) - все снижали высвобождение радиоактивной метки из клеток 3Н-АА аналогичным образом, как и обработка VPA (фиг.8). Была показана различающаяся специфичность этих ингибиторов, поскольку коктейль всех трех ингибиторов обеспечил кумулятивное ингибирование высвобождения. В отличие от действия VPA на высвобождение (вызывающего повышение содержания жирных кислот с течением времени), химическое ингибирование активности PLA2 вызвало снижение поглощения жирных кислот (фиг.8). Эти данные предполагают, что ингибирование PLA2 частично фенокопирует эффект VPA на изменение АА-сигнализации, но VPA имеет более общий эффект на передачу сигнала жирными кислотами.
2.9 VPA-индуцированное поглощение жирных кислот не зависит от активации жирных кислот
Для проверки того, зависит ли включение жирных кислот от активации, изобретатели сначала протестировали способность клеточных экстрактов активировать пальмитиновую кислоту с образованием РаА-СоА. В этих опытах инкубация клеточных экстрактов с 3Н-РаА и коэнзимом A обеспечила активацию жирных кислот, которые затем были разделены на основе различной растворимости в растворителях и определены количественно (von Lohneysen et al., 2003). Включение VPA (1,0 мМ) либо с клеточными экстрактами в процессе опыта по активации, либо путем предварительной обработки клеток перед приготовлением экстрактов (10 мин, 1 мМ), не имело влияния на активацию жирных кислот, а отсутствие пероксисомального фермента СоА синтазы A жирных кислот (FcsA) - фермента, ответственного за активацию CoA жирных кислот в эндосомах - показало значительное снижение синтеза РаА-СоА (фиг.8) по сравнению с клетками дикого типа. Более того, клеточные линии, не содержащие fcsA (DDB_G0269242; (von Lohneysen et al., 2003)), показали аналогичное VPA-индуцированное повышение поглощения жирных кислот, как в клетках дикого типа (фиг.8). Эти результаты предполагают, что эффект VPA в регуляции передачи сигнала жирными кислотами не зависит от активации СоА жирных кислот, как предполагалось ранее (Bazinet et al., 2006b).
2.10 Структурная специфичность индуцированного высвобождения жирных кислот
Исследования SAR определяют физические требования для соединений, вызывающие эффект, и эти исследования могут помочь отличить отдельные эффекты соединения. Чтобы оценить структурную зависимость VPA на высвобождение меченого вещества после включения 3Н-АА, изобретатели использовали ряд соединений, родственных VPA, которые имели различные длины основных и боковых цепей, концевые группы, энантиомерную специфичность и степень насыщения, и измерили высвобождение через 30 минут после обработки 0,5 мМ вещества. Полученные результаты приведены в Таблице 3 ниже.

Протестированные соединения показали диапазон ингибирующей активности с высокой структурной специфичностью, причем степень активности не зависела от силы кислоты и липофильности (значений pKA и logP соответственно).
Поскольку VPA показала снижение активности 50% от контроля, изобретатели определили соединения, такие как 2-пропилоктановая кислота, как высоко активные, поскольку они снижали активность до 45% или менее. Этими высоко активными соединениями являются карбоновые кислоты (поскольку вальпромид не показал ингибирующего эффекта, данные не показаны), разветвленные у второго атома углерода, причем наиболее активные соединения содержат изопропильную группу. В отличие от тератогенности (Eickholt et al. 2006), кислоты с четвертично-замещенным вторым (C2) атомом углерода еще показали активность, а жирные кислоты с длинными и средними цепями еще были активными. Соединения с разветвленной цепью были сильнее, чем соответствующие соединения с прямой цепью, причем предпочтительными были соединения с более длинными боковыми цепями (пропил в боковой цепи показал более сильное ингибирование, чем метил). Наконец, ненасыщенные соединения показали снижение ингибирующей активности. Это исследование SAR является новым описанием VPA-катализируемого эффекта.
Для подтверждения того, что двойной эффект сниженного высвобождения жирных кислот и повышенного поглощения жирных кислот имеет место одновременно, изобретатели проанализировали два соединения, демонстрирующие либо сильный, либо слабый ингибирующий эффект на высвобождение радиоактивной метки (изопропилпентановую кислоту и 4-метилоктановую кислоту, соответственно), на влияние на поглощение 3Н-АА (фиг.9). Согласно этим экспериментам повышенное ингибирование высвобождения радиоактивной метки соответствовало повышенному поглощению жирных кислот в клетках по сравнению с VPA, и сниженный эффект на высвобождение соответствовал сниженному эффекту на поглощение. Эти данные предполагают единственный, высоко структурно-специфичный сайт, на который действуют VPA и родственные соединения, в регуляции передачи сигнала жирными кислотами.
3. Обсуждение
VPA используют для лечения медицинских состояний, включая эпилепсию, биполярные расстройства и мигрень, и ее роль, возможно, распространяется на лечение рака (Blaheta et al., 2006), ВИЧ и болезни Альцгеймера (Qing et al. 2008) (обсуждается в работах Lagace et al., 2005, Terbach & Williams, 2009, Bialer & Yagen, 2007), ишемии (Costa et al. 2006) и фатальной кровопотери (Alam et al. 2009). Было доказано, что очень сложным является понимание того, как эти состояния можно контролировать посредством VPA, поскольку она запускает разнообразие клеточных изменений с неизвестными первичными мишенями, и эти изменения не были отнесены к конкретным клиническим состояниям, и было проведено несколько испытаний зависимости структура-функция (обсуждается в работах Lagace et al., 2005, Terbach & Williams, 2009, Bialer & Yagen, 2007, Nalivaeva et al., 2009).
3.1 Эффект на фосфоинозитольную сигнализацию
Изобретатели показали, что VPA вызывает дозо-зависимое снижение уровней PIP и PIP2 (Фиг.s 1а и b) на биомедицинской модели Dictyostelium, и оно обуславливает один из нескольких эффектов VPA, которые происходят в короткий период времени, что было показано при защите от индуцированных судорог (Фиг.1b; Honack & Loscher, 1992). Огромное большинство исследований механизмов активности VPA осложнялось длительным временем обработки, приводящим к изменениям экспрессии генов (возможно опосредованных тератогенными эффектами (Gurvich ef al., 2004, Phiel et al., 2001)) или временем, позволяющим регуляцию многих косвенных мишеней. Поэтому быстрое ингибирование фосфоинозитидной сигнализации обеспечивает существенное понимание быстрой функции VPA. В свете повышенных уровней фосфоинозитида в течение судорог (Van Rooijen et al., 1986) раскрытые результаты обеспечивают волнующий прорыв в понимании контроля судорог.
Очень трудно определить мишени для лекарства, модулирующего метаболизм фосфоинозитида in vivo у млекопитающих, из-за большого количества киназ и фосфатаз, и обещающего выбора природы субстратов для липидкиназ. Предпочтительный подход, облегчаемый моделью Dictyostelium, заключается в применении изогенных мышиных линий с вырезанными киназными генами. Поскольку, как показано ранее, VPA снижает продукцию PIP3 (Xu et al., 2007), изобретатели проанализировали метаболизм фосфоинозитида в клеточных линиях, не имеющих всех типов активности 1 PI3K (Hoeller & Kay, 2007), и в двух нуль-мутантах с полностью выключенным геном липидкиназ (фосфатидилинозитол-5-киназы, связанной с рецептором (rPKA) (Bakthavatsalam et al., 2006); и ядерной фосфатидилинозитол-4/5-киназы (PIPKinA) (Guo et al., 2001; Фиг.2). Все три мутантных клеточных линии показали значительное снижение метаболизма PIP после обработки VPA по сравнению с клетками дикого типа, что указывает на то, что эти ферменты не могут быть прямой мишенью при ингибировании фосфоинозитида посредством VPA, и что проверка других киназ не будет иметь большого успеха.
Теория элиминации инозитола (Berridge et al., 1989) является хорошо доказанной теорией действия VPA при профилактике биполярных расстройств (Williams et al., 2002, Williams, 2005) потенциально посредством непрямого ингибирования фермента, ответственного за новый биосинтез инозитола, мио-инозитол-1-фосфат-синтазы (MIP). Сильный ингибирующий эффект на активность MIP также был показан на ограниченном круге соединений, родственных VPA (Shaltiel et al., 2004; Shaltiel et al., 2007), предполагая, что регуляция инозитола может относится к контролю судорог. Однако, вновь открытые соединения, демонстрирующие улучшенный контроль судорог (н-р 4-МО и нонановая кислоты), не снижают быстро уровень инозитола за время для контроля судорог, что оспаривает роль инозитольной сигнализации в таком клиническом лечении. Einat et al., 2008 также показали, что фармакологическое ингибирование MIP (соединениями, структурно отличными от VPA) не контролирует судороги, чувствительные к инозитолу, на модели, индуцированной пилокарпином. Наоборот, представленные здесь данные добавляют доказательства того, что фосфоинозитидная сигнализация играет ключевую роль в возникновении судорог (Backman et al., 2001) и предполагают, что влияние VPA на метаболизм фосфоинозитида и контроль судорог не связано с элиминацией инозитола.
Большинство исследований, касающихся мишеней для VPA и клинической эффективности, было сфокусировано на соединениях, имеющих основную цепь из 5 атомов углерода (с точкой разветвления у второго атома углерода) или на циклических производных (Bialer & Yagen, 2007). Поэтому открытие новой группы соединений с более длинными основными цепями, демонстрирующими ингибирование метаболизма фосфоинозитида и контроль судорог, является существенным шагом вперед в развитии новых терапевтических средств. Эта новая группа соединений включает соединения, имеющие разветвления у второго и четвертого атомов углерода, что предполагает эффективность соединений с различными разветвлениями, и, таким образом, предлагает новую большую группу соединений, представляющих потенциальный клинический интерес.
В данной работе изобретатели протестировали эффективность пяти соединений из этой новой группы жирных кислот на модели эпилептиформной активности in vitro, которая является ключевой моделью для скрининга противоэпилептических лекарств (Piredda et al., 1985). Все соединения обеспечили сильное, но обратимое увеличение снижения эпилептиформной активности на модели PTZ (см. Фиг.3). Этот эффект не является специфичным к модели, поскольку одно соединение (4-метилоктановая кислота) показало эффективность на модели с низким Mg2+. Однако, эффективность на моделях in vitro не обязательно предполагает эффективность in vivo, поскольку другие факторы, такие как метаболизм лекарства, проникновение в мозг и доступ к целевой мишени, играют важную роль. Поэтому изобретатели дополнительно протестировали 4-метилоктановую кислоту на модели эпилептического статуса in vivo (Фиг.4), где был доказан более сильный эффект, чем у VPA. Ранее было показано, что эта модель устойчива к фенитоину и отвечает только высоким дозам противосудорожных средств (Chang et al., 2009). Поэтому эти результаты предполагают, что эта группа соединений может обеспечить новый агент для контроля судорог с повышенной эффективностью, и, поскольку предполагают, что эти соединения не являются тератогенными, они также могут иметь сниженные побочные эффекты по сравнению с лечением VPA.
Эти исследования определили механизм действия VPA на ингибирование метаболизма фосфоинозитида на простой биомедицинской модели Dictyostelium и показали, что этот эффект имеет место, не зависимо от ряда фосфоинозитид-киназных ферментов, рециклинга и элиминации инозитола. Изобретатели использовали эту систему для определения новой группы соединений, демонстрирующих повышенное ингибирование фосфоинозитида. Это исследование на простой модели было перенесено на несколько клинических моделей контроля судорог, и было показано сильное повышение эффективности для пяти соединений по сравнению с VPA на модели эпилептиформной активности на срезах энторинальной области коры и гиппокампа, и одного из этих соединений на полной животной модели status epilepticus. Поэтому эти исследования предполагают более высокую эффективность контроля судорог для этой новой группы соединений, имеющих более длинную основную цепь и боковые цепи различной длины и находящиеся у различных атомов углерода основной цепи, по сравнению с VPA. Продолжающийся анализ путей биосинтеза, контролирующих фосфоинозитидную сигнализацию, может дать значительный прогресс в понимании эпилепсии и других расстройств, которые лечат VPA, таких как биполярные расстройства и мигрень.
3.2 Эффект на метаболизм жирных кислот
Предыдущие исследование предположили, что возможный механизм действия VPA заключается в ингибировании метаболизма арахидоновой кислоты (Chang et al., 2001). В данной работе изобретатели продемонстрировали на модели Dictyostelium discoideum, что VPA значительно снижает высвобождение радиоактивной метки после введения 3Н-АА. Изобретатели также неожиданно обнаружили, что поглощение 3Н-АА усиливается в присутствии VPA. Поскольку арахидоновая кислота не является эндогенной жирной кислотой в Dictyostelium, изобретатели также проверили эти результаты с пальмитиновой кислотой, жирной кислотой, которая обнаружена в Dictyostelium (Weeks, 1976). Аналогичные результаты, полученные для полиненасыщенных и насыщенных жирных кислот, предполагают общий механизм модуляции метаболизма жирных кислот посредством VPA. Сходство этих результатов, продемонстрированное в данной работе, а также результатов на животной модели in vivo, таких как сниженный метаболизм АА (Chang et al., 2001) и повышенное накопление липидов (Kesterson et al., 1984), предполагают, что модель Dictyostelium может быть полезной в исследовании VPA-индуцированной динамики жирных кислот.
Некоторые исследования регуляции жирных кислот посредством VPA на животных моделях протестировали роль VPA в усилении транспорта жирных кислот в клетки. Таким образом, для проверки этого и поскольку поглощение экстраклеточных нутриентов в Dictyostelium регулируется динамикой везикул (макропиноцитоз), изобретатели показали, что блокирование функции везикул путем ингибирующей полимеризации не ингибирует VPA-катализируемое повышение поглощения жирных кислот. Эти результаты подтверждаются предыдущими результатами, поскольку они показали, что VPA-обработка также ингибирует динамику везикул в Dictyostelium (Xu et al., 2007), следовательно, эти результаты указывают на влияние VPA на регуляцию передачи сигнала жирными кислотами, которая не зависит от поглощения.
Метаболизм полиненасыщенных жирных кислот главным образом регулируется PLA2-катализируемым расщеплением липидов с высвобождением свободных жирных кислот, и ранее предполагалось, что VPA регулирует PLA2-зависимую сигнализацию (Rapoport и Bosetti, 2002). Была предсказана роль PLA2 в VPA-зависимой сигнализации на нашей модели, когда при скрининге мутантов, устойчивых к действию VPA в процессе развития, было обнаружено, что удаление одного гена PLA2 дает частичную устойчивость к VPA. Это обеспечило связь с потенциальным клиническим действием VPA, поскольку были определены повышенные уровни PLA2 у пациентов с биполярным расстройством (Ross et al., 2006) и с судорогами (Siesjo et al., 1982; Rintala et al., 1999a; Bazan et al., 2002; Basselin et al., 2003a). Однако, удаление одной изоформы PLA2, идентифицированной в генетическом скрининге, не оказало влияния на полное изменение VPA-индуцированного высвобождения радиоактивной метки (фиг.8В). Это может быть потому, что в геноме присутствуют 18 других генов, родственных гену PLA2 (Fey et al., 2009), поскольку активности продуктов этих генов в полноклеточных опытах, возможно, нивелируют небольшие изменения, вызванные удалением только одного гена. Однако, идентифицированный ген может играть критическую, целевую роль в хемотаксисе и развитии Dictyostelium - как было показано (Chen et al., 2007, Kortholt и van Haastert, 2008), и поэтому VPA-опосредованные эффекты развития были частично преодолены. Такое VPA-зависимое ингибирование развития может быть не видно в проведенных исследованиях, поскольку эти исследования не были дифференцированы между особыми функциями клеток, а также не было рассмотрено множество временных точек в процессе развития.
Для дополнительного исследования сигнализации PLA2 в связи с наблюдаемым эффектом VPA изобретатели использовали фармакологические ингибиторы активности PLA2 и показали, что они снижают высвобождение радиоактивной метки из клеток, меченых 3Н-АА, таким образом было подтверждено, что VPA имитирует эффект ингибирования PLA2 в этой модели. Однако, этот эффект VPA происходит не через прямое ингибирование PLA2, поскольку VPA-индуцированное повышение поглощения жирных кислот не воспроизводилось ингибиторами PLA2 (фиг.9). Эти данные предполагают, что этот эффект VPA, подобный эффекту ингибирования PLA2, может быть только одной стороной лекарственного действия на регуляцию метаболизма жирных кислот, и подтверждают, что PLA2 не является главной мишенью VPA в этом эффекте.
Если PLA2 не является фармакологической мишенью для VPA, наблюдаемое частичное фенокопирование ингибиторов PLA2 может указывать на нарушение метаболизма липидов. Например, сниженная активность ацил-СоА синтазы жирных кислот может вызвать сниженное включение радиомеченых жирных кислот в фосфолипиды, в результате будет снижено высвобождение радиомеченых жирных кислот (что напоминает PLA2-ингибирующий эффект). Изобретатели показали, что VPA не ингибирует активацию СоА жирных кислот, ни прямо, ни опосредованно. Более того, генетическое удаление обеих СоА синтаз жирных кислот (FcsA и FcsB) показало VPA-зависимую регуляцию поглощения АА, что подтверждает, что активация жирных кислот не является мишенью для VPA в этом эффекте, в отличие от того, что сообщали в связи с высокими концентрациями VPA (Bazinet et al., 2006b).
Наконец, изобретатели использовали исследование SAR для проверки VPA-индуцированной регуляции жирных кислот. Этот подход обеспечил весьма важное понимание действия VPA, поскольку VPA используется для терапевтического лечения большого круга заболеваний (Terbach и Williams, 2009), при этом большое количество клеточных эффектов остаются не соотнесенными с каждым из терапевтических действий, и для очень малого количества из этих эффектов определена первичная мишень (Lagace и Eisch, 2005, Terbach и Williams, 2009). Исследования SAR могут быть использованы, чтобы дифференцировать терапевтическое действие, механизмы и мишени. Например, было показано, что родственное VPA соединение, демонстрирующее ингибирование гистондеацетилазы в качестве клеточной функции, вызывает тератогенность в качестве биомедицинского действия, и определение структуры сейчас позволяет предсказать тератогенность новых соединений (Phiel et al., 2001). На основании исследований SAR в отношении метаболизма жирных кислот показано, что этот эффект не имеет отношения к тератогенности, поскольку некоторые соединения показали сильную регуляцию жирных кислот, но не показали предсказанной тератогенности (Radatz et al., 1998). Другой клеточный эффект VPA в Dictyostelium и нейронах млекопитающих заключается в ингибировании передачи сигнала, опосредованной инозитолом (Williams et al., 2002, Eickholt et al., 2005, Shimshoni et al., 2007). Хотя некоторые соединения (н-р, изопропилпентановая кислота) являются высоко активными как в отношении ингибирования передачи сигнала, опосредованной инозитолом, так и в отношении регуляции жирных кислот, эти эффекты не являются общими для всех соединений, что указывает на то, что эффекты сигнализации, опосредованной жирными кислотами и инозитолом, являются независимыми. Таким образом, регуляция жирных кислот, ингибирование гистондеацетилазы и снижение уровней инозитола обеспечивают три независимых механизма действия VPA. Следовательно, применение VPA-структур, демонстрирующих повышенную или пониженную активность в регуляции жирных кислот, может привести к повышению терапевтической активности или снижению нежелательных побочных эффектов при лечении состояний, которые лечат посредством VPA.
Одно клиническое следствие этой работы показано на образовании капель липидов, зависимого от VPA. Этот эффект был показан в системах, начиная от S. cerevisiae (Sun et al., 2007) до гиппокампа и коры головного мозга крыс (Sobaniec-Lotowska, 2005), что ясно указывает на то, что описанные наблюдаемые эффекты скорее всего не являются специфичными к модели. Более того, образование капель липидов связано с гепатотоксичностью, хотя механизм этого остается неясным (Fujimura et al., 2009). Определение структурной специфичности для этого эффекта в регуляции липидов обеспечивает потенциальный механизм для выбора новых терапевтических средств, не имеющих этого эффекта. Структурное выделение VPA- зависимого повышенного накопления липидов также может предложить подход к объяснению набора массы тела у пациентов, которых лечат VPA (Wirrell, 2003, Masuccio et al., 2010, Verrotti et al., 2010).
В заключение следует отметить, что изобретатели описали модель для изучения регуляции жирных кислот, индуцированной VPA. Ингибирование PLA2 фенокопирует некоторые, но не все из этих эффектов, зависящих от VPA, однако, маловероятно, что PLA2 является первичной мишенью для VPA. Роль этого эффекта, вероятно, заключается в действии как в отношении лечения биполярных расстройств, так и в отношении контроля судорог, поскольку повышенная активность PLA2 подразумевается в обоих состояниях (Yegin et al., 2002, Rao et al., 2007). Определение новых структур для этого эффекта, включая карбоновые кислоты с короткими (5 атомов углерода) и средними (9 атомов углерода) основными цепями и боковыми цепями (этил или пропил), имеющие разветвление у второго атома углерода основной цепи, обеспечивает потенциальные новые терапевтические средства для лечения обоих состояний. Последующее определение первичного места действия для этого эффекта значительно поможет нашему пониманию VPA и родственных терапевтических средств.
Все цитируемые документы во всей полноте включены в данное описание посредством ссылки.
Список литературы:
Ackermann EJ, Conde-Frieboes K, Dennis EA, Journal of Biological Chemistry 270, 445-450 (1995).
Alam et al. Surgery 146, 325-333 (2009)
Armand, V., Louvel, J., Pumain, R., & Heinemann, U. Epilepsy Res. 32, 345-355 (1998).
Backman, S.A. et al. Nat. Genet. 29, 396-403 (2001).
Bakthavatsalam, D., Meijer, H.J., Noegel, A.A., & Govers, F. Trends Microbiol. 14, 78-382 (2006).
Blaheta, Michaelis, Driever & Cinatl Med. Res. Rev. 25, 383-397 (2005). 3. Deubzer et al. Leuk. Res. 30, 1167-1175 (2006)
Balsinde J, Dennis EA, Journal of Biological Chemistry 271, 6758-6765 (1996).
Basselin M, Chang L, Bell JM, Rapoport SI, Neuropsychopharmacology 31, 1659-1674 (2005).
Basselin M, Chang L, Seemann R, Bell JM, Rapoport SI, J. Neurochem. 85, 1553-1562 (2003).
Bazan NG, Tu B, Rodriguez de Turco EB, Prog. Brain. Res. 135, 175-185 (2002).
Bazinet RP, Rao JS, Chang L, Rapoport SI, Lee HJ, Biol. Psychiatry 59, 401-407 (2006a).
Bazinet RP, Weis MT, Rapoport SI, Rosenberger ТА, Psychopharmacology (Berl) 184, 122-129 (2006b).
Berridge, M.J., Downes, C.P., & Hanley, M.R. Cell 59, 411-419 (1989).
Bialer, M. & White, H.S. Nat Rev Drug Discov. 9, 68-82 (2010).
Bialer, M. & Yagen, B. Neurotherapeutics. 4, 130-137 (2007).
Boeckeler K, Adley K, Xu X, Jenkins A, Jin T, Williams RS, Eur. J. Cell Biol. 85, 1047-1057 (2006).
Chang, P., Chandler, K.E., Williams, R.S., & Walker, M.C. Epilepsia (2009).
Chang MC, Contreras MA, Rosenberger ТА, Rintala JJ, Bell JM, Rapoport SI, J. Neurochem. 77, 796-803 (2001).
Chapman, A.G., Meldrum, B.S., & Mendes, E. Life Sci. 32, 2023-2031 (1983).
Chen CT, Green JT, Orr SK, Bazinet RP Prostaglandins Leukot Essent. Fatty Acids 79, 85-91 (2008).
Chen L, lijima M, Tang M, Landree MA, Huang YE, Xiong Y, Iglesias PA, Devreotes PN, Dev. Cell 12, 603-614 (2007).
Chiu CC, Huang SY, Su KP, Lu мл, Huang MC, Chen CC, Shen WW, Eur. Neuropsychopharmacol 13, 99-103 (2003).
Costa et al. Stroke 37, 1319-1326 (2006)
de Oliveira CA, Mantovani B, Life Science 43, 1825-1830 (1988).
Deutsch, J., Rapoport, S.I., & Rosenberger, T.A. Neurochem. Res. 28, 861-866 (2003).
Drancourt M, Bollet C, Carta A, Rousselier P, Int. J. Syst. Evol. Microbiol. 51, 925-932 (2001).
Drayer, A.L., Van Der, K.J., Mayr, G.W., & Van Haastert, P.J. EMBO J. 13, 1601-1609 (1994).
DSMV IV American Psychiatric Association: Diagnostic u statistical manual of mental disorders (American Psychiatric Association, Washington DC, 2000).
Eickholt BJ, Towers GJ, Ryves WJ, Eikel D, Adley K, Ylinen LM, Chadborn NH, Harwood AJ, Nau H, Williams RS, Mol. Pharmacol. 67, 1426-1433 (2005).
Eikel D, Lampen A, Nau H, Chem. Res. Toxicol. 19, 272-278 (2006).
Einat, H., Tian, F., Belmaker, R.H., & Frost, J.W. J. Neural Transm. 115, 55-58 (2008).
Eyal S, Yagen B, Shimshoni J, Bialer M, Biochem. Pharmacol. 69, 1501-1508 (2005).
Faix J, Kreppel L, Shaulsky G, Schleicher M, KimMel AR, Nucleic Acids Research 32, e143 (2004).
Fey P, Gaudet P, Curk T, Zupan B, Just EM, Basu S, Merchant SN, Bushmanova YA, Shaulsky G, Kibbe WA, Chisholm RL, Nucleic Acids Research 37, D515-519 (2009).
Fujimura H, Murakami N, Kurabe M, Toriumi W, J. Appl. Toxicol. 29, 356-363 (2009).
Guo, Q. et al. Nat Med. 5, 101-106 (1999).
Gurvich, N., Tsygankova, O.M., Meinkoth, J.L., & Klein, P.S. Cancer Res. 64, 1079-1086 (2004).
Hoeller, O. & Kay, R.R. Curr. Biol. 17, 813-817 (2007).
Honack, D. & Loscher, W. Epilepsy Res. 13, 215-221 (1992).
Holtkamp, M., Tong, X., & Walker, M.C. Ann. Neurol. 49, 260-263 (2001).
Isoherranen, N., Yagen, В., & Bialer, M. Curr. Opin. Neurol. 16, 203-211 (2003).
Johnson C.B., Wong E., & Birch E.J. Lipids 12: 340-347 (1977).
Kaufmann, D., Bialer, M., Shimshoni, J.A., Devor, M., & Yagen, B.J. Med. Chem. 52, 7236-7248 (2009).
Keane, P.E., Simiand, J., Mendes, E., Santucci, V., & Morre, M. Neuropharmacology 22, 875-879 (1983).
Kesterson JW, Granneman GR, Machinist JM, Hepatology 4, 1143-1152 (1984).
Kim HW, Rapoport SI, Rao JS, Mol. Psychiatry (2009).
King, J.S. et al. Dis. Model. Mech. 2, 306-312 (2009).
Kortholt A, van Haastert PJ, Cell Signal 20, 1415-1422 (2008).
Kuspa A, Loomis WF, Methods Mol. Biol. 346, 15-30 (2006).
Lagace DC, Eisch AJ, Psychiatr. Clin. North Am. 28, 399-414 (2005).
Lands W, Crawford C, New York: John Wiley & Sons (1976).
Lio YC, Reynolds LJ, Balsinde J, Dennis EA, Biochim. Biophys. Acta. 1302, 55-60 (1996).
Liu, M.J. & Pollack, G.M. P Epilepsia 35, 234-243 (1994).
Loscher, W., Fisher, J.E., Nau, H., & Honack, D.J. Pharmacol. Exp. Ther. 250, 1067-1078 (1989).
Loscher W, Nau H, Neuropharmacology 24, 427-435 (1985).
Maslanski, J.A. & Busa, W.B. Methods in Inositide Research (ed. Irvin, R.F.) 113-126 (Raven Press Ltd., New York, 1990).
Masuccio F, Verrotti A, Chiavaroli V, de Giorgis T, Giannini C, Chiarelli F, Mohn A, J. Child Neurol. (2010).
Meunier H, Carraz G, Neunier Y, Eymard P, Aimard M, Therapie 18, 435-438 (1963).
Mitchell SM, Poyser NL, Wilson NH, Br. J. Pharmacol. 58, 295P (1976).
Mora, A., Gonzalez-Polo, R.A., Fuentes, J.M., Soler, G., & Centeno, F. Eur J. Biochem. 266, 886-891 (1999).
Mora, A., Sabio, G., Alonso, J.C., Soler, G., & Centeno, F. Bipolar Disord. 4, 195-200 (2002).
Nalivaeva, N.N., Belyaev, N.D., & Turner, A.J. Trends Pharmacol. Sci. 30, 509-514 (2009).
Pawolleck, N. & Williams, R.S. Methods Mol. Biol. 571, 283-290 (2009).
Phiel, C.J. et al. J. Biol. Chem. 276, 36734-36741 (2001).
Piredda, S., Yonekawa, W., Whittingham, T.S., & Kupferberg, H.J. Epilepsia 26, 167-174 (1985).
Qing et al. J. Exp. Med. 205, 2781-2789 (2008)
Radatz M, Ehlers K, Yagen B, Bialer M, Nau H, Epilepsy Research 30, 41-48 (1998).
Rao JS, Ertley RN, Rapoport SI, Bazinet RP, Lee HJ, J. Neurochem. 102, 1918-1927 (2007).
Rao JS, Lee HJ, Rapoport SI, Bazinet RP, Mol. Psychiatry 13, 585-596 (2008).
Rapoport SI, J. Nutr. 138, 2515-2520 (2008a).
Rapoport SI, Prostaglandins Leukot Essent. Fatty Acids 79, 153-156 (2008b).
Rapoport SI, Bosetti F, Arch. Gen. Psychiatry 59, 592-596 (2002).
Rintala J, Seemann R, Chandrasekaran K, Rosenberger ТА, Chang L, Contreras MA,
Rapoport SI, Chang MC, Neuroreport 10, 3887-3890 (1999).
Ross BM, Hughes B, Kish SJ, Warsh JJ, Bipolar Disord. 8, 265-270 (2006).
Shaltiel, G., Mark, S., Kofman, O., Belmaker, R.H., & Agam, G. Pharmacol. Rep.59, 402-407 (2007a).
Shaltiel, G., Dalton, E.C., Belmaker, R.H., Harwood, A.J., & Agam, G. Bipolar. Disord. 9, 281-289 (2007b).
Shaltiel, G. et al. Valproate decreases inositol biosynthesis. Biol. Psychiatry 56, 868-874 (2004).
Shimshoni, J.A. et al. Mol. Pharmacol. 71, 884-892 (2007).
Siesjo BK, Ingvar M, Westerberg E, J. Neurochem. 39, 796-802 (1982).
Silva MF, Aires CC, Luis PB, Ruiter JP, Ijlst L, Duran M, Wanders RJ, Tavares de Almeida I, J. Inherit. Metab. Dis. (2008).
Sobaniec-Lotowska ME, Int. J. Exp. Pathol. 86, 91-96 (2005).
Storey, N.M., O'Bryan, J.P., & Armstrong, D.L. Curr. Biol. 12, 27-33 (2002).
Sun Q, Bi L, Su X, Tsurugi K, Mitsui K, FEBS Lett. 581, 3991-3995 (2007).
Terbach N, Williams RS, Biochem. Soc. Trans. 37, 1126-1132 (2009).
Tokuoka, S.M., Saiardi, A., & Nurrish, S.J. Mol. Biol. Cell 19, 2241-2250 (2008).
Vaden, D.L., Ding, D., Peterson, В., & Greenberg, M.L. J. Biol. Chem. 276, 15466-15471 (2001).
van Haastert PJ, Keizer-Gunnink I, Kortholt A, J. Cell Biol. 177, 809-816 (2007).
Van Rooijen, L.A., Vadnal, R., Dobard, P., & Bazan, N.G. Biochem. Biophys. Res. ComMun. 136, 827-834 (1986).
Verrotti A, Manco R, Agostinelli S, Coppola G, Chiarelli F, Epilepsia 51, 268-273 (2010).
von Lohneysen K, Pawolleck N, Ruhling H, Maniak M, Eur. J. Cell Biol. 82, 505-514 (2003).
Walker, M.C. et al. Epilepsia 40, 359-364 (1999).
Weeks G, Biochim. Biophys. Acta. 450, 21-32 (1976).
Williams, R.S.B. Clinical Neuroscience Research 4, 233-242 (2005).
Williams RS, Cheng L, Mudge AW, Harwood AJ, Nature 417, 292-295 (2002).
Williams RS, Eames M, Ryves WJ, Viggars J, Harwood AJ, EMBO J. 18, 2734-2745 (1999).
Wilson DB, Prescott SM, Majerus PW (1982) Discovery of arachidonoyl coenzyme A synthetase in human platelets. J Biol Chem 257: 3510-3515
Wirrell EC, Pediatr. Neurol. 28, 126-129 (2003).
Worsfold O, Toma C, Nishiya T, Biosens. Bioelectron. 19, 1505-1511 (2004).
Xu X, Muller-Taubenberger A, Adley KE, Pawolleck N, Lee VW, Wiedemann C, Sihra TS, Maniak M, Jin T, Williams RS, Eukaryot. Cell 6, 899-906 (2007).
Yedgar S, Cohen Y, Shoseyov D, Biochim. Biophys. Acta. 1761, 1373-1382 (2006).
Yegin A, Akbas SH, Ozben T, Korgun DK, Acta. Neurol. Scand. 106, 258-262 (2002).