КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, АССОЦИИРОВАННОГО С ИНФЕКЦИЕЙ HPV
Вид РИД
Изобретение
Область техники
Эта патентная заявка претендует на приоритет патентной заявки Кореи No. 10-2012-0084820, поданной 02 августа 2012, содержание которой включено в настоящее описание посредством ссылки во всей своей полноте.
Настоящее изобретение относится к композиции для генной терапии заболевания, ассоциированного с инфекцией HPV, в том числе рака шейки матки.
Предшествующий уровень техники
Вирус папилломы человека высокого риска (далее "HPV") типов 16 и 18 является основным фактором развития рака шейки матки и дисплазии шейки матки и может стать причиной других генитальных раков и плоскоклеточного рака головы и шеи. Рак шейки матки является одним из наиболее распространенных видов злокачественных опухолей у женщин. Несмотря на то, что заболеваемость инвазивным раком шейки матки медленно снижается, инвазивный рак шейки матки до сих пор является наиболее часто встречающимся раком у женщин в развивающихся странах, на долю которого приходится 25% от всех видов рака у женщин. HPV представляет собой небольшой ДНК-содержащий вирус, имеющий длину генома приблизительно 8000 оснований, который вызывает доброкачественные или злокачественные опухоли. На настоящий момент, на основании их геномных различий было идентифицировано, по меньшей мере, 100 подтипов HPV, и полностью проанализированы генотипы приблизительно 90 подтипов HPV. Среди этих типов, типы HPV высокого риска (например, HPV-16, 18, 31, 33, 35, 45, 51, 52 и 56) связаны почти с 90% случаев рака шейки матки. По меньшей мере, 50% из этих случаев рака шейки матки с инфекцией HPV связано с HPV типа 16, далее следует HPV типа 18 (12%), HPV типа 45 (8%) и HPV типа 31 (5%). Эти HPV кодируют 2 онкогенных белка, которые представляют собой белки Е6 и Е7. Оба этих белка участвуют в HPV-опосредованной иммортализации и трансформации клеток. Онкогенный белок Е6 связывается с белком-супрессором опухоли р53 дикого типа, вследствие чего р53 деградирует по убиквитиновому пути. С другой стороны, белок Е7 непосредственно связывается с Rb, что приводит к избыточному фосфорилированию Rb. Сначала Е6 образует комплекс с Е6-ассоциированным белком (Е6-АР), который представляет собой белок Е3 убиквитин-лигазу. Далее, комплекс Е6/Е6-АР связывается р53 дикого типа и убиквитинирует его, и далее препятствует осуществлению р53-опосредованной клеточной реакции на повреждение ДНК. Главным образом, регуляция белка-супрессора опухоли р53 осуществляется путем Мс1 т2-опосредованного убиквитинирования, тем не менее, в клетках рака шейки матки, инфицированных HPV, деградация р53 полностью изменена с Мdm2-опосредованного убиквитинирования на Е6-опосредованное убиквитинирование. Таким образом, в отличие от многих других видов рака в большинстве случаев рака шейки матки с инфекцией HPV ген р53 представляет собой ген дикого типа. Тем не менее уровень экспрессии белка р53 является очень низким из-за его постоянной деградации белком Е6. Таким образом, белок Е6 HPV весьма интересен в качестве специфичной мишени для уничтожения только клеток рака шейки матки. Эти стратегии направленного действия на Е6 или комплекс Е6/Е6-АР включают различные виды лечения.
Их примеры включают: применение агента, который представляет собой клеточный токсин, применение ингибитора для высвобождения цинка из онкогенного белка Е6, применение эпитопного пептида (mimotope), который имитирует Е6-АР, применение анти-Е6 рибозима, пептидного аптамера, который направленно действует на онкогенный белок Е6 вируса, применение киРНК, которая направленно действует на онкогенный белок Е6 вируса, и комбинации этих видов лечения. Недавно было доказано, что киРНК селективно выключает собственные гены в клетках животных, а также селективно выключает вирусные гены при заболевании, вызванном вирусом. РНК-интерференция (РНКи) в результате трансфекции киРНК стала новым видом терапии для лечения вирусной инфекции у человека. киРНК, которая направленно действует на гены Е6 и Е7 в клетках рака шейки матки, инфицированных HPV, вызывает накопление р53 и pRb, что приводит к апоптозу или старению клетки. Для линии клеток рака шейки матки, инфицированных HPV-16, и линии клеток, инфицированных HPV-18, было обнаружено, что РНКи, которая направленно действует на вирусные онкогены Е6 и Е7, селективно выключает экспрессию этих белков.
В то же время, эффективность нуклеиновой кислоты, имеющей различные модификации нуклеиновых кислот (например, основания, сахара и/или фосфата) увеличивается за счет ингибирования деградации сывороточными рибонуклеазами. В данной области техники известно несколько примеров, описывающих модификации сахара, основания и фосфата, которые могут быть введены в нуклеиновую кислоту. Например, олигонуклеотид модифицируют для повышения стабильности и/или повышения биологической активности посредством модификации с помощью групп, устойчивых к нуклеазам, например, за счет 2-амино, 2'-С-аллил, 2'-фтор, 2'-O-метил и 2'-Н модификации основания нуклеотида (смотрите Eckstein et al., опубликованную заявку РСТ WO 92/07065; документ [Perrault et al., Nature 344:565-568, 1990]; документ [Pieken et al., Science 253: 314-317, 1991]; документ [Usman and Cedergren, Trends in Biochem. Sci. 17: 334-339, 1992]; Usman et al., опубликованная заявка РСТ WO 93/15187; Sproat, патент США номер 5,334,711 и документ [Beigelman et al., J. Biol. Chem., 270:25702, 1995]; Beigelman et al., опубликованная заявка РСТ WO 97/26270; Beigelman et al., патент США номер 5,716,824; Usman et al., патент США номер 5,627,053; Woolf et al., опубликованная заявка РСТ WO 98/13526; Thompson et al., заявку на патент США номер 60/082,404 (поданную 20 апреля 1998); документ [Karpeisky et al., Tetrahedron Lett., 39:1131, 1998]; документ [Earnshaw and Gait, Biopolymers(Nucleic acid Sciences) 48:39-55, 1998]; документ [Verma and Eckstein, Annu. Rev. Biochem. 67:99-134, 1998]; и документ [Burlina et al., Bioorg. Med. Chem. 5: 1999-2010, 1997]). Аналогичные модификации могут быть использованы для модифицирования нуклеиновой кислоты согласно настоящему изобретению.
В 1999 было показано, что в результате комбинированной терапии химиотерапией на основе цисплатина и лучевой терапией значительно возросла выживаемость женщин с тяжелым локальным раком шейки матки. Цисплатин представляет собой лекарство, повреждающее ДНК, которое широко применяется для лечения рака, в том числе рака яичников, рака шейки матки, рака головы и шеи, немелкоклеточного рака легких и других типов рака. Совсем недавно был проанализирован механизм действия лекарственного препарата на основе платины. Тем не менее, процессы, протекающие под влиянием лечения цисплатином в клетках, включая репарацию ДНК, гибель клетки, динамику клеточного цикла, сигналинг о повреждении ДНК и регуляцию абсорбции и секреции лекарства, все еще до конца не ясны. В клетках HeLa HPV-18 белок р53 избегает Е6-опосредованной деградации и предпочтительно накапливается в ядрышке ядра после лечения цисплатином. Кроме того, в клетках SiHa HPV-16 функция р53 восстанавливается при одновременном осуществлении лучевой терапии и лечения цисплатином, что повышает восприимчивость к лучевой терапии.
Таким образом, в результате попытки исследовать эффективную киРНК, имеющую новую последовательность вследствие химической модификации Е6/Е7-специфичной киРНК, чтобы киРНК могла оказывать противораковый эффект сама по себе или в сложной комбинации, или могла оказывать синергический эффект при проведении комбинированной терапии с традиционной химиотерапией или лучевой терапией, авторы настоящего изобретения обнаружили, что нуклеотиды, список которых приведен в Примерах и Формуле изобретения, и конкретные их комбинации снижают экспрессию соответствующих белков ТР53 и Е7 и мРНК Е6 HPV и индуцируют гибель клеток, и также экспериментально доказали, что эффективность, достигаемая при их применении самих по себе или в комбинации с противораковыми агентами выше, чем в случае РНК, не имеющей модификации в последовательности остатков оснований.
В описании даются ссылки на различные журналы и патентные документы, и указаны места цитирования. Раскрытия цитированных журналов и патентных документов включены в настоящее описание во всей своей полноте посредством ссылки для более ясного описания уровня техники в той области техники, к которой принадлежит настоящее изобретение, и признаков настоящего изобретения.
Сущность изобретения
Техническая задача
Авторы настоящего изобретения длительное время исследуют и пытаются разработать эффективный геннотерапевтический агент для различных заболеваний, вызываемых инфекцией вирусом папилломы человека (HPV). В результате, работа над настоящим изобретением завершилось обнаружением того, что при использовании конкретной РНК для ингибирования экспрессии, которая направленно действует на ген Е6/Е7 вируса HPV типа 16 или вируса HPV типа 18, или при использовании последовательности РНК, имеющей модификацию оснований РНК, экспрессия гена HPV эффективно ингибируется, что, таким образом, демонстрирует превосходную терапевтическую активность по отношению к заболеваниям, ассоциированным с инфекцией HPV, в том числе, по отношению к раку шейки матки.
Одной из целей настоящего изобретения является обеспечение композиции для предотвращения или лечения заболевания, ассоциированного с инфекцией HPV, более конкретно, рака, ассоциированного с инфекцией HPV, и еще более конкретно, рака шейки матки.
Другой целью настоящего изобретения является обеспечение способа предотвращения или лечения заболевания, ассоциированного с инфекцией HPV, более конкретно, рака, ассоциированного с инфекцией HPV, и еще более конкретно, рака шейки матки.
Другие цели и преимущества настоящего изобретения становятся ясными из прилагаемых подробного описания изобретения, формулы изобретения и графических материалов.
Техническое решение
В соответствии с одним из аспектов настоящего изобретения, настоящее изобретение предусматривает композицию для лечения или предотвращения заболевания, ассоциированного с инфекцией вирусом папилломы человека (HPV), где композиция содержит в качестве активного ингредиента одну или несколько нуклеотидных последовательностей, выбранных из группы, состоящей из последовательностей SEQ ID NOs: 16, 22, 28, 34, 40, 66, 72, 84, 90 и 108, и их антисмысловых нуклеотидных последовательностей.
Авторы настоящего изобретения длительное время исследуют и пытаются разработать эффективный геннотерапевтический агент для различных заболеваний, вызываемых инфекцией HPV. В результате было обнаружено, что при использовании конкретной РНК для ингибирования экспрессии, которая направленно действует на гены Е6/Е7 вируса HPV типа 16 или вируса HPV типа 18, или при использовании последовательности РНК, имеющей модификацию в основаниях РНК, экспрессия гена HPV эффективно ингибируется, что, таким образом, демонстрирует превосходную терапевтическую активность по отношению к заболеваниям, ассоциированным с инфекцией HPV, в том числе, по отношению к раку шейки матки.
В соответствии с настоящим изобретением, последовательности SEQ ID No: 16, 22, 28, 34 и 40 и последовательности SEQ ID No: 72, 84 90 и 108 представляют собой последовательности нуклеиновой кислоты РНК для ингибирования экспрессии, среди которых последовательности SEQ ID No: 16, 22, 28, 34 и 40 направленно действую на вирус HPV типа 16; и последовательности SEQ ID No: 72, 84 90 и 108 направленно действую на вирус HPV типа 16.
Использованный в настоящем описании термин "нуклеотид" означает рибонуклеотид, присутствующий в одноцепочечной или двухцепочечной форме, и включает природные аналоги нуклеотидов, если иное специально не указано (смотрите Scheit, Nucleotide Analogs, John Wiley, New York(1980); Uhlman and Peyman, Chemical Reviews, 90:543-584(1990)).
Использованный в настоящем описании термин "ингибирование экспрессии" означает снижение функционирования целевого гена, и предпочтительно означает, что экспрессию целевого гена становится невозможно обнаружить или она присутствует на незначительном уровне.
В соответствии с предпочтительным вариантом воплощения настоящего изобретения, нуклеотидная последовательность согласно настоящему изобретению представляет собой последовательность РНК, которая может выключать гены Е6/Е7 вируса НРV типа 18 или вируса НРV типа 16, и предпочтительно, киРНК, кшРНК или антисмысловой олигонуклеотид.
Использованный в настоящем описании термин "киРНК" означает короткую двухцепочечную РНК, которая может индуцировать РНК интерференцию (РНКи) посредством расщепления конкретной мРНК. киРНК состоит из смысловой цепи РНК, имеющей последовательность, гомологичную мРНК целевого гена, и антисмысловой цепи РНК, имеющей комплементарную ей последовательность. киРНК может ингибировать экспрессию целевого гена, и, таким образом, предусмотрена в качестве эффективного способа нокдауна гена или способа генной терапии.
На киРНК не накладывается такое ограничение, что в киРНК, имеющей двухцепочечную часть РНК, все пары нуклеотидов РНК являются спаренными; наоборот, киРНК включает часть, в которой нуклеотиды не образуют пары из-за несовпадений (т.е. соответствующее основание не является комплементарным), выпетливания (т.е. нет основания, соответствующего одной стороне цепи) и тому подобного. Общая длина составляет от 10 до 100 оснований, предпочтительно, от 15 до 80 оснований, и, предпочтительнее, от 17 до 23 оснований. Концевой структурой киРНК могут являться как тупой конец, так и липкий конец, если при этом возможно ингибировать экспрессию целевого гена путем РНКи. Структура с липким концом может быть как с 3' концевой выступающей структурой, так и с 5' концевой выступающей структурой. Количество выступающих оснований не ограничено. Например, количество оснований может составлять от 1 до 8 оснований, и предпочтительно от 2 до 6 оснований. Кроме того, выступающая часть одного из концов киРНК может включать, например, низкомолекулярную РНК (например, природные молекулы РНК, такие как тРНК, рРНК и вирусная РНК, или синтетические молекулы РНК), если при этом может сохраняться эффект ингибирования экспрессии целевого гена. На конце структуры киРНК необязательно может присутствовать расщепляемая структура по обеим сторонам, и указанная структура может представлять собой структуру стебель-петля, в которой концевая часть одной из сторон двухцепочечной РНК присоединена через линкер РНК. На длину линкера не накладываются особые ограничения, если длина не влияет на спаривание в стеблевой части.
Использованный в настоящем описании термин "короткая шпилечная РНК (кшРНК)" означает одноцепочечную молекулу длиной от 50 до 70 нуклеотидов, которая образует структуру стебель-петля in vivo. Другими словами, кшРНК представляет собой последовательность РНК, которая образует прочную шпилечную структуру для ингибирования экспрессии гена посредством РНК интерференции. Двухцепочечный стебель образован за счет спаривания оснований длинной РНК, имеющей от 15 до 30 комплементарных нуклеотидов по обеим сторонам от участка петли, имеющего от 5 до 10 нуклеотидов. Для конститутивной экспрессии кшРНК вводят в клетки с помощью вектора, включающего промотор U6, который в большинстве случаев передается дочерним клеткам для наследственной передачи ингибирования экспрессии гена. Шпилечная структура кшРНК расщепляется под действием внутриклеточного механизма и превращается в киРНК, которая далее связывается с РНК-индуцируемым комплексом выключения гена (RISC). RISC связывается с мРНК и расщепляет ее. кшРНК транскрибируется РНК полимеразой III. В соответствии с настоящим изобретением, нуклеотидная последовательность согласно настоящему изобретению может образовывать структуру кшРНК, имеющую последовательность двухцепочечного стебля по обеим сторонам участка петли.
Использованный в настоящем описании термин "микроРНК (микроРНК)" означает одноцепочечную молекулу РНК, которая регулирует экспрессию гена и включает от 10 до 50 нуклеотидов в длину, предпочтительно от 15 до 40 нуклеотидов, и, предпочтительнее, от 17 до 25 нуклеотидов. МикроРНК представляет собой олигонуклеотид, который не экспрессируется в клетках и имеет короткую структуру типа «стебель-петля». МикроРНК полностью или частично гомологична, по меньшей мере, одной информационной РНК (мРНК), и ингибирует экспрессию целевого гена, комплементарно связываясь с соответствующей мРНК.
Использованный в настоящем описании термин "антисмысловой олигонуклеотид" означает РНК, содержащую нуклеотидную последовательность, комплементарную конкретной последовательности мРНК, или ее производное, которые ингибируют трансляцию мРНК в белок путем связывания с комплементарной последовательностью в мРНК. Антисмысловая нуклеотидная последовательность согласно настоящему изобретению означает последовательность РНК, которая может быть комплементарна мРНК целевого гена, чтобы связываться с мРНК целевого гена, и может ингибировать трансляцию целевого гена в мРНК, транслокацию в цитоплазму, созревание или другие процессы, важные для всех биологических функций.
Для повышения эффективности антисмыслового олигонуклеотида может быть введена модификация оснований, Сахаров или остова в одном или нескольких положениях (смотрите De Mesmaeker et al., Curr Opin Struct Biol., 5(3):343-55, 1995). Олигонуклеотидный остов может быть модифицирован тиофосфатом, триэфиром фосфорной кислоты, метилфосфонатом, одноцепочечным алкилом, циклоалкилом, одноцепочечным гетероатомным, гетероциклическим сульфонатом сахара и тому подобным. Кроме того, антисмысловая нуклеиновая кислота может включать один или несколько замещенных сахарных фрагментов. Антисмысловой олигонуклеотид может включать модифицированное основание. Примеры модифицированных оснований включают гипоксантин, 6-метиладенин, 5-метилпиримидин (в частности, 5-метилцитозин), 5-гидроксиметилцитозин (НМС), гликозил НМС, гентобиозил НМС, 2-аминоаденин, 2-тиоурацил, 2-тиотимин, 5-бромурацил, 5-гидроксиметилурацил, 8-азагуанин, 7-деазагуанин, N6(6-аминогескил)аденин, 2,6-диаминопурин, 2-O-метилурацил, 2-О-метилгуанин, 2-фторцитизин и тому подобные.
В соответствии с более предпочтительным вариантом воплощения настоящего изобретения, нуклеотидная последовательность согласно настоящему изобретению представляет собой последовательность киРНК.
В соответствии с другим аспектом настоящего изобретения, настоящее изобретение предусматривает композицию для лечения или предотвращения заболевания, ассоциированного с инфекцией HPV, где композиция содержит в качестве активного ингредиента одну или несколько нуклеотидных последовательностей, выбранных из группы, состоящей из SEQ ID NOs: 1, 7, 12, 16, 22, 28, 34, 40, 46, 51, 56, 62, 66, 72, 78, 84, 90, 96, 102 и 108, и их антисмысловых нуклеотидных последовательностей, которые включают модифицированный остов или одно или несколько модифицированных оснований. Другими словами, нуклеотид, имеющий нуклеотидные последовательности, приведенные выше, в которых модифицированы остов или основание, может быть включен в композицию согласно настоящему изобретению для предотвращения или лечения заболевания, ассоциированного с инфекцией HPV.
Модификации остова или основания для применения к нуклеотиду согласно настоящему изобретению могут включать любые модификации, которые традиционно используются в данной области техники для повышения стабильности или требуемой активности.
Предпочтительно, модифицированный остов согласно настоящему изобретению включает одну или несколько модификаций, выбранных из группы, состоящей из алкилфосфоната, тиофосфата, дитиофосфата, алкилтиофосфоната, амидофосфата, эфира фосфорной кислоты, карбамата, ацетамидата, карбоксиметилового эфира, карбоната и триэфира фосфорной кислоты.
Предпочтительно, модифицированное основание согласно настоящему изобретению включает одну или несколько модификаций, выбранных из группы, состоящей из метилирования, гликозилирования и галогенирования. Предпочтительнее, модифицированное основание согласно настоящему изобретению представляет собой 2'-O метилированное или 2'-фторированное основание.
В соответствии с настоящим изобретением, авторы настоящего изобретения обнаружили, что при осуществлении модификации конкретного положения РНК, которая направленно действует на гены Е6/Е7 вируса HPV типа 16 или вируса HPV типа 18 для ингибирования их экспрессии, такой как 2’-O метилирование или 2'-фторирование, по сравнению с немодифицированной молекулой нуклеиновой кислоты значительно повышается эффективность ингибирования экспрессии целевого гена; повышается стабильность в человеческой сыворотке; и в фармакокинетических экспериментах на животных период полувыведения значительно повышается, по меньшей мере, в два раза.
2’-O метилирование означает, что гидроксильная группа, присоединенная ко второму атому углерода рибозы молекулы РНК, является метилированной и, таким образом, модифицирована до 2'-метокси группы; и 2'-фторирование означает, что гидроксильная группа, присоединенная ко второму атому углерода рибозы молекулы РНК, является замещенной на фтор и, таким образом, модифицирована до 2'-фтор группы.
В соответствии с предпочтительным вариантом воплощения настоящего изобретения, 2'-O метилированное основание в нуклеотиде согласно настоящему изобретению представляет собой U или G.
В соответствии с предпочтительным вариантом воплощения настоящего изобретения, 2'-фторированное основание в нуклеотиде согласно настоящему изобретению представляет собой С.
В соответствии с предпочтительным вариантом воплощения настоящего изобретения, нуклеотидная последовательность согласно настоящему изобретению, содержащая одно или несколько 2'-O метилированных или 2'-фторированных оснований, выбрана из группы, состоящей из SEQ ID NOs: 2, 3, 5, 6, 8, 10, 11, 13, 15, 17, 18, 20, 21, 23, 24, 26, 27, 29, 30, 32, 33, 35, 36, 38, 39, 41, 42, 44, 45, 47, 49, 50, 52, 54, 55, 57, 58, 60, 61, 63, 65, 67, 68, 70, 71, 73, 74, 76, 77, 79, 80, 82, 83, 85, 86, 88, 89, 91, 92, 94, 95, 97, 98, 100, 101, 103, 104, 106, 107, 109, 110, 112 и 113.
В соответствии с другим вариантом воплощения настоящего изобретения, настоящее изобретение предусматривает композицию для предотвращения или лечения заболевания, ассоциированного с инфекцией HPV, где композиция содержит в качестве активного ингредиента пул нуклеотидов, выбранный из группы, состоящей из: пула, имеющего нуклеотидные последовательности SEQ ID No: 2, 4, 8, 9, 12 и 15; пула, имеющего нуклеотидные последовательности SEQ ID No: 18, 21, 29 и 32; пула, имеющего нуклеотидные последовательности SEQ ID No: 42, 45, 52 и 55; пула, имеющего нуклеотидные последовательности SEQ ID No: 58, 59, 63 и 65; пула, имеющего нуклеотидные последовательности SEQ ID No: 68, 71, 91 и 94; и пула, имеющего нуклеотидные последовательности SEQ ID No: 98, 100, 109 и 112.
В соответствии с настоящим изобретением, авторы настоящего изобретения обнаружили, что, когда нуклеотидная последовательность согласно настоящему изобретению используется в виде пула, имеющего конкретную комбинацию, эффективность ингибирования экспрессии целевого гена значительно повышается по сравнению с тем случаем, когда используется единственная последовательность РНК, так что достигается более заметная терапевтическая активность в отношении заболевания, ассоциированного с инфекцией HPV.
В соответствии с предпочтительным вариантом воплощения настоящего изобретения, заболевание, ассоциированное с инфекцией HPV, подлежащее лечению композицией согласно настоящему изобретению, выбрано из группы, состоящей из остроконечных кондилом, воспаления влагалища, тазового перитонита и рака, и, предпочтительно, рак, подвергаемый лечению композицией согласно настоящему изобретению, выбран из группы, состоящей из рака шейки матки, рака влагалища, рака вульвы, рака анального канала, рака полового члена, рака миндалин, рака глотки, рака гортани, рака головы и шеи и аденокарциномы легкого. Предпочтительно, рак, подлежащий лечению композицией согласно настоящему изобретению, представляет собой рак шейки матки.
Композиция согласно настоящему изобретению может быть получена в виде фармацевтической композиции, включающей фармацевтически эффективное количество молекулы нуклеиновой кислоты согласно настоящему изобретению.
Использованный в настоящем описании термин "фармацевтически эффективное количество" означает количество, достаточное для достижения активности или эффективности лечения, облегчения или предотвращения артрита, как описано выше, согласно настоящему изобретению.
Фармацевтически приемлемый носитель, который включен в фармацевтическую композицию согласно настоящему изобретению, представляет собой такой носитель, который обычно используется в лекарственных препаратах, и включает, например, лактозу, декстрозу, сахарозу, сорбитол, маннитол, крахмал, гуммиарабик, кальция фосфат, альгинат, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп, метилцеллюлозу, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния, циклодекстрин и его сополимер, минеральное масло и тому подобное, но не ограничивается вышеперечисленным. Фармацевтическая композиция согласно настоящему изобретению кроме указанных выше компонентов может также включать смазывающий агент, увлажняющий агент, подсластитель, вкусовой агент, эмульгирующий агент, суспендирующий агент и консервант. Подходящие фармацевтически приемлемые носители и препараты описаны в Remington's Pharmaceutical Sciences (19th ed., 1995).
Фармацевтическую композицию согласно настоящему изобретению можно вводить перорально или парентерально, и предпочтительно вводить парентерально. Ее можно использовать для парентерального введения, внутривенной инфузии, подкожной инфузии, внутримышечной инфузии, перитонеальной инфузии, местного введения, трансдермального введения и внутрисуставного введения.
Для введения фармацевтической композиции согласно настоящему изобретению может быть назначена подходящая доза в зависимости от различных факторов, таких как способ получения лекарственной формы, способ введения, возраст, вес, пол и стадия заболевания, диета пациентов, время введения, путь введения, скорость секреции и восприимчивость к лечению. Предпочтительная доза для введения фармацевтической композиции согласно настоящему изобретению составляет от 0,0001 до 100 мг/кг в день.
Когда фармацевтическая композиция согласно настоящему изобретению используется в качестве противоракового агента, композиция может быть использована в виде комбинации с противораковой композицией, обычно применяемой в данной области техники. Более конкретно, композиция может быть введена в комбинации с противораковыми агентами, такими как цисплатин или паклитаксел.
Фармацевтическую композицию согласно настоящему изобретению получают в виде единичной лекарственной формы, которая составлена с использованием фармацевтически приемлемого носителя и/или эксципиента, или получают путем включения в контейнер, содержащий множество доз, в соответствии со способами, которые легко может осуществить специалист в области техники, к которой относится настоящее изобретение. В этом случае лекарственная форма может быть в форме раствора, суспензии или эмульсии в масле или в водной среде, или экстракта, порошка, гранул, таблетки или капсулы и может дополнительно включать диспергирующий агент или стабилизатор.
В соответствии с более предпочтительным вариантом воплощения настоящего изобретения, молекула нуклеиновой кислоты согласно настоящему изобретению включена в систему доставки гена.
Использованный в настоящем описании термин "система доставки гена" означает посредника для введения нужного целевого гена в клетки субъекта для экспрессии. Идеальная система доставки гена должна быть нетоксичной для организма человека, ее должно быть легко производить в большом количестве, и она должна эффективно осуществлять доставку гена.
Использованный в настоящем описании термин "доставка гена" означает доставку гена в клетки и имеет то же значение, что и трансдукции гена в клетки. На уровне ткани термин доставка гена имеет то же значение, что и распространение гена. Таким образом, система доставки гена согласно настоящему изобретению может быть описана как система трансдукции гена и система распространения гена.
Для создания системы доставки гена согласно настоящему изобретению нуклеотидная последовательность согласно настоящему изобретению предпочтительно находится в подходящей экспрессирующей конструкции. Предпочтительно, в экспрессирующей конструкции нуклеотидная последовательность согласно настоящему изобретению функционально связана с промотором. Использованный в настоящем описании термин "функционально связанный" означает функциональное связывание между регуляторной последовательностью, регулирующей экспрессию нуклеиновой кислоты (например, промотором, сигнальной последовательностью или последовательностью в сайте связывания фактора, регулирующего транскрипцию), и другими последовательностями нуклеиновых кислот, и регуляторная последовательность, таким образом, регулирует транскрипцию и/или трансляцию других последовательностей нуклеиновых кислот. В настоящем изобретении, промотор, который связан с нуклеотидной последовательностью согласно настоящему изобретению, может функционировать, предпочтительно, в клетках животных и, предпочтительнее, в клетках млекопитающих, регулируя транскрипцию гена релаксина, и включает, но не ограничивается ими, промотор, полученный из вируса млекопитающих, и промотор, полученный из генома клеток млекопитающих, такой как промотор цитомегаловируса (CMV) млекопитающих, поздний промотор аденовируса, промотор 7,5К вируса осповакцины, промотор SV40, промотор tk HSV, промотор RSV, промотор EF1 альфа, промотор металлотионеина, промотор бета-актина, промотор человеческого гена IL-2, промотор человеческого гена IFN, промотор человеческого гена IL-4, промотор человеческого гена лимфотоксина, промотор человеческого гена GM-CSF и промотор U6.
Система доставки гена согласно настоящему изобретению может быть сконструирована в различных формах, которые представляют собой (i) «голую» рекомбинантную молекулу ДНК, (ii) плазмиду, (iii) вирусный вектор и (iv) форму липосомы или ниосомы, включающую «голую» рекомбинантную молекулу ДНК или плазмиду.
Нуклеотидная последовательность согласно настоящему изобретению может применяться с использованием системы доставки целых генов, используемой для обычной генной терапии. Предпочтительно, нуклеотидная последовательность согласно настоящему изобретению может применяться с использованием плазмиды, аденовируса (Lockett LJ, et al., Clin. Cancer Res. 3:2075-2080(1997)), адено-ассоциированного вируса (AAV, Lashford LS., et al., Gene Therapy Technologies, Applications and Regulations Ed. A. Meager, 1999), ретровируса (Gunzburg WH, et al., Retroviral vectors. Gene Therapy Technologies, Applications and Regulations Ed. A. Meager, 1999), лентивируса (Wang G. et al., J. Clin. Invest. 104(11):R55-62(1999)), вируса простого герпеса (Chamber R., et al., Proc. Natl. Act. Sci USA 92:1411-1415(1995)), вируса осповакцины (Puhlmann М. et al., Human Gene Therapy 10:649-657(1999)), липосом (Metho s in Molecular Biology, Vol 199, S.C. Basu and M. Basu (Eds.), Human Press 2002) или ниосом.
Предпочтительнее, нуклеотидные последовательности согласно настоящему изобретению доставляют с использованием катионной липосомы.
В соответствии с другим аспектом настоящего изобретения, настоящее изобретение предусматривает способ предотвращения или лечения заболевания, ассоциированного с инфекцией HPV, где способ включает введение субъекту фармацевтической композиции, включающей: (а) фармацевтически эффективное количество одной или нескольких нуклеотидных последовательностей, выбранных из группы, состоящей из последовательностей SEQ ID No: 16, 22, 28, 34, 40, 66, 72, 84, 90 и 108, и соответствующих антисмысловых нуклеотидных последовательностей; и (b) фармацевтически приемлемый носитель.
В соответствии с другим аспектом настоящего изобретения, настоящее изобретение предусматривает способ предотвращения или лечения заболевания, ассоциированного с инфекцией HPV, где способ включает введение субъекту фармацевтической композиции, включающей: (а) фармацевтически эффективное количество одной или нескольких нуклеотидных последовательностей, выбранных из группы, состоящей из последовательностей SEQ ID No: 1, 7, 12, 16, 22, 28, 34, 40, 46, 51, 56, 62, 66, 72, 78, 84, 90, 96, 102 и 108, и соответствующих антисмысловых нуклеотидных последовательностей, которые имеют модифицированный остов или одно или несколько модифицированных оснований; и (b) фармацевтически приемлемый носитель.
В соответствии с другим аспектом настоящего изобретения, настоящее изобретение предусматривает способ предотвращения или лечения заболевания, ассоциированного с инфекцией HPV, где способ включает введение субъекту фармацевтической композиции, включающей: (а) фармацевтически эффективное количество пула нуклеотидов, выбранного из группы, состоящей из: пула, имеющего нуклеотидные последовательности SEQ ID No: 2, 4, 8, 9, 12 и 15; пула, имеющего нуклеотидные последовательности SEQ ID No: 18, 21, 29 и 32; пула, имеющего нуклеотидные последовательности SEQ ID No: 42, 45, 52 и 55; пула, имеющего нуклеотидные последовательности SEQ ID No: 58, 59, 63 и 65; пула, имеющего нуклеотидные последовательности SEQ ID No: 68, 71, 91 и 94; и пула, имеющего нуклеотидные последовательности SEQ ID No: 98, 100, 109 и 112; и (b) фармацевтически приемлемый носитель.
Поскольку в способе согласно настоящему изобретению применяется описанная выше композиция, свойства, общие для композиции и способа, повторно не описаны, чтобы избежать чрезмерной сложности описания.
Полезные эффекты изобретения
Признаки и преимущества настоящего изобретения могут быть кратко сформулированы следующим образом:
(а) настоящее изобретение предусматривает композицию для предотвращения или лечения заболевания, ассоциированного с инфекцией вирусом папилломы человека (HPV), более конкретно, рака, ассоциированного с инфекцией HPV, и еще более конкретно, рака шейки матки;
(b) нуклеотидная последовательность согласно настоящему изобретению, последовательность, имеющая модификацию основания в нуклеотидной последовательности, и их конкретная комбинация значительно ингибируют экспрессию генов Е6/Е7 вирусов HPV типа 16 или HPV типа 18 и, таким образом, могут использоваться в композиции или способе для эффективного лечения заболевания, ассоциированного с инфекцией HPV.
Краткое описание графических материалов
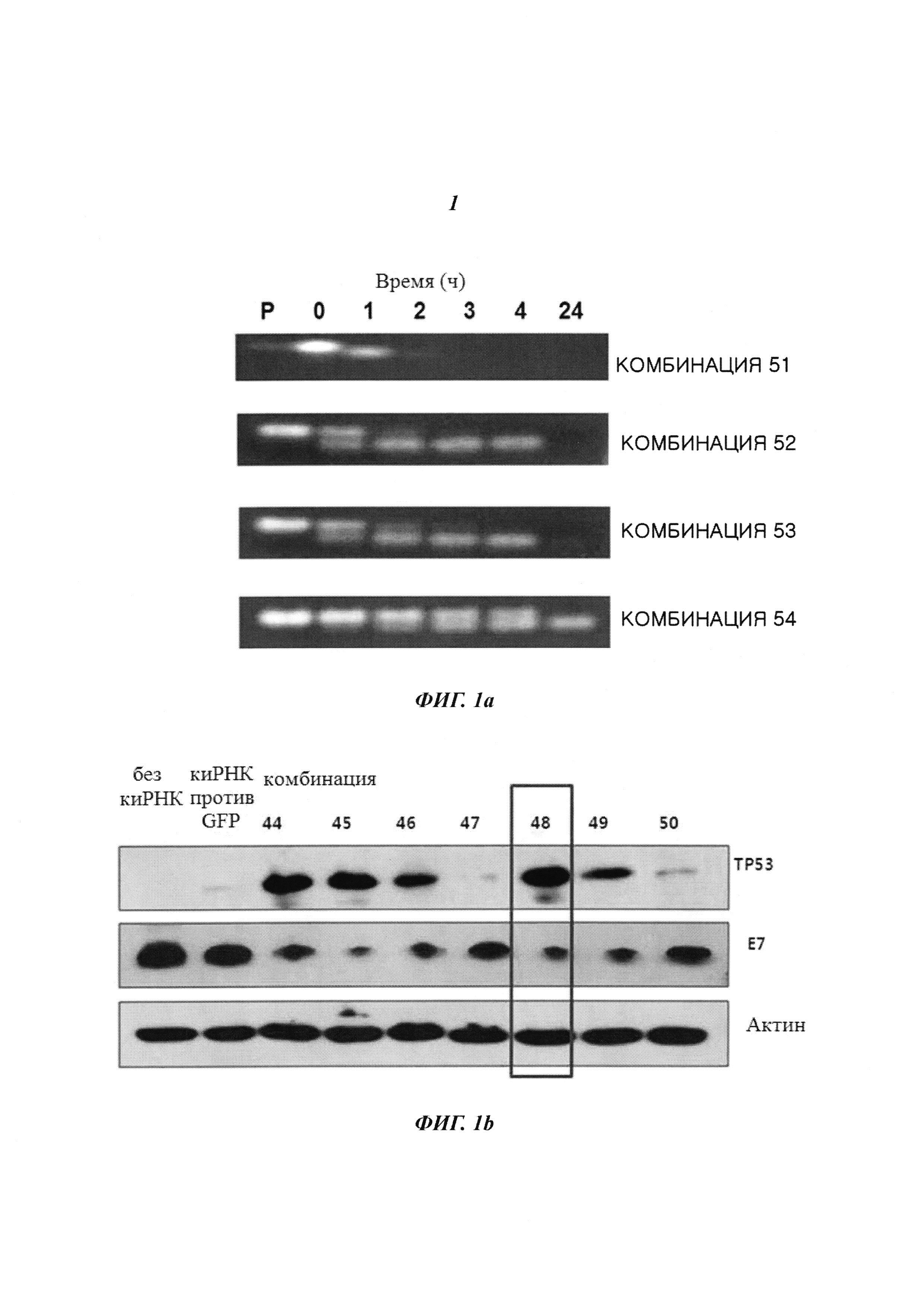
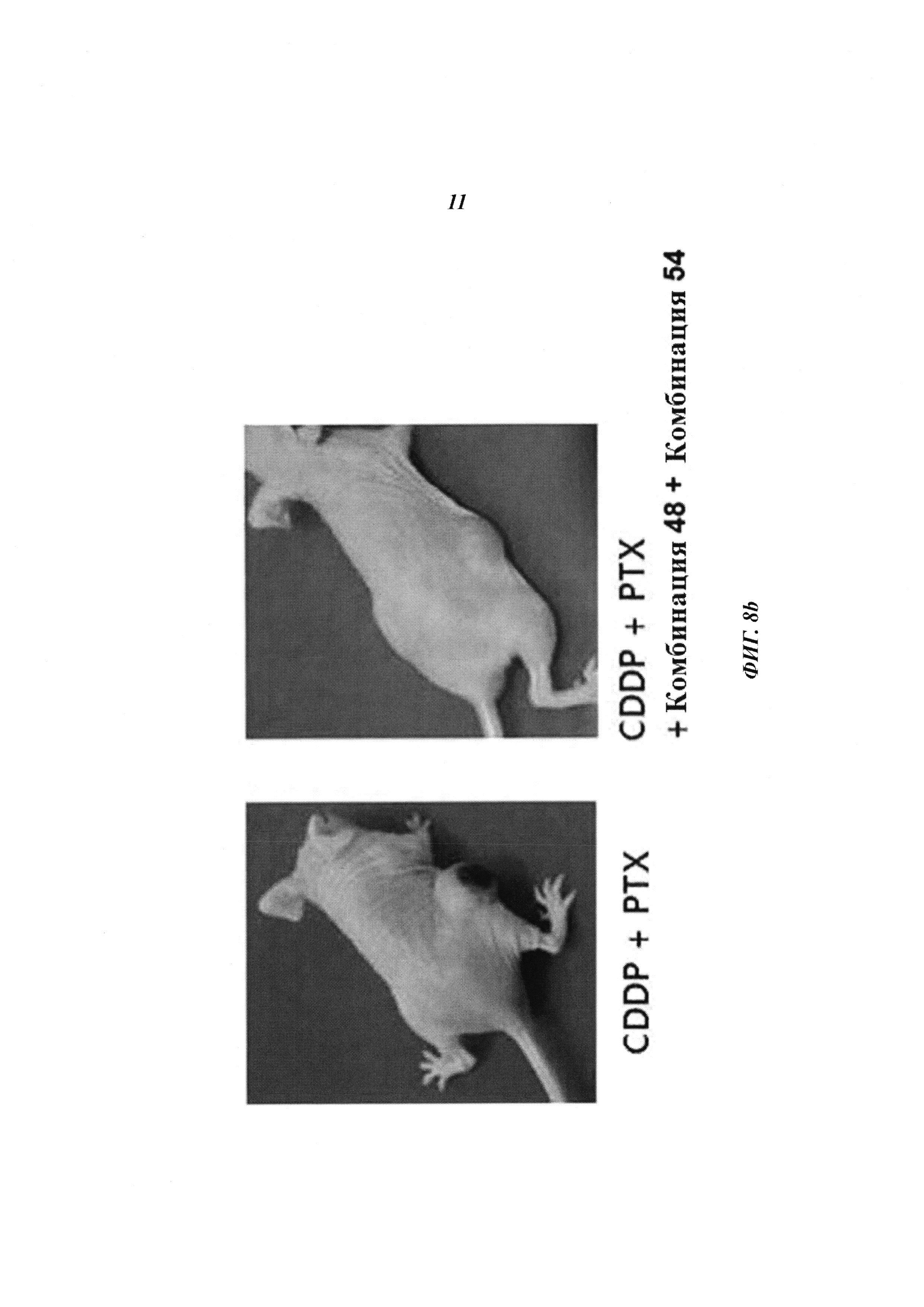
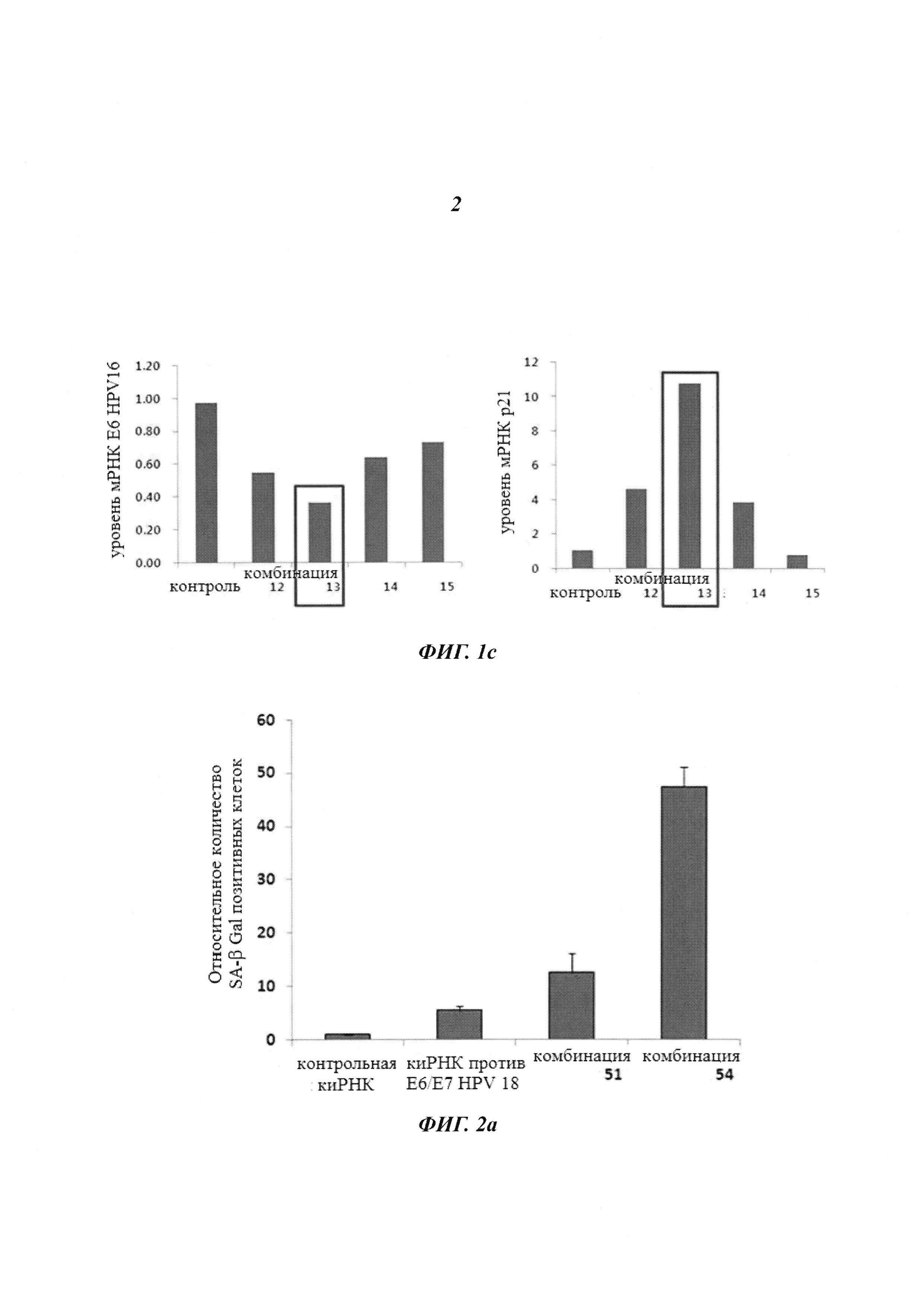
На Фиг. 1 приведены изображения, показывающие результаты, которые подтверждают улучшение стабильности (Фиг. 1а), увеличение эффекта на уровне молекул белка (Фиг. 1b) и увеличение эффекта на уровне молекул мРНК (Фиг. 1с) при модификации в последовательности оснований в киРНК к HPV 16 и 18 типов, представляющей собой замену остатка.
На Фиг. 2 приведены изображения, показывающие результаты, которые подтверждают превосходный эффект индуцирования старения клеток (Фиг. 2а) и превосходный эффект уничтожения клеток (Фиг. 2b) с помощью киРНК, имеющей замену остатка в последовательности оснований HPV типа 18.
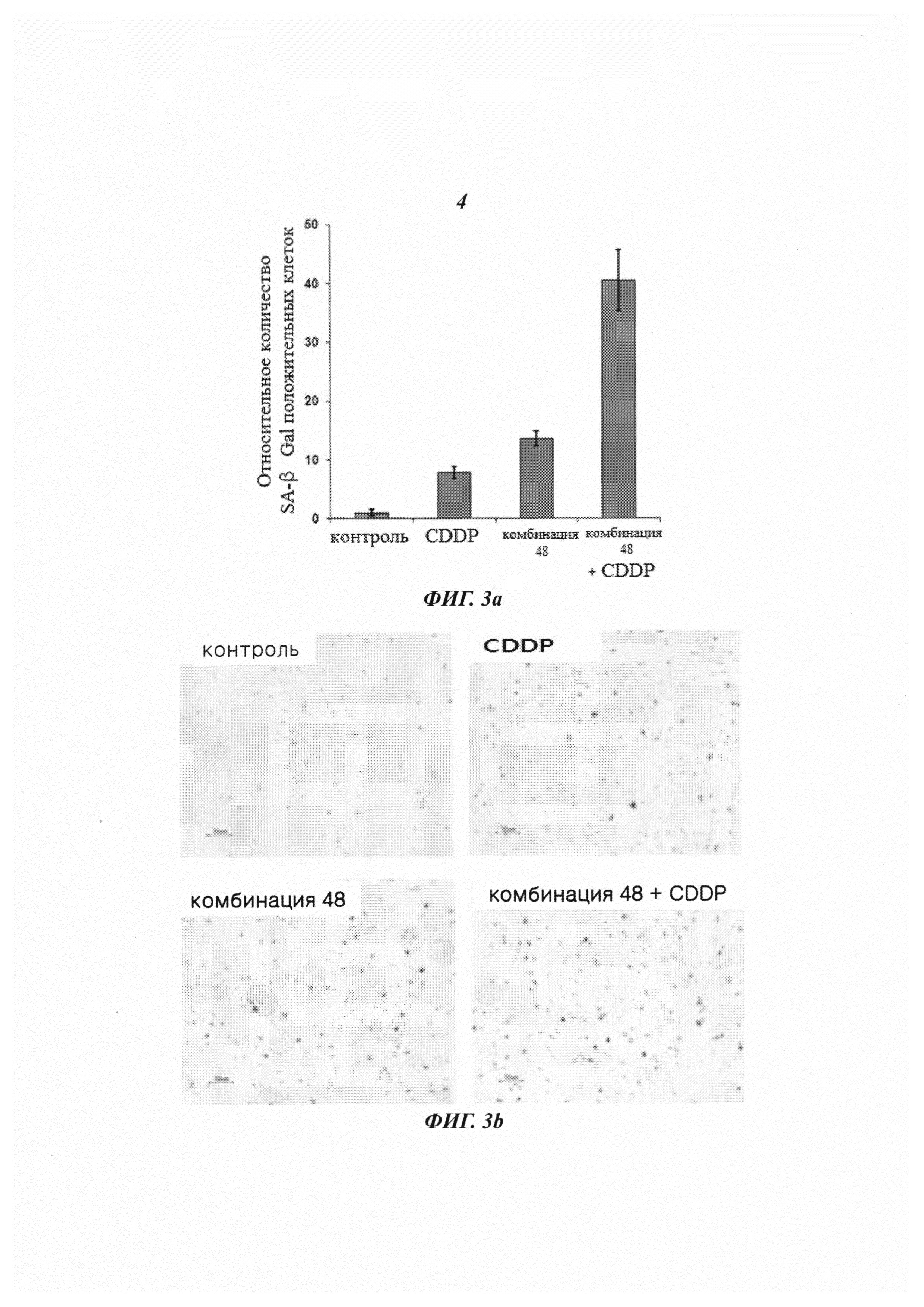
На Фиг. 3 приведены изображения, демонстрирующие эффект индуцирования старения клеток комбинированной обработкой противораковым агентом, цисплатином, и киРНК 426, имеющей замену в последовательности оснований, в линии клеток HeLa рака шейки матки, инфицированных вирусом HPV типа 18 (Фиг. 3а), и наблюдаемый посредством микроскопирования результат указанной обработки (Фиг. 3b).
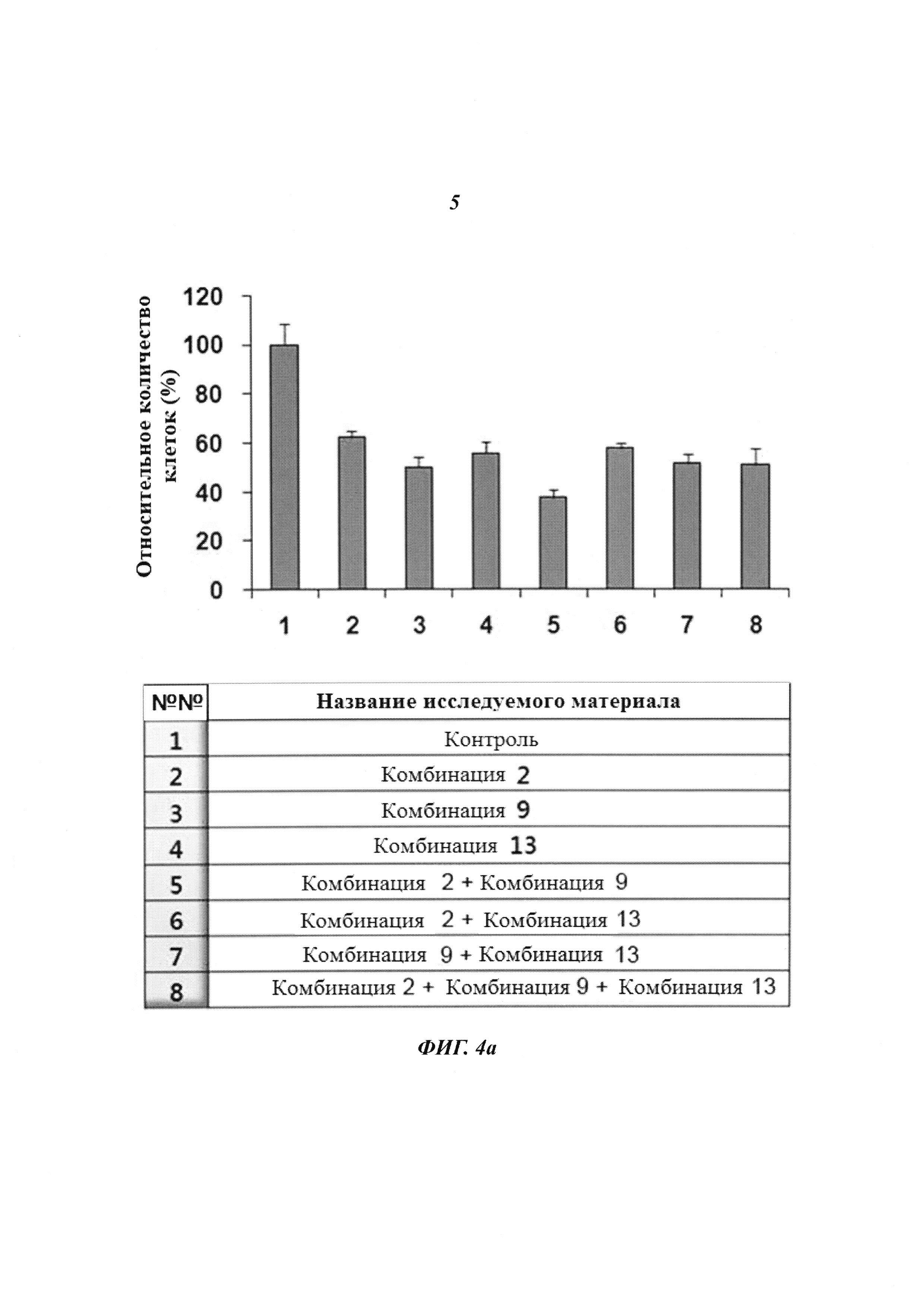
На Фиг. 4 приведены изображения, демонстрирующие результаты, которые подтверждают терапевтический эффект пула киРНК, имеющих замену в последовательности оснований HPV типов 16 и 18, и синергический эффект при комбинированной терапии с цисплатином. Фиг. 4а, 4b и 4с, соответственно, демонстрируют эффект ингибирования пролиферации клеток, эффект уничтожения клеток и эффект на уровне белка.
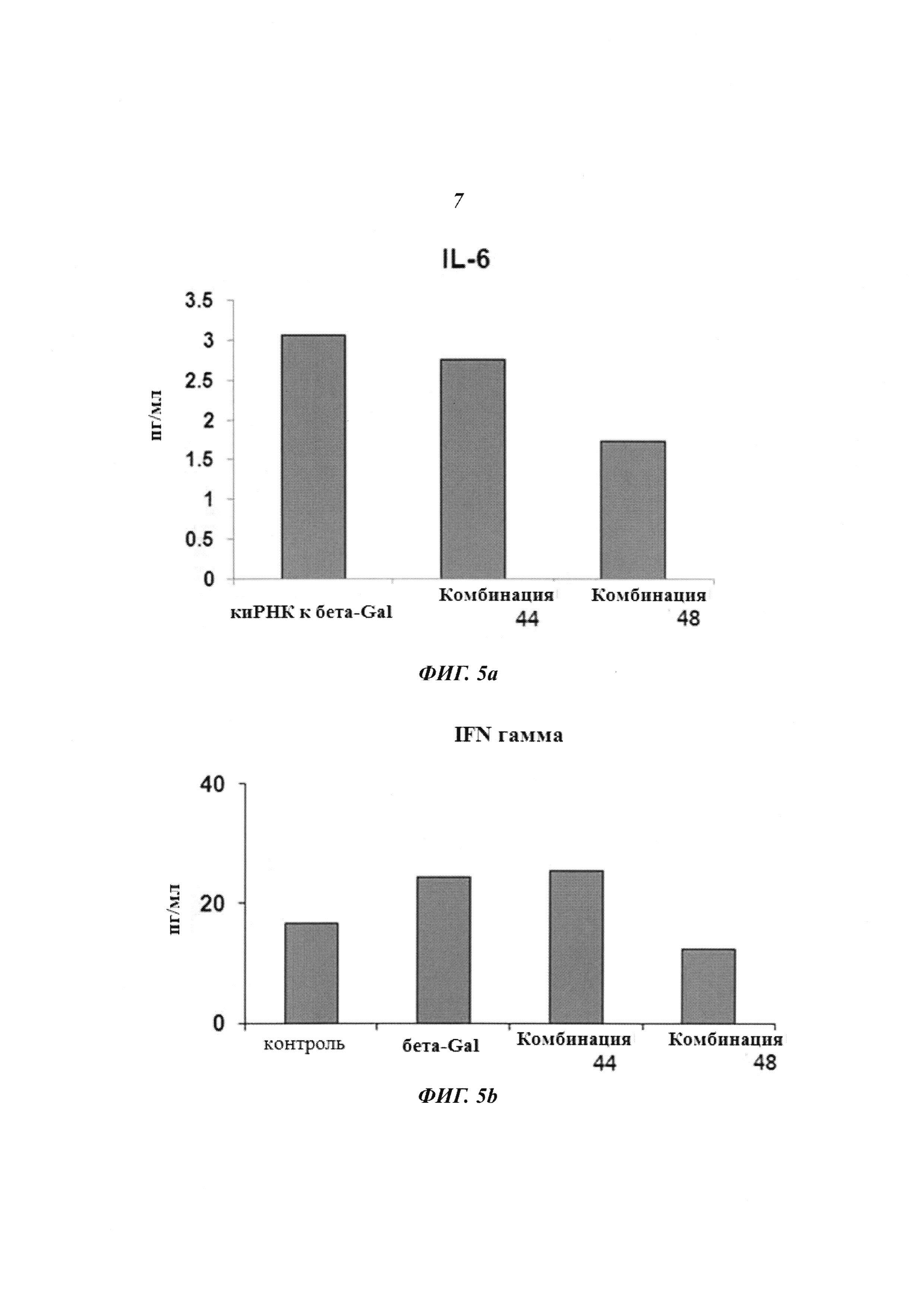
На Фиг. 5 приведено изображение, демонстрирующее результаты проверки наличия побочного эффекта киРНК против НРV типа 18 в клетках и на животных. Фиг. 5а и 5b, соответственно, демонстрируют эффект снижения уровня IL-6 в клетках и эффект снижения уровня IFN-гамма на животных.
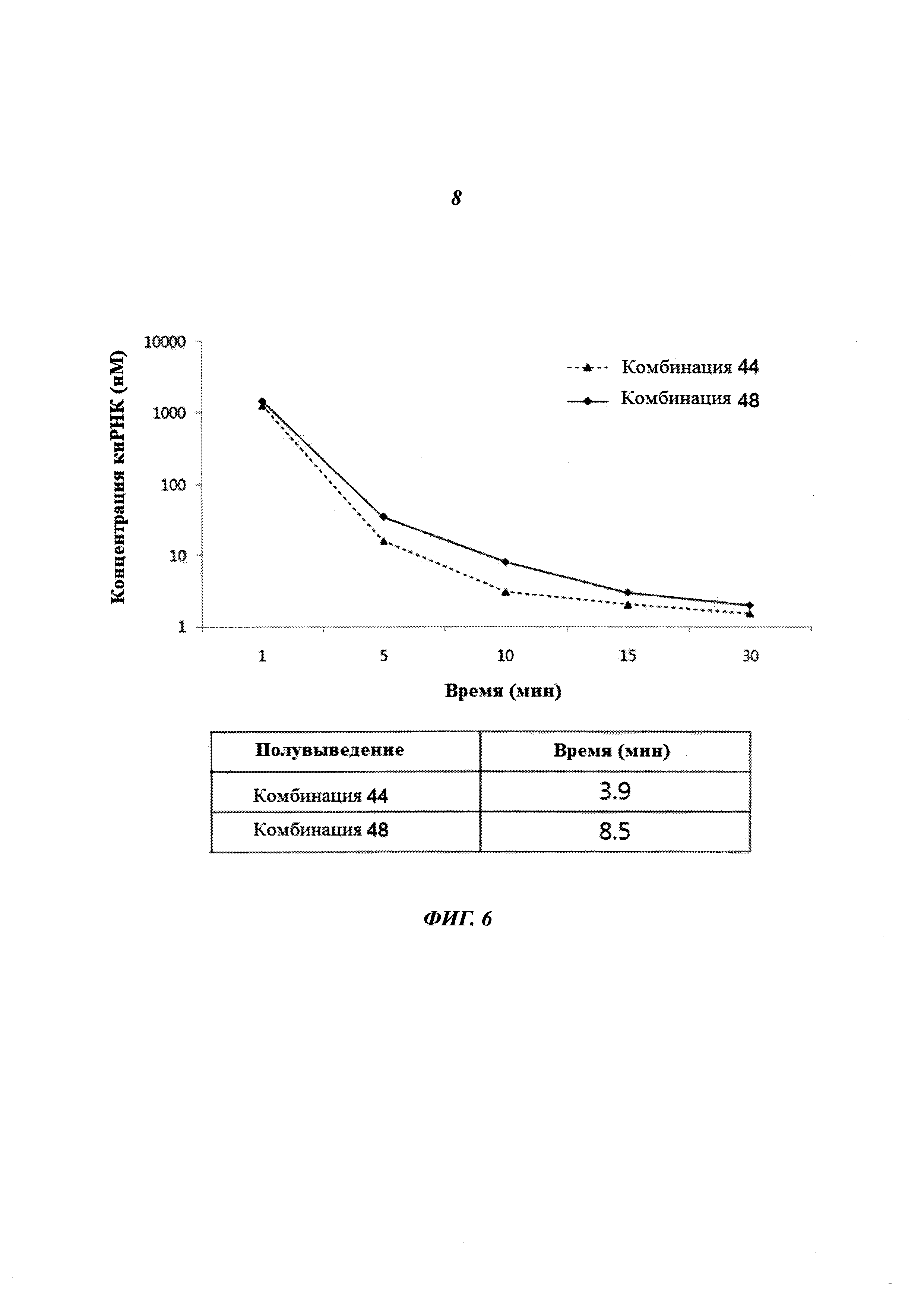
На Фиг. 6 приведено изображение, демонстрирующее результаты количественного определения киРНК 426 против HPV типа 18 с помощью ПЦР в реальном времени с образованием структуры стебель-петля.
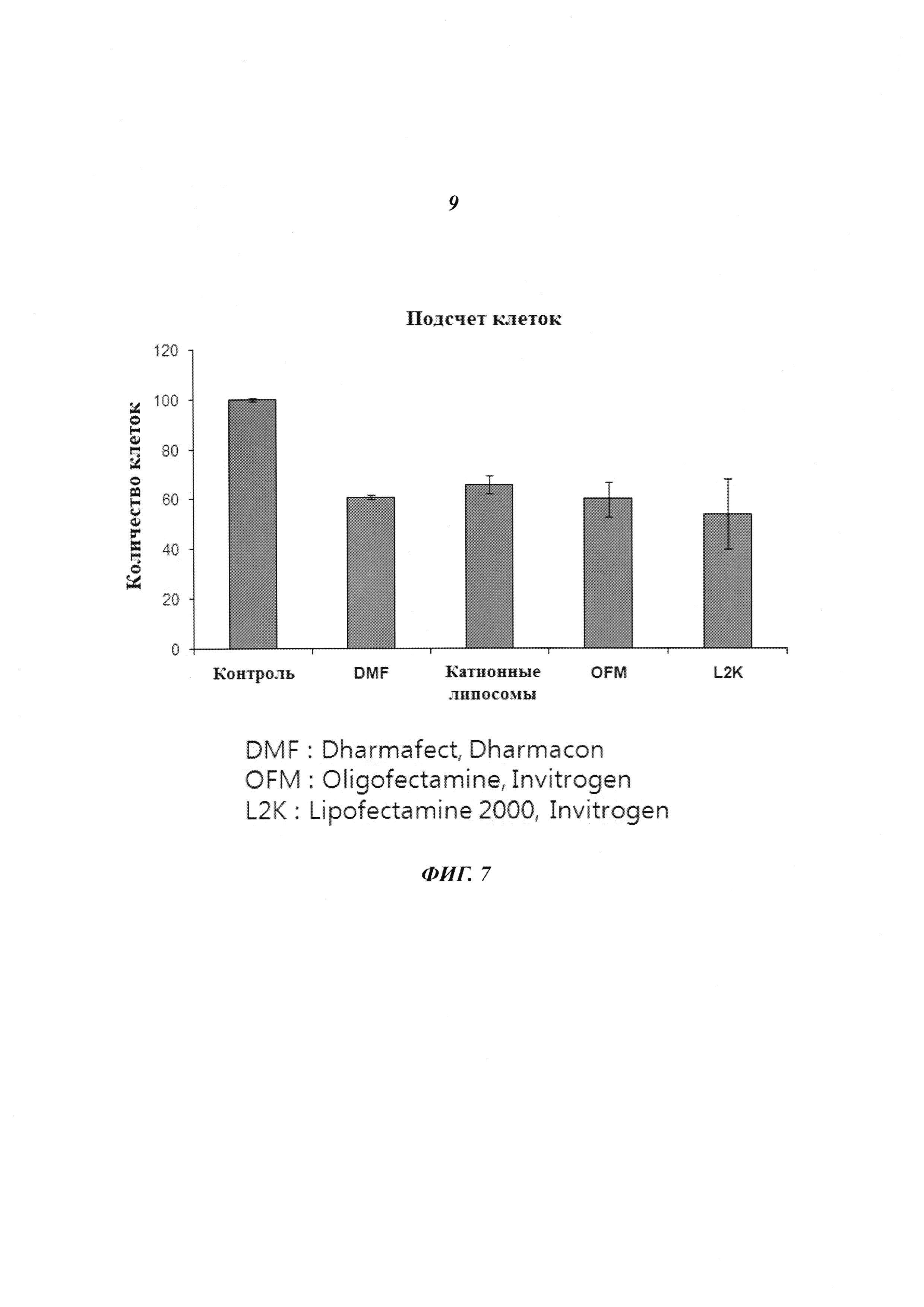
На Фиг. 7 приведено изображение, демонстрирующее результаты, которые подтверждают тот факт, что киРНК в различных типах липосом оказывают такой же эффект уничтожения клеток.
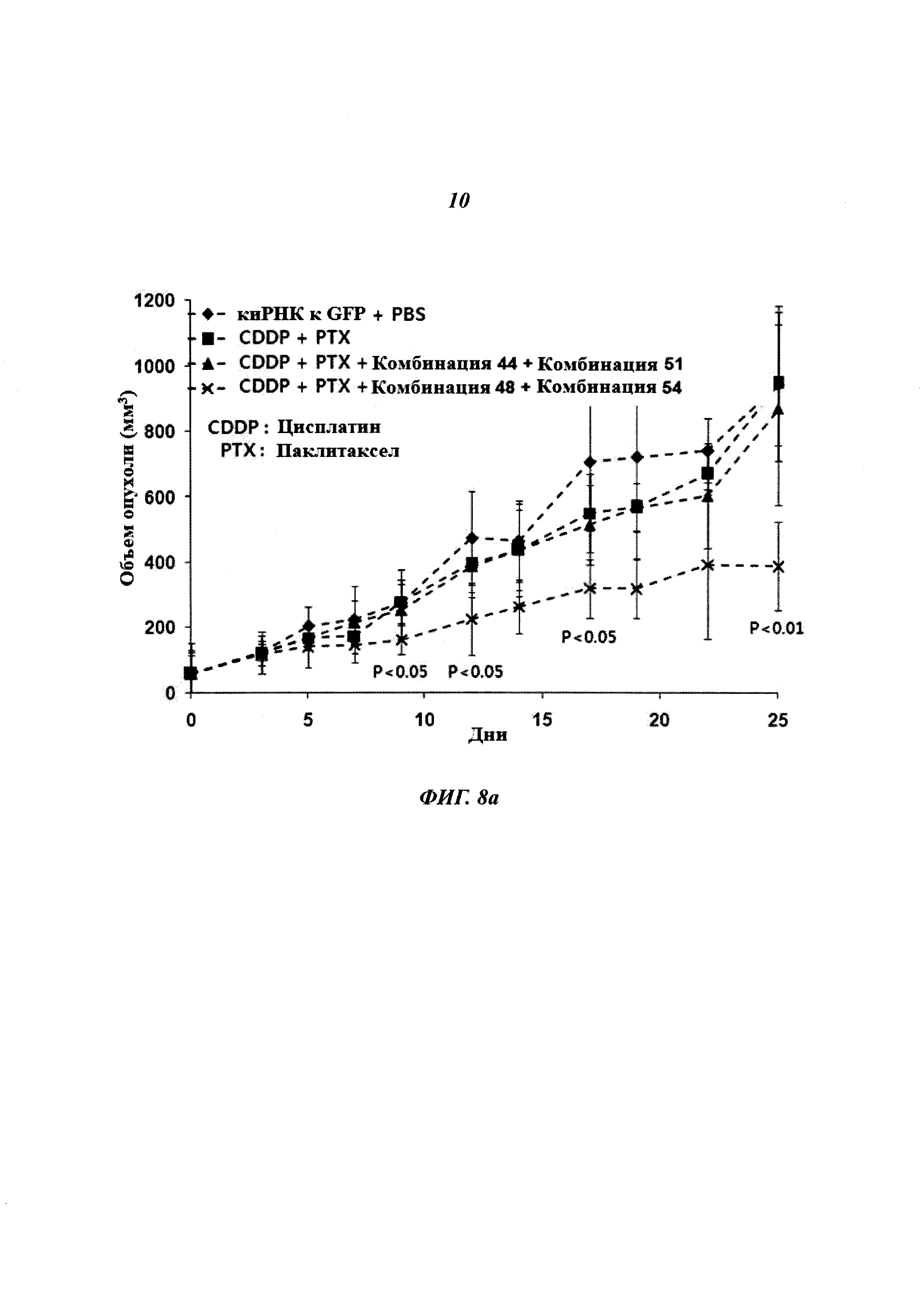
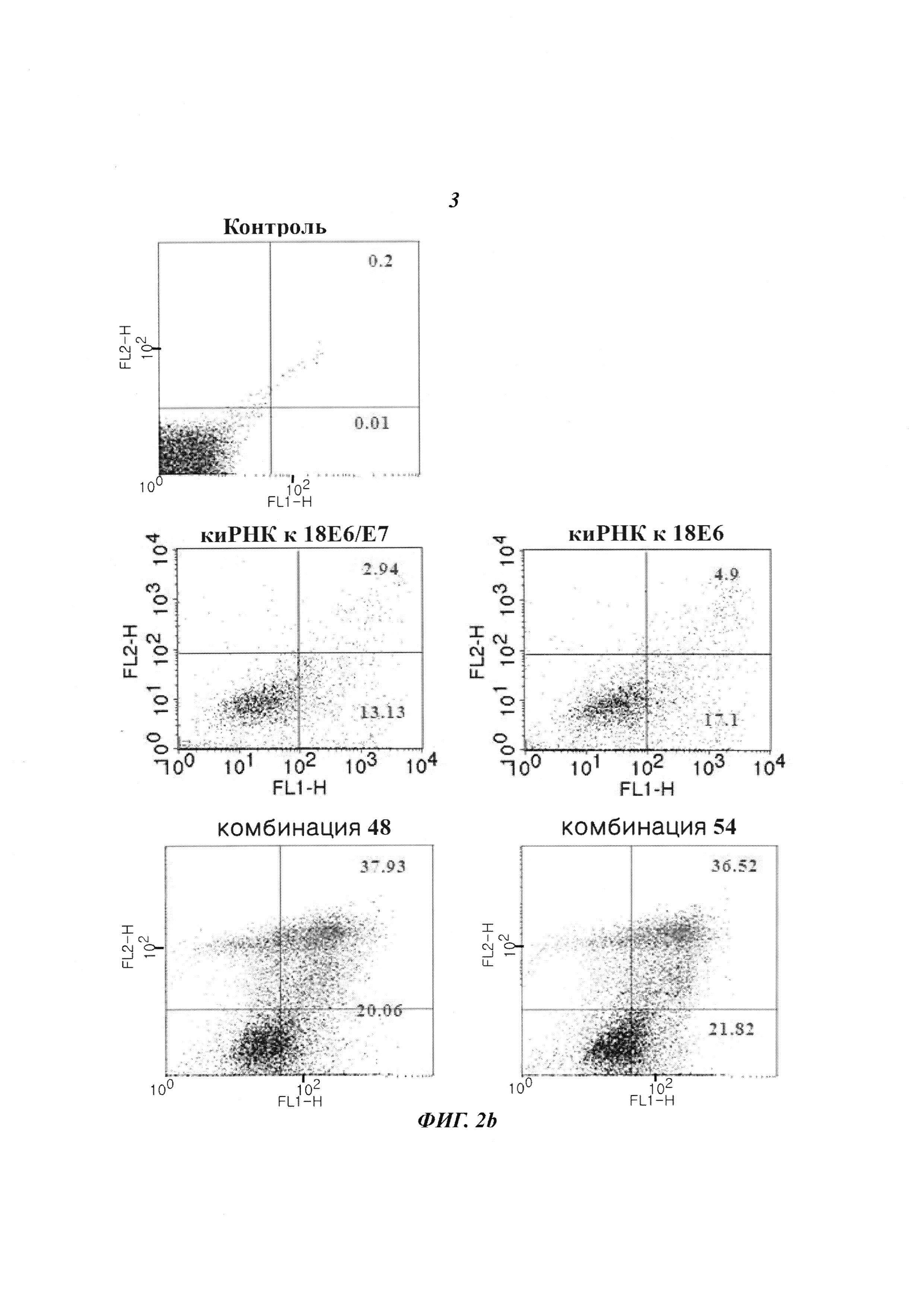
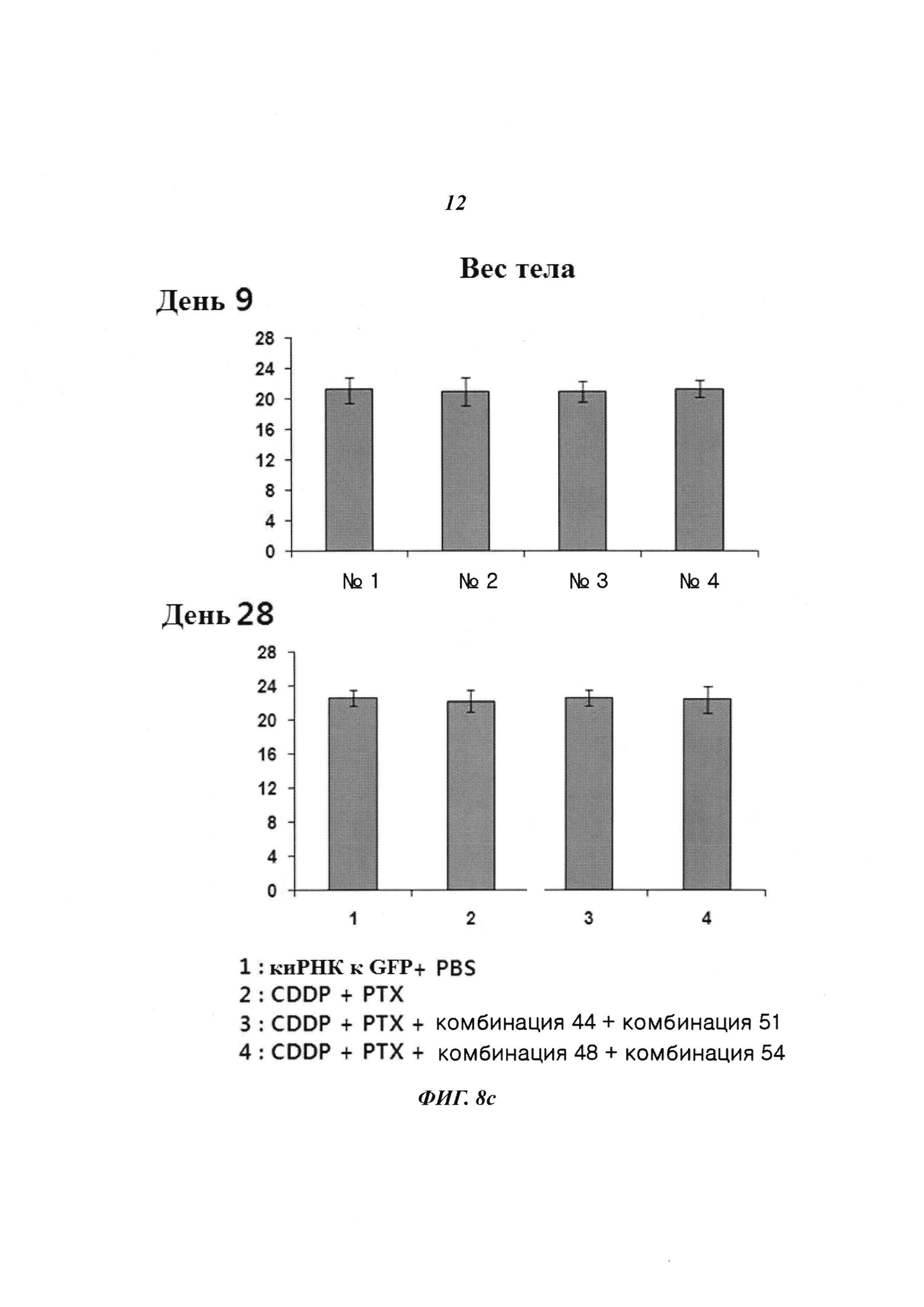
На Фиг. 8 приведены изображения, показывающие синергический эффект комбинированной обработки противораковым агентом и пулом киРНК, которые имеют замену в последовательности оснований и демонстрируют превосходный эффект в эксперименте на животных. На Фиг. 8а, 8b и 8с, соответственно, показано изменение размера опухоли у мышей, изображение опухолей у мышей и изменение веса тела мышей.
Описание примеров осуществления изобретения
Далее в этом описании настоящее изобретение будет описано более подробно со ссылкой на примеры. Эти примеры приведены только для иллюстративного описания настоящего изобретения, и для специалиста в данной области техники будет понятно, что объем настоящего изобретения в соответствии с существенными признаками настоящего изобретения не ограничен приведенными примерами.
ПРИМЕР
Методика эксперимента
Конструирование киРНК к HPV 16 и 18 типа
киРНК, приведенные в Таблицах 1 и 2 ниже, получены от корпорации Bioneer (Корея) по индивидуальному заказу. В таблице, приведенной ниже, подчеркнутая последовательность киРНК указывает на нуклеотид, замещенный на 2'-O-Ме модифицированный нуклеотид, в котором метильная группа связана с остатком основания, и выделенная жирным курсивом последовательность указывает на основание, замещенное на 2-F модифицированный нуклеотид, в котором гидроксильная группа остатка основания замещена на фтор.
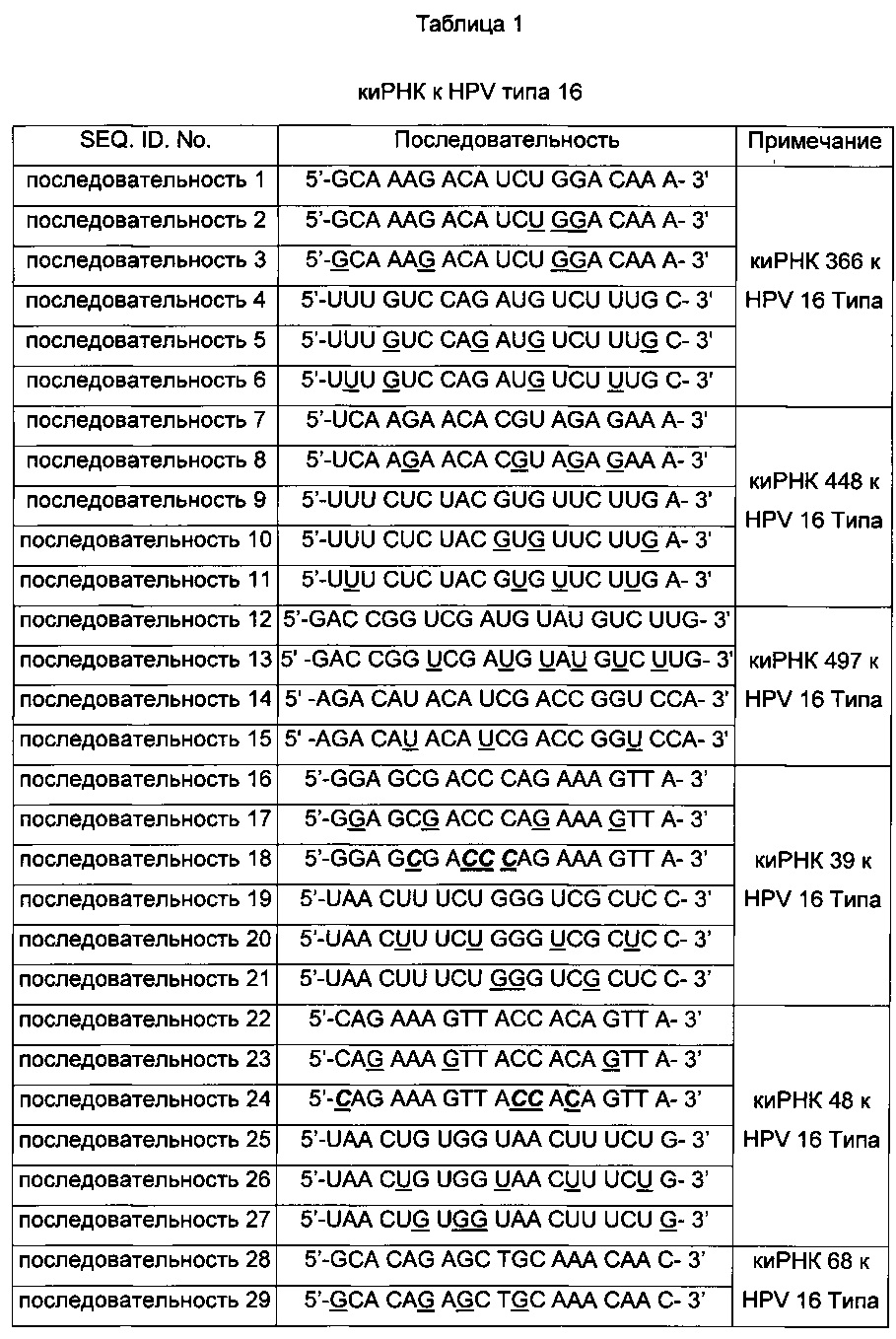

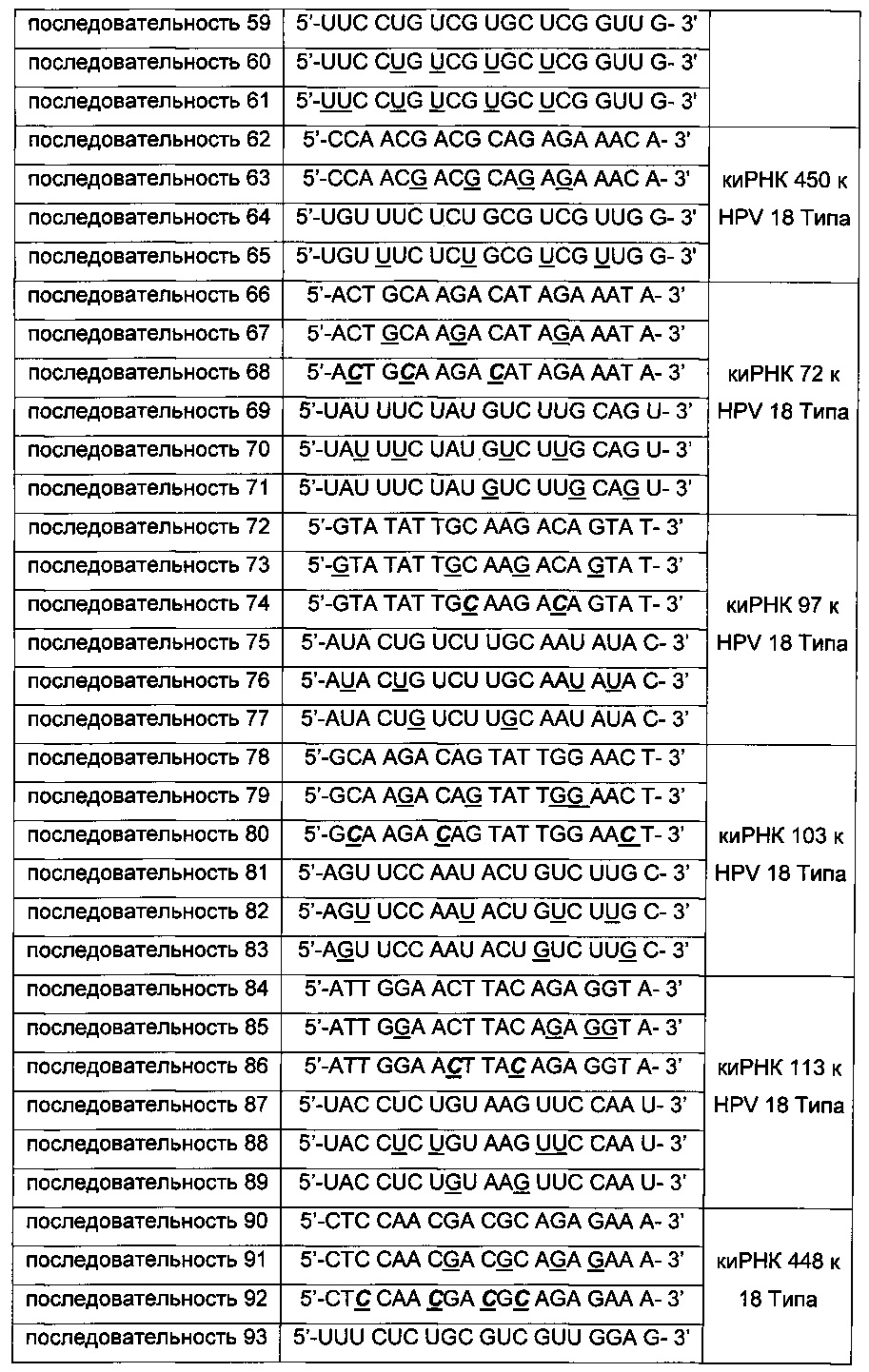
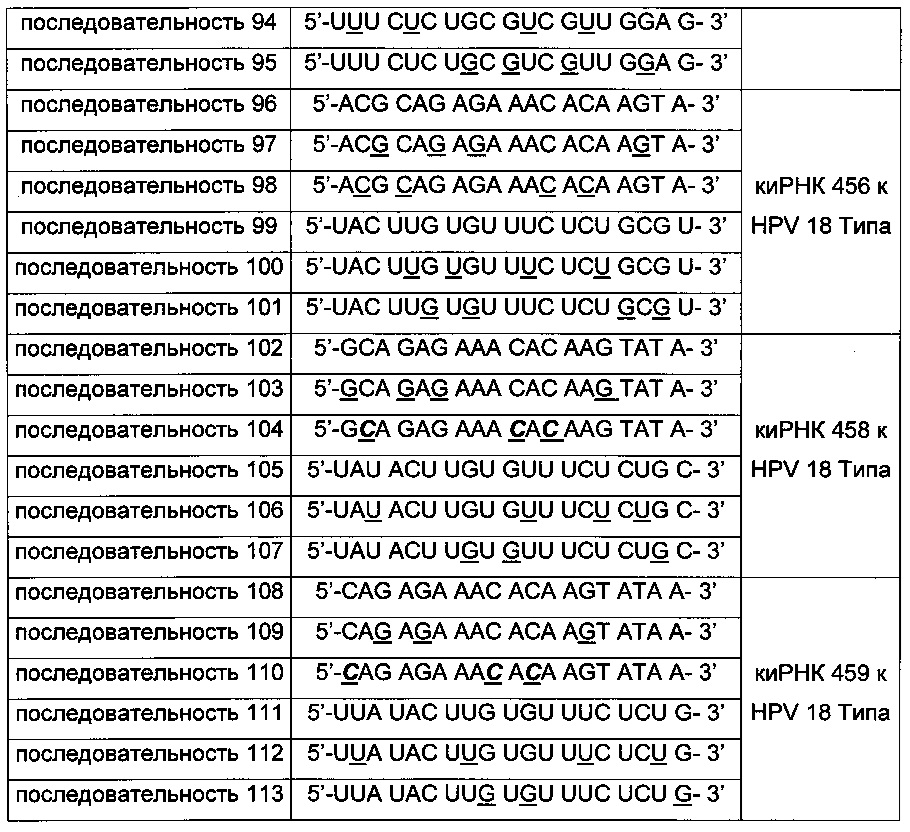
Оценка стабильности киРНК
киРНК смешивали с 10% фетальной бычьей сывороткой или 10% человеческой сывороткой и инкубировали при 37°С, образцы отбирали в ходе инкубации через определенные промежутки времени. Далее образцы быстро замораживали и хранили при -70°С. Собранные образцы подвергали электрофорезу в течение полутора часов в 12% полиакриламидном геле при 50 В с последующим окрашиванием Et-Br для измерения с помощью УФ-излучения.
Культура клеток и трансдукция киРНК
Клетки рака шейки матки, а именно клетки линии рака шейки матки HeLa (АТСС CCL-2), инфицированные вирусом НРV типа 18, или клетки линии рака шейки матки SiHa (АТСС НТВ-35) или CaSki (АТСС CRL-1550), инфицированные вирусом HPV типа 16, высевали на 6-луночный планшет в количестве 2×105 или 1,6×105 клеток, соответственно, и культивировали в среде RPMI1640 или DMEM, содержащей 10% фетальную бычью сыворотку, в течение 24 часов при 37°С и в атмосфере 5% СO2. После культивирования в течение 24 часов в среде для прикрепления клеток к поверхности культурального планшета клетки трансдуцировали немодифицированной киРНК в качестве контроля и олигонуклеотидом киРНК, модифицированным в соответствии со способом, описанным выше, в качестве экспериментального образца (20 нМ в каждом случае) с использованием DharmaFECT 1 (Dharmacon, USA), и обработанные клетки культивировали в течение 24 часов.
Обработка противораковым агентом
Клетки линии HeLa или Caski, которые высевали на 6-луночный планшет в количестве 2×105 или 1,5×105 клеток и далее культивировали в течение одного дня, как описано выше, трансдуцировали киРНК. Далее каждую трансдуцированную линию клеток обрабатывали цисплатином (CDDP) в конечной концентрации 2,5 мкМ и культивировали.
Измерение активности β-галактозидазы (SA-β-gal), ассоциированной со старением клетки
Клетки линии HeLa или Caski трансдуцировали киРНК или трансдуцировали киРНК в комбинации с обработкой противораковым агентом, как описано выше, и далее культивировали в течение одного дня. Использовали набор для анализа старения клеток (BioVision, USA), при этом клетки промывали PBS и обрабатывали окрашивающим раствором SA-β-gal в течение 12 часов при 37°С. Окрашенные синим клетки наблюдали с использованием обычного оптического микроскопа с увеличением 100-200 раз.
Измерение гибели клеток с использованием проточной цитометрии
Клетки линии HeLa или Caski трансдуцировали киРНК или трансдуцировали киРНК в комбинации с обработкой противораковым агентом, как описано выше, и далее культивировали в течение одного дня. Клетки окрашивали и подвергали взаимодействию с реагентами аннексином V и пропидий иодидом (PI) в течение 30 минут при комнатной температуре с использованием набора для анализа гибели клеток (BD, USA), и после этого гибель клеток оценивали с использованием проточной цитометрии.
Исследование эффекта киРНК
Клетки линии HeLa или Caski трансдуцировали киРНК или трансдуцировали киРНК в комбинации с обработкой противораковым агентом, как описано выше, и далее культивировали в течение одного дня. Для наблюдения изменений уровня белка клетки разрушали, добавляя буфер RIPA для лизиса клеток [150 мМ NaCl, 10 мМ Tris-HCl (рН 7.4), 5 мМ EDTA, 0,1% SDS, 0,5% дезоксихолат и 1% NP-40]. Далее изменение уровня белка исследовали с помощью обычного метода вестерн-блоттинга. Использовали мышиные антитела против ТР53, Е7 и актина, которые приобретали у Santa Cruz (USA) и разбавляли 1:1000. Использовали козьи антитела против мышиных IgG, конъюгированные с HRP, которые приобретали у Jackson Laboratories (USA) и разбавляли 1:3000.
Для исследования изменений уровня мРНК клетки разрушали, используя раствор Trizol (Invitrogen, USA), РНК очищали с использованием этанола и изменения уровня мРНК отслеживали с помощью обычного метода полимеразной цепной реакции (ПЦР) в реальном времени.
Исследование побочного эффекта киРНК
Клетки линии HeLa или Caski высевали на 6-луночный планшет и культивировали в среде RPMI1640 или DMEM, содержащей 10% фетальную бычью сыворотку, в течение 24 часов при 37°С и в атмосфере 5% СO2. Трансдуцировали киРНК к β-gal, которую использовали в качестве положительного контроля, и киРНК согласно изобретению, клетки культивировали и далее собирали среду для проведения обычного ELISA на IL-6 (BD, USA).
Мышам в возрасте 6 недель внутривенно инъецировали киРНК к β-gal в качестве положительного контроля, киРНК в качестве отрицательного контроля и киРНК, и обработку проводили в течение 6 часов. После этого у мышей собирали кровь, после чего для проведения ELISA на ИФН-гамма (BD, USA) отделяли сыворотку.
ПЦР в реальном времени с образованием структуры стебель-петля для количественного анализа киРНК
Крысе, имеющей вес примерно 260-300 г (в возрасте 4 недель), внутривенно вводили киРНК и далее кровь крысы собирали для отделения плазмы. Отделенную плазму разбавляли в буфере с 0,25% Triton Х-100. кДНК синтезировали с использованием набора Taqman microRNA Reverse Transcription (Applied Biosystem, USA) и киРНК количественно анализировали с помощью ПЦР в реальном времени.
Тестирование киРНК на животных
Самкам мышей, не имеющих волосяного покрова, ксенотрансплантировали 5×106 клеток HeLa, инфицированных HPV типа 18, и наличие раковых клеток оценивали через 10 дней. Далее 3 мг/кг киРНК внутривенно инъецировали в хвост с интервалом 2-3 дня. Цисплатин (2 мг/кг) и паклитаксел (4 мг/кг) повторно инъецировали 9 раз путем внутрибрюшинной инъекции с интервалом 3-4 дня. Размер опухоли измеряли с интервалом 2-3 дня.
Результат эксперимента
Различия в концентрации киРНК и количестве обработок киРНК
Для линий клеток Caski или HeLa, инфицированных HPV 16 или 18 типа, при осуществлении трансдукции киРНК и обработки противораковым агентом, по-отдельности или в комбинации, при использовании традиционной методики эффективность киРНК была показана при повторяющейся обработке киРНК в течение продолжительного периода времени при высокой концентрации (100 нМ), тогда как модифицированная киРНК согласно настоящему изобретению демонстрировала превосходную эффективность при монотерапии в течение короткого периода времени при низкой концентрации (20 нМ).
Тестирование стабильности киРНК, имеющей замену остатка
киРНК из комбинаций 51-54, полученные, как описано выше, смешивали с 10% человеческой сывороткой. Далее образцы каждой киРНК инкубировали при температуре 37°С, отбирая пробы с течением времени, которые хранили при -70°С. После этого осуществляли гель-электрофорез в 12% полиакриламидном геле. Гель окрашивали Et-Br и проводили измерения с помощью УФ-излучения. В результате, как показано на Фиг. 1а, киРНК комбинации 51, не имеющие замен остатков в последовательности оснований, исчезали через 2 часа, тогда как киРНК комбинаций 52-54, имеющие замену остатка в последовательности оснований, присутствовали, по меньшей мере, в течение 4 часов, что свидетельствовало о значительном повышении стабильности. В частности, комбинация 54 обладала наиболее заметной стабильностью, которая составляла более 24 часов.
Эффект киРНК, имеющей замену остатка, на молекулярном уровне
С использованием описанного выше способа на клетках линии HeLa проводили процедуру трансдукции комбинациями киРНК 44-50, без киРНК и киРНК к GFP и далее оценивали изменение уровней белков TP 53 и Е7, используя актин в качестве гена домашнего хозяйства, где комбинации киРНК 44-50 представляли собой киРНК к HPV типа 18, а образец без киРНК и киРНК к GFP использовали в качестве контролей. Как показано на Фиг. 1b, изменение уровня белков ТР53 и Е7 под действием комбинации 44 сравнивали с изменением уровня белков ТР53 и Е7 под действием комбинаций 45-50, где комбинация 44 не имеет замен остатков в последовательности оснований, а комбинации 45-50 имеют замены остатков в последовательности оснований. Было подтверждено, что эффективность комбинации 48, выражающаяся в увеличении экспрессии белка ТР53 и снижении экспрессии белка Е7, была наибольшей по сравнению с другими последовательностями.
Затем для киРНК 497 к HPV типа 16 линию клеток Caski трансдуцировали комбинациями 12-15, как описано выше, и далее для оценки уровней экспрессии мРНК Е6 и Р21 из клеток экстрагировали мРНК. В результате, как показано на Фиг. 1с, было подтверждено, что комбинация 13 снижала уровень мРНК Е6 на 60% или больше и увеличивала уровень мРНК р21 на 1100% или больше по сравнению с контролем, где комбинация 13 имеет замену остатка в последовательности оснований. Также было показано, что комбинация 13 превосходила последовательности из комбинации 12, которые не имели замен остатков в последовательности оснований.
Эффект индуцирования старения клеток под действием киРНК, имеющей замену остатка Измеряли активность SA β-Gal в линии клеток HeLA или Caski, которую обрабатывали, как описано выше. В результате, как показано на Фиг. 2а, в тех случаях, когда трансдуцировали киРНК к Е6/Е7 HPV 18 и комбинацию 51, активность SA-β Gal увеличивалась примерно в 10-20 раз, тогда как активность SA-β Gal в случае применения комбинации 54 увеличивалась в 50 раз или больше по сравнению с применением контрольной киРНК, где используемая киРНК к Е6/Е7 HPV 18 была раскрыта в предыдущем изобретении; комбинация 51 состояла из киРНК 450, не имеющих замен остатков в последовательности оснований; и комбинация 54 состояла из киРНК, имеющих замену остатка в последовательности оснований. Результаты показали, что эффект индуцирования старения клеток под действием комбинации 54, имеющей замену в последовательности оснований, был значительно лучше, чем в случае комбинации 51, не имеющей замены в последовательности оснований.
Эффект уничтожения клеток под действием киРНК, имеющей замену остатка
Эффект уничтожения клеток измеряли с использованием проточной цитометрии, как описано выше. В результате, при оценке эффекта уничтожения клеток под действием киРНК к Е6/Е7 HPV 18, к Е6 18, комбинации 48 и комбинации 54 (которые имеют замены остатков в последовательностях оснований) при сравнении с контролем было подтверждено, что для групп киРНК к Е6/Е7 HPV 18 и Е6 18 наблюдался только 15-20% эффект уничтожения клеток, тогда как в группах киРНК, имеющих замену остатка, наблюдался примерно 60% или больший эффект уничтожения клеток в сравнении с контролем (Фиг. 2b). Результаты показали, что последовательности киРНК, имеющее замену в последовательности оснований, демонстрируют более значительный эффект уничтожения клеток, чем обычная киРНК.
Эффект комбинированной обработки цисплатином и киРНК, имеющей замену остатка
В результате измерения активности SA β-Gal при обработке линии клеток HeLa цисплатином и комбинацией 48, имеющей замену остатка в последовательности оснований, как описано выше, как показано на Фиг. 3а и 3b, было показано, что в линиях клеток, обработанных только цисплатином и только комбинацией 48, соответственно, клетки окрашивались в синий цвет, что показывало активность SA β-Gal. Однако в группе с комбинированной обработкой комбинацией 48 и цисплатином большинство клеток окрашивались в темно-синий цвет, что свидетельствовало о высокой активности SA β-Gal. Результат показал, что для группы с комбинированной обработкой наблюдался гораздо более сильный эффект старения клеток по сравнению с группами, которые обрабатывали только киРНК или только цисплатином.
Эффект ингибирования пролиферации клеток при обработке киРНК по отдельности или при комбинированной обработке пулом киРНК
Клетки линии Caski, инфицированные HPV типа 16, обрабатывали 20 мМ комбинациями киРНК 2, 9 и 13 по отдельности, соответственно, как описано выше, где комбинации киРНК 2, 9 и 13 имеют замены в последовательностях оснований HPV типа 16, и линии клеток Caski, инфицированные HPV типа 16, трансдуцировали: пулом комбинации 2 и комбинации 9 (10 нМ, для каждой); пулом комбинации 2 и комбинации 13 (10 нМ, для каждой); пулом комбинации 9 и комбинации 13 (10 нМ, для каждой); и пулом комбинации 2, комбинации 9 и комбинации 13 (7 нМ, для каждой). Затем количество клеток измеряли через 24 часа. В результате, как показано на Фиг. 4а, пролиферация клеток снижалась аналогичным образом в группах, которые обрабатывали каждой киРНК, имеющей замену в последовательности оснований, по отдельности, и в группе, которую обрабатывали пулом киРНК. В частности, хотя каждую киРНК применяли в концентрации 7 нМ, для пула 3 типов киРНК наблюдали эффект, эквивалентный случаю, когда применяли 20 нМ каждой киРНК.
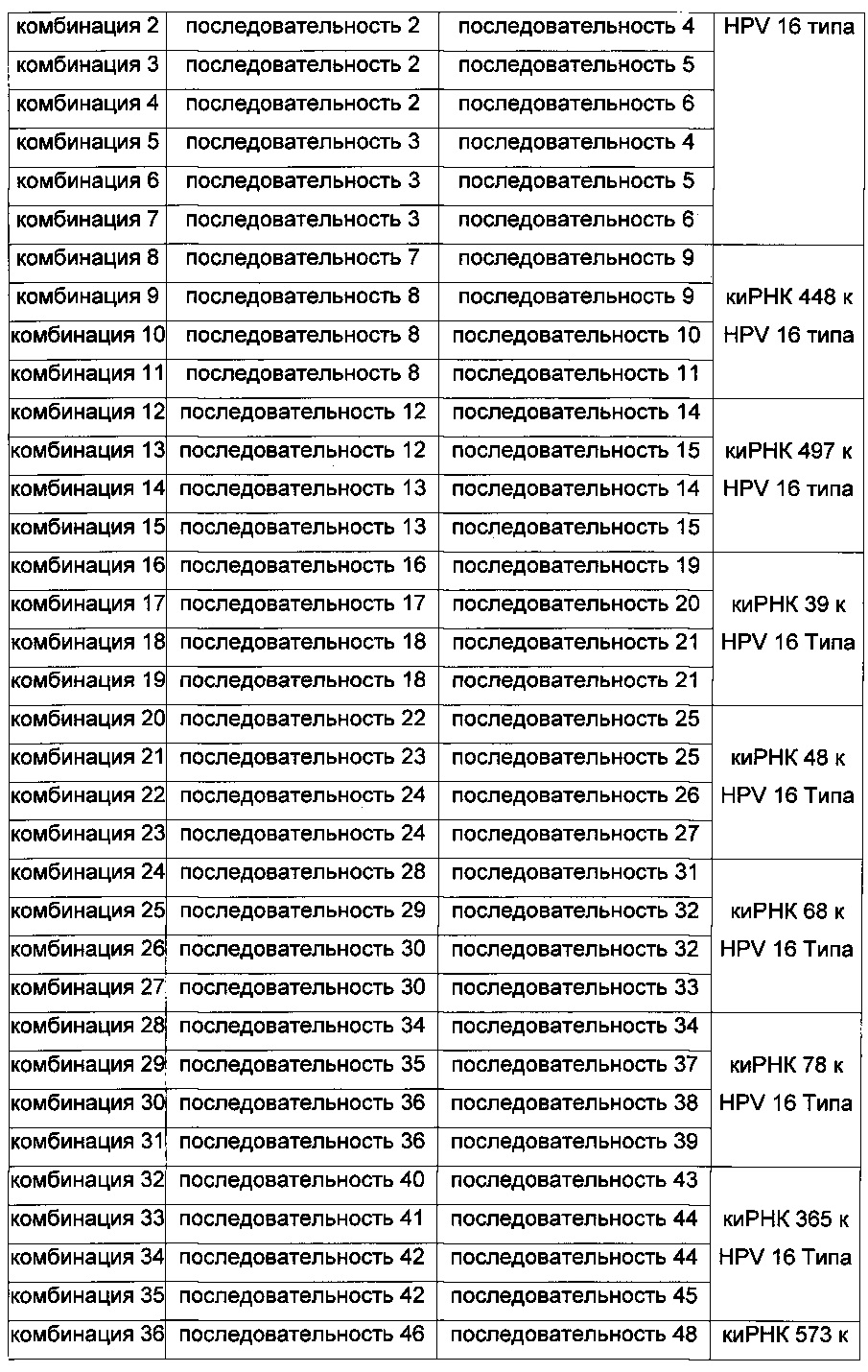
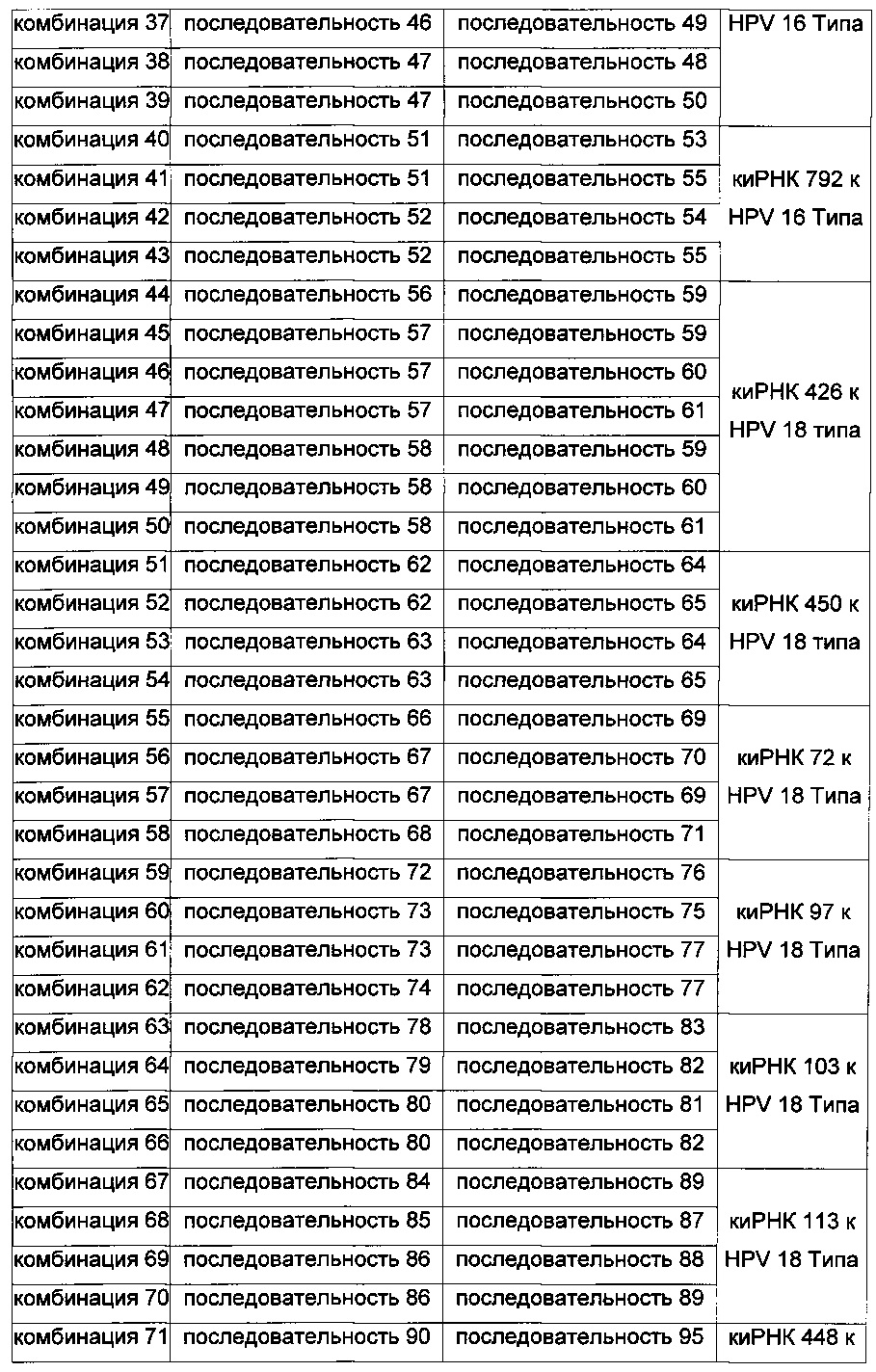
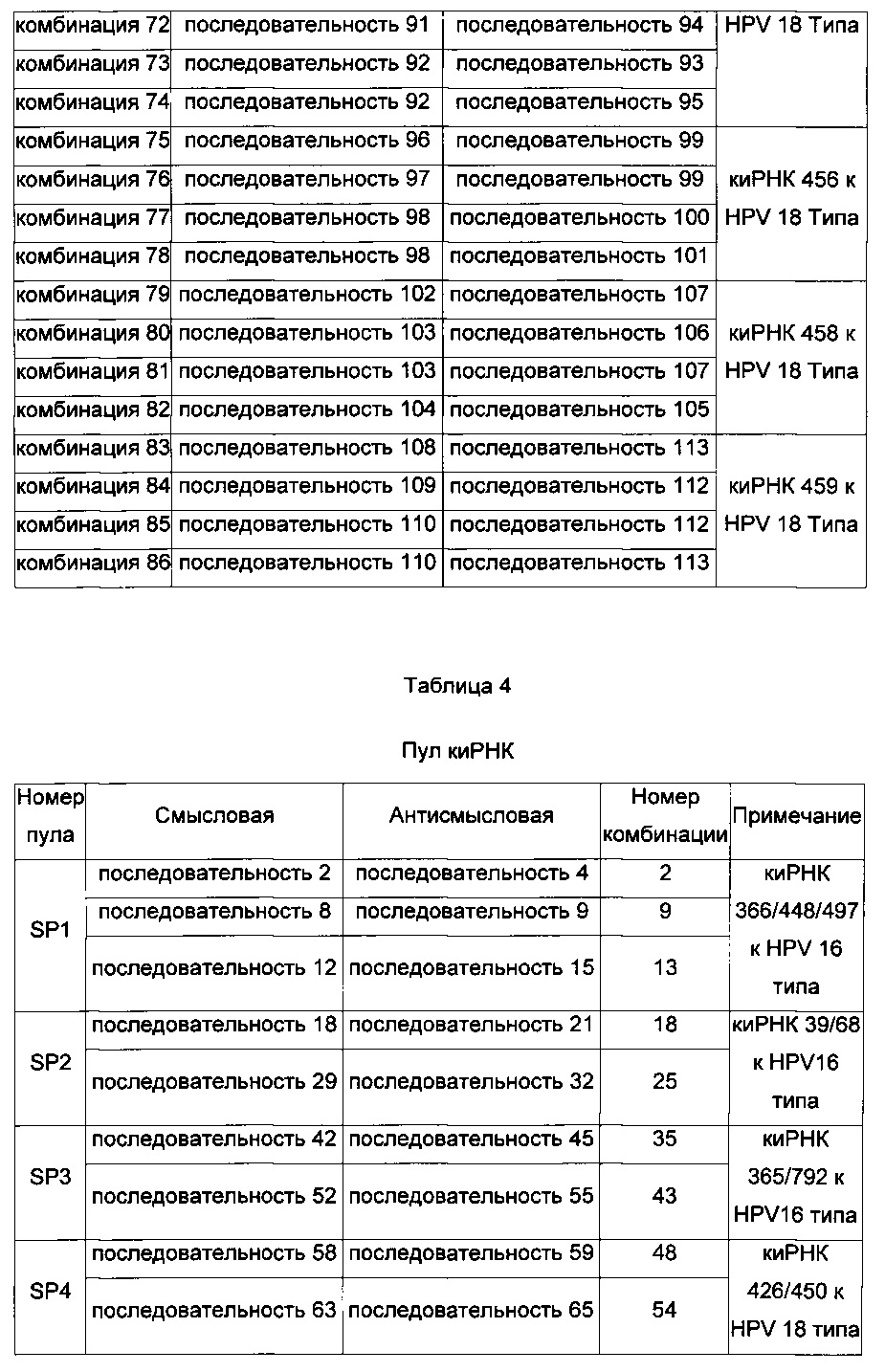
Комбинации пула киРНК, используемые в настоящем изобретении, приведены в Таблице 3 ниже, и пулы киРНК, которые приведены в Таблице 4 ниже, включают смеси двух или нескольких комбинаций, имеющих особенно высокий эффект ингибирования пролиферации клеток. 

Эффект уничтожения клеток при обработке киРНК по отдельности и комбинированной обработке пулом киРНК
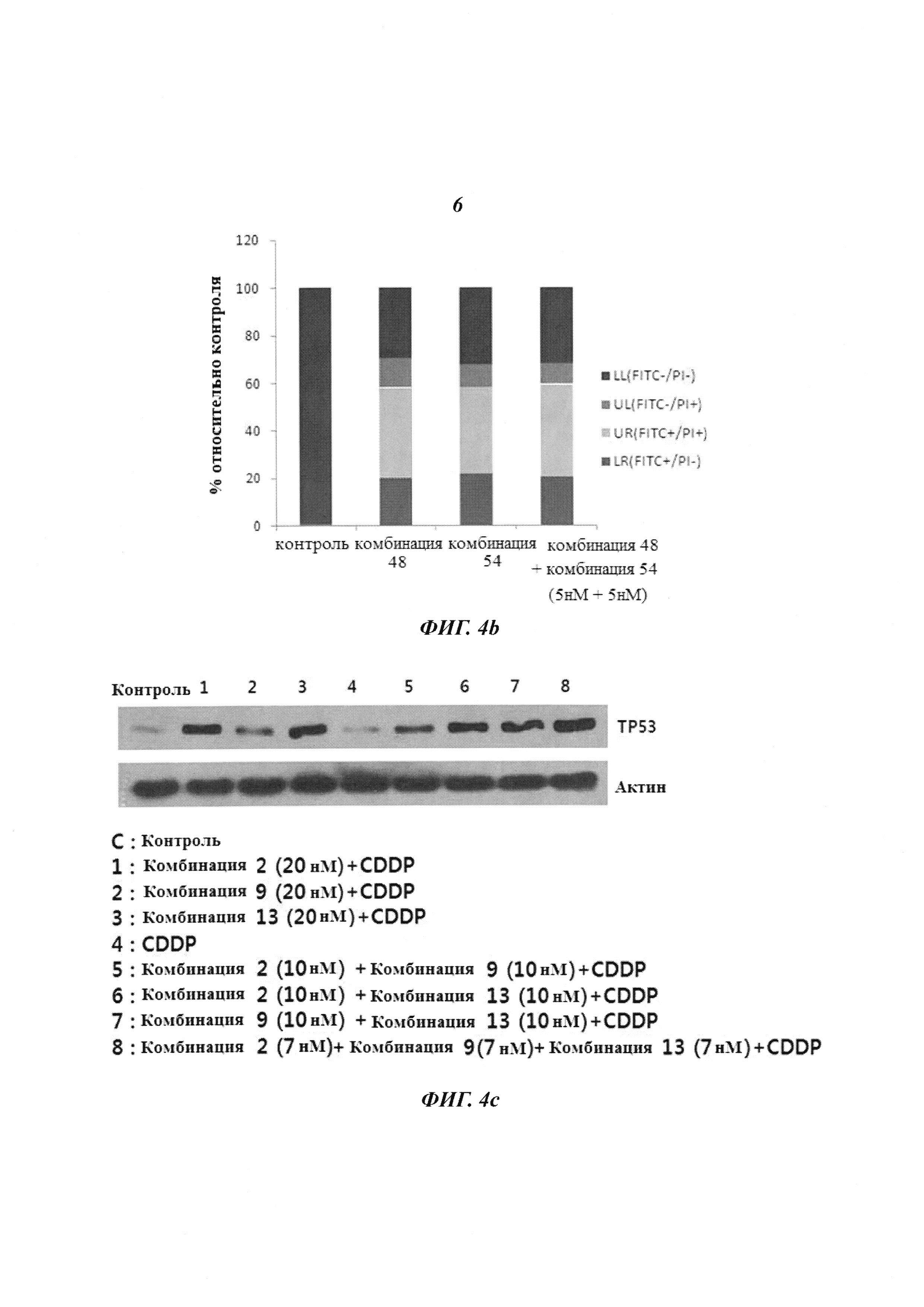
Клетки линии HeLa HPV типа 18 обрабатывали комбинацией 48 и комбинацией 54 (20 нМ, для каждой), как описано выше, где комбинация 48 и комбинация 20 имеют киРНК к HPV типа 18, имеющие замены в последовательности оснований, и трансдуцировали 10 нМ пула SP4, который представляет собой пул киРНК, включающий 5 нМ комбинации 48 и 5 нМ комбинации 54. Спустя 24 часа линию клеток окрашивали аннексином V и пропидий йодидом и измеряли эффект уничтожения клеток, используя проточную цитометрию. В результате, как показано на Фиг. 4b, в группах, которые обрабатывали киРНК, которая имеет замену в последовательности оснований, по отдельности, и в группах, которые обрабатывали пулом киРНК (SP4), наблюдается эффект уничтожения 80% или больше клеток. В результате, было подтверждено, что в группе, которую обрабатывали 20 нМ киРНК по отдельности, наблюдается такой же эффект уничтожения клеток, как в случае 10 нМ пула киРНК, что свидетельствует о том, что пул киРНК оказывает более сильный эффект.
Эффект пула киРНК при обработке по отдельности и комбинированной обработке на молекулярном уровне
Для сравнения уровня экспрессии белка ТР53 в линии клеток CaSki, инфицированной HPV типа 16, в группе с комбинированной обработкой цисплатином и комбинациями 2, 9, 13; в группе с обработкой только цисплатином; в группе с комбинированной обработкой цисплатином и комбинациями 2 и 9; в группе с комбинированной обработкой цисплатином и комбинациями 2 и 13; в группе с комбинированной обработкой цисплатином и комбинациями 9 и 13; и в группе с комбинированной обработкой цисплатином и пулом SP1 (пул комбинации 2, комбинации 9 и комбинации 13), где комбинации 2, 9 и 13 имеют замену в последовательности оснований, использовали метод вестерн-блоттинга. В результате, как показано на Фиг. 4С, среди групп с комбинированной обработкой пулами киРНК и цисплатином наибольшее увеличение уровня экспрессии белка ТР53 наблюдалось в случае пула SP1, который применяли в низкой концентрации 7 нМ.
Результаты показали, что, поскольку пул избирательно состоял их киРНК, которые были компетентны и эффективны, имитируя свойства пула киРНК, встречающихся в природе, их можно смешивать и использовать в более низкой концентрации, чем концентрация при обычном лечении, и снижать побочный эффект.
Побочный эффект киРНК
Линию клеток HeLa, инфицированную HPV типа 18, трансдуцировали киРНК к β-gal в качестве положительного контроля, комбинацией 44, не имеющей замену остатка, и комбинацией 48, имеющей замену остатка в последовательности оснований, как описано выше. Затем проводили эксперимент по исследованию иммунного ответа IL-6. В результате, как показано на Фиг. 5а, иммунный ответ IL-6 был повышен в случае положительного контроля и комбинации 44, тогда как иммунный ответ IL-6 был понижен до 1/2 уровня положительного контроля в случае комбинации 48, имеющей замены остатков в последовательностях оснований.
Затем для проведения эксперимента по исследованию иммунного ответа ИФН-гамма мышам в возрасте 6 недель внутривенно инъецировали киРНК к B-gal и комбинации 44 и 48 против HPV типа 18, которые повышают иммунный ответ, после чего выжидали 6 часов (Фиг. 5b). Несмотря на то, что иммунный ответ наблюдали в случае положительного контроля, киРНК к β-gal, и комбинации 44, что выражалось в повышении уровня ИФН-гамма, иммунный ответ не наблюдали в случае комбинации 48, поскольку уровень ИФН-гамма в случае комбинации 48 был таким же, как в отрицательном контроле, и не был повышен.
Таким образом, было обнаружено, что в группе, которую обрабатывали киРНК, имеющей замену остатка, иммунный ответ был снижен по сравнению с группой, которую обрабатывали киРНК, не имеющей замены остатка.
Фармакокинетический эксперимент с киРНК, имеющей замену остатка
Крысе внутривенно инъецировали комбинацию киРНК 44 и комбинацию киРНК 48 к HPV типа 18, после чего с течением времени отбирали образцы крови, как описано выше. Далее для количественного анализа киРНК с помощью метода ПЦР в реальном времени с образованием структуры стебель-петля отделяли плазму. В результате, как показано на Фиг. 6а, период полувыведения комбинации 48 был, по меньшей мере, в два раза больше по сравнению с комбинацией 44, что означает, что комбинация 48, которая имеет замену остатка в последовательности оснований, является более стабильной in vivo.
Эффект киРНК в различных типах липосом
Как описано ранее, клетки линии HeLa, инфицированные HPV типа 18, трансдуцировали киРНК с использованием коммерчески доступных систем доставки лекарств Dharmafect (Dharmacon), Oligofectamine и Lipofectamine 2000 (Invitrgen) и катионных липосом, полученных авторами настоящего изобретения. Для оценки эффекта ингибирования пролиферации клеток через 24 часа измеряли количество клеток. В результате, как показано на Фиг. 7а, происходила эффективная доставка киРНК в линию клеток, инфицированную HPV, с помощью различных систем доставки лекарств.
Эффект комбинированной обработки пулом киРНК и противораковым агентом
С помощью описанного выше способа раковые клетки ксенотрансплантировали мыши. Спустя 10 дней оценивали присутствие раковых клеток. Затем проводили 9 повторяющихся инъекций киРНК и противоракового агента и измеряли размер опухоли с интервалом 2-3 дня. В результате, как показано на Фиг. 8а, для группы с комбинированной обработкой противораковым агентом и SP4 (пул комбинаций 48 и 54) наблюдался значительный заметный терапевтический эффект по сравнению с группой с комбинированной обработкой противораковым агентом и пулом комбинаций 44 и 51. Было обнаружено, что SP4, имеющий замены остатков в последовательностях оснований, обладал более высокой эффективностью и оказывал больший эффект, чем пул комбинаций киРНК 44 и 51, не имеющих замен остатков в последовательностях оснований. Более того, как показано на Фиг. 8b, сравнение размеров опухолей у мыши из группы, в которой вводили противораковый агент цисплатин и паклитаксел, и у мыши из группы, в которой проводили комбинированную обработку противораковым агентом и пулом SP4, на 17 день показало наличие существенных различий в размере и стадии опухоли. Также, как показано на Фиг. 8с, результаты, полученные при наблюдении изменений веса тела мыши на 9 день и 28 день, продемонстрировали отсутствие снижения веса тела, вызванного токсичностью. Таким образом, было определено, что побочные эффекты, вызванные токсичностью киРНК, отсутствуют.
Выше были подробно описаны отличительные признаки настоящего изобретения. Тем не менее для специалиста в данной области техники будет очевидно, что приведенное описание представляет собой только предпочтительный вариант воплощения изобретения, и объем изобретения не ограничивается им. Поэтому объем настоящего изобретения будет определяться формулой изобретения с учетом ее эквивалентов.