Результат интеллектуальной деятельности: СИНТЕТИЧЕСКИЕ ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТА ИЗ BRASSICA
Вид РИД
Изобретение
ЗАЯВЛЕНИЕ ОБ УСТАНОВЛЕНИИ ПРИОРИТЕТА
По данной заявке испрашивается приоритет по отношению к предварительной патентной заявке США серийный № 61/625222, поданной 17 апреля 2012 г.
ЗАЯВЛЕНИЕ В СООТВЕТСТВИИ С 37 C.F.R. § 1.821(c) или (e) -
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ ПРЕДСТАВЛЕН В ВИДЕ ТЕКСТОВОГО ФАЙЛА В ФОРМАТЕ ASCII
В соответствии с 37 C.F.R. § 1.821(c) или (e), файл, содержащий текстовую версию списка последовательностей в формате ASCII, предоставлен одновременно с данной заявкой.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к композициям и способам генетического кодирования и экспрессирования полипептидов, которые направлены в пластиды содержащих пластиды клеток. В некоторых вариантах осуществления изобретение относится к аминокислотным последовательностям, которые направляют полипептиды в хлоропласты (например, высших растений), и/или молекулам нуклеиновой кислоты, кодирующим их. В некоторых вариантах осуществления изобретение относится к химерным полипептидам, содержащим аминокислотную последовательность, которая контролирует транзит химерных полипептидов в пластиды, и/или молекулам нуклеиновой кислоты, кодирующим их.
УРОВЕНЬ ТЕХНИКИ
Растительные клетки содержат различные субклеточные органеллы, имеющие общее название «пластиды», которые ограничены характерными мембранными системами и выполняют специализированные функции в клетке. Конкретные пластиды отвечают за фотосинтез, а также синтез и хранение определенных химических соединений. Все пластиды происходят из пропластид, которые находятся в областях меристемы растений. Пропластиды могут развиваться, например, в: хлоропласты, этиопласты, хромопласты, геронтопласты, лейкопласты, амилопласты, элайопласты и протеинопласты. Пластиды существуют в клетке полуавтономно, имея собственную генетическую систему и аппарат синтеза белка, но при этом тесно взаимодействуя с ядерно-цитоплазматической системой в своем развитии и биосинтетических активностях.
В фотосинтезирующих клетках листьев высших растений наиболее заметными пластидами являются хлоропласты. Наиболее важной функцией хлоропластов является осуществление запускаемых светом реакций фотосинтеза. Однако хлоропласты также осуществляют многие другие биосинтетические процессы, важные для растительной клетки. Например, все жирные кислоты клетки создаются ферментами, локализованными в строме хлоропластов, с использованием АТФ, NAOPH и углеводов, которые там являются легкодоступными. Кроме того, восстановительная способность активируемых светом электронов приводит к восстановлению нитрита (NO2-) до аммиака (NH3) в хлоропласте; этот аммиак обеспечивает растение азотом, необходимым для синтеза аминокислот и нуклеотидов.
Хлоропласт также принимает участие в процессах, имеющих особое значение в агрохимической промышленности. Например, известно, что многие гербициды действуют, блокируя функции, которые осуществляются внутри хлоропласта. Недавние исследования выявили специфическую мишень некоторых гербицидов. Например, триазиновые гербициды ингибируют фотосинтез, вытесняя молекулу пластохинона из ее сайта связывания на 32-кДа полипептиде фотосистемы II. Этот 32-кДа полипептид кодируется в геноме хлоропласта и синтезируется аппаратом органеллы. Были получены мутантные растения, устойчивые к триазиновым гербицидам. Эти растения содержат мутантный 32-кДа полипептид, с которого пластохинон больше не может быть вытеснен триазиновыми гербицидами. Сульфонилмочевины ингибируют ацетолактатсинтазу в хлоропласте. Ацетолактатсинтаза участвует в синтезе изолейцина и валина. Глифосат ингибирует функцию 5-енолпирувил-3-фосфошикиматсинтазы (EPSPS), которая является ферментом, участвующим в синтезе ароматических аминокислот. Все эти ферменты кодируются ядерным геномом, но они перемещаются в хлоропласт, где фактически происходит синтез аминокислот.
Большинство хлоропластных белков кодируются в ядре растительной клетки, синтезируются в виде крупных белков-предшественников в цитозоле и после трансляции перемещаются в хлоропласт. Введение через внешние и внутренние мембраны оболочки в строму является основным способом поступления внутрь белков, предназначенных для стромы, тилакоидной мембраны и полости тилакоида. Локализация введенных извне белков-предшественников в тилакоидной мембране и полости тилакоида осуществляется четырьмя различными механизмами, включая два, которые гомологичны системам транспорта бактериальных белков. Таким образом, механизмы для локализации белков в хлоропласте частично происходят от прокариотического эндосимбионта. Cline and Henry (1996), Annu. Rev. Cell. Dev. Biol. 12: 1-26.
Белки-предшественники, предназначенные для экспрессии в хлоропластах, содержат N-концевые удлиняющие сегменты, известные как транзитные пептиды хлоропласта (ТПХ) (CTP). Транзитный пептид играет важную роль в специфическом узнавании поверхности хлоропласта и в опосредовании посттрансляционной транслокации белков-предшественников через оболочку хлоропласта и затем в различные субкомпартменты внутри хлоропласта (например, строму, тилакоид и тилакоидную мембрану). Эти N-концевые последовательности транзитного пептида содержат всю информацию, необходимую для поступления хлоропластного белка в пластиды; последовательности транзитного пептида необходимы и достаточны для поступления в пластиды.
Гены растений, которые, как известно, имеют природные последовательности, кодирующие транзитные пептиды, на их N-конце, включают гены хлоропластной малой субъединицы рибулоза-1,5-бисфосфат карбоксилазы (RuBisCo) (de Castro Silva-Filho et al. (1996), Plant Mol. Biol. 30: 769-80; Schnell et al. (1991), J. Biol. Chem. 266: 3335-42); EPSPS (смотри, например, Archer et al. (1990), J. Bioenerg. and Biomemb. 22: 789-810, и патенты США 6867293, 7045684 и Re. 36449); триптофан-синтазы (Zhao et al. (1995), J. Biol. Chem. 270: 6081-7); пластоцианина (Lawrence et al. (1997), J. Biol. Chem. 272: 20357-63); хоризмат-синтазы (Schmidt et al. (1993), J. Biol. Chem. 268: 27447-57); светособирающего хлорофилл a/b-связывающего белка (LHBP) (Lamppa et al. (1988), J. Biol. Chem. 263: 14996-14999); и хлоропластного белка из Arabidopsis thaliana (Lee et al. (2008), Plant Cell 20: 1603-22). В патентной публикации США № US 2010/0071090 приведены некоторые направляющие в хлоропласты пептиды из вида Chlamydomonas.
Однако структурные требования для информации, закодированной в направляющих в хлоропласт пептидах, остаются трудными для понимания из-за высокого уровня разнообразия их последовательностей и отсутствия общих или консенсусных мотивов в последовательностях, хотя вполне возможно, что существуют различные подгруппы направляющих в хлоропласт пептидов с самостоятельными структурными мотивами. Lee et al. (2008), выше. Кроме того, не все из этих последовательностей были полезны в гетерологичной экспрессии направляющих в хлоропласт белков в высших растениях.
ОПИСАНИЕ
В настоящем документе описаны композиции и способы для направления в пластиды полипептидов в растении. В некоторых вариантах осуществления композиция содержит молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический транзитный пептид хлоропласта из Brassica (например, пептид TraP8 и пептид TraP9), функционально связанную с интересующей нуклеотидной последовательностью. В конкретных вариантах осуществления такие молекулы нуклеиновой кислоты могут быть полезны для экспрессии и направления полипептида, кодируемого интересующей нуклеотидной последовательностью, в однодольном или двудольном растении. Кроме того, описаны векторы, содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический транзитный пептид хлоропласта из Brassica, функционально связанную с интересующей нуклеотидной последовательностью.
В некоторых вариантах осуществления нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может представлять собой нуклеотидную последовательность, происходящую из эталонной нуклеотидной последовательности, полученной из гена вида Brassica (например, B. napus, B. rapa, B. juncea и B. carinata), или ее функционального варианта. В некоторых вариантах осуществления нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может представлять собой химерную нуклеотидную последовательность, содержащую частичную кодирующую ТПХ нуклеотидную последовательность из гена вида Brassica, или ее функциональный вариант. В конкретных вариантах осуществления нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может содержать непрерывные нуклеотидные последовательности, полученные из каждого из эталонных ТПХ вида Brassica и ТПХ из другого гена вида Brassica, другого вида Brassica или другого организма (например, растения, прокариота и низшего фотосинтезирующего эукариота), или функциональные варианты любого из вышеперечисленных. В конкретных вариантах осуществления непрерывная нуклеотидная последовательность может быть получена из ортологичной нуклеотидной последовательности эталонного ТПХ Brassica, которая получена из принадлежащего другому организму ортолога эталонного гена вида Brassica (например, генома другого вида Brassica). В этих и других вариантах осуществления нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может быть химерной нуклеотидной последовательностью, содержащей более чем одну кодирующую ТПХ нуклеотидную последовательность.
В некоторых примерах нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может быть химерной нуклеотидной последовательностью, содержащей частичную нуклеотидную последовательность ТПХ из любого вида из B. napus и B. rapa, или ее функциональные варианты. В конкретных примерах нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может содержать непрерывные нуклеотидные последовательности, полученные из любого вида из B. napus и B. rapa, или их функциональные варианты.
В некоторых вариантах осуществления композиция содержит молекулу нуклеиновой кислоты, содержащую по меньшей мере один компонент из Brassica для направления полипептида в хлоропласт. Кроме того, описаны молекулы нуклеиновой кислоты, содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере один компонент из Brassica для направления полипептида в хлоропласт, функционально связанный с интересующей нуклеотидной последовательностью. В конкретных вариантах осуществления такие молекулы нуклеиновой кислоты могут быть полезны для экспрессии и направления полипептида, кодируемого интересующей нуклеотидной последовательностью, в однодольном или двудольном растении. Для целей настоящего изобретения компонент из Brassica для направления полипептида в хлоропласт означает конкретные синтетические нуклеотидные последовательности. В конкретных вариантах осуществления компонент из Brassica для направления полипептида в хлоропласт выбран из группы, состоящей из нуклеотидных последовательностей, кодирующих полипептиды, обозначенные в настоящем документе TraP8 и TraP9.
В настоящем документе также описаны растительные материалы (например, и без ограничений, растения, ткани растений и клетки растений), содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью. В некоторых вариантах осуществления растительный материал может иметь такую молекулу нуклеиновой кислоты, стабильно интегрированную в его геноме. В некоторых вариантах осуществления растительный материал может временно экспрессировать продукт молекулы нуклеиновой кислоты, содержащей по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью. В некоторых вариантах осуществления растительный материал представляет собой клетку растения, из которой растение не может быть регенерировано.
Описаны также способы экспрессирования нуклеотидной последовательности в содержащей пластиду клетке (например, растения), в пластиде (например, хлоропласте) содержащей пластиду клетки. В конкретных вариантах осуществления молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью, можно использовать для трансформации клетки растения таким образом, что слитый полипептид-предшественник, содержащий синтетический ТПХ из Brassica, слитый с продуктом экспрессии интересующей нуклеотидной последовательности, образуется в цитоплазме клетки растения, и слитый полипептид затем транспортируется in vivo в хлоропласт клетки растения. В некоторых вариантах осуществления клетка растения не способна к регенерации в растение.
Кроме того, описаны способы получения трансгенного растения, содержащего молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью. Также описаны растительные товарные продукты (например, семена), полученные от таких трансгенных растений. В некоторых вариантах осуществления эти трансгенные растения или растительные товарные продукты содержат трансгенные клетки, из которых растение не может быть регенерировано.
Вышеуказанные и другие признаки станут более очевидными из следующего далее подробного описания нескольких вариантов осуществления, которое изложено со ссылкой на сопроводительные фигуры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
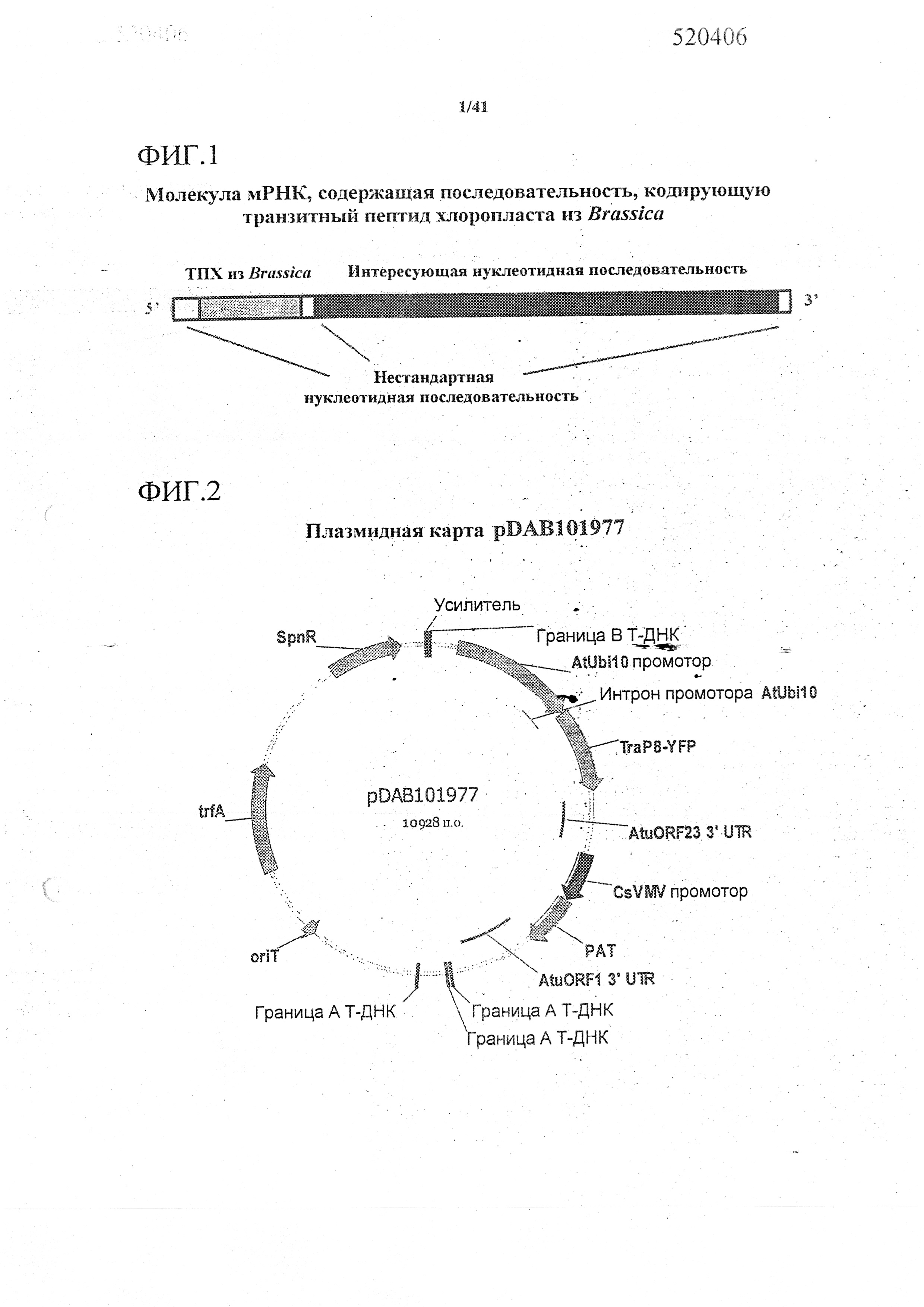
На фиг. 1 изображена молекула мРНК, которая является репрезентативной для конкретных примеров нуклеотидных последовательностей, кодирующих синтетические ТПХ из Brassica (например, для TraP8 и TraP9), функционально связанных с интересующей нуклеотидной последовательностью. В некоторых вариантах осуществления молекула мРНК (такая, как представленная) может транскрибироваться с молекулы ДНК, содержащей открытую рамку считывания, включающую последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью. В некоторых вариантах осуществления интересующая нуклеотидная последовательность может представлять собой последовательность, кодирующую интересующий пептид, например, и без ограничений, продукт маркерного гена или пептид, который должен быть направлен в пластиду.
На фиг. 2 изображена плазмидная карта pDAB101977.
На фиг. 3 изображена плазмидная карта pDAB101908.
На фиг. 4 приведено микроскопическое изображение, показывающее, что TraP8-YFP, инфильтрированный в ткань табачного листа, был перемещен в хлоропласты ткани табачного листа.
На фиг. 5 приведено микроскопическое изображение, показывающее, что TraP9-YFP, инфильтрированный в ткань табачного листа, был перемещен в хлоропласты ткани табачного листа.
На фиг. 6 приведено микроскопическое изображение, показывающее, что ненаправленные контроли YFP, которые были инфильтрированы в ткань табачного листа, не были включены в хлоропласты ткани табачного листа.
На фиг. 7 изображена плазмидная карта pDAB106597.
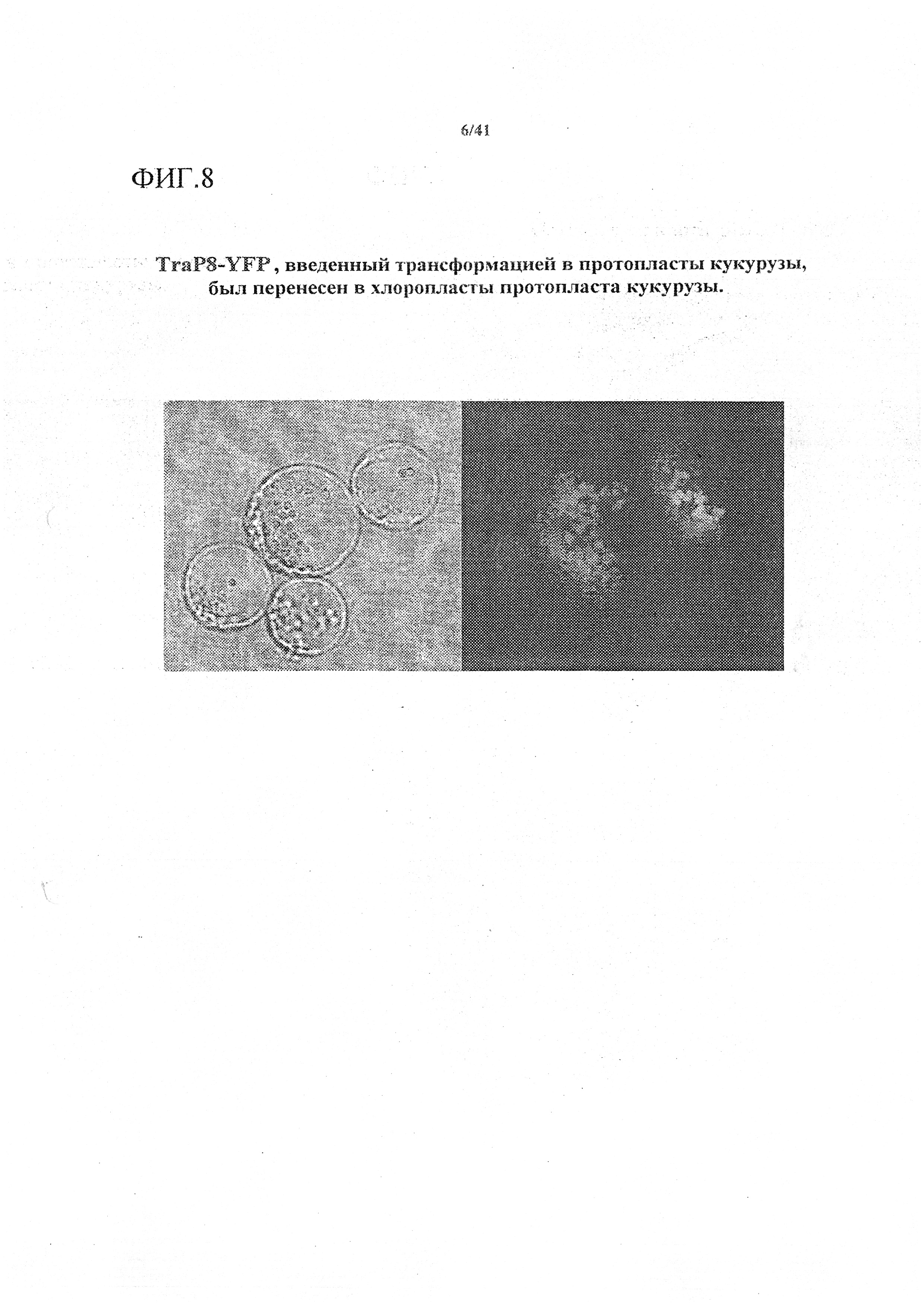
На фиг. 8 приведено микроскопическое изображение конструкта TraP8-YFP, введенного трансформацией в протопласты кукурузы, показывающее перемещение в хлоропласты протопластов кукурузы.
На фиг. 9 изображена плазмидная карта pDAB105526.
На фиг. 10 изображена плазмидная карта pDAB105527.
На фиг. 11 изображена плазмидная карта pDAB109807.
На фиг. 12 изображена плазмидная карта pDAB107687.
На фиг. 13 изображена плазмидная карта pDAB111481.
На фиг. 14 изображена плазмидная карта pDAB111479.
На фиг. 15 изображена плазмидная карта pDAB111338.
На фиг. 16 изображена плазмидная карта pDAB112710.
На фиг. 17 показано выравнивание последовательностей предсказанных транзитных пептидов хлоропласта для белка EPSPS из Brassica napus (SEQ ID NO: 1) и Brassica rapa (SEQ ID NO: 2). Звездочкой указано, где последовательности разделяются и рекомбинируют, с образованием TraP8 и Trap9.
На фиг. 18 изображена плазмидная карта pDAB107527.
На фиг. 19 изображена плазмидная карта pDAB105530.
На фиг. 20 изображена плазмидная карта pDAB105531.
На фиг. 21 изображена плазмидная карта pDAB105532.
На фиг. 22 изображена плазмидная карта pDAB105533.
На фиг. 23 изображена плазмидная карта pDAB105534.
На фиг. 24 изображена плазмидная карта pDAB107532.
На фиг. 25 изображена плазмидная карта pDAB107534.
На фиг. 26 изображена плазмидная карта pDAB107533.
На фиг. 27 изображена плазмидная карта pDAB4104.
На фиг. 28 изображена плазмидная карта pDAB102715.
На фиг. 29 изображена плазмидная карта pDAB102716.
На фиг. 30 изображена плазмидная карта pDAB102717.
На фиг. 31 изображена плазмидная карта pDAB102785.
На фиг. 32 изображена плазмидная карта pDAB102719.
На фиг. 33 изображена плазмидная карта pDAB102718.
На фиг. 34 изображена плазмидная карта pDAB107663.
На фиг. 35 изображена плазмидная карта pDAB107664.
На фиг. 36 изображена плазмидная карта pDAB107665.
На фиг. 37 изображена плазмидная карта pDAB107666.
На фиг. 38 изображена плазмидная карта pDAB109812.
На фиг. 39 изображена плазмидная карта pDAB101556.
На фиг. 40 изображена плазмидная карта pDAB107698.
На фиг. 41 изображена плазмидная карта pDAB108384.
На фиг. 42 изображена плазмидная карта pDAB108385.
На фиг. 43 изображена плазмидная карта pDAB108386.
На фиг. 44 изображена плазмидная карта pDAB108387.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Последовательности нуклеиновых кислот, приведенные в прилагаемом списке последовательностей, изображены с использованием стандартных буквенных сокращений для нуклеотидных оснований, указанных в 37 C.F.R. § 1,822. Показана только одна цепь каждой последовательности нуклеиновой кислоты, однако понятно, что комплементарная цепь включена при каждой ссылке на изображенную цепь. В прилагаемом списке последовательностей:
SEQ ID NO: 1 изображает аминокислотную последовательность транзитного пептида хлоропласта EPSPS из Brassica napus.
SEQ ID NO: 2 изображает аминокислотную последовательность транзитного пептида хлоропласта EPSPS из Brassica rapa.
SEQ ID NO: 3 изображает аминокислотную последовательность химерного транзитного пептида хлоропласта TraP8.
SEQ ID NO: 4 изображает аминокислотную последовательность химерного транзитного пептида хлоропласта TraP9.
SEQ ID NO: 5 изображает полинуклеотидную последовательность, кодирующую химерный транзитный пептид хлоропласта TraP8.
SEQ ID NO: 6 изображает полинуклеотидную последовательность, кодирующую химерный транзитный пептид хлоропласта TraP9.
SEQ ID NO: 7 изображает полинуклеотидную последовательность, кодирующую последовательность линкера.
SEQ ID NO: 8 изображает полинуклеотидную последовательность, кодирующую химерный транзитный пептид хлоропласта TraP8 v2.
SEQ ID NO: 9 изображает полинуклеотидную последовательность, кодирующую химерный транзитный пептид хлоропласта TraP9 v2.
SEQ ID NO: 10 изображает полинуклеотидную последовательность, кодирующую ген cry2aa.
SEQ ID NO: 11 изображает полинуклеотидную последовательность, кодирующую ген vip3ab1v6.
SEQ ID NO: 12 изображает полинуклеотидную последовательность, кодирующую ген vip3ab1v7.
SEQ ID NO: 13 изображает пептид, имеющий аминокислотную последовательность Ser-Val-Ser-Leu.
SEQ ID NO: 14 изображает полинуклеотидную последовательность, кодирующую транзитный пептид хлоропласта EPSPS с SEQ ID NO: 1 из Brassica napus.
SEQ ID NO: 15 изображает полинуклеотидную последовательность, кодирующую транзитный пептид хлоропласта EPSPS с SEQ ID NO: 2 из Brassica rapa.
SEQ ID NO: 16 изображает полинуклеотидную последовательность, кодирующую dgt-28 v5.
SEQ ID NO: 17 изображает полинуклеотидную последовательность, кодирующую dgt-28 v6.
SEQ ID NO: 18 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-1.
SEQ ID NO: 19 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-3 v2 (G173A).
SEQ ID NO: 20 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-3 v3 (G173A; P178S).
SEQ ID NO: 21 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-3 v4 (T174I; P178S).
SEQ ID NO: 22 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-7 v4 (T168I; P172S).
SEQ ID NO: 23 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-32 v3.
SEQ ID NO: 24 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-33 v3.
SEQ ID NO: 25 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-31 v3.
SEQ ID NO: 26 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP4 v2.
SEQ ID NO: 27 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP5 v2.
SEQ ID NO: 28 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP8 v2.
SEQ ID NO: 29 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP9 v2.
SEQ ID NO: 30 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP12 v2.
SEQ ID NO: 31 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP13 v2.
SEQ ID NO: 32 изображает полинуклеотидную последовательность TraP4 v2:dgt-28 v5.
SEQ ID NO: 33 изображает полинуклеотидную последовательность TraP5 v2:dgt-28 v5.
SEQ ID NO: 34 изображает полинуклеотидную последовательность TraP8 v2:dgt-28 v5.
SEQ ID NO: 35 изображает полинуклеотидную последовательность TraP9 v2:dgt-28 v5.
SEQ ID NO: 36 изображает полинуклеотидную последовательность TraP12 v2:dgt-28 v5.
SEQ ID NO: 37 изображает полинуклеотидную последовательность TraP13 v2: dgt-28 v5.
SEQ ID NO: 38 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP14 v2.
SEQ ID NO: 39 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP23 v2.
SEQ ID NO: 40 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP24 v2.
SEQ ID NO: 41 изображает полинуклеотидную последовательность, кодирующую транзитный пептид dgt-32 v3, слитый с TraP14 v2.
SEQ ID NO: 42 изображает полинуклеотидную последовательность, кодирующую транзитный пептид dgt-33 v3, слитый с TraP24 v2.
SEQ ID NO: 43 изображает полинуклеотидную последовательность, кодирующую транзитный пептид dgt-31 v3, слитый с TraP23 v2.
SEQ ID NO: 44 изображает олигонуклеотидную последовательность праймера DSM2A.
SEQ ID NO: 45 изображает олигонуклеотидную последовательность праймера DSM2S.
SEQ ID NO: 46 изображает олигонуклеотидную последовательность зонда DSM2 Cy5.
SEQ ID NO: 47 изображает олигонуклеотидную последовательность праймера DGT28F.
SEQ ID NO: 48 изображает олигонуклеотидную последовательность праймера DGT28R.
SEQ ID NO: 49 изображает олигонуклеотидную последовательность зонда TAFFY-HEX.
SEQ ID NO: 50 изображает олигонуклеотидную последовательность праймера TAFII15-F.
SEQ ID NO: 51 изображает олигонуклеотидную последовательность праймера TAFII15-R.
SEQ ID NO: 52 изображает олигонуклеотидную последовательность прямого олигонуклеотида, используемого для подтверждения экспрессионной кассеты гена dgt-28.
SEQ ID NO: 53 изображает олигонуклеотидную последовательность обратного олигонуклеотида, используемого для подтверждения экспрессионной кассеты гена dgt-28.
SEQ ID NO: 54 изображает олигонуклеотидную последовательность праймера AT26410LP.
SEQ ID NO: 55 изображает олигонуклеотидную последовательность праймера AT26410RP.
SEQ ID NO: 56 изображает олигонуклеотидную последовательность праймера DGT28F.
SEQ ID NO: 57 изображает олигонуклеотидную последовательность праймера DGT28R.
SEQ ID NO: 58 изображает олигонуклеотидную последовательность праймера GAAD1F.
SEQ ID NO: 59 изображает олигонуклеотидную последовательность зонда GAAD1P.
SEQ ID NO: 60 изображает олигонуклеотидную последовательность праймера GAAD1R.
SEQ ID NO: 61 изображает олигонуклеотидную последовательность IV-зонда.
SEQ ID NO: 62 изображает олигонуклеотидную последовательность праймера IVF-Taq.
SEQ ID NO: 63 изображает олигонуклеотидную последовательность праймера IVR-Taq.
SEQ ID NO: 64 изображает олигонуклеотидную последовательность праймера zmDGT28 F.
SEQ ID NO: 65 изображает олигонуклеотидную последовательность зонда zmDGT28 FAM.
SEQ ID NO: 66 изображает олигонуклеотидную последовательность праймера zmDGT28 R.
ПОДРОБНОЕ ОПИСАНИЕ
I. Обзор нескольких вариантов осуществления
Транзитный пептид хлоропласта (ТПХ) (или транзитный пептид пластиды) действует котрансляционно или посттрансляционно для направления полипептида, содержащего ТПХ, в пластиду (например, хлоропласт). В некоторых вариантах осуществления изобретения любые эндогенные хлоропластные белки или гетерологичные белки могут быть направлены в хлоропласт в результате экспрессии такого белка в виде большего по размеру полипептида-предшественника, содержащего ТПХ. В конкретных вариантах осуществления ТПХ может быть получен из нуклеотидной последовательности, полученной из гена вида Brassica, например, и без ограничений, путем включения по меньшей мере одной непрерывной последовательности из ортологичного гена, полученного из другого организма, или ее функционального варианта.
В иллюстративном варианте осуществления нуклеотидные последовательности, каждая из которых кодирует ТПХ, были выделены из последовательностей гена EPSPS, полученных из Brassica napus (регистрационный № базы данных NCBI P17688) и Brassica rapa (регистрационный № базы данных NCBI AAS80163). Кодирующие ТПХ нуклеотидные последовательности были выделены в результате анализа последовательности гена EPSPS с помощью предсказательного сервера ChloroP. Emanuelsson et al. (1999), Protein Science 8: 978-84 (доступно на сайте cbs.dtu.dk/services/ChloroP). Предсказанные белковые продукты выделенных кодирующих ТПХ последовательностей представляют собой транзитные пептиды длиной примерно 60-70 аминокислот. В этом примере использовали родной ТПХ B. napus в качестве эталонной последовательности для разработки иллюстративных синтетических ТПХ из Brassica путем слияния непрерывных последовательностей из других ТПХ в определенном положении в ТПХ B. napus. Этот процесс дизайна иллюстрирует разработку нового, в некоторых аспектах, синтетического ТПХ из нуклеотидной последовательности вида Brassica. Данные иллюстративные синтетические ТПХ из Brassica называются в данном описании TraP8 и TraP9. Эти иллюстративные синтетические TraP были протестированы на функцию направления в пластиду и было установлено, что они демонстрируют направляющую в пластиды способность, которая по меньшей мере не уступает таковой, наблюдаемой индивидуально у природных последовательностей Brassica.
В следующем иллюстративном варианте осуществления нуклеотидные последовательности, каждая из которых кодирует синтетический пептид по изобретению TraP, были синтезированы независимо и функционально связаны с нуклеотидной последовательностью, кодирующей желтый флуоресцентный белок (YFP), с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодирует химерный слитый полипептид TraP:YFP. Все такие молекулы нуклеиновой кислоты, каждая из которых кодирует химерный полипептид TraP:YFP, были встроены в бинарный вектор так, что каждая кодирующая TraP:YFP нуклеотидная последовательность была функционально связана с промотором AtUbi 10.
В еще одном иллюстративном варианте осуществления каждый из бинарных векторов, содержащих кодирующую TraP:YFP нуклеотидную последовательность, функционально связанную с промотором AtUbi 10, был независимо временно введен трансформацией в растение табака (Nicotiana benthamiana) с использованием метода Agrobacterium-опосредованной трансформации. Анализ методом конфокальной микроскопии и вестерн-блоттинга подтвердил, что каждый TraP успешно направлял YFP в хлоропласты табака.
В следующем иллюстративном варианте осуществления нуклеотидные последовательности, каждая из которых кодирует синтетический пептид по изобретению TraP, были синтезированы независимо и функционально связаны с нуклеотидной последовательностью, кодирующей важную с агрономической точки зрения генную последовательность. Последовательности TraP были слиты с генами признаков толерантности к гербицидам (например, dgt-28 и dgt-14), с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодирует химерный слитый полипептид TraP:DGT-28 или TraP:DGT-14. Все такие молекулы нуклеиновой кислоты, каждая из которых кодирует химерный полипептид TraP:DGT-28 или TraP:DGT-14, были встроены в бинарный вектор так, что каждая кодирующая TraP:dgt-28 или TraP:dgt-14 нуклеотидная последовательность была функционально связана с промотором и другими генными регуляторными элементами. Бинарные векторы, содержащие кодирующую TraP:dgt-28 или TraP:dgt-14 нуклеотидную последовательность, были использованы для трансформации различных видов растений. Трансгенные растения анализировали на толерантность к гербицидам в результате экспрессии и транслокации ферментов DGT-28 или DGT-14 в хлоропласт.
В следующем иллюстративном варианте осуществления нуклеотидные последовательности, каждая из которых кодирует синтетический пептид по изобретению TraP, были синтезированы независимо и функционально связаны с нуклеотидной последовательностью, кодирующей важную с агрономической точки зрения генную последовательность. Последовательности TraP были слиты с генами, придающими признаки толерантности к насекомым (например, cry2Aa и vip3ab1), с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодирует химерный слитый полипептид TraP:Cry2Aa или TraP:Vip3Ab1. Все такие молекулы нуклеиновой кислоты, каждая из которых кодирует химерный полипептид TraP:Cry2Aa или TraP:Vip3Ab1, были встроены в бинарный вектор так, что каждая кодирующая TraP:Cry2Aa или TraP:Vip3Ab1 нуклеотидная последовательность была функционально связана с промотором и другими генными регуляторными элементами. Бинарные векторы, содержащие кодирующую TraP:Cry2Aa или TraP:Vip3Ab1 нуклеотидную последовательность, были использованы для трансформации различных видов растений. Трансгенные растения были биологически проанализированы на устойчивость к насекомым в результате экспрессии и транслокации ферментов Cry2Aa или Vip3Ab1 в хлоропласт.
С учетом вышеуказанных подробно описанных действующих образцов, синтетические последовательности ТПХ из Brassica по изобретению, а также нуклеиновые кислоты, кодирующие их, могут быть использованы для направления любого полипептида в пластиду в широком диапазоне содержащих пластиды клеток. Например, с помощью способов, ставших доступными для специалистов в данной области благодаря настоящему изобретению, химерный полипептид, содержащий синтетическую последовательность ТПХ из Brassica, слитую с N-концом любой второй пептидной последовательности, можно вводить в содержащую пластиду клетку-хозяина (или экспрессировать в ней) для направления в пластиду второй пептидной последовательности. Таким образом, в конкретных вариантах осуществления пептид TraP по изобретению может обеспечивать повышенную эффективность введения внутрь и процессинга пептида, для которого желательна экспрессия в пластиде, по сравнению с природным ТПХ.
II. Сокращения
ТПХ транзитный пептид хлоропласта
Bt Bacillus thuringiensis
EPSPS 3-енолпирувилшикимат-5-фосфатсинтетаза
YFP желтый флуоресцентный белок
Ti индуцирующие опухоль (плазмиды, полученные из A. tumefaciens)
T-ДНК трансферная ДНК
III. Термины
Для того чтобы облегчить обзор различных вариантов осуществления изобретения, приведены следующие объяснения специальных терминов:
Транзитный пептид хлоропласта: используемый в настоящем документе термин «транзитный пептид хлоропласта» (ТПХ) (или «транзитный пептид пластиды») может означать аминокислотную последовательность, которая, если присутствует на N-конце полипептида, направляет введение полипептида в пластиду содержащей пластиду клетки (например, клетки растения, например, целого растения или культуры клеток растения). ТПХ, как правило, необходим и достаточен для направленного введения белка в пластиду (например, первичную, вторичную или третичную пластиду, такую как хлоропласт) клетки-хозяина. Предполагаемый транзитный пептид хлоропласта можно идентифицировать с помощью одного из нескольких доступных алгоритмов (например, PSORT и ChloroP, (доступного на сайте cbs.dtu.dk/services/ChloroP)). ChloroP может, в частности, обеспечить хороший уровень предсказания ТПХ. Emanuelsson et al. (1999), Protein Science 8: 978-84. Однако предсказание функциональных ТПХ не достигается со 100% эффективностью любыми существующими алгоритмами. Следовательно, важно убедиться, что идентифицированный предполагаемый ТПХ действительно действует, как должен, например, с помощью in vitro или in vivo методологии.
Транзитные пептиды хлоропласта могут быть расположены на N-конце полипептида, который поступает в пластиду. ТПХ может облегчать ко- или посттрансляционный транспорт полипептида, содержащего ТПХ, в пластиду. Транзитные пептиды хлоропласта, как правило, содержат от примерно 40 до примерно 100 аминокислот и, как установлено, такие ТПХ обладают некоторыми общими характеристиками. Например: ТПХ содержат очень мало, если вообще содержат, отрицательно заряженных аминокислот (таких как аспарагиновая кислота, глютаминовая кислота, аспарагин или глютамин); в N-концевых областях ТПХ отсутствуют заряженные аминокислоты, глицин и пролин; центральная область ТПХ также, по-видимому, содержит в очень высокой пропорции основные или гидроксилированые аминокислоты (такие как серин и треонин); и C-концевая область ТПХ, по всей вероятности, богата аргинином и может содержать структуру амфипатического бета-листа. Пластидные протеазы могут отщеплять ТПХ от остатка полипептида, содержащего ТПХ, после введения полипептида в пластиду.
Контакт: используемый в настоящем документе термин «контакт с» или «поглощение» клеткой, тканью или организмом (например, клеткой растения, тканью растения и растением), применительно к молекуле нуклеиновой кислоты, включает интернализацию молекулы нуклеиновой кислоты в организм, например, и без ограничений: вступление в контакт организма с композицией, содержащей молекулу нуклеиновой кислоты; и вымачивание организмов в растворе, содержащем молекулу нуклеиновой кислоты.
Эндогенный: используемый в настоящем документе термин «эндогенный» относится к веществам (например, молекулам нуклеиновой кислоты и полипептидам), которые происходят из конкретного организма, ткани или клетки. Например, «эндогенный» полипептид, экспрессируемый в клетке растения, может означать полипептид, который обычно экспрессируется в клетках того же типа из генетически не модифицированных растений того же вида. В некоторых примерах эндогенный ген (например, ген EPSPS) из вида Brassica может быть использован для получения эталонной последовательности ТПХ Brassica.
Экспрессия: используемый в настоящем документе термин «экспрессия» кодирующей последовательности (например, гена или трансгена) означает процесс, посредством которого закодированная информация транскрипционной единицы нуклеиновой кислоты (включая, например, геномную ДНК или кДНК) преобразуется в операционную, не операционную или структурную часть клетки, часто включающий синтез белка. На экспрессию гена можно влиять с помощью внешних сигналов; например, подвергая клетку, ткань или организм воздействию средства, которое повышает или снижает экспрессию гена. Экспрессию гена также можно регулировать на любом этапе перехода от ДНК к РНК и к белку. Регуляция экспрессии гена происходит, например, через контрольные элементы, действующие на транскрипцию, трансляцию, транспорт и процессинг РНК, деградацию молекул-посредников, таких как мРНК, или через активацию, инактивацию, компартментализацию или деградацию определенных белковых молекул после их образования, или с помощью сочетаний вышеперечисленного. Экспрессию гена можно количественно определять на уровне РНК или на уровне белка любым методом, известным в данной области, например, и без ограничений: нозерн-блоттингом; ОТ-ПЦР; вестерн-блоттингом или анализом(ми) активности белка in vitro, in situ и in vivo.
Генетический материал: используемый в настоящем документе термин «генетический материал» включает все гены и молекулы нуклеиновой кислоты, такие как ДНК и РНК.
Гетерологичный: используемый в настоящем документе термин «гетерологичный» относится к веществам (например, молекулам нуклеиновой кислоты и полипептидам), которые не происходят из конкретного организма, ткани или клетки. Например, «гетерологичный» полипептид, экспрессируемый в клетке растения, может означать полипептид, который обычно не экспрессируется в клетках того же типа из генетически не модифицированных растений того же вида (например, полипептид, который экспрессируется в других клетках того же организма или клетках другого организма).
Выделенный: используемый в настоящем документе термин «выделенный» относится к молекулам (например, молекулам нуклеиновой кислоты и полипептидам), которые в значительной степени отделены или очищены от других молекул того же типа (например, других молекул нуклеиновой кислоты и других полипептидов), с которыми молекула обычно ассоциирована в клетке организма, в которой молекула обычно присутствует. Например, выделенная молекула нуклеиновой кислоты может быть в значительной степени отделена или очищена от хромосомной ДНК или внехромосомной ДНК в клетке организма, в которой молекула нуклеиновой кислоты обычно присутствует. Таким образом, термин включает рекомбинантные молекулы нуклеиновой кислоты и полипептиды, которые биохимически очищены так, что другие молекулы нуклеиновой кислоты, полипептиды и клеточные компоненты удалены. Термин также включает рекомбинантные молекулы нуклеиновой кислоты, синтезированные химическими методами молекулы нуклеиновой кислоты и полученные рекомбинантными методами полипептиды.
Используемый в настоящем документе термин «в значительной степени очищенная» относится к молекуле, которая отделена от других молекул, обычно ассоциированных с ней в ее естественном состоянии. В значительной степени очищенная молекула может быть преобладающим компонентом, присутствующим в композиции. В значительной степени очищенная молекула может быть, например, по меньшей мере на 60% свободна, по меньшей мере на 75% свободна или по меньшей мере на 90% свободна от других молекул кроме растворителя, присутствующего в природной смеси. Термин «в значительной степени очищенные» не относится к молекулам, находящимся в их естественном состоянии.
Молекула нуклеиновой кислоты: используемый в настоящем документе термин «молекула нуклеиновой кислоты» относится к полимерной форме нуклеотидов, которая может включать как смысловые, так и антисмысловые цепи РНК, кДНК, геномной ДНК, а также синтетические формы и смешанные полимеры вышеперечисленных. Нуклеотид может означать рибонуклеотид, дезоксирибонуклеотид или модифицированную форму нуклеотида любого типа. Используемый в настоящем документе термин «молекула нуклеиновой кислоты» является синонимом терминов «нуклеиновая кислота» и «полинуклеотид». Молекула нуклеиновой кислоты, как правило, имеет по меньшей мере 10 оснований в длину, если не указано иное. Термин включает одно- и двухцепочечные формы ДНК. Молекулы нуклеиновой кислоты включают димерные (так называемые тандемные) формы, а также транскрипционные продукты молекул нуклеиновой кислоты. Молекула нуклеиновой кислоты может включать природные или модифицированные нуклеотиды, либо и те и другие, связанные между собой природными и/или искусственными нуклеотидными связями.
Молекулы нуклеиновой кислоты могут быть модифицированы химически или биохимически, или могут содержать неприродные или дериватизированные нуклеотидные основания, как хорошо известно специалистам в данной области. Такие модификации включают, например, наличие меток, метилирование, замену одного или более природных нуклеотидов аналогами, межнуклеотидные модификации (например, незаряженные связи: например, метилфосфонаты, фосфотриэфиры, фосфорамидаты, карбаматы и так далее; заряженные связи: например, фосфоротиоаты, фосфородитиоаты и так далее; боковые фрагменты: например, пептиды; интеркаляторы: например, акридин, псорален и так далее; хелаторы; алкиляторы; а также модифицированные связи: например, альфа аномерные нуклеиновые кислоты и так далее). Термин «молекула нуклеиновой кислоты» также включает любую топологическую конформацию, в том числе одноцепочечную, двухцепочечную, частично дуплексную, триплексную, шпилечную, кольцевую и закрытую конформации.
Используемый в настоящем документе применительно к ДНК термин «кодирующая последовательность», «структурная нуклеотидная последовательность» или «структурная молекула нуклеиновой кислоты» относится к нуклеотидной последовательности, которая в конечном итоге транслируется в полипептид через транскрипцию и мРНК, будучи помещенной под контроль соответствующих регуляторных последовательностей. Применительно к РНК, термин «кодирующая последовательность» означает нуклеотидную последовательность, которая транслируется в пептид, полипептид или белок. Границы кодирующей последовательности определяются инициирующим кодоном трансляции на 5'-конце и стоп-кодоном трансляции на 3'-конце. Кодирующие последовательности включают, но без ограничения: геномную ДНК; кДНК; EST и рекомбинантные нуклеотидные последовательности.
В некоторых вариантах осуществления изобретение включает нуклеотидные последовательности, которые могут быть выделены, очищены или частично очищены, например, с использованием таких методов разделения, как например, ионообменная хроматография; хроматографией на основе молекулярного размера или аффинности; с помощью методов фракционирования, основанных на растворимости в разных растворителях, и методами генетической инженерии, такими как амплификация, клонирование и субклонирование.
Идентичность последовательности: используемый в настоящем документе термин «идентичность последовательности» или «идентичность» в контексте двух последовательностей нуклеиновых кислот или полипептидов может относиться к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании для максимального соответствия в определенном окне сравнения.
Используемый в настоящем документе термин «процент идентичности последовательностей» может означать величину, определяемую путем сравнения двух оптимально выровненных последовательностей (например, нуклеотидных последовательностей и аминокислотных последовательностей) в окне сравнения, при этом часть последовательности в окне сравнения может содержать дополнения или делеции (то есть, пробелы) по сравнению с эталонной последовательностью (которая не содержит дополнения или делеции) для оптимального выравнивания двух последовательностей. Процент рассчитывают путем определения числа положений, в которых находятся идентичные нуклеотидные или аминокислотные остатки в обеих последовательностях, для получения числа совпадающих положений; деления числа совпадающих положений на общее число положений в окне сравнения и умножения результата на 100 для получения процента идентичности последовательностей.
Методы выравнивания последовательностей для сравнения хорошо известны в данной области. Различные программы и алгоритмы выравнивания описаны, например, в: Smith and Waterman (1981), Adv. Appl. Math. 2: 482; Needleman and Wunsch (1970), J. Mol. Biol. 48: 443; Pearson and Lipman (1988), Proc. Natl. Acad. Sci. U.S.A. 85: 2444; Higgins and Sharp (1988), Gene 73: 237-44; Higgins and Sharp (1989), CABIOS 5: 151-3; Corpet et al. (1988), Nucleic Acids Res. 16: 10881-90; Huang et al. (1992), Comp. Appl. Biosci. 8: 155-65; Pearson et al. (1994), Methods Mol. Biol. 24: 307-31; Tatiana et al. (1999), FEMS Microbiol. Lett. 174: 247-50. Подробное описание методов выравнивания последовательностей и расчетов гомологии можно найти, например, в статье Altschul et al. (1990), J. Mol. Biol. 215: 403-10.
Базовый инструментарий поиска локальных блоков (BLAST™; Altschul et al. (1990)) Национального центра биотехнологической информации (NCBI) доступен из нескольких источников, включая Национальный центр биотехнологической информации (Bethesda, MD), а также в сети интернет, для использования в сочетании с несколькими программами анализа последовательностей. Описание того, как определять идентичность последовательностей с использованием этой программы доступно в сети интернет в разделе «помощь» для BLAST™. Для сравнений нуклеотидных последовательностей можно воспользоваться функцией «Blast 2 последовательности» программы BLAST™ (Blastn) с использованием матрицы по умолчанию BLOSUM62 с установленными по умолчанию параметрами. Нуклеотидные последовательности, имеющие более высокое сходство с эталонными последовательностями, будут демонстрировать возрастающий процент идентичности при оценке данным способом.
Специфически гибридизуемые/специфически комплементарные: используемые в настоящем документе термины «специфически гибридизуемые» и «специфически комплементарные» являются терминами, которые указывают на достаточную степень комплементарности для возникновения стабильного и специфического связывания между молекулой нуклеиновой кислоты и молекулой нуклеиновой кислоты-мишени. Гибридизация между двумя молекулами нуклеиновой кислоты включает образование антипараллельного выравнивания между нуклеотидными последовательностями двух молекул нуклеиновой кислоты. Затем две молекулы могут образовывать водородные связи с соответствующими основаниями на противоположной цепи, с образованием дуплексной молекулы, которую, в случае ее достаточной стабильности, можно обнаруживать с помощью методов, хорошо известных в данной области. Молекула нуклеиновой кислоты не обязательно должна быть на 100% комплементарна своей последовательности-мишени, чтобы быть специфически гибридизуемой. Однако степень комплементарности последовательностей, которая должна существовать, чтобы гибридизация была специфической, зависит от используемых условий гибридизации.
Условия гибридизации, проявляющиеся, в частности, в степени строгости, будут варьироваться в зависимости от характера выбранного метода гибридизации, а также состава и длины гибридизующихся нуклеотидных последовательностей. Как правило, температура гибридизации и ионная сила (в частности, концентрация Na+ и/или Mg++) буфера гибридизации будут определять строгость условий гибридизации, хотя количество промываний также влияет на строгость условий. Расчеты, касающиеся условий гибридизации, необходимых для достижения конкретной степени строгости, известны рядовым специалистам в данной области и описаны, например, в книгах Sambrook et al. (ed.) Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, chapters 9 и 11; и Hames and Higgins (eds.) Nucleic Acid Hybridization, IRL Press, Oxford, 1985. Более подробные инструкции и руководство относительно гибридизации нуклеиновых кислот можно найти, например, в публикации Tijssen, «Overview of principles of hybridization and the strategy of nucleic acid probe assays» в Laboratory Techniques in Biochemistry and Molecular Biology - Hybridization with Nucleic Acid Probes, Part I, Chapter 2, Elsevier, NY, 1993; и Ausubel et al., Eds., Current Protocols in Molecular Biology, Chapter 2, Greene Publishing и Wiley-Interscience, NY, 1995.
При использовании в настоящем документе «строгие условия» включают условия, в которых гибридизация будет происходить только в случае, если будет иметь место менее 20% несоответствий между гибридизующейся молекулой и гомологичной последовательностью в составе молекулы нуклеиновой кислоты-мишени. «Строгие условия» дополнительно включают несколько уровней строгости. Таким образом, при использовании в настоящем документе, условия «умеренной строгости» являются такими, в которых молекулы с более чем 20% несоответствий последовательностей не будут гибридизоваться; условия «высокой строгости» являются такими, в которых последовательности с более чем 10% несоответствий последовательностей не будут гибридизоваться; и условия «очень высокой строгости» являются такими, в которых последовательности с более чем 5% несоответствий последовательностей не будут гибридизоваться.
Далее приведены репрезентативные, неограничивающие условия гибридизации.
Условия высокой строгости (выявление последовательностей, которые имеют по меньшей мере 90% идентичности последовательностей): Гибридизация в 5x SSC буфере при 65°C в течение 16 часов; промывание два раза в 2x SSC буфере при комнатной температуре в течение 15 минут каждое; и промывание два раза в 0,5x SSC буфере при 65°C в течение 20 минут каждое.
Условия умеренной строгости (выявление последовательностей, которые имеют по меньшей мере 80% идентичности последовательностей): Гибридизация в 5x-6x SSC буфере при 65-70°C в течение 16-20 часов; промывание два раза в 2x SSC буфере при комнатной температуре в течение 5-20 минут каждое; и промывание два раза в 1x SSC буфере при 55-70°C в течение 30 минут каждое.
Нестрогие контрольные условия (последовательности, которые имеют по меньшей мере 50% идентичности последовательностей, будут гибридизоваться): Гибридизация в 6x SSC буфере при температуре от комнатной до 55°C в течение 16-20 часов; промывание по меньшей мере два раза в 2x-3x SSC буфере при температуре от комнатной до 55°C в течение 20-30 минут каждое.
Используемый в настоящем документе термин «в значительной степени гомологичные» или «значительная гомология» применительно к непрерывным нуклеотидным последовательностям относится к непрерывным нуклеотидным последовательностям, которые гибридизуются в строгих условиях с эталонной нуклеотидной последовательностью. Например, нуклеотидные последовательности, которые в значительной степени гомологичны с эталонной нуклеотидной последовательностью, являются такими нуклеотидными последовательностями, которые гибридизуются в строгих условиях (например, приведенных выше условиях умеренной строгости) с эталонной нуклеотидной последовательностью. В значительной степени гомологичные последовательности могут иметь по меньшей мере 80% идентичности последовательностей. Например, в значительной степени гомологичные последовательности могут иметь примерно от 80% до 100% идентичности последовательностей, например, примерно 81%; примерно 82%; примерно 83%; примерно 84%; примерно 85%; примерно 86%; примерно 87%; примерно 88%; примерно 89%; примерно 90%; примерно 91%; примерно 92%; примерно 93%; примерно 94%; примерно 95%; примерно 96%; примерно 97%; примерно 98%; примерно 98,5%; примерно 99%; примерно 99,5% и примерно 100%. Свойство значительной гомологии тесно связано со специфичностью гибридизации. Например, молекула нуклеиновой кислоты является специфически гибридизуемой, когда существует достаточная степень комплементарности, чтобы избежать неспецифического связывания нуклеиновой кислоты с последовательностями, не являющимися мишенями, в условиях, когда желательно специфическое связывание, например, в строгих условиях гибридизации.
Используемый в настоящем документе термин «ортолог» (или «ортологичный») относится к гену у двух или более видов, который эволюционировал от общей анцестральной нуклеотидной последовательности и может сохранять одну и ту же функцию у двух или более видов.
В настоящем документе принять говорить, что две молекулы нуклеотидных последовательностей проявляют «полную комплементарность», если каждый нуклеотид последовательности, читаемой в направлении от 5′ к 3′, является комплементарным каждому нуклеотиду другой последовательности, читаемой в направлении от 3′ к 5′. Нуклеотидная последовательность, которая комплементарна эталонной нуклеотидной последовательности, будет иметь последовательность, идентичную обратно-комплементарной последовательности для эталонной нуклеотидной последовательности. Данные термины и описания имеют четкое определение в данной области и хорошо понятны рядовому специалисту в данной области.
При определении процента идентичности последовательностей между аминокислотными последовательностями, как хорошо известно специалистам в данной области, идентификационные характеристики аминокислоты в определенном положении, полученные на основании выравнивания, могут отличаться без влияния на желаемые свойства полипептидов, соответствующих выровненным последовательностям. В этих случаях, процентную идентичность последовательностей можно корректировать с учетом сходства между консервативно замененными аминокислотами. Такие корректировки хорошо известны и обычно используются специалистами в данной области. Смотри, например, Myers and Miller (1988), Computer Applications in Biosciences 4: 11-7.
Варианты осуществления изобретения включают функциональные варианты иллюстративных аминокислотных последовательностей транзитных пептидов пластиды и нуклеотидных последовательностей, кодирующих их. Функциональный вариант иллюстративной последовательности транзитного пептида может представлять собой, например, фрагмент иллюстративной аминокислотной последовательности транзитного пептида (например, N-концевой или C-концевой фрагмент) или модифицированную последовательность полноразмерной иллюстративной аминокислотной последовательности транзитного пептида или фрагмента иллюстративной аминокислотной последовательности транзитного пептида. Иллюстративная аминокислотная последовательность транзитного пептида может быть модифицирована в некоторых вариантах осуществления за счет введения одной или более консервативных аминокислотных замен. «Консервативная» аминокислотная замена представляет собой замену, при которой аминокислотный остаток заменяется аминокислотным остатком, имеющим аналогичную функциональную боковую цепь, аналогичный размер и/или аналогичную гидрофобность. Семейства аминокислот, которые можно использовать для замены другой аминокислоты того же семейства для внесения консервативной замены, известны в данной области. Например, данные семейства аминокислот включают: основные аминокислоты (например, лизин, аргинин и гистидин); кислые аминокислоты (например, аспарагиновая кислота и глютаминовая кислота); незаряженные (при физиологических значениях pH) полярные аминокислоты (например, глицин, аспарагин, глютамин, серин, треонин, тирозин и цитозин); неполярные аминокислоты (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин и триптофан); бета-разветвленные аминокислоты (например, треонин, валин и изолейцин); а также ароматические аминокислоты (например, тирозин, фенилаланин, триптофан и гистидин). Смотри, например, Sambrook et al. (Eds.), выше; и Innis et al., PCR Protocols: A Guide to Methods and Applications, 1990, Academic Press, NY, USA.
Функционально связанные: первая нуклеотидная последовательность является «функционально связанной» со второй нуклеотидной последовательностью, когда первая нуклеотидная последовательность находится в функциональном взаимоотношении со второй нуклеотидной последовательностью. Например, промотор функционально связан с кодирующей последовательностью, если промотор оказывает влияние на транскрипцию или экспрессию кодирующей последовательности. При получении рекомбинантными методами функционально связанные нуклеотидные последовательности, как правило, являются смежными и, если необходимо объединять две кодирующие белок области, в одной и той же рамке считывания. Однако нуклеотидные последовательности не обязательно должны быть смежными, чтобы быть функционально связанными.
Термин «функционально связанные», при использовании применительно к регуляторной последовательности и кодирующей последовательности, означает, что регуляторная последовательность влияет на экспрессию связанной кодирующей последовательности. «Регуляторные последовательности» или «элементы контроля» означают нуклеотидные последовательности, которые влияют на сроки и уровень/степень транскрипции, процессинга или стабильности РНК, или трансляции ассоциированной кодирующей последовательности. Регуляторные последовательности могут включать промоторы; лидерные последовательности трансляции; интроны; энхансеры; структуры стебель-петля; ингибирующие связывание последовательности; последовательности терминации; последовательности узнаваемых сайтов полиаденилирования и так далее. Конкретные регуляторные последовательности могут быть расположены выше и/или ниже кодирующей последовательности, функционально связанной с ними. Кроме того, конкретные регуляторные последовательности, функционально связанные с кодирующей последовательностью, могут быть расположены на связанной комплементарной цепи двухцепочечной молекулы нуклеиновой кислоты.
При использовании применительно к двум или более аминокислотным последовательностям термин «функционально связанные» означает, что первая аминокислотная последовательность находится в функциональном взаимоотношении с по меньшей мере одной из дополнительных аминокислотных последовательностей. Например, транзитный пептид (например, ТПХ) функционально связан со второй аминокислотной последовательностью в составе полипептида, содержащего обе последовательности, если транзитный пептид влияет на экспрессию или перемещение полипептида или второй аминокислотной последовательности.
Промотор: используемый в настоящем документе термин «промотор» означает область ДНК, которая может находиться выше участка начала транскрипции, и которая может участвовать в узнавании и связывании РНК-полимеразы и других белков для инициации транскрипции. Промотор может быть функционально связан с кодирующей последовательностью для экспрессии в клетке или промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с кодирующей последовательностью для экспрессии в клетке. «Растительный промотор» может представлять собой промотор, способный инициировать транскрипцию в растительных клетках. Примеры промоторов, контролируемых стадией развития, включают промоторы, которые предпочтительно инициируют транскрипцию в определенных тканях, таких как листья, корни, семена, волокна, сосуды ксилемы, трахеиды или склеренхима. Такие промоторы называются «тканепредпочтительными». Промоторы, которые инициируют транскрипцию только в определенных тканях, называются «тканеспецифичными». «Специфичный для типа клеток» промотор преимущественно направляет экспрессию в клетках определенных типов в одном или более органах, например, сосудистых клетках в корнях и листьях. «Индуцируемый» промотор может представлять собой промотор, который может находиться под контролем условий окружающей среды. Примеры условий окружающей среды, которые могут инициировать транскрипцию за счет индуцируемых промоторов, включают анаэробные условия и наличие света. Тканеспецифичные, тканепредпочтительные, специфичные для типа клеток и индуцируемые промоторы составляют класс «неконститутивных» промоторов. «Конститутивный» промотор представляет собой промотор, который может быть активен при любых условиях окружающей среды.
Любой индуцируемый промотор можно использовать в некоторых вариантах осуществления изобретения. Смотри Ward et al. (1993), Plant Mol. Biol. 22: 361-366. С индуцируемым промотором скорость транскрипции возрастает в ответ на индуцирующее средство. Иллюстративные индуцируемые промоторы включают, но не ограничиваются ими: промоторы из системы ACEI, реагирующие на медь; ген In2 из кукурузы, который реагирует на антидоты для бензолсульфонамидных гербицидов; Tet репрессор из Tn10 и индуцируемый промотор из гена стероидного гормона, транскрипционная активность которого может быть индуцирована глюкокортикостероидным гормоном (Schena et al. (1991), Proc. Natl. Acad. Sci. USA 88: 0421).
Иллюстративные конститутивные промоторы включают, но не ограничиваются ими: промоторы из вирусов растений, такие как промотор 35S из CaMV; промоторы из генов актина риса; промоторы убиквитина; pEMU; MAS; промотор гистона H3 кукурузы и промотор ALS, Xba1/NcoI 5′-фрагмент структурного гена ALS3 Brassica napus (или нуклеотидную последовательность, аналогичную указанному Xba1/NcoI фрагменту) (международная PCT публикация № WO 96/30530).
Кроме того, в некоторых вариантах осуществления изобретения можно использовать любой тканеспецифичный или тканепредпочтительный промотор. Растения, трансформированные молекулой нуклеиновой кислоты, содержащей кодирующую последовательность, функционально связанную с тканеспецифичным промотором, могут производить продукт кодирующей последовательности исключительно, или предпочтительно, в определенной ткани. Иллюстративные тканеспецифичные или тканепредпочтительные промоторы включают, но не ограничиваются ими: предпочтительный для корней промотор, такой как промотор из гена фазеолина; специфичный для листьев и светоиндуцируемый промотор, такой как промотор из cab или rubisco; специфичный для пыльника промотор, такой как промотор из LAT52; специфичный для пыльцы промотор, такой как промотор из Zm13; и предпочтительный для микроспор промотор, такой как промотор из apg.
Трансформация: используемый в настоящем документе термин «трансформация» или «трансдукция» означает перенос одной или более молекул нуклеиновой кислоты в клетку. Клетка «трансформируется» молекулой нуклеиновой кислоты, трансдуцированной в клетку, когда молекула нуклеиновой кислоты становится стабильно реплицируемой клеткой, либо в результате включения молекулы нуклеиновой кислоты в клеточный геном, либо в результате эписомной репликации. Используемый в настоящем документе термин «трансформация» охватывает все методы, с помощью которых молекулу нуклеиновой кислоты можно вводить в такую клетку. Примеры включают, но не ограничиваются ими: трансфекцию вирусными векторами; трансформацию плазмидными векторами; электропорацию (Fromm et al. (1986), Nature 319: 791-3); липофекцию (Felgner et al. (1987), Proc. Natl. Acad. Sci. USA 84: 7413-7); микроинъекцию (Mueller et al. (1978), Cell 15: 579-85); опосредованный Agrobacterium перенос (Fraley et al. (1983), Proc. Natl. Acad. Sci. USA 80: 4803-7); прямое поглощение ДНК и баллистическую трансфекцию (Klein et al. (1987), Nature 327: 70).
Трансген: экзогенная нуклеотидная последовательность. В некоторых примеры трансген может представлять собой последовательность, которая кодирует полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica. В конкретных примерах трансген может кодировать полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica и по меньшей мере дополнительную пептидную последовательность (например, пептидную последовательность, которая придает устойчивость к гербицидам), для которой желательна экспрессия в пластиде. В этих и других примерах трансген может содержать регуляторные последовательности, функционально связанные с кодирующей последовательностью трансгена (например, промотор). Для целей данного изобретения термин «трансгенный» при использовании применительно к организму (например, растению) означает организм, который содержит экзогенную нуклеотидную последовательность. В некоторых примерах организм, содержащий экзогенную нуклеотидную последовательность, может представлять собой организм, в который нуклеотидная последовательность была введена с помощью методов молекулярной трансформации. В других примерах организм, содержащий экзогенную нуклеотидную последовательность, может представлять собой организм, в который нуклеотидная последовательность была введена, например, интрогрессией или перекрестным опылением у растений.
Транспорт: используемые в настоящем документе термины «транспорт(ы)», «направленность(и)» и «перенос(ы)» относятся к свойству некоторых аминокислотных последовательностей по изобретению, которое способствует движению полипептида, содержащего аминокислотную последовательность, из ядра клетки-хозяина в пластиду клетки-хозяина. В конкретных вариантах осуществления такая аминокислотная последовательность (то есть, синтетическая последовательность ТПХ из Brassica) может быть способна транспортировать примерно 100%, по меньшей мере примерно 95%, по меньшей мере примерно 90%, по меньшей мере примерно 85%, по меньшей мере примерно 80%, по меньшей мере примерно 70%, по меньшей мере примерно 60% и/или по меньшей мере примерно 50% полипептида, содержащего аминокислотную последовательность, в пластиды клетки-хозяина.
Вектор: молекула нуклеиновой кислоты, которую вводят в клетку, например, для получения трансформированной клетки. Вектор может включать нуклеотидные последовательности, которые позволяют ему реплицироваться в клетке-хозяине, такие как точка начала репликации. Примеры векторов включают, но не ограничиваются ими: плазмиду; космиду; бактериофаг или вирус, который переносит экзогенную ДНК в клетку. Вектор может также включать один или более генов, антисмысловые молекулы и/или гены селективных маркеров и другие генетические элементы, известные в данной области. Вектор может трансдуцировать, трансформировать или инфицировать клетку, вызывая, таким образом, экспрессию клеткой молекул нуклеиновой кислоты и/или белков, кодируемых вектором. Вектор необязательно включает материалы, способствующие проникновению молекулы нуклеиновой кислоты в клетку (например, липосому, белковое покрытие и так далее).
Если конкретно не указано или не подразумевается иное, при использовании в настоящем документе грамматическое единственное число означает «по меньшей мере один».
Если иное не оговорено, все технические и научные термины, применяемые в настоящем документе, имеют то же значение, которое им обычно придают специалисты в области техники, к которой относится изобретение. Определения общих молекулярно-биологических терминов можно найти, например, в книге Lewin B., Genes V, Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); и Meyers R.A. (ed.), Molecular Biology and Biotechnology: A Comprehensive Desk Reference, VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8). Все проценты указаны по массе и пропорции в смеси всех растворителей указаны по объему, если нет иных указаний. Все значения температуры приведены в градусах по Цельсию.
IV. Молекулы нуклеиновой кислоты, содержащие последовательности, кодирующие синтетические ТПХ из Brassica
В некоторых вариантах осуществления данное изобретение относится к молекуле нуклеиновой кислоты, содержащей по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью. В конкретных вариантах осуществления интересующая нуклеотидная последовательность может представлять собой нуклеотидную последовательность, которая кодирует интересующий полипептид. В конкретных примерах предложена одна молекула нуклеиновой кислоты, которая кодирует полипептид, в котором последовательность TraP8 или TraP9 слита с N-концом интересующего полипептида.
Синтетический ТПХ из Brassica может происходить из гена EPSPS Brassica. В конкретных примерах таких вариантов осуществления ген EPSPS Brassica может быть геном, который содержит нуклеотидную последовательность, приведенную в SEQ ID NO: 14, или гомологичную нуклеотидную последовательность из другого гена EPSPS, или может быть ортологом гена EPSPS Brassica, содержащего нуклеотидную последовательность, приведенную в SEQ ID NO: 14 (например, геном EPSPS Brassica, содержащим нуклеотидную последовательность, приведенную в SEQ ID NO: 15).
В некоторых вариантах осуществления синтетический транзитный пептид хлоропласта из Brassica может представлять собой химерный ТПХ из Brassica. Синтетический химерный ТПХ из Brassica может быть получен из эталонной последовательности ТПХ Brassica путем присоединения первой непрерывной аминокислотной последовательности, содержащейся в эталонной последовательности ТПХ Brassica, ко второй непрерывной аминокислотной последовательности, содержащейся в другой последовательности ТПХ (например, второй последовательности ТПХ Brassica). В конкретных вариантах осуществления другая последовательность ТПХ, содержащая вторую непрерывную аминокислотную последовательность, может кодироваться последовательностью гомологичного гена из иного генома, чем геном вида Brassica, из которого была получена эталонная последовательность (например, другого вида Brassica, растения, отличного от вида Brassica; низшего фотосинтезирующего эукариота, например, хлорофита; а также прокариота, например, Cyanobacterium или Agrobacterium). Таким образом, нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может быть получена из эталонной генной последовательности, кодирующей ТПХ Brassica, путем слияния нуклеотидной последовательности, кодирующей непрерывную аминокислотную последовательность эталонной последовательности ТПХ Brassica, с нуклеотидной последовательностью, кодирующей непрерывную аминокислотную последовательность из другой последовательности ТПХ, которая гомологична остатку эталонной последовательности ТПХ Brassica. В этих и других примерах непрерывная аминокислотная последовательность эталонной последовательности ТПХ Brassica может быть расположена на 5'-конце или 3'-конце синтетического ТПХ из Brassica.
В некоторых вариантах осуществления синтетический химерный ТПХ из Brassica может быть получен из нескольких последовательностей ТПХ Brassica (включая эталонную последовательность ТПХ Brassica) путем присоединения непрерывной аминокислотной последовательности, содержащейся в одной последовательности ТПХ Brassica, к непрерывной аминокислотной последовательности, содержащейся в другой последовательности ТПХ Brassica. В конкретных вариантах осуществления несколько последовательностей ТПХ Brassica могут кодироваться последовательностями ортологичных генов в разных видах Brassica. В некоторых примерах несколько последовательностей ТПХ Brassica могут представлять собой ровно две последовательности ТПХ Brassica. Таким образом, нуклеотидная последовательность, кодирующая синтетический химерный ТПХ из Brassica, может быть получена из двух гомологичных (например, в значительной степени гомологичных) генных последовательностей, кодирующих ТПХ Brassica (например, последовательностей ортологичных генов), путем слияния нуклеотидной последовательности, кодирующей непрерывную аминокислотную последовательность одной из последовательностей ТПХ Brassica, с нуклеотидной последовательностью, кодирующей непрерывную аминокислотную последовательность из другой из последовательностей ТПХ Brassica, которая гомологична остатку первой последовательности ТПХ Brassica. TraP8 и TraP9 являются иллюстративными примерами такого синтетического химерного ТПХ из Brassica.
Специалисту в данной области будет понятно, что после выбора первой непрерывной аминокислотной последовательности в составе эталонной последовательности ТПХ Brassica, идентификация и выбор непрерывной аминокислотной последовательности из остатка гомологичной последовательности ТПХ в соответствии с вышеуказанным способом являются однозначными и автоматическими. В некоторых примерах первая непрерывная аминокислотная последовательность может составлять от примерно 25 до примерно 41 аминокислот в длину (например, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41 и 42 аминокислоты в длину). В некоторых вариантах осуществления первую непрерывную аминокислотную последовательность в составе эталонной последовательности ТПХ Brassica определяют по положению на 3′-конце фрагмента «SVSL» (SEQ ID NO: 13), который является консервативным в некоторых генах EPSPS Brassica.
Примеры последовательностей синтетического химерного ТПХ из Brassica по вышеуказанному способу представлены в SEQ ID NO: 3 и SEQ ID NO: 4. С учетом вырожденности генетического кода, тип нуклеотидной последовательности, кодирующей эти пептиды, специалист в данной области может легко себе представить. Примеры таких полинуклеотидных последовательностей включают SEQ ID NO: 5, 6, 8 и 9. Данные конкретные примеры иллюстрируют структурные особенности синтетических химерных ТПХ из Brassica за счет включения непрерывных последовательностей из гомологичного ТПХ из одного из нескольких ортологов гена ESPSP B. napus.
Некоторые варианты осуществления включают функциональные варианты синтетического транзитного пептида хлоропласта из Brassica и/или нуклеиновых кислот, кодирующих их. Такие функциональные варианты включают, например, и без ограничений: последовательность, кодирующую синтетический ТПХ из Brassica, которая получена из гомолога и/или ортолога одной или обеих из последовательностей, кодирующих ТПХ Brassica, приведенных в SEQ ID NO: 14 и/или SEQ ID NO: 15, и/или кодируемые ими ТПХ; нуклеиновую кислоту, кодирующую синтетический ТПХ из Brassica, который содержит непрерывную аминокислотную последовательность в составе SEQ ID NO: 1 и/или SEQ ID NO: 2, и/или кодируемый ею ТПХ; укороченную последовательность, кодирующую синтетический ТПХ из Brassica, которая содержит непрерывную нуклеотидную последовательность в составе одной из SEQ ID NO: 5, 6, 8 и 9; укороченную последовательность, кодирующую синтетический ТПХ из Brassica, которая содержит непрерывную нуклеотидную последовательность, которая в значительной степени гомологична одной из SEQ ID NO: 5, 6, 8 и 9; укороченный синтетический ТПХ из Brassica, который содержит непрерывную аминокислотную последовательность в составе одной из SEQ ID NO: 3 и 4; нуклеиновую кислоту, кодирующую синтетический ТПХ из Brassica, содержащий непрерывную аминокислотную последовательность в составе одной из SEQ ID NO: 5, 6, 8 и 9, и/или кодируемый ею ТПХ; нуклеиновую кислоту, кодирующую синтетический ТПХ из Brassica, содержащий непрерывную аминокислотную последовательность в составе одной из SEQ ID NO: 3 и 4, которая имеет одну или более консервативных аминокислотных замен, и/или кодируемый ею ТПХ; и нуклеиновую кислоту, кодирующую синтетический ТПХ из Brassica, содержащий непрерывную аминокислотную последовательность в составе одной из SEQ ID NO: 3 и 4, которая имеет одну или более неконсервативных аминокислотных замен, с продемонстрированной способностью направлять функционально связанный пептид в пластиду в содержащей пластиду клетке, и/или кодируемый ею ТПХ.
Таким образом, некоторые варианты осуществления изобретения включают молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую синтетический химерный ТПХ из Brassica, содержащий одну или более консервативных аминокислотных замен. Такая молекула нуклеиновой кислоты может быть полезна, например, для облегчения манипуляций с кодирующей ТПХ последовательностью по изобретению в молекулярно-биологических методах. Например, в некоторых вариантах осуществления кодирующая ТПХ последовательность по изобретению может быть введена в подходящий вектор для субклонирования последовательности в экспрессионный вектор, или кодирующая ТПХ последовательность по изобретению может быть введена в молекулу нуклеиновой кислоты, которая облегчает получение дополнительной молекулы нуклеиновой кислоты, содержащей кодирующую ТПХ последовательность, функционально связанную с интересующей нуклеотидной последовательностью. В этих и других вариантах осуществления аминокислоты в одном или более положениях в последовательности синтетического химерного ТПХ из Brassica могут быть делетированы. Например, последовательность синтетического химерного ТПХ из Brassica может быть модифицирована таким образом, что аминокислота(ы) в положениях 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 в последовательности делетированы. Можно использовать выравнивание гомологичных последовательностей ТПХ для получения информации о том, какие аминокислоты могут быть делетированы без влияния на функцию синтетического ТПХ.
В конкретных примерах синтетический транзитный пептид хлоропласта из Brassica имеет менее 80 аминокислот в длину. Например, синтетический ТПХ из Brassica может иметь 79, 78, 77, 76, 75, 74, 73, 72, 71, 70, 69, 68, 67, 66, 65, 64, 63, 62, 61, 60 или менее аминокислот в длину. В некоторых примерах синтетический ТПХ из Brassica может иметь примерно 65, примерно 68, примерно 72 или примерно 74 аминокислот в длину. В этих и других примерах синтетический ТПХ из Brassica может содержать аминокислотную последовательность, приведенную в одной из SEQ ID NO: 3 и 4, или функциональный вариант любой из вышеперечисленных. Таким образом, синтетический ТПХ из Brassica может содержать аминокислотную последовательность, содержащую одну из SEQ ID NO: 3 и 4 или ее функциональный вариант, при этом длина синтетического ТПХ из Brassica составляет менее 80 аминокислот. В некоторых примерах синтетический ТПХ из Brassica может содержать аминокислотную последовательность, которая, например, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична одной из SEQ ID NO: 3 и 4.
Все из нуклеотидных последовательностей, кодирующих конкретный синтетический ТПХ из Brassica, например, пептид TraP8 с SEQ ID NO: 3 и пептид TraP9 с SEQ ID NO: 4, или функциональные варианты любого из вышеперечисленных, содержащие любые конкретные делеции и/или консервативные аминокислотные замены, будут признаны специалистами в данной области, ввиду настоящего изобретения. Вырожденность генетического кода создает конечное число кодирующих последовательностей для конкретной аминокислотной последовательности. Выбор конкретной последовательности для кодирования синтетического ТПХ из Brassica остается на усмотрение практика. В различных вариантах применения могут быть желательны различные кодирующие последовательности. Например, для повышения экспрессии синтетического ТПХ из Brassica в конкретном хозяине можно выбирать кодирующую последовательность, которая отражает предпочтительное использование кодонов у хозяина. В качестве примера, синтетический ТПХ из Brassica может кодироваться нуклеотидной последовательностью, приведенной в одной из SEQ ID NO: 5, 6, 8 и 9.
В молекулах нуклеиновой кислоты, предложенных в некоторых вариантах осуществления изобретения, последний кодон нуклеотидной последовательности, кодирующей синтетический ТПХ из Brassica, и первый кодон интересующей нуклеотидной последовательности могут быть разделены любым количеством триплетов нуклеотидов, например, без кодирования интрона или «остановки». В некоторых примерах последовательность, кодирующая первые аминокислоты зрелого белка, обычно связанные с транзитным пептидом хлоропласта в природном полипептиде-предшественнике, может присутствовать между последним кодоном нуклеотидной последовательности, кодирующей синтетический ТПХ из Brassica, и первым кодоном интересующей нуклеотидной последовательности. Последовательность, разделяющая нуклеотидную последовательность, кодирующую синтетический ТПХ из Brassica, и первый кодон интересующей нуклеотидной последовательности, может, например, состоять из любой последовательности так, что закодированная аминокислотная последовательность, скорее всего, не будет существенно изменять трансляцию химерного полипептида и его транслокацию в пластиду. В этих и других вариантах осуществления последний кодон нуклеотидной последовательности, кодирующей синтетический транзитный пептид хлоропласта из Brassica, может быть слит в фазовом регистре с первым кодоном интересующей нуклеотидной последовательности, непосредственно прилегающим к нему, или отделен от него не более чем короткой пептидной последовательностью, такой как закодированная синтетическим нуклеотидным линкером (например, нуклеотидным линкером, который мог быть использован для достижения слияния).
В некоторых вариантах осуществления может быть желательным модифицировать нуклеотиды интересующей нуклеотидной последовательности и/или последовательности, кодирующей синтетический ТПХ из Brassica, слитой с ней в единую кодирующую последовательность, например, для повышения экспрессии кодирующей последовательности в конкретном хозяине. Генетический код является избыточным с 64 возможными кодонами, однако большинство организмов предпочтительно используют подмножество этих кодонов. Кодоны, которые используются у видов наиболее часто, называются оптимальными кодонами, а те, которые используются не очень часто, классифицируются как редкие или малоиспользуемые кодоны. Zhang et al. (1991), Gene 105: 61-72. Кодоны могут быть заменены для отражения предпочтительного использования кодонов у конкретного хозяина в процессе, который иногда называют «оптимизацией кодонов». Можно получать, например, оптимизированные кодирующие последовательности, содержащие кодоны, предпочтительно используемые у конкретного прокариотического или эукариотического хозяина, для повышения скорости трансляции или для получения рекомбинантных транскриптов РНК, имеющих желательные свойства (например, больший период полураспада, по сравнению с транскриптами, полученными из неоптимизированной последовательности).
Любой полипептид может быть направлен в пластиду содержащей пластиду клетки путем включения последовательности синтетического ТПХ из Brassica. Например, в некоторых вариантах осуществления полипептид может быть связан с последовательностью синтетического ТПХ из Brassica для направления полипептида в пластиду в клетке, в которой экспрессируется молекула связанных между собой полипептида-ТПХ. В конкретных вариантах осуществления полипептид, направляемый в пластиду за счет включения последовательности синтетического ТПХ из Brassica, может представлять собой, например, полипептид, который обычно экспрессируется в пластиде клетки, в которой полипептид экспрессируется естественным образом. Например, и без ограничения, полипептид, направляемый в пластиду за счет включения последовательности синтетического ТПХ из Brassica, может представлять собой полипептид, вовлеченный в устойчивость к гербицидам, устойчивость к вирусам, устойчивость к бактериальным патогенам, устойчивость к насекомым, устойчивость к нематодам или устойчивость к грибкам. Смотри, например, патенты США 5569823, 5304730, 5495071, 6329504 и 6337431. Полипептид, направляемый в пластиду за счет включения последовательности синтетического ТПХ из Brassica, может альтернативно представлять собой, например, и без ограничений, полипептид, важный для мощности растения или урожайности (включая полипептиды, вовлеченные в устойчивость к экстремальным температурам, состоянию почвы, уровням освещенности, содержанию воды и химическому составу окружающей среды), или полипептид, который можно использовать в качестве маркера для идентификации растений, содержащих интересующий признак (например, продукт гена селективного маркера, полипептид, вовлеченный в окраску семян и так далее).
Неограничивающие примеры полипептидов, вовлеченных в устойчивость к гербицидам, которые могут быть связаны с последовательностью синтетического ТПХ из Brassica, в некоторых вариантах осуществления изобретения включают: ацетолактат синтазу (ALS), мутантную ALS и предшественники ALS (см., например, патент США 5013659); EPSPS (см., например, патенты США 4971908 и 6225114), например, CP4 EPSPS, EPSPS класса III или EPSPS класса IV; ферменты, которые модифицируют физиологический процесс, происходящий в пластиде, включая фотосинтез, а также синтез жирных кислот, аминокислот, масел, аротеноидов, терпеноидов, крахмала и так далее. Другие неограничивающие примеры полипептидов, которые могут быть связаны с синтетическим транзитным пептидом хлоропласта из Brassica, в конкретных вариантах осуществления включают: зеаксантин эпоксидазу, холин-монооксигеназу, феррохелатазу, десатуразу омега-3 жирных кислот, глютамин-синтетазу, модифицирующие крахмал ферменты, полипептиды, вовлеченные в синтез незаменимых аминокислот, провитамин A, гормоны, белки Bt-токсинов и так далее. Нуклеотидные последовательности, кодирующие вышеуказанные пептиды, известны в данной области, и такие нуклеотидные последовательности могут быть функционально связаны с нуклеотидной последовательностью, кодирующей синтетический ТПХ из Brassica, для экспрессии полипептида, содержащего интересующий полипептид, связанный с синтетическим ТПХ из Brassica. Кроме того, специалисты в данной области могут идентифицировать дополнительные нуклеотидные последовательности, кодирующие любой из вышеуказанных полипептидов (например, путем клонирования генов, имеющих высокую степень гомологии с другими генами, кодирующими конкретный полипептид). После идентификации такой нуклеотидной последовательности довольно просто разработать нуклеотидную последовательность, содержащую последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с идентифицированной нуклеотидной последовательностью, или последовательностью, кодирующей эквивалентный полипептид.
V. Экспрессия полипептидов, содержащих синтетический транзитный пептид хлоропласта из Brassica
В некоторых вариантах осуществления по меньшей мере одну молекулу(ы) нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica, или его функциональный эквивалент, можно вводить в клетку, ткань или организм для экспрессии в них полипептида. В конкретных вариантах осуществления молекула нуклеиновой кислоты может содержать интересующую нуклеотидную последовательность, функционально связанную с нуклеотидной последовательностью, кодирующей синтетический ТПХ из Brassica. Например, молекула нуклеиновой кислоты может содержать кодирующую последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica и по меньшей мере одну дополнительную пептидную последовательность, кодируемую интересующей нуклеотидной последовательностью. В некоторых вариантах осуществления молекулу нуклеиновой кислоты по изобретению можно вводить в содержащие пластиду клетку, ткань или организм хозяина (например, клетку растения, ткань растения и растение) так, что полипептид может экспрессироваться с молекулы нуклеиновой кислоты в содержащих пластиду клетке, ткани или организме хозяина, при этом экспрессируемый полипептид содержит по меньшей мере один синтетический ТПХ из Brassica и по меньшей мере дополнительную пептидную последовательность, кодируемую интересующей нуклеотидной последовательностью. В некоторых примерах синтетический ТПХ из Brassica из такого экспрессированного полипептида может способствовать направлению части полипептида, содержащего по меньшей мере дополнительную пептидную последовательность, в пластиду клетки, ткани или организма хозяина.
В некоторых вариантах осуществления молекулу нуклеиновой кислоты по изобретению можно вводить в содержащую пластиду клетку с использованием любой методологии, известной специалистам в данной области. В конкретных вариантах осуществления клетка, ткань или организм хозяина может вступать в контакт с молекулой нуклеиновой кислоты по изобретению для введения молекулы нуклеиновой кислоты в клетку, ткань или организм. В конкретных вариантах осуществления клетка может быть трансформирована молекулой нуклеиновой кислоты по изобретению так, что молекула нуклеиновой кислоты вводится в клетку и молекула нуклеиновой кислоты стабильно интегрируется в геном клетки. В некоторых вариантах осуществления молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью, можно использовать для трансформации клетки, например, содержащей пластиду клетки (например, клетки растения). Для инициации или усиления экспрессии молекула нуклеиновой кислоты может содержать одну или более регуляторных последовательностей, каковые регуляторные последовательности могут быть функционально связаны с нуклеотидной последовательностью, кодирующей полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica.
Молекула нуклеиновой кислоты может, например, представлять собой векторную систему, включая, например, линейную или замкнутую кольцевую плазмиду. В конкретных вариантах осуществления вектор может представлять собой экспрессионный вектор. Нуклеотидные последовательности по изобретению могут, например, быть вставлены в вектор таким образом, что нуклеотидная последовательность является функционально связанной с одной или более регуляторными последовательностями. Многие векторы доступны для этой цели, и выбор конкретного вектора может зависеть, например, от размера нуклеиновой кислоты, которую предстоит вставлять в вектор, и конкретной клетки-хозяина, которую предстоит трансформировать данным вектором. Вектор, как правило, содержит различные компоненты, характер которых зависит от функции вектора (например, амплификация ДНК и экспрессия ДНК) и от конкретной клетки(ок)-хозяина(ев), с которыми данный вектор совместим.
Некоторые варианты осуществления могут включать трансформирующий вектор растений, который содержит нуклеотидную последовательность, содержащую по меньшей мере одну из описанных выше регуляторных последовательностей, функционально связанную с одной или более нуклеотидными последовательностями, кодирующими полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica. Одна или более нуклеотидных последовательностей могут экспрессироваться под контролем регуляторной последовательности(ей) в клетке, ткани или организме растения, с образованием полипептида, содержащего синтетический ТПХ из Brassica, который направляет по меньшей мере часть полипептида в пластиду клетки, ткани или организма растения.
В некоторых вариантах осуществления регуляторная последовательность, функционально связанная с нуклеотидной последовательностью, кодирующей полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica, может представлять собой последовательность промотора, который действует в клетке-хозяине, такой как бактериальная клетка, в которой молекула нуклеиновой кислоты должна быть амплифицирована, или клетка растения, в которой молекула нуклеиновой кислоты должна быть экспрессирована. Промоторы, подходящие для использования в молекулах нуклеиновой кислоты по изобретению, включают те, которые являются индуцируемыми, вирусными, синтетическими или конститутивными, все из которых хорошо известны в данной области. Неограничивающие примеры промоторов, которые могут быть полезны в вариантах осуществления изобретения, описаны в: патентах США № 6437217 (промотор RS81 кукурузы); 5641876 (промотор актина риса); 6426446 (промотор RS324 кукурузы); 6429362 (промотор PR-1 кукурузы); 6232526 (промотор A3 кукурузы); 6177611 (конститутивные промоторы кукурузы); 5322938, 5352605, 5359142 и 5530196 (промотор 35S); 6433252 (промотор L3 олеозина кукурузы); 6429357 (промотор актина 2 риса и интрон актина 2 риса); 6294714 (индуцируемые светом промоторы); 6140078 (индуцируемые солью промоторы); 6252138 (индуцируемые патогенами промоторы); 6175060 (индуцируемые дефицитом фосфора промоторы); 6388170 (двунаправленные промоторы); 6635806 (промотор гамма-коиксина); и патентной заявке США серийный № 09/757089 (промотор альдолазы хлоропластов кукурузы).
Дополнительные иллюстративные промоторы включают промотор нопалинсинтазы (NOS) (Ebert et al. (1987), Proc. Natl. Acad. Sci. USA 84(16): 5745-9); промотор октопинсинтазы (OCS) (который находится на индуцирующих опухоли плазмидах Agrobacterium tumefaciens); каулимовирусные промоторы, такие как промотор 19S вируса мозаики цветной капусты (CaMV) (Lawton et al. (1987), Plant Mol. Biol. 9: 315-24); промотор CaMV 35S (Odell et al. (1985), Nature 313: 810-2; 35S-промотор вируса мозаики норичника (Walker et al. (1987), Proc. Natl. Acad. Sci. USA 84(19): 6624-8); промотор сахароза синтазы (Yang and Russell (1990), Proc. Natl. Acad. Sci. USA 87: 4144-8); сложный промотор R гена (Chandler et al. (1989), Plant Cell 1: 1175-83); промотор гена хлорофилл a/b-связывающего белка; CaMV35S (патенты США №№ 5322938, 5352605, 5359142 и 5530196); FMV35S (патенты США №№ 6051753 и 5378619); промотор PC1SV (патент США № 5850019); промотор SCP1 (патент США № 6677503) и промоторы AGRtu.nos (регистрационный № GenBank V00087; Depicker et al. (1982), J. Mol. Appl. Genet. 1: 561-73; Bevan et al. (1983), Nature 304: 184-7).
В конкретных вариантах осуществления молекулы нуклеиновой кислоты по изобретению могут содержать тканеспецифичный промотор. Тканеспецифичный промотор представляет собой нуклеотидную последовательность, которая направляет транскрипцию на высоком уровне функционально связанной нуклеотидной последовательности в ткани, для которой данный промотор является специфичным, в сравнении с другими тканями организма. Примеры тканеспецифических промоторов включают, без ограничения: специфичные для тапетума промоторы; специфичные для пыльника промоторы; специфичные для пыльцы промоторы (смотри, например, патент США № 7141424 и международную PCT публикацию № WO 99/042587); специфичные для семяпочки промоторы (смотри, например, патентную заявку США № 2001/047525 A1); специфичные для плодов промоторы (смотри, например, патенты США №№ 4943674, и 5753475); а также специфичные для семян промоторы (смотри, например, патенты США №№ 5420034 и 5608152). В некоторых вариантах осуществления в композиции или способе по изобретению можно использовать специфичный для стадии развития промотор (например, промотор, активный на более поздней стадии развития).
Дополнительные регуляторные последовательности, которые в некоторых вариантах осуществления могут быть функционально связаны с молекулой нуклеиновой кислоты, включают 5' UTRs, расположенные между последовательностью промотора и кодирующей последовательностью, которые действуют как лидерная последовательность трансляции. Лидерная последовательность трансляции присутствует в полностью процессированной мРНК и она может влиять на процессинг первичного транскрипта и/или стабильность РНК. Примеры лидерных последовательностей трансляции включают лидерные последовательности белков теплового шока кукурузы и петунии (патент США № 5362865), лидерные последовательности белков оболочки вирусов растений, лидерные последовательности rubisco растений и другие. Смотри, например, Turner and Foster (1995), Molecular Biotech. 3(3): 225-36. Неограничивающие примеры 5' UTR включают: GmHsp (патент США № 5659122); PhDnaK (патент США № 5362865); AtAnt1; TEV (Carrington and Freed (1990), J. Virol. 64: 1590-7) и AGRtunos (регистрационный № GenBank V00087; и Bevan et al. (1983), Nature 304: 184-7).
Дополнительные регуляторные последовательности, которые в некоторых вариантах осуществления могут быть функционально связаны с молекулой нуклеиновой кислоты, также включают 3' нетранслируемые последовательности, 3'-области терминации транскрипции или области полиаденилирования. Они представляют собой генетические элементы, расположенные ниже нуклеотидной последовательности, и включают полинуклеотиды, которые обеспечивают сигнал полиаденилирования и/или другие регуляторные сигналы, способные влиять на транскрипцию или процессинг мРНК. Сигнал полиаденилирования действует в растениях, вызывая добавление полиаденилатных нуклеотидов к 3'-концу предшественника мРНК. Последовательность полиаденилирования может быть получена из различных генов растений или из генов T-ДНК. Неограничивающим примером 3'-области терминации транскрипции является 3'-область нопалинсинтазы (nos 3'; Fraley et al. (1983), Proc. Natl. Acad. Sci. USA 80: 4803-7). Пример использования различных 3' нетранслируемых областей приведен в статье Ingelbrecht et al., (1989), Plant Cell 1: 671-80. Неограничивающие примеры сигналов полиаденилирования включают сигнал из гена RbcS2 Pisum sativum (Ps.RbcS2-E9; Coruzzi et al. (1984), EMBO J. 3: 1671-9) и AGRtu.nos (регистрационный № GenBank E01312).
Рекомбинантная молекула нуклеиновой кислоты или вектор по настоящему изобретению могут содержать селективный маркер, который придает селективный фенотип трансформированной клетке, такой как клетка растения. Селективные маркеры можно также использовать для селекции растений или клеток растений, которые содержат рекомбинантную молекулу нуклеиновой кислоты по изобретению. Маркер может кодировать устойчивость к биоцидам, устойчивость к антибиотикам (например, канамицину, генетицину (G418), блеомицину, гигромицину и так далее) или устойчивость к гербицидам (например, глифосату и так далее). Примеры селективных маркеров включают, но не ограничиваются ими: ген neo, который придает устойчивость к канамицину и может быть выбран для использования канамицина, G418 и так далее; ген pat или bar, который придает устойчивость к биалафосу; мутантный ген EPSP синтазы, который придает устойчивость к глифосату; ген нитрилазы, который придает устойчивость к бромоксинилу; мутантный ген ацетолактат синтазы (ALS), который придает устойчивость к имидазолинону или сульфонилмочевине; и ген DHFR устойчивости к метотрексату. Доступны многие селективные маркеры, придающие устойчивость к ампициллину, блеомицину, хлорамфениколу, гентамицину, гигромицину, канамицину, линкомицину, метотрексату, фосфинотрицину, пуромицину, спектиномицину, рифампицину, стрептомицину и тетрациклину, и тому подобные. Примеры таких селективных маркеров приведены, например, в патентах США 5550318, 5633435, 5780708 и 6118047.
Рекомбинантная молекула нуклеиновой кислоты или вектор по настоящему изобретению может также или альтернативно включать скринируемый маркер. Скринируемые маркеры можно использовать для мониторинга экспрессии. Иллюстративные скринируемые маркеры включают ген β-глюкуронидазы или uidA (GUS), кодирующий фермент, для которого известны различные хромогенные субстраты (Jefferson et al. (1987), Plant Mol. Biol. Rep. 5: 387-405); ген R-локуса, который кодирует продукт, регулирующий производство пигментов антоцианов (красный цвет) в тканях растений (Dellaporta et al. (1988), «Molecular cloning of the maize R-nj allele by transposon tagging with Ac». В 18th Stadler Genetics Symposium, P. Gustafson and R. Appels, eds. (New York: Plenum), pp. 263-82); ген β-лактамазы (Sutcliffe et al. (1978), Proc. Natl. Acad. Sci. USA 75: 3737-41); ген, кодирующий фермент, для которого известны различные хромогенные субстраты (например, PADAC, хромогенный цефалоспорин); ген люциферазы (Ow et al. (1986), Science 234: 856-9); ген xylE, кодирующий катехол-диоксигеназу, которая может превращать хромогенные катехолы (Zukowski et al. (1983), Gene 46(2-3): 247-55); ген амилазы (Ikatu et al. (1990) Bio/Technol. 8: 241-2); ген тирозиназы, кодирующий фермент, способный окислять тирозин до ДОФА и допахинона, который, в свою очередь, конденсируется до меланина (Katz et al. (1983), J. Gen. Microbiol. 129: 2703-14), и ген α-галактозидазы.
Подходящие методы трансформации клеток-хозяев включают любой метод, с помощью которого ДНК можно вводить в клетку, например, и без ограничений: путем трансформации протопластов (смотри, например, патент США 5508184); путем опосредованного высушиванием/ингибированием поглощения ДНК (смотри, например, Potrykus et al. (1985), Mol. Gen. Genet. 199: 183-8); путем электропорации (смотри, например, патент США 5384253); путем перемешивания с волокнами карбида кремния (смотри, например, патенты США 5302523 и 5464765); путем опосредованной Agrobacterium трансформации (смотри, например, патенты США 5563055, 5591616, 5693512, 5824877, 5981840 и 6384301) и путем ускорения покрытых ДНК частиц (смотри, например, патенты США 5015580, 5550318, 5538880, 6160208, 6399861 и 6403865) и так далее. В результате применения таких методов, как эти, клетки практически любых видов могут быть стабильно трансформированы. В некоторых вариантах осуществления трансформирующая ДНК интегрируется в геном клетки-хозяина. В случае многоклеточных видов, трансгенные клетки могут быть регенерированы в трансгенный организм. Альтернативно, трансгенные клетки могут быть не способны регенерировать в растение. Любые из этих методов можно использовать для получения трансгенного растения, например, содержащего одну или более нуклеотидных последовательностей по изобретению в геноме трансгенного растения.
Наиболее широко используемый способ введения экспрессионного вектора в растения основан на природной системе трансформации Agrobacterium. A. tumefaciens и A. rhizogenes являются патогенными для растений почвенными бактериями, которые генетически трансформируют клетки растений. Плазмиды Ti и Ri из A. tumefaciens и A. rhizogenes, соответственно, несут гены, ответственные за генетическую трансформацию растения. Плазмиды Ti (индуцирующие опухоли) содержат крупный сегмент, известный как T-ДНК, который переносится в трансформированные растения. Другой сегмент плазмиды Ti, область vir, отвечает за перенос T-ДНК. Область T-ДНК ограничена концевыми повторами. В некоторых модифицированных бинарных векторах индуцирующие опухоли гены делетированы, и функции области vir используются для переноса чужеродной ДНК, ограниченной пограничными последовательностями T-ДНК. T-область может также содержать, например, селективный маркер для эффективного восстановления трансгенных растений и клеток, и сайт множественного клонирования для вставки предназначенных для переноса последовательностей, таких как нуклеиновая кислота, кодирующая синтетический ТПХ из Brassica.
Таким образом, в некоторых вариантах осуществления вектор для трансформации растений может быть получен из плазмиды Ti A. tumefaciens (см., например, патенты США № 4536475, 4693977, 4886937 и 5501967; и европейский патент EP 0122791) или плазмиды Ri A. rhizogenes. Дополнительные векторы для трансформации растений включают, например, и без ограничений, те, которые описаны в статьях Herrera-Estrella et al. (1983), Nature 303: 209-13; Bevan et al. (1983), Nature 304: 184-7; Klee et al. (1985), Bio/Technol. 3: 637-42 и в европейском патенте EP 0 120 516, и те, которые получены из любого из вышеперечисленных. Другие бактерии, такие как Sinorhizobium, Rhizobium и Mesorhizobium, которые естественным образом взаимодействуют с растениями, могут быть модифицированы для опосредования переноса генов в целый ряд различных растений. Эти связанные с растениями симбиотические бактерии можно сделать компетентными для переноса генов путем введения в них как обезвреженной плазмиды Ti, так и подходящего бинарного вектора.
После введения экзогенной ДНК в клетки-реципиенты трансформированные клетки, как правило, идентифицируют для дальнейшего культивирования и регенерации растения. Для улучшения способности идентифицировать трансформированные клетки может быть желательным использование селективного или скринируемого маркерного гена, как описано ранее, с вектором, используемым для получения трансформанта. В случае использования селективного маркера трансформированные клетки идентифицируют среди популяции потенциально трансформированных клеток, подвергая клетки воздействию селективного агента или агентов. В случае использования скринируемого маркера можно проводить скрининг клеток на признак желаемого маркерного гена.
Клетки, которые выживают после воздействия селективного агента или агентов, или клетки, которые признаны положительными при проведении скрининга, можно культивировать в средах, которые обеспечивают регенерацию растений. В некоторых вариантах осуществления любые подходящие среды для культивирования тканей растения (например, среды MS и N6) можно модифицировать путем включения дополнительных веществ, таких как регуляторы роста. Ткань можно поддерживать на основной среде с регуляторами роста до образования достаточного количества ткани для начала работы по регенерации растения, или до проведения неоднократных раундов отбора вручную до тех пор, пока морфология ткани не станет подходящей для регенерации (например, по меньшей мере 2 недели), затем переносить в среды, способствующие образованию побегов. Культуры переносят периодически до достаточного образования побегов. После образования побегов их можно переносить в среды, способствующие образованию корней. После достаточного образования корней растения можно переносить в почву для дальнейшего роста и созревания.
Для подтверждения присутствия интересующей нуклеиновой кислоты (например, нуклеотидной последовательности, кодирующей полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica) в регенерирующем растении можно проводить различные анализы. Такие анализы включают, например, например: молекулярно-биологические анализы, такие как саузерн- и нозерн-блоттинг, ПЦР и секвенирование нуклеиновых кислот; биохимические анализы, такие как определение присутствия белкового продукта, например, иммунологическими методами (ELISA и/или вестерн-блоттинг) или по ферментативной функции; анализы частей растений, например, анализы листьев и корней; а также анализ фенотипа целого регенерированного растения.
В качестве примера, интеграционные объекты можно анализировать методом ПЦР-амплификации с использованием, например, олигонуклеотидных праймеров, специфичных для интересующей нуклеотидной последовательности. Генотипирование методом ПЦР, как известно, включает, но не ограничивается ими, амплификацию с помощью полимеразной цепной реакции (ПЦР) геномной ДНК, полученной из выделенной ткани растения-хозяина, которая, согласно прогнозам, содержит интересующую молекулу нуклеиновой кислоты, интегрированную в геном, с последующим стандартным клонированием и анализом последовательности амплифицированных ПЦР-продуктов. Методы ПЦР генотипирования подробно описаны (смотри, например, Rios, G. et al. (2002), Plant J. 32: 243-53) и могут быть применены к геномной ДНК, полученной из любого вида растений (например, Z. mays или G. max) или любого типа ткани, включая культуры клеток.
Трансгенное растение, полученное с использованием зависимых от Agrobacterium методов трансформации, как правило, содержит одну рекомбинантную последовательность ДНК, вставленную в одну хромосому. Одна рекомбинантная последовательность ДНК называется «трансгенный объект» или «интеграционный объект». Такие трансгенные растения являются гетерозиготными по вставленной последовательности ДНК. В некоторых вариантах осуществления трансгенное растение, гомозиготное в отношении трансгена, можно получать половым скрещиванием (самоопылением) независимого сегреганта трансгенного растения, содержащего одну последовательность экзогенного гена, с самим собой, например, F0 растения, для получения F1 семян. Четвертая часть полученных F1 семян будут гомозиготными в отношении трансгена. Прорастание F1 семян приводит к получению растений, которые можно тестировать на гетерозиготность, как правило, с использованием анализа SNP или анализа термальной амплификации, который позволяет различать гетерозиготы и гомозиготы (то есть, анализ зиготности).
В конкретных вариантах осуществления копии по меньшей мере одного полипептида, содержащего по меньшей мере один синтетический ТПХ из Brassica, продуцируются в содержащей пластиду клетке, в которую была введена по меньшей мере одна молекула(ы) нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую по меньшей мере один полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica. Каждый полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica, может экспрессироваться с нескольких нуклеотидных последовательностей, введенных в различные трансформационные объекты, или с одной нуклеотидной последовательности, введенной в один трансформационный объект. В некоторых вариантах осуществления множество таких полипептидов экспрессируются под контролем одного промотора. В других вариантах осуществления множество таких полипептидов экспрессируются под контролем нескольких промоторов. Могут экспрессироваться одиночные полипептиды, содержащие несколько пептидных последовательностей, при этом каждая из пептидных последовательностей должна быть направлена в пластиду.
В дополнение к прямой трансформации растения рекомбинантной молекулой нуклеиновой кислоты, трансгенные растения можно получать путем скрещивания первого растения, имеющего по меньшей мере один трансгенный объект, со вторым растением без такого объекта. Например, рекомбинантную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica, можно вводить в растение первой линии, которое поддается трансформации, получая трансгенное растение, это трансгенное растение можно скрещивать с растением второй линии для интрогрессии нуклеотидной последовательности, кодирующей полипептид, в растение второй линии.
VI. Растительные материалы, содержащие полипептид, направляемый синтетическим транзитным пептидом хлоропласта из Brassica
В некоторых вариантах осуществления предложена клетка растения, содержащая нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica. В конкретных вариантах осуществления такую клетку растения можно получать путем трансформации клетки растения, которая не способна к регенерации для образования растения. В некоторых вариантах осуществления предложено растение, содержащее клетку растения, содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica. В конкретных вариантах осуществления такое растение можно получать путем трансформации ткани растения или клетки растения и регенерации целого растения. В других вариантах осуществления такое растение можно получать из коммерческого источника или путем интрогрессии нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica, в зародышевую плазму. В конкретных вариантах осуществления такое растение содержит клетки растения, содержащие нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica, которые не способны к регенерации для образования растения. Также предложены растительные материалы, содержащие клетку растения, содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica. Такой растительный материал можно получать из растения, содержащего клетку растения.
Трансгенное растение, нерегенерируемая клетка растения или растительный материал, содержащий нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica, могут в некоторых вариантах осуществления проявлять одну или более из следующих характеристик: экспрессию полипептида в клетке растения; экспрессию части полипептида в пластиде клетки растения; введение полипептида из цитозоля клетки растения в пластиду клетки; специфичную для пластиды экспрессию полипептида в клетке растения и/или локализацию полипептида в клетке растения. Такое растение может дополнительно иметь один или более желаемых признаков, отличных от экспрессии закодированного полипептида. Такие признаки могут включать, например: устойчивость к насекомым, другим вредителям и болезнетворным агентам; толерантность к гербицидам; повышенную устойчивость, урожайность или срок годности; толерантность к условиям окружающей среды; производство фармацевтических веществ; производство промышленной продукции, а также усовершенствованные пищевые свойства.
Трансгенное растение по изобретению может представлять собой любое растение, способное подвергаться трансформации молекулой нуклеиновой кислоты по изобретению. Соответственно, растение может быть двудольным или однодольным. Неограничивающие примеры двудольных растений, которые можно использовать в настоящих способах, включают Arabidopsis, люцерну, бобы, брокколи, капусту, морковь, цветную капусту, сельдерей, китайскую капусту, хлопок, огурцы, баклажаны, салат, дыню, горох, перец, арахис, картофель, тыкву, редис, рапс, шпинат, сою, тыкву крупноплодную, сахарную свеклу, подсолнечник, табак, томаты и арбуз. Неограничивающие примеры однодольных растений, которые можно использовать в настоящих способах, включают кукурузу, Brassica, лук, рис, сорго, пшеницу, рожь, просо, сахарный тростник, овес, тритикале, просо прутьевидное и газонную траву. Трансгенные растения по изобретению можно использовать или культивировать любым способом.
В некоторых вариантах осуществления также предложены товарные продукты, содержащие одну или более нуклеотидных последовательностей, кодирующих полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica, например, товарный продукт, полученный из рекомбинантного растения или семени, содержащего одну или более из таких нуклеотидных последовательностей. Товарные продукты, содержащие одну или более нуклеотидных последовательностей, кодирующих полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica, включают, например, и без ограничений: продукты питания, муку, масла или дробленые или целые зерна, или семена растения, содержащие одну или более нуклеотидных последовательностей, кодирующих полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica. Обнаружение одной или более нуклеотидных последовательностей, кодирующих полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica, в одном или более товарах или товарных продуктах свидетельствует де-факто, что товар или товарный продукт был по меньшей мере частично получен из растения, содержащего одну или более нуклеотидных последовательностей, кодирующих полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica. В конкретных вариантах осуществления товарный продукт по изобретению содержит поддающееся определению количество нуклеотидной последовательности, кодирующей полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica. В некоторых вариантах осуществления такие товарные продукты могут быть получены, например, путем получения трансгенных растений и приготовления пищи или корма из них.
В некоторых вариантах осуществления трансгенное растение, нерегенерируемая клетка растения или семя, содержащие трансген, содержащий нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический ТПХ из Brassica, также могут содержать по меньшей мере один другой трансгенный объект в своем геноме, включая, без ограничения: трансгенный объект, с которого транскрибируется молекула мРНК; ген, кодирующий инсектицидный белок (например, инсектицидный белок Bacillus thuringiensis); ген толерантности к гербицидам (например, ген, обеспечивающий толерантность к глифосату); и ген, способствующий формированию желательного фенотипа в трансгенном растении (например, повышенной урожайности, измененного метаболизма жирных кислот или восстановления цитоплазматического мужского бесплодия).
VII. Опосредованная синтетическим транзитным пептидом хлоропласта из Brassica локализация генных продуктов в пластидах
Некоторые варианты осуществления настоящего изобретения относятся к способу экспрессии и/или локализации генного продукта в пластиде (например, хлоропласте). В конкретных вариантах осуществления генный продукт может быть продуктом маркерного гена, например, флуоресцентной молекулой. Экспрессия генного продукта в виде части полипептида, также содержащего синтетический ТПХ из Brassica, может обеспечить систему для оценки пластида-локализующих способностей конкретной последовательности синтетического ТПХ из Brassica. В некоторых вариантах осуществления экспрессию продукта маркерного гена в виде части полипептида, содержащего синтетический ТПХ из Brassica, используют для направления экспрессии продукта маркерного гена в пластиду клетки, в которой экспрессируется полипептид. В некоторых вариантах осуществления такой продукт маркерного гена локализован в пластиде(ах) клетки-хозяина. Например, продукт маркерного гена может экспрессироваться на более высоких уровнях в пластиде(ах), чем в цитозоле или других органеллах клетки-хозяина; продукт маркерного гена может экспрессироваться на гораздо более высоких уровнях в пластиде(ах); продукт маркерного гена может экспрессироваться практически только в пластиде(ах); или продукт маркерного гена может экспрессироваться полностью в пластиде(ах) так, что экспрессию в цитозоле или иных органеллах, чем пластиды, невозможно обнаружить.
В некоторых вариантах осуществления полипептид, содержащий функциональный вариант синтетического ТПХ из Brassica, причем полипептид функционально связан с продуктом маркерного гена, используют для оценки характеристик функционального варианта пептида. Например, последовательность синтетического ТПХ из Brassica можно изменять, например, путем внесения по меньшей мере одной консервативной мутации(й) в синтетический ТПХ из Brassica, и полученный вариантный пептид может быть связан с продуктом маркерного гена. После экспрессии в подходящей клетке-хозяине (например, клетке, в которой один или более регуляторных элементов в экспрессионном конструкте являются действующими), можно определять экспрессию продукта маркерного гена. Путем сравнения субклеточной локализации продукта маркерного гена между конструктом эталонный синтетический ТПХ из Brassica-маркер и конструктом вариантный пептид-маркер, можно определять, обеспечивает ли вариантный пептид, например, лучшую локализацию в пластиде или практически идентичную локализацию в пластиде. Такой вариант можно считать функциональным вариантом. Благодаря идентификации функциональных вариантов синтетического ТПХ из Brassica, которые обеспечивают лучшую локализацию в пластиде, имеющиеся в таких вариантах мутации можно вносить в другие варианты синтетических ТПХ из Brassica. Проведение нескольких раундов такого процесса оценки и последующее внесение идентифицированных благоприятных мутаций в последовательность синтетического ТПХ из Brassica может стать циклическим процессом для оптимизации последовательности синтетического ТПХ из Brassica. Такие оптимизированные последовательности синтетического ТПХ из Brassica и нуклеотидные последовательности, кодирующие их, считаются частью настоящего изобретения, независимо от того, могут или не могут такие оптимизированные последовательности синтетического ТПХ из Brassica быть далее оптимизированы путем дополнительных мутаций.
Литературные источники, обсуждаемые в настоящем документе, приведены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в настоящем документе не должно быть истолковано как признание того, что авторы изобретения не вправе предвосхищать такое раскрытие на основании предшествующего изобретения.
Следующие далее примеры приведены для иллюстрации некоторых конкретных признаков и/или аспектов. Данные примеры не должны рассматриваться как ограничивающие изобретение конкретными описанными признаками или аспектами.
ПРИМЕРЫ
Пример 1: Разработка и получение химерных последовательностей транзитного пептида хлоропласта (TraP)
Пластиды представляют собой цитоплазматические органеллы, имеющиеся у видов высших растений и присутствующие во всех тканях растений. Хлоропласты являются пластидами определенного типа, присутствующими в зеленых фотосинтезирующих тканях, которые отвечают за важные физиологические функции. Например, одной такой основной физиологической функцией является синтез ароматических аминокислот, необходимых для растения. В этом биосинтетическом пути необходимы ферменты, закодированные в ядре и перемещающиеся из цитоплазмы во внутреннюю часть хлоропласта. Эти закодированные в ядре ферменты, как правило, имеют N-концевой транзитный пептид, который взаимодействует с мембраной хлоропласта для облегчения транспорта пептида в строму хлоропласта. Bruce B. (2000) Chloroplast transit peptides: structure, function, and evolution. Trends Cell Bio. 10: 440-447. После проникновения стромальные пептидазы отщепляют транзитный пептид, оставляя перенесенный внутрь хлоропласта зрелый функциональный белок. Richter S., Lamppa GK. (1999) Stromal processing peptidase binds transit peptides and initiates their ATP-dependent turnover in chloroplasts. Journ. Cell Bio. 147: 33-43. Транзитные пептиды хлоропласта представляют собой вариабельные последовательности, которые сильно отличаются по длине, составу и организации. Bruce B. (2000) Chloroplast transit peptides: structure, function, and evolution. Trends Cell Bio. 10: 440-447. Что касается сходства последовательностей транзитных пептидов хлоропласта, наблюдаются значительные расхождения среди гомологичных белков из различных видов растений. Степень расхождения между транзитными пептидами хлоропласта является неожиданной, учитывая, что гомологичные белки, полученные из различных видов растений, как правило, имеют относительно высокую степень сходства последовательностей при сравнении процессированных зрелых функциональных белков.
Новые химерные последовательности транзитного пептида хлоропласта были разработаны, получены и протестированы in planta. Показано, что новые химерные транзитные пептиды хлоропласта обладают свойствами эффективной транслокации и процессирования для введения внутрь хлоропласта важных с агрономической точки зрения белков. Прежде всего, нативные белковые последовательности 5-енолпирувилшикимат-3-фосфатсинтазы (EPSPS) из различных видов растений анализировали с помощью компьютерной программы ChloroP™ для выявления предполагаемых последовательностей транзитного пептида хлоропласта (Emanuelsson O., Nielsen H., von Heijne G., (1999) ChloroP, a neural network-based method for predicting chloroplast transit peptides and their cleavage sites, Protein Science 8, 978-984), программа доступна на сайте http://www.cbs.dtu.dk/services/ChloroP/. После идентификации нативных транзитных пептидов хлоропласта первую последовательность транзитного пептида хлоропласта выравнивали со второй последовательностью транзитного пептида хлоропласта из второго организма. На фиг. 17 показано выравнивание последовательностей транзитных пептидов хлоропласта EPSPS из Brassica napus (регистрационный № NCBI: P17688) и Brassica rapa (регистрационный № NCBI: AAS80163). С использованием выравнивания последовательностей транзитных пептидов хлоропласта были разработаны новые химерные транзитные пептиды хлоропласта путем комбинирования первой половины последовательности транзитного пептида хлоропласта из первого организма со второй половиной последовательности транзитного пептида хлоропласта из второго организма в примерном соотношении 1:1. Иллюстративные последовательности новых разработанных химерных транзитных пептидов хлоропласта представляют собой TraP8 (SEQ ID NO: 3) и TraP9 (SEQ ID NO: 4). Эти новые химерные последовательности транзитных пептидов хлоропласта получены из белков EPSPS Brassica napus [регистрационный № ATCC: P17688] и Brassica rapa [регистрационный № ATCC: AAS80163]. Химерная последовательность транзитного пептида хлоропласта TraP8 (SEQ ID NO: 3) содержит N-концевую часть, происходящую из вида Brassica napus, и C-концевая часть транзитного пептида хлоропласта происходит из вида Brassica rapa. Последовательность транзитного пептида хлоропласта TraP9 (SEQ ID NO: 4) содержит N-концевую часть, происходящую из вида Brassica rapa, и C-концевая часть транзитного пептида хлоропласта происходит из вида Brassica napus. Химерные транзитные пептиды хлоропласта тестировали во множестве анализов, которые включали временную систему экспрессии in planta и использование трансгенов в виде стабильного трансформационного объекта, содержащего генный экспрессионный элемент, слитый с важной с агрономической точки зрения трансгенной последовательностью.
Пример 2: Краткосрочное in planta тестирование последовательностей химерных транзитных пептидов хлоропласта (TraP)
Краткосрочный анализ растений табака:
Последовательности химерных транзитных пептидов хлоропласта Trap8 и TraP9 сначала тестировали в краткосрочном in planta анализе. Были синтезированы полинуклеотидные последовательности, кодирующие последовательности химерных транзитных пептидов хлоропласта Trap8 (SEQ ID NO: 5) и TraP9 (SEQ ID NO: 6). Последовательность линкера (SEQ ID NO: 7) вставляли между последовательностью TraP и кодирующей последовательностью yfp. Полученные конструкты содержали две растительные транскрипционные единицы (PTU). Первая PTU состояла из промотора убиквитина 10 Arabidopsis thaliana (промотор AtUbi10; Callis, et al., (1990) J. Biol. Chem., 265: 12486-12493), слитого гена TraP-желтый флуоресцентный белок (TraP-YFP; патентная заявка США 2007/0298412) и 3' нетранслируемой области ORF 23 Agrobacterium tumefaciens (AtuORF23 3′UTR; патент США № 5428147). Вторая PTU состояла из промотора вируса мозаики маниоки (промотор CsVMV; Verdaguer et al., (1996) Plant Molecular Biology, 31: 1129-1139), гена фосфинотрицин ацетил трансферазы (PAT; Wohlleben et al., (1988) Gene, 70: 25-37) и 3' нетранслируемой области ORF 1 Agrobacterium tumefaciens (AtuORF1 3′UTR; Huang et al., (1990) J. Bacteriol., 172: 1814-1822). Конструкт pDAB101977 содержал химерный транзитный пептид хлоропласта TraP8 (фиг. 2). Конструкт pDAB101978 содержал химерный транзитный пептид хлоропласта TraP9. Была создана и включена в исследование контрольная плазмида 101908, которая не содержала последовательность транзитного пептида хлоропласта выше гена yfp (фиг. 3). Структура конструктов была подтверждена расщеплением ферментами рестрикции и секвенированием. В конечном итоге, конструкты были введены трансформацией в Agrobacterium tumefaciens и хранились в виде маточного материала в глицерине.
Из маточного материала Agrobacterium в глицерине полную путлю замороженной культуры инокулировали в 2 мл YPD (100 мкг/мл спектиномицина) в 14-мл стерильной пробирке. Среду с инокулятом инкубировали при 28°C в течение ночи при встряхивании со скоростью 200 об/мин. На следующий день примерно 100 мкл культуры использовали для инокуляции 25 мл YPD (100 мкг/мл спектиномицина) в 125-мл стерильной колбе с тремя перегородками, и инкубировали при 28°C в течение ночи при встряхивании со скоростью 200 об/мин. На следующий день культуры разбавляли до величины OD600, равной 0,5, в стерильной ддH20 (pH 8,0). Разбавленный штамм Agrobacterium смешивали со вторым штаммом Agrobacterium, содержащим белок-помощник P19, в соотношении 1:1. Культуру использовали для инфильтрации листьев табака методом, описанным в статье Voinnet O., Rivas S., Mestre P., and Baulcombe D., (2003) An enhanced transient expression system in plants based on suppression of gene silencing by the p19 protein of tomato bushy stunt virus, The Plant Journal, 33: 949-956. Инфильтрированные растения табака помещали в Conviron™, установленный на режим 16-часового светового периода при 24°C, на по меньшей мере три дня до проведения анализа.
Результаты микроскопического исследования:
Инфильтрированные Agrobacterium листья табака отделяли от растения и помещали в чашку Петри с водой для предотвращения обезвоживания. Инфильтрированные листья табака наблюдали под возбуждающим синим светом с линзами, пропускающими длинноволновую часть спектра, зафиксированными с помощью Dark Reader Hand Lamp™ (Clare Chemical Research Co.; Dolores, CO) для выявления неповрежденных участков листа, успешно экспрессирующих репортерные белки YFP. Идентифицированные области листа вырезали из листа и монтировали в воде для визуализации с помощью конфокальной микроскопии (Leica TCS-SP5 AOBS™; Buffalo Grove, IL). Репортерный белок YFP возбуждали лазерным лучом с длиной волны 514 нм, используя аргон-ионный многолучевой лазер. Ширину щелей для детекции корректировали с использованием образца неэкспрессирующего (темного) контрольного листа для исключения фоновой аутофлуоресценции листьев. Одновременно на втором канале получали результаты аутофлуоресценции хлорофилла для прямого сравнения с сигналом флуоресцентного репортерного белка с целью определения хлоропластной локализации.
Результаты микроскопической визуализации свидетельствовали о том, что флуоресцентный белок YFP, содержащий транзитный пептид хлоропласта TraP8 или TraP9, накапливался в хлоропластах, находящихся в цитоплазме клеток табака, в отличие от контрольных флуоресцентных белков YFP, которые не переносились в хлоропласты в цитоплазме клеток табака (фиг. 4 и фиг. 5). Эти результаты микроскопической визуализации свидетельствовали о том, что транслокация белка YFP в хлоропласт происходила вследствие наличия транзитного пептида хлоропласта TraP8 или TraP9. Как показано на фиг. 5 и фиг. 6, флуоресцентный сигнал YFP локализован в хлоропластах, которые также флуоресцируют красным вследствие аутофлуоресценции в условиях визуализации под микроскопом. Для сравнения, на фиг.7 представлено микроскопическое изображение ткани листа табака, инфильтрированного контрольным конструктом pDAB101908, не содержащим транзитный пептид хлоропласта. Хлоропласты на этом изображении флуоресцируют только красным вследствие аутофлуоресценции в условиях визуализации под микроскопом и лишены какого-либо флуоресцентного сигнала YFP, который проявляется в инфильтрированных TraP клетках табака. Скорее, флуоресцентный сигнал YFP в контрольных клетках растения табака проявляется диффузно во всей цитоплазме клеток растения табака.
Результаты вестерн-блоттинга
Образцы инфильтрированных растений табака анализировали методом вестерн-блоттинга. Вырезанные фрагменты листьев собирали и размалывали в бисерной мельнице. Примерно 100-200 мг листового материала смешивали с 2 BBs (стальными шариками) (Daisy; Rogers, AR) и 500 мл PBST в течение 3 минут в бисерной мельнице Kleco™. Затем образцы осаждали центрифугированием при 14000 × g при 4°C. Супернатант удаляли и либо анализировали напрямую методом вестерн-блоттинга, либо подвергали иммунопреципитации. Иммунопреципитацию проводили с использованием набора Pierce Direct IP kit™ (Thermo Scientific; Rockford, IL) в соответствии с протоколом производителя. Примерно 50 мкг антитела против YFP связывали со смолой. Образцы инкубировали со смолой в течение ночи при 4°C. Затем образцы промывали и элюировали на следующее утро и готовили для анализа, объединяя с равными объемами 2X буфера с 8M мочевиной для образцов, а затем кипятили образцы в течение 5 минут. Проводили электрофорез прокипяченных образцов в 4-12% SDS-бис-трис геле в буфере MOPS в течение 40 минут. Затем проводили блоттинг геля с использованием Invitrogen iBlot™ (Life Technologies; Carlsbad, CA) в соответствии с протоколом производителя. Мембрану после блоттинга блокировали в течение 10 минут 5%-ным раствором обезжиренного сухого молока в буфере PBS-Tween. Мембрану обрабатывали первичным антителом (моноклональное кроличье анти-GFP антитело), разведенным 1:1000 в 5%-ном растворе обезжиренного сухого молока в буфере PBS-Tween, в течение 1 часа. Затем мембрану промывали три раза по пять минут буфером PBS-Tween для удаления всего несвязанного первичного антитела. Мембрану обрабатывали вторичным моноклональным антителом козы против иммуноглобулинов кролика (Life Technologies) в разведении 1:1000 в течение 60 минут. Мембрану промывали, как описано ранее, и проявляли, добавляя субстрат Themo BCIP/NBT. Окраска колориметрического субстрата развивалась в течение 5-10 минут, а затем блоты промывали водой перед высушиванием.
Результаты вестерн-блоттинга указывали на то, что белок YFP экспрессировался в инфильтрированных клетках табака. Ткани листьев растений табака, инфильтрированные как pDAB101977, так и pDAB101978, экспрессировали белок YFP, о чем свидетельствовало наличие белковой полосы, которая реагировала антителами к YFP и была эквивалентна по размеру белковой полосе YFP, полученной из ткани листьев растений табака, инфильтрированных контрольным конструктом YFP. Более того, данные результаты свидетельствовали о том, что химерные транзитные пептиды хлоропласта TraP процессировались и отщеплялись от белка YFP. Конструкты TraP8-YFP и TraP9-YFP экспрессировали белок до его процессинга, полоса которого соответствовала большей молекулярной массе, чем у контрольного белка YFP. Наличие полос на вестерн-блоте, которые эквивалентны по размеру контрольному YFP, указывало на то, что последовательности транзитных пептидов хлоропласта TraP8 и TraP9 процессировались, в результате чего уменьшался размер YFP до величины молекулярной массы, эквивалентной контрольному YFP.
Краткосрочный анализ протопластов кукурузы:
Кодирующую химерный транзитный пептид хлоропласта Trap8 полинуклеотидную последовательность (SEQ ID NO: 5) и кодирующую линкер полинуклеотидную последовательность (SEQ ID NO: 7) клонировали выше гена желтого флуоресцентного белка и вставляли в конструкт pDAB106597 (фиг.7) для тестирования в краткосрочном in planta анализе протопластов кукурузы. Полученные конструкты содержали одну растительную транскрипционную единицу (PTU). PTU состояла из промотора убиквитина 1 Zea mays (промотор ZmUbi1; Christensen, A., Sharrock R., and Quail P., (1992) Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation, Plant Molecular Biology, 18: 675-689), слитого гена TraP-желтый флуоресцентный белок (TraP8-YFP; патентная заявка США 2007/0298412) и 3′ нетранслируемой области пероксидазы 5 Zea mays (ZmPer5 3′UTR; патент США № 6384207). Структура конструктов была подтверждена расщеплением ферментами рестрикции и секвенированием.
Семена Zea mays сорта B104 поверхностно стерилизовали энергичным встряхиванием в 50% растворе Clorox (3% раствор гипохлорита натрия), содержащем 2-3 капли Tween 20, в течение примерно 20 минут. Семена тщательно промывали стерильной дистиллированной водой. Стерильные семена высаживали на среду ½ MS в лотки Phytatrays или емкости аналогичного типа и оставляли прорастать в темноте (28°C) в течение 12-20 дней. Краткосрочный анализ протопластов кукурузы использовали для получения и трансфицирования протопластов кукурузы из листьев кукурузы сорта B104. Данный анализ протопластов кукурузы представляет собой модификацию системы, описанной в статье Yoo, S.-D., Cho, Y.-H., and Sheen, J., (2007), Arabidopsis Mesophyll Protoplasts: A Versitile Cell System for Transient Gene Expression Analysis, Nature Protocols, 2: 1565-1572. Растворы готовили, как описано Yoo et.al., (2007), за исключением того, что концентрацию маннита, используемого для следующих экспериментов, изменяли на 0,6 M.
Трансфекцию 100-500 мкл протопластов (1-5×105) проводили путем добавления протопластов в 2-мл микроцентрифужную пробирку, содержащую примерно 40 мкг плазмидной ДНК (pDAB106597), при комнатной температуре. Объем ДНК предпочтительно поддерживали на уровне примерно 10% от объема протопластов. Протопласты и ДНК периодически перемешивали в течение 5-минутного периода инкубации. Равный объем раствора ПЭГ медленно добавляли к протопластам и ДНК, по 2 капли за раз, с перемешиванием между добавлением капель раствора ПЭГ. Пробирки оставляли для инкубации в течение примерно 10 минут с периодическим осторожным перемешиванием. Затем добавляли 1 мл раствора W5+ и перемешивали, несколько раз переворачивая пробирку. Пробирку(и) центрифугировали в течение 5 минут при 75 × g при температуре 4°C. В завершение, супернатант удаляли, осадок ресуспендировали в 1 мл раствора WI и протопласты помещали в небольшую чашку Петри (35×10 мм) или в 6-луночные планшеты и инкубировали в течение ночи в темноте при комнатной температуре. Флуоресценцию YFP наблюдали под микроскопом через 12 часов инкубации. Для визуализации использовали условия микроскопического исследования, описанные ранее.
Результаты микроскопической визуализации свидетельствовали о том, что флуоресцентный белок YFP, содержащий транзитный пептид хлоропласта TraP8, накапливался в хлоропластах, находящихся в цитоплазме клеток кукурузы, в отличие от контрольных флуоресцентных белков YFP, которые не переносились в хлоропласты в цитоплазме клеток кукурузы (фиг. 8). Эти результаты микроскопической визуализации свидетельствовали о том, что транслокация белка YFP в хлоропласт происходила вследствие наличия транзитного пептида хлоропласта TraP8.
Пример 3: Последовательности химерного транзитного пептида хлоропласта (TraP) для экспрессии важных с агрономической точки зрения трансгенов в Arabidopsis
Единичная аминокислотная мутация (G96A) в ферменте 5-енолпирувилшикимат-3-фосфатсинтазе (EPSP синтазе) Escherichia coli может приводить к нечувствительности к глифосату (Padgette et al., (1991); Eschenburg et al., (2002); Priestman et al., (2005); Haghani et al., (2008)). При том, что данная мутация придает толерантность к глифосату, также известно, что она негативно влияет на связывание EPSP синтазы с ее природным субстратом, фосфоенолпируватом (PEP). Возникающее изменение в эффективности связывания субстрата может приводить к появлению мутантного фермента, неподходящего для придания in planta толерантности к глифосату.
Проводили скрининг in silico компонентов базы данных Genbank NCBI на белок EPSP синтазу и полинуклеотидные последовательности, которые естественным образом содержат остаток аланина в аналогичном положении в ферменте EPSP синтазе, что и мутация G96A, которая была введена в вариант фермента из E. coli (Padgette et al., (1991); Eschenburg et al., (2002); Priestman et al., (2005); Haghani et al., (2008)).
Ферментом, который, как было установлено, содержит природный остаток аланина в данном положении, был DGT-28 (регистрационный № GENBANK: ZP_06917240.1) из Streptomyces sviceus ATCC29083. Дальнейшие изыскания in silico выявили три других уникальных для Streptomyces фермента с большой гомологией в отношении DGT-28; DGT-31 (регистрационный № GENBANK: YP_004922608.1); DGT-32 (регистрационный № GENBANK: ZP_04696613) и DGT-33 (регистрационный № GENBANK: NC_010572). Каждый из этих ферментов содержит природный остаток аланина в аналогичном положении в ферменте синтазе EPSP, что и мутация G96A, которая была введена в вариант фермента из E. coli. Фиг. 1.
Поскольку белки EPSP синтазы из различных организмов имеют разную длину, порядковый номер для мутации в варианте фермента EPSP синтазы из E. coli не обязательно соответствует порядковому номеру для мутации в ферментах EPSP синтазах из других организмов. Эти идентифицированные ферменты EPSP синтазы ранее не были охарактеризованы в отношении толерантности к глифосату или аффинности к субстрату PEP. Кроме того, эти ферменты EPSP синтазы представляют собой новый класс ферментов EPSP синтаз и не содержат каких-либо фрагментов последовательности, которые были использованы для характеристики описанных ранее ферментов EPSP синтаз класса I (растительные последовательности, дополнительно описанные в патенте США № RE39247), II (бактериальные последовательности, дополнительно описанные в патенте США № RE39247) и III (бактериальные последовательности, дополнительно описанные в международной патентной заявке WO 2006/110586).
Новые ферменты DGT-14, DGT-28, DGT-31, DGT-32 и DGT-33 были охарактеризованы в отношении толерантности к глифосату и аффинности в отношении субстрата PEP в сравнении с ферментами EPSP синтазами класса I. Для сравнения использовали следующие ферменты класса I: DGT-1 из Glycine max, DGT-3 из Brassica napus (регистрационный № GENBANK: P17688) и DGT-7 из Triticum aestivum (регистрационный № GENBANK: EU977181). Ферменты EPSP синтазы класса I и их мутантные варианты были синтезированы и изучены. Мутация, введенная в растительные ферменты EPSP синтазы, заключалась в замене глицина на аланин, произведенной в ферменте EPSP синтазе в том же положении, что и мутация G96A в варианте фермента из E. coli. Кроме того, мутации замены треонина на изолейцин и пролина на серин были введены в эти ферменты EPSP синтазы класса I в положениях, аналогичных аминокислоте 97 (T на I) и аминокислоте 101 (P на S) в EPSP синтазе из E. coli, как описано в статье Funke et al. (2009).
DGT14:
Трансгенные T1 растения Arabidopsis, содержащие химерные транзитные пептиды хлоропласта TraP8 и TraP9, слитые с трансгеном dgt-14, были получены с использованием метода погружения растений, описанного в статье Clough and Bent (1998), Plant J. 16: 735-743. Получали трансгенные растения Arabidopsis и подтверждали наличие в них трансгена методами молекулярного анализа. Трансгенные растения опрыскивали глифосатом в различных нормах применения. В данном исследовании использовали различные нормы применения глифосата, включая повышенные нормы, для определения относительных уровней устойчивости (105, 420, 1680 или 3360 г кэ/га). Обычная 1X норма применения глифосата в полевых условиях составляет 1120 г кэ/га. T1 растения Arabidopsis, используемые в данном исследовании, отличались по количеству копий трансгена dgt-14. T1 растения Arabidopsis с низким количеством копий dgt-14 идентифицировали с использованием молекулярных методов подтверждения, проводили их самоопыление и использовали для получения T2 растений. В таблице 1 приведены результаты определения устойчивости трансгенных по dgt-14 растений по сравнению с контрольными растениями, содержащими ген устойчивости к гербициду глифосату, dgt-1 (описанный в патенте США регистрационный номер 12558351).
T1 трансформанты Arabidopsis сначала отбирали на фоне нетрансформированных семян с использованием схемы отбора с глюфозинатом. Три лотка для прорастания, или 30000 семян, анализировали на каждый T1 конструкт. Выбранные T1 растения характеризовали методами молекулярного анализа и затем растения пересаживали в отдельные горшки и опрыскивали коммерческим глифосатом при различных нормах применения, как описано ранее. Реакция на дозу таких растений представлена в виде % видимых повреждений через 2 недели после обработки (НПО) (WAT). Данные приведены ниже в таблицах, в которых указаны отдельные растения, демонстрирующие небольшие повреждения или их отсутствие (<20%), умеренные повреждения (20-40%) или серьезные повреждения (>40%). Для каждого конструкта, используемого для трансформации Arabidopsis, приведены арифметические средние и стандартные отклонения. Диапазон индивидуальной реакции также указан в последней колонке для каждой нормы применения и трансформации. Нетрансформированные растения Arabidopsis дикого типа (культивар Columbia) служили в качестве чувствительного к глифосату контроля.
В T1 растениях Arabidopsis уровни реакции варьировались. Эти вариации могут быть связаны с тем, каждое растение представляет собой независимый трансформационный объект, и, следовательно, число копий интересующего гена меняется от растения к растению. Средний показатель повреждений для всей популяции в зависимости от нормы применения приведен в таблице 1 для демонстрации толерантности, придаваемой каждым из конструктов dgt-14, связанного с транзитным пептидом хлоропласта, либо TraP8 v2, либо TraP9 v2, в сравнении с содержащими dgt-1 и нетрансформированными контролями дикого типа для различных норм применения глифосата. Объекты содержали dgt-14, связанный с TraP8 v2 (SEQ ID NO: 8) в составе конструкта pDAB105526 (фиг.9) и TraP9 v2 (SEQ ID NO: 9) в составе конструкта pDAB105527 (фиг.10). Данные отбора на устойчивость к глифосату T1 растений показали, что если dgt-14 был связан с этими транзитными пептидами хлоропласта, наблюдалась надежная толерантность к высоким уровням глифосата. Для сравнения, нетрансформированные (или дикого типа) контроли не проявляли толерантность к обработке глифосатом в высоких концентрациях, если были обработаны глифосатом при аналогичных нормах применения. Кроме того, были случаи, когда объекты, содержащие три или более копий dgt-14, были более чувствительны к повышенным нормам применения глифосата. Эти случаи приведены в составе процента видимых повреждений, указанного в таблице 1. Вполне вероятно, что наличие высокого числа копий трансгенов в растениях Arabidopsis приводит к сайленсингу трансгенов или другим эпигенетическим эффектам, результатом которых является чувствительность к глифосату, несмотря на присутствие трансгена dgt-14.
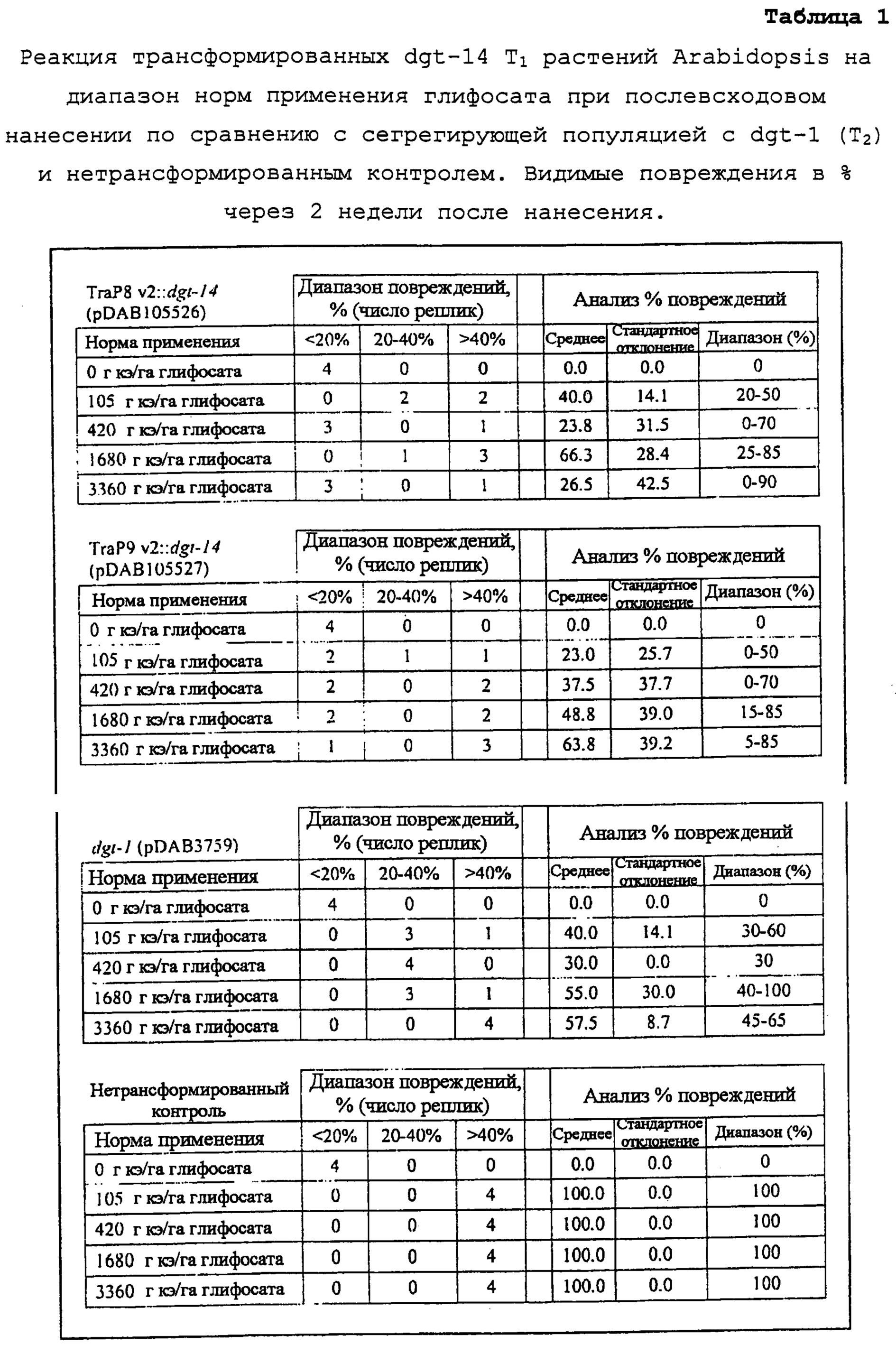
Выбранные T1 растения Arabidopsis, которые были идентифицированы как содержащие низкое число копий трансгенных вставок (1-3 копии), подвергали самоопылению, получая второе поколение для дополнительной оценки толерантности к глифосату. Растения второго поколения (T2) Arabidopsis, которые содержали 1-3 копии трансгена dgt-14, слитого с химерными транзитными пептидами хлоропласта TraP8 и TraP9, дополнительно характеризовали на толерантность к глифосату и толерантность к глюфозинату (устойчивость к глюфозинату указывает на то, что экспрессионная кассета PAT была интактна и не претерпела перестроек при самоопылении Т1 растений). В поколении T2 гемизиготные и гомозиготные растения были доступны для тестирования для каждого объекта, и вследствие этого, были включены в эксперименты с тестированием каждой нормы применения глифосата. Гемизиготные растения содержат два различных аллеля в локусе, в отличие от гомозиготных растений, которые содержат два одинаковых аллеля в локусе. Число копий и уровни плоидности T2 растений подтверждали методами молекулярного анализа. Аналогичным образом, глифосат применяли с использованием методов и норм применения, описанных ранее. Реакция на дозу растений представлена в виде % видимых повреждений через 2 недели после обработки (НПО). Данные представлены в виде гистограммы для отдельных растений, демонстрирующих небольшие повреждения или их отсутствие (<20%), умеренные повреждения (20-40%) или серьезные повреждения (>40%). Для каждого конструкта, используемого для трансформации Arabidopsis, приведены арифметические средние и стандартные отклонения. Диапазон индивидуальной реакции также указан в последней колонке для каждой нормы применения и трансформации. Нетрансформированные растения Arabidopsis дикого типа (культивар Columbia) служили в качестве чувствительного к глифосату контроля. Кроме того, растения, содержащие ген устойчивости к гербициду глифосату, dgt-1 (описанный в патенте США регистрационный номер 12558351) включали в качестве положительного контроля.
В поколении T2 как однокопийные, так и низкокопийные (две или три копии) dgt-14 объекты характеризовали на толерантность к глифосату. Средний показатель повреждений для всей популяции в зависимости от нормы применения приведен в таблице 2 для демонстрации толерантности, придаваемой каждым из конструктов dgt-14, связанного с транзитным пептидом хлоропласта, в сравнении с содержащими dgt-1 и нетрансформированными контролями дикого типа для различных норм применения глифосата. Объекты поколения T2 содержали dgt-14, связанный с TraP8 v2 (pDAB105526) и TraP9 v2 (pDAB105527). Оба эти объекта были высокоустойчивы к глифосату. Результаты свидетельствовали о том, что диапазон повреждений T2 растений Arabidopsis составлял менее 20% для всех протестированных концентраций глифосата. Для сравнения, нетрансформированные (или дикого типа) контроли не проявляли толерантность к обработке глифосатом в высоких концентрациях, если были обработаны глифосатом при аналогичных нормах применения. В целом, результаты показали, что растения, содержащие и экспрессирующие DGT-14, слитый с белками химерного транзитного пептида TraP8 и TraP9, проявляли коммерческий уровень устойчивости к глифосату при уровнях, вплоть до 3 раз превышающих норму применения в полевых условиях (1120 г кэ/га).
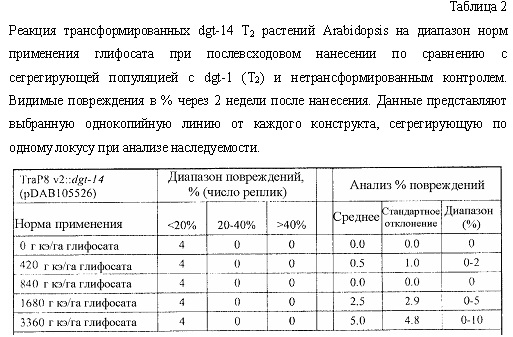
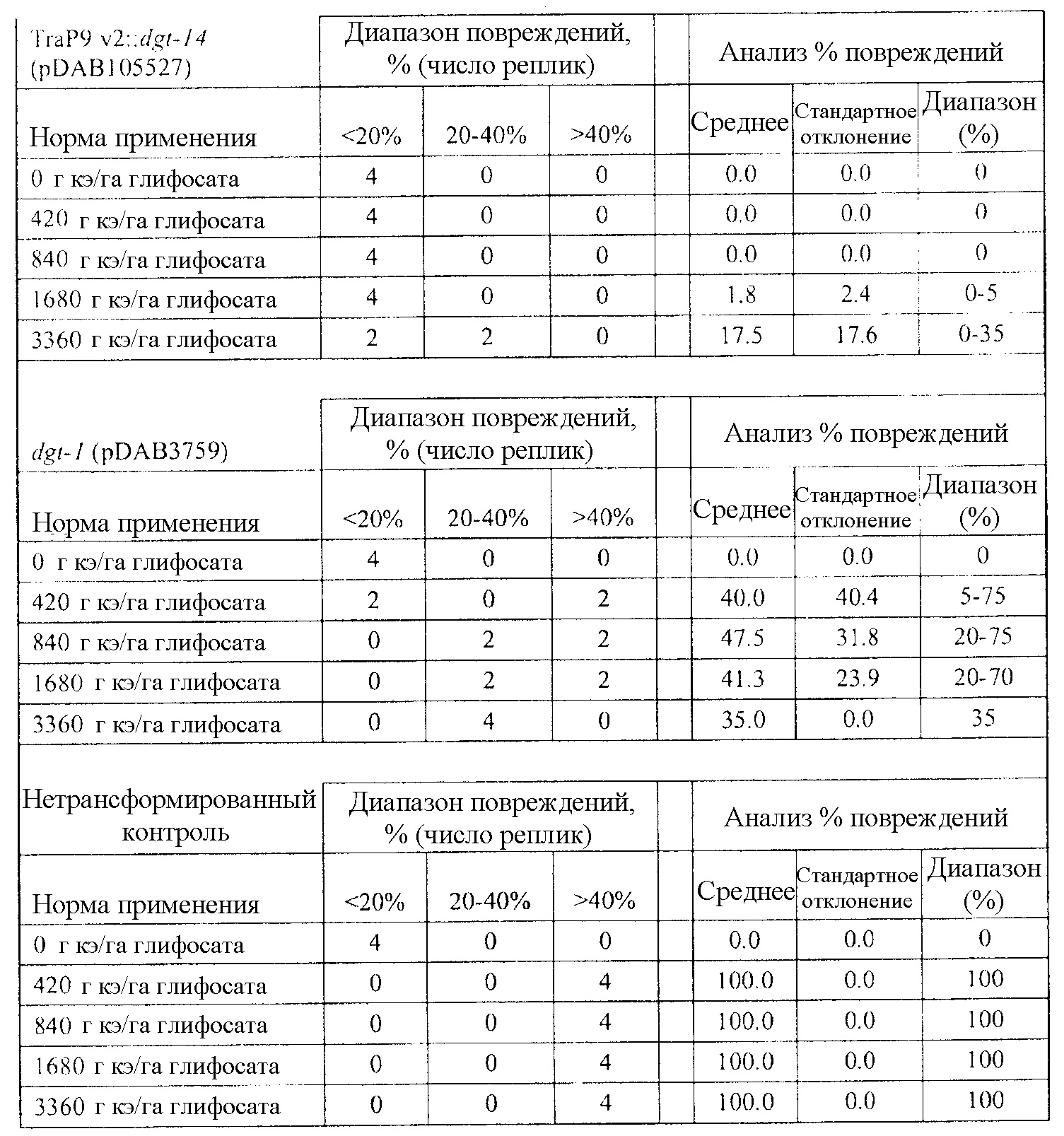
Случайным образом выбранные T2 растения Arabidopsis, которые были идентифицированы как содержащие низкое число копий трансгенных вставок (1-3 копии), подвергали самоопылению, получая третье поколение для дополнительной оценки толерантности к глифосату. Семена Arabidopsis из третьего поколения (T3) были высажены и оценены на толерантность к глифосату с использованием тех же протоколов, которые описаны ранее. Объекты тестировали в поколении T3, включающем реплики из каждой линии, которые были гомозиготными (что определяли путем скрининга на устойчивость к глюфозинату для определения того, демонстрирует ли какое-либо из усовершенствованных растений сегрегацию трансгенов). Эти объекты анализировали методом ЖХ-МС-МС для подтверждения того, что растения экспрессировали белок DGT-14. Результаты определения среднего показателя повреждений для всей популяции поколения T3 в зависимости от нормы применения глифосата приведены в таблице 3, которая показывает толерантность к глифосату, придаваемую каждым из dgt-14 конструктов, для различных норм применения глифосата. Иллюстративные устойчивые T3 объекты содержали dgt-14, связанный с TraP8 v2 (pDAB105526) и TraP9 v2 (pDAB105527). Оба эти объекта были высокоустойчивы к глифосату. Результаты свидетельствовали о том, что диапазон повреждений для T3 растений Arabidopsis составлял менее чем 20% для всех протестированных концентраций глифосата. Для сравнения, нетрансформированные (или дикого типа) контроли не проявляли толерантность к обработке глифосатом в высоких концентрациях, если были обработаны глифосатом при аналогичных нормах применения. В целом, результаты показали, что растения, содержащие и экспрессирующие DGT-14, проявляли коммерческий уровень устойчивости к глифосату при уровнях, вплоть до 3 раз превышающих норму применения в полевых условиях (1120 г кэ/га).
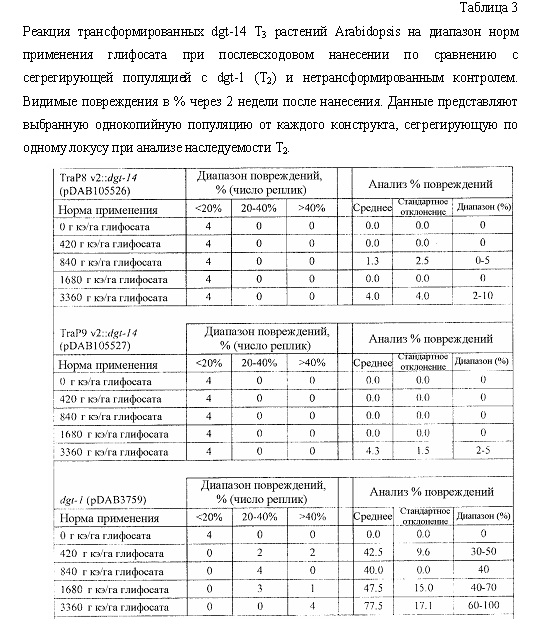
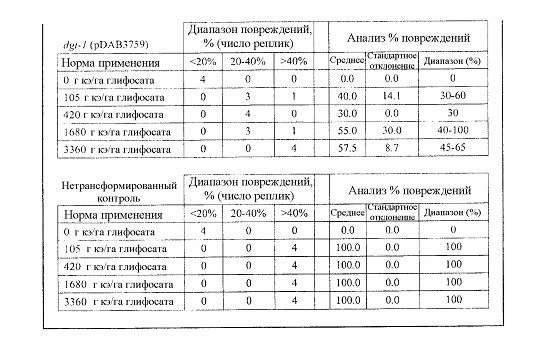
Данные показывают, что экспрессия устойчивого к глифосату фермента (например, DGT-28), направляемого в хлоропласт клетки растения за счет транзитного пептида TraP в слитом белке, способна придавать устойчивость к глифосату клеткам растения и растениям, содержащим эти клетки.
DGT-28, DGT-31, DGT-32 и DGT-33:
Новая разработанная оптимизированная для двудольного растения полинуклеотидная последовательность dgt-28 v5 приведена в SEQ ID NO: 16. Новая разработанная оптимизированная для однодольного растения полинуклеотидная последовательность dgt-28 v6 приведена в SEQ ID NO: 17; эта последовательность была слегка модифицирована путем включения остатка аланина в положение второй аминокислоты для внесения сайта фермента рестрикции. Полученные последовательности ДНК имеют более высокую степень разнообразия кодонов, желаемый состав оснований, содержат стратегически расположенные сайты узнавания ферментами рестрикции и лишены последовательностей, которые могут препятствовать транскрипции гена или трансляции продукта мРНК.
Синтез фрагментов ДНК, содержащих SEQ ID NO: 16 и SEQ ID NO: 17, содержащих дополнительные последовательности, такие как 6-рамочные кодоны остановки (стоп-кодоны, расположенные во всех шести рамках считывания, которые добавляют к 3'-концу кодирующей последовательности), и 5'-сайт рестрикции для клонирования, выполняли коммерческие поставщики (DNA2,0, Menlo Park, CA). Синтетическую молекулу нуклеиновой кислоты затем клонировали в экспрессионные векторы и переносили трансформацией в растения или бактерии, как описано в приведенных ниже примерах.
Аналогичные стратегии оптимизации кодонов использовали для конструирования dgt-1, dgt-3 v2 (G173A), dgt-3 v3 (G173A; P178S), dgt-3 v4 (T174I; P178S), dgt-7 v4 (T168I; P172S), dgt-32 v3, dgt-33 v3 и dgt-31 v3. Оптимизированные по кодонам варианты этих генов приведены в виде SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24 и SEQ ID NO: 25, соответственно.
Конструирование растительного бинарного вектора. Использовали стандартные методы клонирования для конструирования исходных векторов, содержащих полинуклеотидную последовательность транзитного пептида хлоропласта, присоединенную к dgt-28 в виде слитого продукта в одной рамке считывания. Исходные векторы, содержащие транзитный пептид (TraP), слитый с dgt-28, собирали с использованием технологии In-Fusion™ Advantage Technology (Clontech, Mountain View, CA). В результате этого слияния первая аминокислота, метионин, была удалена из dgt-28. Последовательности всех транзитных пептидов TraP4 v2 (SEQ ID NO: 26), TraP5 v2 (SEQ ID NO: 27), TraP8 v2 (SEQ ID NO: 28), TraP9 v2 (SEQ ID NO: 29), TraP12 v2 (SEQ ID NO: 30) и TraP13 v2 (SEQ ID NO: 31) были синтезированы компанией DNA2,0 (Menlo Park, CA) и слиты с 5′-концевым фрагментом dgt-28, вплоть до, и включительно, уникального сайта узнавания эндонуклеазой рестрикции AccI.
Бинарные плазмиды, содержащие различные экспрессионные кассеты TraP и dgt-28, управлялись промотором убиквитина 10 Arabidopsis thaliana (AtUbi10 v2; Callis, et al., (1990) J. Biol. Chem., 265: 12486-12493) и были фланкированы 3′-нетранслируемой областью открытой рамки считывания двадцать три Agrobacterium tumefaciens (AtuORF23 3′ UTR v1; патент США № 5428147).
Собранные экспрессионные кассеты TraP и dgt-28 были разработаны с использованием Gateway® Technology (Invitrogen, Carlsbad, CA) и введены трансформацией в растения методом опосредованной Agrobacterium трансформации растений. Эндонуклеазы рестрикции были получены от компании New England BioLabs (NEB; Ipswich, MA) и для лигирования ДНК использовали ДНК-лигазу T4 (Invitrogen). Реакции Gateway проводили с использованием смеси ферментов Gateway® LR Clonase® (Invitrogen) для сборки одного исходного вектора в один нацеленный вектор, который содержал кассету селективного маркера, содержащую промотор вируса мозаики маниоки (CsVMV v2; Verdaguer et al., (1996) Plant Mol. Biol., 31: 1129-1139) - DSM-2 (патентная заявка США № 2007/086813) - 3′-нетранслируемую область открытой рамки считывания один Agrobacterium tumefaciens (AtuORF1 3′UTR v6; Huang et al., (1990) J. Bacteriol. 172: 1814-1822). Плазмиды получали с использованием набора NucleoSpin® Plasmid Kit (Macherey-Nagel Inc., Bethlehem, PA) или Plasmid Midi Kit (Qiagen) в соответствии с инструкциями поставщиков. Фрагменты ДНК выделяли с использованием набора QIAquick™ Gel Extraction Kit (Qiagen) после электрофореза в геле агарозы с Трис-ацетатом.
Сначала проводили скрининг колоний всех собранных плазмид рестрикционным расщеплением мини-препарата ДНК. Плазмидная ДНК выбранных клонов была секвенирована коммерческой компанией (Eurofins™ MWG Operon, Huntsville, AL). Данные по последовательностям были собраны и проанализированы с помощью программы Sequencher™ (Gene Codes Corp., Ann Arbor, MI).
Следующие бинарные конструкты экспрессируют различные слитые генные последовательности TraP:dgt-28: pDAB107527 (фиг. 18) содержит TraP4 v2:dgt-28 v5 (SEQ ID NO: 32); pDAB105530 (фиг. 19) содержит TraP5 v2:dgt-28 v5 (SEQ ID NO: 33); pDAB105531 (фи. 20) содержит TraP8 v2:dgt-28 v5 (SEQ ID NO: 34); pDAB105532 (фиг.21) содержит TraP9 v2:dgt-28 v5 (SEQ ID NO: 35); pDAB105533 (фиг. 22) содержит TraP12 v2:dgt-28 v5 (SEQ ID NO: 36) и pDAB105534 (фиг. 23) содержит TraP13 v2:dgt-28 v5 (SEQ ID NO: 37). Последовательность dgt-28 v5 в pDAB105534 была модифицирована так, что первый кодон (GCA) был изменен на (GCT).
Конструирование дополнительных растительных бинарных векторов. Стратегии клонирования, аналогичные тем, которые описаны выше, использовали для конструирования бинарных плазмид, содержащих dgt-31, dgt-32, dgt-33, dgt-1, dgt-3 и dgt-7.
Микробные гены: dgt-31, dgt-32 и dgt-33 были слиты с последовательностями различных транзитных пептидов хлоропласта, описанными выше. Использовали следующие транзитные пептиды хлоропласта: TraP14 v2 (SEQ ID NO: 38), TraP23 v2 (SEQ ID NO: 39), TraP24 v2 (SEQ ID NO: 40). pDAB107532 (фиг.24) содержит dgt-32 v3, слитый с TraP14 v2 (SEQ ID NO: 41), pDAB107534 (фиг.25) содержит dgt-33 v3, слитый с TraP24 v2 (SEQ ID NO: 42), и pDAB107533 (фиг.26) содержит dgt-31 v3, слитый с TraP23 v2 (SEQ ID NO: 43). Экспрессионные кассеты dgt управлялись промотором убиквитина 10 Arabidopsis thaliana (AtUbi10 промотор v2) и были фланкированы 3′-нетранслируемой областью открытой рамки считывания двадцать три Agrobacterium tumefaciens (AtuORF23 3′UTR v1). В бинарном векторе также присутствовала кассета селективного маркера DSM-2, содержащая промотор вируса мозаики маниоки (CsVMV v2) - DSM-2 - 3′-нетранслируемую область открытой рамки считывания один Agrobacterium tumefaciens (AtuORF1 3′UTR v6).
Были сконструированы дополнительные бинарные векторы, в которых dgt-31 v3, dgt-32 v3 и dgt-33 v3 были слиты с ранее описанными последовательностями транзитного пептида хлоропласта. Например, последовательность TraP8 v2 была слита с dgt-31 v3, dgt-32 v3 и dgt-33 v3, и клонирована в бинарные векторы, как описано выше.
Были сконструированы бинарные векторы, содержащие гены класса I (dgt-1, dgt-3 и dgt-7). Следующие бинарные векторы были сконструированы и введены трансформацией в растения: pDAB4104 (фиг. 27), содержащий последовательность dgt-1 v4, описанную в публикации патентной заявки США № 2011/0124503, которая фланкирована последовательностями осмотина Nicotiana tabacum, как описано в публикации патентной заявки США № 2009/0064376; pDAB102715 (фиг. 28); pDAB102716 (фиг. 29); pDAB102717 (фиг. 30) и pDAB102785 (фиг. 31). Различные последовательности транзитных пептидов хлоропласта TraP, которые были слиты с dgt-28, dgt-31, dgt-32 и dgt-33, не были добавлены к генам класса I, поскольку данные растительные последовательности обладают природными транзитными пептидами хлоропласта. Эти векторы описаны более подробно в таблице 4.
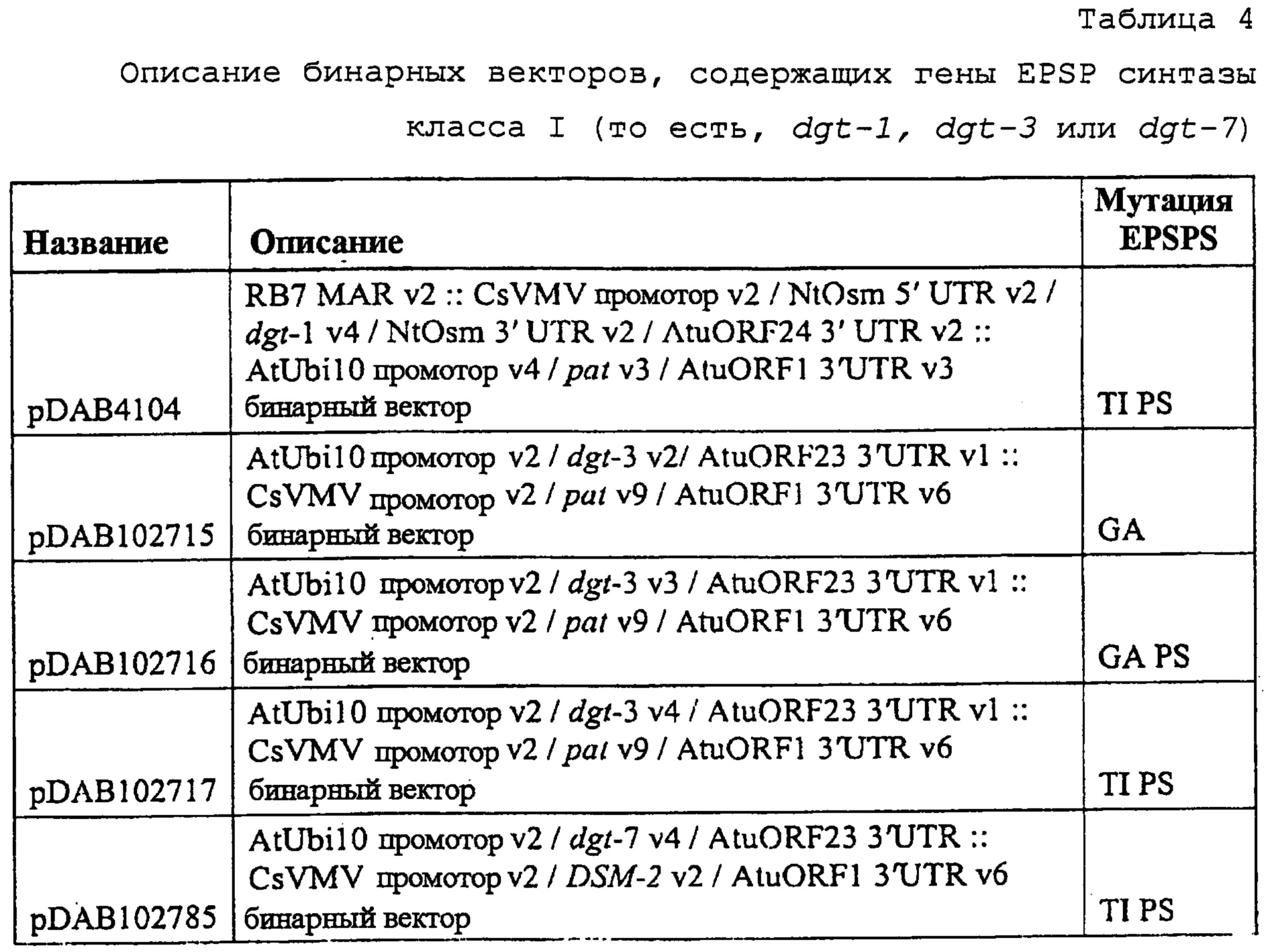
Трансформация Arabidopsis thaliana. Arabidopsis трансформировали с использованием метода погружения растений, описанного в статье Clough и Bent (1998). Выбранную колонию Agrobacterium, содержащую одну из бинарных плазмид, описанных выше, использовали для инокуляции одной или более 100-мл предварительных культур бульона YEP, содержащих спектиномицин (100 мг/л) и канамицин (50 мг/л). Культуры инкубировали в течение ночи при 28°C при постоянном перемешивании со скоростью 225 об/мин. Клетки осаждали центрифугированием при примерно 5000 × g в течение 10 минут при комнатной температуре и полученный супернатант отбрасывали. Осадок клеток осторожно ресуспендировали в 400 мл среды для замачивания, содержащей: 5% (масса/объем) сахарозы, 10 мкг/л 6-бензиламинопурина и 0,04% Silwet™ L-77. Растения в возрасте примерно 1 месяц погружали в среду на 5-10 минут с осторожным перемешиванием. Растения укладывали набок и накрывали прозрачными или непрозрачными пластиковыми пакетами на 2-3 часа, а затем устанавливали в вертикальное положение. Растения выращивали при 22°C с фотопериодом 16-часов света/8-часов темноты. Примерно через 4 недели после погружения собирали семена.
Отбор трансформированных растений. Свежесобранные T1 семена [содержащие экспрессионные кассеты dgt и DSM-2] оставляли высыхать в течение 7 дней при комнатной температуре. T1 семена высевали в лотки для прорастания размером 26,5×51 см, внося в каждый из них 200-мг аликвоту стратифицированных Т1 семян (~10000 семян), которые предварительно были суспендированы в 40 мл 0,1% раствора агарозы и хранились при 4°C в течение 2 дней для соблюдения требования покоя семян и обеспечения синхронного прорастания семян.
Смесь Sunshine Mix LP5 покрывали мелким вермикулитом и орошали инфильтрацией питательной смесью Хогланда до намокания, которую затем оставляли стекать под действием силы тяжести. Каждую 40-мл аликвоту стратифицированных семян высевали равномерно на вермикулит пипеткой и накрывали куполами влажности на 4-5 дней. Купола удаляли за 1 день до первичного отбора трансформантов путем послевсходового опрыскивания глюфозинатом (отбор на котрансформированный ген DSM-2).
Через семь дней после посадки (ДПП) (DAP) и вновь через 11 ДПП T1 растения (семядоля и стадия 2-4 листьев, соответственно) опрыскивали 0,2% раствором гербицида Liberty (200 г аи/л глюфозината, Bayer Crop Sciences, Kansas City, MO) в объеме распыления 10 мл/лоток (703 л/га) с использованием пневматического распылителя DeVilbiss для доставки эффективной нормы 280 г аи/га глюфозината за одно нанесение. Выжившие растения (активно растущие растения) выявляли через 4-7 дней после последнего опрыскивания и пересаживали индивидуально в 3-дюймовые (7,62-сантиметровые) горшки с посадочной средой (Metro Mix 360). Пересаженные растения накрывали куполами влажности на 3-4 дня и помещали в ростовую камеру при 22°C, как прежде, или переносили непосредственно в теплицу. Затем купола удаляли и растения выращивали в теплице (22±5°C, 50±30% RH, 14 ч света:10 ч темноты, минимум 500 мкЭ/м2с1 естественного + дополнительного света). Проводили молекулярный подтверждающий анализ выживших T1 растений для подтверждения того, что ген толерантности к глифосату стабильно интегрирован в геном растений.
Молекулярное подтверждение. Присутствие трансгенов dgt-28 и DSM-2 в геноме растений Arabidopsis, которые были трансформированы pDAB107527, pDAB105530, pDAB105531, pDAB105532, pDAB105533 или pDAB105534, было подтверждено. Присутствие этих полинуклеотидных последовательностей было подтверждено анализом гидролиза зондов, ПЦР генной экспрессионной кассеты (также описанной как ПЦР растительной транскрипционной единицы - ПЦР РТЕ), саузерн-блот анализом и анализом методом количественной ПЦР с обратной транскрипцией.
Сначала проводили скрининг T1 растений Arabidopsis с помощью анализа гидролиза зондов, аналогичного TAQMAN™, для подтверждения присутствия трансгенов DSM-2 и dgt-28. Проводили скрининг объектов методом ПЦР генной экспрессионной кассеты для определения того, интегрирована ли экспрессионная кассета dgt полностью в растительный геном без перестройки. Данные, полученные из этих исследований, использовали для определения числа копий трансгенов и идентификации выбранных объектов Arabidopsis для самоопыления и продвижения к поколению T2. Продвинутые на следующий этап T2 растения Arabidopsis также подвергали скринингу методом гидролиза зондов для подтверждения присутствия и для оценки числа копий генов DSM-2 и dgt в составе хромосомы растения. И наконец, саузерн-блот анализ использовали для подтверждения предполагаемого числа копий в подгруппе T1 растений Arabidopsis.
Аналогичные анализы использовали для подтверждения присутствия трансгена dgt-1 из растений, трансформированных pDAB4101, присутствия трансгена dgt-32 из растений, трансформированных pDAB107532, присутствия трансгена dgt-33 из растений, трансформированных pDAB107534, присутствия трансгена dgt-3 из растений, трансформированных pDAB102715, присутствия трансгена dgt-3 из растений, трансформированных pDAB102716, присутствия трансгена dgt-3 из растений, трансформированных pDAB102717, и присутствия трансгена dgt-7 из растений, трансформированных pDAB102785.
Анализ гидролиза зондов. Число копий определяли в T1 и T2 растениях Arabidopsis с использованием анализа гидролиза зондов, описанного ниже. Растения с различным числом трансгенов были идентифицированы и использованы для дальнейших исследований толерантности к глифосату.
Образцы тканей собирали в 96-луночные планшеты и лиофилизировали в течение 2 дней. Мацерацию тканей проводили при помощи тканевого пульверизатора KLECO™ и вольфрамовых гранул (Environ Metal INC., Sweet Home, Oregon). После мацерации тканей выделяли геномную ДНК в высокопроизводительном формате с использованием набора Biosprint™ 96 Plant kit (Qiagen™, Germantown, MD) в соответствии с протоколом, предложенным производителем. Проводили количественное определение геномной ДНК с помощью набора Quant-IT™ Pico Green DNA assay kit (Molecular Probes, Invitrogen, Carlsbad, CA). Известное количество геномной ДНК доводили до концентрации примерно 2 нг/мкл для анализа гидролиза зондов с использованием автоматического манипулятора жидкостями BIOROBOT3000™ (Qiagen, Germantown, MD). Определение числа копий трансгенов с помощью анализа гидролиза зондов проводили методом ПЦР в реальном времени с использованием системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы были разработаны для DSM-2, dgt-28 и внутреннего эталонного гена, TAFII15 (Genbank ID: NC 003075; Duarte et al., (201) BMC Evol. Biol., 10: 61).
Для амплификации готовили мастер-микс зондов LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN) в 1X конечной концентрации в 10-мкл объеме мультиплексной реакционной смеси, содержащей 0,1 мкМ каждого праймера для DSM-2 и dgt-28, 0,4 мкМ каждого праймера для TAFII15 и 0,2 мкМ каждого зонда.
Таблица 5. Двухступенчатую реакцию амплификации проводили с удлинением цепи при 60°C в течение 40 секунд с возрастанием флуоресценции. Анализировали все образцы и усредненные значения порогового цикла (Ct) использовали для анализа каждого образца. Анализ данных ПЦР в реальном времени был проведен с помощью программы LightCycler™ выпуска 1.5 с использованием относительного квантового модуля и основан на методе ΔΔCt. Для этого, образец геномной ДНК из однокопийного калибровочного стандарта и известный 2-копийный контроль включали в каждый анализ. Результаты анализа гидролиза зондов в виде числа копий получали для T1 и T2 трансгенных растений Arabidopsis.

Подтверждение интеграции dgt-28 саузерн-блот анализом. Саузерн-блот анализ использовали для создания шаблона интеграции вставленного фрагмента T-цепочечной ДНК и выявления объектов, содержащих dgt-28. Были получены данные для демонстрации интеграции и целостности трансгенных вставок в геноме Arabidopsis. Данные саузерн-блоттинга использовали для выявления простой интеграции интактной копии T-цепочечной ДНК. Подробный саузерн-блот анализ проводили с использованием ПЦР-амплифицированного зонда, специфичного для экспрессионной кассеты гена dgt-28. Продукт гибридизации зонда с геномной ДНК, который был расщеплен специфическими ферментами рестрикции, выявил фрагменты геномной ДНК с определенными значениями молекулярной массы, шаблоны которых использовали для выявления полноразмерных, с простой вставкой T1 трансгенных объектов для продвижения к следующему поколению.
Образцы тканей собирали в 2-мл конические пробирки (Eppendorf™) и лиофилизировали в течение 2 дней. Мацерацию тканей проводили при помощи тканевого пульверизатора KLECO™ и вольфрамовых гранул. После мацерации тканей выделяли геномную ДНК, используя метод выделения CTAB. Геномную ДНК дополнительно очищали с использованием набора Qiagen™ Genomic Tips kit. Проводили количественное определение геномной ДНК с помощью набора Quant-IT™ Pico Green DNA assay kit (Molecular Probes, Invitrogen, Carlsbad, CA). Известное количество геномной ДНК доводили до 4 мкг для постоянной концентрации.
Для каждого образца, 4 мкг геномной ДНК полностью расщепляли ферментом рестрикции SwaI (New England Biolabs, Beverley, MA) и инкубировали при 25°C в течение ночи, затем NsiI добавляли к реакционной смеси и инкубировали при 37°C в течение 6 часов. Расщепленную ДНК концентрировали осаждением раствором Quick Precipitation Solution™ (Edge Biosystems, Gaithersburg, MD) в соответствии с протоколом, предложенным производителем. Затем геномную ДНК ресуспендировали в 25 мкл воды при 65°C в течение 1 часа. Ресуспендированные образцы нагружали на 0,8% агарозный гель, приготовленный в 1X TAE, и проводили электрофорез в течение ночи при 1,1 В/см в 1X TAE буфере. Затем гель подвергали денатурации (0,2 M NaOH/0,6 M NaCl) в течение 30 минут и нейтрализовали (0,5 M Трис-HCl (pH 7,5)/1,5 M NaCl) в течение 30 минут.
Перенос фрагментов ДНК на нейлоновые мембраны выполняли путем пассивного капиллярного прохождения 20X раствора SSC в течение ночи через гель на обработанную мембрану для переноса IMMOBILON™ NY+ (Millipore, Billerica, MA), используя впитывающую бумагу для хроматографии и бумажные полотенца. После переноса мембрану быстро промывали 2X SSC, сшивали с STRATALINKER™ 1800 (Stratagene, LaJolla, CA) и запекали в вакууме при 80°C в течение 3 часов.
Блоты инкубировали в прегибридизационном растворе (Perfect Hyb plus, Sigma, St. Louis, MO) в течение 1 часа при 65°C в стеклянных вращающихся колбах с использованием инкубатора для гибридизации модели 400 (Robbins Scientific, Sunnyvale, CA). Зонды получали из ПЦР-фрагмента, содержащего полную кодирующую последовательность. ПЦР-ампликон очищали с использованием набора QIAEX™ II gel extraction kit и метили α32P-дЦТФ с помощью набора для мечения Random RT Prime IT™ labeling kit (Stratagene, La Jolla, CA). Гибридизацию блотов проводили в течение ночи при 65°C с денатурированным зондом, добавленным непосредственно в буфер гибридизации до концентрации примерно 2 миллиона импульсов на блот на мл. После гибридизации блоты последовательно промывали при 65°C смесью 0,1X SSC/0,1% SDS в течение 40 минут. В завершение, блоты экспонировали в кассетах с многократно используемыми фосфорными экранами и получали изображения с использованием системы Molecular Dynamics Storm 860™ imaging system.
Саузерн-блот анализы, проведенные в данном исследовании, использовали для определения числа копий и подтверждения того, что выбранные объекты содержали трансген dgt-28 в геноме Arabidopsis.
Подтверждение наличия экпрессионной кассеты гена dgt-28 с помощью ПЦР-анализа. Наличие экпрессионной кассеты гена dgt-28, содержащейся в объектах T1 растений, обнаруживали методом ПЦР с детекцией по конечной точке. Для детекции использовали праймеры (таблица 6), специфичные для областей промотора AtUbi10 v2 и AtuORF23 3′UTR v1 экспрессионной кассеты гена dgt-28.

В реакциях ПЦР необходим стандартный трехэтапный протокол циклов ПЦР для амплификации генной экспрессионной кассеты. Все реакции ПЦР выполняли с использованием следующих условий ПЦР: 94°C в течение трех минут с последующими 35 циклами при 94°C в течение тридцати секунд, 60°C в течение тридцати секунд и 72°C в течение трех минут. Реакции проводили с использованием набора EX-TAQ™ PCR kit (TaKaRa Biotechnology Inc. Otsu, Shiga, Japan) в соответствии с инструкциями производителя. После конечного цикла реакционную смесь инкубировали при 72°C в течение 10 минут. Электрофорез в агарозном геле с TAE буфером использовали для определения размеров ПЦР-ампликонов. ПЦР-ампликоны ожидаемого размера указывали на присутствие полноразмерной генной экспрессионной кассеты в геноме трансгенных объектов Arabidopsis.
Подтверждение относительной транскрипции dgt-28 методом количественной ПЦР с обратной транскрипцией. Образцы тканей трансгенных по dgt-28 растений собирали в 96-луночные планшеты и замораживали при -80°C. Мацерацию тканей проводили при помощи тканевого пульверизатора KLECO™ и вольфрамовых гранул (Environ Metal INC., Sweet Home, Oregon). После мацерации тканей выделяли суммарную РНК в высокопроизводительном формате с использованием набора Qiagen™ Rneasy 96 kit (Qiagen™, Germantown, MD) в соответствии с протоколом, предложенным производителем, который включал необязательную обработку ДНКазой I на колонке. За этим этапом следовала дополнительная обработка ДНКазой I (Ambion™, Austin, TX) элюированной суммарной РНК. Синтез кДНК проводили, используя суммарную РНК в качестве матрицы, с помощью набора High Capacity cDNA Reverse Transcription™ kit (Applied Biosystems, Austin, TX) следующая методике, предложенной производителем, с добавлением олигонуклеотида TVN. Количественное определение экспрессии проводили с помощью анализа гидролиза зондов и выполняли методом ПЦР в реальном времени с использованием системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы были разработаны для dgt-28 и внутреннего эталонного гена «неизвестного белка» (регистрационный номер Genbank: AT4 Г24610) с использованием программы разработки зондов LIGHTCYCLER® Probe Design Software 2.0. Для амплификации готовили мастер-микс зондов LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN) в 1X конечной концентрации в 10-мкл объеме одноплексной реакционной смеси, содержащей 0,4 мкМ каждого праймера и 0,2 мкМ каждого зонда. Таблица 7.

Двухступенчатую реакцию амплификации проводили с удлинением цепи при 60°C в течение 40 секунд с возрастанием флуоресценции. Все образцы анализировали в трех повторах и усредненные значения порогового цикла (Ct) использовали для анализа каждого образца. Для каждого образца проводили реакцию без обратной транскрипции для гарантии того, что отсутствует любая примесь гДНК. Анализ данных ПЦР в реальном времени выполняли на основе метода ΔΔCt. Этот анализ использовали для определения относительной экспрессии dgt-28 в трансгенных объектах Arabidopsis, которые, как было определено, были гемизигоными и гомозиготными. Уровни относительной транскрипции мРНК dgt-28 находились в диапазоне от 2,5-кратного до 207,5-кратного превышения уровня внутреннего контроля. Эти данные свидетельствуют о том, что трансгенные по dgt-28 растения содержали функциональную экспрессионную кассету гена dgt-28, и растения были способны к транскрипции трансгена dgt-28.
Вестерн-блот анализ. DGT-28 был обнаружен в образцах листьев, полученных от трансгенных растений Arabidopsis thaliana. Растительные экстракты от трансгенных по dgt-28 растений и стандарты белка DGT-28 инкубировали с буфером для образцов NUPAGE® LDS (Invitrogen, Carlsbad, CA), содержащим ДТТ, при 90°C в течение 10 минут и электрофоретически разделяли в готовом акриламидном геле. Затем белки электрофоретически переносили на нитроцеллюлозную мембрану с использованием протокола, предложенного производителем. После блокирования блокирующей смесью WESTERNBREEZE® Blocking Mix (Invitrogen) белок DGT-28 обнаруживали с помощью анти-DGT-28 антисыворотки, с последующей обработкой антителами козы против иммуноглобулинов кролика, конъюгированными с фосфатазой. Обнаруженный белок визуализировали с помощью хемилюминесцентного субстрата BCIP/NBT Western Analysis Reagent (KPL, Gaithersburg, MD). Продукция интактного белка DGT-28, продемонстрированная методом вестрен-блоттинга, свидетельствовала о том, что анализируемые трансгенные по dgt-28 растения экспрессировали белок DGT-28.
Трансгенные T1 растения Arabidopsis, содержащие трансген dgt-28, опрыскивали глифосатом при различных нормах применения. В данном исследовании использовали повышенные нормы применения для определения относительных уровней устойчивости (105, 420, 1680 или 3360 г кэ/га). Типичная 1X норма применения глифосата, которая достаточна для уничтожения нетрансформированных растений Arabidopsis, составляет 1120 г кэ/га. Препараты глифосата с добавлением сульфата аммония наносили на T1 растения с использованием машины для распыления гербицидов, откалиброванной для доставки 187 л/га. T1 растения Arabidopsis, которые использовали в данном исследовании, имели разное число копий трансгена dgt-28. T1 растения Arabidopsis с низким числом копий dgt-28 подвергали самоопылению и использовали для получения T2 растений. В таблице 8 приведено сравнение трансгенных по dgt-28 растений относительно растений с геном устойчивости к гербициду глифосату, dgt-1, а также контролей дикого типа. В таблице 9 приведено сравнение растений с dgt-32 и dgt-33 относительно растений с геном устойчивости к гербициду глифосату, dgt-1, и контролей дикого типа. В таблице 10 приведено сравнение растений с новыми бактериальными ферментами EPSP синтазами относительно растений с ферментами EPSP синтазами класса I и контролей при норме применения глифосата 1680 г кэ/га.
Результаты отбора с помощью глифосата трансформированных dgt-28 растений Arabidopsis. T1 трансформанты Arabidopsis сначала отбирали на фоне нетрансформированных семян с использованием схемы отбора с глюфозинатом. Три лотка для прорастания, или 30000 семян, анализировали на каждый T1 конструкт. Выбранные T1 растения характеризовали методами молекулярного анализа и репрезентативные растения с разным числом копий впоследствии пересаживали в отдельные горшки и опрыскивали коммерческим глифосатом в различных нормах применения, как описано ранее. Реакция на дозу таких растений представлена в виде % видимых повреждений через 2 недели после обработки (НПО). Данные приведены в таблице, в которой указаны отдельные растения, демонстрирующие небольшие повреждения или их отсутствие (<20%), умеренные повреждения (20-40%) или серьезные повреждения (>40%). Для каждого конструкта, используемого для трансформации Arabidopsis, приведены арифметические средние и стандартные отклонения. Диапазон индивидуальной реакции также указан в последней колонке для каждой нормы применения и трансформации. Нетрансформированные растения Arabidopsis дикого типа (культивар Columbia) служили в качестве чувствительного к глифосату контроля.
Уровни реакции растений варьировались. Эти вариации могут быть связаны с тем, что каждое растение представляет собой независимый трансформационный объект, и, следовательно, число копий интересующего гена меняется от растения к растению. Было отмечено, что некоторые растения, содержащие трансген, не были толерантны к глифосату; тщательный анализ для определения того, экспрессируют ли данные растения трансген, не был проведен. Вполне вероятно, что наличие высокого числа копий трансгенов в T1 растениях Arabidopsis приводит к сайленсингу трансгенов или другим эпигенетическим эффектам, результатом которых является чувствительность к глифосату, несмотря на присутствие трансгена dgt-28.
Средний показатель повреждений для всей популяции в зависимости от нормы применения приведен в таблице 10 при норме применения глифосата 1680 г кэ/га для демонстрации значительной разницы между растениями, трансформированными dgt-3, dgt-7, dgt-28, dgt-32 и dgt-33, в сравнении с растениями с dgt-1 и контролями дикого типа.
Толерантность, придаваемая новыми бактериальными EPSP синтазами, варьировалась в зависимости от конкретного фермента. DGT-28, DGT-32 и DGT-33 неожиданно обеспечивали значительную толерантность к глифосату. Гены dgt придавали устойчивость к гербициду отдельным T1 растениям Arabidopsis в случае всех тестируемых транзитных пептидов. Таким образом, использование дополнительных транзитных пептидов хлоропласта (то есть, TraP8-dgt-32 или TraP8-dgt-33) обеспечит защиту от глифосата с уровнями повреждения, аналогичными тем, о которых сообщалось для данного вида обработки.
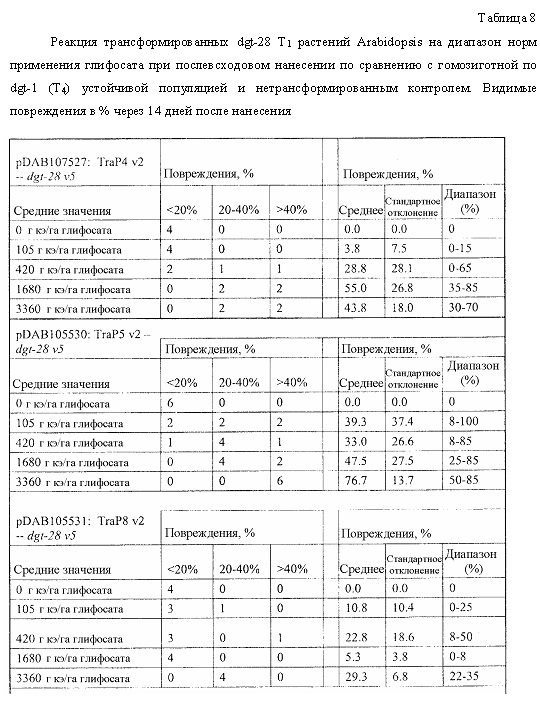
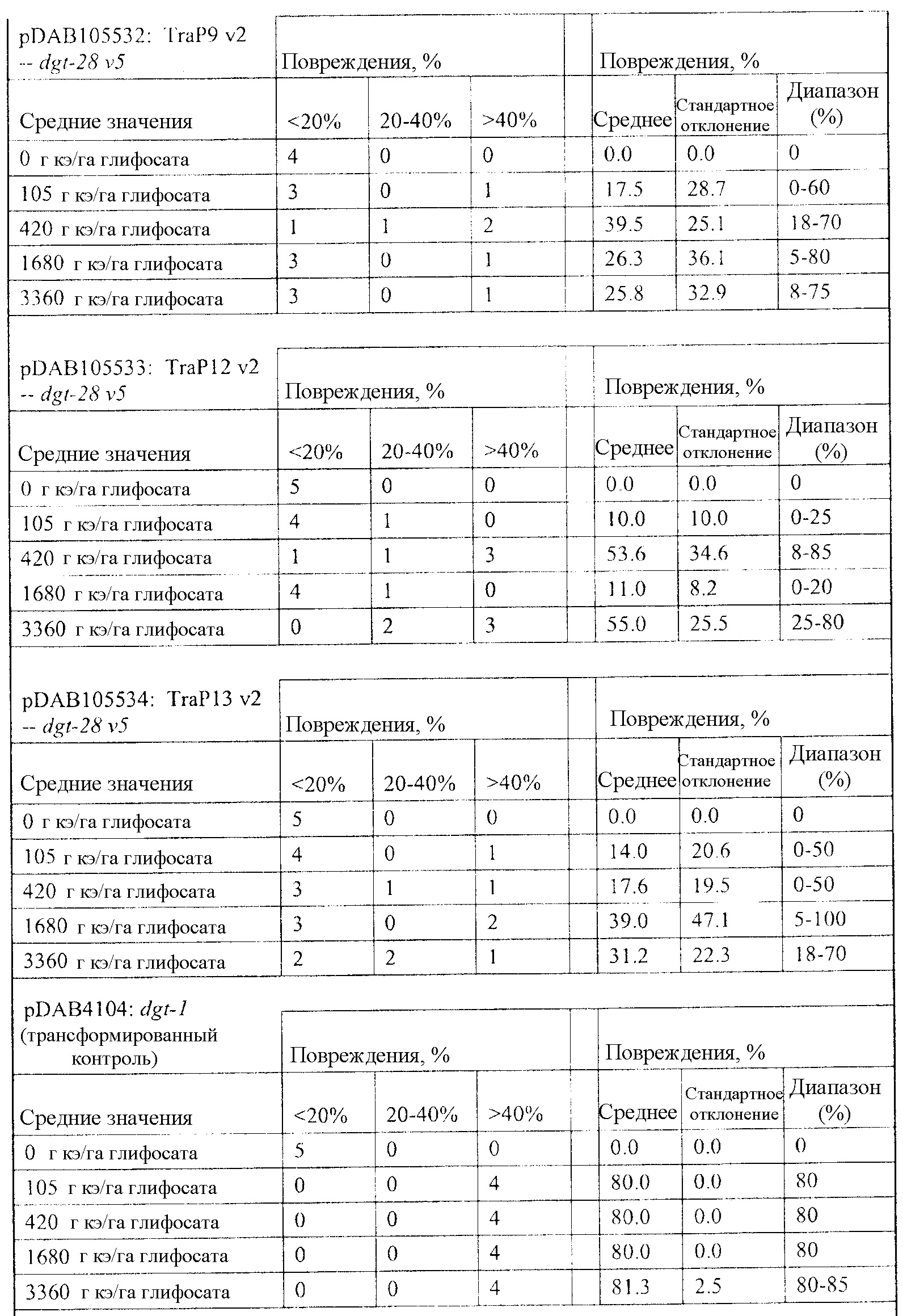
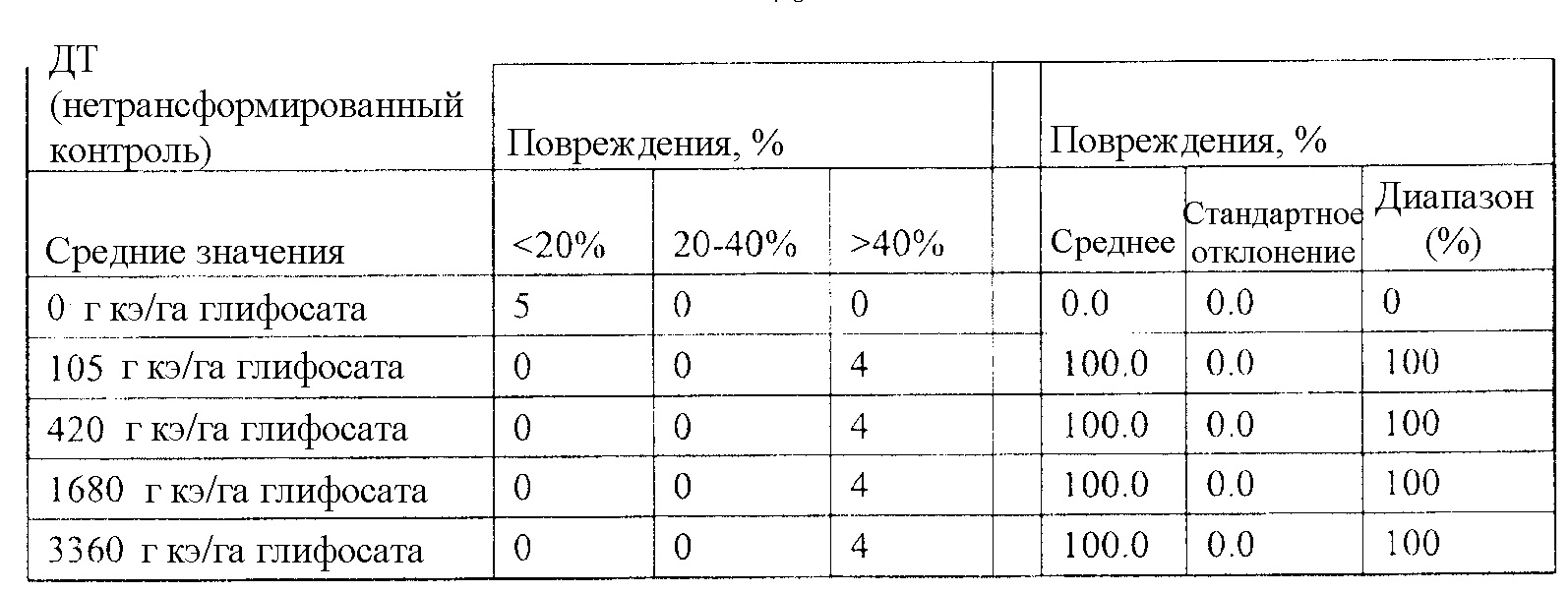
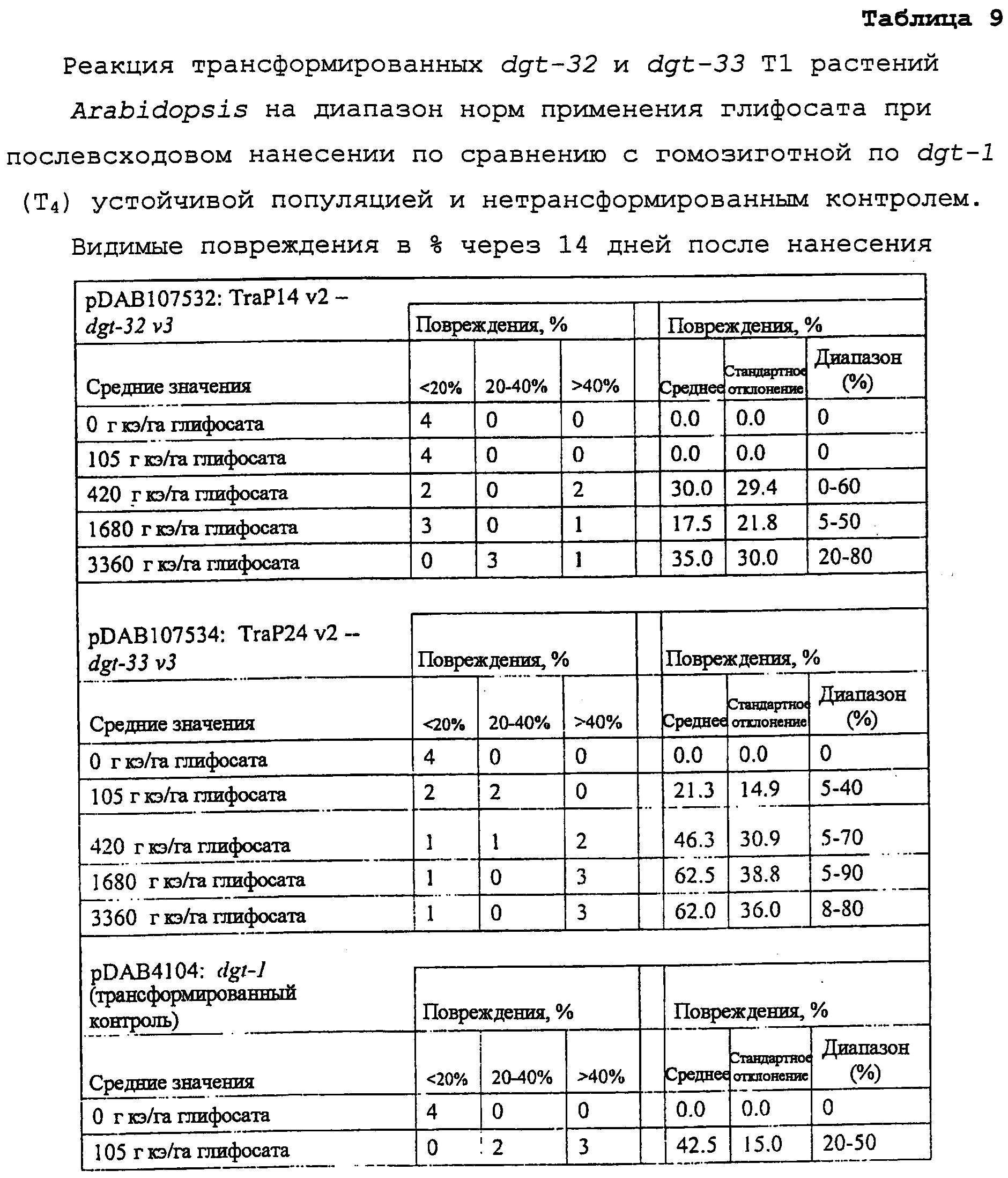

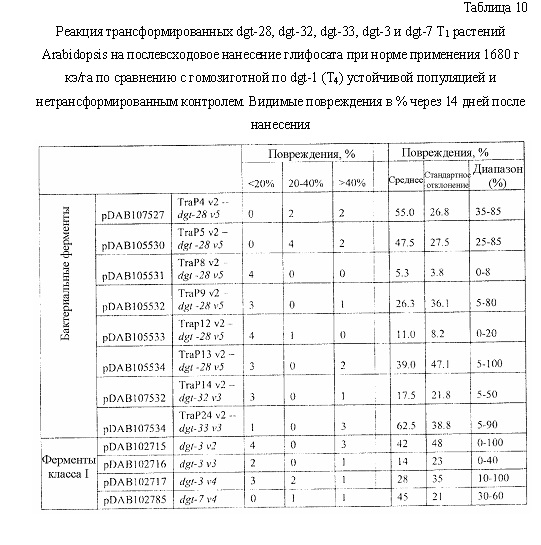
dgt-28 в качестве селективного маркера. Использование dgt-28 в качестве селективного маркера для средства отбора глифосата тестировали на трансформированных растениях Arabidopsis, описанных выше. Примерно 50 семян Arabidopsis поколения T4 (гомозиготные по dgt-28) вносили в примерно 5000 семян растений дикого типа (чувствительных к глифосату). Семена проращивали и проростки опрыскивали селективной дозой глифосата. Сравнивали несколько вариантов обработки глифосатом; на растения в каждом из лотков наносили глифосат один или два раза по одной из следующих схем обработки: через 7 ДПП (дней после посадки), 11 ДПП, либо через 7, а затем через 11 ДПП. Поскольку все растения также содержали ген устойчивости к глюфозинату в одном и том же трансформирующем векторе, содержащие dgt-28 растения, отобранные с помощью глифосата, можно было напрямую сравнивать с содержащими DSM-2 или pat растениями, отобранными с помощью глюфозината.
Обработки глифосатом проводили с использованием распылителя DeVilbiss™, как описано ранее. Трансгенные растения, содержащие dgt-28, идентифицировали как «устойчивые» или «чувствительные» через 17 ДПП. Обработки глифосатом при нормах применения 26,25-1680 г кэ/га, проведенные через 7 и 11 дней после посадки (ДПП), продемонстрировали эффективный отбор на трансгенные растения Arabidopsis, содержащие dgt-28. Чувствительные и устойчивые растения подсчитывали и, как оказалось, число толерантных к глифосату растений коррелировало с исходным числом трансгенных семян, содержащих трансген dgt-28, которые были посажены. Эти результаты указывают на то, что dgt-28 можно эффективно использовать в качестве альтернативного селективного маркера для популяции трансформированных растений Arabidopsis.
Наследуемость. Проводили самоопыление подтвержденных трансгенных T1 объектов Arabidopsis, получая T2 семена. Эти семена тестировали на передаваемые потомству признаки путем нанесения гербицида Ignite™, содержащего глюфозинат (200 г кэ/га), на 100 случайным образом выбранных близкородственных T2 растений. Каждое отдельное T2 растение пересаживали в 7,5-см квадратные горшки перед опрыскиванием (машина для распыления гербицидов, откалиброванная для нормы применения 187 л/га). T1 семейства (T2 растения) сегрегировали в соотношении 3 устойчивые: 1 чувствительное в соответствии с ожидаемой моделью для доминантно наследуемого одного локуса по закону наследования Менделя, что определяли с помощью критерия хи-квадрата (P >0,05). Процент T1 семейств, которые сегрегировали в соответствии с ожидаемым наследованием по закону Менделя, приведен в таблице 11 и свидетельствует о том, что признак dgt-28 проходит по закону наследования Менделя в поколение T2. Семена собирали от 5-15 отдельных T2 растений (T3 семена). Двадцать пять близкородственных T3 растений из каждых 3-4 случайным образом выбранных T2 семейств тестировали на передаваемые потомству признаки, как описано ранее. Данные показали отсутствие сегрегации и, таким образом, продемонстрировали, что dgt-28 и dgt-3 стабильно интегрированы в хромосому и наследуются по закону Менделя на протяжении по меньшей мере трех поколений.

Данные по T2 растениям Arabidopsis. Растения второго поколения (T2) от выбранных T1 объектов Arabidopsis, которые содержали низкое число копий трансгена dgt-28, были дополнительно охарактеризованы на толерантность к глифосату. Глифосат наносили, как описано ранее. Реакцию растений представляли в виде % видимых повреждений через 2 недели после обработки (НПО). Данные представлены в виде гистограммы для отдельных растений, демонстрирующих небольшие повреждения или их отсутствие (<20%), умеренные повреждения (20-40%) или серьезные повреждения (>40%). Для каждого конструкта, используемого для трансформации Arabidopsis, приведены арифметические средние и стандартные отклонения. Диапазон индивидуальной реакции также указан в последней колонке для каждой нормы применения и трансформации. Нетрансформированные растения Arabidopsis дикого типа (культивар Columbia) служили в качестве чувствительного к глифосату контроля. В поколении T2 гемизиготные и гомозиготные растения были доступны для тестирования для каждого объекта, и вследствие этого, были включены в эксперименты с тестированием каждой нормы применения глифосата. Гемизиготные растения содержат два различных аллеля в локусе, в отличие от гомозиготных растений, которые содержат два одинаковых аллеля в локусе. Вариабельность реакции на глифосат ожидается в поколении T2 как следствие разницы в содержании гена в гемизиготных, по сравнению с гомозиготными растениями. Вариабельность реакции на глифосат отражается в величине стандартного отклонения и диапазона реакции.
В поколении T2 как однокопийные, так и многокопийные объекты dgt-28 характеризовали на устойчивость к глифосату. В пределах объекта однокопийные растения демонстрировали сходные уровни толерантности к глифосату. Характерные данные для однокопийного T2 объекта приведены в таблице 12. Объекты, содержащие dgt-28, связанный с TraP5 v2, не обеспечивали надежную толерантность к глифосату, по сравнению с конструктами dgt-28, содержащими другие транзитный пептиды TraP. Однако конструкты dgt-28-TraP5 все же обеспечивали низкий уровень толерантности к глифосату по сравнению с нетрансформированным контролем Columbia. Были случаи, когда объекты, содержащие две или более копий dgt-28, были более чувствительны к повышенным нормам применения глифосата (данные не представлены). Это повышение чувствительности к глифосату аналогично данным, приведенным ранее для T1 растений, которые также содержали высокое число копий трансгена dgt-28. Вполне вероятно, что наличие высокого числа копий трансгенов в растениях Arabidopsis приводит к сайленсингу трансгенов или другим эпигенетическим эффектам, результатом которых является чувствительность к глифосату, несмотря на присутствие трансгена dgt-28.
Эти объекты содержали dgt-28, связанный с TraP5 v2 (pDAB105530), TraP12 v2 (pDAB105533) и TraP13 v2 (pDAB105534).
В дополнение к dgt-28, T2 объекты Arabidopsis, трансформированные dgt-3, приведены в таблице 13. Как описано для dgt-28 объектов в таблице 12, таблица данных содержит репрезентативный объект, который является характерным для реакции на глифосат для каждого конструкта. Для характеристики dgt-3 конструкты, содержащие одну PTU (растительную трансформационную единицу) с геном dgt-3, управляемую промотором AtUbi10 (pDAB102716, фиг. 29 и pDAB102715, фиг. 28), сравнивали с конструктами с тем же геном, содержащими 2 PTU гена (pDAB102719, фиг. 32; pDAB102718, фиг. 33). В конструктах, которые содержали 2 PTU, использовался промотор AtUbi10 для управления одной копией гена и промотор CsVMV для управления другой копией. Использование двойных PTU было включено в исследование для сравнения трансгенных по dgt-3 растений с трансгенными по dgt-28 растениями, содержащими две копии трансгена. Данные показали, что однокопийные T2 dgt-3 объекты с только одной PTU были более чувствительны к глифосату, чем протестированные однокопийные dgt-28 объекты, однако более толерантны, чем нетрансформированный контроль. T1 семейства, содержащие 2 PTU гена dgt-3, проявляли более высокий уровень видимой толерантности к глифосату, по сравнению с содержащими 1 PTU конструктами. В обоих случаях T1 семейства сравнивали с содержащими dgt-1 растениями и контролями дикого типа. Данные по T2 растениям свидетельствуют, что dgt-28 обеспечивает надежную толерантность в качестве однокопийных объектов.
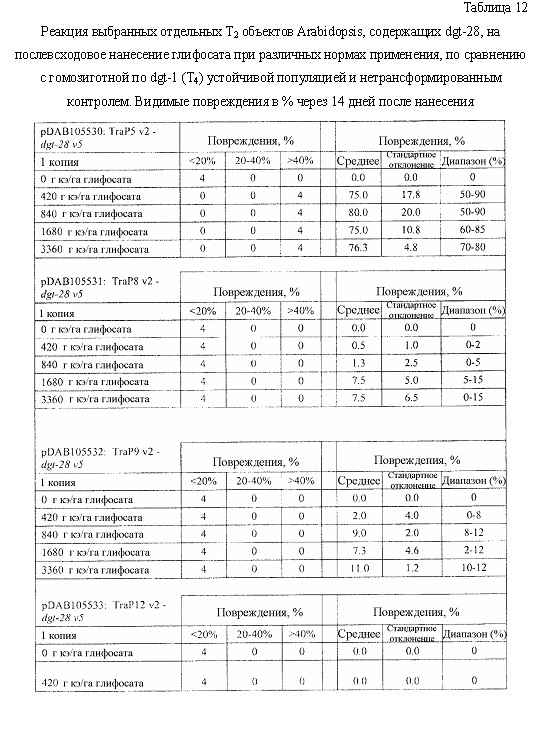
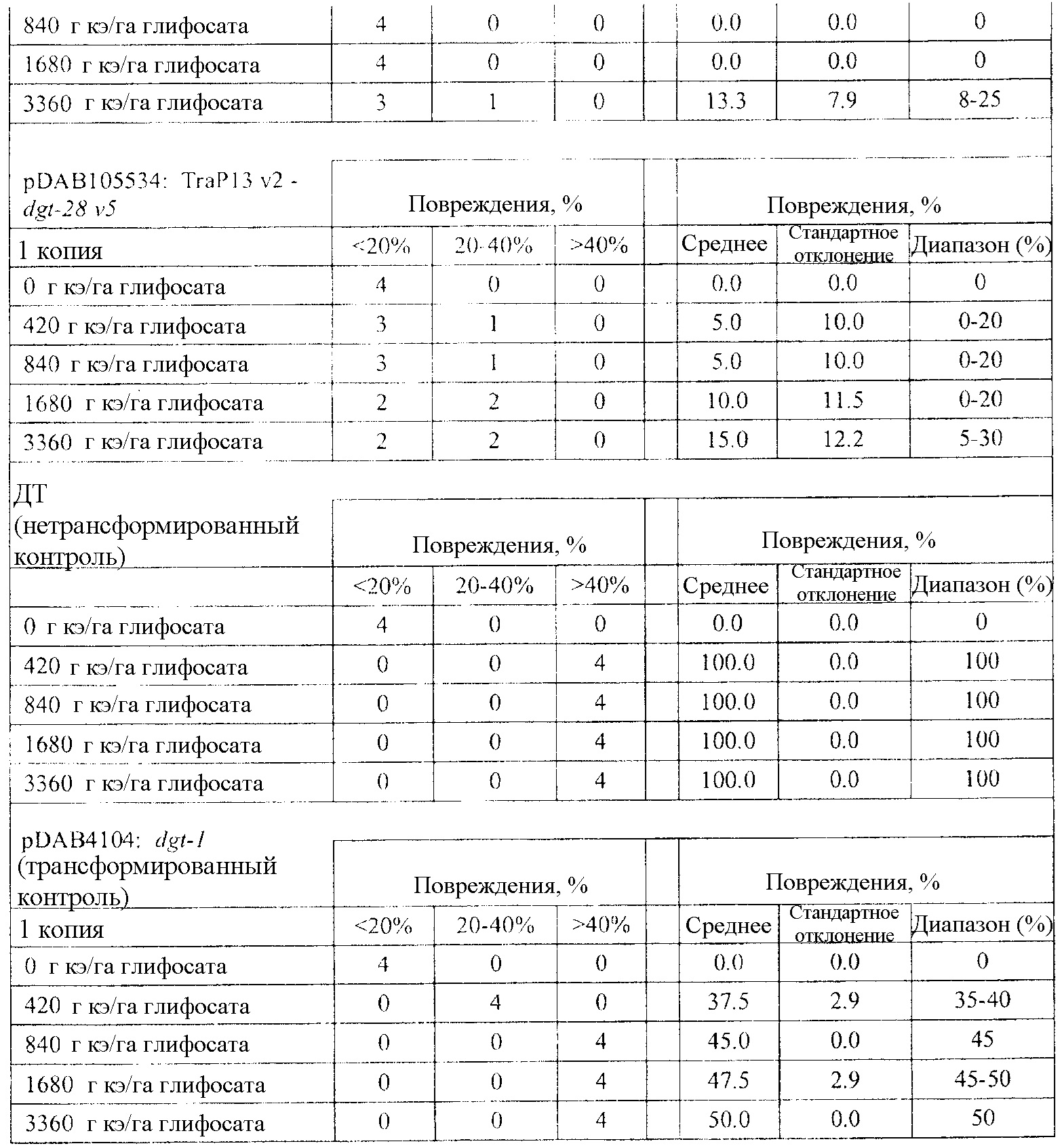

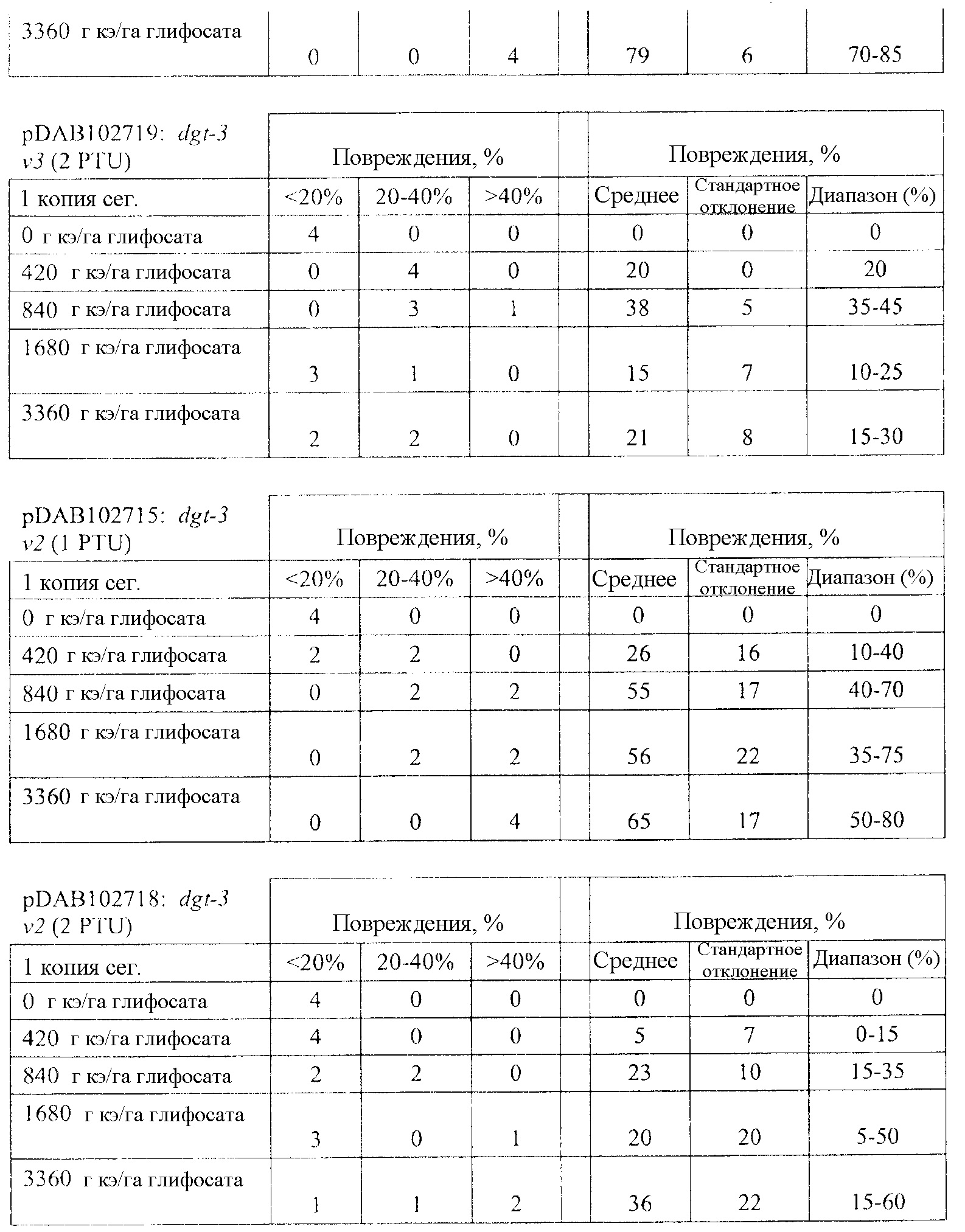
Данные по T3 растениям Arabidopsis. Растения третьего поколения (T3) от выбранных T2 объектов Arabidopsis, которые содержали низкое число копий трансгена dgt-28, были дополнительно охарактеризованы на толерантность к глифосату. Двадцать пять растений на линию отбирали с помощью глюфозината, как описано ранее, и линии от каждого протестированного конструкта не сегрегировали по гену селективного маркера. Глифосат наносили, как описано ранее. Реакция растений представлена в виде % видимых повреждений через 2 недели после обработки (НПО). Данные представлены в виде гистограммы для отдельных растений, демонстрирующих небольшие повреждения или их отсутствие (<20%), умеренные повреждения (20-40%) или серьезные повреждения (>40%). Для каждого конструкта, используемого для трансформации Arabidopsis, приведены арифметические средние и стандартные отклонения. Диапазон индивидуальной реакции также указан в последней колонке для каждой нормы применения и трансформации. Нетрансформированные растения Arabidopsis дикого типа (культивар Columbia) служили в качестве чувствительного к глифосату контроля.
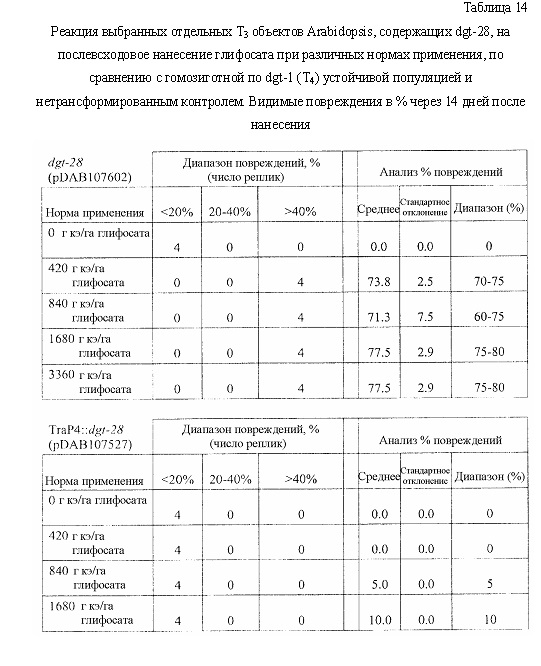
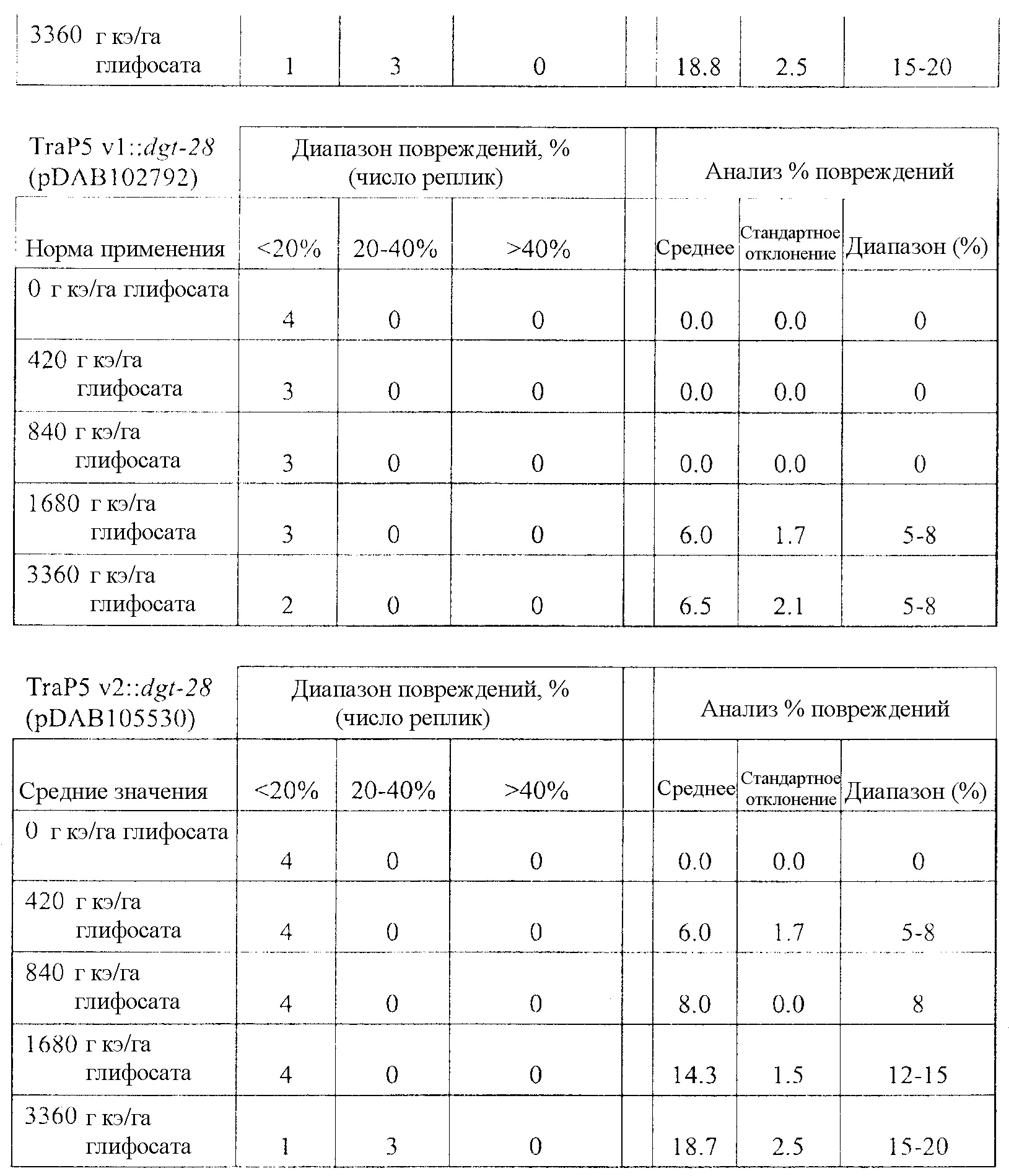
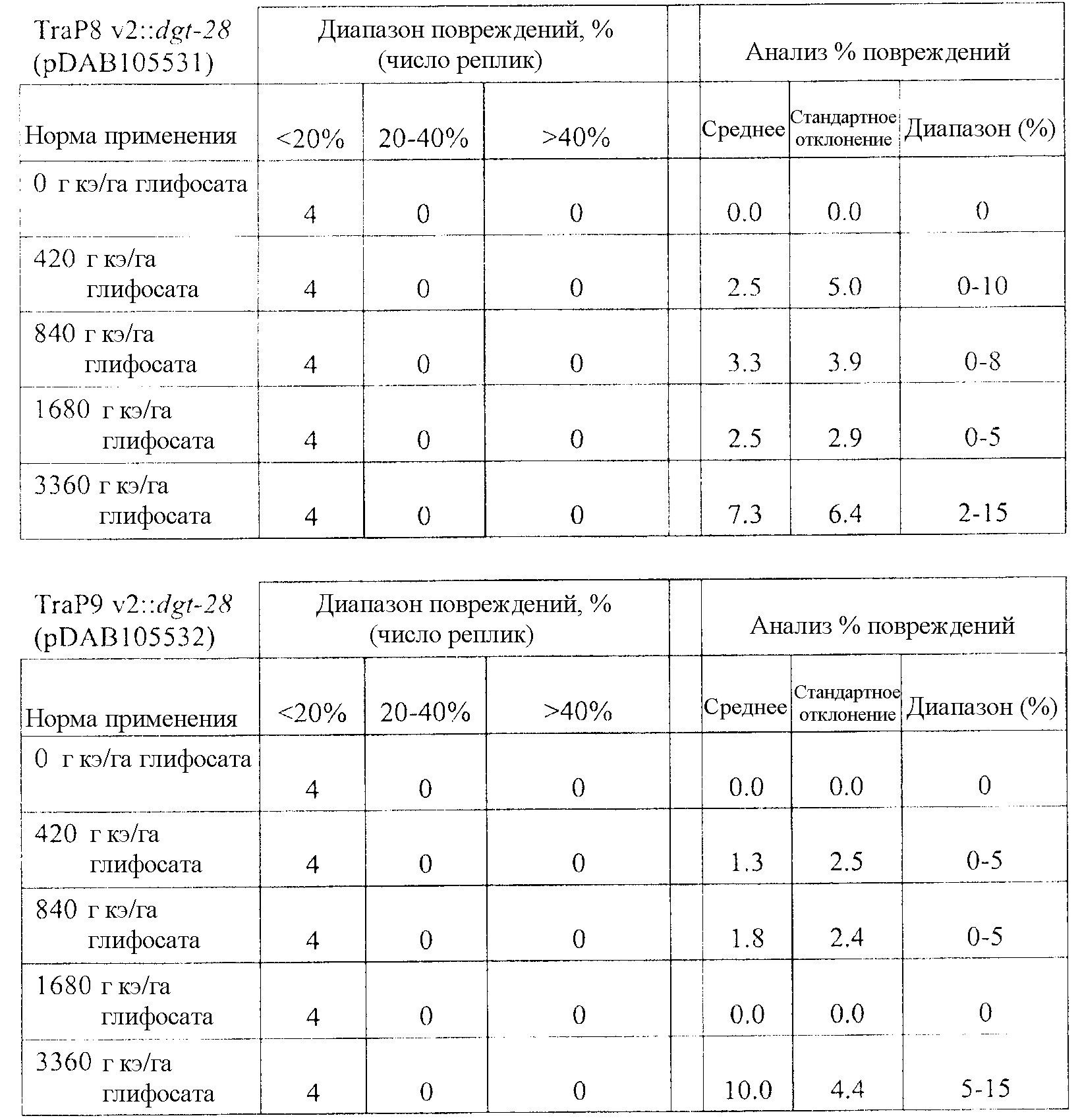
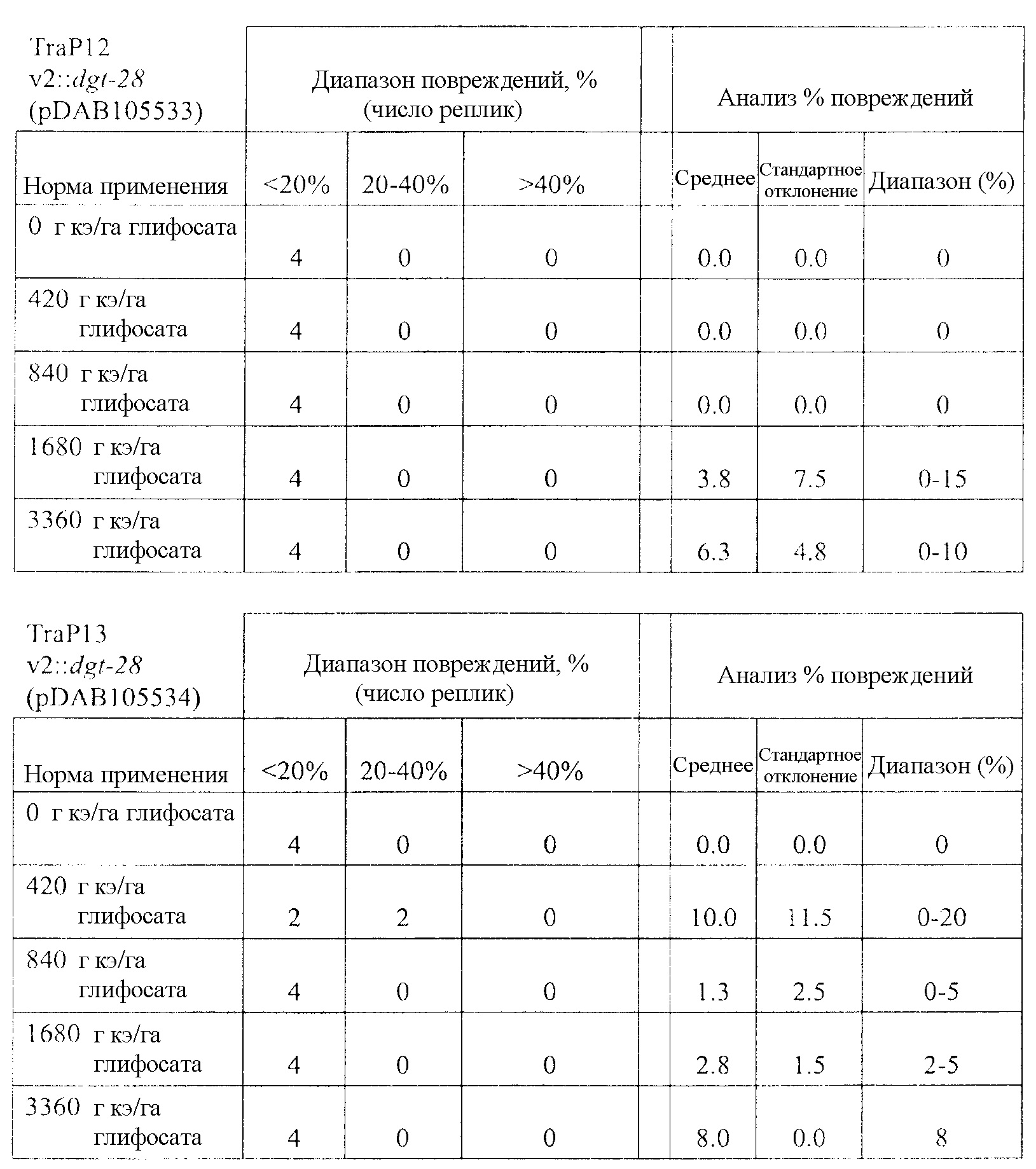
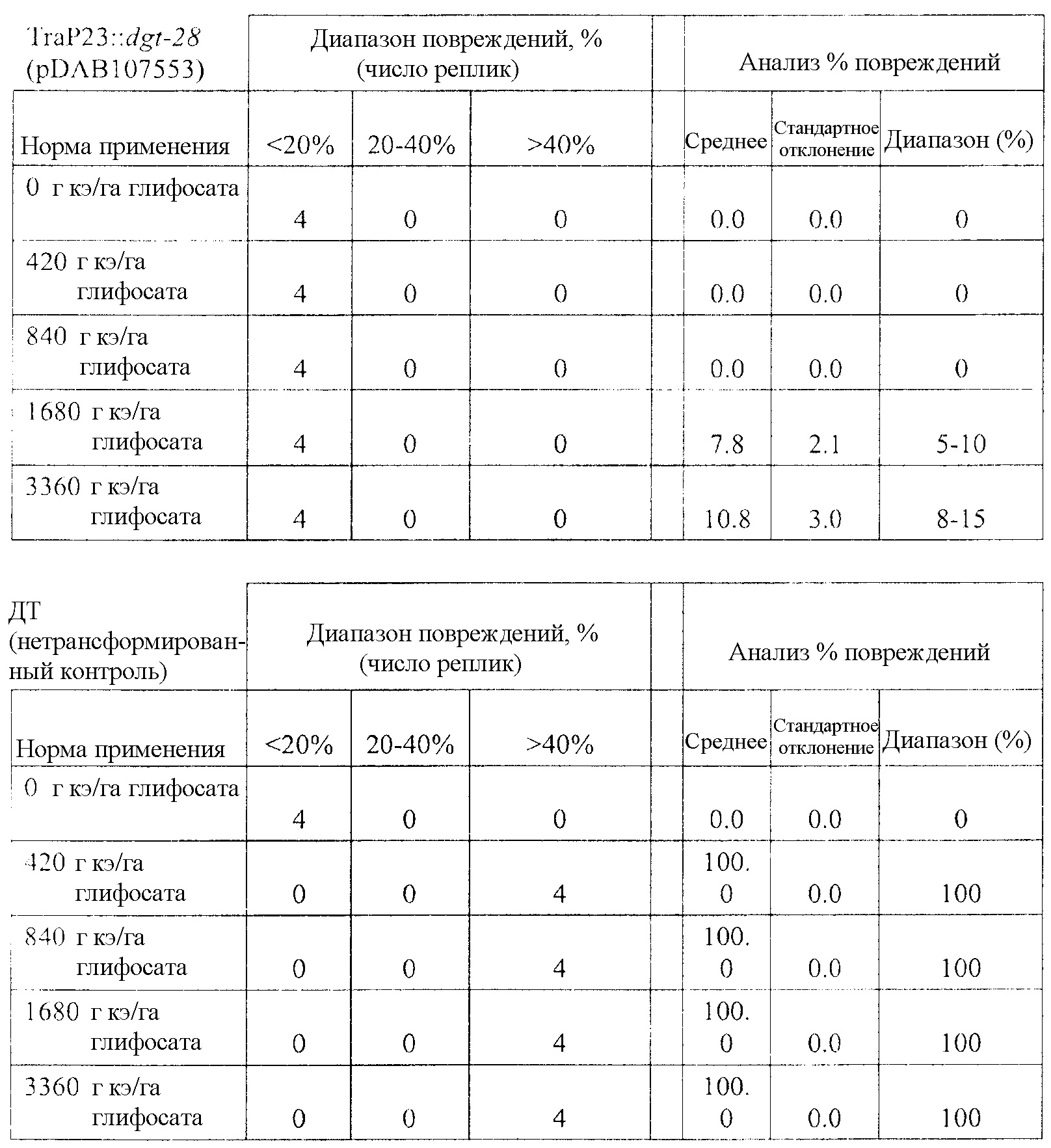
Отбор трансформированных растений. Свежесобранные T1 семена [ген dgt-31, dgt-32 и dgt-33 v1] оставляли высыхать при комнатной температуре и отправляли в Индианаполис для тестирования. T1 семена высевали в лотки для прорастания размером 26,5×51 см (T.O. Plastics Inc., Clearwater, MN), внося в каждый из них 200-мг аликвоту стратифицированных Т1 семян (~10000 семян), которые предварительно были суспендированы в 40 мл 0,1% раствора агарозы и хранились при 4°C в течение 2 дней для соблюдения требования покоя семян и обеспечения синхронного прорастания семян.
Смесь Sunshine Mix LP5 (Sun Gro Horticulture Inc., Bellevue, WA) покрывали мелким вермикулитом и орошали инфильтрацией питательной смесью Хогланда до намокания, которую затем оставляли стекать под действием силы тяжести. Каждую 40-мл аликвоту стратифицированных семян высевали равномерно на вермикулит пипеткой и накрывали куполами влажности (KORD™ Products, Bramalea, Ontario, Canada) на 4-5 дней. Купола удаляли после прорастания растений до первичного отбора трансформантов путем послевсходового опрыскивания глюфозинатом (отбор на котрансформированный ген dsm-2).
Через шесть дней после посадки (ДПП) и вновь через 10 ДПП T1 растения (семядоля и стадия 2-4 листьев, соответственно) опрыскивали 0,1% раствором гербицида Ignite™ (280 г аи/л глюфозината, Bayer Crop Sciences, Kansas City, MO) в объеме распыления 10 мл/лоток (703 л/га) с использованием пневматического распылителя DeVilbiss™ для доставки эффективной нормы 200 г аи/га глюфозината за одно нанесение. Выжившие растения (активно растущие растения) выявляли через 4-7 дней после последнего опрыскивания. Выжившие растения пересаживали индивидуально в 3-дюймовые (7,62-сантиметровые) горшки с посадочной средой (Metro Mix 360™). Растения выращивали в теплице до срока по меньшей мере за 1 день до отбора образцов тканей для анализа числа копий.
Были собраны образцы T1 растений и проведен анализ числа копий для генов dgt-31, dgt-32 и dgt-33 v1. Затем T1 растения были распределены для нанесения глифосата при различных нормах применения таким образом, что диапазон числа копий встречался при каждой норме применения. Для Arabidopsis 26,25 г кэ/га глифосата является эффективной дозой, чтобы отличать чувствительные растения от растений, имеющих значимые уровни устойчивости. Использовали повышенные нормы применения для определения относительных уровней устойчивости (105, 420, 1680 или 3360 г кэ/га). В таблице 15 приведены сравнения относительно растений с геном dgt-1.
Все нанесения гербицида глифосата выполняли машиной для распыления гербицидов в объеме распыления 187 л/га. Используемый глифосат представлял собой коммерческий препарат соли диметиламина Durango (480 г кэ/л, Dow AgroSciences, LLC). Низкокопийные T1 растения, которые проявляли толерантность либо к глюфозинату, либо к глифосату, были дополнительно оценены в поколении T2.
Первые трансформации Arabidopsis проводили с использованием dgt-31, dgt-32 и dgt-33 v1. T1 трансформанты сначала отбирали на фоне нетрансформированных семян с использованием схемы отбора с глюфозинатом. Три лотка для прорастания, или 30000 семян, анализировали на каждый T1 конструкт. Рассчитывали частоту трансформации, и результаты для T1 dgt-31, dgt-32 и dgt-33 конструктов приведены в таблице 15.

T1 растения, выбранные, как описано выше, затем пересаживали в отдельные горшки и опрыскивали коммерческим глифосатом при различных нормах применения. В таблице 16 приводится сравнение реакций для dgt-31, dgt-32 и dgt-33 v1, а также контрольных генов в отношении придания устойчивости к глифосату T1 трансформантам Arabidopsis. Реакция представлена в виде % видимых повреждений через 2 НПО. Данные представлены в виде гистограммы для отдельных растений, демонстрирующих небольшие повреждения или их отсутствие (<20%), умеренные повреждения (20-40%) или серьезные повреждения (>40%). Для каждого варианта обработки приведены арифметические средние и стандартные отклонения. Диапазон индивидуальной реакции также указан в последней колонке для каждой нормы применения и трансформации. Нетрансформированные растения Arabidopsis дикого типа (культивар Columbia) служили в качестве чувствительного к глифосату контроля. Ген DGT-31 (v1) с транзитным пептидом TraP23 придавал небольшую толерантность к гербициду отдельным T1 растениям Arabidopsis по сравнению с отрицательным контролем, однако ген с транзитным пептидом TraP8 придавал повышенную толерантность. Как DGT-32, так и DGT-33 придавали надежную толерантность к глифосату при тестируемых нормах применения с TraP8 и с их соответствующими отличающимися транзитными пептидами хлоропласта (TraP14 и TraP24, соответственно). При данном варианте обработки уровень реакции растений значительно варьировался, это может быть связано с тем, что каждое растение представляет собой независимый трансформационный объект, и, следовательно, число копий интересующего гена меняется от растения к растению. Важно отметить, что при каждой тестируемой норме применения глифосата находились отдельные растения, которые были более толерантными, чем другие. Средние показатели повреждений для всей популяции приведены в таблице 16 для демонстрации значительной разницы между растениями, трансформированными dgt-31, dgt-32 и dgt-33 v1, в сравнении с трансформированными dgt-1 v1 растениями или контролями дикого типа.
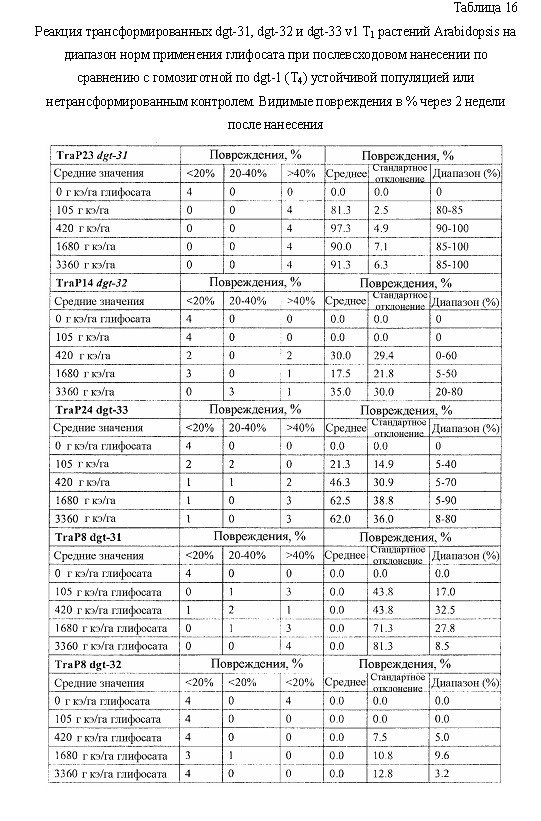
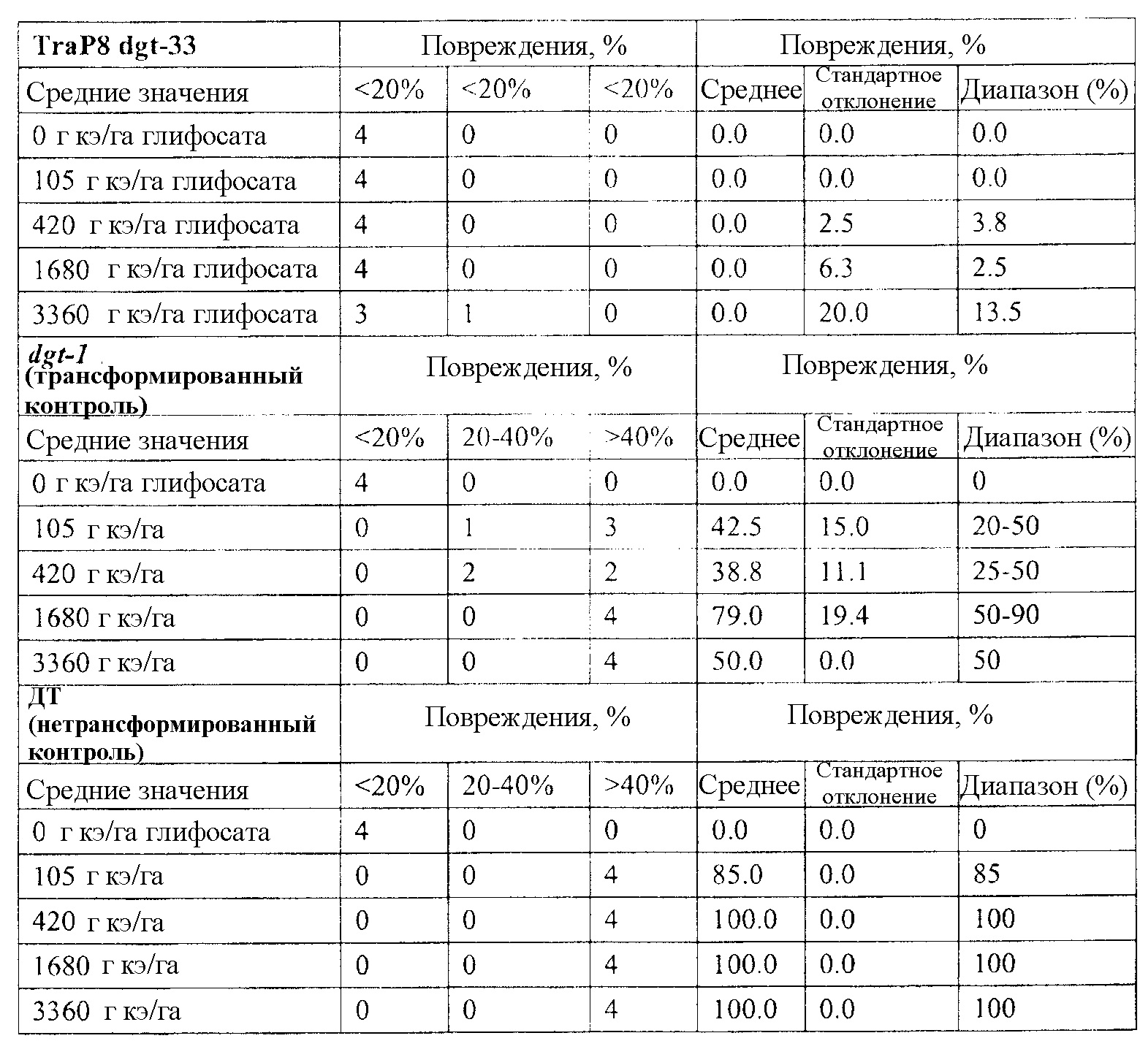
Трансформация кукурузы. Стандартные методы клонирования, описанные выше, использовали в конструировании бинарных векторов с целью использования в опосредованной Agrobacterium tumefaciens трансформации кукурузы. В таблице 17 приведен список векторов, которые были сконструированы для трансформации кукурузы. Следующие генные элементы использовали в векторах, содержащих dgt-28: промотор убиквитина 1 Zea mays (ZmUbi1; патент США № 5510474) использовали для управления кодирующей последовательностью dgt-28, которая фланкирована 3' нетранслируемой областью липазы Zea mays (ZmLip 3′UTR; патент США № 7179902), кассета селективного маркера состояла из промотора убиквитина 1 Zea mays, который был использован для управления кодирующей последовательностью aad-1 (патент США № 7838733), которая фланкирована 3' нетранслируемой областью липазы Zea mays. Кодирующая последовательность aad-1 придает толерантность к гербицидам на основе феноксиуксусной кислоты и ауксина, таким как 2,4-дихлорфеноксиуксусная кислота (2,4-D), и к гербицидам из класса арилоксифеноксипропионатов (AOPP).
Были созданы конструкты dgt-28 в виде стандартных бинарных векторов и векторов супербинарной системы на основе Agrobacterium (Japan Tobacco, Tokyo, JP). Стандартные бинарные векторы включали: pDAB107663, pDAB107664, pDAB107665 и pDAB107665. Векторы супербинарной системы на основе Agrobacterium включали pDAB108384, pDAB108385, pDAB108386 и pDAB108387.
Были созданы дополнительные конструкты, содержащие репортерный ген желтого флуоресцентного белка (yfp; патентная заявка США 2007/0298412). pDAB109812 содержит кассету репортерного гена yfp, которая управляется промотором убиквитина 1 Zea mays и фланкирована 3' нетранслируемой областью per 5 Zea mays (Zmper5 3′UTR; патент США № 7179902), кассета селективного маркера состоит из промотора палочковидного вируса сахарного тростника (SCBV; патент США № 5994123), который использовали для управления экспрессией aad-1, и фланкирована 3′ нетранслируемой областью липазы Zea mays. pDAB101556 содержит кассету yfp, которая управляется промотором убиквитина 1 Zea mays и фланкирована 3' нетранслируемой областью per 5 Zea mays, кассета селективного маркера состоит из промотора убиквитина 1 Zea mays, который использовали для управления экспрессией aad-1, и фланкирована 3' нетранслируемой областью липазы Zea mays. pDAB107698 содержит кассету dgt-28, которая управляется промотором убиквитина 1 Zea mays и фланкирована 3' нетранслируемой областью липазы Zea mays, кассету yfp, которая управляется промотором убиквитина 1 Zea mays и фланкирована 3' нетранслируемой областью per 5 Zea mays, кассета селективного маркера состоит из промотора палочковидного вируса сахарного тростника, который использовали для управления экспрессией aad-1, и фланкирована 3' нетранслируемой областью липазы Zea mays. Все три из этих конструктов представляют собой стандартные бинарные векторы.
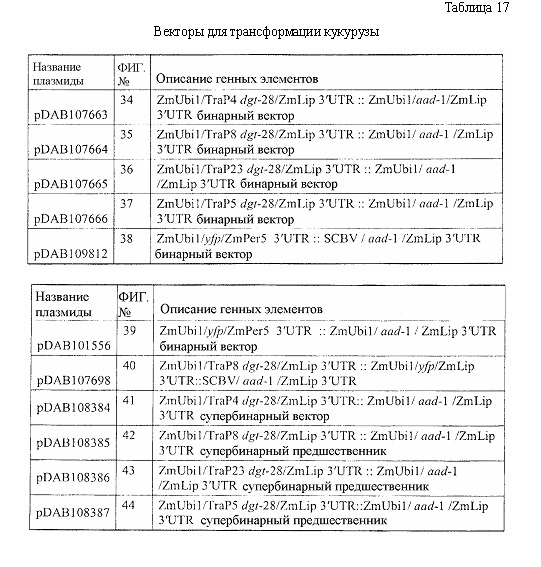
Стерилизация початков и выделение зародышей. Для получения незрелых зародышей кукурузы растения Zea mays инбредной линии B104 выращивали в теплице и подвергали самоопылению или близкородственному опылению для получения початков. Початки собирали примерно через 9-12 дней после опыления. В день эксперимента початки поверхностно стерилизовали, погружая в 20% раствор гипохлорита натрия (5%) и встряхивая в течение 20-30 минут с последующим промыванием три раза стерильной водой. После стерилизации незрелые зиготические зародыши (1,5-2,4 мм) в асептических условиях извлекали из каждого початка и случайным образом распределяли в микроцентрифужные пробирки, содержащие жидкую инфекционную среду (основная среда LS, 4,43 г/л; раствор витаминов N6 [1000X], 1,00 мл/л; L-пролин, 700,0 мг/л; сахароза, 68,5 г/л; D(+) глюкоза, 36,0 г/л; 10 мг/мл 2,4-D, 150 мкл/л). Для данной серии экспериментов использовали объединенные зародыши из трех початков для каждой трансформации.
Получение исходной культуры Agrobacterium:
Исходный материал Agrobacterium в глицерине, содержащий бинарные трансформирующие векторы, описанные выше, наносили штрихом на чашки с минимальной средой AB, содержащей соответствующие антибиотики, и выращивали при 20ºC в течение 3-4 дней. Отбирали одиночную колонию и наносили штрихом на чашки со средой YEP, содержащей те же антибиотики, и инкубировали при 28ºC в течение 1-2 дней.
Культивирование и совместное культивирование Agrobacterium. Колонии Agrobacterium отбирали с чашки со средой YEP, суспендировли в 10 мл инфекционной среды в 50-мл одноразовой пробирке и плотность клеток доводили до значения 0,2-0,4 при OD600 нм, используя спектрофотометр. Культуры Agrobacterium помещали на ротационный шейкер при скорости 125 об/мин при комнатной температуре, пока проводили извлечение зародышей. Незрелые зиготические зародыши размером 1,5-2,4 мм выделяли из стерилизованных початков кукурузы, помещали в 1 мл инфекционной среды и промывали один раз этой же средой. Суспензию Agrobacterium (2 мл) добавляли в каждую пробирку и пробирки помещали на платформу шейкера на 10-15 минут. Зародыши переносили в среду для совместного культивирования (MS соли, 4,33 г/л; L-пролин, 700,0 мг/л; миоинозитол, 100,0 мг/л; ферментный гидролизат казеина 100,0 мг/л; 30 мМ дикамба-KOH, 3,3 мг/л; сахароза, 30,0 г/л; Gelzan™, 3,00 г/л; модифицированная смесь MS-витамины [1000X], 1,00 мл/л; 8,5 мг/мл AgNO3, 15,0 мг/л; ДМСО, 100 мкМ), ориентировали щитком зародыша вверх и инкубировали при 25°C в условиях 24-часовой освещенности при интенсивности света 50 мкмоль м-2 сек-1 в течение 3 дней.
Выбор каллусов и регенерация предполагаемых объектов. После периода совместного культивирования зародыши переносили в среду покоя (MS соли, 4,33 г/л; L-пролин, 700,0 мг/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,500 г/л; ферментный гидролизат казеина 100,0 мг/л; 30 мМ дикамба-KOH, 3,3 мг/л; сахароза, 30,0 г/л; Gelzan™ 2,30 г/л; модифицированная смесь MS-витамины [1000X], 1,00 мл/л; 8,5 мг/мл AgNO3, 15,0 мг/л; карбенициллин, 250,0 мг/л) без селективного средства и инкубировали в условиях 24-часовой освещенности при интенсивности света 50 мкмоль м-2 сек-1 и при 25°C в течение 3 дней.
Эксперименты по дозозависимому ингибированию роста свидетельствовали о том, что концентрации глифосата 0,25 мМ и выше были достаточны для ингибирования клеточного роста в нетрансформированной линии B104 кукурузы. Зародыши переносили в селективную среду 1, содержащую 0,5 мМ глифосата (MS соли, 4,33 г/л; L-пролин, 700,0 мг/л; миоинозитол, 100,0 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,500 г/л; ферментный гидролизат казеина 100,0 мг/л; 30 мМ 30 мМ дикамба-KOH, 3,3 мг/л; сахароза, 30,0 г/л; Gelzan™ 2,30 г/л; модифицированная смесь MS-витамины [1000X], 1,00 мл/л; 8,5 мг/мл AgNO3, 15,0 мг/л; карбенициллин, 250,0 мг/л) и инкубировали или в темноте и/или в условиях 24-часовой освещенности при интенсивности света 50 мкмоль м-2 сек-1 в течение 7-14 дней при 28°C.
Пролиферирующие эмбриогенные каллусы переносили в селективную среду 2, содержащую 1,0 мМ глифосата (MS соли, 4,33 г/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; L-пролин, 700,0 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,500 г/л; ферментный гидролизат казеина 100,0 мг/л; 30 мМ 30 мМ дикамба-KOH, 3,3 мг/л; сахароза, 30,0 г/л; Gelzan™ 2,30 г/л; модифицированная смесь MS-витамины [1000X], 1,00 мл/л; 8,5 мг/мл AgNO3, 15,0 мг/л; карбенициллин, 250,0 мг/л; галоксифоп-Р кислота 0,1810 мг/л) и инкубировали или в темноте и/или в условиях 24-часовой освещенности при интенсивности света 50 мкмоль м-2 сек-1 в течение 14 дней при 28°C. Этот этап отбора позволял трансгенным каллусам далее пролиферировать и дифференцироваться. Период отбора каллусов продолжался в течение трех-четырех недель.
Пролиферирующие эмбриогенные каллусы переносили в среду предварительной регенерации, содержащую 0,5 мМ глифосата (MS соли, 4,33 г/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; L-пролин, 350,0 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,250 г/л; ферментный гидролизат казеина 50,0 мг/л; NAA-NaOH 0,500 мг/л; ABA-EtOH 2,50 мг/л; BA 1,00 мг/л; сахароза, 45,0 г/л; Gelzan™ 2,50 г/л; модифицированная смесь MS-витамины [1000X], 1,00 мл/л; 8,5 мг/мл AgNO3, 1,00 мг/л; карбенициллин, 250,0 мг/л) и культивировали в условиях 24-часовой освещенности при интенсивности света 50 мкмоль м-2 сек-1 в течение 7 дней при 28°C.
Эмбрионогенные каллусы с побеговыми почками переносили на среду регенерации, содержащую 0,5 мМ глифосата (MS соли, 4,33 г/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; сахароза, 60,0 г/л; геллановая камедь G434™ 3,00 г/л; модифицированная смесь MS-витамины [1000X], 1,00 мл/л; карбенициллин, 125,0 мг/л) и культивировали в условиях 24-часовой освещенности при интенсивности света 50 мкмоль м-2 сек-1 в течение 7 дней.
Небольшие побеги с первичными корнями переносили на среду для укоренения (MS соли, 4,33 г/л; модифицированная смесь MS-витамины [1000X], 1,00 мл/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; сахароза, 60,0 г/л; геллановая камедь G434™ 3,00 г/л; карбенициллин, 250,0 мг/л) в лотках для рассады и инкубировали в условиях цикла освещенности 16/8 часов света/темноты при интенсивности света 140-190 мкмоль м-2 сек-1 в течение 7 при 27°C. Предполагаемые трансгенные проростки анализировали на число копий трансгенов с использованием протоколов, описанных выше, и переносили в почву.
Подтверждение молекулярными методами присутствия трансгенов dgt-28 и aad-1 в растениях кукурузы. Присутствие полинуклеотидных последовательностей dgt-28 и aad-1 подтверждали анализом гидролиза зондов. Сначала проводили скрининг выделенных T0 растений кукурузы путем анализа гидролиза зондов, аналогичного TAQMAN™, для подтверждения присутствия трансгенов aad-1 и dgt-28. Данные, полученные из этих исследований, использовали для определения числа копий трансгенов и для выбора трансгенных объектов кукурузы для возвратного скрещивания и продвижения к поколению T1.
Образцы тканей собирали в 96-луночные планшеты, мацерацию тканей проводили при помощи тканевого пульверизатора KLECO™ и гранул из нержавеющей стали (Hoover Precision Products, Cumming, GA) в буфере Qiagen™ RLT. После мацерации тканей выделяли геномную ДНК в высокопроизводительном формате с использованием набора Biosprint™ 96 Plant kit (Qiagen™, Germantown, MD) в соответствии с протоколом, предложенным производителем. Проводили количественное определение геномной ДНК с помощью набора Quant-IT™ Pico Green DNA assay kit (Molecular Probes, Invitrogen, Carlsbad, CA). Известное количество геномной ДНК доводили до концентрации примерно 2 нг/мкл для анализа гидролиза зондов с использованием автоматического манипулятора жидкостями BIOROBOT3000™ (Qiagen, Germantown, MD). Определение числа копий трансгенов путем анализа гидролиза зондов, аналогичного анализу TAQMAN®, проводили методом ПЦР в реальном времени с использованием системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы были разработаны для aad-1, dgt-28 и внутреннего эталонного гена инвертазы (регистрационный № Genbank: U16123.1) с использованием программы разработки зондов LIGHTCYCLER® Probe Design Software 2.0. Для амплификации готовили мастер-микс зондов LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN) в 1X конечной концентрации в 10-мкл объеме мультиплексной реакционной смеси, содержащей 0,4 мкМ каждого праймера для aad-1 и dgt-28 и 0,2 мкМ каждого зонда (таблица 18).
Двухступенчатую реакцию амплификации проводили с удлинением цепи при 60°C в течение 40 секунд с возрастанием флуоресценции. Анализировали все образцы и усредненные значения порогового цикла (Ct) использовали для анализа каждого образца. Анализ данных ПЦР в реальном времени был проведен с помощью программы LightCycler™ выпуска 1.5 с использованием относительного квантового модуля и основан на методе ΔΔCt. Контроли включали образец геномной ДНК из однокопийного калибровочного стандарта и известный двухкопийный контроль, которые включали в каждый анализ. В таблице 19 приведены результаты анализа гидролиза зондов.
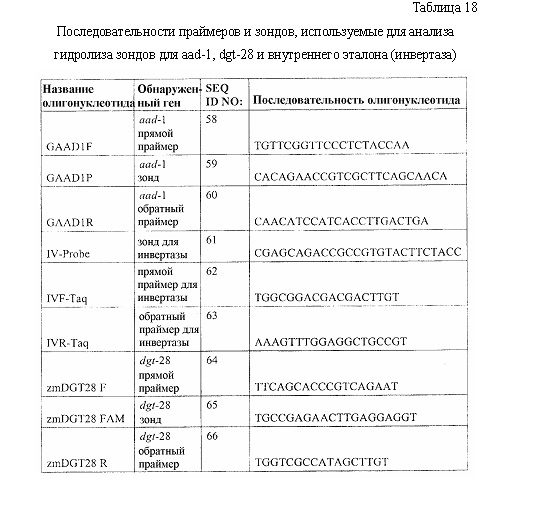
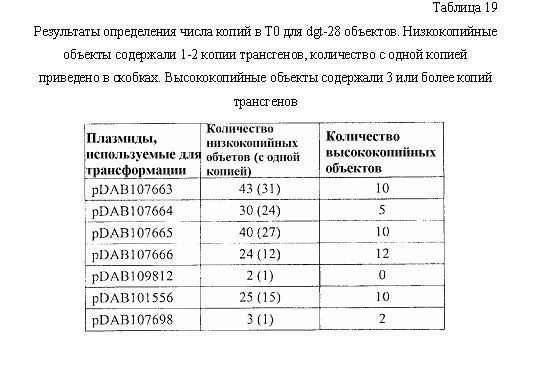
Толерантность к гербицидам трансформированной dgt-28 кукурузы. Трансформированные dgt-28 объекты Zea mays (T0) оставляли для акклиматизации в теплице и выращивали до тех пор, пока растения не переводили из культуры тканей в условия выращивания в теплице (то есть, 2-4 новых нормально выглядящих листа появлялись из мутовки). Растения выращивали при 27°C в условиях 16 часов света:8 часов темноты в теплице. Затем растения обрабатывали коммерческими препаратами Durango DMA™ (содержащими гербицид глифосат) с добавлением 2% масс/об сульфата аммония. Нанесение гербицида выполняли машиной для распыления гербицидов в объеме распыления 187 л/га с 50-см высотой струи. T0 растения опрыскивали глифосатом в диапазоне норм применения 280-4480 г кэ/га глифосата, что способно значительно повреждать нетрансформированные линии кукурузы. Летальную дозу определяли как норму применения, вызывающую >95% повреждений у растений инбредной линии B104.
Результаты, полученные с T0 dgt-28 растениями кукурузы, продемонстрировали, что толерантность к глифосату была достигнута при нормах применения вплоть до 4480 г кэ/га. Для поколения T0 использовали специальный тип среды. Минимальная задержка в росте и в целом рост растений у трансформированных растений по сравнению с нетрансформированными контролями показали, что dgt-28 обеспечивает надежную толерантность к глифосату, если связан с транзитными пептидами хлоропласта TraP5, TraP8 и TraP23.
Выбранные T0 растения подвергали самоопылению или возвратному скрещиванию для дальнейшей характеристики следующего поколения. 100 выбранных содержащих dgt-28 линий T1 растений опрыскивали глюфозинатом в норме применения 140-1120 г кэ/га или глифосатом в норме применения 105-1680 г кэ/га. Как ген селективного маркера, так и ген устойчивости к глифосату были сконструированы на одной и той же плазмиде. Таким образом, если один ген толерантности к гербицидам был отобран в результате опрыскивания гербицидом, считали, что присутствуют оба гена. В 14 ДПО (DAT) устойчивые и чувствительные растения подсчитывали для определения процентной доли линий, которые сегрегировали по одному локусу, доминантному признаку по Менделю (3у:1ч), что определяли анализом хи-квадратов. Эти данные демонстрируют, что dgt-28 является наследуемым как ген надежной устойчивости к глифосату в однодольных видах растений. Глифосат в повышенных нормах применения наносили на выжившие T1 или F1 растения для дальнейшей характеристики толерантности и защиты, обеспечиваемой геном dgt-28.
Толерантность к послевсходовому применению гербицида у трансформированных dgt-28 T0 растений кукурузы. T0 объекты с dgt-28, связанным с TraP4, TraP5, TraP8 и TraP23, получали методом трансформации при помощи Agrobacterium и оставляли для акклиматизации в ростовой камере с контролируемыми условиями до появления из мутовки 2-4 новых нормально выглядящих листьев. Растениям присваивали индивидуальные идентификационные номера и отбирали образцы для анализа числа копий как dgt-28, так и aad-1. На основании анализа числа копий растения отбирали для анализа экспрессии белка. Растения пересаживали в большие по размеру горшки с новой ростовой средой и выращивали при 27°C в условиях 16 часов света:8 часов темноты в теплице. Затем оставшиеся растения, из которых не отбирали образцы на определение экспрессии белка, обрабатывали коммерческими препаратами Durango DMA™ (глифосат) с добавлением 2% масс/об сульфата аммония. Обработку распределяли таким образом, что каждая группа растений содержала T0 объекты с варьирующим числом копий. Нанесение гербицида выполняли машиной для распыления гербицидов в объеме распыления 187 л/га с 50-см высотой струи. T0 растения опрыскивали глифосатом в диапазоне норм применения 280-4480 г кэ/га глифосата, что способно значительно повреждать нетрансформированные линии кукурузы. Летальную дозу определяли как норму применения, вызывающую >95% повреждений у растений инбредной линии B104. Линия B104 являлась генетическим фоном для трансформантов.
Результаты, полученные с T0 dgt-28 растениями кукурузы, продемонстрировали, что толерантность к глифосату была достигнута при нормах применения вплоть до 4480 г кэ/га. Таблица 20. Минимальная задержка в росте и в целом рост растений у трансформированных растений по сравнению с нетрансформированными контролями показали, что dgt-28 обеспечивает надежную защиту от глифосата, если связан с TraP5, TraP8 и TraP23.
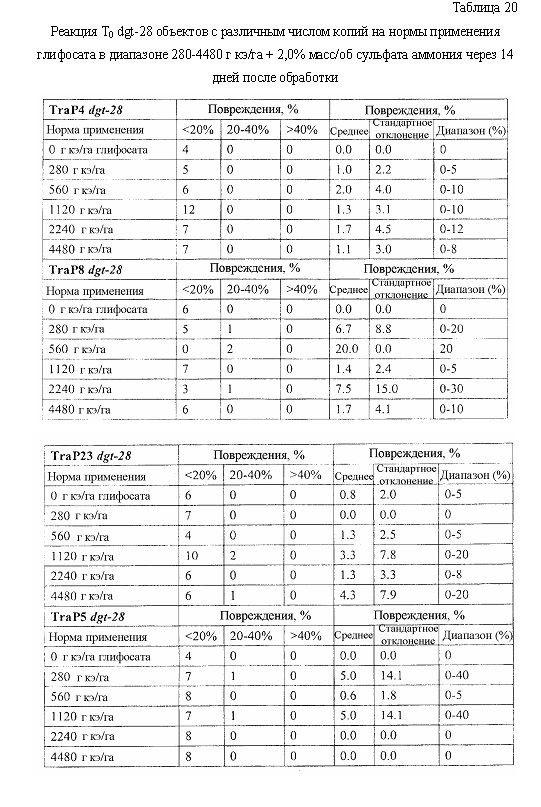
Анализ экспрессии белка стандартным методом ELISA продемонстрировал среднее содержание белка DGT-28 в диапазоне 12,6-22,5 нг/см2 в случае всех протестированных конструктов.
Подтверждение толерантности к глифосату в поколении F1 в условиях теплицы. Однокопийные T0 растения, которые не были опрысканы, подвергали возвратному скрещиванию с растениями нетрансформированной фоновой линии B104 для дальнейшей характеристики в следующем поколении. В поколении T1 оценивали толерантность к глифосату для подтверждения наследования гена dgt-28. Для T1 растений, гербицид Assure II™ (35 г кэ/га квизалофоп-метила) наносили на стадии роста V1 для отбора на наличие белка AAD-1. Как ген селективного маркера, так и ген устойчивости к глифосату были сконструированы на одной и той же плазмиде. Таким образом, если один ген был отобран, считали, что присутствуют оба гена. После 7 ДПО устойчивые и чувствительные растения подсчитывали и нулевые растения удаляли из популяции. Эти данные продемонстрировали, что dgt-28 (v1) является наследуемым как ген надежной устойчивости к глифосату в однодольных видах растений. Собирали образцы от растений для характеристики на наличие белка DGT-28 стандартным методом ELISA и на уровне транскрипции РНК. Устойчивые растения опрыскивали глифосатом при нормах применения 560-4480 г кэ/га, как описано ранее. Данные продемонстрировали надежную толерантность в случае присутствия dgt-28, связанного с транзитными пептидами хлоропласта TraP4, TraP5, TraP8 и TraP23, при нормах применения глифосата вплоть до 4480 г кэ/га. Таблица 21.
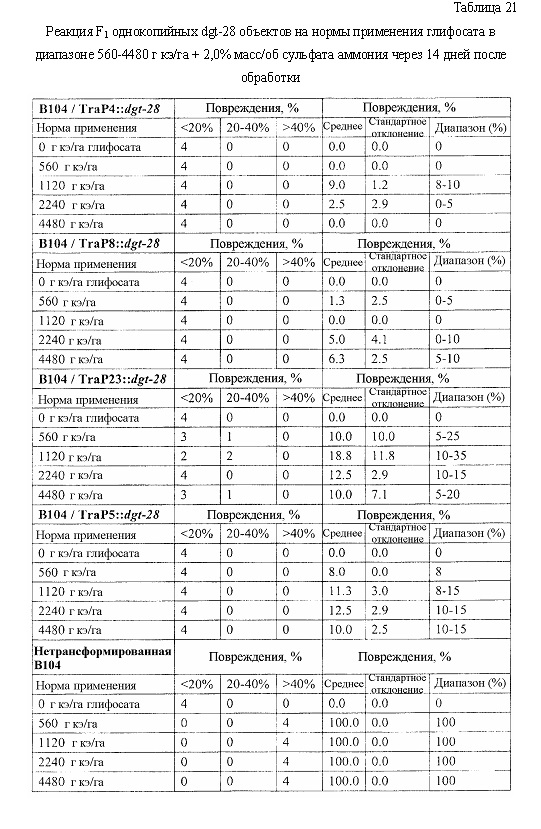
Данные по экспрессии белка продемонстрировали для белка DGT-28 диапазон средних значений 42,2-88,2 нг/см2 среди протестированных T1 объектов и конструктов, подтверждая экспрессию белка в поколении T1.
Характеристика кукурузы с dgt-28 в полевых условиях. Однокопийные T1 объекты были отправлены на полевой участок для получения как гибридных гемизиготных, так и инбредных гомозиготных семян для дополнительной характеристики. Гибридные семена получали путем скрещивания T1 объектов в трансформированной линии B104 кукурузы с растениями инбредной линии 4XP811, получая гибридные популяции с сегрегацией 1:1 (гемизиготные:нулевые) для объекта. Полученные семена отправляли на 2 отдельных участка. В общей сложности пять однокопийных объектов на конструкт высаживали на каждом участке в рандомизированном полноблочном плане в трех повторах. Полевые условия были спланированы для применения глифосата на стадии роста V4 и в отдельных группах растений для применения на стадии роста V8. Обычный гибрид 4XP811/B104 использовали в качестве отрицательного контроля.
Экспериментальные ряды обрабатывали Assure II™ в норме применения 184 г кэ/га (106 г аи/л квизалофоп-метила) для устранения нулевых сегрегантов. Все участвующие в эксперименте растения сегрегировали 1:1 (чувствительные:устойчивые) (p=0,05) при применении Assure II™. В выбранных устойчивых растениях отбирали образцы из каждого объекта для количественного определения белка DGT-28 стандартным методом ELISA.
Устойчивые к квизалофоп-метилу растения обрабатывали коммерческим гербицидом Durango DMA™ (480 г кэ/л глифосата) с добавлением 2,5% масс/об сульфата аммония на стадии роста либо V4, либо V8. Нанесение гербицида производили штанговым опрыскивателем, откалиброванным для доставки объема 187 л/га с 50-см высотой струи. Растения опрыскивали глифосатом в диапазоне норм применения 1120-4480 г кэ/га глифосата, что способно значительно повреждать нетрансформированные линии кукурузы. Летальную дозу определяли как норму применения, вызывающую >95% повреждений у растений инбредной линии 4XP811. Проводили визуальную оценку повреждений для определения процентной доли видимой пятнистости листьев, процентной доли некроза, процентной доли задержки роста и общих видимых повреждений в 7, 14 и 21 ДПО (дни после обработки). Оценки сравнивали с оценками необработанных контролей для каждой линии и отрицательных контролей.
Данные видимых повреждений для всех сроков оценки продемонстрировали наличие надежной толерантности к нормам применения Durango DMA™ вплоть до 4480 г кэ/га на обоих участках и сроках применения. Репрезентативные объекты для применения на стадии V4 представлены из одного участка и согласуются с данными для других объектов, сроков применения и участков. Таблица 22. Один объект от конструкта, содержащего dgt-28, связанный с TraP23 (pDAB107665), был толерантным при отборе с помощью Assure II™ на наличие белка AAD-1, однако был чувствительным ко всем используемым нормам применения глифосата.
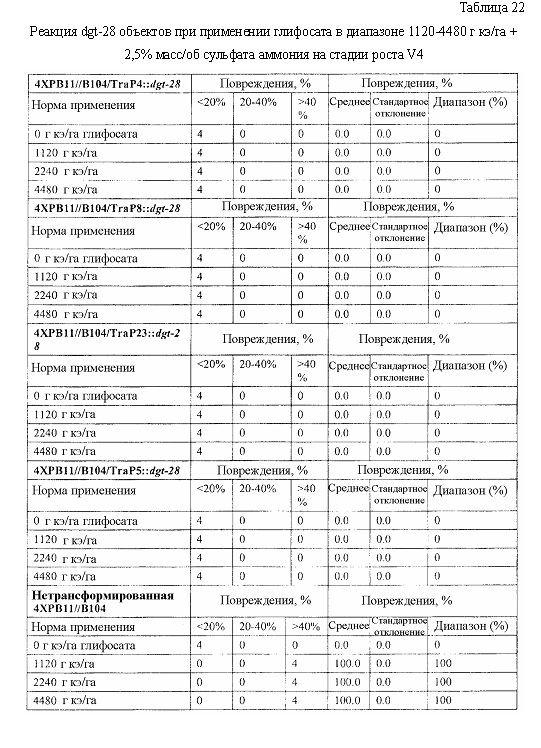
Были сделаны дополнительные оценки на стадии репродуктивного роста для нормы применения глифосата 4480 г кэ/га. Визуальная оценка метелок, сроков опыления и наполненности початка была сходной с оценкой необработанных контролей каждой линии для всех конструктов, сроков опыления и участков. Результаты количественного определения белка DGT-28 показали диапазон средних значений экспрессии белка 186,4-303,0 нг/см2. Данные продемонстрировали надежную толерантность трансформированной dgt-28 кукурузы в полевых условиях на протяжении стадий репродуктивного роста к глифосату при нормах применения вплоть до 4480 г кэ/га. Данные также продемонстрировали наличие и функцию белка DGT-28, исходя из результатов толерантности при опрыскивании.
Подтверждение наследуемости и толерантности dgt-28 кукурузы в гомозиготном состоянии. Семена от T1S2 растений высаживали в условиях теплицы, как описано ранее. Те же пять однокопийных линий, которые были охарактеризованы в полевых условиях, были охарактеризованы в гомозиготном состоянии. Растения выращивали до стадии роста V3 и разделяли на три группы по нормам применения глифосата в диапазоне 1120-4480 г кэ/га глифосата (Durango DMA™) и с четырьмя репликами на каждый вид обработки. Гербициды наносились машиной для распыления гербицидов, как описано ранее, и были сформулированы с 2,0% масс/об сульфата аммония. Нанесение сульфата аммония служило для создания необработанного контроля для каждой линии. Визуальные оценки производили через 7 и 14 дней после обработки, как описано ранее. Данные продемонстрировали надежную толерантность к глифосату при нормах применения вплоть до 4480 г кэ/га для всех протестированных объектов. Таблица 23.
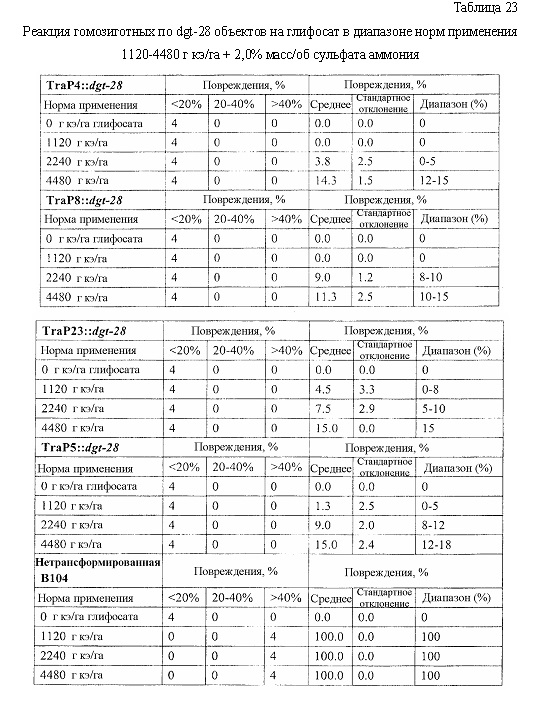
Линия от pDAB107665, которая не была толерантна в полевых условиях, продемонстрировала отсутствие толерантности к глифосату, что, таким образом, согласовалось с результатами полевых наблюдений (данные не представлены). За исключением одной линии, ранее упомянутой, все реплики из линий, которые были обработаны глифосатом, не были чувствительны к глифосату. Таким образом, данные свидетельствуют о наследуемости в гомогенную популяцию dgt-28 кукурузы по закону Менделя. Определение экспрессии белка DGT-28 стандартным методом ELISA продемонстрировало диапазон средних значений экспрессии белка 27,5-65,8 нг/см2 во всех однокопийных объектах, которые были толерантны к глифосату. Данные продемонстрировали наличие функционального белка и стабильность белка DGT-28 на протяжении поколений.
Использование глифосата в качестве селективного маркера в определении толерантности к послевсходовому применению гербицида. Как описано ранее, T0 трансформированные растения были выведены из культуры ткани и акклиматизированы в теплице. Тестируемые объекты содержали dgt-28, связанный с транзитными пептидами хлоропласта TraP5, TraP8 и TraP23. Было показано, что эти T0 растения проявляли надежную толерантность к глифосату при нормах применения вплоть до 4480 г кэ/га глифосата, и нетрансформированные растения были уничтожены глифосатом при концентрации всего лишь 280 г кэ/га. Эти данные свидетельствуют о том, что dgt-28 можно использовать в качестве селективного маркера с использованием концентраций глифосата в диапазоне 280-4480 г кэ/га.
Некоторое количество семян из фиксированных линий кукурузы, содержащих трансген dgt-28, было добавлено в некоторое количество нетрансформированных семян кукурузы. Семена высевали и оставляли расти до стадии развития V1-V3 и в этот момент проростки опрыскивали селективной дозой глифосата в диапазоне 280-4480 г кэ/га. Через 7-10 дней чувствительные и устойчивые растения подсчитывали, и количество толерантных к глифосату растений коррелировало с исходным количеством трансгенных семян, содержащих трансген dgt-28, которые были посажены.
Пакетирование dgt-28 кукурузы. Белок AAD-1 использовали в качестве селективного маркера в трансформированной dgt-28 кукурузе для исследовательских целей. Ген aad-1 также можно использовать в качестве признака толерантности к гербицидам в кукурузе для обеспечения надежной толерантности к 2,4-D при применении к сельскохозяйственной культуре вплоть до стадии развития V8. Четыре объекта из конструктов pDAB107663 (TraP4::dgt-28), pDAB107664 (TraP8::dgt-28) и pDAB107666 (TraP5::dgt-28) были охарактеризованы на толерантность к нанесению баковой смеси глифосата и 2,4-D. Изучение характеристик проводили на F1 семенах в условиях теплицы. Нанесение гербицидов выполняли машиной для распыления гербицидов, как описано ранее, при следующих нормах применения: 1120-2240 г кэ/га глифосата (селективного для гена dgt-28), 1120-2240 г кэ/га 2,4-D (селективного для гена aad-1) или баковой смеси двух гербицидов при указанных нормах применения. Оценку растений в баллах производили в 7 и 14 ДПО. Результаты опыления при применении гербицидов в норме 2240 г кэ/га приведены в таблице 24.
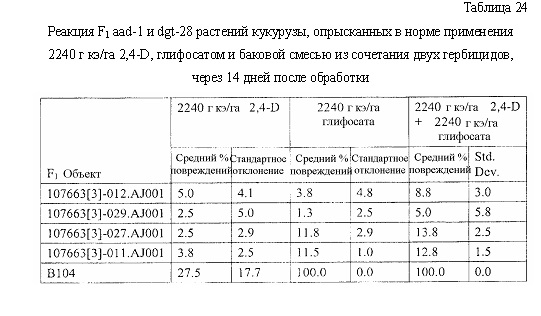
Результаты подтвердили, что dgt-28 может быть успешно пакетирован с aad-1, таким образом, расширяя спектр гербицидов, которые можно применять для интересующих сельскохозяйственных культур (глифосат + гербициды на основе феноксиуксусной кислоты для dgt-28 и aad-1, соответственно). В растениеводстве, в случаях, когда трудно бороться с широколиственными сорняками или существуют устойчивые биотипы сорняков, можно использовать пакет генов в качестве средства борьбы с сорняками и защиты интересующей сельскохозяйственной культуры. Дополнительные признаки вводимых ресурсов или признаки, определяющие производительность, также можно пакетировать с геном dgt-28 в кукурузе и других растениях.
Трансформация сои. Трансгенную сою (Glycine max), содержащую стабильно интегрированный трансген dgt-28, получали путем опосредованной Agrobacterium трансформации эксплантатов семядольного узла сои. Обезвреженный штамм Agrobacterium, несущий бинарный вектор, содержащий функциональный dgt-28, использовали для инициации трансформации.
Опосредованную Agrobacterium трансформацию проводили с использованием модифицированного метода половины семядольных узлов, описанного в статье Zeng et al. (Zeng P., Vadnais D.A., Zhang Z., Polacco J.C., (2004), Plant Cell Rep., 22(7): 478-482). Вкратце, семена сои (культивар Maverick) проращивали на основной среде, и семядольные узлы выделяли и инфицировали Agrobacterium. В среды для инициации побегов, роста побегов и укоренения добавляли цефотаксим, тиментин и ванкомицин для удаления Agrobacterium. Проводили отбор с помощью гербицида для подавления роста нетрансформированных побегов. Выбранные побеги переносили в среду для укоренения для развития корней и затем переносили на почвенную смесь для акклиматизации проростков.
Верхушечные листья выбранных проростков обрабатывали локально (методика покрытия листьев) гербицидом для выявления предполагаемых трансформантов. Отобранные проростки переносили в теплицу, оставляли для акклиматизации, а затем покрывали листья гербицидом для подтверждения толерантности. От этих предполагаемых трансформированных T0 растений собирали образцы, и молекулярные анализы использовали для подтверждения присутствия гербицидного селективного маркера и трансгена dgt-28. Проводили самоопыление T0 растений в теплице для получения T1 семян.
Второй метод трансформации сои можно использовать для получения дополнительных трансгенных растений сои. Обезвреженный штамм Agrobacterium, несущий бинарный вектор, содержащий функциональный dgt-28, использовали для инициации трансформации.
Опосредованную Agrobacterium трансформацию проводили с использованием модифицированного метода половины семян, описанного в статье Paz et al., (Paz M., Martinez J., Kalvig A., Fonger T., and Wang K., (2005) Plant Cell Rep., 25: 206-213). Вкратце, зрелые семена сои стерилизовали в течение ночи газообразным хлором и пропитывали стерильной H2O за двадцать часов до опосредованной Agrobacterium трансформации растений. Семена разделяли напополам продольным разрезом вдоль гилума для разделения семян и удаления семенной оболочки. Зародышевую ось вырезали и любые осевые побеги/почки удаляли из семядольного узла. Полученные эксплантаты половины семян инфицировали Agrobacterium. В среды для инициации побегов, роста побегов и укоренения добавляли цефотаксим, тиментин и ванкомицин для удаления Agrobacterium. Проводили отбор с помощью гербицида для подавления роста нетрансформированных побегов. Выбранные побеги переносили в среду для укоренения для развития корней и затем переносили на почвенную смесь для акклиматизации проростков.
От предполагаемых трансформированных T0 растений собирали образцы, и молекулярные анализы использовали для подтверждения присутствия гена селективного маркера и трансгена dgt-28. Несколько объектов были идентифицированы как содержащие трансгены. Эти T0 растения были использованы для дальнейшего анализа и были подвергнуты самоопылению в теплице для производства T1 семян.
Подтверждение наследуемости dgt-28 в поколение T1. Наследуемость белка DGT-28 в поколение T1 оценивали одним из двух способов. Первый способ включал высаживание T1 семян в среду Metro-mix и нанесение Ignite™ 280 SL в норме применения 411 г кэ/га на проросшие растения на ростовой стадии 1го трилистника. Второй способ заключался в гомогенизации семян в общей сложности для 8 реплик с использованием шарикоподшипника и устройства Geno/Grinder. Метод ELISA на тест-полосках для обнаружения белка PAT затем использовали для обнаружения наследуемых объектов, поскольку ген селективного маркера находился на той же плазмиде, что и dgt-28. В любом способе, если единичное растение было толерантным к глюфозинату или было положительным по PAT в ELISA на тест-полосках, объект демонстрировал наследуемость в поколении T1.
Проводили скрининг в общей сложности пяти конструктов на наследуемость, как описано выше. Плазмиды содержали dgt-28, связанный с TraP4, TraP8 и TraP23. Объекты для всех конструктов демонстрировали 68% наследуемость белка PAT::DGT-28 в поколение T1.
Толерантность к послевсходовому применению гербицида у трансформированных dgt-28 T1 растений сои. Семена от T1 объектов, которые, как показано описанными ранее способами скрининга, наследовали признак, высаживали в среду Metro-mix в условиях теплицы. Растения выращивали до полного раскрытия 1-го трилистника и обрабатывали Ignite™ 280 SL в норме применения 411 г кэ/га для отбора на ген pat, как описано ранее. Устойчивым растениям от каждого объекта присваивали уникальные идентификационные номера и использовали для сбора образцов для анализа зиготности гена dgt-28. Данные по зиготности использовали для распределения 2 гемизиготных и 2 гомозиготных реплик в группу для каждой нормы применения глифосата, что составляло в общей сложности 4 реплики на каждый вариант обработки, при наличии достаточного количества растений. Эти растения сравнивали с табаком дикого типа Petite havana. Все растения опрыскивали машиной для распыления гербицидов, откалиброванной для доставки 187 л/га. Растения опрыскивали солью диметиламина (DMA) Durango™ в диапазоне норм применения 560-4480 г кэ/га. Все наносимые препараты были сформулированы в воде с добавлением 2% масс/об сульфата аммония (AMS). Растения оценивали в 7 и 14 дни после обработки. Растениям присваивали рейтинг повреждений с учетом общих видимых признаков задержки роста, пятнистости листьев и некроза. Поколение T1 является сегрегирующим, так что ожидалась в некоторой степени вариабельная реакция вследствие различий в зиготности.
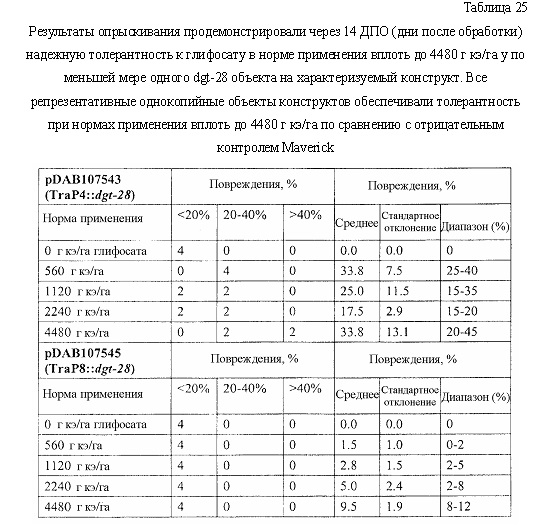
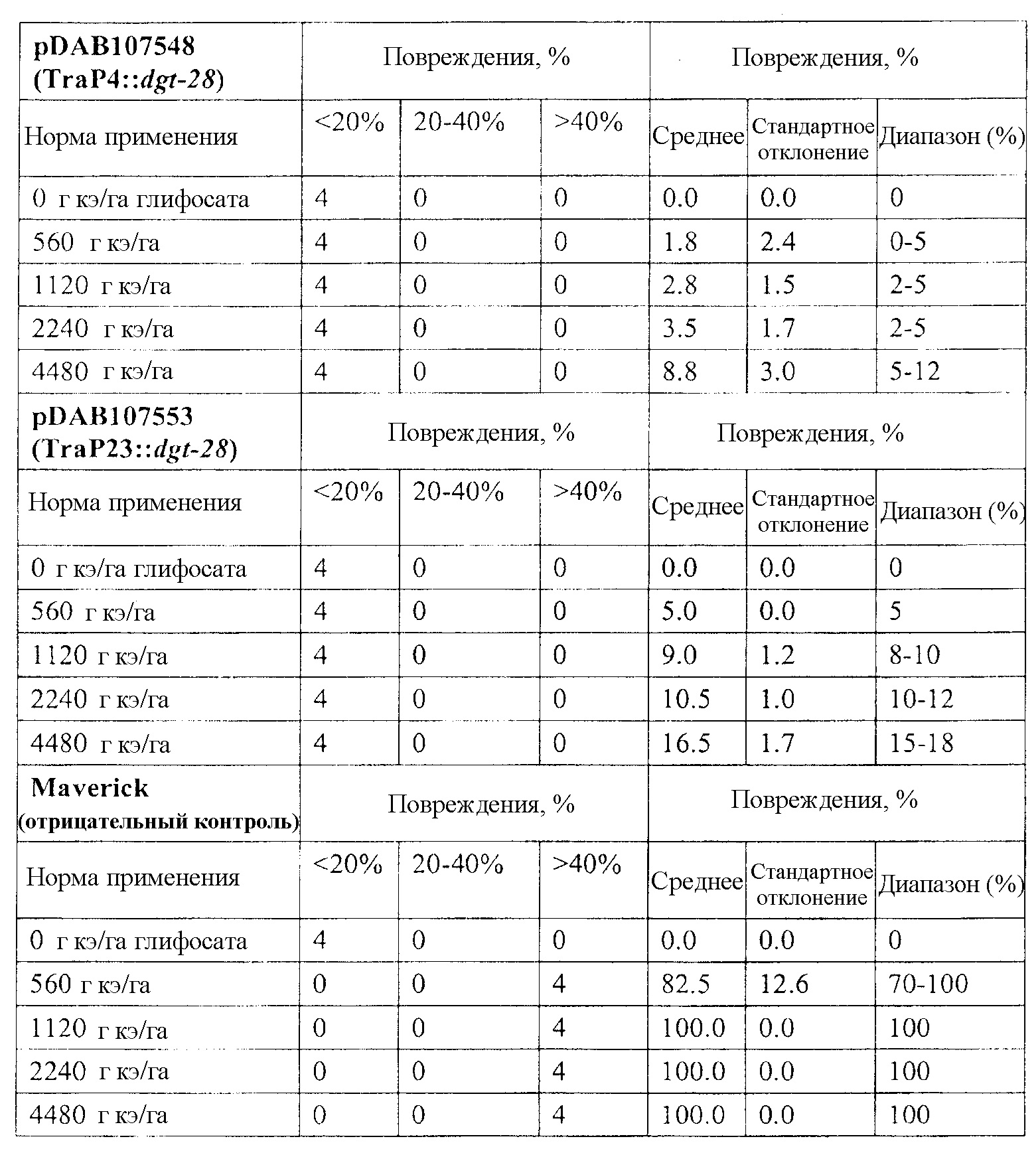
Создаваемая dgt-28 защита от глифосата при повышенных нормах применения в поколении T2. Проводили тестирование 45 растений-потомков в двух-пяти T2 линиях dgt-28 на конструкт. Гомозиготные линии были выбраны на основании анализа зиготности, проведенного на растениях предыдущего поколения. Семена высаживали, как описано ранее. Затем растения опрыскивали Ignite 280 SL в норме применения 411 г кэ/га для отбора на селективный маркер pat, как описано ранее. Через 3 ДПО подсчитывали устойчивые и чувствительные растения.
Для конструктов, содержащих TraP4, связанный с dgt-28 (pDAB107543 и pDAB107548), девять из двенадцати протестированных линий не сегрегировали, тем самым подтверждая гомогенность линий в поколении T2. Линии, содержащие TraP8, связанный с dgt-28 (pDAB107545), демонстрировали у двух из четырех линий отсутствие сегрегантов и проявляли наследование dgt-28 по закону Менделя на протяжении по меньшей мере двух поколений в сое. От устойчивых растений были взяты образцы тканей и количественно определен белок DGT-28 стандартными методами ELISA. Данные показали средние значения для белка DGT-28 в диапазоне 32,8-107,5 нг/см2 для протестированных несегрегирующих T2 линий. Линии от конструкта pDAB107553 (TraP23::dgt-28) ранее не были отобраны с помощью глюфозината, и реакцию на дозу глифосата использовали для проверки как гомогенности, так и толерантности к повышенным нормам применения глифосата. Реплики из этих линий от конструкта pDAB107553 были толерантны к глифосату в диапазоне норм применения 560-4480 г кэ/га, и таким образом, была подтверждена гомогенность популяции и наследуемость на протяжении по меньшей мере двух поколений.
Durango DMA в диапазоне норм применения 560-4480 г кэ/га глифосата наносили на растения сои на стадии 2-3 трилистников, как описано ранее. Данные по видимым повреждениям через 14 ДПО подтвердили результаты по толерантности, продемонстрированной в поколении T1.
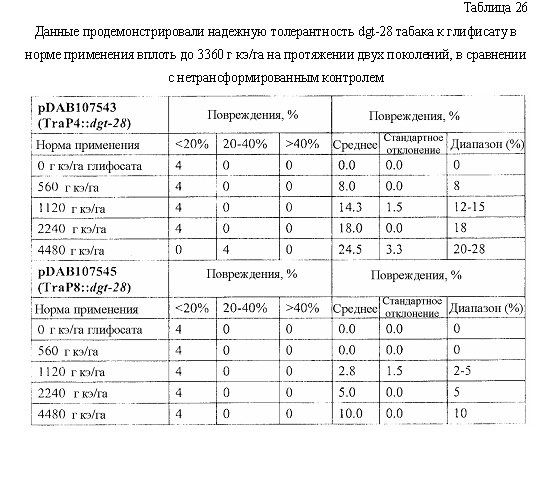
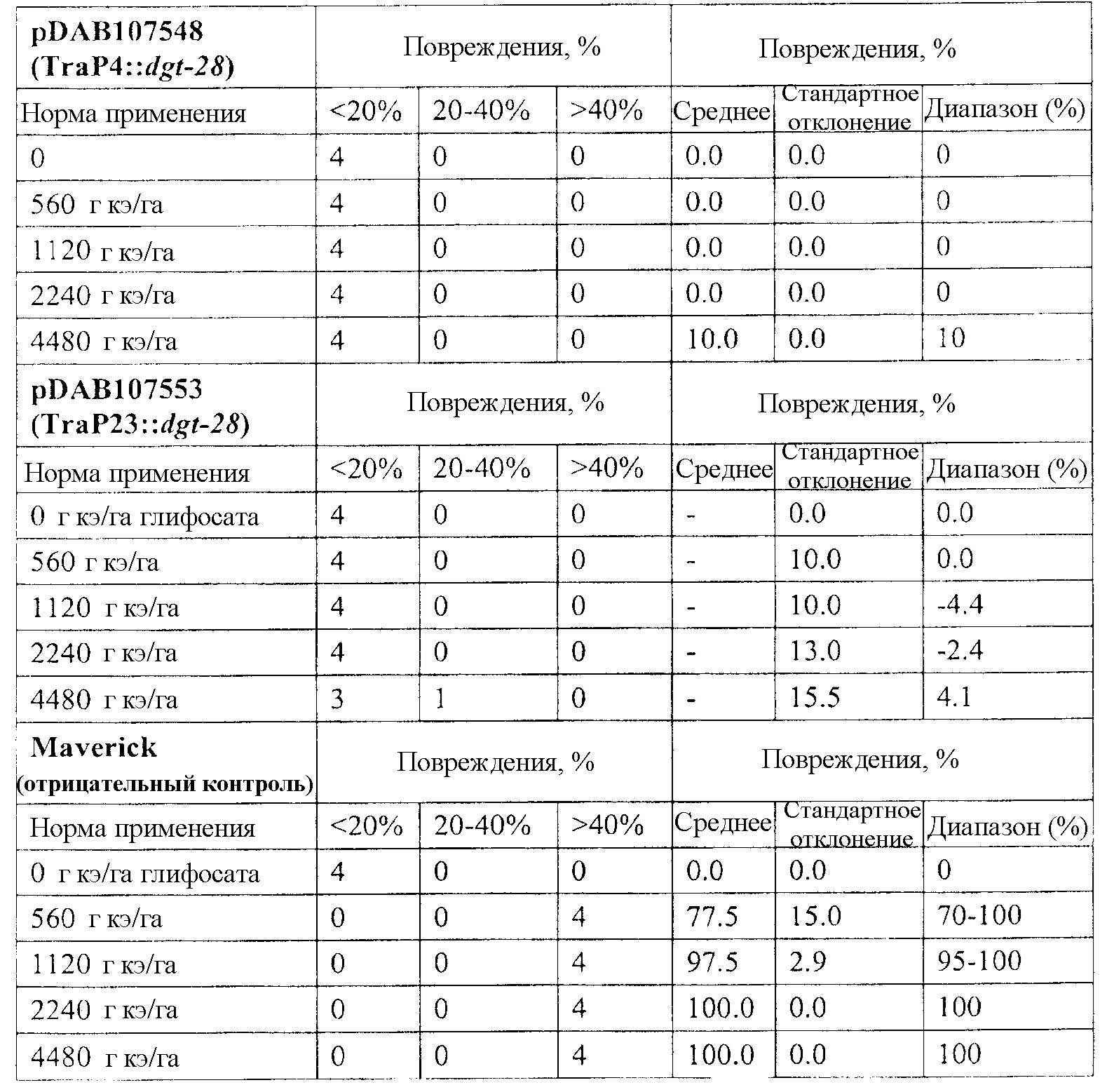
Трансформация риса dgt-28. Трансгенный рис (Oryza sativa), содержащий стабильно интегрированный трансген dgt-28, получали путем опосредованной Agrobacterium трансформации стерилизованных семян риса. Обезвреженный штамм Agrobacterium, несущий бинарный вектор, содержащий функциональный dgt-28, использовали для инициации трансформации.
Культуральную среду доводили до величины pH 5,8 с помощью 1 M KOH и сгущали с помощью 2,5 г/л Phytagel (Sigma-Aldrich, St. Louis, MO). Эмбрионогенные каллусы культивировали в 100×20 мм чашках Петри, содержащих 30 мл полутвердой среды. Проростки риса выращивали на 50 мл среды в коробках MAGENTA. Клеточные суспензии поддерживали в 125-мл конических колбах, содержащих 35 мл жидкой среды, и перемешивали со скоростью 125 об/мин. Индукцию и поддержание эмбриогенных культур проводили в темноте при 25-26°C, а регенерацию растений и культивирование целых растений проводили в освещенной комнате с 16-ч фотопериодом (Zhang et al. 1996).
Индукцию и поддержание эмбриогенного каллуса проводили на модифицированной основной среде NB, как описано ранее (Li et al. 1993), при этом среду адаптировали для содержания 500 мг/л глютамина. Суспензионные культуры инициировали и поддерживали в жидкой среде SZ (Zhang et al. 1998) с добавлением 30 г/л сахарозы вместо мальтозы. Осмотическая среда (NBO) состояла из среды NB с добавлением 0,256 M каждого из маннита и сорбита. Устойчивый к гербицидам каллус отбирали на среде NB с добавлением соответствующего гербицидного селективного средства в течение 3-4 недель. Предварительную регенерацию проводили на среде (PRH50), состоящей из среды NB с 2,4-дихлорфеноксиуксусной кислотой (2,4-D), 1 мг/л α-нафталинуксусной кислотой (NAA), 5 мг/л абсцизовой кислотой (ABA) и селективным гербицидом, в течение 1 недели. Регенерацию проростков проводили путем культивирования на среде регенерации (RNH50), содержащей среду NB, содержащую 2,4-D, 0,5 мг/л NAA и селективный гербицид, пока предполагаемые трансгенные побеги не регенерировали. Побеги переносили на среду для укоренения с половинной концентрацией основных солей Мурасиге-Скуга и комплексом B5 витаминов Гамборга, с добавлением 1% сахарозы и селективного гербицида.
Зрелые обезвоженные семена Oryza sativa подвида L. japonica культивара Taipei 309 стерилизовали, как описано в статье Zhang et al., 1996. Эмбриогенные ткани индуцировали путем культивирования стерильных зрелых семян риса на среде NB в темноте. Первичный каллус диаметром примерно 1 мм удаляли из щитка и использовали для получения клеточной суспензии в жидкой среде SZ. Суспензии затем поддерживали, как описано в статье Zhang, 1996. Полученные из суспензии эмбриогенные ткани удаляли из жидкой культуры через 3-5 дней после предыдущего субкультивирования, помещали на осмотическую среду NBO в форме круга диаметром примерно 2,5 см в чашке Петри и культивировали в течение 4 ч до бомбардировки частицами. Через шестнадцать-двадцать часов после бомбардировки ткани переносили со среды NBO на селективную среду NBH50, следя за тем, чтобы подвергшаяся бомбардировке сторона была направлена вверх, и инкубировали в темноте в течение 14-17 дней. Затем вновь образованный каллус отделяли от исходных бомбардированных эксплантатов и помещали рядом на той же среде. Еще через 8-12 дней относительно компактный непрозрачный каллус визуально определяли и переносили на среду предварительной регенерации PRH50 на 7 дней в темноте. Растущий каллус, который становился более компактным и непрозрачным, затем переносили для субкультивирования на среду регенерации RNH50 на период 14-21 дней в условиях 16-часового фотопериода. Регенерирующие проростки переносили в коробки MAGENTA, содержащие среду ½ MSH50. Несколько растений, регенерировавшие из одного эксплантата, считали близкородственными и обращались как с одной независимой линией растения. Растение оценивали как положительное по гену dgt-28, если оно образовывало толстые белые корни и хорошо росло на среде ½ MSH50. Когда высота проростков достигала верха коробок MAGENTA, их переносили в почву в 6-см горшке в условиях 100% влажности на неделю, а затем переносили в ростовую камеру с 14-ч световым периодом при 30°C и периодом темноты при 21°C на 2-3 недели перед пересадкой в 13-см горшки в теплице. Семена собирали и высушивали при 37°C в течение одной недели до перенесения на хранение при 4°C.
Анализ T0 dgt-28 растений риса. Пересаженные трансформанты риса, полученные методом опосредованной Agrobacterium трансформации, переносили в среду и акклиматизировали к условиям теплицы. От всех растений собирали образцы для определения dgt-28 методом ПЦР, и результаты продемонстрировали наличие двадцати двух ПЦР-положительных объектов для pDAB110827 (TraP8::dgt-28) и минимум шестнадцати ПЦР-положительных объектов для pDAB110828 (TraP23::dgt-28). Анализ по Саузерну на dgt-28 ПЦР-положительных объектов продемонстрировал наличие простых (1-2 копии) объектов для обоих конструктов. Определение экспрессии белка в выбранных T0 объектах показало, что экспрессия белка DGT-28 находится в диапазоне от значений ниже предела обнаружения до 130 нг/см2. Выбранные T0 объекты от конструкта pDAB110828 обрабатывали Durango DMA™ в норме применения 2240 г кэ/га, как описано ранее, и оценивали через 7 и 14 дней после обработки. Данные продемонстрировали наличие надежной толерантности к глифосату при использованных нормах применения. Всем ПЦР-положительным растениям давали возможность произвести T1 семена для дальнейшей характеристики.
Наследуемость Dgt-28 в рисе. Тестирование 100 растений-потомков проводили в четырех T1 линиях с dgt-28 от конструкта pDAB110827, содержащего транзитный пептид хлоропласта TraP8. Семена высаживали в горшки со средой. Затем все растения опрыскивали Durango DMA™ при норме применения 560 г кэ/га для отбора на ген dgt-28, как описано ранее. Через 7 ДПО подсчитывали устойчивые и чувствительные растения. Две из четырех протестированных линий для каждого конструкта сегрегировали по одному локусу, доминантному признаку по Менделю (3у:1ч), что определяли анализом хи-квадратов. Dgt-28 является наследуемым геном устойчивости к глифосату у многих видов.
Толерантность к послевсходовому применению гербицида у трансформированных dgt-28 T1 растений риса. T1 устойчивым растениям от каждого объекта, использованным в тестировании потомства, присваивали уникальные идентификационные номера и от них собирали образцы для анализов зиготности гена dgt-28. Данные по зиготности использовали для распределения 2 гемизиготных и 2 гомозиготных реплик в группу для каждой нормы применения глифосата, что составляло в общей сложности 4 реплики на каждый вариант обработки. Эти растения сравнивали с рисом Kitaake дикого типа. Все растения опрыскивали машиной для распыления гербицидов, откалиброванной для доставки 187 л/га. Растения опрыскивали Durango DMA™ в диапазоне норм применения 560-2240 г кэ/га. Все наносимые препараты были сформулированы в воде с добавлением 2% масс/об сульфата аммония (AMS). Растения оценивали через 7 и 14 дней после обработки. Растениям присваивали рейтинг повреждений с учетом общих видимых признаков задержки роста, пятнистости листьев и некроза. Поколение T1 является сегрегирующим, так что ожидалась в некоторой степени вариабельная реакция вследствие различий в зиготности.
Результаты опрыскивания показали через 7 ДПО (дни после обработки) минимальные вегетативные повреждения в ответ на повышенные нормы применения глифосата (данные не представлены).
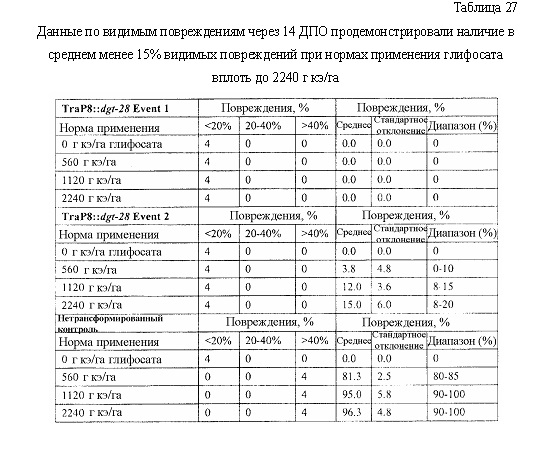
Проводили оценку количества белка DGT-28 для реплик из всех четырех протестированных T1 линий от pDAB110827. Данные показали, что средние значения для белка DGT-28 находятся в диапазонах 20-82 нг/см2 и 21-209 нг/см2 для гемизиготных и гомозиготных реплик, соответственно. Эти результаты продемонстрировали стабильную экспрессию белка в поколении T1 и толерантность dgt-28 риса к глифосату при нормах применения вплоть до 2240 г кэ/га после нанесения глифосата в норме применения 560 г кэ/га, используемого для отбора.
Трансформация табака dgt-28. Кусочки листьев табака (культивар Petit Havana) трансформировали с использованием бактерий Agrobacterium tumefaciens, содержащих трансген dgt-28. Одиночные колонии, содержащие плазмиду, содержащую трансген dgt-28, инокулировали в 4 мл среды YEP, содержащей спектиномицин (50 мкг/мл) и стрептомицин (125 мкг/мл), и инкубировали в течение ночи при 28°C на шейкере при 190 об/мин. 4 мл посевной культуры впоследствии использовали для инокуляции 25 мл той же культуральной среды в 125-мл колбе Эрленмейера с перегородками. Эту культуру инкубировали при 28°C со встряхиванием при 190 об/мин до достижения величины OD600 ~1,2. Затем десять мл суспензии Agrobacterium помещали в стерильные 60×20 мм чашки Петри™.
Свежесрезанные кусочки листьев (0,5 см2) от растений, выращенных в асептических условиях на среде MS (Phytotechnology Labs, Shawnee Mission, KS,) с 30 г/л сахарозы в лотках PhytaTrays™ (Sigma, St. Louis, MO), замачивали в 10 мл ночной культуры Agrobacterium на несколько минут, промокали насухо стерильной фильтровальной бумагой и затем помещали на ту же среду с добавлением 1 мг/л индолуксусной кислоты и 1 мг/л 6-бензиламинопурина. Через три дня кусочки листьев, совместно культивированных с Agrobacterium, несущей трансген dgt-28, переносили в такую же среду, содержащую 5 мг/л Basta™ и 250 мг/л цефотаксима.
Через 3 недели отдельные T0 проростки переносили в среду MS с 10 мг/л Basta™ и 250 мг/л цефотаксима еще на 3 недели до пересаживания в почву и перенесения в теплицу. Выбранные T0 растения (идентифицированные с использованием протоколов молекулярных анализов, описанных выше) подвергали самоопылению, и семена собирали из капсул, где они были полностью высушены. T1 проростки подвергали скринингу на зиготность и экспрессию репортерного гена (как описано ниже) и идентифицировали отдельные растения, содержащие трансген dgt-28.
Растения переносили в теплицу, при этом смывали агар с корней, пересаживали в почву в 13,75-см квадратные горшки, помещали горшок в пакет с застежкой Ziploc® (SC Johnson & Son, Inc.), наливали водопроводную воду на дно пакета и помещали в условия отраженного света при 30°C в теплицу на одну неделю. Через 3-7 дней пакет открывали; растения опыляли и оставляли расти в открытом пакете до акклиматизации растений к условиям теплицы, после чего пакет удаляли. Растения выращивали в обычных условиях теплицы (27°C днем, 24°C ночью, 16-часовой день, минимальный естественный + дополнительный свет = 1200 мкЭ/м2с1).
Перед размножением собирали образцы от T0 растений для анализа ДНК с целью определения числа копий вставки dgt-8 методом ПЦР в реальном времени. Свежую ткань помещали в пробирки и лиофилизировали при 4ºC в течение 2 дней. После того, как ткань была полностью высушена, вольфрамовый бисер (Valenite) помещали в пробирку и образцы в течение 1 минуты всухую измельчали с использованием бисерной мельницы Kelco. Затем следовали стандартной процедуре выделения ДНК с помощью DNeasy™ (Qiagen, DNeasy 69109). Вслед за этим, аликвоту экстрагированной ДНК окрашивали красителем Pico Green (Molecular Probes P7589) и снимали показания во флуорометре (BioTek™) с известными стандартами для определения концентрации в нг/мкл. Всего 100 нг суммарной ДНК использовали в качестве матрицы. ПЦР проводили в термоциклере 9700 Geneamp™ (Applied Biosystems), подвергая образцы реакции при 94°C в течение 3 минут и 35 циклам при 94°C в течение 30 секунд, 64°C в течение 30 секунд и 72°C в течение 1 минуты и 45 секунд, а затем при 72°C в течение 10 минут. ПЦР-продукты анализировали электрофорезом на 1% агарозном геле, окрашивали бромистым этидием и проверяли методом саузерн-блоттинга.
Пять-девять ПЦР-положительных объектов с 1-3 копиями гена dgt-28 от 3 конструктов, содержащих различные последовательности транзитных пептидов хлоропласта (TraP4, TraP8 и TraP23), были регенерированы и перенесены в теплицу.
От всех ПЦР-положительных растений собирали образцы для количественного определения белка DGT-28 стандартным методом ELISA. DGT-28 белок был обнаружен во всех ПЦР-положительных растениях и была отмечена тенденция к возрастанию концентрации белка при увеличении числа копий dgt-28.
Наследуемость aad-12 (v1) в растениях табака. Тестирование 100 растений-потомков проводили в пяти T1 линиях с dgt-28 на каждый конструкт. Конструкты содержали одну из следующих последовательностей транзитного пептида хлоропласта: TraP4, TraP8 или TraP23. Семена были стратифицированы, высеяны и пересажены во многом аналогично процедуре с Arabidopsis, описанной выше, за исключением того, что нулевые растения не были удалены путем первичного отбора перед пересадкой. Затем все растения опрыскивали Ignite 280 SL при норме применения 280 г кэ/га для отбора на селективный маркер pat, как описано ранее. Через 3 ДПО подсчитывали устойчивые и чувствительные растения.
Четыре из пяти линий, протестированных для каждого конструкта, сегрегировали по одному локусу, доминантному признаку по Менделю (3у:1ч), что определяли анализом хи-квадратов. Dgt-28 является наследуемым геном устойчивости к глифосату у многих видов.
Толерантность к послевсходовому применению гербицида у трансформированных dgt-28 T1 растений табака. T1 устойчивым растениям от каждого объекта, использованным в тестировании потомства, присваивали уникальные идентификационные номера и от них собирали образцы для анализов зиготности гена dgt-28. Данные по зиготности использовали для распределения 2 гемизиготных и 2 гомозиготных реплик в группу для каждой нормы применения глифосата, что составляло в общей сложности 4 реплики на каждый вариант обработки. Эти растения сравнивали с табаком дикого типа Petite havana. Все растения опрыскивали машиной для распыления гербицидов, откалиброванной для доставки 187 л/га. Растения опрыскивали Durango DMA™ в диапазоне норм применения 560-4480 г кэ/га. Все наносимые препараты были сформулированы в воде с добавлением 2% масс/об сульфата аммония (AMS). Растения оценивали через 7 и 14 дней после обработки. Растениям присваивали рейтинг повреждений с учетом общих видимых признаков задержки роста, пятнистости листьев и некроза. Поколение T1 является сегрегирующим, так что ожидалась в некоторой степени вариабельная реакция вследствие различий в зиготности.
Результаты опрыскивания показали через 7 ДПО (дни после обработки) минимальные вегетативные повреждения в ответ на повышенные нормы применения глифосата (данные не представлены). Через 14 ДПО данные по видимым повреждениям свидетельствовали о более выраженных повреждениях в случае однокопийных объектов от конструкта, содержащего TraP4, по сравнению с однокопийными объектами от конструктов, содержащих TraP8 и TraP23. Таблица 28.
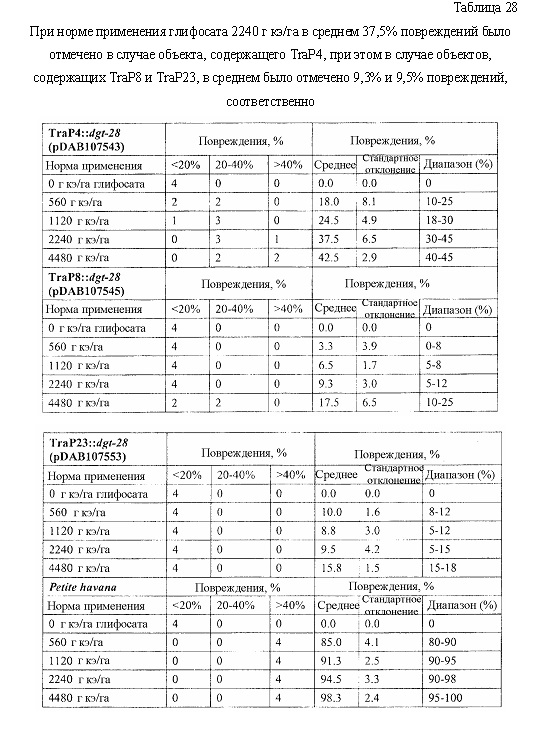
Эти результаты свидетельствуют о толерантности растений с dgt-28 к глифосату при нормах применения вплоть до 4480 г кэ/га, а также о различиях в толерантности в зависимости от последовательностей транзитного пептида хлоропласта, связанных с геном dgt-28.
Создаваемая Dgt-28 защита от глифосата при повышенных нормах применения в поколении T2. Проводили тестирование 25 растений-потомков в двух-трех T2 линиях dgt-28 на конструкт. Гомозиготные линии были выбраны на основании анализа зиготности, проведенного на растениях предыдущего поколения. Семена стратифицировали, высевали и пересаживали, как описано ранее. Затем все растения опрыскивали Ignite 280 SL в норме применения 280 г кэ/га для отбора на селективный маркер pat, как описано ранее. Через 3 ДПО подсчитывали устойчивые и чувствительные растения. Все линии, протестированные для каждого конструкта, не сегрегировали, тем самым подтверждая гомогенность линий в поколении T2 и демонстрируя наследуемость по закону Менделя на протяжении по меньшей мере двух поколений гена dgt-28 в растениях табака.
Durango DMA™ в диапазоне норм применения 420-3360 г кэ/га глифосата наносили на растения табака на стадии 2-3 листьев, как описано ранее. Данные по видимым повреждениям через 14 ДПО подтвердили результаты по толерантности, которые были продемонстрированы в поколении T1. Результаты, полученные на листьях от двухкопийных линий от конструкта, содержащего TraP4, свидетельствовали о толерантности, аналогичной таковой у однокопийных линий с TraP8 и TraP23 (данные не представлены).
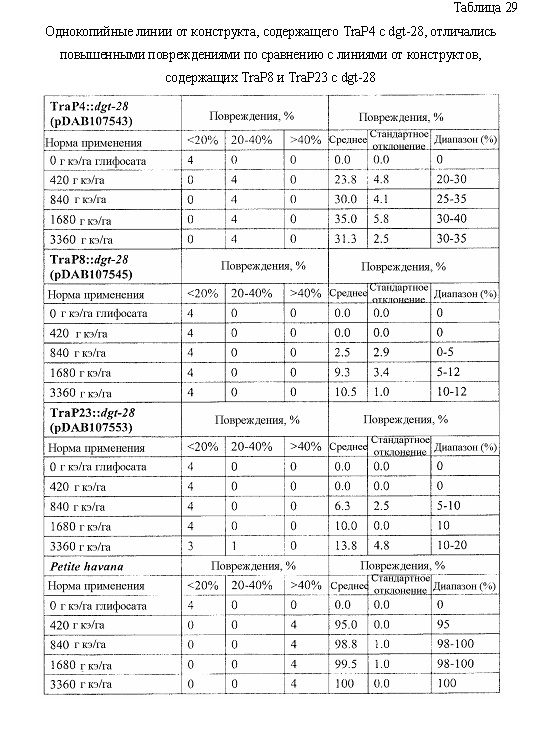
Данные продемонстрировали надежную толерантность растений табака с dgt-28 к глифосату при нормах применения вплоть до 3360 г кэ/га на протяжении двух поколений в сравнении с нетрансформированным контролем.
Перед нанесением глифосата у выбранных растений от каждого объекта были собраны образцы для анализов на белок DGT-28 стандартным методом ELISA для DGT-28. Данные показали, что средняя экспрессия белка DGT-28 в простых (1-2 копии) линиях среди конструктов находилась в диапазоне 72,8-114,5 нг/см2. Данные продемонстрировали, что dgt-28 экспрессирует белок в поколении T2 трансформированного табака и данные по толерантности подтвердили функциональность белка DGT-28.
Пакетирование dgt-28 для расширения спектра толерантности к гербицидам растений табака (культивар Petit Havana). Растения, гомозиготные по dgt-28 (pDAB107543 и pDAB107545), и растения, гомозиготные по aad-12 v1 (pDAB3278) (смотри PCT/US2006/042133 для информации о последних), подвергали реципрокному скрещиванию и собирали F1 семена. F1 семена от двух реципрокных скрещиваний каждого гена были стратифицированы и обработаны по 6 реплик для каждого скрещивания глифосатом при норме применения 1120 г кэ/га (селективным для гена dgt-28), 2,4-D при норме применения 1120 г кэ/га (селективным для гена aad-12), или баковой смесью двух гербицидов при указанных нормах применения. Оценку растений в баллах производили через 14 ДПО. Результаты опрыскивания приведены в таблице 30.
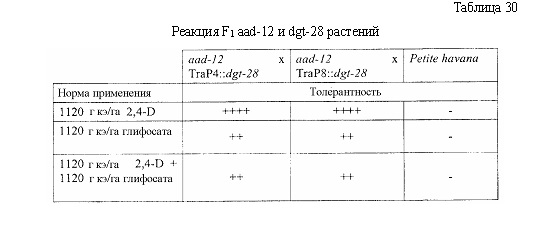
Результаты подтвердили, что dgt-28 может быть успешно пакетирован с aad-12 (v1), таким образом, расширяя спектр гербицидов, которые можно применять для интересующих сельскохозяйственных культур (глифосат + гербициды на основе феноксиуксусной кислоты для dgt-28 и aad-1, соответственно). В растениеводстве, в случаях, когда трудно бороться с широколиственными сорняками или существуют устойчивые биотипы сорняков, можно использовать пакет генов в качестве средства борьбы с сорняками и защиты интересующей сельскохозяйственной культуры. Дополнительные признаки вводимых ресурсов или признаки, определяющие производительность, также можно пакетировать с геном dgt-8.
Устойчивость к глифосату у растений пшеницы. Получение бинарных векторов, кодирующих DGT-28. Бинарные векторы, содержащие экспрессионную кассету DGT-28 и селекционную кассету PAT, были разработаны и собраны с использованием навыков и методов, обычно используемых в данной области. Каждая экспрессионная кассета DGT-28 содержала промотор, 5' нетранслируемую область и интрон из гена убиквитина (Ubi) из Zea mays (Toki et al., Plant Physiology, 1992, 100, 1503-07), за которыми следовала кодирующая последовательность, состоящая из последовательности одного из четырех транзитных пептидов (TraP4, TraP8, TraP23 или TraP5), слитой с 5'-концом синтетического варианта гена 5-енолпирувилшикимат-3-фосфатсинтазы (DGT-28), оптимизированная по кодонам для экспрессии в растениях. Экспрессионная кассета DGT-28 заканчивалась 3' нетранслируемой областью (UTR), содержащей терминатор транскрипции и сайт полиаденилирования гена липазы (Vp1) из Z. mays (Paek et al., Mol. Cells 1998 30; 8(3), 336-42). Селекционная кассета PAT состояла из промотора, 5' нетранслируемой области и интрона из гена актина (Act1) из Oryza sativa (McElroy et al., The Plant Cell 1990 2(2), 163-171), за которыми следовала последовательность синтетического варианта гена фосфинотрицин ацетил трансферазы (PAT), выделенная из Streptomyces viridochromogenes, оптимизированная по кодонам для экспрессии в растениях. Ген PAT кодирует белок, который придает устойчивость к ингибиторам глютамин-синтетазы, включающим фосфинотрицин, глюфозинат и биалафос (Wohlleben et al., Gene 1988, 70(1), 25-37). Селекционная кассета заканчивалась 3' UTR, содержащей терминатор транскрипции и сайты полиаденилирования из гена 35s вируса мозаики цветной капусты (CaMV) (Chenault et al., Plant Physiology 1993 101 (4), 1395-1396).
Селекционная кассета была синтезирована коммерческой компанией, занимающейся синтезом генов (GeneArt, Life Technologies), и клонирована в бинарный вектор на основе Gateway. Экспрессионные кассеты DGT-28 были субклонированы в pDONR221. Полученный исходный клон был использован в реакции LR Clonase II (Invitrogen, Life Technologies) с бинарным вектором на основе Gateway, кодирующим экспрессионную кассету фосфинотрицин ацетил трансферазы (PAT). Сначала проводили скрининг колоний всех собранных плазмид рестрикционным расщеплением очищенной ДНК с использованием эндонуклеаз рестрикции, полученных от компаний New England BioLabs (NEB; Ipswich, MA) и Promega (Promega Corporation, WI). Получение плазмидной ДНК проводили с использованием набора QIAprep Spin Miniprep Kit (Qiagen, Hilden) или Pure Yield Plasmid Maxiprep System (Promega Corporation, WI), следуя инструкциям поставщиков. Плазмидную ДНК выбранных клонов секвенировали с использованием протокола ABI Sanger Sequencing and Big Dye Terminator v3.1 cycle sequencing protocol (Applied Biosystems, Life Technologies). Данные по последовательностям были собраны и проанализированы с помощью программы Sequencher™ (Gene Codes Corp., Ann Arbor, MI).
Каждый из полученных четырех бинарных экспрессионных клонов: pDAS000122 (TraP4-DGT28), pDAS000123 (TraP8-DGT28), pDAS000124 (TraP23-DGT28) и pDAS000125 (TraP5-DGT28) был введен трансформацией в Agrobacterium tumefaciens штамм EHA105.
Получение трансгенных объектов пшеницы с экспрессионным конструктом dgt-28. Трансгенные растения пшеницы, экспрессирующие один из четырех экспрессионных конструктов DGT-28, получали путем опосредованной Agrobacterium трансформации с использованием донорской линии пшеницы Bobwhite MPB26RH, следуя протоколу, аналогичному тому, который описан в статье Wu et al., Transgenic Research 2008, 17: 425-436. Предполагаемые T0 трансгенные объекты отбирали на толерантность к фосфинотрицину (PPT), фенотип, придаваемый селективным маркером PAT, и пересаживали в почву. T0 растения выращивали в тепличных условиях содержания и получали T1 семена. В общей сложности, примерно 45 независимых T0 объектов было получено для каждого экспрессионного конструкта DGT-28.
Устойчивость к глифосату у T0 dgt-28 объектов пшеницы. T0 объекты оставляли для акклиматизации в теплице и выращивали до того, как 2-4 новых нормально выглядящих листа появлялись из мутовки (то есть, растения переводили из культуры тканей в условия выращивания в теплице). Растения выращивали при 25°C в условиях 12-часового дополнительного освещения в теплице до созревания. Первоначальный скрининг на устойчивость к глифосату и Taqman анализ проводили на T1 растениях, выращенных в тех же условиях, которые описаны ранее. Данные позволяли определять наследуемые T1 объекты для дальнейшей характеристики. Шесть низкокопийных (1-2 копии) и два многокопийных T1 объектов пересаживали в условиях теплицы и выращивали до стадии 3 листа. T1 растения опрыскивали коммерческим препаратом глифосата (Durango DMATM) в диапазоне норм применения 420-3360 г кэ/га, что способно значительно повреждать нетрансформированные линии пшеницы. В препараты для нанесения добавляли 2% масс/об сульфата аммония. Летальную дозу определяли как норму применения, вызывающую >75% повреждений у нетрансформированного контроля Bob White MPB26RH. Наносили гербицид.
В данном примере нанесение глифосата использовали как для определения сегрегации гена dgt-28 в поколении T1, так и для демонстрации толерантности к глифосату при повышенных нормах применения. Реакция растений представлена в виде шкалы видимых повреждений через 21 день после обработки (ДПО). Данные представлены в виде гистограммы для отдельных растений, демонстрирующих менее 25% видимых повреждений (4), 25%-50% видимых повреждений (3), 50%-75% видимых повреждений (2) и более 75% повреждений (1). Для каждого конструкта, используемого для трансформации пшеницы, приведены арифметические средние и стандартные отклонения. Диапазон шкалы индивидуальной реакции также указан в последней колонке для каждой нормы применения и трансформации. Нетрансформированные растения пшеницы дикого типа (культивар Bob White MPB26RH) служили в качестве чувствительного к глифосату контроля. В поколении T1 гемизиготные и гомозиготные растения были доступны для тестирования для каждого объекта, и вследствие этого, были включены в эксперименты с тестированием каждой нормы применения глифосата. Гемизиготные растения будут содержать половинное количество генов по сравнению с гомозиготными растениями, таким образом, в поколении T1 можно ожидать вариабельность реакции на применение глифосата.
Результаты, полученные с T1 dgt-28 растениями пшеницы, продемонстрировали, что толерантность к глифосату была достигнута при нормах применения вплоть до 3360 г кэ/га при наличии транзитных пептидов хлоропласта TraP4, TraP5, TraP8 и TraP23. Таблица 31. Данные относятся к низкокопийному T1 объекту, однако являются репрезентативными для популяции для каждого конструкта.
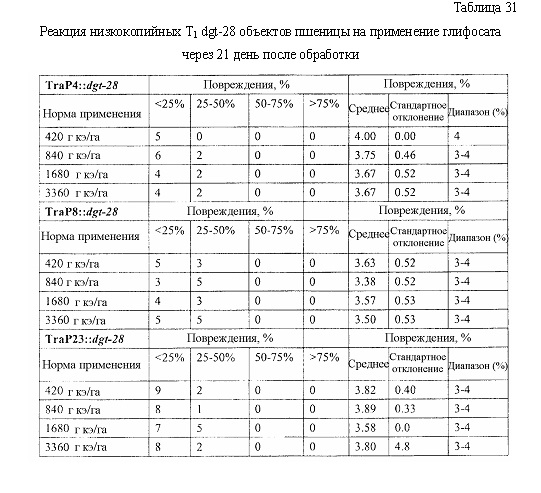
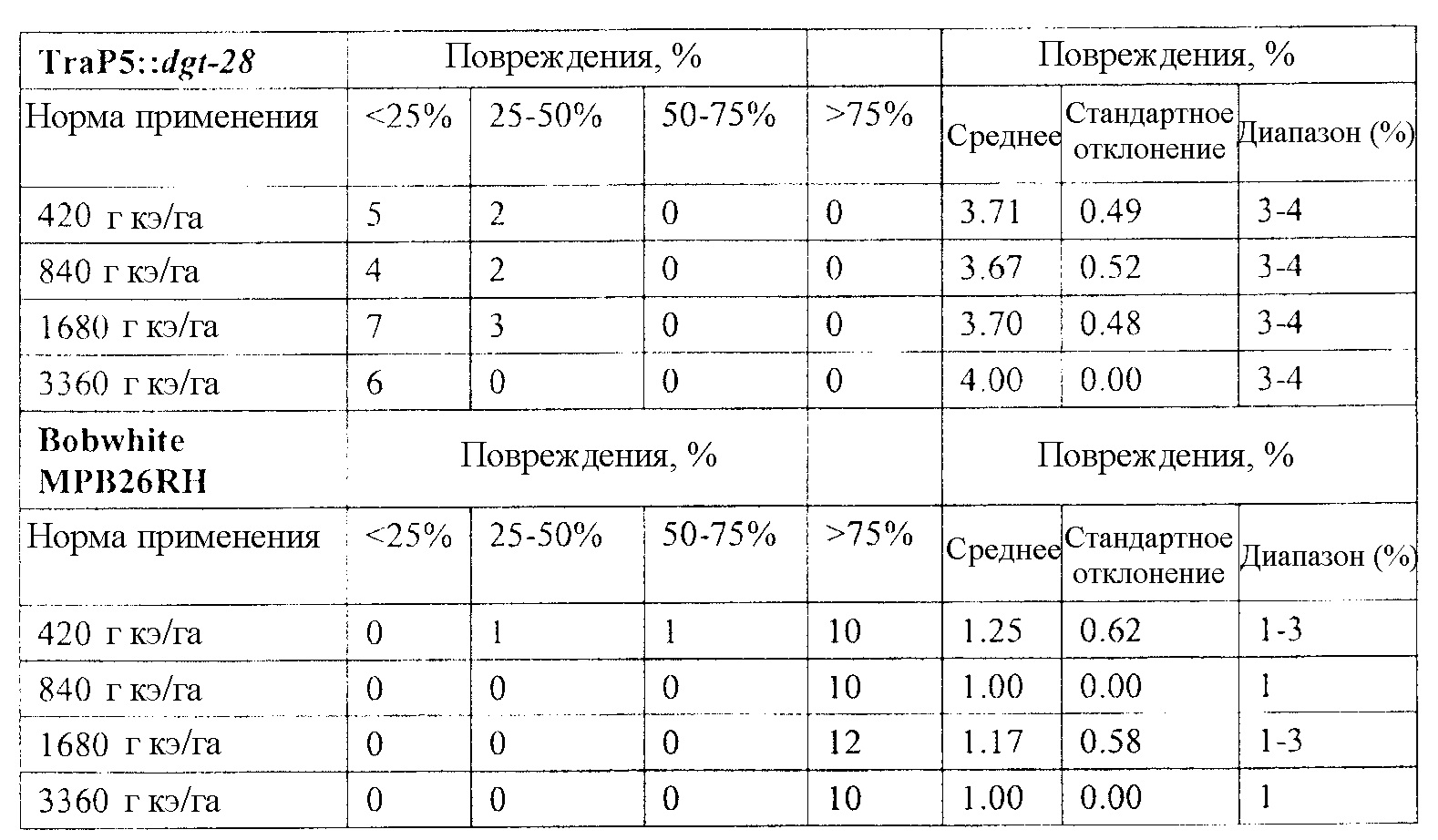
Через 21 ДПО устойчивые и чувствительные растения подсчитывали для определения процентной доли линий, которые сегрегировали по одному локусу, доминантному признаку по Менделю (3у:1ч), что определяли анализом хи-квадратов. Таблица 32. Эти данные продемонстрировали, что dgt-28 является наследуемым в качестве гена надежной устойчивости к глифосату у однодольных видов растений.
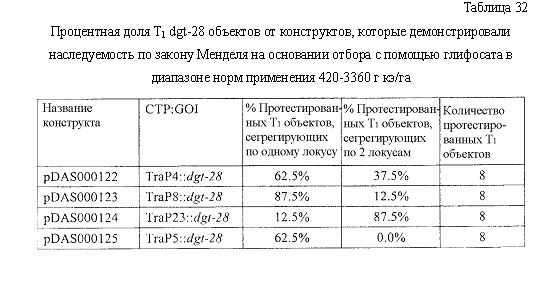
Пример 4: Последовательности химерных транзитных пептидов хлоропласта (TraP) для экспрессии важных с агрономической точки зрения трансгенов в кукурузе
Cry2Aa:
Белок Cry2Aa из Bacillus thuringiensis продемонстрировал активность против Helicoverpa zea (CEW) и Ostrinia nubilalis (ECB). Один вариант гена cry2Aa (SEQ ID NO: 10) с кодонами, предпочтительными для кукурузы, тестировали в растениях кукурузы. В данном эксперименте Cry2Aa оценивали сам по себе и в сочетании с химерным транзитным пептидом хлоропласта TraP8 в растениях кукурузы для определения активности толерантности к насекомым и для оценки эффекта, который последовательность химерного транзитного пептида хлоропласта TraP8 v2 будет оказывать на экспрессию белка Cry2Aa в кукурузе.
Для конструкта pDAB109807, последовательность химерного транзитного пептида хлоропласта Trap8 v2 (SEQ ID NO: 8) и кодон линкера GCA были клонированы выше гена cry2Aa и включены в конструкт pDAB109807 (фиг.11) для тестирования толерантности к насекомым у растений кукурузы. Полученные конструкты содержали две растительные транскрипционные единицы (PTU). Первая PTU содержала промотор убиквитина 1 Zea mays (промотор ZmUbi1; Christensen, A., Sharrock R., and Quail P., (1992) Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation, Plant Molecular Biology, 18: 675-689), слитый ген TraP8-cry2Aa (TraP8 Cry2Aa) и 3' нетранслируемую область липазы Zea mays (ZmLip 3′UTR; патент США № 7179902). Структура конструктов была подтверждена расщеплением ферментами рестрикции и секвенированием. Вторая PTU содержала промотор палочковидного вируса сахарного тростника (промотор SCBV; патент США № 6489462), ген толерантности к гербициду aad-1, содержащий лидерную последовательность MSV и интрон 6 алкогольдегидрогеназы 1 (AAD-1; патент США № 7838733, и лидерную последовательность MSV; регистрационный № Genbank FJ882146.1, и интрон алкогольдегидрогеназы; регистрационный № Genbank EF539368.1), а также 3' нетранслируемую область липазы Zea mays (ZmLip 3′UTR). Контрольная плазмида, pDAB107687, не содержащая последовательность транзитного пептида хлоропласта выше гена cry2Aa, была сконструирована и включена в исследование (фиг. 12). Плазмиды вводили в Agrobacterium tumefaciens для трансформации растений.
Початки Zea mays культивара B104 собирали через 10-12 дней после опыления. У собранных початков снимали листовые обертки, и початки поверхностно стерилизовали погружением в 20% раствор коммерческого отбеливателя (Ultra Clorox® Germicidal Bleach, 6,15% гипохлорит натрия) с двумя каплями Tween 20 на 20 минут, с последующим промыванием три раза в стерильной, деионизированной воде в вытяжном шкафу с ламинарным потоком. Незрелые зиготические зародыши (1,8-2,2 мм длиной) в асептических условиях извлекали из каждого початка и распределяли в одну или более микроцентрифужных пробирок, содержащих 2,0 мл суспензии Agrobacterium, в которую было добавлено 2 мкл 10% раствора сурфактанта Break-Thru® S233.
После завершения выделения зародышей пробирку с зародышами закрывали и помещали на вращающуюся платформу на 5 минут. Затем содержимое пробирок выливали на чашку со средой для совместного культивирования и жидкую суспензию Agrobacterium удаляли стерильной одноразовой пипеткой для переноса материала. Чашку для совместного культивирования, содержащую зародыши, помещали вглубь вытяжного шкафа с ламинарным потоком с приоткрытой на 30 минут крышкой; после чего зародыши ориентировали щитком зародыша вверх, используя микроскоп. Затем чашку для совместного культивирования с зародышами вновь помещали вглубь вытяжного шкафа с ламинарным потоком с приоткрытой еще на 15 минут крышкой. Затем чашку закрывали, запечатывали лентой 3M Micropore и помещали в инкубатор при 25°C с освещением 24 часа/сутки при интенсивности света примерно 60 мкмоль м-2 сек-1.
После периода совместного культивирования зародыши переносили в среду покоя. В каждую чашку переносили не более 36 зародышей. Чашки оборачивали лентой 3M Micropore и инкубировали при 27°C с освещением 24 часа/сутки при интенсивности света примерно 50 мкмоль м-2 сек-1 в течение 7-10 дней. Затем эмбриогенные каллусы переносили в селективную среду I. В каждую чашку с селективной средой I переносили не более 18 эмбриогенных каллусов. Чашки оборачивали лентой 3M Micropore и инкубировали при 27°C с освещением 24 часа/сутки при интенсивности света примерно 50 мкмоль м-2 сек-1 в течение 7 дней. Затем эмбриогенные каллусы переносили в селективную среду II. В каждую чашку с селективной средой II переносили не более 12 эмбриогенных каллусов. Чашки оборачивали лентой 3M Micropore и инкубировали при 27°C с освещением 24 часа/сутки при интенсивности света примерно 50 мкмоль м-2 сек-1 в течение 14 дней.
На этой стадии устойчивые каллусы переносили в среду предварительной регенерации. В каждую чашку со средой предварительной регенерации переносили не более 9 каллусов. Чашки оборачивали лентой 3M Micropore и инкубировали при 27°C с освещением 24 часа/сутки при интенсивности света примерно 50 мкмоль м-2 сек-1 в течение 7 дней. Затем регенерирующие каллусы переносили в среду регенерации в лотках Phytatrays™ и инкубировали при 28°C со световым периодом 16 часов света/8 часов темноты в сутки при интенсивности света примерно 150 мкмоль м-2 сек-1 в течение 7-14 дней или до развития побегов. В каждый лоток Phytatray™ помещали не более 5 каллусов. Затем небольшие побеги с первичными корнями выделяли и переносили в среду для побегов/корней. Укоренившиеся проростки высотой примерно 6 см или выше пересаживали в почву и переносили в ростовую камеру для закаливания.
Трансгенным растениям присваивали уникальные идентификационные номера и переносили обычным порядком в теплицу. Растения пересаживали из лотков Phytatrays™ в небольшие горшки (T.O. Plastics, 3,5-дюймовые (8,89 сантиметровые) SVD, 700022C) с ростовой средой (Premier Tech Horticulture, ProMix BX, 0581 P) и накрывали куполами влажности, чтобы помочь растениям акклиматизироваться. Растения помещали в ростовую камеру Conviron™ (28°C/24°C, 16-часовой фотопериод, 50-70% RH, 200 мкмоль интенсивность света) до достижения ими стадии V3-V4. Это способствовало акклиматизации растений к почве и более жестким температурным условиям. Затем растения переносили в теплицу (тип световой экспозиции: фотосинтез или ассимиляция; высокий световой лимит: 1200 ФАР (PAR); 16-часовая продолжительность дня; 27°C днем/24°C ночью) и пересаживали из небольших горшков в 5,5-дюймовые (13,97-сантиметровые) горшки. Примерно через 1-2 недели после пересадки в большие по размеру горшки собирали образцы от растений для биоанализа. Проводили биоанализ одного растения на объект.
Для продвижения к следующему поколению выбирали отдельные растения, исходя из числа копий генов, результатов определения белка методом вестерн-блоттинга и активности против насекомых в биоанализах. Объекты, которые содержали ген устойчивости к спектиномицину, были отмечены, но не обязательно были исключены из продвижения к следующему поколению. Объекты, выбранные для дальнейшего продвижения, пересаживали в 5-галлонные горшки. Периодически проводили наблюдения для отслеживания любых аномальных фенотипов. Перед появлением шелка над побегами размещали пакеты для побегов для предотвращения перекрестного загрязнения случайной пыльцой. Любые побеги, у которых появлялся шелк до накрывания, были отмечены и побег был удален. Второй побег был накрыт и использован для опылений. Растения, которые образовывали аномальные, или вовсе не образовывали побегов, регистрировали в базе данных. Шелк подрезали за день перед опылением для выравнивания принимающих пыльцу щеток и растения подвергали самоопылению.
Растения для отбора T1 опрыскивали через 7 дней после посева. Их выращивали в 4-дюймовых (10,16-сантиметровых) горшках с почвой для горшечных культур Metro 360 с установкой по 15 горшков на стеллаже. Стадия роста саженцев была V1-V1,5. Горшки с плохой всхожестью или содержащие очень маленькие растения (мутовка все еще закрыта) отмечали, чтобы не включать их в селекционную оценку. Полные стеллажи растений затем помещали во вторичные поддоны для опрыскивания машиной. Поддоны размещали по два поддона за раз в машину для распыления гербицидов Mandel, откалиброванную для доставки объема 187 л/га в целевую зону с использованием плоскоструйной насадки 8002E (Tee Jet). Для данного нанесения гербицида готовили раствор Assure II (квизалофоп) в норме применения 35 г кэ/га + 1% COC (маслянистый концентрат, снижающий повреждение целевых растений при обработке гербицидом). Объем 15 мл/распыление использовали для расчета общего необходимого количества раствора для опрыскивания. Расчеты: (35 г кэ/га) × (1 га/187 л) × (1 л/97,7 г кэ Assure II) = 0,192% раствор или 28,74 мкл/15 мл H2O + 1% по объему). После нанесения гербицида растения оставляли высыхать в течение одного часа в комнате для опрыскивания перед возвращением в теплицу. Примерно через 1-2 недели после пересадки в более крупные горшки собирали образцы от растения для биоанализа. Биоанализ проводили для одного растения на объект.
Все T0 объекты, которые прошли отбор молекулярными методами анализа, анализировали на уровни экспрессии белка Cry2Aa. Объекты от контрольного конструкта, pDAB107687, которые содержали Cry2Aa без TraP, имели значительно более высокий уровень экспрессии Cry2Aa (15,0 нг/см2) по сравнению с объектами от конструкта pDAB109807 (5,0 нг/см2), содержащего TraP8. Несмотря на сниженные уровни экспрессии объектов pDAB109807, эти объекты все еще экспрессировали белок Cry2Aa.
Объекты T1 также анализировали на уровни экспрессии белка Cry2Aa. Объекты от контрольного конструкта, pDAB107687, содержащего Cry2Aa без TraP, имели значительно более высокий средний уровень экспрессии Cry2Aa (55 и 60 нг/см2) по сравнению с объектами от pDAB109807 (примерно 20-40 нг/см2), содержащими TraP8. Несмотря на сниженные уровни экспрессии объектов pDAB109807, эти объекты все еще экспрессировали белок Cry2Aa.
Трансгенные растения, содержащие одиночные гены Bt, тестировали на инсектицидную активность в биоанализах, проводимых с новорожденными личинками чешуекрылых на листьях от трансгенных растений. Анализируемыми видами чешуекрылых были мотылек кукурузный, Ostrinia nubilalis (Hübner) (ECB) и совка хлопковая, Helicoverpa zea (CEW).
32-луночные лотки (C-D International, Pitman, NJ) частично заполняли 2% раствором агара и оставляли агар для застывания. Фрагменты листьев размером 1 дюйм2 собирали от каждого растения и помещали индивидуально в лунки 32-луночных лотков. Один фрагмент листа помещали в каждую лунку, и по два листовых фрагмента тестировали на каждое растение и на каждый вид насекомых. Проводили массовое заражение насекомыми с помощью кисти, помещая по 10 новорожденных личинок в каждую лунку. Лотки запечатывали перфорированными липкими крышками, допускающими вентилирование в процессе теста. Лотки помещали в условия 28°C, 40% RH, 16 часов света:8 часов темноты на три дня. После периода испытания для каждого фрагмента листа определяли простую процентную долю показателей повреждений в баллах. Показатели повреждений в баллах для каждого теста усредняли и использовали наряду с анализом экспрессии белка для проведения корреляционных анализов.
Результаты биоанализа T0 и T1 указывали на то, что последовательность химерного транзитного пептида хлоропласта TraP8 была функциональной и что объекты pDAB109807 обеспечивали защиту от тестируемых насекомых. В T1 объектах, растения, экспрессирующие белок Cry2Aa без TraP (pDAB107687), имели среднее повреждение листьев, которое существенно не отличалось от такового у растений, экспрессирующих белок Cry2Aa с TraP8 (pDAB109807), в случае всех протестированных видов насекомых. Эти результаты оказались неожиданными, учитывая, что растения, экспрессирующие белок Cry2Aa без TraP (pDAB107687), экспрессировали более высокие уровни белка по сравнению с растениями, экспрессирующими белок Cry2Aa с TraP8 (pDAB109807).
VIP3Ab1:
Белок Vip3Ab1 из Bacillus thuringiensis продемонстрировал активность против Helicoverpa zea (CEW), совки травяной (FAW) и устойчивой совки травяной (rFAW). Гены vip3Ab1 v6 (SEQ ID NO: 11) и vip3Ab1 v7 (SEQ ID NO: 12) были экспрессированы и протестированы на толерантность к насекомым в растениях кукурузы. В данном эксперименте vip3Ab1 v6 и vip3Ab1 v7 оценивали индивидуально и вместе с химерным транзитным пептидом хлоропласта TraP8 в растениях кукурузы для определения активности толерантности к насекомым и для оценки эффекта, который последовательность химерного транзитного пептида хлоропласта TraP8 v2 будет оказывать на экспрессию белков Vip3Ab1v6 и Vip3Ab1 v7 в кукурузе.
Для конструкта pDAB111481 (фигура 13), полинуклеотидную последовательность, кодирующую химерный транзитный пептид хлоропласта Trap8 v2 (SEQ ID NO: 8), и кодон линкера GCA были клонированы выше гена vip3ab1 v6 и протестированы на толерантность к насекомым в растениях кукурузы. Полученный конструкт содержал две растительные транскрипционные единицы (PTU). Первая PTU содержала промотор убиквитина 1 Zea mays (промотор ZmUbi1; Christensen, A., Sharrock R., and Quail P., (1992) Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation, Plant Molecular Biology, 18: 675-689), слитый ген TraP8-vip3ab1 v6 (TraP8-Vip3Ab1v6) и 3′ нетранслируемую область пероксидазы 5 Zea mays (ZmPer5 3′UTR). Структура конструкта была подтверждена расщеплением ферментами рестрикции и секвенированием. Вторая PTU содержала промотор палочковидного вируса сахарного тростника (промотор SCBV; патент США № 6489462), ген толерантности к гербициду aad-1, содержащий лидерную последовательность MSV и интрон 6 алкогольдегидрогеназы 1 (AAD-1; патент США № 7838733, и лидерную последовательность MSV; регистрационный № Genbank FJ882146.1, и интрон алкогольдегидрогеназы; регистрационный № Genbank EF539368.1), а также 3′ нетранслируемую область липазы Zea mays (ZmLip 3′UTR). Контрольная плазмида, pDAB111479, которая не содержала последовательность транзитного пептида хлоропласта выше гена vip3ab1 v6, была сконструирована и включена в исследование (фиг.14). Плазмиды вводили в Agrobacterium tumefaciens для трансформации растений.
Для конструкта pDAB111338 (фиг.15), последовательность химерного транзитного пептида хлоропласта Trap8 v2 (SEQ ID NO: 8) и кодон линкера GCA были клонированы выше гена vip3ab1 v7 и протестированы на толерантность к насекомым в растениях кукурузы. Полученный конструкт содержал две растительные транскрипционные единицы (PTU). Первая PTU содержала промотор убиквитина 1 Zea mays (промотор ZmUbi1; Christensen, A., Sharrock R., and Quail P., (1992) Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation, Plant Molecular Biology, 18: 675-689), слитый ген TraP8-Vip3Ab1 v7 (TraP8-vip3ab1 v7) и 3′ нетранслируемую область пероксидазы 5 Zea mays (ZmPer5 3′UTR). Структура конструкта была подтверждена расщеплением ферментами рестрикции и секвенированием. Вторая PTU содержала промотор палочковидного вируса сахарного тростника (промотор SCBV; патент США № 6489462), ген толерантности к гербициду aad-1, содержащий лидерную последовательность MSV и интрон 6 алкогольдегидрогеназы 1 (AAD-1; патент США № 7838733, и лидерную последовательность MSV; регистрационный № Genbank FJ882146.1, и интрон алкогольдегидрогеназы; регистрационный № Genbank EF539368.1), а также 3' нетранслируемую область липазы Zea mays (ZmLip 3′UTR). Контрольная плазмида, pDAB112710, которая не содержала последовательность транзитного пептида хлоропласта выше гена Vip3Ab1 v7, была сконструирована и включена в исследование (фиг.16). Плазмиды клонировали в Agrobacterium tumefaciens для трансформации растений.
Трансформацию кукурузы, анализ экспрессии белка и биоанализы с насекомыми проводили, следую протоколам, описанным выше, и результаты приведены в таблице 33. Результаты биоанализов с насекомыми показали, что химерная последовательность транзитного пептида хлоропласта TraP8 была функциональной и что объекты pDAB111338 и pDAB111481 обеспечивали защиту от насекомых, протестированных в биоанализе. В протестированных объектах растения, экспрессирующие белок Vip3Ab1 без TraP, (pDAB112710 и pDAB111479), имели среднее повреждение листьев, которое существенно не отличалось от такового у растений, экспрессирующих белок Vip3Ab1 с TraP8 (pDAB111338 и pDAB111481). В заключение, вестерн-блот анализы и биоанализы показали, что все из протестированных объектов экспрессировали белок Vip3 Ab1.
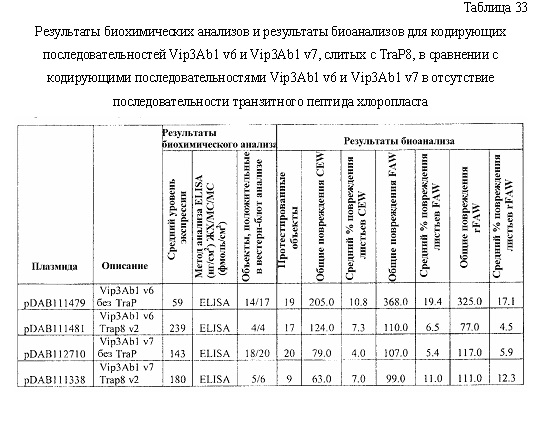
Пример 5: Отщепление последовательностей химерного транзитного пептида хлоропласта (TraP)
Сайт отщепления химерных транзитных пептидов хлоропласта TraP8 и TraP9 определяли методом MALDI-спектрометрии и N-концевым секвенированием по Эдману. Растительный материал получали от трансгенных растений, содержащих слитые гены TraP8-dgt14, TraP8-dgt28, TraP9-dgt14 и TraP9-dgt28, и анализировали для определения локализации сайта отщепления химерного транзитного пептида хлоропласта, происходящего во время транслокации в хлоропласт.
Результаты MALDI:
Полуочищенные белки из растительного образца разделяли SDS-ПААГ. Полосы белка с размером, соответствующим молекулярной массе YFP, вырезали из геля, удаляли краситель и высушивали. Затем высушенные белковые полосы расщепляли в геле трипсином (Promega; Madison, WI) в 25 мМ аммоний-бикарбонатном буфере в течение ночи при 37ºC. Пептиды очищали с помощью C18 ZipTip™ (Millipore, Bedford, MA) и элюировали смесью 50% ацетонитрил/0,1% ТФУ. Образцы смешивали с матричной α-циано-гидроксикоричной кислотой в соотношении 1:1, смесь наносили на пластину для образца для MALDI и высушивали на воздухе.
Получали масс-спектр пептида с использованием масс-спектрометра Voyager DE-PRO MALDI-TOF Mass Spectrometer™ (Applied Biosystems; Framingham, MA). Внешнее калибрование выполняли с использованием калибровочной смеси Calibration Mixture 2™ (Applied Biosystems). Внутреннее калибрование выполняли с использованием пиков автолиза трипсина при m/z 842,508; 1045,564 и 2211,108. Все масс-спектры получали в модели с рефлектором положительных ионов. Анализ масс-спектрометрических «отпечатков пальцев» пептидов (PMF) проводили с использованием бесплатного программного обеспечения PAWS™ (Protein Analysis WorkSheet) от компании Proteometrics LLC путем сопоставления PMF образца с теоретическими PMF целевого белка для проверки того, являлся ли образец целевым белком. Идентификацию белка проводили путем поиска в базе данных с использованием MASCOT (MatrixScience, London, UK) в базе данных белков сетевых ресурсов NCBI.
N-концевое секвенирование по Эдману:
N-концевое секвенирование проводили на секвенаторе Procise Protein Sequencer (модель 494) от компании Applied Biosystems (Foster City, CA). Образцы белка сначала разделяли методом SDS-ПААГ, затем переносили блоттингом на PVDF мембрану. Белковые полосы вырезали из мембраны и загружали в Procise Protein Sequencer. Восемь циклов химической деградации по Эдману проводили для каждого образца, получая пять остатков AA на N-конце. Стандартную смесь из 20 PTH-аминокислот (Applied Biosystems) анализировали с каждым образцом. Аминокислотные остатки от каждой деградации по Эдману определяли на основании их времени удерживания на колонке C-18 в сравнении со стандартами.
Результаты MALDI секвенирования свидетельствовали о том, что белки DGT-28 и DGT14 экспрессировались и что последовательности химерных транзитных пептидов хлоропласта TraP процессировались. В таблице 34 приведен список процессированных последовательностей, полученных с использованием N-концевой деградации по Эдману и MALDI секвенирования.