Результат интеллектуальной деятельности: СОЕДИНЕНИЯ КАРБОНОВЫХ КИСЛОТ
Вид РИД
Изобретение
Настоящее раскрытие относится к новым соединениям карбоновых кислот и, более конкретно, к некоторым соединениям карбоновых кислот, которые могут выступать в качестве агонистов TLR7 и в то же самое время демонстрировать эффективную селективность по TLR8 и hERG. Это раскрытие также относится к способам приготовления таких соединений и интермедиатов, подходящих для их приготовления, к фармацевтическим композициям, содержащим такие соединения, к применению таких соединений в приготовлении лекарственных препаратов и к применению таких соединений в терапии состояний, опосредуемых TLR7, таких как аллергические заболевания, аутоиммунные заболевания, вирусные заболевания и, в частности, рак.
Уровень техники
Толл-подобные рецепторы (TLR) экспрессируются на различных иммунных клетках, включая макрофаги и дендритные клетки (DC). TLR распознают молекулярные мотивы патогенов, именуемые патоген-ассоциированными молекулярными паттернами (РАМР). К настоящему времени у человека идентифицировано 13 TLR, они включают TLR 1, 2, 4, 5 и 6, которые ограничиваются поверхностью клетки и TLR 3, 7, 8 и 9, которые экспрессируются в эндосоме. Различные TLR распознают различные вырабатываемые патогенами лиганды, например: TLR2 (бактериальные липопротеины), TLR3 (двуспиральная РНК/поли-(I:С)), TLR4 (липополисахариды), TLR5 (флагеллин), TLR7 (одноцепочечная РНК) и TLR9 (CpG-содержащая ДНК). Лигирование TLR на антиген-презентирующих клетках, таких как DC, ведет к продуцированию провоспалительных цитокинов, созреванию DC и примированию адаптивной иммунной системы. TLR7 и TLR9 экспрессируются плазмоцитоидными дендритными клетками (pDC) и распознавание лиганда приводит к секреции α-интерферона (α-INF). Доклинические исследования, изучавшие эффекты активации TLR с применением бактериальных или вирусных компонентов, дозируемых в качестве монотерапии и/или объединяемых с антиопухолевыми средствами, показали торможение роста опухолей в различных моделях опухолей на мышах.
Было описано несколько небольших молекул-агонистов TLR7, включая имидазохинолин, имиквимод, который применяется для лечения ряда дерматологических состояний, например, остроконечной кондиломы, контагиозного моллюска и меланомы.
В случае меланомы местное нанесение имиквимода (ALDARA™, Graceway Pharmaceuticals, Bristol, TN) продемонстрировало терапевтические реакции в случае кожной метастатической меланомы и злокачественного лентиго и было одобрено для терапии поверхностного базально-клеточного рака (ВСС). Доклинические и клинические исследования показывают, что имиквимод, вероятно, действует через индукцию IFN типа 1 и IFN-индуцируемые гены, которые, в свою очередь могут обладать эффектами прямого воздействия на рост опухолевой клетки и/или через регулировочные компоненты адаптивной иммунной системы. 852А - другой имидазохинолин, который, в отличие от имиквимода, является подходящим для системного введения. В настоящее время 852А находится в фазе клинических испытаний по множеству раковых показаний, включая меланому.
Раскрытие изобретения
Техническая задача
Тем не менее, сохраняется потребность в разработке дальнейших агонистов TLR7, от которых можно было бы ожидать большей эффективности в терапии заболеваний, например, рака благодаря их более высокому потенциалу, и/или предпочтительным физическим свойствам (например, более высокой растворимости и/или меньшему связыванию с белками плазмы), и/или благоприятным профилям токсичности, и/или благоприятным метаболическим профилям по сравнению с другими известными агонистами TLR7, например, 852А.
Решение задачи
Как здесь показано, соединения карбоновых кислот настоящего раскрытия могут быть способными к активированию TLR7 in vitro. Как следствие этой активности, соединения настоящего раскрытия могут иметь ценность для профилактики и/или терапии таких заболеваний человека, как, например, рак, как в форме монотерапии, так и в комбинации с другими химиотерапевтическими средствами или режимами лучевой терапии.
Полезные эффекты изобретения
Кроме того, соединения настоящего раскрытия могут иметь неожиданно улучшенную селективность по TLR7 перед TLR8. TLR7 и TLR8 отличаются их клеточной экспрессией и в результате стимуляции избирательными агонистами индуцируют различные цитокиновые профили. Стимулирование TLR8 (либо в качестве TLR8 избирательного агониста, либо двойного агониста TLR7/8) приводит к повышению уровней провоспалительных цитокинов, включая TNF-α, IL-1β и IL-6 (Gorden и др. (2005) J. Immunol. 174, 1259-1268). Напротив, стимулирование TLR8 может привести к более низким уровням IFN-α. Поэтому избирательный агонист TLR7 может благоприятствовать индукции IFN-α, который важен в супрессии цитокинов Th2 (Huber и др. (2010) J. Immunol 185; 813-817), уровень которых возрастает при аллергических заболеваниях. Кроме того, делая соединения избирательными для TLR7 по сравнению с TLR8, может быть достигнуто снижение индукции провоспалительных цитокинов, тем самым предупреждая воспалительные реакции у человека.
Помимо этого, соединения настоящего раскрытия могут иметь неожиданно предпочтительный профиль hERG. Соединения, которые обладают значительной активностью против ионного канала hERG, избегаются, поскольку такая активность вовлечена в развитие двунаправленной тахикардии и необратимой остановки сердца.
Краткое описание чертежей
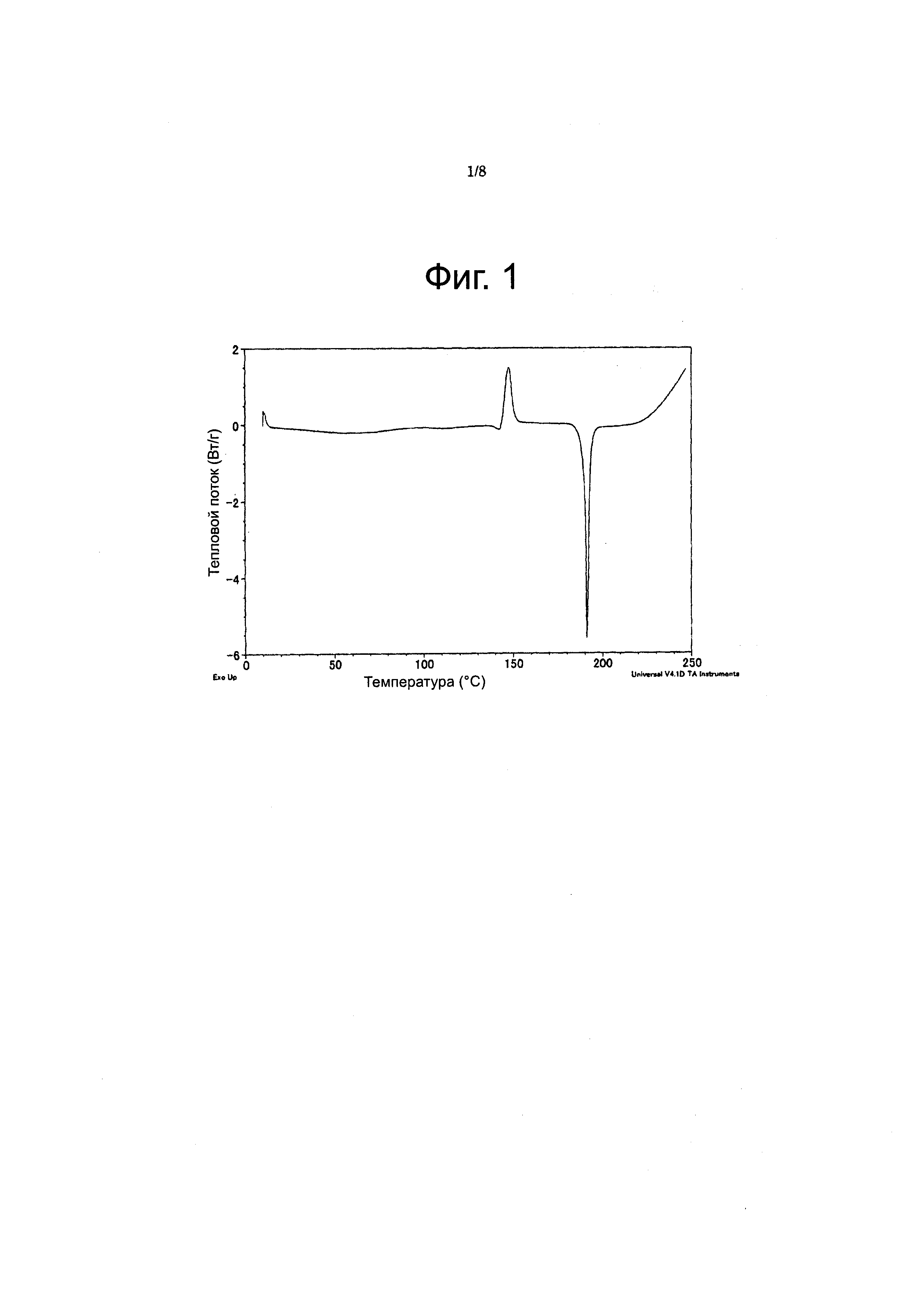
Фиг. 1
Фигура 1 представляет кривую, полученную дифференциальной сканирующей калориметрией (DSC), для соединения из Примера 18 (форма B). На оси X отображена температура (°C), а по оси Y - тепловой поток (ватты/г).
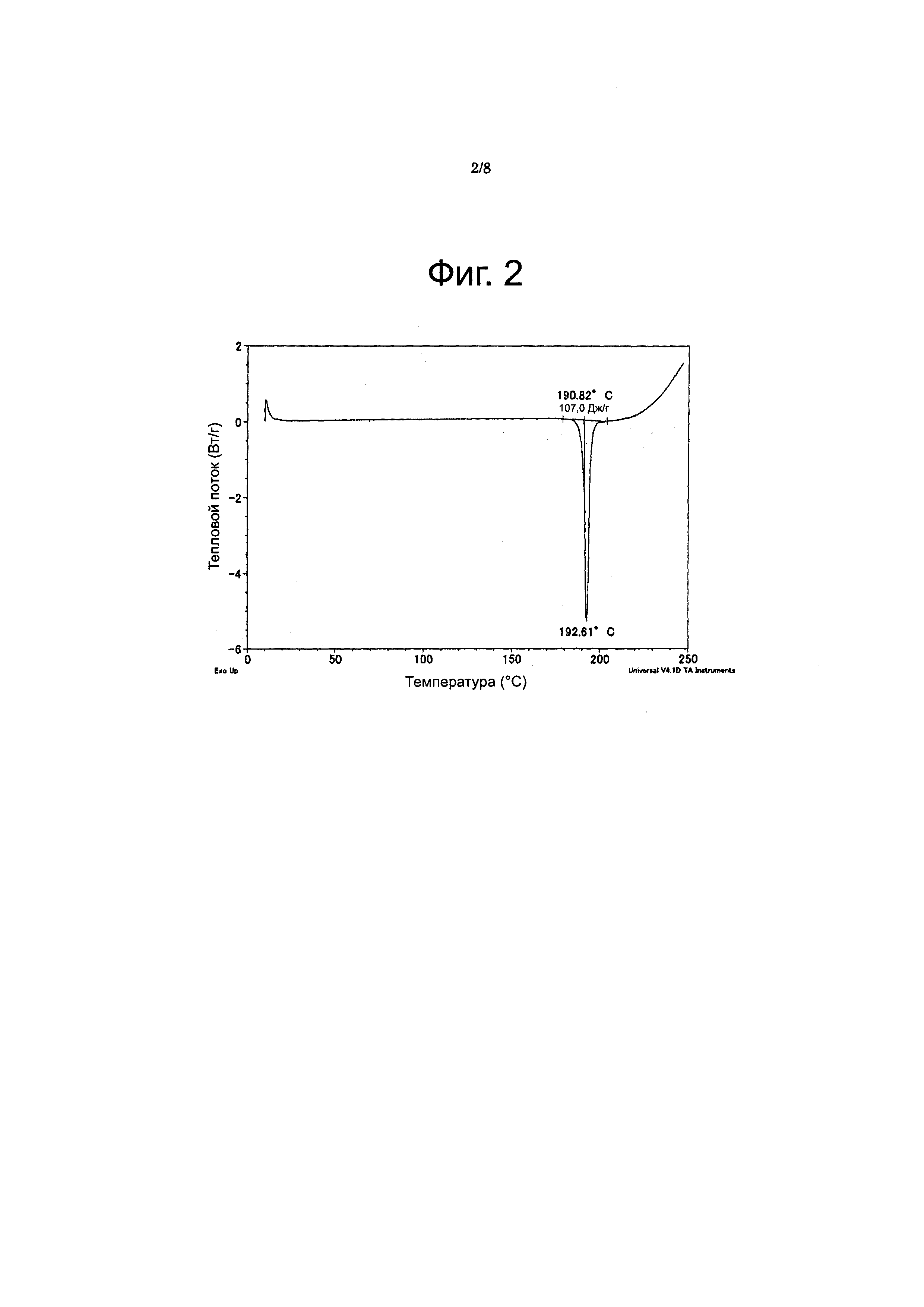
Фиг. 2
Фигура 2 представляет кривую, полученную дифференциальной сканирующей калориметрией (DSC), для соединения из Примера 19 (форма A). На оси X отображена температура (°C), а по оси Y - тепловой поток (ватты/г).
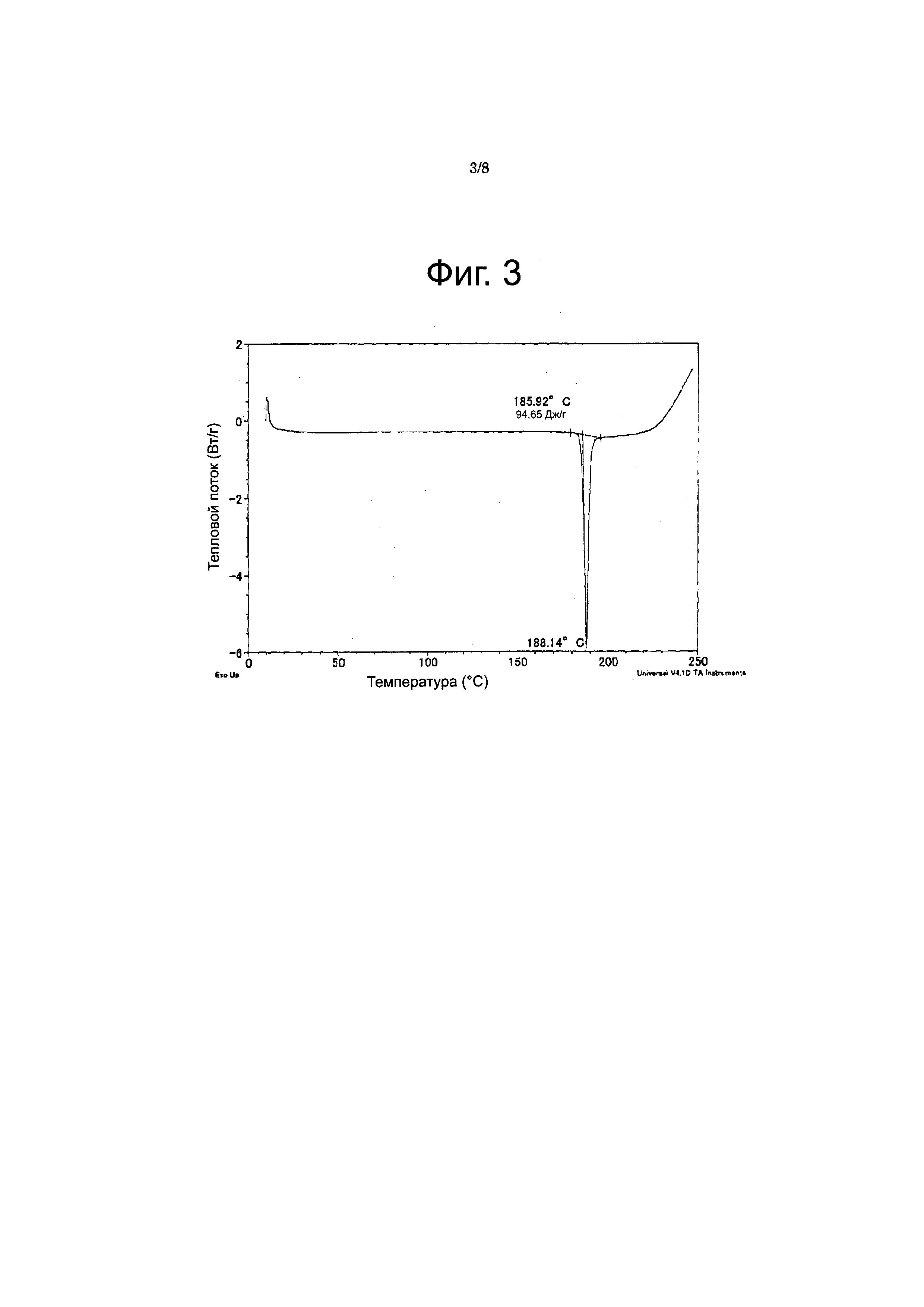
Фиг. 3
Фигура 3 представляет кривую, полученную дифференциальной сканирующей калориметрией (DSC), для соединения из Примера 20 (форма E). На оси X отображена температура (°C), а по оси Y - тепловой поток (ватты/г).
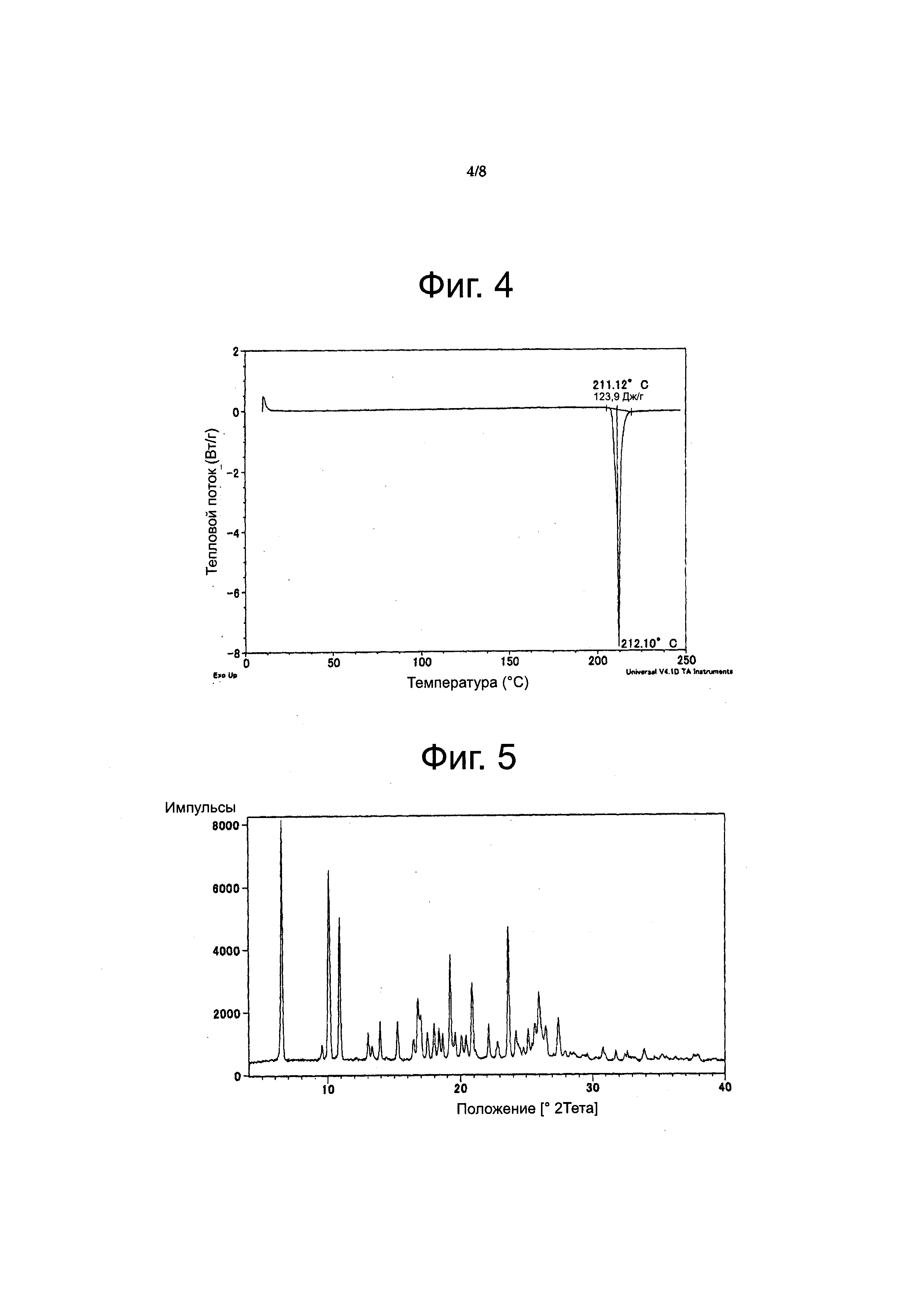
Фиг. 4
Фигура 4 представляет кривую, полученную дифференциальной сканирующей калориметрией (DSC), для соединения из Примера 21 (форма A). На оси X отображена температура (°C), а по оси Y - тепловой поток (ватты/г).
Фиг. 5
Фигура 5 представляет порошковую рентгеновскую дифрактограмму соединения из Примера 18 (форма B). На оси X отложена величина 2 тета, а на оси Y - интенсивность.
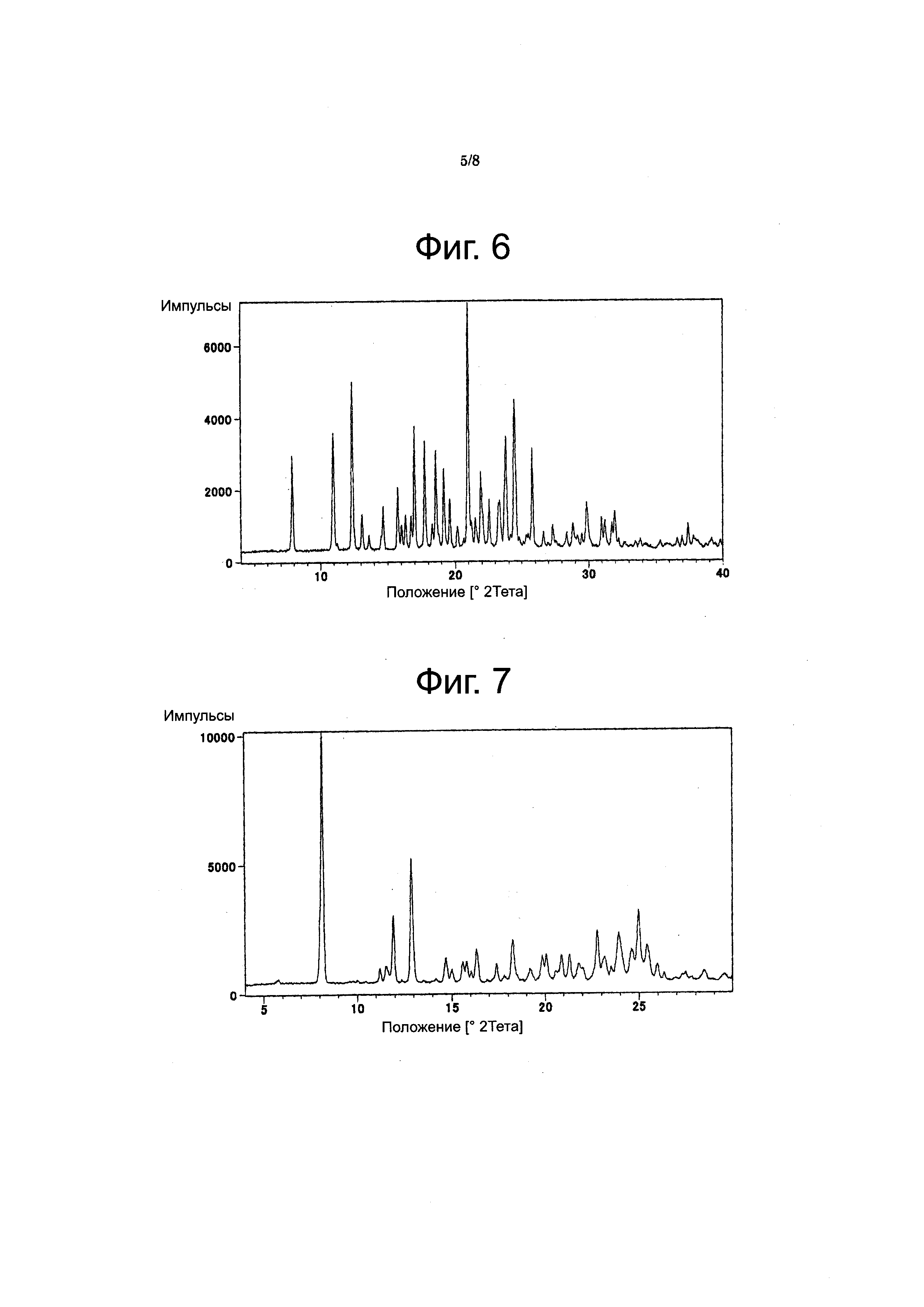
Фиг. 6
Фигура 6 представляет порошковую рентгеновскую дифрактограмму соединения из Примера 19 (форма A), на оси X отложена величина 2 тета, а на оси Y - интенсивность.
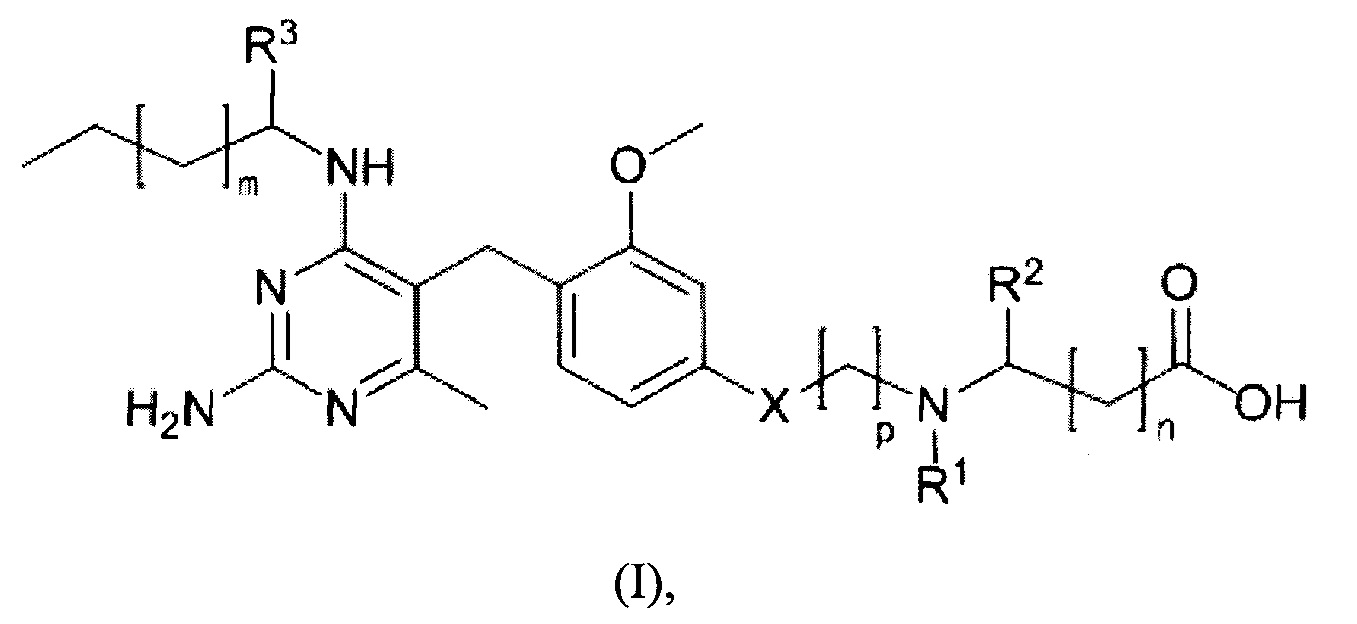
Фиг. 7
Фигура 7 представляет порошковую рентгеновскую дифрактограмму соединения из Примера 20 (форма E), на оси X отложена величина 2 тета, а на оси Y - интенсивность.
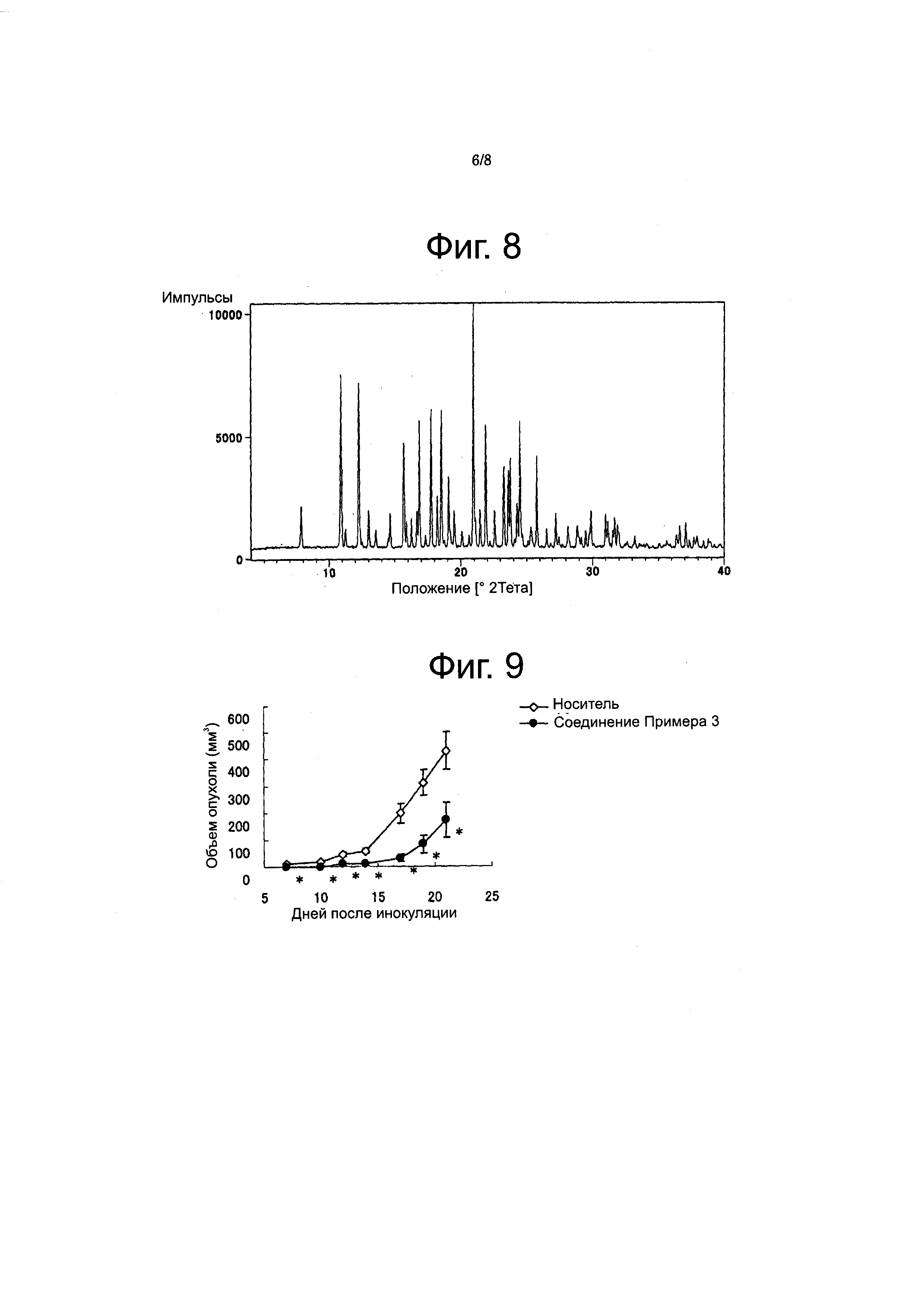
Фиг. 8
Фигура 8 представляет порошковую рентгеновскую дифрактограмму соединения из Примера 21 (форма A), на оси X отложена величина 2 тета, а на оси Y - интенсивность
Фиг. 9
Фигура 9 показывает результаты противоопухолевой активности в ингибировании мышиного изогенного почечного рака ("Renca") для соединения из Примера 3 (среднее и SD). Ось X: дни после прививки, ось Y: объем опухоли, незаштрихованные ромбы: группа, обработки 0,5% метилцеллюлозой, заштрихованные кружки: группа, леченная соединением из Примера 3, *: p<0,05 против носителя.
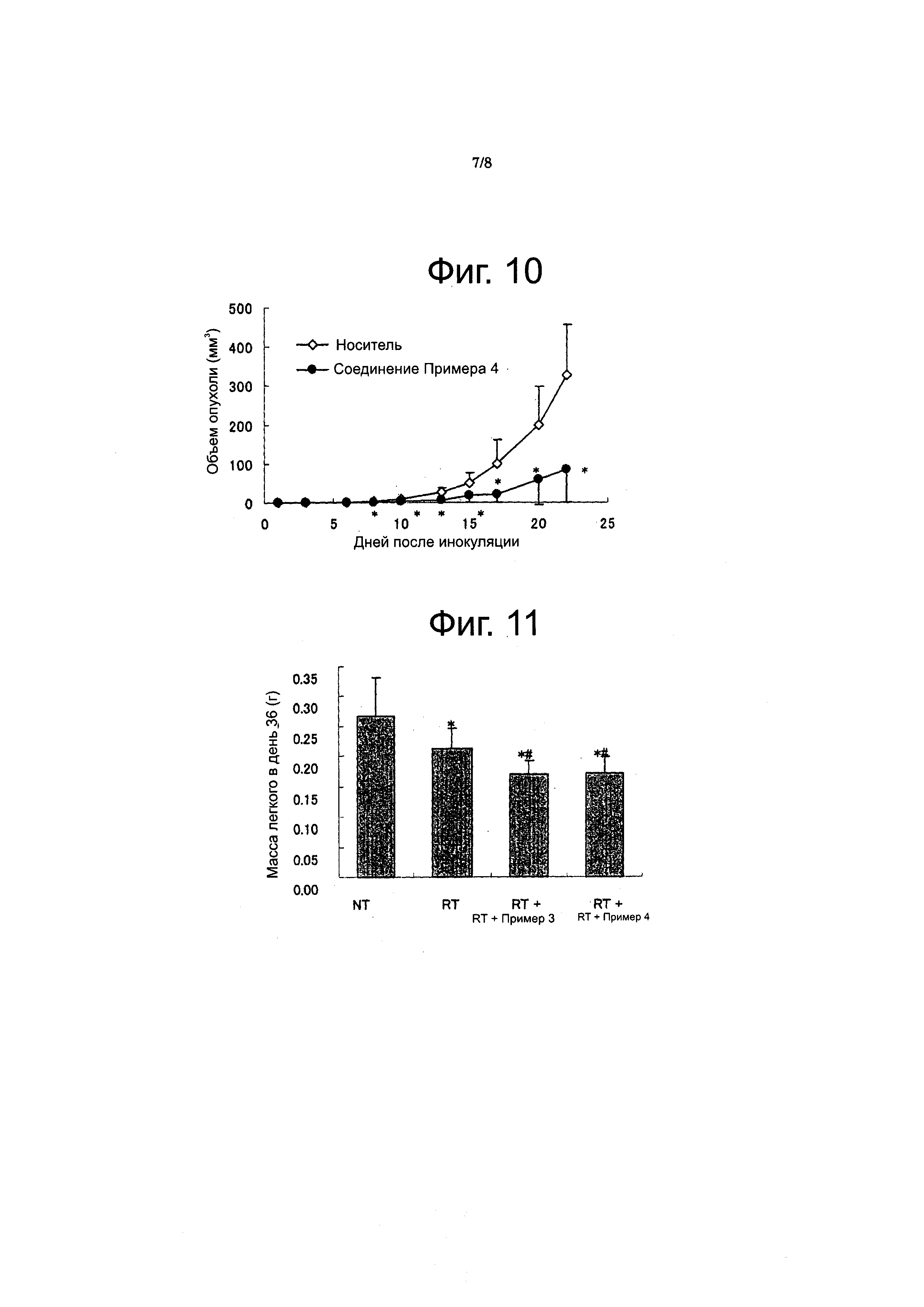
Фиг. 10
Фигура 10 показывает результаты противоопухолевой активности в ингибировании мышиного изогенного почечного рака ("Renca") для соединения из Примера 4 (среднее и SD). Ось X: дни после прививки, ось Y: объем опухоли, незаштрихованные ромбы: группа, обработки 0,5% метилцеллюлозой, заштрихованные кружки: группа, леченная соединением из Примера 4, *: p<0,05 против носителя.
Фиг. 11
Фигура 11 показывает результаты изучения метастазирования в условиях противоопухлевой активности ингибирования LM8 (среднее и SD). Ось X: NT означает отсутствие терапии и RT обозначает облучение (2Gy×5 последовательных дней), ось Y: масса легкого на 36 день, *: p<0,05 против носителя, #: p<0,05 против RT.
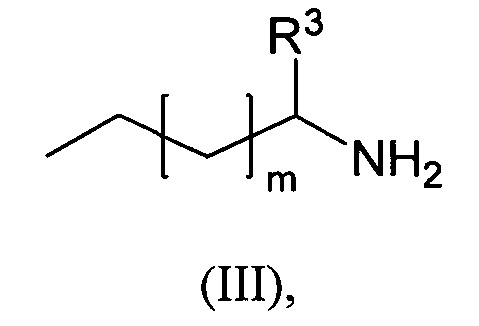
Фиг. 12
Фигура 12 показывает результаты испытаний на выживание в СТ26. NT означает отсутствие терапии и RT обозначает облучение (2Gy×5 последовательных дней). Закрашенные кружки - NT, закрашенные квадратики - RT, закрашенные треугольники - комбинация RT и соединения из Примера 3.
Фиг. 13
Фигура 13 показывает результаты испытаний на выживание в СТ26. NT означает отсутствие терапии и RT обозначает облучение (2Gy×5 последовательных дней). Закрашенные кружки - NT, закрашенные квадратики - RT, закрашенные треугольники - комбинация RT и соединения из Примера 4.
Описание воплощений изобретения
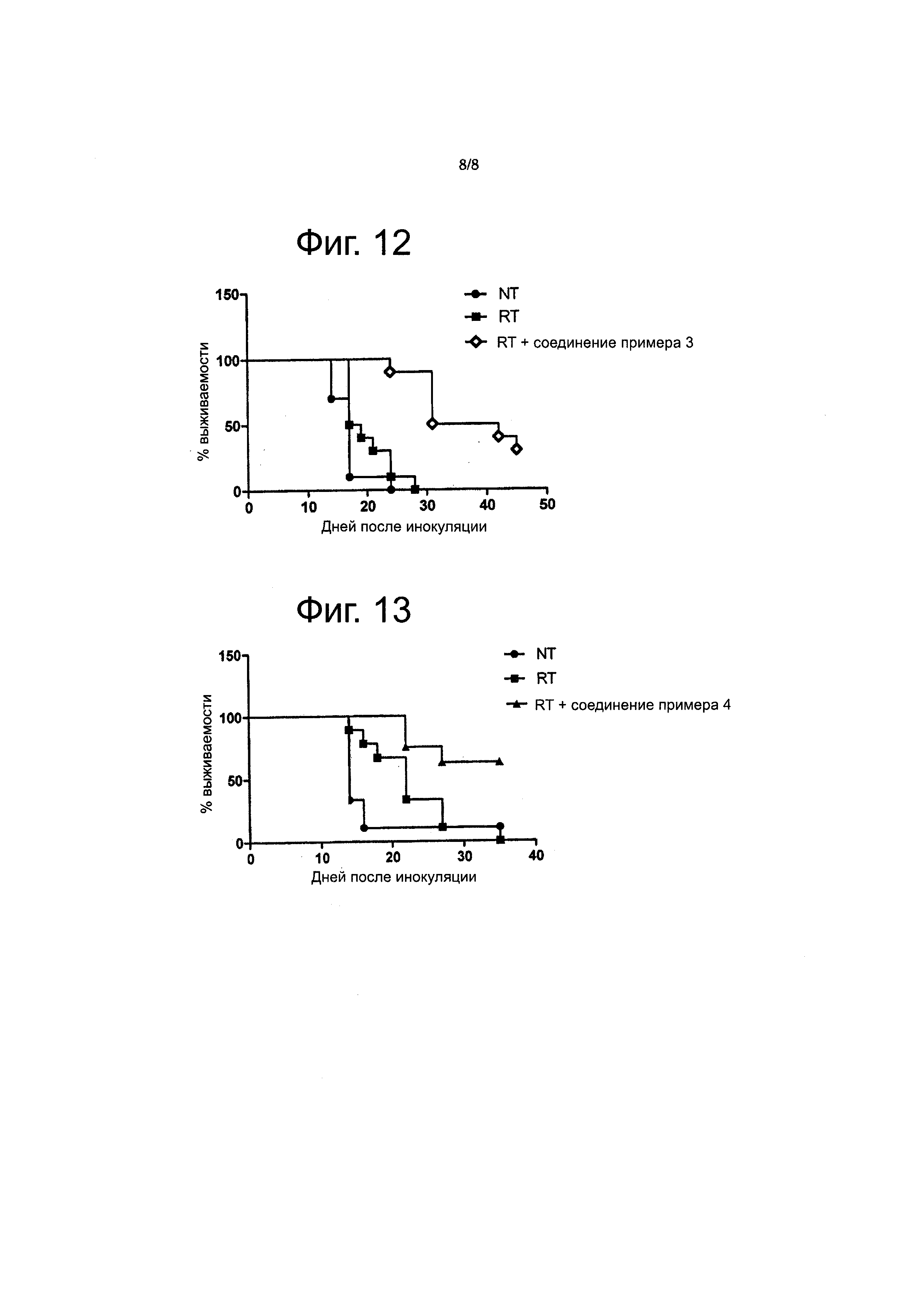
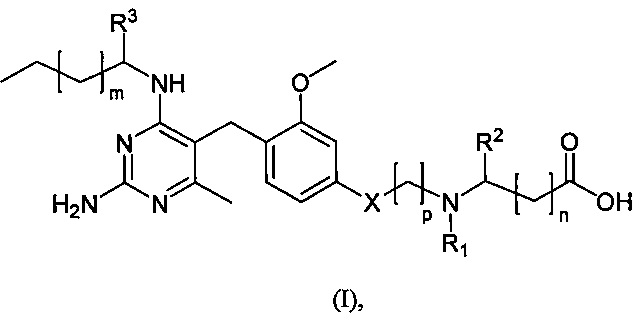
Поэтому, согласно первому аспекту настоящего раскрытия обеспечивается по меньшей мере один такой объект, выбираемый из соединений формулы (I):
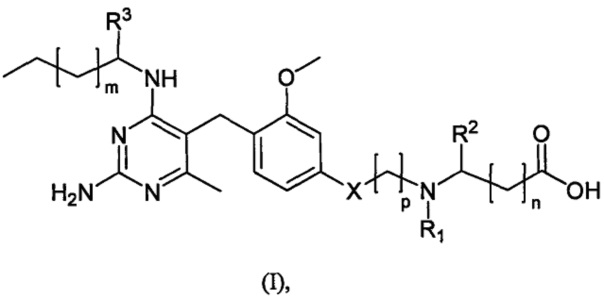
где
n равно 0,1 или 2;
m равно 1 или 2;
p равно 1, 2 или 3 с условием, что когда X - кислород, p равно 2 или 3, а когда X - одинарная связь, p равно 1;
× - кислород или одинарная связь;
R1 выбирается из водорода, C1-4 алкильной группы, C1-3 алкил-(CH2)- группы, в которой C1-3 алкильная функциональная группа замещена 1, 2 или 3 атомами фтора, C1-4 алкильной группы, замещенной цианом, C1-3 алкокси-C2-4 алкильной группы, C3-6 циклоалкильной группы, C1-4 алкилкарбонильной группы и формила;
R2 выбирается из водорода и алкильной группы C1-4;
или R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, образуют кольцо, выбираемое из насыщенных и ненасыщенных 4-6-членных гетероциклических колец, которые необязательно содержат дополнительный гетероатом, выбираемый из N, O и S, при этом указанный гетероатом N может быть при необходимости замещен C1-3 алкилом;
R3 выбирается из водорода, гидроксиметила и 2-гидроксиэтила;
и их фармацевтически приемлемых солей.
Следует понимать, что некоторые из определенных выше соединений формулы (I) и/или их фармацевтически приемлемые соли могут существовать в оптически активных или рацемических формах, базирующихся на одном или нескольких асимметрических атомах углерода, настоящее раскрытие включает в свой охват любые такие оптически активные или рацемические формы. Синтез оптически активных форм может быть выполнен стандартными методиками органической химии, хорошо известными в данной области, например, синтезом из оптически активных исходных материалов или разрешением рацемической формы. Вышеупомянутая активность может быть оценена с помощью стандартных лабораторных методик, рассматриваемых далее.
Следует понимать, что некоторые соединения вышеприведенной формулы (I) и/или их фармацевтически приемлемые соли могут существовать в несольватированных формах, а также в сольватированных формах, таких как, например, гидратированные формы. Следует понимать, что настоящее раскрытие охватывает все такие сольватированные формы.
Следует также понимать, что некоторые соединения формулы (I) и/или их фармацевтически приемлемые соли могут существовать в кристаллической форме и демонстрировать полиморфизм. Настоящее раскрытие охватывает все такие формы.
Термин «C1-4 алкил» предназначается для обозначения насыщенной углеродной цепи длиной от 1 до 4 атомов углерода, которая может быть линейной или разветвленной. Однако обращение к индивидуальным алкильным группам, таким как, например, «пропил», касается только версий с линейной цепью, при том, что упоминание индивидуальных алкильных групп с разветвленной цепью, таких как, например, «трет-бутил», относится только к версиям с разветвленной цепью. Неограничивающие примеры «C1-4 алкила» включают метил, этил, пропил, изопропил, бутил, н-бутил, изобутил и трет-бутил. Термины «C2-4 алкил» и «C1-3 алкил» должны рассматриваться соответственно.
Термин «C1-3 алкокси» предназначается для обозначения алкоксильной группы с насыщенной углеродной цепью длиной от 1 до 3 атомов углерода, которая может быть линейной или разветвленной. Однако обращение к индивидуальным алкокси-группам, таким как, например, «пропокси», касается только версий с линейной цепью, при том, что упоминание индивидуальных алкоксильных групп с разветвленной цепью, таких как изопропокси, относится только к версиям с разветвленной цепью. Неограничивающие примеры «C1-3 алкокси» включают метокси, этокси, пропокси и изопропокси.
Термин «C1-3 алкокси-C2-4 алкил» предназначается для обозначения C1-4 алкила, замещенного C1-3 алкоксильной группой.
Термин «C1-3 алкил-(CH2)-, в котором C1-3 алкильная функциональная группа замещена 1, 2 или 3 атомами фтора» предназначается для обозначения метиленовой группы, связанной с C1-3 алкильной функциональной группой, в которой 1, 2 или 3 водородных атома замещены атомами фтора. Неограничивающие примеры «C1-3 алкила-(CH2)-, в котором C1-3 алкильная функциональная группа замещена 1, 2 или 3 атомами фтора» включают 2-монофторэтил, 2,2-дифторэтил и 2,2,2-трифторэтил.
Термин «C1-4 алкил, замещенный цианом» предназначается для обозначения C1-4 алкила, замещенного пиано-группой.
Термин «C3-6 циклоалкил» предназначается для обозначения от 3-х до 6-членного насыщенного циклоалкила. Неограничивающие примеры «C3-6 циклоалкила» включают циклопропил, циклобутил, циклопентил и циклогексил.
Термин «C1-4 алкилкарбонил» предназначается для обозначения C1-4 карбонильной группы, замещенной алкилом C1-4. Неограничивающие примеры «C1-4 алкилкарбонила» включают ацетил, этаноил, пропаноил, бутаноил, пентаноил, 2-метилпропаноил и 3-метилбутаноил.
Термин «насыщенное 4-6-членное гетероциклическое кольцо», которое образуется R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, предназначается для обозначения насыщенного 4-, 5- или 6-членного гетероциклического кольца. Такое кольцо может необязательно содержать дополнительный гетероатом, выбранный из N, O и S, при этом указанный атом N может быть при необходимости замещен C1-3 алкилом. Неограничивающие примеры таких насыщенных 4-6-членных гетероциклических колец включают пирролидинил, пиперидинил, морфолино и пиперазинил.
В случаях, когда «насыщенное или ненасыщенное 4-6-членное гетероциклическое кольцо» замещено C1-3 алкилом при атоме N, C1-3, алкилом может быть замещен любой водородный атом на доступном атоме N. Неограничивающий пример «доступного» азотного атома, который может быть при необходимости замещен C1-3 алкилом, представлен азотом в 4 положении группы пиперазин-1-ил.
Термин «ненасыщенное 4-6-членное гетероциклическое кольцо», которое образуется R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, предназначается для обозначения ненасыщенного 4-, 5- или 6-членного гетероциклического кольца. Такое кольцо может необязательно содержать дополнительный гетероатом, выбранный из N, O и S, при этом указанный атом N может быть при необходимости замещен C1-3 алкилом. Неограничивающие примеры «ненасыщенного 4-6-членного гетероциклического кольца» включают ненасыщенные 5- и 6-членные гетероциклические кольца. Дополнительные неограничивающие примеры ненасыщенных 4-6-членных гетероциклических колец включают имидазолил, пиразолил и тиазолил.
В одном воплощении по меньшей мере один объект выбирается из соединений формулы (IA):
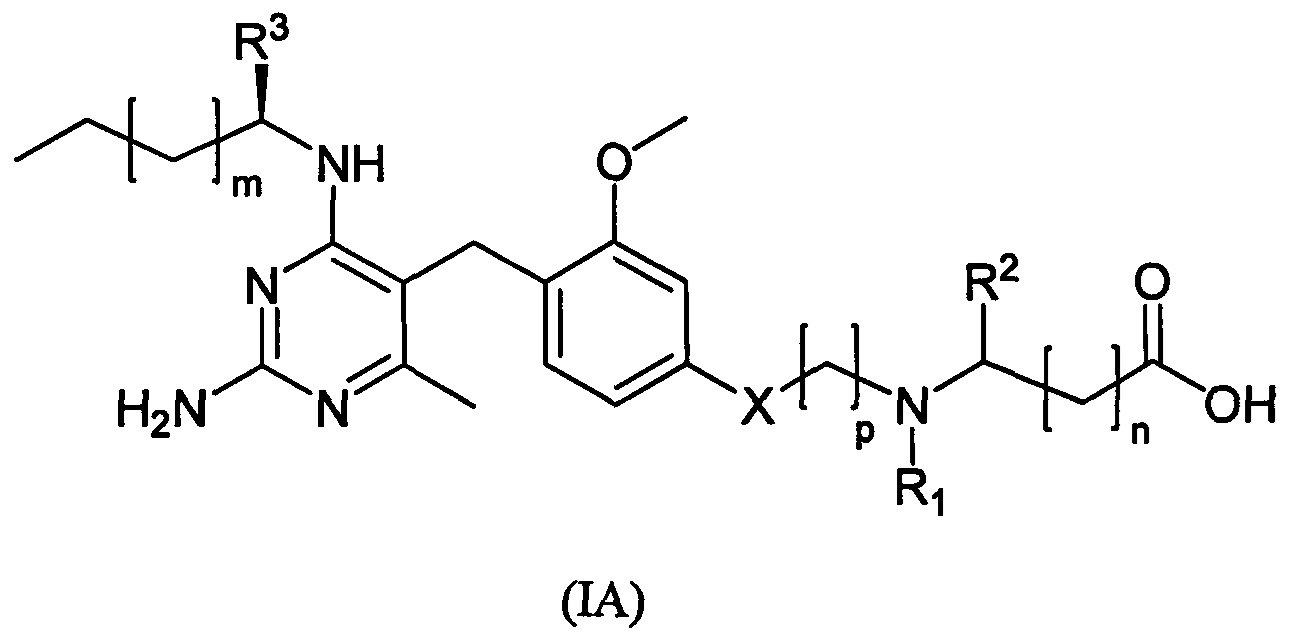
и их фармацевтически приемлемых солей, в которых величины X, R1, R2, R3, m, n и p могут принимать любые из значений, определенных в приведенной выше формуле (I).
Неограничивающие примеры значений, которые могут принимать X, R1, R2, R3, m, n и p в формуле (I) и/или формула (IA), указаны ниже. Такие значения могут использоваться вместе с любым из определений, пунктов формулы изобретения, аспектов и/или воплощений, определяемых здесь, с целью предоставления дальнейших воплощений или пунктов формулы изобретения настоящего раскрытия, и, если контекст не позволяет, любое количество вариабельных определений указанных групп может применяться в любой комбинации друг с другом для образования дальнейших воплощений, аспектов и/или пунктов формулы изобретения.
(i) m равно 1;
(ii) m равно 2;
(iii) n равно 0 или 1;
(iv) n равно 0;
(v) n равно 1;
(vi) n равно 2;
(vii) X - одинарная связь, и p равно 1;
(viii) X - атом кислорода, и p равно 2;
(ix) X - атом кислорода, и p равно 3;
(х) R1 выбирается из алкильной группы C1-4, C1-3 алкил-(CH2)-группы,
где C1-3 алкильная функциональная группа замещается 1, 2 или 3 атомами фтора, C1-4 алкильной группой, замещенной цианом, C1-3 алкокси-C2-4 алкильной группой, C3-6 циклоалкильной группой, C1-4 алкилкарбонильной группой и формилом;
(xi) R1 выбирается из этила, 2-монофторэтила, 2,2-дифторэтила, 2,2,2-трифторэтила и ацетила;
(xii) R1 выбирается из этила, 2,2-дифторэтила, 2,2,2-трифторэтила и ацетила;
(xiii) R1 выбирается из алкильной группы C1-4;
(xiv) R1 выбирается из алкильной группы C1-3;
(xv) R1 выбирается из метила, этила и пропила;
(xvi) R1 является этилом, необязательно замещенным 1, 2 или 3 атомами фтора;
(xvii) R1 является этилом;
(xviii) R1 является 2,2-дифторэтилом или 2,2,2-трифторэтилом;
(xix) R1 является 2,2-дифторэтилом;
(хх) R1 является 2,2,2-трифторэтилом;
(xxi) R1 выбирается из C1-4 алкилкарбонильной группы;
(xxii) R1 является ацетилом;
(xxiii) R2 выбирается из водорода и алкильной группы C1-4;
(xxiv) R2 выбирается из водорода и алкильной группы C1-2;
(xxv) R2 является водородом или метилом;
(xxvi) R2 является водородом;
(xxvii) R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, образуют насыщенное или ненасыщенное 4-6-членное гетероциклическое кольцо, необязательно содержащее дополнительный гетероатом, выбираемый из N, O и S, при этом указанный гетероатом N может быть при необходимости замещен C1-3 алкилом;
(xxviii) R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, образуют насыщенное 4-6-членное гетероциклическое кольцо, необязательно содержащее дополнительный гетероатом, выбираемый из N, O и S, при этом указанный гетероатом N может быть при необходимости замещен C1-3 алкилом;
(xxix) R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, образуют пирролидинильное, пиперидинильное, морфолиновое или пиперазинильное кольцо, в котором азотный атом в положении 4 при необходимости замещен C1-3 алкилом;
(ххх) R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, образуют пирролидинильное, пиперидинильное или морфолиновое кольцо, в котором азотный атом в положении 4 при необходимости замещен C1-3 алкилом;
(xxxi) R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, образуют пирролидинильное кольцо;
(xxxii) R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, образуют ненасыщенное 5-6-членное гетероциклическое кольцо, необязательно содержащее дополнительный гетероатом, выбираемый из N, O и S, при этом указанный гетероатом N может быть при необходимости замещен C1-3 алкилом;
(xxxiii) R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, образуют имидазолильное кольцо;
(xxxiv) R3 является водородом, гидроксиметилом и 2-гидроксиэтилом;
(xxxv) R3 является водородом или 2-гидроксиэтилом;
(xxxvi) R3 является 2-гидроксиэтилом.
В одном воплощении настоящего раскрытия обеспечивается соединение формулы (I) или формулы (IA), в котором X является одинарной связью, p равно 1 и n равно 0 или 1.
В одном воплощении настоящего раскрытия обеспечивается соединение формулы (I) или формулы (IA), в котором X является одинарной связью, p равно 1, n равно 0 или 1 и R2 является водородом.
В одном воплощении настоящего раскрытия обеспечивается соединение формулы (I) или формулы (IA), в котором X является одинарной связью, p равно 1, n равно 0 или 1 и R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, образуют насыщенное или ненасыщенное 4-6-членное гетероциклическое кольцо, необязательно содержащее дополнительный гетероатом, выбираемый из N, O и S, в котором указанный гетероатом N может быть при необходимости замещен C1-3 алкилом.
В одном воплощении настоящего раскрытия обеспечивается соединение формулы (I) или формулы (IA), в котором X является одинарной связью, p равно 1 и n равно 0.
В одном воплощении настоящего раскрытия обеспечивается соединение формулы (I) или формулы (IA), в котором X является одинарной связью, p равно 1, n равно 0 и R2 является водородом.
В одном воплощении настоящего раскрытия обеспечивается соединение формулы (I) или формулы (IA), в котором X является кислородом, p равно 3 и n равно 0.
В одном воплощении настоящего раскрытия обеспечивается соединение формулы (I) или формулы (IA), в котором X является кислородом, p равно 3, n равно 0 и R1, и R2 вместе с атомами азота и углерода, к которым они присоединены, образует насыщенное или ненасыщенное 4-6-членное гетероциклическое кольцо, необязательно содержащее дополнительный гетероатом, выбираемый из N, O и S, в котором указанный гетероатом N может быть при необходимости замещен C1-3 алкилом.
В одном воплощении настоящего раскрытия обеспечивается соединение формулы (I) или формулы (IA), в котором X является кислородом, p равно 3 и n равно 0 и R1, и R2 объединяются вместе с соседними атомами азота и углерода и образует пирролидинил или имидазолил.
В одном воплощении настоящего раскрытия обеспечивается соединение формулы (I) или формулы (IA), в котором m равно 1 и R3 является 2-гидроксиэтилом.
В одном воплощении настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединения формулы (I) и/или соединения формулы (IA), в котором:
n равно 0 или 1;
m равно 1;
p равно 1 или 3 с условием, что когда X - кислород, p равно 3, а когда X - одинарная связь, р равно 1;
X - кислород или одинарная связь;
R1 выбирается из C1-4 алкильной группы, C1-3 алкил-(CH2)- группы, в которой C1-3 алкильная функциональная группа замещена 1, 2 или 3 атомами фтора, C1-4 алкильной группы, замещенной пианом, и C1-4 алкилкарбонильной группы;
R2 является водородом;
или R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, образуют пирролидинильное, имидазолильное или морфолиновое кольцо;
R3 является водородом или 2-гидроксиэтилом;
и их фармацевтически приемлемых солей.
В одном воплощении настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединения формулы (I) и/или соединения формулы (IA), в котором:
n равно 0;
m равно 1;
p равно 1;
X является одинарной связью;
R1 выбирается из C1-4 алкильной группы, C1-3 алкил-(CH2)- группы, в которой C1-3 алкильная функциональная группа замещена 1, 2 или 3 атомами фтора, C1-4 алкильной группы, замещенной пианом, и C1-4 алкилкарбонильной группы;
R2 является водородом;
или R1 и R2 вместе с атомами азота и углерода, к которым они присоединены, образуют пирролидинильное, имидазолильное или морфолиновое кольцо;
R3 является водородом или 2-гидроксиэтилом;
и их фармацевтически приемлемых солей.
В одном воплощении настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединения формулы (I) и/или соединения формулы (IA), в котором:
n равно 0;
m равно 1;
p равно 1;
X является одинарной связью;
R1 является C1-4 алкильной группой, C1-3 алкил-(CH2)- группой, в которой C1-3 алкильная функциональная группа замещена 1, 2 или 3 атомами фтора;
R2 является водородом; и
R3 является водородом или 2-гидроксиэтилом;
и их фармацевтически приемлемых солей.
В одном воплощении настоящего раскрытия обеспечивается по меньшей мере один аспект, выбираемый из:
2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)уксусной кислоты;
2-((4-((2-амино-4-(бутиламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)уксусной кислоты;
2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты;
2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусной кислоты;
3-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)пропионовой кислоты;
3-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)пропионовой кислоты;
2-(N-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)ацетамидо)уксусной кислоты;
1-(3-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)пирролидин-2-карбоновой кислоты;
3-((3-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(этил)амино)пропионовой кислоты;
2-((3-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(этил)амино)уксусной кислоты;
2-((3-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(2,2-дифторэтил)амино)уксусной кислоты;
1-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)пирролидин-2-карбоновой кислоты;
1-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)-1Н-имидазол-5-карбоновой кислоты;
и их фармацевтически приемлемых солей.
В одном воплощении настоящего раскрытия обеспечивается по меньшей мере один аспект, выбираемый из:
(S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)уксусной кислоты
и их фармацевтически приемлемых солей.
В одном воплощении настоящего раскрытия обеспечивается (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)уксусная кислота.
В одном воплощении настоящего раскрытия обеспечивается по меньшей мере один аспект, выбираемый из фармацевтически приемлемых солей (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)уксусной кислоты.
В одном воплощении настоящего раскрытия обеспечивается по меньшей мере один аспект, выбираемый из (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты и ее фармацевтически приемлемых солей.
В одном воплощении настоящего раскрытия обеспечивается (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусная кислота.
В одном воплощении настоящего раскрытия обеспечивается по меньшей мере один аспект, выбираемый из фармацевтически приемлемых солей (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты.
В одном воплощении настоящего раскрытия обеспечивается по меньшей мере один аспект, выбираемый из (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусной кислоты и ее фармацевтически приемлемых солей.
В одном воплощении настоящего раскрытия обеспечивается (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусная кислота.
В одном воплощении настоящего раскрытия обеспечивается по меньшей мере один аспект, выбираемый из фармацевтически приемлемых солей (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусной кислоты.
Следующим аспектом данного изобретения является любое из определенных здесь воплощений с условием, что один или несколько конкретных примеров, таких как Пример 1, Пример 2, Пример 3, Пример 4, Пример 5, Пример 6 и т.д. по отдельности дискламируются.
Как упоминалось ранее, некоторые соединения формулы (I) могут демонстрировать полиморфизм. Известно, что кристаллические материалы могут анализироваться с применением таких стандартных методик, как рентгеновская порошковая дифрактометрия (в дальнейшем XRPD), дифференциальная сканирующая калориметрия (в дальнейшем DSC), термогравиметрический анализ (в дальнейшем TGA), инфракрасная спектроскопия диффузного отражения с Фурье-преобразованием (DRIFT), спектроскопия в ближней инфракрасной области (NIR), ядерная магнитно-резонансная спектроскопия в растворе и/или твердом состоянии. Содержание воды в таких кристаллических материалах может быть определено методом Карла Фишера.
В качестве примера, соединение из Примера 3 демонстрирует полиморфизм и здесь идентифицированы три его кристаллические формы.
Соответственно, следующий аспект изобретения представляет форму В (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма В (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере одним специфическим пиком в области 2 тета около 6,5°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма В (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере одним специфическим пиком в области 2 тета около 9,5°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма В (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере двумя специфическими пиками в области 2 тета около 6,5° и 9,5°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма В (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму со специфическими пиками в области 2 тета около 6,5, 9,5, 10,1, 10,9, 13,9, 15,2, 16,5 и 16,8°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма В (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представлена порошковой рентгеновской дифрактограммой, по существу аналогичной порошковой рентгеновской дифрактограмме, показанной на Фигуре 5.
Следующий аспект изобретения представляет форму А (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма А (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере одним специфическим пиком в области 2 тета около 7,9°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма А (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере одним специфическим пиком в области 2 тета около 12,4°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма А (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере двумя специфическими пиками в области 2 тета около 7,9° и 12,4°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма А (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму со специфическими пиками в области 2 тета около 7,9, 10,9, 12,4, 13,1, 14,7, 15,7, 16,3 и 17,0°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма А (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представлена порошковой рентгеновской дифрактограммой, по существу аналогичной порошковой рентгеновской дифрактограмме, показанной на Фигуре 6.
Следующий аспект изобретения представляет форму Е (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма Е (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере одним специфическим пиком в области 2 тета около 8,2°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма Е (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере одним специфическим пиком в области 2 тета около 11,6°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма Е (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере двумя специфическими пиками в области 2 тета около 8,2° и 11,6°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма Е (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму со специфическими пиками в области 2 тета около 8,2, 11,6, 11,9, 12,9, 14,7, 15,6, 16,3 и 18,3°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма Е (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты, которая представлена порошковой рентгеновской дифрактограммой, по существу аналогичной порошковой рентгеновской дифрактограмме, показанной на Фигуре 7.
Было обнаружено, что соединение из Примера 4 также демонстрирует полиморфизм и здесь идентифицирована одна его кристаллическая форма.
Соответственно, следующий аспект изобретения представляет форму A (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусной кислоты.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма А (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере одним специфическим пиком в области 2 тета около 10,9°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма А (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере одним специфическим пиком в области 2 тета около 12,3°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма А (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму с по меньшей мере двумя специфическими пиками в области 2 тета около 10,9° и 12,3°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма А (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусной кислоты, которая представляет порошковую рентгеновскую дифрактограмму со специфическими пиками в области 2 тета около 7,9, 10,9, 12,3, 13,0, 15,7, 16,3, 16,9 и 17,8°.
Согласно следующему аспекту настоящего изобретения, обеспечивается кристаллическая форма, форма А (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусной кислоты, которая представлена порошковой рентгеновской дифрактограммой, по существу аналогичной порошковой рентгеновской дифрактограмме, показанной на Фигуре 8.
Понимается, что величины 2 тета порошковых рентгеновских дифрактограмм могут несколько варьировать от одной установки к другой или от одного образца к другому и, таким образом, указанные здесь величины не должны рассматриваться в качестве абсолютных (см. Jenkins, R и Snyder, R.L. "Introduction to X-Ray Powder Diffractometry" («Введение в рентгеновскую порошковую дифрактометрию») John Wiley & Sons 1996; Bunn, C.W. (1948), Chemical Crystallography, Clarendon Press, London; Klug, H.P. & Alexander, L.E. (1974), X-Ray Diffraction Procedures («Методы рентгеновской дифракции»). Обычно ошибка измерения дифракционного угла на рентгеновской порошковой дифрактограмме составляет, например, приблизительно плюс-минус 0,1° 2 тета и такая степень ошибки измерений должна приниматься во внимание при рассмотрении данных рентгеновской порошковой дифрактометрии. Кроме того, следует понимать, что интенсивности могут колебаться в зависимости от условий эксперимента и подготовки пробы (предпочтительная ориентация).
В следующем аспекте изобретения обеспечивается кристаллическая форма, отличающаяся указанными здесь величинами XRD 2 тета, для которой указанные величины 2 тета составляют плюс-минус 0,1 2 тета.
Также известно, что может быть получена порошковая рентгеновская дифрактограмма, имеющая одну или несколько ошибок измерения в зависимости от условий измерения (таких как используемые оборудование или установка). Например, на относительную интенсивность пиков могут влиять размеры зерна выше 30 микрон и неоднородность соотношений длины и ширины. Специалист также поймет, что на положение отраженного сигнала может влиять точность установки высоты размещения образца в дифрактометре и установка нуля дифрактометра. Также небольшое воздействие может оказывать плоскостность поверхности образца. Поэтому следует понимать, что описанные выше кристаллические формы настоящего изобретения, если не указывается иного, не ограничиваются кристаллами, обеспечивающими порошковые рентгеновские дифрактограммы, идентичные порошковым рентгеновским дифрактограммам, показанным в Фигурах 5, 6, 7 и 8, и любые кристаллы, обеспечивающие порошковые рентгеновские дифрактограммы, по существу аналогичные показанным на этих Фигурах, подпадают под рамки охвата настоящего изобретения. Специалист в области рентгеновской порошковой дифрактометрии способен оценить степень идентичности порошковых рентгеновских дифрактограмм.
В случаях, когда в формуле (I) X представлено одинарной связью и p равно O, соединение формулы (I) может быть приготовлено в ходе выполнения последовательности, показанной на Схеме 1:
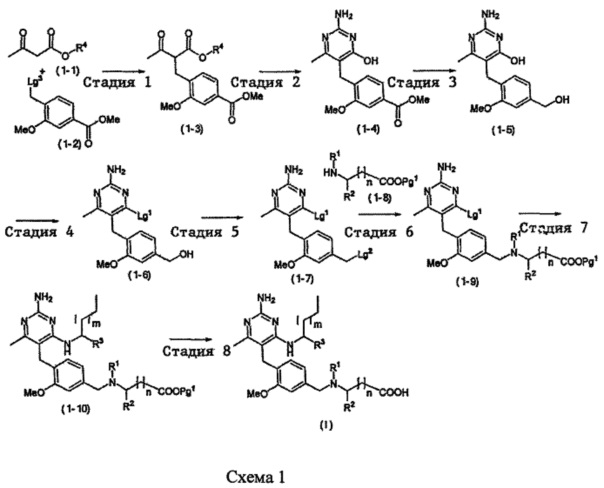
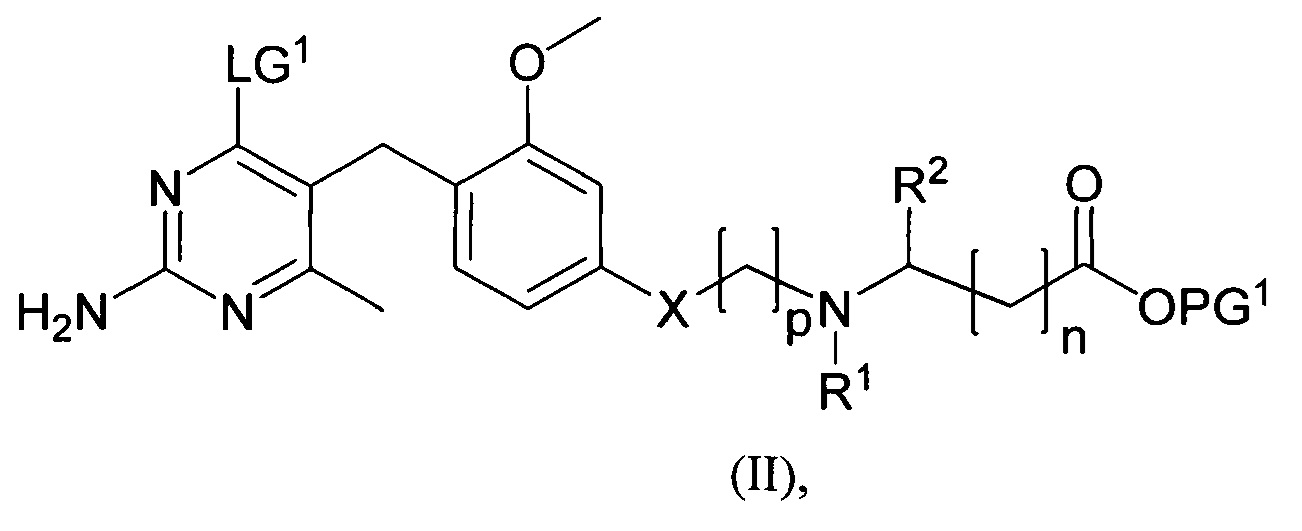
где m, n, R1, R2 и R3 являются такими, как определено в формуле (I), R4 выбирается из алкильной группы C1-4, а группы Lg1, Lg2 и Lg3 могут быть независимым образом выбраны из обычных уходящих групп, известных специалистам в данной области, например, замещенных и незамещенных гидрокарбилсульфонилокси уходящих групп, например, п-толуолсульфонилокси групп, мезитиленсульфонилокси, 2,4,6-триизопропилбензолсульфонилокси и метансульфонилокси групп и галоидных уходящих групп, таких как, например, уходящие группы, представленные йодом, бромом или хлором. Группа Pg1 выбирается из защитных групп для карбоксильной группы, например, сложного эфира, такого как, например, сложный метиловый эфир, сложный этиловый эфир или сложный трет-бутиловый эфир.
Стадия 1
Соединения формулы (1-3) могут быть приготовлены стандартной реакцией алкилирования, используя соединения формулы (1-1) и формулы (1-2). Например, реакцией соединения формулы (1-1) с основанием, таким как, например, NaH, KOtBu или гексаметилдисилазидом натрия, в подходящем растворителе, таком как, например, ТГФ или ДМФ, при подходящей температуре, например, при температуре в пределах от 0°C до 20°C, сопровождаемой добавлением соединения формулы (1-2). Реакционная смесь может нагреваться, например, при температуре в диапазоне от 50°C до 100°C, при необходимости в присутствии каталитических количеств йодидной соли, такой как, например, йодид калия.
Стадия 2
Соединения формулы (1-4) могут быть приготовлены реакцией соединения формулы (1-3) с гуанидином или карбонатом гуанидина в подходящем растворителе, таком как метанол или этанол, при повышенной температуре, например, при температуре в пределах от 50°C до 150°C. Соединения формулы (1-4) могут быть выделены в виде соли.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (1-4), как определено на Схеме 1, и его соли.
Стадия 3
Соединения формулы (1-5) могут быть приготовлены реакцией соединения формулы (1-4) с восстановителем, таким как, например, триэтилборгидрид лития или алюмогидрид лития, в подходящем растворителе, таком как, например, ТГФ, при температуре в пределах от 0°C до 50°C.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (1-5), как определено на Схеме 1, и их солей.
Стадия 4
В случаях, когда Lg1 является гидрокарбилсульфонилокси уходящей группой, такой как, например, метансульфонилокси, п-толуолсульфонилокси, мезитиленсульфонилокси или 2,4,6-триизопропилбензолсульфонилокси, соединения формулы (1-6) могут быть получены реакцией соединения формулы (1-5) с гидрокарбилсульфонилгалоидным соединением, таким как, например, 2-мезитиленсульфонилхлорид или 2,4,6-триизопропилбензолсульфонилоксихлорид, в присутствии основания, такого как, например, триалкиламин, такой как, например, диизопропилэтиламин, триэтиламин или 1,4-диазабицикло[2.2.2]октан, в подходящем растворителе, таком как, например, ТГФ, при температуре в пределах от 0°C до 50°C.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (1-6), как определено на Схеме 1, и его солей.
Стадия 5
В случаях, когда Lg2 является атом галогена, таким как, например, хлор или бром, соединения формулы (1-7) могут быть получены реакцией соединения формулы (1-6) с бромидом или хлоридом гидрокарбилсульфонила в присутствии бромида лития или хлорида лития, например, метансульфонилхлорида с хлоридом лития, в подходящем растворителе таком как, например, ТГФ, при подходящей температуре, например, при температуре в пределах от 10°C до 40°C, сопровождаемой обработкой с кислотой, такой как, например, HCl в диоксане, в подходящем растворителе, таком как, например, дихлорметан или ТГФ, при температуре окружающей среды, например, при температуре в пределах от 10°C до 40°C.
В качестве варианта, в случаях, когда Lg2 является гидрокарбилсульфонилокси уходящей группой, такой как, например, метансульфонилокси, п-толуолсульфонилокси или мезитиленсульфонилокси, соединения формулы (1-7) могут быть приготовлены реакцией соединения формулы (1-6) с галоидным соединением гидрокарбилсульфонила, таким как, например, 2-мезитиленсульфонилхлорид, в присутствии основания, такого как, например, триалкиламин, например, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как, например, ТГФ, при температуре в пределах от 0°C до 50°C.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (1-7), как определено на Схеме 1, и их солей.
Стадия 6
Соединения формулы (1-9) могут быть приготовлены реакцией соединения формулы (1-7) с соединением формулы (1-8) в присутствии основания, такого как, например, бикарбонат калия или бикарбонат натрия, при необходимости с йодидом калия или йодидом натрия, в подходящем растворителе, таком как, например, ацетонитрил, при температуре в пределах от 0°C до 100°C. Стадия 5 может последовательно сопровождаться Стадией 6 без выделения соединения формулы (1-7).
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (1-9), как определено на Схеме 1, и его соли.
Стадия 7
Соединения формулы (1-10) могут быть приготовлены реакцией соединения формулы (1-9) с избытком подходящего амина или аминоспирта, при этом аминоспирт при необходимости может иметь защищенную спиртовую группу, в подходящем растворителе, таком как, например, пропионитрил, бутанол, анизол, хлорбензол или 1,4-диоксан, в присутствии трифторуксусной кислоты при повышенной температуре, например, при температуре в пределах от 50°C до 200°C, обеспечиваемой стандартным или микроволновым нагревом.
В одном аспекте обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (1-10), как здесь определено, и его соли.
Стадия 8
Соединения формулы (I) могут быть приготовлены посредством удаления защитной группы с карбоксильного фрагмента. В случаях, когда PG1 является С1-4 алкилом, PG1 может быть удален гидролитической реакцией в присутствии основания, такого как, например, водный гидроксид натрия, при температуре в пределах от 0°C до 40°C. В случаях, когда PG1 является трет-бутилом, PG1 может быть удален гидролизом в присутствии кислоты, такой как 0,1 N - 10 N соляная кислота или трифторуксусная кислота, при температуре в пределах от 0°C до 100°C.
В случаях, когда R3 является гидроксиметилом или гидроксиэтилом и гидроксильная группа защищена защитной группой, такая защитная группа также может быть удалена известными специалистам в данной области способами.
В качестве варианта, соединение формулы (I) может быть приготовлено с применением последовательности, показанной на Схеме 2:
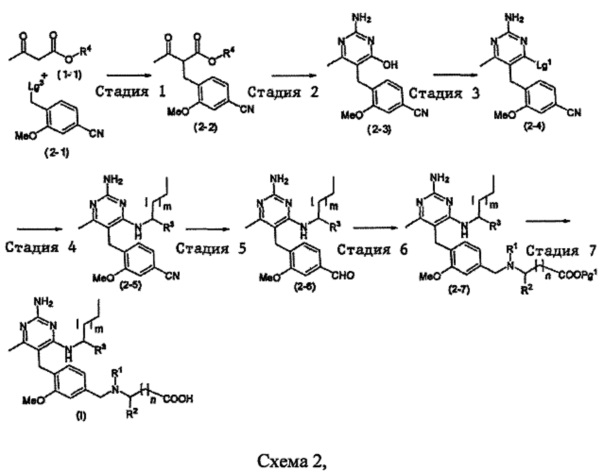
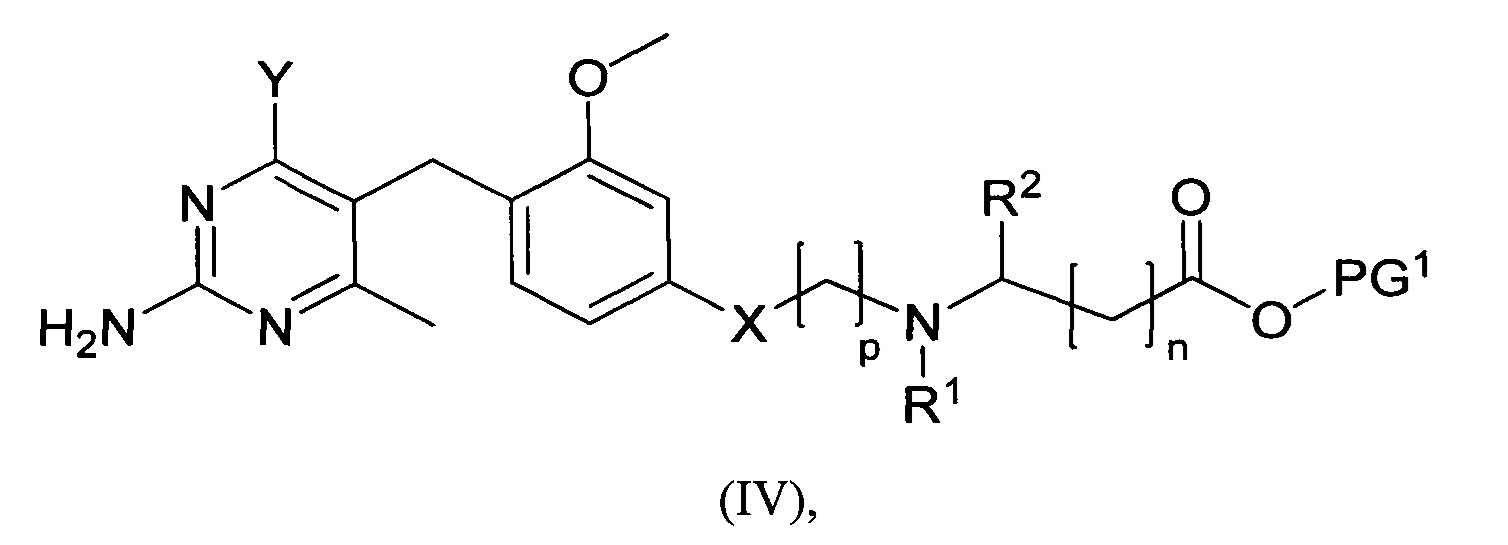
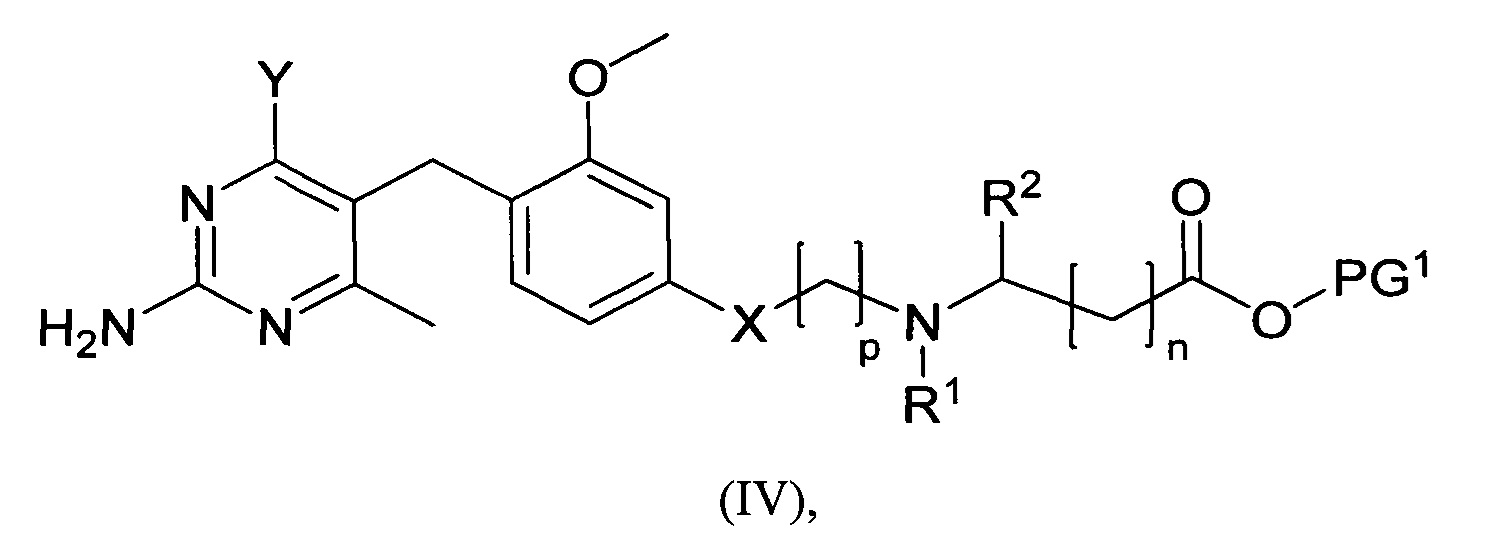
где m, n, R1, R2 и R3 являются такими, как определено в формуле (I), R4 выбирается из алкильной группы C1-4, а группы Lg1 и Lg3 могут быть независимым образом выбраны из обычных уходящих групп, известных специалистам в данной области, например, замещенных и незамещенных гидрокарбилсульфонилокси уходящих групп, например, п-толуолсульфонилокси групп, мезитиленсульфонилокси групп, 2,4,6-триизопропилбензолсульфонилокси групп и метансульфонилокси групп, а также галоидных уходящих групп, таких как, например, уходящие группы, представленные йодом, бромом или хлором. Группа Pg1 выбирается из защитных групп для карбоксильной группы, например, сложного эфира, такого как сложный метиловый эфир, сложный этиловый эфир или сложный трет-бутиловый эфир.
Стадия 1
Соединения формулы (2-2) могут быть приготовлены способом, подобным Стадии 1 из Схемы 1.
Стадия 2
Соединения формулы (2-3) могут быть приготовлены способом, подобным Стадии 2 из Схемы 1.
Стадия 3
Соединения формулы (2-4) могут быть приготовлены способом, подобным Стадии 4 из Схемы 1.
Стадия 4
Соединения формулы (2-5) могут быть приготовлены способом, подобным Стадии 7 из Схемы 1.
Стадия 5
Соединения формулы (2-6) могут быть приготовлены реакцией соединения формулы (2-5) с восстановителем, таким как никель Ренея, в подходящей растворяющей смеси, такой как, например, пиридин, уксусная кислота и вода, при подходящей температуре, например, при температуре в пределах от 20°C до 50°C.
Стадия 6
Соединения формулы (2-7) или (1-10) могут быть приготовлены реакцией соединения формулы (2-6) с подходящим соединением амина формулы (1-8) в условиях восстановительного аминирования, которые известны специалистам. Например, восстановительное аминирование может быть выполнено с помощью подходящего восстановителя, такого как, например, триацетоксиборгидрид натрия, в подходящем растворителе, таком как, например, дихлорметан, и кислоте, такой как, например, уксусная кислота, в присутствии активированных молекулярных сит или при использовании NaBH4 в подходящем растворителе, таком как, например, метанол.
Стадия 7
Соединения формулы (I) могут быть приготовлены способом, подобным Стадии 8 из Схемы 1.
В одном аспекте обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (2-3) и его солей. В одном аспекте обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (2-4) и его солей. В одном аспекте обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (2-5) и его солей. В одном аспекте обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (2-6) и его солей.
Дополнительная защитная группа, введенная в соединения формулы (2-7) или формулы (1-10), может быть удалена в любой удобный момент синтеза с помощью стандартных условий снятия защитных групп, которые являются известными специалистам. Соединения формулы (2-7) и соединения формулы (1-10) могут быть выделены в виде соли.
В случаях, когда в формуле (I) X является кислородом и p равно 2 или 3, соединение формулы (I) может быть приготовлено с помощью показанной на Схеме 3-1 и 3-2 последовательности следующим образом:
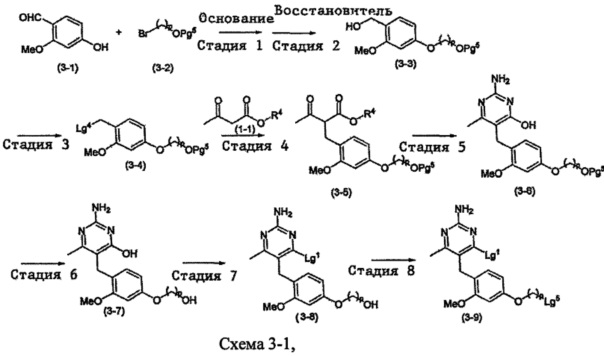
где m, n, R1 и R2 являются такими, как определено в формуле (I), р равно 2 и ил 3, R4 выбирается из алкильной группы C1-4, а группы Lg1, Lg4 и Lg5 могут быть независимым образом выбраны из обычных уходящих групп, известных специалистам в данной области, например, замещенных и незамещенных гидрокарбилсульфонилокси уходящих групп, таких как, например, п-толуолсульфонилокси группы, мезитиленсульфонилокси группы, 2,4,6-триизопропилбензолсульфонилокси группы и метансульфонилокси группы, а также галоидных уходящих групп, таких как, например, уходящие группы, представленные йодом, бромом или хлором. Группа Pg5 выбирается из защитных групп для гидроксильной группы, например, триалкилсилильной группы, такой как, например, трет-бутилдиметилсилильная группа.
Стадии 1 и 2
Соединения формулы (3-3) могут быть приготовлены стандартным способом, известным специалистам в данной области. Например, бензальдегидное соединение формулы (3-1) может быть введено в реакцию с соединением формулы (3-2) в присутствии основания, такого как, например, бикарбонат калия, в подходящем растворителе, таком как, например, ДМФ, при температуре окружающей среды, сопровождаться восстановлением продукта восстановителем, таким как, например, боргидрид натрия, в подходящем растворителе, например, спирте, таком как, например, метанол или этанол, или эфире, таком как, например, ТГФ, при температуре в пределах от 0°C до 40°C, давая соединения формулы (3-3).
Стадия 3
Гидроксильная группа в соединениях формулы (3-3) может быть преобразована в стандартную уходящую группу, известную специалистам в данной области, например, замещенную или незамещенную замещаемую гидрокарбилсульфонилокси группу, например, п-толуолсульфонилокси, метансульфонилокси и мезитиленсульфонилокси, или уходящую галоидную группу, такую как, например, уходящие группы йода, брома или хлора, давая соединения формулы (3-4).
Стадия 4
Соединения формулы (3-5) могут быть приготовлены стандартной реакцией алкилирования, используя соединения формулы (3-4) и формулы (1-1), как показано на Стадии 1 из Схемы 1. Например, реакцией соединения формулы (1-1) с основанием, таким как, например, NaH, в подходящем растворителе, таком как, например, ТГФ или ДМФ, при подходящей температуре, например, при температуре в пределах от 0°C до 20°C, сопровождаемой добавлением соединения формулы (3-4). Реакционная смесь может нагреваться, например, при температуре в диапазоне от 50°C до 100°C, при необходимости в присутствии каталитических количеств йодидной соли, такой как, например, KI.
Стадия 5
Соединения формулы (3-6) могут быть приготовлены реакцией соединения формулы (3-5) с гуанидином или карбонатом гуанидина в подходящем растворителе, таком как, например, метанол или этанол, при повышенной температуре, например, при температуре в пределах от 50°C до 150°C. Соединения формулы (3-6) могут быть выделены в виде соли.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (3-6), как определено на Схеме 3-1, и их солей.
Стадия 6
Защитная группа Pg5 соединений формулы (3-6) может быть удалена с помощью подходящего средства депротектирования. В случаях, когда Pg5 является триалкилсилильной группой, соединения формулы (3-6) могут быть введены в реакцию с кислотой, такой как, например, хлорид водорода, в метаноле при температуре в пределах от 0°C до 40°C, давая соединения формулы (3-7).
Стадия 7
В случаях, когда Lg1 является гидрокарбилсульфонилокси уходящей группой, соединения формулы (3-8) могут быть приготовлены реакцией соединения формулы (3-7) с галоидным соединением гидрокарбилсульфонила, таким как, например, 2-мезитиленсульфонилхлорид, в присутствии основания, такого как, например, триалкиламин, например, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как, например, ТГФ, при температуре в пределах от 0°C до 50°C.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (3-8), как определено на Схеме 3-1, и их солей.
Стадия 8
В случаях, когда Lg5 является гидрокарбилсульфонилокси уходящей группой, соединения формулы (3-9) могут быть приготовлены реакцией соединения формулы (3-8) с галоидным соединением гидрокарбилсульфонила, таким как, например, метансульфонилхлорид, в подходящем растворителе, таком как, например, ТГФ, при температуре окружающей среды, например, при температуре в пределах от 10°C до 40°C. Соединения формулы (3-9) могут быть также приготовлены реакцией соединения формулы (3-8) с галогенирующим реагентом, таким как, например, бромид лития или хлорид лития, в присутствии бромида или хлорида гидрокарбилсульфонила, в подходящем растворителе, таком как, например, ТГФ, при температуре окружающей среды, например, при температуре в пределах от 10°C до 40°C.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (3-9), как определено на Схеме 3-1, и их солей.
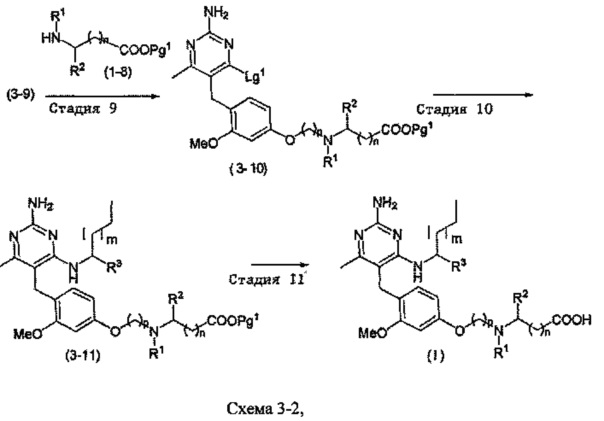
где m, n, R1, R2 и R3 являются такими, как определено в формуле (I), p равно 2 или 3 и группа Lg1 может независимым образом выбираться из обычных уходящих групп, известных специалистам в данной области, например, замещенных и незамещенных гидрокарбилсульфонилокси уходящих групп, таких как, например, п-толуолсульфонилокси, мезитиленсульфонилокси, 2,4,6-триизопропилбензолсульфонилокси и метансульфонилокси группы, а также галоидных уходящих групп, таких как, например, уходящие группы, представленные йодом, бромом или хлором. Группа Pg1 выбирается из защитных групп для карбоксильной группы, например, сложного эфира, такого как, например, сложный метиловый эфир, сложный этиловый эфир или сложный трет-бутиловый эфир.
Стадия 9
Соединения формулы (3-10) могут быть приготовлены реакцией соединения формулы (3-9) с соединением формулы (1-8) в присутствии основания, такого как, например, бикарбонат калия или бикарбонат натрия, при необходимости с йодидом калия или йодидом натрия, в подходящем растворителе, таком как, например, ацетонитрил, при температуре в пределах от 0°C до 100°C.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (3-10), как определено на Схеме 1, и их солей.
Стадия 10.
Соединения формулы (3-11) могут быть приготовлены реакцией соединения формулы (3-10) с избытком подходящего амина или аминоспирта, при этом аминоспирт при необходимости может иметь защищенную спиртовую группу, в подходящем растворителе, таком как, например, пропионитрил, бутанол или 1,4-диоксан, в присутствии трифторуксусной кислоты при повышенной температуре, например, при температуре в пределах от 50°C до 200°C, обеспечиваемой стандартным или микроволновым нагревом.
В одном аспекте обеспечивается соединение формулы (3-11), как здесь определено, и его соли.
Стадия 11
Соединения формулы (I) могут быть приготовлены посредством удаления защитной группы с карбоксильного фрагмента в присутствии основания, такого как, например, водный раствор гидроксида натрия, при температуре в пределах от 0°C до 40°C. В случаях, когда R3 является гидроксиметилом или гидроксиэтилом и гидроксильная группа защищена защитной группой, она также может быть удалена известными специалистам в данной области способами.
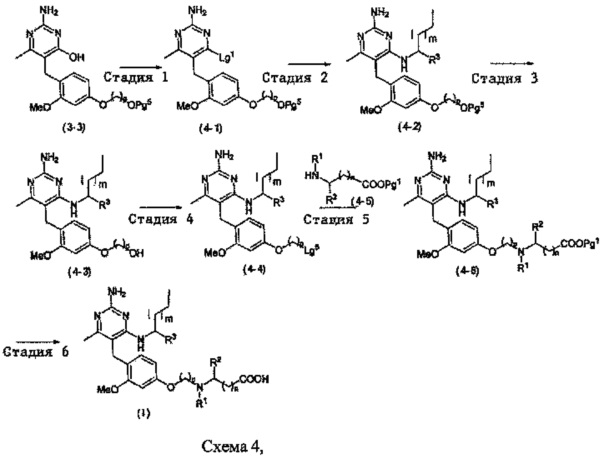
В качестве варианта, соединение формулы (I) может быть приготовлено с применением последовательности, показанной на Схеме 4:
где m, n, R1, R2 и R3 являются такими, как определено в формуле (I), p равно 2 или 3 и группы Lg1 и Lg5 могут независимым образом выбираться из обычных уходящих групп, известных специалистам в данной области, например, замещенных и незамещенных гидрокарбилсульфонилокси уходящих групп, таких как, например, п-толуолсульфонилокси, мезитиленсульфонилокси, 2,4,6-триизопропилбензолсульфонилокси и метансульфонилокси группы, а также галоидных уходящих групп, таких как, например, уходящие группы, представленные йодом, бромом или хлором. Группа Pg1 выбирается из защитных групп для карбоксильной группы, например, сложного эфира, такого как сложный метиловый эфир, сложный этиловый эфир или сложный трет-бутиловый эфир. Группа Pg5 выбирается из защитных групп для гидроксильной группы, например, триалкилсилильной группы, такой как, например, трет-бутилдиметилсилильная группа.
Стадия 1
Соединения формулы (4-1) могут быть приготовлены способом, подобным Стадии 7 из Схемы 3-1.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (4-1), как определено на Схеме 1, и их солей.
Стадия 2
Соединения формулы (4-2) могут быть приготовлены способом, подобным Стадии 10 из Схемы 3-2.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (4-2), как определено на Схеме 1, и их солей.
Стадия 3.
В случаях, когда R3 является гидроксиметилом или гидроксиэтилом, и гидроксильная группа не защищена, защита гидроксильной группы может быть обеспечена реакцией соединения формулы (4-2) с уксусным ангидридом или ацетилхлоридом в присутствии основания, такого как, например, триалкиламин, например, диизопропилэтиламин или триэтиламин, и каталитических количеств N,N-диметил-4-аминопиридина в подходящем растворителе, таком как, например, ТТФ, при подходящей температуре, например, при температуре в пределах от 10°C до 40°C, сопровождаемой депротектированием защитной группы Pg5 с использованием подходящего агента депротектирования. В случаях, когда Pg5 является триалкилсилильной группой, интермедиат может быть введен в реакцию с фторидом тетрабутиламмония в ТГФ при температуре в пределах от 0°C до 40°C с получением соединения формулы (4-3).
В качестве варианта, в случае, когда R3 не содержит свободной гидроксильной группы, соединения формулы (4-3) могут быть приготовлены способом, подобным Стадии 6 из Схемы 3-1.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (4-3), как определено на Схеме 1, и их солей.
Стадия 4
Соединения формулы (4-4) могут быть приготовлены способом, подобным Стадии 8 из Схемы 3-1.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (4-4), как определено на Схеме 1, и их солей.
Стадия 5
Соединения формулы (4-6) могут быть приготовлены способом, подобным Стадии 9 из Схемы 3-2.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (4-6), как определено на Схеме 1, и их солей.
Стадия 6
Соединения формулы (I) могут быть приготовлены посредством удаления защитной группы с карбоксильного фрагмента в присутствии основания, такого как, например, водный раствор гидроксида натрия, при температуре в пределах от 0°C до 40°C. В случаях, когда R3 является гидроксиметилом или гидроксиэтилом и гидроксильная группа защищена защитной группой, она также может быть удалена известными специалистам в данной области способами.
В случаях, когда гидроксильная группа в R3 защищена, такая защитная группа может быть, например, алкилэфирной группой, защитной группой на кремнийорганической основе или защитной группой на основе бензила.
В одном воплощении такая гидроксильная группа в R3 в формуле (1-10), формуле (2-5), формуле (2-6), формуле (2-7), формуле (3-11) или соединении с формулой
которое является исходным веществом для этих соединений, может быть защищена защитной группой на кремнийорганической основе или защитной группой на основе бензила. Защитная группа на кремнийорганической основе может быть три(C1-4алкил)силильной группой, например, триметилсилильной группой или трет-бутилдиметилсилильной группой. В одном воплощении R3 является трет-бутилдиметилсилилом.
В одном воплощении такая гидроксильная группа в R3 может быть защищена ацетильной группой, которая может быть удалена в щелочных условиях на последней стадии каждой из Схем.
Соединения формулы (1-8) могут быть коммерчески доступными или же могут быть приготовлены стандартными способами, известными специалистам в данной области. Например, когда R2 - водород или C1-4 алкил, соединения формулы (1-8) могут быть приготовлены согласно Схеме 5-1:
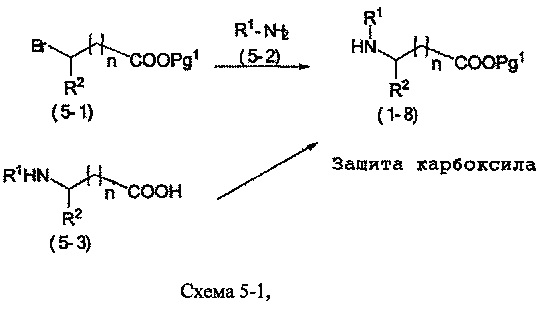
на которой n, R1 и R2 являются такими же, как определены в формуле (I), и группа Pg1 выбирается из защитных групп для карбоксильной группы, например, сложного эфира, такого как сложный метиловый эфир, сложный этиловый эфир или сложный трет-бутиловый эфир.
Соединения формулы (1-8) могут быть приготовлены реакцией соединения формулы (5-1) с соединением формулы (5-2) в присутствии основания, такого как, например, триалкиламин, например, триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как, например, ТГФ, ацетонитрил или дихлорметан, и при подходящей температуре, например, при температуре в пределах от 10°C до 40°C.
В качестве варианта, соединения формулы (1-8) могут быть приготовлены защитой карбоновой кислоты формулы (5-3), которая является коммерчески доступной или может быть приготовлена стандартным способом, известным специалистам в данной области. Когда n рано 1, соединения формулы (1-8) могут быть приготовлены реакцией алкилирования, как представлено на Схеме 5-2 ниже.
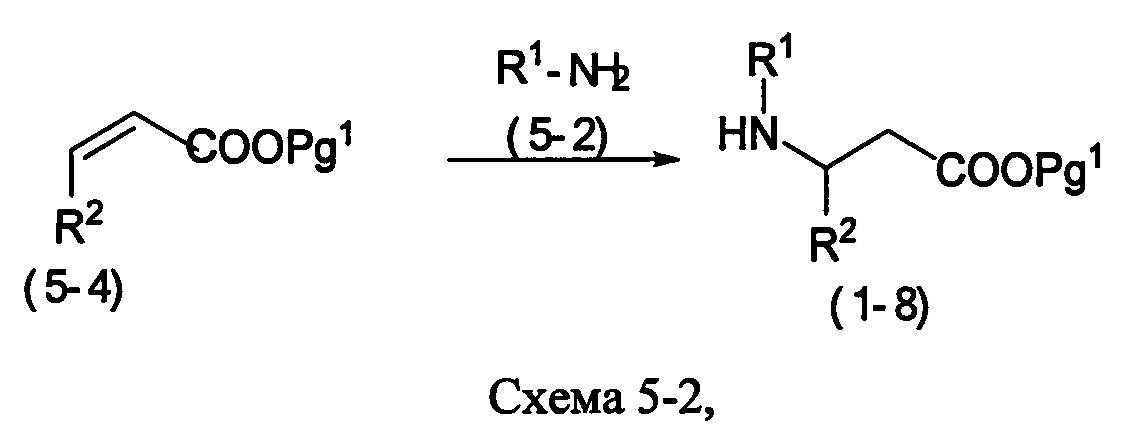
где R1 и R2 являются такими же, как определены в формуле (I), и группа Pg1 выбирается из защитных групп для группы карбоновой кислоты, например, сложного эфира, такого как сложный метиловый эфир, сложный этиловый эфир или сложный трет-бутиловый эфир.
Соединение формулы (5-4) может быть введено в реакцию с соединением формулы (5-2) в подходящем растворителе, таком как спирт, например, этанол, с получением соединения формулы (1-8).
В качестве варианта, соединение формулы (I) может быть приготовлено с применением последовательности, показанной на Схеме 6:
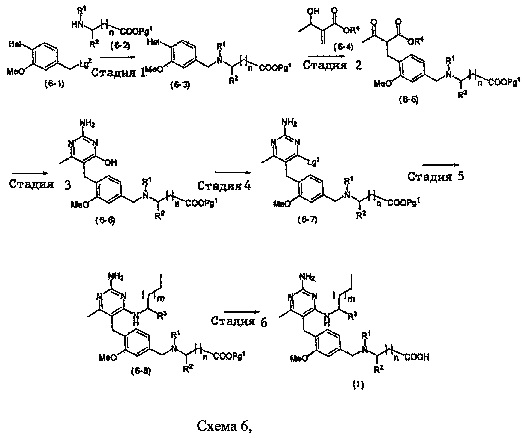
где m, n, R1, R2 и R3 являются такими, как определено в формуле (I), R4 выбирав из алкильной группы C1-4, группы Lg1 и Lg3 могут быть независимым образом выбраны обычных уходящих групп, известных специалистам в данной области, например, замещенных и незамещенных гидрокарбилсульфонилокси уходящих групп, таких как п-толуолсульфонилокси, мезитиленсульфонилокси, 2,4,6-триизопропилбензолсульфонилокси и метансульфонилокси группы, а также галоидных уходящих групп, таких как уходящие группы, представленные йодом, бромом или хлором. Группа Pg1 выбирается из защитных групп для карбоксильной группы, например, сложного эфира, такого как сложный метиловый эфир, сложный этиловый эфир или сложный трет-бутиловый эфир. Hal является бромом или йодом.
Стадия 1
Соединение формулы (6-3) может быть приготовлено стандартной реакцией N-алкилирования с помощью соединения формулы (6-1) с соединением формулы (6-2) в присутствии основания, такого как бикарбонат калия, бикарбонат натрия, карбонат натрия, карбонат калия, триэтиламин или N,N-диизопропилэтиламин, при необходимости с йодидом калия или йодидом натрия, в подходящем растворителе, таком как ацетонитрил, диметилформамид и диметилацетамид, при температуре, например, в пределах от 0°C до 100°C.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (6-3), как определено на Схеме 6, и их солей.
Стадия 2
Соединение формулы (6-5) может быть приготовлено реакцией Хека между соединением формулы (6-3) и соединением формулы (6-4). Такая реакция может быть проведена с помощью палладиевого катализатора, такого как Pd(OAc)2 или 1,1'-бис(ди-трет-бутилфосфино)ферроцен дихлорид палладия, основания, такого как бикарбонат калия, бикарбонат натрия, карбонат натрия, карбонат калия или дициклогексилметиламин, и соли аммония, такой как тетрабутиламмонийхлорид или тетрабутиламмонийбромид. Реакция может быть выполнена в подходящем растворителе, таком как тетрагидрофуран или диметилацетамид, при температуре, например, в пределах от 50°C до 150°C.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (6-3), как определено на Схеме 6, и их солей.
Стадия 3
Соединение формулы (6-6) может быть приготовлено способом, подобным Стадии 2 на Схеме 1.
Стадия 4
Соединение формулы (6-7) может быть приготовлено способом, подобным Стадии 4 на Схеме 1.
Стадия 5
Соединение формулы (6-8) может быть приготовлено способом, подобным Стадии 7 на Схеме 1.
Стадия 6
Соединение формулы (I) может быть приготовлено способом, подобным Стадии 8 на Схеме 1. В случаях, когда R3 является гидроксиметилом или гидроксиэтилом и гидроксильная группа защищена защитной группой, она также может быть удалена известными специалистам в данной области способами.
Понятно, что в некоторых из упомянутых здесь реакций может быть необходимо или желательно защитить любые чувствительные группы в соединениях. Примеры того, когда защита необходима или желательна, а также подходящие способы осуществления такой защиты известны специалистам в данной области. Могут применяться общеизвестные защитные группы в соответствии со стандартной практикой (для иллюстрации см. T.W. Green Protective Groups in Organic Synthesis («Защитные группы в органическом синтезе»), 3-е издание, John Wiley and Sons, 1999). Таким образом, если реагенты включают такие группы, как амино-, карбокси- или гидроксигруппы, в некоторых из упомянутых здесь реакций может быть желательным обеспечение защиты такой группы.
Описанные здесь соединения могут оказаться интермедиатами, подходящими для приготовления соединений формулы (I), и могут быть выделены в виде свободного основания/кислоты или в форме соли. Поэтому в некоторых аспектах и воплощениях настоящего раскрытия обеспечивается описанный здесь интермедиат или его соль, при этом любая из вариабельных групп, описанных для указанного интермедиата, может принимать любую из величин, описанных здесь в отношении такой группы.
Неограничивающие примеры подходящих фармацевтически приемлемых солей соединения формулы (I) включают кислотно-аддитивные соли соединения формулы (I), например, кислотно-аддитивные соли с неорганической или органической кислотой, такой как, например, соляная кислота, бромистоводородная кислота, серная кислота, трифторуксусная кислота, лимонная кислота, малеиновая кислота, аспарагин или глютамин. Неограничивающие примеры подходящих фармацевтически приемлемых солей соединения формулы (I) также включают соли присоединения основания соединения формулы (I), например, соли присоединения основания с неорганическим или органическим основанием, такие как, например, натриевая соль, калиевая соль, метиламин или 2-аминоэтанол.
По меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей настоящего раскрытия, может применяться в форме пролекарства, то есть соединения, которое распадается в организме человека или животного с высвобождением соединения или соли настоящего раскрытия. Пролекарство может применяться в целях изменения физических свойств и/или фармакокинетических свойств по меньшей мере одного аспекта настоящего раскрытия. Пролекарство может быть образовано, когда по меньшей мере один аспект настоящего раскрытия содержит по меньшей мере одну подходящую группу и/или заместитель, к которому может быть присоединена по меньшей мере одна модифицирующая свойства группа. Неограничивающие примеры пролекарств включают in vivo расщепляемые амидные производные, которые могут быть образованы, например, по меньшей мере на одной аминогруппе по меньшей мере в одном аспекте, выбранном из соединений формулы (I) и их фармацевтически приемлемых солей.
Соответственно, настоящее раскрытие включает такие соединения формулы (I), как определено выше, и их фармацевтически приемлемые соли в условиях их предоставления средствами органического синтеза и обеспечения внутри организма человека или животного вследствие расщепления их пролекарства. Соответственно, настоящее изобретение включает такие соединения формулы (I), которые готовятся средствами органического синтеза, а также такие соединения, которые продуцируются в организме человека или животных посредством метаболизма соединения-предшественника, то есть соединение формулы (I) может быть синтетически получаемым соединением или метаболически продуцируемым соединением.
Неограничивающим примером подходящего фармацевтически приемлемого пролекарства соединения формулы (I) является такое, которое основывается на разумной медицинской аттестации в качестве являющегося подходящим для введения в организм человека или животного без проявлений нежелательной фармакологической активности и без неспецифической токсичности.
Различные формы пролекарств были описаны, например, в следующих источниках:
a) Methods in Enzymology («Методы энзимологии»), том 42, стр. 309-396, под редакцией K. Widder и др. (Academic Press, 1985);
b) Design of Pro-drugs («Создание пролекарств»), под редакцией Н. Bundgaard, (Elsevier, 1985);
c) Textbook of Drug Design and Development («Руководство по разработке и созданию лекарственных средств»), под редакцией Krogsgaard-Larsen и Н. Bundgaard, Глава 5 "Design and Application of Pro-drugs" («Разработка и применение пролекарств»), Н. Bundgaard, стр. 113-191 (1991);
d) Н. Bundgaard Advanced Drug Delivery Reviews («Перспективные обзоры доставки лекарственных средств»), 8,1-38 (1992);
e) Н. Bundgaard и др., Journal of Pharmaceutical Sciences, 77,285 (1988);
f) N. Kakeya и др., Chem. Pharm. Bull., 32, 692 (1984);
g) T. Higuchi и V. Stella "Pro-Drugs as Novel Delivery Systems" («Пролекарства как новые системы доставки»), материалы симпозиумов A.C.S., том 14; и h) Е. Roche (редактор) "Bioreversible Carriers in Drug Design" («Биообратимые носители при разработке лекарственных средств»), Pergamon Press, 1987.
Одним неограничивающим примером подходящего фармацевтически приемлемого пролекарства соединения формулы (I), которое содержит аминогруппу, является его in vivo расщепляемое амидное производное. Неограничивающие примеры подходящих фармацевтически приемлемых амидов из аминогруппы включают амид, образованный с C1-10 алканоил-группой, такой как, например, ацетильная группа, бензоильная группа, фенилацетильная группа, замещенная бензоильная группа и замещенная фенилацетильная группа. Неограничивающие примеры циклических заместителей на фенилацетильной и бензоильной группах включают аминометил, N-алкиламинометил, N,N-диалкиламинометил, морфолинометил, пиперазин-1-илметил и 4-(C1-4 алкил)пиперазин-1-илметил.
In vivo эффекты соединения формулы (I) могут частично проявляться одним или несколькими метаболитами, образующимися в организме человека или животного после введения соединения формулы (I). Как указывалось выше, in vivo эффекты соединения формулы (I) могут также проявляться вследствие метаболизма соединения-предшественника (пролекарства).
Согласно одному воплощению настоящего раскрытия обеспечивается фармацевтическая композиция, которая содержит по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, как определено выше, в сочетании с по меньшей мере одним фармацевтически приемлемым растворителем или носителем. Такая фармацевтическая композиция может применяться в терапии рака. Композиция может быть в форме, подходящей для перорального приема, например, в виде таблетки или капсулы; для парентеральных инъекций (включая внутривенные, подкожные, внутримышечные, внутрисосудистые или инфузии) в виде стерильного раствора, суспензии или эмульсии; для местного применения, например, в виде мази или крема; или для ректального введения, например, в виде свечей.
По меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, может также применяться в виде спрея для ингаляций. Рецептура для воздушного распыления (например, спрей, аэрозоль, сухой порошкообразный препарат и т.д.) может быть при необходимости разработана в виде водного раствора или суспензии, или в форме аэрозоля, высвобождающегося из находящейся под давлением упаковки, такой как находящийся под давлением дозирующий ингалятор, с использованием, например, сжиженного пропеллента. Также может применяться сухой порошкообразный препарат. Подходящий для ингаляции аэрозоль может быть или суспензией, или раствором, и в типичном случае содержал бы по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей и любого подходящего пропеллента(-ов), такого как, например, фторзамещенный углеводород, или содержащий водород хлорфторуглерод, или их смеси. Например, он может содержать гидрофторалкан, такой как 1,1,1,2-тетрафторэтан, гептафторалкан (HFA), такой как 1,1,1,2,3,3,3-гептафтор-н-пропан, или их смеси. Аэрозоль может при необходимости содержать препарат дополнительного известного специалистам в данной области инертного наполнителя, такого как поверхностно-активное вещество (например, олеиновая кислота или лецитин) и сорастворитель (например, этанол), и т.д. Например, препарат аэрозоля может доставляться с помощью ингалятора, известного как "TURBUHALER™".
Для перорального приема по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей настоящего раскрытия, может быть смешан с по меньшей мере одним вспомогательным средством и/или носителем, выбранным, например, из лактозы, сахарозы, сорбита, маннита; крахмала, например, картофельного крахмала, кукурузного крахмала или амилопектина; производных целлюлозы; связующих веществ, например, желатина или поливинилпирролидона; и/или смазочных веществ, например, стеарата магния, стеарата кальция, полиэтиленгликолей, восков, парафинов и других подобных, и после этого спрессован в таблетки. Если желательны таблетки в оболочке, сердцевины, приготовленные как описано выше, могут быть покрыты концентрированным сахарным раствором, который может содержать, например, аравийскую камедь, желатин, тальк и диоксид титана. В качестве варианта, таблетка может быть покрыта подходящим полимером, растворенным в легколетучем органическом растворителе.
Для приготовления мягких желатиновых капсул по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей настоящего раскрытия может быть смешан, например, с растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы по меньшей мере одного аспекта, использующего любые вышеупомянутые инертные наполнители для таблеток. Также в твердые желатиновые капсулы могут заполняться жидкие или полутвердые рецептуры по меньшей мере одного аспекта настоящего раскрытия. Жидкие препараты для перорального приема могут быть в форме сиропов или суспензий, например, в форме растворов, содержащих по меньшей мере один аспект настоящего раскрытия, с остальной частью, представленной сахаром и смесью этанола, воды, глицерина и пропиленгликоля. При необходимости такие жидкие препараты могут содержать красители, ароматизирующие вещества, сахарин, карбоксиметилцеллюлозу в качестве загустителя и/или другие инертные наполнители, известные специалистам в данной области.
По меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, может вводиться субъекту, такому как теплокровное животное, в унифицированной дозе в пределах от 5 мг/м2 до 5000 мг/м2 площади тела животного, то есть приблизительно в пределах от 0,1 мг/м2 до 100 мг/кг, и это может обеспечивать терапевтически эффективную дозу. О дозах сообщается, исходя из массы соединения формулы (I). Форма унифицированной дозы, такой как таблетка или капсула, обычно будет содержать активный ингредиент, например, соединение формулы (I), в количестве, например, от 1 мг до 250 мг. Например, может использоваться суточная доза в диапазоне от 1 мг/кг до 50 мг/кг. Однако суточная доза будет обязательно различаться в зависимости от получающего лечение организма, конкретного пути введения и тяжести излечиваемого заболевания. Соответственно, оптимальная дозировка может быть определена практикующим врачом, обеспечивающим лечение данного конкретного пациента.
За дополнительной информацией о способах введения и дозировках читатель отсылается к главе 25.3 в томе 5 Comprehensive Medicinal Chemistry («Полная медицинская химия»), (председатель редакционной коллегии Corwin Hansch), Pergamon Press 1990.
В контексте настоящего описания термин «терапия» также включает и профилактику, если нет прямых указаний на противоположное. Термины «терапевтический» и «терапевтически» должны рассматриваться соответственно.
В данном контексте термин «терапия» предназначается для восприятия в его обычном повседневном значении касательства заболевания в целях полного или частичного ослабления его одного, некоторых или всех симптомов, или устранения либо компенсации лежащей в основе патологии.
В данном контексте термин «профилактика» предназначается для восприятия в его обычном повседневном значении и включает первичную профилактику в целях предотвращения развития заболевания и вторичную профилактику, когда заболевание уже развилось, и пациент временно или постоянно защищается против обострения или ухудшения заболевания, или развития новых, связанных с заболеванием симптомов.
По меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, настоящего раскрытия может быть эффективным активатором TLR7 in vitro. Соответственно, можно ожидать, что по меньшей мере один аспект настоящего раскрытия будет потенциально полезным средством для применения в терапии или профилактике заболеваний, или медицинских состояний, индивидуально или частично опосредуемых TLR7. Например, следующие (без ограничения) заболевания и состояния, перечисленные ниже в абзацах 1-8, могут быть поддающимися терапии соединениями настоящего раскрытия.
1. Дыхательные пути: обструктивные заболевания дыхательных путей, включающие астму, включая бронхиальную, аллергическую, эндогенную, экзогенную, вызванную физической нагрузкой, лекарственную (включая индуцированную аспирином и NSAID (нестероидные противовоспалительные препараты)) и вызываемую пылью астму, как перемежающуюся, так и стойкую, любых степеней тяжести, а также обусловленную другими причинами гиперчувствительности дыхательных путей; хроническое обструктивное заболевание легких (COPD); бронхит, включая инфекционный и эозинофильный бронхит; эмфизему; расширение бронхов; муковисцедоз; саркоидоз; легкое фермера и связанные заболевания; гиперчувствительный пневмонит; фиброз легкого, включая криптогенный фиброзирующий альвеолит, идиопатические интерстициальные пневмонии, фиброзные осложнения противоопухолевой терапии и хронической инфекции, включая туберкулез, аспергиллез и другие микозы; осложнения после трансплантации легкого; васкулитические и тромбические расстройства сосудистой сети легкого и легочную гипертензию; противокашлевую активность, включая терапию хронического кашля, ассоциированного с воспалительными и секреторными состояниями дыхательных путей, и ятрогенный кашель; острый и хронический ринит, включая медикаментозный ринит и вазомоторный ринит; круглогодичный и сезонный аллергический ринит, включая rhinitis nervosa (сенная лихорадка)); полипоз носа; острую вирусную инфекцию, включающую простуду и инфекцию, обусловленную респираторно-синцитиальным вирусом, вирусом гриппа, коронавирусом (включая SARS (тяжелый острый респираторный синдром)) и аденовирусом;
2. Кожа: псориаз, атонический дерматит, контактный дерматит или другие экзематозные дерматозы и реакции гиперчувствительности замедленного типа; фито- и фотодерматит; себорейная экзема, герпетический дерматит, красный плоский лишай, склеротический атрофический лишай, гангренозная пиодермия, саркоид кожи, дискоидная красная волчанка, пузырчатка, пемфигоид, буллезный эпидермолиз, крапивница, ангионевротический отек, васкулиты, токсические эритемы, кожные эозинофилии, гнездная алопеция, облысение по мужскому типу, синдром Свита, синдром Вебера-Христиана, мультиформная эритема, как инфекционная, так и неинфекционная; панникулит; кожные лимфомы, немеланомный рак кожи и другие диспластические поражения; расстройства, индуцированные лекарственными средствами, включая стойкие лекарственные сыпи.
3. Глаза: блефарит; конъюнктивит, включая хронический и весенний аллергический конъюнктивит; ирит; передний и задний увеит; хориоидит; аутоиммунные, дегенеративные или воспалительные расстройства, поражающие сетчатку; офтальмит, включая симпатический офтальмит; саркоидоз; инфекции, включая вирусные, грибковые и бактериальные.
4. Мочеполовая система: нефрит, включая интерстициальный и гломерулонефрит; нефротический синдром; цистит, включая острый и хронический (интерстициальный) цистит и язву Ханнера; острый и хронический уретрит, простатит, эпидидимит, оофорит и сальпингит; вульвовагинит; болезнь Пейрони; эректильная дисфункция (как мужская, так и женская).
5. Отторжение аллотрансплантата: острое и хроническое, следующее, например, за трансплантацией почки, сердца, печени, легкого, костного мозга, кожи или роговицы, или после переливания крови; или хроническая реакция «трансплантат против хозяина».
6. Другие аутоиммунные и аллергические расстройства, включая ревматоидный артрит, синдром раздраженного кишечника, системную красную волчанку, рассеянный склероз, тиреоидит Хашимото, болезнь Грейвса (диффузный токсический зоб), болезнь Аддисона, сахарный диабет, идиопатическая тромбоцитопеническая пурпура, эозинофильный фасциит, синдром гиперпродукции IgE, антифосфолипидный синдром и ретикулез Сезари.
7. Онкология: терапия рака, включая опухоли мочевого пузыря, головы и шеи, простаты, молочной железы, легких, яичника, поджелудочной железы, кишечника и толстой кишки, колоректальные, желудка, кожи, почек, ренальные, пищевода, печени, матки, щитовидной железы, мозга, желчных протоков и опухоли головного мозга и злокачественные образования, поражающие костный мозг (включая лейкозы) и лимфопролиферативные системы, такие как лимфома Ходжкина и неходжкинская лимфома; включая предупреждение и лечение метастатических заболеваний, опухолевых рецидивов и паранеопластических синдромов; и
8. Инфекционные болезни: вирусные заболевания, такие как остроконечная кондилома, обыкновенные бородавки, роговые бородавки, гепатит B, гепатит C, вирус простого герпеса, контагиозный моллюск, оспа, вирус иммунодефицита человека (HTV), вирус папилломы человека (HPV), цитомегаловирус (CMV), вирус ветряной оспы (VZV), риновирус, аденовирус, коронавирус, грипп, парагрипп; бактериальные заболевания, такие как туберкулез и микобактериальный комплекс Mycobacterium avium, лепра; другие инфекционные болезни, такие как грибковые заболевания, вызываемые микроорганизмами хламидия, кандида, аспергиллюс, криптококковый менингит, плазмоклеточная пневмония, криптоспоридиоз, гистоплазмоз, токсоплазмоз, трипаносомная инфекция и лейшманиоз.
Предусматривается, что для упоминаемых здесь способов терапии или профилактики по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, будет применяться к млекопитающему, такому как человек. Аналогичным образом, для применений по меньшей мере одного аспекта, выбранного из соединений формулы (I) и их фармацевтически приемлемых солей, в целях терапии или профилактики упоминаемых здесь заболеваний или медицинских состояний предусматривается, что по меньшей мере один аспект будет применяться к млекопитающему, такому как человек.
Поэтому, согласно другому аспекту настоящего раскрытия, обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, предназначаемый для применения в качестве лекарственного препарата.
Согласно следующему аспекту настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, предназначаемый для применения в терапии или профилактике заболевания, опосредуемого TLR7. В одном воплощении настоящего раскрытия указанное опосредуемое TLR7 заболевание является раком. Также предполагается, что соединение формулы (I) или его фармацевтически приемлемые соли будут полезными в терапии или профилактике метастаз, рецидивов опухолей и паранеопластического синдрома.
В дальнейшем воплощении настоящего раскрытия указанный рак выбирается из рака мочевого пузыря, раковых образований головы и шеи, рака простаты, рака молочной железы, рака легкого, рака матки, рака поджелудочной железы, рака печени, рака почки, рака яичников, рака толстой кишки, рака желудка, рака кожи, рака костей, рака щитовидной железы, рака желчных протоков, опухоли головного мозга, миеломной болезни и лимфопролиферативных опухолей. В одном воплощении настоящего раскрытия указанное опосредуемое TLR7 заболевание является астмой, COPD, аллергическим ринитом, аллергическим конъюнктивитом, аллергическим дерматитом, гепатитом B, гепатитом C, HIV, HPV, бактериальными инфекциями или дерматозом.
Согласно следующему аспекту настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, предназначаемый для применения в терапии или профилактике заболевания, опосредуемого TLR7. В одном воплощении настоящего раскрытия указанное опосредуемое TLR7 заболевание является раком. В дальнейшем воплощении настоящего раскрытия указанный рак выбирается из рака мочевого пузыря, раковых образований головы и шеи, рака простаты, рака молочной железы, рака легкого, рака матки, рака поджелудочной железы, рака печени, рака почки, рака яичников, рака толстой кишки, рака желудка, рака кожи, рака костей, рака щитовидной железы, рака желчных протоков, опухолей головного мозга, миеломной болезни и лимфопролиферативных опухолей. В одном воплощении настоящего раскрытия указанное опосредуемое TLR7 заболевание является астмой, COPD, аллергическим ринитом, аллергическим конъюнктивитом, аллергическим дерматитом, гепатитом B, гепатитом C, HIV, HPV, бактериальными инфекциями или дерматозом.
Согласно следующему аспекту настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, предназначаемый для применения в терапии или профилактике рака. В дальнейшем воплощении настоящего раскрытия указанный рак выбирается из рака мочевого пузыря, раковых образований головы и шеи, рака простаты, рака молочной железы, рака легкого, рака матки, рака поджелудочной железы, рака печени, рака почки, рака яичников, рака толстой кишки, рака желудка, рака кожи, опухолей головного мозга, миеломной болезни и лимфопролиферативных опухолей.
Согласно следующему аспекту настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, предназначаемый для применения в терапии или профилактике астмы, COPD, аллергического ринита, аллергического конъюнктивита, аллергического дерматита, гепатита B, гепатита C, HIV, HPV, бактериальных инфекций или дерматоза.
В одном аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, предназначенный для применения в терапии рака.
Согласно следующему аспекту настоящего раскрытия обеспечивается способ применения по меньшей мере одного аспекта, выбранного из соединений формулы (I) и их фармацевтически приемлемых солей, для терапии или профилактики рака. Поэтому, соответственно, обеспечивается способ терапии или профилактики рака у нуждающегося в такой терапии или профилактике субъекта, такого как теплокровное животное, кроме того, такого как человек, который содержит введение указанному субъекту терапевтически эффективного количества по меньшей мере одного аспекта, выбранного из указанных здесь соединений формулы (I) и их фармацевтически приемлемых солей. В одном воплощении настоящего раскрытия указанный рак выбирается из рака мочевого пузыря, раковых образований головы и шеи, рака простаты, рака молочной железы, рака легкого, рака матки, рака поджелудочной железы, рака печени, рака почки, рака яичников, рака толстой кишки, рака желудка, рака кожи, рака костей, рака щитовидной железы, рака желчных протоков, опухолей головного мозга, миеломной болезни и лимфопролиферативных опухолей.
Согласно следующему аспекту настоящего раскрытия обеспечивается способ применения по меньшей мере одного аспекта, выбранного из соединений формулы (I) и их фармацевтически приемлемых солей, для терапии или профилактики астмы, COPD, аллергического ринита, аллергического конъюнктивита, аллергического дерматита, гепатита B, гепатита C, HIV, HPV, бактериальных инфекций или дерматоза.
Согласно следующему аспекту настоящего раскрытия обеспечивается способ терапии или профилактики у человека, страдающего заболеванием, при котором оказывается полезной активация TLR7, содержащий этапы введения нуждающемуся в этом человеку терапевтически эффективного количества по меньшей мере одного аспекта, выбранного из соединений формулы (I) и их фармацевтически приемлемых солей. В одном воплощении настоящего раскрытия заболевание, при котором оказывается полезной активация TLR7, является раком. В дальнейшем воплощении настоящего раскрытия указанный рак выбирается из рака мочевого пузыря, раковых образований головы и шеи, рака простаты, рака молочной железы, рака легкого, рака матки, рака поджелудочной железы, рака печени, рака почки, рака яичников, рака толстой кишки, рака желудка, рака кожи, рака костей, рака щитовидной железы, рака желчных протоков, опухолей головного мозга, миеломной болезни и лимфопролиферативных опухолей. В одном воплощении настоящего раскрытия заболевание, при котором оказывается полезной активация TLR7, является астмой, COPD, аллергическим ринитом, аллергическим конъюнктивитом, аллергическим дерматитом, гепатитом B, гепатитом C, HIV, HPV, бактериальными инфекциями или дерматозом.
В любом описанном здесь аспекте или воплощении рак может быть раком мочевого пузыря.
В любом описанном здесь аспекте или воплощении рак может быть раковым образованием головы и шеи.
В любом описанном здесь аспекте или воплощении рак может быть раком простаты.
В любом описанном здесь аспекте или воплощении рак может быть раком молочной железы.
В любом описанном здесь аспекте или воплощении рак может быть раком легких.
В любом описанном здесь аспекте или воплощении рак может быть раком матки.
В любом описанном здесь аспекте или воплощении рак может быть раком поджелудочной железы.
В любом описанном здесь аспекте или воплощении рак может быть раком печени.
В любом описанном здесь аспекте или воплощении рак может быть раком почки.
В любом описанном здесь аспекте или воплощении рак может быть раком яичников.
В любом описанном здесь аспекте или воплощении рак может быть раком толстой кишки.
В любом описанном здесь аспекте или воплощении рак может быть раком желудка.
В любом описанном здесь аспекте или воплощении рак может быть раком кожи.
В любом описанном здесь аспекте или воплощении рак может быть раком костей.
В любом описанном здесь аспекте или воплощении рак может быть раком щитовидной железы.
В любом описанном здесь аспекте или воплощении рак может быть раком желчных протоков.
В любом описанном здесь аспекте или воплощении рак может быть опухолью головного мозга.
В любом описанном здесь аспекте или воплощении рак может быть миеломной болезнью.
В любом описанном здесь аспекте или воплощении рак может быть лимфопролиферативной опухолью.
Определенная здесь противоопухолевая терапия или профилактика может применяться в качестве монотерапии или же может включать в дополнение к соединениям настоящего раскрытия общепринятые хирургические способы, или лучевую терапию, или химиотерапию.
Такие общепринятые хирургические способы могут применяться до или после терапии с соединением изобретения.
Такая лучевая терапия может применяться параллельно, одновременно, последовательно или отдельно от терапии с соединением изобретения и может включать одну или более наружных дистанционных лучевых терапий, внутреннюю лучевую терапию или системную лучевую терапию с применением радиоактивного вещества, такого как меченное изотопом моноклональное антитело.
В следующем аспекте изобретения обеспечивается комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и лучевую терапию, в целях применения для терапии рака.
В следующем аспекте изобретения обеспечивается способ терапии рака у нуждающегося в такой терапии теплокровного животного, такого как человек, которая содержит введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли в комбинации с эффективным количеством лучевой терапии.
Такая химиотерапия может применяться параллельно, одновременно, последовательно или отдельно от терапии с соединением изобретения и может включать одну или несколько следующих неограничивающих категорий антиопухолевых средств:
(i) Другие антипролиферативные/противоопухолевые препараты и их комбинации, используемые в терапевтической онкологии, такие как алкилирующие агенты (например, цисплатин, оксалиплатин, карбоплатин, мириплатин, циклофосфамид, азотистый иприт, мелфалан, хлорамбуцил, бисульфан, бендамустин, темозоломид и нитрозомочевина); антиметаболиты (например, гемцитабин и антифолаты, такие как фторпиримидины, например, 5-фторурацил и тегафур, ралтитрексед, метотрексат, арабинозид цитозина, гидроксикарбамид и аналоги пурина, такие как флударабин); противоопухолевые антибиотики (например, антрациклины, такие как адриамицин, блеомицин, доксорубицин, дауномицин, эпирубицин, амрубицин, идарубицин, митомицин C, дактиномицин и митрамицин); антимитотические средства (например, алкалоиды барвинка, такие как винкристин, винбластин, виндезин и винорелбин и таксоид, такие как таксол и таксотер, и ингибиторы Polo-подобной киназы); а также ингибиторы топоизомеразы (например, эпидофиллотоксины, такие как этопозид и тенипозид, амсакрин, топотекан и камптотецин);
(ii) цитостатические средства, такие как антиэстрогены (например, тамоксифен, фулвестрант, торемифен, ралоксифен, дролоксифен и йодоксифен), антиандрогены (например, бикалутамид, флутамид, нилутамид и ципротерон ацетат), антагонисты андрогенового рецептора MDV3100 или ARN-509, которые предотвращают ядерную транслокацию андрогенового рецептора и его присоединение к ДНК или к белкам-коактиваторам, ингибиторы CYP17A1, такие как абиратерон (ZYTIGA™) и смешанные ингибиторы функции андрогенового рецептора и CYP17A1, такие как TOK-001 (галетерон), антагонисты LHRH или агонисты LHRH (например, гозерелин, лейпрорелин и бусерелин), прогестогены (например, мегестрол ацетат), ингибиторы ароматазы (такие как, например, анастрозол, летрозол, ворозол и эксеместан) и ингибиторы 5α-редуктазы, такие как финастерид;
(iii) антиинвазивные средства, например, ингибиторы c-Src-семейства киназ, такие как 4-(6-хлор-2,3-метилендиоксианилино)-7-[2-(4-метилпиперазин-1-ил)этокси]-5-тетрагидропиран-4-илоксихиназолин (AZD0530; международная патентная заявка WO 01/94341), N-(2-хлор-6-метилфенил)-2-{6-[4-(2-гидроксиэтил)пиперазин-1-ил]-2-метилпиримидин-4-иламино}тиазол-5-карбоксамид (дазатиниб, BMS-354825; J. Med. Chem., 2004, 47, 6658-6661) и босутиниб (SKI-606) и ингибиторы металлопротеиназы, такие как маримастат, ингибиторы функции рецептора урокиназного активатора плазминогена или антитела к гепараназе;
(iv) ингибиторы функции фактора роста: такие ингибиторы включают, например, антитела фактора роста и антитела рецептора фактора роста (например, анти-erbB2 антитело трастузумаб [Herceptin™], анти-EGFR антитело панитумумаб, анти-erbB1 антитело цетуксимаб [Erbitux, C225] и любые факторы роста или антитела рецептора фактора роста, раскрытые Stern и др. Critical reviews in oncology/haematology, 2005, том 54, стр. 11-29); такие ингибиторы также включают ингибиторы тирозинкиназы, например, ингибиторы семейства эпидермального фактора роста (например, ингибиторы тирозинкиназы семейства EGFR, такие как N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)хиназолин-4-амин (гефинитиб, ZD1839), N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI 774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)-хиназолин-4-амин (CI 1033), erbB2 ингибиторы тирозинкиназы, такие как лапатиниб); ингибиторы семейства фактора роста гепатоцитов; ингибиторы семейства фактора роста инсулина; ингибиторы семейства тромбоцитарного фактора роста, такие как иматиниб и/или нилотиниб (AMN107); ингибиторы серин/треонин киназ (например, ингибиторы сигнальных путей Ras/Raf, такие как фарнезил, ингибиторы трансферазы, например, сорафениб (BAY 43-9006), типифарниб (R115777), ингибитор BRAF (вемурафениб) и лонафарниб (SCH66336)), ингибиторы МЕК клеточных сигнальных путей (например, селуметиниб) и/или АКТ киназ, с-KIT ингибиторы, ингибиторы abl киназы, ингибиторы PI3 киназы, ингибиторы Plt3 киназы, ингибиторы CSF-1R киназы, ингибиторы киназы рецептора IGF (инсулиноподобный фактор роста); ингибиторы аврора-киназы (например, AZD1152, РН739358, VX-680, MLN8054, R763, МР235, МР529, VX-528 И АХ39459) и ингибиторы циклин-зависимой киназы, такой как CDK2, и/или ингибиторы CDK4;
(v) антиангиогенные средства, такие как ингибирующие действие фактора роста эндотелия сосудов (например, ингибитор фактора роста эндотелия сосудов антитело бевацизумаб (AVASTIN™) и, например, ингибитор VEGF-рецептора тирозинкиназы, такой как вандетаниб (ZD6474), ваталаниб (PTK787), сунитиниб (SU11248), акситиниб (AG-013736), пазопаниб (GW 786034) и 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171; пример 240 патентной заявки WO 00/47212), такие соединения, как раскрытые в международных патентных заявках WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354, и соединения, которые действуют по другим механизмам (например, линомид, ингибиторы функции интегрина αvβ3 и ангиостатин);
(vi) сосудоразрушающие агенты, такие как комбретастатин А4 и соединения, раскрытые в международных патентных заявках WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213;
(vii) антагонист рецепторов эндотелина, например, зиботентан (ZD4054) или атрасентан;
(viii) антисмысловые терапии, например, нацеленные на упоминаемые выше мишени, такие как ISIS 2503, антисенс anti-ras;
(ix) подходы генотерапии, включая, например, способы с заменой аберратных генов, таких как аберрантный р53 или аберрантный BRCA1, или BRCA2, GDEPT (ген, направленный на ферментативную пролекарственную терапию), такие подходы как применяющие цитозиндеаминазу, тимидинкиназу или фермент бактериальной нитроредуктазы, и подходы по увеличению переносимости пациентами химиотерапии или лучевой терапии, такие генотерапия мультилекарственной резистентности; и
(х) иммунотерапевтические подходы, включая, например, способы ингибирования контрольных сигналов иммунитета, такие как с применением анти-CTLA4 антитела ипилимумаб (Yervoy™), анти-CTLA4 антитела (MEDI-1123), анти-PD1 антитела (BMS 936558 или MK3475) или анти-PDL1 антитела (BMS-936559), подходы, стимулирующие иммунный ответ, такие как с применением анти-CD40 антитела (HCD-122), анти-ОХ-40 антитела или анти-4-1BB антитела (BMS-663513 или PF-05082566), подходы, вызывающие апоптоз, такие как с применением анти-TRAIL антитела (AMG-951), анти-TRAIL-R1 антитела (HGS-ETR1) или анти-TRAIL-R2 антитела (AMG-655), ex vivo и in vivo подходы, подразумевающие увеличение иммуногенности опухолевых клеток пациента, такие как трансфекция цитокинами, например, интерлейкином-2, интерлейкин-4 или гранулоцитарно-моноцитарный колониестимулирующий фактор, подходы с уменьшением анергии Т-клеток, подходы с использованием трансфицированных иммуноцитов, таких как цитокин-трансфицированные дендритные клетки, подходы с использованием трансфицированных цитокинами линий опухолевых клеток и подходы, использующие антиидиотипические антитела, подходы со снижением функции иммуносупрессорных клеток, таких как регуляторные Т-лимфоциты, миелоидзависимых супрессорных клеток или экспрессирующих IDO (индолеамин-2,3-деоксигеназа) дендритных клеток и подходы с применением противораковых вакцин, состоящих из белков или пептидов, полученных из ассоциированных с опухолью антигенов, таких как NY-ESO-1, MAGE-3, WT1 или Her2/neu.
Согласно другому аспекту настоящего раскрытия обеспечивается фармацевтический продукт, содержащий по меньшей мере один аспект, выбранный из указанных здесь соединений формулы (I) и их фармацевтически приемлемых солей, и по меньшей мере одно указанное здесь дополнительное противоопухолевое вещество для совместной терапии рака.
Согласно этому аспекту настоящего раскрытия обеспечивается фармацевтический продукт, содержащий по меньшей мере один аспект, выбранный из указанных здесь соединений формулы (I) и их фармацевтически приемлемых солей, и по меньшей мере одно указанное здесь дополнительное противоопухолевое вещество для совместной терапии рака.
Согласно этому аспекту настоящего раскрытия обеспечивается фармацевтический продукт, содержащий по меньшей мере один аспект, выбранный из указанных здесь соединений формулы (I) и их фармацевтически приемлемых солей, и по меньшей мере одно дополнительное противоопухолевое вещество для совместной терапии рака.
Согласно этому аспекту настоящего раскрытия обеспечивается комбинация, подходящая для применения в терапии рака, содержащая по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, и по меньшей мере одно противоопухолевое средство, выбранное из противоопухолевых средств, перечисленных выше под п.п. (i) - (ix).
Согласно этому аспекту изобретения обеспечивается комбинация, подходящая для применения в терапии рака, содержащая соединение формулы (I), как определено выше, или его фармацевтически приемлемую соль, и любое из противоопухолевых средств, перечисленных выше под п.п. (i) - (х).
Поэтому в следующем аспекте настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, в комбинации с по меньшей мере одним противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) - (ix).
Поэтому в следующем аспекте изобретения обеспечивается соединение формулы (I) или его фармацевтически приемлемая соль в комбинации с противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) - (х).
В одном воплощении обеспечивается комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и гемцитабин, предназначенную для применения в терапии рака.
В одном воплощении обеспечивается комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и анти-CTLA4 антитело (такое как Yervoy™ или MEDI-1123), предназначенную для применения в терапии рака.
В одном воплощении обеспечивается комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и анти-PDL1 антитело (такое как BMS-936559), предназначенную для применения в терапии рака.
Когда здесь применяется термин «комбинация», следует понимать, что он относится к одновременному, раздельному или последовательному введению. В одном воплощении «комбинация» обращается к одновременному введению. В другом воплощении «комбинация» относится к раздельному введению.
В еще одном воплощении «комбинация» относится к последовательному введению. Когда введение является последовательным или раздельным, задержка во введении второго компонента должна быть такой, чтобы не утратить полезного эффекта комбинации.
Согласно следующему аспекту настоящего раскрытия обеспечивается фармацевтическая композиция, которая содержит по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, в комбинации с противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) - (ix), и в сочетании с по меньшей мере одним фармацевтически приемлемым растворителем или носителем.
Согласно следующему аспекту изобретения обеспечивается фармацевтическая композиция, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) - (х), в сочетании с фармацевтически приемлемым растворителем или носителем.
Согласно следующему аспекту настоящего раскрытия обеспечивается фармацевтическая композиция, которая содержит по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, в комбинации с по меньшей мере одним противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) - (ix), в сочетании с по меньшей мере одним фармацевтически приемлемым растворителем или носителем, предназначенная для применения в терапии рака.
Согласно следующему аспекту изобретения обеспечивается фармацевтическая композиция, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) - (х), в сочетании с фармацевтически приемлемым растворителем или носителем, предназначенная для применения в терапии рака.
Согласно еще одному аспекту настоящего раскрытия обеспечивается применение по меньшей мере одного аспекта, выбранного из соединений формулы (I) и их фармацевтически приемлемых солей в комбинации с по меньшей мере одним противоопухолевым средством, выбранным из перечисленных здесь выше под (i) - (ix), в производстве лекарственного препарата, предназначенного для применения в терапии рака у теплокровного животного, такого как человек.
Согласно следующему аспекту изобретения обеспечивается фармацевтическая композиция, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) - (х), в сочетании с фармацевтически приемлемым растворителем или носителем, предназначенная для применения в терапии рака.
Согласно еще одному аспекту настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей в комбинации с по меньшей мере одним противоопухолевым средством, выбранным из перечисленных здесь выше под (i) - (ix), предназначенный для применения в терапии рака у теплокровного животного, такого как человек.
Согласно еще одному аспекту изобретения обеспечивается соединение формулы (I) или его фармацевтически приемлемая соль в комбинации с противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) - (х), предназначенное для применения в терапии рака у теплокровного животного, такого как человек.
Поэтому в дополнительном аспекте настоящего раскрытия обеспечивается способ терапии рака у нуждающегося в такой терапии теплокровного животного, такого как человек, которая содержит введение указанному животному терапевтически эффективного количества по меньшей мере одного аспекта, выбранного из соединений формулы (I) и их фармацевтически приемлемых солей, в комбинации с по меньшей мере одним противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) - (ix).
Поэтому в дополнительном признаке изобретения обеспечивается способ терапии рака у нуждающегося в такой терапии теплокровного животного, такого как человек, который содержит введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли в комбинации с противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) - (x).
Согласно следующему аспекту настоящего раскрытия обеспечивается комплект, содержащий по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, в комбинации с по меньшей мере одним противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) -(ix).
Согласно следующему аспекту настоящего изобретения обеспечивается комплект, содержащий соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с противоопухолевым средством, выбранным из перечисленных здесь выше под п.п. (i) - (х).
Согласно следующему аспекту настоящего раскрытия обеспечивается комплект, содержащий:
a) по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, в первой единичной дозированной форме;
b) по меньшей мере одно противоопухолевое средство, выбранное из противоопухолевых средств, перечисленных здесь выше под п.п. (i) - (ix), во второй единичной дозированной форме; и
c) контейнерные средства, предназначенные для содержания по меньшей мере указанных первой и второй дозированных форм.
Согласно следующему аспекту настоящего раскрытия обеспечивается комплект, содержащий по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, в комбинации с по меньшей мере одним дополнительным противоопухолевым средством.
Согласно следующему аспекту настоящего изобретения обеспечивается комплект, содержащий:
a) соединение формулы (I) или его фармацевтически приемлемую соль в первой единичной дозированной форме;
b) противоопухолевое средство, выбранное из перечисленных здесь выше под п.п. (i) - (х), во второй единичной дозированной форме; и
c) контейнерные средства, предназначенные для содержания указанных первой и второй дозированных форм.
Согласно следующему аспекту настоящего изобретения обеспечивается комплект, содержащий соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с дополнительным противоопухолевым средством.
Согласно следующему аспекту настоящего раскрытия обеспечивается комплект, содержащий:
a) по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, в первой единичной дозированной форме;
b) по меньшей мере одно второе противоопухолевое средство во второй единичной дозированной форме; и
c) контейнерные средства, предназначенные для содержания указанных первой и второй дозированных форм.
В одном аспекте настоящего раскрытия по меньшей мере один аспект, выбранный из соединений формулы (I) и их фармацевтически приемлемых солей, может быть подходящим для применения в качестве вакцинного адъюванта.
В качестве следующего аспекта настоящего раскрытия обеспечивается по меньшей мере один аспект, выбранный из указанных здесь соединений формулы (I) и их фармацевтически приемлемых солей, предназначаемых для применения в качестве вакцинного адъюванта.
В качестве следующего аспекта настоящего раскрытия обеспечивается применение по меньшей мере одного аспекта, выбранного из указанных здесь соединений формулы (I) и их фармацевтически приемлемых солей, в качестве вакцинного адъюванта в производстве вакцины для терапии заболевания или состояния.
Настоящее раскрытие, помимо этого, обеспечивает способ терапии, или снижения риска заболевания или состояния, при этом такой способ содержит введение нуждающемуся в этом пациенту терапевтически эффективного количества вакцины и по меньшей мере одного аспекта, выбранного из указанных здесь соединений формулы (I) и их фармацевтически приемлемых солей.
Настоящее раскрытие, помимо этого, обеспечивает способ усиления у пациента реакции на вакцину, при этом такой способ содержит введение нуждающемуся в этом пациенту терапевтически эффективного количества вакцины и по меньшей мере одного аспекта, выбранного из указанных здесь соединений формулы (I) и их фармацевтически приемлемых солей.
Осуществление изобретения
Экспериментальная часть (химические синтезы и биологические испытания).
В описанных ниже методиках эксперимента могут применяться следующие сокращения:
"EtOAc" - этилацетат; «мин» - минута(-ы); «ТГФ» - тетрагидрофуран; «ДМФ» - N,N-диметилформамид; "NaH" - гидрид натрия; "M" - моль/л; "час" - час(-ы); «Аминосиликагель» - колоночная флэш-хроматография с использованием поверхностно-модифицированного аминопропилом диоксида кремния, (HiFlash Column Amino 40 мкМ 60 А; каталожный номер W091, W092 или W093, заполнение поверхностно-модифицированным аминопропилом силикагелем, приобретено у Yamazen Science, Inc); "DMSO" - диметилсульфоксид; "Mes" - мезитиленил; "Ms" - метансульфонил; "sat." - насыщенный водный раствор; "RT" - комнатная температура; "LC-MS" - жидкостная хроматография с масс-спектрометрией; "m/z" - измеряемое отношение массы к заряду; "M" - молярность; "EtOH" - этанол. Данные протонного ядерного магнитного резонанса ("1Н ЯМР") обычно получали на 300-500 МГц с использованием дейтерированного диметилсульфоксида, если не заявлялось иного. Сокращения, используемые для 1H ЯМР: "s" = синглет, "d" = дуплет; "t" = триплет; "q" = квадруплет; "m" = мультиплет; "dd" = дуплет дуплетов; "br s" = широкий синглет; "dt" = дуплет триплетов, "td" = триплет дуплетов и т.д.
Препаративная обращенно-фазовая ВЭЖХ ("RPHPLC") осуществлялась с помощью Phenomenex GeminiTM С18 5 мкм колонки при использовании CH3CN в водном растворе 0,1% NH3 в качестве элюента. Фракции отбирались после детектирования УФ-спектроскопией на длине волны 220 или 254 нм.
Примеры
Пример 1.
(S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)уксусная кислота
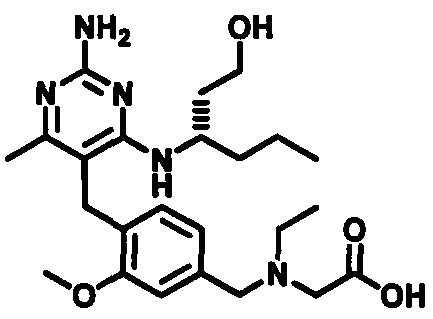
Указанное в заголовке соединение было приготовлено, как описано ниже.
(i) Метил-3-метокси-4-(2-(метоксикарбонил)-3-оксобутил)бензоат
NaH (60% в минеральном масле, 1,5 г) добавлялся порциями на протяжении 10 минут к раствору этилацетоацетата (4,4 мл) в ТГФ (60 мл) при 0°C. Затем смесь перемешивалась в течение 10 минут. Далее был добавлен раствор метил-4-(бромметил)-3-метоксибензоата (7,5 г) в ТГФ (40 мл) и смесь нагревалась до 70°C и перемешивалась в течение 15 час. После этого смесь вливалась в воду со льдом (300 мл) и перемешивалась в течение 30 минут. Полученная водная смесь экстрагировалась EtOAc. Органические экстракты были объединены, осушены и сконцентрированы в вакууме с получением неочищенного продукта. Реакция была повторена в том же самом масштабе. Две партии неочищенного продукта были объединены и очищены колоночной флэш-хроматографией на силикагеле с получением указанного в подзаголовке соединения (15 г) в виде бесцветного масла; 1H ЯМР (300 МГц, CDCl3) δ=7,48 (1Н, dd), 7,45 (1H, d), 7,24 (1H, d), 4,05 (2Н, q), 3,95 (1H, dd), 3,86 (3H, s), 3,84 (3H, s), 3,10 (1H, dd), 3,00 (1H, dd), 2,17 (3H, s), 1,09 (3H, t).
(ii) Метил-4-((2-амино-4-гидрокси-6-метилпиримидин-5-ил)метил)-3-метоксибензоат
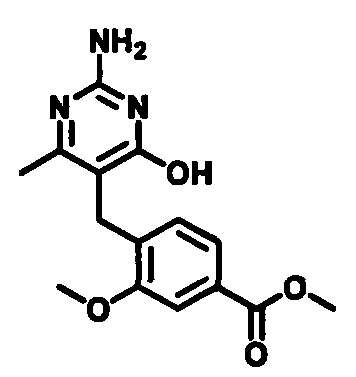
Гуанидинкарбонат (7,2 г) был добавлен к раствору продукта со стадии (i) (9,0 г) в EtOH (60 мл) и смесь после этого нагревалась в течение 15 час при 80°C. После охлаждения полученное твердое вещество было собрано фильтрацией. Это твердое вещество затем было суспендировано в воде и собрано фильтрацией. Данное твердое вещество после этого было промыто EtOAc и осушено с получением указанного в подзаголовке соединения (5,8 г) в виде бесцветного твердого вещества, которое использовалось без дальнейшей очистки; 1H ЯМР (300 МГц, d6-DMSO) δ=10,78 (1H, s), 7,46 (1H, d), 7,45 (1H, s), 6,98 (1H, d), 6,42 (2Н, s), 3,89 (3H, s), 3,83 (3H, s), 3,61 (2Н, s), 1,93 (3H, s); LC-MS: m/z 304.
(iii) 2-Амино-5-(4-(гидроксиметил)-2-метоксибензил)-6-метилпиримидин-4-ол
Триэтилборгидрид лития (93 мл) был добавлен к раствору продукта со стадии (ii) (5,0 г) в ТГФ (25 мл) на протяжении 5 минут и реакционная смесь перемешивалась в течение 3,5 час при RT. К смеси были добавлены вода (60 мл) и 2М соляная кислота (40 мл). Органический растворитель был удален испарением. Была добавлена 2М соляная кислота (16 мл) и смесь перемешивалась при RT в течение 4 час. Смесь была нейтрализована насыщенным водным раствором бикарбоната натрия. Осадок был собран фильтрацией, промыт водой и осушен в вакууме при 50°C с получением представленного в подзаголовке соединения (4,7 г) в виде белого твердого вещества; 1H ЯМР (300 МГц, d6-DMSO); 10,76 (1H, br s), 6,89 (1H, s), 6,77-6,70 (2Н, m), 6,30 (2Н, br s), 5,10 (1H, t), 4,42 (2Н, d), 3,79 (3H, s), 3,51 (2Н, s), 1,91 (3H, s).
(iv) 2-Амино-5-(4-(гидроксиметил)-2-метоксибензил)-6-метилпиримидин-4-ил-2,4,6-триметилбензолсульфонат
2-Мезитиленсульфонилхлорид (7,2 г) был добавлен к суспензии диизопропилэтиламина (5,5 мл) и продукта со стадии (iii) (6,1 г) в ТГФ (200 мл) и смесь перемешивалась с обратным холодильником в течение 12 час. Полученная смесь разбавлялась водой и экстрагировалась EtOAc. Объединенный органический слой был промыт соляным раствором, осушен и сконцентрирован под пониженным давлением. Остаток был очищен колоночной флэш-хроматографией на аминосиликагеле с получением представленного в подзаголовке соединения (8,6 г) в виде белого твердого вещества; 1H ЯМР (300 МГц, CDCl3); 6,92 (2Н, s), 6,86 (1Н, s), 6,77 (2H, s), 4,67 (2H, br s), 4,64 (2H, d), 3,82 (3H, s), 3,81 (2H, s), 2,57 (6H, s), 2,29 (3H, s), 2,21 (3H, s), 1,81 (1Н, t).
(v) 2-Амино-5-(4-(хлорметил)-2-метоксибензил)-6-метилпиримидин-4-ил-2,4,6-триметилбензолсульфонат
Метансульфонилхлорид (1,4 мл) был добавлен к смеси хлорида лития (0,74 г) и продукта со стадии (iv) (4,0 г) в ТГФ (45 мл). Смесь перемешивалась при RT в течение 1,5 час, разбавлялась водой и экстрагировалась EtOAc. Объединенный органический слой был промыт соляным раствором, осушен и сконцентрирован под пониженным давлением с получением неочищенного продукта в виде светло-желтого масла, которое использовалось для последующей реакции без дальнейшей очистки; 1H ЯМР (300 МГц, CDCl3); 6,91 (2H, s), 6,83 (1Н, s), 6,81-6,74 (2H, m), 4,69 (2H, br s), 4,54 (2H, s), 3,82 (3H, s), 3,80 (2H, s), 2,54 (6H, s), 2,29 (3H, s), 2,24 (3H, s).
Серная кислота (3 мл) была добавлена к раствору N-этилглицина (2,0 г) в EtOH (15 мл) и смесь перемешивалась с обратным холодильником в течение 9 час. Смесь была охлаждена до RT и нейтрализована 5М гидроксидом натрия и насыщенным водным раствором бикарбоната натрия. Раствор экстрагировался в EtOAc, объединенный органический слой промывался соляным раствором, был осушен и сконцентрирован под пониженным давлением. Указанное в подзаголовке соединение (1,4 г) было получено в виде светло-желтого масла; 1H ЯМР (300 МГц, CDCl3); 4,17 (2Н, q), 3,38 (2Н, s), 2,63 (2H, q), 1,25 (3H, t), 1,10 (3H, t).
(vii) Этил-2-((4-((2-амино-4-(мезитилсульфонилокси)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)ацетат
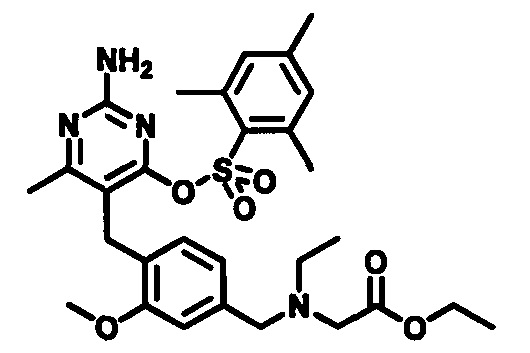
Продукт со стадии (vi) (390 мг) был добавлен к смеси бикарбоната калия (410 мг), йодида калия (49 мг) и неочищенного продукта со стадии (v) в ацетонитриле (5 мл). После перемешивания в течение 4 час при 70°C реакционная смесь была охлаждена до RT, отфильтрована и сконцентрирована под пониженным давлением. Остаток был очищен колоночной флэш-хроматографией с получением представленного в подзаголовке соединения (490 мг) в виде бесцветного, аморфного твердого вещества; 1H ЯМР (300 М Гц, CDCl3); 6,91 (2Н, s), 6,87 (1H, s), 6,72 (2Н, s), 4,65 (2Н, br s), 4,14 (2Н, q), 3,82-3,79 (5H, m), 3,70 (2Н, s), 3,28 (2Н, s), 2,67 (2Н, q), 2,56 (6H, s), 2,28 (3H, s), 2,23 (3H, s), 1,25 (3H, t), 1,07 (3H, t).
(viii) (S)-этил-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)ацетат
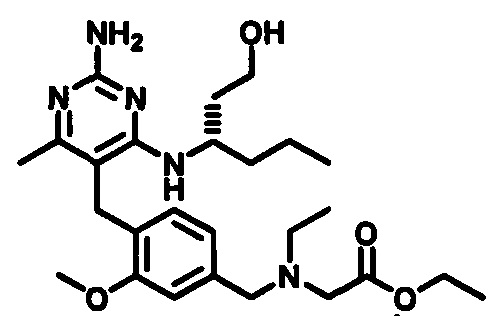
Трифторуксусная кислота (0,066 мл) была добавлена к смеси (S)-3-аминогексан-1-ола (300 мг) и продукта со стадии (vii) (490 мг) в пропионитриле (5 мл). Смесь нагревалась при 120°C в течение 16 час и охлаждалась до RT. Растворитель был удален испарением. Остаток был очищен колоночной флэш-хроматографией на аминосиликагеле с получением представленного в подзаголовке соединения (330 мг) в виде бесцветной смолы; 1H ЯМР (CDCl3); 6,94 (1H, s), 6,88 (1H, d), 6,79 (1H, d), 4,66 (1H, d), 4,58 (2Н, br s), 4,13 (2Н, q), 4,11-4,06 (1H, m), 3,88 (3H, s), 3,70 (2Н, s), 3,66 (2Н, s), 3,42 (1H, ddd), 3,28-3,20 (3H, m), 2,65 (2Н, q), 2,34 (3H, s), 1,82-1,74 (1H, m), 1,45-1,33 (1H, m), 1,26-1,21 (5H, m), 1,07-1,02 (5H, m), 0,73 (3H, t).
(ix) (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)уксусная кислота
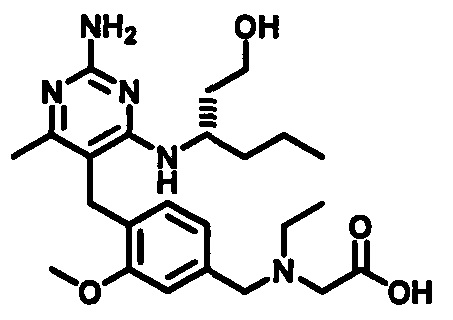
3М гидроксид натрия (1 мл) был добавлен к раствору продукта со стадии (viii) (310 мг) в метаноле (3 мл). Раствор перемешивался при RT в течение 16 час. Реакционная смесь была нейтрализована 4М соляной кислотой (1 мл) и экстрагировалась смесью хлороформ/EtOH (3/1). Объединенный органический слой был осушен и сконцентрирован под пониженным давлением с получением представленного в подзаголовке соединения (300 мг) в виде бесцветного, аморфного твердого вещества; 1Н ЯМР (DMSO); 7,00 (1Н, s), 6,79 (1Н, d), 6,72 (1Н, d), 5,87 (2H, br s), 5,63 (1Н, d), 4,20-4,14 (1Н, m), 3,83 (3Н, s), 3,76 (2H, s), 3,60 (2H, s), 3,27 (2H, q), 3,13 (2H, s), 2,66 (2H, q), 2,02 (3Н, s), 1,60-1,51 (1Н, m), 1,45-1,31 (3Н, m), 1,13-1,06 (2H, m), 1,00 (3Н, t), 0,75 (3Н, t).
Пример 2.
2-((4-((2-Амино-4-(бутиламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)уксусная кислота.
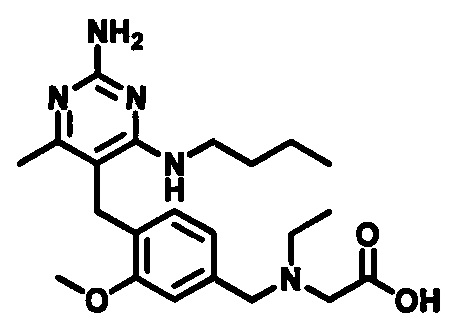
Указанное в заголовке соединение было приготовлено описанной ниже последовательностью стадий.
(i) Этил-2-((4-((2-амино-4-(бутиламино)-6-метилпиримидин-5-ил)метил)-3-метокси-бензил)(этил)амино)ацетат
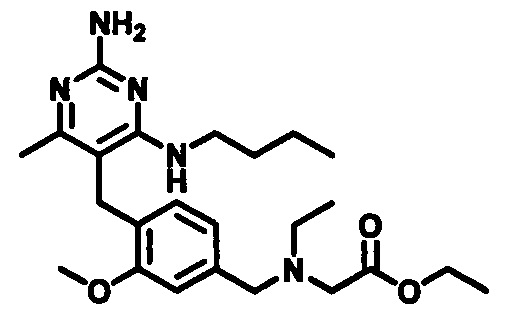
Соединение подзаголовка синтезировалось способом из примера 1, стадия (viii), из продукта со стадии (vii) примера 1 (150 мг) и 1-бутиламина (56 мг). Соединение подзаголовка (77 мг) было получено в виде желтого масла; 1H ЯМР (CDCl3); 6,94 (1Н, s), 6,86 (1Н, d), 6,77 (1Н, d), 4,84 (1Н, t), 4,55 (2H, br s), 4,13 (2H, q), 3,88 (3Н, s), 3,70 (2H, s), 3,64 (2H, s), 3,30-3,23 (4H, m), 2,66 (2H, q), 2,30 (3Н, s), 1,43-1,34 (2H, m), 1,24 (3Н, t), 1,19-1,12 (2H, m), 1,06 (3Н, t), 0,83 (3Н, t).
(ii) 2-((4-((2-Амино-4-(бутиламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)уксусная кислота
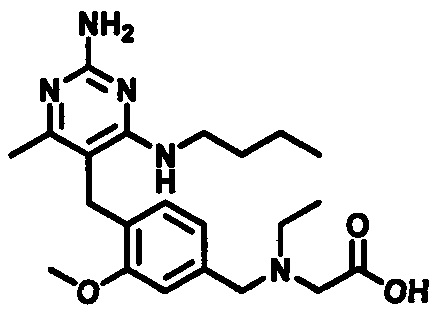
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (ix), из продукта со стадии (i) (71 мг). Соединение подзаголовка (74 мг) было получено в виде кремового твердого вещества; 1Н ЯМР (DMSO); 7,00 (1Н, s), 6,77 (1Н, d), 6,65 (1Н, d), 6,09 (1Н, t), 5,85 (2H, br s), 3,83 (3H, s), 3,76 (2H, s), 3,58 (2H, s), 3,22 (2H, dt), 3,15 (2H, s), 2,66 (2H, q), 1,96 (3H, s), 1,44-1,34 (2H, m), 1,23-1,10 (2H, m), 1,00 (3H, t), 0,81 (3H, t).
Пример 3
(S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусная кислота
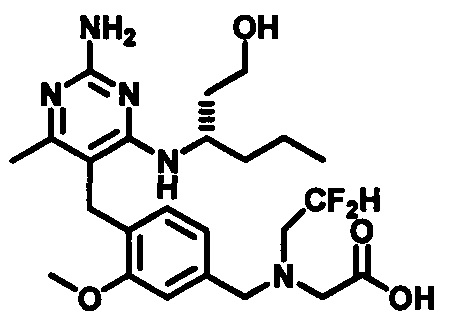
Указанное в заголовке соединение было приготовлено описанной ниже последовательностью стадий.
(i) Этил-2-(2,2-дифторэтиламино)ацетат
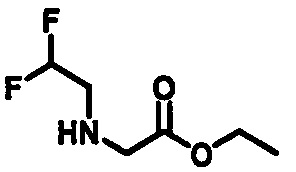
2,2-Дифторэтиламин (4,0 г) был добавлен к суспензии этилбромацетата (5,4 мл), йодида калия (0,82 г), диизопропилэтиламина (9,8 мл) в ацетонитриле (100 мл) и смесь перемешивалась при RT в течение 25 час. Смесь была сконцентрирована под пониженным давлением. Остаток был очищен колоночной флэш-хроматографией на силикагеле с получением представленного в подзаголовке соединения (7,0 г) в виде бесцветного масла; 1H ЯМР (300 МГц, CDCl3); 5,82 (1Н, tt), 4,18 (2H, q), 3,46 (2H, s), 3,00 (2H, dt), 1,26 (3H, t).
(ii) Этил-2-((4-((2-амино-4-(мезитилсульфонилокси)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)ацетат
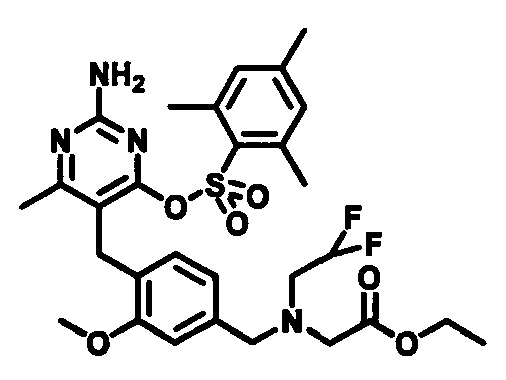
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (vii), из продукта со стадии (i) (490 мг) и из примера 1, стадия (v) (470 мг). Представленное в подзаголовке соединение (520 мг) было получено в виде бесцветного, аморфного твердого вещества; 1H ЯМР (300 МГц, CDCl3); 6,91 (2Н, s), 6,83 (1Н, s), 6,76-6,72 (2Н, m), 5,75 (1Н, tt), 4,65 (2Н, br s), 4,10 (2Н, q), 3,85 (2Н, s), 3,79 (5H, s), 3,11-3,01 (4H, m), 2,55 (6H, s), 2,29 (3H, s), 2,24 (3H, s), 1,25 (3H, t).
(iii) (S)-этил-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)ацетат
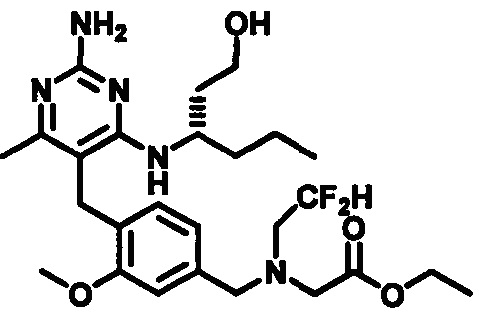
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (viii), из продукта со стадии (ii) (520 мг) и (S)-3-аминогексан-1-ола (300 мг). Соединение подзаголовка (340 мг) было получено в виде бесцветной смолы; 1H ЯМР (CDCl3); 6,90-6,88 (2Н, m), 6,78 (1Н, d), 5,73 (1Н, tt), 4,60 (1Н, d), 4,55 (2Н, br s), 4,15 (2Н, q), 4,11-4,03 (1Н, m), 3,88 (3H, s), 3,85 (2Н, s), 3,66 (2Н, s), 3,47-3,37 (3H, m), 3,25 (1Н, ddd), 3,04 (2Н, dt), 2,33 (3H, s), 1,83-1,73 (1Н, m), 1,51-1,32 (3H, m), 1,25 (3H, t), 1,06-0,99 (2Н, m), 0,73 (3H, t).
(iv) (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусная кислота
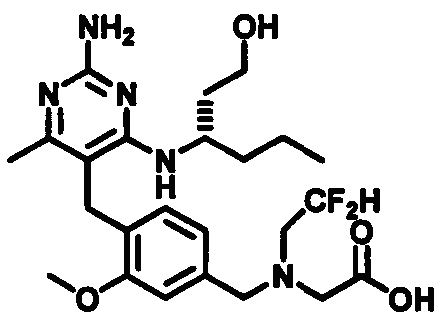
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (ix), из продукта со стадии (iii) (330 мг). Соединение подзаголовка (340 мг) было получено в виде бесцветного, аморфного твердого вещества; 1H ЯМР (DMSO); 6,94 (1Н, s), 6,76-6,70 (2Н, m), 6,40 (2Н, br s), 6,02 (1Н, tt), 5,93 (1Н, d), 4,24-4,17 (1Н, m), 3,82 (5H, s), 3,60 (2Н, s), 3,31-3,25 (4H, m), 3,03 (2H, dt), 2,02 (3H, s), 1,60-1,54 (1H, m), 1,48-1,43 (1H, m), 1,38-1,32 (2H, m), 1,12-1,03 (2H, m), 0,75 (3H, t).
Пример 4
(S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусная кислота
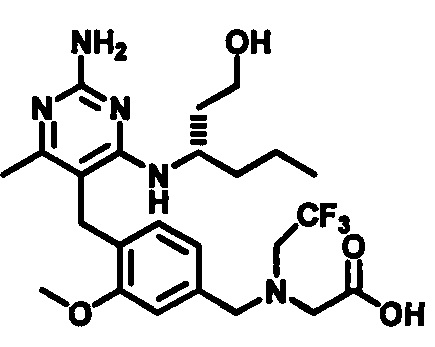
Указанное в заголовке соединение было приготовлено описанной ниже последовательностью стадий.
(i) Этил-2-(2,2,2-трифторэтиламино)ацетат
2,2,2-Трифторэтиламин (2,0 г) был добавлен к суспензии этилбромацетата (2,3 мл), йодида калия (0,34 г) в диизопропилэтиламине (3,3 мл) и смесь перемешивалась при RT в течение 5,5 час. Смесь была разбавлена диэтиловым эфиром (30 мл) и перемешивалась при RT в течение 30 минут. Суспензия фильтровалась и концентрировалась под пониженным давлением. Указанное в подзаголовке соединение (2,6 г) было получено в виде желтого масла; 1H ЯМР (300 МГц, CDCl3); 4,19 (2H, q), 3,50 (2H, s), 3,22 (2H, q), 1,26 (3H, t).
(ii) Этил-2-((4-((2-амино-4-(мезитилсульфонилокси)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)ацетат
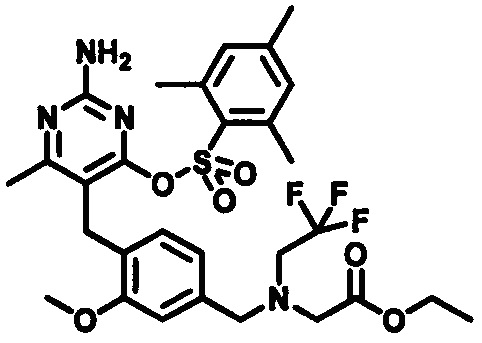
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (vii), из продукта со стадии (i) (190 мг) и из примера 1, стадия (v) (500 мг). Представленное в подзаголовке соединение (360 мг) было получено в виде желтого масла; 1H ЯМР (300 МГц, CDCl3); 6,91 (2H, s), 6,86 (1H, s), 6,76-6,68 (2H, m), 4,67 (2H, br s), 4,15 (2H, q), 3,95 (2H, s), 3,79 (5H, s), 3,45 (2H, s), 3,35 (2H, q), 2,53 (6H, s), 2,29 (3H, s), 2,24 (3H, s), 1,04 (3H, t).
(iii) (S)-этил-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)ацетат
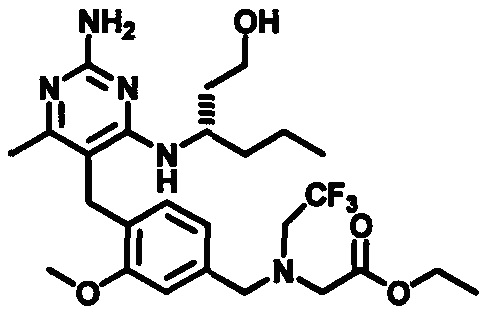
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (viii), из продукта со стадии (ii) (61 мг) и (S)-3-аминогексан-1-ола (34 мг). Соединение подзаголовка (24 мг) было получено в виде светло-желтой смолы; 1H ЯМР (СDСl3); 6,93 (1Н, s), 6,89 (1Н, d), 6,76 (1Н, d), 4,62-4,59 (3H, m), 4,15 (2H, q), 4,10-4,04 (1H, m), 3,91 (2H, s), 3,87 (3H, s), 3,66 (2H, s), 3,44 (2H, s), 3,37-3,20 (4H, m), 2,33 (3H, s), 1,82-1,69 (1Н, m), 1,42-1,32 (3H, m), 1,24 (3H, t), 1,09-0,98 (2H, m), 0,73 (3H, t).
(iv) (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусная кислота
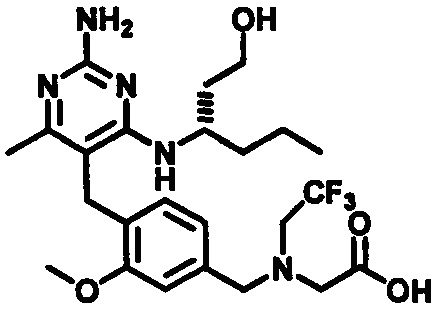
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (ix), из продукта со стадии (iii) (20 мг). Соединение подзаголовка (20 мг) было получено в виде светло-желтого твердого вещества; 1H ЯМР (DMSO); 6,90 (1Н, s), 6,71 (2H, s), 5,79 (2H, br s), 5,52 (1Н, d), 4,17-4,10 (1Н, m), 3,87 (2H, s), 3,81 (3H, s), 3,58 (2H, s), 3,54-3,44 (2H, m), 3,23- 3,17 (2H, m), 2,95 (2H, s), 2,03 (3H, s), 1,59-1,50 (1Н, m), 1,45-1,23 (3H, m), 1,14-1,05 (2H, m), 0,76 (3H, t).
Пример 5
(S)-3-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)пропионовая кислота
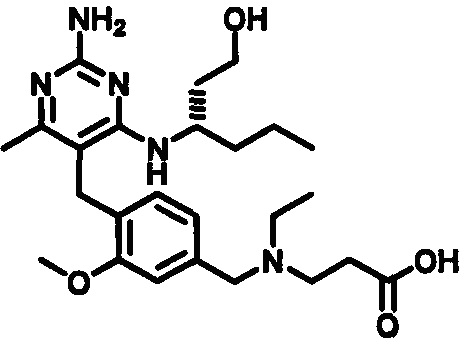
Указанное в заголовке соединение было приготовлено описанной ниже последовательностью стадий.
(i) Этил-3-(этиламино)пропаноат
Раствор этиламина (70% в воде, 5,8 мл) в EtOH (30 мл) был добавлен к суспензии этилакрилата (2,0 г) в EtOH (20 мл) при 0°C и смесь была перемешана при RT в течение 30 минут. Смесь была сконцентрирована под пониженным давлением. Остаток был очищен колоночной флэш-хроматографией на аминосиликагеле с получением представленного в подзаголовке соединения (2,4 г) в виде бледно-желтого масла; 1H ЯМР (300 Гц, CDCl3); 4,13 (2Н, q), 2,88 (2Н, t), 2,66 (2H, q), 2,52 (2H, t), 1,24 (2H, t), 1,11 (3H, t).
(ii) Этил-3-((4-((2-амино-4-(мезитилсульфонилокси)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)пропаноат
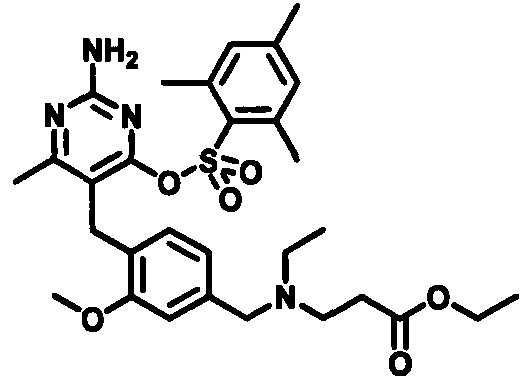
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (vii), из продукта со стадии (i) и примера 1, стадия (v) (3,1 г). Представленное в подзаголовке соединение (2,7 г) было получено в виде желтой смолы; 1H ЯМР (300 МГц, CDCl3); 6,91 (2H, s), 6,82 (1Н, s), 6,70 (2H, s), 4,65 (2H, br s), 4,10 (2H, q), 3,82-3,79 (5H, m), 3,51 (2H, s), 2,79 (2H, t), 2,56 (6H, s), 2,51-2,45 (4H, m), 2,28 (3H, s), 2,24 (3H, s), 1,21 (3H, t), 1,01 (3H, t).
(iii) (S)-этил-3-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)пропаноат
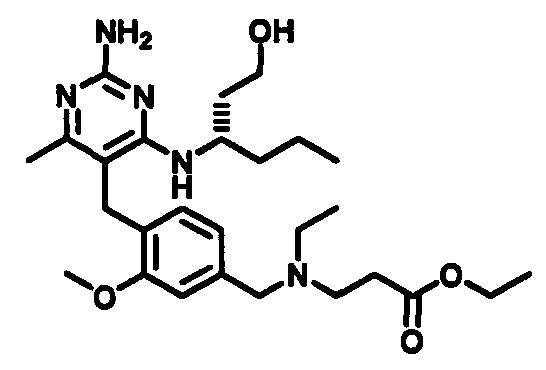
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (viii), из продукта со стадии (ii) (2,7 г) и (S)-3-аминогексан-1-ола (1,6 г). Соединение подзаголовка (670 мг) было получено в виде бесцветной смолы; 1H ЯМР (CDCl3); 6,93 (1Н, s), 6,86 (1Н, d), 6,76 (1Н, d), 4,80-4,65 (3H, m), 4,09 (2H, q), 3,88 (3H, s), 3,65 (2H, s), 3,50 (2H, s), 3,42-3,37 (1Н, m), 3,24 (1Н, ddd), 2,77 (2H, t), 2,46-2,41 (4H, m), 2,02 (3H, s), 1,82-1,72 (1Н, m), 1,42-1,29 (1Н, m), 1,26-1,19 (5H, m), 1,07-0,96 (5H, m), 0,74 (3Н, t).
(iv) (S)-3-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(этил)амино)пропионовая кислота
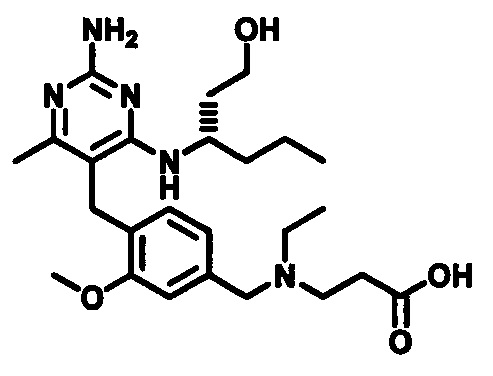
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (ix), из продукта со стадии (iii) (670 мг). Соединение подзаголовка (640 мг) было получено в виде белого твердого вещества; 1H ЯМР ((DMSO); 6,97 (1Н, s), 6,79-6,70 (4Н, m), 6,56-6,51 (1Н, m), 4,31-4,23 (1Н, m), 3,83 (ЗН, s), 3,64 (2H, s), 3,57 (2H, s), 3,33-3,26 (4Н, m), 2,70 (2H, t), 2,36 (2H, t), 2,07 (3Н, s), 1,60-1,49 (2H, m), 1,42-1,34 (2H, m), 1,13-1,04 (2H, m), 0,96 (3H, t), 0,76 (3H, t).
Пример 6
(S)-3-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)пропионовая кислота
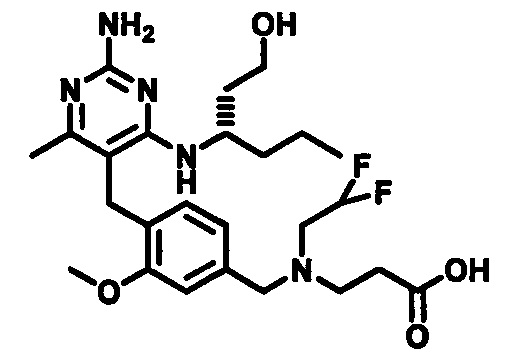
Указанное в заголовке соединение было приготовлено описанной ниже последовательностью стадий.
(i) Этил-3-(2,2-дифторэтиламино)пропаноат
2,2-Дифторэтиламин (0,50 г) был добавлен к суспензии этил-3-бромпропаноата (1,1 г), йодида калия (0,10 г) в диизопропилэтиламине (1,2 мл) и смесь перемешивалась при 100 в течение 3,5 час. Смесь охлаждалась до RT и концентрировалась под пониженным давлением. Остаток был очищен колоночной флэш-хроматографией на силикагеле с получением представленного в подзаголовке соединения (0,69 г) в виде бледно-желтого масла; 1H ЯМР (300 М Гц, CDCl3); 5,81 (1Н, tt), 4,13 (2H, q), 2,95 (2H, dt), 2,93 (2H, t), 2,48 (2H, t), 1,24 (3H, t).
(ii) Этил-3-((4-((2-амино-4-(мезитилсульфонилокси)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)пропаноат
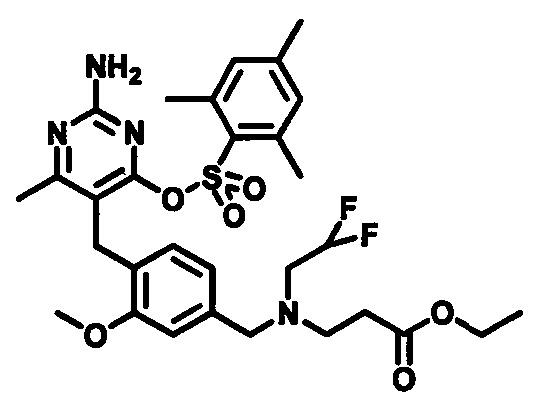
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (vii), из продукта со стадии (i) и примера 1, стадия (v) (260 мг). Представленное в подзаголовке соединение (310 мг) было получено в виде бледно-желтого масла; 1H ЯМР (300 МГц, CDCl3); 6,91 (2Н, s), 6,80 (1Н, s), 6,74 (1H, d), 6,68 (1H, d), 5,70 (1H, tt), 4,64 (2H, br s), 4,10 (2H, q), 3,79 (5H, s), 3,65 (2H, s), 2,80 (2H, dt), 2,55 (6H, s), 2,51-2,45 (4H, m), 2,29 (3H, s), 2,24 (3H, s), 1,24 (3H, t).
(iii) (S)-этил-3-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)пропаноат
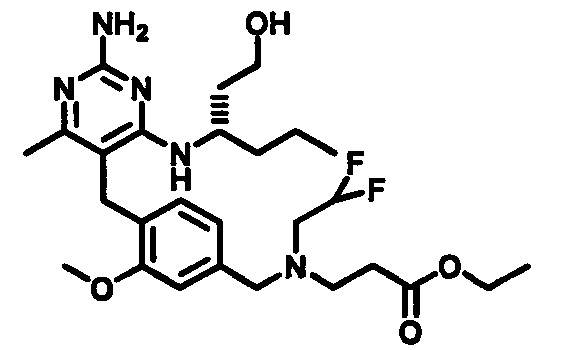
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (viii), из продукта со стадии (ii) (190 мг) и (S)-3-аминогексан-1-ола (110 мг). Соединение подзаголовка (130 мг) было получено в виде бесцветной смолы; 1H ЯМР (CDCl3); 6,91 (1H, s), 6,87 (1H, d), 6,79 (1H, d), 5,72 (1H, tt), 5,69 (2H, br s), 4,19-4,15 (2H, m), 4,11 (2H, q), 3,89 (3H, s), 3,65-3,64 (4H, m), 3,45-3,40 (1H, m), 3,21 (1H, ddd), 2,90 (2H, t), 2,78 (2H, dt), 2,48-2,43 (5H, m), 1,85-1,74 (1H, m), 1,49-1,37 (1H, m), 1,32-1,17 (5H, t), 1,09-0,99 (2H, m), 0,77 (3H, t).
(iv) (S)-3-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)пропионовая кислота
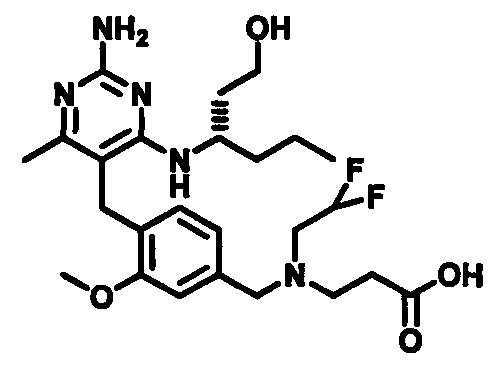
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (ix), из продукта со стадии (iii) (120 мг). Соединение подзаголовка (86 мг) было получено в виде белого твердого вещества; 1H ЯМР (DMSO); 66,95 (1H, s), 6,75-6,68 (2H, m), 6,01 (1H, tt), 5,74 (2H, br s), 5,59 (1H, d), 4,19-4,12 (1H, m), 3,83 (3H, s), 3,62 (2H, s), 3,58 (2H, s), 3,49-3,21 (2H, m), 2,79 (2H, dt), 2,71 (2H, t), 2,19 (2H, t), 2,00 (3H, s), 1,59-1,50 (1H, m), 1,43-1,27 (3H, m), 1,16-1,05 (2H, m), 0,76 (3H, t).
Пример 7
(S)-2-(N-(4-((2-амино-4-(1-гадроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)ацетамидо)уксусная кислота
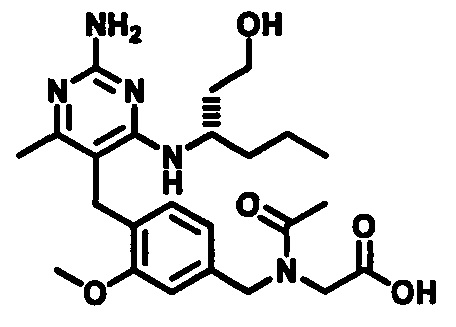
Указанное в заголовке соединение было приготовлено описанной ниже последовательностью стадий.
(i) Этил-2-(4-((2-амино-4-(мезитилсульфонилокси)-6-метилпиримидин-5-ил)метил)-3-метоксибензиламино)ацетат
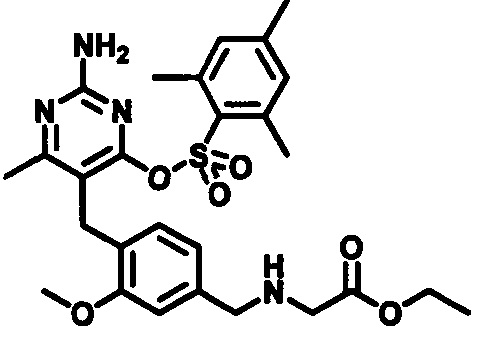
Соединение подзаголовка синтезировалось способом из примера 1, стадия (vii), из продукта со стадии (v) примера 1 (100 мг) и этилглицината. Представленное в подзаголовке соединение (23 мг) было получено в виде бесцветного, аморфного твердого вещества; 1H ЯМР (300 МГц, CDCl3); 6,92 (2H, s), 6,84 (1H, s), 6,76-6,70 (2H, m), 4,68 (2H, br s), 4,18 (2H, q), 3,81 (3H, s), 3,79 (2H, s), 3,77 (2H, s), 3,39 (2H, s), 2,56 (6H, s), 2,28 (3H, s), 2,22 (3H, s), 1,26 (3H, t); LC-MS: m/z=543.
(ii) Этил-2-(N-(4-((2-амино-4-(мезитилсульфонилокси)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)ацетамидо)ацетат
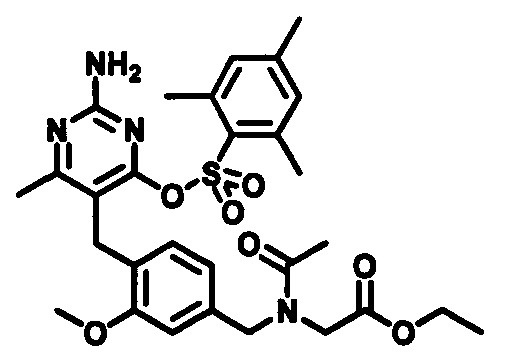
Уксусный ангидрид (6 мкл) был добавлен к раствору продукта со стадии (i) (23 мг) и триэтиламину (9 мкл) в ТГФ (1 мл) и смесь перемешивалась при RT в течение 3 час. Смесь была охлаждена водой, экстрагирована в EtOAc, объединенный органический слой промыт соляным раствором, осушен и сконцентрирован под пониженным давлением. Соединение подзаголовка (25 мг) было получено в виде бесцветной смолы, которая использовалась для следующей реакции без дальнейшей очистки; LC-MS: m/z=585.
(iii) (S)-этил 2-(N-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)ацетамидо)ацетат
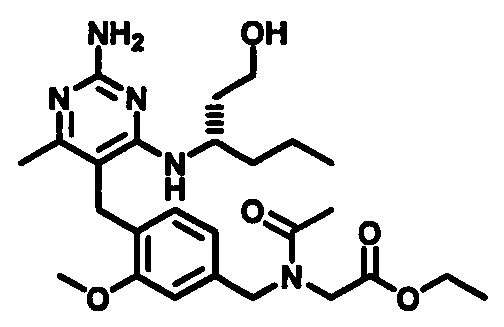
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (viii), из продукта со стадии (ii) (25 мг) и (S)-3-аминогексан-1-ола (15 мг). Соединение подзаголовка (5,1 мг) было получено в виде бесцветной смолы; 1H ЯМР (CDCl3); 6,93 (1Н, d), 6,72-6,67 (2H, m), 4,82 (2H, br s), 4,65 (1H, d), 4,56 (2H, s), 4,18-4,08 (3H, m), 3,99 (2H, s), 3,88 (3H, s), 3,65 (2H, s), 3,48-3,42 (1H, m), 3,32-3,26 (1H, m), 2,33 (3H, s), 2,17 (3H, s), 1,84-1,74 (1H, m), 1,46-1,35 (1H, m), 1,23 (3H, t), 1,16-0,97 (4H, m), 0,73 (3H, t); LC-MS: m/z=502.
(iv) (S)-2-(N-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)ацетамидо)уксусная кислота
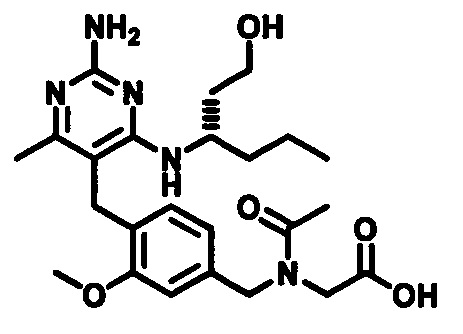
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (ix), из продукта со стадии (iii) (330 мг). Соединение подзаголовка (330 мг) было получено в виде бесцветного, аморфного твердого вещества; 1H ЯМР (DMSO); 6,96-6,92 (4H, m), 6,81 (1H, d), 5,83 (1H, d), 4,73 (1H, d), 4,50 (1H, d), 4,21-4,10 (1H, m), 3,88 (3H, s), 3,80 (2H, s), 3,60 (2H, s), 3,21-3,06 (2H, m), 2,38 (3H, s), 2,14 (3H, s), 1,81-1,71 (1H, m), 1,43-1,37 (1H, m), 1,31-1,09 (4H, m), 0,82 (3H, t); LC-MS: m/z=474.
Пример 8
(R)-1-(3-(4-((2-амино-4-((S)-1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)пирролидин-2-карбоновая кислота
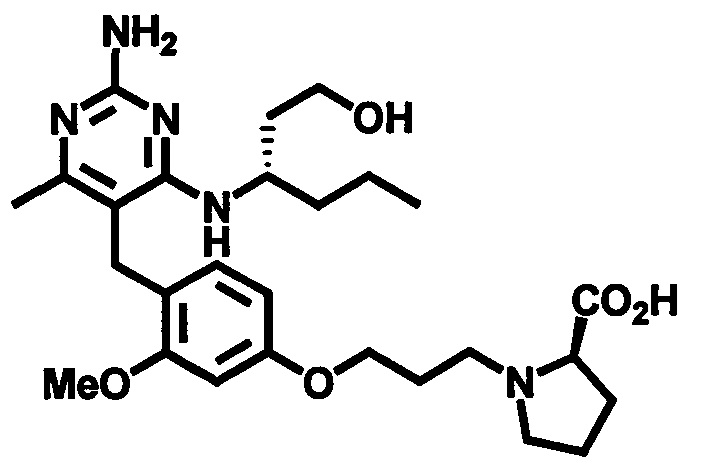
Указанное в заголовке соединение было приготовлено описанными ниже стадиями.
(i) 4-[3-(трет-Бутилдиметилсилилокси)пропокси]-2-метоксибензальдегид
Смесь 4-гидрокси-2-метоксибензальдегида (10,0 г), (3-бромпропокси)-трет-бутилдиметилсилана (25,0 г) и бикарбоната калия (13,6 г) в ДМФ (100 мл) перемешивалась при RT в течение 5 час. Смесь разбавлялась водой и экстрагировалась EtOAc. Объединенные органические растворы были промыты водой и соляным раствором, осушены и сконцентрированы. Остаток был очищен хроматографией на силикагеле элюированием смесью гексан/EtOAc с получением 21,3 г указанного в подзаголовке соединения в виде масла желтого цвета (в виде смеси с (3-бромпропокси)-трет-бутилдиметилсиланом).
(ii) {4-[3-(трет-Бутилдиметилсилилокси)пропокси]-2-метоксифенил}метанол
Боргидрид натрия (1,24 г) был добавлен к раствору продукта со стадии (i) (21,3 г) в ТГФ (100 мл) и метаноле (15 мл) и перемешивался при RT в течение 2,5 час .Смесь была разбавлена водой и соляным раствором и экстрагировалась EtOAc. Объединенные органические растворы были осушены и сконцентрированы. Остаток был очищен хроматографией на силикагеле элюированием смесью гексан/EtOAc с получением представленного в подзаголовке соединения (18,5 г) в виде бесцветного масла; 1H ЯМР: 7,14 (1Н, d), 6,42-6,48 (2Н, m), 4,61 (2Н, d), 4,06 (2H, t), 3,84 (3H, s), 3,80 (2H, t), 2,15 (1H, t), 1,94-2,02 (2H, m), 0,89 (9H, s), 0,04 (6H, s).
(iii) трет-Бутил {3-[4-(хлорметил)-3-метоксифенокси]пропокси}диметилсилан
Метансульфонилхлорид (4,02 мл) был добавлен к смеси продукта со стадии (ii) (8,47 г), диизопропилэтиламина (13,4 мл) и хлорида лития (3,29 г) в ТГФ (105 мл) и перемешивался при RT в течение 40 минут. Смесь была разбавлена водой и соляным раствором и экстрагировалась EtOAc. Объединенные органические растворы были промыты соляным раствором, осушены и сконцентрированы с получением 10,0 г указанного в подзаголовке соединения в виде масла желтого цвета; 1H ЯМР: 7,23 (1Н, dd), 6,44-6,49 (2Н, m), 4,63 (2Н, s), 4,06 (2H, t), 3,85 (3H, s), 3,79 (2H, t), 1,94-2,02 (2H, m), 0,89 (9H, s), 0,04 (6H, s).
(iv) Метил-2-{4-[3-(трет-бутилдиметилсилилокси)пропокси]-2-метоксибензил}-3-оксибутаноат
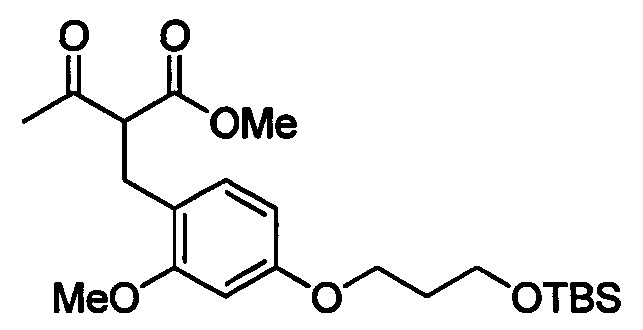
Метилацетоацетат (4,18 мл) был добавлен к суспензии NaH (55% дисперсия в масле, 1,70 г) в ДМФ (60 мл) при 0°C и перемешивался при RT в течение 0,5 час. К смеси были добавлены продукт со стадии (iii) (10,0 г) в ДМФ (60 мл) и йодид калия (4.73 г) и перемешивались при 80°C в течение 6 час. Смесь была охлаждена до RT, разбавлена водой и экстрагировалась EtOAc. Объединенные органические растворы были промыты водой и соляным раствором, осушены и сконцентрированы. Остаток был очищен хроматографией на силикагеле с получением 9,98 г представленного в подзаголовке соединения в виде желтого масла; 1H ЯМР: 6,99 (1Н, d), 6,42 (1Н, d), 6,37 (1Н, dd), 4,02 (2H, t), 3,89 (1Н, t), 3,80 (3H, s), 3,79 (2H, t), 3,67 (3H, s), 2,99-3,14 (2H, m), 2,17 (3H, s), 1,92-2,00 (2H, m), 0,88 (9H, s), 0,04 (6H, s).
(v) 2-Амино-5-{4-[3-(трет-бутилдиметилсилилокси)пропокси]-2-метоксибензил}-6-метилпиримидин-4-ол
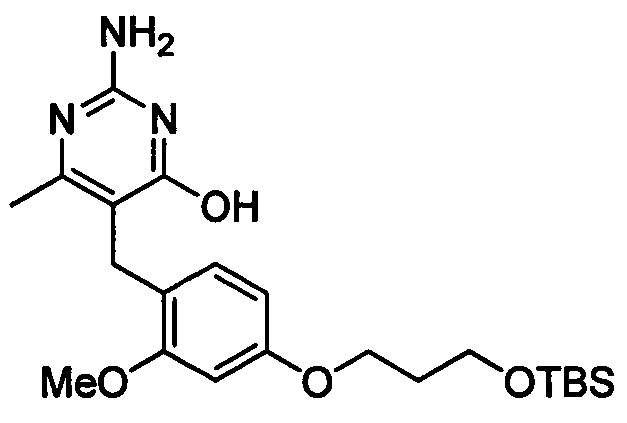
Гуанидинкарбонат (6,4 г) был добавлен к раствору продукта со стадии (iv) (11,6 г) в метаноле (116 мл) и нагревался в течение 8 час при 75°C. Смесь была охлаждена до RT и сконцентрирована. Остаток был разбавлен EtOAc (50 мл) и водой (50 мл) и перемешивался в течение 5,5 час. Был собран осадок и промыт водой и EtOAc с получением 7,49 г представленного в подзаголовке соединения в виде белого твердого вещества; 1H ЯМР: (d6-DMSO) 10,75 (1Н, br s), 6,71 (1Н, d), 6,48 (1Н, d), 6,36 (1Н, dd), 6,30 (2Н, br s), 3,97 (2H, t), 3,77 (3H, s), 3,73 (2H, t), 3,45 (2H, s), 1,92 (3H, s), 1,82-1,90 (2H, m), 0,85 (9H, s), 0,02 (6H, s).
(vi) 2-Амино-5-(4-(3-гидроксипропокси)-2-метоксибензил)-6-метилпиримидин-4-ол гидрохлорид
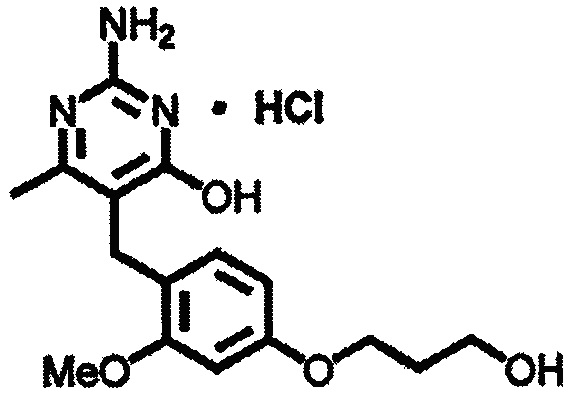
Концентрированная соляная кислота (2,5 мл) добавлялась по каплям к раствору продукта со стадии (v) (4,33 г) в метаноле (43 мл) при RT и перемешивалась 14 час. Смесь была сконцентрирована и разбавлена метанолом. Осадок был собран фильтрацией, промыт метанолом и осушен с получением 2,87 г представленного в подзаголовке соединения в виде белого твердого вещества, которое использовалось без дальнейшей очистки; 1H ЯМР (300 МГц d6-DMSO) δ=12,59 (2H, brs), 8,05 (2H, s), 6,89 (1H, d), 6,51 (1H, d), 6,36 (1H, dd), 3,97 (2H, t), 3,52 (2H, t), 3,46 (2H, s), 2,13 (3H, s), 1,78-1,86 (2H, m); LC-MS: m/z 320.
(vii) 2-Амино-5-(4-(3-гидроксипропокси)-2-метоксибензил)-6-метилпиримидин-4-ил 2,4,6-триметилбензолсульфонат
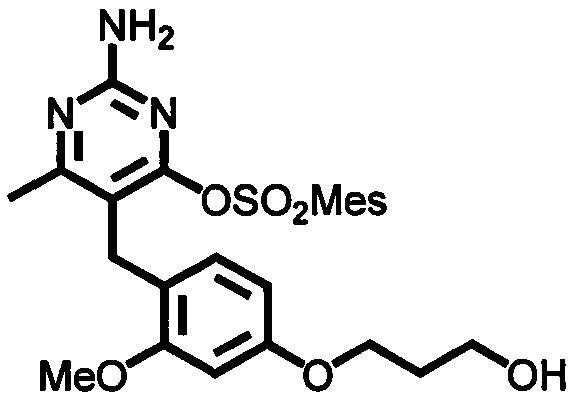
2-Мезитиленсульфонилхлорид (2,7 г) был добавлен к суспензии диизопропилэтиламина (4,6 мл) и продукта со стадии (vi) (2,9 г) в ТГФ (200 мл) и смесь перемешивалась с обратным холодильником в течение 18 час. Полученная смесь разбавлялась водой и экстрагировалась EtOAc. Объединенный органический слой был промыт соляным раствором, осушен и сконцентрирован под пониженным давлением. Остаток был очищен колоночной флэш-хроматографией на аминосиликагеле с получением представленного в подзаголовке соединения (3,6 г) в виде белого твердого вещества; 1H ЯМР (300 МГц, CDCl3); 6,92 (2H, s), 6,71 (1H, d), 6,40 (1H, d), 6,32 (1H, dd), 4,70 (2H, br s), 4,07 (2H, t), 3,88-3,82 (2H, m), 3,76 (3H, s), 3,73 (2H, s), 2,57 (6H, s), 2,29 (3H, s), 2,24 (3H, s), 2,06-1,98 (2H, m); LC-MS: m/z 502.
(viii) 2-Амино-5-(2-метокси-4-(3-(метилсульфонилокси)пропокси)бензил)-6-метилпиримидин-4-ил-2,4,6-триметилбензолсульфонат
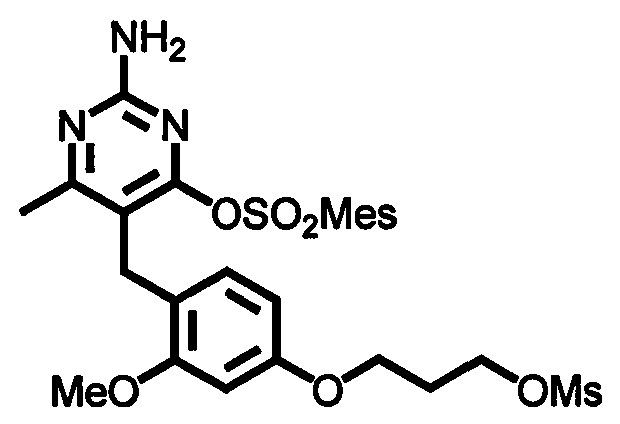
Метансульфонилхлорид (0,293 мл) был добавлен к раствору диизопропилэтиламина (0,988 мл) и продукта со стадии (vii) (0,95 г) в ТГФ (9,5 мл). Смесь перемешивалась при RT в течение 2 час, разбавлялась водой и экстрагировалась EtOAc. Объединенный органический слой был промыт соляным раствором, осушен и сконцентрирован под пониженным давлением с получением неочищенного продукта в виде светло-желтого масла, которое использовалось для последующей реакции без дальнейшей очистки; 1H ЯМР (300 МГц, CDCl3); 6,93 (2Н, s), 6,73 (1Н, d), 6,39 (1H, d), 6,31 (1H, dd), 4,76 (2Н, br s), 4,43 (2Н, t), 4,03 (2Н, t), 3,77 (3H, s), 3,73 (2Н, s), 2,98 (3H, s), 2,57 (6H, s), 2,29 (3H, s), 2,25 (3H, s), 2,24-2,16 (2Н, m); LC-MS: m/z 580.
(ix) (R)-трет-бутил-1-(3-(4-((2-амино-4-(мезитилсульфонилокси)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)пирролидин-2-карбоксилат
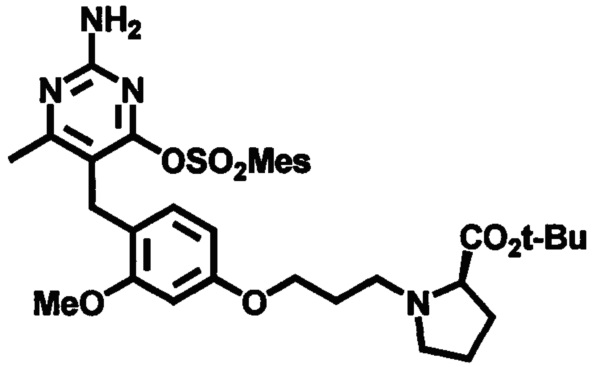
(R)-трет-бутилпирролидин-2-карбоксилат (485 мг) был добавлен к смеси карбоната калия (393 мг), йодида калия (31 мг) и неочищенного продукта со стадии (viii) в CH3CN (20 мл). После перемешивания в течение 16 час при 70°C реакционная смесь была охлаждена до RT, разбавлена водой и экстрагирована в EtOAc. Объединенный органический слой был промыт водой и соляным раствором, осушен и сконцентрирован под пониженным давлением. Остаток был очищен колоночной флэш-хроматографией на аминосиликагеле с получением представленного в подзаголовке соединения (975 мг) в виде белого, аморфного твердого вещества; 1H ЯМР (300 МГц, CDCl3); 6,92 (2Н, s), 6,67 (1H, d), 6,39 (1H, d), 6,30 (1H, dd), 4,64 (2Н, br s), 4,03-3,90 (2Н, m), 3,76 (3H, s), 3,73 (2Н, s), 3,20-3,00 (2Н, m), 2,96-2,80 (1H, m), 2,66-2,50 (1H, m), 2,57 (6H, s), 2,46-2,30 (1H, m), 2,28 (3H, s), 2,22 (3H, s), 2,21-1,74 (6H, m), 1,43 (9H, s); LC-MS: m/z 655.
(x) (R)-трет-бутил-1-(3-(4-((2-амино-4-((S)-1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)пирролидин-2-карбоксилат
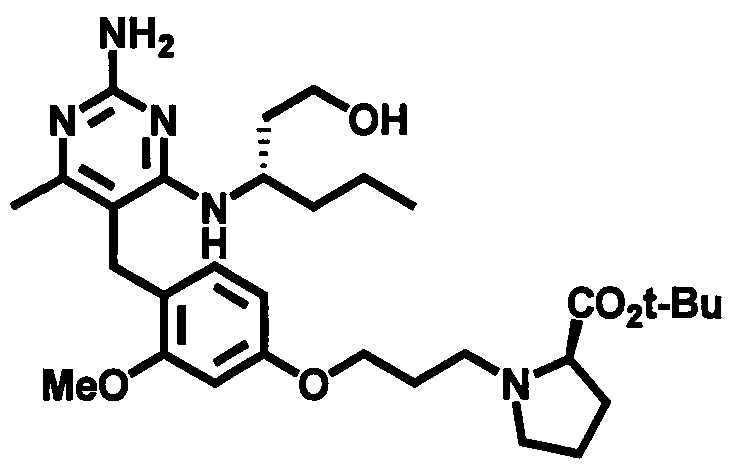
Трифторуксусная кислота (0,091 мл) была добавлена к смеси (S)-3-аминогексан-1-ола (416 мг) и продукта со стадии (ix) (775 мг) в пропионитриле (8 мл). После нагревания смеси в течение 16 час при 120°C реакционная смесь была охлаждена до RT, разбавлена насыщенным раствором бикарбоната натрия и экстрагирована в EtOAc. Объединенный органический слой был осушен и сконцентрирован под пониженным давлением. Остаток был очищен колоночной флэш-хроматографией на аминосиликагеле с получением представленного в подзаголовке соединения (520 мг) в виде смолы белого цвета; 1H ЯМР (CDCl3); 6,81 (1Н, d), 6,44 (1H, d), 6,38 (1H, dd), 4,80 (2H, br s), 4,13-4,03 (1H, m), 4,03-3,90 (2H, m), 3,84 (3H, s), 3,59 (2H, s), 3,49-3,37 (1H, m), 3,34-3,22 (1H, m), 3,18-3,08 (1H, m), 3,08-3,00 (1H, m), 2,91-2,80 (1H, m), 2,62-2,49 (1H, m), 2,41-2,30 (1H, m), 2,35 (3H, s), 2,10-1,70 (8H, m), 1,44-1,34 (1H, m), 1,42 (9H, s), 1,28-0,89 (4H, m), 0,75 (3H, t); LC-MS: m/z 573.
(xi) (R)-1-(3-(4-((2-амино-4-((S)-1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)пирролидин-2-карбоновая кислота
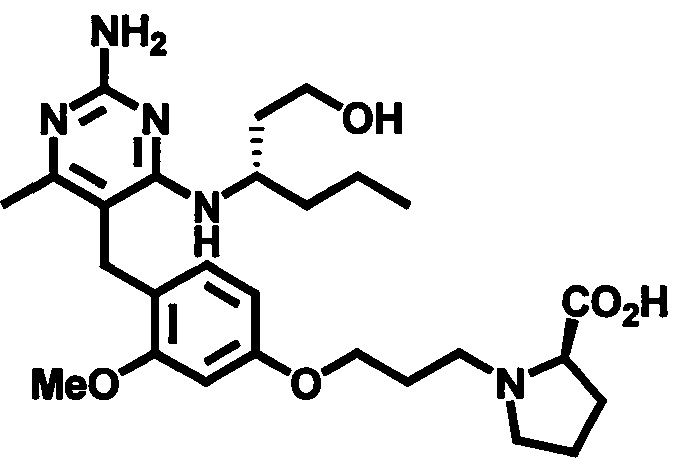
Трифторуксусная кислота (6 мл) была добавлена к продукту со стадии (x) (505 мг) и смесь перемешивалась при RT в течение 14 час. После того, как реакционная смесь была сконцентрирована, к остатку были добавлены 1М гидроксид натрия (20 мл) и метанол (10 мл), и смесь перемешивалась в метаноле в течение 30 минут. Реакционная смесь была сконцентрирована, разбавлена водой и промыта хлороформом. Водный слой был нейтрализован 6М соляной кислотой и насыщенным раствором бикарбоната натрия, и экстрагировался смесью хлороформ/EtOH (3/1). Объединенный органический слой был осушен и сконцентрирован. Остаток был разбавлен хлороформ, профильтрован, сконцентрирован и разбавлен смесью хлороформ/EtOAc. Осадок был собран фильтрацией, промыт EtOAc и высушен с получением 450 мг представленного в подзаголовке соединения в виде белого твердого вещества; 1H ЯМР (CDCl3); 6,78 (1Н, d), 6,48 (1Н, d), 6,38 (1Н, dd), 5,35-5,20 (1Н, m), 4,20-3,97 (3H, m), 3,86 (3H, s), 3,55 (2H, s), 3,63-3,47 (1Н, m), 3,40-3,09 (4H, m), 2,91-2,75 (1Н, m), 2,60-2,45 (1Н, m), 2,35 (3H, s), 2,30-2,02 (4H, m), 2,02-1,70 (3H, m), 1,50-1,33 (1Н, m), 1,33-0,95 (5H, m), 0,77 (3H, t); LC-MS: m/z 516.
Пример 9.
(S)-1-(3-(4-((2-амино-4-((S)-1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)пирролидин-2-карбоновая кислота
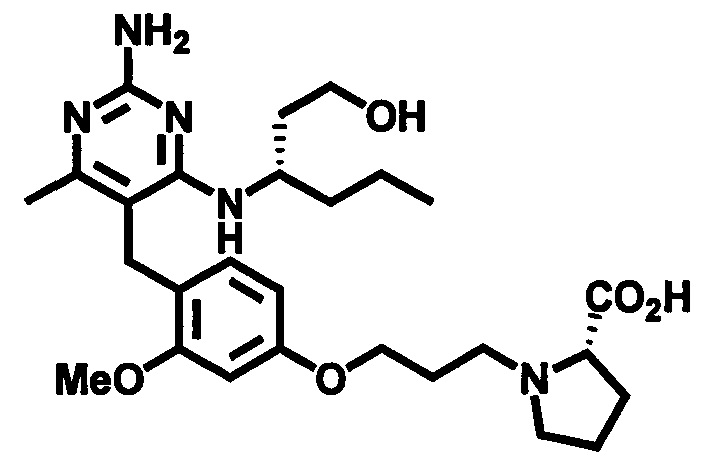
Указанное в заголовке соединение было приготовлено описанными ниже стадиями.
(i) 2-Амино-5-{4-[3-(трет-бутилдиметилсилилокси)пропокси]-2-метоксибензил}-6-метилпиримидин-4-ил-2,4,6-триметилбензолсульфонат
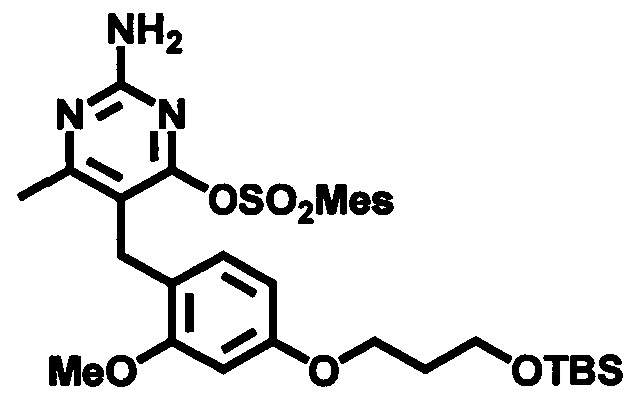
2-Мезитиленсульфонилхлорид (4,96 г, 22,7 ммоль) был добавлен к раствору N,N,N',N'-тетраметил-1,3-пропандиамина (3,79 мл, 22,7 ммоль) и продукта из примера 8, стадия (v) (6,55 г, 15,1 ммоль) в ТГФ (66 мл), и смесь была перемешана в течение 3 час при RT. Полученная смесь разбавлялась водой и экстрагировалась ЕtOАс. Объединенные органические растворы были промыты соляным раствором, осушены и сконцентрированы. Остаток был очищен хроматографическим способом на силикагеле с получением 8,87 г представленного в подзаголовке соединения в виде белого твердого вещества; 1H ЯМР ((CDCl3); 6,93 (2H, s), 6,71 (1Н, d), 6,41 (1Н, d), 6,33 (1Н, dd), 4,66 (2H, br s), 4,02 (2H, t), 3,78 (3H, s), 3,77-3,82 (2H, m), 3,75 (2H, s), 2,59 (6H, s), 2,31 (3H, s), 2,25 (3H, s), 1,93-2,01 (2H, m), 0,89 (9H, s), 0,05 (6H, s); LC-MS: m/z 616.
(ii) (S)-3-(2-амино-5-(4-(3-(трет-бутилдиметилсилилокси)пропокси)-2-метоксибензил)-6-метилпиримидин-4-иламино)гексан-1-ол
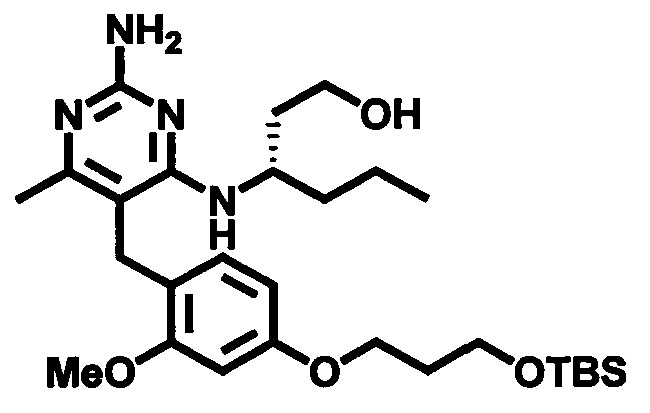
Трифторуксусная кислота (0,154 мл) была добавлена к смеси (S)-3-аминогексан-1-ола (586 мг) и продукта со стадии (i) (616 мг) в пропионитриле (6 мл). После нагревания смеси в течение 23 час при 120°C реакционная смесь была охлаждена до RT, разбавлена насыщенным раствором бикарбоната натрия и экстрагирована в EtOAc. Объединенный органический слой был осушен и сконцентрирован под пониженным давлением. Остаток был очищен колоночной флэш-хроматографией на аминосиликагеле с получением представленного в подзаголовке соединения (430 мг) в виде бесцветного масла; 1H ЯМР (CDCl3); 6,83 (1Н, d), 6,44 (1H, d), 6,39 (1H, dd), 4,79 (2H, br s), 4,15-4,04 (1H, m), 4,00 (2H, t), 3,85 (3H, s), 3,77 (2H, t), 3,60 (2H, s), 3,50-3,40 (1H, m), 3,33-3,22 (1H, m), 2,36 (3H, s), 2,00-1,88 (2H, m), 1,86-1,71 (1H, m), 1,48-1,32 (1H, m), 1,30-0,95 (4H, m), 0,86 (9H, s), 0,75 (3H, t), 0,01 (6H, s); LC-MS: m/z 534.
(iii) (S)-3-(2-амино-5-(4-(3-(трет-бутилдиметилсилилокси)пропокси)-2-метоксибензил)-6-метилпиримидин-4-иламино)гексил ацетат
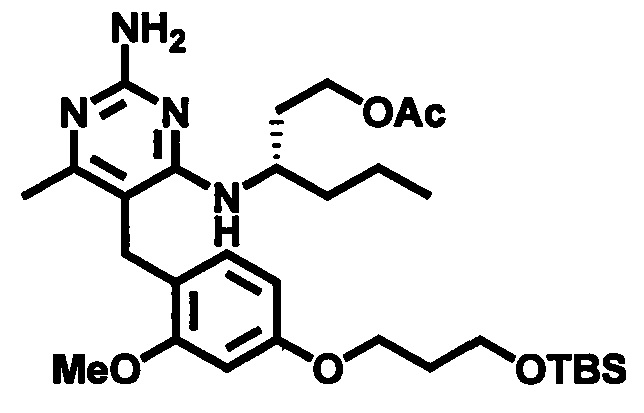
4-Диметиламинопиридин (каталитические количества) был добавлен к смеси уксусного ангидрида (0,162 мл), диизопропилэтиламина (0,697 мл) и продукта со стадии (ii) (760 мг) в ТГФ (10 мл). После перемешивания при RT в течение 3,5 час реакционная смесь была разбавлена водой и насыщенным раствором бикарбоната натрия и экстрагирована в EtOAc. Объединенный органический слой был промыт водой и соляным раствором, осушен и сконцентрирован под пониженным давлением с получением неочищенного продукта в виде светло-желтого масла, которое использовалось для последующей реакции без дальнейшей очистки; 1H ЯМР (CDCl3); 6,81 (1H, d), 6,44 (1H, d), 6,38 (1H, dd), 4,79 (2H, br s), 4,25-4,15 (1H, m), 3,99 (2H, t), 3,96-3,88 (2H, m), 3,85 (3H, s), 3,76 (2H, t), 3,58 (2H, s), 2,33 (3H, s), 1,97 (3H, s), 2,00-1,88 (2H, m), 1,86-1,71 (1H, m), 1,64-1,50 (1H, m), 1,48-1,32 (1H, m), 1,30-0,95 (3H, m), 0,86 (9H, s), 0,76 (3H, t), 0,02 (6H, s); LC-MS: m/z 576.
(iv) (S)-3-(2-амино-5-(4-(3-гидроксипропокси)-2-метоксибензил)-6-метилпиримидин-4-ил-амино)гексил ацетат
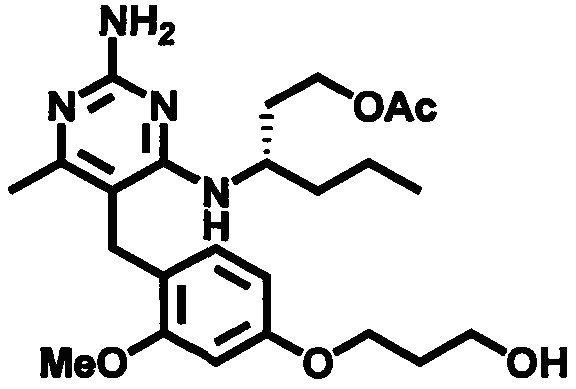
Тетра-н-бутиламмонийфторид (561 мг) был добавлен к смеси продукта со стадии (iii) в ТГФ (14 мл). После перемешивания при RT в течение 1,5 час реакционная смесь была разбавлена водой и насыщенным раствором бикарбоната натрия и экстрагирована в EtOAc. Объединенный органический слой был промыт соляным раствором, высушен и сконцентрирован под пониженным давлением. Остаток был очищен колоночной флэш-хроматографией на аминосиликагеле с получением представленного в подзаголовке соединения (660 мг) в виде бесцветного масла; 1H ЯМР (CDCl3); 6,82 (1Н, d), 6,45 (1H, d), 6,39 (1H, dd), 4,71 (2H, br s), 4,23-4,13 (1H, m), 4,07 (2H, t), 3,85 (3H, s), 3,85-3,74 (4H, m), 3,58 (2H, s), 2,33 (3H, s), 2,15 (1H, br s), 2,04-1,97 (2H, m), 1,97 (3H, s), 1,88-1,75 (1H, m), 1,60-1,47 (1H, m); 1,45-1,32 (1H, m), 1,31-1,19 (1H, m), 1,17-1,03 (2H, m), 0,79 (3H, t); LC-MS: m/z 461.
(v) (S)-3-(2-амино-5-(2-метокси-4-(3-(метилсульфонилокси)пропокси)бензил)-6-метилпиримидин-4-иламино)гексилацетат
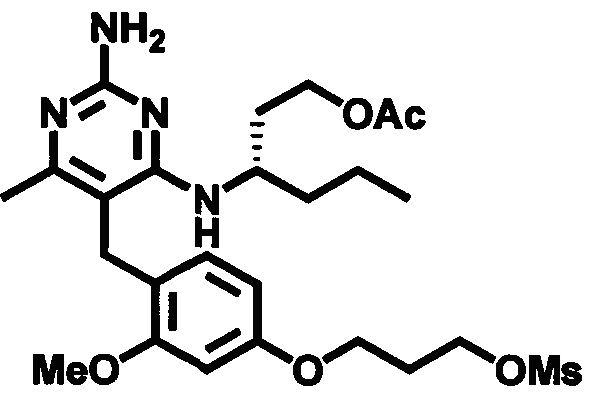
Метансульфонилхлорид (0,083 мл) был добавлен к раствору диизопропилэтиламина (0,279 мл) и продукта со стадии (iv) (0,246 г) в ТГФ (10 мл). Смесь перемешивалась при RT в течение 3 час, после чего был добавлен дополнительный диизопропилэтиламин (0,14 мл) и метансульфонилхлорид (0,042 мл). Смесь перемешивалась при RT в течение 2 час, разбавлялась водой и насыщенным раствором бикарбоната натрия и экстрагировалась EtOAc. Объединенный органический слой был осушен и сконцентрирован под пониженным давлением с получением неочищенного продукта (300 мг) в виде светло-желтого масла, которое использовалось для следующей реакции без дальнейшей очистки; LC-MS: m/z 539.
(vi) (S)-метил 1-(3-(4-((4-((S)-1-ацетоксигексан-3-иламино)-2-амино-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пирролидин-2-карбоксилат
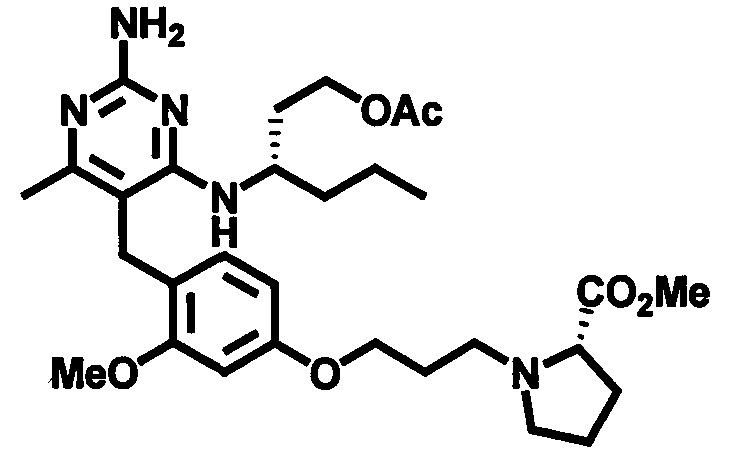
(S)-метилпирролидин-2-карбоксилат гидрохлорид (44 мг) был добавлен к смеси карбоната калия (74 мг), йодида калия (3 мг) и неочищенного продукта (75 мг) со стадии (v) в ацетонитриле (2 мл). После перемешивания в течение 16 час при 70°C реакционная смесь была охлаждена до RT, разбавлена водой и насыщенным раствором бикарбоната натрия и экстрагирована в EtOAc. Объединенный органический слой был осушен и сконцентрирован под пониженным давлением. Остаток был очищен колоночной флэш-хроматографией на аминосиликагеле с получением представленного в подзаголовке соединения (60 мг) в виде бесцветного масла; 1H ЯМР (CDCl3); 6,80 (1Н, d), 6,44 (1H, d), 6,37 (1H, dd), 4,85 (2H, br s), 4,24-4,15 (1H, m), 4,00-3,87 (4H, m), 3,85 (3H, s), 3,67 (3H, s), 3,57 (2H, s), 3,22-3,14 (2H, m), 2,89-2,78 (1H, m), 2,61-2,50 (1H, m), 2,42-2,30 (1H, m), 2,34 (3H, s), 2,16-2,05 (1H, s), 1,97 (3H, s), 1,97-1,70 (6H, m), 1,63-1,49 (1H, m), 1,46-1,32 (1H, m), 1,29-1,15 (1H, m), 1,12-0,98 (2H, m), 0,77 (3H, t); LC-MS: m/z 572.
(vii) (S)-1-(3-(4-((2-амино-4-((S)-1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)пирролидин-2-карбоновая кислота
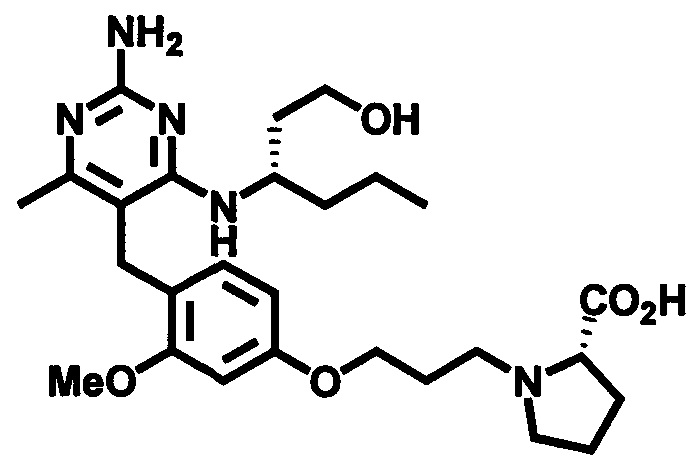
1М Гидроксид натрия (2 мл) был добавлен к раствору продукта (60 мг) со стадии (vi) в метаноле (2 мл) и смесь перемешивалась при RT в течение 9 час. Реакционная смесь была сконцентрирована, разбавлена водой и промыта хлороформом. Водный слой был нейтрализован 2М соляной кислотой (1 мл) и экстрагирован смесью хлороформ/EtOH (3/1). Объединенный органический слой был осушен и сконцентрирован. Остаток был разбавлен хлороформ, отфильтрован, сконцентрирован под пониженным давлением с получением представленного в подзаголовке соединения (48 мг) в виде белого твердого вещества; 1H ЯМР (CDCl3); 6,79 (1H, d), 6,48 (1H, d), 6,38 (1H, dd), 6,17 (1H, br s), 5,24 (1H, br s), 4,20-3,97 (3H, m), 3,85 (3H, s), 3,70-3,58 (1H, m), 3,55 (2H, s), 3,48-3,34 (2H, m), 3,32-3,15 (2H, m), 3,05-2,80 (1H, m), 2,75-2,55 (1H, m), 2,35 (3H, s), 2,30-2,07 (4H, m), 2,05-1,85 (2H, m), 1,85-1,70 (1H, m), 1,48-1,34 (1H, m), 1,33-0,98 (4H, m), 0,77 (3H, t); LC-MS: m/z 516.
Пример 10
(S)-3-((3-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(этил)амино)пропионовая кислота
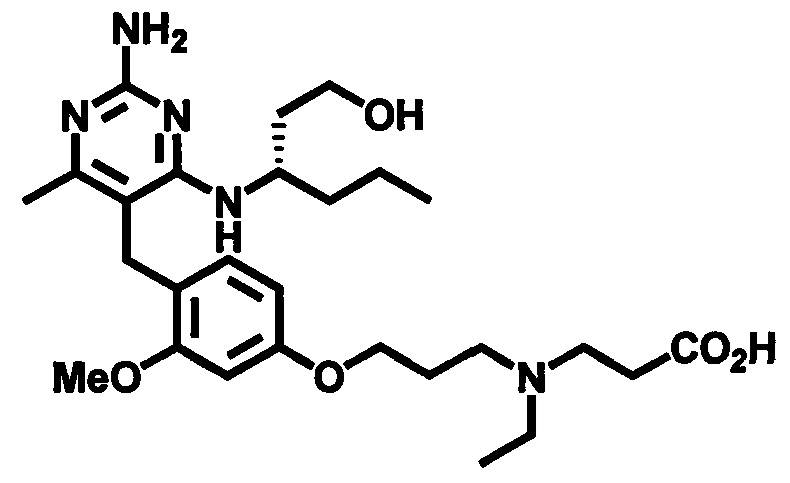
Указанное в заголовке соединение было приготовлено описанными ниже стадиями.
(i) (S)-этил 3-((3-(4-((4-(1-ацетоксигексан-3-иламино)-2-амино-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(этил)амино)пропаноат
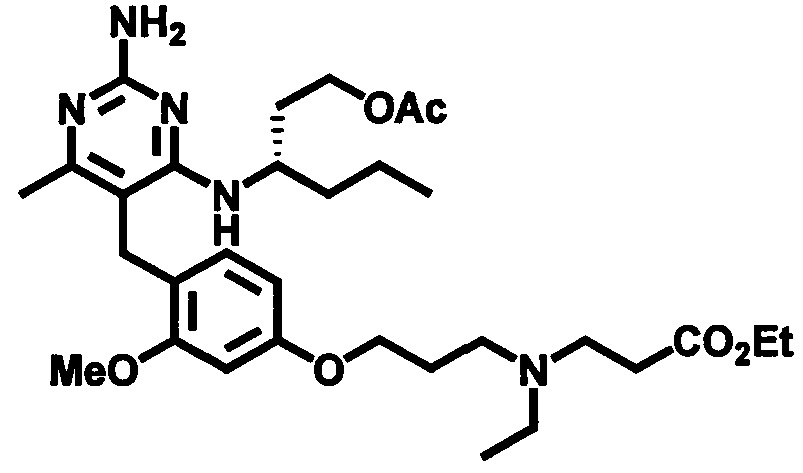
Указанное в подзаголовке соединение синтезировалось способом из примера 9, стадия (vi), из продукта со стадии (v) примера 9 (75 мг) и продукта со стадии (i) примера 5. Представленное в подзаголовке соединение (60 мг) было получено в виде светло-желтого масла; 1H ЯМР (300 МГц, CDCl3); 6,81 (1H, d), 6,45 (1H, d), 6,37 (1H, dd), 4,95 (2H, br s), 4,28-4,13 (1H, m), 4,09 (2H, q), 3,97-3,86 (4H, m), 3,86 (3H, s), 3,57 (2H, s), 2,77 (2H, t), 2,56 (2H, t), 2,50 (2H, q), 2,41 (2H, t), 2,35 (3H, s), 1,97 (3H, s), 1,92-1,70 (3H, m), 1,63-1,50 (1H, m), 1,46-1,32 (1H, m), 1,30-1,15 (2H, m), 1,22 (3H, t), 1,13-0,95 (2H, m), 0,99 (3H, t), 0,77 (3H, t); LC-MS: m/z 588.
(ii) (S)-3-((3-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(этил)амино)пропионовая кислота
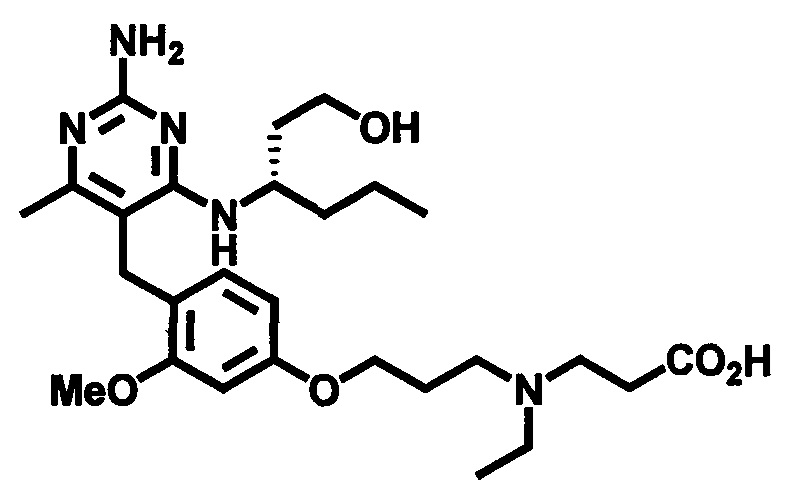
Указанное в подзаголовке соединение синтезировалось способом из примера 9, стадия (vii), из продукта со стадии (i) (60 мг). Представленное в подзаголовке соединение (47 мг) было получено в виде белого, аморфного твердого вещества; 1H ЯМР (300 МГц, CDCl3); 6,81 (1Н, d), 6,44 (1Н, d), 6,37 (1H, dd), 5,61 (1H, br s), 5,06-4,92 (1H, m), 4,18-4,04 (1H, m), 3,98 (2H, t), 3,86 (3H, s), 3,58 (2H, s), 3,46-3,36 (1H, m), 3,30-3,19 (1H, m), 2,94-2,66 (6H, m), 2,47 (2H, t), 2,35 (3H, s), 2,08-1,93 (2H, m), 1,85-1,70 (1H, m), 1,48-1,35 (1H, m), 1,34-1,00 (7H, m), 0,77 (3H, t); LC-MS: m/z 518.
Пример 11
(S)-2-((3-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(этил)амино)уксусная кислота
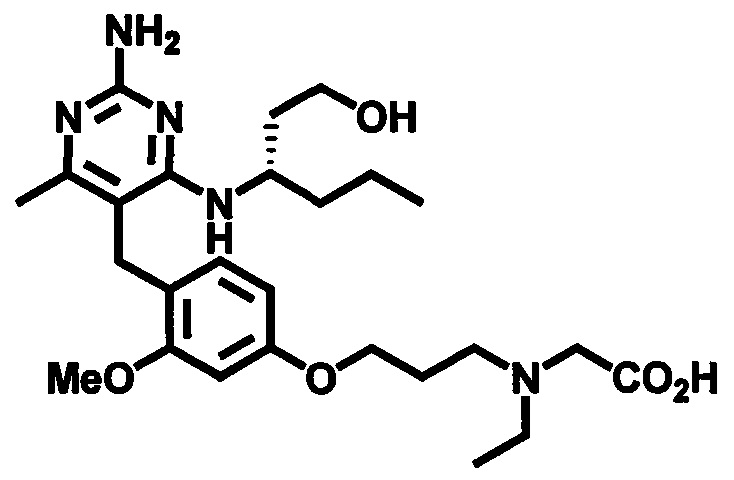
Указанное в заголовке соединение было приготовлено описанными ниже стадиями.
(i) (S)-этил 2-((3-(4-((4-(1-ацетоксигексан-3-иламино)-2-амино-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(этил)амино)ацетат
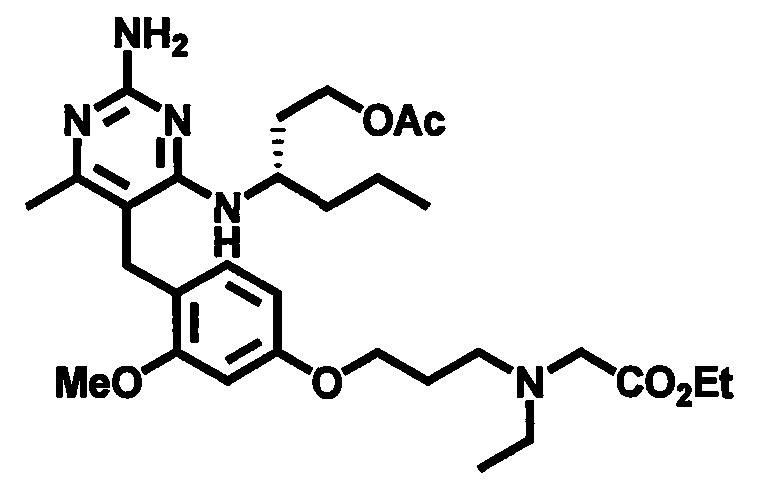
Указанное в подзаголовке соединение синтезировалось способом из примера 9, стадия (vi), из продукта со стадии (v) примера 9 (75 мг) и продукта со стадии (vi) примера 1. Представленное в подзаголовке соединение (60 мг) было получено в виде светло-желтого масла; 1H ЯМР (300 МГц, CDCl3); 6,81 (1H, d), 6,44 (1H, d), 6,38 (1H, dd), 4,95 (2H, br s), 4,28-4,05 (3H, m), 4,00-3,85 (4H, m), 3,85 (3H, s), 3,57 (2H, s), 3,32 (2H, s), 2,77-2,62 (4H, m), 2,36 (3H, s), 1,97 (3H, s), 1,95-1,72 (3H, m), 1,63-1,50 (1H, m), 1,48-1,33 (1H, m), 1,30-1,15 (2H, m), 1,24 (3H, t), 1,11-0,98 (2H, m), 1,03 (3H, t), 0,77 (3H, t); LC-MS: m/z 574.
(ii) (S)-2-((3-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(этил)амино)уксусная кислота
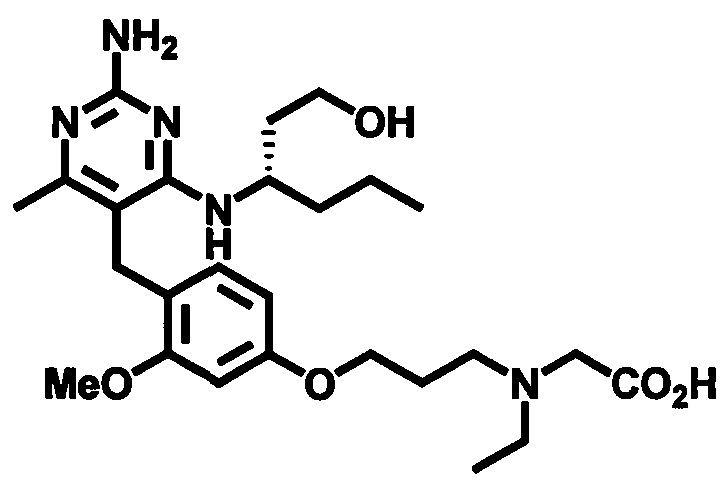
Указанное в подзаголовке соединение синтезировалось способом из примера 9, стадия (vii), из продукта со стадии (i) (52 мг). Представленное в подзаголовке соединение (44 мг) было получено в виде белого, аморфного твердого вещества; 1H ЯМР (300 МГц, CDCl3); 6,90-6,60 (1H, m), 6,79 (1H, d), 6,47 (1H, d), 6,40 (1H, dd), 5,40 (1H, d), 4,20-4,07 (1H, m), 4,03 (2H, t), 3,85 (3H, s), 3,55 (2H, s), 3,40-3,30 (1H, m), 3,32 (2H, s), 3,24-3,14 (1H, m), 3,02-2,87 (4H, m), 2,37 (3H, s), 2,10-1,98 (2H, m), 1,85-1,70 (1H, m), 1,49-1,36 (1H, m), 1,34-0,98 (7H, m), 0,78 (3H, t); LC-MS: m/z 504.
Пример 12
(S)-2-((3-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(2,2-дифторэтил)амино)уксусная кислота
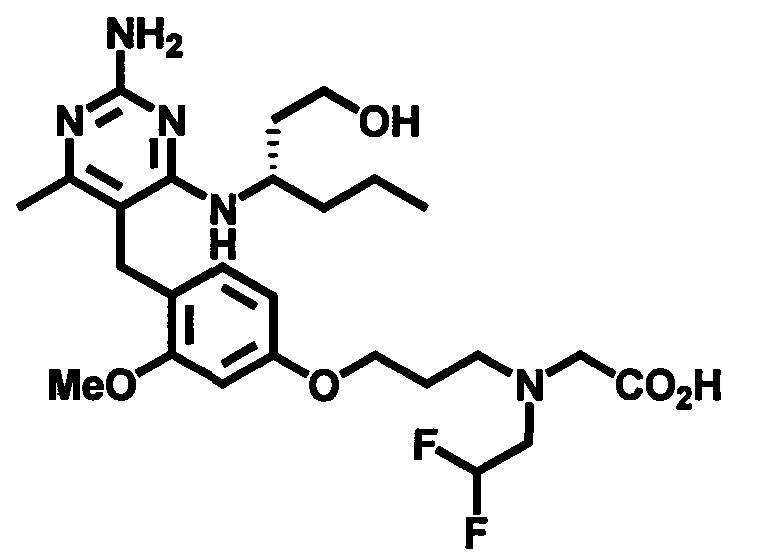
Указанное в заголовке соединение было приготовлено описанными ниже стадиями.
(i) (S)-этил 2-((3-(4-((4-(1-ацетоксигексан-3-иламино)-2-амино-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(2,2-дифторэтил)амино)ацетат
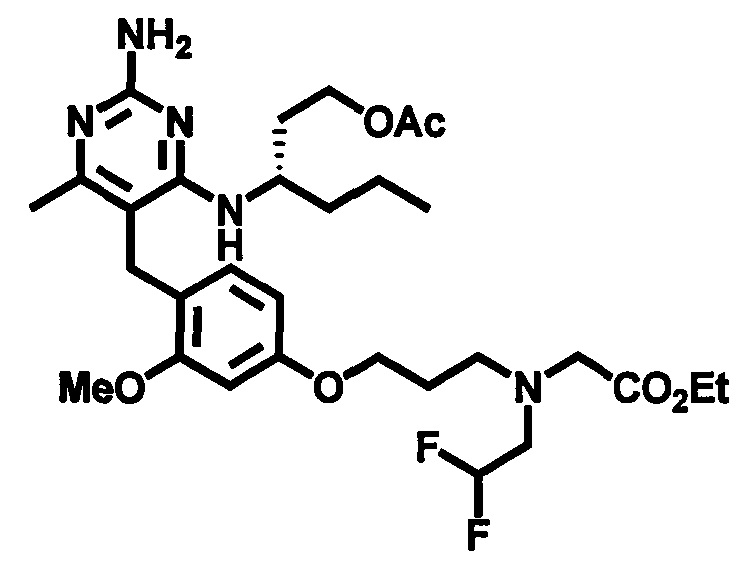
Указанное в подзаголовке соединение синтезировалось способом из примера 9, стадия (vi), из продукта со стадии (v) примера 9 (75 мг) и продукта со стадии (i) примера 3 (112 мг). Представленное в подзаголовке соединение (44 мг) было получено в виде светло-желтого масла; 1H ЯМР (300 МГц, CDCl3); 6,81 (1Н, d), 6,44 (1H, d), 6,37 (1H, dd), 5,77 (1H, tt), 4,97 (2H, br s), 4,28-4,09 (3H, m), 4,00-3,85 (4H, m), 3,86 (3H, s), 3,58 (2H, s), 3,45 (2H, s), 3,11-2,86 (4H, m), 2,36 (3H, s), 1,97 (3H, s), 1,95-1,74 (3H, m), 1,63-1,50 (1H, m), 1,46-1,33 (1H, m), 1,30-1,15 (5H, m), 1,12-0,98 (2H, m), 0,77 (3H, t); LC-MS: m/z 610.
(ii) (S)-2-((3-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксифенокси)пропил)(2,2-дифторэтил)амино)уксусная кислота
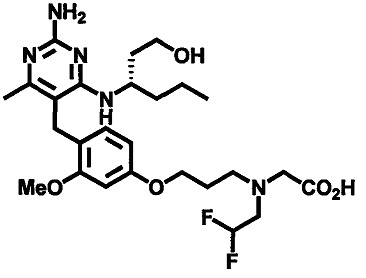
Указанное в подзаголовке соединение синтезировалось способом из примера 9, стадия (vii), из продукта со стадии (i) (44 мг). Представленное в подзаголовке соединение (38 мг) было получено в виде белого, аморфного твердого вещества; 1H ЯМР (300 МГц, CDCl3); 6,80 (1H, d), 6,48-6,40 (2H, m), 5,89 (1H, tt), 5,89-5,73 (1H, m), 4,28-4,13 (1H, m), 4,07-3,97 (2H, m), 3,86 (3H, s), 3,63-3,56 (1H, m), 3,56 (2H, s), 3,40-3,30 (1H, m), 3,33 (2H, s), 3,17-2,85 (5H, m), 2,44 (3H, s), 1,96-1,85 (2H, m), 1,85-1,71 (1H, m), 1,52-1,39 (1H, m), 1,39-1,00 (4H, m), 0,81 (3H, t); LC-MS: m/z 540.
Пример 13
(R)-1-(4-((2-амино-4-((S)-1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)пирролидин-2-карбоновая кислота
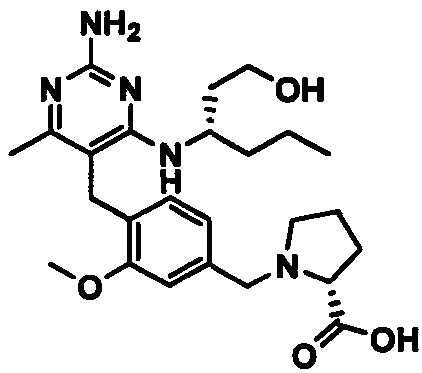
Указанное в заголовке соединение было приготовлено описанной ниже последовательностью стадий.
(i) (R)-трет-бутил-1-(4-((2-амино-4-(мезитилсульфонилокси)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)пирролидин-2-карбоксилат
Соединение подзаголовка синтезировалось способом из примера 1, стадия (vii), из продукта со стадии (v) примера 1 (200 мг) и (R)-трет-бутилпирролидин-2-карбоксилата (108 мг). Представленное в подзаголовке соединение (234 мг) было получено в виде бесцветного, аморфного твердого вещества; LC-MS: m/z 611.
(ii) (R)-трет-бутил-1-(4-((2-амино-4-((S)-1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)пирролидин-2-карбоксилат
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (viii), из продукта со стадии (i) (234 мг) и (S)-3-аминогексан-1-ола (X мг). Представленное в подзаголовке соединение (70 мг) было получено в виде бесцветного, аморфного твердого вещества; LC-MS: m/z 528.
(iii) (R)-1-(4-((2-амино-4-((S)-1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)пирролидин-2-карбоновая кислота
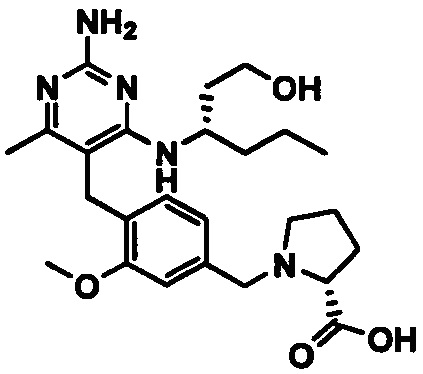
К раствору продукта со стадии (ii) (70 мг) в хлороформе (1,5 мл) была добавлена трифторуксусная кислота (1,5 мл) и смесь перемешивалась при RT. Спустя 12 час при комнатной температуре был примешан метанол (10 мл). Через 12 час смесь была сконцентрирована под пониженным давлением. Был добавлен 10%-ый водный раствор бикарбоната калия и полученная смесь экстрагировалась смесью хлороформ/EtOH (3/1). Объединенный органический слой был осушен и сконцентрирован под пониженным давлением с получением представленного в подзаголовке соединения (50 мг) в виде белого твердого вещества; 1H ЯМР (метанол-d4); 7,23 (1Н, d), 7,02-6,97 (2Н, m), 4,47 (1Н, m), 4,34 (2Н, s), 3,97 (3H, s), 3,85-3,80 (3H, m), 3,64 (1Н, m), 3,45-3,41 (2Н, m), 2,44 (1Н, m), 2,28 (3H, s), 2,11 (2Н, m), 1,96 (1Н, m), 1,74-1,20 (7H, m), 0,87 (3H, t); LC-MS: m/z 472.
Пример 14
(S)-1-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)-1Н-имидазол-5-карбоновая кислота
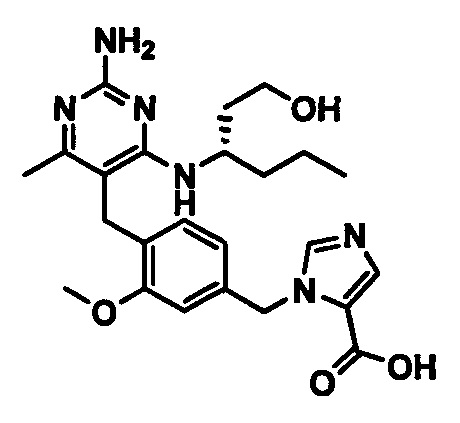
Указанное в заголовке соединение было приготовлено описанной ниже последовательностью стадий.
(i) Метил-1-(4-((2-амино-4-(мезитиленсульфонилокси)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)-1Н-имидазол-5-карбоксилат
Соединение подзаголовка синтезировалось способом из примера 1, стадия (vii), из продукта со стадии (v) примера 1 (500 мг) и метил-1Н-имидазол-5-карбоксилата (199 мг). Представленное в подзаголовке соединение (90 мг) было получено в виде белого твердого вещества; 1H ЯМР (300 МГц, CDCl3); 7,73 (1Н, s), 7,61 (1Н, s), 6,89 (2Н, s), 6,83 (1Н, d), 6,61 (1Н, s), 6,55 (1Н, d), 5,42 (2Н, s), 3,78 (3H, s), 3,68 (5H, s), 2,46 (3H, s), 2,42 (6H, s), 2,26 (3H, s); LC-MS: m/z 566.
(ii) (S)-метил 1-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)-1Н-имидазол-5-карбоксилат
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (viii), из продукта со стадии (i) (90 мг) и (S)-3-аминогексан-1-ола (56 мг). Представленное в подзаголовке соединение (53 мг) было получено в виде бесцветного масла; LC-MS: m/z 483.
(iii) (S)-1-(4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)-1Н-имидазол-5-карбоновая кислота
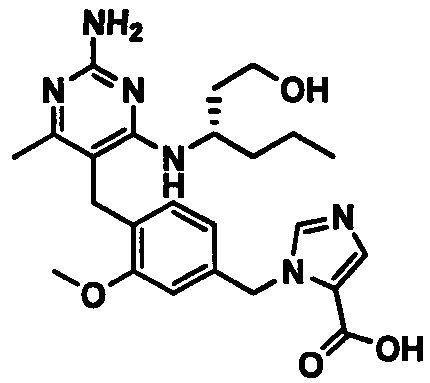
Указанное в подзаголовке соединение синтезировалось способом из примера 1, стадия (ix), из продукта со стадии (ii) (53 мг). Представленное в подзаголовке соединение (16 мг) было получено в виде бесцветного, аморфного твердого вещества; LC-MS: m/z 469.
Пример 15. Альтернативный вариант для
(S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусной кислоты
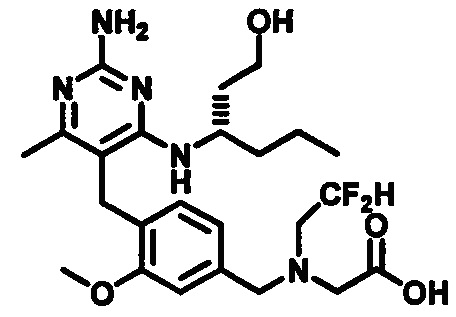
Указанное в заголовке соединение было приготовлено описанной ниже последовательностью стадий.
(i) трет-Бутил-2-(2,2-дифторэтиламино)ацетат
трет-Бутилбромацетат (2,72 г) был добавлен к суспензии 2,2-дифторэтиламина (1,46 г) и карбоната калия (2,48 г) в ацетонитриле (5 мл) и смесь перемешивалась при RT в течение 24 час. Смесь была разбавлена EtOAc (10 мл) и гексаном (10 мл). Суспензия была промыта смесью водного раствора NaHCO3 (20 мл) и соляного раствора (10 мл). Органические экстракты были осушены и сконцентрированы в вакууме с получением неочищенного продукта. Сырой продукт был очищен перегонкой в вакууме (12 ГПа, 78-80°C) с получением представленного в подзаголовке соединения (1,85 г) в виде бесцветного масла; 1H ЯМР (300 МГц, CDCl3); 5,82 (1Н, tt, J=4,4, 56 Гц), 3,45 (2Н, s), 2,98 (2H, dt, J=4,4,15,1 Гц), 1,45 (9Н, s).
(ii) 2-Амино-5-(4-хлорметил-2-метоксибензил)-6-метилпиримидин-4-ил 2,4,6-триизопропилбензолсульфонат
К раствору 2-амино-5-(4-гидроксиметил-2-метоксибензил)-6-метилпиримидин-4-ола (5,0 г) и N,N-диизопропилэтиламина (11,7 г) в тетрагидрофуране (50 г) был добавлен 2,4,6-триизопропилбензолсульфонилхлорид (8,3 г) и нагревался с обратным холодильником в течение 10 час. После охлаждения до RT к реакционной смеси был добавлен хлорид лития (2,3 г) и перемешивался в течение 0,5 час, на протяжении 0,25 час по каплям был добавлен метансульфонилхлорид (4,2 г) и реакционная смесь перемешивалась 4 час при RT. К реакционной смеси была добавлена вода (25 г) и выполнена экстракция в этилацетат (25 г). Органический слой был промыт водой (25 мл) и сконцентрирован в вакууме. К остатку был добавлен толуол (20 г) и сконцентрирован под вакуумом с получением светло-коричневого твердого вещества. Для получения представленного в подзаголовке соединения (6,8 г) твердое вещество было осаждено толуолом (30 г).
1H-ЯМР (300 МГц, CDCl3) δ 7,17 (2H, s), 6,90-6,82 (3Н, m), 5,16 (2H, brs), 4,55 (2H, s), 4,10 (2H, септет, J=6,8 Гц), 3,82 (3Н, s), 3,81 (2H, s), 2,91 (1Н, септет, J=6,8 Гц), 2,32 (3Н, s), 1,25 (6H, d, J=7,2 Гц), 1,19 (12Н, d, J=6,8 Гц).
(iii) трет-Бутил-2-((4-((2-амино-4-метил-6-(2,4,б-триизопропилфенилсульфонилокси)пиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)ацетат
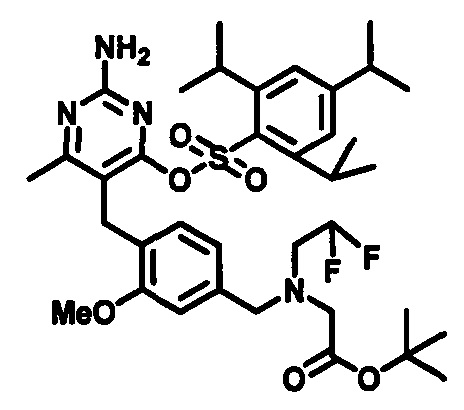
Смесь продукта со стадии (i) (209 мг), стадии (ii) (500 мг), карбоната натрия (283 мг) и йодида калия (44 мг) в ацетонитриле (4,0 г) была нагрета с обратным холодильником на протяжении 7 час. После охлаждения до RT к смеси была добавлена вода (7,5 мл) и выполнена экстракция в смесь EtOAc (10 мл) и н-гептана (4 мл). Органический слой был осушен с Na2SO4 и сконцентрирован в вакууме. Остаток был осажден с н-гептаном (18 г) с получением представленного в подзаголовке соединения (537 мг).
1H-ЯМР (300 МГц, CDCl3) δ 7,24 (2Н, s), 6,83 (1Н, s), 6,78 (1H, d, J=7,6 Гц), 6,71 (1H, dd, J=7,6 Гц, 1,2 Гц), 5,74 (1H, tt, J=4,4, 56 Гц), 4,73 (2Н, brs), 4,17-4,08 (2H, m), 3,85 (2H, s), 3,80-3,77 (5H, m), 3,33 (2H, s), 3,04 (2H, dt, J=4,4, 15 Гц), 2,93-2,85 (1H, m), 2,23 (3H, s), 1,45 (9H, s), 1,18 (6H, d, J=6,8 Гц), 1,12 (12H, d, J=6,8 Гц).
(iv) (S)-трет-бутил-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)ацетат
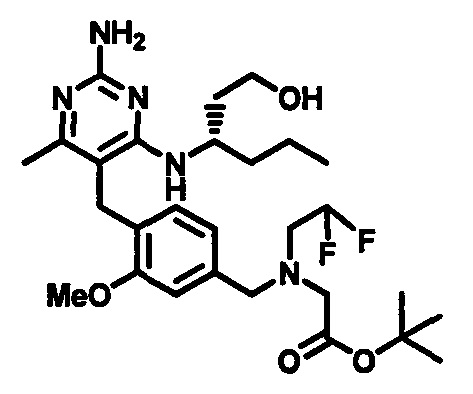
Смесь продукта со стадии (iii) (300 мг), (S)-3-амино-1-гексанола (98 мг) и трифторуксусной кислоты (24 мг) в моно-хлорбензоле (1,5 мл) нагревалась с обратным холодильником в течение 8 час. Смесь была охлаждена до RT и разбавлена толуолом (4 мл) и ТГФ (1 мл). Смесь была троекратно промыта 0,5% водным раствором LiOH (10 мл) и соляным раствором (5 мл). Органический слой был осушен, сконцентрирован в вакууме и очищен колоночной флэш-хроматографией на силикагеле с получением представленного в подзаголовке соединения (210 мг) в виде бесцветного масла. 1H ЯМР (300 МГц, CDCl3); 6,91-6,76 (2H, m), 6,78 (1H, d, J=7,6 Гц), 5,73 (1H, tt, J=4,4, 56 Гц), 4,87 (1H, brs), 4,69 (2H, brs), 4,15-4,05 (1H, m), 3,88 (3H, s), 3,85 (2H, s), 3,66 (1H, s), 3,48-3,42 (2H, m), 3,30-3,07 (3H, m), 3,03 (2H, dt, J=4,4, 15 Гц), 2,35 (3H, s), 1,83-1,75 (1H, m), 1,43-0,99 (15H, m), 0,74 (3H, t, J=7,6 Гц).
(v) (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2-дифторэтил)амино)уксусная кислота
Смесь продукта со стадии (iv) (13 мг) в 3N HCl (1 мл) перемешивалась при 50°C в течение 1,5 час. Смесь была охлаждена до RT и pH смеси был отрегулирован lN водным NaOH до величины между 5 и 6. Смесь экстрагировалась смесью этанол/хлороформ (1/3) и органический слой был осушен и сконцентрирован в вакууме с получением представленного в подзаголовке соединения (12 мг) в виде бесцветного порошка.
Пример 16
Альтернативная методика получения (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусной кислоты
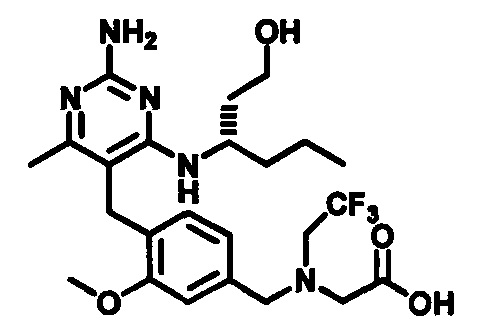
Указанное в заголовке соединение было приготовлено описанной ниже последовательностью стадий.
(i) трет-Бутил-2-(2,2,2-трифторэтиламино)ацетат
Представленное в подзаголовке соединение было синтезировано способом из примера 15, стадия (i), из трет-бутилбромацетата (13,6 г) и 2,2,2-трифторэтиламина (8,9 г). Указанное в подзаголовке соединение (11 г) было получено в виде бесцветного масла; 1H ЯМР (300 МГц, CDCl3); 3,39 (2Н, s), 3,20 (2Н, q, J=9,4 Гц), 1,44 (9Н, s).
(ii) трет-Бутил-2-((4-бром-3-метоксибензил)(2,2,2-трифторэтил)амино)ацетат
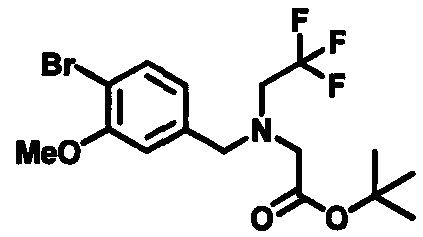
Смесь 1-бром-4-(бромметил)-2-метоксибензола (200 мг), продукта со стадии (i) (228 мг), карбоната калия (179 мг) и йодида калия (35 мг) в N,N-диметилацетамиде (2 мл) перемешивалась при 75°C в течение 2 час. Смесь была разбавлена EtOAc (10 мл) и промыта водой (10 мл) и соляным раствором (10 мл). Органический слой был осушен, сконцентрирован в вакууме и очищен колоночной флэш-хроматографией на силикагеле с получением представленного в подзаголовке соединения (166 мг) в виде бесцветного масла; 1H ЯМР (300 МГц, DMSO-d6); 7,51 (1Н, d, J=8,0 Гц), 7,12 (1Н, d, J=1,6 Гц), 6,82 (1H, dd, J=1,6, 8,0 Гц), 3,89 (2Н, s), 3,81 (3H, s), 3,50 (2H, q, J=10 Гц), 3,35 (2Н, s), 1,41 (9H, s).
(iii) Метил-2-(4-(((2-трет-бутокси-2-оксоэтил)(2,2,2-трифторэтил)амино)метил)-2-метоксибензил)-3-оксибутаноат
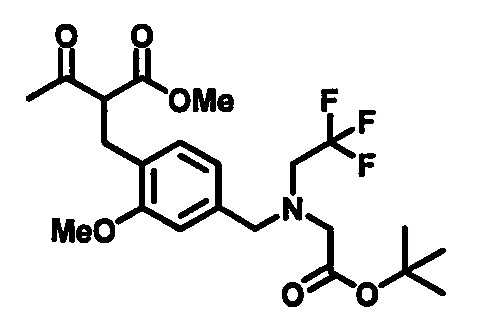
Смесь продукта со стадии (ii) (110 мг), метил-3-гидрокси-2-метиленбутаноата (70 мг), N-метилдициклогексиламина (105 мг), тетра-бутиламмонийхлорида (8 мг) и 1,1'-бис(ди-трет-бутилфосфино)ферроцен дихлорида палладия (19 мг) в N,N-диметилацетамиде (1 мл) перемешивалась при 100°C в течение 8 час. Смесь была разбавлена EtOAc (10 мл) и промыта водным раствором NaHCO3 (10 мл). Органический слой был осушен, сконцентрирован в вакууме и очищен колоночной флэш-хроматографией на силикагеле с получением представленного в подзаголовке соединения (81 мг) в виде бесцветного масла; 1H ЯМР (300 МГц, DMSO-d6); 7,01 (1Н, d, J=8,0 Гц), 6,86 (1H, d, J=1,6 Гц), 6,75 (1Н, dd, J=1,6, 3,91 Гц), -3,84 (2Н, s), 3,81 (3H, s), 3,75 (2Н, q, J=10 Гц), 3,57 (2Н, s), 1,41 (9H, s). MS:APCI 462 (M+1).
(iv) трет-Бутил-2-((4-((2-амино-4-гидрокси-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)ацетат
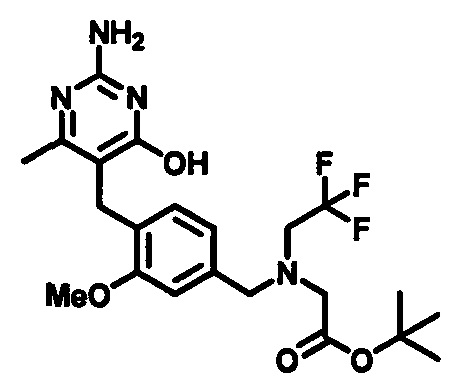
Смесь продукта со стадии (iii) (75 мг) и гуанидинкарбоната (50 мг) в MeOH (1 мл) перемешивалась при 65°C в течение 12 час. Смесь была охлаждена до RT и pH смеси был отрегулирован уксусной кислотой до величины около 8, после чего она перемешивалась в течение 0,5 час. Остаток был отфильтрован и фильтрат очищен колоночной флэш-хроматографией на силикагеле с получением представленного в подзаголовке соединения (35 мг) в виде бесцветного порошка; 1H ЯМР (300 МГц, DMSO-d6); 10,71 (1Н, s), 6,87-6,84 (1Н, m), 6,79-6,77 (1Н, m), 6,71-6,68 (1Н, m), 6,28 (2Н, s), 3,85 (2Н, s), 3,78 (3H, s), 3,52-3,45 (4H, m), 1,92 (3H, s), 1,41 (9H, s).
(v) трет-Бутил-2-((4-((2-амино-4-метил-6-(2,4,6-триизопропилфенилсульфонилокси)пиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)ацетат
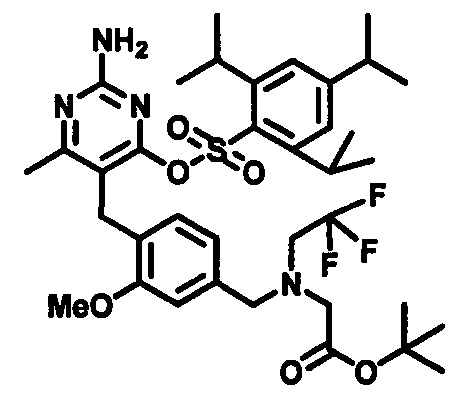
Смесь продукта со стадии (iv) (28 мг), 2,4,6-триизопропилбензолсульфонилхлорида (30 мг) и DABCO (1,4-диазабицикло[2.2.2]октан) (5,5 мг) в ТГФ (1 мл) перемешивалась в течение 3 часов при 40°C. Смесь была охлаждена до RT и разбавлена EtOAc (10 мл). Смесь была промыта водным раствором NaHCO3 (10 мл). Органический слой был осушен, сконцентрирован в вакууме и очищен колоночной флэш-хроматографией на силикагеле с получением представленного в подзаголовке соединения (28 мг) в виде бесцветного масла; 1H-ЯМР (300 МГц, CDCl3) δ 7,16 (2H, s), 6,88 (1Н, d, J=1,2 Гц), 6,79 (1H, d, J=7,6 Гц), 6,71 (1H, dd, J=7,6 Гц, 1,2 Гц), 4,73 (2Н, brs), 4,15 (2H, септет, J=6,8 Гц), 3,92 (2Н, s), 3,82 (2Н, s), 3,80 (3H, s), 3,39-3,32 (4H, m), 2,91 (1H, септет, J=7,2 Гц), 2,25 (3Н, s), 1,47 (9H, s), 1,25 (6H, d, J-6,8 Гц), 1,19 (12H, d, J=6,4 Гц).
(vi) (S)-трет-Бутил-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)ацетат
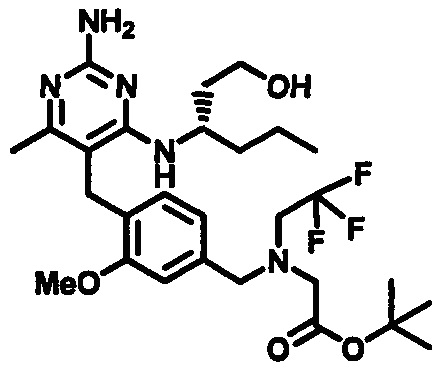
Указанное в подзаголовке соединение синтезировалось способом из примера 15, стадия (iv), из продукта со стадии (i) примера 16 (25 мг). Представленное в подзаголовке соединение (12 мг) было получено в виде бесцветного масла; 1H ЯМР (300 МГц, CD3OD ); 7,01 (1H, s), 6,87-6,85 (1H, m), 6,81-6,78 (1H, m), 4,23-4,20 (1H, m), 3,92 (2Н, s), 3,90 (3Н, s), 3,72 (2Н, s), 3,44-3,30 (6H, m), 2,24 (3Н, s), 1,85-1,70 (1H, m), 1,46-1,30 (13H, m), 1,23-1,08 (2Н, m), 0,81-0,77 (3Н, m).
(vii) (S)-2-((4-((2-амино-4-(1-гидроксигексан-3-иламино)-6-метилпиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)уксусная кислота
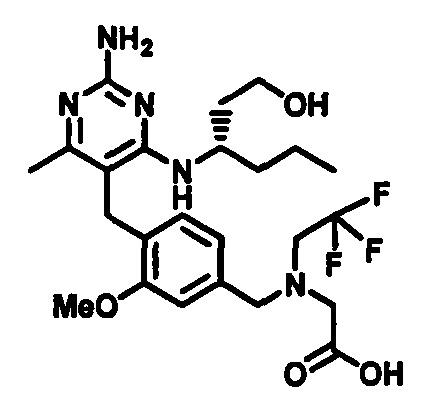
Указанное в подзаголовке соединение синтезировалось способом из примера 15, стадия (v), из продукта со стадии (vi) (12 мг). Представленное в подзаголовке соединение (11 мг) было получено в виде бесцветного порошка.
Пример 17. Альтернативная методика получения трет-бутил-2-((4-((2-амино-4-метил-6-(2,4,6-триизопропилфенилсульфонилокси)пиримидин-5-ил)метил)-3-метоксибензил)(2,2,2-трифторэтил)амино)ацетата
Смесь 2-амино-5-(4-хлорметил-2-метоксибензил)-6-метилпиримидин-4-ил 2,4,6-триизопропилбензолсульфоната (6,0 г), трет-бутил-2-(2,2,2-трифторэтиламино)ацетата (2,7 г), карбоната натрия (3,4 г) и йодида калия (0,5 г) в ацетонитриле (48 г) нагревалась с обратным холодильником в течение 8 час. После охлаждения до RT к смеси была добавлена вода (30 г) и выполнена экстракция в толуол (48 г). Органический слой был промыт водой (30 мл) и сконцентрирован в вакууме. Остаток был осажден с н-гептаном (18 г) с получением представленного в подзаголовке соединения (12,2 г).
Пример 18. Приготовление формы В соединения из Примера 3
К раствору продукта со стадии (iii) из примера 3 (1,38 г) в MeOH (12,5 мл) был добавлен 3М водный раствор NaOH (4,2 мл). Смесь перемешивалась в течение 3 час при комнатной температуре и нейтрализовалась 4М водным раствором HCl (5,0 мл) и насыщенным водным раствором NaHCO3 (5,0 мл). Полученная суспензия была сконцентрирована до около половины объема. Затем были отфильтрованы осадившиеся кристаллы и промыты холодной водой (15 мл). После вакуумной сушки был получена форма В соединения из примера 3 (1,0 г) в виде белого твердого вещества.
Пример 19. Приготовление формы А соединения из Примера 3
Соединение из Примера 18 (45 мг) было смешано с водой (1 мл) и ацетоном (0,2 мл) и перемешивалось при 60°C в течение 1 часа. Затем была добавлена вода (0,5 мл) и смесь охлаждена до температуры окружающей среды. Спустя 1 час были отфильтрованы осадившиеся кристаллы. После вакуумной сушки был получена форма А соединения из примера 3 (38 мг) в виде белого твердого вещества.
Пример 20. Приготовление формы Е соединения из Примера 3
Соединение из Примера 19 (5 мг) было растворено при 90°C в EtOH (50 мл). Раствор был охлажден до температуры окружающей среды. Через 1 час выпавшие кристаллы отфильтровывались и оставлялись на 3 дня в условиях 93% влажности RH. Форма Е из примера 3 (2 мг) была получена в виде белого твердого вещества.
Пример 21. Приготовление формы А соединения из Примера 4
К раствору в MeOH (2 мл) продукта со стадии (iii) из примера 4 (170 мг) был добавлен 3N NaOH (0,5 мл). Раствор перемешивался при комнатной температуре в течение 1,5 час. Реакционная смесь была подкислена 2N HCl (1,4 мл), нейтрализовала насыщенным водным раствором NaHCO3 (0,3 мл) и экстрагирована смесью CHCl3/EtOH (объемное отношение 3/1). Объединенный органический слой был осушен над Na2SO4, профильтрован и сконцентрирован под пониженным давлением. К остатку был добавлен EtOAC (20 мл) и подвергнут ультразвуковой обработке. Смесь перемешивалась с обратным холодильником в течение 5 мин, а затем охлаждалась до комнатной температуры. Суспензия перемешивалась при комнатной температуре в течение 30 мин. С помощью фильтрации был собран осадок. Форма А соединения из примера 4 (143 мг) была получена в виде белого твердого вещества.
Пример 22. Дифференциальная сканирующая калориметрия (DSC) соединения, полученного в Примерах 18-21
Был исследован калориметрический отклик образца для испытаний на увеличение температуры с помощью дифференциального сканирующего калориметра (DSC) ТА Instruments Q1000. Измерения выполнялись от 10 до 250°C при скорости изменений 10°C в минуту. Приблизительно от 0,5 до 5 мг исследуемого образца помещалось в алюминиевую чашку с крышкой (гофрированную и перфорированную) под током газообразного азота (50 мл/мин).
Результаты представлены на Фигурах 1-4. Эндотермический пик и экзотермический пик проявились от 260°C.
Пример 23. Исследования соединения, полученного в Примерах 18-21, методом рентгеновской порошковой дифрактометрии
При анализе использовалась система Panalytical X'pert Alpha 1 с монохроматическим излучением CuK α (45 кВ и 40 мА). Основная оптика содержала металлическую маску и автоматическую щель расходимости. Плоские образцы были приготовлены на пластинах с нулевым уровнем фона, которые вращались во время измерений. Вторичная оптика содержала щелевые коллиматоры Соллера, автоматические антирассеивающие щели и монохроматор. Дифрагированный сигнал обнаруживался детектором (X'Celerator). Дифрактограммы снимались на углах 4°≤2θ (тета)≤30-40° в режиме непрерывного сканирования со 100-секундной экспозицией через 0,017°. Исходные данные сохранялись на электронном носителе.
Результаты показаны на Фигурах 5-8 и в Таблицах 1-4.
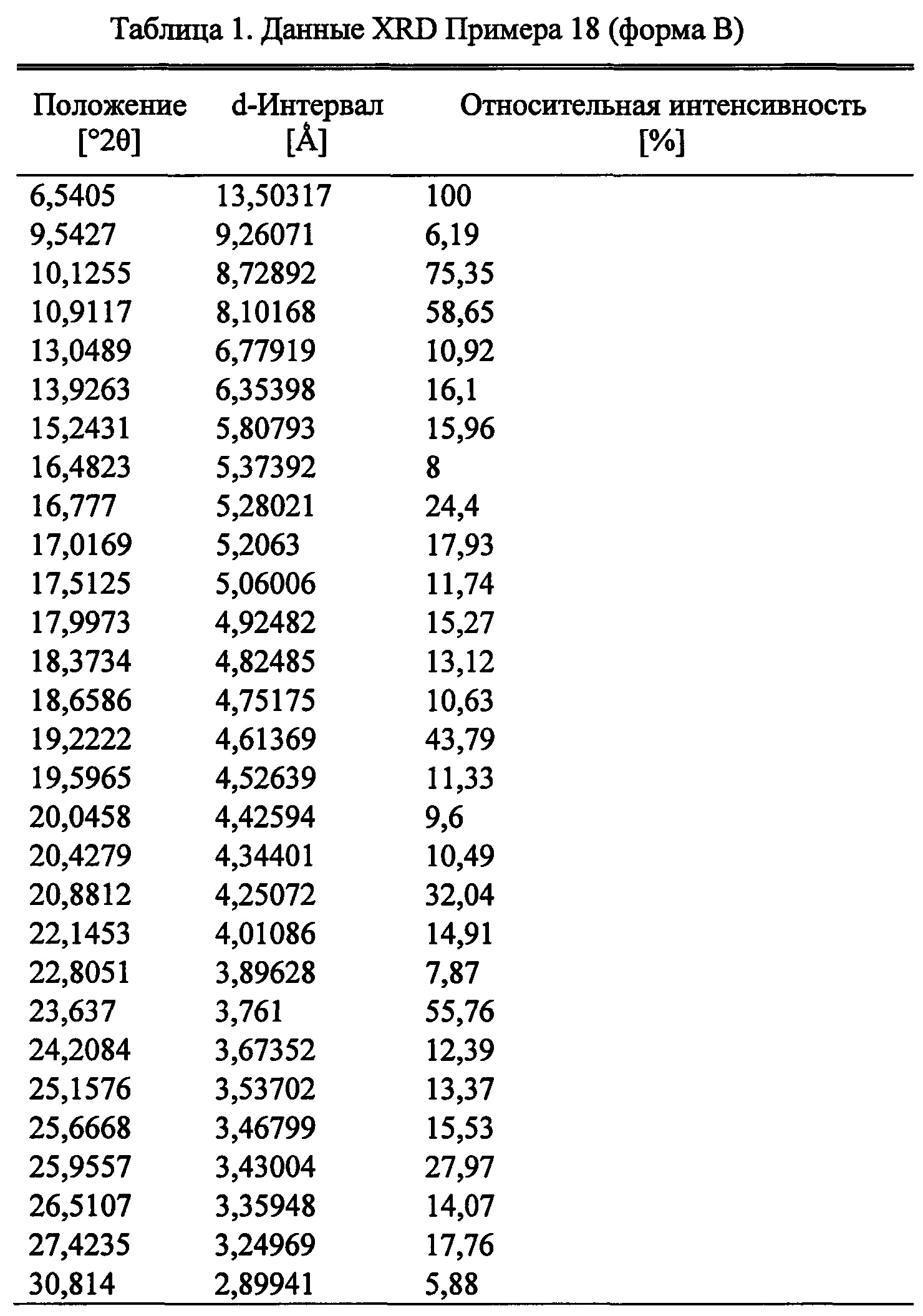
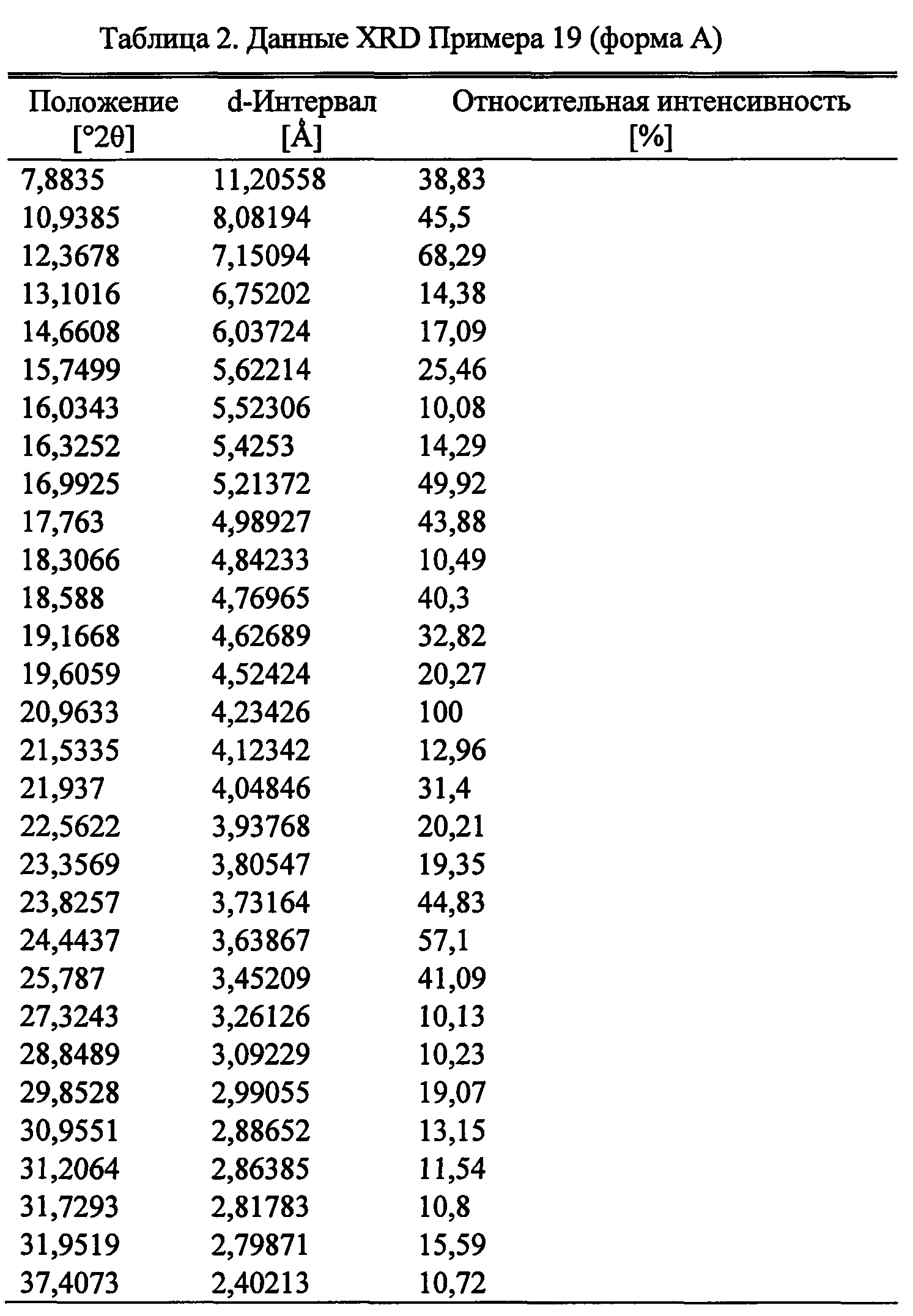
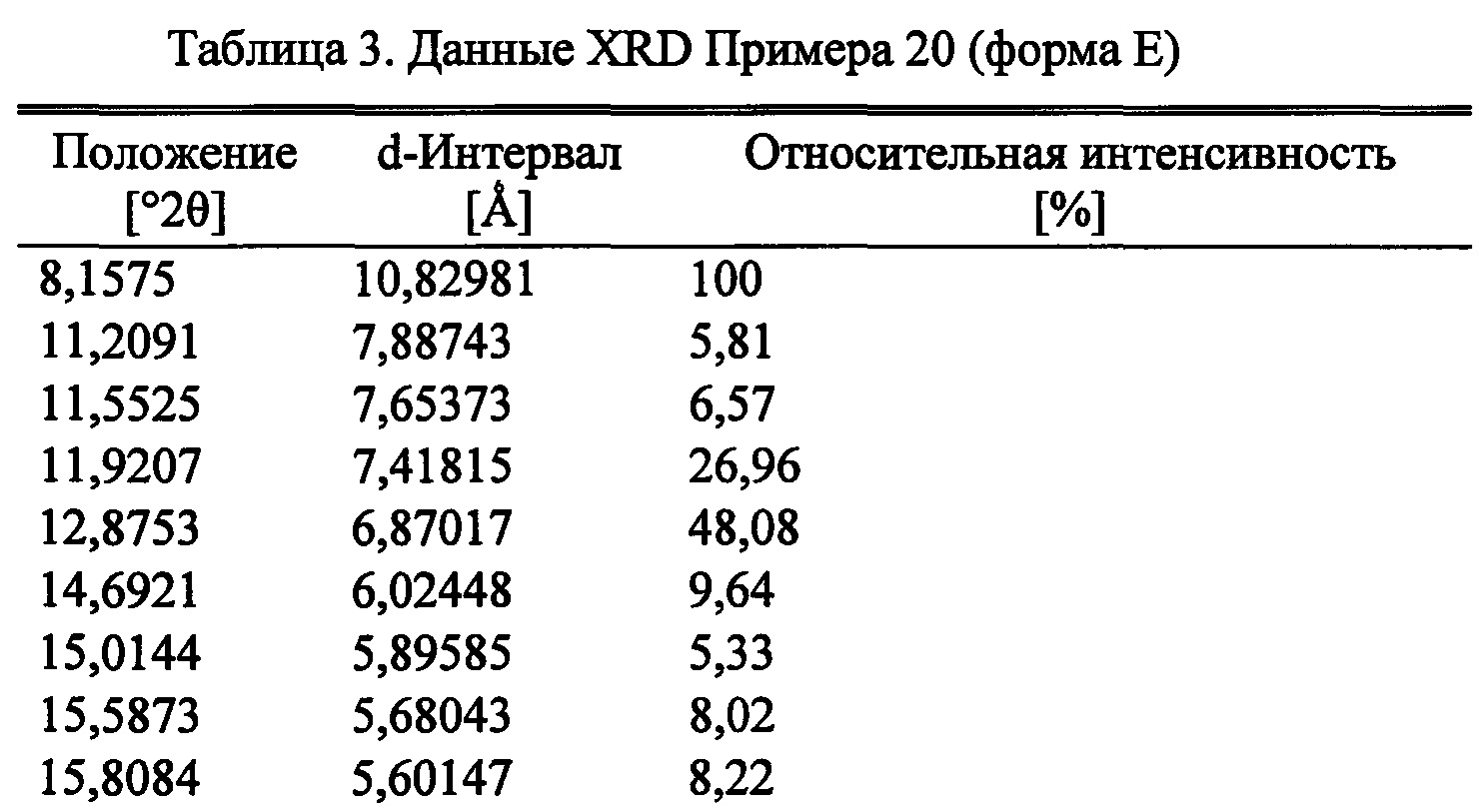
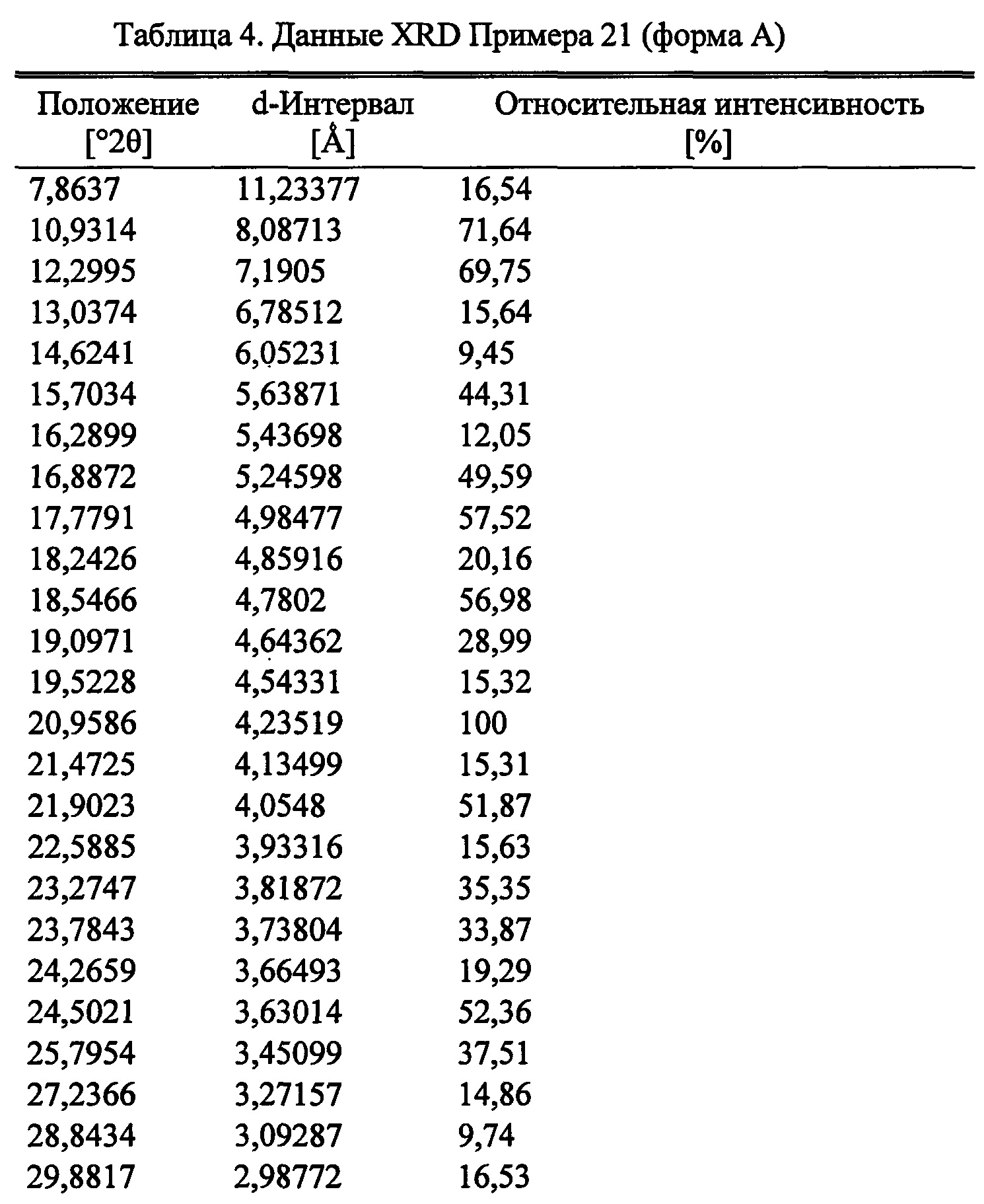

Пример 24. Исследование TLR7 человека
Рекомбинантный человеческий TLR7 стабильно экспрессировался в клеточной линии НЕК293, уже устойчиво экспрессирующей репортерную плазмиду pNiFty2-SEAP; интеграция гена-репортера поддерживалась отбором с антибиотиком зеоцином. Наиболее общая вариантная последовательность человеческого TLR7 (представленная EMBL последовательностью AF240467) копировалась с вектора экспрессии клеток млекопитающих pUNO и трансфицировалась в клеточную линию этого репортера. Трансфектанты с устойчивой экспрессией отбирались с использованием антибиотика бластицидина. В этой репортерной клеточной линии экспрессией секретируемой щелочной фосфатазы (SEAP) управляет NFkB/ELAM-1 составной промотор, содержащий пять сайтов NFkB, объединенных с проксимальным ELAM-1 промотором. Передача сигналов TLR ведет к транслокации NFkB, а активация промотора приводит к экспрессии гена SEAP. TLR7-спепифическая активация была оценена определением уровня SEAP, продуцированного при инкубации клеток в течении ночи при 37°C со стандартным соединением в присутствии 0,1 об. % диметилсульфоксида (DMSO). Зависимая от концентрации индукция соединениями продуцирования SEAP была выражена в виде концентрации соединения, которая обеспечивала половину максимального уровня индукции SEAP для такого соединения (EC50). Активность TLR7 для соединений настоящего раскрытия была оценена с помощью испытаний на TLR7 человека, результаты которых показаны ниже в Таблице 5, где степень активации TLR7 для каждого соединения выражается в виде величины pEC50.
Пример 25. Исследование TLR8 человека
Клеточная линия TLR8/NF-kB/SEAPorter™ HEK 293 (Imgenex Corporation) является устойчиво котрансфицированной клеточной линией, которая экспрессирует полноразмерные репортерные гены человеческих TLR8 и секретируемой щелочной фосфатазы (SEAP) под транскрипционным контролем элемента ответа NF-кВ. Экспрессия TLR8 в этой клеточной линии исследовалась проточной цитометрией. Трансфектанты с устойчивой экспрессией отбирались с помощью антибиотиков бластицидина и генетицина. Передача сигналов TLR ведет к транслокации NF-kB и активация промотора приводит к экспрессии гена SEAP. TLR8-специфическая активация была оценена определением уровня SEAP, продуцированного при инкубации клеток в течении ночи при 37°C со стандартным соединением в присутствии 0,1 об. % диметилсульфоксида (DMSO). Зависимая от концентрации индукция соединениями продуцирования SEAP была выражена в виде концентрации соединения, которая обеспечивала половину максимального уровня индукции SEAP для такого соединения (ЕС50). Активность TLR8 для соединений настоящего раскрытия была оценена с помощью испытаний на TLR8 человека, результаты которых показаны ниже в Таблице 6, где степень активации TLR8 для каждого соединения выражается в виде величины pEC50.
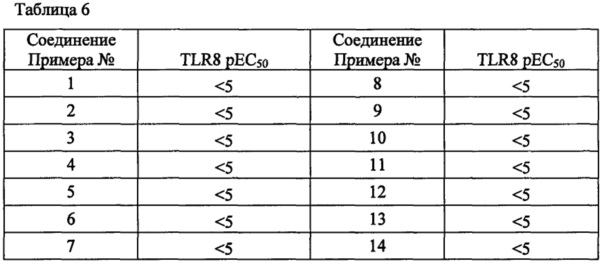
Пример 26. Анализ hERG - способ 1
Клеточная культура
Описанные Persson, Carlsson, Duker и Jacobson (2005) hERG-экспрессирующие K1 (CHO) клетки яичника китайского хомячка выращивались до состояния полуслияния при 37°C в увлажненной атмосфере (5% CO2) в среде Ham F-12, содержащей L-глютамин, 10% эмбриональную бычью сыворотку (FCS) и 0,6 мг/мл гигромицин (все от Sigma-Aldrich). Перед применением мономолекулярный слой был промыт предварительно нагретой (37°C) 3 мл аликвотой версена 1:5000 (hivitrogen). После аспирации флакон с раствором инкубировался в термостате при 37°C с дальнейшим добавлением 2 мл версена 1:5000 в течение 6 минут. Затем клетки были отделены от дна флакона его легким обстукиванием, в флакон было добавлено 10 мл физиологического раствора, забуференного фосфатом Дульбекко, содержащего кальций (0,9 мМ) и магний (0,5 мМ) (PBS; Invitrogen) и выполнено аспирирование в 15 мл центрифужную пробирку перед центрифугированием (50 g) в течение 4 минут. Полученная надосадочная жидкость была отброшена, а осадок аккуратно ресуспендирован в 3 мл PBS. Была извлечена 0,5 мл аликвота клеточной суспензии и с помощью аппарата для автоматического чтения планшетов (Cedex; Innovatis) определено число жизнеспособных клеток (методом вытеснения трипанового синего) так, чтобы объем ресуспендированных клеток мог быть доведен с помощью PBS до желательной конечной концентрации клеток. На этой стадии испытания это та концентрация клеток, которая указывается при обращении к этому параметру. Клетки CHO-Kv1.5, которые использовались для регулировки смещения напряжения на IONWORKS™ НТ, выдерживались и готовились к применению таким же образом.
Электрофизиология
Устройство и принцип работы этого прибора были описаны Schroeder, Neagle, Trezise и Worley (2003). В общих чертах данная методика базируется на 384-луночном планшете (PATCHPLATE™), в котором регистрация выполняется на каждой лунке посредством присасывания и удержания клетки в положении на маленьком отверстии, разделяющем две изолированные жидкостные камеры. После запечатывания раствор в нижней части PATCHPLATE™ был заменен на содержащий амфотерицин В. Это пермеабилизирует участок клеточной мембраны, покрывающей отверстие каждой лунки, и фактически позволяет выполнять регистрацию методом перфорированного пэтч-клампа цельной клетки.
Применялся β-тестер IONWORKS™ НТ производства Essen Instrument. В этом устройстве отсутствует возможность нагревания растворов и поэтому оно функционирует при ~RT (~21°C) следующим образом. Емкость в положении «Буфер») была заполнена 4 мл PBS и в положении «Клетки») описанной выше клеточной суспензией CHO-hERG. 96-Луночный планшет (V-образное дно, Greiner Bio-one), содержащий исследуемые соединения (в 3-кратном избытке относительно конечной исследуемой концентрации), помещался в положение "Plate 1" («Планшет 1») и закреплялся в блоке PATCHPLATE™. Планшет с каждым соединением был разбит на 12 столбцов, чтобы получить возможность построения по 8 точкам десяти кривых зависимости концентрация-эффект, оставшиеся два столбца на планшете были заняты носителем (конечная концентрации 0,33% DMSO) для определения базовой линии испытания и сверхмаксимальной блокирующей концентрацией цисаприда (конечная концентрация 10 мкм) для установления уровня 100% ингибирования. Дозирующая головка (F-Head) IONWORKS™ НТ после этого добавляла по 3,5 мкл PBS к каждой лунке PATCHPLATE™, а его нижняя часть была залита «внутренним» раствором, который имел следующую композицию (в ммоль): K-глюконат (100 частей), KCl (40 частей), MgCl2 (3,2 части), EGTA (этиленгликольтетрауксусная кислота) (3 части) и HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота) (5 частей, pH 7,25-7,30 с использованием 10М KOH). После заливки и устранения пузырения по PATCHPLATE™ перемещалась электронная головка (E-head), выполняющая проверку отверстий (то есть прикладывающая импульс напряжения для определения, открыто ли отверстие в каждой лунке). F-головка затем распределяла в каждую лунку PATCHPLATE™ по 3,5 мкл описанной выше клеточной суспензии и клеткам давалось 200 секунд, чтобы достичь и закупорить отверстия в каждой лунке. Вслед за этим вблизи PATCHPLATE™ перемещалась Е-головка для оценки сопротивления закупорки, достигнутого в каждой лунке. Далее выполнялась замена раствора на нижней стороне PATCHPLATE™ на «обеспечивающий доступ» раствор со следующей композицией (в ммоль): KCl (140 частей), EGTA (1 часть), MgCl2 (1 часть) и HEPES (20 частей, pH 7,25-7,30 при использовании 10М KOH) плюс 100 мкг/мл амфотерицина В (Sigma-Aldrich). После предоставления 9 минут для прохождения перфорации пэтчей Е-головка перемещается одновременно вблизи 48 лунок PATCHPLATE™ для выполнения измерений тока предсоединений hERG. После этого F-головкой добавлялось по 3,5 мкл раствора из каждой лунки планшета с соединением к 4 лункам на PATCHPLATE™ (конечная концентрация DMSO в каждой лунке 0,33%). Это было достигнуто продвижением от лунок с наиболее разбавленным к наиболее концентрированному соединению планшета с тем, чтобы минимизировать воздействие любого переноса соединения. После выдержки приблизительно в течение 3,5 минут Е-головка перемещалась вблизи всех 384 лунок PATCHPLATE™ для получения измерений тока постсоединения hERG. Таким образом могут быть получены некумулятивные кривые зависимости концентрация-эффект, где обеспечение критериев приемлемости достигается в достаточной процентной доле лунок (см. ниже) и эффект каждой концентрации исследуемого соединения базируется на данных, полученных от 1 до 4 клеток.
Ток пред- и постсоединения hERG вызывался единственным импульсом напряжения, состоящим из 20-секундного периода поддержания -70 мВ, 160-миллисекундной стадии при -60 мВ (чтобы оценить утечку), 100-миллисекундного возврата к -70 мВ, 1-секундной стадия при +40 мВ, 2-секундной стадии при -30 мВ и, наконец, 500-миллисекундной стадии при -70 мВ. Между импульсами напряжения пред- и постсоединения никакой фиксации мембранного потенциала не происходило. Из показателей тока были вычтены данные по утечке, основанные на оценке тока, вызванного стадией с +10 мВ в начале протокола импульсов напряжения. Любые смещения напряжения в IONWORKS™ НТ регулировались одним из двух способов. При определении потенциала соединения к клеткам CHO-Kv1.5 прикладывалось линейно изменяющееся напряжение деполяризации и отмечалось напряжение, при котором наблюдался перегиб кривой тока (то есть точка, в которой происходила активация канала в ходе линейного протокола изменений). Напряжение, при котором это происходило, было предварительно определено с помощью того же управляющего напряжения, которое используется в стандартной электрофизиологии, и было найдено равным -15 мВ (данные не показаны); таким образом, смещение потенциала может быть введено в программное обеспечение IONWORKS™ НТ с использованием этой величины в качестве опорной точки. При определении основных электрофизиологических свойств hERG любое смещение регулировалось посредством определения следового тока потенциала реверсии hERG в lonWorks™ НТ, сравнения его с найденным в стандартной электрофизиологии (-82 мВ) и выполнением затем необходимой коррекции в программном обеспечении IONWORKS™ НТ. Токовый сигнал снимался при 2,5 кГц.
Величина тока hERG пред- и постсканирования измерялась автоматически из вычитаемых программным обеспечением lonWorks™ НТ данных по утечке, принимая среднюю 40 мс продолжительность тока в начальный период поддержания -70 мВ (ток базовой линии) и вычитая ее из пика отклика следового тока. Критерии приемлемости для токов, индуцированных в каждой лунке: сопротивление закупорки предварительного сканирования >60 МОм, амплитуда следового тока hERG предварительного сканирования >150 пА; сопротивление закупорки пост-сканирования >60 МОм. Степень ингибирования тока hERG может быть оценена делением величины тока hERG предварительного сканирования на соответствующий ток hERG пост-сканирования для каждой лунки. Библиография: Persson F. и др., J Cardiovasc. Electrophysiol., 16, 329-341 (2005) и Schroeder K. и др, J Biomol Screen., 8, 50-64, (2003).
Пример 27. Анализ hERG - способ 2
Калиевый ток hERG был измерен в стабильно экспрессирующих hERG клетках K1 (СНО) яичника китайского хомячка. Эксперименты были выполнены с помощью автоматизированной системы для планарного пэтч-клампа QPATCH НТ (Sophion Bioscience A/S). Приложение давления для образования гигаомного контакта и создания конфигурации цельноклеточного пэтч-клампа обеспечивалось с помощью исследовательского программного обеспечения QPATCH. Пэтч-кламп эксперименты выполнялись в режиме фиксации потенциала с регистрацией токов цельной клетки, снимаемых с индивидуальных клеток. Был применен следующий протокол возбуждения для исследования действия различных соединений на hERG калиевый канал. Поддерживался мембранный потенциал -80 мВ и регулярно (каждые 15 с) деполяризовывался на 5 с до +20 мВ после прохождения в течение 20 с импульса -50 мВ, предназначенного для определения базовой линии, сопровождаемого длившейся 5 с стадией повторной поляризации до -50 мВ для оценки амплитуды следового тока. Эксперименты проводились при комнатной температуре (22±2°C).
Эффекты соединений были определены по кумулятивному действию увеличения 4 концентраций и рассчитаны в виде процентной доли заблокированного тока. Экспериментальные точки были обработаны уравнением Хила для вычисления полумаксимальных концентраций ингибирования. Испытуемый раствор включает: внеклеточный раствор (ммоль) из 2 ммоль CaCl2, 1 ммоль MgCl2, 10 ммоль HEPES, 4 ммоль KCl, 145 ммоль NaCl и 10 ммоль глюкозы; и внутриклеточный раствор (ммоль) из 5,4 ммоль CaCl2, 1,8 ммоль MgCl2 10 ммоль HEPES, 31 ммоль KOH, 10 ммоль EGTA, 120 ммоль KCl и 4 ммоль АТФ.
Результаты анализа hERG представлены в Таблице 7.
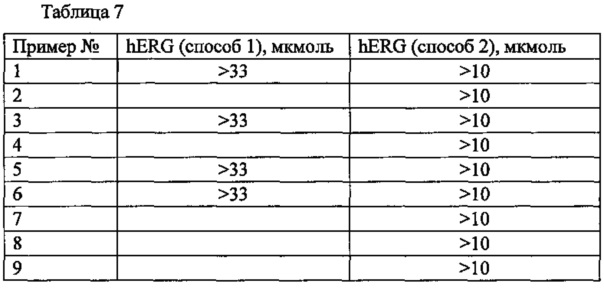
Пример 28. Рост опухолей изучался на Renca, изогенной мышиной модели почечно-клеточной карциномы
Эксперименты проводились на самках мышей (генотип Balb/C, возраст по меньшей мере 5 недель). Опухолевые клетки мыши Renca (Cancer Chemother Pharmacol. 1995; 36 (1): 7-12) были любезно предоставлены доктором Т. Fujioka из урологического отделения Iwate Medical University School of Medicine. Опухолевые клетки мыши Renca (5×104) были имплантированы подкожно в подвздошье мышей в день 0. Мыши обрабатывались носителем лекарственного средства (0,5% метилцеллюлоза), соединением из Примера 3 (0,3 мг/кг один раз в неделю), либо соединением из Примера 4 (3 мг/кг один раз в неделю), вводимыми перорально (р.о.) в дни 1, 8 и 15. Объемы опухолей оценивались по меньшей мере дважды в неделю двусторонними измерениями с помощью штангенциркуля.
Ингибирование роста опухоли от начала терапии оценивалось сравнением различий в темпах роста опухоли между группой контрольной группой и группой соединения из Примера 3, как показано на Фигуре 9.
Ингибирование роста опухоли от начала терапии оценивалось сравнением различий в темпах роста опухоли между группами контроля и соединения из Примера 4, как показано на Фигуре 10.
Фигура 9 и Фигура 10 показывают, что соединения из Примера 3 и 4 ингибировали рост опухолей при пероральном приеме.
Пример 29. Изучение метастаз в LM8, мышиной модели опухоли остеогенной саркомы.
Эксперименты проводились на самках мышей (генотип С3Н, возраст по меньшей мере 5 недель). Опухолевые клетки мыши LM8 (RCB1450) были приобретены в RIKEN. Опухолевые клетки мыши LM8 (3×104) были имплантированы подкожно в подвздошье мышей в день 0. Мыши из группы только лучевой терапии (RT) и группы комбинированной терапии были анестезированы и получали лучевую терапию (2Gy) в дни 11, 12, 13, 14 и 15. Мыши в комбинированной группе также лечились каким-либо из лекарственных средств: соединением из Примера 3 (10 мг/кг один раз в неделю) или соединением из Примера 4 (5 мг/кг один раз в неделю), применяемых внутривенно (i.v.) в дни 11, 18, 25 и 32. Мыши были умерщвлены в день 36, были выделены их легкие. Каждое легкое было взвешено и изучено с точки зрения наличия метастаз.
По сравнению с контрольной группой в группе RT-терапии и группе комбинированной обработки метастазирование легкого было значительно ингибировано. Как показано на Фигуре 11, метастазирование легкого в комбинированной группе было значительно ингибировано по сравнению с RT-группой.
Пример 30. Исследование выживаемости в СТ26, мышиной изогенной модели карциномы толстой кишки.
Эксперименты проводились на самках мышей (генотип Balb/C, возраст по меньшей мере 5 недель). Опухолевые клетки мыши СТ26 (CRL-2638) были приобретены в АТСС. Опухолевые клетки мыши СТ26 (1×104) были имплантированы подкожно в подвздошье мышей в день 0. Мыши из группы только лучевой терапии (RT) и группы комбинированной терапии были анестезированы и получали лучевую терапию (2Gy) в дни 7, 8, 9, 10 и 11. Мыши в комбинированной группе также лечились соединением из Примера 3 (30 мг/кг один раз в неделю), вводимым перорально (р.о.), или соединением из Примера 4 (5 мг/кг один раз в неделю), применяемым внутривенно (i.v.) в дни 7, 14, 22 и 27. Объемы опухолей оценивались по меньшей мере дважды в неделю двусторонними измерениями с помощью штангенциркуля. Период выживания определялся по времени, требовавшемуся опухоли для увеличения ее объема во время терапии в 4 раза.
Мыши в группе комбинированной терапии выживали значительно дольше, чем в контрольной или группе RT-терапии, Фигура 12 и 13.