Результат интеллектуальной деятельности: Средство, обладающее противовирусной активностью в отношении вируса гриппа
Вид РИД
Изобретение
Изобретение относится к химико-фармацевтической промышленности, медицине, ветеринарии и вирусологии и касается средства, обладающего противовирусной активностью в отношении вируса гриппа.
Известно, что грипп представляет серьезную проблему для здравоохранения. Вирусы гриппа поражают различные органы и системы, наносят огромный ущерб здоровью населения, у 5% больных вызывают тяжелые гипертоксические формы заболевания, летальность в период эпидемии возрастает до 2,5%. Для вируса гриппа характерна высокая скорость возникновения новых штаммов вируса, а также возникновение штаммов, устойчивых к существующим препаратам.
Для предотвращения и лечения заболевания в настоящее время известен широкий спектр патогенетических, иммуномодулирующих, общеукрепляющих препаратов, наряду со средствами специфической противогриппозной терапии. Последние препараты представлены химическими соединениями двух групп, отличающихся по механизму действия и мишеням в жизненном цикле вируса гриппа. Препараты первой группы - римантадин (α-метил-1-адамантилметиламина гидрохлорид) и амантадин (1-аминоадамантан) - блокируют белок М2 вируса гриппа, играющий роль ионного канала в вирусной мембране, препятствуя тем самым процессу слияния мембран вируса и лизосомальной вакуоли (Scholtissek C., Quack G., Klenk H.D., Webster R.G. // Antiviral Res. 1998, v. 37, p. 83-95). Препараты второй группы направлены на ингибирование вирусной нейраминидазы - фермента, необходимого для нормального почкования вирусных частиц и проявления инфекционных свойств вируса гриппа. К этой группе соединений относятся занамивир [5-(ацетиламино)-4-[(аминоиминометил)-амино]-2,6-ангидро-3,4,5-тридезокси-D-глицеро-D-галактонон-2-еноновая кислота], озелтамивир [(3R,4R,5S)-этил-4-ацетамидо-5-амино-3-(пентан-3-илокси)циклогекс-1-енкарбоксилат] (Woodhead М., Lavanchy D., Johnston S., Colman P., Fleming D. // Int. J. Clin. Pract. 2000, v. 54(9), p. 604-610) и перамивир [(1S,2S,3S,4R)-3-[(1S)-1-ацетамидо-2-этил-бутил]-4-(диаминометилиденамино)-2-гидрокси-циклопентан-1-карбоновая кислота] (O'Malley P. // Clin. Nurse Spec. 2010, v. 24(2), p. 51-53).
Обе группы соединений имеют свои недостатки. В отношении группы производных адамантана можно отметить сравнительно высокую токсичность, узкий спектр действия (препараты активны против гриппа А, но не против гриппа В) и быстрое формирование устойчивости вируса к препаратам. Для ингибиторов нейраминидазы характерна несколько меньшая клиническая эффективность и высокая стоимость синтеза, что делает эти препараты менее доступными для широкого использования.
Известно средство, обладающее интерферониндуцирующей и иммуномодулирующей активностями (Арбидол), представляющее собой гидрохлорид моногидрата 1-метил-2-фенилтиометил-3-карбэтокси-4-диметиламинометил-5-окси-6-броминдола (Патент RU 2033156 С1, оп. 20.04.1995).
Арбидол оказывает специфическое противовирусное действие, ингибируя слияние вирусной оболочки с клеточными мембранами, что предотвращает проникновение вируса внутрь клеток и нарушает его репродукцию (Leneva I.A. et al. // Antiviral Res. 2009, 81(2), 132-140). Кроме того, арбидол усиливает общую противовирусную защиту, стимулируя выработку интерферонов и повышая активность клеточного иммунитета (Глушков Р.Г. и соавт. // Вестник РАМН, 1999, 3, 36-40).
Недостатками арбидола являются его низкая растворимость и использование в комплексной терапии в качестве иммуностимулирующего, а не в качестве противовирусного средства.
Следует отметить, что все перечисленные лекарственные средства являются синтетическими препаратами.
Но известны природные и полусинтетические соединения, действующие против вируса гриппа, например сульфатированные углеводы обладают высокой специфической биологической активностью, включая антивирусную (Ikeda S, Neyts J, Verma S, Wickramasinghe A. "In Vitro and In Vivo Inhibition of Ortho- and Paramyxovirus Infections by a New Class of Sulfonic Acid. Polymers Interacting with Virus-Cell Binding and/or Fusion." // Antimicrobial. Agents for Chemotherapy: 1994, v. 38, p. 256-259; Fitton J.H. "Therapies from fucoidan; multifunctional marine polymers". Marine Drugs: 2011, v. 9, p. 1731-60).
Сульфатированные производные полисахаридов, главным образом каррагинаны, а также декстран сульфат, хондроитин сульфат, гепарин сульфат, сульфатированные производные целлюлозы, курдлан, ксилан, фукоиданы - так называемые гепариноиды, могут напрямую взаимодействовать с вирусом гриппа и другими оболоченными вирусами, такими как вирус герпеса или вирус иммунодефицита человека, предотвращая их адсорбцию и интернализацию внутрь клетки. К сожалению, их растворимость весьма ограничена, особенно в водных растворах, содержащих ионы калия или кальция. Еще в большей степени ограничивает их применение наличие у них антикоагулянтной активности, что вызывает значительные побочные эффекты, наиболее опасными из которых являются тромбоцитопения с последующим гепарининдуцированным тромбозом - так называемым "синдромом белого сгустка", остеопороз, некрозы кожи, алопеция, гипоальдостеронизм, агрегация кровяных пластинок и наиболее часто - кровоточивость. Применение гепариноидов противопоказано у больных с активным кровотечением или с гемофилией, пурпурой, тромбопитопенией, внутричерепным кровоизлиянием, бактериальным эндокардитом, активным туберкулезом, повышенной капиллярной проницаемостью, язвенными поражениями желудочно-кишечного тракта, тяжелой гипертонией, угрозой аборта или висцеральной карциномой. Тем не менее, например, i-каррагинан, представляющий собой сульфатированный полисахарид, прошел клинические испытания и в настоящее время разрешен к выпуску и продается в некоторых странах, как лекарство против гриппа. (Leibbrandt A, Meier С, 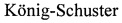 М,
М,  R, Kalthoff D, Pflugfelder В, Graf P, Frank-Gehrke B, Beer M, Fazekas T, Unger H, Prieschl-Grassauer E, Grassauer A. "Iota-carrageenan is a potent inhibitor of influenza A virus infection. // PLoS One: 2010, No.5, p. e14320; Grassauer A, Weinmuellner R, Meier C, Pretsch A, Prieschl-Grassauer E, Unger H. "Iota-Carrageenan is a potent inhibitor of rhinovirus infection." // Virol. J.: 2008, v. 5, p. 107).
R, Kalthoff D, Pflugfelder В, Graf P, Frank-Gehrke B, Beer M, Fazekas T, Unger H, Prieschl-Grassauer E, Grassauer A. "Iota-carrageenan is a potent inhibitor of influenza A virus infection. // PLoS One: 2010, No.5, p. e14320; Grassauer A, Weinmuellner R, Meier C, Pretsch A, Prieschl-Grassauer E, Unger H. "Iota-Carrageenan is a potent inhibitor of rhinovirus infection." // Virol. J.: 2008, v. 5, p. 107).
Известно также, что к-каррагинан и некоторые его производные, со средним молекулярным весом около 2 kDa, эффективно ингибируют репликацию вируса гриппа (Fengxiang Tang, Fang Chen, Feng Li "Preparation and potential in vivo anti-influenza virus activity of low molecular-weight κ-carrageenans and their derivatives", Journal of Applied Polymer Science, v. 127, No. 3, p. 2110-2115). Степень полимеризации к-каррагинана олигосахарида составляет от 3 до 13 звеньев. Структурная формула к-каррагинана олигосахарида в основном состоит из (1,4)-β-d-галактозы и (1,3)-α-d-галактозы со степенью сульфатирования равной 0.4 сульфатных групп на остаток сахара.
Все вышеперечисленные сульфатированные поли- и олигохариды представляют собой О-сульфаты и/или О- и N-сульфаты, как например:
К-каррагинан:
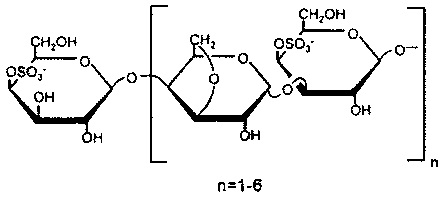
и/или O-, N-сульфаты (хитозан сульфат):
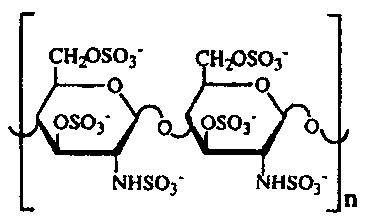
в этих полисахаридах сера связана с атомами углерода пиранозного кольца через кислород или азот, а для аналогичных сульфопроизводных углеводов, в которых сера связана напрямую с атомом углерода (С-сульфаты)? антивирусная активность не известна.
В то же время известно, что С-сульфаты других типов органических соединений обладают разнообразными фармакологическими свойствами: противовирусной, антигельминтной, антипротозойной, противоопухолевой активностями (Linhardt R.J. et al. // Carbohydrate in Drug Designing. - New York, 1997), способностью связывания амилоидов в опытах in vivo, что дает возможность их использования в качестве потенциальных средств для лечения болезни Альцгеймера (Kisilevsky R. et al. // Nature Medicine. - 1995. - №1. - P. 143-148), однако их широкое применение ограничивает высокая цитотоксичность и рецепторная неселективность, а также большое количество побочных эффектов.
К С-сульфатам относятся также синтетические полимеры - N-сульфонатные производные поли(аллиламин) гидрохлорида с молекулярным весом 56 кДа и степенью замещения 98%, которые проявили сильную противовирусную активность против репликации вируса гриппа A in vitro и ex vivo, преимущественно на поздних стадиях инфицирования. (J. Ciejka, A. Milewska, M. Wytrwal, J. Wojarski, A. Golda, M. Ochman, M. Nowakowska, K. Szczubialka, K. Pyrc, "Novel polyanions inhibiting replication of influenza". // Antimicrobal Agents for Chemotherapy: 2016, v. 60. No.4, p. 1955-1966). Механизм их противовирусного действия сходен с механизмом действия каррагинанов и заключается в ингибировании процессов высвобождения вируса из клетки. Инкубация клеток MDCK с N-сульфированным полиаллиламин гидрохлоридом в концентрации 5 мг/мл во время инфицирования и в течение 48 часов после инфицирования приводила к снижению репликации вируса A/H3N2/EVA. Титр вируса в супернатанте обработанных клеток снижался в 10000 раз (с 2×107 TCID50 до 7×102 TCID50 (tissue culture infectious doses). При этом было показано, что N-сульфированный полиаллиламин гидрохлорид в концентрациях, меньших чем 5 мг/мл, не токсичен для клеток MDCK.
Наиболее близкими по структуре и молекулярному весу к заявляемому средству - прототипом, являются полианионные низкомолекулярные (<10 кДа) сульфонатные полимеры такие, как, например, сополимер мочевины и бифенил дисульфоновой кислоты (С-сульфаты): поли{имино[2,2'-дисульфо(1,1'-бифенил)-4,4'-диил]иминокарбонил-1,4-фениленкарбонил}, полученные синтетическим путем и обладающие противовирусной активностью (Пат. США 5728731 (А), 1998; S.P. Ahmed, A.D. Cardin, C.G. Bridges, R.L. Jacson, M.J. Mullins, A.S. Tyms. Potent inhibition of herpes simplex virus by MDL 101028, a novel biphenyl disulfonic acid urea co-polymer. // Antiviral Chemistry & Chemotherapy, 1995, v. 6. No.1, p. 34-42.), обладающие противовирусной активностью, а именно против оболочечных вирусов, например вируса герпеса (ЭД50=0,29 мг/мл, или IC50=1,1 мг/мл).
Недостатком прототипа является недостаточный уровень инактивации вируса, так как после инкубации клеток с препаратом часть вируса сохраняла жизнеспособность и соответственно могла привести к возобновлению инфекционного процесса.
Задачей изобретения является получение нового эффективного, низкотоксичного фармакологически активного средства, обладающего противовирусной активностью в отношении вируса гриппа.
Техническим результатом изобретения является повышение противовирусной активности и расширение ассортимента средств, обладающих противовирусной активностью в отношении вируса гриппа.
Поставленная задача достигается получением бисульфитных производных окисленных невосстанавливающих гомоолигосахаридов, имеющих в своем составе бисульфитную (или иначе, сульфонатную) группировку, связанную непосредственно с атомом углерода (С-сульфаты), общей формулой [(Gluox)n-Cx]-(SO3R)x, где
[(Gluox)n-Cx] - окисленный невосстанавливающий гомоолигосахарид, где n - число моносахаридных звеньев, равное 2-7, а x - количество сульфированных атомов углерода линейного или циклического строения, равное 4-14;
SO3R - бисульфитная (сульфонатная) группировка,
R=H, М, где М - металлы I или II групп,
со степенью замещения, в пересчете на количественное содержание серы, 11,5-14,5%.
Предлагаемое средство получают на основе невосстанавливающих гомоолигосахаридов путем их периодатного окисления в стандартных условиях (Общая органическая химия // Под ред. Д. Бартона и У.Д. Оллиса. Т. 11. Липиды, углеводы, макромолекулы, биосинтез. // Под ред. Е. Хаслама. - Пер. с англ. / Под ред. Н.К. Кочеткова. - М.: Химия, 1986, с. 376) с последующим выделением в виде бисульфитного производного.
Для этого исходный олигосахарид растворяют при перемешивании в воде (1:50), затем добавляют 2-3% раствор периодата калия или натрия (2:5), смесь выдерживают при комнатной температуре в темноте от нескольких часов до нескольких суток, поддерживая слабокислые значения pH с помощью гидрокарбонатного буфера. Затем реакционную смесь обрабатывают 40% водным раствором пиросульфита калия или натрия и проводят очистку полученного бисульфитного производного окисленного олигосахарида от низкомолекулярных примесей методом ультрафильтрации и/или препаративной гельпроникающей хроматографией и высушивают сублимацией или распылительной сушкой.
В качестве невосстанавливающих гомоолигосахаридов могут быть использованы линейные или циклические углеводы, содержащие до 10 одинаковых моносахаридных остатков, чаще всего глюкозы [(Glu)n-(глюкозил)n-1-гликозиды, где n - число моносахаридных звеньев]. При этом в результате окисления можно получить от одного до нескольких окисленных мономеров, вплоть до полностью окисленного олигосахарида, при этом окислению будут подвергаться, как первичные, так и вторичные гидроксильные группы мономера. Таким образом, в макромолекуле окисленного олигосахарида могут присутствовать одинаковые или разные мономеры, окисленные по первичным гидроксильным группам и/или вторичным гидроксильным группам.
Изобретение иллюстрируется следующими примерами.
Пример 1.
1 г трегалозы растворяли при перемешивании в 50 мл воды очищенной, затем добавляли 20 мл 2% раствора периодата калия (KJO4). Окисление проводили при периодическом перемешивании при комнатной температуре в темноте не более 6 ч, поддерживая слабокислые значения pH с помощью гидрокарбонатного буфера. После этого реакционную смесь обрабатывали 18 мл 40% водного раствора пиросульфита калия (K2S2O5) и через 1 ч проводили очистку от низкомолекулярных примесей методом ультрафильтрации через полиэфирсульфоновый мембранный модуль с размером пор 1-5 кДа в течение 1 ч. Полученный ретант распыляли через пневматическую форсунку (размер капель до 150 мкм) в течение 15 минут при давлении в системе -65 мБар и температуре на входе распылительной сушилки +120°С, а на выходе +50°С.
Выход продукта [(Gluox)2-C4]-(SO3K)4 составил 56%, количественное содержание серы 11,6%.
Пример 2.
Определение ингибирующего действия бисульфитного производного окисленной трегалозы [(Gluox)2-C4]-(SO3K)4 на репродукцию вируса гриппа субтипа H1N1 в культуре клеток MDCK.
Клетки MDCK вносили по 5×104 в лунку 24-луночного планшета в среде DMEM, содержащей 10% фетальную телячью сыворотку и антибиотики и инкубировали в течение 48 ч при 37°С до образования полного монослоя. Клетки промывали с помощью PBS, затем вносили соединение [(Gluox)2-C4]-(SO3K)4 в различных концентрациях от 1,25 до 5 мг/мл и одновременно вносили вирус. Далее клетки инкубировали с соединением [(Gluox)2-C4]-(SO3K)4 и вирусом без смены среды в течение 48 ч, в качестве контроля использовали клетки MDCK, инкубированные только в присутствии вируса гриппа. Для инфицирования клеток использовали вирус A/WSN/33 (H1N1) с множественностью заражения (MOI) 0,01 ФОЕ/клетку (фокус-образующих единиц). По окончании инкубации собирали надклеточную жидкость и определяли титр вируса в ней по методу ФОЕ, описанному ранее (Гончарова Е.П., Ковпак М.П., Рябчикова Е.И., Коневец Д.А., Сильников В.Н., Зенкова М.А., Власов В.В. Расщепление вирусного генома с помощью искусственных рибонуклеаз - новый способ инактивации РНК-содержащих вирусов // Доклады АН. 2009. Т. 427. С. 840-843).
Клетки MDCK выращивали в 96-луночных планшетах в среде DMEM до образования монослоя. Затем клетки инфицировали различными разведениями полученных образцов. После инкубации при 37°С в течение 24 ч клетки фиксировали в течение 10-15 мин в охлажденном ацетоне и обрабатывали препаратом моноклональных антител к белку NP вируса гриппа А. После инкубации с антителами вносили антивидовые антитела, конъюгированные с пероксидазой хрена (Sigma). Наличие пероксидазы в комплексах на поверхности инфицированных клеток выявляли в ферментативной реакции с хромогенным субстратом 3-амино-9-этилкарбазолом (АЕС) (Sigma). Инфицированные вирусом окрашенные клетки (фокусы) подсчитывали и титр вируса представляли в виде десятичного логарифма (log10).
В таблице 1 представлены титры вируса (lg ФОЕ/мл) в культуральной среде через 48 ч после инфицирования клеток вирусом гриппа A/WSN/33, в зависимости от концентрации соединения [(Gluox)2-C4]-(SO3K)4.

Пример 3.
1 г β-циклодекстрина растворяли при перемешивании в 50 мл воды очищенной, затем добавляли 50 мл 3% раствора периодата натрия (NaJO4). Окисление проводили при периодическом перемешивании при комнатной температуре в темноте в течение 5 суток, поддерживая слабокислые значения pH с помощью гидрокарбонатного буфера. После этого реакционную смесь обрабатывали 50 мл 40% водного раствора пиросульфита натрия (Na2S2O5) и через 15 минут проводили очистку полученного соединения от низкомолекулярных примесей методом ультрафильтрации через полиэфирсульфоновый мембранный модуль с размером пор 1-5 кДа в течение 1 ч, с последующей доочисткой методом препаративной гель-проникающей хроматографии на колонке Bio Gel Р4 (BioRad) (d=1,5 см; l=70 см, элюент 0,2% раствор (NH4)2СО3. Очищенный продукт замораживали при t=-40°С и подвергали сублимации при t≤-55°C не более 3 ч.
Выход продукта [(Gluox)7-C14]-(SO3Na)14, составил 60%, количественное содержание серы 14,3%.
Пример 4.
Определение цитотоксичности бисульфитного производного окисленного β-циклодекстрина [(Gluox)7-C14]-(SO3Na)14
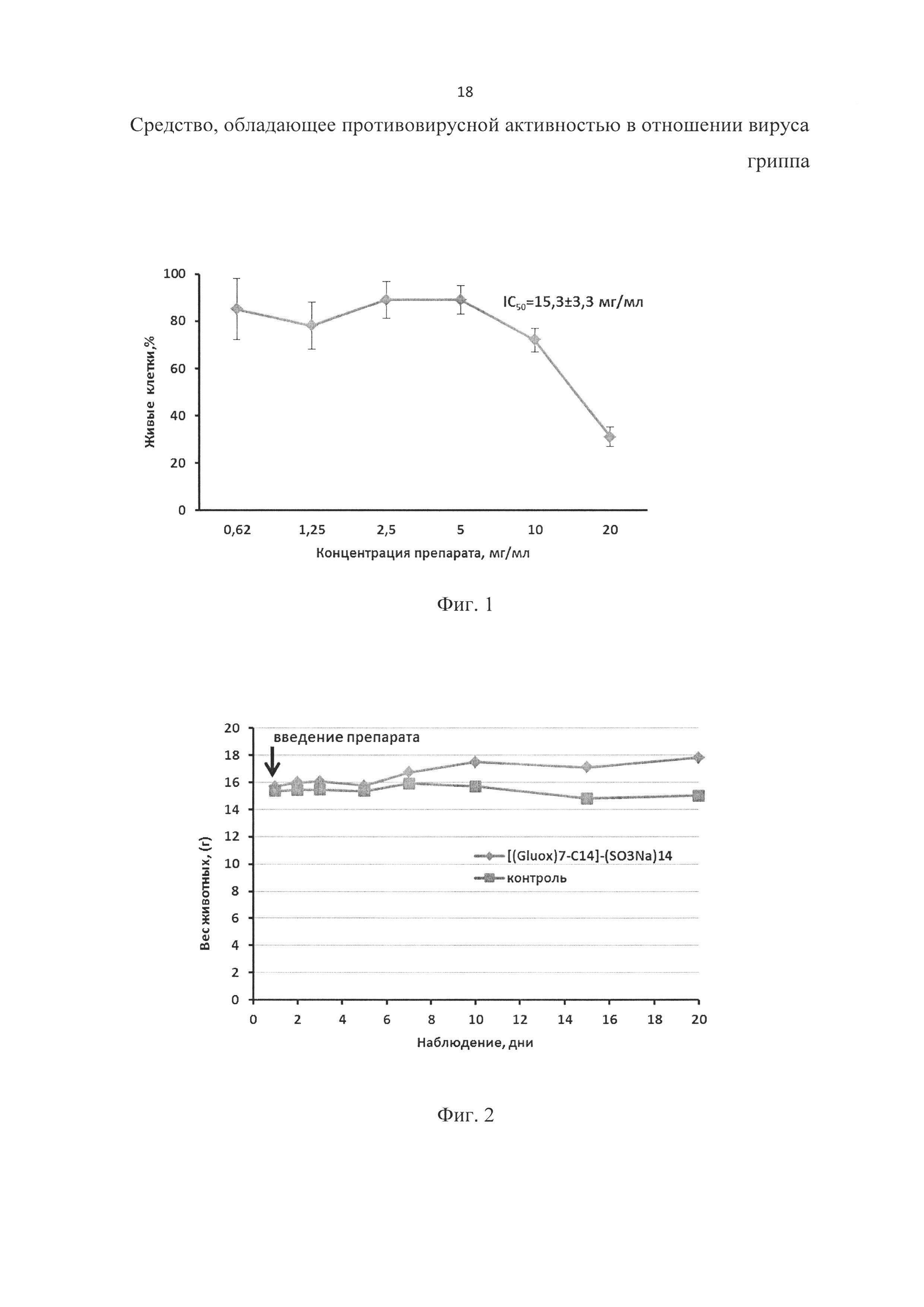
Определение цитотоксичности соединения [(Gluox)7-C14]-(SO3Na)14 проводили с помощью МТТ теста. В лунки 96-луночного планшета вносили клетки MDCK по 1.5×104 в 100 мкл среды DMEM, содержащей 10% фетальную телячью сыворотку и антибиотики. Клетки инкубировали до образования монослоя при 37°С и 5% CO2. Далее среду отбирали, клетки промывали PBS (фосфатный буфер, MP Biomedical), в лунки планшета вносили по 100 мкл среды DMEM, содержащей соединение [(Gluox)7-C14]-(SO3Na)14 в различных концентрациях, и инкубировали в течение 24 ч. По окончании инкубации среду из лунок отбирали, в лунки добавляли 100 мкл раствора МТТ (0.5 мг/мл) в среде DMEM и инкубировали 3 ч при 37°С. Затем среду отбирали, в лунки вносили по 100 мкл DMSO и инкубировали 20 мин. После инкубации измеряли оптическую плотность на многоканальном спектрофотометре Multiscan RC на длине волны 570 нм. Данные представляли в виде доли живых клеток, принимая оптическую плотность раствора в контрольных образцах – клетки, инкубированные в отсутствие соединения как соответствующую 100% живых клеток в образце. Концентрацию соединения, при которой выжило 50% клеток после 24 ч инкубации, обозначали IC50. Зависимость количества живых клеток MDCK от концентрации соединения [(Gluox)7-C14]-(SO3Na)14 в среде приведена на фиг. 1, при этом количество клеток в лунках, инкубированных в отсутствие соединения, принимали за 100%.
Обнаружено, что соединение [(Gluox)7-C14]-(SO3Na)14 в концентрациях, меньших чем 5 мг/мл, не токсично для клеток MDCK. IC50 для исследуемого соединения составляет 15±3,3 мг/мл.
Пример 5.
Определение ингибирующего действия бисульфитного производного окисленного [(Gluox)7-C14]-(SO3Na)14 на репродукцию вируса гриппа субтипа H1N1 в культуре клеток MDCK.
Клетки MDCK вносили по 5×104 в лунку 24-луночного планшета в среде DMEM, содержащей 10% фетальную телячью сыворотку и антибиотики и инкубировали в течение 48 ч при 37°С до образования полного монослоя. Клетки промывали с помощью PBS, затем вносили соединение [(Gluox)7-C14]-(SO3Na)14 в различных концентрациях от 0,6 до 5 мг/мл и одновременно вносили вирус. Далее клетки инкубировали с соединением [(Gluox)7-C14]-(SO3Na)14 и вирусом без смены среды в течение 48 ч, в качестве контроля использовали клетки MDCK, инкубированные только в присутствии вируса гриппа. При применении лечебной схемы клетки инфицировали вирусом гриппа, через 1 ч вирус удаляли, вносили соединение [(Gluox)7-C14]-(SO3Na)14 в концентрации 5 мг/мл и инкубировали течение 48 ч. Для инфицирования клеток использовали вирус A/WSN/33 (H1N1) с множественностью заражения (MOI) 0,01 ФОЕ/клетку (фокус-образующих единиц). По окончании инкубации собирали надклеточную жидкость и определяли титр вируса в ней по методу ФОЕ, описанному ранее [Гончарова Е.П., Ковпак М.П., Рябчикова Е.И. и др. // Доклады АН. - 2009. - Т. 427. - №6. - С. 840-843].
Клетки MDCK выращивали в 96-луночных планшетах в среде DMEM до образования монослоя. Затем клетки инфицировали различными разведениями полученных образцов. После инкубации при 37°С в течение 24 ч клетки фиксировали в течение 10-15 мин в охлажденном ацетоне и обрабатывали препаратом моноклональных антител к белку NP вируса гриппа А. После инкубации с антителами вносили антивидовые антитела, конъюгированные с пероксидазой хрена (Sigma). Наличие пероксидазы в комплексах на поверхности инфицированных клеток выявляли в ферментативной реакции с хромогенным субстратом 3-амино-9-этилкарбазолом (АЕС) (Sigma). Инфицированные вирусом окрашенные клетки (фокусы) подсчитывали и титр вируса представляли в виде десятичного логарифма (log10).
В таблице 2 представлены титры вируса (lg ФОЕ/мл) в культуральной среде через 48 ч после инфицирования клеток вирусом гриппа A/WSN/33, в зависимости от концентрации соединения [(Gluox)7-C14]-(SO3Na)14 и времени добавления его к клеткам.
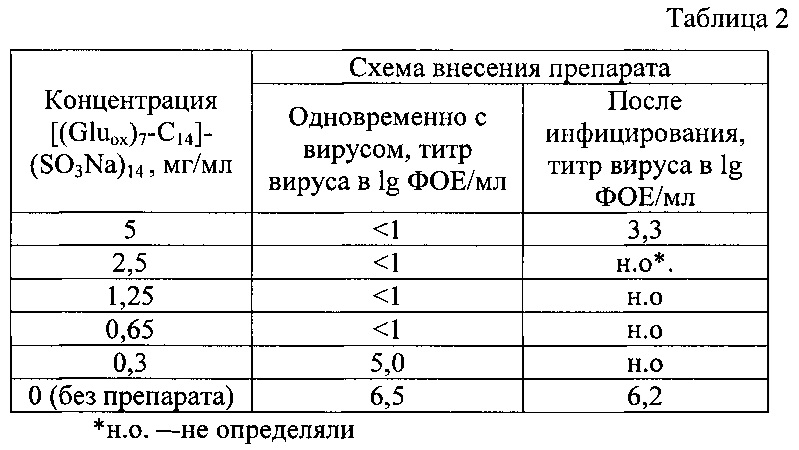
Обнаружено, что в результате обработки клеток соединением [(Gluox)7-C14]-(SO3Na)14 в концентрации от 0,6 мг/мл до 5 мг/мл одновременно с внесением вируса репродукция вируса в клетках MDCK снижалась в 1000000 раз (на 6 lg) (профилактическая схема) по сравнению с контролем.
Инкубация клеток при концентрации соединения 0,3 мг/мл приводила к снижению титра вируса более чем в 10 раз. При применении лечебной схемы обработки клеток соединением [(Gluox)7-C14]-(SO3Na)14 в концентрации от 5 мг/мл титр вируса снижался на 2.2 lg ФОЕ/мл.
Пример 6. Исследование токсичности соединения [(Gluox)7-C14]-(SO3Na)14 при интраназальном введении мышам линии BALB/c.
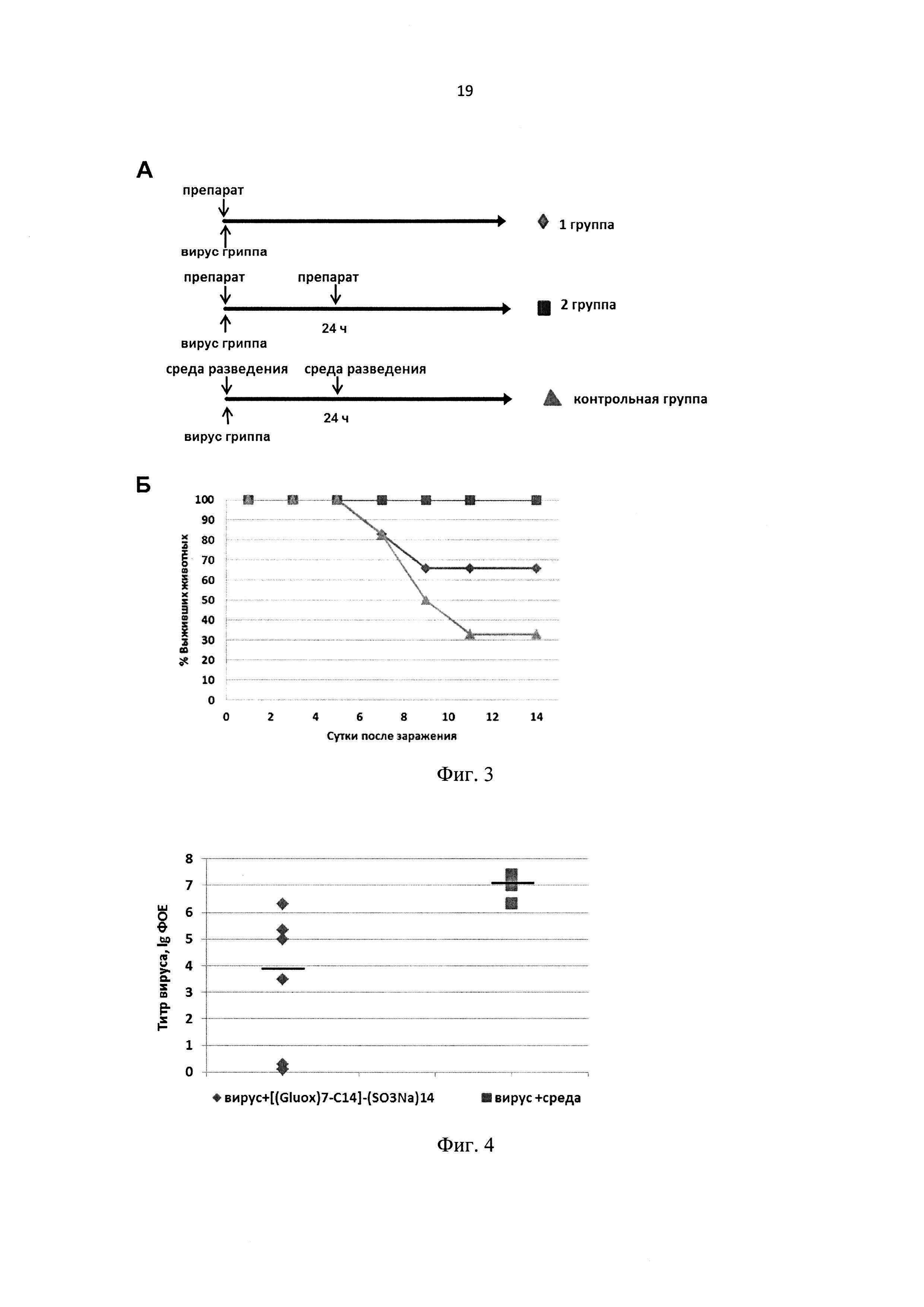
Токсичность соединения [(Gluox)7-C14]-(SO3Na)14 исследовали на мышах линии BALB/c (самки весом 14-16 г) при интраназальном введении препарата. Исследуемое соединение в дозе 312 мг/кг однократно вводили мышам интраназально под легким эфирным наркозом в объеме 30 мкл. При оценке токсичности соединения регулярно фиксировали общее состояние животных, особенности их поведения, интенсивность и характер двигательной активности, состояние волосяного и кожного покрова, потребление корма и воды, изменение массы тела. Всех мышей взвешивали ежедневно, начиная с момента введения препарата. Результаты влияния соединения [(Gluox)7-C14]-(SO3Na)14 в дозе 312 мг/кг на вес мышей после однократного интраназального введения представлены в виде графика на фиг. 2. Не обнаружено значимых различий массы тела, изменения поведения, состояния волосяного покрова животных, потребления корма и воды между группой мышей, получавшей интраназально [(Gluox)7-C14]-(SO3Na)14, и контрольной группой, получавшей PBS, что свидетельствует о низкой токсичности соединения [(Gluox)7-C14]-(SO3Na)14.
Пример 7. Определение противовирусной активности соединения [(Gluox)7-C14]-(SO3Na)14 in vivo.
Для определения противовирусной активности [(Gluox)7-C14]-(SO3Na)14 in vivo исследуемое соединение [(Gluox)7-C14]-(SO3Na)14 в дозе 312 мг/кг вводили мышам линии BALB/c (самцы весом 14-16 г) интраназально под легким эфирным наркозом в объеме 30 мкл один раз в сутки и затем инфицировали вирусом гриппа A/WSN/33 (H1N1) (доза 5 LD50 на мышь). Первой группе мышей (n=6) соединение вводили однократно, второй группе животных (n=6) соединение вводили двукратно: сразу после инфицирования и через сутки после первого введения. Инфицированным мышам контрольной группы (n=6) вводили среду разведения. Схема эксперимента представлена на фиг. 3 (А), где 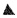 - контроль, животные получали среду разведения;
- контроль, животные получали среду разведения;  - животные получали соединение [(Gluox)7-C14]-(SO3Na)14 однократно,
- животные получали соединение [(Gluox)7-C14]-(SO3Na)14 однократно,  - животные получали соединение [(Gfuox)7-C14]-(SO3Na)14 двукратно. Результаты данного эксперимента представлены на фигуре 3 (Б). Показано, что интраназальное применение соединения [(Gluox)7-C14]-(SO3Na)14 приводит к снижению специфической смертности животных. При однократном введении соединения [(Gluox)7-C14]-(SO3Na)14 выжило 66% животных, тогда как его двукратное введение обеспечивало полную защиту от заражения вирусом гриппа.
- животные получали соединение [(Gfuox)7-C14]-(SO3Na)14 двукратно. Результаты данного эксперимента представлены на фигуре 3 (Б). Показано, что интраназальное применение соединения [(Gluox)7-C14]-(SO3Na)14 приводит к снижению специфической смертности животных. При однократном введении соединения [(Gluox)7-C14]-(SO3Na)14 выжило 66% животных, тогда как его двукратное введение обеспечивало полную защиту от заражения вирусом гриппа.
Для определения инфекционного титра вируса гриппа в легочной ткани животных легкие мышей, извлеченные на 4-е сутки после заражения, гомогенизировали в 10-кратном объеме среды DMEM и готовили серийные разведения для определения титра вируса методом ФОЕ. На фиг. 4. приведены значения титра вируса гриппа A/WSN/33(H1N1) в ткани легких мышей, lg(ФОЕ/мл) после интраназального введения соединения [(Gluox)7-C14]-(SO3Na)14 или среды, инфицированных дозой 5 LD50 на 4 сутки после заражения (указана медиана значений).
На фиг. 4 видно, что титр вируса в легких мышей, получавших однократно соединение [(Gluox)7-C14]-(SO3Na)14, снизился на 3 lg ФОЕ/мл (в 1000 раз) по сравнению с титром вируса в легких мышей контрольной группы (вирус + среда).
Показано, что интраназальное применение соединения [(Gluox)7-C14]-(SO3Na)14 приводит к снижению специфической смертности животных в дозе 312 мг/кг и снижению титров вируса в ткани легких на 3 lg ФОЕ/мл (в 1000 раз).
Таким образом, установлено, что:
1). Соединения [(Gluox)n-Cx]-(SO3M)x (где n=2-7; х=4-14, линейного или циклического строения, М = металл натрий или калий) в испытанных дозах эффективно снижают репродукцию вируса гриппа в культурах клеток MDCK;
2). Максимальная антивирусная активность наблюдалась для соединения [(Gluox)7-C14]-(SO3Na)14 в условиях, когда его добавляли до инфицирования клеток MDCK с последующей инкубацией инфицированных клеток с соединением [(Gluox)7-C14]-(SO3Na)14. В этих условиях снижение титров вируса гриппа под действием исследуемого соединения в концентрации от 0,6 до 5 мг/мл составляло 6,0 lg ФОЕ/мл (в 1000000 раз)
3). Соединение [(Gluox)7-C14]-(SO3Na)14 не токсично для модельных животных в дозе 312 мг/кг при интраназальном введении.
4). Соединение [(Gluox)7-C14]-(SO3Na)14 в дозе 312 мг/кг при однократном введении снижает репродукцию вируса гриппа в ткани легких на 3 lg ФОЕ/мл (в 1000 раз).
5). Соединение [(Gluox)7-C14]-(SO3Na)14 обеспечивает полную защиту животных от заражения вирусом гриппа при двукратном интраназальном введении в дозе 312 мг/кг.
Предлагаемое средство в виде соединений [(Gluox)n-Cx]-(SO3M)x (где n=2-7; х=4-14, линейного или циклического строения, М = металл натрий или калий) может быть использовано для профилактики и лечения инфекции, вызываемой вирусом гриппа. Предлагаемое средство обладает повышенной противовирусной активностью за счет снижения репродукции вируса гриппа в ткани легких, что обеспечивает полную защиту животных от заражения вирусом гриппа.
Средство, обладающее противовирусной активностью в отношении вируса гриппа, представляющее собой бисульфитные производные окисленных линейных или циклических невосстанавливающих олигосахаридов, содержащих до 7 одинаковых моносахаридных остатков глюкозы, имеющее в своем составе бисульфитную группировку, связанную непосредственно с атомом углерода общей формулы [(Glu)-C]-(SOM), где n=2-7; х=4-14, М = металл натрий или калий) со степенью замещения, в пересчете на количественное содержание серы, 11,5-14,5%.