Результат интеллектуальной деятельности: СПОСОБ ПРЯМОГО КОНДУКТОМЕТРИЧЕСКОГО КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ХЛОРИДОВ
Вид РИД
Изобретение
Изобретение относится к аналитической химии, в частности, к способу количественного определения хлорида калия - побочного продукта в производстве субстанции ферроцина, который может быть успешно использован в исследовательской и производственной практике.
Ферроцин (калиевая форма гексацианоферрата железа) является исходной субстанцией для производства фармацевтического препарата «Ферроцин», обладающего высокой специфичностью к сорбции цезия и применяющегося в качестве антидота при интоксикациях радиоактивным цезием (Cs137). В промышленности субстанцию ферроцина получают взаимодействием в водной среде хлорного железа с калием железистосинеродистым по реакции:

В результате этой реакции наряду с ферроцином в большом количестве образуется побочный продукт - хлорид калия, около 80,0% которого удаляется с фильтратом, а оставшийся хлорид калия содержится в пасте технического ферроцина. Очистку технического ферроцина от остаточных количеств хлорида калия и непрореагировавшего хлорного железа осуществляют его промывкой большим количеством дистиллированной воды (до 100 л на кг субстанции по технологическому регламенту), используя при этом различные технологические приемы.
В соответствии с фармстатьей [ЛС-002201-310512] к субстанции ферроцина предъявляется высокое требование по содержанию хлоридов. Их содержание в субстанции не должно быть более 0,6%. Поэтому возникает острая технологическая необходимость в разработке простого, точного, легко реализуемого в производственных условиях способа количественного анализа хлорида калия в промывной воде, приводящего к обеспечению не только требуемого качества ферроцина по показателю «Хлориды», но и к оптимизации расхода дистиллированной воды, используемой на очистку (промывку) технического продукта.
Широкое распространение количественного определения хлоридов в растворах, в том числе хлорида калия, получили методы осаждения, основанные на реакциях образования труднорастворимых солей серебра [Крешков А.П. Основы аналитической химии. Изд-во Химия, 1970, 471 с.]. К ним относится метод Мора, в основе которого лежит реакция взаимодействия ионов серебра с ионами галогенов: Ag+ + Cl- = AgCl↓.
Для установления конечной точки титрования в анализируемый неокрашенный раствор добавляют хромат калия, образующий с избытком серебра осадок по реакции: 2Ag+ + CrO42- = Ag2CrO4↓, вызывающий переход окраски раствора от желтой до красно-коричневой.
В случае окрашенных растворов, такими являются промывные воды в производстве ферроцина, для количественного анализа хлоридов используют также метод осаждения нитратом серебра, но точку эквивалентности определяют кондуктометрически: по изменению электропроводности раствора [Крешков А.П. Основы аналитической химии. Из-во Химия, 1970, 471 с; Худякова Т.А., Крешков А.П. Теория и практика кондуктометрического и хроно-кондуктометрического анализа. Изд-во Химия, 1976, 304 с.].
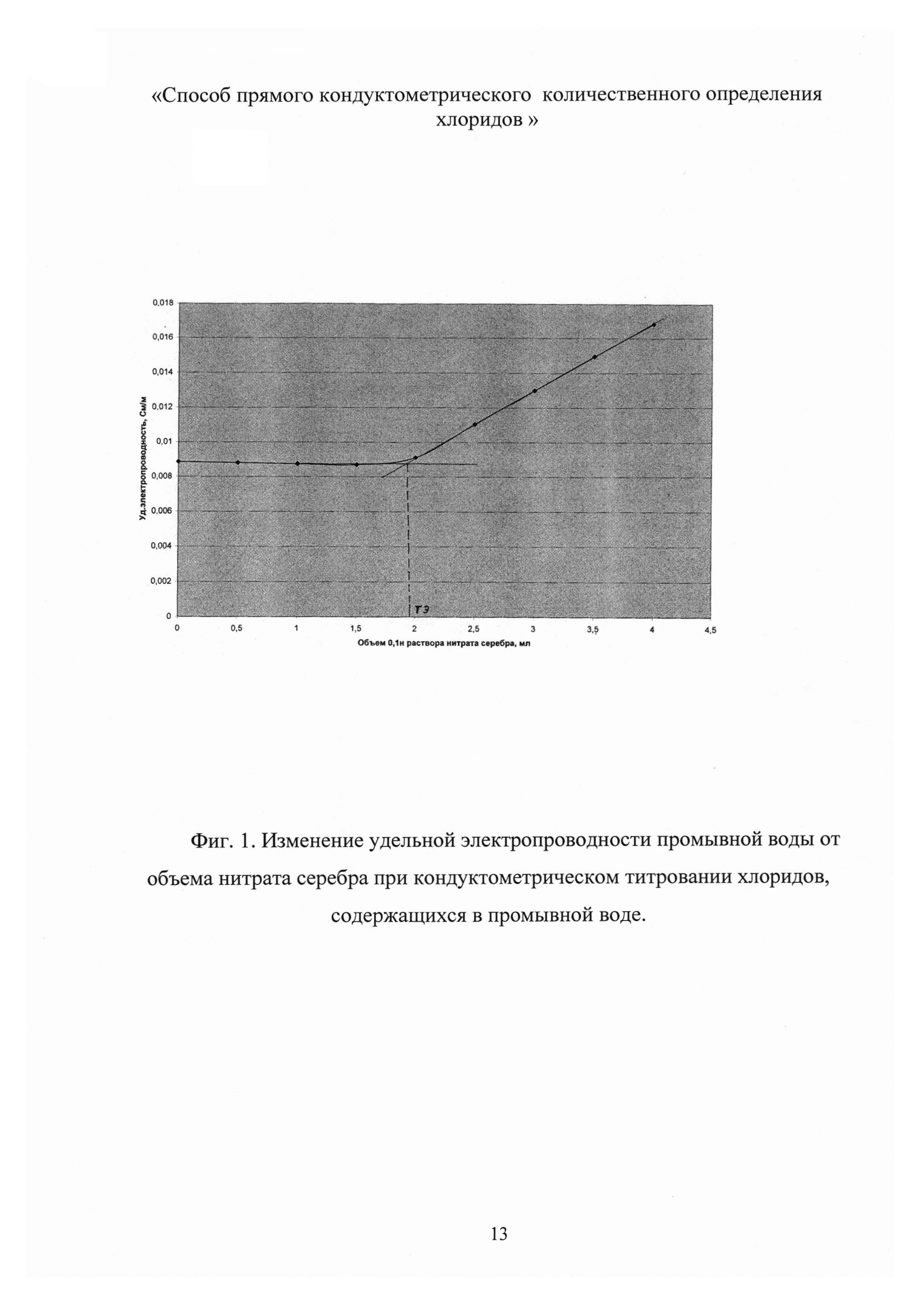
Как показали наши исследования, что аргентометрический метод с кондуктометрическим определением конечной точки титрования может успешно использоваться для анализа хлоридов в промывной воде, используемой для очистки ферроцина (фиг.1). Из фиг. 1 видно, что при титровании хлоридов, содержащихся в промывной воде, нитратом серебра, удельная электропроводность этого раствора до точки эквивалентности понижается, так как подвижность ионов хлора (λcl- = 76,4) выше подвижности заменяющих их нитрат-ионов (λNO3- = 71,5). Избыток нитрата серебра вызывает повышение величины удельной электропроводности раствора. Точка эквивалентности определяется графически пересечением линейных отрезков, наблюдаемых на кондуктометрической кривой или более точно вычисляется с использованием программы Microsoft Excel. По полученным экспериментальным данным строят прямолинейные участки кривой кондуктометрического титрования в координатах χ (См/м) - V (мл). Первый линейный участок описывается уравнением χ1=-0,0001V+0,0089, а второй - χ2=0,0039V+0,0014. Точка пересечения этих прямых является эквивалентной точкой, которая определяется решением этих уравнений при χ1=χ2. Затем проводят расчет концентрации хлоридов (С) в промывной воде по формуле
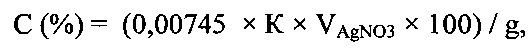
где C- концентрация хлоридов в анализируемой промывной воде, %;
g - навеска анализируемой промывной воды, г;
0,00745 г хлоридов соответствует 1 мл точно 0,1 н раствора AgNO3;
K - поправочный коэффициент 0,1 н раствора нитрата серебра.
Несмотря на простоту исполнения этого способа и точность определения эквивалентных точек титрования, этот метод является продолжительным из-за построения кондуктометрической кривой титрования. Кроме того, в качестве титранта используется дефицитная соль серебра.
Известен фотометрический метод определения хлорида калия в растворах: по калибровочному графику зависимости оптической плотности от концентрации хлорид - ионов, построенному для стандартных растворов, находят содержание хлорида калия в исследуемой пробе [Федоровский Н.Н., Якубович Л. М., Марахова А.И. Фотометрические методы анализа. Из-во Наука. 2012, 72 с]. Недостатком этого способа является также использование нитрата серебра.
Метод, исключающий применение нитрата серебра, основан на проведении ионного обмена ионов калия из анализируемого раствора на катионите и количественном определении ионов водорода методом титриметрического анализа [Харитонов Ю.А, Джабаров Д.Н., Григорьев В.Ю. Аналитическая химия, Из-во «Гэотар-Медиа», 2012]. При пропускании раствора с анализируемым хлоридом калия через катионит в Н-форме происходит процесс ионного обмена, который можно записать в виде

Катион калия вытесняет водород из катионита, сорбируется и удерживается в ионогенной группе, а ион водорода выделяется в раствор в количестве, эквивалентном содержанию иона калия в анализируемом растворе, и определяется методом кислотно-основного титрования. К недостатку этого метода следует отнести его многостадийность: сначала требуется тщательная подготовка катионита, затем пропускание анализируемого раствора хлорида калия через колонку с катионообменной смолой и последующее титрование, что существенно увеличивает продолжительность анализа.
В [Худякова Т.А., Крешков А.П. Кондуктометрический метод анализа. Из-во «Высшая школа», 1975, 207 с.] предлагается способ кондуктометрического титрования хлорида калия в растворе без применения нитрата серебра, а в качестве титранта рекомендуется натриевая соль тетрафенилбората. Кроме того, достоинство этого метода заключается в возможности определения хлорида калия в присутствии ионов Fe3+. Однако, несмотря на дифференцированное титрование хлорида калия и точность определения эквивалентных точек титрования, этот метод является также продолжительным из-за построения графических зависимостей изменения величины удельной электропроводности растворов хлорида калия от объема титранта (натриевая соль тетрафенилбората).
Наиболее близкий к предлагаемому способу по технической сущности и достигаемому результату является метод определения хлорида аммония в промывных фильтратах прямой кондуктометрией в производстве субстанции карбамазепина, в основу которого положена линейная зависимость удельной электропроводности фильтрата от концентрации хлорида аммония в интервале от 0,01 до 0,06% [Конарев А.А. Тезисы доклада. 11 Международная научно-техническая конференция «Современные методы в теоретической и экспериментальной электрохимии», Плес, 2010, с. 164.]. К недостатку этого метода анализа хлорида аммония следует отнести узкий диапазон определения концентрации соли в промывной воде. Кроме того, следует отметить, что растворимость в воде хлорида аммония заметно выше (372 г в 1000 мл воды при 20°C), чем хлорида калия (343 г в 1000 мл воды при 20°C), что упрощает процесс очистки субстанции карбамазепина.
Задачей предлагаемого изобретения является разработка способа количественного определения хлорида калия в промывной воде, используемой для очистки ферроцина, и обеспечивающего быстрый и точный анализ его концентрации.
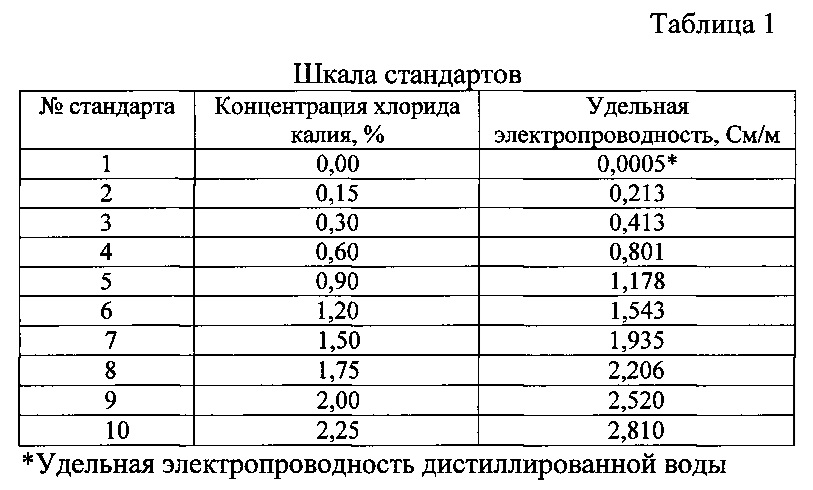
Для решения этой задачи предложен способ прямого кондуктометрического количественного определения хлорида калия с концентрацией от 0,10 до 2,25% в промывной воде, используемой для очистки ферроцина, заключающийся в измерении величины удельной электропроводности последней при температуре 20°C и последующем расчете концентрации хлоридов (С) в промывной воде по градуировочному (калибровочному) графику или по формуле
С (%)=0,3823 (χ - 0,0353),
где χ - величина удельной электропроводности анализируемого раствора, измеренная при температуре 20°C, См/м;
0,3823 - коэффициент пересчета концентрации хлорида калия в хлорид-ион.
Предлагаемый способ осуществляют с использованием кондуктометра серийного производства, в частности, Анион-4100 для измерения величины удельной электропроводности анализируемых растворов, получаемых после промывки ферроцина.
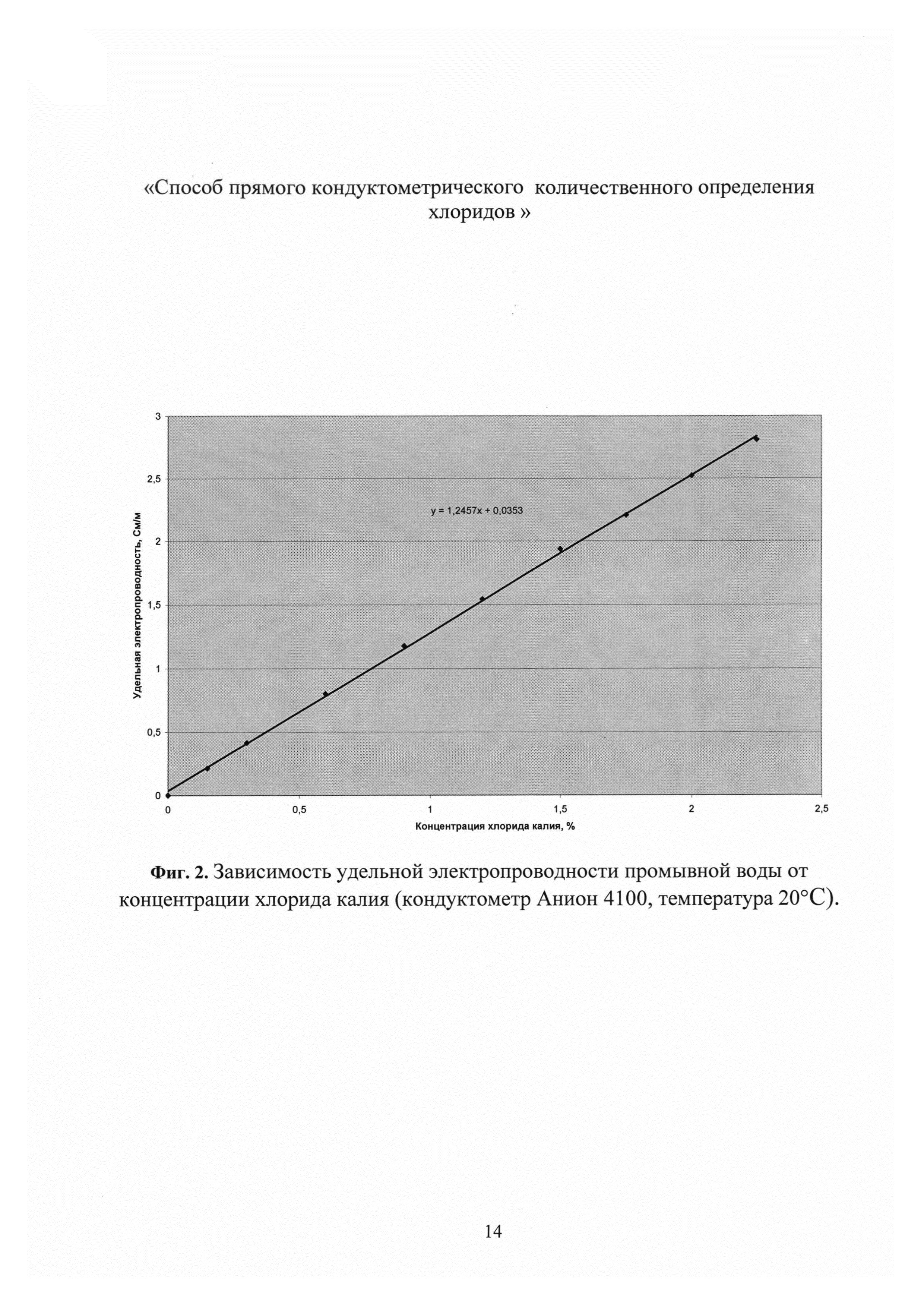
Концентрацию хлорида калия в промывной воде определяют по предварительно построенному градуировочному графику зависимости удельной электропроводности раствора от концентрации хлорида калия (Фиг. 2), пересчитывая концентрацию хлорида калия в хлорид-ион, или по формуле приведенной выше. Для построения калибровочного графика готовят шкалу стандартных растворов хлорида калия согласно табл. 1. Для приготовления стандартного раствора хлорида калия взвешивают точную навеску хлорида калия квалификации «хч», предварительно прокаленного, и растворяют ее в дистиллированной воде в мерной колбе вместимостью 100 см3, а затем доводят объем раствора дистиллированной водой до метки и измеряют величину удельной электропроводности данного стандарта при температуре 20°C. Для построения градуировочного графика использовали программу «Microsoft Excel».
Относительная ошибка определения концентрации хлоридов в промывной воде составляет 2,0-2,5%, а время, затрачиваемое на анализ, 10-15 мин.
Данные, касающиеся количественного определения хлорида калия в разбавленных растворах прямой кондуктометрией, в научной и патентной литературе отсутствуют. В то же время в справочной литературе [Справочник по электрохимии, под ред. A.M. Сухотина. Л.: Химия, 1981. - 488 с.; Добош Д. Электрохимические константы, М.: Мир, 1980. - 365 с] приводятся величины удельной электропроводности хлорида калия в растворах с концентрацией от 5 до 20% при температуре 18°C, а в монографиях [Ротинян А.Л., Тихонов К.И., Шошина И.А. Теоретическая электрохимия. Л.: Химия, 1981, - 424 с.; Левин А.И. Теоретические основы электрохимии. М.: Металлургиздат.1963, - 430 с.; Дамаскин Б.Б., Петрий О.А. Основы теоретической электрохимии. М.: «Высшая школа». 1978, - 239 с.] представлены зависимости изменения удельной электропроводности от
концентрации хлорида калия в том же интервале. Приведенные кривые χ=f(C) имеют сложный характер, связанный с изменением подвижности ионов с увеличением концентрации соли, и проходят через максимум, специфичный для данной соли и растворителя.
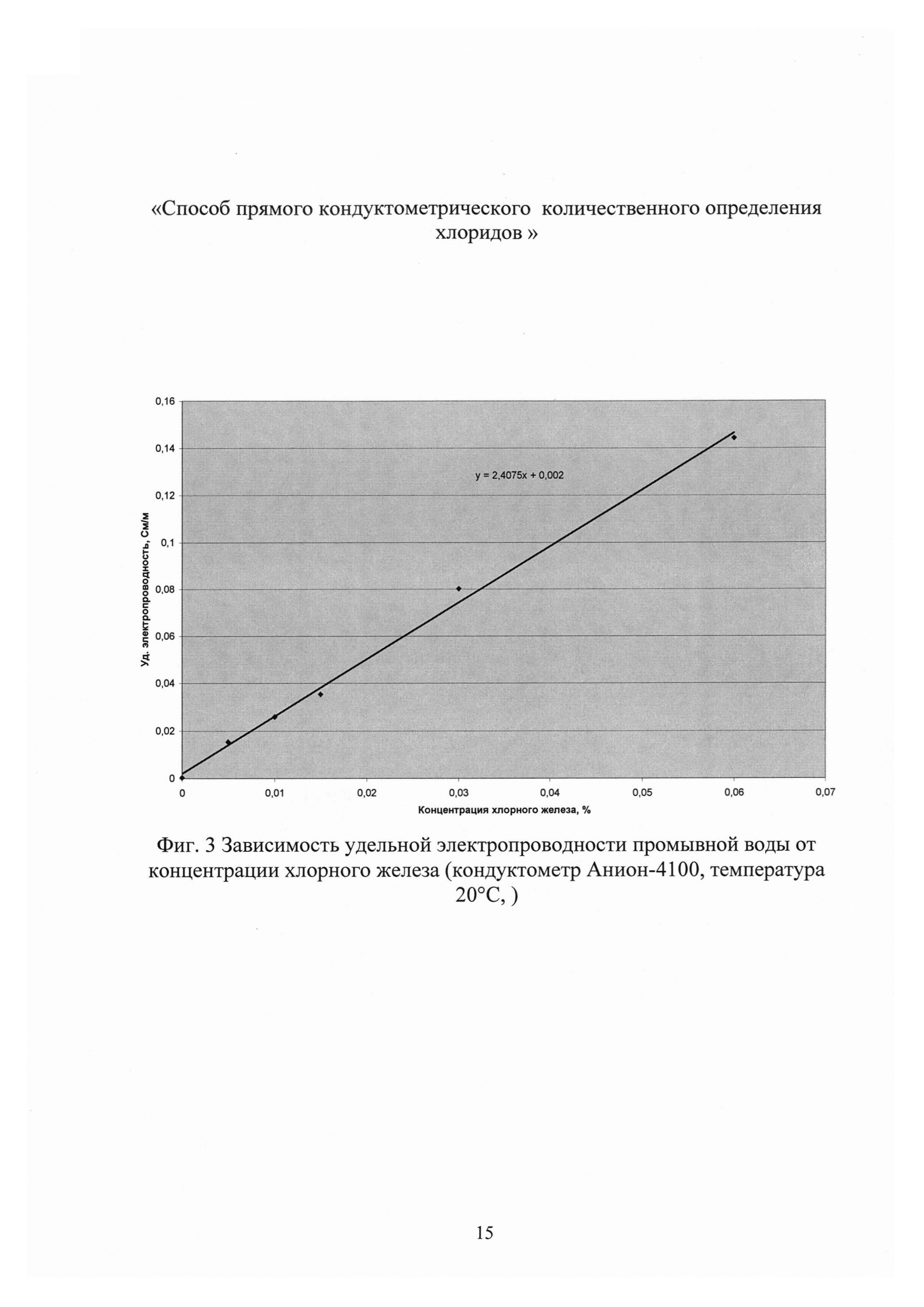
Выбор прямого кондуктометрического определения концентрации хлоридов в промывной воде обусловлен неожиданно низкими концентрациями хлорного железа в промывной воде от следовых количеств до 0,01-0,013% при концентрации хлорида калия 1,0-1,5% и хорошей корреляцией концентраций хлоридов в промывной воде и в субстанции ферроцина. Поэтому вклад хлорного железа в электропроводность промывной воды, полученной после промывки ферроцина, незначительный (не более 2,0%) и им можно пренебречь, а по концентрации хлорида калия в фильтрате можно судить о степени очистки осадка ферроцина от хлоридов и оптимизировать расход дистиллированной воды на очистку целевого продукта. Концентрацию хлорного железа в промывной воде определяли по методике, приведенной в фармстатье [ЛС-002201-310512]. В разбавленных растворах как для хлорида калия с концентрацией от 0,10 до 2,25% (фиг. 2), так и для растворов хлорного железа с концентрацией от 0,01 до 0,06% (фиг. 3) наблюдаются линейные зависимости изменения удельной электропроводности от концентрации соли, что является основой количественного определения хлоридов в промывной воде.
Дальнейшее увеличение диапазона концентраций хлорида калия нецелесообразно, так как при концентрации хлорида калия в промывной воде 0,70% достигается достаточная очистка ферроцина от хлорида калия.
Так как удельная электропроводность растворов электролитов существенно зависит от температуры, то для измерения величины удельной электропроводности анализируемой промывной воды рекомендуется температура 20°C. К тому же, при этой температуре осуществляется очистка ферроцина от побочных хлоридов в производственных условиях.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Из промывной воды, используемой для очистки (промывки) ферроцина, отбирают пробу в количестве 60 мл и измеряют в ней величину удельной электропроводности при температуре раствора 20°C, охлаждая или подогревая анализируемый раствор до этой температуры. В том случае, если происходит проскок ферроцина при фильтрации, то промывную воду дополнительно фильтруют через плотный бумажный фильтр (синяя лента), а затем измеряют удельную электропроводность.
Расчет концентрации хлоридов в промывной воде проводят по формуле, приведенной выше. Величина удельной электропроводности составляет 0,37 См/м, а концентрация хлорида калия в анализируемой промывной воде 0,27% и соответственно хлоридов 0,13%.
Субстанция ферроцина, полученная при очистке этой промывной водой, соответствует требованиям фармстатьи [ЛС-002201-310512] по показателю «Хлориды»: их в ферроцине не более 0,6%.
Пример 2.
Подготовка пробы промывной воды для измерения удельной электропроводности проводится аналогично примеру 1.
Расчет концентрации хлоридов в другом образце промывной воды проводят по формуле, приведенной выше. Величина удельной электропроводности составляет 0,63 См/м, а концентрация хлорида калия в анализируемой промывной воде 0,48% и соответственно хлоридов 0,23%. Концентрация хлоридов, определенная в этой промывной воде кондуктометрическим титрованием 0,1 н раствором нитрата серебра, составляет 0,25%.
Субстанция ферроцина, полученная при очистке этой промывной водой, соответствует требованиям фармстатьи [ЛС-002201-310512] по показателю «Хлориды»: их в ферроцине не более 0,6%.
Пример 3.
Подготовка пробы промывной воды для измерения удельной электропроводности проводится аналогично примеру 1.
Расчет концентрации хлоридов в образце промывной воды проводят по формуле, приведенной выше. Величина удельной электропроводности составляет 0,91 См/м, а концентрация хлорида калия в анализируемой промывной воде 0,70% и соответственно хлоридов 0,33%.
Субстанция ферроцина, полученная при очистке этой промывной водой, соответствует требованиям фармстатьи [ЛС-002201-310512] по показателю «Хлориды»: их в ферроцине не более 0,6%.
Пример 4.
Подготовка пробы промывной воды для измерения удельной электропроводности проводится аналогично примеру 1.
Расчет концентрации хлоридов в образце промывной воды проводят по формуле, приведенной выше. Величина удельной электропроводности составляет 1,27 См/м, а концентрация хлорида калия в анализируемой промывной воде 1,0% и соответственно хлоридов 0,47%.
Субстанция ферроцина, полученная при очистке этой промывной водой, не соответствует требованиям фармстатьи [ЛС-002201-310512] по показателю «Хлориды»: их в ферроцине более 0,6%.
Результаты анализа промывной воды (примеры 1-4) и ферроцина, полученного с использованием этой промывной воды, приведены в табл. 2.
Из данных табл. 2 видно, что для производства ферроцина, соответствующего требованиям фармстатьи [ЛС-002201-310512] по показателю «Хлориды», концентрация хлорида калия в промывной воде должна быть не более 0,7% и соответственно хлоридов не более 0,33%. Этой концентрации хлорида калия в промывной воде соответствует удельная электропроводность 0,91 См/м, величина которой является критерием очистки ферроцина от побочных хлоридов и при этом достигается оптимальный расход дистиллированной воды на отмывку технического ферроцина: 48-50 л/кг против 100 л/кг - по существующей технологии без анализа хлорида калия в промывной воде.
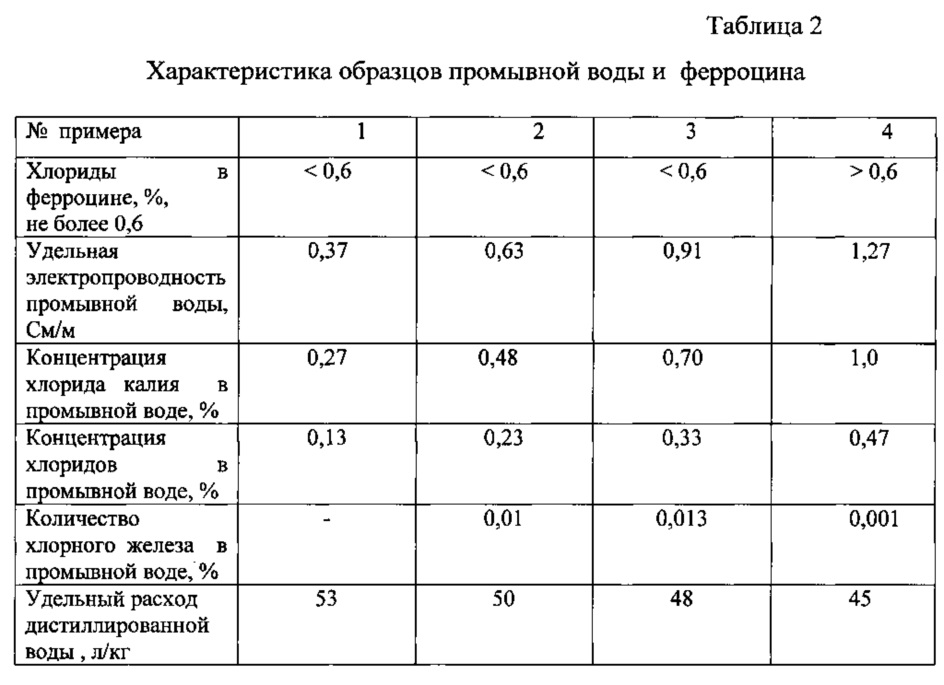
При большей удельной электропроводности промывной воды (пример 4) не достигается нормативное содержание хлоридов в целевом продукте, а при меньшей удельной электропроводности промывной воды (пример 1) наблюдается нерациональный расход дистиллированной воды.
Таким образом, предлагаемый способ прямого кондуктометрического количественного определения хлорида калия существенным образом упрощает и ускоряет анализ концентрации соли в промывной воде, используемой для очистки ферроцина, что обеспечивает его реализацию в производственных условиях как экспресс-метода для решения важнейших технологических задач производства ферроцина, в частности обеспечение фармакопейного качества субстанции и оптимального расхода дистиллированной воды, а также сокращение продолжительности стадий очистки ферроцина и фильтрации.