НОВЫЕ ТВЕРДЫЕ ФОРМЫ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ 5-ГО ТИПА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым твердым формам ингибиторов фосфодиэстеразы 5-го типа, в частности к комплексным сокристаллам и к их сольватам, гидратам и полиморфам, и их применению в производстве фармацевтической композиции, пригодной для лечения эректильной дисфункции.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым твердым формам (NSF) ингибиторов фосфодиэстеразы 5-го типа, а именно к комплексным кристаллам, имеющим постоянное качество и, возможно, обладающим улучшенными физико-химическими свойствами, такими как физическая и химическая стабильность и модифицированная скорость растворения.
Для настоящего изобретения новые твердые фазы (NSP) также называют сокристаллами и получают средствами технической постановки эксперимента. Сокристаллы представляют собой химические структурные единицы с физико-химическими свойствами, отличающимися от свойств солей или полиморфов основного активного ингредиента, включая их соли и/или их полиморфы, вследствие природы межмолекулярных взаимодействий между активной молекулой и вторым твердым составляющим, называемым коформером (сообразователем).
Сокристалл представляет собой кристалл, образованный двумя или более неидентичными молекулами, в которых исходные компоненты являются твердыми при комнатных условиях, когда они находятся в их чистой форме, и где два или более компонентов сокристалла образуют агрегаты, которые характеризуются тем, что связаны межмолекулярными взаимодействиями, такими как сила Ван-дер-Ваальса, π-сборка, водородное связывание или электростатические взаимодействия, но без образования ковалентных связей. При использовании методик образования кристаллов может быть получено новое соединение с модифицированными физико-химическими свойствами, отличающееся от полиморфов, солей, гидратов и/или существующих сольватов. Регулируемые параметры скрининга выше, таким образом, в случае фармацевтических ингредиентов могут быть оптимизированы физические и химические свойства активного ингредиента с клинической значимостью.
Фармацевтические сокристаллы представляют собой сокристаллы, содержащие по меньшей мере одну терапевтическую молекулу и фармацевтически приемлемый коформер (сообразователь). В этих кристаллах их компоненты - активный ингредиент и коформер - сосуществуют в четко определенном стехиометрическом соотношении. Сокристаллы в твердой форме склонны быть более стабильными, чем существующие сольваты или гидраты.
В настоящем изобретении описываются сокристаллы, которые будут называться «комплексные сокристаллы», полученные из ингибитора фосфодиэстеразы 5-го типа - тадалафила и нейтрального сообразователя, где оба являются твердыми при комнатной температуре. Полученные сокристаллы имеют постоянное качество и могут обладать улучшенными физико-химическими свойствами, такими как более высокая растворимость и скорость растворения, улучшенные реологические свойства и улучшенная стабильность.
Ингибиторы фосфодиэстеразы 5-го типа представляют собой группу лекарственных средств, применяемых в лечении эректильной дисфункции и для лечения легочной артериальной гипертензии. Структурно они состоят из гетероциклов с атомами азота, ароматическими группами и карбонильными группами. Ингибиторы фосфодиэстеразы 5-го типа, применяемые в клинической практике, представляют собой тадалафил, силденафил и варденафил. В настоящем изобретении разработан способ получения сокристаллов и других твердых форм на основе одного из этих ингибиторов фосфодиэстеразы 5-го типа, напр., тадалафила.
Молекула тадалафила, также как и других ингибиторов фосфодиэстеразы 5-го типа, структурно составлена из гетероциклов, ароматических групп и карбонильных групп. Тадалафил имеет индольную группу, пиразиновую группу и бензодиоксол, прикрепленный к С6, как показано на Схеме I.

В коммерческих фармацевтических препаратах тадалафил находится в нейтральной форме и состоит из D+изомера (6R, 12R), который практически нерастворим в воде. Абсолютная биодоступность тадалафила после его перорального введения до сих пор не была определена. В терапевтических концентрациях 94% плазматического тадалафила связывается с белками, он имеет период полураспада 17,5 часов и выводится с помощью метаболизма в печени, преимущественно в виде метаболитов, главным образом, с фекалиями (приблизительно 61% от дозы) и в меньшей степени с мочой (приблизительно 36% от дозы). Тадалафил ингибирует фосфодиэстеразу 5-го типа (ФДЭ-5) и улучшает эректильную функцию путем увеличения количества циклического гуанозинмонофосфата (цГМФ). цГМФ определяет расслабление гладкой мускулатуры и увеличивает приток крови в пещеристые тела. Его доставка осуществляется пероральным путем в ежедневных дозах 5, 10 или 20 мг.
Побочные эффекты тадалафила обычно легкие или умеренные, временные и улучшаются без медицинского лечения. Наиболее частые побочные эффекты представляют собой головную боль, диспепсию, боль в спине, миалгию, заложенность носа, приливы, головокружение и боль в конечностях.
Лекарственные средства, которые ингибируют CYP3A4, такие как кетоконазол, ритонавир, эритромицин и итриконазол, увеличивают воздействие тадалафила, так как тадалафил представляет собой субстрат CYP3A4 и в основном метаболизируется этим путем. С другой стороны, лекарственные средства, которые индуцируют CYP3A4, такие как рифампицин, карбамазепин, фенитоин и фенобарбитал, могут снизить воздействие тадалафила. Одновременная доставка антацида, такого как гидроксид алюминия/гидроксид магния, замедляет скорость абсорбции тадалафила. Значительное потребление алкоголя (более чем 5 единиц) в сочетании с тадалафилом может увеличить риск развития ортостатических признаков и симптомов, включающих увеличение частоты сердечных сокращений, снижение кровяного давления стоя, головокружение и головные боли. Когда тадалафил вводят совместно с альфа-блокирующими агентами, такими как тамсулозин, доксазосин или другими антигипертензивными агентами, такими как амлодипин, метопролол, бендрофлуазид, эналаприл или блокаторы ангиотензина II, они могут взаимно усилить в большей или меньшей степени его гипотензивный эффект.
В документе US 20090131667 A1 описывается получение и процесс изготовления аморфной формы тадалафила путем вспомогательного выпаривания с перегонкой раствора тадалафила в органическом растворителе. В нем также описывается получение и процесс изготовления чистой кристаллической формы В тадалафила путем осаждения раствора тадалафила в кетонном растворителе; и описывается приготовление смеси из тадалафила формы А и формы В путем осаждения раствора тадалафила в эфирном растворителе.
В документе US 2006/0111571 А1 (МХ/а/2007/003719) описывается получение и способ приготовления кристаллических форм (полиморфов) I, II, III, IV, V, VI, VII и VIII тадалафила путем кристаллизации и/или осаждения в органических растворителях; описывается способ приготовления кристаллической формы I тадалафила путем кристаллизации растворов тадалафила в органических растворителях, таких как 2-метоксиэтанол, этанол, ацетонитрил, 1-пропанол, изопропанол, этилацетат, толуол, диметилсульфоксид, н-бутанол, метанол, хлороформ, тетрагидрофуран, ацетон и/или метилэтилкетон, и путем осаждения, когда объединяются эти растворы с растворителями, такими как петролейный эфир, циклогексан, толуол, ксилол, бензол и метил-трет-бутиловый эфир, до получения осадка, который выделяют. В нем описывается способ получения кристаллической формы I исходя из кристаллических форм II, III и IV при определенных условиях влажности и температуры; описывается способ получения кристаллической формы II при кристаллизации раствора тадалафила в ацетоне или метилэтилкетоне или путем осаждения с добавлением растворителя, такого как петролейный эфир, циклогексан или метил-трет-бутиловый эфир, к раствору метилэтилкетона; описывается способ получения кристаллической формы III тадалафила исходя из кристаллической формы II путем нагревания при 65°С; описывается способ получения кристаллической формы IV путем кристаллизации раствора тадалафила в метиленхлориде или путем осаждения из этого раствора с добавлением петролейного эфира; описывается способ получения кристаллической формы V из раствора уксусной кислоты; описывается получение кристаллической формы VI с помощью формы IV из суспензии в метаноле и высушивании при 65°С; описывается получение тадалафила формы VII с помощью форм II, IV и V из суспензии в толуоле и высушивании при 65°С; описывается способ получения кристаллической формы VIII из кристаллической формы IV в диапазоне 50-70°С.
Настоящее изобретение в отличие от кристаллов, приведенных в документах US 20090131667 A1 и US 20060111571 А1, включает «комплексные» сокристаллы, которые получают из ингибитора фосфодиэстеразы 5-го типа, такого как тадалафил, используя его полиморф I. Сокристаллы по настоящему изобретению получают с сообразователями, такими как 3-гидроксибензойная кислота, 4-гидроксибензойная кислота, 2,3-дигидроксибензойная кислота, 2,5-дигидроксибензойная кислота, 3,4,5-тригидроксибензойная кислота, D-яблочная кислота и L-винная кислота. Эти сообразователи имеют одну или более гидроксильных и карбоксильных групп, образующих агрегат посредством водородного связывания и Ван-дер-Ваальсовых взаимодействий с тадалафилом или другими активными ингредиентами, которые имеют структурное сходство, например силденафилом и варденафилом.
В заявке WO 20120099323 описывается образование сокристаллов тадалафила с щавелевой кислотой, салициловой кислотой, 4-гидроксибензойной кислотой, малоновой кислотой, 3-фенилпропановой кислотой, метилпарабеном и пропилпарабеном. В документе Weyna et al., "Crystal engineering of multiple-component organic solids: Pharmaceutical cocrystals of tadalafil with persistent hydrogen bonding motifs", CrystEngComm, 2012. 14, 2377 описывается синтез сокристаллов тадалафила с метилпарабеном, пропилпарабеном, коричной кислотой и 4-гидроксибензойной кислотой.
Хотя это правда, что документы WO 20120099323 и статья Weyna et al. описывают существование сокристаллов тадалафила, и даже когда в процессе получения сокристаллов можно предусмотреть большое количество комбинаций с возможными коформерами, не все комбинации приводят к сокристаллу или стабильной твердой форме, как показано в описании настоящей заявки.
Настоящее изобретение включает новые твердые фазы тадалафила, которые могут показать улучшенные физико-химические свойства, такие как повышенные растворимость, скорость растворения, биодоступность, стабильность и/или реологические свойства.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение в предпочтительном варианте выполнения обеспечивает несколько неопубликованных соединений тадалафила, определенных как комплексные сокристаллы, образованные из тадалафила формы I и нейтрального коформера (сообразователя). Эти новые твердые формы могут обладать улучшенными физико-химическими и биофармацевтическими свойствами, которые делают их выгодными для приготовления фармацевтических композиций, такими как повышенная биодоступность, повышенная растворимость и, следовательно, сниженные побочные эффекты.
В предпочтительном варианте выполнения настоящее изобретение включает способ получения новых твердых форм тадалафила, которые могут обладать улучшенными характеристиками, такими как более высокая растворимость, скорость растворения, улучшенные свойства обработки лекарственных средств и/или улучшенные фармакокинетические свойства, которые позволили бы снизить дозу и, следовательно, снизить побочные эффекты.
Настоящее изобретение является специфическим для получения NSF ингибиторов фосфодиэстеразы 5-го типа, таких как тадалафил, методом преобразования твердой фазы (суспензии), методом реакции кристаллизации и методом химического механического измельчения с использованием минимума растворителей и в условиях окружающей среды, которые не приводят его к точке замерзания. Этот способ получения снижает затраты на эксплуатацию оборудования для получения сокристаллов и имеет минимальное воздействие на окружающую среду, поскольку практически не используются органические растворители или используются их небольшие количества.
ОБОСНОВАНИЕ ИЗОБРЕТЕНИЯ
Рациональное применение лекарственных средств направлено на получение наибольшей возможной пользы для людей при их применении и минимизации экономических затрат, поэтому важно иметь лекарственные средства, которые производят один и тот же терапевтический эффект при более низких дозах и, следовательно, снижаются побочные эффекты с достижением большей предрасположенности к лечению.
Силденафил, варденафил и тадалафил, которые являются селективными ингибиторами цГМФ, в частности фосфодиэстеразы 5-го типа (ФДЭ-5) имеют серьезные проблемы растворимости в водных средах так, что существует необходимость в комплексных сокристаллах, которые увеличивают растворимость и, следовательно, их активность, и которые позволяют снизить дозу пациента.
В уровне техники имеются некоторые документы, в которых раскрывается получение сокристаллов тадалафила, но сокристаллы и сольваты, описанные в настоящем документе, не описаны в предшествующем уровне техники. В процессе получения сокристаллов можно предусмотреть большое количество комбинаций с возможными коформерами. Однако не каждая комбинация приводит к сокристаллу или стабильной твердой форме.
Несмотря на то, что существует хорошее понимание физикохимии компонентов сокристалла, их идентификация a priori практически невозможна, так как взаимодействия, которые определяют структуру, относительно слабые, и число степеней свободы для задачи оптимизации неизмеримо. По этим причинам новые твердые формы, раскрытые в настоящем документе, не являются очевидными для специалиста в данной области техники. Кроме того, сокристаллы и сольваты по настоящему изобретению показали физико-химическую стабильность, что позволяет использовать их в фармацевтических композициях.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигуры 1-20 иллюстрируют результаты охарактеризовывания NSF тадалафила, полученных в настоящем изобретении.
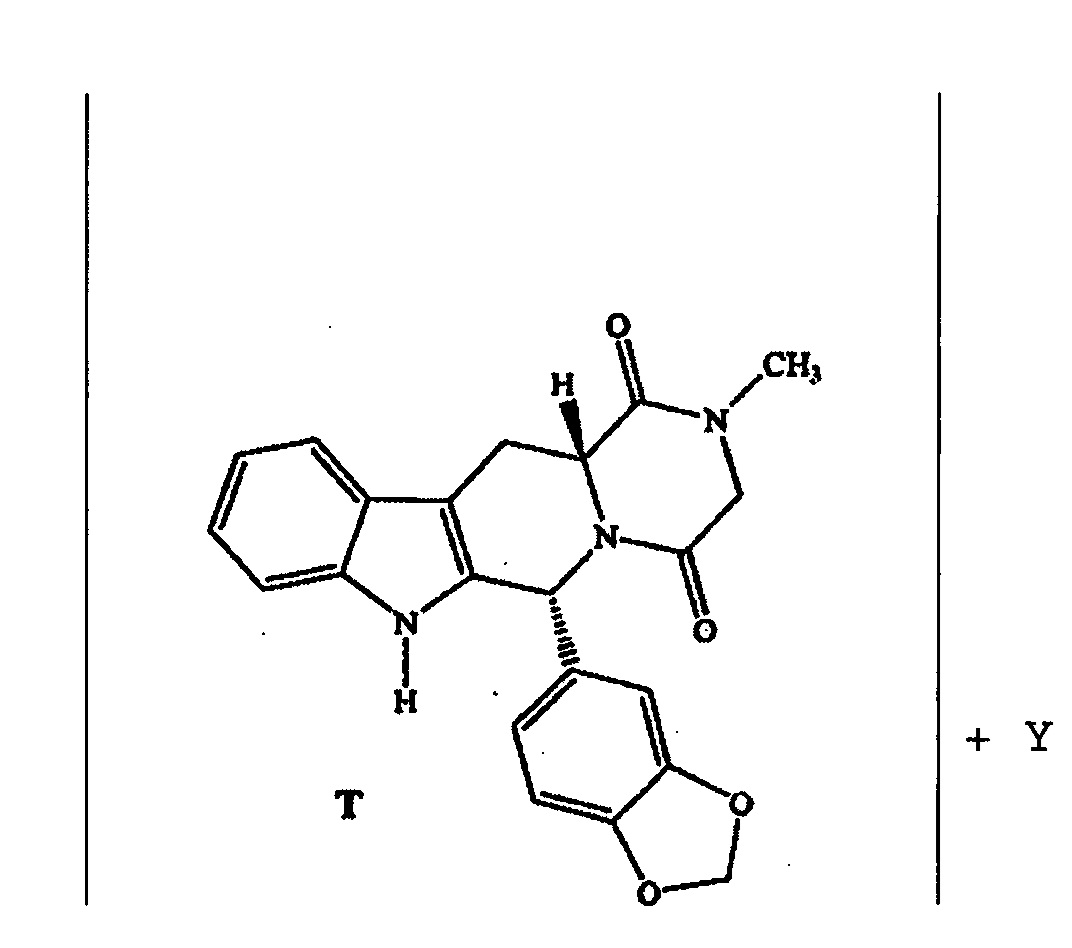
Фигура 1. Рентгеновская порошковая дифрактограмма сокристалла тадалафила с 3-гидроксибензойной кислотой.
Фигура 2. Инфракрасный спектр с Фурье-преобразованием сокристалла тадалафила с 3-гидроксибензойной кислотой.
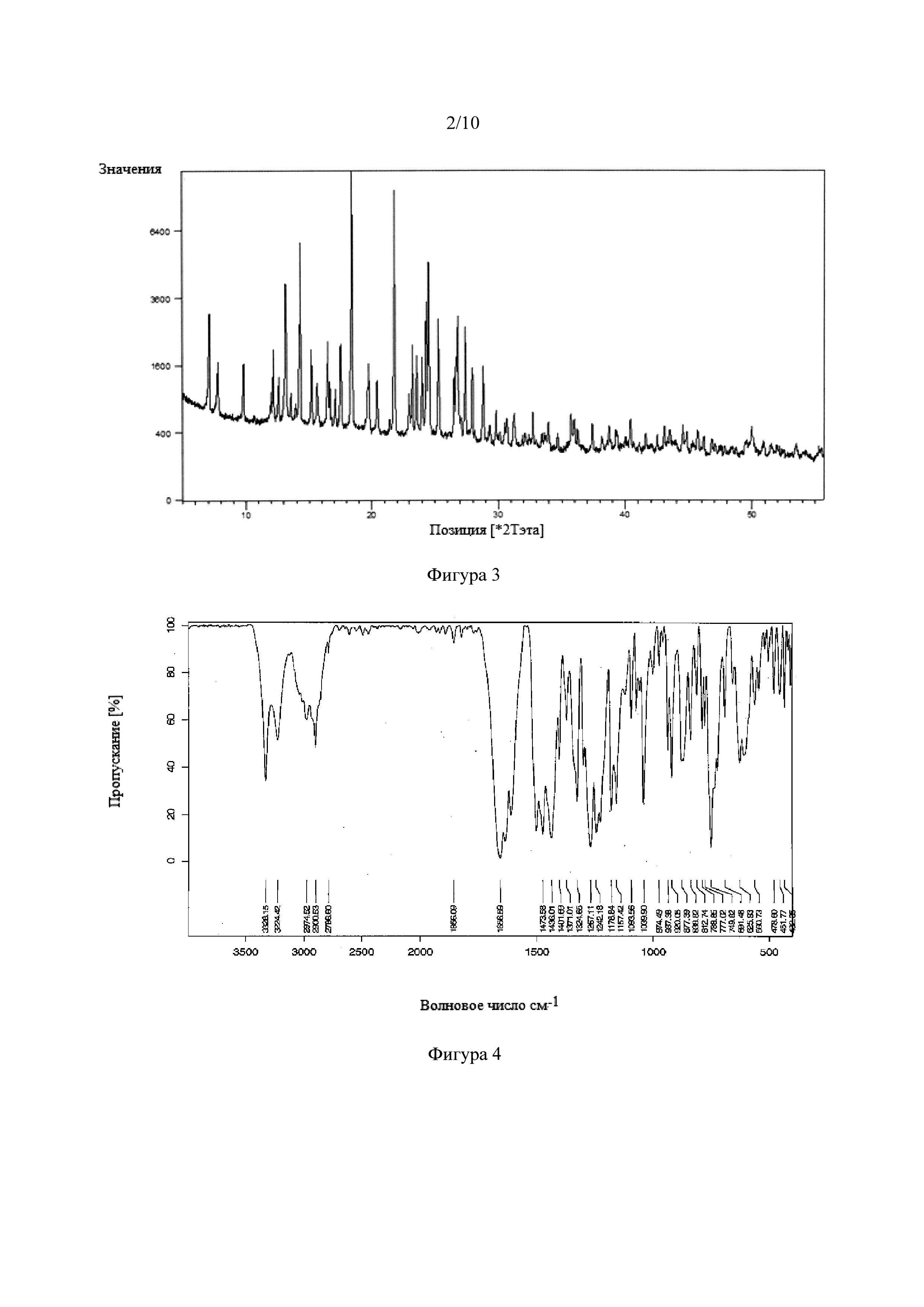
Фигура 3. Рентгеновская порошковая дифрактограмма сокристалла тадалафила с 2,3-дигидроксибензойной кислотой.
Фигура 4. Инфракрасный спектр с Фурье-преобразованием сокристалла тадалафила с 2,3-дигидроксибензойной кислотой.
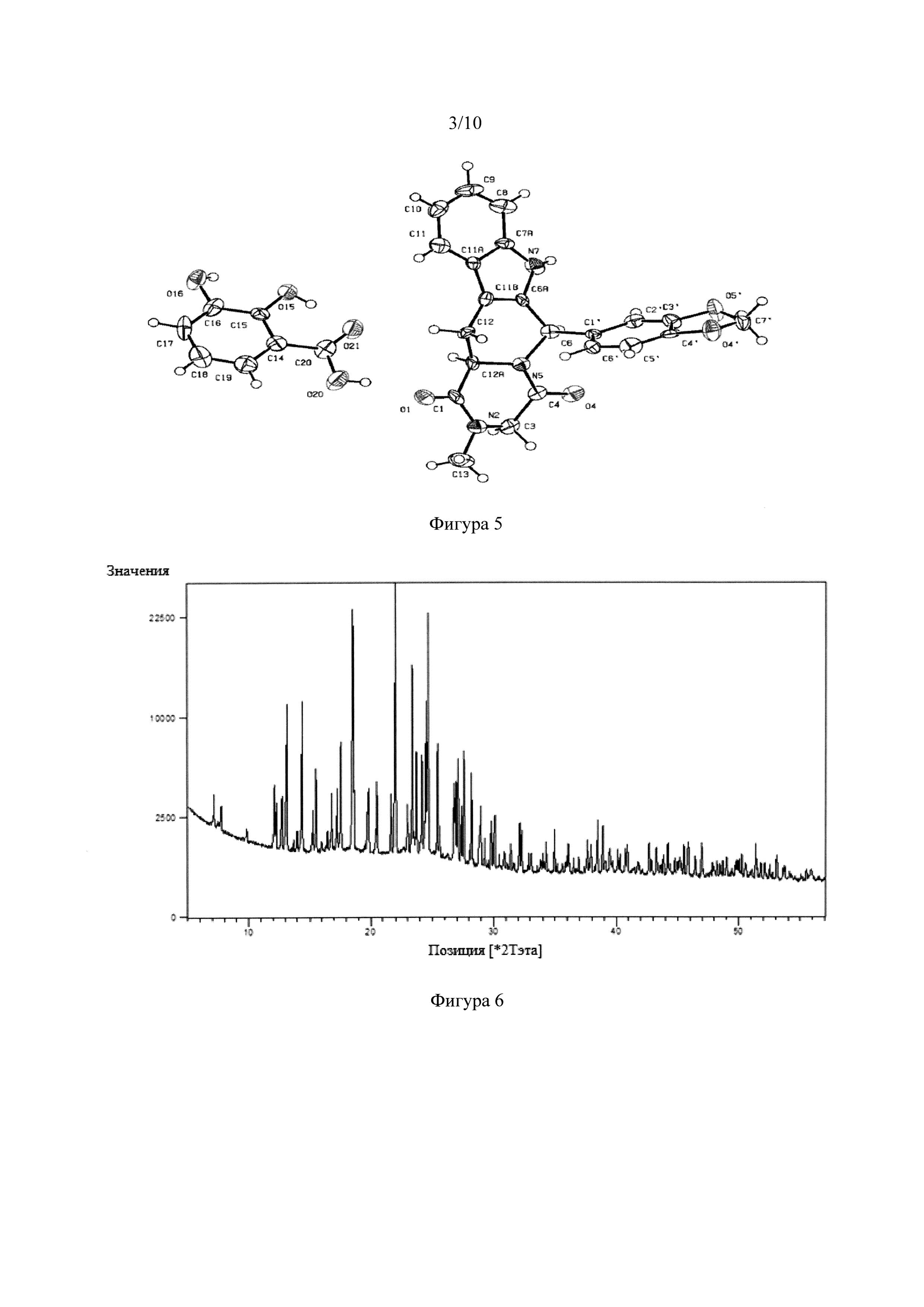
Фигура 5. Кристаллическая структура сокристалла тадалафила с 3-дигидроксибензойной кислотой.
Фигура 6. Рентгеновская порошковая дифрактограмма сокристалла тадалафила с 2,5-дигидроксибензойной кислотой.
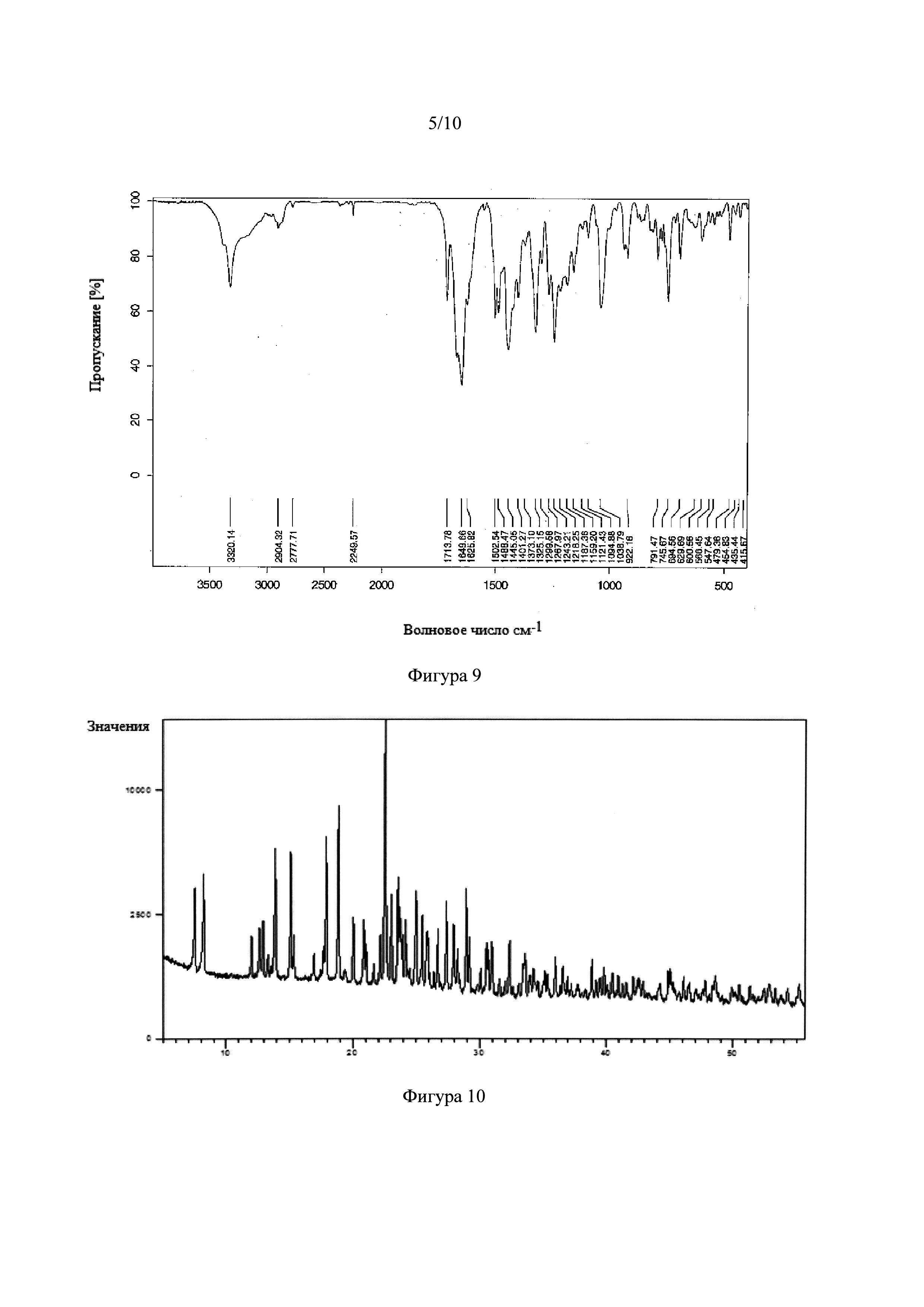
Фигура 7. Инфракрасный спектр с Фурье-преобразованием сокристалла тадалафила с 2,5-дигидроксибензойной кислотой.
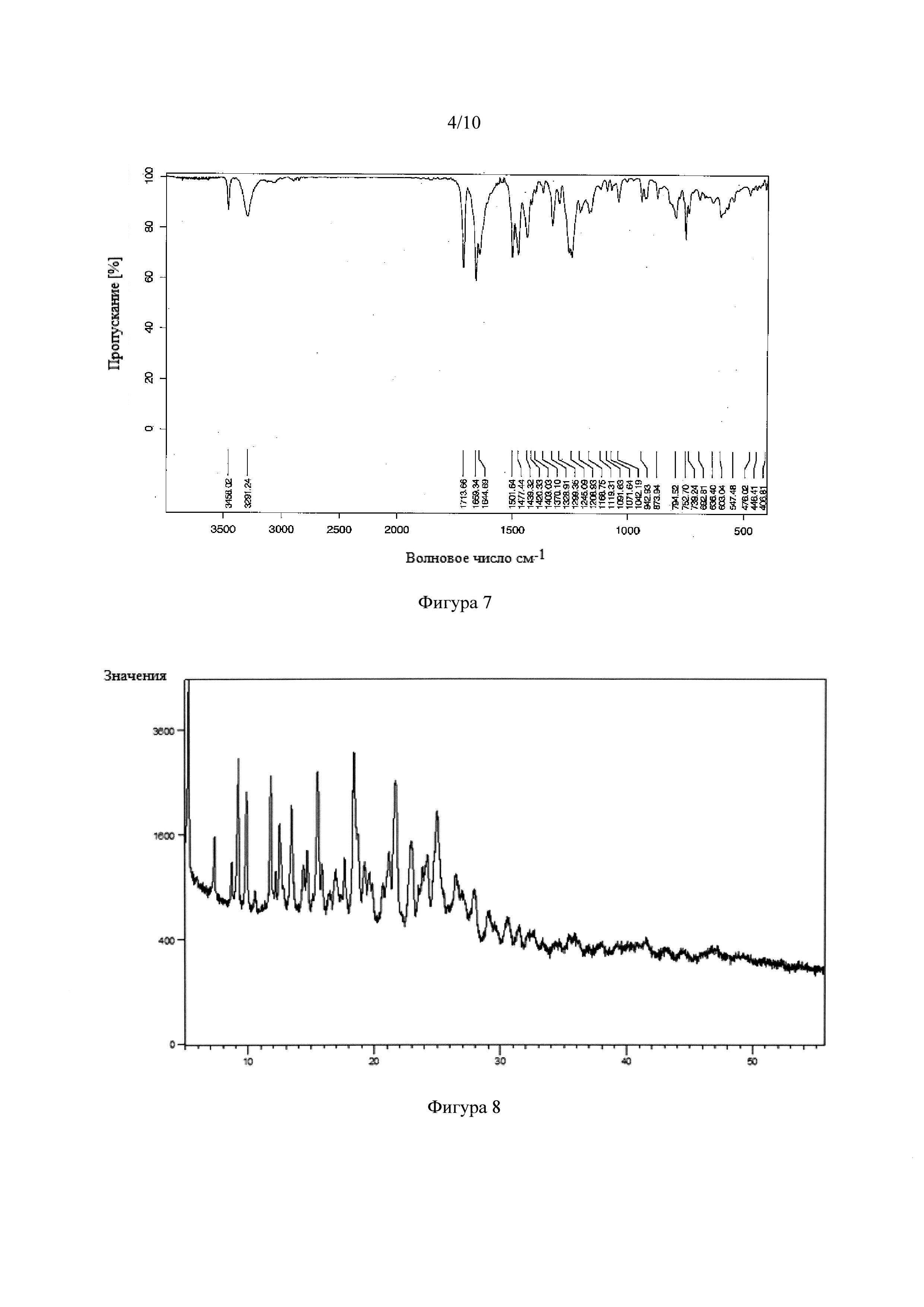
Фигура 8. Рентгеновская порошковая дифрактограмма сокристалла тадалафила с 3,4,5-тригидроксибензойной кислотой.
Фигура 9. Инфракрасный спектр с Фурье-преобразованием сокристалла тадалафила с 3,4,5-тригидроксибензойной кислотой.
Фигура 10. Рентгеновская порошковая дифрактограмма сокристалла тадалафила с D-яблочной кислотой.
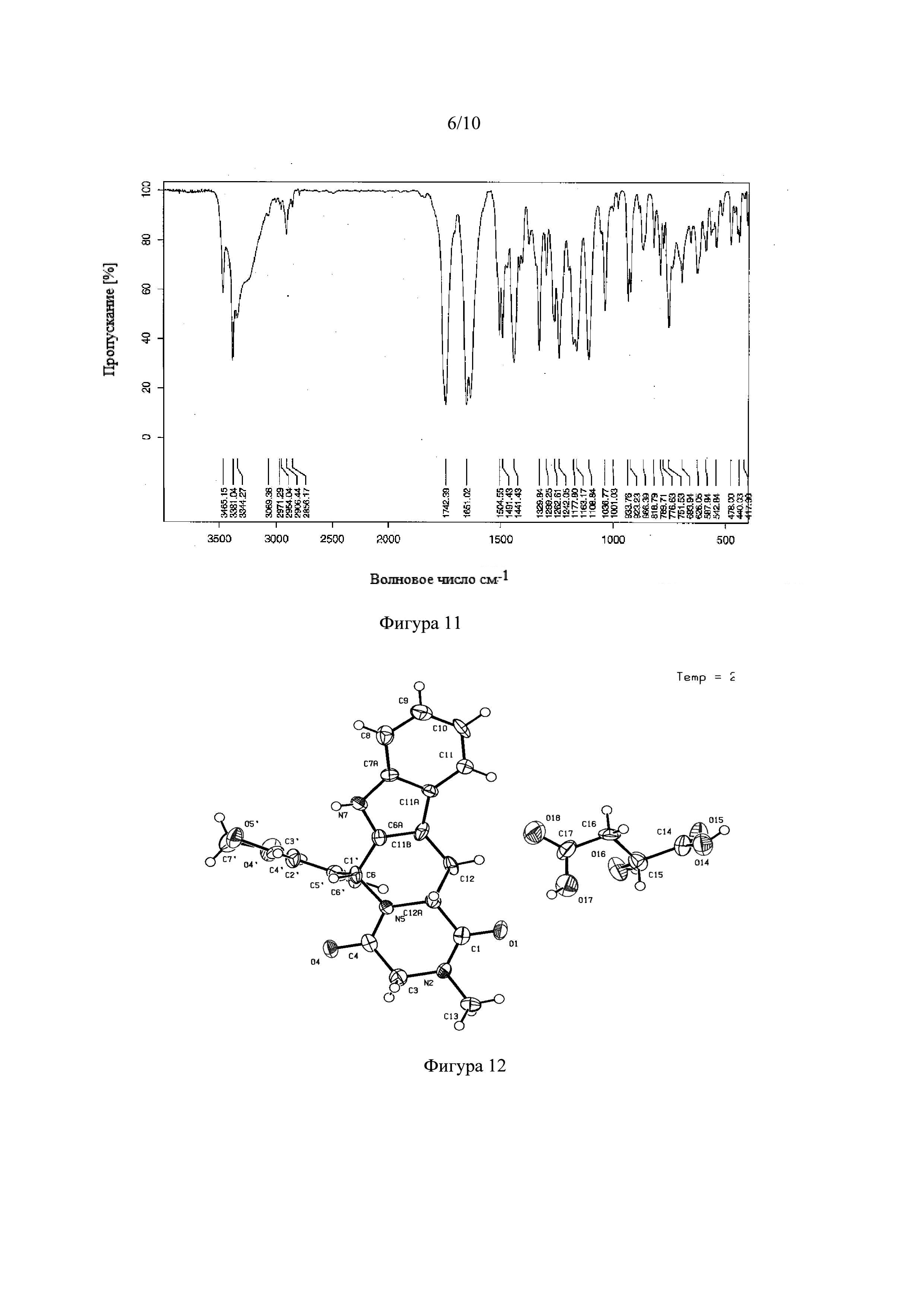
Фигура 11. Инфракрасный спектр с Фурье-преобразованием сокристалла тадалафила с D-яблочной кислотой.
Фигура 12. Кристаллическая структура сокристалла тадалафила с D-яблочной кислотой.
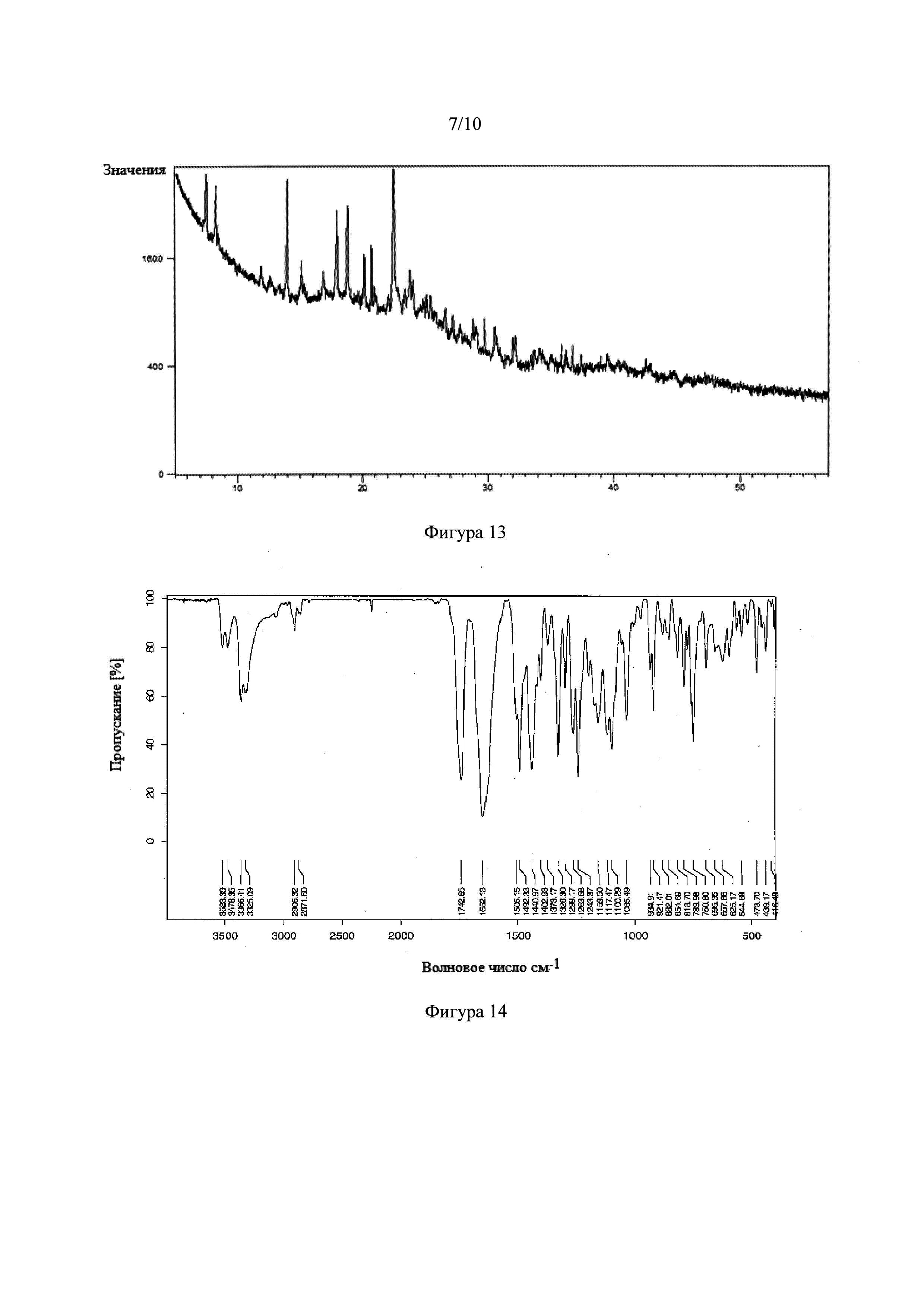
Фигура 13. Рентгеновская порошковая дифрактограмма сокристалла тадалафила с L-винной кислотой.
Фигура 14. Инфракрасный спектр с Фурье-преобразованием сокристалла тадалафила с L-винной кислотой.
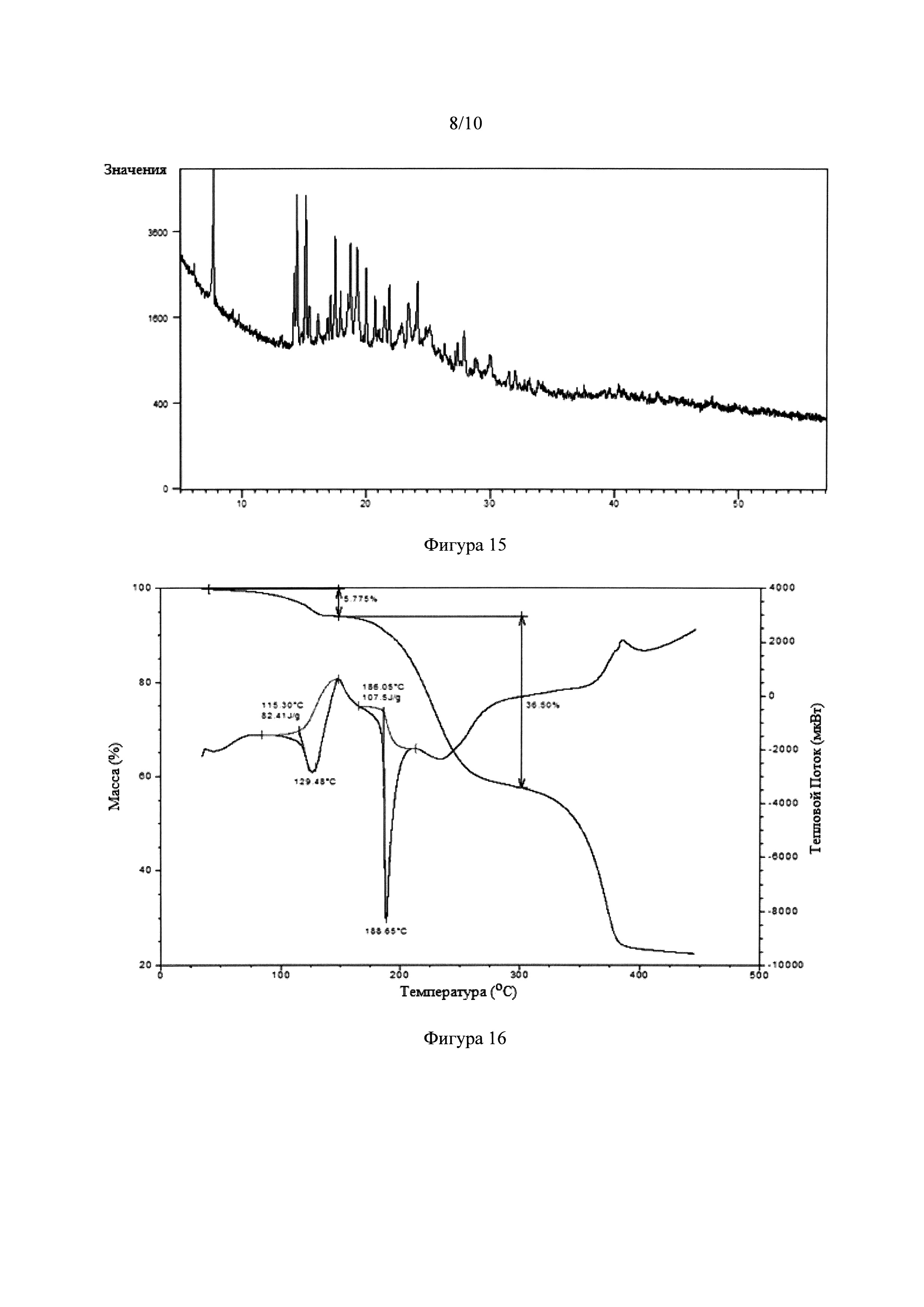
Фигура 15. Рентгеновская порошковая дифрактограмма NSF, образованной из тадалафила и 4-гидроксибензойной кислоты.
Фигура 16. Калориметрический анализ DSC-TGA NSF, образованной из тадалафила и 4-гидроксибензойной кислоты.
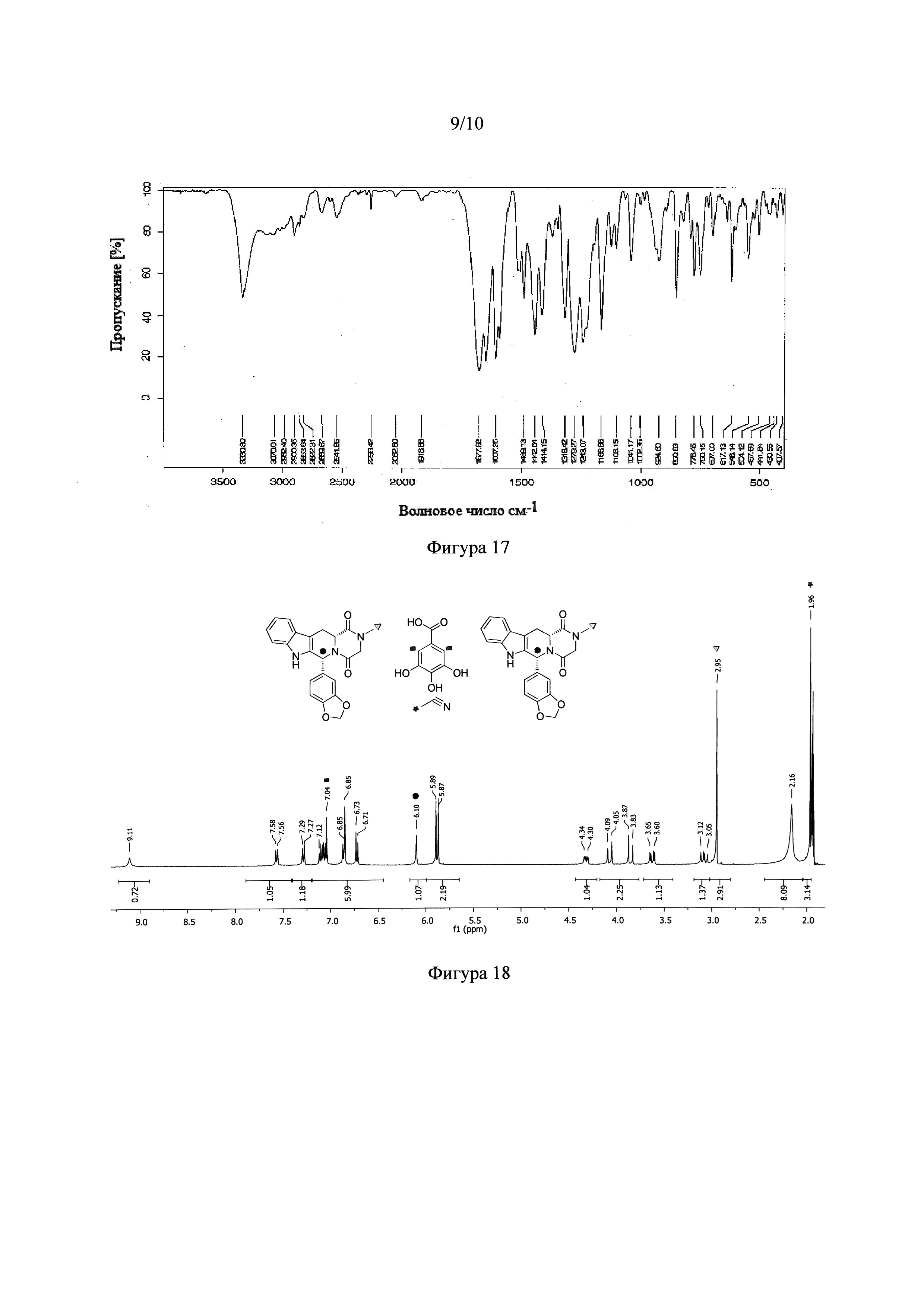
Фигура 17. Инфракрасный спектр с Фурье-преобразованием NSF, образованной из тадалафила и 4-гидроксибензойной кислоты.
Фигура 18. 1Н ЯМР спектр NSF, образованной из тадалафила и 3,4,5-тригидроксибензойной кислоты.
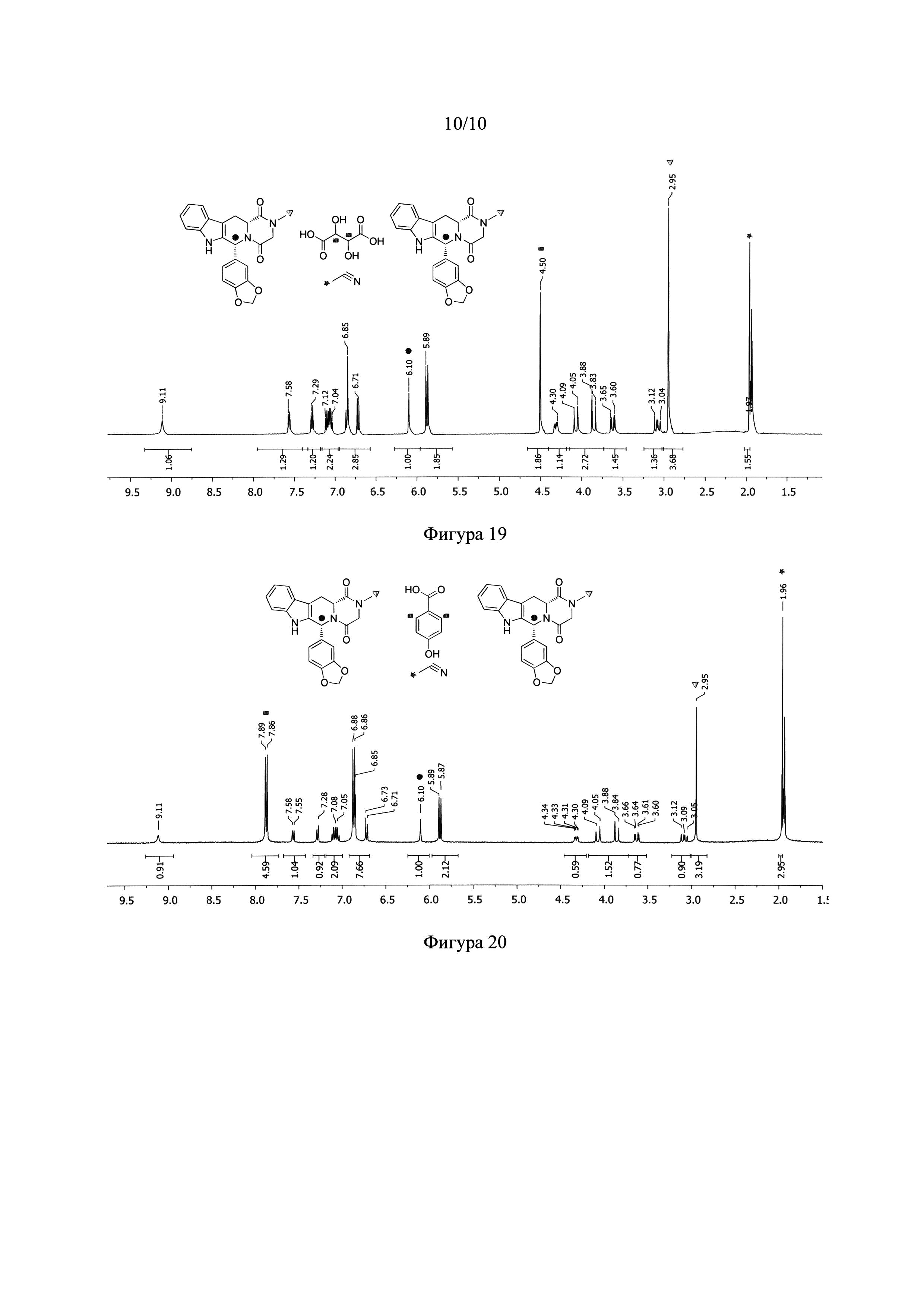
Фигура 19. 1Н ЯМР спектр NSF, образованной из тадалафила и L-винной кислоты.
Фигура 20. 1Н ЯМР спектр NSF, образованной из тадалафила и 4-гидроксибензойной кислоты.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Одна из проблем, с которой столкнулись при разработке настоящего изобретения, состоит в получении стабильного соединения, образованного из ингибитора фосфодиэстеразы 5-го типа, такого как тадалафил, с высокой степенью чистоты, с физико-химическими свойствами, пригодными для получения фармацевтической композиции, и которое улучшает существующие формы с точки зрения стабильности, растворимости и/или скорости растворения. Из-за сложности взаимодействий в твердой структуре окончательную структуру и, таким образом, свойства новых твердых форм, невозможно предсказать теоретически, поэтому должно было проводиться большое количество экспериментов для того, чтобы найти соединения, описанные в настоящем документе.
Комплексные сокристаллы по настоящему изобретению в предпочтительном варианте выполнения изобретения образованы из тадалафила формы I и нейтрального коформера, которые оба являются твердыми при комнатной температуре. NSF, полученные из комбинации этих твердых веществ, состоят из агрегата, в котором лекарственный компонент и молекула нейтрального сообразователя взаимодействуют посредством водородного связывания и Ван-дер-Ваальсовых взаимодействий. Новые твердые формы, полученные по настоящему документу, дают возможность образования твердых частиц активных ингредиентов с улучшенными физико-химическими свойствами, такими как повышенная растворимость, стабильность или текучесть.
Настоящее изобретение начинается с селективного ингибитора фосфодиэстеразы 5-го типа, напр., тадалафила.
Тадалафил подвергали взаимодействию с несколькими возможными коформерами с тестированием различных растворителей, таких как тетрагидрофуран (ТГФ), метанол (МеОН), ацетон или ацетонитрил.
Стратегии синтеза, используемые для получения NSF тадалафила, представляли собой реакцию кристаллизации, суспензионный метод и метод химического механического измельчения.
Настоящее изобретение работает, среди прочих, со следующими сообразователями: алифатическими карбоновыми кислотами, ароматическими карбоновыми кислотами, ароматическими гидроксикарбоновыми кислотами, алифатическими гидроксикарбоновыми кислотами, ароматическими гетероциклическими амидами, производными аминокислот, полифенолами, спиртами, такими как ксилит, и ароматическими аминокарбоновыми кислотами, такими как 3-аминобензойная кислота. Новая твердая форма (NSF), которая была стабильна с 3-гидроксибензойной кислотой, была найдена в различных анализах по настоящему изобретению. Полученная NSF соответствует соединению, в котором нейтральный сообразователь имеет гидроксильную группу и карбоновую кислоту и дополнительно содержит фенильную группу как часть его структуры.
Кроме того, и для того, чтобы разграничить структурное разнообразие коформеров, которые образуют сокристаллы, проводили другие реакции, теперь с алифатическими и ароматическими карбоновыми кислотами, такими как щавелевая, янтарная, адипиновая, малеиновая, бензойная, фталевая и ацетилсалициловая кислоты. NSF не были получены в результате работы с алифатическими и ароматическими дикарбоновыми кислотами.
Кроме того, проводили реакции с ароматическими монокарбоновыми кислотами с гидроксильной группой, такими как 2-гидроксибензойная кислота, 3-гидроксибензойная кислота, 4-гидроксибензойная кислота, миндальная кислота и 1-гидрокси-2-нафтойная кислота. В этом случае NSF были получены с 3-гидроксибензойной кислотой и 4-гидроксибензойной кислотой.
Другие реакции проводили с ароматическими монокарбоновыми кислотами с двумя и тремя гидроксильными группами, представляющими собой ванилиновую кислоту, 2,3-дигидроксибензойную кислоту, 2,4-дигидроксибензойную кислоту, 2,5-дигидроксибензойную кислоту, 2,6-дигидроксибензойную кислоту, 3,4-дигидроксибензойную кислоту, 3,5-дигидроксибензойную кислоту и 3,4,5-тригидроксибензойную кислоту, также известную как галловая кислота. В этом случае NSF были получены с 2,3-гидроксибензойной кислотой, 2,3-дигидроксибензойной кислотой и 3,4,5-тригидроксибензойной кислотой. Однако NSF не были получены с 3,4-дигидроксибензойной кислотой и 3,5-дигидроксибензойной кислотой, что снова показывает, что образование NSF непредсказуемо.
Также проводили реакции с алифатическими гидроксикарбоновыми коформерами, такими как гликолевая, D-винная, L-винная, D,L-винная, мезо-винная, D-яблочная, L-яблочная, DL-яблочная и лимонная кислоты. В этом случае NSF были получены с D-яблочной кислотой и L-винной кислотой.
В других случаях для того, чтобы получить NSF и определить, влияет ли замещение спиртовой группы на амин на получение NSF, оценивали реакцию с 3-аминобензойной кислотой по аналогии с 3-гидроксибензойной кислотой. В этом случае NSF не была получена.
Подобно этому и для того, чтобы определить образование NSF с молекулами, содержащими другой тип доноров водородного связывания, помимо карбоновых и гидроксильных групп исследовали аминокислоты, такие как L-глутамин, L-фенилаланин, L-серии, L-треонин и L-тирозин. В результате NSF не были получены с этими сообразователями.
Также проводили реакции с бензамидами, такими как пиколинамид, никотинамид и изоникотинамид, и спиртами, такими как ксилит, которые не приводили к NSF.
На основании результатов, полученных для тадалафила, формирование сокристаллов с силденафилом и варденафилом является возможным посредством образования межмолекулярного водородного связывания и Ван-дер-Ваальссовых взаимодействий активных ингредиентов с нейтральными сообразователями, особенно теми, которые содержат гидроксикарбоксильные группы.
Результаты получения NSF различными способами
В предпочтительном варианте выполнения изобретения готовили эквимолярные смеси тадалафила и соответствующих коформеров, к которым добавляли небольшое количество растворителя с образованием суспензии при постоянном перемешивании в течение 8 часов. С помощью этого способа получили несколько возможных комбинаций между тадалафилом, коформерами и растворителями. Продукт таких реакций характеризовали анализом рентгеновской порошковой дифракции. Этот тест показал получение NSF либо в виде сокристаллов, либо в виде их сольватов. Из результатов этих тестов можно сделать вывод, что образование сокристаллов является непростым, а также непредсказуемым.
Суспензионные эксперименты с алифатическими и ароматическими карбоновыми кислотами, такими как щавелевая кислота, янтарная кислота, адипиновая кислота, малеиновая кислота, бензойная кислота, фталевая кислота и ацетилсалициловая кислота в метаноле или ацетонитриле, свидетельствуют на основании анализа рентгеновской порошковой дифракции, что во всех случаях твердое вещество, полученное способом кристаллизации насыщенного раствора, точно соответствует тадалафилу и/или сообразователю, т.е. NSF не была получена. Подобные результаты были получены с аминокислотами, спиртами, такими как ксилит, амидами и 3-аминокарбоновыми кислотами.
Эксперименты по кристаллизации, проведенные с ароматическими гидроксикарбоновыми кислотами, показали различные результаты. Например, синтез NSF с 3-гидроксибензойной кислотой и 4-гидроксибензойной кислотой протекал по методам кристаллизации из суспензии, измельчения или реакции кристаллизации с использованием ацетонитрила в качестве растворителя. Фазу, полученную с 3-гидроксибензойной кислотой, также получали из метанола. В противоположность этому, ни одна из трех методик не позволила получить NSF с 2-гидроксибензойной кислотой. Эти анализы демонстрируют, что реакции кристаллизации для формирования сокристаллов не предсказуемы.
Эти полученные новые фазы, проверяли в основном анализом рентгеновской порошковой дифракции (XRD) (Фигуры 1 и 15) и по инфракрасному спектру (FT-IR) (Фигуры 2 и 17). В частности, для фазы, полученной с 4-гидроксибензойной кислотой, ИК-спектр (Фигура 17) показывает полосу при 2250 см-1, что соответствует колебательной полосе цианогруппы, что предполагает образование сольвата ацетонитрила. Для выяснения стехиометрического соотношения компонентов полученного сольватированного сокристалла проводили анализ 1Н Ядерного Магнитного Резонанса (Фигура 20). Это исследование показывает, что сольватированный сокристалл с 4-гидроксибензойной кислотой имеет стехиометрию 1:2:1 лекарственное средство: сообразователь:растворитель (ацетонитрил). Наконец, на Фигуре 16 показаны результаты анализа дифференциальной сканирующей калориметрии/термогравиметрии (TGA/DSC) NSF, образованной с тадалафилом и 4-гидроксибензойной кислотой.
С другой стороны, с дигидроксибензойными кислотами с использованием ацетонитрила в качестве реакционной среды были получены NSF с 2,3-гидроксибензойной и 2,5-дигидроксибензойной кислотами, но никаких новых фаз не было получено, например, с 3,5-дигидроксибензойной кислотой, 3,4-дигидроксибензойной кислотой и 2,4-дигидроксибензойной кислотой. Опять же, это свидетельствует о том, что формирование сокристаллов непредсказуемо.
Синтез NSF с 2,3-диоксибензойной кислотой протекает по трем вышеупомянутым методикам синтеза. Однако реакции в суспензии и химические механические реакции оказались неэффективным с 5-дигидроксибензойной кислотой, но NSF была действительно получена с этим сообразователем с использованием способа реакции кристаллизации. NSF тадалафила с 2,3-дигидроксибензойной кислотой также получали с использованием ТГФ в качестве реакционной среды.
NSF тадалафила с 2,3-дигидроксибензойной кислотой и 2,5-дигидроксибензойной кислотой анализировали с помощью рентгеновской порошковой дифракции (XRD) и инфракрасного спектра (FT-IR). На Фигуре 3 показана рентгеновская порошковая дифрактограмма сокристалла тадалафила с 2,3-гидроксибензойной кислотой. На Фигуре 4 показан инфракрасный спектр (FT-IR). На Фигуре 5 показана асимметричная единица кристаллической структуры сокристалла тадалафила с 2,3-гидроксибензойной кислотой, полученная рентгеновской дифракцией монокристалла. На Фигурах 6 и 7 показана рентгеновская порошковая дифрактограмма (XRD) и инфракрасный спектр FT-IR сокристалла тадалафила с 2,5-гидроксибензойной кислотой.
3,4,5-тригидроксибензойная кислота также образовывала NSF (Фигура 8) в ацетонитриле. ИК-спектр (Фигура 9) для этой твердой фазы имеет полосу при 2250 см-1, что соответствует колебательной полосе цианогруппы, что предполагает образование сольвата ацетонитрила. 1Н Ядерный Магнитный Резонанс (Фигура 18) показывает, что сольватированный сокристалл с 3,4,5-тригидроксибензойной кислотой имеет стехиометрию 2:1:1 лекарственное средство:сообразватель:растворитель (ацетонитрил).
При кристаллизации из суспензии, измельчении и/или насыщенных растворов сообразователя в ацетонитриле с использованием алифатических гидроксикарбоновых кислот были получены NSF с D-яблочной кислотой и L-винной кислоты, но этого не было в случае с D-винной кислотой, DL-винной кислотой, мезо-винной кислотой, L-яблочной кислотой и DL-яблочной кислотой. Для последней дифрактограмма полученного твердого вещества соответствует тадалафилу, демонстрируя образование энантиомерно селективного молекулярного образования.
Получение NSF тадалафила с D-яблочной кислотой и L-винной кислотой подтверждали рентгеновской порошковой дифракцией (XRD) (Фигуры 10 и 13) и инфракрасным спектром (FT-IR) (Фигуры 11 и 14). На Фигуре 12 показана асимметричная единица кристаллической структуры сокристалла тадалафила с D-яблочной кислотой, полученной рентгеновской дифракцией монокристалла.
ИК-спектр для NSF с винной кислотой (Фигура 14) имеет полосу при 2250 см-1, что соответствует колебательной полосе цианогруппы, что предполагает образование сольвата ацетонитрила. Для выяснения стехиометрического соотношения компонентов сольватированного сокристалла проводили анализ 1Н Ядерного Магнитного Резонанса (Фигура 19). Это исследование показывает, что сольватированый сокристалл с L-винной кислотой имеет стехиометрию 2:1:1 лекарственное средство:коформер:растворитель (ацетонитрил).
Полученные Новые Твердые Фазы (NSP)
В предпочтительном варианте выполнения настоящего изобретения NSF тадалафила были получены в результате постановки экспериментов. Некоторые примеры приведены ниже.
Сочетание тадалафила с химическим соединением типа алифатических гидроксикарбоновых кислот, таких как D-яблочная кислота и L-винная кислота.
Сочетание тадалафила с химическим соединением, принадлежащим к производным ароматических гидроксикарбоновых кислот, таких как 3-гидроксибензойная кислота, 4-гидроксибензойная кислота, 2,3-дигидроксибензойная кислота, 2,5-дигидроксибензойная кислота и 3,4,5-дигидроксибензойная кислота.