Результат интеллектуальной деятельности: СПОСОБ ТРАНСДЕРМАЛЬНОЙ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ
Вид РИД
Изобретение
Изобретение относится к медицине и нацелено на доставку биологически активных веществ (БАВ) через придатки кожи (волосяные фолликулы и воронки, протоки сальной и потовой желез) при помощи субмикронных и/или микроразмерных пористых частиц карбоната кальция. Данные частицы принадлежат к ватеритной форме карбоната кальция и выступают в роли матриц-носителей, предназначенных для инкапсуляции БАВ и применяемых в виде порошка для приготовления суспензий для аппликации на поверхность кожи.
Известен способ трансфолликулярной доставки субмикронных частиц, поглощающих энергию (в частности световую), путем их нанесения на поверхность кожи с последующим воздействием (механическим, ультразвуковым и т.д.) для усиления их внедрения в волосяные фолликулы (заявка № WO2013158278, МПК A61K47/30; A61K47/38; A61K9/14; A61K9/16). Данный метод предполагает использование субмикронных (в том числе наноразмерных) частиц из материала, поглощающего и трансформирующего энергию различной природы (энергию света, звука и т.д.) в тепловую или энергию химических реакций, способного таким образом оказывать терапевтический эффект. В качестве таких материалов, например, предлагаются фотоактивные химические соединения, фотодинамические красители и пролекарства, плазмоннорезонансные структуры «ядро-оболочка» на основе частиц диоксида кремния, покрытого золотой оболочкой, которые также могут быть дополнены покрытием из полиэтиленгликоля или сурфактанта. Терапевтический эффект достигается при активации таких частиц после внедрения в волосяные фолликулы или сальную железу. Изобретение нацелено на лечение заболеваний соответствующей локализации (акне, гиперплазии сальной железы, расширенные поры и избыток кожного сала и т.д.), а также на удаление волос.
Недостатком указанного способа является отсутствие раскрытия специфики трансфолликулярного внедрения в зависимости от типа внедряемых частиц: режимы внедряющих воздействий (механического втирания, акустических вибраций, ультразвука, давления) приведены в общем случае и не учитывают трудности проникновения, связанные с геометрическими и физическими особенностями частиц, а также ограничения, обусловленные чувствительностью применяемых частиц к внедряющему воздействию (например, разрушение или трансформацию под действием указанных доз энергетического воздействия). Оптимизация технических параметров внедрения и подбор химической композиции частиц являются отдельными задачами, требующими рассмотрения.
Кроме того, указанный способ фокусируется на применение частиц, выполняющих активную роль в последующем лечении (активизируемых внешним воздействием после доставки с целью обеспечения терапевтического воздействия) и не рассматривает возможность использования матриц-носителей (контейнеров для лекарственного вещества), применение которых способно расширить спектр доставляемых в фолликулы лекарственных соединений, а также добиться синергетических эффектов путем инкапсуляции нескольких различных веществ. Такие матрицы-носители могут быть выполнены из биоразлагаемого или рН-чувствительного материала и выполнять роль депо-систем, обеспечивающих управляемое высвобождение инкапсулированных препаратов в объеме волосяных фолликулов, сальной и потовой желез после внедрения.
Также известен способ электрофоретической доставки БАВ в волосяные фолликулы после их инкапсуляции в липосомы (заявка № WO2008053983, МПК A61K47/18; A61K47/24; A61K47/28; A61K9/127; A61N1/30). Согласно данному способу, в качестве контейнера-носителя терапевтического препарата используются липосомы размером 400-1000 нм с различным составом липидной мембраны, внедрение данной композиции в волосяные фолликулы обеспечивают посредством электрофореза при значениях прикладываемого тока от 0.1 до 0.6 мA/cм2.
Недостатком данного способа является длительность процедуры внедрения при электрофоретическом воздействии. Как показано в примерах, эффективное заполнение фолликулов контейнерами достигается в течение 1 часа. Однако даже при такой длительности воздействия не обеспечивается in vivo доставка частиц на всю глубину фолликула (более глубокое заполнение демонстрируется при внедрении контейнеров in vitro). Кроме того, данный способ не рассматривает пути высвобождения инкапсулированного препарата в объеме волосяных фолликулов, сальной и потовой желез после внедрения.
Наиболее близким к заявленному техническому решению является способ трансфолликулярной доставки к дендритным клеткам кожи особой лекарственной формы-иммуномодулятора при ее инкапсуляции с помощью микро- и/или наночастиц (заявка № WO2012146364, МПК A61K39/39; A61K49/14). Изобретение основано на применении контейнеров с иммобилизованным препаратом путем их нанесения на поверхность кожи с последующей транспортировкой в волосяные фолликулы, в физиологических условиях которых происходит постепенное высвобождение препарата из носителя и его доставка к клеткам-мишеням. Предлагаемая для иммобилизации лекарственная форма содержит антигенные детерминанты цитотоксических T-лимфоцитов (Т-киллеров) и Т-хэлперов и синтетические аналоги бактериальных липопептидов, и, таким образом, индуцирует специфический Т-клеточный иммунный ответ при взаимодействии с дендритными клетками, обеспечивая терапевтический эффект.
К недостаткам указанного способа можно отнести отсутствие конкретного инженерного решения для контейнера-носителя, метода его активного внедрения в волосяные фолликулы, а также способа управления высвобождением инкапсулированной лекарственной формы. Данный метод принят за прототип.
Задачей заявляемого изобретения является разработка неинвазивного способа доставки биологически активных веществ in vivo через придатки кожи: волосяные фолликулы и воронки, протоки сальной и потовой желез.
Технический результат изобретения заключается в увеличении эффективности заполнения волосяных фолликулов (увеличение числа внедренных частиц и глубины заполнения) частицами, содержащими БАВ, при ускорении процедуры внедрения и обеспечении возможности управления длительностью высвобождения БАВ из них.
Указанный технический результат достигается тем, что способ трансдермальной доставки биологически активных веществ включает аппликацию контейнеров с иммобилизованным биологически активным веществом на поверхность кожи с последующей транспортировкой через придатки кожи, согласно решению в качестве контейнеров используют пористые частицы карбоната кальция размером менее 1.5 мкм, а транспортировку осуществляют путем воздействия ультразвуком интенсивностью 0,1-1 Вт/см2 длительностью 1-4 мин. В наилучшем варианте выполнения заявляемого способа для аппликации используют спиртовую суспензию частиц размером 0.7±0.1 мкм концентрацией 0.25 мг/мл, а воздействие ультразвуком осуществляют с частотой 1 МГц интенсивностью 0.4-0.5 Вт/см2 в течение 2 минут. Согласно заявляемому способу для ускорения высвобождения биологически активного вещества из частиц карбоната кальция возможно осуществление дополнительного пост-воздействия на область аппликации при помощи ультразвука частотой 1 МГц и интенсивностью 1 Вт/см2 по крайней мере однократно в течение до 10 минут.
Изобретение поясняется таблицами и чертежами, описание которых приведено ниже.
Таблица 1 содержит данные о режимах внедрения контейнеров в волосяные фолликулы спинной зоны лабораторной крысы in vivo, обобщая данные приведенные в примерах 1-12.
Таблица 1. Режимы внедрения контейнеров в волосяные фолликулы спинной зоны лабораторной крысы in vivo (примеры 1-12)
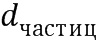 - размер частиц (диаметр), представленный как «средний диаметр ± стандартное отклонение среднего»;
- размер частиц (диаметр), представленный как «средний диаметр ± стандартное отклонение среднего»;
 - длительность внедряющего ультразвукового воздействия;
- длительность внедряющего ультразвукового воздействия;
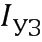 - интенсивность ультразвука;
- интенсивность ультразвука;
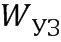 - ультразвуковая энергия, приходящаяся на 1 см2 (энергия потока ультразвука, проходящего через площадь в 1 см2), рассчитанная по формуле
- ультразвуковая энергия, приходящаяся на 1 см2 (энергия потока ультразвука, проходящего через площадь в 1 см2), рассчитанная по формуле 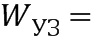
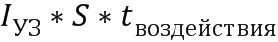 , где S=1 см2.
, где S=1 см2.
Обозначения в графе «Результат»:
«+ +» - оптимальные режимы внедрения, обеспечивающие обильное заполнение на глубину фолликула частицами без разрушения последних в процессе внедрения;
«+» - режимы внедрения, обеспечивающие заполнение на глубину фолликула частицами, однако менее обильное, чем при оптимуме.
«+/-» - режимы, при которых достигается внедрение частиц в фолликулы, но которые, однако, не являются оптимальными;
«-» - режимы, при которых не достигается внедрение частиц в волосяные фолликулы, или режимы, при которых можно фолликулы заполняются частицами, но их применение недопустимо.
В Таблице 2 сведены результаты мониторинга состояния внедренных частиц внутри волосяных фолликулов в течение времени и влияния ультразвукового пост-воздействия на него.
Таблица 2. Состояние внедренных частиц внутри волосяных фолликулов в течение времени и влияние ультразвукового пост-воздействия на него
|
Обозначения в графе «Результат»:
«+» - обильное заполнение фолликула частицами, большое содержание;
«+/-» - менее 50% внедренных частиц остается в луковице;
«-» - полная резорбция частиц в волосяной луковице
Фиг. 1. СЭМ-изображения частиц ватерита размером 0.7±0.1 мкм, снятые при различном увеличении
Фиг. 2. СЭМ-изображения частиц ватерита размером 1.0±0.1 мкм, снятые при различном увеличении
Фиг. 3. СЭМ-изображение частиц ватерита размером 4-5 мкм
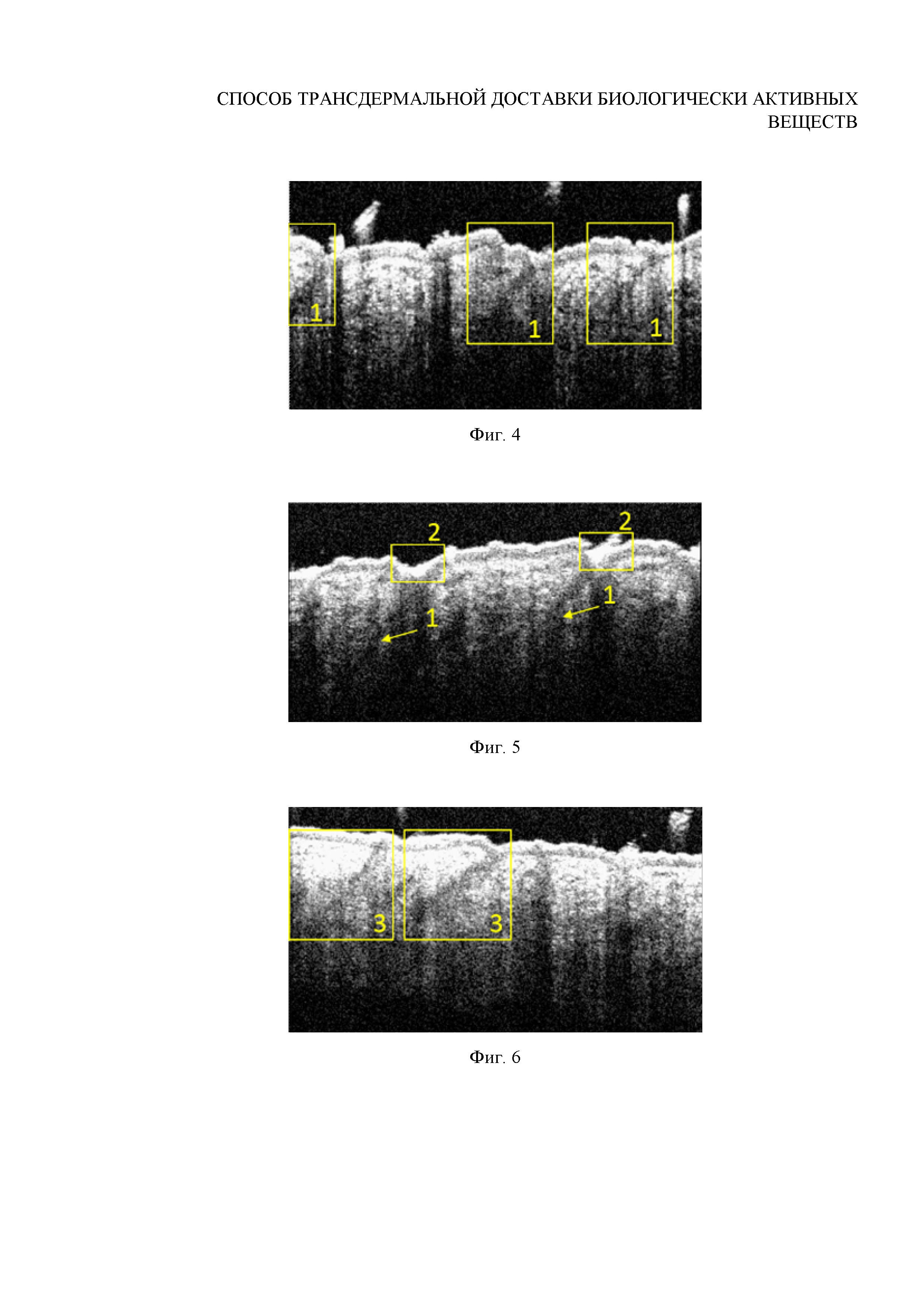
Фиг. 4. ОКТ-изображение волосяных фолликулов лабораторной крысы из спинной зоны in vivo до внедрения частиц
Фиг. 5. ОКТ-изображение волосяных фолликулов после втирания субмикронных частиц ватерита in vivo (массаж области нанесения при отсутствии УЗ-воздействия)
Фиг. 6. ОКТ-изображение волосяных фолликулов после внедрения субмикронных частиц ватерита in vivo при помощи ультразвука интенсивности 0.1 Вт/см2 в течение 2 минут (доза ультразвуковой энергии 12 Дж)
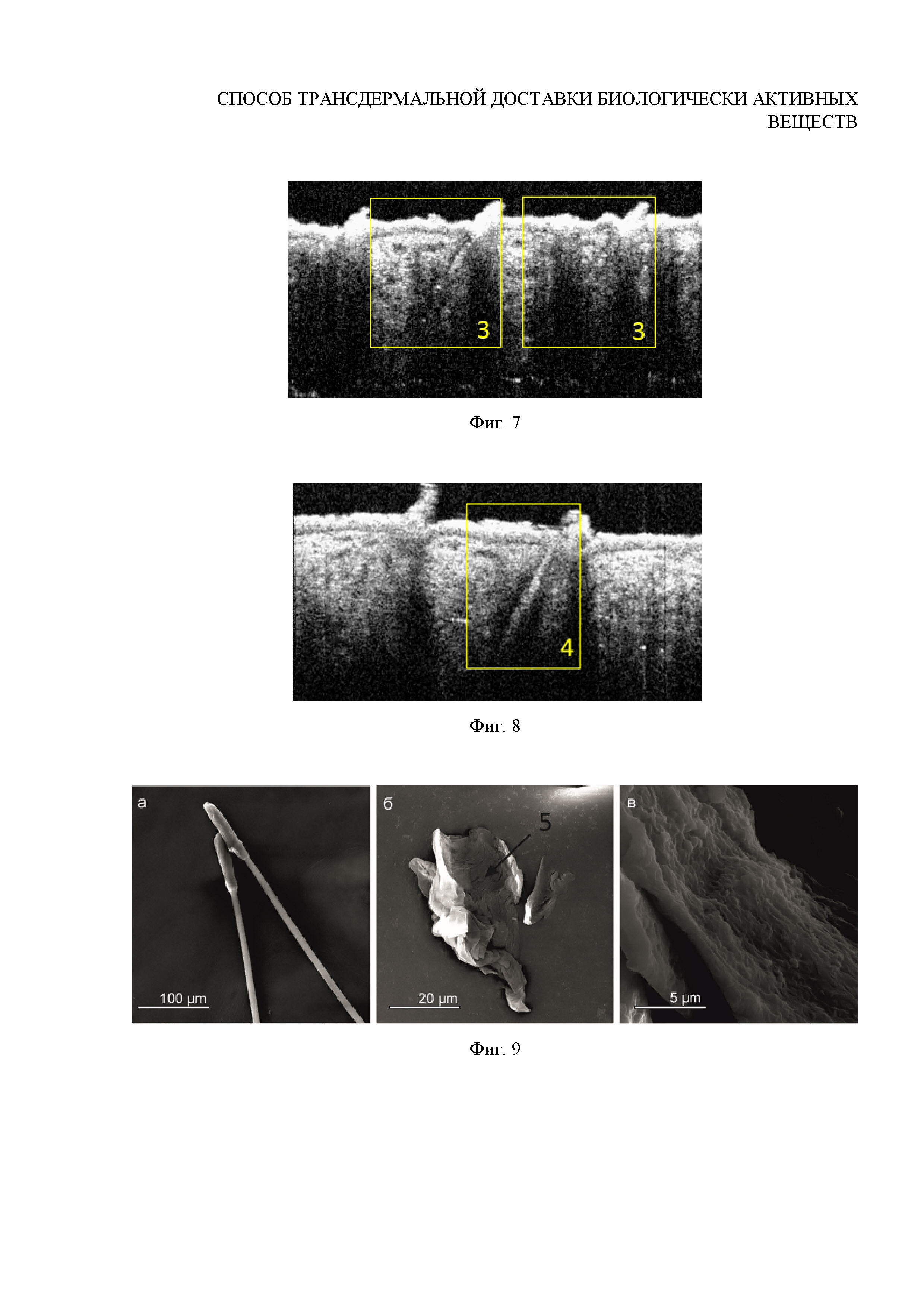
Фиг. 7. ОКТ-изображение волосяных фолликулов после внедрения субмикронных частиц ватерита in vivo при помощи ультразвука интенсивности 0.4 Вт/см2 в течение 2 минут (доза воздействия 48 Дж)
Фиг. 8. ОКТ-изображение волосяных фолликулов после внедрения субмикронных частиц ватерита in vivo при помощи ультразвука интенсивности 0.5 Вт/см2 в течение 2 минут (доза воздействия 60 Дж)
Фиг. 9. СЭМ-изображения луковицы волоса, выдернутого из контрольной зоны без внедрения частиц ватерита: а - неразрушенные луковицы; б, в - разрушенные пинцетом луковицы
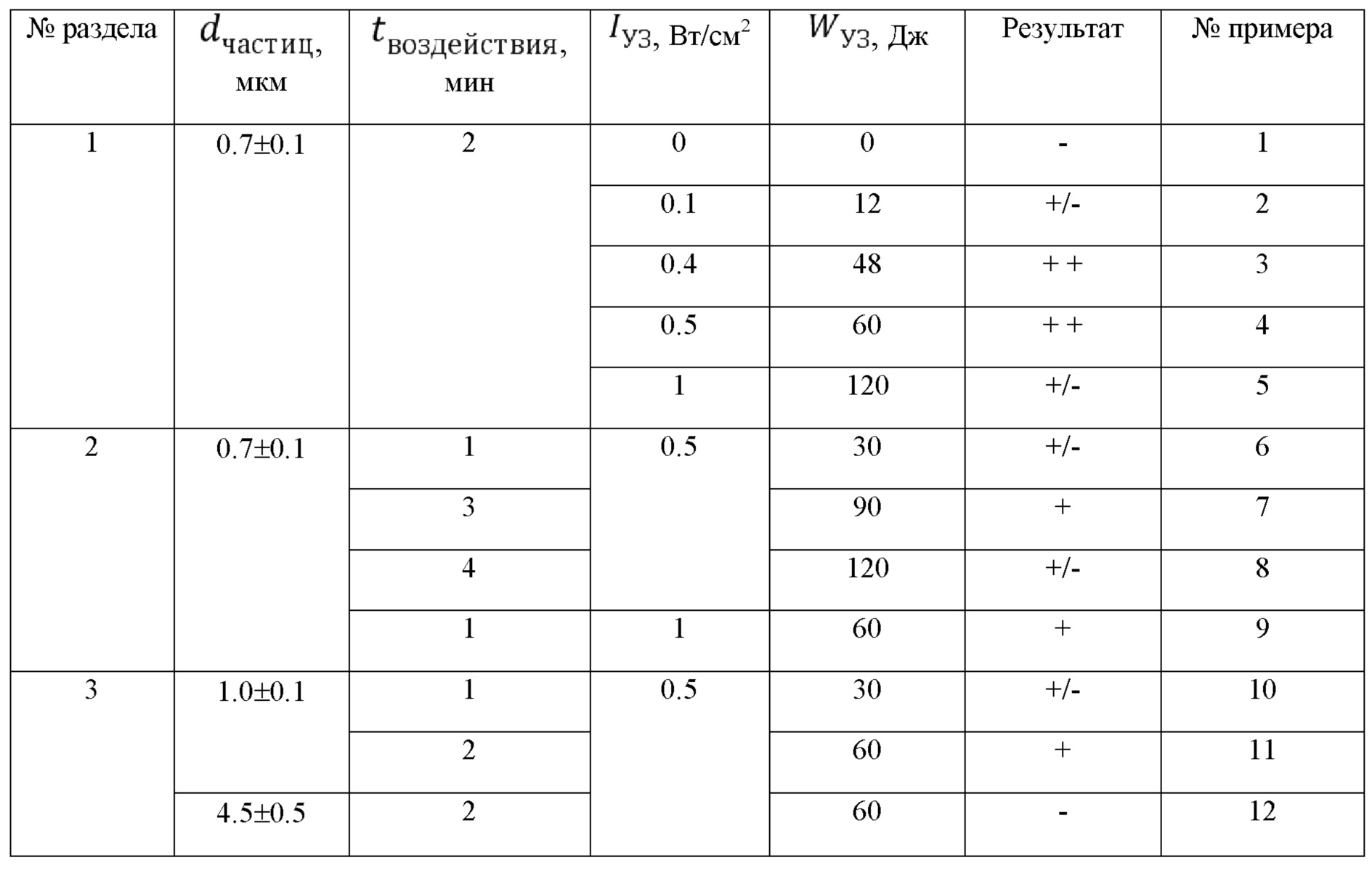
Фиг. 10. СЭМ-изображения луковицы волоса, выдернутого после УЗ-внедрения субмикронных частиц ватерита (размером 0.7±0.1 мкм): а - неразрушенные луковицы; б, в - разрушенные пинцетом луковицы: обильное заполнение частицами ватерита, частицы сохраняют форму.
Фиг. 11. ОКТ-изображение волосяных фолликулов после внедрения субмикронных частиц ватерита in vivo при помощи ультразвука интенсивности 1 Вт/см2 в течение 2 минут (доза воздействия 120 Дж)
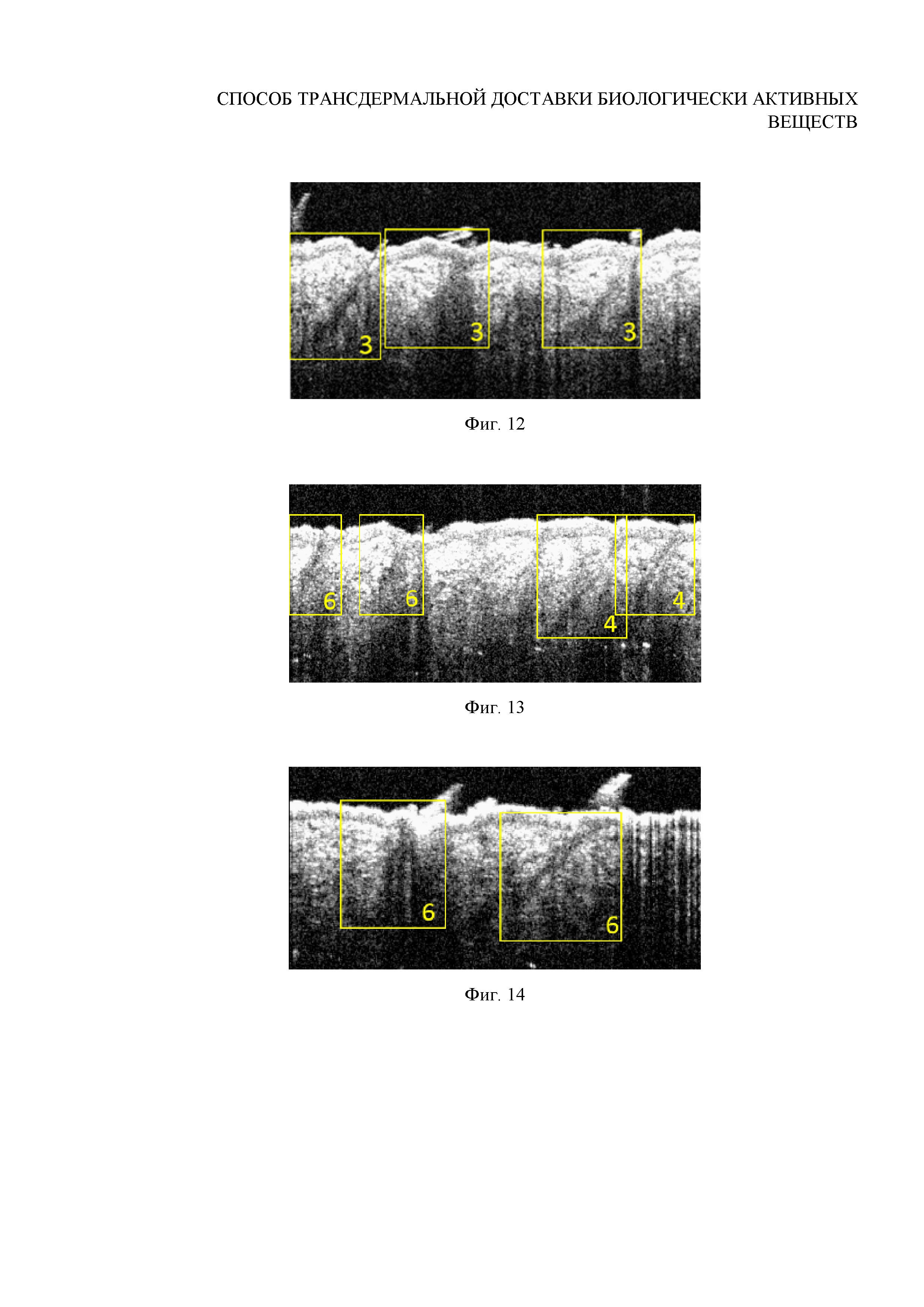
Фиг. 12. ОКТ-изображение волосяных фолликулов после внедрения субмикронных частиц ватерита in vivo при помощи ультразвука интенсивности 0.5 Вт/см2 в течение 1 минуты (доза воздействия 30 Дж)
Фиг. 13. ОКТ-изображение волосяных фолликулов после внедрения субмикронных частиц ватерита in vivo при помощи ультразвука интенсивности 0.5 Вт/см2 в течение 3 минут (доза воздействия 90 Дж)
Фиг. 14. ОКТ-изображение волосяных фолликулов после внедрения субмикронных частиц ватерита in vivo при помощи ультразвука интенсивности 0.5 Вт/см2 в течение 4 минут (доза воздействия 120 Дж)
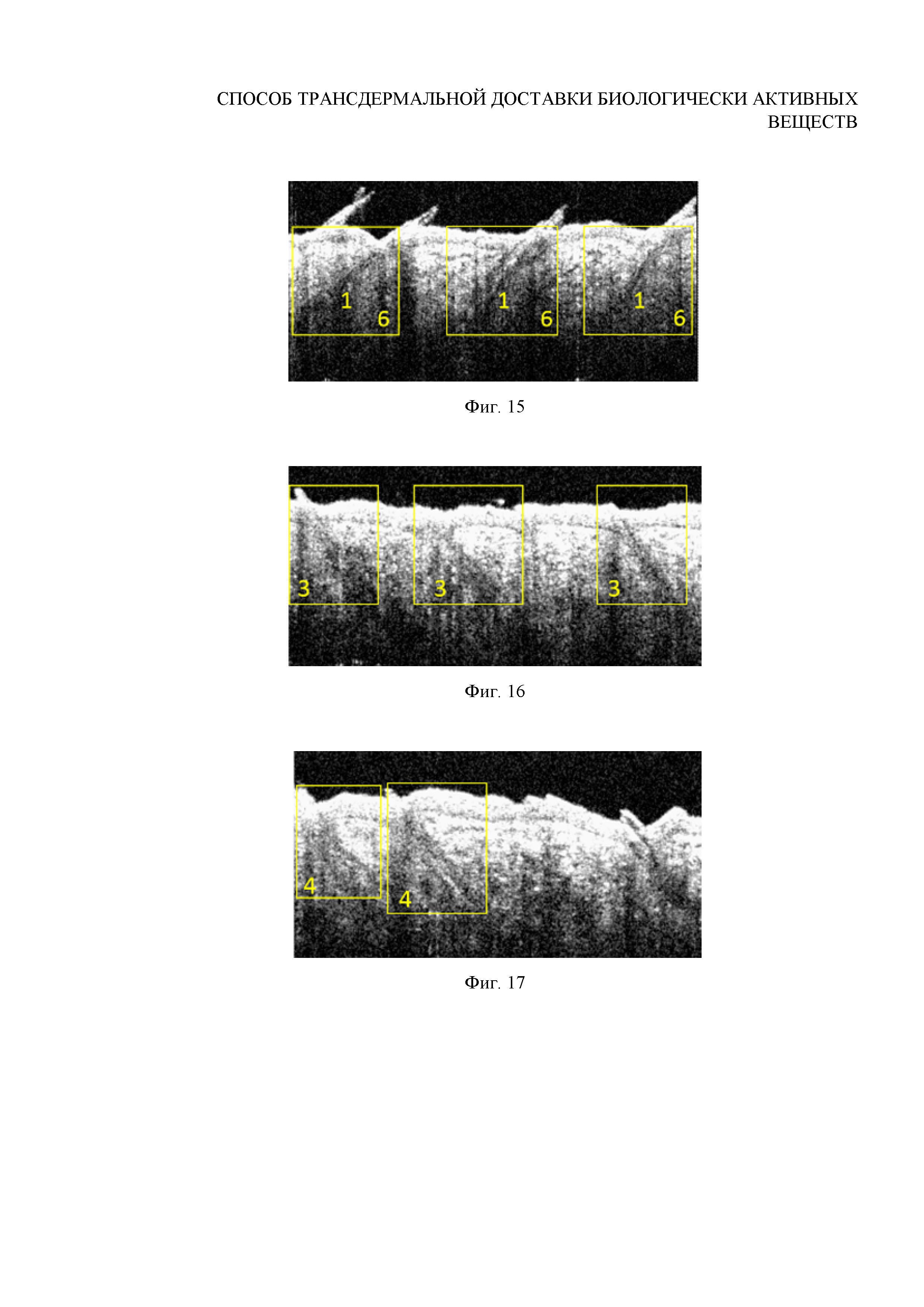
Фиг. 15. ОКТ-изображение волосяных фолликулов после внедрения субмикронных частиц ватерита in vivo при помощи ультразвука интенсивности 1 Вт/см2 в течение 1 минуты (доза воздействия 60 Дж)
Фиг. 16. ОКТ-изображение волосяных фолликулов после внедрения микроразмерных частиц ватерита (1.0±0.1 мкм) in vivo при помощи ультразвука интенсивности 0.5 Вт/см2 в течение 1 минуты
Фиг. 17. ОКТ-изображение волосяных фолликулов после внедрения микроразмерных частиц ватерита (1.0±0.1 мкм) in vivo при помощи ультразвука интенсивности 0.5 Вт/см2 в течение 2 минут
Фиг. 18. СЭМ-изображения разрушенных пинцетом луковиц волос, выдернутых после УЗ-внедрения микроразмерных частиц ватерита (1.0±0.1 мкм): обильное заполнение частицами
Фиг. 19. ОКТ-изображение волосяных фолликулов после внедрения микрочастиц ватерита (4.5±0.5 мкм) in vivo при помощи ультразвука интенсивности 0.5 Вт/см2 в течение 2 минут
Фиг. 20. СЭМ-изображения разрушенных пинцетом луковиц волос, выдернутых после УЗ-внедрения микрочастиц ватерита (4.5±0.5 мкм): обильное заполнение частицами
Фиг. 21. СЭМ-изображения разрушенной пинцетом луковицы волоса, выдернутого на 3-й день после УЗ-внедрения субмикронных частиц ватерита: а - общий план: формирование агрегатов, начало процесса перекристаллизации, б - внутренняя стенка луковицы: утопление частиц в стенку луковицы.
Фиг. 22. СЭМ-изображения разрушенной пинцетом луковицы волоса, выдернутого на 5-й день после УЗ-внедрения субмикронных частиц ватерита: а - внутренняя стенка луковицы: процесс перекристаллизации внедренных частиц, б - стенка луковицы: глубокое утопление частиц в стенку.
Фиг. 23. СЭМ-изображения разрушенной пинцетом луковицы волоса, выдернутого на 8-й день после УЗ-внедрения субмикронных частиц ватерита: заращивание агрегатов частиц в стенку волосяной луковицы в результате активных процессов деления ее тканей
Фиг. 24. СЭМ-изображения разрушенной пинцетом луковицы волоса, выдернутого на 10-й день после УЗ-внедрения субмикронных частиц ватерита: а, б - внутренняя стенка луковицы: заращивание частиц в стенку волосяной луковицы и растворение частиц
Фиг. 25. СЭМ-изображение разрушенной пинцетом луковицы волоса, выдернутого на 12-й день после УЗ-внедрения субмикронных частиц ватерита: резорбция внедренных субмикронных частиц в волосяной луковице.
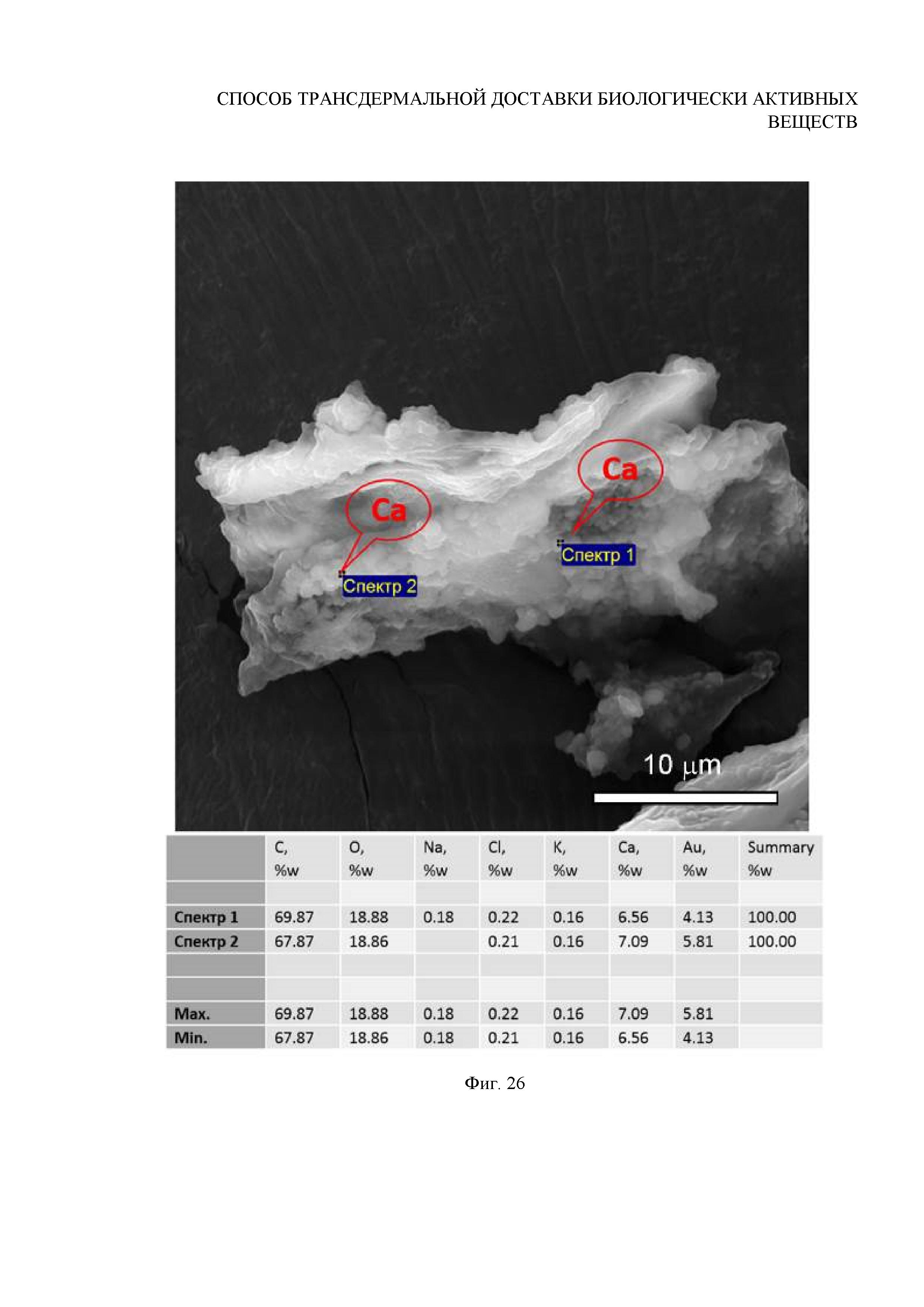
Фиг. 26. Данные EDX-исследования химического состава внутреннего содержимого волосяных луковиц, выдернутых сразу после УЗ-внедрения частиц в фолликулы
Фиг. 27. Данные EDX-исследования химического состава внутреннего содержимого волосяных луковиц, выдернутых на 3-й день после УЗ-внедрения субмикронных частиц в фолликулы
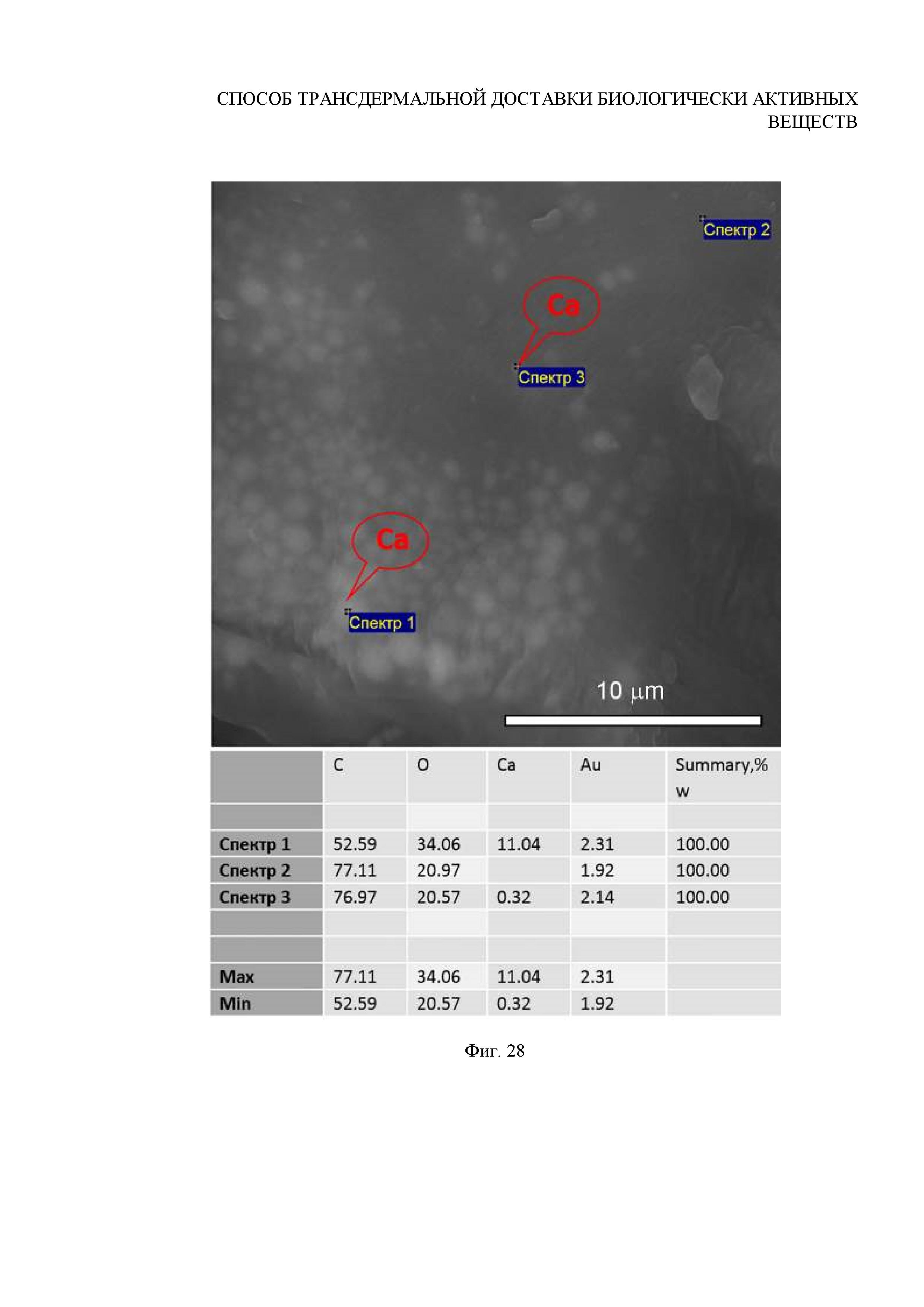
Фиг. 28. Данные EDX-исследования химического состава внутреннего содержимого волосяных луковиц, выдернутых на 8-й день после УЗ-внедрения субмикронных частиц в фолликулы
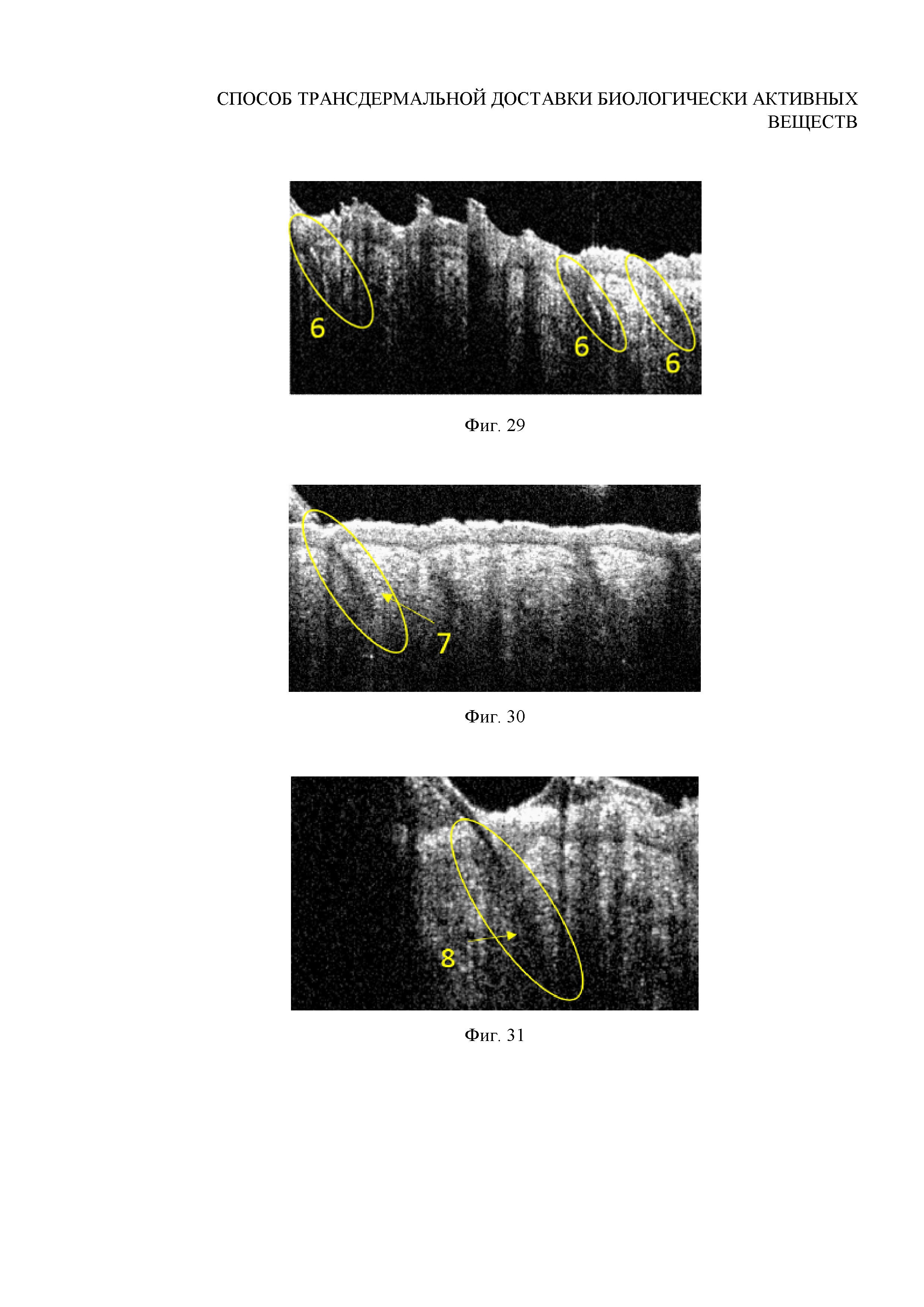
Фиг. 29. ОКТ-изображение волосяных фолликулов после УЗ-внедрения субмикронных частиц ватерита in vivo, дополненного УЗ пост-воздействием в течение 4 минут
Фиг. 30. ОКТ-изображение волосяных фолликулов после УЗ-внедрения субмикронных частиц ватерита in vivo, дополненного УЗ пост-воздействием в течение 5 минут
Фиг. 31. ОКТ-изображение волосяных фолликулов после УЗ-внедрения субмикронных частиц ватерита in vivo, дополненного УЗ пост-воздействием в течение 9 минут
Фиг. 32. СЭМ-изображение разрушенных пинцетом луковиц волос, выдернутых после УЗ-внедрения субмикронных частиц ватерита и УЗ пост-воздействия в течение 4 минут
Фиг. 33. СЭМ-изображение разрушенных пинцетом луковиц волос, выдернутых после УЗ-внедрения субмикронных частиц ватерита и УЗ пост-воздействия в течение 5 минут
Фиг. 34. СЭМ-изображение разрушенных пинцетом луковиц волос, выдернутых после УЗ-внедрения субмикронных частиц ватерита и УЗ пост-воздействия в течение 9 минут
Фиг. 35. СЭМ-изображения разрушенных пинцетом луковиц волос, выдернутых через 3 дня после УЗ-внедрения субмикронных частиц ватерита и УЗ пост-воздействия в течение 4 минут: а - заращиванием частиц в стенку волосяной луковицы в результате активных процессов деления его тканей, б - процесс растворения и перекристаллизации внедренных частиц
Фиг. 36. СЭМ-изображение разрушенных пинцетом луковиц волос, выдернутых через 8 дней после УЗ-внедрения субмикронных частиц ватерита и УЗ пост-воздействия в течение 4 минут
Фиг. 37. СЭМ-изображение разрушенных пинцетом луковиц волос, выдернутых через 10 дней после УЗ-внедрения субмикронных частиц ватерита и УЗ пост-воздействия в течение 4 минут
Фиг. 38. СЭМ-изображения разрушенных пинцетом луковиц волос, выдернутых через 3 дня после УЗ-внедрения субмикронных частиц ватерита и УЗ пост-воздействия в течение 9 минут: а - заращиванием частиц в стенку волосяной луковицы в результате активных процессов деления его тканей, б - процесс растворения и перекристаллизации внедренных частиц
Фиг. 39. СЭМ-изображения разрушенных пинцетом луковиц волос, выдернутых через 5 дней после УЗ-внедрения субмикронных частиц ватерита и УЗ пост-воздействия в течение 9 минут
Фиг. 40. СЭМ-изображения разрушенных пинцетом луковиц волос, выдернутых через 8 дней после УЗ-внедрения субмикронных частиц ватерита и УЗ пост-воздействия в течение 9 минут
Фиг. 41. ОКТ-изображение in vivo волосяных фолликулов внешней стороны предплечья добровольца до внедрения частиц
Фиг. 42. СЭМ-изображение субмикронных частиц ватерита, нагруженных препаратом «Аммифурин»
Фиг. 43. Флуоресцентное изображение субмикронных частиц ватерита, нагруженных препаратом «Аммифурин»
Фиг. 44. ОКТ-изображение волосяных фолликулов из зоны внешней стороны предплечья добровольца in vivo после УЗ-внедрения субмикронных частиц ватерита, нагруженных препаратом «Аммифурин»
Фиг. 45. СЭМ-изображения разрушенных пинцетом луковиц волос, выдернутых после УЗ-внедрения субмикронных частиц ватерита, нагруженных препаратом «Аммифурин»: обильное заполнение частицами
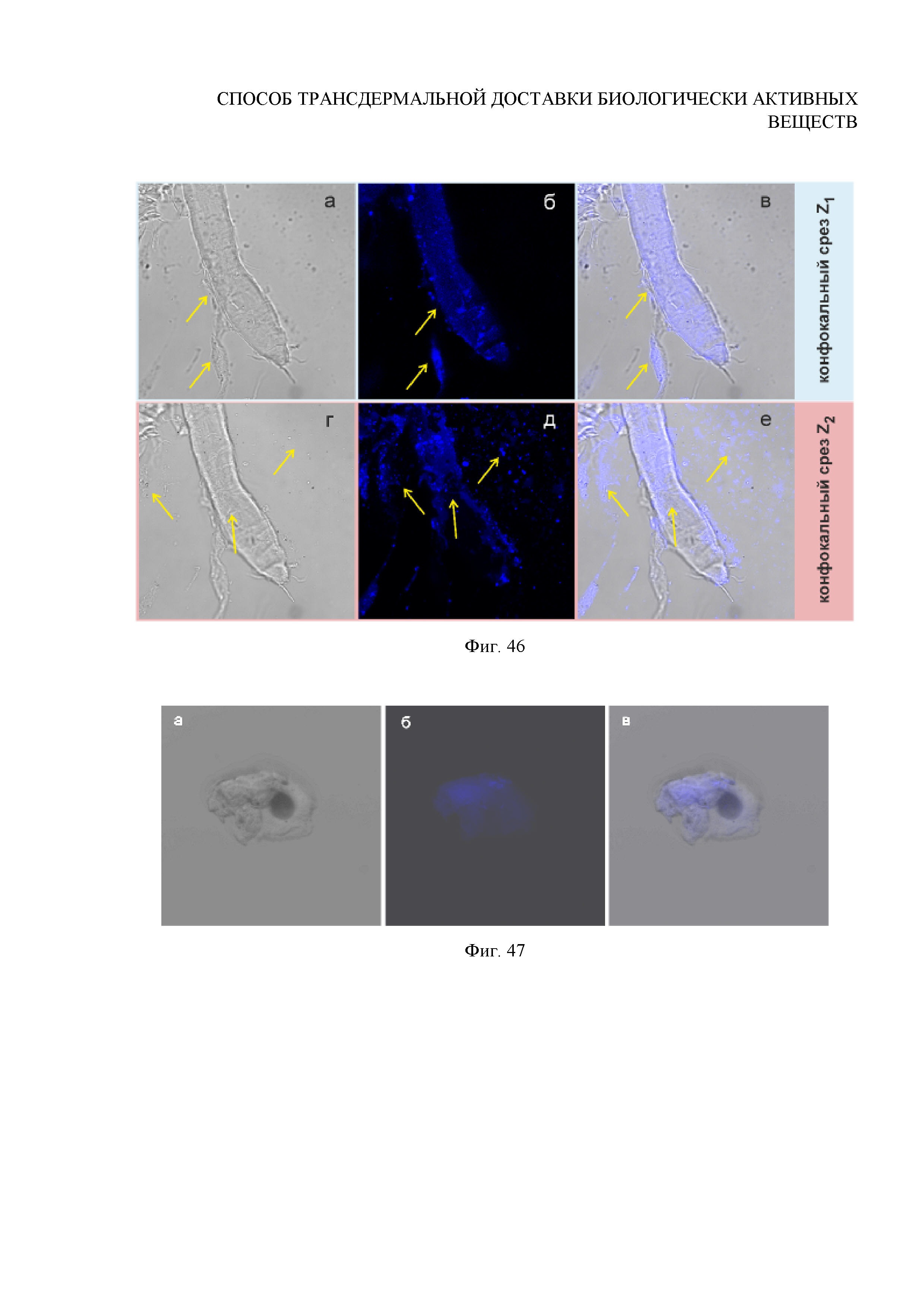
Фиг. 46. Флуоресцентные изображения разрушенной пинцетом луковицы волоса, выдернутого после УЗ-внедрения субмикронных частиц ватерита, нагруженных препаратом «Аммифурин», снятые при разных положениях фокальной плоскости методом сканирующей лазерной конфокальной микроскопии (срезы Z1 и Z2): а, г - светлопольные изображения; б, д - флуоресцентные изображения; в, е - наложение светлопольного и флуоресцентного каналов. Стрелки указывают на россыпь контейнеров.
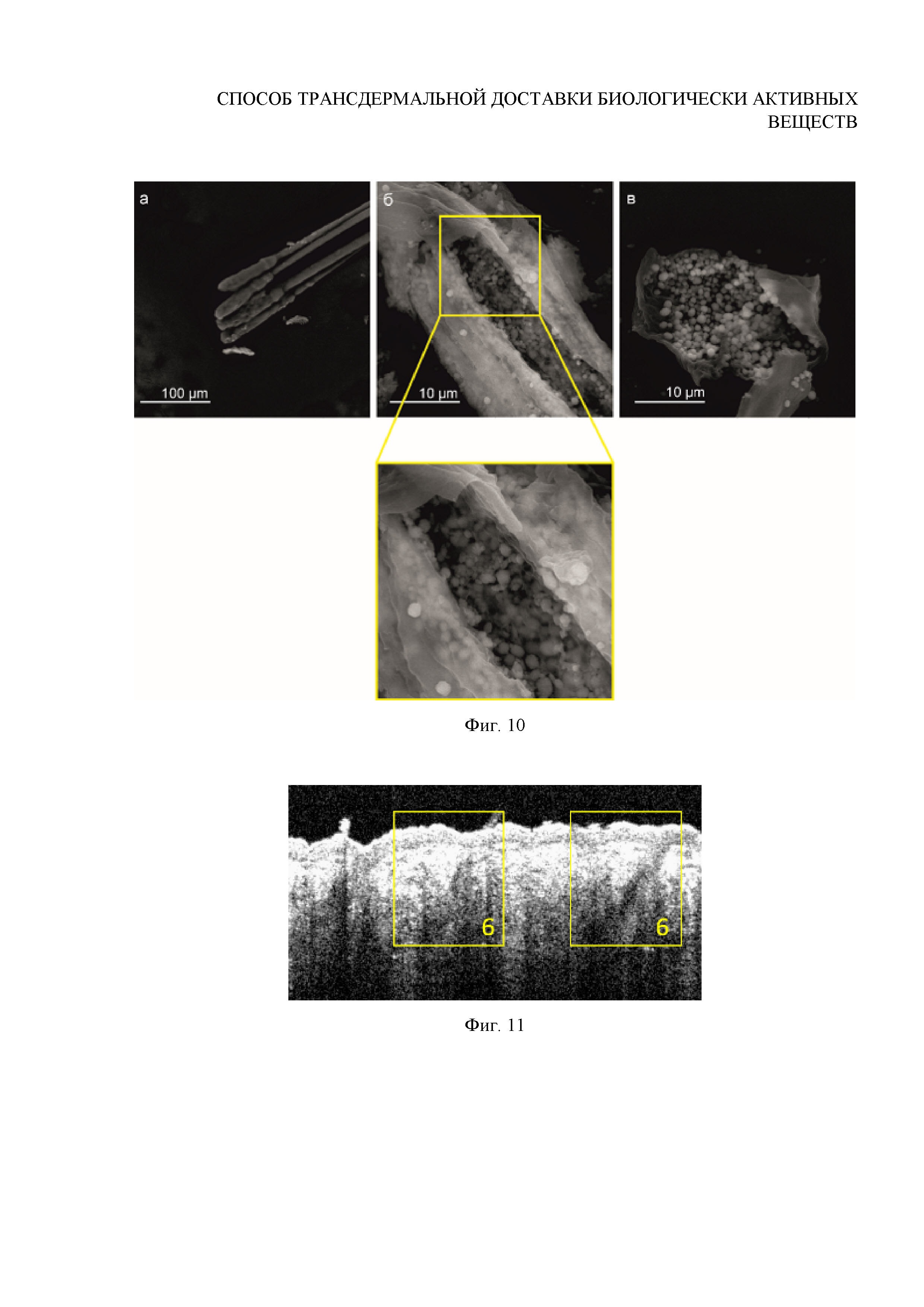
Фиг. 47. Флуоресцентное изображение порушенной пинцетом луковицы контрольного волоса без внедрения частиц
Позициями на фигурах обозначены:
1 - незаполненные волосяные фолликулы;
2 - частицы в волосяных воронках;
3 - заполнение волосяных фолликулов частицами карбоната кальция;
4 - глубокое и обильное заполнение волосяных фолликулов частицами;
5 - внутренняя стенка волосяной луковицы;
6 - прореживание частиц в волосяных фолликулах;
7 - вбивание частиц в стенку волосяного фолликула (белая полоска по контуру фолликула);
8 - карбонизация стенки мешочка.
Раскрытие изобретения
Предложенный способ доставки БАВ включает в себя применение матриц-носителей из биодеградируемого материала - карбоната кальция в виде пористых частиц (в кристаллографической модификации ватерита) размером менее 1.5 мкм, высокопористая архитектура которых обеспечивает возможность иммобилизации до 20% w/w активного вещества - в виде аппликации на поверхность кожи с последующим воздействием при помощи терапевтического низкоинтенсивного (не более 1 Вт/см2) ультразвука как фактора, усиливающего эффективность внедрения в волосяные фолликулы и воронки, протоки сальной и потовой желез и/или ускоряющего разложение внедренного контейнера (в зависимости от режима УЗ-воздействия). Наиболее эффективное внедрение в волосяные фолликулы достигается при нанесении спиртовой суспензии субмикронных частиц ватерита размером 0.7±0.1 мкм концентрацией 0.25 мг/мл с последующим воздействием ультразвуком частотой 1 МГц интенсивностью 0.4-0.5 Вт/см2 в течение 2 минут. Постепенная деградация контейнеров в течение 12 дней, вплоть до их полной резорбции, внутри волосяных мешочков обеспечивает пролонгированное высвобождение иммобилизованного в них лекарственного препарата, осуществляя таким образом адресную доставку БАВ в глубь фолликула и прилегающие области. Дополнение процедуры внедрения контейнеров ультразвуковым пост-воздействием частотой 1 МГц интенсивностью 1 Вт/см2 позволяет ускорить процесс деградации носителя и высвобождения иммобилизованного БАВ, при этом управление высвобождением осуществляется путем варьирования длительности пост-воздействия.
Субмикронные и микрочастицы карбоната кальция (CaCO3) являются перспективными контейнерами для иммобилизации биологически активных веществ (БАВ). В природе карбонат кальция может находиться в виде одной из трех полиморфных модификаций: ватерита, арагонита или кальцита [De Leeuw N.H. et al. J. Phys. Chem. B. 102, 16 (1998) 2914-2922]. Частицы ватерита обладают пористой структурой с диаметром пор от 20 до 60 нм и рядом таких достоинств, как биосовместимость, мягкие условия разрушения (растворение при рН≤5.5), простота приготовления и низкая себестоимость [Volodkin D.V. et al. Angew. Chem. Int. Ed. Engl. 49 (2010) 9258-61]. Изменение параметров (температуры, скорости перемешивания реакционной смеси, концентрации исходных реагентов и др.) при синтезе таких частиц позволяет варьировать форму и размер получаемых микрообъектов [Svenskaya Y.I. et al. Adv. Powder Technol. 2,27 (2016) 618-624; Parakhonskiy B. et al. J. Nanobiotech. 13,1 (2015) 1-13]. Пористость частиц ватерита определяет эффективность включения лекарственных форм в их объем, а также обуславливает развитость поверхности, увеличивая ее адсорбционную емкость [Donatan S. et al. ACS App. Mat. Int. 8, 22 (2016) 14284-14292]. Путем изменения значения рН среды можно добиться растворения частиц карбоната кальция, что обеспечит высвобождение иммобилизованного в них препарата [Svenskaya Yu.I. et al. Biophys. Chem. 182 (2013) 11-15].
Субмикронные и микроразмерные частицы карбоната кальция были получены методом кристаллизации из раствора при непосредственном сливании солей хлорида кальция (CaCl2) и карбоната натрия (Na2CO3).
Для синтеза микрочастиц ватерита размером 4.5±0.5 мкм применялась методика МС1 [Volodkin D.V. et al. Angew. Chem. Int. Ed. Engl. 49 (2010) 9258-61], согласно которой 0.33 М водные растворы дигидрата хлорида кальция и карбоната натрия равных объемов одновременно приливались в пустой сосуд, смесь интенсивно перемешивалась на магнитной мешалке со скоростью 500 оборотов в минуту в течение 30 секунд. Далее суспензия образовавшихся частиц выдерживалась в покое при комнатной температуре в течение 1 минуты до полной кристаллизации карбоната кальция. Осадок CaCO3 дважды промывался деионизованной водой и один раз 95% раствором этилового спирта, после чего высушивался при температуре 60°С в течение 30 минут.
Микроразмерные частицы ватерита (1.0±0.1 мкм) были получены по методике МС2 [Svenskaya Y.I. et al. Adv. Powder Technol. 2,27 (2016) 618-624], отличие которой от методики МС1 заключалось в том, что перемешивание реакционной смеси осуществлялось с помощью ультразвука частотой 20 кГц при мощности излучения 70 Вт (УЗ-гомогенизатор «Sonopuls», Bandelin, Германия).
Синтез субмикронных контейнеров (0.7±0.1 мкм) осуществлялся по методике МС3 [Parakhonskiy B.V. et al. Angew. Chem. Int. Ed. Engl. 51 (2012) 1195-1197], согласно которой 1-М растворы дигидрата хлорида кальция и карбоната натрия одинаковых объемов смешивались с этиленгликолем, а затем между собой, содержание ЭГ в смеси составляло 83% от ее общего объема. Перемешивание реакционной смеси осуществлялось с помощью магнитной мешалки со скоростью 500 оборотов в минуту в течение 3 часов при комнатной температуре. Осадок (частицы карбоната кальция) трижды промывался 95% этиловым спиртом и высушивался при температуре 60°С в течение 30 минут.
Иммобилизации БАВ в частицы карбоната кальция осуществлялась методом его адсорбции из раствора. Для этого навеска сухих частиц ватерита диспергировалась в растворе иммобилизуемого БАВ и выдерживались в нем в течение 1 часа при непрерывном встряхивании с помощью шейкера, затем осадок CaCO3 промывался этиловым спиртом и высушивался.
Другим методом иммобилизации БАВ в объем пористой ватеритной матрицы является его совместное осаждение с частицами CaCO3 в процессе их формирования. Для этого 1-M водные растворы дигидрата хлорида кальция и карбоната натрия равных объемов одновременно приливаются к раствору БАВ в соотношении 1:4 (1 часть CaCl2, 1 часть Na2CO3 и 4 части раствора БАВ). Далее смесь обрабатывается согласно одной из приведенных методик синтеза частиц (МС1-МС3).
При приготовлении суспензии для внедрения в волосяные фолликулы, навеска полученных контейнеров диспергировалась в медицинском антисептическом растворе до концентрации диапазона 0.1-1.0 мг/мл непосредственно перед аппликацией. Трансфолликулярная доставка контейнеров осуществлялась путем нанесения суспензии частиц на исследуемую поверхность кожи и последующего их внедрения в придатки кожи при помощи терапевтического ультразвука интенсивностью не более 1 Вт/см2 в течение 1-4 минут. Высвобождение иммобилизованного в контейнеры БАВ в глубь фолликула и прилегающие области осуществлялось в процессе деградации внедренных частиц. Применение ультразвука частотой 1 МГц интенсивностью 1 Вт/см2 как фактора, ускоряющего разложение внедренного в фолликулы контейнера, позволяло сократить процесс высвобождения иммобилизованного БАВ и обеспечивало управление этим процессом путем варьирования длительности пост-воздействия.
Примеры реализации способа
Влияние интенсивности ультразвука на заполнение волосяных фолликулов частицами при фиксированной длительности воздействия.
Пример 1.
Нанесение суспензии частиц карбоната кальция со средним диаметром 700 нм на поверхность кожи in vivo с последующим массированием области нанесения (в отсутствие УЗ-воздействия).
Исследование проводится in vivo на поверхности спины самца лабораторной крысы-альбиноса возрастом 1 год, весом 250 г. Перед проведением исследования крыса подвергается анестезии, и волосы в зоне спины выстригаются ножницами максимально коротко (до 1 мм длины волос). Проводится мониторинг состояния волосяных фолликулов с помощью установки для спектральной оптической когерентной томографии (ОКТ) OCP930SR (Thorlabs, USA). Результаты представлены на Фигуре 4. Навеска высушенных частиц массой 100 мг диспергируется в 100 мкл 70% этилового спирта. Изображение внедряемых частиц приведено на Фигуре 1.
После нанесения полученной суспензии на поверхность кожи спины лабораторной крысы осуществляется массаж в течение 2 минут на область нанесения. Затем избыток частиц смывается с поверхности кожи ватным тампоном, смоченным в воде. Далее осуществляется in vivo визуализация волосяных фолликулов данного участка кожи с помощью ОКТ. Результаты представлены на Фигуре 5.
Вывод: при использовании массажа как внедряющего воздействия наблюдается сосредоточение контейнеров на поверхности кожи и в верхней части волосяных воронок, не происходит обильного внедрения контейнеров в волосяные фолликулы. Данный режим признан неэффективным.
Пример 2.
Нанесение суспензии частиц карбоната кальция со средним диаметром 700 нм на поверхность кожи in vivo с последующим воздействием при помощи низкоинтенсивного терапевтического ультразвука (0.1 Вт/см2, 2 минуты; доза ультразвуковой энергии 12 Дж) на область аппликации. Под дозой ультразвуковой энергии (воздействия) здесь и далее понимается энергия потока ультразвука, проходящего через площадь в 1 см2:
Wуз=Iуз*S*tвоздействия, где Iуз - интенсивность ультразвука, tвоздействия - длительность воздействия, S=1 см2.
Исследование проводится in vivo на поверхности спины лабораторной крысы-альбиноса, как это описано в примере 1, с тем отличием, что после нанесения суспензии частиц на область нанесения осуществляется воздействие ультразвуком Dynatron 125 (Dynatronics, USA) частотой 1 МГц с диаметром ультразвукового зонда 2 см. Интенсивность УЗ-воздействия составляет 0.1 Вт/см2, длительность - 2 минуты. Затем избыток частиц смывается с поверхности кожи ватным тампоном, смоченным в воде. Далее осуществляется in vivo визуализация волосяных фолликулов данного участка кожи с помощью ОКТ. Результаты представлены на Фигуре 6.
Вывод: аппликация частиц ватерита размером 0.7±0.1 мкм в сочетании с УЗ-воздействием интенсивностью 0.1 Вт/см2 в течение 2 мин (доза ультразвуковой энергии 12 Дж) обеспечивает заполнение волосяных фолликулов, однако необильное и неоднородное: в верхней части фолликула плотнее. Данный режим позволяет внедрить частицы в волосяные фолликулы, однако не является оптимальным.
Пример 3.
Нанесение суспензии частиц карбоната кальция со средним диаметром 700 нм на поверхность кожи in vivo с последующим воздействием при помощи низкоинтенсивного терапевтического ультразвука (0.4 Вт/см2, 2 минуты, доза воздействия 48 Дж) на область аппликации.
Исследование проводится in vivo на поверхности спины лабораторной крысы-альбиноса, как это описано в примере 2, с тем отличием, что интенсивность УЗ-воздействия, осуществляемого после нанесения суспензии частиц, составляет 0.4 Вт/см2. Результаты in vivo визуализации волосяных фолликулов данного участка кожи с помощью ОКТ представлены на Фигуре 7.
Вывод: аппликация частиц ватерита размером 0.7±0.1 мкм в сочетании с УЗ-воздействием интенсивностью 0.4 Вт/см2 в течение 2 мин (доза энергии 48 Дж) обеспечивает плотное однородное заполнение волосяных фолликулов. Данный режим является эффективным.
Пример 4.
Нанесение суспензии частиц карбоната кальция со средним диаметром 700 нм на поверхность кожи in vivo с последующим воздействием при помощи низкоинтенсивного терапевтического ультразвука (0.5 Вт/см2, 2 минуты, доза воздействия 60 Дж) на область аппликации.
Исследование проводится in vivo на поверхности спины лабораторной крысы-альбиноса, как это описано в примере 2, с тем отличием, что интенсивность УЗ-воздействия, осуществляемого после нанесения суспензии частиц, составляет 0.5 Вт/см2 на область нанесения. Результаты in vivo визуализации волосяных фолликулов данного участка кожи с помощью ОКТ представлены на Фигуре 8.
Для изучения распределения и состояния частиц в волосяном мешочке, осуществляется быстрая экстракция 10 волос вместе с луковицей при помощи пинцета из области исследования и из контрольной зоны, в которой не осуществлялось внедрение контейнеров. После этого ткань луковицы каждого выдернутого волоса разрушается при помощи лезвия, и материал исследуется методом сканирующей электронной микроскопии (СЭМ) на установке MIRA II LMU (Tescan). Результаты представлены на Фигурах 9 и 10.
Вывод: как показывают данные ОКТ, аппликация частиц ватерита размером 0.7±0.1 мкм в сочетании с УЗ-воздействием интенсивностью 0.5 Вт/см2 в течение 2 мин (доза энергии 60 Дж) обеспечивает плотное однородное заполнение волосяных фолликулов. Отличительной особенностью данного режима является большая глубина заполнения фолликулов: частицы заполняют всю видимую для ОКТ область волосяного фолликула (более 600 нм вглубь). Данные СЭМ также свидетельствуют об обильном заполнении волосяных мешочков частицами карбоната кальция и об их налипании на внутреннюю стенку волосяной луковицы. Частицы обнаруживаются в большом количестве на всей глубине экстрагированной волосяной луковицы, что свидетельствует об их проникновении на всю глубину волосяного фолликула. При этом частицы ватерита сохраняют форму, что говорит об отсутствии разрушающего воздействия ультразвука на такую матрицу-носитель. Режим признан оптимальным.
Пример 5.
Нанесение суспензии частиц карбоната кальция со средним диаметром 700 нм на поверхность кожи in vivo с последующим воздействием при помощи низкоинтенсивного терапевтического ультразвука (1 Вт/см2, 2 минуты, доза воздействия 120 Дж) на область аппликации.
Исследование проводится in vivo на поверхности спины лабораторной крысы-альбиноса, как это описано в примере 2, с тем отличием, что интенсивность УЗ-воздействия, осуществляемого после нанесения суспензии частиц, составляет 1 Вт/см2 на область нанесения. Результаты in vivo визуализации волосяных фолликулов данного участка кожи с помощью ОКТ представлены на Фигуре 11.
Вывод: ультразвуковое воздействие интенсивностью 1 Вт/см2 в течение 2 мин (доза энергии 120 Дж), дополняющее аппликацию частиц ватерита размером 0.7±0.1 мкм, является избыточным и приводит к разрушению частиц в фолликулах, и выражается более редким их заполнением. Оказывая разрушающее действие на матрицу-носитель, такой режим внедрения будет инициировать преждевременный выход инкапсулированного вещества из нее. Режим не является оптимальным.
Вывод по примерам 1-5:
Внедрение частиц ватерита размером 0.7±0.1 мкм в волосяные фолликулы in vivo обеспечивается при воздействии с помощью низкоинтенсивного терапевтического ультразвука во всем диапазоне интенсивности, однако оптимум заполнения достигается при 0.5 Вт/см2 (доза энергии 60 Дж). Доза УЗ-воздействия до 12 Дж обеспечивает необильное заполнение фолликулов, доза ≥ 120 Дж является избыточной и приводит к разрушению внедряемых частиц. Результаты исследований, описанных в примерах 1-5 обобщены в разделе 1 таблицы 1, где оптимальные режимы внедрения, обеспечивающие обильное заполнение на глубину фолликула частицами без разрушения последних в процессе внедрения, обозначены как «+ +»; режимы, при которых не достигается внедрение частиц в волосяные фолликулы, обозначены как «-»; режимы, при которых достигается внедрение частиц в фолликулы, но которые однако не являются оптимальными, обозначены как «+/-».
Влияние длительности ультразвукового воздействия на заполнение волосяных фолликулов частицами при фиксированной интенсивности ультразвука
Пример 6.
Нанесение суспензии частиц карбоната кальция со средним диаметром 700 нм на поверхность кожи in vivo с последующим воздействием при помощи низкоинтенсивного терапевтического ультразвука (0.5 Вт/см2, 1 минута, доза воздействия 30 Дж) на область аппликации.
Исследование проводится in vivo на поверхности спины самца лабораторной крысы-альбиноса возрастом 1 год, весом 230 г по схеме, приведенной в примере 4, с тем отличием, что воздействие ультразвуком интенсивностью 0.5 Вт/см2 осуществляется в течение 1 минуты. Результаты in vivo визуализации волосяных фолликулов данного участка кожи с помощью ОКТ представлены на Фигуре 12.
Вывод: аппликация частиц ватерита размером 0.7±0.1 мкм в сочетании с УЗ-воздействием интенсивностью 0.5 Вт/см2 в течение 1 минуты (доза энергии 30 Дж) обеспечивает заполнение волосяных фолликулов, однако неоднородное (в верхней части фолликула плотнее) и необильное, по сравнению с режимами, описанным в примерах 3 и 4.
Пример 7.
Нанесение суспензии частиц карбоната кальция со средним диаметром 700 нм на поверхность кожи in vivo с последующим воздействием при помощи низкоинтенсивного терапевтического ультразвука (0.5 Вт/см2, 3 минуты, доза воздействия 90 Дж) на область аппликации.
Исследование проводится in vivo на поверхности спины самца лабораторной крысы-альбиноса по схеме, приведенной в примере 6, с тем отличием, что воздействие ультразвуком интенсивностью 0.5 Вт/см2 осуществляется в течение 3 минут. Результаты in vivo визуализации волосяных фолликулов данного участка кожи с помощью ОКТ представлены на Фигуре 13.
Вывод: ультразвуковое воздействие интенсивностью 0.5 Вт/см2 в течение 3 минут (доза энергии 90 Дж), дополняющее аппликацию частиц ватерита размером 0.7±0.1 мкм, обеспечивает глубокое и обильное заполнение фолликулов, однако является избыточным и приводит к более редкому заполнению фолликулов, по сравнению с результатами, приведенными в примере 4. Данный режим внедрения признан эффективным, но не оптимальным.
Пример 8.
Нанесение суспензии частиц карбоната кальция со средним диаметром 700 нм на поверхность кожи in vivo с последующим воздействием при помощи низкоинтенсивного терапевтического ультразвука (0.5 Вт/см2, 4 минуты, доза воздействия 120 Дж) на область аппликации
Исследование проводится in vivo на поверхности спины самца лабораторной крысы-альбиноса по схеме, приведенной в примере 6, с тем отличием, что воздействие ультразвуком интенсивностью 0.5 Вт/см2 осуществляется в течение 4 минут. Результаты in vivo визуализации волосяных фолликулов данного участка кожи с помощью ОКТ представлены на Фигуре 14.
Вывод: ультразвуковое воздействие интенсивностью 0.5 Вт/см2 в течение 4 минут (120 Дж), дополняющее аппликацию частиц ватерита размером 0.7±0.1 мкм, является избыточным и приводит к разрушению частиц в фолликулах, и выражается более редким их заполнением. Данные коррелируют с результатами, описанными в примере 5, характеризующими такую же дозу энергии (120 Дж). Такое воздействие также будет инициировать преждевременный выход инкапсулированного вещества из ватеритных матриц.
Пример 9.
Нанесение суспензии частиц карбоната кальция со средним диаметром 700 нм на поверхность кожи in vivo с последующим воздействием при помощи низкоинтенсивного терапевтического ультразвука (1 Вт/см2, 1 минута, доза воздействия 60 Дж) на область аппликации.
Исследование проводится in vivo на поверхности спины самца лабораторной крысы-альбиноса весом 230 г по схеме, приведенной в примере 5, с тем отличием, что воздействие ультразвуком интенсивностью 1 Вт/см2 осуществляется в течение 1 минуты. Результаты in vivo визуализации волосяных фолликулов данного участка кожи с помощью ОКТ представлены на Фигуре 15.
Вывод: ультразвуковое воздействие интенсивностью 1 Вт/см2 в течение 1 минуты (доза энергии 60 Дж), дополняющее аппликацию частиц ватерита размером 0.7±0.1 мкм, обеспечивает глубокое и обильное заполнение фолликулов, однако является избыточным и выражается более редким их заполнением, по сравнению с результатами, приведенными в примере 4. Однако данный режим внедрения, аналогично режиму, описанному в примере 7, является допустимым.
Вывод по примерам 4-9:
Оптимум внедрения частиц ватерита размером 0.7±0.1 мкм в волосяные фолликулы in vivo достигается при воздействии с помощью низкоинтенсивного терапевтического ультразвука интенсивностью 0.4-0.5 Вт/см2 в течение 2 минут (доза энергии 50-60 Дж). Интенсивность внедряющего УЗ-воздействия ≥ 1 Вт/см2 является избыточной при любой его длительности, однако допустимой при воздействии не более 1 минуты (доза энергии 60 Дж). Доза энергии ≥90 Дж (увеличение длительности УЗ-воздействия) является избыточной и приводит к разрушению частиц, внедряемых в фолликулы. При дозе УЗ-воздействия ≤ 30 Дж обеспечивается необильное заполнение фолликулов. Результаты исследований, описанных в примерах 6-9 обобщены в разделе 2 таблицы 1.
Влияние размера внедряемых частиц на заполнение ими волосяных фолликулов
Пример 10.
Нанесение суспензии частиц карбоната кальция со средним размером 1 мкм на поверхность кожи in vivo с последующим воздействием при помощи низкоинтенсивного терапевтического ультразвука (0.5 Вт/см2, 1 минута) на область аппликации.
Исследование проводится in vivo на поверхности спины самца лабораторной крысы-альбиноса возрастом 1 год, весом 250 г по схеме, приведенной в примере 6. Изображение внедряемых частиц приведено на Фигуре 2. Результаты in vivo визуализации волосяных фолликулов данного участка кожи с помощью ОКТ представлены на Фигуре 16.
Вывод: аппликация частиц ватерита размером 1.0±0.1 мкм в сочетании с УЗ-воздействием интенсивностью 0.5 Вт/см2 в течение 1 минуты (доза энергии 30 Дж) обеспечивает заполнение волосяных фолликулов, однако неоднородное (в верхней части фолликула плотнее) и необильное, по сравнению с режимами, описанным в примерах 3 и 4. Результат внедрения таких частиц сходен с результатов внедрения частиц размером 0.7±0.1 мкм, представленным в примере 6.
Пример 11.
Нанесение суспензии частиц карбоната кальция со средним диаметром 1 мкм на поверхность кожи in vivo с последующим воздействием при помощи низкоинтенсивного терапевтического ультразвука на область аппликации (0.5 Вт/см2, 2 минуты, оптимальный режим воздействия, по данным примеров 1-9).
Исследование проводится in vivo на поверхности спины самца лабораторной крысы-альбиноса возрастом 1 год, весом 250 г по схеме, приведенной в примере 4. Изображение внедряемых частиц приведено на Фигуре 2. Результаты in vivo визуализации волосяных фолликулов данного участка кожи с помощью ОКТ представлены на Фигуре 17.
Для изучения распределения и состояния частиц в волосяном мешочке, осуществляется быстрая экстракция 10 волос вместе с луковицей при помощи пинцета из области исследования и из контрольной зоны, в которой не осуществлялось внедрение контейнеров. После этого ткань луковицы каждого выдернутого волоса разрушается при помощи лезвия, и материал исследуется методом сканирующей электронной микроскопии (СЭМ) на установке MIRA II LMU (Tescan). Результаты представлены на Фигурах 9 и 18.
Вывод: как показывают данные ОКТ, аппликация частиц ватерита размером 1.0±0.1 мкм в сочетании с УЗ-воздействием интенсивностью 0.5 Вт/см2 в течение 2 минут обеспечивает обильное и глубокое заполнение волосяных фолликулов, однако более редкое, чем для частиц размером 0.7±0.1 мкм (пример 4). Данные СЭМ свидетельствуют об обильном заполнении волосяных мешочков частицами карбоната кальция, а также об их налипании на внутреннюю стенку волосяных луковиц. Большинство частиц ватерита сохраняет свою изначальную форму, однако для некоторых начинается процесс перекристаллизации в модификацию кальцита (кубические частицы на Фигуре 18), что свидетельствует о наличии разрушающее воздействия ультразвука, применяемого в данном режиме, на частицы размером 1 мкм: ультразвук ускоряет растворение и перекристаллизацию таких частиц. Это объясняет более редкое, по сравнению с примером 4, заполнение фолликулов на ОКТ-изображениях. Однако число кубов и поврежденных частиц составляет менее 5% от общего числа внедренных частиц, поэтому описанный режим внедрения является эффективным, хотя и уступает режимам, приведенным в примерах 3 и 4, с точки зрения эффективности доставки БАВ.
Пример 12.
Нанесение суспензии частиц карбоната кальция со средним диаметром 4-5 мкм на поверхность кожи in vivo с последующим воздействием при помощи низкоинтенсивного терапевтического ультразвука на область аппликации (0.5 Вт/см2, 2 минуты, оптимальный режим воздействия, по данным примеров 1-9).
Исследование проводится in vivo на поверхности спины самца лабораторной крысы-альбиноса возрастом 1 год, весом 250 г по схеме, приведенной в примере 4. Изображение внедряемых частиц приведено на Фигуре 3. Результаты in vivo визуализации волосяных фолликулов данного участка кожи с помощью ОКТ представлены на Фигуре 19.
Для изучения распределения и состояния частиц в волосяном мешочке, осуществляется быстрая экстракция волос вместе с луковицей и их исследование методом СЭМ по схеме, описанной в примере 11. Результаты представлены на Фигурах 9 и 20.
Вывод: как показывают данные ОКТ, аппликация частиц ватерита размером 4.5±0.5 мкм в сочетании с УЗ-воздействием интенсивностью 0.5 Вт/см2 в течение 2 минут обеспечивает обильное и глубокое заполнение волосяных фолликулов, однако более редкое, чем для частиц размером 0.7±0.1 мкм (пример 4). Данные СЭМ свидетельствуют об обильном заполнении волосяных мешочков частицами карбоната кальция, а также об их налипании на внутреннюю стенку волосяных луковиц. Однако большинство внедренных частиц имеет кубическую форму или представляет собой фрагменты разрушенных под действием ультразвука контейнеров (Фигура 20), на изображениях присутствуют также целостные сферические частицы, прошедшие внутрь луковиц. Можно заключить, что ультразвук оказывает разрушающее воздействие на такую матрицу-носитель в процессе внедрения в волосяные фолликулы и инициирует процесс перекристаллизации в модификацию кальцита (кубические частицы на Фигуре 20). Это объясняет более редкое, по сравнению с примером 4, заполнение фолликулов на ОКТ-изображениях. Процент кубов и поврежденных частиц велик, поэтому описанный режим внедрения не является допустимым. В результате разрушения и перекристаллизации будет осуществлено преждевременное высвобождение инкапсулированного БАВ.
Вывод по примерам 4, 10-12:
Хотя для частиц всего рассмотренного диапазона продемонстрировано эффективное внедрение в волосяные фолликулы, только частицы размером 500-1200 нм способны выступать в качестве матрицы-носителя БАВ для трансдермальной доставки под действием ультразвука, поскольку являются устойчивыми к внедряющему воздействию (при использовании оптимальных режимов внедрения). Наиболее оптимальными контейнерами признаны частицы размером 0.7±0.1 мкм. Результаты исследований, описанных в примерах 1-12 обобщены в таблице 1.
Мониторинг состояния частиц, заполняющих волосяные фолликулы в течение времени
Пример 13
Мониторинг состояния частиц внутри волосяной луковицы in vivo в течение 12 дней после внедрения частиц карбоната кальция со средним диаметром 700 нм с помощью низкоинтенсивного терапевтического ультразвука (0.5 Вт/см2, 2 минуты). Размер внедряемых частиц и режим УЗ-воздействия являются оптимальными, по данным, приведенным в примерах 1-12.
Исследование проводится in vivo на поверхности спины лабораторной крысы-альбиноса возрастом 1 год, весом 250 г. Внедрение частиц осуществляется по схеме, приведенной в примере 4. Для изучения распределения и состояния частиц в волосяной луковице, осуществляется экстракция волос из области исследования и из контрольной зоны (без внедрения частиц) в количестве 10 волос на каждую зону. После этого ткань изъятой волосяной луковицы каждого волоса рушится при помощи лезвия и материал исследуется методом сканирующей электронной микроскопии (СЭМ) на установке MIRA II LMU (Tescan). Процедура экстракции и исследования волос из зоны внедрения частиц повторяется на 3-й, 5-й, 8-й, 10-й и 12-й дни после внедрения. Наиболее значимые результаты, отображающие динамику разрушения частиц в волосяном фолликуле, представлены на Фигурах 9, 21, 22, 23, 24 и 25. Для некоторых образцов проводится исследование химического состава содержимого методом энергодисперсионной рентгеновской спектроскопии на приборе EDX INCA ENERGY 350 (Oxford Instruments). Результаты представлены на Фигурах 26, 27 и 28.
Вывод: по данным СЭМ установлено, что для внедренных в волосяные фолликулы частиц ватерита размером 0.7±0.1 мкм с течением времени наблюдается постепенная деградация вплоть до полного их растворения в объеме волосяной луковицы в течение 12 дней после внедрения (Фигура 25). Продемонстрировано, что на 3й день после внедрения начинается процесс растворения частиц ватерита в активной внутренней среде волосяного фолликула (Фигура 21). Поскольку был подобран оптимальный режим внедрения, обеспечивающий заполнение волосяных луковиц большим числом частиц (локализованных в результате в малом объеме луковицы), то процесс растворения ватерита на первом этапе сопровождается перекристаллизацией в модификацию кальцита. Причиной является то, что при взаимодействии поверхности частиц ватерита с активной средой волосяного фолликула гидратированные ионы Ca2+ и CO32- покидают поверхность частиц, однако, в силу их большой локальной концентрации, не успевают диффундировать в объем ткани и осаждаются снова на крупных частицах CaCO3, формируя кристаллы кальцита. Процесс растворения и перекристаллизации продолжается в течение 8 дней, сопровождаясь заращиванием частиц в стенку волосяной луковицы в результате активных процессов деления ее тканей (Фигура 23). В течение этого времени уменьшается концентрация и размер частиц карбоната кальция в объеме волосяного фолликула. Данные исследования химического состава содержимого методом энергодисперсионной рентгеновской спектроскопии подтвердили, что обнаруженные в волосяной луковице на 1й (Фигура 26), 3й (Фигура 27) и 8й (Фигура 28) дни частицы и агрегаты частиц являются частицами карбоната кальция. Дальнейший мониторинг состояния частиц в фолликуле показал, что недорастворенные на 8й день частицы и их агрегаты резорбируются полностью в течение 12 дней. Обобщенные данные представлены в Таблице 2.
Влияние ультразвукового пост-воздействия на внедрение частиц в фолликулы и на их состояние внутри волосяной луковицы
Пример 14
Управление разрушением частиц карбоната кальция со средним диаметром 700 нм, внедренных в волосяные фолликулы с помощью ультразвукового пост-воздействия (1 МГц, 1 Вт/см2) разной длительности (4, 5 или 9 минут) на область внедрения. Мониторинг состояния частиц внутри волосяной луковицы in vivo в течение 12 дней после внедрения. Размер внедряемых частиц и режим УЗ-воздействия (0.5 Вт/см2, 2 минуты) являются оптимальными, по данным, приведенным в примерах 1-12.
Исследование проводится in vivo на разных сегментах поверхности спины самца лабораторной крысы-альбиноса возрастом 1 год, весом 230 г по схеме, описанной примере 13, с тем отличием, что после внедрения и смывки остатка частиц с поверхности кожи производится повторное воздействие ультразвуком Dynatron 125 (Dynatronics, USA) частотой 1 МГц интенсивностью 1 Вт в течение 4, 5 или 9 минут. Дальнейшее увеличение времени непрерывного пост-воздействия в условиях заданного эксперимента является невозможным, поскольку приводит к перегреву тканей исследуемого животного. После снятия внешнего воздействия осуществляется in vivo мониторинг волосяных фолликулов данного участка кожи с помощью ОКТ. Результаты представлены на Фигурах 29, 30 и 31.
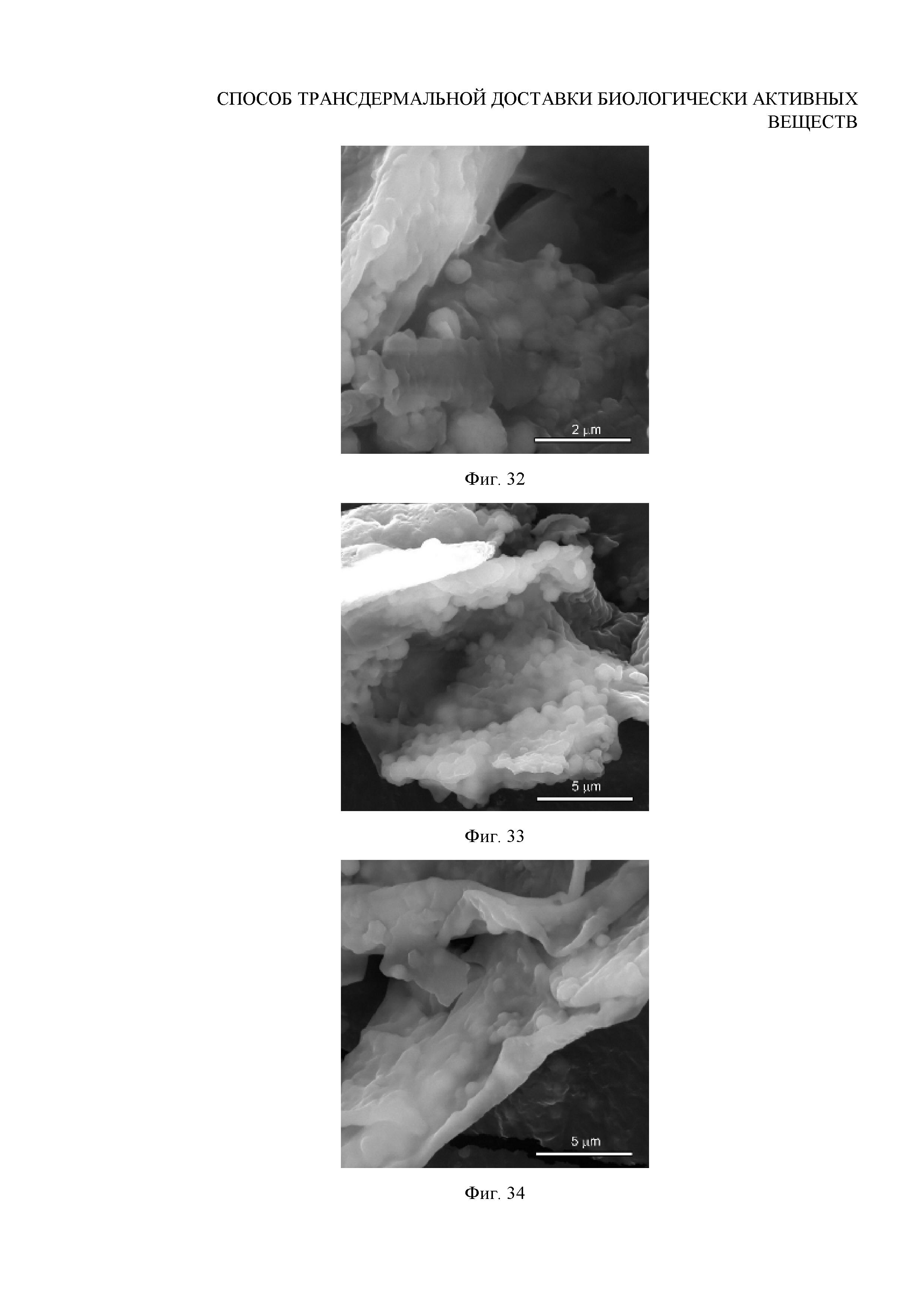
Для изучения влияния ультразвукового пост-воздействия на распределение и состояния частиц в волосяной луковице, осуществляется экстракция волос из каждой области исследования и из контрольной зоны (без внедрения частиц) в количестве 10 волос на каждую зону. После этого ткань изъятой волосяной луковицы каждого волоса рушится при помощи лезвия и материал исследуется методом сканирующей электронной микроскопии (СЭМ) на установке MIRA II LMU (Tescan). Результаты представлены на Фигурах 9, 32, 33 и 34.
Для проведения мониторинга состояния частиц внутри волосяной луковицы в течение времени, процедура экстракции и исследования волос из зоны внедрения частиц повторяется на 3-й, 5-й, 8-й, 10-й и 12-й дни после внедрения. Наиболее значимые результаты, отображающие динамику разрушения частиц в волосяном фолликуле, представлены на Фигурах 9, 35-37 и 38-40.
Вывод: по данным ОКТ (Фигуры 8, 29-31) и СЭМ (Фигуры 9, 32-34) установлено, что ультразвуковое пост-воздействие на область внедрения частиц обеспечивает более глубокое и обильное их утопление в стенку волосяной луковицы, причем с увеличением времени ультразвуковой экспозиции указанный эффект усиливается, что приводит, фактически, к минерализации ткани мешочка. В самом же внутреннем объеме волосяной луковицы наблюдается прореживание частиц, их упаковка становится менее плотной. Кроме того, показано (Фигуры 9, 35-40), что дополнительное УЗ-воздействие ускоряет процесс деградации частиц ватерита в волосяной луковице (по сравнению с режимом без повторного озвучивания, описанным в примере 13), причем с увеличением времени ультразвуковой экспозиции указанный эффект также усиливается. УЗ пост-воздействие в течение 4 минут ускоряет процесс растворения и перекристаллизации внедренных в волосяные фолликулы частиц ватерита размером 0.7±0.1 мкм, сокращая его продолжительность с 8 до 5 дней (Фигуры 35-37). Этот процесс также сопровождается заращиванием частиц в стенку волосяной луковицы в результате активных процессов деления его тканей, однако более быстрым (Фигура 35). В течение этого времени уменьшается концентрация и размер частиц карбоната кальция в объеме волосяного фолликула. Дальнейший мониторинг состояния частиц в фолликуле показал, что недорастворенные частицы и их агрегаты резорбируются в течение 10 дней (Фигура 37). При увеличении УЗ-экспозиции до 9 минут удается сократить время деградации частиц в волосяной луковице до 8 дней (Фигуры 38-40). Обобщенные данные представлены в Таблице 2.
Трансфолликулярная доставка биологически активного вещества при помощи частиц ватерита
Пример 15
Внедрение частиц ватерита со средним диаметром 700 нм, нагруженных лекарственным препаратом «Аммифурин», в волосяные фолликула добровольца (человека) in vivo.
Исследование проводится in vivo на внешней стороне предплечья здорового добровольца 30 лет мужского пола. Перед проведением исследования волосы на внешней стороне предплечья аккуратно сбриваются бритвенным станком до 1 мм длины волос. Проводится мониторинг состояния волосяных фолликулов с помощью установки для спектральной оптической когерентной томографии (ОКТ) OCP930SR (Thorlabs, USA). Результаты представлены на Фигуре 41. Навеска высушенных частиц массой 100 мг диспергируется в 100 мкл 70% этилового спирта. Исследуемый порошок представляет собой частицы ватерита размером 0.7±0.1 мкм, нагруженные препаратом «Аммифурин», с концентрацией действующего 2% по массе. «Аммифурин» обладает выраженной флуоресценцией с максимумом на 460 нм при возбуждении светом с длиной волны 405 нм. СЭМ-изображение внедряемых частиц приведено на Фигуре 42, флуоресцентное изображение, полученное методом конфокальной флуоресцентной микроскопии на микроскопе Leica TCS SP8 (Leica, Germany), представлено на Фигуре 43.
После нанесения полученной суспензии на внешнюю поверхность предплечья добровольца осуществляется воздействие ультразвуком Dynatron 125 (Dynatronics, USA) частотой 1 МГц с диаметром ультразвукового зонда 2 см. Интенсивность УЗ-воздействия составляет 0.5 Вт/см2, длительность - 2 минуты (размер внедряемых частиц и режим УЗ-воздействия являются оптимальными, по данным, приведенным в примерах 1-12). Затем избыток частиц смывается с поверхности кожи ватным тампоном, смоченным в воде. Далее осуществляется in vivo визуализация волосяных фолликулов данного участка кожи с помощью ОКТ. Результаты представлены на Фигуре 44.
Для изучения распределения и состояния частиц и действующего флуоресцентного лекарственного вещества в волосяной луковице, осуществляется экстракция 10 волос вместе с луковицей из области исследования. После этого ткань изъятой волосяной луковицы каждого волоса рушится при помощи лезвия и материал исследуется методом сканирующей электронной микроскопии (СЭМ) на установке MIRA II LMU (Tescan). Результаты представлены на Фигуре 45. Исследование флуоресценции внедренных в волосяные луковицы частиц осуществляется методом конфокальной флуоресцентной микроскопии на микроскопе Leica TCS SP8 (Leica, Germany). Результаты представлены на Фигуре 46. Флуоресцентное изображение порушенного контрольного волоса, снятое при тех же параметрах сканирования, приведено на Фигуре 47.
Вывод: данные ОКТ и СЭМ свидетельствуют об успешности заполнения волосяных мешочков исследуемыми контейнерами. Наличие яркого флуоресцентного сигнала, регистрируемого от рассыпавшихся частиц после разрушения волосяной луковицы методом конфокальной флуоресцентной микроскопии (Фигура 46), свидетельствует о загрузке внедренных в волосяную луковицу частиц Аммиуфрином, что указывает на успешность его трансфолликулярной доставки in vivo при помощи матриц-контейнеров на основе ватерита человеку. Отсутствие выраженной флуоресценции для контрольного волоса подтвердило (Фигура 47), что указанный сигнал был принят от внедренных в фолликул флуоресцирующих контейнеров.