Композиции сложных эфиров омега-3 жирных кислот
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка заявляет преимущество приоритета предварительной заявки на патент США №61/618161, поданной 30 марта 2012 г.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0002] Согласно информационному бюллетеню Всемирной организации здравоохранения (WHO) по сердечно-сосудистым заболеваниям (CVD), CVD являются главной причиной смерти во всем мире (информационный бюллетень №317, сентябрь 2012, доступный по адресу (http://www.who.int/mediacentre/factsheets/fs317/en/index.html от 31 января 2013 г.). По оценкам WHO приблизительно 17,3 миллиона человек умерли от CVD в 2008 г., что составило 30% всех случаев смерти в мире. Из данных смертей приблизительно 7,3 миллиона произошли вследствие ишемической болезни сердца (CHD) и 6,2 миллиона вследствие инсульта. Также по оценкам WHO к 2030 году почти 25 миллионов человек умрет от CVD, в основном от заболеваний сердца и инсульта. По оценкам Исследования глобального бремени заболеваний (Global Burden of Disease Study) на долю развивающихся стран пришлось 3,5 миллиона из 6,2 миллионов случаев смерти от CHD в мире в 1990 году. (Murray CJL and Lopez AD. The Global Burden of Disease A Comprehensive Assessment of Mortality and Disability from Disease, Injuries and Risk Factors in 1990 and Projected to 2020. Boston, Ma Harvard University Press; 1996). По оценке предполагаемых показателей на данные страны будет приходиться 7,8 миллиона из 11,1 миллиона смертей вследствие CHD в 2020 году. Развитые страны не застрахованы от CHD. Например, в США и Европе CHD остается самой распространенной единой причиной смерти и инвалидности. В 2005 году CHD стала причиной приблизительно 1 из каждых 5 смертей в США (Heron MP, et. al. Deaths preliminary data for 2006. Natl. Vital. Stat. Rep. 2008; 56: 1-52.). По данным Центров по контролю и профилактике заболеваний (Centers for Disease Control and Prevention) она является ведущей причиной смерти в Америке. Приблизительно 37% людей, у которых развивается коронарный приступ в определенном году, умрет от него. В то время как в Европе достигнуто наиболее значимое снижение смертности, связанной с CVD, на CVD по-прежнему приходится 54% всех смертей среди женщин и 43% всех смертей среди мужчин.
[0003] CVD связаны с многими факторами риска. Из данных факторов риска гиперлипидемия (например, гипертриглицеридемия) и гиперхолестеринемия являются важными индикаторами CVD. Поэтому в настоящее время пищевые добавки, нутрицевтики и отпускаемые по рецепту лекарственные средства, содержащие сложные эфиры омега-3 жирных кислот, такие как сложные этиловые эфиры ЕРА и DHA, применяются для лечения CVD и, в частности, для снижения повышенного уровня триглицеридов.
[0004] Однако, введение пищевых добавок, нутрицевтиков и отпускаемых по рецепту лекарственных средств, содержащих сложные эфиры омега-3 жирных кислот, представляет значительные трудности. Например, в настоящее время пищевые добавки, нутрицевтики и отпускаемые по рецепту лекарственные средства, содержащие сложные эфиры омега-3 жирных кислот, характеризуются различной абсорбцией и эффективностью при пероральном введении. В частности, существующие в настоящее время композиции подвергаются выраженному "влиянию пищи" со слабой абсорбцией при приеме натощак или с едой с низким содержанием жиров. При приеме с жирной пищей абсорбция сложных эфиров омега-3 жирных кислот улучшается частично благодаря присутствию выделяющихся в желудок солей желчных кислот, которые способствуют абсорбции сложных эфиров омега-3 жирных кислот.
[0005] Для преодоления низкой абсорбции пациентам можно давать дозы композиций, содержащие большие количества сложных эфиров омега-3 жирных кислот, но существуют практические ограничения для данного подхода в связи с побочными эффектами, которые обычно связаны с такими композициями. Окислительный распад сложных эфиров омега-3 жирных кислот, который происходит с течением времени, может привести к неприятному привкусу после введения, особенно при употреблении в больших количествах. Отрыжка и расстройство желудка являются дополнительными побочными эффектами, связанными с употреблением сложных эфиров омега-3 жирных кислот. После употребления сложные эфиры омега-3 жирных кислот, как правило, плавают на поверхности жидкого содержимого в желудке, образуя слой, который препятствует прохождению мелких пузырьков газа. При накоплении количества газа, достаточного для преодоления поверхностного натяжения масляного слоя, человек отрыгивает. Отрыжка обычно имеет рыбный привкус и запах.
[0006] Соответственно, побочные эффекты, связанные с введением существующих в настоящее время композиций, содержащих сложные эфиры омега-3 жирных кислот (например, подверженность влиянию пищи, большие дозы для достижения эффективности и получаемый привкус, неприятный запах и отрыжка), как известно, значительно снижают соблюдение пациентом режима и схемы лечения.
[0007] В то время как ведение здорового образа жизни может снизить заболеваемость CVD, новые терапевтические подходы для контроля CVD являются оправданными. Такие новые подходы могут включать поиск новых лекарственных средств или улучшение существующих в настоящее время лекарственных средств, применяемых для лечения CVD. Поиск новых лекарственных средств, однако, является дорогостоящим, без уверенности в конечном успехе. Соответственно, следует разрабатывать новые или более эффективные способы доставки существующих в настоящее время лекарственных средств с доказанным профилем безопасности и эффективности. Таким образом, существует потребность в улучшенных композициях, содержащих сложные эфиры омега-3 жирных кислот, такие как сложные этиловые эфиры ЕРА и DHA, которые менее подвержены влиянию пищи и которые имеют высокую эффективность при низких дозах. В идеальном случае такие улучшенные композиции могли бы минимизировать или устранить неприятный запах, и/или неприятный привкус, и/или отрыжку у пациента. Такая улучшенная композиция с уменьшенными побочными эффектами могла бы улучшить соблюдение пациентом режима и схемы лечения и более эффективно бороться с факторами риска, связанными с сердечно-сосудистыми заболеваниями.
КРАТКОЕ ОПИСАНИЕ
[0008] Во всех вариантах осуществления, предусматриваемых в данном документе, все композиции не содержат свободные омега-3 жирные кислоты. В определенных вариантах осуществления в данном документе предусмотрены композиции, содержащие сложные эфиры ЕРА и DHA в комбинации по меньшей мере с одним поверхностно-активным веществом. В определенных вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от более чем 2:1 до не более чем 3,4:1. Определенные варианты осуществления предусматривают соотношение сложного эфира ЕРА и сложного эфира DHA от приблизительно 2:1 до приблизительно 3,4:1. В определенных вариантах осуществления в данном документе предусматриваются композиции, содержащие по меньшей мере один сложный эфир омега-3 жирной кислоты и по меньшей мере одно поверхностно-активное вещество. В определенных вариантах осуществления сложный эфир омега-3 жирной кислоты выбран из группы, состоящей из гексадекатриеновой кислоты, α-линоленовой кислоты, стеаридоновой кислоты, эйкозатриеновой кислоты, эйкозапентаеновой кислоты, генэйкозапентаеновой кислоты, докозапентаеновой кислоты, докозагексаеновой кислоты, тетракозапентаеновой кислоты, тетракозагексаеновой кислоты или их комбинации. Определенные варианты осуществления предусматривают композиции, содержащие сложный этиловый эфир - производное указанного сложного эфира омега-3 жирной кислоты, необязательно в комбинации по меньшей мере с одним поверхностно-активным веществом, по меньшей мере одним терпеном, по меньшей мере одним антиоксидантом или их комбинациями. Определенные варианты осуществления также предусматривают комбинации различных сложных эфиров омега-3 жирных кислот в соотношениях от приблизительно 2:1 до приблизительно 3,4:1. Другие варианты осуществления предполагают соотношение от более чем 2:1 до не более чем 3,4:1. Как правило, соотношение составляет приблизительно 2,4:1. Определенные варианты осуществления предусматривают способ лечения различных состояний или нарушений, которые можно лечить путем введения указанных сложных эфиров омега-3 жирных кислот в композициях, описанных в данном документе, которые характеризуются описанными соотношениями, необязательно по меньшей мере с одним поверхностно-активным веществом, по меньшей мере одним терпеном, по меньшей мере одним антиоксидантом или их комбинациями. Композиции, описанные в данном документе, минимизируют несколько побочных эффектов, обнаруживаемых у зарегистрированных в настоящее время для продажи композиций, содержащих сложные эфиры омега-3 жирных кислот, которые могут удерживать субъекта-человека от выполнения схемы дозирования, необходимой для лечения состояния или нарушения, поддающегося лечению путем введения сложных эфиров омега-3 жирных кислот. В определенных вариантах осуществления биодоступность указанных сложных эфиров омега-3 жирных кислот при введении в виде определенных композиций, описанных в данном документе, практически остается одинаковой при введении с пищей или без пищи субъекту-человеку, нуждающемуся в таком введении, т.е. практически не зависит от влияния пищи.
[0009] Таким образом, определенные варианты осуществления предусматривают фармацевтические композиции, содержащие по меньшей мере один сложный эфир омега-3 жирной кислоты и по меньшей мере одно поверхностно-активное вещество, где указанный по меньшей мере один сложный эфир омега-3 жирной кислоты составляет по меньшей мере приблизительно 40% (вес/вес) композиции.
[0010] Определенные варианты осуществления предусматривают фармацевтические композиции, содержащие первый сложный эфир омега-3 жирной кислоты, выбранный из группы, состоящей из гексадекатриеновой кислоты, α-линоленовой кислоты, стеаридоновой кислоты, эйкозатриеновой кислоты, эйкозапентаеновой кислоты, генэйкозапентаеновой кислоты, докозапентаеновой кислоты, докозагексаеновой кислоты, тетракозапентаеновой кислоты, тетракозагексаеновой кислоты, и второй сложный эфир омега-3 жирной кислоты, выбранный из группы, состоящей из гексадекатриеновой кислоты, α-линоленовой кислоты, стеаридоновой кислоты, эйкозатриеновой кислоты, эйкозапентаеновой кислоты, генэйкозапентаеновой кислоты, докозапентаеновой кислоты, докозагексаеновой кислоты, тетракозапентаеновой кислоты, тетракозагексаеновой кислоты, таким образом, что выбранные первый и второй сложные эфиры омега-3 жирных кислот отличаются друг от друга, и соотношение первого и второго сложных эфиров омега-3 жирных кислот составляет от более чем 2:1 до не более чем 3,4:1 (первый сложный эфир омега-3 жирной кислоты: второй сложный эфир омега-3 жирной кислоты); где первый и второй сложные эфиры омега-3 жирных кислот в сумме составляют по меньшей мере приблизительно 40% (вес/вес) композиции, и где указанная композиция практически не содержит активные ингредиенты кроме указанных сложных эфиров омега-3 жирных кислот.
[0011] Определенные варианты осуществления предусматривают применение по меньшей мере одного сложного эфира омега-3 жирной кислоты. Как правило, сложный эфир омега-3 жирной кислоты является сложным этиловым эфиром.
[0012] Определенные варианты осуществления предусматривают фармацевтические композиции, содержащие по меньшей мере один сложный эфир омега-3 жирной кислоты и по меньшей мере один терпен, где указанный по меньшей мере один сложный эфир омега-3 жирной кислоты составляет по меньшей мере приблизительно 40% (вес/вес) композиции, которые практически не содержат активные ингредиенты кроме сложных эфиров омега-3 жирных кислот. В определенных вариантах осуществления по меньшей мере один сложный эфир омега-3 жирной кислоты составляет приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%. Терпен, как правило, но не обязательно, представляет собой d-лимонен. В определенных других вариантах осуществления такие композиции содержат натуральное апельсиновое масло.
[0013] Определенные варианты осуществления предусматривают композиции, содержащие сложные этиловые эфиры ЕРА и сложные этиловые эфиры DHA и по меньшей мере один терпен, где соотношение EPA:DHA составляет приблизительно 2,4:1, и где указанные этиловые эфиры ЕРА и DHA в сумме составляют от приблизительно 40% (вес/вес) до приблизительно 95% (вес/вес) указанной композиции. В определенных вариантах осуществления сложные этиловые эфиры ЕРА и DHA в сумме составляют приблизительно 40% (вес/вес) указанной композиции. Терпен, как правило, но не обязательно, представляет собой d-лимонен. В определенных других вариантах осуществления такие композиции содержат натуральное апельсиновое масло.
[0014] В вариантах осуществления, включающих практически чистый d-лимонен, d-лимонен характеризуется от приблизительно 95% до приблизительно 98% чистоты. В определенных вариантах осуществления практически чистый d-лимонен характеризуется по меньшей мере 95%, 96%, 97% или 98% чистоты.
[0015] В определенных вариантах осуществления сложный эфир омега-3 жирной кислоты выбран из группы, которая состоит по меньшей мере из одного сложного эфира ЕРА, по меньшей мере одного сложного эфира DHA или их комбинации, и включает по меньшей мере одно поверхностно-активное вещество. В определенных вариантах осуществления по меньшей мере один сложный эфир ЕРА и по меньшей мере один сложный эфир DHA являются практически чистыми. Определенные варианты осуществления также предусматривают композиции, содержащие по меньшей мере один сложный эфир ЕРА и по меньшей мере один сложный эфир DHA в соотношениях от приблизительно 2:1 до приблизительно 3,4:1, которые практически не содержат активные ингредиенты кроме сложных эфиров омега-3 жирных кислот. Также описаны композиции, характеризующиеся другими соотношениями. Определенные композиции также могут не содержать натуральное апельсиновое масло или d-лимонен. В определенных вариантах осуществления сложные эфиры омега-3 жирных кислот составляют по меньшей мере 40% композиции. Как правило, сложные эфиры омега-3 ЕРА и DHA являются сложными этиловыми эфирами. Определенные композиции, описанные в данном документе, образуют мицеллы в водной среде и не зависят от влияния пищи. Определенные композиции при введении с пищей или без пищи, практически не зависят от влияния пищи. Также в данном документе предусмотрены способы лечения сердечно-сосудистых состояний или нарушений с использованием описанных композиций. Композиции, описанные в данном документе, минимизируют или устраняют побочные эффекты по сравнению с введением композиций предшествующего уровня техники. Также предусмотрены упакованные композиции или наборы сложных эфиров омега-3 жирных кислот, содержащие одну или несколько единичных лекарственных форм вместе с инструкциями по применению композиций.
[0016] Соответственно, по меньшей мере в одном варианте осуществления предусмотрена фармацевтическая композиция, содержащая по меньшей мере один сложный эфир ЕРА, и по меньшей мере один сложный эфир DHA в соотношении веса к весу от более чем приблизительно 2:1 до не более чем приблизительно 3,4:1 (EPA:DHA), и по меньшей мере одно поверхностно-активное вещество, где указанные сложные эфиры ЕРА и DHA в сумме составляют от приблизительно 40% до приблизительно 85% по весу композиции. В определенных таких вариантах осуществления сложные этиловые эфиры ЕРА и DHA в сумме составляют приблизительно 50% (вес/вес) указанной композиции.
[0017] По меньшей мере в одном другом варианте осуществления предусмотрена фармацевтическая композиция, содержащая по меньшей мере один сложный эфир ЕРА, и по меньшей мере один сложный эфир DHA в соотношении веса к весу от приблизительно 2:1 до приблизительно 3,4:1 (EPA:DHA), и по меньшей мере одно поверхностно-активное вещество, где указанные сложные эфиры ЕРА и DHA в сумме составляют от приблизительно 40% до приблизительно 85% по весу композиции. В определенных таких вариантах осуществления сложные этиловые эфиры ЕРА и DHA в сумме составляют приблизительно 50% (вес/вес) указанной композиции.
[0018] По меньшей мере в одном другом варианте осуществления предусмотрена фармацевтическая композиция, содержащая по меньшей мере один сложный эфир ЕРА, и по меньшей мере один сложный эфир DHA в соотношении веса к весу от более чем 2:1 до не более чем 3,4:1 (EPA:DHA), и по меньшей мере одно поверхностно-активное вещество, где указанные сложные эфиры ЕРА и DHA в сумме составляют от приблизительно 40% до приблизительно 85% по весу композиции. В определенных таких вариантах осуществления сложные этиловые эфиры ЕРА и DHA в сумме составляют приблизительно 50% (вес/вес) указанной композиции.
[0019] По меньшей мере в еще одном варианте осуществления предусмотрена фармацевтическая композиция, содержащая по меньшей мере один сложный эфир EPA, и по меньшей мере один сложный эфир DHA в соотношении веса к весу от более чем 2:1 до не более чем 3,4:1 (EPA:DHA), и по меньшей мере одно поверхностно-активное вещество, где указанные сложные эфиры ЕРА и DHA в сумме составляют от приблизительно 40% до приблизительно 85% по весу композиции, и где композиция при введении с пищей или без пищи субъекту-человеку, нуждающемуся в таком введении, практически не зависит от влияния пищи. В таких определенных вариантах осуществления сложные этиловые эфиры ЕРА и DHA в сумме составляют приблизительно 50% (вес/вес) указанной композиции.
[0020] По меньшей мере в одном варианте осуществления композиции, описанные в данном документе, содержат практически чистый по меньшей мере один сложный эфир ЕРА и/или по меньшей мере один сложный эфир DHA.
[0021] По меньшей мере в одном варианте осуществления композиции, описанные в данном документе, по сути, включают по меньшей мере один сложный эфир ЕРА и/или по меньшей мере один сложный эфир DHA.
[0022] В определенных вариантах осуществления любой или каждый из сложных эфиров ЕРА и DHA, составляющих композицию, является сложным этиловым эфиром.
[0023] В определенных вариантах осуществления композиции, описанные в данном документе, содержат практически чистый сложный этиловый эфир ЕРА и/или практически чистый сложный этиловый эфир DHA.
[0024] В определенных вариантах осуществления композиции, описанные в данном документе, по сути, включают практически чистый сложный этиловый эфир ЕРА и/или практически чистый сложный этиловый эфир DHA.
[0025] В определенных вариантах осуществления соотношение сложных эфиров ЕРА и DHA, составляющих композицию, составляет приблизительно 2,4:1 (сложный эфир ЕРА:сложный эфир DHA).
[0026] Определенные варианты осуществления предусматривают композиции, содержащие также натуральное апельсиновое масло, составляющее от приблизительно 0,1% до приблизительно 5% (вес/вес) указанной композиции. В вариантах осуществления, включающих натуральное апельсиновое масло, натуральное апельсиновое масло присутствует в количестве приблизительно 1,6% (вес/вес) композиции. Определенные другие варианты осуществления включают практически чистый d-лимонен, составляющий от приблизительно 0,1% до приблизительно 5%. В вариантах осуществления, включающих практически чистый d-лимонен, d-лимонен присутствует в количестве приблизительно 1,5% (вес/вес) композиции.
[0027] В определенных вариантах осуществления фармакологический эффект композиций, описанных в данном документе, практически не зависит от влияния пищи при введении субъекту.
[0028] По меньшей мере в одном варианте осуществления предусмотрена фармацевтическая композиция смешанных жирных кислот, в которой а) по меньшей мере 80% по весу композиции составляет комбинация (все-Z омега-3)-5,8,11,14,17-эйкозапентаеновых кислот (ЕРА) и (все-Z омега-3)-4,7,10,13,16,19-докозагексаеновых кислот (DHA) в весовом соотношении EPA:DHA от приблизительно 1:2 до приблизительно 2:1; b) (все-Z омега-3)-6,9,12,15,18-генэйкозапентаеновая кислота присутствует в количестве по меньшей мере одного процента по весу; и с) присутствует по меньшей мере одно поверхностно-активное вещество. Данные композиции могут необязательно дополнительно содержать натуральное апельсиновое масло в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) или практически чистый d-лимонен в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) композиции. Натуральное апельсиновое масло, как правило, присутствует в количестве приблизительно 1,6% (вес/вес) указанной композиции, и d-лимонен, как правило, присутствует в количестве приблизительно 1,5% (вес/вес) композиции.
[0029] По меньшей мере в одном варианте осуществления предусмотрена фармацевтическая композиция смешанных жирных кислот для лечения или профилактики по меньшей мере одного из множества факторов риска CVD, в которой а) по меньшей мере 80% по весу композиции составляют омега-3 жирные кислоты; b) по меньшей мере 80% по весу от общего содержания жирных кислот в композиции составляет комбинация (все-Z омега-3)-5,8,11,14,17-эйкозапентаеновой кислоты (ЕРА) и (все-Z омега-3)-4,7,10,13,16,19-докозагексаеновой кислоты (DHA) в весовом соотношении EPA:DHA от 1:2 до 2:1, с) омега-3 жирные кислоты, кроме ЕРА и DHA, присутствуют в количестве по меньшей мере 1,5% по весу от общего содержания жирных кислот; и с) присутствует по меньшей мере одно поверхностно-активное вещество. Такие композиции могут необязательно дополнительно содержать натуральное апельсиновое масло в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) или практически чистый d-лимонен в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) композиции. Натуральное апельсиновое масло, как правило, присутствует в количестве приблизительно 1,6% (вес/вес) указанной композиции, и d-лимонен, как правило, присутствует в количестве приблизительно 1,5% (вес/вес) композиции.
[0030] По меньшей мере в одном варианте осуществления предусмотрена фармацевтическая композиция смешанных жирных кислот, в которой а) по меньшей мере 80% по весу композиции составляет комбинация (все-Z омега-3)-5,8,11,14,17-эйкозапентаеновой кислоты (ЕРА) и (все-Z омега-3)-4,7,10,13,16,19-докозагексаеновой кислоты (DHA) в весовом соотношении EPA:DHA от 1:2 до 2:1, b) по меньшей мере 3% по весу композиции составляют омега-3 жирные кислоты, кроме ЕРА и DHA, которые содержат 18, 20, 21 или 22 атома углерода, и с) присутствует по меньшей мере одно поверхностно-активное вещество. Такие композиции могут необязательно дополнительно содержать натуральное апельсиновое масло в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) или практически чистый d-лимонен в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) композиции. Натуральное апельсиновое масло, как правило, присутствует в количестве приблизительно 1,6% (вес/вес) указанной композиции, и d-лимонен, как правило, присутствует в количестве приблизительно 1,5% (вес/вес) композиции.
[0031] По меньшей мере в одном варианте осуществления предусмотрена фармацевтическая композиция смешанных жирных кислот, в которой а) по меньшей мере 90% по весу композиции составляют длинноцепочечные полиненасыщенные омега-3 жирные кислоты; b) по меньшей мере 80% по весу композиции составляет комбинация (все-Z омега-3)-5,8,11,14,17-эйкозапентаеновой кислоты (ЕРА) и (все-Z омега-3)-4,7,10,13,16,19-докозагексаеновой кислоты (DHA) в весовом соотношении EPA:DHA от 1:1 до 2:1, причем ЕРА составляет от 40 до 60% по весу композиции, и DHA составляет от 25 до 45% по весу композиции; с) по меньшей мере 4,5% по весу композиции составляют омега-3 жирные кислоты, кроме ЕРА и DHA, которые содержат 18, 20, 21 или 22 атома углерода; d) от 1 до 4% по весу композиции составляет (все-Z омега-3)-6,9,12,15,18-генэйкозапентаеновая кислота; е) присутствует по меньшей мере одно поверхностно-активное вещество; и f) композиция представлена в лекарственной форме для перорального применения и включает эффективное количество фармацевтически приемлемого антиоксиданта. Такие композиции могут необязательно дополнительно содержать натуральное апельсиновое масло в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) или практически чистый d-лимонен в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) композиции. Натуральное апельсиновое масло, как правило, присутствует в количестве приблизительно 1,6% (вес/вес) указанной композиции, и d-лимонен, как правило, присутствует в количестве приблизительно 1,5% (вес/вес) композиции.
[0032] Следует отметить, что во всех вариантах осуществления, включающих композиции, описанные в данном документе, общее количество всех ингредиентов, входящих в состав композиции, не превышает 100%.
[0033] В определенных вариантах осуществления предусмотрена фармацевтическая или лекарственная композиция, содержащая ЕРА и DHA в соотношении веса к весу от приблизительно 3,5:1 до приблизительно 5:1 и по меньшей мере одно поверхностно-активное вещество, и где композиция более чем на 84% по весу состоит из комбинированных ЕРА и DHA. Такие композиции могут необязательно дополнительно содержать натуральное апельсиновое масло в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) или практически чистый d-лимонен в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) композиции. Натуральное апельсиновое масло, как правило, присутствует в количестве приблизительно 1,6% (вес/вес) указанной композиции, и d-лимонен, как правило, присутствует в количестве приблизительно 1,5% (вес/вес) композиции.
[0034] Определенные варианты осуществления предусматривают определенные композиции, которые содержат по меньшей мере приблизительно 96% по весу этилэйкозапентаеноата (этил-ЕРА), по меньшей мере одно поверхностно-активное вещество, практически не содержат докозагексаеновую кислоту (DHA) или ее сложные эфиры. Такие композиции могут необязательно дополнительно содержать натуральное апельсиновое масло в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) или практически чистый d-лимонен в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) композиции. Натуральное апельсиновое масло, как правило, присутствует в количестве приблизительно 1,6% (вес/вес) указанной композиции, и d-лимонен, как правило, присутствует в количестве приблизительно 1,5% (вес/вес) композиции.
[0035] По меньшей мере в одном варианте осуществления предусмотрен способ лечения следующих нарушений: метаболического синдрома, дегенерации желтого пятна, дефицита омега-3, когнитивного нарушения, в том числе в результате хирургического вмешательства или травматического повреждения головного мозга (такого как, например, в результате сотрясения мозга), большой депрессии, суицидального поведения, послеродовой депрессии, воспаления, первичного склерозирующего холангита, пограничного расстройства личности у женщин, рака молочной железы, неалкогольной жировой болезни печени, и улучшения когнитивной деятельности и поведения у детей. Данные состояния или нарушения можно лечить путем введения композиций, описанных в данном документе, субъекту, как правило, человеку, нуждающемуся в таком введении.
[0036] По меньшей мере в одном варианте осуществления предусмотрен способ лечения по меньшей мере одного сердечно-сосудистого состояния или нарушения у субъекта, нуждающегося в таком лечении, причем указанный способ включает введение субъекту по меньшей мере одной композиции, описанной в данном документе, которая содержит терапевтически эффективное количество сложных эфиров омега-3 жирных кислот и по меньшей мере одно поверхностно-активное вещество.
[0037] По меньшей мере в одном варианте осуществления предусмотрен способ лечения по меньшей мере одного сердечно-сосудистого состояния или нарушения, например и без ограничений, нарушений в сердце и сосудистой системе, включая, например, гипертензию, гиперлипидемию, гипертриглицеридемию, атеросклероз, транзиторную ишемическую атаку, систолическую дисфункцию, диастолическую дисфункцию, аневризму, расслоение аорты, ишемию миокарда, острый инфаркт миокарда (AMI), острый инфаркт миокарда с подъемом сегмента ST (STEMI), острый инфаркт миокарда без подъема сегмента ST (NSTEMI), стенокардию, нестабильную стенокардию (UA) и стабильную стенокардию (SA), инфаркт миокарда, застойную сердечную недостаточность, дилатационную застойную кардиомиопатию, гипертрофическую кардиомиопатию, рестриктивную кардиомиопатию, легочное сердце, аритмию, порок клапанов сердца, эндокардит, легочную эмболию, венозный тромбоз, заболевание периферических сосудов и заболевание периферических артерий. Способ включает введение субъекту, нуждающемуся в лечении, терапевтически эффективного количества композиции, описанной в данном документе.
[0038] По меньшей мере в одном варианте осуществления предусмотрен способ лечения гипертензии и/или гиперлипидемии.
[0039] По меньшей мере в еще одном варианте осуществления предусмотрен способ лечения гипертриглицеридемии.
[0040] В определенных вариантах осуществления общее количество триглицеридов (TG) в крови субъекта-человека, у которого содержится ≥150 мг TG на дл сыворотки крови в начале применения схемы дозирования, снижается по меньшей мере на 20% в течение приблизительно 30 дней после введения композиций согласно определенным вариантам осуществления, описанным в данном документе.
[0041] По меньшей мере в еще одном варианте осуществления предусмотрен способ лечения субъекта-человека, у которого содержится ≥150 мг TG на дл сыворотки, который нуждается в таком лечении, причем указанный способ включает введение субъекту-человеку композиции согласно по меньшей мере одному варианту осуществления, описанному в данном документе, содержащей терапевтически эффективное количество сложных эфиров омега-3 жирных кислот.
[0042] Также предусмотрены варианты осуществления, где композиции, описанные в данном документе, упакованы вместе в виде набора с инструкциями по применению композиций для лечения сердечно-сосудистых состояний или нарушений.
[0043] В определенных вариантах осуществления поверхностно-активное вещество выбрано из группы, состоящей по меньшей мере из одного неионного поверхностно-активного вещества, катионного поверхностно-активного вещества, анионного поверхностно-активного вещества, цвиттерионного поверхностно-активного вещества или их комбинаций.
[0044] В определенных вариантах осуществления поверхностно-активное вещество выбрано из группы, состоящей по меньшей мере из одного анионного поверхностно-активного вещества, по меньшей мере одного неионного поверхностно-активного вещества и их комбинации.
[0045] В определенных вариантах осуществления, включающих по меньшей мере одно поверхностно-активное вещество, по меньшей мере одно поверхностно-активное вещество характеризуется гидрофильно-липофильным балансом (HLB), составляющим приблизительно 8,0.
[0046] В определенных вариантах осуществления, включающих по меньшей мере одно поверхностно-активное вещество, поверхностно-активное вещество может являться неионным поверхностно-активным веществом, выбранным из группы, состоящей по меньшей мере из одного полисорбата, по меньшей мере одного полоксамера и их комбинации.
[0047] В определенных вариантах осуществления, по меньшей мере одно поверхностно-активное вещество включает полисорбат, присутствующий в количестве от приблизительно 15% вес/вес до приблизительно 31% вес/вес композиции. В определенных вариантах осуществления полисорбат представляет собой полисорбат 80.
[0048] В определенных других вариантах осуществления по меньшей мере одно поверхностно-активное вещество включает полоксамер, присутствующий в количестве от приблизительно 0,1% до приблизительно 5% вес/вес композиции.
[0049] В определенных вариантах осуществления композиции, описанные в данном документе, содержат комбинацию полисорбата 80 и полоксамера Pluronic F87, [(НО(C2H4O)64(С3Н6О)37(C2H4O)64Н].
[0050] В определенных вариантах осуществления композиция дополнительно содержит по меньшей мере один антиоксидант. В таких вариантах осуществления по меньшей мере один антиоксидант выбран из группы, состоящей из токоферола, токотриенола или их комбинаций. В таких вариантах осуществления токоферол, токотриенол или их комбинации присутствуют в количестве от приблизительно 0,01% до приблизительно 5% по весу композиций. В определенных таких вариантах осуществления токоферолы, токотриенолы или их комбинации могут присутствовать в количестве приблизительно 0,01%, 0,05%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5% или 5% по весу композиции. В определенных таких вариантах осуществления токоферолы, токотриенолы или их комбинации могут присутствовать в количестве приблизительно 0,4% по весу композиции. В определенных вариантах осуществления токоферол, токотриенол или комбинации присутствуют в количестве приблизительно 0,4% по весу композиции. В определенных вариантах осуществления, дополнительно включающих по меньшей мере один антиоксидант, антиоксидантом является токоферол в количестве приблизительно 0,4% по весу композиции.
[0051] В определенных вариантах осуществления композиция самостоятельно образует мицеллы в водной среде. В определенных других вариантах осуществления водная среда является водой. В определенных других вариантах осуществления водная среда имеет кислый рН. В определенных других вариантах осуществления водной средой является 0,1 н. HCl.
[0052] В определенных вариантах осуществления композиции, описанные в данном документе, самостоятельно образуют мицеллы в водной среде, где мицеллы имеют диаметр от приблизительно 1 мкм до приблизительно 10 мкм. В определенных вариантах осуществления композиции, описанные в данном документе, самостоятельно образуют мицеллы в водной среде, имеющей кислый рН, где мицеллы имеют диаметр от приблизительно 1 мкм до приблизительно 10 мкм. В определенных других вариантах осуществления композиции, описанные в данном документе, самостоятельно образуют мицеллы в 0,1 н. HCL, где мицеллы имеют диаметр от приблизительно 1 мкм до приблизительно 10 мкм. В определенных вариантах осуществления мицеллы имеют средний диаметр приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мкм.
[0053] В определенных вариантах осуществления композиции, описанные в данном документе, можно вводить с пищей или без пищи субъекту-человеку, нуждающемуся в таком введении, где биодоступность сложных эфиров омега-3 жирных кислот, составляющих композиции, практически не зависит от влияния пищи.
[0054] Определенные варианты осуществления предусматривают композиции, которые минимизируют или устраняют по меньшей мере один побочный эффект за счет введения композиции по настоящему раскрытию по сравнению с введением композиции, содержащей сложные эфиры омега-3 жирных кислот, которая практически не содержит поверхностно-активное вещество. В других вариантах осуществления неограничивающие примеры побочных эффектов включают регургитацию, частую отрыжку, гастроэзофагеальную рефлюксную болезнь (GERD), вздутие живота, увеличение количества кишечных газов, вкус рыбы, рыбный запах изо рта, запах рыбы, тошноту, диарею или их комбинации.
[0055] В определенных вариантах осуществления композиции, описанные в данном документе, содержат d-лимонен или натуральное апельсиновое масло. Такие композиции могут минимизировать или устранять по меньшей мере один побочный эффект за счет введения композиции по настоящему раскрытию по сравнению с введением композиции, содержащей сложные эфиры омега-3 жирных кислот, которая практически не содержит d-лимонен или натуральное апельсиновое масло. В других вариантах осуществления неограничивающие примеры побочных эффектов включают регургитацию, частую отрыжку, гастроэзофагеальную рефлюксную болезнь (GERD), вздутие живота, увеличение количества кишечных газов, вкус рыбы, рыбный запах изо рта, запах рыбы, тошноту, диарею или их комбинации.
[0056] В определенных вариантах осуществления композиции, описанные в данном документе, при введении субъекту-человеку, выбранному из группы, состоящей из индивидуумов, у которых содержится от приблизительно 155 до приблизительно 199 мг TG на дл сыворотки крови, от приблизительно 200 до приблизительно 499 мг TG на дл сыворотки крови и от приблизительно 500 мг или более TG на дл сыворотки крови, снижают указанные уровни TG в сыворотке субъекта по меньшей мере приблизительно на 20%.
[0057] Определенные варианты осуществления композиций, описанных в данном документе, можно вводить субъекту-человеку, нуждающемуся в таком введении, с гиполипидемическим средством, не являющимся сложным эфиром омега-3 жирной кислоты, выбранным из группы, состоящей из ингибиторов всасывания холестерина, секвестрантов желчных кислот/смол, статинов, ниацина и производных, ингибиторов МТР, фибратов и ингибиторов СЕТР.
[0058] В определенных вариантах осуществления композиции, описанные в данном документе, могут снижать общее количество TG в сыворотке крови субъекта-человека, подвергаемого лечению по поводу гипертриглицеридемии, по меньшей мере приблизительно на 20% в течение приблизительно 30 дней введения композиции, где показатели крови субъекта-человека составляют ≥150 мг TG на дл сыворотки крови в начале применения схемы дозирования.
[0059] По меньшей мере в одном варианте осуществления композиции, описанные в данном документе, можно вводить перорально или парентерально в пригодной лекарственной форме. При пероральном введении композиции, описанные в данном документе, можно вводить, как правило, но не обязательно, в форме желатиновых капсул или капсул с жидкостью.
[0060] В определенных других вариантах осуществления предусмотрены способы введения по меньшей мере приблизительно 0,5 г/сутки композиций согласно определенным вариантам осуществления, описанным в данном документе, которые содержат от приблизительно 40% до приблизительно 85% по весу композиции по меньшей мере одного сложного эфира ЕРА, и по меньшей мере одного сложного эфира DHA в соотношении более чем 2:1, но не более чем 3,4:1, и по меньшей мере одно поверхностно-активное вещество. Как правило, но не обязательно, сложный эфир представляет собой сложный этиловый эфир, и по меньшей мере одно поверхностно-активное вещество представляет собой полисорбат 80, Pluronic F87 или их комбинацию. В определенных таких вариантах осуществления сложные этиловые эфиры ЕРА и DHA в сумме составляют приблизительно 50% (вес/вес) указанной композиции. Необязательно композиция может дополнительно содержать практически чистый d-лимонен или натуральное апельсиновое масло.
[0061] В определенных других вариантах осуществления предусмотрены способы введения по меньшей мере приблизительно 4 г/сутки композиций согласно определенным вариантам осуществления, описанным в данном документе, которые содержат этилэйкозапентаеновую кислоту (этил-ЕРА), по меньшей мере одно поверхностно-активное вещество и практически не содержат докозагексаеновую кислоту (DHA), где этил-ЕРА составляет по меньшей мере приблизительно 96% по весу от общего количества сложных эфиров омега-3 жирных кислот в композиции. В определенных вариантах осуществления такие композиции могут дополнительно содержать натуральное апельсиновое масло или практически чистый d-лимонен.
[0062] Определенные варианты осуществления предусматривают применение композиций, описанных в данном документе, в изготовлении лекарственного препарата для лечения сердечно-сосудистого заболевания или нарушения. В определенных вариантах осуществления сердечно-сосудистым заболеванием или нарушением является гиперлипидемия. В определенных других вариантах осуществления сердечно-сосудистое заболевание или нарушение является гиперхолестеринемией. В определенных вариантах осуществления сердечнососудистым заболеванием или нарушением является гипертриглицеридемия.
[0063] Определенные варианты осуществления предусматривают применение композиций, описанных в данном документе, в изготовлении лекарственного препарата для лечения сердечно-сосудистого заболевания или нарушения. В определенных вариантах осуществления сердечно-сосудистым заболеванием или нарушением является гиперлипидемия. В определенных других вариантах осуществления сердечно-сосудистым заболеванием или нарушением является гиперхолестеринемия. В определенных вариантах осуществления сердечнососудистым заболеванием или нарушением является гипертриглицеридемия.
[0064] В определенных вариантах осуществления введение композиций, описанных в данном документе, предусматривает концентрацию комбинированных по меньшей мере одного сложного эфира ЕРА и по меньшей мере одного сложного эфира DHA в сыворотке крови субъекта-человека по меньшей мере приблизительно 20 нмоль/мл в течение приблизительно четырех часов после введения определенных вариантов осуществления.
[0065] Также предусмотрены наборы, содержащие композиции сложных эфиров омега-3 жирных кислот в виде одной или нескольких единичных лекарственных форм вместе с инструкциями по применению лекарственных форм. В определенных вариантах осуществления лекарственные формы, описанные в данном документе, могут быть упакованы в виде блистерных упаковок или во флаконах с инструкциями по применению лекарственных форм. Например, инструкции могут предоставляться в виде листка-вкладыша в упаковке или непосредственно на этикетке, прикрепленной к блистерной упаковке, флакону, или на вторичной упаковке, в которой блистерная упаковка или флакон предоставлены субъекту-человеку. Инструкции могут включать, например, частоту введения, необходимость введения лекарственных форм с пищей или без пищи, активные ингредиенты, составляющие лекарственные формы, и сердечно-сосудистые состояния или нарушения, в отношении которых будет достигнут благоприятный эффект при введении лекарственных форм.
[0066] В определенных вариантах осуществления предусмотрены наборы, где определенные лекарственные формы, содержащие композиции, описанные в данном документе, могут быть упакованы вместе с другими гиполипидемическими средствами, не являющимися сложными эфирами омега-3 жирных кислот. Набор (наборы), содержит одну или несколько единичных лекарственных форм в соответствии с определенными вариантами осуществления композиций, описанных в данном документе, вместе с одной или несколькими единичными лекарственными формами, содержащими гиполипидемические средства, не являющиеся сложными эфирами омега-3 жирных кислот, вместе с инструкциями по применению лекарственных форм.
[0067] Определенные варианты осуществления предусматривают функциональный пищевой продукт (продукты) для лечения и/или предупреждения CVD, содержащий композиции, описанные в данном документе.
[0068] Определенные варианты осуществления предусматривают способы лечения CVD путем введения функционального пищевого продукта, содержащего композиции, описанные в данном документе.
[0069] Определенные варианты осуществления предусматривают функциональный пищевой продукт (продукты), содержащий композиции, описанные в данном документе, и способы лечения гипертриглицеридемии у субъекта-человека.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0070] На фигуре 1 показана микрофотография варианта осуществления. Получили содержащую мицеллы композицию, описанную в данном документе, поместили между предметным и покровным стеклом, изучали при 40-кратном увеличении с использованием тринокулярной насадки модели Nikon (Nikon Model Trinocular Head) и цифровой камеры Spot RT3 и измеряли диаметры нескольких репрезентативных мицелл.
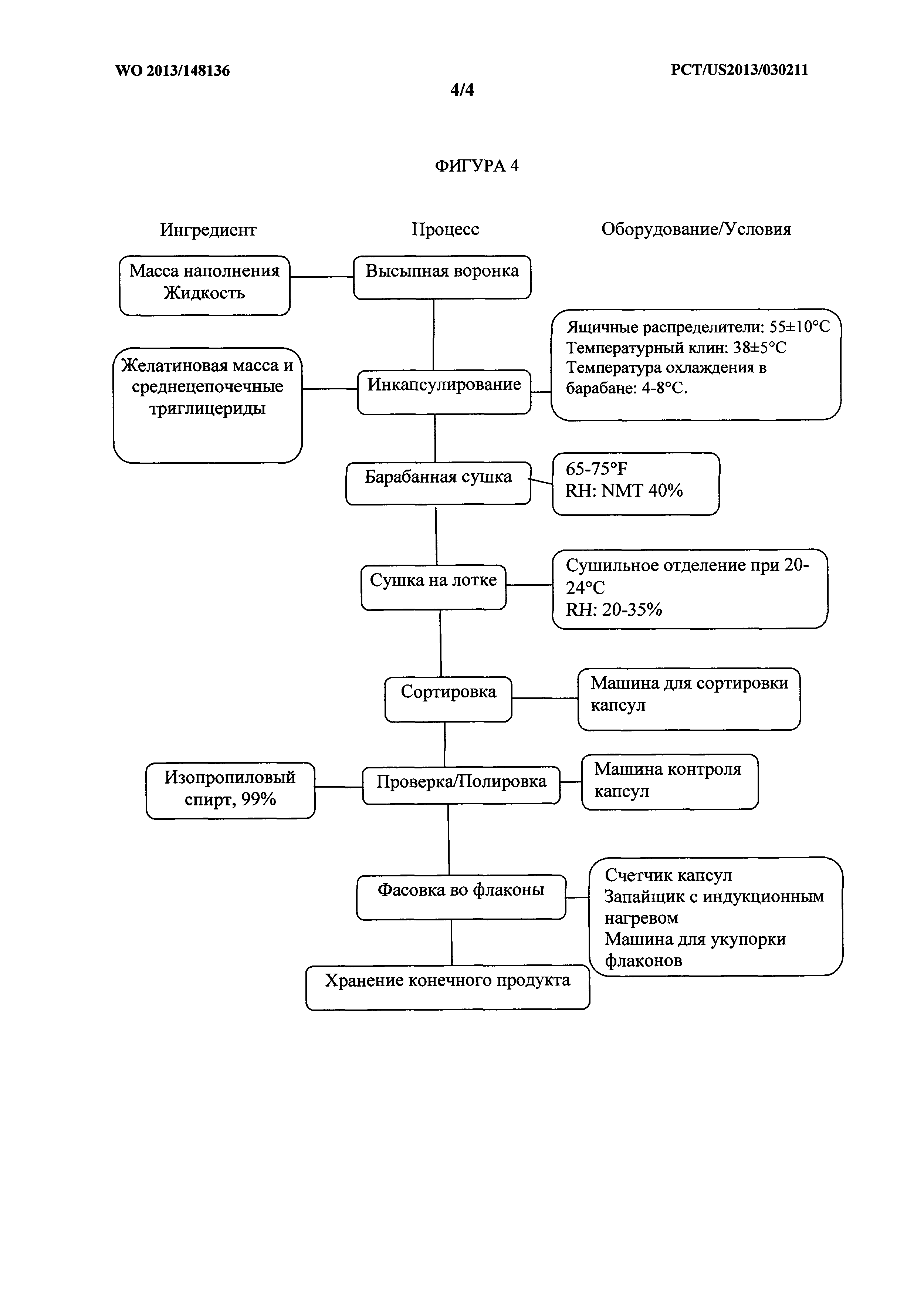
[0071] На фигуре 2 показана блок-схема процесса изготовления одного варианта осуществления композиций, описанных в данном документе.
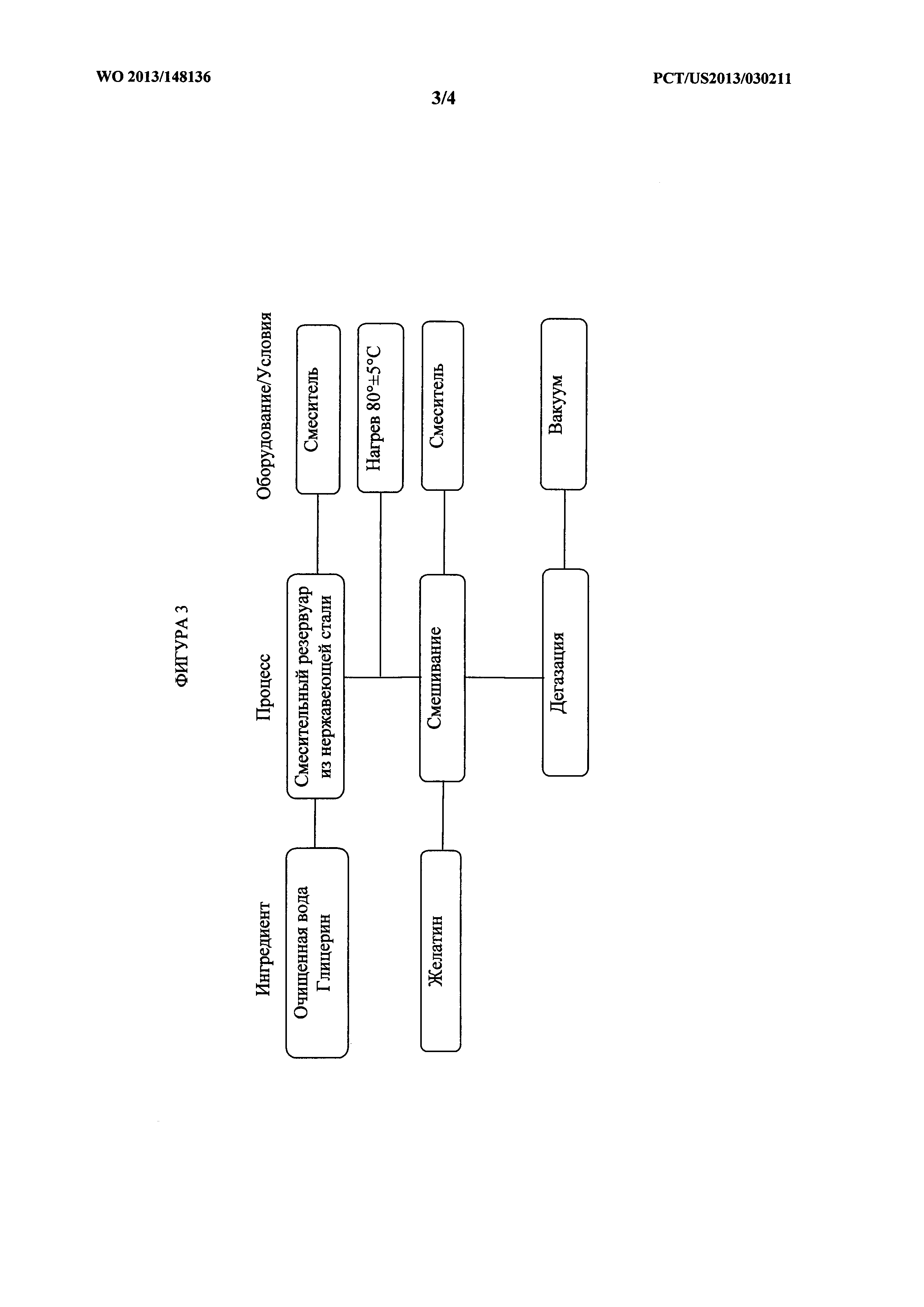
[0072] На фигуре 3 показана блок-схема процесса изготовления гелевой массы для инкапсулирования одного варианта осуществления композиций, описанных в данном документе.
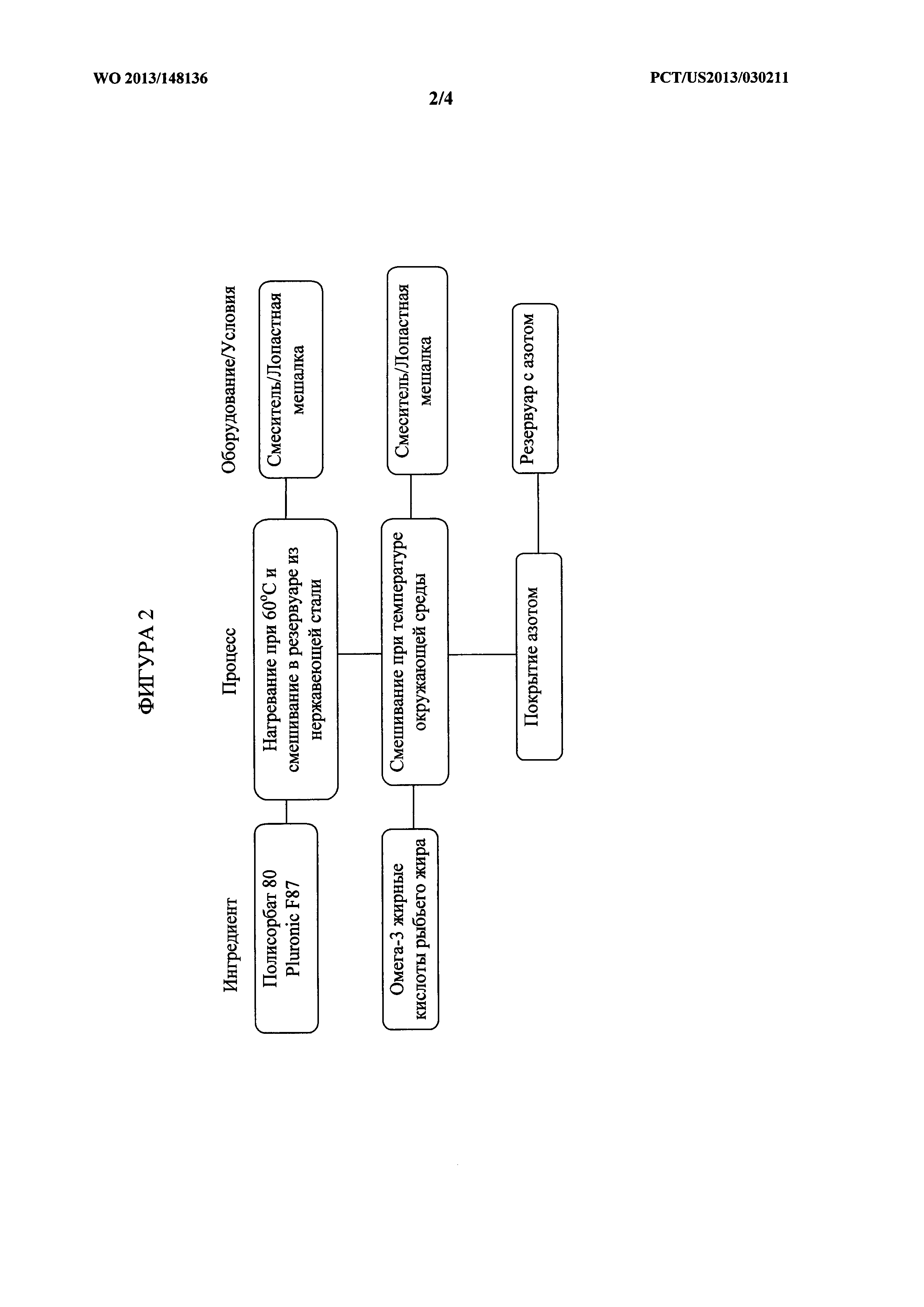
[0073] На фигуре 4 показана блок-схема процесса инкапсулирования для изготовления одной лекарственной формы, содержащей один вариант осуществления композиций описанных в данном документе.
ПОДРОБНОЕ ОПИСАНИЕ
[0074] Определенные аспекты, методы, варианты осуществления, вариации и признаки настоящего изобретения описаны в данном документе с различной степенью детализации для обеспечения дополнительного понимания вариантов осуществления, касающихся композиций, содержащих сложные эфиры омега-3 жирных кислот, и способов, касающихся применения таких композиций, содержащих высокую концентрацию сложных эфиров омега-3 жирных кислот. В определенных вариантах осуществления сложный эфир ЕРА и сложный эфир DHA присутствуют в определенных весовых процентных соотношениях и относительных количествах. Как уже отмечалось, данные композиции оказывают благоприятный эффект в отношении определенных факторов риска CVD, включая снижение уровня триглицеридов и холестерина в сыворотке крови.
ОПРЕДЕЛЕНИЯ
[0075] Применяемый в данном документе выражение "композиция (композиции)" или "состав (составы)" включает терапевтические и диетические композиции, включая, но без ограничений, пищевую добавку, нутрицевтический состав или фармацевтический состав. Дополнительно, выражения "композиция", "пищевая добавка", "нутрицевтический состав" или "фармацевтический состав" применяются в данном документе взаимозаменяемо.
[0076] Применяемое в данном документе выражение "ЕРА" относится включительно к (5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентеновой кислоте или ее производным, включая алкиловые сложные эфиры, такие как, например, этиловый сложный эфир.
[0077] Применяемое в данном документе выражение "DHA" включительно относится к (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеновой кислоте или ее производным, включая алкиловые сложные эфиры, такие как, например, этиловый сложный эфир.
[0078] Применяемое в данном документе выражение "мицелла" (во множественном числе "мицеллы") относится к скоплению молекул, которые формируют приблизительно сферическую структуру ядро/оболочка и суспендированы в водной фазе. Типичная мицелла в водном растворе образует агрегат с гидрофильными участками-"головками" в контакте с окружающим растворителем и/или в контакте с полярным участком одного или нескольких поверхностно-активных веществ, соединяя гидрофобные участки в центре мицеллы. Мицеллы имеют примерно сферическую форму.
[0079] Выражение "самостоятельно образует мицеллы", применяемое в данном документе, относится к процессу, в котором мицеллы образуются в водной среде без применения энергии, в том числе встряхивания или усилия сдвига.
[0080] Применяемое в данном документе выражение "водная среда" относится к любому раствору или суспензии, которая содержит воду, включая, например, без ограничений воду саму по себе; фосфатно-солевой буферный раствор с рН 7,4, Sprite, яблочный сок, фруктовый пунш G-2 и шоколадное молоко. В определенных вариантах осуществления водная среда включает по меньшей мере одну жидкость, имеющую кислый рН. В определенных других вариантах осуществления водная среда включает биологическую жидкость, такую как, например и без ограничения, желудочный сок. В других вариантах осуществления водная среда включает искусственный желудочный сок, содержащий 0,1 н. HCl.
[0081] Применяемое в данном документе выражение "свободная жирная кислота" относится к одной или нескольким полиненасыщенным жирным кислотам, которые не были модифицированы или не содержат никакие другие присоединенные группы.
[0082] Применяемое в данном документе выражение "сложный эфир" относится к замещению водорода в группе карбоновой кислоты молекулы полиненасыщенной жирной кислоты другим заместителем. Специалистам в данной области известны типичные сложные эфиры, рассмотрение которых приводится в Higuchi, T. et al., Pro-drugs as Novel Delivery Systems, Vol. 14, A.C.S. Symposium Series, Bioreversible Carriers in Drug Design, Ed. Edward B. Roche, Amer. Pharma. Assoc., Pergamon Press (1987), и Protective Groups in Organic Chemistry, McOmie ed., Plenum Press, New York (1973), каждый из которых включен в данный документ во всей полноте посредством ссылки. Примеры распространенных сложных эфиров включают метиловый, этиловый, трихлорэтиловый, пропиловый, бутиловый, пентиловый, трет-бутиловый, бензиловый, нитробензиловый, метоксибензиловый, бензгидриловый, моноглицерид, диглицерид, триглицерид.
[0083] Применяемое в данном документе выражение "моноглицерид" относится к цепи жирной кислоты, такой как молекула DHA или ЕРА, ковалентно связанной с молекулой глицерина посредством сложноэфирной связи. Применяемое в данном документе выражение "диглицерид" относится к цепи жирной кислоты, такой как DHA или ЕРА, ковалентно связанной с молекулой глицерина посредством сложноэфирной связи, где молекула глицерина дополнительно связана с одной дополнительной цепью жирной кислоты, которой может являться либо может не являться DHA или ЕРА, посредством одной дополнительной сложноэфирной связи. Применяемое в данном документе выражение "триглицерид" относится к цепи жирной кислоты, такой как DHA или ЕРА, ковалентно связанной с молекулой глицерина посредством сложноэфирной связи, где молекула глицерина дополнительно связана с двумя дополнительными цепями жирных кислот, любой или обеими из которых могут являться либо могут не являться DHA или ЕРА, посредством двух дополнительных сложноэфирных связей.
[0084] Применяемое в данном документе выражение "терпен" относится к большому и разнообразному классу органических соединений, вырабатываемых различными растениями, в частности хвойными. Если терпены модифицированы химически, например, путем окисления или перегруппировки углеродного скелета, получаемые в результате соединения обычно называют "терпеноиды" (например, карвон). Терпены и терпеноиды являются основными составляющими эфирных масел многих видов растений и цветов.
[0085] Каждое из применяемых в данном документе выражений "α-токоферол", "токоферол" и "витамин Е" относится к ряду токоферолов и токотриенолов, которые являются жирорастворимыми витаминами с антиоксидантными свойствами.
[0086] Применяемое в данном документе выражение "антиоксидант" относится к молекуле, способной ингибировать окисление других молекул. Окисление является химической реакцией, при которой происходит перенос электронов или водорода от вещества на окислитель. В результате реакций окисления могут образовываться свободные радикалы. В свою очередь, данные радикалы могут начинать цепные реакции. Когда в клетке происходит цепная реакция, она может привести к повреждению или гибели клетки. Антиоксиданты останавливают такие цепные реакции путем удаления свободнорадикальных промежуточных продуктов и ингибируют другие реакции окисления. Они осуществляют это, окисляясь сами, таким образом, антиоксидантами часто являются восстановители, такие как тиолы, аскорбиновая кислота или полифенолы. Типичные антиоксиданты включают розмариновое масло, аскорбиновую кислоту (витамин С), глутатион, липоевую кислоту, мочевую кислоту, каротины, мелатонин, убихинол (коэнзим Q), α-токоферол (витамин Е), аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, монотиоглицерин и метабисульфит калия.
[0087] Применяемое в данном документе выражение фармацевтически приемлемый "носитель" относится к любому веществу, пригодному в качестве связующего вещества для доставки молекулы или композиции к пригодному in vivo месту абсорбции. Примеры таких носителей включают, но без ограничений, воду, фосфатно-солевой буферный раствор (PBS), раствор Рингера, раствор декстрозы, растворы, содержащие сыворотку, раствор Хэнка и другие водные физиологически сбалансированные растворы.
[0088] Фармацевтически приемлемый "консервант", как применяется в данном документе, включает, но без ограничений, сорбат калия, метилпарабен, пропилпарабен, бензойную кислоту и ее соли, другие сложные эфиры парагидроксибензойной кислоты, такие как бутилпарабен, спирты, такие как этиловый или бензиловый спирт, фенольные соединения, такие как фенол, или четвертичные соединения, такие как хлорид бензалкония.
[0089] "Краситель", как применяется в данном документе, осуществляет окрашивание композиции или лекарственной формы. Такие красители включают пищевые красители.
[0090] Применяемое в данном документе выражение "субъект" относится к млекопитающему, включая, но без ограничений, собаку, кошку, лошадь, корову, свинью, овцу, козу, курицу, грызуна, примата или человека. Субъекты включают таких животных, как домашние животные (например, собаки, кошки и т.п.), субъекты-сельскохозяйственные животные (например, коровы, лошади, свиньи, куры и т.д.), субъекты-лабораторные животные (например, мыши, крысы, кролики и т.д.), но не ограничиваются ими. Субъект-человек может являться субъектом детского возраста, взрослого возраста или старческого возраста. Субъект-человек может принадлежать к любому полу.
[0091] Применяемые в данном документе выражения "сердечно-сосудистое заболевание" и "сердечно-сосудистое состояние" включают нарушения в сердце и сосудистой системе, в том числе, например, гипертензию, гиперлипидемию, гипертриглицеридемию, атеросклероз, транзиторную ишемическую атаку, систолическую дисфункцию, диастолическую дисфункцию, аневризму, расслоение аорты, ишемию миокарда, острый инфаркт миокарда (AMI), острый инфаркт миокарда с подъемом сегмента ST (STEMI), острый инфаркт миокарда без подъема сегмента ST (NSTEMI), стенокардию, нестабильную стенокардию (UA) и стабильную стенокардию (SA), инфаркт миокарда, застойную сердечную недостаточность, дилатационную застойную кардиомиопатию, гипертрофическую кардиомиопатию, рестриктивную кардиомиопатию, легочное сердце, аритмию, порок клапанов сердца, эндокардит, легочную эмболию, венозный тромбоз, заболевание периферических сосудов и заболевание периферических артерий.
[0092] Гипертриглицеридемия, например, является состоянием, связанным с сердечно-сосудистым заболеванием, при котором концентрации триглицеридов в сыворотке крови натощак составляют ≥150 мг/дл. Концентрации в крови могут увеличиваться от умеренно высоких уровней 200 мг/дл до 500 мг/дл или, в тяжелых случаях, более 500 мг/дл. Американская кардиологическая ассоциация классифицировала концентрации триглицеридов как "нормальные" (менее 150 мг/дл), "повышенные" (150-199 мг/дл), "высокие" (200-499 мг/дл) и "очень высокие" (более 500 мг/дл). Специалисту в данной области будет очевидно, что классификация гипертриглицеридемии может варьировать в разных странах. Например, канадские и европейские руководства предлагают уровни триглицеридов в сыворотке крови натощак менее 1,7 ммоль/л считать "желательными", от 1 до 2,2 ммоль/л "погранично высокими" и от 2,3 до 5,6 ммоль/л "высокими", а более 5,6 ммоль/л - "очень высокими". Специалисту в данной области также будет понятно, что являющиеся повышенными уровни триглицеридов в сыворотке крови могут варьировать в зависимости от возраста и пола.
[0093] Как применяется в данном документе, "эффективное количество" или "терапевтически эффективное количество" композиции, которое описано в некоторых вариантах осуществления в данном документе, может являться количеством, достаточным для достижения желаемого терапевтического и/или профилактического эффекта, например, количеством, которое приводит к предупреждению или уменьшению симптомов, связанных с заболеванием, лечение которое осуществляют. Количество композиции, которое вводят субъекту, в частности, субъекту, нуждающемуся в композиции, может зависеть от типа и тяжести заболевания и от характеристик индивидуума, таких как общее состояние здоровья, возраст, пол, вес тела и переносимость лекарственных средств. Специалист в данной области сможет определить соответствующие дозы в зависимости от данных и других факторов. Как правило, эффективное количество композиций, описанных в данном документе, может быть достаточным для достижения терапевтического или профилактического эффекта.
[0094] Выражения "единица дозы", "однократная доза" и "единица дозирования", применяемые в данном документе, относятся к части композиции, которая содержит эффективное количество активного ингредиента, пригодное для однократного введения для обеспечения или увеличения терапевтического эффекта. Такие единицы дозирования можно вводить от одного до нескольких (т.е. от 1 до приблизительно 10, от 1 до 8, от 1 до 6, от 1 до 4 или от 1 до 2) раз в день или столько раз, сколько необходимо для того, чтобы вызвать терапевтический ответ.
[0095] Выражение "влияние пищи", применяемое в данном документе, относится к относительной разнице в AUC (площадь под кривой), Cmax (максимальная концентрация в плазме) и/или Tmax (время достижения максимальной концентрации) активного вещества при пероральном введении указанного вещества или его композиции, такой как таблетка, капсула или жидкость, субъекту одновременно с пищей или в сытом состоянии по сравнению с такими же значениями при введении этой же композиции натощак. Влияние пищи, F, рассчитывают как:
F (Yв сытом состоянии-Yнатощак)/Yнатощак,
где Yв сытом состоянии и Υнатощак являются найденными значениями AUC, Cmax или Tmax в сытом состоянии и натощак, соответственно. Влияние пищи, F, как правило, устанавливают при F>1.
[0096] В целом, выражение "AUC" или "площадь под кривой зависимости концентрации в плазме от времени" относится к общему количеству активного ингредиента, измеряемому в системном кровотоке после введения разовой дозы. AUC является математическим и визуальным представлением суммарного количества активного ингредиента в системном кровотоке в течение определенного периода времени. Изменения AUC не обязательно отражают изменения общего количества абсорбированного активного ингредиента, но могут отражать изменения в кинетике распределения, метаболизма и выведения. Соответственно, выражение AUC, применяемое в данном документе, относится к общему количеству омега-3 жирных кислот, измеряемому в системном кровотоке после введения разовой дозы любой из композиций, описанных в данном документе.
[0097] Выражение "Tmax" или "время достижения максимальной концентрации" относится к периоду времени, необходимому для достижения максимальной концентрации активного ингредиента в плазме после введения разовой дозы. Соответственно, выражение "Tmax", применяемое в данном документе, относится к периоду времени, необходимому для достижения максимальной концентрации сложных эфиров омега-3 жирных кислот в плазме после введения однократной дозы любой из композиций, описанных в данном документе.
[0098] Выражение "Cmax" или "максимальная концентрация" означает наивысшую концентрацию активного ингредиента, достигаемую в плазме крови. Соответственно, выражение "Cmax", применяемое в данном документе, относится к максимальной концентрации сложных эфиров омега-3 жирных кислот после введения разовой дозы любой из композиций, описанных в данном документе.
[0100] Выражение "практически не зависит от влияния пищи" или "практически свободен от влияния пищи", применяемое в данном документе, относится к существенному устранению влияния пищи на абсорбцию (например, F составляет приблизительно 0) после перорального введения любой из композиций, описанных в данном документе. Другими словами, биодоступность сложных эфиров омега-3 жирных кислот, измеряемая с помощью логарифм-трансформированных значений AUC, практически неизменна, независимо от того, вводятся ли композиции, описанные в данном документе, с пищей или без пищи. В определенных вариантах осуществления фармакологические эффекты введения композиций, описанных в данном документе, практически не зависят от влияния пищи.
[0101] Выражение "сниженное влияние пищи", применяемое в данном документе, относится к существенному снижению влияния пищи на абсорбцию после перорального введения любой из описанных композиций. В определенных вариантах осуществления композиции, описанные в данном документе, характеризуется сниженным влиянием пищи.
[0102] Выражение "одновременно с пищей" или "введение в сытом состоянии", применяемое в данном документе, относится к введению от приблизительно 30 минут до еды до приблизительно 1 часа после еды.
[0103] Подразумевается, что различные режимы лечения или предупреждения медицинских состояний, которые описаны в данном документе, означают "существенное" или "практически", что включает полное, но также и менее чем полное лечение или предупреждение, и где достигается некий значимый с биологической или медицинской точки зрения результат. Субъект, такой как субъект-человек, нуждающийся в лечении, обозначает субъекта, нуждающегося в лечении определенного болезненного состояния или нуждающегося в превентивном лечении (т.е. профилактике) такого болезненного состояния.
[0104] Выражение "приблизительно" или "примерно", применяемое в данном документе, означает в пределах допустимого диапазона ошибок для конкретного значения, определенного специалистом в данной области, которое будет зависеть отчасти от того, как значение измеряется или определяется, т.е. ограничений системы измерения. При описании конкретных значений в заявке и формуле изобретения, если не указано иное, выражение "приблизительно" означает в пределах допустимого диапазона ошибок для конкретного значения.
[0105] Выражение "активный (активные)", "активный ингредиент (ингредиенты)", "действующие вещества" или "фармацевтически активный ингредиент" означает химическое соединение, предназначенное для обеспечения фармакологической активности или для оказания иным образом непосредственного влияния на диагностику, устранение, ослабление, лечение или предупреждение заболевания или для оказания непосредственного влияния на восстановление, коррекцию или изменение физиологических функций у субъекта.
[0106] Выражение "функциональный пищевой продукт", применяемое в данном документе, означает любые годные к употреблению в пищу или для питья продукты или пищевые компоненты (например, соки, молоко, йогурт, масло, маргарин, продукты выпечки), которые обогащены или улучшены посредством любой из композиций, описанных в данном документе. Функциональный пищевой продукт может быть, например, твердым, жидким, полутвердым или их комбинацией. Выражение "функциональный пищевой продукт" также охватывает годные к употреблению в пищу или для питья пищевые добавки.
[0107] Выражение "гидрофильно-липофильный баланс" или "HLB," применяемое в данном документе, относится к относительной аффинности вещества или композиции к водной и масляной фазам. Значения HLB можно рассчитать на основе способов и уравнений, известных специалистам в данной области, таких как те, которые описаны в патенте США №5585192. Вещества или композиции обычно характеризуются средним HLB от приблизительно 6 до приблизительно 20. Значения гидрофильно-липофильного баланса можно определить с помощью различных формул или экспериментальных способов, приведенных, например, в патенте США №5585192.
[0108] Выражение "практически чистый", применяемое в данном документе, означает характеризующийся по меньшей мере 90% чистоты.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
[0109] По меньшей мере в одном варианте осуществления предусмотрена композиция, где композиция содержит по меньшей мере один сложный эфир омега-3 жирной кислоты, по меньшей мере одно поверхностно-активное вещество, и где композиция самостоятельно образует мицеллы при контакте с водной средой. В определенных вариантах осуществления указанный по меньшей мере один сложный эфир омега-3 жирной кислоты составляет от приблизительно 40% (вес/вес) до приблизительно 85% (вес/вес) композиции. В определенных вариантах осуществления по меньшей мере один сложный эфир омега-3 жирной кислоты составляет приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80% или 85% (вес/вес) композиции.
[0110] В определенных вариантах осуществления композиции, описанные в данном документе, самостоятельно образуют мицеллы в 0,1 н. HCl. Общепризнано, что 0,1 н. HCl (искусственный желудочный сок) служит в качестве показателя, представляющего значение кислотности содержимого желудка. Соответственно, и не будучи связанными теорией, полагают, что композиции, описанные в данном документе, могут самостоятельно образовывать мицеллы in situ в желудке или тонком кишечнике. В определенных вариантах осуществления композиции, описанные в данном документе, более успешно и эффективно доставляют сложные эфиры омега-3 жирных кислот через кишечный тракт при введении с пищей или без пищи.
[0111] Определенные варианты осуществления предусматривают применение сложных эфиров омега-3 жирных кислот. Соответственно, в одном аспекте предусмотрена композиция, содержащая по меньшей мере один сложный эфир (5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентеновой кислоты (EPA) или по меньшей мере один сложный эфир (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеновой кислоты (DHA); или их комбинацию, где композиция характеризуется соотношением сложного эфира ЕРА и сложного эфира DHA от более чем 2,0:1,0 до не более чем 3,4:1,0 и практически не содержит активные ингредиенты, кроме указанных сложных эфиров омега-3 жирных кислот. В определенных вариантах осуществления сложные эфиры омега-3 жирных кислот в указанной композиции включают сложные этиловые эфиры омега-3 жирных кислот. В определенных вариантах осуществления сложные эфиры ЕРА и DHA составляют по меньшей мере от приблизительно 40% до приблизительно 95% (вес/вес) от общего количества сложных эфиров омега-3 жирных кислот в композиции. В определенных вариантах осуществления сложные эфиры ЕРА и DHA составляют приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% (вес/вес) от общего количества сложных эфиров омега-3 жирных кислот в композиции.
[0112] Обнаружено что композиции, содержащие сложные эфиры омега-3 жирных кислот, характеризующиеся соотношением алкил(5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентеноата и алкил(4Z,7Z,10Ζ,13Ζ,16Ζ,19Z)-докоза-4,7,10,13,16,19-гексаеноата (EPA:DHA) от более чем 2,0:1,0 до не более чем 3,4:1,0, являются эффективными для снижения концентраций TG в сыворотке крови. В определенных вариантах осуществления сложные эфиры ЕРА и DHA составляют по меньшей мере 40% от общего количества сложных эфиров омега-3 жирных кислот в композиции. В определенных вариантах осуществления сложные эфиры ЕРА и DHA составляют приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% от общего количества сложных эфиров омега-3 жирных кислот в композиции. Также обнаружено, что композиции, содержащие сложные эфиры омега-3 жирных кислот, характеризующиеся от более чем приблизительно 2,0: 1,0 до не более чем 3,4:1,0 (сложных эфиров EPA:DHA), можно вводить в состав с одним или несколькими поверхностно-активными веществами для получения композиций, которые самостоятельно образуют мицеллы в водной среде. Мицеллы обычно являются однородно сферическими и стабильными и обеспечивают абсорбцию сложных эфиров омега-3 жирных кислот практически независимо от любого влияния пищи. На основании наблюдения, что композиции, описанные в данном документе, самостоятельно образуют мицеллы в 0,1 н. HCl, считается, что композиции, описанные в данном документе, также будут самостоятельно образовывать мицеллы в желудке или тонком кишечнике. В определенных вариантах осуществления такие композиции обеспечивают предпочтительные профили доставки лекарственных средств для сложных эфиров омега-3 жирных кислот.
[0113] В определенных вариантах осуществления композиции, описанные в данном документе, содержащие сложные эфиры ЕРА и DHA, устраняют многие из побочных эффектов, обычно связанных с введением сложных эфиров омега-3 жирных кислот. Таким образом, композиции, описанные в данном документе, содержащие сложные эфиры ЕРА и DHA, не имеют неприятного запаха, и/или не дают неприятного привкуса, и/или не вызывают отрыжку у пациента. В другом аспекте предусмотрена композиция, содержащая, по меньшей мере один сложный эфир (5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентеновой кислоты (ЕРА) или по меньшей мере один сложный эфир (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеновой кислоты (DHA) или их комбинацию, где композиция характеризуется соотношением сложного эфира ЕРА и сложного эфира DHA от более чем приблизительно 2,0:1,0 до не более чем приблизительно 3,4:1,0, и по меньшей мере одно поверхностно-активное вещество; где указанный сложный эфир ЕРА, сложный эфир DHA или их комбинация составляет по меньшей мере 40% от общего количества сложных эфиров омега-3 жирных кислот в указанной композиции. В определенных вариантах осуществления сложные эфиры омега-3 жирных кислот в указанной композиции составляют сложные эфиры омега-3 жирных кислот. В определенных вариантах осуществления сложные эфиры ЕРА и DHA составляют по меньшей мере от приблизительно 40% до приблизительно 95% от общего количества сложных эфиров омега-3 жирных кислот в композиции. Соответственно, в определенных вариантах осуществления сложные эфиры ЕРА и DHA составляют приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% от общего количества сложных эфиров омега-3 жирных кислот в композиции.
[0114] В определенных вариантах осуществления соотношение сложного эфира жирной кислоты ЕРА и сложного эфира DHA составляет от более чем 2,0:1,0 до не более чем 3,4:1.0. В определенных вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,0:1 до приблизительно 3,4:1.0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,0:1,0 до приблизительно 3,0:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,0:1,0 до приблизительно 2,7:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,0:1,0 до приблизительно 2,5:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,0:1,0 до приблизительно 2,4:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,1:1,0 до приблизительно 2,3:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,1:1,0 до приблизительно 2,2:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет приблизительно 2,4:1,0.
[0115] В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 2,0:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 2,1:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 2,15:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 2,2:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 2,3:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 2,4:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 2,5:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 2,6:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 2,7:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 2,8:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 2,9:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 3,0:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 3,1:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 3,2:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 3,3:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет приблизительно 3,4:1,0.
[0116] В определенных вариантах осуществления композиции, описанные в данном документе, содержат сложный эфир омега-3 жирной кислоты, выбранной по меньшей мере из одной из следующих: гексадекатриеновой кислоты ("ΗΤΑ" или 16:3 (n-3) или все-Z-7,10,13-гексадекатриеновой кислоты), а-линоленовой кислоты ("ALA" или 18:3 (n-3) или все-Z-9,12,15-октадекатриеновой кислоты), стеаридоновой кислоты ("SDA" или 18:4 (n-3) или все-Z-6,9,12,15-октадекатетраеновой кислоты), эйкозатриеновой кислоты ("ETE" или 20:3 (n-3) или все-Z-11,14,17-эйкозатриеновой кислоты), эйкозатетраеновой кислоты ("ЕТА" или 20:4 (n-3) или все-Z-8,11,14,17-эйкозатетраеновой кислоты), эйкозапентаеновой кислоты ("ЕРА" или 20:5 (n-3) или все-Z-5,8,11,14,17-эйкозапентаеновой кислоты), генэйкозапентаеновая кислоты ("ΗΡΑ" или 21:5 (n-3) или все-2-6,9,12,15,18-генэйкозапентаеновая кислоты), докозапентеновой кислоты ("DPA", или клупанодоновой кислоты или 22:5 (n-3), или все-Z-7,10,13,16,19-докозапентеновой кислоты); докозагексаеновой кислоты ("DHA" или 22:6 (n-3) или все-Z-4,7,10,13,16,19-докозагексаеновой кислоты), тетракозапентаеновой кислоты (24:5 (n-3) или все-Z-9,12,15,18,21-тетракозапентаеновой кислоты), тетракозагексаеновой кислоты (низиновой кислоты или 24:6 (n-3) или все-Z-6,9,12,15,18,21-тетракозагексаеновой кислоты). В определенных вариантах осуществления, предусмотренных в данном документе, сложные эфиры включают сложный эфир (5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентеновой кислоты (ЕРА), сложный эфир (4Z,7Z,10Z,13Z,16Z,19Z)-доказа-4,7,10,13,16,19-гексаеновой кислоты (DHA) или их комбинацию. В определенных вариантах осуществления сложные эфиры являются сложными этиловыми эфирами. В определенных вариантах осуществления сложные эфиры представляют собой один сложный эфир омега-3 жирной кислоты. В определенных вариантах осуществления сложные эфиры являются комбинациями различных сложных эфиров омега-3 жирных кислот, таких как перечисленные в настоящем документе. В определенных вариантах осуществления также могу присутствовать другие жирные кислоты или пищевые масла.
[0117] В определенных вариантах осуществления указанный сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 40% (вес/вес) указанной композиции. В определенных вариантах осуществления указанный сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 45% (вес/вес) указанной композиции. В определенных вариантах осуществления указанный сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 50% (вес/вес) указанной композиции. В других вариантах осуществления указанный сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 55% (вес/вес) указанной композиции. В других вариантах осуществления указанный сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 60% (вес/вес) указанной композиции. В других вариантах осуществления указанный сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 65% (вес/вес) указанной композиции. В других вариантах осуществления указанный сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 70% (вес/вес) указанной композиции. В других вариантах осуществления указанный сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 75% (вес/вес) указанной композиции. В других вариантах осуществления сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 80% (вес/вес) указанной композиции. В других вариантах осуществления сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 85% (вес/вес) указанной композиции. В других вариантах осуществления сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 90% (вес/вес) указанной композиции. В других вариантах осуществления сложный эфир (сложные эфиры) омега-3 жирной кислоты составляет приблизительно 95% (вес/вес) указанной композиции.
[0118] В определенных вариантах осуществления композиции включают фармацевтическую композицию, содержащую первый сложный эфир омега-3 жирной кислоты, выбранный из группы, состоящей из сложного эфира гексадекатриеновой кислоты, α-линоленовой кислоты, стеаридоновой кислоты, эйкозатриеновой кислоты, эйкозапентаеновой кислоты, генэйкозапентаеновой кислоты, докозапентаеновой кислоты, докозагексаеновой кислоты, тетракозапентаеновой кислоты, тетракозагексаеновой кислоты или их комбинаций; и второй сложный эфир омега-3 жирной кислоты, выбранный из группы, состоящей из сложного эфира гексадекатриеновой кислоты, α-линоленовой кислоты, стеаридоновой кислоты, эйкозатриеновой кислоты, эйкозапентаеновой кислоты, генэйкозапентаеновой кислоты, докозапентаеновой кислоты, докозагексаеновой кислоты, тетракозапентаеновой кислоты, тетракозагексаеновой кислоты или их комбинаций, и по меньшей мере одно поверхностно-активное вещество. Первый и второй выбранные сложные эфиры омега-3 жирных кислот будут разными. Соотношение между первым и вторым сложным эфиром омега-3 жирной кислоты должно составлять от более чем 2:1 до не более чем 3,4:1 (первый сложный эфир омега-3 жирной кислоты: второй сложный эфир омега-3 жирной кислоты). Как правило, соотношение между первым и вторым сложным эфиром омега-3 жирной кислоты составляет приблизительно 2,4:1. Первый и второй сложный эфир омега-3 жирной кислоты в сумме составляют от приблизительно 40% до приблизительно 85% (вес/вес) композиции. В определенных вариантах осуществления первый и второй сложный эфир омега-3 жирной кислоты в сумме составляют по меньшей мере приблизительно 40% (вес/вес) композиции. В определенных вариантах осуществления первый и второй сложный эфир омега-3 жирной кислоты в сумме составляют по меньшей мере приблизительно 45% (вес/вес) композиции. В определенных вариантах осуществления первый и второй сложный эфир омега-3 жирной кислоты в сумме составляют по меньшей мере приблизительно 50% (вес/вес) композиции. В определенных вариантах осуществления первый и второй сложный эфир омега-3 жирной кислоты в сумме составляют по меньшей мере приблизительно 55% (вес/вес) композиции. В определенных вариантах осуществления первый и второй сложный эфир омега-3 жирной кислоты в сумме составляют по меньшей мере приблизительно 60% (вес/вес) композиции. В определенных вариантах осуществления первый и второй сложный эфир омега-3 жирной кислоты в сумме составляют по меньшей мере приблизительно 65% (вес/вес) композиции. В определенных вариантах осуществления первый и второй сложный эфир омега-3 жирной кислоты в сумме составляют по меньшей мере приблизительно 70% (вес/вес) композиции. В определенных вариантах осуществления первый и второй сложный эфир омега-3 жирной кислоты в сумме составляют по меньшей мере приблизительно 75% (вес/вес) композиции. В определенных вариантах осуществления первый и второй сложный эфир омега-3 жирной кислоты в сумме составляют по меньшей мере приблизительно 80% (вес/вес) композиции. В определенных вариантах осуществления первый и второй сложный эфир омега-3 жирной кислоты в сумме составляют по меньшей мере приблизительно 85% (вес/вес) композиции. В определенных вариантах осуществления данные смешанные композиции сложных эфиров омега-3 жирных кислот практически не содержат активные ингредиенты, кроме указанных сложных эфиров омега-3 жирных кислот. Данные смешанные композиции сложных эфиров омега-3 жирных кислот могут дополнительно содержать по меньшей мере один терпен и/или по меньшей мере один антиоксидант. Терпен, как правило, является практически чистым d-лимоненом и присутствует в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) указанной композиции. Необязательно композиция также может дополнительно содержать натуральное апельсиновое масло в количестве от приблизительно 0,1% до приблизительно 5% (вес/вес) указанной композиции. По меньшей мере одно поверхностно-активное вещество может представлять собой любое одно или несколько из поверхностно-активных веществ, описанных в данном документе, но, как правило, представляет собой полисорбат и/или полоксамер, такой как, например, полисорбат 80 и Pluronic F87. Поверхностно-активное вещество присутствует в количестве от приблизительно 15% до приблизительно 31% (вес/вес) композиции. Антиоксидант (антиоксиданты), пригодные для применения в данных смешанных композициях сложных эфиров омега-3 жирных кислот, включают, но без ограничений, токоферолы и/или токотриенолы и могут присутствовать в количестве от приблизительно 0,01% до приблизительно 5% (вес/вес) композиции. В таких определенных вариантах осуществления токоферолы и/или токотриенолы могут присутствовать в количестве приблизительно 0,01%, 0,05%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5% или 5% по весу композиций. В таких определенных вариантах осуществления антиоксидантом является токоферол, присутствующий в количестве приблизительно 0,4% по весу композиции.
[0119] В определенных вариантах осуществления композиции содержат сложный эфир омега-3 жирной кислоты, такой как сложный этиловый эфир, одно или несколько поверхностно-активных веществ. В определенных вариантах осуществления указанное поверхностно-активное вещество выбрано из группы, состоящей из неионных поверхностно-активных веществ, катионных поверхностно-активных веществ, анионных поверхностно-активных веществ, цвиттерионных поверхностно-активных веществ или их комбинаций. В некоторых вариантах осуществления композиции включают одно или несколько неионных поверхностно активных веществ. Неионные поверхностно-активные вещества обычно содержат гидрофобную группу и реакционноспособный атом водорода, например, алифатические спирты, кислоты, амиды и алкилфенолы с алкиленоксидами, в частности, этиленоксидом либо отдельно, либо в комбинации с пропиленоксидом. Примеры неионных соединений поверхностно-активных веществ включают, но без ограничений, алкиловые эфиры полиоксиэтиленгликоля и сорбитана, блок-сополимеры полиэтиленгликоля и полипропиленгликоля, сложные эфиры этиленгликоля и жирных кислот, сложные эфиры поли(оксиэтиленгликоля) и жирных кислот, сложные эфиры пропиленгликоля и жирных кислот, сложные эфиры поли(пропиленгликоля) и жирных кислот, гликолевые эфиры жирных кислот, сложные эфиры триметилолпропана и жирных кислот, сложные эфиры пентаэритритола и жирных кислот, глюкозидные производные, алкиловые эфиры жирных кислот и глицерина, алкиловые эфиры оксиэтилена и триметилолпропана, амиды жирных кислот, алкилоламиды, алкиламиноксиды, ланолин и его производные, производные касторового масла, отвержденные производные касторового масла, стерины и их производные, алкиловые эфиры полиоксиэтилена, алкилаллиловые эфиры полиоксиэтилена, полиоксиэтиленалкиламины, полиоксиэтиленовые амиды жирных кислот, полиоксиэтиленалкилоламиды, полиоксиэтиленовые сложные эфиры диэтаноламина и жирных кислот, полиоксиэтиленовые сложные эфиры триметилолпропана и жирных кислот, алкиловые эфиры жирных кислот и полиоксиэтилена, полиоксиэтиленполиоксипропиленгликоли, алкиловые эфиры полиоксиэтиленполиоксипропилена, эфиры полиоксиэтиленполиоксипропилена и многоатомных спиртов, сложные эфиры глицерина и жирных кислот, сложные эфиры полиглицерина и жирных кислот, сложные эфиры полиоксиэтиленглицерина и жирных кислот, сложные эфиры сорбитана и жирных кислот, сложные эфиры полиоксиэтиленсорбитана и жирных кислот, сложные эфиры сахарозы и жирных кислот или их комбинации.
[0120] В определенных вариантах осуществления поверхностно-активные вещества включают алкиловые эфиры полиоксиэтиленгликоля и сорбитана, блок-сополимеры полиэтиленгликоля и полипропиленгликоля или их комбинации.
[0121] Примерами алкиловых эфиров полиоксиэтиленгликоля и сорбитана, как правило, являются полисорбаты. Полисорбаты являются классом маслянистых жидкостей, получаемых из пегилированного сорбитана (производного сорбита), этерифицированного жирными кислотами. Распространенные торговые названия полисорбатов включают Tween®. Tween-20, Tween-60 и Tween-80, например, доступны от AkzoNobel (Strawinskylaan 2555 1077 ZZ, Амстердам, Нидерланды).
Примеры полисорбатов включают полисорбат 20 (полиоксиэтилен(20)сорбитанмонолаурат), полисорбат 40 (полиоксиэтилен(20)сорбитанмонопальмитат), полисорбат 60 (полиоксиэтилен(20)сорбитанмоностеарат), и полисорбат 80 (полиоксиэтилен(20)сорбитанмоноолеат).
[0122] Примеры блок-сополимеров полиэтиленгликоля и полипропиленгликоля включают полоксамеры. Полоксамеры являются неионными триблочными сополимерами, включающие центральную гидрофобную цепь полиоксипропилена (поли(пропиленоксида)) в окружении двух гидрофильных цепей полиоксиэтилена (поли(этиленоксида)). Определенные полоксамеры, такие как перечисленные в данном документе, также известны под торговыми названиями Pluronic®, доступными у таких поставщиков, как BASF AG (Людвигсхафен, Германия). Поскольку длины полимерных блоков можно приспосабливать к требованию заказчика, существует много различных полоксамеров, которые обладают немного отличающимися свойствами. Дополнительные примеры полоксамеров Pluronic включают, но без ограничений, Pluronic® 10R5, Pluronic® 17R2, Pluronic® 17R4, Pluronic® 25R2, Pluronic® 25R4, Pluronic® 31R1, Pluronic® F 108 Cast Solid Surfacta, Pluronic® F 108 NF, Pluronic® F 108 Pastille, Pluronic® F 108 Prill, Pluronic® F 108NF Prill Poloxamer 338, Pluronic® F 127, Pluronic® F 127 Prill, Pluronic® F 127 NF, Pluronic® F 127 NF 500 BHT Prill, Pluronic® F 127 NF Prill Poloxamer 407, Pluronic® F 38, Pluronic® F 38 Pastille, Pluronic® F 68, Pluronic® F 68 Pastille, Pluronic® F 68 LF Pastille, Pluronic® F 68 NF, Pluronic® F 68 NF Prill Poloxamer 188, Pluronic® F 68 Prill, Pluronic® F 68 Prill, Pluronic® F 77, Pluronic® F 77 Micropastille, Pluronic® F 87, Pluronic® F 87 NF, Pluronic® F 87 NF Prill Poloxamer 237, Pluronic® F 87 Prill, Pluronic® F 88, Pluronic® F 88 Pastille, Pluronic® F 88 Prill, Pluronic® F 98, Pluronic® F 88 Prill, Pluronic® F 98, Pluronic® F 98 Prill, Pluronic® L 10, Pluronic® L 101, Pluronic® L 121, Pluronic® L 31, Pluronic® L 35, Pluronic® L 43, Pluronic® L 44, Pluronic® L 61, Pluronic® L 62, Pluronic® L 62 LF, Plufonic® L 62D, Pluronic® L 64, Pluronic® L 81, Pluronic® L 92, Pluronic® L44 NF ΓΝΗ surfactant Poloxamer 124, Pluronic® N 3, Pluronic® Ρ 103, Pluronic® Ρ 104, Pluronic® Ρ 105, Pluronic® Ρ 123 Surfactant, Pluronic® Ρ 65, Pluronic® Ρ 84, Pluronic® Ρ 85 или их комбинации.
[0123] В определенных вариантах осуществления композиция содержит от приблизительно 15% (вес/вес) до приблизительно 31% (вес/вес) полисорбата. В определенных вариантах осуществления указанный полисорбат представляет собой полисорбат 80. В других вариантах осуществления композиция содержит от приблизительно 0,5% (вес/вес) до приблизительно 5% (вес/вес) полоксамера. В определенных вариантах осуществления полисорбат представляет собой полисорбат 20, полисорбат 60, полисорбат 80 или их комбинацию, полоксамер представляет собой Pluronic F87, Pluronic L61, Pluronic F127 или их комбинацию. В некоторых вариантах осуществления композиция содержит сложные эфиры омега-3 жирных кислот, такие как сложные этиловые эфиры, в количестве от приблизительно 50% (вес/вес) до приблизительно 80% (вес/вес); и полисорбат в количестве от приблизительно 15% (вес/вес) до приблизительно 99% (вес/вес); и полоксамер в количестве от приблизительно 0,05% (вес/вес) до приблизительно 50% (вес/вес). В определенных вариантах осуществления по меньшей мере одно поверхностно-активное вещество представляет собой комбинацию полисорбата, такого как, например, полисорбат 80, в количестве от приблизительно 15% (вес/вес) до приблизительно 31% (вес/вес) указанной композиции и полоксамера, такого как, например, Pluronic F87, в количестве от приблизительно 0,5% (вес/вес) до приблизительно 5% (вес/вес) указанной композиции.
[0124] В определенных вариантах осуществления указанный полисорбат составляет от приблизительно 15% (вес/вес) до приблизительно 70% (вес/вес) указанной композиции. В определенных вариантах осуществления указанный полисорбат составляет от приблизительно 15% (вес/вес) до приблизительно 50% (вес/вес) указанной композиции. В определенных вариантах осуществления указанный полисорбат составляет от приблизительно 15% (вес/вес) до приблизительно 31% (вес/вес) указанной композиции. В определенных вариантах осуществления указанный полисорбат составляет от приблизительно 15% (вес/вес) до приблизительно 25% (вес/вес) указанной композиции. В определенных вариантах осуществления указанный полисорбат составляет от приблизительно 15% (вес/вес) до приблизительно 20% (вес/вес) указанной композиции. В определенных вариантах осуществления указанный полисорбат составляет от приблизительно 20% (вес/вес) до приблизительно 31% (вес/вес) указанной композиции.
[0125] В определенных вариантах осуществления полоксамер составляет от приблизительно 0,5% (вес/вес) до приблизительно 5% (вес/вес) указанной композиции. В определенных вариантах осуществления полоксамер составляет от приблизительно 0,5% (вес/вес) до приблизительно 4% (вес/вес) указанной композиции. В определенных вариантах осуществления полоксамер составляет от приблизительно 0,5% (вес/вес) до приблизительно 3% (вес/вес) указанной композиции. В определенных вариантах осуществления полоксамер составляет от приблизительно 0,5% (вес/вес) до приблизительно 2% (вес/вес) указанной композиции. В определенных вариантах осуществления полоксамер составляет от приблизительно 0,5% (вес/вес) до приблизительно 1% (вес/вес) указанной композиции.
[0126] В некоторых вариантах осуществления композиции включают одно или несколько анионных поверхностно-активных веществ. Примеры "анионных поверхностно-активных веществ" включают, но без ограничений, диэтаноламин N-ацил-L-глутаминовой кислоты, триэтаноламин N-ацил-L-глутаминовой кислоты, N-ацил-L-глутамат натрия, алкансульфонат натрия, алкил(С12, С14, С16)сульфат аммония, триэтаноламин алкил(С11, С13, С15)серной кислоты, триэтаноламин алкил(С11, С13, С15)серной кислоты, триэтаноламин алкил(С12-С14)серной кислоты, жидкий триэтаноламин алкилсерной кислоты, алкил(С12, С13)сульфат натрия, жидкий алкилсульфат натрия, изоэтионат натрия, лакто-изостеарат натрия, двунатриевый ундециленоиламидоэтилсульфосукцинат, сульфоолеат триэтаноламина, сульфоолеат натрия, динатрий олеамидсульфосукцинат, олеат калия, олеат натрия, олеат морфолина, олеоилсаркозин, натриевую соль олеоилметилтаурина, калийсодержащую мыльную основу, жидкую основу для калийного мыла, калийное мыло, карбоксилированный тридодециловый эфир полиоксиэтилена, натриевую соль (3 этиленоксид "Е.О.") карбоксилированного тридодецилового эфира полиоксиэтилена, триэтаноламин-N-гидрогенизированный талловый жирный ацил-L-глутамат, N-гидрогенизированный талловый жирный ацил-L-глутамат натрия, гидрогенизированных жирных кислот кокосового масла глицерилсульфат натрия, диундециленоиламидоэтилсульфосукцинат натрия, стеарилсульфат натрия, стеарат калия, стеарат триэтаноламина, стеарат натрия, N-стеароил-L-глутамат натрия, двунатриевый стеароил-L-глутамат, натриевую соль стеароилметилтаурина, диоктилсульфосукцинат натрия, жидкий диоктилсульфосукцинат натрия, жидкий двунатриевый полиоксиэтиленмоноолеиламидосульфосукцинат (2 Е.О.), двунатриевый полиоксиэтиленлауроилэтаноламидсульфосукцинат (5 Е.О.), двунатриевый лаурилсульфосукцинат, цетилсульфат диэтаноламида, цетилсульфат натрия, мыльную основу, цетостеарилсульфат натрия, тридецилсульфат триэтаноламина, пальмитат калия, пальмитат натрия, натриевую соль пальмитоилметилтаурина, натриевую соль жирных кислот жидкого касторового масла (30%), аммониевый полиоксиэтиленалкиловый эфир-сульфат (3 Е.О.), жидкий полиоксиэтиленалкиловый (С12, С13) эфир-сульфат диэтаноламина, жидкий полиоксиэтиленалкиловый эфир-сульфат триэтаноламина (3 Е.О.), полиоксиэтиленалкиловый (C11, С13, С15) эфир-сульфат триэтаноламина (1 Е.О.), полиоксиэтиленалкиловый (С12, С13) эфир-сульфат триэтаноламина (3 Е.О.), жидкий полиоксиэтиленалкиловый эфир-сульфат натрия (3 Е.О.), полиоксиэтиленалкиловый (C11, С13, С15) эфир-сульфат натрия (1 Е.О.), полиоксиэтиленалкиловый (C11-С15) эфир-сульфат натрия (3 Е.О.), полиоксиэтиленалкиловый (С12, С13) эфир-сульфат натрия (3 Е.О.), полиоксиэтиленалкиловый (С12-С14) эфир-сульфат натрия (3 Е.О.), полиоксиэтиленалкиловый (С12-С15) эфир-сульфат натрия (3 Е.О.), двунатриевый полиоксиэтиленалкил (С12-С14) сульфосукцинат (7 Е.О.), полиоксиэтиленундециловый эфир-сульфат натрия, жидкий полиоксиэтиленоктилфениловый эфир-сульфат натрия, полиоксиэтиленолеиловый эфир-сульфат аммония, двунатриевый полиоксиэтиленлаурилсульфосукцинат, полиоксиэтиленнонилфениловый эфир-сульфат натрия, полиоксиэтиленпентадециловый эфир-сульфат натрия, полиоксиэтиленмиристиловый эфир-сульфат триэтаноламина, полиоксиэтиленмиристиловый эфир-сульфат натрия, полиоксиэтиленмиристиловый эфир-сульфат натрия (3 Е.О.), жидкий полиоксиэтиленлауриловый эфир-ацетат натрия (16 Е.О.), полиоксиэтиленлауриловый эфир-сульфат аммония (2 Е.О.), полиоксиэтиленлауриловый эфир-сульфат триэтаноламина, полиоксиэтиленлауриловый эфир-сульфат натрия, миристилсульфат диэтаноламина, миристилсульфат натрия, миристилсульфат калия, N-миристоил-L-глутамат натрия, миристоилметиламиноацетат натрия, жидкую натриевую соль миристоил метил-аланина, натриевую соль миристоилметилтаурина, медицинские мыла, кокоалкилсульфат триэтаноламина/магния, N-жирных кислот кокосового масла-ацил-L-глутамат триэтаноламина, N-жирных кислот кокосового масла-ацил-L-глутамат натрия, этилового эфира жирных кислот кокосового масла сульфонат натрия, калиевую соль жирных кислот кокосового масла, жидкую калиевую соль жирных кислот кокосового масла, N-жирных кислот кокосового масла/гидрогенизированных жирных кислот-ацил-L-глутамат натрия, саркозин жирных кислот кокосового масла, триэтаноламиновую соль саркозина жирных кислот кокосового масла, натриевую соль саркозина жирных кислот кокосового масла, триэтаноламиновую соль жирных кислот кокосового масла, жидкую триэтаноламиновую соль жирных кислот кокосового масла, натриевую соль жирных кислот кокосового масла, натриевую соль метилаланина жирных кислот кокосового масла, жидкую натриевую соль метилаланина жирных кислот кокосового масла, калиевую соль метилтаурина жирных кислот кокосового масла, натриевую соль метилтаурина жирных кислот кокосового масла, лауриламинодипропионат натрия, жидкий лауриламинодипропионат натрия (30%), лаурилсульфоацетат натрия; лаурилбензолсульфонат натрия, лаурилсульфат, лаурилсульфат аммония, лаурилсульфат калия, лаурилсульфат диэтаноламина, лаурилсульфат триэтаноламина, лаурилсульфат натрия, лаурилсульфат магния, лаурилсульфат моноэтаноламина, лаурат калия, триэтаноламин лауриновой кислоты, жидкий триэтаноламин лауриновой кислоты, лаурат натрия, триэтаноламин лауриновой кислоты/миристиновой кислоты, триэтаноламин лауроил-L-глутаминовой кислоты, N-лауроил-L-глутамат натрия, калий лауроилсаркозин, жидкую триэтаноламиновую соль лауроилсаркозина, натрий лауроилсаркозин, жидкую натриевую соль лауроилметил-.бета.-аланина, натриевую соль лауроилметилтаурина, жидкую натриевую соль лауроилметилтаурина или их комбинации.
[0127] В определенных вариантах осуществления указанное анионное поверхностно-активное вещество (вещества) составляет от приблизительно 0,05% (вес/вес) до приблизительно 25% (вес/вес) указанной композиции. В определенных вариантах осуществления указанное анионное поверхностно-активное вещество (вещества) составляет от приблизительно 0,05% (вес/вес) до приблизительно 15% (вес/вес) указанной композиции. В определенных вариантах осуществления указанное анионное поверхностно-активное вещество (вещества) составляет от приблизительно 0,05% (вес/вес) до приблизительно 5% (вес/вес) указанной композиции. В определенных вариантах осуществления указанное анионное поверхностно-активное вещество (вещества) составляет от приблизительно 0,5% (вес/вес) до приблизительно 3% (вес/вес) указанной композиции. В определенных вариантах осуществления указанное анионное поверхностно-активное вещество (вещества) составляет от приблизительно 0,7% (вес/вес) указанной композиции. В определенных вариантах осуществления указанное анионное поверхностно-активное вещество (вещества) включает лаурилсульфат натрия.
[0128] В определенных вариантах осуществления композиции содержат сложный эфир омега-3 жирной кислоты, такой как сложный этиловый эфир, и дополнительно содержат одно или несколько поверхностно-активных веществ. В определенных вариантах осуществления указанное поверхностно-активное вещество выбрано из группы, состоящей из полисорбата или комбинации полисорбатов и анионного поверхностно-активного вещества, или комбинации анионных поверхностно-активных веществ, или комбинации указанных полисорбатов и указанных анионных поверхностно-активных веществ. В других вариантах осуществления композиция содержит от приблизительно 15% (вес/вес) до приблизительно 31% (вес/вес) полисорбата. В определенных вариантах осуществления указанный полисорбат представляет собой полисорбат 80. В других вариантах осуществления композиция содержит от приблизительно 0,5% (вес/вес) до приблизительно 5% (вес/вес) анионного поверхностно-активного вещества (веществ). В определенных вариантах осуществления полисорбат представляет собой полисорбат 80, полисорбат 2 или их комбинацию, и анионное поверхностно-активное вещество представляет собой лаурилсульфат натрия. В некоторых вариантах осуществления композиция содержит сложные эфиры омега-3 жирных кислот, такие как сложные этиловые эфиры, в количестве от приблизительно 40% (вес/вес) до приблизительно 85% (вес/вес); и полисорбат в количестве от приблизительно 15% (вес/вес) до приблизительно 99% (вес/вес); и анионное поверхностно-активное вещество (вещества) в количестве от приблизительно 0,05% (вес/вес) до приблизительно 50% (вес/вес). В некоторых вариантах осуществления композиция содержит сложные эфиры омега-3 жирных кислот, такие как сложные этиловые эфиры, в количестве от приблизительно 50% (вес/вес) до приблизительно 80% (вес/вес) (90); и полисорбат в количестве от приблизительно 15% (вес/вес) до приблизительно 99% (вес/вес); и анионное поверхностно-активное вещество (вещества), такое как, например, лаурилсульфат натрия, в количестве от приблизительно 0,05% (вес/вес) до приблизительно 2% (вес/вес). В некоторых вариантах осуществления композиция содержит приблизительно 0,7% (вес/вес) лаурилсульфата натрия.
[0129] В определенных вариантах осуществления указанный полоксамер составляет от приблизительно 0,05% (вес/вес) до приблизительно 25% (вес/вес) указанной композиции! В определенных вариантах осуществления указанный полоксамер составляет от приблизительно 0,05% (вес/вес) до приблизительно 15% (вес/вес) указанной композиции. В определенных вариантах осуществления указанный полоксамер составляет от приблизительно 0,05% (вес/вес) до приблизительно 5% (вес/вес) указанной композиции. В определенных вариантах осуществления указанный полоксамер составляет от приблизительно 0,5% (вес/вес) до приблизительно 3% (вес/вес) указанной композиции.
[0130] В некоторых вариантах осуществления композиции включают дополнительные поверхностно-активные вещества, такие как цвиттерионные и катионные поверхностно-активные вещества. Примеры таких поверхностно-активных веществ включают, но без ограничений, желчные кислоты (например, холевую кислоту, хенодезоксихолевую кислоту, гликохолевую кислоту, гликодезоксихолевую кислоту, таурохолевую кислоту, таурохенодезоксихолевую кислоту, тауролитохолевую кислоту, дезоксихолевую кислоту, литохолевую кислоту и урсодезоксихолевую кислоту и их соли, например, натриевые, калиевые, литиевые), природные эмульгаторы (например, аравийская камедь, агар, альгиновая кислота, альгинат натрия, трагакант, карраген, холестерин, ксантан, пектин, желатин, яичный желток, казеин, ланолин, холестерин, воск и лецитин), производные длинноцепочечных аминокислот, высокомолекулярные спирты (например, стеариловый спирт, цетиловый спирт, олеиловый спирт, триацетинмоностеарат, этиленгликольдистеарат, глицерилмоностеарат и пропиленгликольмоностеарат, поливиниловый спирт), карбомеры (например, карбоксиполиметилен, полиакриловая кислота, полимер акриловой кислоты и карбоксивиниловый полимер), каррагинан, производные целлюлозы (например, натриевая соль карбоксиметилцеллюлозы, порошковая целлюлоза, гидроксиметилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза), эфиры полиоксиэтилена (например, полиоксиэтиленмоностеарат [Myrj 45], полиоксиэтиленовое гидрогенизированное касторовое масло, полиэтоксилированное касторовое масло, стеарат полиоксиметилена и солютол), сложные эфиры сахарозы и жирных кислот, сложные эфиры полиэтиленгликоля и жирных кислот (например, кремофор), эфиры полиоксиэтилена (например, лауриловый эфир полиоксиэтилена [Brij 30]), сополимер винила и пирролидона, монолаурат диэтиленгликоля, олеат триэтаноламина, олеат натрия, олеат калия, этилолеат, олеиновую кислоту, этиллаурат, лаурилсульфат натрия, бромид цетримония, хлорид цетилпиридиния, хлорид бензалкония, докузат натрия или их комбинации.
[0131] Композиции, пригодные для самостоятельного образования мицелл, которые описаны в данном документе, как правило, характеризуются HLB от приблизительно 12 до приблизительно 18. В определенных вариантах осуществления указанные композиции характеризуются HLB от приблизительно 12,0 до приблизительно 14,0. В определенных вариантах осуществления указанные композиции характеризуются HLB от приблизительно 13,0 до приблизительно 14,0. В определенных вариантах осуществления указанные композиции характеризуются HLB от приблизительно 13,5 до приблизительно 13,8. Суммарный HLB всех поверхностно-активных веществ или сурфактантов, применяемых в композиции, обычно составляет от приблизительно 12 до приблизительно 18. В некоторых вариантах осуществления суммарный HLB всех поверхностно-активных веществ, применяемых в композиции, обычно составляет от приблизительно 12 до приблизительно 15. В некоторых вариантах осуществления суммарный HLB всех поверхностно-активных веществ или сурфактантов, применяемых в композиции, обычно составляет от приблизительно 13 до приблизительно 15.
[0132] В определенных вариантах осуществления по меньшей мере одно поверхностно-активное вещество или сурфактант характеризуется HLB. составляющим по меньшей мере 8,0. В некоторых вариантах осуществления указанное поверхностно-активное вещество (вещества) или сурфактант (сурфактанты) характеризуются совокупным HLB в диапазоне от приблизительно 13 до приблизительно 15. По мере того как значение HLB поверхностно-активного вещества (веществ) или сурфактанта (сурфактантов) увеличивается, количество поверхностно-активного вещества или сурфактанта должно уменьшаться, так что при HLB 17 может требоваться только от приблизительно 25% (вес/вес) до приблизительно 42% (вес/вес) поверхностно-активного вещества (веществ) или сурфактанта (сурфактантов).
[0133] В определенных вариантах осуществления композиция дополнительно содержит терпен. В определенных вариантах осуществления терпен представляет собой d-лимонен. В одном варианте осуществления терпен является циклическим терпеном. В одном варианте осуществления терпен представляет собой d-лимонен ((+)-лимонен), который является (11)-энантиомером. В одном варианте осуществления терпен представляет собой L-лимонен, который является (S)-энантиомером. В одном варианте осуществления терпен представляет собой рацемический лимонен, известный как дипентен. В другом варианте осуществления терпен является терпеноидом. В другом варианте осуществления терпен или терпены получены из натурального масла (например, цитрусового масла, такого как апельсиновое масло). Предусматриваются другие терпены, такие как монотерпены (например, терпинены, терпинолены, фелландрены или ментол), имеющие структуры, подобные d-лимонену. В определенных вариантах осуществления композиции дополнительно содержат практически чистый d-лимонен в количестве от приблизительно 0,1% до приблизительно 5% по весу композиции. В определенных других вариантах осуществления композиции дополнительно содержат натуральное апельсиновое масло в количестве от приблизительно 0,1% до приблизительно 5% по весу композиции. Композиции, содержащие d-лимонен или апельсиновое масло, могут способствовать устранению и/или минимизации побочных эффектов при пероральном введении сложных эфиров омега-3 жирных кислот. Такие побочные эффекты включают регургитацию, частую отрыжку, гастроэзофагеальную рефлюксную болезнь (GERD), вздутие живота, увеличение количества кишечных газов, рыбный привкус, рыбный запах изо рта, запах рыбы, тошноту, диарею или их комбинации.
[0134] В других вариантах осуществления композиция дополнительно содержит антиоксидант. В определенных вариантах осуществления антиоксидант выбран из группы, состоящей из по меньшей мере одного токоферола, по меньшей мере одного токотриенола или их комбинаций. В других вариантах осуществления композиции, описанные в данном документе, могут включать один или несколько токоферол (токоферолов). В вариантах осуществления, дополнительно включающих по меньшей мере один или несколько антиоксидант (антиоксидантов), антиоксидант (антиоксиданты) может присутствовать в количестве от приблизительно 0,01% до приблизительно 5% по весу композиций. В таких вариантах осуществления антиоксидант (антиоксиданты) может присутствовать в количестве приблизительно 0,01%, 0,05%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5% или 5% по весу композиций. В определенных вариантах осуществления антиоксидант (антиоксиданты) может присутствовать в количестве приблизительно 0,4% по весу композиций.
[0135] По меньшей мере в одном дополнительном варианте осуществления предусмотрены композиции, содержащие мицеллы, где мицеллы образуются при добавлении водной среды в композицию по любому из вариантов осуществления, предусмотренных в данном документе, перед введением указанной композиции субъекту, нуждающемуся в лечении. Альтернативно, мицеллы также могут образовываться при добавлении композиции в водную среду. В определенных вариантах осуществления мицеллы имеют диаметр до приблизительно 10 мкм. В других вариантах осуществления практически все мицеллы имеют средний диаметр от приблизительно 1 мкм до приблизительно 10 мкм. В определенных вариантах осуществления мицеллы имеют средний диаметр приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мкм. В определенных вариантах осуществления указанные мицеллы являются стабильными при комнатной температуре. В определенных вариантах осуществления композиция образует мицеллы в водной среде с кислым рН. В определенных других вариантах осуществления композиции образуют мицеллы в 0,1 н. HCl.
[0136] В другом варианте осуществления предусмотрена композиция, где указанная композиция содержит, по меньшей мере один сложный эфир (5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентеновой кислоты (ЕРА) и по меньшей мере один сложный эфир (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеновой кислоты (DHA), и где в указанной композиции соотношение сложного эфира ЕРА и сложного эфира DHA составляет от более чем 2,0:1,0 до не более чем приблизительно 3,4:1,0 при условии, что концентрация указанного сложного эфира ЕРА, сложного эфира DHA или их комбинации составляет от приблизительно 40% до приблизительно 85% по весу от общего количества эфиров омега 3 в указанной композиции. В определенных вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,0:1,0 до приблизительно 2,5:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,1:1,0 до приблизительно 2,4:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,1:1,0 до приблизительно 2,3:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,1:1,0 до приблизительно 2,2:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет 2,4:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,0:1,0 до приблизительно 3,3:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,2:1,0 до приблизительно 3,2:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,4:1,0 до приблизительно 3,1:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,5:1,0 до приблизительно 3,0:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,6:1,0 до приблизительно 2,9:1,0. В других вариантах осуществления соотношение сложного эфира ЕРА и сложного эфира DHA составляет от приблизительно 2,7:1,0 до приблизительно 2,8:1,0. В определенных вариантах осуществления указанное соотношение сложного эфира ЕРА и сложного эфира DHA в указанной композиции составляет более чем 2,0:1,0.
[0137] В определенных вариантах осуществления сложные эфиры омега-3 жирных кислот, применяемые в данном документе, являются практически чистыми. В определенных вариантах осуществления сложные эфиры омега-3 жирных кислот характеризуются от приблизительно 80% до приблизительно 99% чистоты. В определенных вариантах осуществления сложные эфиры омега-3 жирных кислот характеризуются по меньшей мере 80%, 85%, 90%, 92%, 94%, 96%, 98% или 99% чистоты.
СПОСОБЫ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ СОСТОЯНИЙ ИЛИ НАРУШЕНИЙ
[0138] Предусмотрены способы лечения одного или нескольких сердечнососудистых состояний или нарушений у субъекта, нуждающегося в лечении, при этом способ включает введение указанному субъекту терапевтически эффективного количества композиции по любому из вариантов осуществления, предусмотренных в данном документе, или мицеллы по любому из вариантов осуществления, предусмотренных в данном документе.
[0139] Соответственно, в определенных вариантах осуществления сердечнососудистое состояние или нарушение имеет отношение к сердцу или сосудистой системе, и включает, например, гипертензию, гиперлипидемию, гипертриглицеридемию, атеросклероз, транзиторную ишемическую атаку, систолическую дисфункцию, диастолическую дисфункцию, аневризму, расслоение аорты, ишемию миокарда, острый инфаркт миокарда (AMI), острый инфаркт миокарда с подъемом сегмента ST (STEMI), острый инфаркт миокарда без подъема сегмента ST (NSTEMI), стенокардию, нестабильную стенокардию (UA) и стабильную стенокардию (SA), инфаркт миокарда, застойную сердечную недостаточность, дилатационую застойную кардиомиопатию, гипертрофическую кардиомиопатию, рестриктивную кардиомиопатию, легочное сердце, аритмию, порок клапанов сердца, эндокардит, легочную эмболию, венозный тромбоз, заболевание периферических сосудов и заболевание периферических артерий.
[0140] В конкретных вариантах осуществления сердечно-сосудистым состоянием или нарушением является гипертензия, гиперлипидемия или их комбинация. В других вариантах осуществления сердечно-сосудистым состоянием или нарушением является гипертриглицеридемия.
[0141] В другом варианте осуществления предусмотрен способ лечения гипертриглицеридемии от умеренной до тяжелой степени тяжести у субъекта, нуждающегося в таковом, где способ включает выявление субъекта с исходным уровнем TG натощак от приблизительно 200 мг/дл до приблизительно 500 мг/дл и введение субъекту композиции, описанной в данном документе. В одном варианте осуществления композицию можно вводить в суточном количестве от приблизительно 0,5 г до приблизительно 1 г, от приблизительно 1 г до приблизительно 2 г, от приблизительно 2 г до приблизительно 4 г, от приблизительно 4 г до приблизительно 6 г или от приблизительно 6 г до приблизительно 10 г.
[0142] В определенных вариантах осуществления количество общих TG натощак в сыворотке крови субъекта уменьшается по меньшей мере на 20% в течение тридцати дней введения указанной композиции или указанных мицелл субъекту с уровнем TG в сыворотке крови натощак по меньшей мере 150 мг/дл в начале применения схемы дозирования. В других вариантах осуществления общая концентрация липопротеинов низкой плотности (LDL) в сыворотке крови указанного субъекта не увеличивается значительно в течение тридцати дней введения указанной композиции или указанных мицелл. В определенных вариантах осуществления терапевтически эффективное количество указанной композиции или указанных мицелл составляет по меньшей мере 0,5 г/сутки сложных эфиров омега-3 жирных кислот. В других вариантах осуществления концентрация ЕРА, DHA в сумме или их комбинаций в сыворотке крови указанного субъекта составляет по меньшей мере 20 нмоль/мл в течение четырех часов после введения указанной композиции или указанных мицелл.
[0143] В дополнительных вариантах осуществления предусмотрен способ введения субъекту композиции, содержащей по меньшей мере один сложный эфир омега-3 жирной кислоты, где соотношение липопротеинов высокой плотности увеличивается по сравнению с LDL в сыворотке крови субъекта. В определенных вариантах осуществления введение является пероральным введением. В определенных вариантах осуществления субъектом является человек.
[0144] Некоторые варианты осуществления предусматривают способ введения субъекту композиции, содержащей по меньшей мере один сложный эфир омега-3 жирной кислоты и по меньшей мере одно поверхностно-активное вещество, где указанный по меньшей мере один сложный эфир омега-3 жирной кислоты самостоятельно образует мицеллы при контакте с водной средой, и указанный по меньшей мере один сложный эфир омега-3 жирной кислоты при пероральном введении абсорбируется указанным субъектом со скоростью, которая практически не зависит от влияния пищи. В определенных вариантах осуществления снижение влияния пищи может привести к снижению F по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50% или по меньшей мере на 75%.
[0145] Предусмотрен способ введения субъекту композиции, содержащей, по меньшей мере один сложный эфир омега-3 жирной кислоты и по меньшей мере одно поверхностно-активное вещество, где указанный по меньшей мере один сложный эфир омега-3 жирной кислоты самостоятельно образует мицеллы при контакте с водной средой, и указанный по меньшей мере один сложный эфир омега-3 жирной кислоты при пероральном введении абсорбируется указанным субъектом со скоростью, которая практически не зависит от влияния пищи. В определенных вариантах осуществления указанная композиция является композицией по любому из вариантов осуществления, предусмотренных в данном документе. В других вариантах осуществления указанному субъекту вводят по меньшей мере 0,5 г/сутки сложного эфира омега-3 жирной кислоты.
[0146] В другом варианте осуществления композицию, описанную в данном документе, вводят, например, на протяжении периода от приблизительно 1 до приблизительно 200 недель, от приблизительно 1 до приблизительно 100 недель, от приблизительно 1 до приблизительно 80 недель, от приблизительно 1 до приблизительно 50 недель, от приблизительно 1 до приблизительно 40 недель, от приблизительно 1 до приблизительно 20 недель, от приблизительно 1 до приблизительно 15 недель, от приблизительно 1 до приблизительно 12 недель, от приблизительно 1 до приблизительно 10 недель, от приблизительно 1 до приблизительно 5 недель, от приблизительно 1 до приблизительно 2 недель или на протяжении приблизительно 1 недели. В другом варианте осуществления композицию, описанную в данном документе, вводят в течение неограниченного периода времени субъекту, нуждающемуся в длительном лечении.
[0147] В других вариантах осуществления в сыворотке крови указанного субъекта концентрация указанного по меньшей мере одного сложного эфира омега-3 жирной кислоты составляет по меньшей мере 20 нмоль/мл в течение четырех часов после введения указанной композиции. В других вариантах осуществления в сыворотке крови указанного субъекта концентрация указанного по меньшей мере одного сложного эфира омега-3 жирной кислоты составляет по меньшей мере 50 нмоль/мл в течение четырех часов после введения указанной композиции. В других вариантах осуществления в сыворотке крови указанного субъекта концентрация указанного по меньшей мере одного сложного эфира омега-3 жирной кислоты составляет по меньшей мере 100 нмоль/мл в течение четырех часов после введения указанной композиции. В других вариантах осуществления концентрация указанного по меньшей мере одного сложного эфира омега-3 жирной кислоты в воротке крови указанного субъекта может быть повышена при введении возрастающих доз указанной композиции.
[0148] В определенных вариантах осуществления предусмотрен способ минимизации и/или устранения побочных эффектов при пероральном введении сложных эфиров омега-3 жирных кислот в присутствии поверхностно-активного вещества субъекту, нуждающемуся в лечении, включающий введение композиции по любому из вариантов осуществления, предусмотренных в данном документе, или мицелл по любому из вариантов осуществления, предусмотренных в данном документе. В определенных вариантах осуществления способ минимизации побочных эффектов устраняет возникновение побочных эффектов. В некоторых вариантах осуществления неограничивающие примеры побочных эффектов включают регургитацию, частую отрыжку, гастроэзофагеальную рефлюксную болезнь (GERD), вздутие живота, повышение количества кишечных газов, рыбный привкус, рыбный запах изо рта, запах рыбы, тошноту, диарею или их комбинации.
[0149] В определенных вариантах осуществления предусмотрен способ минимизации и/или устранения побочных эффектов при пероральном введении сложных эфиров омега-3 жирных кислот в присутствии по меньшей мере одного терпена или натурального апельсинового масла субъекту, нуждающемуся в лечении, включающий введение композиции по любому из вариантов осуществления, предусмотренных в данном документе, или мицелл по любому из вариантов осуществления, предусмотренных в данном документе. В определенных вариантах осуществления по меньшей мере один терпен, как правило, но не обязательно, представляет собой d-лимонен, который характеризуется по меньшей мере 95% чистоты. В определенных вариантах осуществления способ минимизации побочных эффектов устраняет возникновение побочных эффектов. В некоторых вариантах осуществления неограничивающие примеры побочных эффектов включают регургитацию, частую отрыжку, гастроэзофагеальную рефлюксную болезнь (GERD), вздутие живота, повышение количества кишечных газов, рыбный привкус, рыбный запах изо рта, запах рыбы, тошноту, диарею или их комбинации.
[0150] Некоторые варианты осуществления предусматривают способ снижения влияния пищи у субъекта, нуждающегося в лечении, при этом способ включает введение субъекту-человеку терапевтически эффективного количества любой из композиций, описанных в данном документе. В определенных вариантах осуществления влияние пищи практически устраняется.
[0151] Также предусмотрены способы улучшения соблюдения пациентом режима и схемы лечения при пероральном введении сложных эфиров омега-3 жирных кислот субъекту, нуждающемуся в лечении, включающие введение композиции, описанной в данном документе.
[0152] Композиции, описанные в данном документе, можно вводить субъекту-человеку, нуждающемуся в таком введении, с гиполипидемическим или гипохолестеринемическим средством, не являющимся сложным эфиром омега-3 жирной кислоты, которое выбрано из группы, состоящей из ингибиторов абсорбции холестерина, секвестрантов желчных кислот/ смол, статинов, ниацина и производных, ингибиторов МТР, фибратов и ингибиторов СЕТР. Данные гиполипидемические или гипохолестеринемические средства можно классифицировать по их механизму действия. Например, ингибиторы абсорбции холестерина ингибируют абсорбциию пищевого холестерина и ингибируют реабсорбцию находящегося в желчи холестерина. Примеры ингибиторов абсорбции холестерина, включают, но без ограничений, фитостерины, эзетимиб и (3R,4S)-1,4-бис(4-метоксифенил)-3-(3-фенилпропил)-2-азетидинон (SCH 48461). Секвестранты желчных кислот/смолы являются полимерными соединениями и функционируют как ионообменные смолы. Секвестранты желчных кислот меняют анионы, такие как хлорид-ионы, на желчные кислоты. При этом они связывают желчные кислоты и выводят их из кишечно-печеночной циркуляции. Так как секвестранты желчных кислот являются крупными полимерными структурами, они плохо всасываются из кишечника в кровоток. Таким образом, секвестранты желчных кислот вместе с любыми желчными кислотами, связанными с лекарственным средством, выводятся из организма с фекалиями после прохождения через желудочно-кишечный тракт. Примеры секвестрантов желчных кислот/смол включают, но без ограничений, холестирамин, колесевелам и колестипол. Статины являются классом соединений, которые ингибируют фермент HMG-CoA редуктазу. Примеры статинов включают, но без ограничений, розувастатин, ловастатин, флувастатин, симвастатин, правастатин и аторвастатин. Считается, что ниацин и его производные действуют путем стимуляции рецептора GPR109A, связанного с G-белком, что приводит к ингибированию утилизации жиров в жировой ткани. Примеры ниацина и его производных включают, но без ограничений, ницеритрол, ниацин, никофураноз, никотинат алюминия, никотиниловый спирт и аципимокс. МТР (микросомальный белок-переносчик триглицеридов) является белком-переносчиком липидов, который необходим для сборки и секреции липопротеинов очень низкой плотности печенью и хиломикронов кишечником. Соответственно, ингибиторы МТР снижают уровни LDL-C в плазме. Примеры ингибиторов МТР включают, но без ограничений, ломитапид для применения людям и дирлотапид и митратапид для ветеринарного применения в отношении собак. Исследования на грызунах и людях показывают, что фибраты проявляют свои гиполипидемические эффекты посредством нескольких механизмов. Примеры фибратов включают, но без ограничений, безафибрат, ципрофибрат, клофибрат, гемфиброзил и фенофибрат. Ингибиторы СЕТР (белка-переносчика холестериловых эфиров) улучшают липидный профиль плазмы крови путем увеличения количества HDL (частицы, содержащие "хороший" холестерин) и снижения количества LDL (частицы, содержащие "плохой" холестерин). Примеры ингибиторов СЕТР включают, но без ограничений, анацетрапиб и эвацетрапиб.
[0153] В дополнение к вышеупомянутым болезненным состояниям на некоторые другие состояния или нарушения также может быть оказан благоприятный эффект в результате лечения с использованием композиций, описанных в данном документе, такие как, например, метаболический синдром; дегенерация желтого пятна (AREDS2 Research Group et. al. The Age-Related Eye Disease 2 (AREDS2): study design and baseline characteristics (AREDS2 report number 1), Opthalmology. 2012 Nov. 119(11): 2282-9. doi 10.1016/j.optha 2012.05.027. Epub 2012 Jul 26; SanGiovanni JP et. al., ω-3 long-chain polyunsaturated fatty acid intake and 12-y incidence of neovascular age-related macular degeneration and central geographic atrophy: AREDS report 30, a prospective cohort study from the Age-Related Eye Disease Study. Am. J. Clin. Nutr. 2009; 90:1601-70.); когнитивные нарушения в результате хирургического вмешательства или травматического повреждения головного мозга, такие как, например, в результате сотрясения мозга (Lewis M. et. al. Therapeutic use of omega-3 fatty acids in severe head trauma. Am J Emerg Med. 2013 Jan; 31(1): 273.e5-8. doi: 10.1016/j.ajem.2012.05.014. Epub 2012 Aug 3; Mills JD. et. al. Dietary supplementation with the omega-3 fatty acid docosahexaenoic acid in traumatic brain injury. Neurosurgery. 2011 Feb; 68(2): 474-81; discussion 481. doi: 10.1227/NEU.0b013e3181ff692b.); большая депрессия, суицидальное поведение, послеродовая депрессия (Logan AC. Omega-3 fatty acids and major depression: a primer for the mental health professional. Lipids Health Dis. 2004 Nov 9; 3: 25; Lewis MD et al. Suicide deaths of active-duty US military and omega-3 fatty-acid status: a case-control comparison. J Clin Psychiatry. 2011 Dec; 72(12): 1585-90. doi: 10.4088/JCP.11m06879. Epub 2011 Aug 23; Makrides M. et. al. Docosahexaenoic acid and post-partum depression - is there a link? Asia Pac J Clin Nutr. 2003; 12 Suppl: S37.); воспаление (Kelley DS et. al. DHA supplementation decreases serum C-reactive protein and other markers of inflammation in hypertriglyceridemic men. J Nutr. 2009 Mar; 139(3): 495-501. doi: 10.3945/jn.108.100354. Epub 2009 Jan 21.); первичный склерозирующий холангит (Martin CR. et. al. The safety and efficacy of oral docosahexaenoic acid supplementation for the treatment of primary sclerosing cholangitis - a pilot study. Aliment Pharmacol Ther. 2012 Jan; 35(2): 255-65. doi: 10.1111/j.1365-2036.2011.04926.x. Epub 2011 Nov 30.), пограничное расстройство личности у женщин (Zanarini МС et al. Омега-3 Fatty acid treatment of women with borderline personality disorder: a double-blind, placebo-controlled pilot study. Am J Psychiatry. 2003 Jan; 160(1): 167-9.), рак молочной железы (Bougnoux P. et al. Improving outcome of chemotherapy of metastatic breast cancer by docosahexaenoic acid: a phase II trial. Br J Cancer. 2009 Dec 15; 101(12): 1978-85. doi: 10.1038/sj.bjc.6605441. Epub 2009 Nov 17.), неалкогольная жировая болезнь печени (Parker НМ. et. al. Omega-3 supplementation and non-alcoholic fatty liver disease: a systematic review and meta-analysis. J Hepatol. 2012 Apr; 56(4): 944-51. doi: 10.1016/j.jhep.2011.08.018. Epub 2011 Oct 21; Nobili V. Docosahexaenoic acid for the treatment of fatty liver: Randomised controlled trial in children. Nutr Metab Cardiovasc Dis. 2012 Dec 7. pii: S0939-4753(12)00256-6. doi: 10.1016/j.numecd.2012.10.010. [Epub ahead of print]; Christopher M.D. et. al. Menhaden oil decreases high-fat diet-induced markers of hepatic damage, steatosis, inflammation, and fibrosis in obese Ldlr-/- mice. J Nutr. 2012 Aug; 142(8): 1495-503. doi: 10.3945/jn.112.158865. Epub 2012 Jun 27.) и улучшение познавательной способности и поведения у детей (Richardson AJ. et. al. Docosahexaenoic acid for reading, cognition and behavior in children aged 7-9 years: a randomized, controlled trial (the DOLAB Study). PLoS One. 2012; 7(9): e43909. doi: 10.1371/journal.pone.0043909. Epub 2012 Sep 6.). Данные состояния или нарушения можно лечить путем введения композиций, описанных в данном документе, субъекту, как правило, человеку, нуждающемуся в таком введении.
НАБОРЫ
[0154] В данный документ включены фармацевтические наборы в упаковке. Наборы содержат композиции, описанные в данном документе, в виде единичных лекарственных форм в контейнере и инструкции по применению лекарственной формы для лечения субъекта с заболеванием или нарушением, поддающимся лечению путем введения лекарственных форм, содержащих композиции, описанные в данном документе.
[0155] Фармацевтические наборы в упаковке предусматривают информацию по применению лекарственного средства, информацию по медицинскому применению отпускаемого без рецепта лекарственного средства и/или информацию о пищевой ценности лекарственной формы, например и без ограничения, для субъекта или специалиста, обеспечивающего медицинское обслуживание, или в виде этикетки в фармацевтическом наборе в упаковке. Информация, входящая в набор, может включать, например и без ограничения, информацию об эффективности, способе применения и дозах, противопоказаниях и нежелательных реакциях, относящихся к лекарственной форме омега-3 жирных кислот. Информация о способе применения и дозах, например, может включать частоту приема, а также введение композиции с пищей или без пищи.
[0156] В определенных вариантах осуществления лекарственные формы, содержащие композиции, предусмотренные в данном документе, находятся в виде жидкости или капсул, предоставляемых либо в блистерных упаковках, либо во флаконах вместе с информацией по медицинскому применению отпускаемого без рецепта лекарственного средства и/или информацией о пищевой ценности.
[0157] Фармацевтические наборы в упаковке могут содержать одну или несколько композиций, описанных в данном документе, в качестве единственного активного ингредиента. В других вариантах осуществления одну или несколько композиций, описанных в данном документе, можно упаковывать в комбинации с одним или несколькими действующими веществами, не являющимися сложным эфиром омега-3, такими как, например и без ограничения, одно или несколько других гиполипидемических или гипохолестеринемических средств, выбранных из группы, состоящей из ингибиторов абсорбции холестерина, секвестрантов желчных кислот/смол, статинов, ниацина и производных, ингибиторов МТР, фибратов и ингибиторов СЕТР.
ЛЕКАРСТВЕННЫЕ ФОРМЫ
[0158] Любую из композиций, предусмотренных в настоящем документе, содержащих по меньшей мере один сложный эфир омега-3 жирной кислоты, можно получить в виде фармацевтической композиции, нутрицевтического состава или пищевой добавки.
[0159] Фармацевтические композиции, описанные в данном документе, могут дополнительно включать одно или несколько фармацевтически приемлемых вспомогательных веществ. Фармацевтически приемлемые вспомогательные вещества включают, но без ограничений, носители, консерванты и/или красители. Общие положения по составлению и/или изготовлению фармацевтических композиций можно найти, например, в Remington The Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005.
[0160] В определенных вариантах осуществления композиции, описанные в данном документе, можно составлять в виде жидкости для перорального введения. Жидкие композиции включают растворы, суспензии и эмульсии. Примеры жидких фармацевтических препаратов включают растворы пропиленгликоля и растворы, содержащие подсластители для растворов, суспензий и эмульсий для перорального введения. При контакте жидкой композиции с водной средой, такой как, например, водная среда, характеризующаяся кислыми условиями, композиция образует мицеллы.
[0161] В определенных вариантах осуществления лекарственная форма содержит мицеллы, предварительно сформировавшиеся до введения субъекту, нуждающемуся в таком введении. Такие предварительно сформировавшиеся мицеллы являются стабильными при комнатной температуре.
[0162] В других вариантах осуществления композиции, описанные в данном документе, можно составлять в виде наполняющего материала для мягкой желатиновой капсулы. Аналогичным образом, при контакте содержимого мягкой желатиновой капсулы с водной средой композиция образует мицеллы после растворения капсулы.
[0163] Капсулу можно получить, например, путем помещения композиции, описанной выше, внутрь оболочки капсулы. Капсула является лекарственной формой, которую вводят как специальный контейнер или корпус, содержащий действующее вещество. В некоторых вариантах осуществления композициями, описанными в данном документе, можно заполнять мягкие капсулы. Оболочку капсулы можно изготавливать из метилцеллюлозы, гидроксипропилметилцеллюлозы, поливиниловых спиртов или денатурированных желатинов или крахмала или другого материала. Капсулы в твердой оболочке, как правило, изготавливают из смеси желатинов костей и свиной кожи с относительно высокой прочностью студня. В некоторых вариантах осуществления единичной лекарственной формой является желатиновая капсула. В некоторых вариантах осуществления оболочка капсулы является глицериновой оболочкой капсулы, например, продукт № GSU0051, изготовляемый SwissCaps и который соответствует требованиям USP 25 (SwissCaps, USA 14193 SW 119th Ave., Miami/Fla., U.S. 33186). В других вариантах осуществления капсула представляет собой оболочку из бычьего желатина, например, SwissCaps продукт № GSU0708. Другие пригодные материалы оболочек капсул включают полиэтилен, полипропилен, поли(метилметакрилат), поливинилхлорид, полистирол, полиуретаны, политетрафторэтилен, найлоны, полиформальдегиды, сложные полиэфиры, ацетат целлюлозы и нитроцеллюлозу. Сама оболочка капсулы может содержать небольшие количества красителей, кроющих средств, пластификаторов и консервантов. Традиционные способы получения других твердых лекарственных форм, например, капсул, суппозиториев и т.п., также хорошо известны. Оболочки желатиновых капсул также можно изготавливать из тапиоки, трав, полученного из растений или рыбы желатина. Например, K-CAPS (Capsuline, Inc. Помпано Бич, Флорида) является сертифицированной кошерной оболочкой мягкой капсулы растительного происхождения. Другие полученные из растений желатиновые капсулы можно получать из гидроксипропилметилцеллюлозы (НРМС) растительного происхождения. Оболочки капсул также могут содержать модифицированный кукурузный крахмал, глицерин и каррагинан в качестве желатинирующего средства.
[0164] В других вариантах осуществления капсула имеет оболочку, содержащую материал ограничивающей скорость мембраны, включая покрывающие материалы, и заполнена композициями, описанными в данном документе. Оболочки капсул могут изготавливаться из пористого или рН-чувствительного полимера, полученного с помощью процесса горячего формования. В определенных вариантах осуществления оболочка капсулы выполнена в виде асимметричной мембраны; т.е. мембраны, которая имеет тонкую оболочку на одной поверхности и большую часть толщины которой составляет высокопроницаемый пористый материал.
[0165] Можно применять еще одну пригодную капсулу, "устройство с набухающей пробкой". Композиции, описанные в данном документе, можно заключать в нерастворяющуюся капсулу - половину устройства, которая запечатана на одном конце с помощью пробки из гидрогеля. Такая пробка из гидрогеля набухает в водной среде и после набухания течение заранее определенного времени, выходит из капсулы, тем самым открывая проход, через который действующее вещество может выходить из капсулы и доставляться в водную среду. Предпочтительными закупоренными гидрогелем капсулами являются капсулы, которые практически не характеризуются высвобождением действующего вещества из лекарственной формы, прежде чем лекарственная форма покинет желудок и проведет в тонком кишечнике приблизительно 15 минут или более, предпочтительно приблизительно 30 минут или более, тем самым гарантируя минимальное высвобождение сложных эфиров омега-3 жирной кислоты в желудке или в тонком кишечнике. Закупоренные гидрогелем капсулы данного типа описаны в заявке на патент WO 90/19168.
[0166] Лекарственные формы могут содержать пластификатор, в частности, в оболочке капсулы. Пригодные пластификаторы включают, например, полиэтиленгликоли, такие как PEG 300, PEG 400, PEG 600, PEG 1450, PEG 3350 и PEG 800, стеариновую кислоту, пропиленгликоль, олеиновую кислоту, триэтилцеллюлозу, триацетин, глицерин, сорбит, сорбитан или их комбинации.
[0167] В дополнительных вариантах осуществления композиции можно составлять в виде жидкости для парентерального введения.
[0168] Композиции можно составлять в виде одной или нескольких единиц дозирования. В некоторых вариантах осуществления может являться предпочтительным составление композиций для перорального введения в единичной форме дозирования для простоты введения и однородности дозирования. Единичные формы дозирования, описанные в некоторых вариантах осуществления, могут относиться к физически дискретным единицам, пригодным в качестве единичных доз для субъекта, подлежащего лечению; причем каждая единица содержит заранее определенное количество активной композиции, рассчитанное для получения желаемого терапевтического эффекта в сочетании с пригодным фармацевтическим носителем. В определенных вариантах осуществления лекарственная форма может необязательно содержать ароматизатор, такой как апельсиновое масло, практически чистый d-лимонен и антиоксидант, такой как токоферол, аскорбилпальмитат, или комбинации антиоксидантов.
ФУНКЦИОНАЛЬНЫЕ ПИЩЕВЫЕ ПРОДУКТЫ
[0169] В определенных вариантах осуществления композиции, описанные в данном документе, содержат мицеллы, предварительно сформированные до введения субъекту, нуждающемуся в таком введении. Такие предварительно сформированные мицеллы являются стабильными при комнатной температуре.
[0170] Соответственно, либо такие предварительно сформированные мицеллы, либо предварительно мицеллизированные композиции, описанные в данном документе, можно добавлять к пищевым продуктам, которые затем могут потребляться как часть здорового питания для повышения уровней омега-3 жирных кислот у субъекта, или в качестве диетического лечения в дополнение к пероральному/парентеральному введению композиций, описанных в данном документе, назначенному медицинским работником.
[0171] В определенных вариантах осуществления функциональный пищевой продукт находится в форме пригодных для употребления в пищу или для питья композиций, например, продуктов питания, таких как жевательные или пригодные для употребления в пищу плитки, кондитерские изделия (например, шоколадные плитки), печенье, сокосодержащие напитки, хлебобулочные изделия или заменители хлебобулочных изделий (например, шоколадные пирожные), сухое печенье, леденцы или жевательная резинка. Примеры жевательных или пригодных для употребления в пищу плиток включают шоколадные плитки или энергетические батончики. Такие функциональные пищевые продукты могут являться особенно пригодными для людей, занимающихся спортом или другими видами физических упражнений.
[0172] В определенных вариантах осуществления функциональные пищевые продукты также могут находиться в форме, например, сливочного масла, маргарина, хлеба, пирожного, молочных коктейлей, мороженого, йогурта и другого кисломолочного продукта.
[0173] В определенных вариантах осуществления функциональный пищевой продукт также может находиться в форме жидкости для нанесения распылением на мясо, салаты и другие продукты.
[0174] Другими формами функциональных пищевых продуктов могут быть зерновые завтраки, такие как, например, зерновые хлопья, мюсли, отруби, овсяная каша.
[0175] Если функциональный пищевой продукт находится в пригодной для питья форме, композиции, описанные в данном документе, можно добавлять непосредственно в напиток, такой как, например, молоко без добавок, молоко с вкусовыми наполнителями, кисломолочные продукты или соки. Композиции будут образовывать мицеллы, содержащие сложные эфиры омега-3 жирных кислот, в пригодном для питья продукте.
[0176] Если функциональный пищевой продукт находится в форме твердого пригодного для употребления в пищу продукта, композиции, описанные в данном документе, можно сначала добавлять в водную среду, где композиция будет образовывать мицеллы, описанные в данном документе. Водную среду, содержащую мицеллы, можно впоследствии либо наносить распылением на твердый пригодный для употребления в пищу продукт, либо смешивать с ингредиентами при изготовлении пригодного для употребления в пищу продукта.
[0177] Настоящее изобретение дополнительно определяется ссылкой на следующие примеры, которые не предназначены для ограничения объема настоящего изобретения. Специалистам в данной области будет очевидно, что можно осуществлять различные модификации как материалов, так и способов, без отступления от цели и интересов настоящего изобретения.
НЕОГРАНИЧИВАЮЩИЕ ДЕМОНСТРАЦИОННЫЕ ПРИМЕРЫ
ПРИМЕР 1
[0178] Количество и процентное содержание ингредиентов, составляющих композицию, показано в таблице 1.

[0179] Процесс изготовления лекарственной формы, содержащей один вариант осуществления композиции, можно разделить на три этапа: а) процесс изготовления композиции (масса наполнения), b) процесс изготовления желатиновой массы, применяемой для инкапсулирования массы наполнения и с) процесс инкапсулирования. Этапы (а) и (b) можно осуществлять в любом порядке.
[0180] Процесс изготовления композиции начинается со взвешивания соответствующих количеств полисорбата 80 и Pluronic F87 в соответствии с требуемым размером партии и перемешивания их до однородного состояния при 60°С в резервуаре из нержавеющей стали. Данную смесь оставляют охлаждаться до комнатной температуры перед количественным переносом с помощью вакуума смеси практически чистых сложных этиловых эфиров омега-3 жирных кислот в тот же резервуар из нержавеющей стали, содержащий полисорбат 80 и Pluronic F87. Данную смесь снова перемешивают до однородного состояния при комнатной температуре перед покрытием азотом. Данную окончательную композицию также называют "масса наполнения".
[0181] Процесс изготовления гелевой массы начинается со взвешивания соответствующих количеств каждого из глицерина и воды в соответствии с требуемым размером партии и перемешивания их до однородного состояния в отдельном смесителе из нержавеющей стали при приблизительно 80°С. Далее, соответствующее количество желатина взвешивают в соответствии с размером партии, добавляют к смеси глицерин/вода и снова перемешивают до однородного состояния при 80°С перед дегазацией в вакууме. Данную окончательную смесь, содержащую глицерин/воду/желатин называют "желатиновая масса".
[0182] В зависимости от требуемой формы капсулы пригодные штампы и соединительные трубки для переноса устанавливают в машину для наполнения мягких желатиновых капсул (капсульная машина для получения мягких желатиновых капсул SS-60 Softgel Encapsulation Machine от SKY Softgel Co. Ltd., Инчхон, Корея). Массу наполнения накачивают в штампы, содержащие предварительно сформированную ленту, содержащую полутвердую желатиновую массу. Штампы формируют мягкие желатиновые капсулы, которые затем подвергают барабанной сушке в течение приблизительно 20-60 мин. Капсулы переносят на поднос и высушивают в сушильной камере с низкой температурой и влажностью и сушат до достижения капсулами твердости выше 75 по Шору. Капсулы затем проверяют, сортируют, полируют, наносят оттиски и упаковывают во флаконы. На флаконы прикрепляют этикетку, которая включает информацию по применению препарата. Альтернативно, флаконы можно упаковывать в коробки с листком-вкладышем в упаковке, который включает информацию по применению препарата.
ПРИМЕР 2
[0183] Проводили эксперименты по определению образования мицелл в двух композициях, А и В, которые показаны в таблице 2. Обе композиции получали как описано в примере 1, композиции содержали сложные этиловые эфиры омега-3 жирных кислот, где сложные этиловые эфиры омега-3 жирных кислот характеризовались повышенной абсорбцией, и влияние пищи было практически устранено.
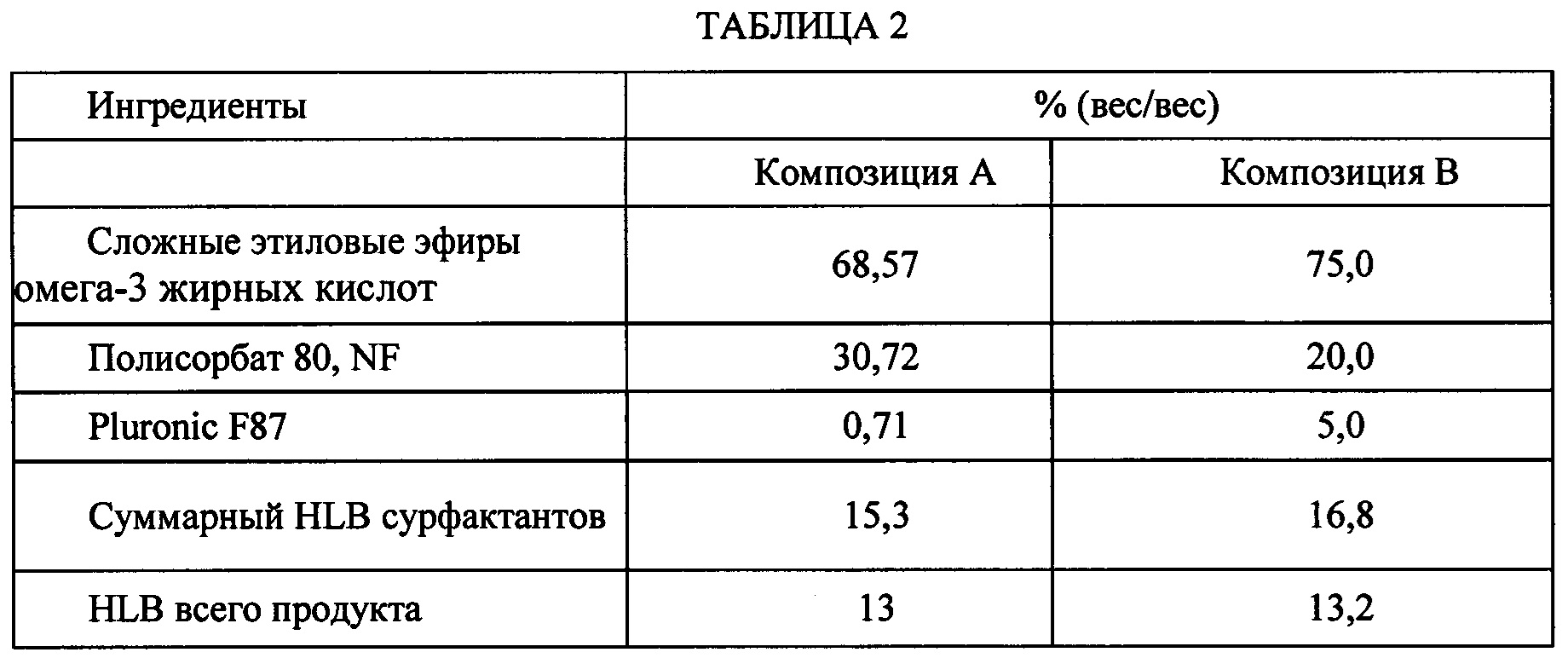
[0184] Композиции, которые образовывали хорошо диспергированные мицеллы, как правило, характеризовались суммарным значением HLB сурфактантов от приблизительно 15 до приблизительно 17.
[0185] Другие композиции с уровнями полисорбата 80 в пределах 27-29% в комбинации с Pluronic F87 от приблизительно 7% до приблизительно 22%, как
правило, образовывали крупные глобулы масла. Данные композиции характеризовались суммарным значением HLB сурфактантов от приблизительно 17 до приблизительно 19. Исходя из этих экспериментов HLB всего продукта составлял от приблизительно 13 и приблизительно 14,4, а суммарный HLB сурфактантов составлял от приблизительно 12 до приблизительно 17.
ПРИМЕР 3
[0186] Композиции А и В (1000 мг), которые показаны в таблице 2, добавляли в отдельные контейнеры, содержащие 500-900 мл воды в 0,1 н. HCl, в условиях 2 полного растворения согласно Фармакопее США, как описано в General Chapter 711, United States Pharmacopeia, 34/National/2011, и наблюдали. Ни одну из композиций не подвергали встряхиванию или усилию сдвига. При исследовании под микроскопом наблюдали очень малые, хорошо диспергированные мицеллы. Мицеллы оставались стабильными в течение более двенадцати месяцев при комнатной температуре, и выраженное отделение сложных эфиров омега-3 жирных кислот от других ингредиентов композиции отсутствовало. Таким образом, композиции, которые содержали уровни полисорбата 80 в пределах 20-31% в комбинации с Pluronic F87 от 0,7 до 5%, образовывали стабильные мицеллы.
ПРИМЕР 4
[0187] Субъект-человек принимал внутрь композицию А из примера 2 ("экспериментальная композиция"), и осуществляли мониторирование показателей крови для измерения увеличения абсорбции сложных этиловых эфиров омега-3 жирных кислот по сравнению со сложными этиловыми эфирами омега-3 жирных кислот в композиции, содержащей сложные этиловые эфиры омега-3 жирных кислот, которая является представителем зарегистрированных для продажи в настоящее время лекарственных средств и продуктов питания, содержащих омега-3 ("стандартная композиция"). Стандартную композицию получали путем инкапсулирования сложных этиловых эфиров омега-3 жирных кислот, применяя стандартные способы инкапсулирования. Абсорбцию сложных этиловых эфиров омега-3 жирных кислот определяли путем сравнения изменений индекса Omegalndex у субъекта после приема композиций при измерении с помощью тестового набора Omegalndex test kit от OmegaQuant. Перед приемом композиции у субъекта брали кровь для определения исходного индекса Omegalndex. Затем субъект принимал внутрь мягкие желатиновые капсулы, содержащие либо экспериментальную композицию, либо стандартную композицию. Последующий забор крови осуществляли через четыре часа после приема. Субъект оставался в голодном состоянии от первоначального исходного забора крови вплоть до взятия крови через четыре часа. Результаты приведены в таблице 4.
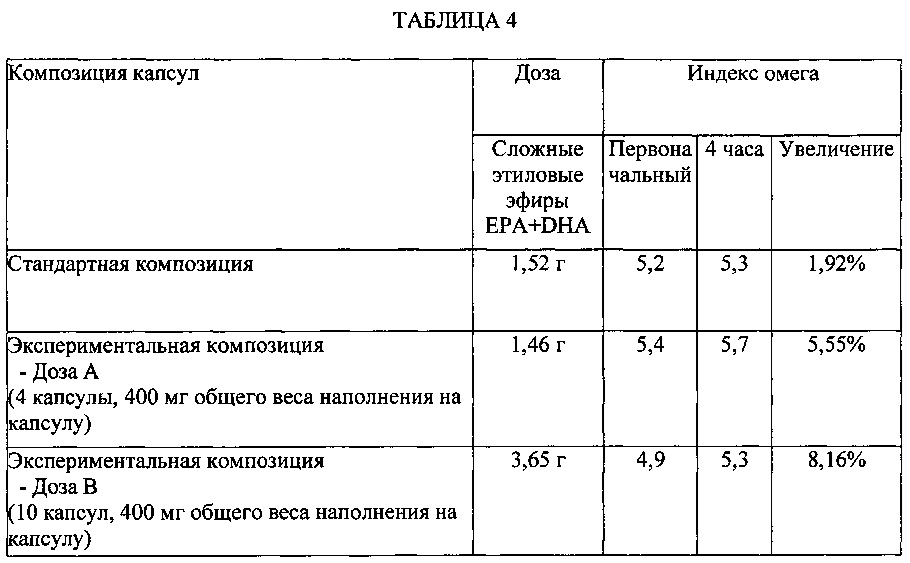
ПРИМЕР 5
[0188] Открытое, рандомизированное, проводимое на 3 параллельных группах, предварительное исследование клинической эффективности проводили для оценки эффективности снижения TG в сыворотке крови и безопасности капсул SC401 1100 мг (полученных как описано в примере 1) по сравнению с капсулами LOVAZA® (сложные этиловые эфиры омега-3-кислот) 1000 мг, по сравнению с плацебо у субъектов с гипертриглицеридемией с TG в сыворотке крови от 250 до 500 мг/дл при приеме доз натощак.
[0189] Целью данного исследования являлась оценка эффективности SC401 по снижению TG по сравнению с LOVAZA® и по сравнению с плацебо в течение 14 дней лечения. В исследование включали 45 субъектов для того, чтобы исследование завершили по меньшей мере 12 субъектов в каждой из трех групп лечения.
[0190] Следующие критерии включения и исключения использовали для отбора субъектов для данного исследования.
[0191] КРИТЕРИИ ВКЛЮЧЕНИЯ:
- Мужчины и женщины в возрасте 18 лет или старше;
- уровень TG в сыворотке крови от 200 до 500 мг/дл.
- Обычно активные и здоровые на основе анамнеза, краткого объективного обследования, электрокардиограммы и рутинных лабораторных тестов.
- Без избыточного либо недостаточного веса для его/ее роста в соответствии с прилагаемой таблицей значений роста/веса (смотри прилагаемую таблицу роста/веса).
- предоставление письменного информированного согласия.
- Женщины, способные к деторождению, в течение всего срока исследования должны применять приемлемый способ контрацепции по оценке исследователя (исследователей), например, презервативы, пенки, желе, диафрагму, внутриматочное средство (IUD) или половое воздержание; или находиться в периоде постменопаузы в течение по меньшей мере 1 года; или являться стерилизованными хирургическим путем (двусторонняя перевязка маточных труб, двустороннее удаление яичников или удаление матки).
[0192] КРИТЕРИИ ИСКЛЮЧЕНИЯ:
- Тяжелая гипертриглицеридемия (TG в сыворотке крови >500 мг/дл).
- Непереносимость омега-3 или рыбы.
- Применение омега-3 жирных кислот рыбьего жира, другого ЕРА или DHA и/или обогащенных DHA продуктов питания или других снижающих уровень TG лекарственных средств в течение трех месяцев после первоначального введения исследуемого лекарственного средства или в течение исследования.
- Употребление любой рыбы в течение семи дней после первоначального введения исследуемого лекарственного средства или в течение исследования.
- Определенные заболевания сердца, почек, печени, легких или желудочно-кишечного тракта, или рак (за исключением немеланоцитарного рака кожи) в ближайшем анамнезе.
- Диабет или получение инсулинотерапии.
- Беременные и лактирующие женщины. Женщины, способные к деторождению, которые не применяют способы контрацепции, одобренные с медицинской точки зрения.
- Применение определенных видов гормонов, противосудорожных лекарственных средств, иммунологических лекарственных средств, антибиотиков, противогрибковых и противовирусных лекарственных средств и кардиотропных лекарственных средств.
- Применение варфарина (кумадина).
- Злоупотребление наркотическими веществами или злоупотребление алкоголем в ближайшем анамнезе (за прошлые 12 месяцев).
- Воздействие любого экспериментального продукта в течение 28 дней до введения исследуемого лекарственного средства.
- Субъекты, у которых диагностированы следующие состояния:
- эндокринный инсулинозависимый сахарный диабет, гипотиреоз, беременность;
- ожирение, обусловленное питанием, употребление алкоголя;
- нефротическое заболевание почек, хроническая почечная недостаточность;
- заболевание печени холестаз, гепатоцеллюлярная дисфункция;
- парапротеинемия с избытком иммуноглобулина;
- подагра;
- любое другое состояние, которое по мнению исследователя может препятствовать возможности пациента давать информированное согласие, соблюдать инструкции исследования или которое может затруднить интерпретацию результатов исследования или подвергнуть пациента неоправданному риску; и субъекты, принимающие следующие лекарственные средства: тиазидные диуретики, стероидные гормоны, микросомальные ферменты, производные ретиноевой кислоты, ингибиторы протеаз (инфекция HIV).
[0193] Документ информированного согласия (ICD) прочитывался добровольцем и подписывался до конкретных процедур исследования. Дополнительно проводили следующие тесты при посещении медицинского учреждения в каждый период:
- анализ мочи с целью выявления злоупотребления наркотическими веществами, включая кокаин, каннабис, амфетамины, барбитураты, бензодиазепины и опиаты. Субъектов не допускали/исключали из исследования, если результат в отношении данных наркотических веществ был положительным,
- проба на алкоголь в выдыхаемом воздухе - субъектов не допускали/исключали из исследования, если результат в отношении алкоголя был положительным,
- анализ мочи на беременность (HCG) (только для субъектов женского пола) - субъектов женского пола не допускали/исключали из исследования, если результат в отношении беременности был положительным, и
- гинекологическое обследование и обследование молочных желез (только для субъектов женского пола) - субъектов не допускали/исключали из исследования в случае наличия любых отклонений при обследовании.
[0194] Субъектов помещали в медицинское учреждение заранее перед применением лекарственного средства, от по меньшей мере 48 часов до по меньшей мере 14 дней, и просили оставаться в учреждении в течение 16 ночей подряд.
[0195] Субъекты воздерживались от пищи в течение по меньшей мере 10 часов до утреннего введения дозы и получали указание воздерживаться от употребления продуктов, содержащих кофеин и/или ксантин (т.е. кофе, чая, шоколада и кофеин-содержащих газированных напитков, колы и т.д.), алкоголя и витаминных добавок, включая витамин С и аскорбиновую кислоту, и грейпфрута и его сока, в течение по меньшей мере 48 часов до введения дозы и на протяжении всего исследования. В течение исследования не предоставляли цитрусовые соки, включая апельсиновый сок и сок грейпфрута.
[0196] После ночного голодания в течение 10 часов субъектам вводили дозу в условиях монохроматического света или низкой освещенности следующим образом:
[0197] 2 капсулы (в виде разовой дозы) SC401 (сложные этиловые эфиры омега-3 жирных кислот, 1100 мг), принимаемые после пробуждения (по меньшей мере за 2 часа до завтрака, принимались только с водой на пустой желудок); затем 2 капсулы (в виде однократной дозы), принимаемые перед сном (по меньшей мере через 2 часа после ужина, принимались только с водой, и после этого никакой пищи или жидкостей в течение ночи), или
[0198] 2 капсулы (в виде разовой дозы) LOVAZA® (сложные этиловые эфиры омега-3 жирных кислот, 1000 мг, от GlaxoSmithKline, RTP, NC 2770), принимаемые после пробуждения (по меньшей мере за 2 часа до завтрака, принимались только с водой на пустой желудок); затем 2 капсулы (в виде однократной дозы), принимаемые перед сном (по меньшей мере через 2 часа после ужина, принимались только с водой, и после этого никакой пищи или жидкостей в течение ночи), или
[0199] 2 капсулы (в виде разовой дозы) плацебо (этилолеат, капсулы по 1000 мг), принимаемые после пробуждения (по меньшей мере за 2 часа до завтрака, принимались только с водой на пустой желудок); затем 2 капсулы (в виде разовой дозы), принимаемые перед сном (по меньшей мере через 2 часа после ужина, принимались только с водой, и после этого никакой пищи или жидкостей в течение ночи).
[0200] Количества сложных этиловых эфиров омега-3 жирных кислот, входящих в состав Lovaza, SC401 и плацебо, приведены в таблице 5 ниже.
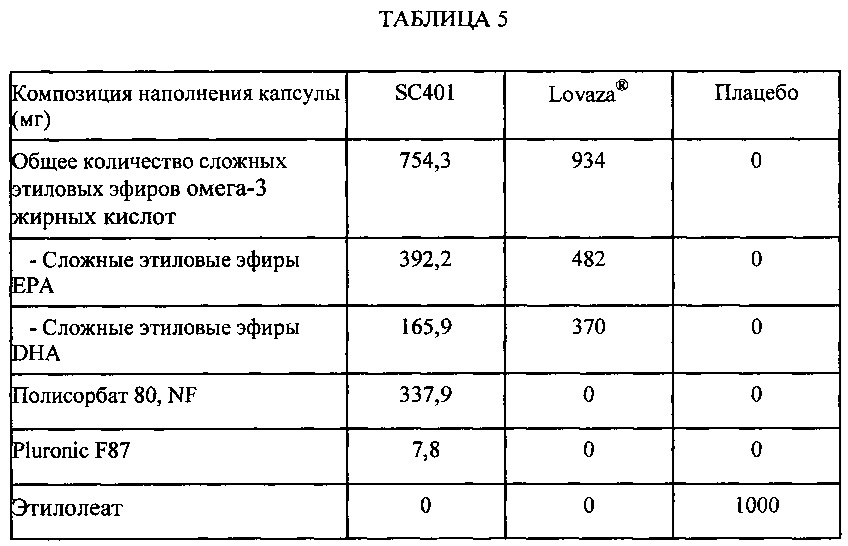
[0201] Собирали 4 пробы крови (по 8 мл каждая) в течение периода исследования. Пробы крови собирают в моменты времени Ts, Т0, T7d, T14d в простые вакуумные пробирки путем прямой пункции вены. Вакуумные пробирки помещали вертикально в штатив, который держали на ледяной бане с водным льдом до передачи в отделение диагностики.
[0202] Для каждого пациента в каждой из трех групп определяли уровни триглицеридов/HDL/LDL/общего холестерина/не-HDL/ натощак во моменты времени Ts, Т0, T7d, T14d.
[0203] Данные приведены в таблице 6 ниже.