ГЕТЕРОЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ И ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО
Вид РИД
Изобретение
Область изобретения, к которой относится изобретение
Настоящее изобретение относится к новым гетероциклическим производным.
Уровень техники
Простагландины (PG) в изобилии продуцируются в месте воспаления и участвуют в развитии воспаления. Продукция простагландинов инициируется высвобождением арахидоновой кислоты из глицерофосфолипидов мембраны под действием фосфолипазы А2, арахидоновая кислота затем преобразуется в простагландин Н2 (PGH2) под действием циклооксигеназы (COX). PGH2 преобразуется в простагландины, в том числе в простагландин Е2 (PGE2), простагландин F2α (PGF2α), простагландин D2 (PGD2), простагландин I2 (PGI2) и тромбоксан А2 (ТХА2). Эти простагландины, как известно, имеют различную физиологическую или патофизиологическую активность, включая эффект индукции воспаления. Известно, что PGE2 главным образом вызывает воспаление при острых и хронических воспалений и также вызывает гипертермию и гиперпатию. Нестероидные противовоспалительные лекарственные средства (NSAID) и селективные ингибиторы COX-2 обладают противовоспалительным эффектом посредством уменьшения продукции PGE2 благодаря ингибирующему эффекту COX-1 и/или COX-2. PGE2 синтаза (PGES) катализирует конечную стадию пути синтеза PGE2, который является медиатором воспаления. На сегодняшний день известно три подтипа PGES, микросомальная простагландин Е-синтаза-1 (mPGES-1) [например, непатентный документ 1], mPGES-2 [например, непатентный документ 2] и цитозольная простагландин синтаза (cPGES) [например, непатентный документ 3]. Среди них mPGES-1, так же как и COX-2, преимущественно индуцируется во время воспаления и играет важную роль в продукции PGE2 при воспалительном поражении. С другой стороны, cPGES конститутивно экспрессируется PGES и связывается с COX-1, играя роль в продукции базального PGE2 [например, непатентный документ 4]. Что касается mPGES-2, то данные в отношении его противоречивы, так как сообщалось, что он может связываться с обоими изоформами COX. Исследования мышей с дефицитом mPGES-1 позволяет предположить, что mPGES-1 способствует патологическому прогрессу в различных моделях воспаления, например, в модели корчей, индуцированных уксусной кислотой (например, непатентный документ 5), модели артрита (например, непатентные документы 5 и 6), модели рассеянного склероза (например, непатентный документ 7), модели лихорадки (например, непатентный документ 8). Кроме того, ингибиторы mPGES-1 специфично ингибируют COX-2-зависимую продукцию PGE2 и, таким образом, продолжительно уменьшают различные побочные эффекты, по сравнению с NSAID или ингибиторами COX-2. Полагают, что повышенный риск сердечно-сосудистых реакций, вызываемых ингибиторами COX-2, связывают с повышенной активностью свертывающей системы и сужением сосудов при ингибировании COX-2-зависимой продукции PGI2 (например, непатентный документ 9). В противоположность этому полагают, что ингибиторы mPGES-1 не повышают риск сердечно-сосудистых реакций, но его связывают с ингибиторами COX-2, так как они не ингибируют продукцию PGI2 (например, непатентный документ 10). Предполагают, что ингибиторы mPGES-1, служат надежным противовоспалительным средством путем ингибирования только продукции PGE2, участвующего в воспалении. Таким образом, фармацевтическое средство, которое способно ингибировать mPGES-1, и уменьшать продукцию PGE2 может использоваться для профилактики или лечения заболевания, такого как воспалительное заболевание, в котором участвует mPGES-1. Ингибиторы mPGES-1 описаны в патентных заявках NovaSAID AB (патентные документы 1 и 2) и Boehringer Ingelheim International GmbH (патентный документ 3).
ДОКУМЕНТЫ УРОВЕНЯ ТЕХНИКИ
Патентные документы
Патентный документ 1 WO2009/103778
Патентный документ 2 US2010/0324086
Патентный документ 3 WO2011/048004
Непатентные документы
Непатентный документ 1 Jakobsson et al., Proc. Natl. Acad. Sci. USA, 1999, 96, 7220-7225
Непатентный документ 2 Tanikawa et al., Biochem. Biophys. Res. Commun., 2002, 291, 884-889
Непатентный документ 3 Tanioka et al., J. Biol. Chem., 2000, 275, 32775-32782
Непатентный документ 4 Murakami et al., J. Biol. Chem., 2000, 275, 32783-32792
Непатентный документ 5 Kamei et al., J. Biol. Chem., 2004, 279, 33684-33695
Непатентный документ 6 Kojima et al., J. Immunol., 2008, 108, 3861-3868
Непатентный документ 7 Kimura et al., Proc. Natl. Acad. Sci. USA, 2000, 106, 21807-21812
Непатентный документ 8 Engblom et al., Nat. Neurosci., 2003, 6, 1137-1138
Непатентный документ 9 Foudi et al., Cardiovasc. Res., 2009, 81, 269-277
Непатентный документ 10 Cheng et al., J. Clin. Invest., 2006, 116, 1391-1399
Непатентный документ 11 J. Biol. Chem., 2004, 279(13), 12647-12658
Непатентный документ 12 Biomed. Pharmacother., 2011, 65(1), 77-84
Непатентный документ 13 Acta. Med. Okayama, 2008, 62(6), 373-378
Непатентный документ 14 Proc. Natl. Acad. Sci. USA, 2009, 106, 21807-21812
Непатентный документ 15 J. Biol. Chem., 279(32), 33684-33695
Непатентный документ 16 J. Immunol., 2008, 180, 8361-8368
Непатентный документ 17 Glia, 2011, 59, 208-218
Непатентный документ 18 J. Burn. Care. Res., 2011, 32(1), 79-90
Непатентный документ 19 J. Biol. Chem., 2003, 278(21), 19396-19405
Непатентный документ 20 Oncogene, 2012, 31(24), 2943-2952
Непатентный документ 21 Cancer Res., 2008, 68(9), 3251-3259
Непатентный документ 22 Proc. Natl. Acad. Sci. USA, 2006, 103, 14507-14512
Непатентный документ 23 Proc. Natl. Acad. Sci. USA, 2006, 103(31), 11790-11795
Непатентный документ 24 J. Rheumatol., 2005, 32(5), 887-895
Непатентный документ 25 J. Pharmacol. Exp. Ther., 2008, 326, 754-763
Непатентный документ 26 Почка Int., 2011, 79(1), 77-88
Непатентный документ 27 J. Immunol., 2012, 188, 4093-4102
Непатентный документ 28 Am. J. Physiol. Lung Cell Mol. Physiol., 2004, 287, L981-L991
Непатентный документ 29 Am. J. Physiol. Lung Cell Mol. Physiol., 2005, 288, L1010-L1016
Непатентный документ 30 J. Immunol., 2012, 188, 4093-4102
Непатентный документ 31 Oncogene, 2012, 31(24), 2943-2952
Непатентный документ 32 Arthritis Res. Ther., 2011, 13, R6
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задача, решаемая изобретением
Настоящее изобретение относится к новому гетероциклическому производному или его фармацевтически приемлемой соли. Кроме того, изобретение относится к фармацевтической композиции, содержащей в качестве активного ингредиента такое гетероциклическое производное или его фармацевтически приемлемую соль.
Средства для решения задачи
Настоящее изобретение основано на обнаружении авторами настоящего изобретения, что новое гетероциклическое производное или его фармацевтически приемлемая соль, как описано ниже, обладают превосходной ингибирующей активностью в отношении mPGES-1.
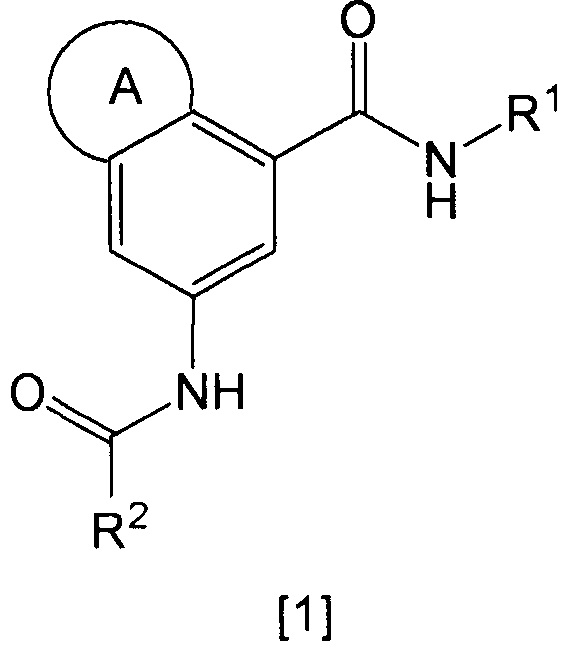
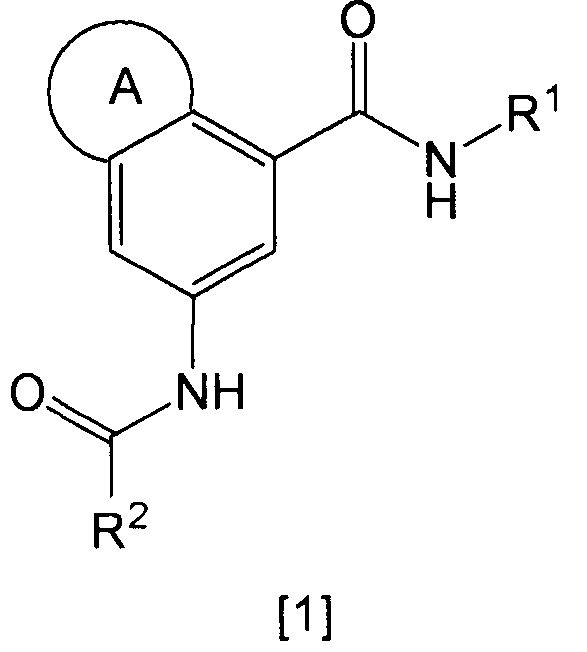
Настоящее изобретение относится к гетероциклическому производному, представленному общей формулой [1], или его таутомеру (в настоящем документе обозначены как "соединение по изобретению"), или к его фармацевтически приемлемой соли.
Химическая формула 1
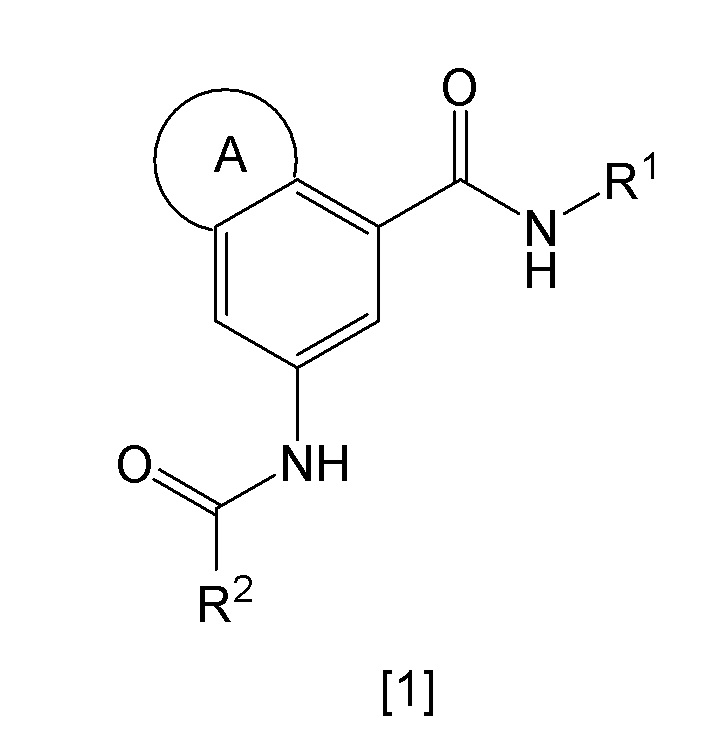 ,
,
где
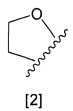
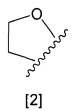
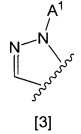
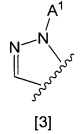
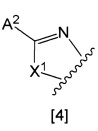
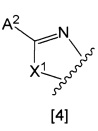
кольцо А представляет собой группу, представленную общими формулами [2], [3] или [4]:
Химическая формула 2
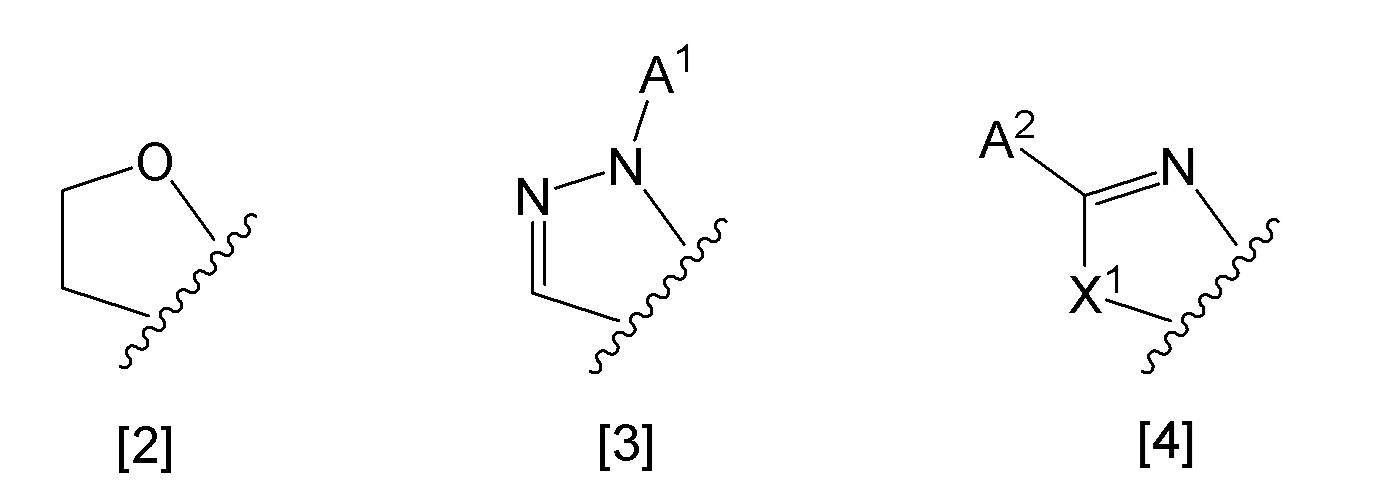 ,
,
где
X1 представляет собой NH, N-алкил, или O;
A1 представляет собой водород или алкил;
A2 представляет собой
i) водород;
ii) галоген;
iii) алкил, необязательно замещенный от одной до трех групп, выбранных из группы, состоящей из галогена, амино, моноалкиламино, диалкиламино, карбамоила, моноалкиламинокарбонила, диалкиламинокарбонила, насыщенного циклического аминокарбонила, алкокси, алкоксиалкокси и алкилкарбонилокси;
iv) циклоалкил, необязательно замещенный алкилом, необязательно замещенным от одного до трех галогенами;
v) алкокси;
vi) насыщенную гетероциклическую группу, необязательно замещенную алкилом, алкилоксикарбонилом, алкилкарбонилом или оксо;
vii) алкилтио;
viii) алкилсульфонил;
ix) алкилсульфинил;
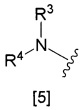
x) группа, представленная общей формулой [5]:
Химическая формула 3
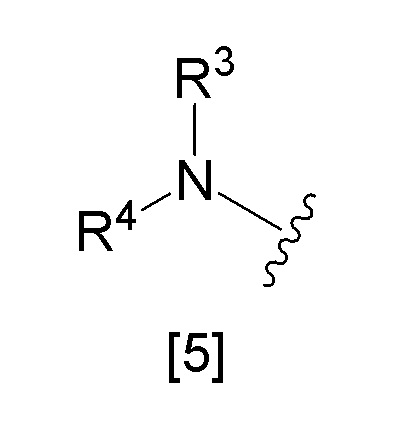 ,
,
где R3 и R4 представляют собой одинаковые или различные группы, выбранные из
a) водорода,
b) алкила, необязательно замещенного группой, выбранной из группы, состоящей из моноалкиламино, диалкиламино, насыщенного циклического амино, необязательно замещенного алкила, насыщенной гетероциклической группы, необязательно замещенного алкила, алкокси, гидроксикарбонила, гидроксила, алкилоксикарбонила и алкилтио, или
c) циклоалкила; или
xi) насыщенного циклического амино, необязательно замещенного алкилом, амино, моноалкиламино, диалкиламино, алкокси или гидроксилом;
R1 представляет собой фенил, бензил, нафтил, циклоалкил, циклоалкилметил, гетероарил, гетероарилметил,
1,2,3,4-тетрагидронафтален-5-ил,
1,2,3,4-тетрагидронафтален-6-ил,
2,3-дигидро-1H-инден-4-ил, 2,3-дигидро-1H-инден-5-ил,
1,2-дигидроциклобутабензол-3-ил,
1,2-дигидроциклобутабензол-4-ил или алкил,
где указанный фенил, бензил, циклоалкил, циклоалкилметил, гетероарил и гетероарилметил необязательно замещен от одной до трех групп, выбранных из группы, состоящей из
i) галогена,
ii) алкила, необязательно замещенного от одной до трех групп, выбранных из группы, состоящей из галогена, гидрокси и фенила,
iii) алкокси,
iv) гидрокси, и
v) циано;
R2 представляет собой фенил или пиридил,
где указанный фенил и пиридил необязательно замещен от одной до трех групп, выбранных из группы, состоящей из
i) галогена,
ii) алкилсульфонила,
iii) алкокси, необязательно замещенного от одного до трех галогенами или алкокси,
iv) алкинила, необязательно замещенного алкоксиалкила или циклоалкила, и
v) алкила, необязательно замещенного от одной до трех групп, выбранных из группы, состоящей из алкокси, алкоксиалкокси, циклоалкила, фенила и галогена.
Предпочтительный вариант осуществления изобретения представляет собой любое из соединений (A)-(C), или его фармацевтически приемлемую соль:
(A) соединение по изобретению или его фармацевтически приемлемую соль, где кольцо А представляет собой группу формулы [4], и X1 представляет собой NH;
(B) соединение по изобретению или его фармацевтически приемлемую соль, где R1 представляет собой фенил,
1,2,3,4-тетрагидронафтален-5-ил,
1,2,3,4-тетрагидронафтален-6-ил,
2,3-дигидро-1H-инден-4-ил,
2,3-дигидро-1H-инден-5-ил,
1,2-дигидроциклобутабензол-3-ил или
1,2-дигидроциклобутабензол-4-ил, и указанный фенил необязательно замещен от одной до трех группами, выбранными из группы, состоящей из
i) галогена,
ii) алкила, необязательно замещенного от одного до трех галогенами,
iii) алкокси и
iv) циано; или
(C) соединение по изобретению или его фармацевтически приемлемую соль, где R2 представляет собой фенил, и указанный фенил необязательно замещен от одной до трех групп, выбранных из группы, состоящей из
i) галогена
ii) алкилсульфонила,
iii) алкокси, необязательно замещенный алкокси,
iv) алкинила, необязательно замещенный алкоксиалкилом или циклоалкилом, и
v) алкила, необязательно замещенного от одной до трех групп, выбранных из группы, состоящей из галогена, алкокси, алкоксиалкокси, циклоалкила и фенила.
Более предпочтительный вариант осуществления изобретения представляет собой соединение по изобретению или его фармацевтически приемлемую соль, где
кольцо А представляет собой группу формулы [4],
X1 представляет собой NH,
A2 представляет собой
i) водород,
ii) алкил, необязательно замещенный группой, выбранной из группы, состоящей из галогена, моноалкиламино, диалкиламино, моноалкиламинокарбонила, диалкиламинокарбонила, насыщенного циклического аминокарбонила, алкокси, алкоксиалкокси и алкилкарбонилокси,
iii) циклоалкил, необязательно замещенный алкилом, необязательно замещенным от одного до трех галогенами,
iv) алкокси,
v) насыщенную гетероциклическую группу, необязательно замещенную алкилом или алкилоксикарбонилом,
vi) алкилтио,
vii) алкилсульфонил,
viii) алкилсульфинил,
ix) амино, замещенный алкилом, где указанный алкил необязательно замещен группой, выбранной из группы, состоящей из моноалкиламино, диалкиламино, насыщенного циклического амино, необязательно замещенного алкила, тетрагидрофурила, морфолино, алкокси, гидроксикарбонила, гидроксила и алкилтио,
x) амино, замещенного циклоалкилом или
xi) насыщенный циклический амино, необязательно замещенный алкилом, диалкиламино, алкокси или гидроксилом, и
R1 представляет собой
i) фенил, необязательно замещенный от одной до трех групп, выбранных из группы, состоящей из галогена, алкила, необязательно замещенного от одного до трех галогенами, алкокси и циано,
ii) 1,2,3,4-тетрагидронафтален-5-ил,
iii) 2,3-дигидро-1H-инден-5-ил,
iv) бензил, необязательно замещенный галогеном или алкилом, необязательно замещенным от одного до трех галогенами,
v) циклоалкил,
vi) циклоалкилметил,
vii) нафтил,
viii) пиридилметил, необязательно замещенный алкил, необязательно замещенный от одного до трех галогенами,
ix) тиенил,
x) тиенилметил,
xi) бензотиазолил,
xii) бензотиадиазолил,
xiii) индолил или
xiv) алкил, и
R2 представляет собой фенил или пиридил,
где указанный фенил необязательно замещен от одной до трех групп, выбранных из группы, состоящей из
i) галогена,
ii) алкилсульфонила,
iii) алкокси, необязательно замещенного алкокси,
iv) алкинила, необязательно замещенного алкоксиалкила или циклоалкила, и
v) алкила, необязательно замещенного от одной до трех групп, выбранных из группы, состоящей из галогена, алкокси, алкоксиалкокси, циклоалкила и фенила, и
указанный пиридил необязательно замещен галогеном.
Другим предпочтительным вариантом осуществления изобретения является соединение по изобретению или его фармацевтически приемлемая соль, где
кольцо А представляет собой группу формулы [4],
X1 представляет собой NH,
A2 представляет собой алкил, замещенный алкокси, диалкиламино, тетрагидрофурилом, тетрагидрофурилметилом, алкоксиалкиламино, или циклоалкил, необязательно замещенный алкилом, необязательно замещенным от одного до трех галогенами,
R1 представляет собой фенил, замещенный одним галогеном и одним метилом, и
R2 представляет собой фенил, необязательно замещенный одним трифторметилом или двумя галогенами.
Особенно предпочтительный вариант осуществления изобретения представляет собой любой соединение из следующих (1)-(239), или его таутомер или его фармацевтически приемлемую соль:
(1) N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(2) N-циклогексил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(3) N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(4) N-[(1-гидроксициклогексил)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(5) N-[2-(трифторметил)бензил]-5-({[2-(трифторметил)фенил]карбонил}амино}-2,3-дигидро-1-бензофуран-7-карбоксамид),
(6) N-циклогексил-5-({[2-(трифторметил)фенил]карбонил}амино)-2,3-дигидро-1-бензофуран-7-карбоксамид,
(7) N-(3-хлор-2-метилфенил)-5-({[2-(трифторметил)фенил]карбонил}амино)-2,3-дигидро-1-бензофуран-7-карбоксамид,
(8) N-циклогексил-5-({[2-(трифторметил)фенил]карбонил}амино)-1H-индазол-7-карбоксамид,
(9) N-[2-(трифторметил)бензил]-5-({[2-(трифторметил)фенил]карбонил}амино)-1H-индазол-7-карбоксамид,
(10) N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(11) 2-метил-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(12) N-циклогексил-2-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(13) N-(3-хлор-2-метилфенил)-2-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(14) N-циклопентил-2-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(15) N-циклобутил-2-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(16) N-(3-хлор-2-метилфенил)-2-этил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(17) N-циклогексил-2-этил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(18) 2-этил-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(19) N-циклогексил-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(20) 2-(метоксиметил)-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(21) 2-(метоксиметил)-N-(2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(22) 2-(метоксиметил)-N-(4-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(23) N-(2-хлорбензил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(24) 2-(метоксиметил)-N-(4-метилбензил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(25) N-(4,4-дифторциклогексил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(26) N-(4-трет-бутилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(27) 2-(метоксиметил)-N-[4-(трифторметил)фенил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(28) N-(2,4-диметилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(29) N-(2-хлор-4-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(30) N-(3,4-диметилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(31) N-(3-хлор-4-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(32) N-(2,3-дигидро-1H-инден-5-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(33) 2-(метоксиметил)-N-(5,6,7,8-тетрагидронафтален-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(34) N-(2-фторфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(35) 2-(метоксиметил)-N-(2-метоксифенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(36) 2-(метоксиметил)-N-(4-метоксифенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(37) N-(3-бром-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(38) N-(3-хлор-2-метилбензил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(39) N-(2,6-дифторфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(40) N-(3-циано-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(41) 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-N-{[3-(трифторметил)пиридин-2-ил]метил}-1H-бензимидазол-4-карбоксамид,
(42) N-(2-хлор-6-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(43) 2-(2-амино-2-оксоэтил)-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(44) 2-(2-амино-2-оксоэтил)-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(45) N-(3-хлор-2-метилфенил)-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(46) N-циклогексил-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(47) 1-метил-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(48) N-(3-хлор-2-метилфенил)-1-этил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(49) N-циклогексил-1-этил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(50) 1-этил-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(51) N-(3-хлор-2-метилфенил)-2-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1,3-бензоксазол-4-карбоксамид,
(52) 2-метил-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1,3-бензоксазол-4-карбоксамид,
(53) N-(3-хлор-2-метилфенил)-2-этил-6-({[2-(трифторметил)фенил]карбонил}амино)-1,3-бензоксазол-4-карбоксамид,
(54) N-(3-хлор-2-метилфенил)-2-этокси-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(55) 2-этокси-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(56) N-(3-хлор-2-метилфенил)-2-(1-хлор-2-метилпропан-2-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(57) N-(3-хлор-2-метилфенил)-2-[(диметиламино)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(58) N-(3-хлор-2-метилфенил)-2-(2-метилпропил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(59) 2-(2-метилпропил)-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(60) трет-бутил 3-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}азетидин-1-карбоксилат,
(61) N-(3-хлор-2-метилфенил)-2-[(метиламино)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(62) {4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}метилацетат,
(63) N-(3-хлор-2-метилфенил)-2-[(2R)-тетрагидрофуран-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(64) 2-[[(2R)-тетрагидрофуран-2-ил]-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(65) N-(3-хлор-2-метилфенил)-2-[(2S)-тетрагидрофуран-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(66) 2-[[(2S)-тетрагидрофуран-2-ил]-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(67) 2-(1-ацетилазетидин-3-ил)-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(68) трет-бутил (2S)-2-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}пирролидин-1-карбоксилат,
(69) трет-бутил (2R)-2-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}пирролидин-1-карбоксилат,
(70) N-(3-хлор-2-метилфенил)-2-[(2S)-пирролидин-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(71) N-(3-хлор-2-метилфенил)-2-[(2S)-1-метилпирролидин-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(72) 2-[(2S)-1-ацетилпирролидин-2-ил]-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(73) N-(3-хлор-2-метилфенил)-2-[(2-метоксиэтокси)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(74) N-(3-хлор-2-метилфенил)-2-(1-метокси-2-метилпропан-2-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(75) 2-трет-бутил-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(76) 2-трет-бутил-6-({[2-(трифторметил)фенил]карбонил}амино)-N-{[3-(трифторметил)пиридин-2-ил]метил}-1H-бензимидазол-4-карбоксамид,
(77) N-(3-хлор-2-метилфенил)-2-(2-этоксиэтил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(78) N-(3-хлор-2-метилфенил)-2-(этоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(79) 2-(этоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-N-{[3-(трифторметил)пиридин-2-ил]метил}-1H-бензимидазол-4-карбоксамид,
(80) N-(3-хлор-2-метилфенил)-2-(2-метоксиэтил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(81) N-(3-хлор-2-метилфенил)-2-(2,2-диметилпропил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(82) N-(3-хлор-2-метилфенил)-2-циклопропил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(83) N-(3-хлор-2-метилфенил)-2-(2-метилпентан-2-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(84) N-(3-хлор-2-метилфенил)-2-(1-метилциклопропил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(85) 2-трет-бутил-N-(3-хлор-4-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(86) 2-трет-бутил-N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамид,
(87) 2-трет-бутил-N-(3-хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамид,
(88) N-(3-хлор-2-метилфенил)-2-[1-(трифторметил)циклопропил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(89) N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(90) N-(2-хлорбензил)-2-(метоксиметил)-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(91) 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(92) 6-{[(2-хлор-4-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-метоксиметил-1H-бензимидазол-4-карбоксамид,
(93) 6-{[(2-хлор-5-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(94) N-(3-хлор-2-метилфенил)-6-{[(2-хлорфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(95) N-(3-хлор-2-метилфенил)-6-{[(2-хлорпиридин-3-ил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(96) 6-{[(2-бромфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(97) N-(3-хлор-2-метилфенил)-6-{[(2,6-дихлорфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(98) N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(99) 6-{[(2-хлор-3-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(100) 6-{[(2-хлор-3,6-дифторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(101) 6-{[(2-бром-6-хлорфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(102) 6-{[(2-бром-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(103) N-(3-хлор-2-метилфенил)-6-{[(2-хлор-6-метилфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(104) N-(3-хлор-2-метилфенил)-6-{[(2-хлор-4-метилфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(105) 6-{[(5-бром-2-хлорфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(106) 6-{[(2-бром-5-хлорфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(107) N-(3-хлор-2-метилфенил)-6-{[(2-хлор-5-метилфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(108) N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-({[5-метил-2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(109) 6-({[2,5-бис(трифторметил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(110) 6-({[2,4-бис(трифторметил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(111) N-(3-хлор-2-метилфенил)-6-({[5-фтор-2-(трифторметил)фенил]карбонил}амино)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(112) N-(3-хлор-2-метилфенил)-6-({[2-хлор-6-(трифторметил)фенил]карбонил}амино)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(113) N-(3-хлор-2-метилфенил)-6-[({2-хлор-5-[2-(пропан-2-илокси)этокси]фенил}карбонил)амино]-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(114) 6-({[2-хлор-5-(2-этоксиэтокси)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(115) 6-({[2-хлор-5-(3-метоксипропил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(116) 6-({[5-(3-трет-бутоксипроп-1-ин-1-ил)-2-хлорфенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(117) 6-({[5-(3-трет-бутоксипропил)-2-хлорфенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(118) 6-({[2-хлор-5-(3-гидрокси-3-метилбутил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(119) 6-({[2-хлор-5-(этоксиметил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(120) 6-[({2-хлор-5-[(2-этоксиэтокси)метил]фенил}карбонил)амино]-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(121) 6-({[2-хлор-5-(2-циклопропилэтил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(122) N-(3-хлор-2-метилфенил)-6-({[2-хлор-5-(2-фенилэтил)фенил]карбонил}амино)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(123) N-(3-хлор-2-метилфенил)-2-циклопентил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(124) N-(3-хлор-2-метилфенил)-2-циклопентил-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамид,
(125) 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-циклопентил-1H-бензимидазол-4-карбоксамид,
(126) 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксамид,
(127) N-(3-хлор-2-метилфенил)-6-{[(2,6-дихлорфенил)карбонил]амино}-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксамид,
(128) N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксамид,
(129) N-(3-хлор-2-метилфенил)-2-[(2S)-5-оксопирролидин-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(130) N-(3-хлор-2-метилфенил)-2-[(2R)-5-оксопирролидин-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(131) N-(3-хлор-2-метилфенил)-2-[2-оксо-2-(пирролизин-1-ил)этил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(132) N-(3-хлор-2-метилфенил)-2-[2-(диметиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(133) N-(3-хлор-2-метилфенил)-2-[2-(метиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(134) 2-хлор-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(135) N-(3-хлор-2-метилфенил)-2-[(2-метоксиэтил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(136) N-(3-хлор-2-метилфенил)-2-[(2-гидроксиэтил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(137) N-(3-хлор-2-метилфенил)-2-(метиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(138) N-(3-хлор-2-метилфенил)-2-(этиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(139) N-(3-хлор-2-метилфенил)-2-[(2,2-диметилпропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(140) N-(3-хлор-2-метилфенил)-2-(циклопентиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(141) N-(3-хлор-2-метилфенил)-2-(пиперидин-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(142) N-(3-хлор-2-метилфенил)-2-(4-метилпиперазин-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(143) 2-[бис(2-гидроксиэтил)амино]-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(144) N-(3-хлор-2-метилфенил)-2-(диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(145) N-(3-хлор-2-метилфенил)-2-{[2-(морфолин-4-ил)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(146) N-(3-хлор-2-метилфенил)-2-{[2-(диметиламино)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(147) N-(3-хлор-2-метилфенил)-2-(3-гидроксиазетидин-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(148) N-(3-хлор-2-метилфенил)-2-[(3S)-3-(диметиламино)пирролизин-1-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(149) N-(3-хлор-2-метилфенил)-2-[(3S)-3-гидроксипирролизин-1-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(150) N-(3-хлор-2-метилфенил)-2-{[2-(диэтиламино)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(151) N-(3-хлор-2-метилфенил)-2-{[2-(пирролизин-1-ил)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(152) N-(3-хлор-2-метилфенил)-2-{[3-(диметиламино)пропил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(153) N-(3-хлор-2-метилфенил)-2-{[3-(диметиламино)-2,2-диметилпропил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(154) N-(3-хлор-2-метилфенил)-2-{[2-(дипропан-2-иламино)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(155) N-(3-хлор-2-метилфенил)-2-(морфолин-4-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(156) 2-амино-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(157) N-(3-хлор-2-метилфенил)-2-[(3-гидрокси-2,2-диметилпропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(158) N-(3-хлор-2-метилфенил)-2-{[(3-метилоксетан-3-ил)метил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(159) трет-бутил N-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}глицинат,
(160) N-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}глицин,
(161) N-(3-хлор-2-метилфенил)-2-[(3-гидрокси-2,2-диметилпропил)амино]-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(162) N-(3-хлор-2-метилфенил)-2-[(3-метокси-2,2-диметилпропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(163) N-(3-хлор-2-метилфенил)-2-(пирролизин-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(164) 2-(азетидин-1-ил)-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(165) N-(3-хлор-2-метилфенил)-2-(3-метоксиазетидин-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(166) N-(3-хлор-2-метилфенил)-2-[(2-гидрокси-2-метилпропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(167) N-(3-хлор-2-метилфенил)-2-{[(2S)-тетрагидрофуран-2-илметил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(168) N-(3-хлор-2-метилфенил)-2-{[(2R)-тетрагидрофуран-2-илметил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(169) N-(3-хлор-2-метилфенил)-2-{[(2S)-1-гидрокси-3-метилбутан-2-ил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(170) N-(3-хлор-2-метилфенил)-2-{[(2R)-1-гидрокси-3-метилбутан-2-ил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(171) N-(3-хлор-2-метилфенил)-2-{[(2S)-1-гидрокси-3,3-диметилбутан-2-ил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(172) N-(3-хлор-2-метилфенил)-2-[(3-метокси-2,2-диметилпропил)(метил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(173) N-(3-хлор-2-метилфенил)-2-[(3-метоксипропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(174) N-(3-хлор-2-метилфенил)-2-{[2-(пропан-2-илокси)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(175) 2-[(2-трет-бутоксиэтил)амино]-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(176) N-(3-хлор-2-метилфенил)-2-[(2-метокси-2-метилпропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(177) N-(3-хлор-2-метилфенил)-2-{[2-(метилсульфанил)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(178) N-(3-хлор-2-метилфенил)-2-(метилсульфанил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(179) N-(3-хлор-2-метилфенил)-2-(метилсульфонил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(180) N-(3-хлор-2-метилфенил)-2-(метилсульфинил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(181) 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамид,
(182) N-(3-хлор-2-метилфенил)-6-{[(2,6-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамид,
(183) N-(3-хлор-2-метилфенил)-6-{[(2,4-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамид,
(184) N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамид,
(185) 6-{[(2-бром-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамид,
(186) 6-{[(2-бром-6-хлорфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамид,
(187) 6-({[2-хлор-5-(циклопропилэтинил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамид,
(188) N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(3-гидрокси-2,2-диметилпропил)амино]-1H-бензимидазол-4-карбоксамид,
(189) N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(3-метокси-2,2-диметилпропил)амино]-1H-бензимидазол-4-карбоксамид,
(190) N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(2-гидрокси-2-метилпропил)амино]-1H-бензимидазол-4-карбоксамид,
(191) N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(2-метокси-2-метилпропил)амино]-1H-бензимидазол-4-карбоксамид,
(192) N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-{[2-(пропан-2-илокси)этил]амино}-1H-бензимидазол-4-карбоксамид,
(193) 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-{[2-(пропан-2-илокси)этил]амино}-1H-бензимидазол-4-карбоксамид,
(194) 2-[(2-трет-бутоксиэтил)амино]-6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-1H-бензимидазол-4-карбоксамид,
(195) 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-[(3-метокси-2,2-диметилпропил)амино]-1H-бензимидазол-4-карбоксамид,
(196) 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-[(2-метокси-2-метилпропил)амино]-1H-бензимидазол-4-карбоксамид,
(197) 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-{[(2S)-тетрагидрофуран-2-илметил]амино}-1H-бензимидазол-4-карбоксамид,
(198) 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-{[(2R)-тетрагидрофуран-2-илметил]амино}-1H-бензимидазол-4-карбоксамид,
(199) 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-[(3-гидрокси-2,2-диметилпропил)амино]-1H-бензимидазол-4-карбоксамид,
(200) 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-{[(2S)-1-гидрокси-3-метилбутан-2-ил]амино}-1H-бензимидазол-4-карбоксамид,
(201) N-(3-хлор-4-метилфенил)-2-(диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(202) N-(4-трет-бутилфенил)-2-(диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(203) N-(2,3-дигидро-1H-инден-5-ил)-2-(диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(204) 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-4-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамид,
(205) N-(3-хлор-4-метилфенил)-6-{[(2,6-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамид,
(206) N-(3-хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамид,
(207) N-(3-хлор-2-метилфенил)-2-циклопропил-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамид,
(208) N-(3-хлор-4-метилфенил)-2-циклопропил-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамид,
(209) N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(1-метилциклопропил)-1H-бензимидазол-4-карбоксамид,
(210) N-(3-хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(1-метилциклопропил)-1H-бензимидазол-4-карбоксамид,
(211) N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(метилсульфонил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(212) N-(3-хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(2-метоксиэтил)-1H-бензимидазол-4-карбоксамид,
(213) 2-(метоксиметил)-N-фенил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(214) 2-(метоксиметил)-N-пропил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(215) 2-(метоксиметил)-N-(пиридин-3-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(216) N-бензил-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(217) N-(циклогексилметил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(218) 2-(метоксиметил)-N-(нафтален-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(219) 2-(метоксиметил)-N-(тиофен-3-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(220) N-(2,1,3-бензотиадиазол-4-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(221) N-(1,1-диоксид-1-бензотиофен-6-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(222) 2-(метоксиметил)-N-(тиофен-2-илметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(223) N-(1H-индол-5-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(224) N-(1,3-бензотиазол-2-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(225) N-(2,2-диметилпропил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(226) 2-(метоксиметил)-N-(тиофен-2-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(227) N-(5-хлор-1,3-бензоксазол-2-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(228) N-(2-бензилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(229) 2-(метоксиметил)-N-(хинолин-8-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(230) N-(циклогептилметил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(231) N-(1,3-бензоксазол-2-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(232) N-(6-хлор-1,3-бензоксазол-2-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(233) N-[3-хлор-2-(гидроксиметил)фенил]-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид,
(234) N-(3-хлор-2-метилфенил)-6-{[(3-фторпиридин-2-ил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(235) N-(3-хлор-2-метилфенил)-6-{[(3-хлорпиридин-4-ил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(236) N-(3-хлор-2-метилфенил)-6-{[(3,5-дихлорпиридин-4-ил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(237) 6-{[(5-бутокси-2-хлорфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(238) 6-({[2-хлор-5-(2,2-дифторэтокси)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид,
(239) N-(3-хлор-2-метилфенил)-6-({[2-хлор-5-(4,4,4-трифторбутокси)фенил]карбонил}амино)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ниже приведено подробное описание терминов, использованных в настоящем описании.
Примеры "галогена" включают фтор, хлор, бром и йод.
Примеры "алкила" включают неразветвленный или разветвленный алкил с 1-8 атомами углерода, такой как, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил, изогексил, н-гептил, изогептил, н-октил. Из них предпочтительным является алкил с 1-6 атомами углерода, и наиболее предпочтительным является алкил с 1-3 атомами углерода.
Группа алкила "моноалкиламино", "диалкиламино", "моноалкил аминокарбонила", "диалкиламинокарбонила", "алкилкарбонилокси", "алкилоксикарбонила", "алкилкарбонила", "алкилтио", "алкилсульфонила", "алкилсульфинила", "алкоксиалкила", "моногалогеналкила", "дигалогеналкила", "тригалогеналкила" и "алкоксиалкиламино" определена выше для "алкила".
Примеры "алкокси" включают неразветвленный или разветвленный алкокси с 1-8 атомами углерода, такой как, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, т-бутокси, н-пентилокси, н-гексилокси, н-гептилокси, н-октилокси.
Группа алкокси "алкоксиалкокси", "алкоксиалкил" и "алкоксиалкиламино" определена выше для "алкокси".
Примеры "гетероарила" включают моноциклические или бициклические ароматические кольца с 1-3 гетероатомами, выбранными из группы, состоящей из атома азота, атома кислорода и атома серы. Конкретные примеры включают фурил (например, 2-фурил, 3-фурил), тиенил (например, 2-тиенил, 3-тиенил), пирролил (например, 1-пирролил, 2-пирролил, 3-пирролил), имидазолил (например, 1-имидазолил, 2-имидазолил, 4-имидазолил), пиразолил (например, 1-пиразолил, 3-пиразолил, 4-пиразолил), триазолил (например, 1,2,4-триазол-1-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-4-ил), тетразолил (например, 1-тетразолил, 2-тетразолил, 5-тетразолил), оксазолил (например, 2-оксазолил, 4-оксазолил, 5-оксазолил), изоксазолил (например, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил), оксадиазолил (например, 1,3,4-оксадиазол-2-ил), тиазолил (например, 2-тиазолил, 4-тиазолил, 5-тиазолил), тиадиазолил (например, 1,3,4-тиадиазолил, 1,2,4-тиадиазолил, 1,2,3-тиадиазолил), изотиазолил (например, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил), пиридил (например, 2-пиридил, 3-пиридил, 4-пиридил), пиридазинил (например, 3-пиридазинил, 4-пиридазинил), пиримидинил (например, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил), пиразинил (например, 2-пиразинил), бензотиадиазолил (например, 1,2,3-бензотиадиазол-4-ил, 1,2,3-бензотиадиазол-5-ил, 2,1,3-бензотиадиазол-4-ил, 2,1,3-бензотиадиазол-5-ил), бензотиазолил (например, бензотиазол-2-ил, бензотиазол-4-ил, бензотиазол-5-ил, бензотиазол-6-ил, бензотиазол-7-ил), индолил (например, индол-3-ил и индол-4-ил, индол-5-ил, индол-6-ил, индол-7-ил), бензотиофенил (например, 1-бензотиофен-2-ил, 1-бензотиофен-3-ил, 1-бензотиофен-4-ил, 1-бензотиофен-5-ил, 1-бензотиофен-6-ил, 1-бензотиофен-7-ил), 1,1-диоксо-1-бензотиофенил (например, 1,1-диоксо-1-бензотиофен-2-ил, 1,1-диоксо-1-бензотиофен-3-ил, 1,1-диоксо-1-бензотиофен-4-ил, 1,1-диоксо-1-бензотиофен-5-ил, 1,1-диоксо-1-бензотиофен-6-ил, 1,1-диоксо-1-бензотиофен-7-ил), хинолил (хинолин-2-ил, хинолин-3-ил, хинолин-4-ил, хинолин-5-ил, хинолин-6-ил, хинолин-7-ил, хинолин-8-ил) и 1,3-бензоксазол-2-ил.
Гетероарильная группа "гетероарилметила" определена выше для "гетероарила".
Примеры "насыщенного циклического амино" включают 4-7-членные насыщенные циклические аминогруппы с одним или двумя атомами азота, указанное кольцо необязательно имеет один атом кислорода или серы и, необязательно, замещено оксо. Конкретные примеры включают 1-азетидинил, 1-пирролидинил, 1-имидазолидинил, пиперидино, 1-пиперазинил, 1-тетрагидропиримидинил, 4-морфолино, 4-тиоморфолино, 1-гомопиперазинил и 2-оксо-оксазолидин-3-ил.
Насыщенная циклическая аминогруппа "насыщенного циклического аминокарбонила" определена выше для "насыщенного циклического амино".
Примеры "насыщенной гетероциклической группы" включают 4-6-членную насыщенную гетероциклическую группу, имеющую один атом азота или кислорода в кольце. Конкретные примеры включают 2-пирролидинил, 3-пирролидинил, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил, 2-оксетанил, 3-оксетанил, 2-тетрагидрофуранил и 3-тетрагидрофуранил.
Примеры "циклоалкила" включают циклоалкил с 3-8 атомами углерода. Конкретные примеры включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил.
Циклоалкильная группа "циклоалкилметила" определена выше для "циклоалкила".
Примеры "нафтила" включают 1-нафтил и 2-нафтил.
Примеры "пиридила" включают 2-пиридил, 3-пиридил и 4-пиридил.
Примеры "алкинила" включают неразветвленный или разветвленный алкинил с 2-6 атомами углерода. Конкретные примеры включают этинил, 1-пропинил, 1-бутинил, 1-пентинил, 2-пропинил, 2-бутинил, 3-бутинил, 1-метил-2-пропинил, 2-пентинил, 3-пентинил и 4-пентинил.
Варианты осуществления изобретения
Соединение по изобретению может быть получено в соответствии с нижеприведенными методиками, рабочими примерами или методиками, известными в данной области. Если исходное вещество имеет заместительную группу, которая может взаимодействовать в реакции в процессе осуществления методики, то она может быть защищена соответствующей защитной группой в соответствии с известным способом перед проведением реакции.
Следующие аббревиатуры могут быть использованы в настоящем описании для его упрощения.
п-: пара-,
т-: трет-,
в-: втор-,
м-: мета-,
ТГФ: тетрагидрофуран,
ДМФ: N,N-диметилформамид,
ДМА: N,N-диметилацетамид,
HBTU: гексафторфосфат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония,
HATU: гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония,
ТФУ: трифторуксусная кислота,
DME: этиленгликоля диметиловый эфир,
NMP: N-метил-2-пирролидон,
ДМСО: диметилсульфоксид,
MeOH: метанол,
EtOH: этанол.
Методика 1
Формула 4
 ,
,
где кольцо А, R1 и R2 такие, как определено выше.
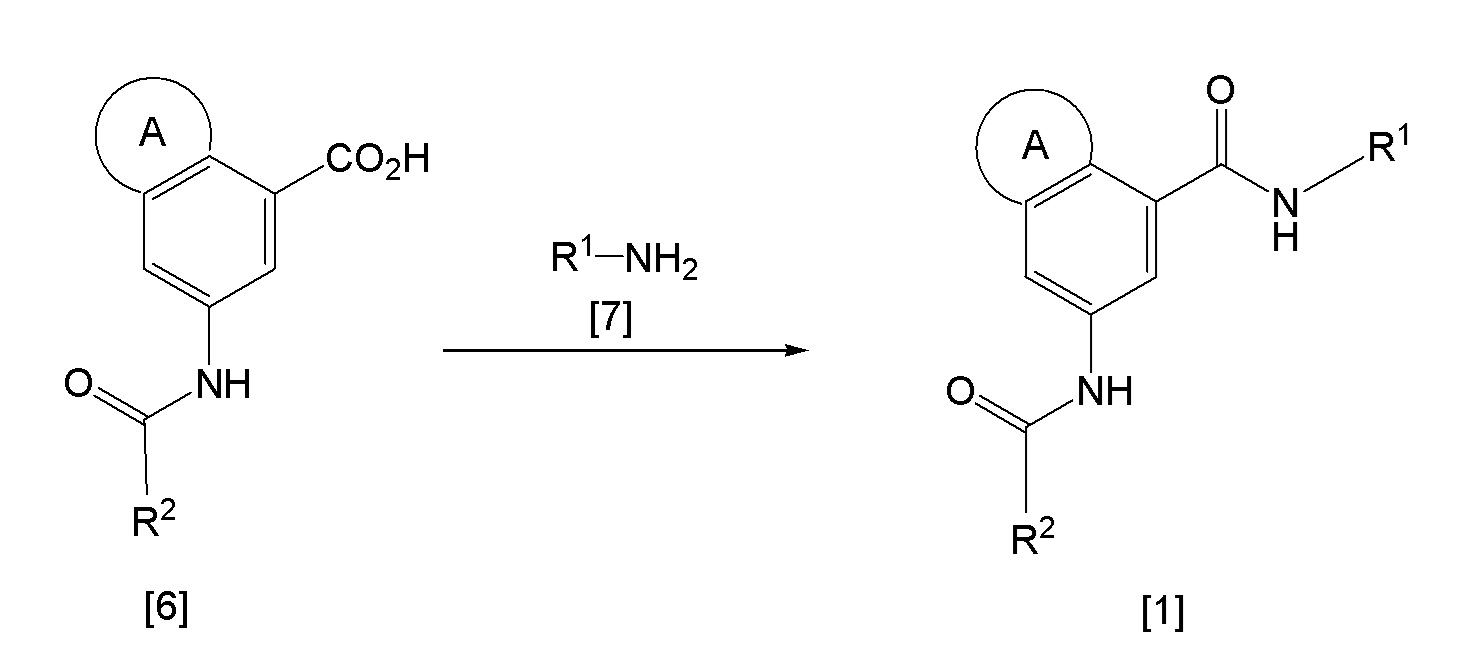
Настоящая реакция является конденсацией соединения [6] и соединения [7] и может быть осуществлена в соответствии со способом проведения реакции конденсации, по сути известным. Соединение по изобретению может быть синтезировано путем взаимодействия карбоновой кислоты соединения [6] или его реакционно-способного производного с аминовым производным [7]. Примеры такого реакционно-способного производного соединения [6] включают соединения, широко используемые в реакции амидной конденсации, такие как, например, галогенангидриды (например, хлорангидрид, бромангидрид), смешанные ангидриды, имидазолиды, активные амиды. При использовании соединения [6] взаимодействие может быть проведено, используя конденсирующий агент при температуре в диапазоне от -20°C до 100°C в присутствии или отсутствии основания. Примеры конденсирующего агента, который может быть использован для этой реакции, включают 1,1'-оксалилдиимидазол, 1-этил-3-(3-диметиламинопропил)карбодиимид, дициклогексилкарбодиимид, диэтил цианофосфонат, HBTU, HATU, гексафторфосфат 1H-бензотриазол-1-ил-окси-трис-пирролидино-фосфония. Примеры основания, которое может быть использован для этой реакции, включают органические основания, так как триэтиламин, N,N-диизопропилэтиламин, N,N-диметиланилин, пиридин, 1,8-диазабицикло[5,4,0]-7-ундецен. Может быть использован любой растворитель, при условии, что он не оказывает влияния на взаимодействие, и примеры такого растворителя включают простые эфиры, такие как ТГФ, 1,4-диоксан и диэтиловый эфир, амиды, такие как ДМФ и ДМА, нитрилы, такие как ацетонитрил и пропионитрил, углеводороды, такие как бензол и толуол, галогенированные углеводороды, такие как хлороформ и метиленхлорид, и смеси этих растворителей. Кроме того, может быть использован вспомогательный агент, если необходимо. Примеры такого вспомогательного агента, который может быть использован, включают 1-гидроксибензотриазол и 1-гидрокси-7-аза-бензотриазол. Предпочтительное время реакции обычно находится в диапазоне от 10 минут до 24 часов, но может изменяться в зависимости от исходного вещества, температуры реакции и тому подобное. Предпочтительные количества использующегося соединения [7] и конденсирующего агента находятся в диапазоне от 1 до 3 моль для одного моля соединения [6]. Предпочтительное количество используемого основания находится в диапазоне от 1 экв. до 10 экв., предпочтительно, от 1 экв. до 4 экв., соединения [6].
Например, соединение [6] может быть получено в соответствии с методикой, описанной ниже.
Формула 5
 ,
,
где кольцо А и R2 такие, как определено выше, X представляет собой галоген, и R5 представляет собой алкил.
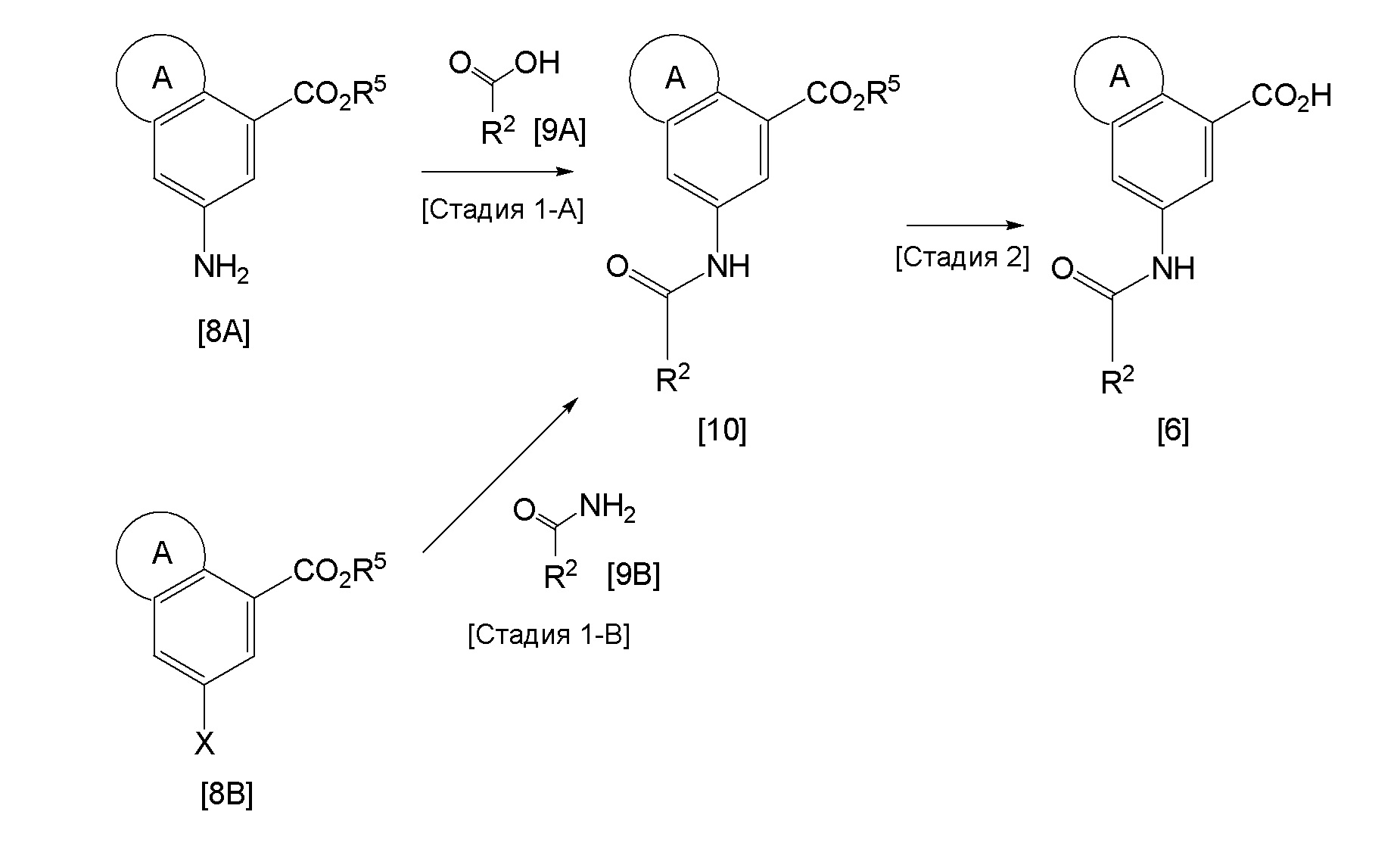
Стадия 1-A
Эта реакция представляет собой реакцию конденсации соединения [8A] и соединения [9A] с синтезом соединения [10] в соответствии с методикой 1, как описано выше.
Стадия 1-B
Реакция представляет собой реакцию связывания соединения [8B] и соединения [9B], используя палладиевый катализатор, и реакцию проводят в соответствии со способом, по сути известным. Растворитель, который может быть использован, не ограничен, при условии, что он не оказывает влияния на взаимодействие, и примеры такого растворителя включают углеводороды, такие как толуол и ксилол, простые эфиры, такие как 1,4-диоксан и ТГФ, амиды, такие как ДМФ, ДМА и NMP, и смеси этих растворителей. Реакцию проводят в присутствии основания при температуре в диапазоне от 20°C до 200°C, необязательно используя микроволновую печь. Примеры палладиевого катализатора, который может быть использован, включают трис(дибензилиденацетон)(хлороформ)дипалладий (0), трис(дибензилиденацетон)дипалладий (0) и палладий ацетат (II). Подходящее количество такого палладиевого катализатора находится в диапазоне от 0,001 моль до 0,3 моль, до 1 моль арилгалогенида. Примеры лиганда для палладиевого катализатора, который может быть использован, включают 1,1'-бис(дифенилфосфино)ферроцен, 4,5-бис(дифенилфосфино)-9,9'-диметилксантен, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, (±)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 2-(ди-трет-бутилфосфино)бифенил, эфир бис[2-(дифенилфосфино)фенил], три-трет-бутилфосфин и тому подобное. Примеры основания, которое может быть использовано, включают натрий т-бутоксид, трикалий фосфат и карбонат цезия. Количество используемого основания находится в диапазоне от 1 экв. до 10 экв., предпочтительно, в диапазоне от 1 экв. до 4 экв., соединения [8B]. Подходящее время реакции обычно находится в диапазоне от 10 минут до 24 часов, но может изменяться в зависимости от исходного вещества, температуры реакции и тому подобное.
Стадия 2
Соединение [6] может быть получено путем гидролиза соединения [10] в соответствии с известным способом. Взаимодействие, как правило, проводят в присутствии кислоты или основания в подходящем растворителе. Примеры кислоты, используемой в гидролизе, включают неорганические кислоты, такие как хлористоводородная кислота и серная кислота, а примеры основания включают неорганические основания, такие как гидроксид натрия и гидроксид калия. Примеры реакционного растворителя включают спирты, такие как MeOH и EtOH, простые эфиры, такие как ТГФ и диоксан, вода и смесь этих растворителей. Реакцию проводят при температуре в диапазоне от 0°C до 100°C, и время реакции, как правило, находится в диапазоне от 30 минут до 24 часов.
Например, соединение [8A] может быть получено с помощью следующей методики.
Формула 6
 ,
,
где кольцо А и R5 такие, как определено выше.
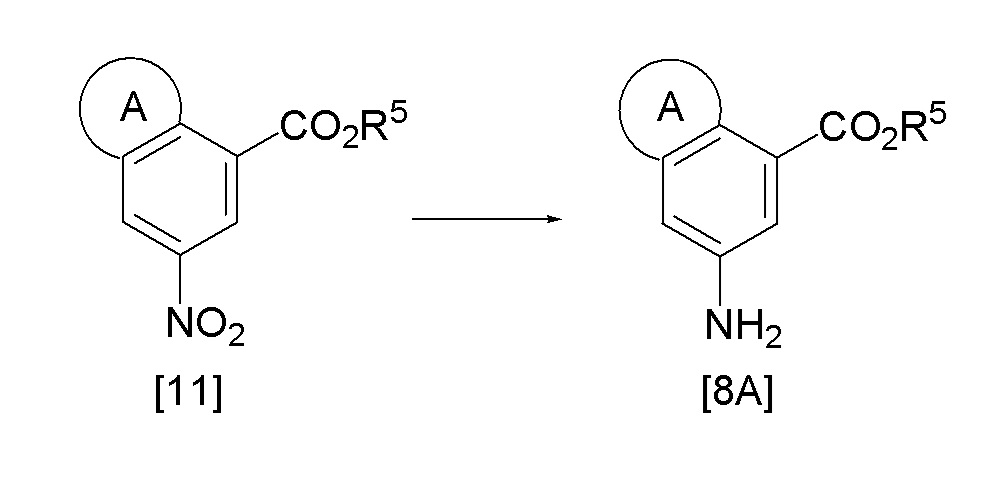
Эта реакция представляет собой реакцию восстановления соединения [11] до ароматического амина, и реакцию можно проводить общепринятым способом. Например, реакция достигается путем каталитического водородного восстановления соединения [11], используя катализатор, такой как никель Ренея, палладий, родий, платина и тому подобное, в подходящем растворителе в атмосфере газообразного водорода, путем восстановления гидридом, используя алюмогидрид лития и тому подобное, путем восстановления с железом, используя агент восстановленного железа и хлорид аммония и тому подобное, или путем восстановления с цинком, используя цинковую пыль и уксусную кислоту, и тому подобное. Кроме того, существует также способ, использующий сульфиды, такие как гидросульфит натрия, и способ восстановления с помощью формиата аммония, гидразина и тому подобное вместе с металлическим катализатором, таким как палладий на угле. Выбор растворителя зависит от используемого соединения или агента, и растворитель может быть использован самостоятельно или в смеси. Примеры такого растворителя включают толуол, ТГФ, 1,4-диоксан, 1,2-диметоксиэтан, этилацетат, ацетон, ацетонитрил, ДМФ или спирты, такие как MeOH, EtOH и трет-бутанол, и воду. Хотя температура реакции зависит от используемого соединения и агента, она, как правило, находится в диапазоне от 0°C до 300°C, предпочтительно, в диапазоне от 20°C до 150°C.
Если кольцо А соединения [8A] представляет собой группу, представленную общей формулой [2] или [3], то соединение может быть получено в соответствии со способом, описанным в WO2008/65508. Если кольцо А соединения [8A] представляет собой группу, представленную общей формулой [4], то соединение может быть получено в соответствии со способом, описанным в литературе (например, EP2226315, J. Org. Chem., 1960, 25,942, и тому подобное). Кроме того, соединение может быть получено в соответствии со следующей методикой.
Формула 7
 ,
,
где X1, R5 и A2 такие, как определено выше, и X2 представляет собой NH2 или OH.
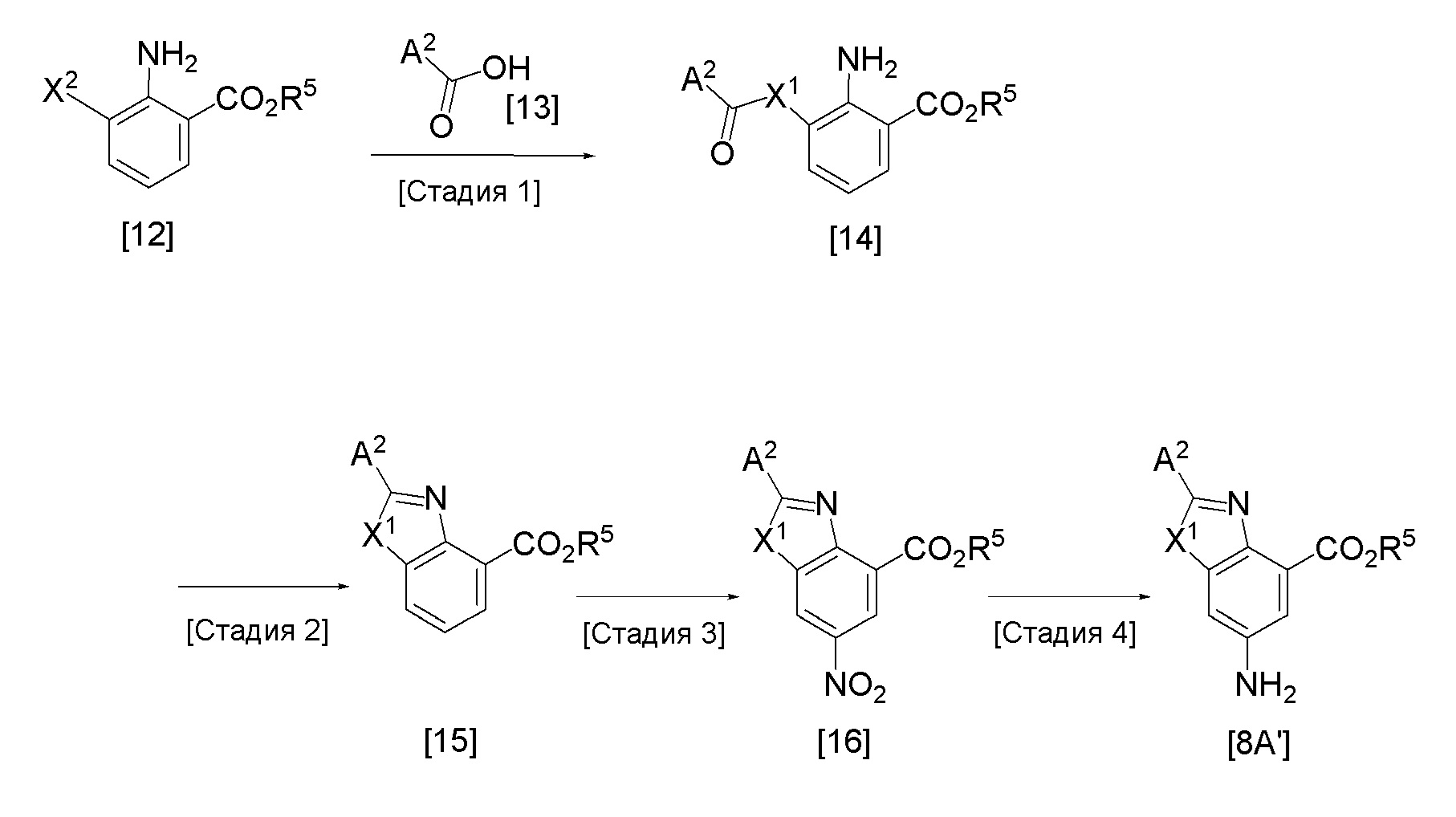
Стадия 1
Эта реакция представляет собой реакцию ацилирования соединения [12] и соединения [13] или их реакционно-способного производного, и она может быть проведена в соответствии со способом, по сути известным как реакция ацилирования. Примеры реакционно-способного производного соединения [13] включают соединения, обычно используемые для реакции ацилирования, и включают галогенангидриды (например, хлорангидрид, бромангидрид), смеси ангидридов кислот, имидазолиды, активные амиды и тому подобное. Если используется соединение [13], то реакция может быть проведена, используя конденсирующий агент в присутствии или отсутствии основания при температуре в диапазоне от -20°C до 100°C. Примеры конденсирующего агента, который может быть использован для этой реакции, включают 1,1'-оксалилдиимидазол, 1-этил-3-(3-диметиламинопропил)карбодиимид, дициклогексилкарбодиимид, диэтил цианофосфонат, HBTU, HATU и гексафторфосфат 1H-бензотриазол-1-илокситрипирролидинофосфония. Примеры основания, которое может быть использовано для этой реакции, включают органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, N,N-диметиланилин, пиридин, 1,8-диазабицикло[5,4,0]-7-ундецен. Используемый растворитель не ограничен, при условии, что он не оказывает влияние на взаимодействие, и примеры такого растворителя включают простые эфиры, такие как ТГФ, 1,4-диоксан и диэтиловый эфир, амиды, такие как ДМФ и ДМА, нитрилы, такие как ацетонитрил и пропионитрил, углеводороды, такие как бензол и толуол, галогенированные углеводороды, такие как хлороформ и метиленхлорид, и смеси этих растворителей.
Кроме того, если необходимо, может быть использован вспомогательный агент. Примеры такого вспомогательного агента, который может быть использован, включают 1-гидроксибензотриазол и 1-гидрокси-7-аза-бензотриазол. Предпочтительное количество используемого основания находится в диапазоне от 1 экв. до 10 экв., предпочтительно, от 1 экв. до 4 экв., соединения [13]. Предпочтительное время реакции обычно находится в диапазоне от 10 минут до 24 часов, но может изменяться в зависимости от исходного вещества, температуры реакции и тому подобное. Предпочтительные количества использующегося соединения [13] и конденсирующего агента находятся в диапазоне от 1 до 3 моль для одного моля соединения [12].
Стадия 2
Эта реакция представляет собой внутримолекулярную циклизацию соединения [14], используя кислый катализатор, и она может быть проведена в соответствии со способом, по сути известным. Взаимодействие проводят в подходящем растворителе или в отсутствии растворителя, и примеры кислоты, которая может быть использована, включают хлористоводородную кислоту, п-толуолсульфоновую кислоту, уксусную кислоту, п-толуолсульфонат пиридина, полифосфорную кислоту, фосфорилхлорид и тому подобное. Реакция может быть проведена, как правило, при температуре в диапазоне от 0°C до 200°C.
Растворитель, который может быть использован, не ограничен, при условии, что он не оказывает влияние на взаимодействие, и примеры такого растворителя включают углеводороды, такие как толуол и ксилол, спирты, такие как MeOH и EtOH, простые эфиры, такие как 1,4-диоксан и ТГФ, амиды, такие как ДМФ и ДМА, галогенированный углеводород, такие как хлороформ и дихлорметан, ацетонитрил, или смеси этих растворителей. Время реакции обычно находится в диапазоне от 30 минут до 48 часов, хотя может изменяться в зависимости от исходного вещества и температуры реакции.
Стадия 3
Эта реакция представляет собой реакцию нитрирования соединения [15] и она может быть проведена в соответствии с известным способом. Обычно используют нитрирующий агент, такой как азотная кислота, смешанная кислота, метал нитрат, ацетил нитрат, пентаоксид диазота, соль нитрония (например, тетрафторборат нитрония, трифторметансульфонат нитрония) и тому подобное. Растворитель реакции не ограничен при условии, что он не оказывает влияние на взаимодействие, и пример такого растворителя включает галогенированные растворители, такие как дихлорметан и хлороформ, пентан, ТФУ, сульфолан, ацетонитрил и тому подобное.
Реакцию проводят в нейтральных или кислых условиях. Если реакцию проводят в кислых условиях, то примеры используемой кислоты включают серную кислоту, азотную кислоту, уксусную кислоту и уксусный ангидрид. Кроме того, в качестве реакционного растворителя может быть использована только такая кислота, без использования реакционного растворителя, как указано выше. Температура реакции обычно находится в диапазоне от -20°C до комнатной температуры, хотя может изменяться в зависимости от используемого соединения и агента. Предпочтительное время реакции обычно находится в диапазоне от 30 минут до 24 часов, хотя может изменяться в зависимости от исходного вещества и температуры реакции.
Стадия 4
Эта реакция представляет собой реакцию восстановления соединения [16] до ароматического амина, и она может быть проведена с получением соединения [8A'] в соответствии с методикой, аналогичной методике получения соединения [8A].
Соединение [8B] может быть получено в соответствии со способом, описанным в литературе (например, J. Med. Chem., 1999, 42, 5020, WO2008/65508). Если кольцо А соединения [8B] представляет собой группу, представленную общей формулой [4], то соединение также может быть получено в соответствии со следующей методикой.
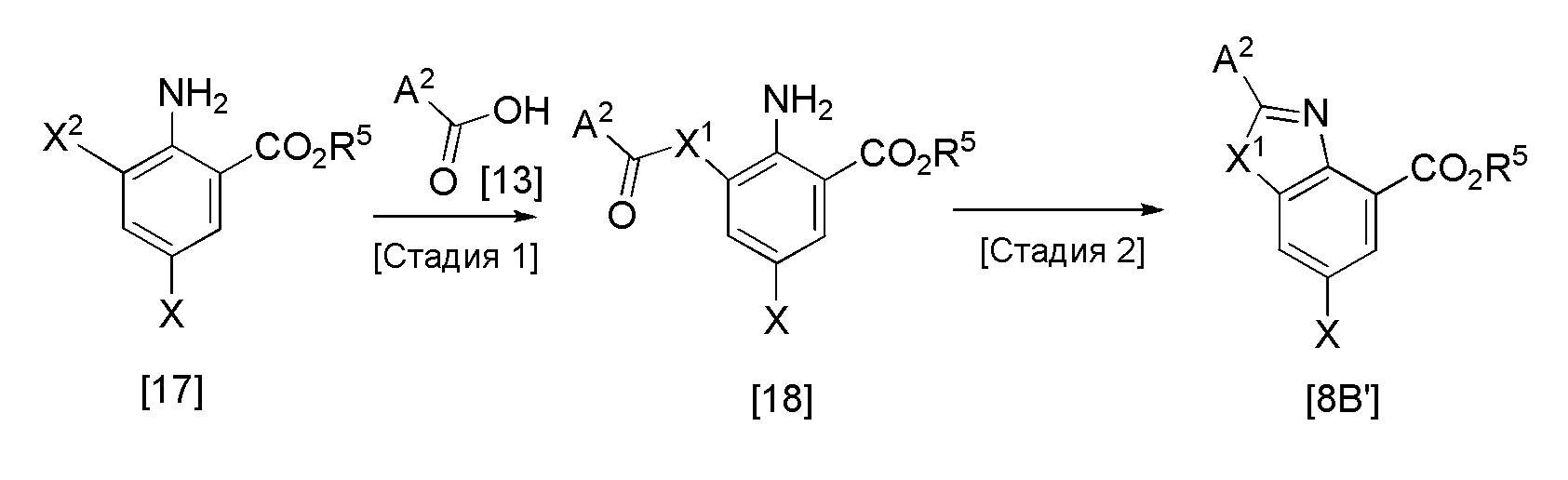
Формула 8
 ,
,
где A2, X, X1, X2 и R5 такие, как определено выше.
Стадия 1
Эта реакция представляет собой реакцию конденсации соединения [17] и соединения [13] или их реакционно-способного производного, и она может быть проведена с получением соединения [18] в соответствии с методикой, аналогичной методике стадии 1 получения соединения [8A'].
Стадия 2
Эта реакция представляет собой реакцию внутримолекулярной циклизации ацильной группы и аминогруппы, используя кислотный катализатор, и она может быть проведена с получением соединения [8B'] согласно методике стадии 2 в вышеуказанном способе получения соединения [8A'].
Например, соединение [17] может быть получено в соответствии со следующей методикой.
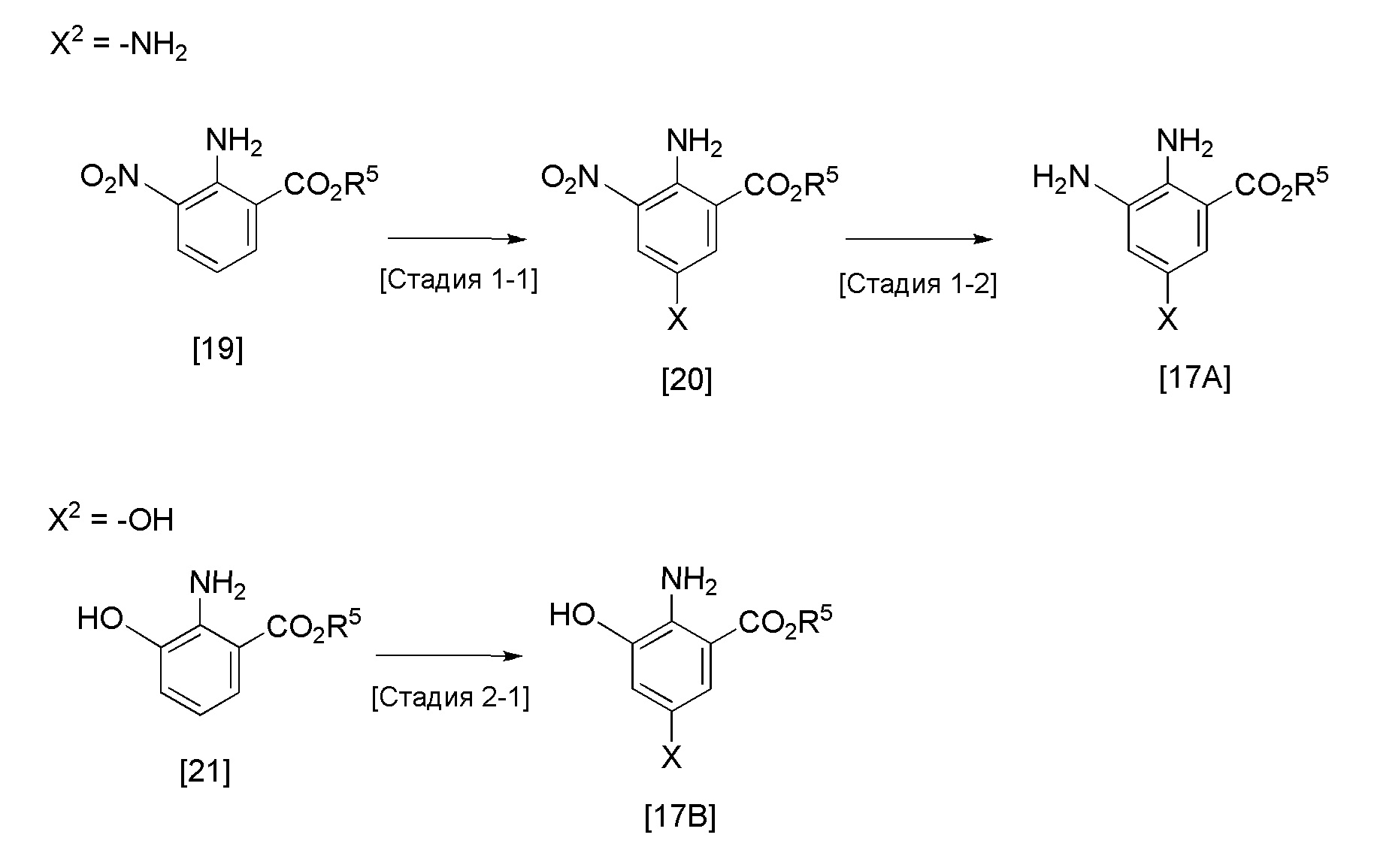
Формула 9
 ,
,
где X и R5 такие, как определено выше.
Стадия 1-1
Эта реакция представляет собой реакцию галогенирования соединения [19], и она может быть проведена в соответствии со способом, по сути известным как реакция галогенирования. Примеры галогенирующего агента, которое может быть использовано, включают N-бромсукцинимид, N-йодсукцинимид, бром, йод и тому подобное, и, обычно, реакцию можно проводить при температуре в диапазоне от 0°C до 200°C. Растворитель, который может быть использован, не ограничен, при условии, что он не оказывает влияние на взаимодействие, и примеры такого растворителя включают углеводороды, такие как толуол и ксилол, простые эфиры, такие как 1,4-диоксан и ТГФ, амиды, такие как ДМФ и ДМА, галогенированные углеводороды, такие как хлороформ и дихлорметан, ацетонитрил, и смеси этих растворителей. Также может быть добавлено подходящее основание, и примеры такого основания, которое может быть использовано, включают пиридин, N,N-диизопропилэтиламин и тому подобное. Количество используемого основания, например, находится в диапазоне от 1 экв. до 10 экв., предпочтительно, в диапазоне от 1 экв. до 4 экв., соединения [19]. Предпочтительное время реакции обычно находится в диапазоне от 30 минут до 24 часов, хотя может изменяться в зависимости от исходного вещества и температуры реакции.
Стадия 1-2
Эта реакция представляет собой реакцию восстановления соединения [20] до ароматического амина, и она может быть проведена с получением соединения [17A] в соответствии с методикой, аналогичной методике получения соединения [8A] выше.
Стадия 2-1
Эта реакция представляет собой реакцию галогенирования соединения [21], и она может быть проведена с получением соединения [17B] в соответствии с методикой, аналогичной методике стадии 1-1 в способе получения соединения [17].
Методика 2
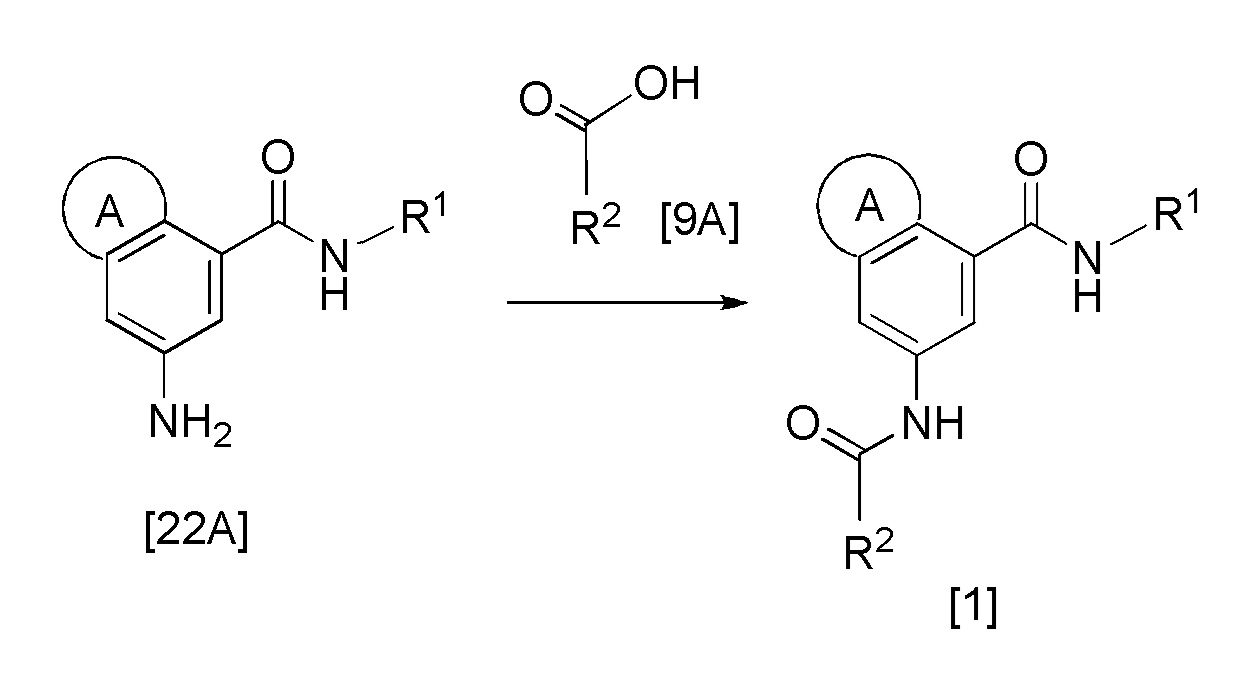
Формула 10
 ,
,
где кольцо А, R1 и R2 такие, как определено выше.
Эта реакция представляет собой реакцию конденсации соединения [22A] и соединения [9A], и она может быть проведена в соответствии с методикой 1 с получением соединения по изобретению.
Также соединение по изобретению может быть получено в соответствии со следующими методиками.
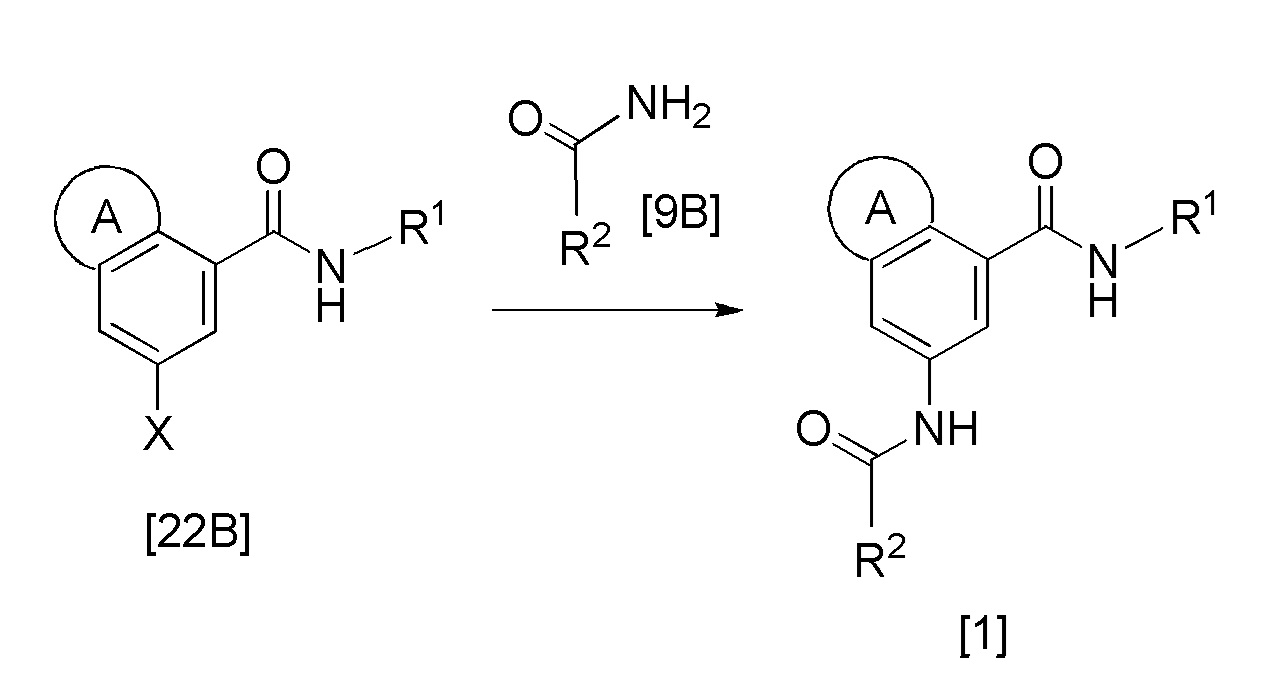
Формула 11
 ,
,
где кольцо А, R1, R2 и X такие, как определено выше.
Эта реакция представляет собой реакцию связывания соединения [22B] и соединения [9B], и она может быть проведена с получением соединения по изобретению в соответствии с методикой, аналогичной методике стадии 1-B в стадии получения соединения [6].
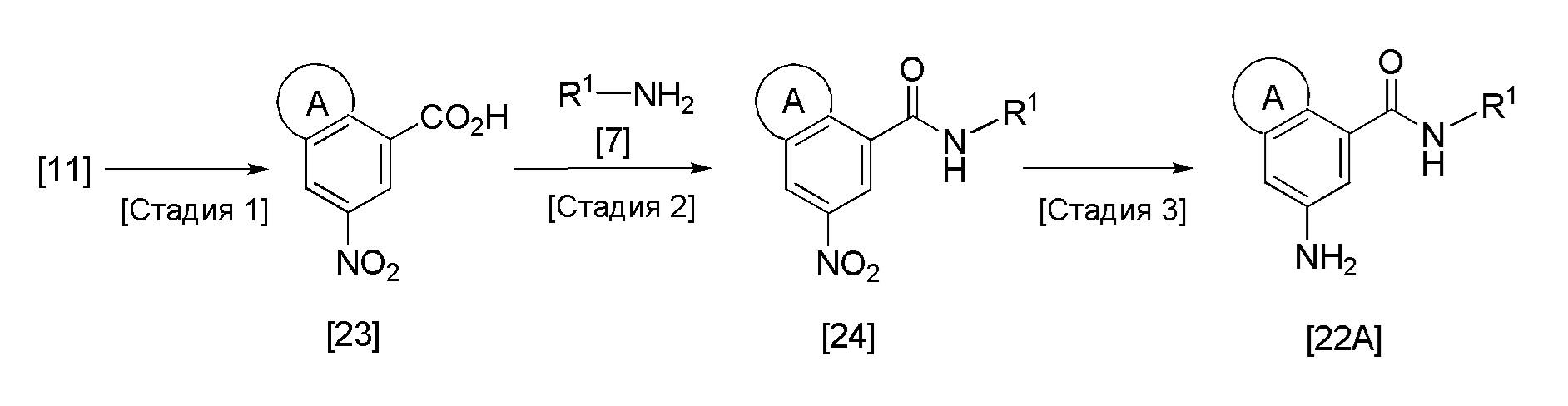
Соединение [22A] может быть получено в соответствии со следующей методикой, например.
Формула 12
 ,
,
где кольцо А и R1 такие, как определено выше.
Стадия 1
Эта реакция представляет собой реакцию гидролиза соединения [11] в качестве исходного вещества, и она может быть проведена с получением соединения [23] в соответствии с методикой, аналогичной методике стадии 2 способа получения соединения [6].
Стадия 2
Эта реакция представляет собой реакцию конденсации соединения [23] и соединения [7], и она может быть проведена с получением соединения [24] в соответствии с методикой 1.
Стадия 3
Эта реакция представляет собой реакцию восстановления соединения [24] до ароматического амина, и она может быть проведена с получением соединения [22A] в соответствии с методикой получения соединения [8A].
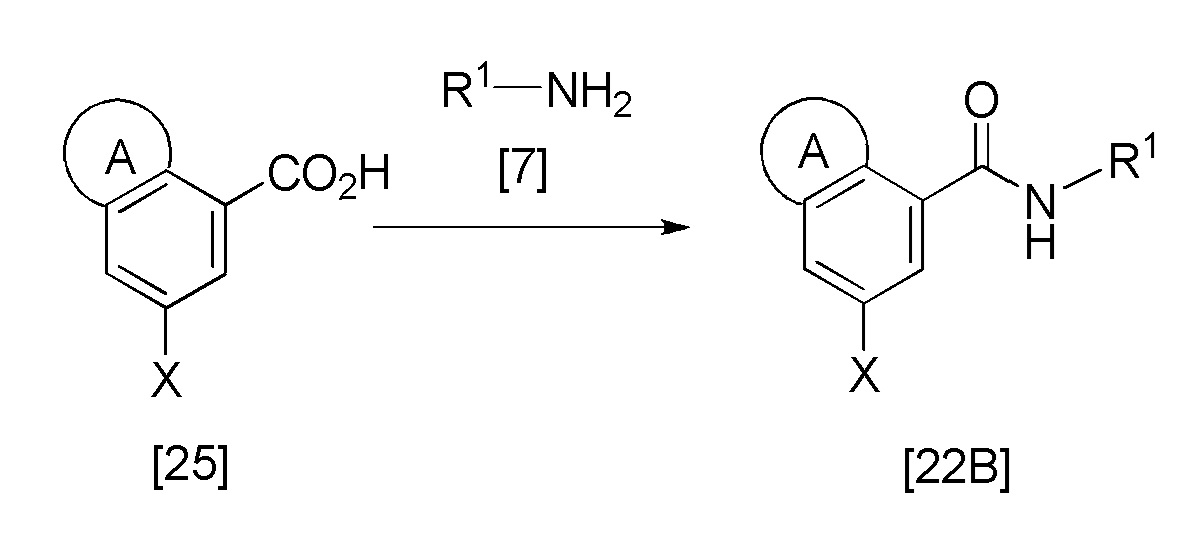
Например, соединение [22B] также может быть получено следующей методикой.
Формула 13
 ,
,
где кольцо А, R1 и X такие, как определено выше.
Эта реакция представляет собой реакцию конденсации соединения [25] и соединения [7], и она может быть проведена с получением соединения [22B] в соответствии с методикой 1. Соединение [25] может быть получено в соответствии со способом, описанным в литературе (например, EP234872B1; US6387938B1; Bioorg. Med. Chem., 1999, 7, 2271; J. Med. Chem., 1999, 42, 5020), и также может быть получено гидролизом соединения [8B] в соответствии с методикой, аналогичной методике стадии 2 способа получения соединения [6].
Методика 3
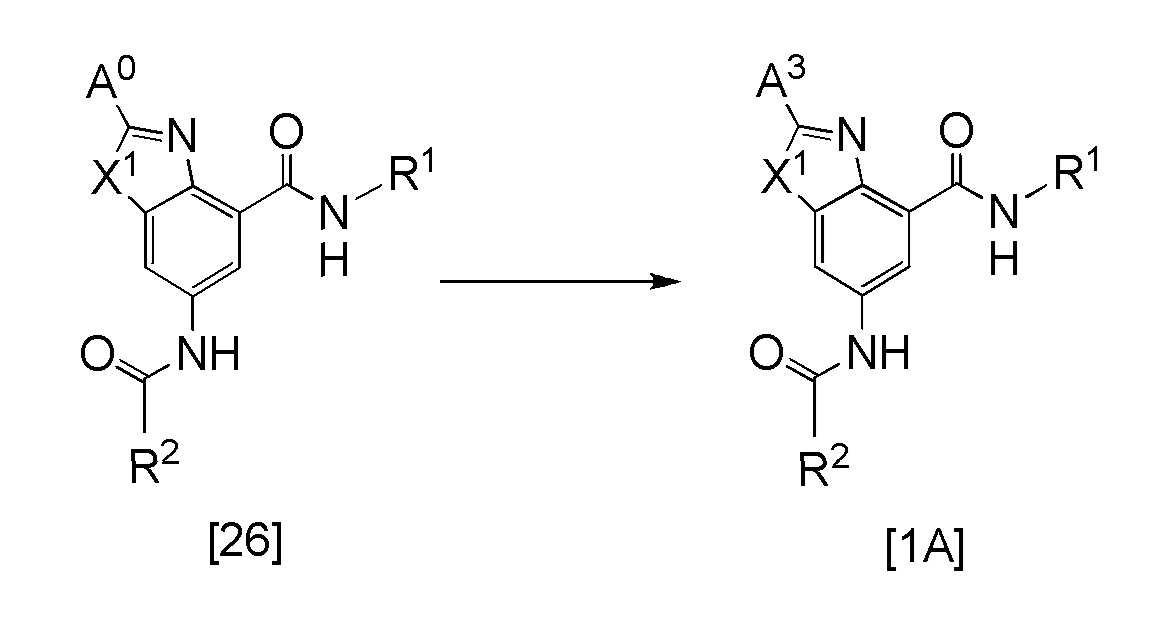
Если кольцо А представляет собой группу, представленную общей формулой [4], а A2 представляет собой алкилтио, алкокси или группу, представленную общей формулой [5], то соединение может быть получено в соответствии со следующей методикой.
Формула 14
 ,
,
где R1, R2 и X1 такие, как определено выше, и A0 представляет собой галоген, мезилат, тозилат и тому подобное, и A3 представляет собой алкилтио, алкокси или группу, представленную общей формулой [5].
Эта реакция представляет собой реакцию нуклеофильного замещения соединения [26] аминами, метал алкокси или замещенным тиолом, и она может быть проведена в соответствии с известным способом. Реакцию проводят либо в подходящем растворителе, либо в отсутствии растворителя, используя избыточное количество агентов, либо в присутствии основания. Примеры подходящего используемого основания включают пиридин, триэтиламин, N,N-диизопропилэтиламин, карбонат калия, гидрокарбонат натрия и тому подобное. Используемый растворитель не ограничен при условии, что он не оказывает влияние на взаимодействие, и примеры такого растворителя включают простые эфиры, такие как ТГФ и диэтиловый эфир, амиды, такие как ДМФ и ДМА, нитрилы, такие как ацетонитрил и пропионитрил, углеводороды, такие как бензол и толуол, спирты, такие как MeOH и EtOH, воду или смеси этих растворителей. Также в реакции может быть использовано избыточное количество амина вместо растворителя. Реакцию обычно проводят при температуре в диапазоне от 0°C до 200°C, хотя она зависит от используемого соединения и агентов. Количество основания, например, находится в диапазоне от 1 экв. до 10 экв., предпочтительно, в диапазоне от 1 экв. до 4 экв., соединения [26]. Предпочтительное время реакции обычно находится в диапазоне от 30 минут до 24 часов, хотя может изменяться в зависимости от исходного вещества и температуры реакции.
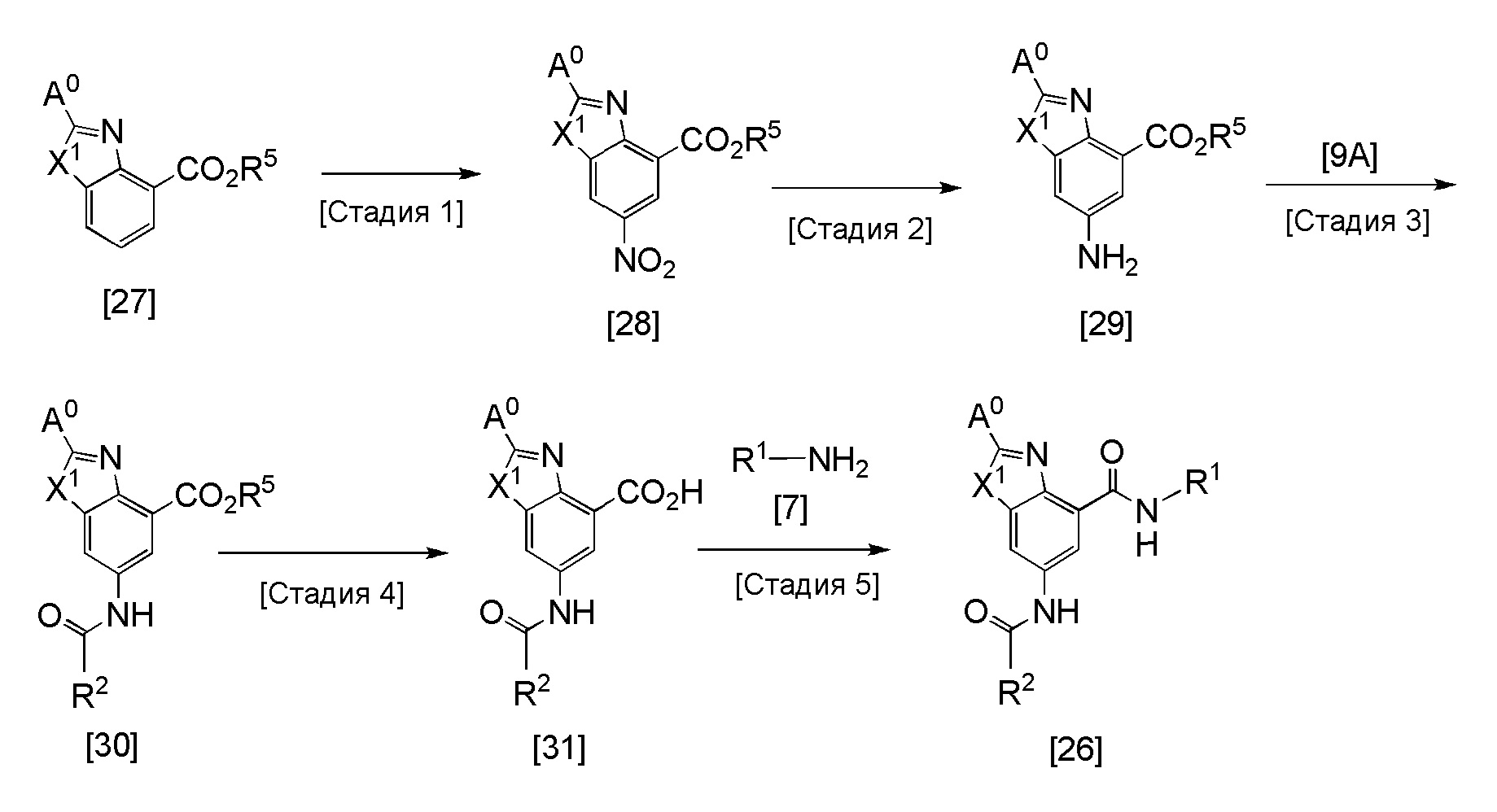
Соединение [26] может быть получено, например, в соответствии со следующей методикой.
Формула 15
 ,
,
где X1, R1, R2, R5 и A0 такие, как определено выше.
Стадия 1
Эта реакция представляет собой реакцию нитрирования соединения [27] в качестве исходного вещества, и она может быть проведена в соответствии с методикой, аналогичной методике стадии 3 способа получения соединения [8A']. Соединение [27] может быть получено в соответствии со способом, описанным в литературе (например, WO2006/116412; J. Med. Chem., 1993, 36, 2182).
Стадия 2
Эта реакция представляет собой реакцию восстановления соединения [28] до ароматического амина, и она может быть проведена с получением соединения [29] в соответствии с методикой, аналогичной методике получения соединения [8A].
Стадия 3
Эта реакция представляет собой реакцию конденсации соединения [29] и соединения [9A], и она может быть проведена с получением соединения [30] в соответствии с методикой, аналогичной методике 1.
Стадия 4
Эта реакция представляет собой реакцию гидролиза соединения [30], и она может быть проведена с получением соединения [31] в соответствии с методикой, аналогичной методики стадии 2 получения соединения [6].
Стадия 5
Эта реакция представляет собой реакцию конденсации соединения [31] и соединения [7], и она может быть проведена с получением соединения [26] в соответствии с методикой, аналогичной методике 1.
Методика 4
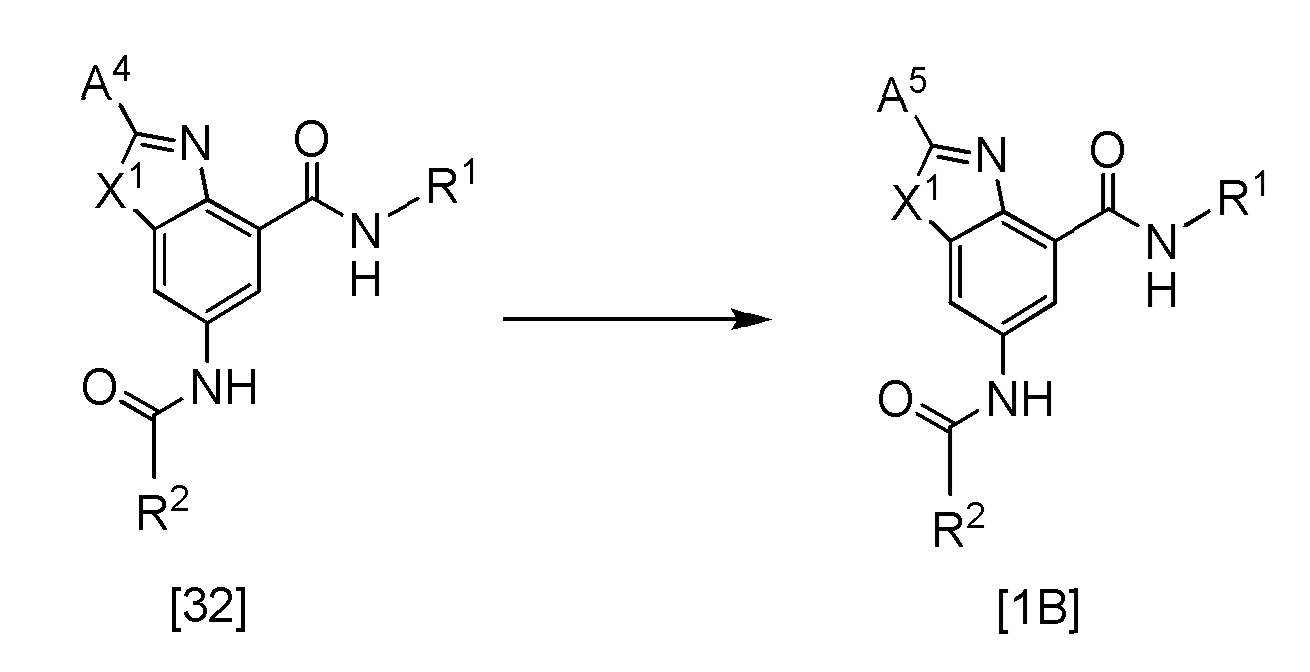
Соединение также может быть получено следующей методикой, если кольцо А представляет собой группу, представленную общей формулой [4], и A представляет собой алкилсульфинил, алкилсульфонил.
Формула 16
 ,
,
где R1, R2, и X1 такие, как определено выше, A4 представляет собой алкилтио, и A5 представляет собой алкилсульфинил, алкилсульфонил.
Эта реакция представляет собой реакцию окисления соединения [32] в виде исходного вещества, и она может быть проведена в соответствии с общепринятым способом. Например, реакция может быть достигнута в подходящем растворителе, используя пероксид, такой как перманганат калия, мета-хлор пербензойная кислота и оксон пермоносульфат. Растворитель следует выбирать в соответствии с исходным веществом и, не ограничиваясь, при условии, что он не оказывает влияние на взаимодействие, и примеры такого растворителя включают дихлорметан, хлороформ, дихлорэтан, ТГФ, 1,4-диоксан, DME, толуол, MeOH и тому подобное, и такой растворитель может быть использован самостоятельно или в виде смеси растворителей. Количество окислителя находится в диапазоне от 0,5 экв. до 10 экв., предпочтительно, в диапазоне от 0,9 экв. до 3 экв., исходного вещества. Температура реакции, как правило, находится в диапазоне от -20°C до 80°C, предпочтительно, в диапазоне от 0°C до 50°C, хотя она зависит от использующегося соединения и агента. Предпочтительная температура реакции, как правило, находится в диапазоне от 30 минут до 24 часов, хотя может зависеть от используемого исходного вещества и температуры реакции.
Соединение по изобретению может быть использовано само по себе в качестве фармацевтического соединения, и также может использоваться как фармацевтически приемлемая соль, полученная в соответствии с известным способом. Примеры такой соли включают неорганическую соль кислот, такие как хлористоводородная кислота, бромистоводородная кислота, серная кислота и фосфорная кислота, и органическую соль кислот, такие как уксусная кислота, лимонная кислота, винная кислота, малеиновая кислота, янтарная кислота, фумаровая кислота, п-толуолсульфоновая кислота, бензолсульфоновая кислота, и метансульфоновая кислота.
Например, гидрохлорид соединения по изобретению может быть получен путем растворения соединения по изобретению в растворе хлористоводородной кислоты в спирте, этилацетате или диэтиловом эфире.
Соединение по изобретению может быть асимметрическим углеродом, и каждый такой оптический изомер и их смесь входят в объем настоящего изобретения. Такой оптический изомер может быть получен путем разделения оптических изомеров из рацемической смеси, как получены в следующих рабочих примерах, в соответствии с известным способом, используя оптически активную кислоту, такую как винная кислота, дибензоилвинная кислота, миндальная кислота, 10-камфорсульфоновая кислота и тому подобное, или путем использования оптически активного соединения, заранее полученного в качестве исходного вещества. Альтернативно, такое соединение может быть получено путем разделения оптических изомеров, используя хиральную колонку или асимметрического синтеза.
Некоторые соединения по изобретению могут существовать в виде таутомеров, и каждый такой таутомер и их смесь входят в объем изобретения.
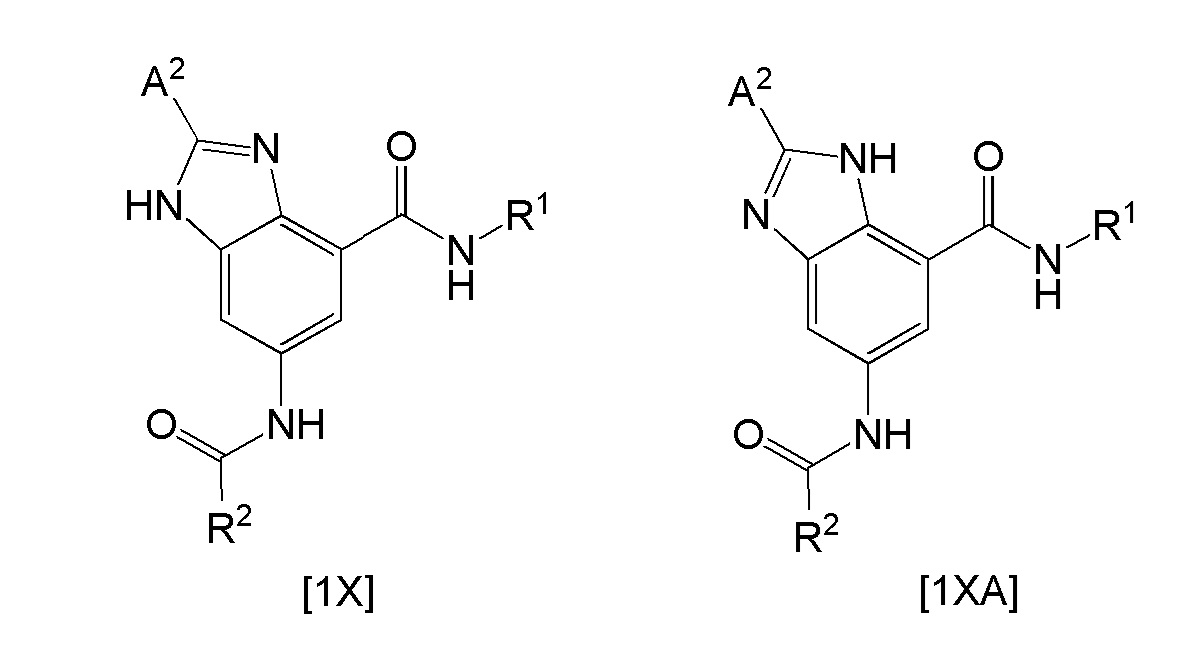
Например, гетероциклическое производное, представленное общей формулой [1] (т.е. гетероциклическое производное, представленное следующей общей формулой [1X]), где кольцо А представляет собой группу, представленную общей формулой [4] и X1 представляет собой NH, могут образовывать гетероциклическое производное, представленное следующей общей формулой [1XA].
Формула 17
 ,
,
где R1, R2, и A2 такие, как определено выше.
Как показано в примерах исследования ниже соединение по изобретению или его фармацевтически приемлемая соль имеет ингибиторную активность в отношении mPGES-1. Также, так как соединение по изобретению или его фармацевтически приемлемая соль имеет ингибиторную активность в отношении mPGES-1, то оно имеет ингибирующее действие в отношении PGE2, анальгетическую активность и противовоспалительный эффект.
Таким образом, соединение по изобретению или его фармацевтически приемлемая соль может быть использовано в качестве средства для профилактики или лечения заболевания, связанного с mPGES-1, заболевания, связанного с PGE2, и заболевания, для которого анальгетическое или противовоспалительное действие будет иметь эффект.
Примеры заболевания, при котором можно использовать соединение по изобретению или его фармацевтически приемлемую соль, включают воспалительное заболевание кишечника (например, см. непатентный документ 11), синдром раздраженного кишечника, мигрень, головную боль, боль в пояснице, спинальный стеноз, грыжу межпозвоночного диска, нарушения височно-нижнечелюстного сустава, шейный синдром, шейный спондилез, эндометриоз (например, см. непатентный документ 12), аденомиоз, преждевременные роды и угрозу преждевременных родов, дисменорею, гиперактивность мочевого пузыря, ноктурию (например, см. непатентный документ 13), интерстициальный цистит, нейродегенеративное заболевание, такое как болезнь Альцгеймера, рассеянный склероз (например, см. непатентный документ 14), псориаз, ревматоидный артрит (например, см. непатентный документ 15 и непатентный документ 16), ревматическую лихорадку, фибромиалгию, невралгию (например, см. непатентный документ 17), комплексный региональный болевой синдром, фасциальную дисфункцию, вирусную инфекцию, такую как грипп, простуда, опоясывающий лишай и СПИД, бактериальную инфекцию, микоз, ожог (например, см. непатентный документ 18), воспаление и боль после операции, травму и дентальную экстракцию, злокачественную опухоль, такую как рак толстого кишечника, рак молочной железы, рак легкого, рак предстательной железы и тому подобное (например, см. непатентный документ 19, непатентный документ 20 и непатентный документ 21), атеросклероз (например, см. непатентный документ 22), инсульт (например, см. непатентный документ 23), подагру, артрит, остеоартрит (например, см. непатентный документ 24 и непатентный документ 25), юношеский артрит, анкилозирующий спондилит, тендовагинита, окостенение связок, системную красную волчанку, васкулит, панкреатит, нефрит (например, см. непатентный документ 26), конъюнктивит, ирит, склерит, увеит, терапию раны, дерматит, экзему, остеопороз, астму (например, см. непатентный документ 27), хроническое обструктивное заболевание легких (например, см. непатентный документ 28), легочный фиброз (например, см. непатентный документ 29), аллергическое заболевание (например, см. непатентный документ 30), семейный аденоматозный полипоз (например, см. непатентный документ 31), склеродермию (например, см. непатентный документ 32), бурсит, лейомиому матки, простатит и боль при злокачественной опухоли.
При введении в виде фармацевтического средства соединение по изобретению или его фармацевтически приемлемую соль вводят самостоятельно или в виде фармацевтической композиции, содержащей, например, от 0,001% до 99,5%, предпочтительно, от 0,1% до 90%, в фармацевтически приемлемом нетоксическом и неактивном носителе млекопитающему, включая человека.
В фармацевтической композиции в качестве носителя может использоваться разбавитель в форме твердого вещества, полутвердого вещества или жидкости, наполнитель, и один или несколько других добавок в состав. Предпочтительно, фармацевтическую композицию по изобретению вводят в лекарственной форме. Фармацевтическую композицию можно вводить путем внутритканевого введения, перорального введения, внутривенного введения, местного введения, такого как кожное введение, введение в глаз, внутрибрюшинное введение, интраторакальное введение и тому подобное, или трансректальное введение. Конечно, композицию следует вводить в лекарственной форме, подходящей для этих способов введения.
Доза лекарственного средства должна быть скорректирована предпочтительно с учетом пациентам, а именно возраста, массы тела, природы и тяжести заболевания, пути введения, соединения по изобретению для введения, является ли соединение солью или нет, и вида такой соли. Для перорального введения суточная доза соединения по изобретению или его фармацевтически приемлемой соли в качестве активного ингредиента для взрослого, предпочтительно, находится в диапазоне от 0,01 мг до 5 г, предпочтительно, от 1 мг до 500 мг для взрослого человека. Однако в некоторых случаях может быть достаточна доза, ниже указанного диапазона, или в других случаях может быть необходима доза, выше указанного диапазона. Как правило, суточную дозу вводят один раз в сутки или может быть введена несколько раз в сутки. Альтернативно, суточная доза может быть введена внутривенно быстрым введением или непрерывной инфузией в течение 24 часов.
Пример
Хотя настоящее изобретение далее описано подробно в следующих ссылочных примерах, примерах, примерах исследований и примерах состава, настоящее изобретение ими не ограничено.
Условиями измерения масс-спектральной высокоэффективной жидкостной хроматографии; LCMS являются следующие.
Аналитический прибор: система ACUITY UPLC MS/PDA (Waters)
Масс-спектрометр: детектор Waters 3100 MS
Фотодетектор на диодной матрице: детектор ACUITY PDA (210-400 нм)
Колонка: Acuity BEH C18, 1,7 мкм, 2,1×50 мм
Скорость потока: 0,5 мл/мин
Температура колонки: 40°C
Растворитель:
Жидкость A: 0,1% муравьиная кислота/H2O (об./об.)
Жидкость B: 0,1% муравьиная кислота/ацетонитрил (об./об.)
Градиентные условия:
Способ A:
0,0-2,5 мин; % жидкость А /% жидкость B = 90/10 → 10/90
2,5-3,0 мин; % жидкость А /% жидкость B = 10/90
3,0-3,5 мин; % жидкость А /% жидкость B = 0/100
Способ B:
0,0-2,5 мин; % жидкость А /% жидкость B = 50/50 → 10/90
2,5-3,0 мин; % жидкость А /% жидкость B = 10/90
3,0-3,5 мин; % жидкость А /% жидкость B = 0/100
Значения [MS(m/z)] (MS: масс-спектрометрия), наблюдаемые в масс-спектрометрии, выражали в m/z, а время удержания в Rt (минута).
Ссылочный пример 1
2-Хлор-5-(этоксиметил)бензойная кислота
Смесь метил 5-(бромметил)-2-хлорбензоата (получен, как описано в WO2010/132999) (0,2 г), карбоната калия (0,21 г), EtOH (3 мл) и ТГФ (3 мл) перемешивали при 80°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, затем добавляли воду, и смесь экстрагировали этилацетатом. Органический слой разделяли и промывали насыщенным солевым раствором, и сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на колонке с получением этил 2-хлор-5-(этоксиметил)бензоата (0,15 г). Его растворяли в ТГФ-MeOH-H2O (3:3:2, 8 мл), и добавляли гидроксид лития гидрат (0,15 г), и смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь подкисляли 1н хлористоводородной кислотой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния и концентрировали в вакууме с получением указанного в заголовке соединения (0,12 г) в виде светло-желтого масла.
Ссылочный пример 2
2-Хлор-5-[(2-этоксиэтокси)метил]бензойная кислота
Указанное в заголовке соединение получали согласно методике, описанной в ссылочном примере 1, используя 2-этоксиэтанол вместо EtOH.
Ссылочный пример 3
2-Хлор-5-(циклопропилэтинил)бензойная кислота
К раствору этил 5-бром-2-хлорбензоата (1,9 г) в ДМФ (12 мл), добавляли толуол (0,3 мл), циклопропилацетилен (714 мг), йодид меди (275 мг), дихлор бис(трифенилфосфин)палладий (1,01 г) и триэтиламин (20,1 мл), и смесь дегазировали, затем перемешивали при 100°C в атмосфере аргона в течение 8 часов, а затем реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Нерастворимое вещество отфильтровывали на целите. Маточный раствор промывали насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. При очистке хроматографией на колонке получали этил 2-хлор-5-(циклопропилэтинил)бензоат (1,86 г) в виде коричневого масла.
Масло растворяли в MeOH-ТГФ (1:1, 60 мл), добавляли 10% водный раствор гидроксида натрия (20 мл), и раствор перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли при пониженном давлении, к остатку добавляли воду, и смесь разделяли диэтиловым эфиром.
Водный слой разделяли, подкисляли с помощью 1н хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и концентрировали в вакууме. Осажденное твердое вещество промывали н-гексаном, и указанное в заголовке соединение (1,02 г) получали в виде бежевого порошка.
Ссылочный пример 4
2-Хлор-5-(2-циклопропилэтил)бензойная кислота
К раствору 2-хлор-5-(циклопропилэтинил)бензойной кислоты (200 мг) в этилацетате (20 мл) добавляли 10% палладий на угле (40 мг), и смесь затем перемешивали в атмосфере водорода (0,2MPa)) в течение 14 часов, затем отфильтровывали на целите, и маточный раствор концентрировали в вакууме.
Остаток очищали хроматографией на колонке с силикагелем с получением указанного в заголовке соединения (190 мг) в виде желтого масла.
Ссылочный пример 5
2-Хлор-5-(2-фенилэтил)бензойная кислота
Стадии 1
2-хлор-5-(фенилэтинил)бензойная кислота
Согласно методике, описанной в ссылочному примере 3, используя фенилацетилен вместо циклопропилацетилена, получали 2-хлор-5-(фенилэтинил)бензойную кислоту в виде желтого порошка.
Стадия 2
2-Хлор-5-(2-фенилэтил)бензойная кислота
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в ссылочном примере 4, используя 2-хлор-5-(фенилэтинил)бензойную кислоту вместо 2-хлор-5-(циклопропилэтинил)бензойная кислота.
Ссылочный пример 6
5-(3-трет-Бутокси-1-пропинил)-2-хлорбензойная кислота
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в ссылочном примере 3, используя трет-бутилпропаргиловый эфир вместо циклопропилацетилена.
Ссылочный пример 7
5-(3-трет-Бутоксипропил)-2-хлорбензойная кислота
Указанное в заголовке соединение получали в виде светло-желтого масла согласно методике, описанной в ссылочном примере 4, используя 5-(3-трет-бутокси-1-пропинил)-2-хлорбензойную кислоту вместо 2-хлор-5-(циклопропилэтинил)бензойной кислоты.
Ссылочный пример 8
2-Хлор-5-(3-гидрокси-3-метилбутил)бензойная кислота
Стадия 1
2-Хлор-5-(3-гидрокси-3-метил-1-бутинил)бензойная кислота
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в ссылочном примере 3, используя 2-метил-3-бутин-2-ол вместо циклопропилацетилена.
Стадия 2
2-Хлор-5-(3-гидрокси-3-метилбутил)бензойная кислота
Указанное в заголовке соединение получали в виде светло-желтого масла согласно методике, описанной в ссылочном примере 4, используя 2-хлор-5-(3-гидрокси-3-метил-1-бутинил)бензойную кислоту вместо 2-хлор-5-(циклопропилэтинил)бензойной кислоты.
Ссылочный пример 9
3-Метокси-N,2,2-триметилпропан-1-амин
Стадия 1
трет-Бутил (3-гидрокси-2,2-диметилпропил)карбамат
Раствор 3-амино-2,2-диметил-1-пропанола (6,98 г) и карбоната натрия (7,18 г) в 1,4-диоксан-H2O (1:1, 240 мл) перемешивали при охлаждении на льду и добавляли ди-трет-бутил дикарбонат (14,77 г), и смесь перемешивали в течение 5 часов.
Добавляли этилацетат и органический слой разделяли, последовательно промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали в вакууме с получением указанного в заголовке соединения (12,7 г) в виде бесцветного твердого вещества.
Стадия 2
3-Метокси-N,2,2-триметилпропан-1-амин
Раствор 60% гидрида натрия (1,89 г) в ДМФ (60 мл) перемешивали при охлаждении на льду, по каплям медленно добавляли раствор трет-бутил (3-гидрокси-2,2-диметилпропил)карбамата (3,84 г) в ДМФ (45 мл) в течение 5 минут. Добавляли метилйодид (10,73 г) и смесь перемешивали при комнатной температуре в течение 3 часов. В реакционную смесь добавляли диэтиловый эфир. Органический слой разделяли, последовательно промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на колонке с получением трет-бутил (3-метокси-2,2-диметилпропил)метилкарбамата (3,1 г) в виде бесцветного масла. Масло перемешивали при охлаждении на льду, добавляли ТФУ (8 мл), и затем смесь перемешивали при комнатной температуре в течение 1 часа. Смесь перемешивали при охлаждении на льду, и поднимали pH до приблизительно pH 9 с помощью 1н водного раствора гидроксида натрия и экстрагировали диэтиловым эфиром. Слой диэтилового эфира сушили и концентрировали в вакууме с помощью сульфата магния с получением указанного в заголовке соединения (2,6 г) в виде светло желтого масла.
Ссылочный пример 10
5-Бутокси-2-хлорбензойная кислота
К раствору 2-хлор-5-фторбензойной кислоты (50 мг) и 1-бутанола (263 мкл) в ТГФ (0,5 мл) и ДМФ (3 мл) добавляли т-бутоксид калия (329 мг), и раствор взаимодействовал при 120°C в течение 10 минут в микроволновом синтезаторе (Biotage, Initiator). Реакционную смесь охлаждали и подкисляли добавлением воды и 2M хлористоводородной кислоты, экстрагировали диэтиловым эфиром, сушили над безводным сульфатом натрия. Растворитель удаляли в вакууме, и остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (17 мг) в виде белого порошка.
Ссылочный пример 11
2-Хлор-5-(2,2-дифторэтокси)бензойная кислота
Стадия 1
Метил 2-хлор-5-(2,2-дифторэтокси)бензоат
К суспензии метил 2-хлор-5-гидроксибензоата (50 мг) и карбоната калия (111 мг) в ацетоне (1 мл) добавляли 2-йод-1,1-дифторэтан (35 мкл), и суспензия взаимодействовала при 120°C в течение 10 минут в микроволновом синтезаторе (Biotage, Initiator). После реакции при 130°C в течение дополнительных 15 минут реакционную смесь непосредственно очищали хроматографией на колонке с силикагелем с получением указанного в заголовке соединения (55 мг) в виде желтого масла.
Стадия 2
2-Хлор-5-(2,2-дифторэтокси)бензойная кислота
К раствору метил 2-хлор-5-(2,2-дифторэтокси)бензоата (55 мг) в MeOH (1 мл) добавляли 1M водный раствор гидроксида лития (0,88 мл), и раствор перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь перемешивали при охлаждении на льду, медленно добавляли 2M хлористоводородную кислоту для подкисления до рН 2-3, и осажденное твердое вещество фильтровали. Твердое вещество последовательно промывали небольшим количеством воды и диэтиловым эфиром, сушили при пониженном давлении с получением указанного в заголовке соединения (28 мг) в виде белого порошка.
Ссылочный пример 12
2-Хлор-5-(4,4,4-трифторбутокси)бензойная кислота
Стадия 1
Метил 2-хлор-5-(4,4,4-трифторбутокси)бензоат
К суспензии метил 2-хлор-5-гидрокси бензоата (50 мг) и карбоната калия (111 мг) в ацетоне (1 мл) добавляли 1-бром-4,4,4-трифторбутан (50 мкл), и суспензия взаимодействовала при 120°C в течение 10 минут в микроволновом синтезаторе (Biotage, Initiator). Реакционную смесь непосредственно очищали хроматографией на колонке с силикагелем с получением указанного в заголовке соединения (74 мг) в виде бесцветного масла.
Стадия 2
2-Хлор-5-(4,4,4-трифторбутокси)бензойная кислота
К раствору метил 2-хлор-5-(4,4,4-трифторбутокси)бензоата (74 мг) в MeOH (1 мл) добавляли 1M водный раствор гидроксида лития (0,99 мл), и реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь перемешивали при охлаждении на льду, и медленно добавляли 2M хлористоводородную кислоту для подкисления до рН 2-3. Осажденное твердое вещество фильтровали, промывали водой, и сушили при пониженном давлении с получением указанного в заголовке соединения (49 мг) в виде бесцветного порошка.
Пример 1
N-[2-(Трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Стадия 1
Метил 1H-бензимидазол-4-карбоксилат
К суспензии метил 2-амино-3-нитробензоата (1,0 г) в муравьиной кислоте (>87%) добавляли 5% палладий на угле (100 мг), и суспензию нагревали при перемешивании при 100°C в течение 23 часов. После того как реакционную смесь охлаждали до комнатной температуры, катализатор отфильтровывали на целите, и маточный раствор концентрировали в вакууме. Осажденное твердое вещество промывали диэтиловым эфиром при перемешивании, твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (872 мг), в виде бесцветного порошка.
Стадия 2
Метил 6-нитро-1H-бензимидазол-4-карбоксилат
Метил 1H-бензимидазол-4-карбоксилат (315 мг) растворяли в концентрированной серной кислоте (3 мл), и раствор перемешивали на ледяной бане. Порциями добавляли небольшое количество нитрата калия (199 мг), раствор перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь выливали в лед, подщелачивали 3н водным раствором гидроксида натрия при перемешивании на ледяной бане, и экстрагировали этилацетатом. Этилацетатный слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния. Указанное в заголовке соединение (334 мг) получали в виде бесцветного порошка, затем отдистиллировывали растворитель при пониженном давлении.
Стадия 3
Метил 6-амино-1H-бензимидазол-4-карбоксилат
Метил 6-нитро-1H-бензимидазол-4-карбоксилат (304 мг) суспендировали в MeOH (10 мл), в суспензию добавляли 5% палладий на угле (30 мг) и перемешивали в атмосфере водорода (1 атм). Катализатор отфильтровывали на целите и промывали MeOH, и маточный раствор концентрировали в вакууме с получением указанного в заголовке соединения (269 мг), в виде светло-желтого порошка.
MS(ESI+) m/z 192(M+H)+
Стадия 4
Метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
К раствору метил 6-амино-1H-бензимидазол-4-карбоксилата (266 мг) в обезвоженном ТГФ (12 мл), добавляли N,N-диизопропилэтиламин (284 мкл), и раствор перемешивали при охлаждении на льду. К этому раствору медленно по каплям добавляли 2-(трифторметил)бензоилхлорид (284 мкл) в обезвоженном ТГФ (5 мл), и перемешивали при той же температуре в течение 3 часов. После того как добавляли ледяную воду, ТГФ удаляли при пониженном давлении, и добавляли водный насыщенный раствор бикарбоната натрия, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с NH силикагелем (этилацетат→этилацетат/MeOH) с получением указанного в заголовке соединения (309 мг) в виде светло-желтого порошка.
Стадия 5
6-({[2-(Трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат (356 мг) растворяли в MeOH (10 мл) и добавляли 1н водный раствор гидроксида натрия (2 мл), и реакционную смесь перемешивали при комнатной температуре в течение ночи.
После того как MeOH удаляли при пониженном давлении, к остатку добавляли воду, и раствор подкисляли 1н хлористоводородной кислотой до рН 5 при охлаждении на льду. Осадок собирали фильтрованием с получением указанного в заголовке соединения (276 мг), в виде светловато-коричневого порошка.
Стадия 6
N-[2-(Трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
К раствору 6-({[2-(Трифторметил)фенил]карбонил}амино-1H-бензимидазол-4-карбоновой кислоты (50 мг) в ДМФ (2 мл) добавляли гидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина (33 мг), 1-гидроксибензотриазол (23 мг) и триэтиламин (24 мкл), и 2-(трифторметил)бензиламин (24 мкл) при охлаждении на льду, и раствор перемешивали при комнатной температуре в течение ночи. Смесь выливали в ледяную воду и экстрагировали этилацетатом. Этилацетатный слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток промывали н-гексан/этилацетат (1:1), и собирали фильтрованием с получением указанного в заголовке соединения (61 мг) в виде бесцветного порошка.
MS(ESI+)m/z 507(M+H)+
Пример 2
N-циклогексил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 6 примера 1, используя циклогексиламин вместо 2-(трифторметил)бензиламина.
MS(ESI+) m/z 431(M+H)+
Пример 3
N-(3-Хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
К раствору 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты (пример 1, стадия 5) (40 мг) в ДМФ (2 мл) добавляли HBTU (53 мг), триэтиламин (20 мкл). При охлаждении на льду добавляли 3-хлор-2-метиланилин (17 мкл), и раствор перемешивали при комнатной температуре в течение 24 часов.
Реакционную смесь выливали в ледяную воду, экстрагировали этилацетатом. Этилацетатный слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении.
Остаток промывали н-гексаном/этилацетатом (1:1) и собирали фильтрованием с получением указанного в заголовке соединения (33 мг), в виде бесцветного порошка.
MS(ESI+)m/z 473(M+H)+
Пример 5
N-[(1-Гидроксициклогексил)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 6 примера 1, используя 1-аминометил-1-циклогексанол вместо 2-(трифторметил)бензиламина.
MS(ESI+)m/z 461(M+H)+
Пример 6
N-[2-(Трифторметил)бензил]-5-({[2-(трифторметил)фенил]карбонил}амино)-2,3-дигидро-1-бензофуран-7-карбоксамид)
Стадия 1
Этил 5-бром-2,3-дигидро-1-бензофуран-7-карбоксилат
К раствору 5-бром-2,3-дигидро-1-бензофуран-7-карбоновой кислоты (1,0 г) в EtOH (15 мл), добавляли серную кислоту (0,5 мл), и раствор нагревали при кипячении с обратным холодильником в течение 30 часов. Реакционную смесь охлаждали до комнатной температуры и удаляли EtOH. К остатку добавляли воду, и раствор экстрагировали этилацетатом. Этилацетатный слой последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (1,07 г), в виде светло-желтого порошка.
Стадия 2
Этил 5-({[2-(Трифторметил)фенил]карбонил}амино)-2,3-дигидро-1-бензофуран-7-карбоксилат
К этил 5-бром-2,3-дигидро-1-бензофуран-7-карбоксилату (600 мг), 2-(трифторметил)бензамиду (501 мг), 4,5-бис(дифенилфосфино)-9,9-диметилксантену (Xantphos) (96 мг), карбонату цезия (1,01 г) и трис(дибензилиденацетон)дипалладию (114 мг) добавляли 1,4-диоксан (20 мл). После дегазирования смесь перемешивали при 100°C в атмосфере аргона в течение 24 часов. Реакционную смесь отфильтровывали на целите, растворитель удаляли при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем с получением указанного в заголовке соединения (220 мг) в виде слегка желтого порошка.
Стадия 3
5-({[2-(Трифторметил)фенил]карбонил}амино)-2,3-дигидро-1-бензофуран-7-карбоновая кислота
К суспензии этил 5-({[2-(трифторметил)фенил]карбонил}амино)-2,3-дигидро-1-бензофуран-7-карбоксилата (220 мг), полученного на стадии 2, в EtOH (5 мл), добавляли 1н водный раствор гидроксида натрия (1 мл), и смесь перемешивали при 80°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и при пониженном давлении удаляли EtOH. К остатку добавляли воду и подкисляли до рН 3 с помощью 1н хлористоводородной кислоты при охлаждении на льду и экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (195 мг), в виде слегка желтого порошка.
Стадия 4
N-[2-(Трифторметил)бензил]-5-({[2-(трифторметил)фенил]карбонил}амино)-2,3-дигидро-1-бензофуран-7-карбоксамид
К раствору 5-({[2-(трифторметил)фенил]карбонил}амино)-2,3-дигидро-1-бензофуран-7-карбоновой кислоты (35 мг) в ДМФ (2 мл), добавляли гидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина (23 мг), 1-гидроксибензотриазол (23 мг) и триэтиламин (17 мкл). При охлаждении на льду в смесь добавляли 2-(трифторметил)бензиламин (15 мкл) и перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Этилацетатный слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток промывали н-гексан/этилацетатом (1:1) и собирали фильтрованием с получением указанного в заголовке соединения (43 мг) в виде бесцветного порошка.
MS(ESI+) m/z 509 (M+H)+, Rt = 2,31 минут (способ A)
Пример 7
N-циклогексил-5-({[2-(трифторметил)фенил]карбонил}амино)-2,3-дигидро-1-бензофуран-7-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 4 примера 6, используя циклогексиламин вместо 2-(трифторметил)бензиламина.
MS(ESI+) m/z 433 (M+H)+, Rt = 2,25 минут (способ A)
Пример 8
N-(3-Хлор-2-метилфенил)-5-({[2-(трифторметил)фенил]карбонил}амино)-2,3-дигидро-1-бензофуран-7-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, как описано в примере 3, используя 5-({[2-(трифторметил)фенил]карбонил}амино)-2,3-дигидро-1-бензофуран-7-карбоновую кислоту вместо 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 475 (M+H)+, Rt = 2,47 минут (способ A)
Пример 9
N-циклогексил-5-({[2-(трифторметил)фенил]карбонил}амино)-1H-индазол-7-карбоксамид
Стадия 1
Метил 5-бром-1-{[2-(триметилсилил)этокси]метил}-1H-индазол-7-карбоксилат
В атмосфере аргона раствор метил 5-бром-1H-индазол-7-карбоксилата (получен в соответствии с WO2008/65508) (658 мг) в ДМФ (20 мл) перемешивали при охлаждении на льду. Медленно добавляли 60% гидрид натрия (124 мг), и смесь перемешивали в течение 30 минут при той же температуре. По каплям медленно добавляли хлорид 2-(триметилсилил)этоксиметила (544 мкл), используя шприц, и смесь перемешивали при комнатной температуре в течение 4 часов. Смесь выливали в ледяную воду и экстрагировали этилацетатом. Этилацетатный слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем с получением указанного в заголовке соединения (696 мг), в виде слегка желтого масла.
Стадия 2
Метил 5-{[(бензилокси)карбонил]амино}-1-{[2-(триметилсилил)этокси]метил}-1H-индазол-7-карбоксилат
Указанное в заголовке соединение получали в виде слегка желтого масла из метил 5-бром-1-{[2-(триметилсилил)этокси]метил}-1H-индазол-7-карбоксилата, полученного на стадии 1, согласно методике, описанной в стадии 2 примера 6, используя бензил карбамат вместо 2-(трифторметил)бензамида.
Стадия 3
Метил 5-амино-1-{[2-(триметилсилил)этокси]метил}-1H-индазол-7-карбоксилат
К раствору метил 5-{[(бензилокси)карбонил]амино}-1-{[2-(триметилсилил)этокси]метил}-1H-индазол-7-карбоксилата (364 мг) в MeOH (10 мл) добавляли 5% палладий на угле (55 мг), и реакционную смесь перемешивали в течение ночи в атмосфере водорода при обычном давлении. Реакционную смесь отфильтровывали на целите и промывали MeOH. Маточный раствор концентрировали при пониженном давлении с получением указанного в заголовке соединения (234 мг), в виде зеленого порошка.
Стадия 4
Метил 5-({[2-(трифторметил)фенил]карбонил}амино)-1-{[2-(триметилсилил)этокси]метил}-1H-индазол-7-карбоксилат
Указанное в заголовке соединение (323 мг) получали в виде бесцветного порошка согласно методике, описанной в стадии 4 примера 1, используя метил 5-амино-1-{[2-(триметилсилил)этокси]метил}-1H-индазол-7-карбоксилат (231 мг).
Стадия 5
5-({[2-(Трифторметил)фенил]карбонил}амино)-1-{[2-(триметилсилил)этокси]метил}-1H-индазол-7-карбоновая кислота
Указанное в заголовке соединение (291 мг) получали в виде бесцветного порошка согласно методике, описанной в стадии 5 примера 1, используя метил 5-({[2-(трифторметил)фенил]карбонил}амино)-1-{[2-(триметилсилил)этокси]метил}-1H-индазол-7-карбоксилат (321 мг).
Стадия 6
N-циклогексил-5-({[2-(трифторметил)фенил]карбонил}амино)-1H-индазол-7-карбоксамид
К раствору 5-({[2-(трифторметил)фенил]карбонил}амино)-1-{[2-(триметилсилил)этокси]метил}-1H-индазол-7-карбоновой кислоты (полученной на стадии 5) (48 мг) в ДМФ (2 мл) добавляли HBTU (46 мг) и триэтиламин (17 мкл), и смесь перемешивали при комнатной температуре и добавляли циклогексиламин (12,5 мкл) и перемешивали при той же температуре в течение ночи. Реакционную смесь выливали в ледяную воду, экстрагировали этилацетатом. Этилацетатный слой последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток растирали в н-гексане/этилацетате (10:1), и собирали фильтрованием с получением 59 мг N-циклогексил-5-({[2-(трифторметил)фенил]карбонил}амино)-1-[2-(триметилсилил)этоксиметил]индазол-7-карбоксамида в виде бесцветного порошка. Его растворяли в MeOH (2 мл), добавляли 6н хлористоводородную кислоту (2 мл), и раствор перемешивали на мясляной бане при 60-80°C в течение 10 часов. Растворитель удаляли, и к остатку добавляли ледяную воду. Осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (33 мг) в виде бесцветного порошка.
MS(ESI+) m/z 431 (M+H)+, Rt = 1,91 минут (способ A)
Элементный анализ для C22H21F3N4O2 + 0,1H2O
Вычисл.(%) C:61,13 H:4,94 N:12,96
Найдено.(%) C:60,93 H:4,91 N:12,71
Пример 10
N-[2-(Трифторметил)бензил]-5-({[2-(трифторметил)фенил]карбонил}амино)-1H-индазол-7-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 6 примера 9, используя 2-(трифторметил)бензиламин вместо циклогексиламина.
MS(ESI+) m/z 507 (M+H)+, Rt = 2,05 минут (способ A)
Пример 11
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 2-амино-3-[(метоксиацетил)амино]бензоат
К раствору метил 2,3-диаминобензоата (3,0 г) в ТГФ (50 мл) добавляли N,N-диизопропилэтиламин (4,0 мл). Раствор перемешивали при охлаждении на льду и медленно по каплям добавляли метоксиацетилхлорид (1,81 мл) в ТГФ (10 мл) и перемешивали в течение 3 часов при той же температуре. В реакционную смесь добавляли насыщенным водным раствором бикарбоната натрия, и удаляли ТГФ при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия, и экстрагировали этилацетатом, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем с получением указанного в заголовке соединения (3,60 г), в виде светло-желтого порошка.
Стадия 2
Метил 2-(метоксиметил)-1H-бензимидазол-4-карбоксилат
Метил 2-амино-3-[(метоксиацетил)амино]бензоат (280 мг) растворяли в уксусной кислоте (6 мл), и раствор нагревали при 100°C в течение 0,5 часа при перемешивании. После охлаждения реакционной смеси до комнатной температуры удаляли уксусную кислоту. К остатку добавляли насыщенный водный раствор бикарбоната натрия при охлаждении на льду, и экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (241 мг), в виде светло-желтого порошка.
Стадия 3
Метил 2-(метоксиметил)-6-нитро-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение (274 мг) получали в виде бесцветного порошка согласно методике, описанной в стадии 2 примера 1, используя метил 2-(метоксиметил)-1H-бензимидазол-4-карбоксилат (240 мг) вместо метил 1H-бензимидазол-4-карбоксилата.
Стадия 4
Метил 6-амино-2-(метоксиметил)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение (202 мг) получали в виде желтого порошка согласно методике, описанной в стадии 3 примера 1, используя метил 2-(метоксиметил)-6-нитро-1H-бензимидазол-4-карбоксилат (271 мг) вместо метил 6-нитро-1H-бензимидазол-4-карбоксилата.
Стадия 5
Метил 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение (281 мг) получали в виде бесцветного порошка согласно методике, описанной в стадии 4 примера 1, используя метил 6-амино-2-(метоксиметил)-1H-бензимидазол-4-карбоксилат (200 мг) вместо метил 6-амино-1H-бензимидазол-4-карбоксилата.
Стадия 6
2-(Метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение (263 мг) получали в виде бесцветного порошка согласно методике, описанной в стадии 5 примера 1, используя метил 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат (278 мг) вместо метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 7
N-(3-Хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
К раствору 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота (153 мг) в ДМФ (5 мл), добавляли HBTU (178 мг) и триэтиламин (65 мкл). В смесь добавляли 3-хлор-2-метиланилин (56 мкл) при перемешивании при комнатной температуре, и смесь перемешивали в течение ночи. Реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия, экстрагировали этилацетатом. Этилацетатный слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем с получением N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (165 мг) в виде бесцветного порошка.
Стадия 8
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид (165 мг), полученный на стадии 7, суспендировали в EtOH (3 мл). В суспензию добавляли 1M хлористоводородную кислоту (0,32 мл) и перемешивали с получением гомогенного раствора, и растворитель удаляли при пониженном давлении. Остаток растирали в этилацетате, собирали фильтрованием, и сушили с получением указанного в заголовке соединения (167 мг) в виде бесцветного порошка.
MS(ESI+) m/z 517 (M+H)+, Rt = 2,41 минут (способ A)
Элементный анализ для C25H20ClF3N4O3⋅HCl+1,0H2O
Вычисл. (%) C:52,55 H:4,06 N:9,81
Найдено (%) C:52,35 H:3,96 N:9,89
Пример 12
Гидрохлорид 2-метил-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 11, используя ацетилхлорид вместо метоксиацетилхлорида, и 2-(трифторметил)бензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 521 (M+H)+,
Rt = 1,74 минут (способ A)
Элементный анализ для C25H18F6N4O2•HCl + 1,5H2O
Вычисл.(%) C:51,42 H:3,80 N:9,60
Найдено(%) C:51,68 H:3,81 N:9,45
Пример 13
Гидрохлорид N-циклогексил-2-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 11, используя ацетилхлорид вместо метоксиацетилхлорида, циклогексиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 445 (M+H)+, Rt = 1,52 минут (способ A)
Пример 14
Гидрохлорид N-(3-хлор-2-метилфенил)-2-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 11, используя ацетилхлорид вместо метоксиацетилхлорида.
MS(ESI+) m/z 487 (M+H)+, Rt = 2,10 минут (способ A)
Пример 15
N-Циклопентил-2-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11 со стадии 1 до стадии 7, используя ацетилхлорид вместо метоксиацетилхлорида, и циклопентиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 431 (M+H)+, Rt = 1,39 минут (способ A)
Пример 16
N-циклобутил-2-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11 со стадии 1 по стадии 7, используя ацетилхлорид вместо метоксиацетилхлорида, и циклобутиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 417 (M+H)+, Rt = 1,29 минут (способ A)
Пример 17
N-(3-Хлор-2-метилфенил)-2-этил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11 со стадии 1 по стадии 7, используя пропионилхлорид вместо метоксиацетилхлорида.
MS(ESI+) m/z 501 (M+H)+, Rt = 2,39 минут (способ A)
Пример 18
N-циклогексил-2-этил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11 со стадии 1 по стадии 7, используя пропионилхлорид вместо метоксиацетилхлорида, и циклогексиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 459 (M+H)+, Rt = 1,75 минут (способ A)
Пример 19
2-Этил-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11 со стадии 1 по стадии 7, используя пропионилхлорид вместо метоксиацетилхлорида, и 2-(трифторметил)бензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 535 (M+H)+, Rt = 1,96 минут (способ A)
Пример 20
N-циклогексил-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11 со стадии 1 по стадии 7, используя циклогексиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 475 (M+H)+, Rt = 1,97 минут (способ A)
Пример 21
2-(Метоксиметил)-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11 со стадии 1 по стадии 7, используя 2-(трифторметил)бензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 551 (M+H)+, Rt = 2,12 минут (способ A)
Пример 22
Гидрохлорид 2-(метоксиметил)-N-(2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя орто-толуидин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 483 (M+H)+, Rt = 1,06 минут (способ B)
Пример 23
Гидрохлорид 2-(метоксиметил)-N-(4-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя пара-толуидин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 483 (M+H)+, Rt = 1,06 минут (способ B)
Пример 24
Гидрохлорид N-(2-хлорбензил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 11, используя 2-хлорбензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 517 (M+H)+, Rt = 2,04 минут (способ A)
Пример 25
Гидрохлорид 2-(метоксиметил)-N-(4-метилбензил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 4-метилбензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 497 (M+H)+, Rt = 1,99 минут (способ A)
Пример 26
Гидрохлорид N-(4,4-дифторциклогексил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 4,4-дифторциклогексиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 511 (M+H)+, Rt = 1,88 минут (способ A)
Пример 27
Гидрохлорид N-(4-трет-бутилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 4-трет-бутиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 525 (M+H)+, Rt = 1,63 минут (способ B)
Пример 28
Гидрохлорид 2-(метоксиметил)-N-[4-(трифторметил)фенил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 1-амино-4-(трифторметил)бензол вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 537 (M+H)+, Rt = 1,39 минут (способ B)
Пример 29
Гидрохлорид N-(2,4-диметилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 2,4-диметиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 497 (M+H)+, Rt = 1,24 минут (способ B)
Пример 30
Гидрохлорид N-(2-хлор-4-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 2-хлор-4-метиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 517 (M+H)+, Rt = 1,42 минут (способ B)
Пример 31
Гидрохлорид N-(3,4-диметилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 3,4-диметиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 497 (M+H)+, Rt = 1,22 минут (способ B)
Пример 32
Гидрохлорид N-(3-хлор-4-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 3-хлор-4-метиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 517 (M+H)+, Rt = 1,46 минут (способ B)
Пример 33
Гидрохлорид N-(2,3-дигидро-1H-инден-5-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде серого порошка согласно методике, описанной в примере 11, используя 5-аминоиндан вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 509 (M+H)+, Rt = 2,36 минут (способ A)
Пример 34
Гидрохлорид 2-(метоксиметил)-N-(5,6,7,8-тетрагидронафтален-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя 5,6,7,8-тетрагидро-1-нафтиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 523 (M+H)+, Rt = 2,44 минут (способ A)
Пример 35
N-(2-Фторфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Перемешиваемый раствор 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты в ТГФ (2 мл) перемешивали при охлаждении на льду, к нему добавляли каталитическое количество ДМФ, а затем добавляли оксалилхлорид (7,7 мкл). Через час в реакционную смесь добавляли дополнительное количество оксалилхлорида (7,7 мкл) и перемешивали в течение еще одного часа и удаляли летучие элементы при пониженном давлении. Остаток растворяли в ТГФ (2 мл) и последовательно добавляли 2-фторанилин (8,8 мкл) и триэтиламин (11 мкл), и смесь перемешивали при комнатной температуре в течение 1 часа, и к ней добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом.
Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток растирали в н-гексан/диэтиловом эфире с получением указанного в заголовке соединения (21 мг) в виде бесцветного порошка.
MS(ESI+) m/z 487 (M+H)+, Rt = 2,14 минут (способ A)
Пример 36
2-(Метоксиметил)-N-(2-метоксифенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11 со стадии 1 по стадии 7, используя орто-анизидин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 499 (M+H)+, Rt = 2,07 минут (способ A)
Пример 37
2-(Метоксиметил)-N-(4-метоксифенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11 со стадии 1 по стадии 7, используя пара-анизидин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 499 (M+H)+, Rt = 1,96 минут (способ A)
Пример 38
N-(3-Бром-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11 со стадии 1 по стадии 7, используя 3-бром-2-метиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 563 (M+H)+, Rt = 2,45 минут (способ A)
Пример 39
Гидрохлорид N-(3-хлор-2-метилбензил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11 со стадии 1 по стадии 7, используя 3-хлор-2-метилбензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 531 (M+H)+, Rt = 2,19 минут (способ A)
Пример 40
N-(2,6-дифторфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 35, используя 2,6-дифторанилин вместо 2-фторанилина.
MS(ESI+) m/z 505 (M+H)+, Rt = 1,94 минут (способ A)
Пример 41
N-(3-Циано-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
К раствору N-(3-бром-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (пример 38) (85 мг) в ДМФ (0,5 мл), добавляли цианид цинка (60% содержание, 60 мг). После дегазирования в смесь добавляли тетракис(трифенилфосфин)палладия (88 мг) и перемешивали при 100°C в течение 24 часов. В реакционную смесь добавляли ледяную воду и экстрагировали этилацетатом. Этилацетатный слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали на препаративной тонкослойной хроматографии с получением указанного в заголовке соединения (14 мг) в виде бесцветного порошка.
MS(ESI+) m/z 508 (M+H)+, Rt = 1,02 минут (способ B)
Пример 42
Дигидрохлорид 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-N-{[3-(трифторметил)пиридин-2-ил]метил}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 2-(аминометил)-3-(трифторметил)пиридин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 552 (M+H)+, Rt = 1,86 минут (способ A)
Пример 43
Гидрохлорид N-(2-хлор-6-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 2-хлор-6-метиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 517 (M+H)+, Rt = 2,35 минут (способ A)
Пример 44
Гидрохлорид 2-(2-амино-2-оксоэтил)-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 2-(2-амино-2-оксоэтил)-6-нитро-1H-бензимидазол-4-карбоксилат
При охлаждении медленно порциями добавляли на льду нитрат калия (117 мг) к перемешиваемому раствору метил 2-(цианометил)-1H-бензимидазол-4-карбоксилата (получен, как описано в EP1479681) (226 мг) в концентрированной серной кислоте (5 мл), и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь выливали в лед и подщелачивали 3н водным раствором гидроксида натрия и экстрагировали этилацетатом. Этилацетатный слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток промывали MeOH, фильтровали и сушили с получением указанного в заголовке соединения (243 мг).
Стадия 2
Метил 6-амино-2-(2-амино-2-оксоэтил)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде желтого порошка согласно методике, описанной в стадии 4 примера 11, используя метил 2-(2-амино-2-оксоэтил)-6-нитро-1H-бензимидазол-4-карбоксилат вместо метил 2-(метоксиметил)-6-нитро-1H-бензимидазол-4-карбоксилата.
Стадия 3
Метил 2-(2-амино-2-оксоэтил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде оранжевого порошка согласно методике, описанной в стадии 4 примера 1, используя метил 6-амино-2-(2-амино-2-оксоэтил)-1H-бензимидазол-4-карбоксилат вместо метил 6-амино-1H-бензимидазол-4-карбоксилата.
Стадия 4
2-(2-Амино-2-оксоэтил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали в виде коричневого порошка согласно методике, описанной в стадии 5 примера 1, используя метил 2-(2-амино-2-оксоэтил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат вместо метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 5
Гидрохлорид 2-(2-амино-2-оксоэтил)-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадии 7 примера 11, используя 2-(2-амино-2-оксоэтил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 530 (M+H)+, Rt = 1,86 минут (способ A)
Пример 45
Гидрохлорид 2-(2-Амино-2-оксоэтил)-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадии 7 примера 11, используя 2-(2-амино-2-оксоэтил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты, и 2-(трифторметил)бензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 564 (M+H)+, Rt = 1,72 минут (способ A)
Пример 46
N-(3-Хлор-2-метилфенил)-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Стадия 1
Метил 1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
К раствору метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата (пример 1, стадия 4) (189 мг) в ТГФ (5 мл), при охлаждении на льду медленно добавляли NaH (60%, 25 мг), и смесь перемешивали при той же температуре в течение 30 минут и дополнительно при комнатной температуре в течение 1 часа. Реакционную смесь дополнительно перемешивали при охлаждении на льду, и медленно добавляли метилйодид (81 мкл) и перемешивали при комнатной температуре в течение ночи. В реакционную смесь добавляли насыщенный водный хлорид аммония и экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (78 мг) в виде бесцветного порошка.
Стадия 2
1-Метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 5 примера 1, используя метил 1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат вместо метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 3
N-(3-Хлор-2-метилфенил)-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 7 примера 11, используя 1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 487 (M+H)+, Rt = 1,44 минут (способ B)
Пример 47
N-циклогексил-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 46, используя циклогексиламин вместо 3-хлор-2-метиланилина.
MS(ESI+)m/z 445(M+H)+
Пример 48
1-Метил-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 46, используя 2-(трифторметил)бензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 521 (M+H)+, Rt = 1,06 минут (способ B)
Пример 49
N-(3-Хлор-2-метилфенил)-1-этил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 46, используя этилйодид вместо метилйодида.
MS(ESI+) m/z 501 (M+H)+, Rt = 2,53 минут (способ A)
Пример 50
N-Циклогексил-1-этил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 46, используя этилйодид вместо метилйодида, и циклогексиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 459 (M+H)+, Rt = 2,14 минут (способ A)
Пример 51
1-Этил-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 46, используя этилйодид вместо метилйодида, и 2-(трифторметил)бензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 535 (M+H)+, Rt = 2,28 минут (способ A)
Пример 52
N-(3-Хлор-2-метилфенил)-2-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1,3-бензоксазол-4-карбоксамид
Стадия 1
6-Бром-2-метил-1,3-бензоксазол-4-карбоновая кислота
К раствору 5-бром-3-гидроксиантраниловой кислоты (получена, как описано в Eur. J. Med. Chem., 1999, 34,729) (400 мг) в ксилоле (30 мл) добавляли ацетилхлорид (135 мкл), триэтиламин (265 мкл) и п-толуолсульфонат пиридин (130 мг), и смесь нагревали при кипячении с обратным холодильником в течение 8 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом, последовательно промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем с получением указанного в заголовке соединения (471 мг).
Стадия 2
6-Бром-N-(3-хлор-2-метилфенил)-2-метил-1,3-бензоксазол-4-карбоксамид
К раствору 6-бром-2-метил-1,3-бензоксазол-4-карбоновой кислоты (136 мг) в ДМФ (2 мл), добавляли HBTU (242 мг) и триэтиламин (110 мкл). В смесь добавляли 3-хлор-2-метиланилин (76 мкл) и перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Этилацетатный слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем с получением указанного в заголовке соединения (53 мг) в виде белого порошка.
Стадия 3
N-(3-Хлор-2-метилфенил)-2-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1,3-бензоксазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 6, используя 6-бром-N-(3-хлор-2-метилфенил)-2-метил-1,3-бензоксазол-4-карбоксамид вместо этил 5-бром-2,3-дигидро-1-бензофуран-7-карбоксилата.
MS(ESI) m/z 488 (M+H)+, Rt = 1,96 минут (способ B)
Пример 53
2-Метил-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1,3-бензоксазол-4-карбоксамид
Стадия 1
6-Бром-2-метил-N-[2-(трифторметил)бензил]-1,3-бензоксазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 52, используя 2-(трифторметил)бензиламин вместо 3-хлор-2-метиланилина.
Стадия 2
2-Метил-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1,3-бензоксазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 6, используя 6-бром-2-метил-N-[2-(трифторметил)бензил]-1,3-бензоксазол-4-карбоксамид вместо этил 5-бром-2,3-дигидро-1-бензофуран-7-карбоксилата.
MS(ESI) m/z 522 (M+H)+, Rt = 2,49 минут (способ A)
Пример 54
N-(3-Хлор-2-метилфенил)-2-этил-6-({[2-(трифторметил)фенил]карбонил}амино)-1,3-бензоксазол-4-карбоксамид
Стадия 1
6-Бром-2-этил-1,3-бензоксазол-4-карбоновая кислота
Указанное в заголовке соединение получали согласно методике, описанной в стадии 1 примера 52, используя пропионилхлорид вместо ацетилхлорида.
Стадия 2
6-Бром-N-(3-хлор-2-метилфенил)-2-этил-1,3-бензоксазол-4-карбоксамид
Указанное в заголовке соединение получали согласно методике, описанной в стадии 2 примера 52, используя 6-бром-2-этил-1,3-бензоксазол-4-карбоновую кислоту вместо 6-бром-2-метил-1,3-бензоксазол-4-карбоновой кислоты.
Стадия 3
N-(3-Хлор-2-метилфенил)-2-этил-6-({[2-(трифторметил)фенил]карбонил}амино)-1,3-бензоксазол-4-карбоксамид
Указанное в заголовке соединение получали в виде порошка согласно методике, описанной в стадии 2 примера 6, используя 6-бром-N-(3-хлор-2-метилфенил)-2-этил-1,3-бензоксазол-4-карбоксамид вместо этил 5-бром-2,3-дигидро-1-бензофуран-7-карбоксилата.
MS(ESI) m/z 502 (M+H)+, Rt = 2,29 минут (способ B)
Пример 55
N-(3-Хлор-2-метилфенил)-2-этокси-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Стадия 1
Метил 2-этокси-6-нитро-1H-бензимидазол-4-карбоксилат
К перемешиваемому раствору метил 2-этокси-1H-бензимидазол-4-карбоксилата (получен, как описано в J. Med. Chem., 1993, 36, 2182) (500 мг) в концентрированной серной кислоте (5 мл) порциями добавляли калий нитрат (275 мг) при охлаждении на льду, и смесь перемешивали при комнатной температуре в течение 2,5 часов. Реакционную смесь выливали в лед, подщелачивали водным раствором гидроксида натрия и экстрагировали этилацетатом. Этилацетатный слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (595 мг) в виде белого порошка.
Стадия 2
Метил 6-амино-2-этокси-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадии 3 примера 1, используя метил 2-этокси-6-нитро-1H-бензимидазол-4-карбоксилат вместо метил 6-нитро-1H-бензимидазол-4-карбоксилата.
Стадия 3
Метил 2-этокси-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 4 примера 1, используя метил 6-амино-2-этокси-1H-бензимидазол-4-карбоксилат вместо метил 6-амино-1H-бензимидазол-4-карбоксилата.
Стадия 4
2-Этокси-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 5 примера 1, используя метил 2-этокси-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат вместо метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 5
N-(3-Хлор-2-метилфенил)-2-этокси-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 7 примера 11, используя 2-этокси-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 517 (M+H)+, Rt = 1,72 минут (способ B)
Пример 56
2-Этокси-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 55, используя 2-(трифторметил)бензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 551 (M+H)+, Rt = 1,32 минут (способ B)
Пример 57
N-(3-Хлор-2-метилфенил)-2-(1-хлор-2-метилпропан-2-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя 3-хлор-2,2-диметилпропионилхлорид вместо метоксиацетилхлорида.
MS(ESI+) m/z 563 (M+H)+, Rt = 2,75 минут (способ A)
Пример 58
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(диметиламино)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 2-(хлорметил)-6-нитро-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде слегка желтого порошка согласно методике, описанной в стадии 2 примера 1, используя метил 2-(хлорметил)-1H-бензимидазол-4-карбоксилат (получен, как описано в WO2003/106430) вместо метил 1H-бензимидазол-4-карбоксилата.
Стадия 2
Метил 2-[(диметиламино)метил]-6-нитро-1H-бензимидазол-4-карбоксилат
К раствору метил 2-(хлорметил)-6-нитро-1H-бензимидазол-4-карбоксилата (72 мг) в ацетонитриле (3 мл) добавляли 2M раствор диметиламин/MeOH (1,3 мл), и смесь перемешивали при 80°C в течение ночи.
Растворитель удаляли при пониженном давлении, и остаток очищали хроматографией на силикагеле с получением указанного в заголовке соединения (68 мг) в виде слегка желтого твердого вещества.
Стадия 3
Метил 6-амино-2-[(диметиламино)метил]-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде желтого аморфного вещества согласно методике, описанной в стадии 3 примера 1, используя метил 2-[(диметиламино)метил]-6-нитро-1H-бензимидазол-4-карбоксилат вместо метил 6-нитро-1H-бензимидазол-4-карбоксилата.
Стадия 4
Метил 2-[(диметиламино)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 4 примера 1, используя метил 6-амино-2-[(диметиламино)метил]-1H-бензимидазол-4-карбоксилат вместо метил 6-амино-1H-бензимидазол-4-карбоксилата.
Стадия 5
2-[(Диметиламино)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали в виде желтого аморфного вещества согласно методике, описанной в стадии 5 примера 1, используя метил 2-[(диметиламино)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат вместо метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 6
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(диметиламино)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 7 примера 11, используя 2-[(диметиламино)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислоты.
MS(ESI+) m/z 530 (M+H)+, Rt = 1,54 минут (способ A)
Пример 59
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(2-метилпропил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя изовалерилхлорид вместо метоксиацетилхлорида.
MS(ESI+) m/z 529 (M+H)+, Rt = 1,95 минут (способ B)
Пример 60
Гидрохлорид 2-(2-метилпропил)-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя изовалерилхлорид вместо метоксиацетилхлорида, и 2-(трифторметил)бензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 563 (M+H)+, Rt = 1,20 минут (способ B)
Пример 61
трет-Бутил 3-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}азетидин-1-карбоксилат
Указанное в заголовке соединение получали в виде светло-желтого порошка, следуя методикам, описанным в стадиях 1-7 примера 11, используя хлорид 1-(трет-бутоксикарбонил)азетидин-3-карбонила (получен, как описано в US6020368) вместо метоксиацетилхлорида.
MS(ESI+) m/z 628 (M+H)+, Rt = 1,87 минут (способ B)
Пример 62
Дигидрохлорид N-(3-хлор-2-метилфенил)-2-[(метиламино)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 2-{[(трет-бутоксикарбонил)(метил)амино]метил}-6-нитро-1H-бензимидазол-4-карбоксилат
К раствору метил 2-(хлорметил)-6-нитро-1H-бензимидазол-4-карбоксилата (пример 58, стадия 1) (72 мг) в ацетонитриле (2 мл) добавляли 40% метиламин/MeOH раствор (0,27 мл), и смесь перемешивали при 80°C в течение 1 часа. Растворитель удаляли при пониженном давлении. К остатку добавляли воду, и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Полученный остаток (68 мг) растворяли в безводном ТГФ (2 мл), к раствору добавляли триэтиламин (93 мкл). К раствору добавляли ди-трет-бутилдикарбонат (141 мкл) при перемешивании при охлаждении на льду в течение 3 часов. В реакционную смесь добавляли воду и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным магнием и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (54 мг) в виде слегка желтого аморфного вещества.
Стадия 2
Метил 6-амино-2-{[(трет-бутоксикарбонил)(метил)амино]метил}-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде желтого аморфного вещества, согласно методике, описанной в стадии 3 примера 1, используя метил 2-{[(трет-бутоксикарбонил)(метил)амино]метил}-6-нитро-1H-бензимидазол-4-карбоксилат вместо метил 6-нитро-1H-бензимидазол-4-карбоксилата.
Стадия 3
Метил 2-{[(трет-бутоксикарбонил)(метил)амино]метил}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде слегка желтого аморфного вещества согласно методике, описанной в стадии 4 примера 1, используя метил 6-амино-2-{[(трет-бутоксикарбонил)(метил)амино]метил}-1H-бензимидазол-4-карбоксилат вместо метил 6-амино-1H-бензимидазол-4-карбоксилата.
Стадия 4
2-{[(трет-бутоксикарбонил)(метил)амино]метил}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали в виде желтого аморфного вещества согласно методике, описанной в стадии 5 примера 1, используя метил 2-{[(трет-бутоксикарбонил)(метил)амино]метил}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат вместо метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 5
Дигидрохлорид N-(3-Хлор-2-метилфенил)-2-[(метиламино)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
2-{[(трет-бутоксикарбонил)(метил)амино]метил}-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид (9 мг) получали согласно методике, описанной в стадии 7 примера 11, используя 2-{[(трет-бутоксикарбонил)(метил)амино]метил}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты. Его растворяли в метиленхлориде (1 мл). К остатку добавляли ТФУ (0,5 мл) при охлаждении на льду и перемешивали в течение 0,5 часа. В реакционную смесь добавляли лед, а затем насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением N-(3-хлор-2-метилфенил)-2-[(метиламино)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (5 мг) в виде слегка желтого порошка. Его растворяли в MeOH (0,5 мл) и обрабатывали 1M хлористоводородной кислотой (2 экв.) и концентрировали с получением указанного в заголовке соединения (5 мг) в виде слегка желтого порошка.
MS(ESI+) m/z 516 (M+H)+, Rt = 1,55 минут (способ A)
Пример 63
{4-[(3-Хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}метилацетат
Стадия 1
Метил 2-[(ацетилокси)метил]-6-нитро-1H-бензимидазол-4-карбоксилат
К раствору метил 2-(хлорметил)-6-нитро-1H-бензимидазол-4-карбоксилата (пример 58, стадия 1) (99 мг) в ДМФ (1 мл), добавляли ацетат натрия (17 мг), и смесь перемешивали при 50°C в течение 6 часов. В реакционную смесь добавляли ледяную воду и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (65 мг) в виде бесцветного порошка.
Стадия 2
Метил 2-[(ацетилокси)метил]-6-амино-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадии 3 примера 1, используя метил 2-[(ацетилокси)метил]-6-нитро-1H-бензимидазол-4-карбоксилат вместо метил 6-нитро-1H-бензимидазол-4-карбоксилата.
Стадия 3
Метил 2-[(ацетилокси)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде светло-желтого аморфного вещества согласно методике, описанной в стадии 4 примера 1, используя метил 2-[(ацетилокси)метил]-6-амино-1H-бензимидазол-4-карбоксилат вместо метил 6-амино-1H-бензимидазол-4-карбоксилата.
Стадия 4
2-(Гидроксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 5 примера 1, используя метил 2-[(ацетилокси)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат вместо метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 5
{4-[(3-Хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}метилацетат
Смесь 2-(гидроксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты (50 мг) и N,N-диизопропилэтиламина (49 мкл) в метиленхлорид-ТГФ (1:1)(2 мл) перемешивали при охлаждении на льду, в смесь добавляли ацетилхлорид (19 мкл) и перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в холодный 10% водный раствор лимонной кислоты и экстрагировали этилацетатом. Органический слой разделяли и промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток растворяли в ДМФ (3 мл) и к нему добавляли HBTU (65 мг) и триэтиламин (24 мкл) и перемешивали при комнатной температуре. В смесь добавляли 3-хлор-2-метиланилин (16 мкл) и перемешивали в течение ночи. Реакционную смесь выливали в ледяную воду, и экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении.
Полученный остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (6 мг) в виде бесцветного порошка.
MS(ESI+) m/z 545 (M+H)+, Rt = 2,41 минут (способ A)
Пример 64
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(2R)-тетрагидрофуран-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя (2R)-тетрагидро-2-фуранкарбонилхлорид (получен, как описано в WO2006/79642) вместо метоксиацетилхлорида.
MS(ESI+) m/z 543 (M+H)+, Rt = 2,56 минут (способ A)
Элементный анализ для C27H22ClF3N4O3⋅HCl+1,5H2O
Вычисл.(%) C:53,48 H:4,32 N:9,24
Найдено(%) C:53,26 H:4,17 N:9,19
Пример 65
2-[(2R)-Тетрагидрофуран-2-ил]-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя (2R)-тетрагидро-2-фуранкарбонилхлорид (получен, как описано в WO2006/79642) вместо метоксиацетилхлорида, и 2-(трифторметил)бензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 577 (M+H)+, Rt = 2,25 минут (способ A)
Пример 66
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(2S)-тетрагидрофуран-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя (2S)-тетрагидро-2-фуранкарбонилхлорид (получен, как описано в WO2006/79642) вместо метоксиацетилхлорида.
MS(ESI+) m/z 543 (M+H)+, Rt = 2,56 минут (способ A)
Пример 67
Гидрохлорид 2-[(2S)-тетрагидрофуран-2-ил]-N-[2-(трифторметил)бензил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя (2S)-тетрагидро-2-фуранкарбонилхлорид (получен, как описано в WO2006/79642) вместо метоксиацетилхлорида, и 2-(трифторметил)бензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 577 (M+H)+, Rt = 2,25 минут (способ A)
Пример 68
Гидрохлорид 2-(1-ацетилазетидин-3-ил)-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
К раствору трет-бутил 3-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-анил}азетидин-1-карбоксилата (пример 61) (50 мг) в метиленхлориде (2 мл) добавляли тиоанизол (50 мкл). В смесь добавляли ТФУ (1 мл) при охлаждении на льду, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток растирали в н-гексане/этилацетате, и осадок собирали фильтрованием и сушили с получением 2-(азетидин-3-ил)-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (38 мг). Его растворяли в ТГФ (1 мл) и добавляли пиридин (23 мкл), и смесь перемешивали при охлаждении на льду.
В смесь по каплям добавляли ацетилхлорид (7,7 мкл) и перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с получением 2-(1-ацетилазетидин-3-ил)-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (7,5 мг). Его растворяли в MeOH (0,5 мл), обрабатывали 1M хлористоводородной кислотой/MeOH и концентрировали с получением указанного в заголовке соединения (5,5 мг), в виде не совсем серого порошка.
MS(ESI+) m/z 570 (M+H)+, Rt = 1,98 минут (способ A)
Пример 69
трет-Бутил (2S)-2-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}пирролидин 1-карбоксилат
Указанное в заголовке соединение получали в виде белого порошка, следуя методикам, как описано в Стадиях 1-7 примера 11, используя трет-бутил (2S)-2-(хлоркарбонил)пирролидин-1-карбоксилат (получен, как описано в Tetrahedron Asymmetry, 2007, 18, 2011) вместо метоксиацетилхлорида.
MS(ESI+) m/z 642 (M+H)+, Rt = 2,77 минут (способ A)
Пример 70
трет-Бутил (2R)-2-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}пирролидин-1-карбоксилат
Указанное в заголовке соединение получали в виде белого порошка, следуя методикам, описанным в стадиях 1-7 примера 11, используя трет-бутил (2R)-2-(хлоркарбонил)пирролидин-1-карбоксилат (получен, как описано в Tetrahedron Asymmetry, 2007, 18, 2011) вместо метоксиацетилхлорида.
MS(ESI+) m/z 642 (M+H)+, Rt = 2,77 минут (способ A)
Пример 71
Дигидрохлорид N-(3-хлор-2-метилфенил)-2-[(2S)-пирролидин-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
К раствору трет-бутил (2S)-2-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}пирролидин-1-карбоксилата (26 мг) (пример 69) в этилацетате (2 мл) добавляли раствор 4н хлористоводородной кислоты/этилацетата (2 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. В реакционную смесь добавляли N-гексан, осадки собирали и сушили с получением указанного в заголовке соединения (20 мг), в виде светло-желтого порошка.
MS(ESI+) m/z 542 (M+H)+, Rt = 1,65 минут (способ A)
Пример 72
N-(3-Хлор-2-метилфенил)-2-[(2S)-1-метилпирролидин-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
К раствору N-(3-хлор-2-метилфенил)-2-[(2S)-пирролидин-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (Пример 71) (25 мг) в MeOH (0,4 мл), добавляли 38% водный раствор формальдегида (7,2 мкл), и смесь перемешивали при комнатной температуре в течение ночи. В смесь добавляли 2-пиколин бора (10 мг) и перемешивали в течение 3 часов, растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (11 мг) в виде белого порошка.
MS(ESI+) m/z 556 (M+H)+, Rt = 1,67 минут (способ A)
Пример 73
2-[(2S)-1-Ацетилпирролидин-2-ил]-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
К раствору N-(3-хлор-2-метилфенил)-2-[(2S)-пирролидин-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (пример 71) (26 мг) в растворе ТГФ (0,5 мл), добавляли пиридин (12 мкл), и смесь перемешивали при охлаждении на льду. В смесь добавляли ацетилхлорид (5,1 мкл) и перемешивали при комнатной температуре в течение 1 часа. В реакционную смесь добавляли ледяную воду, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (15 мг) в виде белого порошка.
MS(ESI+) m/z 584 (M+H)+, Rt = 2,26 минут (способ A)
Пример 74
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(2-метоксиэтокси)метил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя 2-(метоксиэтокси)ацетилхлорид вместо метоксиацетилхлорида.
MS(ESI+) m/z 561 (M+H)+, Rt = 2,43 минут (способ A)
Пример 75
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(1-метокси-2-метилпропан-2-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя 3-метокси-2,2-диметилпропаноилхлорид (получен, как описано в Bull. Chem. Soc. Jpn., 2001, 74, 1695) вместо метоксиацетилхлорида.
MS(ESI+) m/z 559 (M+H)+, Rt = 2,82 минут (способ A)
Пример 76
Гидрохлорид 2-трет-бутил-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя пивалоилхлорид вместо метоксиацетилхлорида.
MS(ESI+) m/z 529 (M+H)+, Rt = 3,03 минут (способ A)
Пример 77
Дигидрохлорид 2-трет-бутил-6-({[2-(трифторметил)фенил]карбонил}амино)-N-{[3-(трифторметил)пиридин-2-ил]метил}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя пивалоилхлорид вместо метоксиацетилхлорида, и 2-(аминометил)-3-(трифторметил)пиридин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 564 (M+H)+, Rt = 2,39 минут (способ A)
Пример 78
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(2-этоксиэтил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя 3-этокси-пропионилхлорид (получен, как описано в EP1803350) вместо метоксиацетилхлорида.
MS(ESI+) m/z 545 (M+H)+, Rt = 2,69 минут (способ A)
Пример 79
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(этоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя этоксиацетилхлорид (получен, как описано в US2004/39038) вместо метоксиацетилхлорида.
MS(ESI+) m/z 531 (M+H)+, Rt = 2,77 минут (способ A)
Пример 80
Дигидрохлорид 2-(этоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-N-{[3-(трифторметил)пиридин-2-ил]метил}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя этоксиацетилхлорид (получен, как описано в US2004/39038) вместо метоксиацетилхлорида, и 2-(аминометил)-3-(трифторметил)пиридин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 566 (M+H)+, Rt = 2,18 минут (способ A)
Пример 81
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(2-метоксиэтил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя метоксипропионилхлорид вместо метоксиацетилхлорида.
MS(ESI+) m/z 531 (M+H)+, Rt = 2,58 минут (способ A)
Пример 82
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(2,2-диметилпропил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя трет-бутилацетилхлорид вместо метоксиацетилхлорида.
MS(ESI+) m/z 543 (M+H)+, Rt = 3,25 минут (способ A)
Пример 83
Гидрохлорид N-(3-хлор-2-метилфенил)-2-циклопропил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя циклопропанкарбонилхлорид вместо метоксиацетилхлорида.
MS(ESI+) m/z 513 (M+H)+, Rt = 2,91 минут (способ A)
Пример 84
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(2-метилпентан-2-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя 2,2-диметилпентаноилхлорид (получен, как описано в J. Am. Chem. Soc., 1974, 96, 1518) вместо метоксиацетилхлорида.
MS(ESI+) m/z 557 (M+H)+, Rt = 3,16 минут (способ B)
Пример 85
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(1-метилциклопропил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя 1-метил-циклопропанкарбонилхлорид (получен, как описано в WO2009/68512) вместо метоксиацетилхлорида.
MS(ESI+) m/z 527 (M+H)+, Rt = 3,16 минут (способ A)
Элементный анализ для C27H22ClF3N4O2⋅HCl+1,0H2O
Вычисл.(%) C:55,78 H:4,33 N:9,64
Найдено(%) C:55,48 H:3,94 N:9,63
Пример 86
Гидрохлорид 2-трет-бутил-N-(3-хлор-4-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя пивалоилхлорид вместо метоксиацетилхлорида, и 3-хлор-4-метиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 529 (M+H)+, Rt = 2,83 минут (способ B)
Пример 87
Гидрохлорид 2-трет-бутил-N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 6-амино-2-трет-бутил-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде белого порошка, следуя методикам, описанным в примере 11 со стадии 1 до стадии 4, используя пивалоилхлорид вместо метоксиацетилхлорида в стадии 1.
Стадия 2
2-трет-Бутил-6-{[2,5-дихлорфенил]карбонил]амино}-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали, следуя методикам как описано в примере 1 стадия 4 и стадия 5, используя метил 6-амино-2-трет-бутил-1H-бензимидазол-4-карбоксилат вместо метил 6-амино-1H-бензимидазол-4-карбоксилата, и 2,5-дихлорбензоилхлорид вместо 2-(трифторметил)бензоилхлорида.
Стадия 3
Гидрохлорид 2-трет-бутил-N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали, следуя методикам как описано в примере 11 стадия 7 и стадия 8, используя 2-трет-бутил-6-{[2,5-дихлорфенил]карбонил]амино}-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 529 (M+H)+, Rt = 2,97 минут (способ B)
Пример 88
Гидрохлорид 2-трет-бутил-N-(3-хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка следуя методикам, как описано в примере 11 стадия 7 и стадия 8, используя 2-трет-бутил-6-{[2,5-дихлорфенил]карбонил]амино}-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты, и 3-хлор-4-метиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 529 (M+H)+, Rt = 3,05 минут (способ B)
Пример 89
N-(3-Хлор-2-метилфенил)-2-[1-(трифторметил)циклопропил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка, следуя методикам как описано в примере 11 стадии 1-7, используя 1-(трифторметил)циклопропанкарбонилхлорид (получен, как описано в WO2005/23773) вместо метоксиацетилхлорида.
MS(ESI+) m/z 581 (M+H)+, Rt = 3,15 минут (способ A)
Пример 90
N-(3-Хлор-2-метилфенил)-2-(метоксиметил)-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Стадия 1
2-(Метоксиметил)-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали согласно методике, описанной в примере 46, используя метил 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат вместо метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 2
N-(3-Хлор-2-метилфенил)-2-(метоксиметил)-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 7 примера 11, используя 2-(метоксиметил)-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 531 (M+H)+, Rt = 2,58 минут (способ A)
Пример 91
N-(2-Хлорбензил)-2-(метоксиметил)-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в стадии 7 примера 11, используя 2-(метоксиметил)-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты, и 2-хлорбензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 531 (M+H)+, Rt = 2,25 минут (способ A)
Пример 92
Гидрохлорид 6-{[(2-Хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Стадия 1
6-Амино-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид
К суспензии метил 2-(метоксиметил)-6-нитро-1H-бензимидазол-4-карбоксилата (пример 11, стадия 3) (4,8 г) в MeOH (120 мл) добавляли гидрат гидроксида лития (4,56 г) и воду (54 мл). Смесь перемешивали при комнатной температуре в течение 16 часов. При охлаждении на льду в реакционную смесь медленно добавляли 1н хлористоводородную кислоту для доведения pH до приблизительно 2. Осадок собирали фильтрованием и сушили с получением 2-(метоксиметил)-6-нитро-1H-бензимидазол-4-карбоновой кислоты (4,6 г). К раствору 2-(метоксиметил)-6-нитро-1H-бензимидазол-4-карбоновой кислоты (4,6 г) в ДМФ (90 мл), HBTU (8,23 г), последовательно добавляли триэтиламин (2,19 г) и 3-хлор-2-метиланилин (3,07 г), и раствор перемешивали в течение 18 часов. Реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия и перемешивали в течение 1 часа. Осадок собирали фильтрованием и последовательно промывали водой и этилацетатом с получением N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-нитро-1H-бензимидазол-4-карбоксамида (7,2 г) в виде светло-желтого порошка. К раствору N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-нитро-1H-бензимидазол-4-карбоксамида (7,2 г) в MeOH-ТГФ (1:1, 120 мл) добавляли 1% платину + 0,1% медь-активированный уголь (Degussa тип CF105 R/W) (1,4 г). Смесь перемешивали в атмосфере водорода (3 атм) в течение 4 часов. Катализатор отфильтровывали, и маточную жидкость концентрировали. Осажденное твердое вещество промывали этилацетатом с получением 6-амино-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида (5,1 г) в виде светло-желтого порошка.
Стадия 2
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
К раствору 6-амино-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида (40 мг) в ТГФ (1 мл) добавляли N,N-диизопропилэтиламин (24 мкл), и смесь перемешивали при охлаждении на льду. В смесь добавляли 2-хлор-6-фторбензоилхлорид (24 мг) и перемешивали в течение 3 часов. В реакционную смесь добавляли насыщенный водный раствор бикарбоната натрия, и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении.
Остаток очищали хроматографией на колонке с получением 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида (50 мг). Его растворяли в этилацетате (2 мл) и обрабатывали 4н хлористоводородная кислота/этилацетатом (1,2 экв.). Осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (40 мг) в виде белого порошка.
MS(ESI+) m/z 501 (M+H)+, Rt = 2,39 минут (способ A)
Пример 93
Гидрохлорид 6-{[(2-хлор-4-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-метоксиметил-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадии 2 примера 92, используя 2-хлор-4-фторбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 501 (M+H)+, Rt = 2,40 минут (способ A)
Пример 94
Гидрохлорид 6-{[(2-хлор-5-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 2-хлор-5-фторбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 501 (M+H)+, Rt = 2,41 минут (способ A)
Пример 95
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2-хлорфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 2-хлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 483 (M+H)+, Rt = 2,36 минут (способ A)
Пример 96
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2-хлорпиридин-3-ил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 2-хлорникотиноилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 484 (M+H)+, Rt = 2,16 минут (способ A)
Пример 97
Гидрохлорид 6-{[(2-бромфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 2-бромбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 527 (M+H)+, Rt = 2,39 минут (способ A)
Пример 98
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,6-дихлорфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 2,6-дихлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 517 (M+H)+, Rt = 2,46 минут (способ A)
Пример 99
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 2,5-дихлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 517 (M+H)+, Rt = 2,54 минут (способ A)
Пример 100
Гидрохлорид 6-{[(2-хлор-3-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 2-хлор-3-фторбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 501 (M+H)+, Rt = 2,43 минут (способ A)
Пример 101
Гидрохлорид 6-{[(2-хлор-3,6-дифторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 2-хлор-3,6-дифторбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 519 (M+H)+, Rt = 2,46 минут (способ A)
Пример 102
Гидрохлорид 6-{[(2-бром-6-хлорфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 2-хлор-6-бромбензоилхлорид (получен, как описано в WO2008/124575) вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 561 (M+H)+, Rt = 2,50 минут (способ A)
Пример 103
Гидрохлорид 6-{[(2-бром-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
К раствору 6-амино-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида (50 мг) в ДМФ (1,5 мл) по очереди добавляли HBTU (66 мг), N,N-диизопропилэтиламин (30 мкл) и 2-бром-6-фторбензойную кислоту (38 мг), и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой разделяли, последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением 6-{[(2-бром-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида (46 мг). Его растворяли в этилацетате (2 мл) и обрабатывали 4н хлористоводородная кислота/этилацетатом (1,2 экв.). Осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (24 мг) в виде белого порошка.
MS(ESI+) m/z 545 (M+H)+, Rt = 2,44 минут (способ A)
Пример 104
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2-хлор-6-метилфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2-хлор-6-метилбензойную кислота вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 497 (M+H)+, Rt = 2,44 минут (способ A)
Пример 105
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2-хлор-4-метилфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2-хлор-4-метилбензойную кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 497 (M+H)+, Rt = 2,47 минут (способ A)
Пример 106
Гидрохлорид 6-{[(5-бром-2-хлорфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 5-бром-2-хлорбензойную кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 561 (M+H)+, Rt = 2,62 минут (способ A)
Пример 107
Гидрохлорид 6-{[(2-бром-5-хлорфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2-бром-5-хлорбензойную кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 561 (M+H)+, Rt = 2,63 минут (способ A)
Пример 108
Гидрохлорид N-(3-[лор-2-метилфенил)-6-{[(2-хлор-5-метилфенил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2-хлор-5-метилбензойную кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 497 (M+H)+, Rt = 2,54 минут (способ A)
Пример 109
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-({[5-метил-2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 5-метил-2-(трифторметил)бензойную кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 531 (M+H)+, Rt = 2,59 минут (способ A)
Пример 110
Гидрохлорид 6-({[2,5-бис(трифторметил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2,5-бис(трифторметил)бензойную кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 585 (M+H)+, Rt = 2,76 минут (способ A)
Пример 111
Гидрохлорид 6-({[2,4-бис(трифторметил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2,4-бис(трифторметил)бензойную кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 585 (M+H)+, Rt = 2,80 минут (способ A)
Пример 112
Гидрохлорид N-(3-хлор-2-метилфенил)-6-({[5-фтор-2-(трифторметил)фенил]карбонил}амино)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 5-фтор-2-(трифторметил)бензойную кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 535 (M+H)+, Rt = 2,68 минут (способ A)
Пример 113
Гидрохлорид N-(3-хлор-2-метилфенил)-6-({[2-хлор-6-(трифторметил)фенил]карбонил}амино)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2-хлор-6-(трифторметил)бензойную кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 551 (M+H)+, Rt = 2,76 минут (способ A)
Пример 114
Гидрохлорид N-(3-хлор-2-метилфенил)-6-[({2-хлор-5-[2-(пропан-2-илокси)этокси]фенил}карбонил)амино]-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
В атмосфере аргона к раствору 2-изопропоксиэтанола (172 мкл) в NMP (1,5 мл) добавляли калий трет-бутоксид (168 мг). Смесь перемешивали при комнатной температуре в течение 10 минут, добавляли 2-хлор-5-фторбензойную кислоту (87 мг), а затем перемешивали при 130°C в течение 4 часов. Реакционную смесь охлаждали на ледяной бане и добавляли воду, а затем подкисляли с помощью 1н хлористоводородной кислоты и экстрагировали этилацетатом.
Органический слой разделяли, промывали насыщенным солевым раствором и сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением сырой 2-хлор-5-[2-(пропан-2-илокси)этокси]бензойной кислоты. Его растворяли в ДМФ (2 мл), добавляли HATU (61 мг), N,N-диизопропилэтиламин (29 мкл) и 6-амино-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид (50 мг) в указанной последовательности и перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой разделяли, последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением N-(3-хлор-2-метилфенил)-6-[({2-хлор-5-[2-(пропан-2-илокси)этокси]фенил}карбонил)амино]-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида (41 мг) в виде белого порошка. Его растворяли в этилацетате (2 мл) и обрабатывали 4н хлористоводородная кислота/этилацетатом (1,2 экв.). Осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (28 мг) в виде белого порошка.
MS(ESI+) m/z 585 (M+H)+, Rt = 3,14 минут (способ A)
Пример 115
Гидрохлорид 6-({[2-хлор-5-(2-этоксиэтокси)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 114, используя 2-этоксиэтанол вместо 2-изопропоксиэтанола.
MS(ESI+) m/z 571 (M+H)+, Rt = 2,71 минут (способ A)
Пример 116
Гидрохлорид 6-({[2-хлор-5-(3-метоксипропил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 103, используя 2-хлор-5-(3-метоксипропил)бензойную кислоту (получена, как описано в Bioorg. Med. Chem. Lett., 2010, 20, 2204) вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 555 (M+H)+, Rt = 2,73 минут (способ A)
Пример 117
Гидрохлорид 6-({[5-(3-трет-бутокси-1-пропинил)-2-хлорфенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 103, используя 5-(3-трет-бутокси-1-пропинил)-2-хлорбензойную кислоту (ссылочный пример 6) вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 593 (M+H)+, Rt = 3,17 минут (способ A)
Пример 118
Гидрохлорид 6-({[5-(3-трет-бутоксипропил)-2-хлорфенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 5-(3-трет-бутоксипропил)-2-хлорбензойную кислоту (ссылочный пример 7) вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 597 (M+H)+, Rt = 3,28 минут (способ A)
Пример 119
Гидрохлорид 6-({[2-хлор-5-(3-гидрокси-3-метилбутил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 103, используя 2-хлор-5-(3-гидрокси-3-метилбутил)бензойную кислоту (ссылочный пример 8) вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 569 (M+H)+, Rt = 2,64 минут (способ A)
Пример 120
6-({[2-Хлор-5-(этоксиметил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2-хлор-5-(этоксиметил)бензойную кислоту (ссылочный пример 1) вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 541 (M+H)+, Rt = 2,52 минут (способ A)
Пример 121
Гидрохлорид 6-[({2-хлор-5-[(2-этоксиэтокси)метил]фенил}карбонил)амино]-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2-хлор-5-[(2-этоксиэтокси)метил]бензойную кислоту (ссылочный пример 2) вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 585 (M+H)+, Rt = 2,51 минут (способ A)
Пример 122
6-({[2-Хлор-5-(2-циклопропилэтил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2-хлор-5-(2-циклопропилэтил)бензойную кислоту (ссылочный пример 4) вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 551 (M+H)+, Rt = 2,92 минут (способ A)
Пример 123
Гидрохлорид N-(3-хлор-2-метилфенил)-6-({[2-хлор-5-(2-фенилэтил)фенил]карбонил}амино)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2-хлор-5-(2-фенилэтил)бензойную кислоту (ссылочный пример 5) вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 587 (M+H)+, Rt = 2,98 минут (способ A)
Пример 124
Гидрохлорид N-(3-хлор-2-метилфенил)-2-циклопентил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 2-циклопентил-6-нитро-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадиях 1 до 3 примера 11, используя циклопентанкарбонилхлорид вместо метоксиацетилхлорида.
Стадия 2
6-Амино-N-(3-хлор-2-метилфенил)-2-циклопентил-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде желтого порошка согласно методике, описанной в стадии 1 примера 92, используя метил 2-циклопентил-6-нитро-1H-бензимидазол-4-карбоксилат вместо метил 2-(метоксиметил)-6-нитро-1H-бензимидазол-4-карбоксилата.
Стадия 3
Гидрохлорид N-(3-хлор-2-метилфенил)-2-циклопентил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 6-амино-N-(3-хлор-2-метилфенил)-2-циклопентил-1H-бензимидазол-4-карбоксамид вместо 6-амино-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида, и 2-(трифторметил)бензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 541 (M+H)+, Rt = 3,21 минут (способ A)
Пример 125
Гидрохлорид N-(3-хлор-2-метилфенил)-2-циклопентил-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 6-амино-N-(3-хлор-2-метилфенил)-2-циклопентил-1H-бензимидазол-4-карбоксамид вместо 6-амино-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида, и 2,5-дихлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 543 (M+H)+, Rt = 3,32 минут (способ A)
Пример 126
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-циклопентил-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 6-амино-N-(3-хлор-2-метилфенил)-2-циклопентил-1H-бензимидазол-4-карбоксамид вместо 6-амино-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида.
MS(ESI+) m/z 525 (M+H)+, Rt = 3,24 минут (способ A)
Пример 127
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 6-нитро-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадиях 1 до 3 примера 11, используя (2R)-тетрагидро-2-фуранкарбонилхлорид (получен, как описано в WO2006/79642) вместо метоксиацетилхлорида.
Стадия 2
6-Амино-N-(3-хлор-2-метилфенил)-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде желтого порошка согласно методике, описанной в стадии 1 примера 92, используя метил 6-нитро-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксилат вместо метил 2-(метоксиметил)-6-нитро-1H-бензимидазол-4-карбоксилата.
Стадия 3
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 6-амино-N-(3-хлор-2-метилфенил)-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксамид вместо 6-амино-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида.
MS(ESI+) m/z 527 (M+H)+, Rt = 2,75 минут (способ A)
Пример 128
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,6-дихлорфенил)карбонил]амино}-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадии 2 примера 92, используя 6-амино-N-(3-хлор-2-метилфенил)-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксамид вместо 6-амино-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида, и 2,6-дихлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 543 (M+H)+, Rt = 2,80 минут (способ A)
Пример 129
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 92, используя 6-амино-N-(3-хлор-2-метилфенил)-2-[(2R)-тетрагидрофуран-2-ил]-1H-бензимидазол-4-карбоксамид вместо 6-амино-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида, и 2,5-дихлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 543 (M+H)+, Rt = 2,86 минут (способ A)
Пример 130
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(2S)-5-оксопирролидин-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя (S)-(-)-2-пирролидон 5-карбонилхлорид (получен, как описано в Tetrahedron Lett., 1997, 38, 2259) вместо метоксиацетилхлорида.
MS(ESI+) m/z 556 (M+H)+, Rt = 2,03 минут (способ A)
Пример 131
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(2R)-5-оксопирролидин-2-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 11, используя (R)-(+)-2-пирролидон-5-карбонилхлорид (получен, как описано в Tetrahedron Lett., 1997, 38, 2259) вместо метоксиацетилхлорида.
MS(ESI+) m/z 556 (M+H)+, Rt = 2,03 минут (способ A)
Пример 132
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[2-оксо-2-(пирролидин-1-ил)этил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 2-(2-этокси-2-оксоэтил)-1H-бензимидазол-4-карбоксилат
Раствор метил 2,3-диаминобензоата (680 мг) и гидрохлорида этил 3-амино-3-этоксиакрилата (880 мг) в EtOH (12 мл) перемешивали при 60°C в течение 2 часов. EtOH удаляли при пониженном давлении, и остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (1,14 г) в виде бледно-желтого твердого вещества.
Стадия 2
Метил 2-(2-этокси-2-оксоэтил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде светло-желтого порошка, следуя методикам, описанным в стадиях 3 до 5 примера 11, используя метил 2-(2-этокси-2-оксоэтил)-1H-бензимидазол-4-карбоксилат вместо метил 1H-бензимидазол-4-карбоксилата в качестве исходного вещества.
Стадия 3
Метил 2-[2-оксо-2-(пирролидин-1-ил)этил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
К метил 2-(2-этокси-2-оксоэтил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилату (80 мг) добавляли пирролидин (1 мл), и раствор перемешивали при 70°C в течение 30 минут. Реакционную смесь разбавляли этилацетатом и промывали насыщенным солевым раствором. Этилацетатный слой концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (74 мг) в виде белого порошка.
Стадия 4
2-[2-Оксо-2-(пирролидин-1-ил)этил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Раствор метил 2-[2-оксо-2-(пирролидин-1-ил)этил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата (74 мг), гидрат гидроксида лития (66 мг) в MeOH-вода (1:1, 2 мл) перемешивали при 50°C в течение 30 минут. Из реакционной смеси удаляли растворитель при пониженном давлении, добавляли к воде и нейтрализовали 1 н хлористоводородной кислотой при охлаждении на льду.
Осадок собирали фильтрованием, промывали диэтиловым эфиром и сушили при пониженном давлении с получением указанного в заголовке соединения (60 мг) в виде светло-желтого порошка.
Стадия 5
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[2-оксо-2-(пирролидин-1-ил)этил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
К раствору 2-[2-оксо-2-(пирролидин-1-ил)этил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты (30 мг) и HATU (30 мг) в ДМФ (0,5 мл) добавляли N,N-диизопропилэтиламин (28 мкл) и 3-хлор-2-метиланилин (10 мкл), и смесь перемешивали при комнатной температуре в течение 15 минут. Реакционную смесь разбавляли этилацетатом, промывали насыщенным солевым раствором, и органический слой концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением светло-желтого порошка (28 мг). Его суспендировали в MeOH (1 мл) и добавляли 2н раствор хлористоводородная кислота/EtOH (1 экв.) с получением гомогенного раствора, который затем концентрировали при пониженном давлении. Остаток растирали в диэтиловом эфире и промывали. Осадок собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (20 мг) в виде белого порошка.
MS(ESI+) m/z 584 (M+H)+, Rt = 2,24 минут (способ A)
Пример 133
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[2-(диметиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 2-[2-(диметиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадии 3 примера 132, используя 40% водный раствор диметиламина и ТГФ вместо пирролидина.
Стадия 2
2-[2-(Диметиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали в виде серого порошка согласно методике, описанной в стадии 4 примера 132, используя метил 2-[2-(диметиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат вместо метил 2-[2-оксо-2-(пирролидин-1-ил)этил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 3
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[2-(диметиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадии 5 примера 132, используя 2-[2-(диметиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновую кислоту вместо 2-[2-оксо-2-(пирролидин-1-ил)этил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 558 (M+H)+, Rt = 2,12 минут (способ A)
Пример 134
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[2-(метиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 2-[2-(метиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 3 примера 132, используя 40% водный раствор метиламина и ТГФ вместо пирролидина.
Стадия 2
2-[2-(Метиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали в виде коричневого порошка согласно методике, описанной в стадии 4 примера 132, используя метил 2-[2-(метиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат вместо метил 2-[2-оксо-2-(пирролидин-1-ил)этил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 3
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[2-(метиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-красного порошка согласно методике, описанной в стадии 5 примера 132, используя 2-[2-(метиламино)-2-оксоэтил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновую кислоту вместо 2-[2-оксо-2-(пирролидин-1-ил)этил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 544 (M+H)+, Rt = 1,98 минут (способ A)
Пример 135
2-Хлор-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Стадия 1
Метил 2-хлор-1H-бензимидазол-4-карбоксилат
Раствор метил 2-оксо 2,3-дигидро-1H-бензимидазол-4-карбоксилата (получен, как описано в US2009/186879) (2,0 г) в фосфорилхлориде (18 мл) перемешивали при 120°C в течение 2,5 часов. Избыток фосфорилхлорида удаляли при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия при охлаждении на льду и экстрагировали этилацетатом. Этилацетатный слой сушили над безводным сульфатом магния и концентрировали. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (1,5 г) в виде белого порошка.
Стадия 2
Метил 2-хлор-6-нитро-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение (0,98 г) получали в виде светло-желтого порошка согласно методике, описанной в стадии 2 примера 1, используя метил 2-хлор-1H-бензимидазол-4-карбоксилат (1,46 г) вместо метил-1H-бензимидазол-4-карбоксилата.
Стадия 3
Метил 6-амино-2-хлор-1H-бензимидазол-4-карбоксилат
К раствору метил 2-хлор-6-нитро-1H-бензимидазол-4-карбоксилата (0,87 г) в MeOH (100 мл) добавляли 1% платина + 0,1% медь-активированный уголь (Degussa тип CF105 R/W) (0,19 г), и смесь перемешивали в атмосфере водорода (0,2 мПа) в течение 4 часов. Реакционную смесь отфильтровывали через целит и промывали MeOH. Маточную жидкость концентрировали с получением указанного в заголовке соединения (0,78 г) в виде желтого порошка.
Стадия 4
Метил 2-хлор-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение (0,69 г) получали в виде бесцветного порошка согласно методике, описанной в стадии 4 примера 1, используя метил 6-амино-2-хлор-1H-бензимидазол-4-карбоксилат (0,78 г) вместо метил 6-амино-1H-бензимидазол-4-карбоксилата.
Стадия 5
2-Хлор-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение (620 мг) получали в виде белого порошка согласно методике, описанной в стадии 5 примера 1, используя метил 2-хлор-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат (688 мг) вместо метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 6
2-Хлор-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Оксалилхлорид (1,42 мл) по каплям добавляли к перемешиваемому раствору 2-хлор-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты (1,27 г) в ТГФ (13 мл) при охлаждении на льду. В смесь добавляли ДМФ (пять капель) и перемешивали при комнатной температуре в течение 2 часов. Из реакционной смеси удаляли растворитель и избыточное количество оксалилхлорида при пониженном давлении. К остатку добавляли толуол и концентрировали при пониженном давлении, сушили, а затем растворяли в ТГФ (10 мл). Раствор по каплям медленно добавляли к раствору 3-хлор-2-метиланилина (0,42 мл) и N,N-диизопропилэтиламина (2,3 мл) в ТГФ (10 мл) при охлаждении на льду в течение 1 часа. Реакционную смесь разбавляли этилацетатом, промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (0,58 г) в виде белого порошка.
MS(ESI+) m/z 507 (M+H)+, Rt = 2,56 минут (способ A)
Пример 136
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(2-метоксиэтил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
2-Метоксиэтиламин (2 мл) добавляли к 2-хлор-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамиду (40 мг, пример 135). Смесь перемешивали при 150°C в герметизированном устойчивом к давлению контейнере из нержавеющей стали в течение 17 часов. Реакционную смесь промывали насыщенным солевым раствором и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением N-(3-хлор-2-метилфенил)-2-[(2-метоксиэтил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (35 мг) в виде белого порошка. Его растворяли в MeOH (1 мл), добавляли 2н раствор хлористоводородная кислота/EtOH (1 экв.), перемешивали и концентрировали. Остаток растирали в диэтиловом эфире, и осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (28 мг) в виде белого порошка.
MS(ESI+) m/z 546 (M+H)+, Rt = 1,80 минут (способ A)
Пример 137
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(2-гидроксиэтил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде коричневого порошка согласно методике, описанной в примере 136, используя 2-аминоэтанол вместо 2-метоксиэтиламина.
MS(ESI+) m/z 532 (M+H)+, Rt = 1,58 минут (способ A)
Пример 138
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(метиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 136, используя 40% водный раствор метиламина вместо 2-метоксиэтиламина.
MS(ESI+) m/z 502 (M+H)+, Rt = 1,69 минут (способ A)
Пример 139
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(этиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 136, используя 70% водный раствор этиламина место 2-метоксиэтиламина.
MS(ESI+) m/z 516 (M+H)+, Rt = 1,80 минут (способ A)
Пример 140
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(2,2-диметилпропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 136, используя неопентиламин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 558 (M+H)+, Rt = 2,22 минут (способ A)
Элементный анализ для C28H27Cl3N5O2⋅HCl+0,5H2O
Вычисл.(%) C:55,73 H:4,84 N:11,61
Найдено(%) C:55,99 H:4,75 N:11,69
Пример 141
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(циклопентиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 136, используя циклопентиламин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 556 (M+H)+, Rt = 2,10 минут (способ A)
Пример 142
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(пиперидин-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 136, используя пиперидин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 556 (M+H)+, Rt = 2,54 минут (способ A)
Пример 143
Дигидрохлорид N-(3-хлор-2-метилфенил)-2-(4-метилпиперазин-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 136, используя 1-метилпиперазин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 571 (M+H)+, Rt = 1,63 минут (способ A)
Пример 144
Гидрохлорид 2-[бис(2-гидроксиэтил)амино]-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 136, используя диэтаноламин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 576 (M+H)+, Rt = 1,66 минут (способ A)
Пример 145
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя 50% водный раствор диметиламина вместо 2-метоксиэтиламина.
MS(ESI+) m/z 516 (M+H)+, Rt = 2,13 минут (способ A)
Элементный анализ для C25H21ClF3N5O2⋅HCl+0,5H2O
Вычисл.(%) C:53,49 H:4,13 N:12,48
Найдено(%) C:53,44 H:4,17 N:12,39
Пример 146
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[2-(морфолин-4-ил)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде розового порошка согласно методике, описанной в примере 136, используя 4-(2-аминоэтил)морфолин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 601 (M+H)+, Rt = 1,53 минут (способ A)
Пример 147
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[2-(диметиламино)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя N,N-диметилэтилендиамин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 559 (M+H)+, Rt = 1,51 минут (способ A)
Пример 148
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(3-гидроксиазетидин-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 136, используя гидрохлорид 3-гидроксиазетидина, N,N-диизопропилэтиламин и EtOH вместо 2-метоксиэтиламина.
MS(ESI+) m/z 544 (M+H)+, Rt = 1,77 минут (способ A)
Пример 149
Дигидрохлорид N-(3-хлор-2-метилфенил)-2-[(3S)-3-(диметиламино)пирролидин-1-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде коричневого порошка согласно методике, описанной в примере 136, используя (S)-(-)-3-диметиламинопирролидин, N,N-диизопропилэтиламин и EtOH вместо 2-метоксиэтиламина.
MS(ESI+) m/z 585 (M+H)+, Rt = 1,53 минут (способ A)
Пример 150
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(3S)-3-гидроксипирролидин-1-ил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя (S)-3-гидроксипирролидин, N,N-диизопропилэтиламин и EtOH вместо 2-метоксиэтиламина.
MS(ESI+) m/z 558 (M+H)+, Rt = 1,75 минут (способ A)
Пример 151
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[2-(диэтиламино)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя N,N-диэтилэтилендиамин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 587 (M+H)+, Rt = 1,57 минут (способ A)
Пример 152
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[2-(пирролидин-1-ил)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя 1-(2-аминоэтил)пирролидин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 585 (M+H)+, Rt = 1,59 минут (способ A)
Пример 153
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[3-(диметиламино)пропил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя N,N-диметил-1,3-пропандиамин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 573 (M+H)+, Rt = 1,43 минут (способ A)
Пример 154
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[3-(диметиламино)-2,2-диметилпропил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя N,N,2,2-тетраметил-1,3-пропандиамин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 601 (M+H)+, Rt = 1,56 минут (способ A)
Пример 155
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[2-(дипропан-2-иламино)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя N,N-диизопропилэтилендиамин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 615 (M+H)+, Rt = 1,69 минут (способ A)
Пример 156
N-(3-Хлор-2-метилфенил)-2-(морфолин-4-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136 используя морфолин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 558 (M+H)+, Rt = 2,25 минут (способ A)
Пример 157
Гидрохлорид 2-амино-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Согласно методике как описано в пример 136 получали N-(3-хлор-2-метилфенил)-2-[(4-метоксибензил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид (97 мг) в виде желтого порошка, используя 4-метоксибензиламин вместо 2-метоксиэтиламина. Его растворяли в ТФУ (2 мл), и раствор перемешивали при 70°C в течение 2 часов, и удаляли ТФУ при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением 2-амино-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (35 мг). Вещество суспендировали в MeOH (3 мл), добавляли 2н раствор хлористоводородная кислота/MeOH (0,3 мл) и удаляли MeOH при пониженном давлении. Остаток растирали в 2-пропанол/диэтиловом эфире, и осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (21 мг) в виде желтого порошка.
MS(ESI+) m/z 488 (M+H)+, Rt = 1,62 минут (способ A)
Пример 158
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(3-гидрокси-2,2-диметилпропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя 3-амино-2,2-диметил-1-пропанол вместо 2-метоксиэтиламина.
MS(ESI+) m/z 574 (M+H)+, Rt = 1,81 минут (способ A)
Пример 159
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[(3-метилоксетан-3-ил)метил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя 1-(3-метилоксетан-3-ил)метанамин (получен, как описано в US2009/76062) вместо 2-метоксиэтиламина.
MS(ESI+) m/z 572 (M+H)+, Rt = 1,66 минут (способ A)
Пример 160
Гидрохлорид трет-бутил N-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}глицината
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя глицин трет-бутиловый сложный эфир вместо 2-метоксиэтиламина.
MS(ESI+) m/z 602 (M+H)+, Rt = 2,42 минут (способ A)
Пример 161
Гидрохлорид N-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}глицина
К раствору трет-бутил N-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}глицината (95 мг) в метиленхлориде (2 мл) добавляли ТФУ (1 мл), и смесь перемешивали в течение 1 часа при комнатной температуре и концентрировали. Остаток нейтрализовали 1н водным раствором NaOH при охлаждении на льду и экстрагировали EtOAc. Этилацетатный слой сушили над безводным сульфатом магния и концентрировали. Остаток очищали хроматографией на колонке с получением N-{4-[(3-хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}глицина (50 мг) в виде белого порошка. N-{4-[(3-Хлор-2-метилфенил)карбамоил]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-2-ил}глицин (16 мг) суспендировали в MeOH. К суспензии добавляли 2н раствор хлористоводородная кислота/EtOH (1 экв.) с получением гомогенного раствора. Из реакционной смеси удаляли растворитель при пониженном давлении. Остаток растирали в диэтиловом эфире, и осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (12 мг) в виде белого порошка.
MS(ESI+) m/z 546 (M+H)+, Rt = 1,74 минут (способ A)
Пример 162
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(3-гидрокси-2,2-диметилпропил)амино]-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Порошок гидроксида натрия (6,2 мг) добавляли к раствору N-(3-хлор-2-метилфенил)-2-[(3-гидрокси-2,2-диметилпропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (80 мг) в ДМФ (2 мл), и раствор перемешивали при комнатной температуре в течение 30 минут, добавляли метилйодид (8,7 мкл) и перемешивали в течение 17 часов. Реакционную смесь разбавляли этилацетатом, промывали насыщенным солевым раствором и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением N-(3-хлор-2-метилфенил)-2-[(3-гидрокси-2,2-диметилпропил)амино]-1-метил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (20 мг) в виде белого порошка. Вещество суспендировали в MeOH и добавляли 2н раствор хлористоводородная кислота/EtOH (1 экв.) и перемешивали с получением раствора, и растворитель удаляли при пониженном давлении. Остаток промывали диэтиловым эфиром, и осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (15 мг) в виде белого порошка.
MS(ESI+) m/z 588 (M+H)+, Rt = 2,06 минут (способ A)
Пример 163
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(3-метокси-2,2-диметилпропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 136, используя 3-метокси-2,2-диметилпропиламин (получен, как описано в WO2007/28051) вместо 2-метоксиэтиламина.
MS(ESI+) m/z 588 (M+H)+, Rt = 2,11 минут (способ A)
Элементный анализ для C29H29ClF3N5O3⋅HCl+0,5H2O
Вычисл.(%) C:54,98 H:4,93 N:11,06
Найдено(%) C:54,94 H:4,63 N:11,09
Пример 164
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(пирролидин-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя пирролидин вместо 2-метоксиэтиламина.
MS(ESI+) m/z 542 (M+H)+, Rt = 2,15 минут (способ A)
Элементный анализ для C27H23ClF3N5O2⋅HCl+1,0H2O
Вычисл.(%) C:54,37 H:4,39 N:11,74
Найдено(%) C:54,34 H:4,66 N:12,26
Пример 165
Гидрохлорид 2-(азетидин-1-ил)-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Раствор 2-хлор-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (80 мг, пример 135), гидрохлорида азетидина (60 мг) и N,N-диизопропилэтиламина (208 мкл) в EtOH (1,8 мл) взаимодействовал при 120°C в течение 20 минут в микроволновом реакторе (Biotage, Initiator). Реакционную смесь концентрировали при пониженном давлении, и остаток очищали хроматографией на колонке с получением 2-(азетидин-1-ил)-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (27 мг). Его растворяли в MeOH (1 мл) и добавляли 2н раствор хлористоводородная кислота/MeOH (1 экв.), и перемешивали и концентрировали. Остаток растирали с диэтиловым эфиром, и осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (21 мг) в виде белого порошка.
MS(ESI+) m/z 528 (M+H)+, Rt = 2,09 минут (способ A)
Пример 166
Гидрохлорид N-(3-хлор-2-метилфенил)-2-(3-метоксиазетидин-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 136, используя 3- гидрохлорид метоксиазетидина, N,N-диизопропилэтиламин и EtOH вместо 2-метоксиэтиламина.
MS(ESI+) m/z 558 (M+H)+, Rt = 2,20 минут (способ A)
Пример 167
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(2-гидрокси-2-метилпропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя 1-амино-2-метил-2-пропанол (получен, как описано в WO2009/57827) и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 560 (M+H)+, Rt = 1,87 минут (способ A)
Пример 168
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[(2S)-тетрагидрофуран-2-илметил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя (S)-(+)-тетрагидрофурфуриламин и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 572 (M+H)+, Rt = 2,04 минут (способ A)
Пример 169
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[(2R)-тетрагидрофуран-2-илметил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя (R)-(-)-тетрагидрофурфуриламин и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 572 (M+H)+, Rt = 2,04 минут (способ A)
Элементный анализ для C28H25Cl3N5O3⋅HCl+0,7H2O.
Вычисл.(%) C:54,15 H:4,45 N:11,28
Найдено(%) C:54,16 H:4,57 N:11,19
Пример 170
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[(2S)-1-гидрокси-3-метилбутан-2-ил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя (S)-(+)-2-амино-3-метил-1-бутанол и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 574 (M+H)+, Rt = 1,98 минут (способ A)
Пример 171
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[(2R)-1-гидрокси-3-метилбутан-2-ил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя (R)-(-)-2-амино-3-метил-1-бутанол и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 574 (M+H)+, Rt = 1,98 минут (способ A)
Пример 172
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[(2S)-1-гидрокси-3,3-диметилбутан-2-ил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя (S)-трет-лейцинол и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 588 (M+H)+, Rt = 2,20 минут (способ A)
Пример 173
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(3-метокси-2,2-диметилпропил)(метил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя 3-метокси-N,2,2-триметилпропан-1-амин (Ссылочный пример 9) и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 602 (M+H)+, Rt = 2,71 минут (способ A)
Пример 174
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(3-метоксипропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя 3-метоксипропиламин и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 560 (M+H)+, Rt = 2,10 минут (способ A)
Пример 175
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[2-(пропан-2-илокси)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя 2-аминоэтилизопропиловый эфир и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 574 (M+H)+, Rt = 2,29 минут (способ A)
Пример 176
Гидрохлорид 2-[(2-Трет-бутоксиэтил)амино]-N-(3-хлор-2-метилфенил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя O-трет-бутил-2-аминоэтанол и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 588 (M+H)+, Rt = 2,42 минут (способ A)
Пример 177
Гидрохлорид N-(3-хлор-2-метилфенил)-2-[(2-метокси-2-метилпропил)амино]-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя 2-метокси-2-метилпропиламин и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 574 (M+H)+, Rt = 2,30 минут (способ A)
Пример 178
Гидрохлорид N-(3-хлор-2-метилфенил)-2-{[2-(метилсульфанил)этил]амино}-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 136, используя 2-(метилтио)этиламин и ТГФ вместо 2-метоксиэтиламина.
MS(ESI+) m/z 562 (M+H)+, Rt = 2,51 минут (способ A)
Пример 179
N-(3-Хлор-2-метилфенил)-2-(метилсульфанил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Стадия 1
Метил 2-(метилсульфанил)-1H-бензимидазол-4-карбоксилат
К раствору метил 2-сульфанил-1H-бензимидазол-4-карбоксилата (получен, как описано в WO2003/106430) (1,0 г) в ДМФ (15 мл), добавляли карбонат калия (700 мг) и метилйодид (0,32 мл), и смесь перемешивали при комнатной температуре в течение 3 суток. Реакционную смесь разбавляли этилацетатом, промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (860 мг) в виде белого порошка.
Стадия 2
Метил 2-(метилсульфанил)-6-нитро-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение (840 мг) получали в виде светло-желтого порошка согласно методике, описанной в стадии 2 примера 1, используя метил 2-(метилсульфанил)-1H-бензимидазол-4-карбоксилат (860 мг) вместо метил-1H-бензимидазол-4-карбоксилата.
Стадия 3
Метил 6-амино-2-(метилсульфанил)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение (380 мг) получали в виде светло-желтого порошка согласно методике, описанной в стадии 3 примера 1, используя метил 2-(метилсульфанил)-6-нитро-1H-бензимидазол-4-карбоксилат (840 мг) вместо метил 6-нитро-1H-бензимидазол-4-карбоксилата.
Стадия 4
Метил 2-(метилсульфанил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение (250 мг) получали в виде белого порошка согласно методике, описанной в стадии 4 примера 1, используя метил 6-амино-2-(метилсульфанил)-1H-бензимидазол-4-карбоксилат (150 мг) вместо метил 6-амино-1H-бензимидазол-4-карбоксилата.
Стадия 5
2-(Метилсульфанил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение (240 мг) получали в виде светло-желтого порошка согласно методике, описанной в стадии 5 примера 1, используя метил 2-(метилсульфанил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилат (250 мг) вместо метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 6
N-(3-Хлор-2-метилфенил)-2-(метилсульфанил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение (35 мг) получали в виде белого порошка согласно методике, описанной в стадии 6 примера 135, используя 2-(метилсульфанил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновую кислоту (45 мг) вместо 2-хлор-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 519 (M+H)+, Rt = 2,79 минут (способ A)
Пример 180
N-(3-Хлор-2-метилфенил)-2-(метилсульфонил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
К раствору N-(3-хлор-2-метилфенил)-2-(метилсульфанил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (33 мг) в MeOH (5 мл) добавляли водный раствор (0,5 мл) соединения оксонмоноперсульфата (75 мг), и смесь перемешивали при комнатной температуре в течение 17 часов. Дополнительно в смесь добавляли водный раствор (0,5 мл) соединения оксонмоноперсульфата (50 мг), и перемешивали в течение 3 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия. Органический слой разделяли, и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (11 мг) в виде белого порошка.
MS(ESI+) m/z 551 (M+H)+, Rt = 2,54 минут (способ A)
Пример 181
N-(3-Хлор-2-метилфенил)-2-(метилсульфинил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
К раствору N-(3-хлор-2-метилфенил)-2-(метилсульфанил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (26 мг) в ТГФ (3 мл) добавляли водный раствор м-хлорпербензойной кислоты (75%, 12 мг) (1 мл), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь разбавляли этилацетатом, последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (10 мг) в виде светло-желтого порошка.
MS(ESI+) m/z 535 (M+H)+, Rt = 2,42 минут (способ A)
Пример 182
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 2-(диметиламино)-1H-бензимидазол-4-карбоксилат
Хлорид (дихлорметилен)диметилимина (4,93 г) добавляли к раствору метил 2,3-диаминобензоата (4,2 г) в метиленхлориде (75 мл), и раствор перемешивали на масляной бане при 50°C в течение 1 часа. В реакционную смесь добавляли насыщенный водный раствор бикарбоната натрия, и экстрагировали этилацетатом. Органический слой разделяли, промывали насыщенным солевым раствором и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (4,7 г) в виде бледно-желтого твердого вещества.
Стадия 2
Метил 2-(диметиламино)-6-нитро-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение (1,8 г) получали в виде оранжевого порошка согласно методике, описанной в стадии 2 примера 1, используя метил 2-(диметиламино)-1H-бензимидазол-4-карбоксилат (4,57 г) вместо метил 1H-бензимидазол-4-карбоксилата.
Стадия 3
2-(Диметиламино)-6-нитро-1H-бензимидазол-4-карбоновая кислота
Раствор метил 2-(диметиламино)-6-нитро-1H-бензимидазол-4-карбоксилата (1,5 г) и гидрат гидроксида лития (2,4 г) в ТГФ-H2O (1:1, 100 мл) перемешивали при 50°C в течение 2 часов. ТГФ удаляли при пониженном давлении, и к остатку добавляли 1н хлористоводородную кислоту при перемешивании при охлаждении на льду, доводя рН до 5. Осадок собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (1,38 г) в виде желтого твердого вещества.
Стадия 4
N-(3-Хлор-2-метилфенил)-2-(диметиламино)-6-нитро-1H-бензимидазол-4-карбоксамид
К раствору 2-(диметиламино)-6-нитро-1H-бензимидазол-4-карбоновой кислоты (520 мг) и HBTU (1,03 г) в ДМФ (6 мл) добавляли N,N-диизопропилэтиламин (942 мкл) и 3-хлор-2-метиланилин (323 мкл), и смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавляли этилацетатом-ТГФ (1:1), промывали насыщенным солевым раствором, и органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток промывали MeOH с получением указанного в заголовке соединения (650 мг) в виде желтого твердого вещества.
Стадия 5
6-Амино-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамид
К суспензии N-(3-хлор-2-метилфенил)-2-(диметиламино)-6-нитро-1H-бензимидазол-4-карбоксамида (580 мг) в MeOH-ТГФ (1:1, 60 мл) добавляли 2н раствор хлористоводородная кислота/EtOH (1 мл). В смесь добавляли 1% платина + 0,1% медь-активированный уголь (Degussa тип CF105 R/W) (150 мг) и энергично перемешивали в атмосфере водорода (0,2 МПа) в течение 3 часов. Реакционную смесь отфильтровывали через целит, и маточную смесь концентрировали. К остатку добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением указанного в заголовке соединения (265 мг) в виде коричневого порошка.
Стадия 6
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
К раствору 6-амино-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида (30 мг) в ТГФ (1 мл), добавляли N,N-диизопропилэтиламин (22 мкл). Смесь перемешивали при охлаждении на льду и медленно добавляли хлорид 2-хлор-6-фторбензоила (13 мкл) и перемешивали в течение 2 часов. Реакционную смесь разбавляли этилацетатом, последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида (30 мг) в виде светло-желтого порошка. Вещество суспендировали в MeOH (1 мл) и добавляли с помощью 1н раствора хлористоводородная кислота/MeOH (1 экв.) с получением гомогенного раствора и удаляли MeOH при пониженном давлении. Остаток растирали в н-гексане/этилацетате (1:1), и осадок собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (23 мг) в виде светло-желтого порошка.
MS(ESI+) m/z 500 (M+H)+, Rt = 2,13 минут (способ A)
Пример 183
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,6-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 6 примера 182, используя 2,6-дихлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 516 (M+H)+, Rt = 2,19 минут (способ A)
Пример 184
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,4-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 6 примера 182, используя 2,4-дихлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 516 (M+H)+, Rt = 2,31 минут (способ A)
Пример 185
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 6 примера 182, используя 2,5-дихлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 516 (M+H)+, Rt = 2,31 минут (способ A)
Элементный анализ для C24H20Cl3N5O2⋅HCl+0,5H2O
Вычисл.(%) C:51,27 H:3,94 N:12,46
Найдено(%) C:51,10 H:4,02 N:12,45
Пример 186
Гидрохлорид 6-{[(2-бром-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде серого порошка согласно методике, описанной в стадии 6 примера 182, используя 2-бром-6-фторбензоилхлорид (получен, как описано в WO2007/144327) вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 544 (M+H)+, Rt = 2,23 минут (способ A)
Пример 187
Гидрохлорид 6-{[(2-бром-6-хлорфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светлого коричневого порошка согласно методике, описанной в стадии 6 примера 182, используя 2-бром-6-хлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 560 (M+H)+, Rt = 2,29 минут (способ A)
Пример 188
Гидрохлорид 6-({[2-хлор-5-(циклопропилэтинил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
К раствору 2-хлор-5-(циклопропилэтинил)бензойной кислоты (33 мг, ссылочный пример 3), 6-амино-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида (50 мг) и HATU (72 мг) в ДМФ (1 мл) добавляли N,N-диизопропилэтиламин (66 мкл), и смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь разбавляли этилацетатом и последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением 6-({[2-хлор-5-(циклопропилэтинил)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида (74 мг). Вещество суспендировали в MeOH (1 мл) и добавляли 2н раствор хлористоводородная кислота/EtOH (1 экв.) с получением гомогенного раствора, и растворитель удаляли при пониженном давлении. Остаток растирали в этилацетате, и осадок собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (58 мг) в виде светло-желтого порошка.
MS(ESI+) m/z 546 (M+H)+, Rt = 2,60 минут (способ A)
Пример 189
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(3-гидрокси-2,2-диметилпропил)амино]-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 2-хлор-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение (1,68 г) получали в виде бесцветного аморфного вещества согласно методике, описанной в стадии 4 примера 1, используя метил 6-амино-2-хлор-1H-бензимидазол-4-карбоксилат вместо метил 6-амино-1H-бензимидазол-4-карбоксилата, и 2,5-дихлорбензоилхлорид вместо 2-(трифторметил)бензоилхлорида.
Стадия 2
2-Хлор-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение (1,41 г) получали в виде белого порошка согласно методике, описанной в стадии 5 примера 1, используя метил 2-хлор-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксилат (1,68 г) вместо метил 6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата.
Стадия 3
2-Хлор-N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого твердого вещества согласно методике, описанной в стадии 6 примера 135, используя 2-хлор-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоновую кислоту вместо 2-хлор-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
Стадия 4
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(3-гидрокси-2,2-диметилпропил)амино]-1H-бензимидазол-4-карбоксамида
К 2-хлор-N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамиду (50 мг) и 3-амино-2,2-диметил-1-пропанолу (400 мг) добавляли ТГФ (1 мл). Смесь перемешивали при 150°C в герметизированном, устойчивому к давлению, контейнере из нержавеющей стали в течение 8 часов. Реакционную смесь разбавляли этилацетатом, промывали насыщенным солевым раствором и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(3-гидрокси-2,2-диметилпропил)амино]-1H-бензимидазол-4-карбоксамида (50 мг) в виде светло-желтого порошка. Его растворяли в MeOH (1 мл) и добавляли 2н раствор соляная кислота/EtOH (1 экв.), перемешивали и концентрировали. Остаток растирали с диэтиловым эфиром, и осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (40 мг) в виде белого порошка.
MS(ESI+) m/z 574 (M+H)+, Rt = 2,06 минут (способ A)
Пример 190
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(3-метокси-2,2-диметилпропил)амино]-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 189, используя 3-метокси-2,2-диметилпропиламин вместо 3-амино-2,2-диметил-1-пропанола.
MS(ESI+) m/z 588 (M+H)+, Rt = 2,41 минут (способ A)
Пример 191
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(2-гидрокси-2-метилпропил)амино]-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 189, используя 2-гидрокси-2-метилпропиламин вместо 3-амино-2,2-диметил-1-пропанола.
MS(ESI+) m/z 560 (M+H)+, Rt = 2,12 минут (способ A)
Пример 192
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-[(2-метокси-2-метилпропил)амино]-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 189, используя 2-метокси-2-метилпропиламин вместо 3-амино-2,2-диметил-1-пропанола.
MS(ESI+) m/z 574 (M+H)+, Rt = 2,48 минут (способ A)
Пример 193
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-{[2-(пропан-2-илокси)этил]амино}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде молочно-белого порошка согласно методике, описанной в примере 189, используя 2-аминоэтилизопропиловый эфир вместо 3-амино-2,2-диметил-1-пропанола.
MS(ESI+) m/z 574 (M+H)+, Rt = 2,60 минут (способ A)
Элементный анализ для C27H26Cl3N5O3⋅HCl+0,1H2O
Вычисл.(%) C:52,89 H:4,47 N:11,42
Найдено(%) C:52,55 H:4,10 N:11,36
Пример 194
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-{[2-(пропан-2-илокси)этил]амино}-1H-бензимидазол-4-карбоксамида
Стадия 1
2-Хлор-6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде белого твердого вещества, следуя методикам, как описано в стадиях 1 до 3 примера 189, используя 2-хлор-6-фторбензоилхлорид вместо 2,5-дихлорбензоилхлорида в стадии 1.
Стадия 2
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-{[2-(пропан-2-илокси)этил]амино}-1H-бензимидазол-4-карбоксамида
К 2-хлор-6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-1H-бензимидазол-4-карбоксамиду (50 мг) и 2-аминоэтилизопропиловому эфиру (32 мг) добавляли ТГФ (1 мл). Смесь перемешивали при 150°C в герметизированном, устойчивом к давлению, контейнере из нержавеющей стали в течение 17 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным солевым раствором и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-{[2-(пропан-2-илокси)этил]амино}-1H-бензимидазол-4-карбоксамида (41 мг) в виде светло-желтого порошка. Его растворяли в MeOH (1 мл), и добавляли 2н раствор хлористоводородная кислота/EtOH (1 экв.), перемешивали и концентрировали. Остаток растирали с диэтиловым эфиром, и осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (35 мг) в виде белого порошка.
MS(ESI+) m/z 558 (M+H)+, Rt = 2,41 минут (способ A)
Пример 195
Гидрохлорид 2-[(2-трет-бутоксиэтил)амино]-6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 194, используя O-трет-бутил 2-аминоэтанол вместо 2-аминоэтил изопропилового эфира.
MS(ESI+) m/z 572 (M+H)+, Rt = 2,49 минут (способ A)
Пример 196
Гидрохлорид 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-[(3-метокси-2,2-диметилпропил)амино]-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 194, используя 3-метокси-2,2-диметилпропиламин вместо 2-аминоэтилизопропилового эфира.
MS(ESI+) m/z 572 (M+H)+, Rt = 2,51 минут (способ A)
Пример 197
Гидрохлорид 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-[(2-метокси-2-метилпропил)амино]-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 194, используя 2-метокси-2-метилпропиламин вместо 2-аминоэтилизопропилового эфира.
MS(ESI+) m/z 558 (M+H)+, Rt = 2,34 минут (способ A)
Пример 198
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-{[(2S)-тетрагидрофуран-2-илметил]амино}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-розового порошка согласно методике, описанной в стадии 2 примера 194, используя (S)-(+)-тетрагидрофурфуриламин вместо 2-аминоэтилизопропилового эфира.
MS(ESI+) m/z 556 (M+H)+, Rt = 2,28 минут (способ A)
Пример 199
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-{[(2R)-тетрагидрофуран-2-илметил]амино}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-розового порошка согласно методике, описанной в стадии 2 примера 194, используя (R)-(-)-тетрагидрофурфуриламин вместо 2-аминоэтилизопропилового эфира.
MS(ESI+) m/z 556 (M+H)+, Rt = 2,28 минут (способ A)
Пример 200
Гидрохлорид 6-[{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-[(3-гидрокси-2,2-диметилпропил)амино]-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадии 2 примера 194, используя 3-амино-2,2-диметил-1-пропанол вместо 2-аминоэтилизопропилового эфира.
MS(ESI+) m/z 558 (M+H)+, Rt = 2,22 минут (способ A)
Пример 201
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-{[(2S)-1-гидрокси-3-метилбутан-2-ил]амино}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадии 2 примера 194, используя (S)-(+)-2-амино-3-метил-1-бутанол вместо 2-аминоэтилизопропилового эфира.
MS(ESI+) m/z 558 (M+H)+, Rt = 2,31 минут (способ A)
Пример 202
Гидрохлорид N-(3-хлор-4-метилфенил)-2-(диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Стадия 1
2-(Диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновая кислота
К перемешиваемому раствору метил 6-амино-2-хлор-1H-бензимидазол-4-карбоксилата (400 мг, пример 135, стадия 3) и триэтиламина (209 мкл) в ТГФ (18 мл), медленно по каплям добавляли 2-(трифторметил)бензоилхлорид (316 мкл) при охлаждении на льду. Через 1 час реакционную смесь разбавляли этилацетатом, последовательно промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением сырого метил 2-хлор-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксилата. Его растворяли в ТГФ (15 мл) и MeOH (7 мл), и добавляли 1н водный раствор гидроксида лития (9 мл) и перемешивали при комнатной температуре в течение ночи. Из реакционной смеси удаляли ТГФ и MeOH при пониженном давлении. К остатку добавляли воду и нейтрализовали с помощью 1н хлористоводородной кислоты при охлаждении на льду. Осадок собирали фильтрацией с получением сырой 2-хлор-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты. Вещество растворяли в ТГФ (10 мл) и добавляли 40% водный раствор диметиламина (7 мл) и перемешивали при 120°C в течение 14 часов. Реакционную смесь охлаждали до комнатной температуры, удаляли ТГФ при пониженном давлении. К остатку добавляли воду и доводили до рН 3-4 с помощью 1н хлористоводородной кислоты при охлаждении на льду. Осадок собирали фильтрованием, промывали диэтиловым эфиром и сушили при пониженном давлении с получением указанного в заголовке соединения (589 мг) в виде слегка желтого твердого вещества.
Стадия 2
Гидрохлорид N-(3-хлор-4-метилфенил)-2-(диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
К раствору 2-(диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты (50 мг) и HATU (82 мг) в ДМФ (1 мл) добавляли N,N-диизопропилэтиламин (88 мкл) и 3-хлор-4-метиланилин (26 мкл), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли этилацетатом, последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением N-(3-хлор-4-метилфенил)-2-(диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (65 мг) в виде белого порошка. Вещество суспендировали в MeOH (1,5 мл) и добавляли 2н раствор хлористоводородной кислоты/MeOH (1 экв.), перемешивали и концентрировали. Остаток растирали с диэтиловым эфиром, и осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (40 мг) в виде белого порошка.
MS(ESI+) m/z 516 (M+H)+, Rt = 2,20 минут (способ A)
Пример 203
Гидрохлорид N-(4-трет-бутилфенил)-2-(диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в стадии 2 примера 202, используя 4-трет-бутиланилин вместо 3-хлор-4-метиланилина.
MS(ESI+) m/z 524 (M+H)+, Rt = 2,30 минут (способ A)
Пример 204
Гидрохлорид N-(2,3-дигидро-1H-инден-5-ил)-2-(диметиламино)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде серого порошка согласно методике, описанной в стадии 2 примера 202, используя 5-аминоиндан вместо 3-хлор-4-метиланилина.
MS(ESI+) m/z 508 (M+H)+, Rt = 2,11 минут (способ A)
Пример 205
Гидрохлорид 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-4-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
Стадия 1
6-Амино-N-(3-хлор-4-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамид
N-(3-хлор-4-метилфенил)-2-(диметиламино)-6-нитро-1H-бензимидазол-4-карбоксамид (520 мг) получали в виде желтого порошка согласно методике, описанной в стадии 4 примера 182, используя 3-хлор-4-метиланилин вместо 3-хлор-2-метиланилина. Вещество затем подвергали реакции согласно методике, описанной в стадии 5 примера 182, с получением указанного в заголовке соединения (358 мг) в виде желтого порошка.
Стадия 2
6-{[(2-Хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-4-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
К раствору 6-амино-N-(3-хлор-4-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида (50 мг) в ТГФ (1,5 мл) добавляли N,N-диизопропилэтиламин (37 мкл), и смесь перемешивали при охлаждении на льду. В смесь медленно добавляли хлорид 2-хлор-6-фторбензоила (24 мкл) и перемешивали в течение 2 часов. Реакционную смесь разбавляли этилацетатом, последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с получением 6-{[(2-хлор-6-фторфенил)карбонил]амино}-N-(3-хлор-4-метилфенил)-2-(диметиламино)-1H-бензимидазол-4-карбоксамида (30 мг) в виде светло-желтого порошка. Вещество затем суспендировали в MeOH (1 мл) и добавляли 2н раствор хлористоводородная кислота/MeOH (1 экв.) с получением гомогенного раствора и удаляли MeOH при пониженном давлении. Остаток растирали в н-гексане/этилацетате (1:1), и осадок собирали фильтрованием и сушили с получением указанного в заголовке соединения (24 мг) в виде светло-розового порошка.
MS(ESI+) m/z 500 (M+H)+, Rt = 2,20 минут (способ A)
Пример 206
Гидрохлорид N-(3-хлор-4-метилфенил)-6-{[(2,6-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-розового порошка согласно методике, описанной в стадии 2 примера 205, используя 2,6-дихлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 516 (M+H)+, Rt = 2,26 минут (способ A)
Пример 207
Гидрохлорид N-(3-хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в стадии 2 примера 205, используя 2,5-дихлорбензоилхлорид вместо 2-хлор-6-фторбензоилхлорида.
MS(ESI+) m/z 516 (M+H)+, Rt = 2,39 минут (способ A)
Элементный анализ для C24H20Cl3N5O2⋅HCl
Вычисл.(%) C:52,10 H:3,83 N:12,66
Найдено(%) C:51,96 H:3,61 N:12,76
Пример 208
Гидрохлорид N-(3-хлор-2-метилфенил)-2-циклопропил-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 6-амино-2-циклопропил-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде белого порошка, следуя методикам, как описано в примере 11 от стадии 1 до стадии 4, используя циклопропанкарбонилхлорид вместо метоксиацетилхлорида в стадии 1.
Стадия 2
2-Циклопропил-6-{[2,5-дихлорфенил]карбонил]амино}-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали следуя методикам как описано в примере 1 стадии 4 и стадии 5, используя метил 6-амино-2-циклопропил-1H-бензимидазол-4-карбоксилат вместо метил 6-амино-1H-бензимидазол-4-карбоксилата, и 2,5-дихлорбензоилхлорид вместо 2-(трифторметил)бензоилхлорида.
Стадия 3
Гидрохлорид N-(3-хлор-2-метилфенил)-2-циклопропил-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали следуя методикам как описано в примере 11 стадии 7 и стадии 8, используя 2-циклопропил-6-{[2,5-дихлорфенил]карбонил]амино}-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 513 (M+H)+, Rt = 1,88 минут (способ A)
Пример 209
Гидрохлорид N-(3-хлор-4-метилфенил)-2-циклопропил-6-{[(2,5-дихлорфенил)карбонил]амино}-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка следуя методикам как описано в примере 11 стадии 7 и стадии 8, используя 2-циклопропил-6-{[2,5-дихлорфенил]карбонил]амино}-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты, и 3-хлор-4-метиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 513 (M+H)+, Rt = 1,85 минут (способ A)
Пример 210
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(1-метилциклопропил)-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 6-амино-2-(1-метилциклопропил)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде белого порошка, следуя методикам как описано в примере 11 от стадии 1 до стадии 4, используя 1-метил-циклопропанкарбонилхлорид (получен, как описано в WO2009/68512) вместо метоксиацетилхлорида в стадии 1.
Стадия 2
2-(1-Метилциклопропил)-6-{[2,5-дихлорфенил]карбонил]амино}-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали, следуя методикам как описано в стадии 4 и стадии 5 примера 1, используя метил 6-амино-2-(1-метилциклопропил)-1H-бензимидазол-4-карбоксилат вместо метил 6-амино-1H-бензимидазол-4-карбоксилата, и 2,5-дихлорбензоилхлорид вместо 2-(трифторметил)бензоилхлорида.
Стадия 3
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(1-метилциклопропил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали, следуя методикам как описано в стадии 7 и стадии 8 примера 11, используя 2-(1-метилциклопропил)-6-{[2,5-дихлорфенил]карбонил]амино}-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 527 (M+H)+, Rt = 2,12 минут (способ A)
Пример 211
Гидрохлорид N-(3-хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(1-метилциклопропил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка, следуя методикам как описано в стадии 7 и стадии 8 примера 11, используя 2-(1-метилциклопропил)-6-{[2,5-дихлорфенил]карбонил]амино}-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты, и 3-хлор-4-метиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 527 (M+H)+, Rt = 2,18 минут (способ A)
Пример 212
N-(3-Хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(метилсульфонил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 103, используя 2-(метилсульфонил)бензойную кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 527 (M+H)+, Rt = 2,08 минут (способ A)
Пример 213
Гидрохлорид N-(3-хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(2-метоксиэтил)-1H-бензимидазол-4-карбоксамида
Стадия 1
Метил 6-амино-2-(2-метоксиэтил)-1H-бензимидазол-4-карбоксилат
Указанное в заголовке соединение получали в виде белого порошка, следуя методикам, как описано в примере 11 от стадии 1 до стадии 4, используя метоксипропионилхлорид вместо метоксиацетилхлорида в стадии 1.
Стадия 2
2-(2-Метоксиэтил)-6-{[2,5-дихлорфенил]карбонил]амино}-1H-бензимидазол-4-карбоновая кислота
Указанное в заголовке соединение получали, следуя методикам, как описано в стадии 4 и стадии 5 примера 1, используя метил 6-амино-2-(2-метоксиэтил)-1H-бензимидазол-4-карбоксилат вместо метил 6-амино-1H-бензимидазол-4-карбоксилата, и 2,5-дихлорбензоилхлорид вместо 2-(трифторметил)бензоилхлорида.
Стадия 3
Гидрохлорид N-(3-хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(2-метоксиэтил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали, следуя методикам, как описано в стадии 7 и стадии 8 примера 11, используя 2-(2-метоксиэтил)-6-{[2,5-дихлорфенил]карбонил]амино}-1H-бензимидазол-4-карбоновую кислоту вместо 2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоновой кислоты.
MS(ESI+) m/z 531 (M+H)+, Rt = 2,43 минут (способ A)
Пример 214
Гидрохлорид 2-(метоксиметил)-N-фенил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя анилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 469 (M+H)+, Rt = 2,01 минут (способ A)
Пример 215
Гидрохлорид 2-(метоксиметил)-N-пропил-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя н-пропиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 435 (M+H)+, Rt = 1,61 минут (способ A)
Пример 216
Гидрохлорид 2-(метоксиметил)-N-(пиридин-3-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 3-аминопиридин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 470 (M+H)+, Rt = 1,25 минут (способ A)
Пример 217
Гидрохлорид N-бензил-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя бензиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 483 (M+H)+, Rt = 1,83 минут (способ A)
Пример 218
Гидрохлорид N-(циклогексилметил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя циклогексанметиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 489 (M+H)+, Rt = 2,11 минут (способ A)
Пример 219
Гидрохлорид 2-(метоксиметил)-N-(нафтален-1-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 1-нафтиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 519 (M+H)+, Rt = 2,29 минут (способ A)
Пример 220
Гидрохлорид 2-(метоксиметил)-N-(тиофен-3-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 3-аминотиофен вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 475 (M+H)+, Rt = 1,92 минут (способ A)
Пример 221
Гидрохлорид N-(2,1,3-бензотиадиазол-4-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 4-амино-2,1,3-бензотиадиазол вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 527 (M+H)+, Rt = 2,16 минут (способ A)
Пример 222
Гидрохлорид N-(1,1-диоксид-1-бензотиофен-6-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 6-аминобензо[b]тиофен 1,1-диоксид вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 557 (M+H)+, Rt = 1,82 минут (способ A)
Пример 223
Гидрохлорид 2-(метоксиметил)-N-(тиофен-2-илметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 2-тиофенметиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 489 (M+H)+, Rt = 1,77 минут (способ A)
Пример 224
N-(1H-Индол-5-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 5-аминоиндол вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 508 (M+H)+, Rt = 1,75 минут (способ A)
Пример 225
Гидрохлорид N-(1,3-бензотиазол-2-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 2-аминобензотиазол вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 526 (M+H)+, Rt = 2,20 минут (способ A)
Пример 226
Гидрохлорид N-(2,2-диметилпропил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя неопентиламин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 463 (M+H)+, Rt = 1,95 минут (способ A)
Пример 227
Гидрохлорид 2-(метоксиметил)-N-(тиофен-2-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 2-аминотиофен вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 475 (M+H)+, Rt = 1,94 минут (способ A)
Пример 228
Гидрохлорид N-(5-хлор-1,3-бензоксазол-2-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 2-амино-5-хлорбензоксазол вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 544 (M+H)+, Rt = 2,09 минут (способ A)
Пример 229
Гидрохлорид N-(2-бензилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 2-бензиланилин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 559 (M+H)+, Rt = 2,34 минут (способ A)
Пример 230
Гидрохлорид 2-(метоксиметил)-N-(хинолин-8-ил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 11, используя 8-аминохинолин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 520 (M+H)+, Rt = 2,03 минут (способ A)
Пример 231
Гидрохлорид N-(циклогептилметил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 11, используя циклогептанметиленамин вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 503 (M+H)+, Rt = 2,23 минут (способ A)
Пример 232
Гидрохлорид N-(1,3-бензоксазол-2-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 2-аминобензоксазол вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 510 (M+H)+, Rt = 1,80 минут (способ A)
Пример 233
Гидрохлорид N-(6-хлор-1,3-бензоксазол-2-ил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя 2-амино-6-хлорбензоксазол вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 544 (M+H)+, Rt = 2,09 минут (способ A)
Пример 234
N-3-Хлор-2-(гидроксиметил)фенил]-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид
Указанное в заголовке соединение получали в виде бесцветного порошка согласно методике, описанной в примере 11, используя (2-амино-6-хлорфенил)метанол (получен, как описано в J. Med. Chem., 2005, 48, 2080) вместо 3-хлор-2-метиланилина.
MS(ESI+) m/z 533 (M+H)+, Rt = 2,08 минут (способ A)
Пример 235
Метансульфонат N-(3-хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамида
К суспензии N-(3-хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамида (200 мг) (получен в примере 207) в MeOH (2 мл) добавляли метансульфоновую кислоту (1 экв.). Смесь перемешивали при комнатной температуре в течение 30 минут и отфильтровывали через стеклянный фильтр для сбора кристаллов, которые сушили при пониженном давлении с получением указанного в заголовке соединения (180 мг) в виде белого порошка.
Элементный анализ для C24H20Cl3N5O2⋅CH3SO3H+1,5H2O
Вычисл.(%) C:46,92 H:4,25 N:10,94
Найдено(%) C:46,85 H:4,04 N:10,89
Пример 236
N-(3-Хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамид 4-метилбензолсульфонат
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 235, используя моногидрат п-толуолсульфоновой кислоты (1 экв.) вместо метансульфоновой кислоты.
Элементный анализ для C24H20Cl3N5O2⋅C7H8O3S+1,2H2O
Вычисл.(%) C:52,40 H:4,31 N:9,86
Найдено(%) C:52,24 H:4,28 N:9,95
Пример 237
N-(3-Хлор-4-метилфенил)-6-{[(2,5-дихлорфенил)карбонил]амино}-2-(диметиламино)-1H-бензимидазол-4-карбоксамид сульфат
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 235, используя серную кислоту (1 экв.) вместо метансульфоновой кислоты.
Элементный анализ для C24H20Cl3N5O2⋅H2SO4+1,5H2O
Вычисл.(%) C:44,91 H:3,93 N:10,91
Найдено(%) C:44,71 H:3,81 N:10,85
Пример 238
N-(3-Хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид метансульфонат
Метансульфоновую кислоту (1 экв.) добавляли к суспензии N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (250 мг) (получен в примере 11) в MeOH (2 мл). После перемешивания в течение 30 минут при комнатной температуре, удаляли MeOH при пониженном давлении с получением указанного в заголовке соединения в виде белого порошка.
Элементный анализ для C25H20ClF3N4O3⋅CH3SO3H+1,0H2O
Вычисл.(%) C:49,49 H:4,15 N:8,88
Найдено(%) C:49,20 H:4,14 N:8,78
Пример 239
N-(3-Хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамид 4-метилбензолсульфонат
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 238, используя моногидрат п-толуолсульфоновой кислоты (1 экв.) вместо метансульфоновой кислоты.
Элементный анализ для C25H20ClF3N4O3⋅C7H8O3S
Вычисл.(%) C:55,78 H:4,10 N:8,13
Найдено(%) C:55,62 H:4,12 N:8,16
Пример 240
Сульфат N-(3-хлор-2-метилфенил)-2-(метоксиметил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 238, используя серную кислоту (1 экв.) вместо метансульфоновой кислоты.
Элементный анализ для C25H20ClF3N4O3⋅H2SO4+0,5H2O
Вычисл.(%) C:48,12 H:3,72 N:8,98
Найдено(%) C:48,34 H:3,57 N:8,99
Пример 241
Метансульфонат N-(3-хлор-2-метилфенил)-2-(1-метилциклопропил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Метансульфоновую кислоту (1 экв.) добавляли к суспензии N-(3-хлор-2-метилфенил)-2-(1-метилциклопропил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида (250 мг) (получен в примере 85) в MeOH (2 мл). После перемешивания при комнатной температуре в течение 30 минут, удаляли MeOH при пониженном давлении с получением указанного в заголовке соединения в виде белого порошка.
Элементный анализ для C27H22ClF3N4O2⋅CH3SO3H+0,5H2O
Вычисл.(%) C:53,21 H:4,31 N:8,86
Найдено(%) C:52,97 H:4,14 N:8,90
Пример 242
4-Метилбензолсульфонат N-(3-хлор-2-метилфенил)-2-(1-метилциклопропил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 241, используя моногидрат п-толуолсульфоновой кислоты (1 экв.) вместо метансульфоновой кислоты.
Элементный анализ для C27H22ClF3N4O2⋅C7H8O3S
Вычисл.(%) C:58,41 H:4,32 N:8,01
Найдено(%) C:58,13 H:4,50 N:8,00
Пример 243
Сульфат N-(3-хлор-2-метилфенил)-2-(1-метилциклопропил)-6-({[2-(трифторметил)фенил]карбонил}амино)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 241, используя серную кислоту (1 экв.) вместо метансульфоновой кислоты.
Элементный анализ для C27H22ClF3N4O2⋅H2SO4+0,6H2O
Вычисл.(%) C:51,00 H:3,99 N:8,81
Найдено(%) C:51,35 H:4,39 N:8,85
Пример 244
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(3-фторпиридин-2-ил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 3-фторпиридин-2-карбоновую кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 468 (M+H)+, Rt = 2,17 минут (способ A)
Пример 245
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(3-хлорпиридин-4-ил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде светло-желтого порошка согласно методике, описанной в примере 103, используя 3-хлорпиколиновую кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 484 (M+H)+, Rt = 2,08 минут (способ A)
Пример 246
Гидрохлорид N-(3-хлор-2-метилфенил)-6-{[(3,5-дихлорпиридин-4-ил)карбонил]амино}-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 3,5-дихлоризоникотиновую кислоту вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 518 (M+H)+, Rt = 2,24 минут (способ A)
Пример 247
Гидрохлорид 6-{[(5-бутокси-2-хлорфенил)карбонил]амино}-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 5-бутокси-2-хлорбензойную кислоту (получена в ссылочном примере 10) вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 555 (M+H)+, Rt = 2,67 минут (способ A)
Пример 248
Гидрохлорид 6-({[2-хлор-5-(2,2-дифторэтокси)фенил]карбонил}амино)-N-(3-хлор-2-метилфенил)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2-хлор-5-(2,2-дифторэтокси)бензойную кислоту (получена в ссылочном примере 11) вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 563 (M+H)+, Rt = 1,66 минут (способ A)
Пример 249
Гидрохлорид N-(3-хлор-2-метилфенил)-6-({[2-хлор-5-(4,4,4-трифторбутокси)фенил]карбонил}амино)-2-(метоксиметил)-1H-бензимидазол-4-карбоксамида
Указанное в заголовке соединение получали в виде белого порошка согласно методике, описанной в примере 103, используя 2-хлор-5-(4,4,4-трифторбутокси)бензойную кислоту (получена в ссылочном примере 12) вместо 2-бром-6-фторбензойной кислоты.
MS(ESI+) m/z 609 (M+H)+, Rt = 1,99 минут (способ A)
Химические структуры соединений примеров 1-249 показаны на нижеприведенных таблицах 1-14.
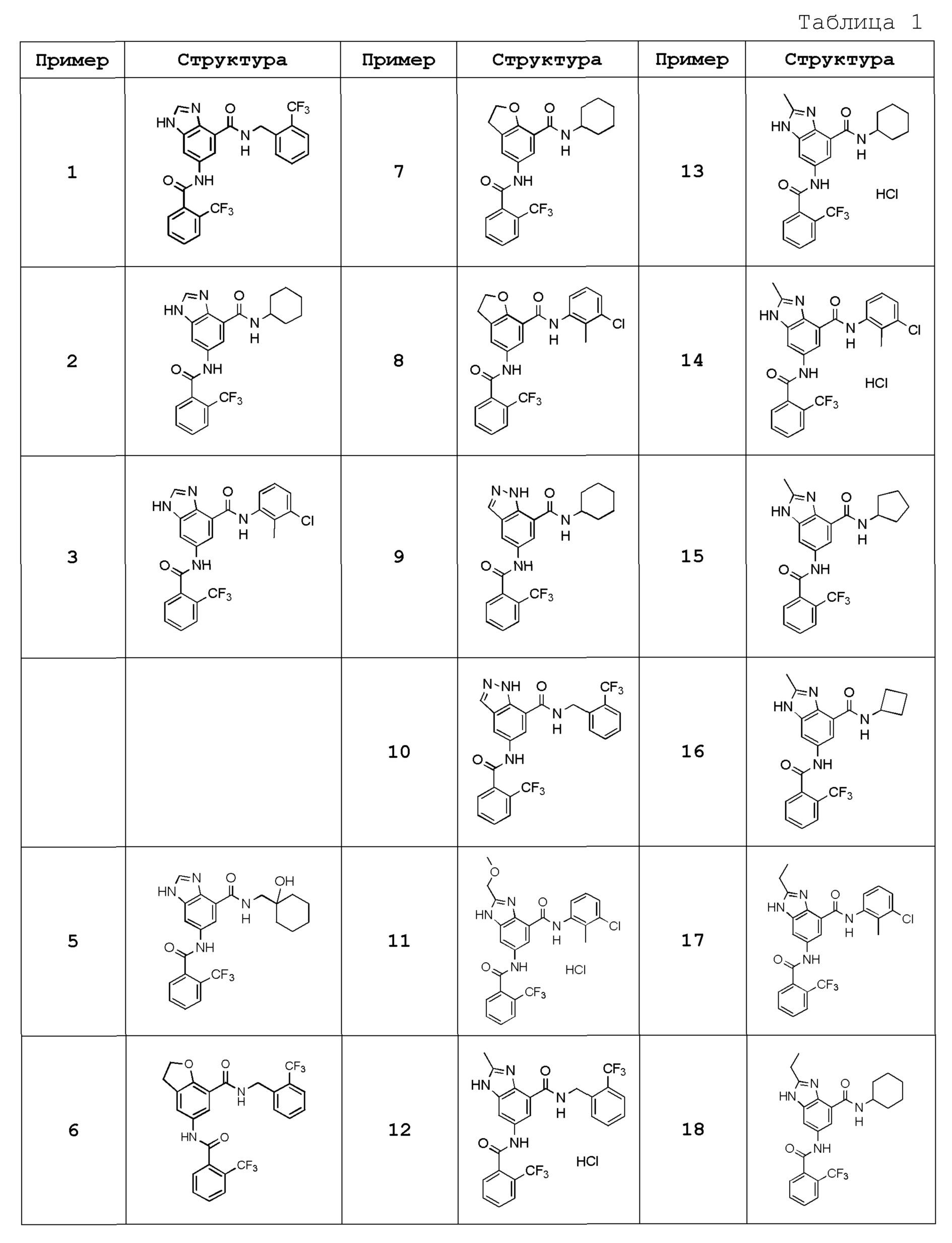
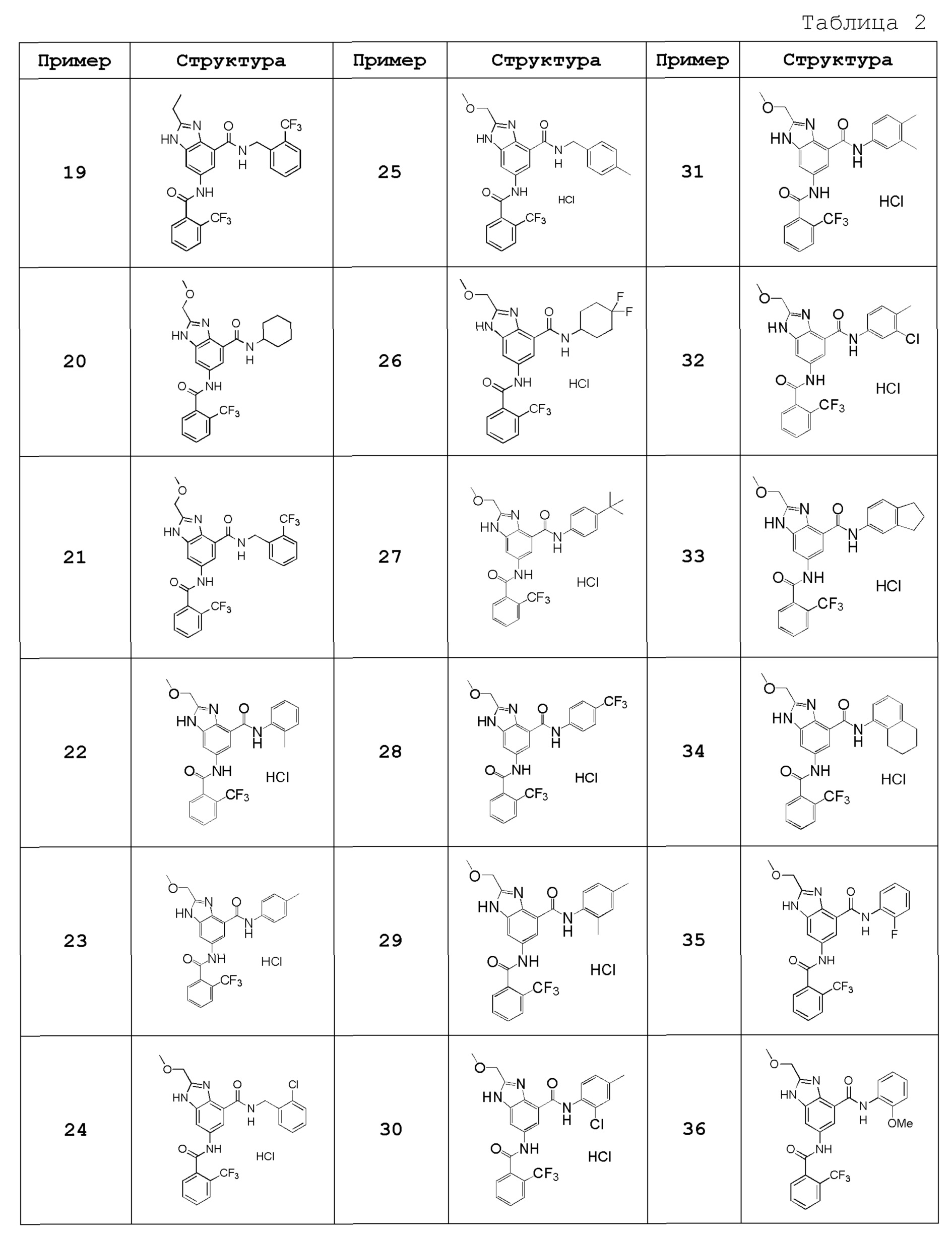
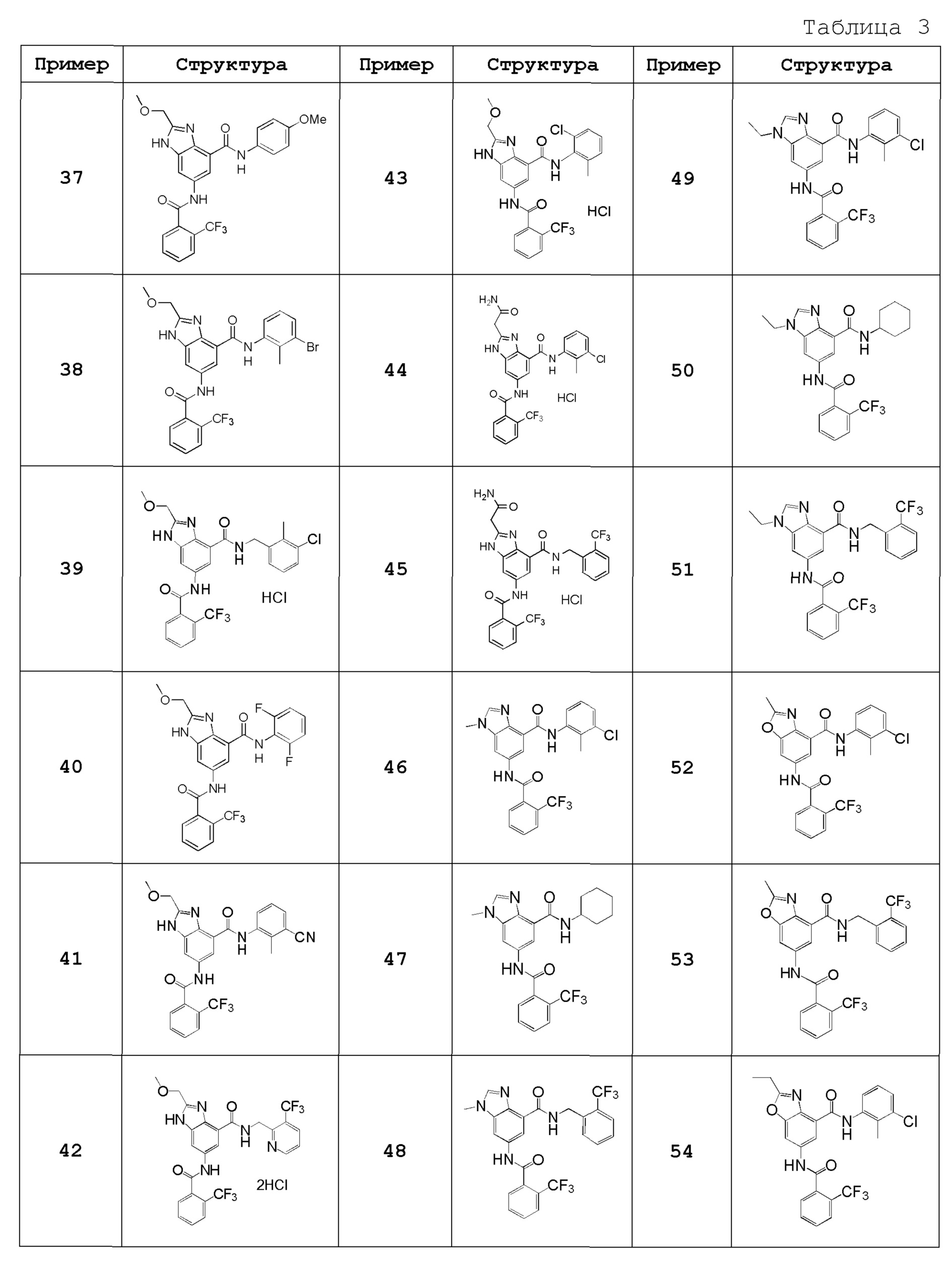
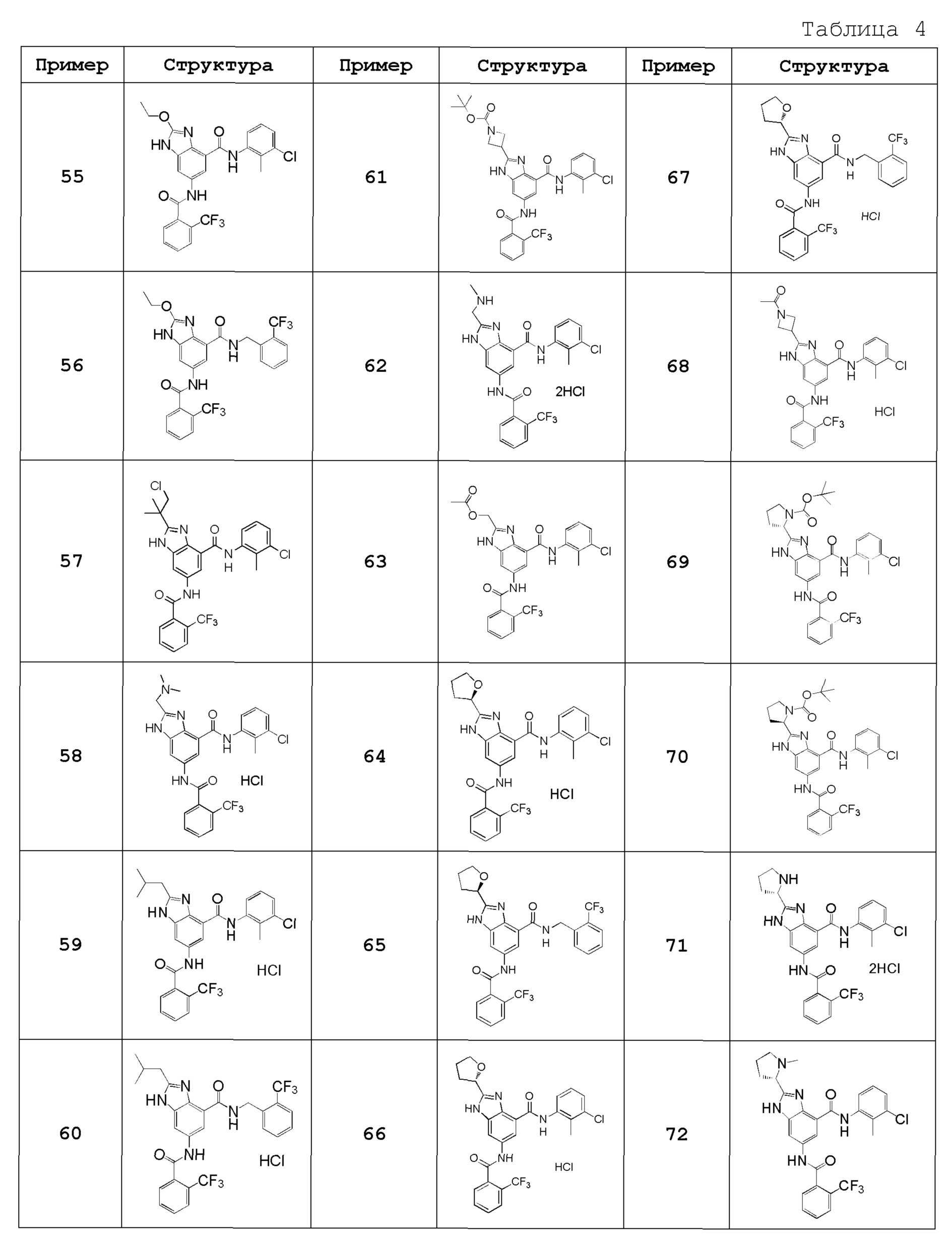
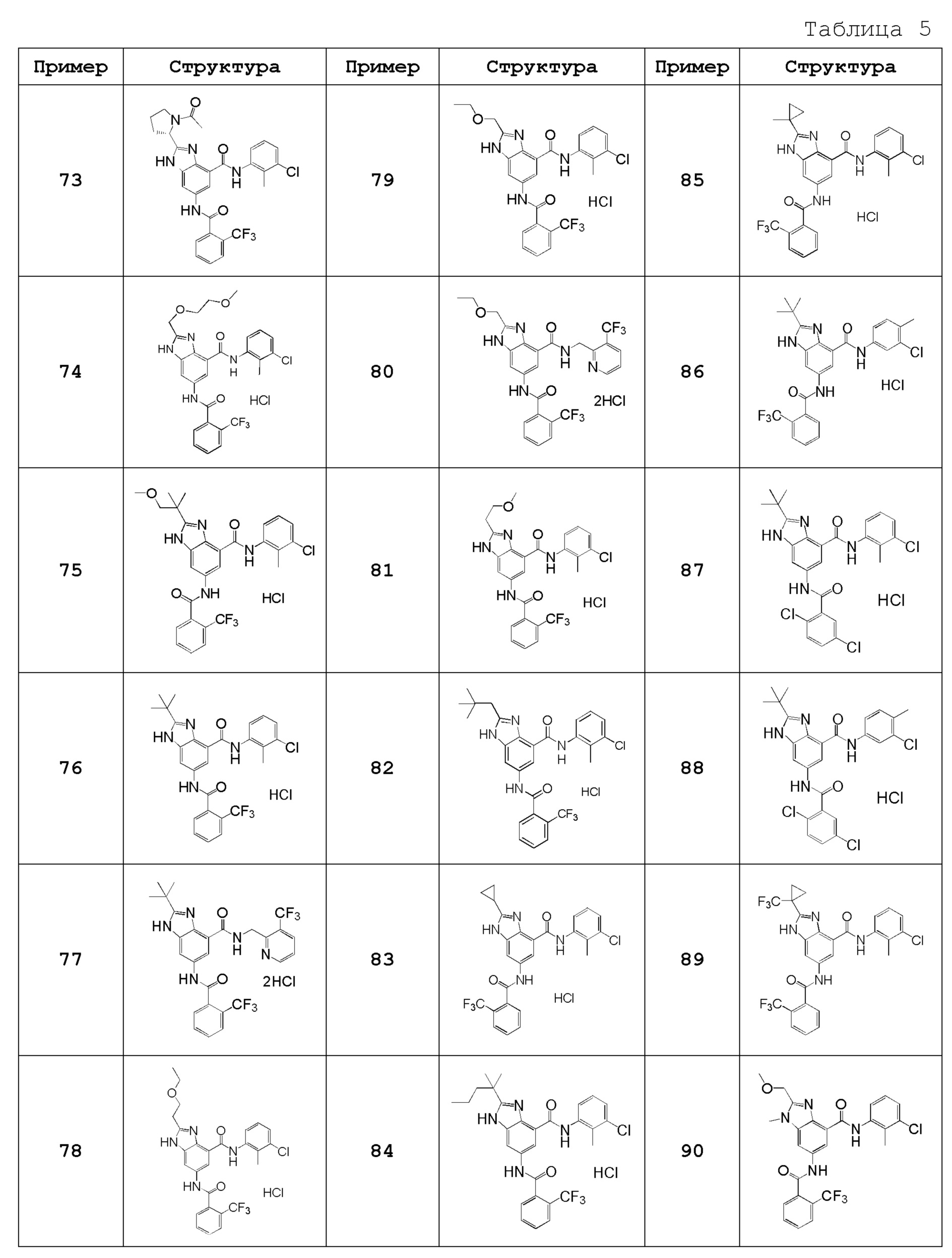
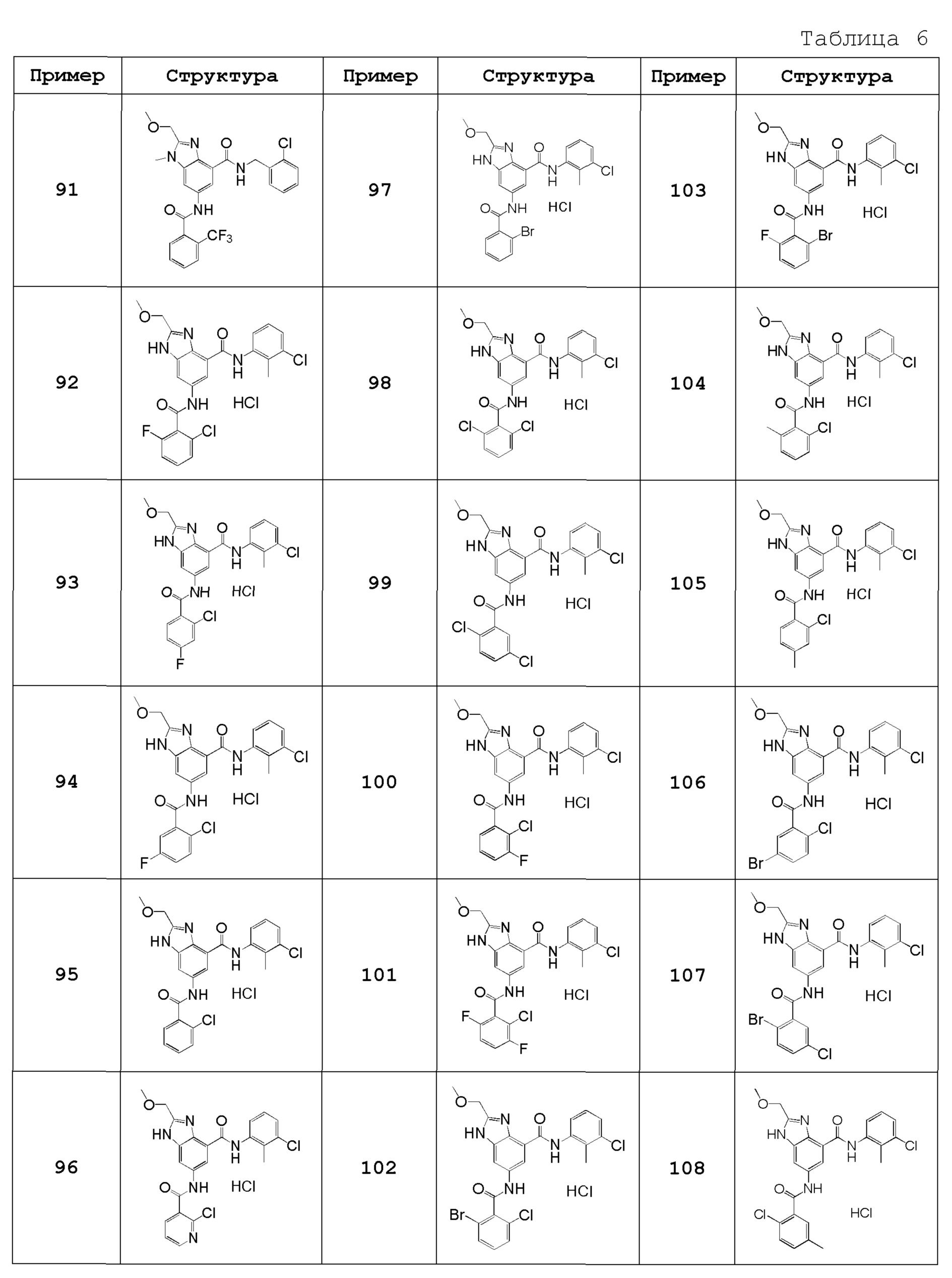
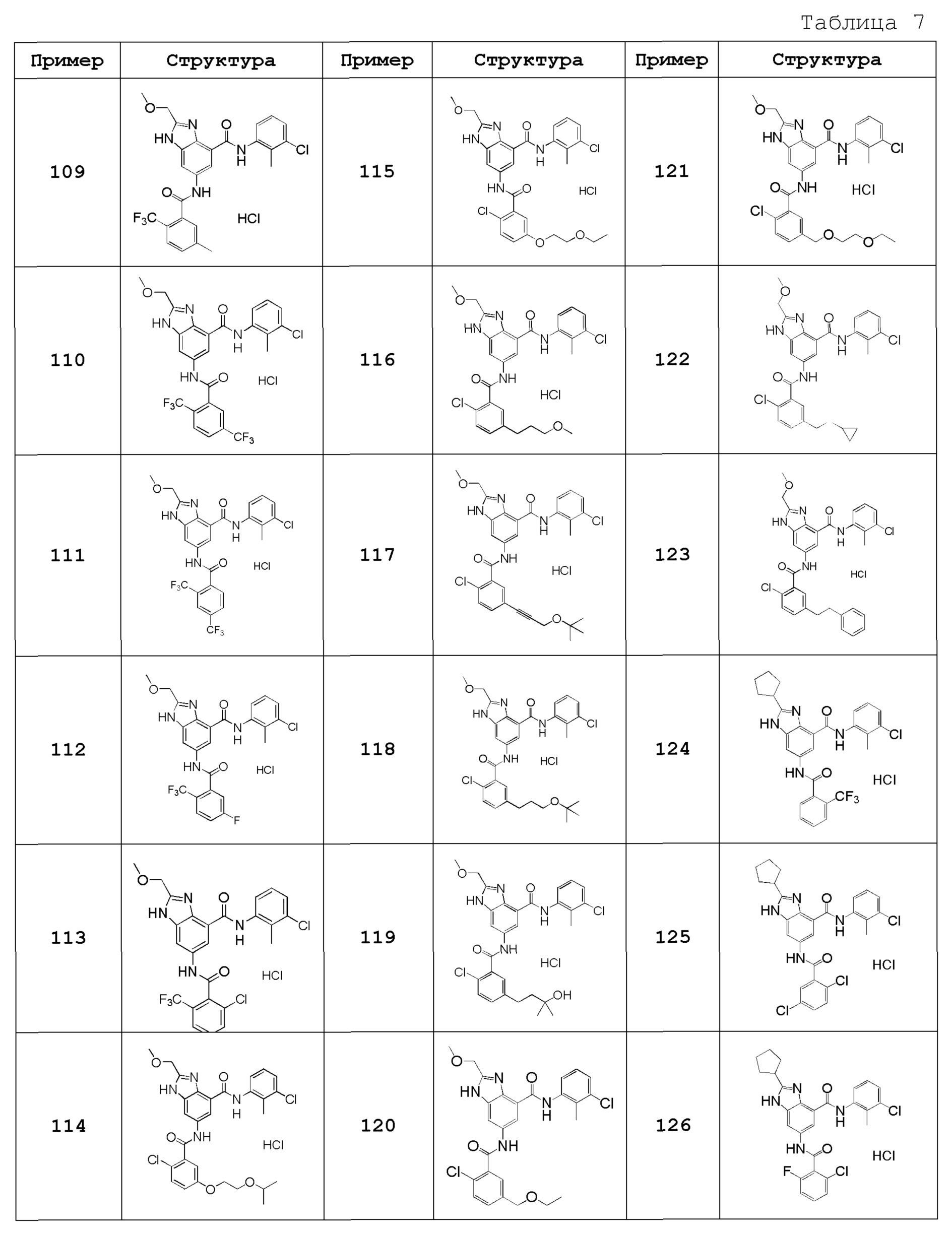
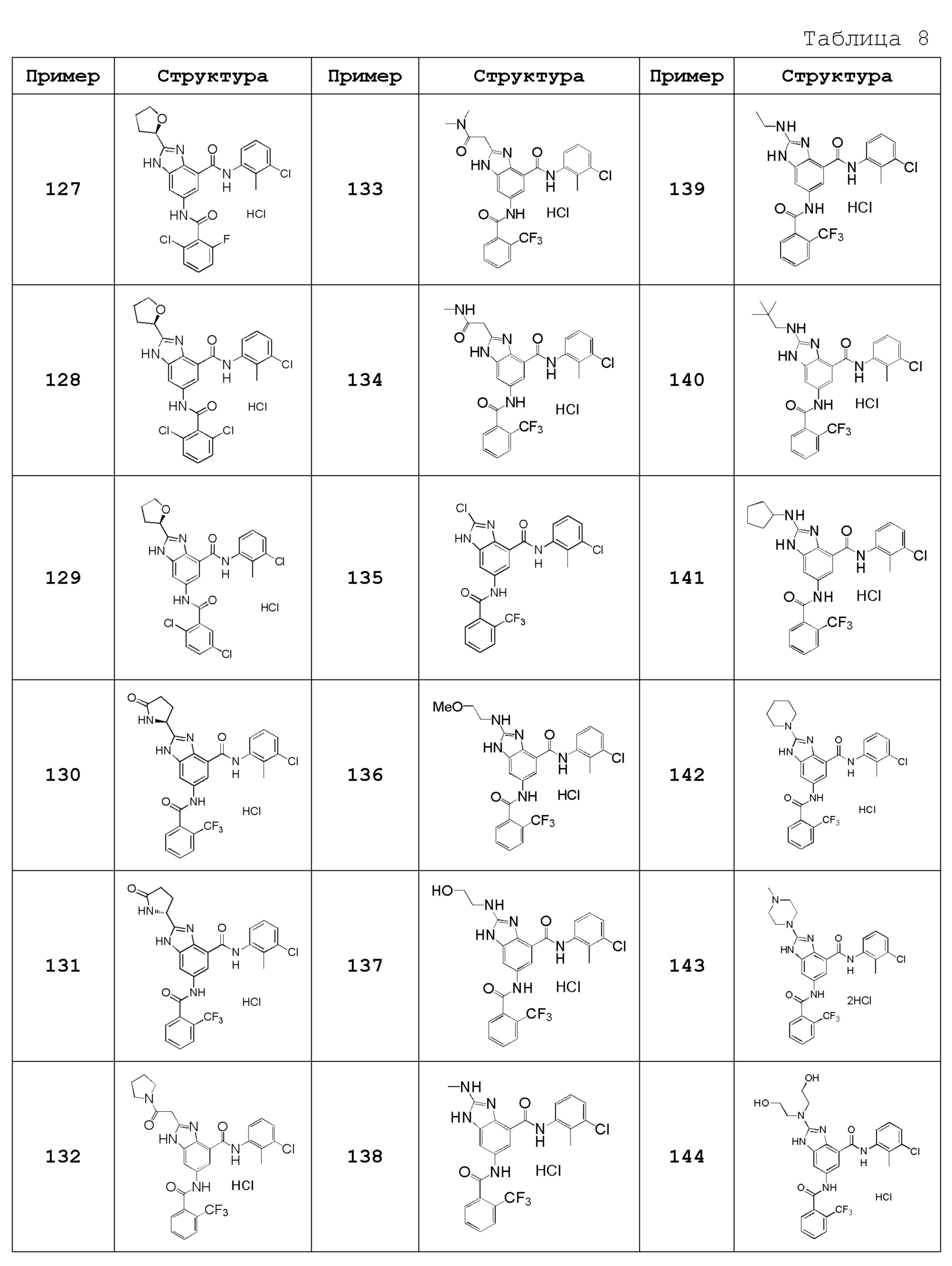
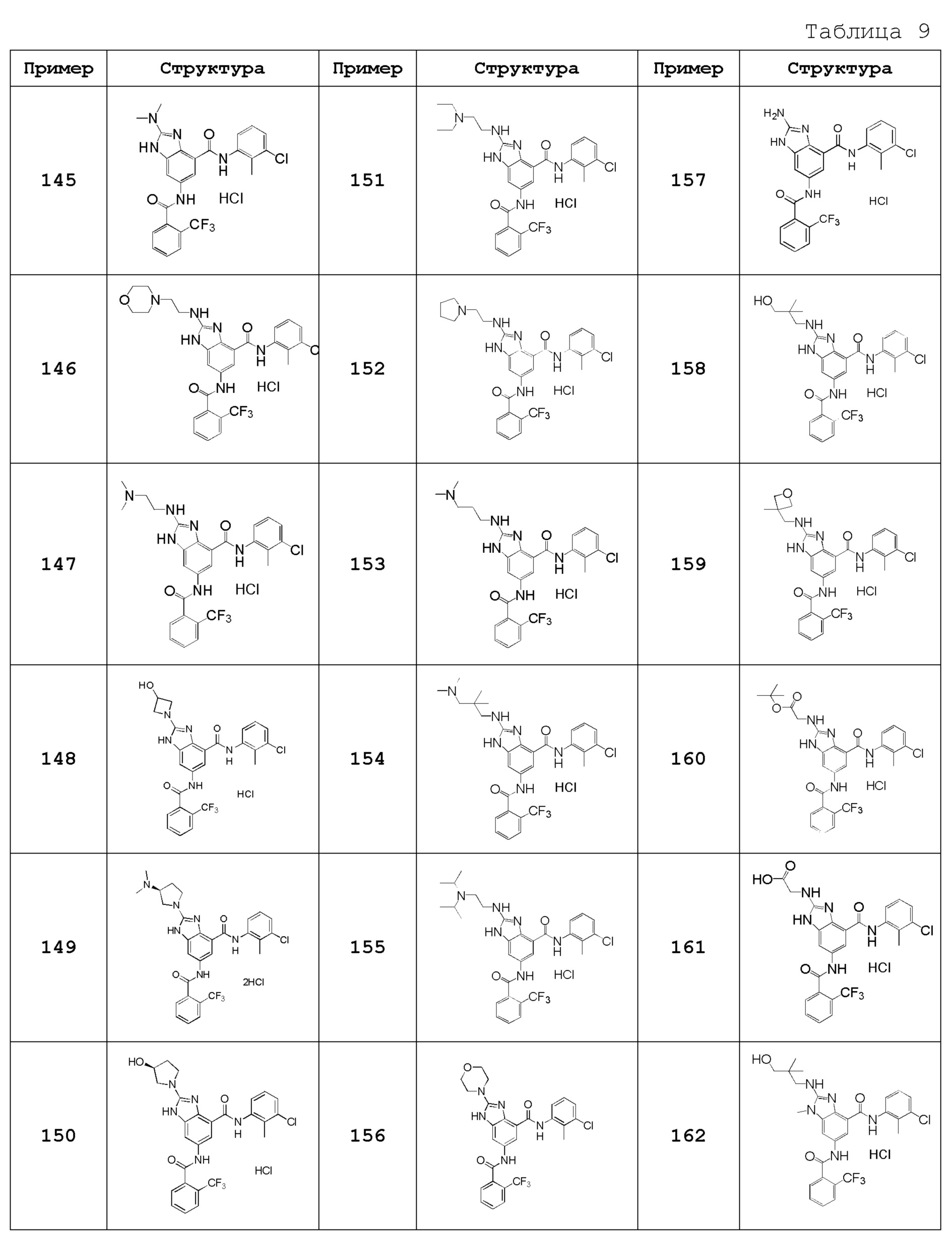
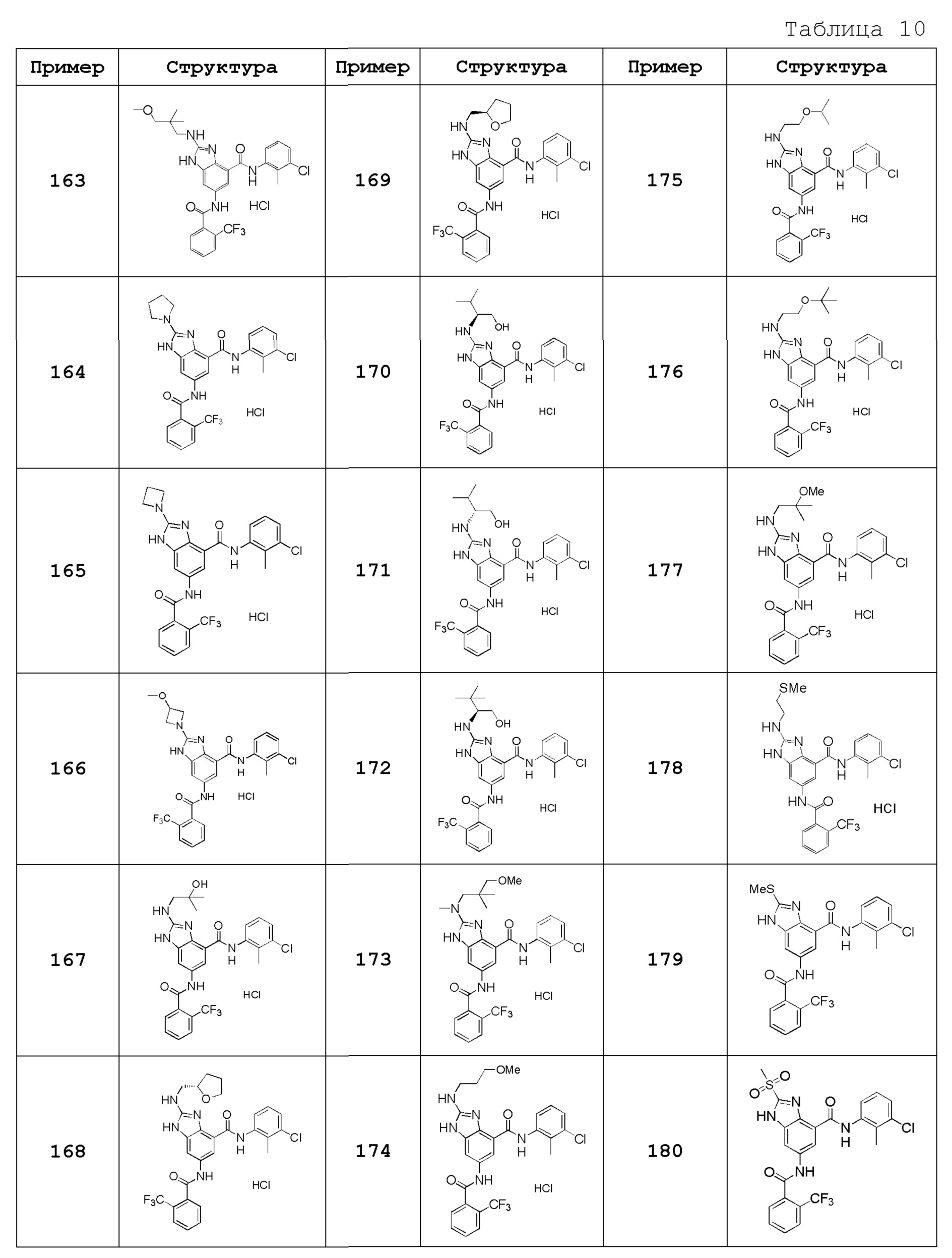
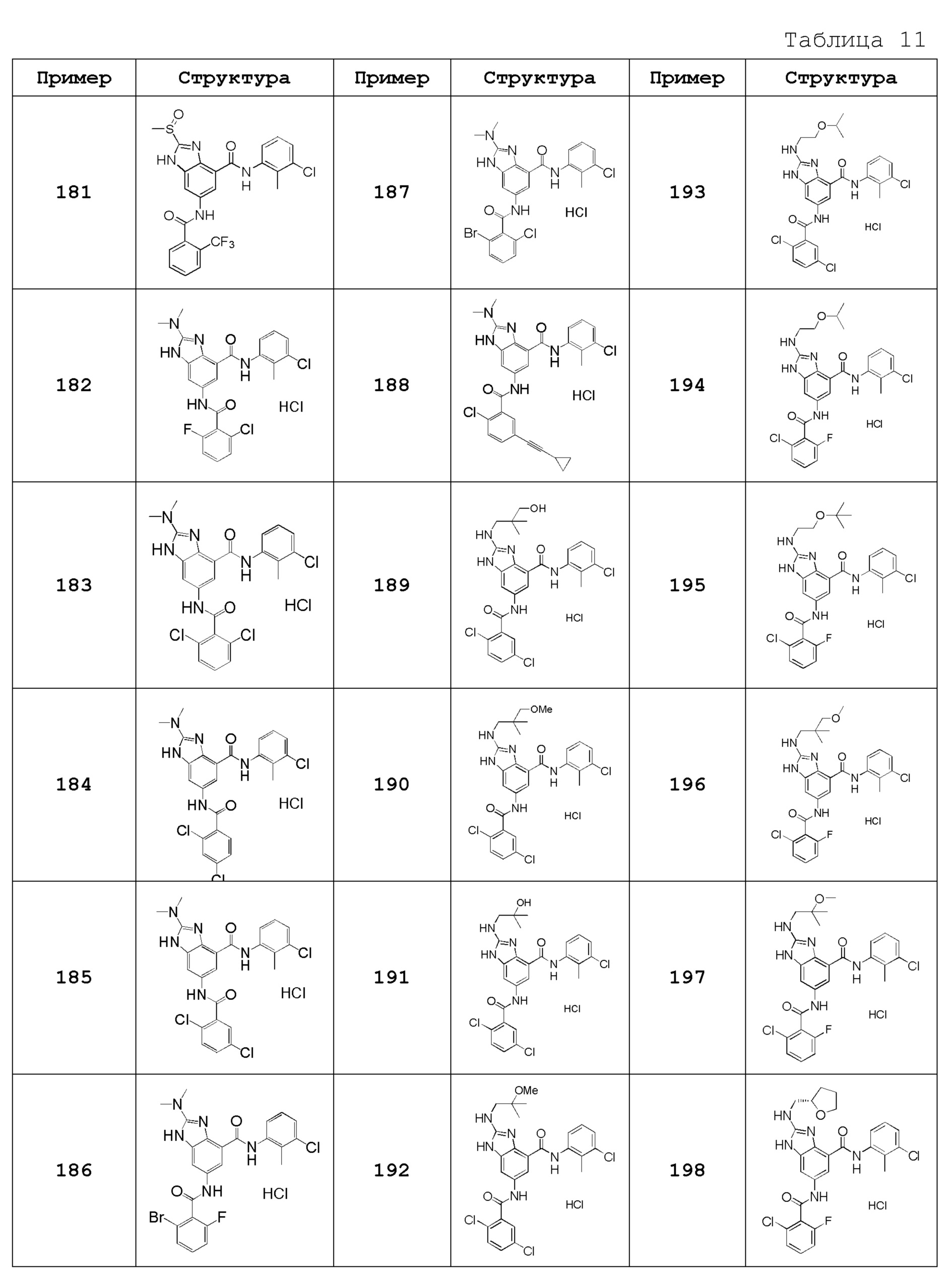
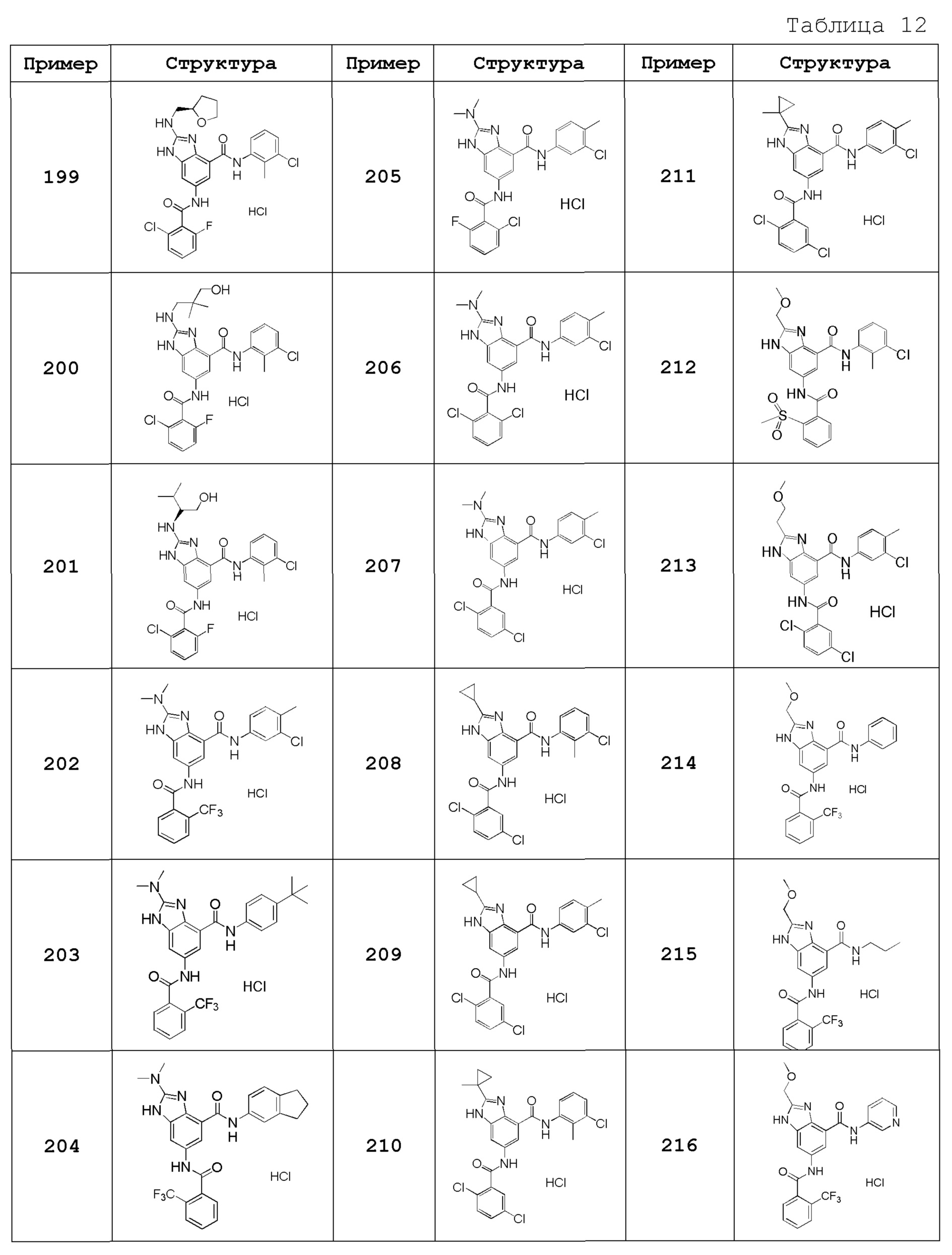
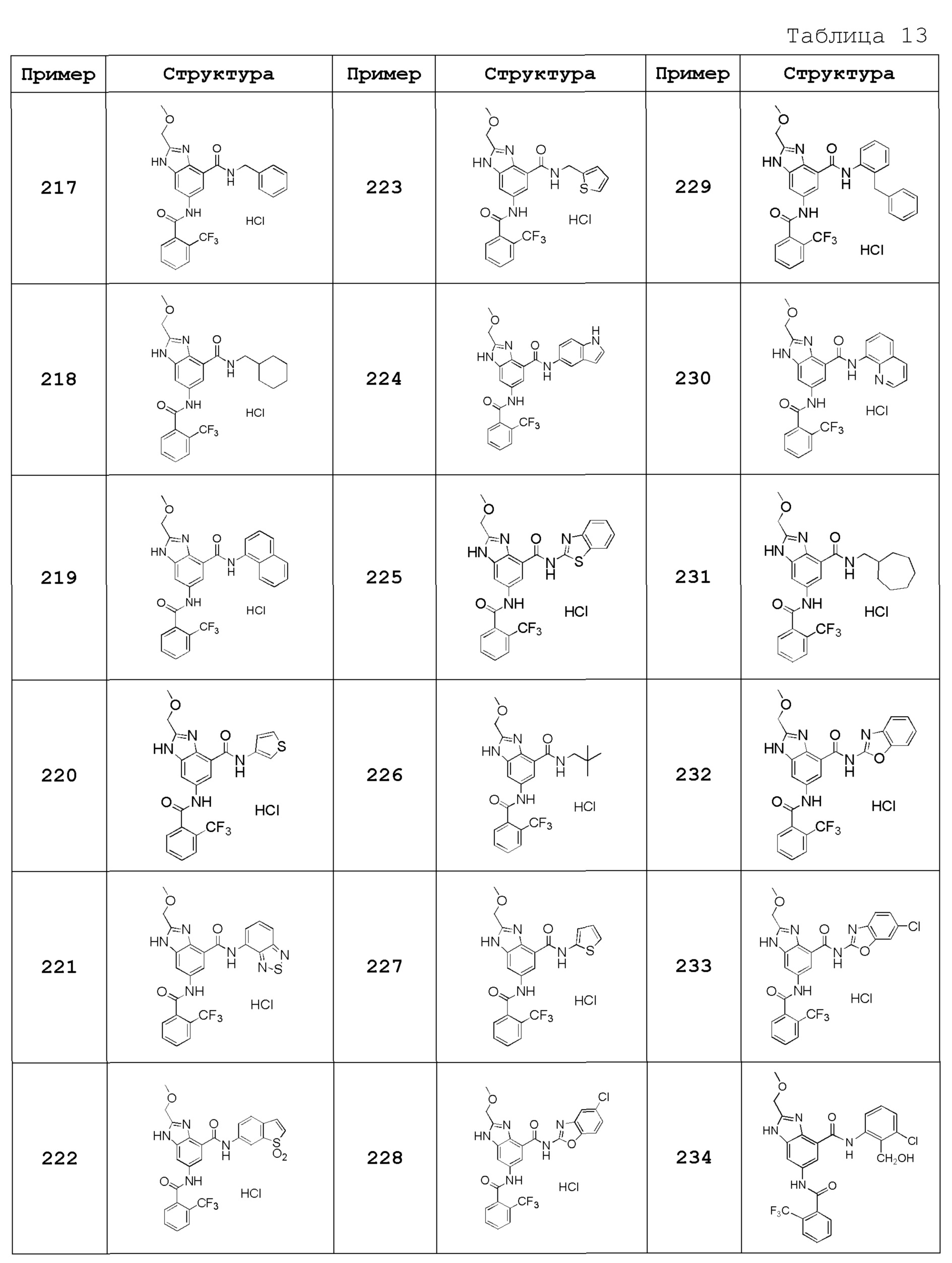
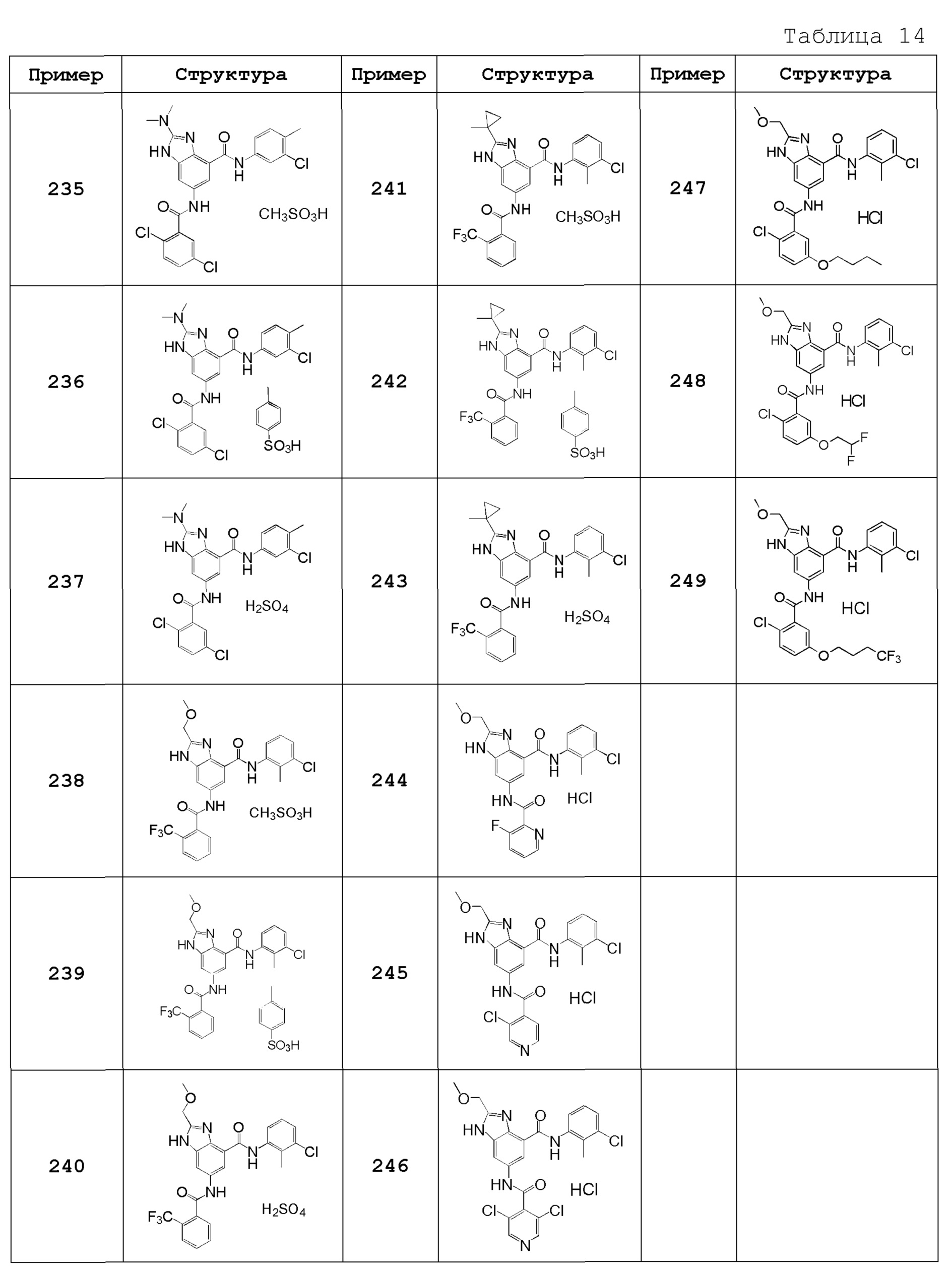
Пример исследования 1: Ингибиторная активность mPGES-1
Микросомальную фракцию mPGES-1 получали из клеток CHO-K1, временно трансфицированных плазмидой, кодирующей mPGES-1cDNA человека. Микросомы разбавляли калий фосфатным буфером, содержащим восстановленный глутатион (pH 7,4), и добавляли DMSO, содержащее тестируемое соединение, или только DMSO, каждый имел конечную концентрацию DMSO, равную 1%, и инкубировали при 4°C в течение 20 минут. Затем ферментативную реакцию инициировали путем добавления субстрата PGH2 (конечная концентрация 1 мкМ) и инкубировали при 4°C в течение 60 секунд. Взаимодействие завершали путем добавления раствора цитрата (конечная концетрация цитрата 50 мМ), содержащего хлорид железа (конечная концентрация 1 мг/мл). Продукцию PGE2 в аликвоте ферментативной реакции измеряли, используя набор HTRF (Cisbio International, номер в каталоге #62P2APEC). Раствор без тестируемого соединения использовали в качестве положительного контроля, и раствор без тестируемого соединения и макросомального образца использовали в качестве отрицательного контроля. 100% активность определяли как продукцию PGE2 в положительном контроле минус продукция PGE2 в отрицательном контроле. Значение IC50 рассчитывали стандартным способом.
Пример исследования 2: Ингибирование PGE2 и продукция PGF2α в клетке A549
Клетки A549 человека высевали в 96-луночный планшет при 2×104 клетки/100 мкл на лунку и оставляли инкубировать в течение ночи. После удаления среды для культивирования и промывки фосфатно-солевым буфером среду для культивирования заменяли средой RPMI для культивирования с 3% FBS, содержащим раствор DMSO, содержащим тестируемое соединение или только DMSO, каждый имел конечную концентрацию DMSO, равную 0,1%. После инкубации в течение 60 минут добавляли IL-1β (5 нг/лунку) и инкубировали при 37°C в течение 24 часов. Затем измеряли PGE2 в среде для культивирования, используя набор HTRF (Cisbio International, номер в каталоге #62P2APEC), и измеряли PGF2α в среде для культивирования, используя набор EIA (Cayman Chemical Company, каталог #516011). Раствор без тестируемого соединения использовали в качестве положительного контроля, и раствор без тестируемого соединения и IL-1β использовали в качестве отрицательного контроля. 100% активность определяли как продукция PGE2 и PGF2α в положительном контроле минус продукция PGE2 и PGF2α в отрицательном контроле. Значение IC50 рассчитывали стандартным способом.
Результаты примера исследования 1 и примера исследования 2 показаны в таблицах 15-18 ("-" означает не проведенный тест).
|
|
|
|
|
|
|
Пример исследования 3: Ингибирование продукции PGE2 в цельной крови человека
Анализ цельной крови человека проводили в соответствии с Brideau et al. (Inflamm. Res., vol.45, p.68, 1996). Венозную кровь добровольцев собирали в отдельные пробирки (содержащие гепарин). Добровольцы не имели клинических проявлений воспаления и не принимали NSAID по меньшей мере за семь суток до сбора крови. Раствор DMSO, содержащий тестируемое соединение или только DMSO, каждый из которых имел конечную концентрацию DMSO 0,25%, добавляли в кровь и инкубировали при 37°C в течение 20 минут. LPS из E.coli (серотип E.coli 0111:B4 разбавляли фосфатно-солевым буфером) добавляли при конечной концентрации 100 мкг/мл и инкубировали при 37°C в течение 24 часов. После ингибирования кровь центрифугировали при 2000 об/мин в течение 5 минут при 4°C, и PGE2 в супернатанте измеряли, используя набор HTRF (Cisbio International, номер в каталоге #62P2APEC). Раствор без тестируемого соединения использовали в качестве положительного контроля, и раствор без тестируемого соединения и LPS использовали в качестве отрицательного контроля. 100% активность определяли как продукция PGE2 в положительном контроле минус продукция PGE2 в отрицательном контроле. Значение IC50 рассчитывали стандартным способом.
Пример исследования 4: Ингибирование продукции PGE2 на модели мышь с воздушным мешком
Воздушный мешок формировали у мышей BALB/c путем подкожной инъекции (два раза с интервалом 3 суток) стерильного воздуха в спину. Через 3 суток после второй инъекции воздуха, в воздушный мешок инъецировали 0,5% зимозан. Через 5 часов в воздушный мешок инъецировали 1 мл фосфатно-солевого буфера, содержащего 10 мкМ индометацина, для промывки внутренней части мешка, и измеряли лейкоциты и PGE2 в жидкости мешка. PGE2 количественно определяли, используя набор HTRF (Cisbio International, номер в каталоге #62P2APEC). Тестируемое соединение суспендировали в растворе 0,5% метилцеллюлозе и вводили перорально за 1 час до инъекции зимозана. Группу, которой вводили только раствор метилцеллюлозы, использовали в качестве контроля для сравнения.
Пример исследования 5: Фармакокинетический анализ у крысы
10 мг/5 мл жидкого тестируемого соединения получали путем суспендирования соединения в 0,5% растворе метилцеллюлозы. Жидкость вводили перорально самкам крысы SD натощак в дозе 10 мг/кг, и кровь собирали из югулярной вены через 1, 2, 4 и 6 часов после введения. Образцы крови центрифугировали для разделения плазмы. После депротеинизации плазмы измеряли концентрацию тестируемого соединения в плазме с помощью ВЭЖХ.
Пример исследования 6: Оценка анальгетического эффекта с использованием модели корчей у мыши
Анальгетический эффект оценивали по поведению, вызванному болью, индуцированной внутрибрюшинной инъекцией 0,6% раствора уксусной кислоты (10 мл/кг) у мыши ddY. Число скрючиваний в течение 20 минут после инъекции уксусной кислоты считали как поведение, вызванное болью. Тестируемое соединение суспендировали в 0,5% растворе метилцеллюлозы и вводили перорально через 1 час после инъекции уксусной кислоты. Группу, которой вводили только раствор метилцеллюлозы, использовали в качестве контроля для сравнения.
Пример исследования 7: Оценка анальгетического эффекта с использованием теста формалина на мыши
Анальгетический эффект оценивали по поведению, вызванному болью, индуцированной инъекцией 5% раствора формалина (0,02 мл/мышь) в подошву правой задней лапы мыши ICR. Продолжительность зализывания через 30 минут после инъекции формалина измеряли как поведение, вызванное болью. Тестируемое соединение суспендировали в 0,5% растворе метилцеллюлозы и вводили перорально за 1 час до инъекции формалина. Группу, которой вводили только раствор метилцеллюлозы, использовали в качестве контроля для сравнения.
Пример исследования 8: Оценка противовоспалительного эффекта на модели крысы с отеком, вызванным каррагенаном
Противовоспалительный эффект оценивали по отеку лапы, вызванному инъекцией 0,5% раствора каррагенана (0,1 мл/крыса) в подошву правой задней лапы крысы SD. Размер лапы измеряли до и через 3 часа после инъекции каррагенана, используя плетизмометр (Unicom Inc., номер в каталоге #TK-105). Размер отека определяли по увеличению размера по сравнению с размером перед инъекцией. Скорость ингибирования определяли как отношение среднего объема отека в группе, получавшей тестируемое соединение, со средним значением отека в контрольной группе. Тестируемое соединение суспендировали в 0,5% растворе метилцеллюлозы и вводили перорально за 1 час до инъекции каррагенана. Группу, которой вводили только раствор метилцеллюлозы, использовали в качестве контроля для сравнения.
Соединение по изобретению или его фармацевтически приемлемая соль показали эффективную ингибиторную активность в отношении mPGES-1 и ингибирование продукции PGE2, как показано в примере исследования 1 и примере исследования 2. Таким образом, оно особенно эффективно в качестве средства для лечения или профилактики воспалительного заболевания кишечника, синдрома раздраженного кишечника, мигрени, головной боли, боли в пояснице, спинального стеноза, грыжи межпозвоночного диска, нарушения височно-нижнечелюстного сустава, шейного синдрома, шейного спондилеза, эндометриоза, аденомиоза, преждевременных родов и угрозы преждевременных родов, дисменореи, гиперактивности мочевого пузыря, ноктурии, интерстициального цистита, нейродегенеративного заболевания, псориаза, ревматоидного артрита, ревматической лихорадки, фибромиалгии, невралгии, комплексного регионального болевого синдрома, фасциальной дисфункции, вирусной инфекции, бактериальной инфекции, микоза, ожога, воспаления и боли после операции, травмы и дентальной экстракции, злокачественной опухоли, атеросклероза, инсульта, подагры, артрита, остеоартрита, юношеского артрита, анкилозирующего спондилита, тендовагинита, окостенения связок, системной красной волчанки, васкулита, панкреатита, нефрита, конъюнктивита, ирита, склерита, увеита, при терапии раны, дерматита, экземы, остеопороза, астмы, хронического обструктивного заболевания легких, легочного фиброза, аллергического заболевания, семейного аденоматозного полипоза, склеродермии, бурсита, лейомиомы матки, простатита и боли при злокачественной опухоли.
Состав 1: 80 мг таблетки для перорального введения
|
Компоненты смешивали и компрессировали с получением таблеток.
Промышленная применимость
Соединение по изобретению или его фармацевтически приемлемая соль обладает ингибирующей активностью в отношении mPGES-1 и, в частности, может использоваться в качестве средства для лечения или профилактики воспалительного заболевания кишечника, синдрома раздраженного кишечника, мигрени, головной боли, боли в пояснице, спинального стеноза, грыжи межпозвоночного диска, нарушения височно-нижнечелюстного сустава, шейного синдрома, шейного спондилеза, эндометриоза, аденомиоза, преждевременных родов и угрозы преждевременных родов, дисменореи, гиперактивности мочевого пузыря, ноктурии, интерстициального цистита, нейродегенеративного заболевания, псориаза, ревматоидного артрита, ревматической лихорадки, фибромиалгии, невралгии, комплексного регионального болевого синдрома, фасциальной дисфункции, вирусной инфекции, бактериальной инфекции, микоза, ожога, воспаления и боли после операции, травмы и дентальной экстракции, злокачественной опухоли, атеросклероза, инсульта, подагры, артрита, остеоартрита, юношеского артрита, анкилозирующего спондилита, тендовагинита, окостенения связок, системной красной волчанки, васкулита, панкреатита, нефрита, конъюнктивита, ирита, склерита, увеита, при терапии раны, дерматита, экземы, остеопороза, астмы, хронического обструктивного заболевания легких, легочного фиброза, аллергического заболевания, семейного аденоматозного полипоза, склеродермии, бурсита, лейомиомы матки, простатита и боли при злокачественной опухоли.