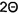СТАБИЛЬНЫЙ КРИСТАЛЛИЧЕСКИЙ МОНОГИДРАТ ЭПИРУБИЦИНА ГИДРОХЛОРИДА И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к стабильному кристаллическому моногидрату эпирубицина гидрохлорида (т.е. 4ʹ-эпидоксорубицина гидрохлорида) и к соответствующему способу получения. В частности, настоящее изобретение относится к кристаллическому моногидрату эпирубицина гидрохлорида с содержанием воды от 2,7% до 3,5% (вес/вес.) и свободному от остаточных растворителей.
УРОВЕНЬ ТЕХНИКИ
Антрациклины представляют собой класс биоактивных соединений природного происхождения, получаемых из бактерий рода Streptomyces. В клинических испытаниях было продемонстрировано, что несколько антрациклинов, включая даунорубицин, идарубицин, доксорубицин, эпирубицин и карминомицин, являются эффективными антинеопластическими агентами, которые могут быть использованы для лечения широкого ряда раковых заболеваний, включая рак груди, рак легкого, а также гемобластозы, такие как лейкозы и лимфомы. Дополнительно было показано, что представители данного класса соединений могут использоваться в трансплантатах костного мозга и во время трансплантации стволовых клеток.
Эпирубицин представляет собой 4-эпимер доксорубицина и полусинтетическое производное даунорубицина, и представлен следующей формулой:
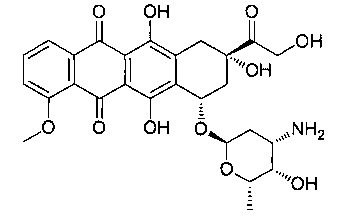
Несмотря на то что точные механизмы его цитотоксичных свойств до конца еще не объяснены, считается, что эпирубицин образует комплексы с ДНК путем интеркаляции своих плоских колец между парами нуклеотидных оснований с последующим ингибированием синтеза нуклеиновой кислоты (ДНК и РНК) и протеинов за счет инициирования расщепления ДНК топоизомеразой II. Эпирубицин и его соли присоединения, такие как эпирубицина гидрохлорид, используются в качестве компонента в лечении рака груди вспомогательными лекарственными средствами.
В настоящее время в данной области техники известны различные способы получения эпирубицина гидрохлорида. Однако обычно считается, что аморфный эпирубицина гидрохлорид (напр., приготовленный так, как описано в патенте США 4,861,870) не подходит для применения в фармации из-за своей значительной гигроскопичности и химической нестабильности во время хранения из-за накопления агликона доксорубицинона.
Определенные кристаллические полиморфные модификации эпирубицина гидрохлорида, охарактеризованные конкретными рентгеновскими дифрактограммами, стали доступными ранее и, среди прочих, описаны в патентных документах: WO 2005/004805 А1; WO 2010/039159 А1; WO 2011/118929 А2 и WO 2012/163508 А1. Хотя разные рентгеновские дифрактограммы имеют определенную схожесть, соответствующие способы получения значительно различаются. В частности, впоследствии было отмечено, что схемы синтеза, описанные в первых двух упомянутых документах, не приводят гарантированно к образованию кристаллического продукта (см. также WO 2012/163508 А1; параграфы [0007] и [0069]), и, в частности, продукта, имеющего равномерное распределение по размерам частиц, что считается ключевым аспектом для фармацевтического применения.
Отмечено, что кристаллические полиморфные модификации эпирубицина гидрохлорида, описанные в WO 2005/004805 А1 и WO 2010/039159 А1 (обозначено как “тип II”), а также в WO 2011/118929 А2 (обозначено с “форма А” по “форма D”), проявляют некоторую термическую стабильность при хранении до шести месяцев.
Однако несколько способов получения, используемых в патентных документах, упомянутых выше, включают использование значительного количества растворителей. В области техники хорошо известно, что антрациклины образуют сольваты (см., напр., Courseille, С. et al. (1979) Acta Cryst. В35, 764-767). Известно, что Taidie сольваты проявляют улучшенную термическую стабильность по сравнению с соответствующим “чистым” соединением. В схемах получения, ссылки на которые приведены выше, проблема образования сольватов не решена. Таким образом, не вполне ясно, может ли термическая стабильность, наблюдаемая для вышеупомянутых полиморфных модификаций эпирубицина гидрохлорида, быть фактически присуща (чистому) соединению как таковому, или она вызвана образованием сольватов (т.е. присутствием остаточных растворителей в конечном продукте).
Кроме того, также очевидно, что содержание сольватов труднее контролировать из-за их гигроскопических свойств, т.к. сольваты имеют повышенную склонность поглощать воду. Присутствие остаточных растворителей (по меньшей мере в легко обнаруживаемых количествах), по-видимому, также влияет на безопасность продукта (см., среди прочего, руководство Международной конференции по гармонизации технических требований к регистрации фармацевтических продуктов, предназначенных для применения человеком Q3C (R5) [ICH, International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use] Guideline Q3C (R5)). Например, получение кристаллических форм A, C и D, согласно WO 2011/118929 А2, включает применение растворителей 2 класса (по классификации ICH), таких как ацетонитрил и N,N-диметилформамид, использование которых в фармацевтических продуктах нужно ограничивать из-за присущей им токсичности.
Таким образом, до сих пор существует потребность в кристаллической форме эпирубицина гидрохлорида, которая лишена вышеупомянутых недостатков, в частности, относящихся к однородности, долговременной стабильности и безопасности продукта.
В частности, сохраняется необходимость в соединении, которое имеет улучшенную термическую стабильность и увеличенный срок годности, в то же время также обладает пониженной гигроскопичностью (т.е. стабильностью по отношению к воде) и по существу свободно от остаточных растворителей.
Соответственно, задачей настоящего изобретения является обеспечение такой кристаллической формы эпирубицина гидрохлорида, а также соответствующего способа ее получения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к способу получения кристаллического моногидрата эпирубицина гидрохлорида, включающему: (а) добавление по меньшей мере первого растворителя и по меньшей мере второго растворителя к эпирубицина гидрохлориду, где первый растворитель представляет собой линейный или разветвленный С4-С5 спирт, а второй растворитель представляет собой линейный или разветвленный С2-С3 спирт; (b) доведение содержания воды в растворе, полученном на стадии (а), до количества в диапазоне от 7% до 12% (вес/вес); и (с) нагревание раствора, полученного на стадии (b), до температуры от 70°C до 90°C для того, чтобы обеспечить кристаллизацию; где полученный кристаллический моногидрат имеет содержание воды в диапазоне от 2,7% до 3,5% (вес/вес.) и свободен от остаточных растворителей.
Согласно предпочтительным вариантам реализации содержание воды на стадии (b) данного способа доведено до количества в диапазоне от 8% до 11% (вес/вес).
Согласно более предпочтительным вариантам реализации первый растворитель выбран из группы, состоящей из 1-бутанола, 2-бутанола, изобутанола, трет-бутанола и их смесей; и второй растворитель выбран из группы, состоящей из 1-пропанола, изопропанола, этанола и их смесей. Особенно предпочтительно, первый растворитель представляет собой 1-бутанол, и второй растворитель представляет собой 1-пропанол.
Согласно отдельным вариантам реализации объемное отношение первого растворителя к второму растворителю находится в диапазоне от 1:1 до 2:1 (в объемном отн.).
Согласно другим отдельным вариантам реализации конечная концентрация эпирубицина гидрохлорида в растворе со стадии (b) находится в диапазоне от 10 г/л до 100 г/л.
Согласно предпочтительным вариантам реализации раствор на стадии (с) нагревают до температуры от 75°C до 85°C.
Согласно особым вариантам реализации способ дополнительно включает введение затравки в раствор, полученный на стадии (b), для того чтобы вызвать кристаллизацию.
Согласно другим особым вариантам реализации способ дополнительно включает очистку кристаллов, полученных на стадии (с).
Согласно предпочтительным вариантам реализации содержание воды в полученном кристаллическом моногидрате эпирубицина гидрохлорида находится в диапазоне от 2,8% до 3,3% (вес/вес).
В другом аспекте настоящее изобретение относится к кристаллическому моногидрату эпирубицина гидрохлорида, полученному согласно способу, описанному в данном документе выше.
Согласно предпочтительным вариантам реализации размер по меньшей мере 60%, и в частности по меньшей мере 80% полученных кристаллических частиц находится в диапазоне, имеющем вид: средний диаметр ±10%.
Согласно другим предпочтительным вариантам реализации средний диаметр полученных кристаллических частиц находится в диапазоне от 20 мкм до 50 мкм.
Согласно отдельным вариантам реализации кристаллический моногидрат эпирубицина гидрохлорида дополнительно охарактеризован одним или и тем, и другим из группы, состоящей из: порошковой рентгеновской дифрактограммы, включающей пики при средних углах дифракции (2Θ) 5,1°, 9,1°, 13,6°, 22,1°, 22,5° и 24,0° (каждый ±0,2°), и термостабильности, составляющей менее 0,5% (вес/вес.) доксорубицинона, образовавшегося после инкубации при 100°C в течение одного месяца, согласно руководству ICH.
Дополнительный аспект настоящего изобретения относится к кристаллическому моногидрату эпирубицина гидрохлорида, как описано выше в настоящем документе, для применения для предотвращения и лечения рака.
КРАТКОЕ ОПИСАНИЕ ФИГУР
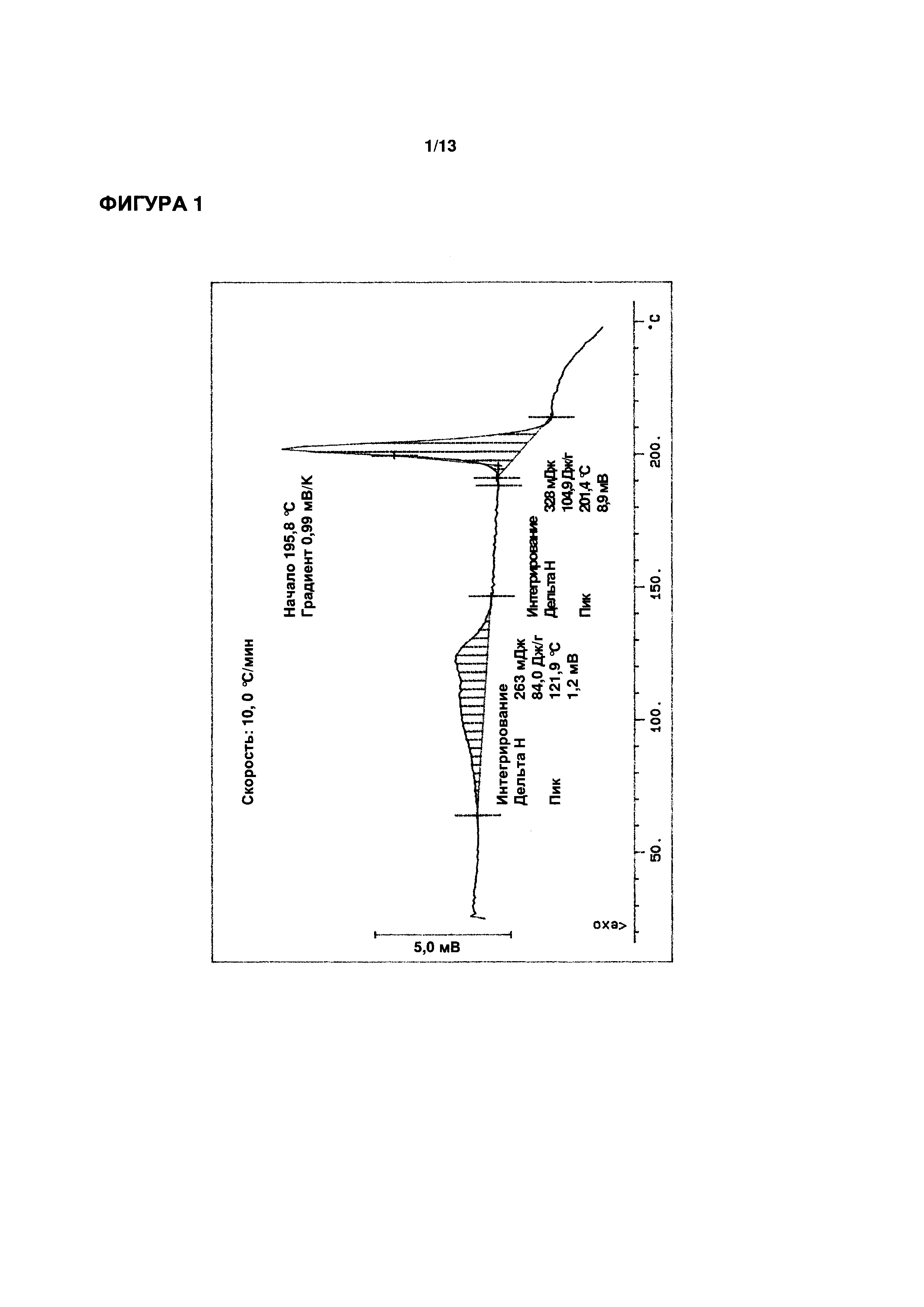
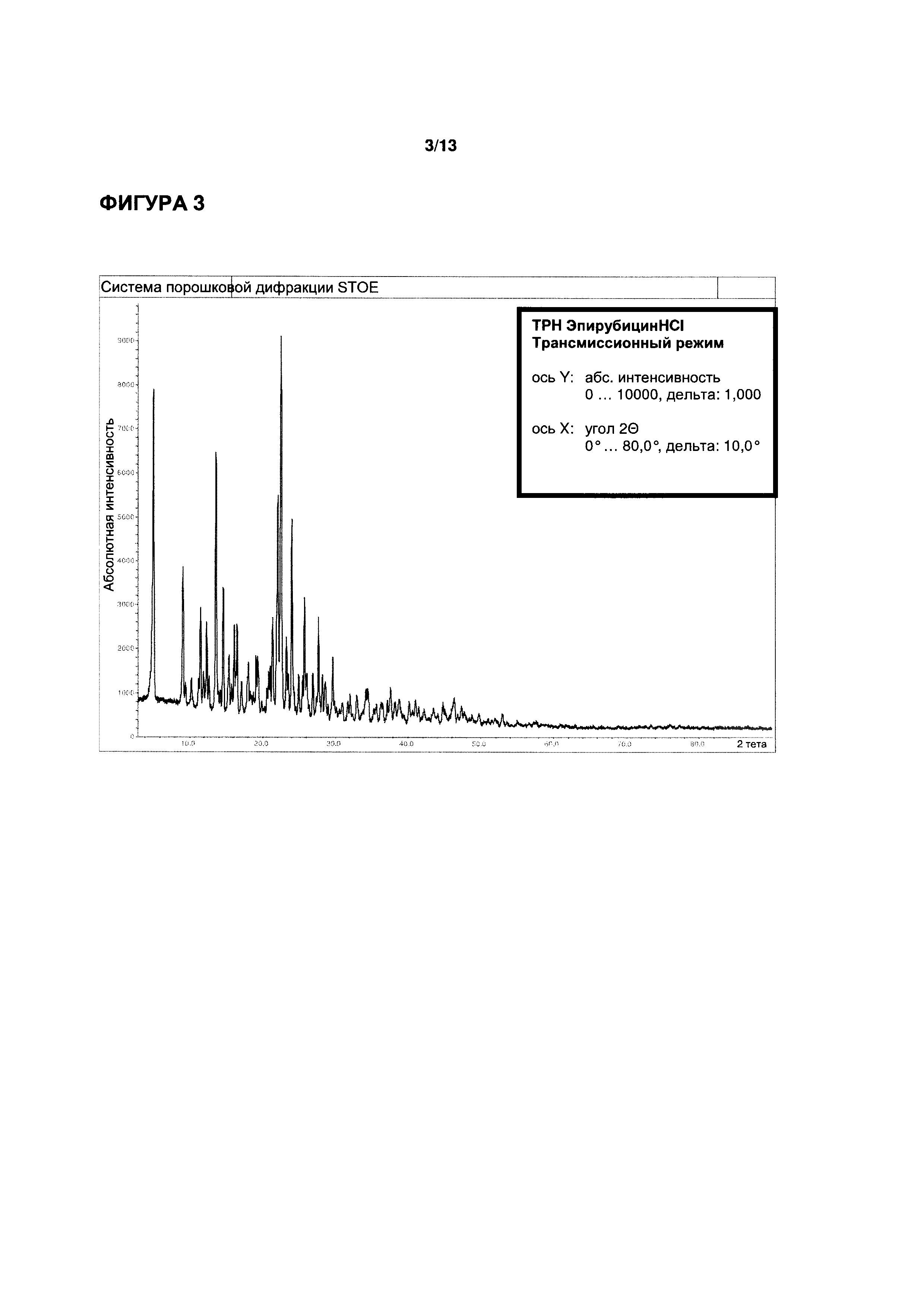
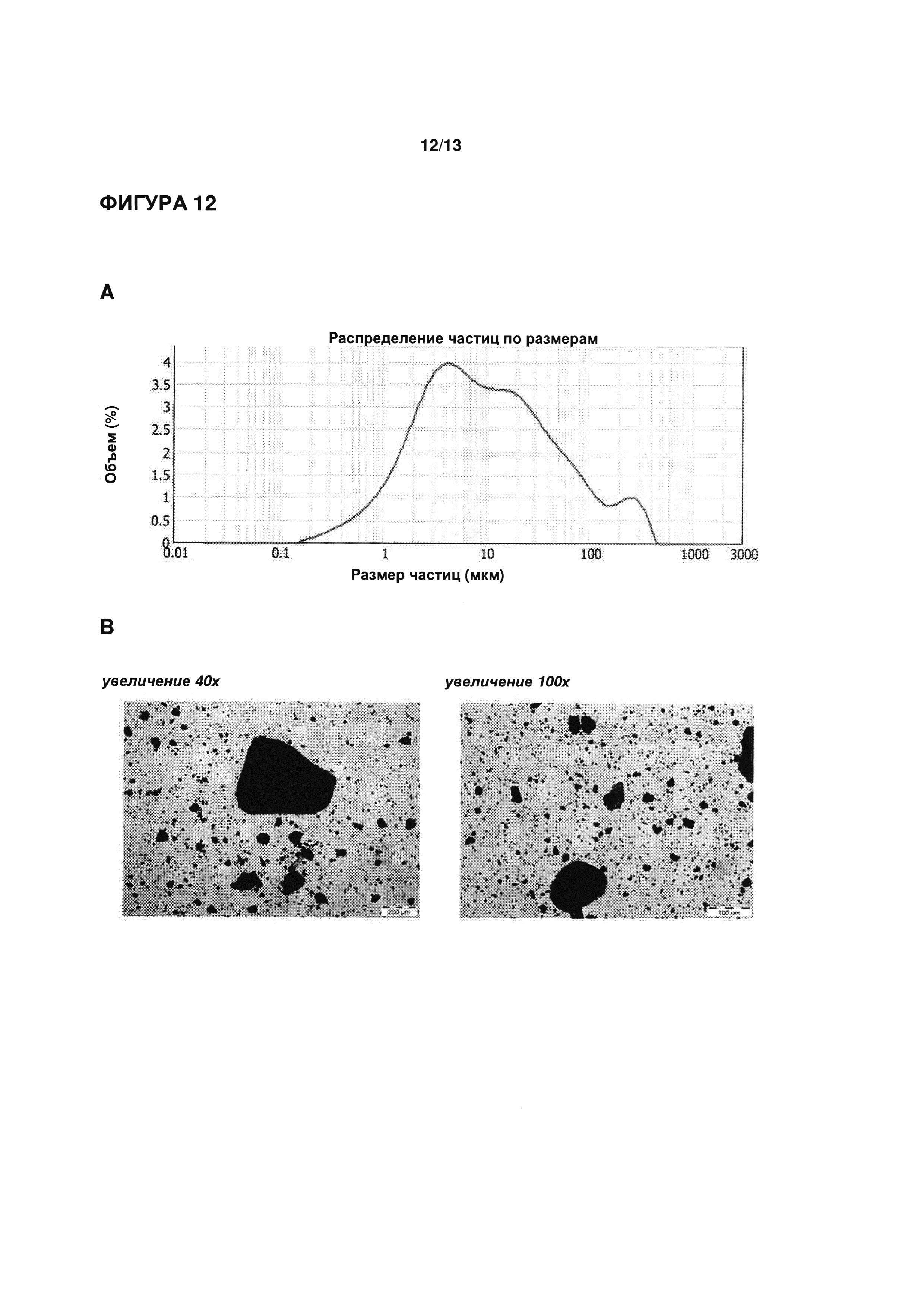
ФИГУРЫ 1-3 иллюстрируют определение функциональных параметров приводимого в качестве примера кристаллического моногидрата эпирубицина гидрохлорида согласно настоящему изобретению, полученного согласно Примеру 1. На ФИГ. 1 показаны результаты репрезентативного анализа дифференциальной сканирующей калориметрии для определения точки плавления; на ФИГ. 2 показаны результаты репрезентативного термогравиметрического анализа для определения содержания воды; и на ФИГ. 3 показаны результаты репрезентативного исследования методом рентгеновской порошковой дифрактометрии.
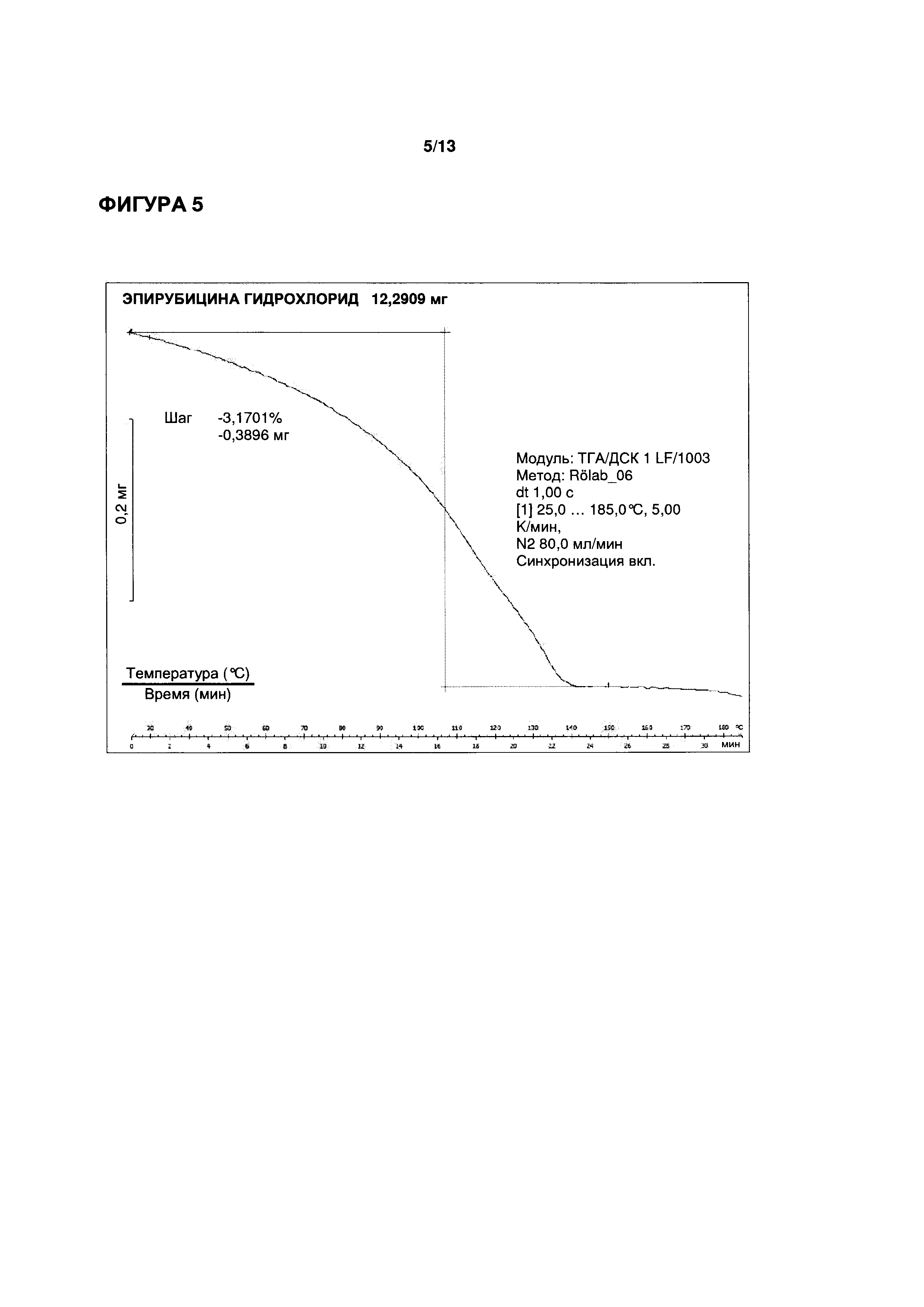
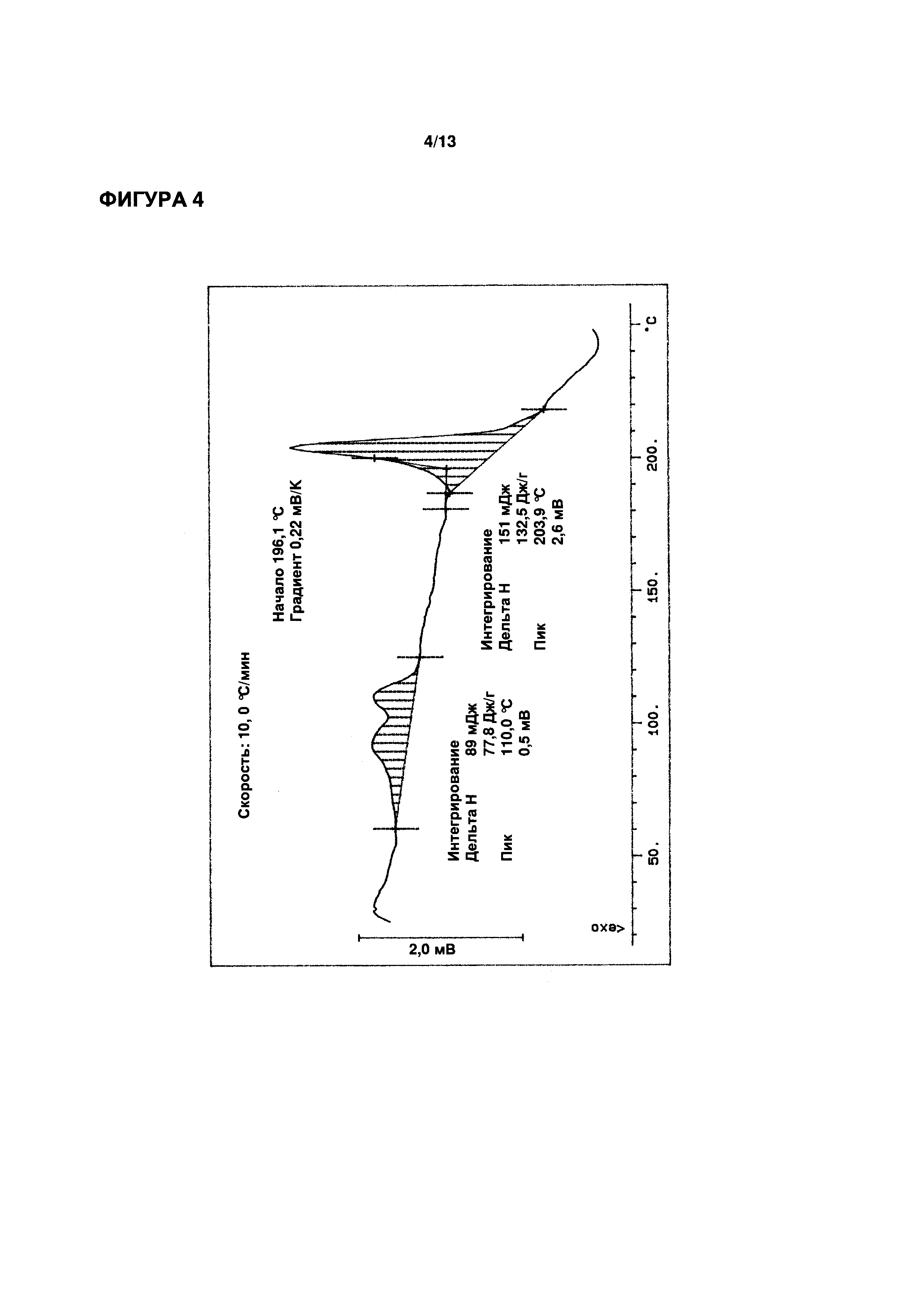
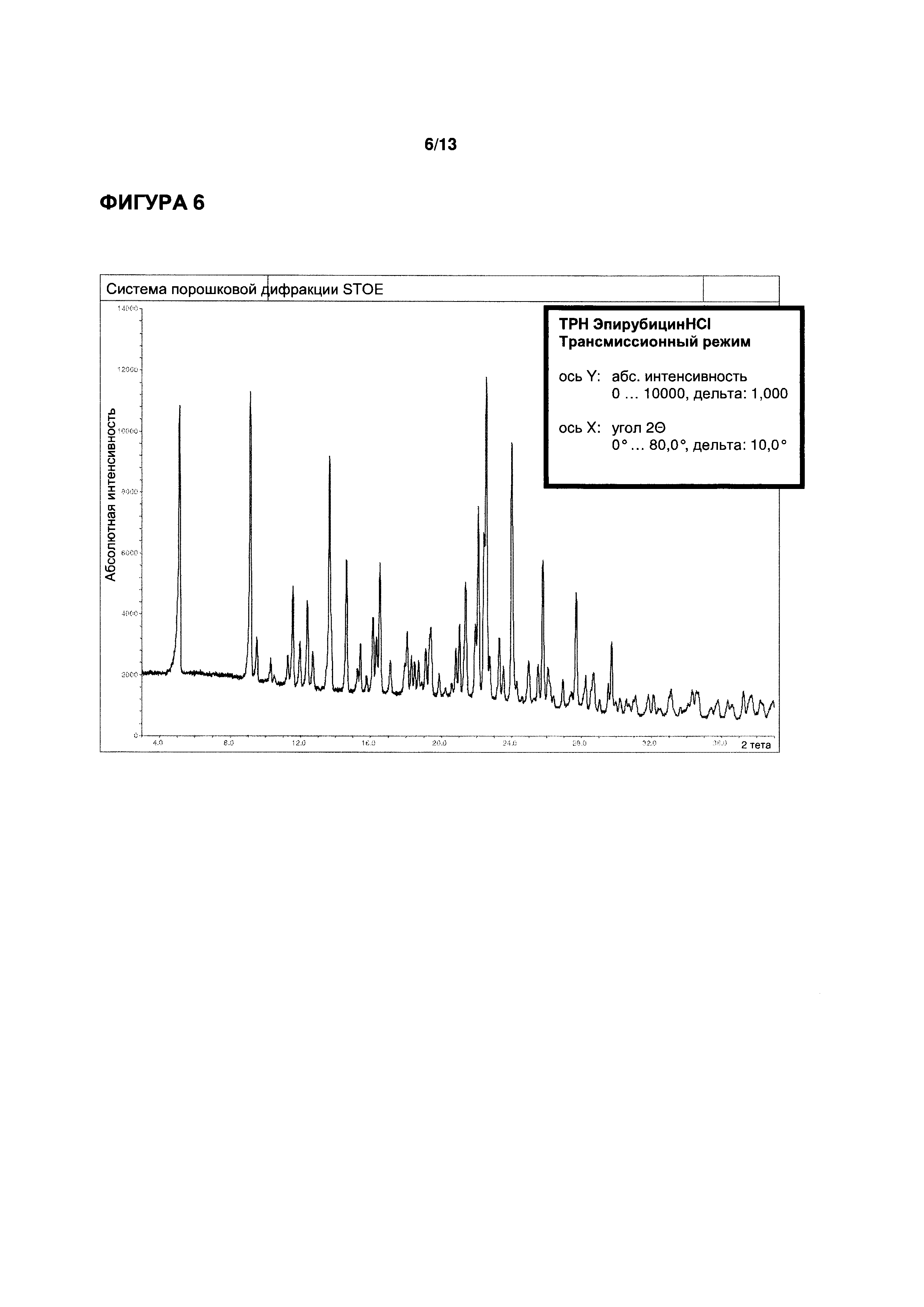
ФИГУРЫ 4-6 иллюстрируют определение функциональных параметров приводимого в качестве примера кристаллического моногидрата эпирубицина гидрохлорида согласно настоящему изобретению, полученного согласно Примеру 2. На ФИГ. 4 показаны результаты репрезентативного анализа дифференциальной сканирующей калориметрии для определения точки плавления; на ФИГ. 5 показаны результаты репрезентативного термогравиметрического анализа для определения содержания воды; и на ФИГ. 6 показаны результаты репрезентативного исследования методом рентгеновской порошковой дифрактометрии.
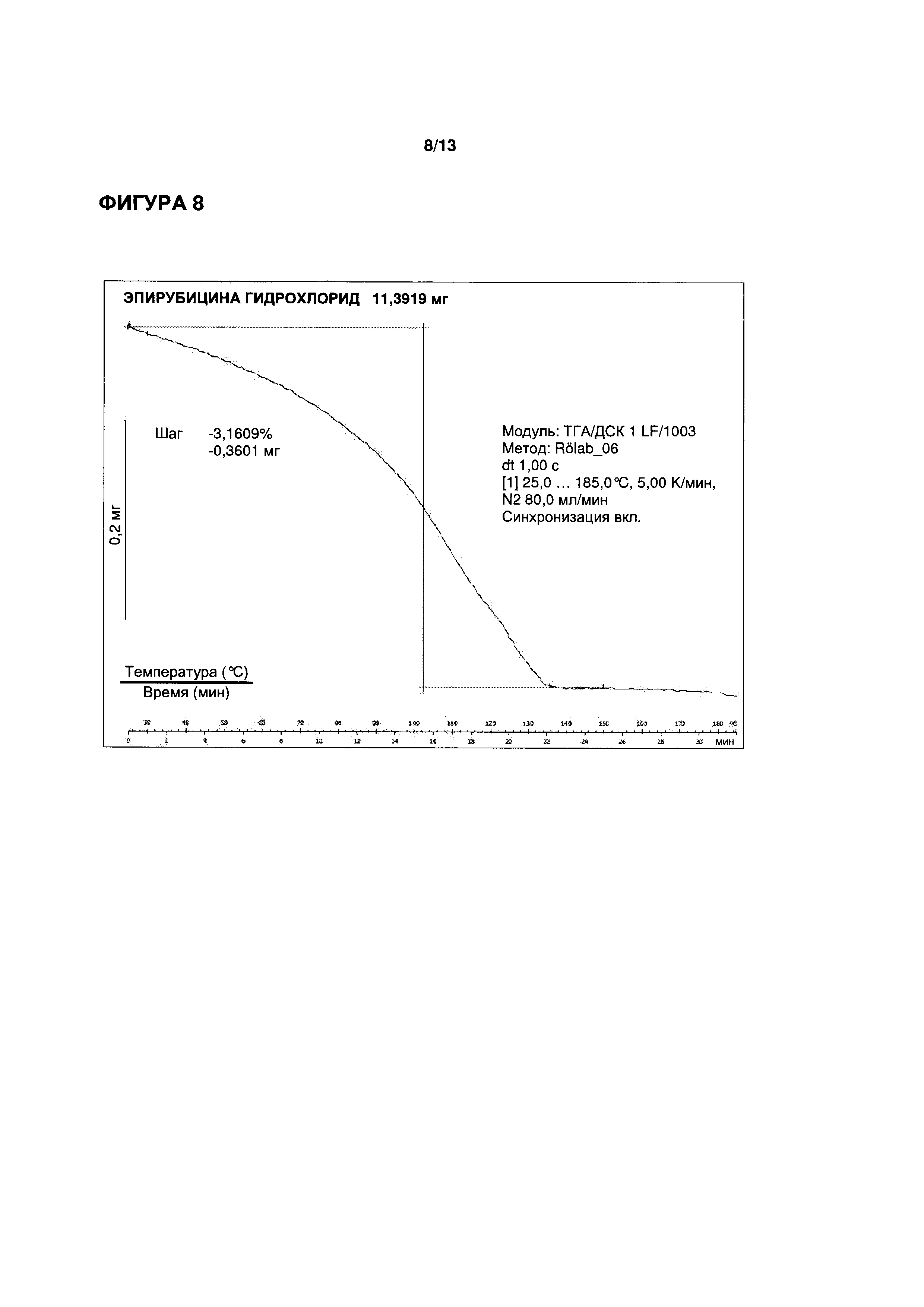
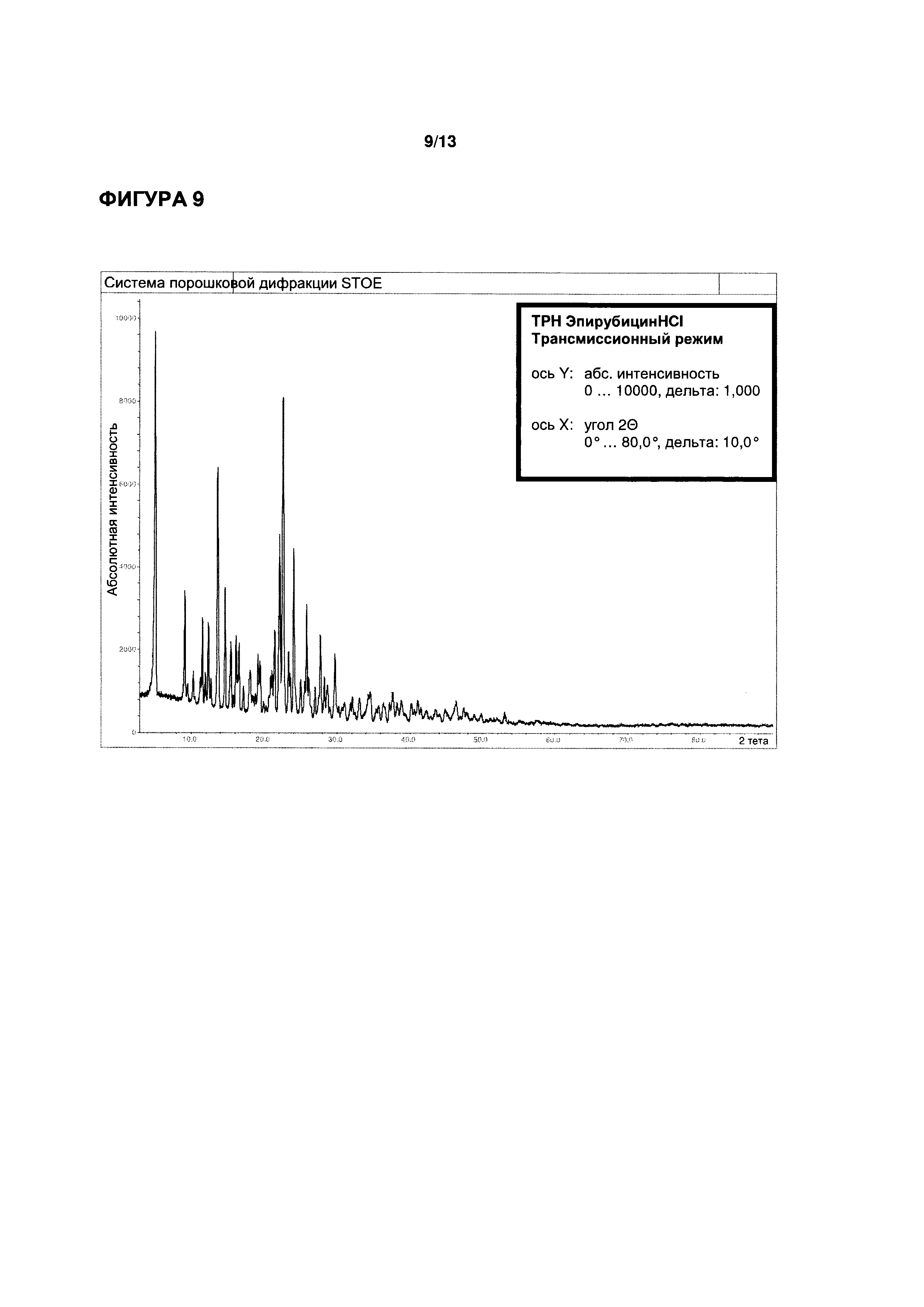
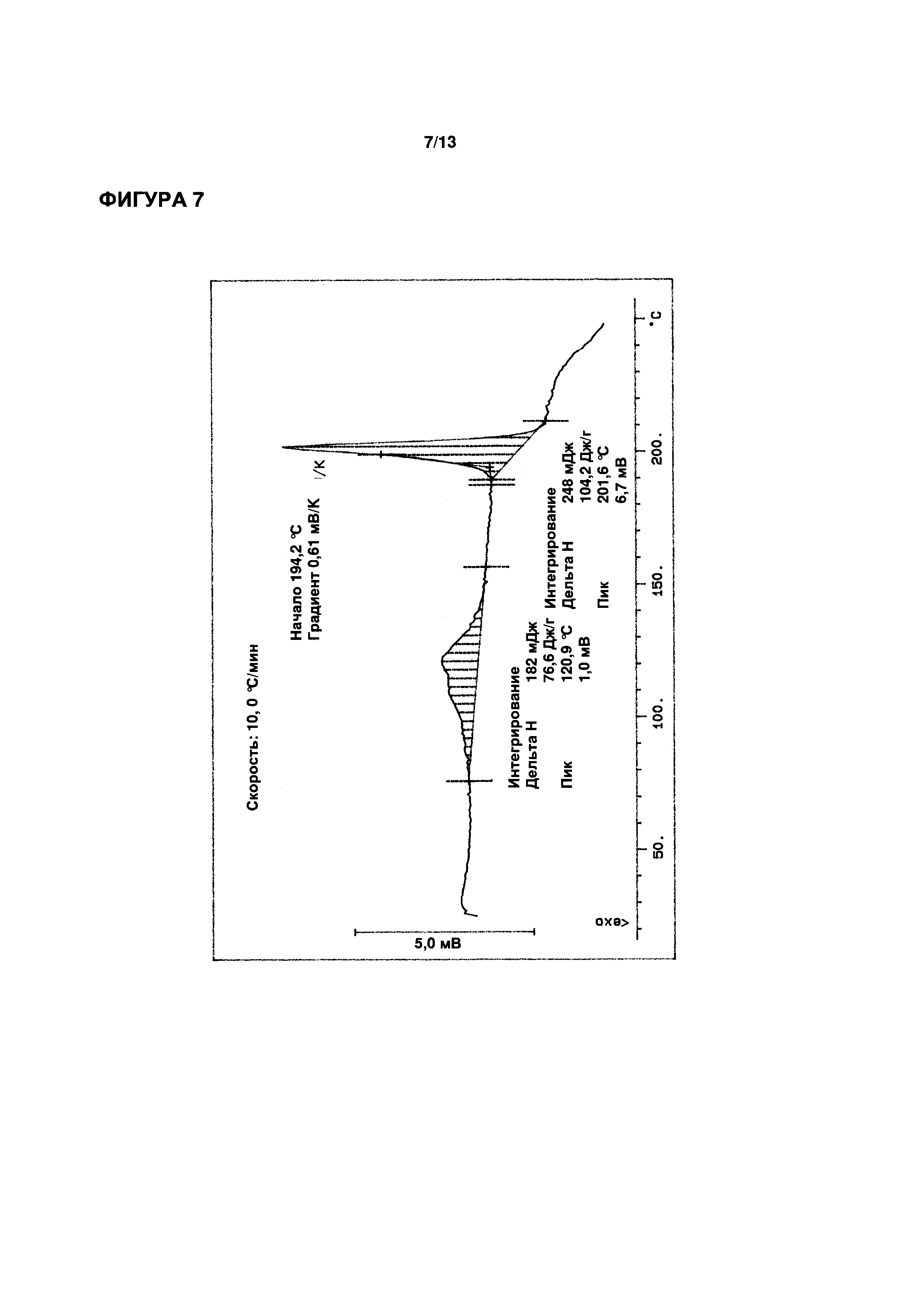
ФИГУРЫ 7-9 иллюстрируют определение функциональных параметров приводимого в качестве примера кристаллического моногидрата эпирубицина гидрохлорида согласно настоящему изобретению, полученного согласно Примеру 3. На ФИГ. 7 показаны результаты репрезентативного анализа дифференциальной сканирующей калориметрии для определения точки плавления; на ФИГ. 8 показаны результаты репрезентативного термогравиметрического анализа для определения содержания воды; и на ФИГ. 9 показаны результаты репрезентативного исследования методом рентгеновской порошковой дифрактометрии.
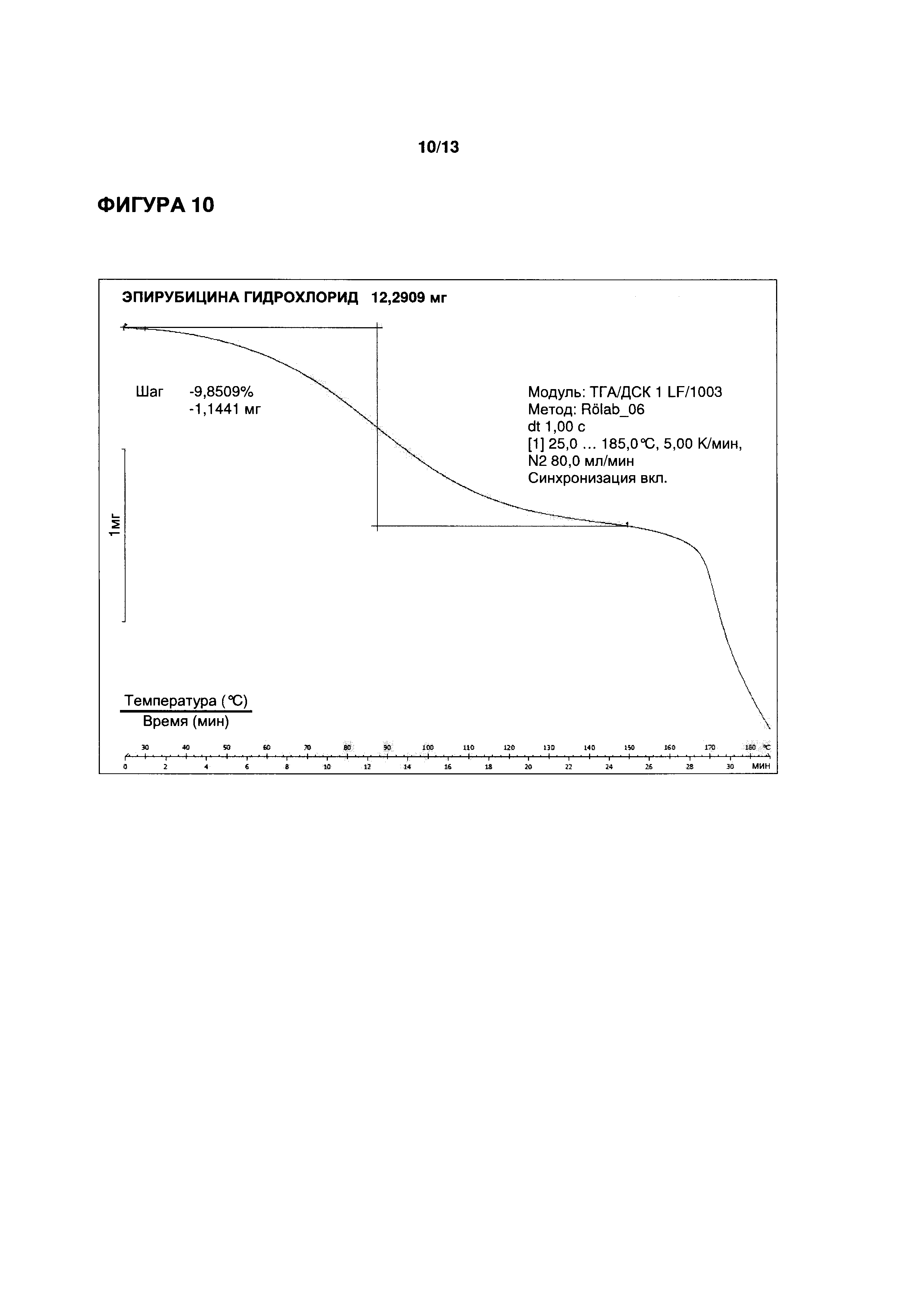
ФИГУРА 10 иллюстрирует репрезентативное термогравиметрическое исследование для определения содержания воды в кристаллическом тригидрате эпирубицина гидрохлорида, полученном согласно Примеру 3.
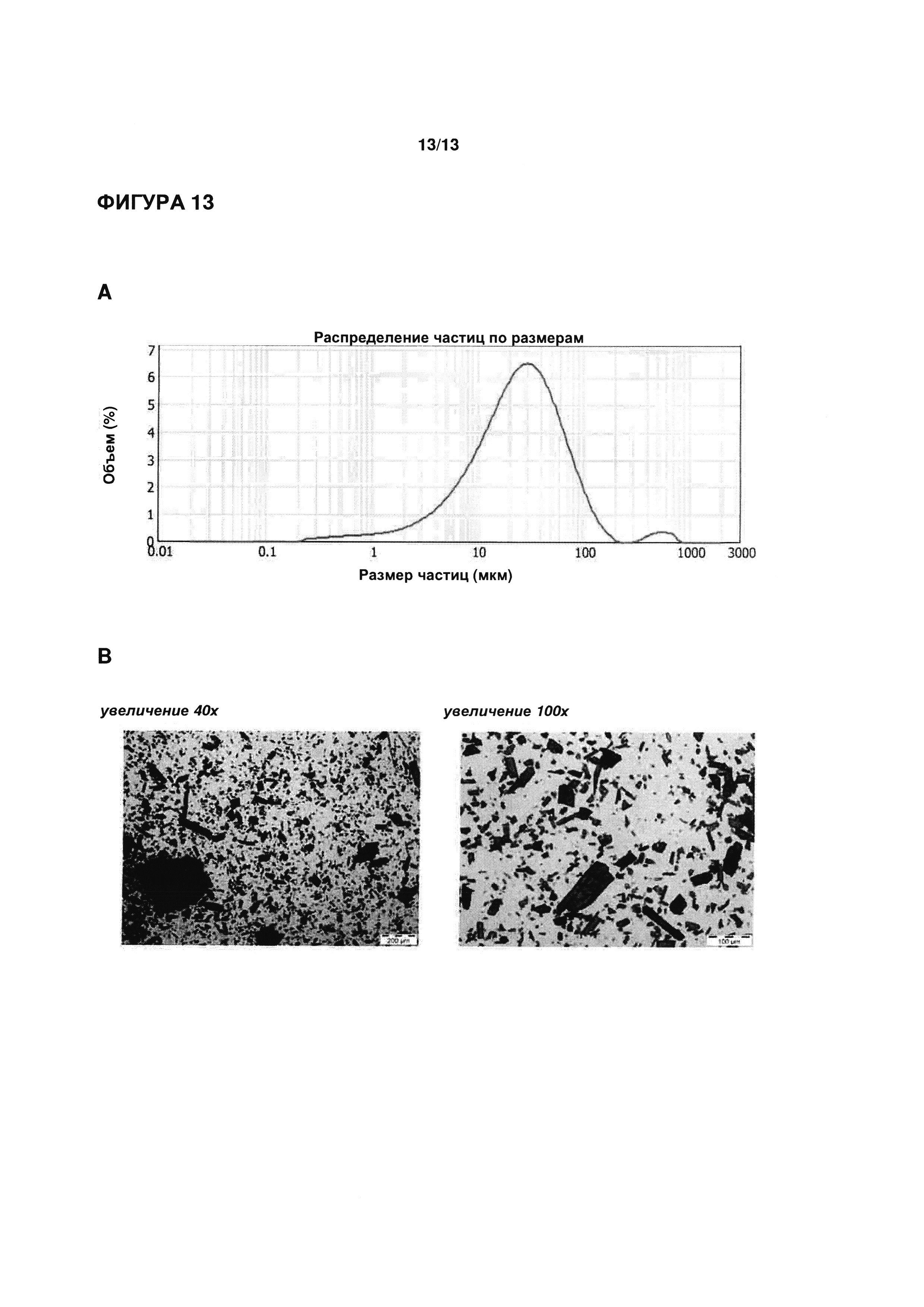
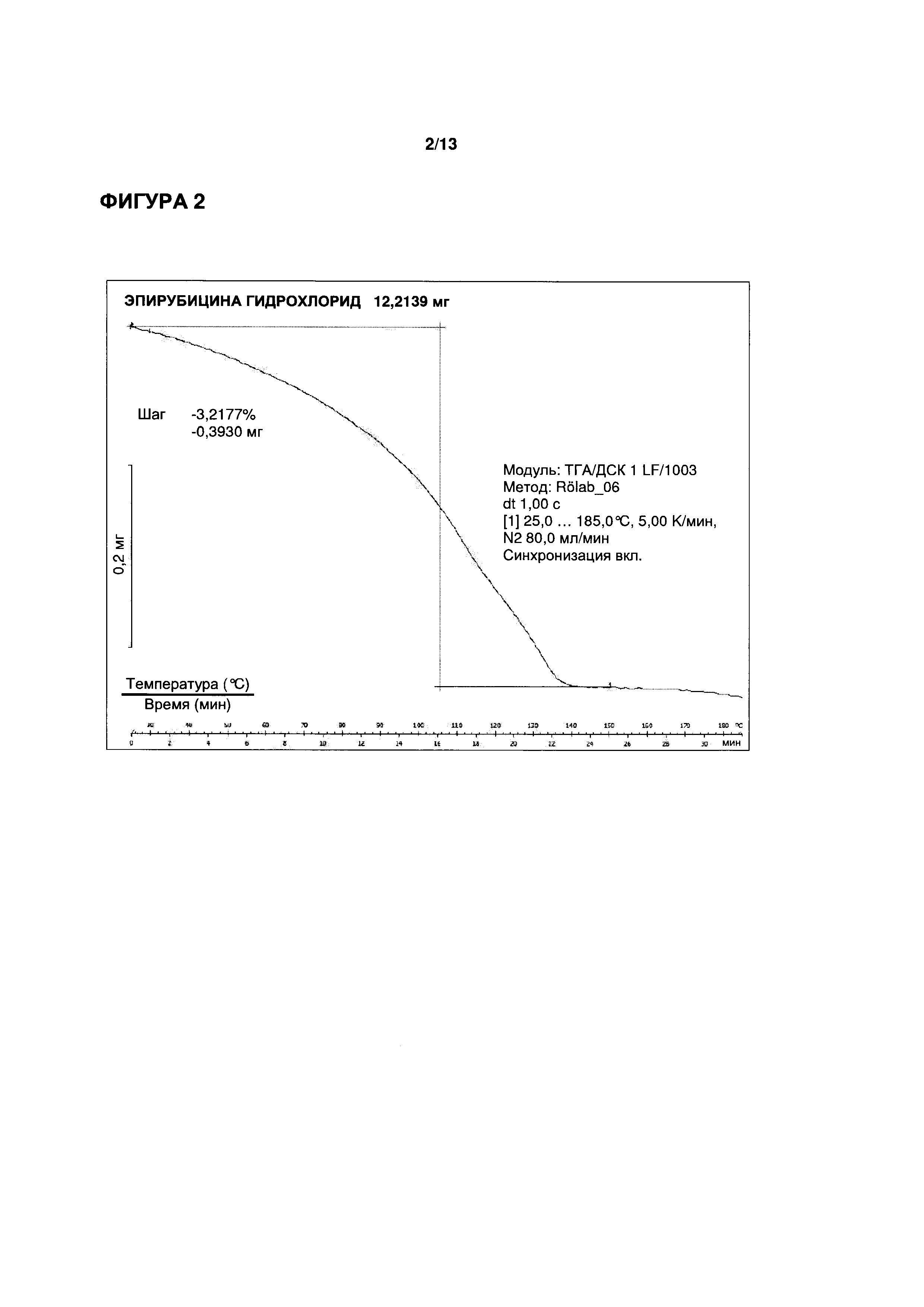
ФИГУРЫ 11-13 иллюстрируют распределение частиц по размерам разных образцов кристаллических гидрохлоридов эпирубицина, определенное методом лазерной дифракции на анализаторе размера частиц Mastersizer 2000 (Malvern Instruments Ltd., Малверн, Великобритания). На ФИГ. 11 показаны результаты репрезентативного анализа с использованием кристаллического эпирубицина гидрохлорида, полученного согласно Примеру 1 патентного документа WO 2012/163508 А1; на ФИГ. 12 показаны результаты репрезентативного анализа с использованием кристаллического эпирубицина гидрохлорида, полученного согласно Примеру 2 патентного документа WO 2012/163508 А1; и на ФИГ. 13 показаны результаты репрезентативного анализа с использованием кристаллического моногидрата эпирубицина гидрохлорида согласно настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к неожиданному обнаружению того факта, что обеспечение эпирубицина гидрохлорида в форме моногидрата, имеющего содержание воды в диапазоне от 2,7% до 3,5% (вес/вес), сопровождается улучшенной термической стабильностью и большим сроком годности, с обеспечением весьма однородного продукта, благоприятных гигроскопических свойств, а также улучшенной безопасности продукта (обусловленной отсутствием остаточных растворителей). Доведение содержания воды в смеси растворителей до кристаллизации до количества в диапазоне от 7% до 12% (вес/вес), и в частности от 8% до 11% (вес/вес.) в сочетании со сравнительно высокой температурой кристаллизации и определенной комбинацией растворителей, как было обнаружено, является отличительным техническим признаком при получении кристаллического моногидрата.
Вне связи с какой-либо теорией, полагают, что присутствие определенного количества остаточной воды в кристаллической полиморфной форме препятствует включению молекул растворителя в кристаллическую структуру и/или вытесняют их из кристаллической структуры, не вызывая при этом каких-либо значительных негативных воздействий на стабильность кристаллов под действием тепла или воды, при этом последний из перечисленных эффектов является особенно неожиданным.
Примечательно, что, когда эпирубицина гидрохлорид получают в форме тригидрата путем увеличения количества воды, присутствующей в смеси растворителей, улучшенные характеристики, обнаруженные у моногидратной формы, не наблюдались. В частности, тригидратная форма является значительно менее стабильной под действием тепла и воды, чем моногидратная форма. Соответственно, указанные улучшенные свойства определенным образом связаны с моногидратной формой эпирубицина гидрохлорида.
Настоящее изобретение будет в дальнейшем описано по отношению к отдельным вариантам реализации и со ссылкой на отдельные фигуры, при этом следует понимать, что настоящее изобретение не ограничено ими, но ограничено только прилагаемой формулой изобретения. Описанные фигуры являются схематичными, и их следует рассматриваться как неограничивающие.
Там, где в настоящем описании и в формуле изобретения используется термин “включающий”, он не исключает других элементов или стадий. Для целей настоящего изобретения термин “состоящий из” рассматривается как предпочтительный вариант реализации термина “включающий”. Если где-либо в настоящем документе определено, что группа включает по меньшей мере определенное число вариантов реализации, также следует понимать, что раскрывается группа, которая предпочтительно состоит только из этих вариантов реализации.
В случаях, когда используется существительное в единственном числе, изобретение включает также и множественное число этого существительного, если не указано иное.
В случаях, когда в контексте настоящего изобретения указаны числовые значения, специалисту будет понятно, что технический результат рассматриваемого признака обеспечивается в интервале точности, который обычно включает отклонение от указанного числового значения в виде ±10%, и предпочтительно ±5%.
Кроме того, термины первый, второй, третий, (a), (b), (c) и подобные в описании и в формуле изобретения используются для обозначения различия между схожими элементами, и необязательно для описания последовательного или хронологического порядка. Понимают, что в соответствующих условиях используемые термины являются взаимозаменяемыми, и что варианты реализации настоящего изобретения, описанные в настоящем документе, могут осуществляться в последовательности, отличной от описанной.
Дополнительные определения термина будут даны в дальнейшем, в контексте, в котором употребляются термины. Следующие термины и определения приведены исключительно с целью облегчения понимания изобретения. Эти определения не должны быть истолкованы как имеющие объем меньший, чем будет понятно специалисту в данной области техники.
В одном аспекте настоящее изобретение относится к способу получения кристаллического моногидрата эпирубицина гидрохлорида, включающему:
(a) добавление по меньшей мере первого растворителя и по меньшей мере второго растворителя к эпирубицина гидрохлориду, где первый растворитель представляет собой линейный или разветвленный С4-С5 спирт, и второй растворитель представляет собой линейный или разветвленный С2-С3 спирт;
(b) доведение содержания воды в растворе, полученном на стадии (а), до количества в диапазоне от 7% до 12% (вес/вес); и
(c) нагревание раствора, полученного на стадии (b), до температуры от 70°C до 90°C для того, чтобы обеспечить кристаллизацию;
при этом полученный кристаллический моногидрат имеет содержание воды в диапазоне от 2,7% до 3,5% (вес/вес.) и свободен от остаточных растворителей.
Для получения кристаллического моногидрата эпирубицина гидрохлорида соединение смешивают с по меньшей мере первым растворителем и по меньшей мере вторым растворителем. Исходное соединение эпирубицина гидрохлорид может быть обеспечено в виде твердого вещества, аморфного вещества или в любой кристаллической форме. Альтернативно, эпирубицина гидрохлорид быть обеспечен в виде раствора или суспензии, например, в виде водного раствора. Соединение может быть получено путем химического синтеза или ферментации, или оно коммерчески доступно у различных поставщиков.
Обычно эпирубицина гидрохлорид обеспечивают в виде твердого вещества и затем растворяют в воде, например, в концентрации в диапазоне от 10 г/л до 100 г/л. Значение рН этого раствора может находиться в диапазоне от 3,0 до 5,0, предпочтительно от 3,5 до 4,5. Согласно отдельным вариантам реализации затем воду удаляют до достижения гелевого состояния раствора. Например, удаление воды может быть достигнуто путем испарения (напр., с использованием роторного испарителя) при низком давлении и при температуре от 30°C до 45°C, предпочтительно при температуре от 35°C до 40°C.
“По меньшей мере первый растворитель”, как определено в настоящем документе, представляет собой линейный или разветвленный С4-С5 спирт, т.е. спирт, содержащий четыре или пять атомов углерода, включая, среди прочих, С4 спирты: 1-бутанол, 2-бутанол, изобутанол, и трет-бутанол; а также С5 спирты: 1-пентанол, 2-пентанол, 3-пентанол, 2-метил-1-бутанол, 2-метил-2-бутанол, 3-метил-1-бутанол, 3-метил-2-бутанол и 2,2-диметил-1-пропанол. Термин “по меньшей мере первый растворитель” в настоящем документе также относится к смесям одного или более С4 спиртов, таким как (1-бутанол и изобутанол) или (1-бутанол, изобутанол и трет-бутанол), смесям одного или более С5 спиртов, таким как (1-пентанол и 2-пентанол) или (1-пентанол, 2-пентанол и 2-метил-1-бутанол), а также к смесям одного или более С4 и С5 спиртов, таким как (1-бутанол и 1-пентанол) или (1-бутанол, 2-бутанол и 1-пентанол).
“По меньшей мере второй растворитель”, как определено в настоящем документе, представляет собой линейный или разветвленный С2-С3 спирт, т.е. спирт, содержащий два или три атома углерода, среди прочего, включая С2 спирт - этанол, и С3 спирты - 1-пропанол и изопропанол. Термин “по меньшей мере второй растворитель”, в данном документе, также относится к смесям одного или более С2 и/или С3 спиртов, таких как (этанол и 1-пропанол) или (1-пропанол и изопропанол) или (этанол, 1-пропанол и изопропанол).
В предпочтительных вариантах реализации способа первый растворитель выбран из группы, состоящей из 1-бутанола, 2-бутанола, изобутанола, трет-бутанола и их смесей; и где второй растворитель выбран из группы, состоящей из 1-пропанола, изопропанола, этанола и их смесей. Например, указанный по меньшей мере первый растворитель может представлять собой 1-бутанол, и второй растворитель - этанол. Или указанный по меньшей мере первый растворитель может представлять собой трет-бутанол, и указанный по меньшей мере второй растворитель - смесь 1-пропанола и этанола.
Согласно определенным вариантам реализации первый растворитель представляет собой 1-бутанол, и второй растворитель выбран из группы, состоящей из 1-пропанола, изопропанола, этанола и их смесей. Согласно другим определенным вариантам реализации первый растворитель выбран из группы, состоящей из 1-бутанола, 2-бутанола, изобутанола, трет-бутанола и их смесей, и второй растворитель представляет собой 1-пропанол.
Согласно особенно предпочтительным вариантам реализации первый растворитель представляет собой 1-бутанол, и второй растворитель представляет собой 1-пропанол.
Согласно определенным вариантам реализации эпирубицина гидрохлорид может быть смешан с по меньшей мере третьим или по меньшей мере четвертым растворителем, при этом указанные по меньшей мере третий или по меньшей мере четвертый растворитель выбраны из линейных или разветвленных С1-С10 спиртов, и в частности из линейных или разветвленных С1-С6 спиртов.
По меньшей мере первый растворитель и по меньшей мере второй растворитель могут быть добавлены к эпирубицина гидрохлориду одновременно или последовательно в любом порядке. Обычно по меньшей мере первый растворитель и по меньшей мере второй растворитель добавляют последовательно, начиная с по меньшей мере первого растворителя.
Согласно определенным вариантам реализации после добавления по меньшей мере первого растворителя воду, присутствующую в смеси, удаляют (полностью, насколько это возможно), пока не будет получен твердый осадок. Удаление воды может быть достигнуто путем испарения (напр., с использованием роторного испарителя) при низком давлении и при температуре от 30°C до 45°C, предпочтительно при температуре от 35°C до 40°C.
После добавления по меньшей мере второго растворителя (одновременно или последовательно) полученная в результате смесь обычно выдерживается, возможно при повышенной температуре, до достижения полного растворения, т.е. пока не растворится вся присутствующая твердая фаза. С этой целью смесь можно нагревать (предпочтительно при перемешивании) до температуры от 40°C до 55°C, предпочтительно до температуры от 45°C до 50°C.
В дополнительных определенных вариантах реализации объемное соотношение первого растворителя к второму растворителю находится в диапазоне от 1:1 до 2:1 (в объемном отн.). В иллюстративных вариантах реализации это объемное соотношение составляет 1:1, 1,2:1, 1,4:1, 1,6:1, 1,8:1 или 2:1 (в объемном отн.). Однако, также возможны другие объемные соотношения первого растворителя к второму растворителю, такие как больший, чем 2:1, избыток первого растворителя (в объемном отн.) (напр., 2,5:1, 3:1 или 5:1 (в объемном отн.)) или избыток второго растворителя (напр., 1:1,2, 1:2 или 1:3 (в объемном отн.)).
Далее, содержание воды в растворе, полученном после добавления по меньшей мере первого растворителя и по меньшей мере второго растворителя доведено до количества в диапазоне от 7% до 12% (вес/вес). Это может быть достигнуто путем добавления недостающей воды или удаления излишней воды, например, путем испарения (см. выше). Содержание воды может быть определено различными способами, принятыми в области техники, например, титрованием по методу Карла Фишера (Fischer, K. (1935) Angew. Chem. 48, 394-396), при котором можно проводить кулонометрическое или объемное титрование, или методом термогравиметрического анализа (описанным, напр., в Coats, A.W. and Redfern, J.P. (1963) Analyst 88, 906-924).
В иллюстративных вариантах реализации содержание воды в растворе находится в диапазоне от 7,2% до 12% (вес/вес), от 7,5% до 12% (вес/вес), от 8% до 11,8% (вес/вес), от 7% до 11,5% (вес/вес.) или от 7,5% до 11% (вес/вес), например, 7,5%, 8,0%, 8,5%, 9,0%, 9,5%, 10,0%, 10,5%, 11,0%, 11,5% или 12% (вес/вес).
В предпочтительных вариантах реализации способа содержание воды, в растворе доведено до количества в диапазоне от 8% до 11% (вес/вес.) или от 8% до 10% (вес/вес.) или от 9% до 11% (вес/вес.) или между 8% и 12% (вес/вес), например 8,0%, 8,2%, 8,4%, 8,6%, 8,8%, 9,0%, 9,2%, 9,4%, 9,6%, 9,8%, 10,0%, 10,2%, 10,4%, 10,6%, 10,8% или 11,0% (вес/вес).
Согласно определенным вариантам реализации конечная концентрация эпирубицина гидрохлорида в растворе, полученном после доведения содержания воды, находится в диапазоне от 10 г/л до 100 г/л, например, 10 г/л, 20 г/л, 50 г/л, 80 г/л или 100 г/л. Однако также возможно использовать растворы, имеющие более высокую концентрацию эпирубицина гидрохлорида, например, до 120 г/л, 150 г/л или 200 г/л.
Значение рН раствора, полученного после доведения содержания воды, может находиться в диапазоне от 2,5 до 6,0 или от 3,0 до 5,5. Согласно предпочтительным вариантам реализации значение рН в растворе доводят до значения в диапазоне от 3,5 до 4,5, например, до 4,0.
Затем полученный раствор (т.е. после добавления по меньшей мере первого растворителя и по меньшей мере второго растворителя к эпирубицина гидрохлориду и полного растворения) нагревают до температуры от 70°C до 90°C для того, чтобы обеспечить кристаллизацию. Предпочтительно, раствор нагревают до температуры от 75°C до 85°C, или особенно предпочтительно до температуры от 78°C до 85°C или от 78°C до 82°C, например, 75°C, 76°C, 77°C, 78°C, 79°C, 80°C, 81°C, 82°C, 83°C, 84°C или 85°C. Предпочтительно смесь нагревают при перемешивании.
Выдерживание при температуре от 70°C до 90°C продолжают до образования твердого осадка (т.е. кристаллов эпирубицина гидрохлорида), например, в течение времени до 1 часа, до 2 часов, до 4 часов или до 6 часов. Во время выдерживания можно продолжать перемешивание.
В отдельном варианте реализации способ согласно настоящему изобретению включает:
(a) добавление по меньшей мере первого растворителя и по меньшей мере второго растворителя к эпирубицина гидрохлориду, где первый растворитель представляет собой 1-бутанол, и второй растворитель представляет собой 1-пропанол;
(b) доведение в растворе, полученном на стадии (а), содержания воды до количества в диапазоне от 8% до 11% (вес/вес); и
(c) нагревание раствора, полученного на стадии (b), до температуры от 75°C до 85°C для того, чтобы обеспечить кристаллизацию;
при этом полученный кристаллический моногидрат имеет содержание воды в диапазоне от 2,8% до 3,3% (вес/вес.) и является свободным от остаточных растворителей. В частности, способ дополнительно включает любую одну или более из следующих стадий:
(i) обеспечение первого растворителя и второго растворителя в объемном соотношении в диапазоне от 1:1 до 2:1 (в объемном отн.);
(ii) нагревание смеси со стадии (а) до температуры от 45°C до 50°C до полного растворения;
(iii) доведение значения рН на стадии (b) до значения в диапазоне от 3,5 до 4,5; и
(iv) продолжение выдерживания раствора на стадии (с) при температуре от 75°C до 85°C до образования твердого осадка.
В отдельных вариантах реализации способ дополнительно включает введение затравки в раствор, полученный после доведения содержания воды, для того, чтобы инициировать кристаллизацию. То есть один или более небольших кристаллов эпирубицина добавляют в раствор, из которого вырастают более крупные кристаллы.
В других отдельных вариантах реализации способ дополнительно включает очистку кристаллов, полученных во время кристаллизации. Обычно такая очистка подразумевает отделение кристаллов от других компонентов смеси, что обычно достигается фильтрацией или перегонкой. Помимо того, процесс очистки может подразумевать стадию промывки подходящим промывочным раствором, таким как спирт или кетон.
Согласно отдельным вариантам реализации способов необязательный процесс очистки включает процесс флюидной экстракции с использованием сверхкритической жидкости, т.е. субстанции при температуре и давлении выше ее критической точки, когда отдельные жидкие и газовые фазы не существуют. Сверхкритические жидкости для использования согласно настоящему изобретению включают, среди прочих, оксонитрид азота, пропан, этилен, фторуглероды и углекислый газ, при этом последний является предпочтительным. Процесс флюидной экстракции может быть осуществлен при температуре от 25 до 55°C (напр., от 40 до 45°C) и при давлении от 10 до 60 МПа (напр., от 40 до 55 МПа) в течение 2-4 часов (напр., 3 часов) при скорости потока в диапазоне от 200 до 2000 мл/мин (напр., от 500 до 1000 мл/мин).
В заключение кристаллы могут быть высушены с использованием процедур, принятых в области техники, возможно в вакууме. Например, полученные кристаллы могут быть высушены на воздухе при температуре от 30°C до 40°C.
С помощью определения функциональных параметров полученных кристаллов было установлено, что кристаллы представляют собой моногидратную форму эпирубицина гидрохлорида (т.е. на каждую молекулу эпирубицина гидрохлорида приходится одна молекула воды) с содержанием воды в диапазоне от 2,7% до 3,5% (вес/вес). Содержание воды может быть определено как описано выше, например, титрованием по методу Карла Фишера или методом термогравиметрического анализа.
В предпочтительных вариантах реализации способа содержание воды в кристаллическом моногидрате эпирубицина гидрохлорида находится в диапазоне от 2,8% до 3,3% (вес/вес), например, 2,8%, 2,9%, 3,0%, 3,1%, 3,2% или 3,3% (вес/вес).
Помимо того, с помощью определения функциональных параметров полученного кристаллического моногидрата эпирубицина гидрохлорида было продемонстрировано, что соединение свободно от остаточных растворителей. Термин “свободный от” в данном документе относится к количеству остаточных растворителей в кристаллах менее чем 0,5% (вес/вес), предпочтительно менее чем 0,3% (вес/вес.) и особенно предпочтительно менее чем 0,25% (вес/вес). Количество остаточных растворителей, присутствующих в кристаллах, может быть определено при помощи различных способов, известных в области техники, таких как газовая хроматография.
В другом аспекте настоящее изобретение относится к кристаллическому моногидрату эпирубицина гидрохлорида, полученному согласно способу, описанному в настоящем документе.
Кристаллический моногидрат эпирубицина гидрохлорида, полученный согласно настоящему изобретению, характеризуется равномерным распределением по размерам для кристаллических частиц, то есть без значительного отклонения размера подавляющего большинства отдельных кристаллических частиц, присутствующих в образце, от среднего диаметра частиц (обычно рассчитываемого как средняя величина, средневзвешенная по объему). Например, распределение частиц по размерам может быть определено с помощью лазерного дифракционного анализа, хорошо известного в данной области техники (напр., описано в European Pharmacopeia, 7th Edition (2010), 20931). Репрезентативный анализ с использованием кристаллического моногидрата эпирубицина гидрохлорида согласно настоящему изобретению приведен на ФИГУРЕ 13.
Обычно средний диаметр кристаллических частиц моногидрата эпирубицина гидрохлорида согласно настоящему изобретению больше 10 мкм или больше 15 мкм или больше 18 мкм. Согласно предпочтительным вариантам реализации средний диаметр кристаллических частиц, полученных согласно способу по настоящему изобретению, находится в диапазоне от 20 мкм до 50 мкм, например, 22 мкм, 25 мкм, 28 мкм, 30 мкм, 35 мкм, 40 мкм или 45 мкм.
В отдельных вариантах реализации размер по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, и особенно по меньшей мере 80% или по меньшей мере 90% полученных кристаллических частиц находится в диапазоне вида: средний диаметр ±30%. Например, если средний диаметр полученных кристаллических частиц составляет 25 мкм, то соответствующее количество (в %) кристаллических частиц в данном образце будут иметь диаметр в диапазоне от 17,5 мкм до 32,5 мкм. Согласно отдельным вариантам реализации размер по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, и особенно по меньшей мере 80% или по меньшей мере 90% полученных кристаллических частиц находится в диапазоне вида: средний диаметр ±20%. Например, если средний диаметр полученных кристаллических частиц составляет 25 мкм, то соответствующее количество (в %) кристаллических частиц в данном образце будут иметь диаметр в диапазоне от 20 мкм до 30 мкм. Согласно предпочтительным вариантам реализации размер по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, и особенно по меньшей мере 80% или по меньшей мере 90% полученных кристаллических частиц находится в диапазоне вида: средний диаметр ±10%. Например, если средний диаметр полученных кристаллических частиц составляет 25 мкм, то соответствующее количество (в %) кристаллических частиц в данном образце будут иметь диаметр в диапазоне от 22,5 мкм до 27,5 мкм.
В других определенных вариантах реализации настоящее изобретение относится к кристаллическому моногидрату эпирубицина гидрохлорида, имеющему содержание воды в диапазоне от 2,7% до 3,5% (вес/вес.) и свободному от остаточных растворителей, то есть содержит остаточные растворители в количестве меньше чем 0,5% (вес/вес.) (см. выше). Предпочтительно содержание воды в кристаллическом моногидрате находится в диапазоне от 2,8% до 3,3% (вес/вес.) (см. выше и иллюстративные данные термогравиметрического анализа на ФИГ. 2, 5, и 8).
Согласно отдельным вариантам реализации кристаллический моногидрат эпирубицина гидрохлорида дополнительно охарактеризован определенной порошковой рентгеновской дифрактограммой, пример которой приведен на ФИГ 3, 6, и 9, где рентгеновская дифрактограмма включает характеристические пики при средних углах дифракции (2Θ) 5,1°, 9,1°, 13,6°, 22,1°, 22,5°, и 24,0° (каждый ±0,2°).
Согласно дополнительным отдельным вариантам реализации кристаллический моногидрат эпирубицина гидрохлорида дополнительно охарактеризован определенной термостабильностью, составляющей менее чем 0,5% (вес/вес.) доксорубицинона (т.е. агликона, представляющего собой продукт разложения, эпирубицина) образованного после выдержки при 100°C в течение одного месяца согласно руководству ICH (см, среди прочего, ICH Guideline Q1A (R2)), как далее показано в ТАБЛИЦЕ 8-1.
В конкретных вариантах реализации кристаллический моногидрат эпирубицина гидрохлорида согласно настоящему изобретению дополнительно охарактеризован определенной диаграммой дифференциальной сканирующей калориметрии (ДСК), пример которой приведен на ФИГ 1, 4, и 7, имеющей максимальную интенсивность в интервале температур от 195°C до 205°C со средним пиком (т.е. точкой плавления) в диапазоне от 201°C до 204°C.
Наконец, еще один аспект настоящего изобретения относится к кристаллическому моногидрату эпирубицина гидрохлорида, как описано в настоящем документе выше, для применения для предотвращения и лечения рака. В частности, кристаллический моногидрат эпирубицина гидрохлорида используют для лечения рака груди.
Изобретение дополнительно описано с помощью фигур и следующих примеров, которые приведены исключительно с целью проиллюстрировать отдельные варианты реализации настоящего изобретения и не ограничивают настоящее изобретение каким-либо образом.
ПРИМЕРЫ
МАТЕРИАЛЫ И МЕТОДЫ
Дифференциальная сканирующая калориметрия (ДСК; для определения точки плавления) проводилась путем точного взвешивания образца в тигли из оксида алюминия (70 мкл, герметично закрытые крышкой из оксида алюминия) при помощи калиброванных ультрамикровесов. Измерения: Mettler ТС11-ТА-процессор с модулем DSC 30 или Mettler DSC 25 с серебряной печью и керамическим сенсорным кристаллом и блоком управления Mettler ТС15А-ТА (с 25°C до 250°C, 10°C/мин). Продувочный газ: N2, 80 мл/мин, калибровка с контролем расхода по массе: проведена непосредственно перед измерением образца с использованием сверхчистого индия (In) в качестве эталона (шкала температуры, шкала теплоотдачи).
Кулонометрическое титрование по методу Карла Фишера (KFT; для определения содержания воды) проводилось с использованием внешней сушильной печи (Metrohm 707 KF; работающая при 140°C с продувкой N2). Образцы точно взвешивались на аналитических весах (10-5 г).
Термогравиметрический анализ (анализ ТГ; для определения содержания воды) проводился путем точного взвешивания образца в тигли из оксида алюминия (100 мкл, герметично закрытые крышкой из оксида алюминия с отверстием 50 мкм, просверленным лазером) при помощи калиброванных ультрамикровесов. Измерения: Mettler TGA/DSC1, большая печь; модуль контроля газа (продувочный газ: N2, 80 мл/мин, контроль расхода по массе).
Анализы ВЭЖХ и ГХ проводились согласно стандартным методикам.
Рентгеновская порошковая дифрактометрия проводилась с использованием трансмиссионного дифрактометра STOE-STADI Ρ на следующих настройках: излучение nCu-Kα1, (λ=1,54056 Å), U=40 кВ, I=35 мА, монохроматор первичного пучка (изогнутый Ge(111)), линейный позиционно-чувствительный детектор, щели: 1 мм, d=8 мм, область углов: 2θ=от 3 до 90°, ширина шага Δ2θ=0,02°, 25 с/0,2° шаг. Сначала порошок помещают между двумя пленками майлар, а затем - в держатель для образца, имеющий маску d=8 мм.
ПРИМЕР 1
(1) 500,0 г аморфного эпирубицина гидрохлорида (91,0% (вес/вес), определено ВЭЖХ) растворяли в 10 л воды. Воду выпаривали с использованием роторного испарителя при низком давлении при температуре 40°C до достижения гелевого состояния раствора.
(2) 1-бутанол в количестве 10 л добавляли к раствору и продолжали выпаривание до образования твердого осадка.
(3) Абсолютный этанол в количестве 5 л добавляли к раствору в 1-бутаноле. Смесь нагревали до повторного растворения твердого осадка. Содержание воды в растворе 1-бутанол/этанол доводили с помощью выпаривания до значения от 8% до 10% (вес/вес.) (определено титрованием по методу Карла Фишера). Затем выпаривание было прекращено, и раствор перемешивали при температуре 75°C до образования твердого осадка.
(4) Кристаллы эпирубицина гидрохлорида отделяли с помощью фильтрации, промывали 500 мл ацетона и сушили на воздухе при температуре от 30°C до 35°C. Было получено 423 г кристаллического эпирубицина гидрохлорида (общий выход: 92,9%).
Определение функциональных параметров полученного соединения:
Точка плавления (метод ДСК): 201,4°C (см. ФИГ. 1)
Содержание воды: 3,11% (вес/вес.) (KFT)
3,22% (вес/вес.) (метод ТГ; см. ФИГ. 2)
Расчетное значение для моногидрата: 3,01% (вес/вес.))
Содержание эпирубицина HCI (метод ВЭЖХ): 96,4% (вес/вес.)
Содержание остаточных растворителей (метод ГХ): 0,26% (вес/вес.)
Порошковая рентгеновская дифрактометрия (см. ФИГ. 3): характеристические пики при углах дифракции (2Θ) 5,1°, 9,1°, 13,6°, 22,1°, 22,5° и 24,0°
Экспериментальные данные показывают, что полученное соединение представляет собой эпирубицина гидрохлорид (ВЭЖХ), имеющий определенную кристаллическую структуру (рентгенография), с содержанием воды, характерным для моногидратной формы (KFT и ТГ) и свободный от остаточных растворителей (ГХ).
ПРИМЕР 2
(1) 500,0 г аморфного эпирубицина гидрохлорида (содержание: 91,0% (вес/вес), определено методом ВЭЖХ) растворяли в 10 л воды. Воду выпаривали с использованием роторного испарителя при низком давлении при температуре 40°C до достижения гелевого состояния раствора.
(2) 1-бутанол в количестве 10 л добавляли к раствору и продолжали выпаривание до образования твердого осадка.
(3) 1-пропанол в количестве 5 л добавляли к раствору в 1-бутаноле. Смесь нагревали до повторного растворения твердого осадка. Содержание воды в растворе н-бутанол/1-пропанол доводили с помощью выпаривания до значения от 9% до 10% (вес/вес.) (определено титрованием по методу Карла Фишера). Затем выпаривание было прекращено, и раствор перемешивали при температуре 78°C до образования твердого осадка.
(4) Кристаллы эпирубицина гидрохлорида отделяли с помощью фильтрации, промывали 500 мл ацетона и сушили на воздухе при температуре от 30°C до 35°C. Было получено 435 г кристаллического эпирубицина гидрохлорида (общий выход: 95,6%).
Определение функциональных параметров полученного соединения:
Точка плавления (метод ДСК): 203,9°C (см. ФИГ. 4)
Содержание воды: 3,11% (вес/вес.) (KFT)
3,17% (вес/вес.) (метод ТГ; см. ФИГ. 5)
Расчетное значение для моногидрата: 3,01% (вес/вес.))
Содержание эпирубицина HCl (метод ВЭЖХ): 96,1% (вес/вес.)
Содержание растворителя (метод ГХ): 0,23% (вес/вес.)
Порошковая рентгеновская дифрактометрия (см. ФИГ. 6): характеристические пики при углах дифракции (2Θ) 5,1°, 9,1°, 13,6°, 22,1°, 22,5° и 24,0°
Экспериментальные данные показывают, что полученное соединение представляет собой эпирубицина гидрохлорид (ВЭЖХ), имеющий определенную кристаллическую структуру (рентгенография), с содержанием воды, характерным для моногидратной формы (KFT и ТГ) и свободный от остаточных растворителей (ГХ).
ПРИМЕР 3
(1) 500,0 г аморфного эпирубицина гидрохлорида (содержание: 91,0% (вес/вес), определено методом ВЭЖХ) растворяли в 10 л воды. Воду выпаривали с использованием роторного испарителя при низком давлении при температуре 40°C до достижения гелевого состояния раствора.
(2) 1-бутанол в количестве 10 л добавляли к раствору и продолжали выпаривание до образования твердого осадка.
(3) Смесь этанола и 1-пропанола (1:1 (в объемном отн.)) в количестве 5 л добавляли к раствору в 1-бутаноле. Смесь нагревали до повторного растворения твердого осадка. Содержание воды в полученном растворе доводили с помощью выпаривания до значения от 8% до 10% (вес/вес.) (определено титрованием по методу Карла Фишера). Затем выпаривание было прекращено, и раствор перемешивали при температуре 75°C до образования твердого осадка.
(4) Кристаллы эпирубицина гидрохлорида отделяли с помощью фильтрации, промывали 500 мл ацетона и сушили на воздухе при температуре от 30°C до 35°C. Было получено 431 г кристаллического эпирубицина гидрохлорида (общий выход: 94,7%).
Определение функциональных параметров полученного соединения:
Точка плавления (метод ДСК): 201,6°C (см. ФИГ. 7)
Содержание воды: 3,11% (вес/вес.) (KFT)
3,16% (вес/вес.) (метод ТГ; см. ФИГ. 8)
Расчетное значение для моногидрата: 3,01% (вес/вес.))
Содержание эпирубицина HCl (метод ВЭЖХ): 97,0% (вес/вес.)
Содержание растворителя (метод ГХ): 0,21% (вес/вес.)
Порошковая рентгеновская дифрактометрия (см. ФИГ. 9): характеристические пики при углах дифракции (2Θ) 5,1°, 9,1°, 13,6°, 22,1°, 22,5° и 24,0°
Экспериментальные данные показывают, что полученное соединение представляет собой эпирубицина гидрохлорид (ВЭЖХ), имеющий определенную кристаллическую структуру (рентгенография), с содержанием воды, характерным для моногидратной формы (KFT и ТГ) и свободный от остаточных растворителей (ГХ).
Функциональные данные, полученные в Примерах 1-3, демонстрируют очень высокую степень постоянства, что является характерным признаком получения одного и того же соединения.
ПРИМЕР 4 (СРАВНИТЕЛЬНЫЙ ПРИМЕР)
(1) 500,0 г кристаллического эпирубицина гидрохлорида растворяли в 5 л воды. Воду выпаривали с использованием роторного испарителя при низком давлении при температуре 40°C до достижения гелевого состояния раствора.
(2) Гелевый раствор эпирубицина гидрохлорида выливали в 9 л ацетона.
(3) Осажденные кристаллы эпирубицина гидрохлорида отделяли с помощью фильтрации, промывали 500 мл ацетона и сушили на воздухе при температуре от 30°C до 35°C. Было получено 512 г осажденных кристаллов. Присутствие эпирубицина гидрохлорида было подтверждено ВЭЖХ.
(4) Определение содержания воды (расчетное значение для тригидрата: 9,03% (вес/вес.)
|
Экспериментальные данные показывают, что полученный кристаллический эпирубицина гидрохлорид имеет содержание воды, характерное для тригидратной формы.
ПРИМЕР 5
Кристаллический моногидрат эпирубицина гидрохлорида, полученный согласно Примеру 1, выдерживали при температуре 25°C, 40°C и 100°C, соответственно, в течение указанного периода времени (в месяцах). Испытание проводили согласно руководству ICH (см., среди прочего, ICH Guideline Q1A (R2)). Количество образовавшегося продукта разложения (т.е. доксорубицинона), а также количество исходного эпирубицина гидрохлорида (оба в % (вес/вес.)) определяли методом ВЭЖХ (“LT” = менее чем).
Результаты приведены в ТАБЛИЦЕ 5-1.
Результаты показывают неожиданно высокую стабильность полученного кристаллического моногидрата не только в части общего срока годности (стабильности в течение периода времени (по меньшей мере) 5 лет при температуре 25°C), но также и в части термостабильности (стабильности в течение (по меньшей мере) 6 месяцев при температуре 40°C).
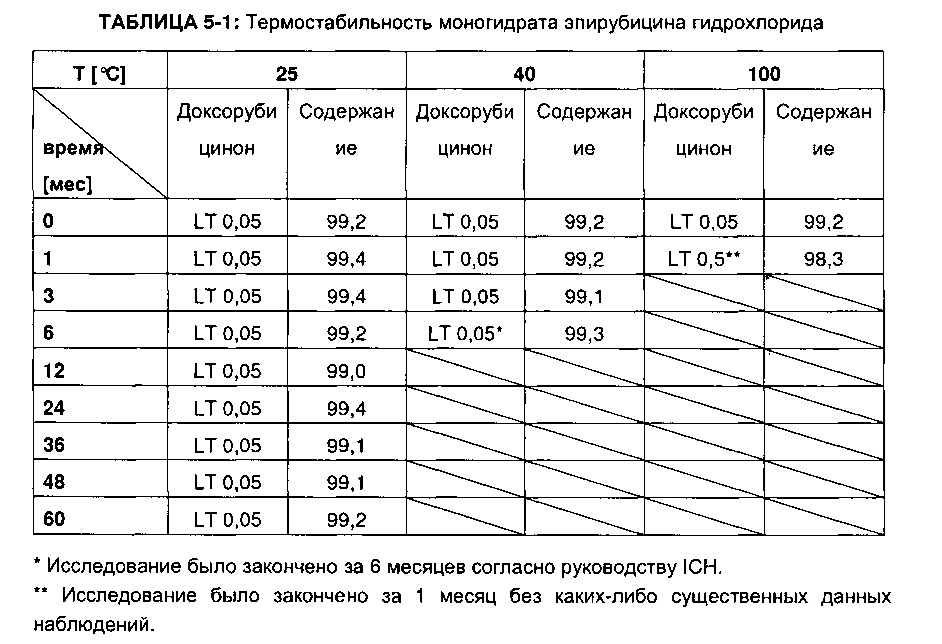
Дополнительные исследования с использованием кристаллического моногидрата эпирубицина гидрохлорида, полученного согласно Примерам 2 и 3, соответственно, показали почти идентичные результаты (не показаны).
Те же самые исследования были проведены с кристаллическим тригидратом эпирубицина гидрохлорида, полученным согласно Примеру 4. Результаты приведены в ТАБЛИЦЕ 5-2.
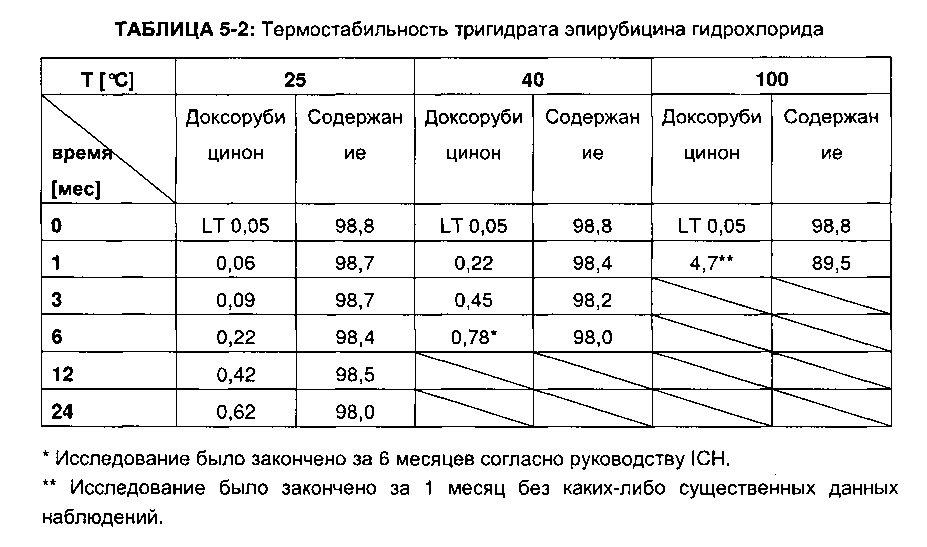
Данные показали значительное разложение тригидратной формы даже при хранении в течение шести месяцев при температуре 25°C. Накопление доксорубицинона агликона значительно увеличивалось с повышением температуры. Следовательно, улучшенные свойства кристаллического эпирубицина гидрохлорида согласно настоящему изобретению являются свойствами, присущими полученной моногидратной форме.
ПРИМЕР 6
Кристаллический моногидрат эпирубицина гидрохлорида, полученный согласно Примеру 1, выдерживали при температуре 25°C или 40°C и относительной влажности 40-90%, соответственно, в течение указанного периода времени (в днях). Анализ проводился, как описано в руководстве ICH. Соответствующее содержание воды в образцах (в % (вес/вес.)) измеряли титрованием по методу Карла Фишера, результаты представлены в ТАБЛИЦЕ 6-1.
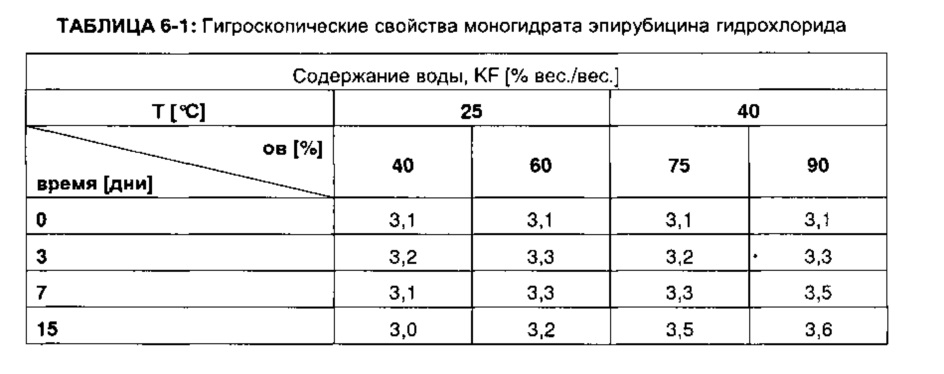
Экспериментальные данные показывают, что полученный кристаллический моногидрат эпирубицина гидрохлорида не демонстрирует сколько-либо значительной гигроскопичности. Даже в случае выдержки при относительной влажности 90% и 40°C в течение 15 дней, абсорбция воды была неожиданно невелика.
Дополнительные анализы с использованием кристаллического моногидрата эпирубицина гидрохлорида, полученного согласно Примерам 2 и 3 соответственно, показали почти идентичные результаты (не показаны).
Те же самые исследования были проведены с кристаллическим тригидратом эпирубицина гидрохлорида, полученного согласно Примеру 4. Результаты приведены в ТАБЛИЦЕ 6-2.

Экспериментальные данные показывают значительную степень абсорбции воды уже после выдержки в течение 3 дней. Следовательно, отметим еще раз, улучшенные свойства кристаллического эпирубицина гидрохлорида согласно настоящему изобретению являются свойствами, присущими полученной моногидратной форме.
ПРИМЕР 7 (СРАВНИТЕЛЬНЫЙ ПРИМЕР)
Три образца кристаллического эпирубицина гидрохлорида, полученного согласно различным способам, были проанализированы на предмет распределения частиц по размерам с использованием лазерного дифракционного анализа.
Образец 1 получен согласно Примеру 1 патентного документа WO 2012/163508 А1.
Вкратце, 9,0 г аморфного эпирубицина гидрохлорида суспендировали в смеси 12 мл воды, 258 мл 2-пропанола и 30 мл 1-бутанола. Эту суспензию при перемешивании нагревали до 65°C, и выдерживали при этой температуре четыре часа. Затем суспензию охлаждали ступенчато до температуры 22°C. После удаления растворителя, содержащегося в суспензии, при помощи фильтрации, кристаллы промыли ацетоном и после удаления ацетона высушены в течение 24 часов в вакууме.
Лазерный дифракционный анализ был проведен в форме лазерной дифракции во влажном состоянии в ацетоне: 1750 об/мин, время цикла 3×20 с, 60 с в фоновом режиме, без обработки ультразвуком, и время перемешивания 5 мин, с использованием анализатора размера частиц Mastersizer 2000 (Malvern Instruments Ltd., Малверн, Великобритания) в соответствии с инструкциями производителя.
На ФИГ. 11 приведены результаты репрезентативного анализа, а также иллюстративные микроизображения влажной дисперсии с 40-кратным и 100-кратным увеличением, соответственно.
Результаты демонстрируют разброс в размерах частиц в диапазоне от 1 мкм до 80 мкм с одним пиком при примерно 5 мкм и вторым пиком при примерно 50 мм. Может быть рассчитано, что средний диаметр исходя из объема частиц (обозначаемый также “D(v/0,5)”) составляет 4,62 мкм. Разброс в размерах частиц также явно заметен под микроскопом. Кроме того, частицы не являются кристаллическими.
Образец 2 получен согласно Примеру 2 патентного документа WO 2012/163508 А1.
Вкратце, 10,0 г аморфного эпирубицина гидрохлорида растворяли в смеси 13 мл воды и 13 мл 2-пропанола с тем, чтобы приготовить раствор, содержащий эпирубицина гидрохлорид. Затем этот раствор смешивали с 33 мл 1-бутанола и 274 мл 2-пропанола. Получившуюся смесь нагревали до 65°C и оставляли при этой температуре в течение четырех часов, в результате чего образовались кристаллы эпирубицина гидрохлорида. Затем полученную суспензию охлаждали ступенчато до температуры 22°C. Растворитель, содержащийся в суспензии, удаляли при помощи фильтрации, и кристаллы, полученные как остаток на фильтре, были промыты ацетоном. После удаления ацетона кристаллы высушены в течение 24 часов в вакууме.
Лазерный дифракционный анализ проведен, как описано выше.
ФИГ. 12 показывает результаты репрезентативного анализа, а также иллюстративные микроизображения влажной дисперсии с 40-кратным и 100-кратным увеличением, соответственно.
Результаты также демонстрируют значительный разброс в размерах частиц в диапазоне от 1 мкм до 80 мкм без какого-либо выделенного одного максимального пика. Можно рассчитать, что величина D(v/0,5) составляет 9,04 мкм. Неравномерное распределение частиц по размерам также непосредственно видно под микроскопом. Кроме того, частицы не являются кристаллическими.
Образец 3 получен согласно настоящему изобретению, как описано в Примере 3 выше. Лазерный дифракционный анализ проведен, как описано выше.
ФИГ. 13 показывает результаты репрезентативного анализа, а также иллюстративные микроизображения влажной дисперсии с 40-кратным и 100-кратным увеличением, соответственно.
Результаты явно показывают в высокой степени равномерное распределение частиц по размерам с одним максимальным пиком при значении D(v/0,5). Можно рассчитать, что значение D(v/0,5) составляет 25,25 мкм. Подавляющее большинство кристаллических частиц, присутствующих в образце, имеют размер в диапазоне, заданном в виде: средний диаметр ±10%. Под микроскопом частицы действительно выглядят кристаллическими.
Эти данные показывают, что способ согласно настоящему изобретению обеспечивает получение кристаллического моногидрата эпирубицина гидрохлорида, имеющего в высокой степени равномерное распределение размера частиц.
ПРИМЕР 8 (СРАВНИТЕЛЬНЫЙ ПРИМЕР)
Три образца кристаллического эпирубицина гидрохлорида, полученные согласно различным способам, были проанализированы на предмет термостабильности в стрессовых условиях (т.е. при хранении в течение одного месяца при 100°C).
Образец S получили согласно настоящему изобретению, как описано в Примере 3 выше. Образец М1 получили согласно Примеру 1 документа WO 2012/163508 А1, как описано выше в Примере 7. Наконец, Образец М2 получен согласно Примеру 2 из WO 2012/163508 А1, как описано выше в Примере 7.
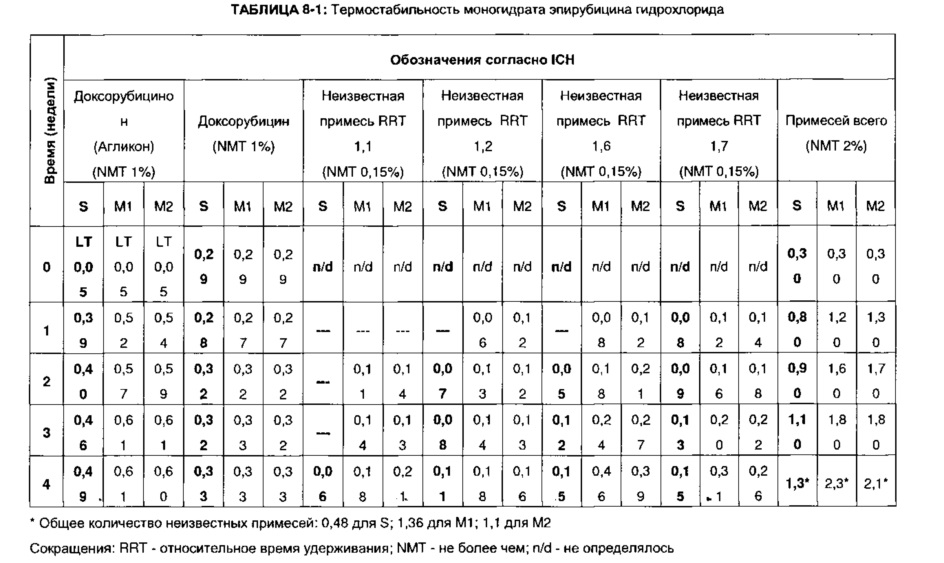
Образцы выдерживались при температуре 100°C в течение указанного периода времени (в неделях). Анализ проводился как описано в руководстве ICH Guideline Q1A (R2) (см. выше). Количество образовавшегося продукта разложения (т.е. доксорубицинона), а также количество различных примесей (т.е. доксорубицина и четырех разных еще не идентифицированных примесей; все приведены в % (вес/вес); “n.d.” = не определялось) определяли методом ВЭЖХ (“LT” = менее чем). Результаты представлены в ТАБЛИЦЕ 8-1.
По аналогии с приведенными выше данными по термостабильности, дополнительные данные, полученные в стрессовых условиях, показали менее выраженное разложение эпирубицина гидрохлорида, полученного согласно настоящему изобретению (“S”), по сравнению с образцами, полученными согласно патентному документу WO 2012/163508 А1 (“М1” и “М2”). Заманчиво предположить, что снижение стабильности последних образцов может быть отнесено к большей удельной площади поверхности за счет более высокой молекулярной доступности аморфных материалов по сравнению с кристаллическими состояниями (см. также Пример 7). Более того, в эпирубицина гидрохлориде, полученном согласно настоящему изобретению (“S”), также содержится значительно меньшее количество примесей, присутствующих в образце (данные выделены жирным шрифтом), что представляет собой дополнительные доказательства улучшенных свойств эпирубицина гидрохлорида согласно настоящему изобретению, например, в части безопасности продукта.
Настоящее изобретение, иллюстративно описанное в настоящем документе, может соответствующим образом быть осуществлено в отсутствие любого элемента или элементов, ограничения или ограничений, конкретно не раскрытых в настоящем документе. Так, например, термины “содержащий”, “включающий”, “содержащий в составе” и т.п. должны быть поняты в широком смысле и без каких-либо ограничений. Кроме того, термины и выражения, используемые в настоящем документе, были использованы в качестве терминов описания, а не ограничения, и без намерения использовать такие термины и выражения для исключения любых эквивалентов показанных и описанных признаков или их частей, но должно быть признано, что возможны различные модификации в пределах объема заявленного изобретения. Таким образом, следует понимать, что, хотя настоящее изобретение было конкретно раскрыто в вариантах реализации и дополнительными признаками, специалисты в данной области техники могут использовать модификации и варианты описанных в настоящем документе изобретений, и что такие модификации и варианты включены в объем настоящего изобретения.
Изобретение описано в настоящем документе в широком и общем смысле. Каждый из более узких видов и субродовых групп, входящих в общее описание, также составляет часть настоящего изобретения. Это относится и к общему описанию изобретения с оговоркой или негативными признаками, устраняющими любой объект из рода, независимо от того, был ли исключенный материал специально описан в настоящем документе.
Другие варианты реализации находятся в рамках формулы изобретения. Кроме того, если признаки или аспекты изобретения описаны с помощью групп Маркуша, специалистам в данной области техники будет понятно, что изобретение также тем самым описано с помощью любого отдельного члена группы или любой подгруппы членов группы Маркуша.