АНАЛОГИ ЦИСТАМИНА, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА
Вид РИД
Изобретение
Существующие способы лечения болезни Паркинсона (БП) являются преимущественно симптоматическими и не предотвращают нейронную дегенерацию, лежащую в основе развития заболевания. Связь между свойствами цистамина и болезнями Паркинсона и Хантингтона была изучена на различных животных моделях. На животных моделях болезни Хантингтона (БХ) цистамин продемонстрировал нейрозащитное влияние, увеличив продолжительность жизни и ослабив двигательные симптомы у мышей, являвшихся носителями гена болезни Хантингтона (Dedeoglu et al., 2002; Karpuj et al., 2002). Экспериментальные данные, полученные in vitro и in vivo, демонстрируют способность цистамина ингибировать трансглутаминазу - фермент, вовлеченный в белковые структуры, такие как мутантная форма белка хантингтин (Green, 1993; Jeitner et al., 2005; Wang et al., 2005). Как один из ключевых элементов данного нейронального защитного эффекта, было отмечено увеличение в мозге уровней нейротрофического фактора головного мозга (НФГМ, BDNF) (Borrell-Pages et al., 2006). Высокая доза цистамина, доставляемого посредством питевой воды, ослабляет окислительный стресс и вредное влияние 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МФТП, МРТР) на митохондриальные функции (Stack et al., 2008). Влияние цистамина и/или цистеамина было описано в результатах исследований на мышиной модели болезни Паркинсона, вызванной МФТП (Sun et al., 2010; Tremblay et al., 2006; Stack et al., 2008; Gibrat et al., 2010).
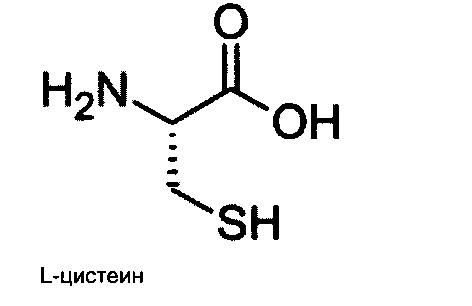
В результате метаболизма цистамин образует несколько промежуточных продуктов, включая не только цистеамин, но также гипотаурин и таурин. Цистамин и цистеамин оба являются органическими соединениями, и впервые были описаны как радиозащитные средства (Bacq and Beaumariage, 1965). Хотя цистеамин представляет собой декарбоксилированную форму цистеина, основным источником этого вещества является его конститутивное вырабатывание всеми тканями посредством распада кофермента А (Pitari et al., 1992), который задействован в метаболических процессах, особенно в образовании аденозинтрифосфата (АТФ, АТР) в цикле Кребса (Leonardi et al., 2005). Хотя цистеин является общим компонентом большинства белков (Lee et al., 2004), базальные уровни цистеина в плазме обычно являются низкими, так как его тиол подвержен окислению, что приводит к образованию дисульфидного производного цистина.
Цистеамин (2-аминоэтантиол), являющийся восстановленной формой цистамина, одобрен для лечения цистиноза - детского заболевания, приводящего к почечной недостаточности по причине внутриклеточного накопления цистина (Dohil et al., 2009). В связи с тем, что цистеамин продемонстрировал достаточную эффективность в мышиных моделях болезни Хантингтона (Borrell-Pages et al., 2006), и его безопасность была задокументирована, в настоящее время данная молекула находится в освоении для применения у пациентов, страдающих от этого заболевания (Dubinsky and Gray, 2006).
Недавно были проведены предварительные исследования битартрата цистеамина (CYSTAGON®) на пациентах, страдающих болезнью Хантингтона, в частности, для того, чтобы установить безопасную терапевтическую дозу (Dubinsky and Gray, 2006). В данном одноцентровом открытом клиническом исследовании фазы I было задействовано девять пациентов, страдающих болезнью Хантингтона. Субъекты получали лечение цистеамином с дозировкой 10 мг/кг в день с еженедельным увеличением дозы на 10 мг/кг в день до достижения максимальной дозы 70 мг/кг, или до появления неприемлемых побочных эффектов (тошнота и нарушение моторной деятельности). Проведенное испытание позволило сделать вывод о том, что доза цистеамина, равная 20 мг/кг в день, является приемлемой для людей страдающих болезнью Хантингтона (Dubinsky and Gray, 2006). Однако клиническая эффективность данного вещества не была показана. Даже если их результаты нельзя полностью применить к людям, исследования, проведенные на животных моделях болезни Хантингтона, показали, что для получения значительного терапевтического эффекта требуются гораздо более высокие дозы цистамина или цистеамина. Более того, хотя цистеамин может проникать через гематоэнцефалический барьер (ГЭБ), для обнаружения изменения количества цистеамина или его метаболитов в мозге необходимы большие дозы цистамина или цистеамина (вводимого интраперитонеально или перорально) (Bousquet at al., 2010). Эффективность влияния цистамина и цистеамина на изменение развития болезни Паркинсона, также как и их транспортные свойства в мозге, являются неизвестными.
Существующие способы лечения болезни Паркинсона в основном предназначены для симптоматической терапии, и до сих пор не существует лечения, пригодного для замедления развития заболевания. Следовательно, существует необходимость разработки терапевтических средств, которые могли бы изменять скорость развития болезни Паркинсона.
Авторы настоящего изобретения впервые продемонстрировали, что аналоги цистамина пригодны для применения для лечения болезни Паркинсона.
Согласно настоящему изобретению предложен способ лечения болезни Паркинсона, указанный способ включает введение терапевтически эффективного количества по меньшей мере одного аналога цистамина, его фармацевтически приемлемой соли, композиции или комбинации по настоящему изобретению нуждающемся в этом пациенту.
Согласно настоящему изобретению предложено применение терапевтически эффективного количества по меньшей мере одного аналога цистамина, или его фармацевтически приемлемой соли, композиции или комбинации для лечения болезни Паркинсона у пациента, нуждающегося в этом.
Согласно настоящему изобретению предложено применение терапевтически эффективного количества по меньшей мере одного аналога цистамина или его фармацевтически приемлемой соли в качестве нейроспасательного (neurorescue agent) и/или нейровосстанавливающего агента (neurorestorative agent) для лечения болезни Паркинсона у пациента.
Согласно настоящему изобретению предложена комбинация или фармацевтическая композиция для лечения болезни Паркинсона, содержащая по меньшей мере один аналог цистамина или его фармацевтически приемлемую соль, и содержащая цистеин или его фармацевтически приемлемую соль.
Согласно настоящему изобретению предложено сочетание или лекарственный препарат для лечения болезни Паркинсона, содержащий по меньшей мере один аналог цистамина или его фармацевтически приемлемую соль, используемый в качестве нейрозащитного и/или нейровосстанавливающего средства, и содержащий цистеин или его фармацевтически приемлемую соль.
В еще одном аспекте согласно настоящему изобретению предложено применение аналога цистамина или его фармацевтически приемлемой соли, композиции или комбинации по настоящему изобретению для получения лекарственного средства как описано в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
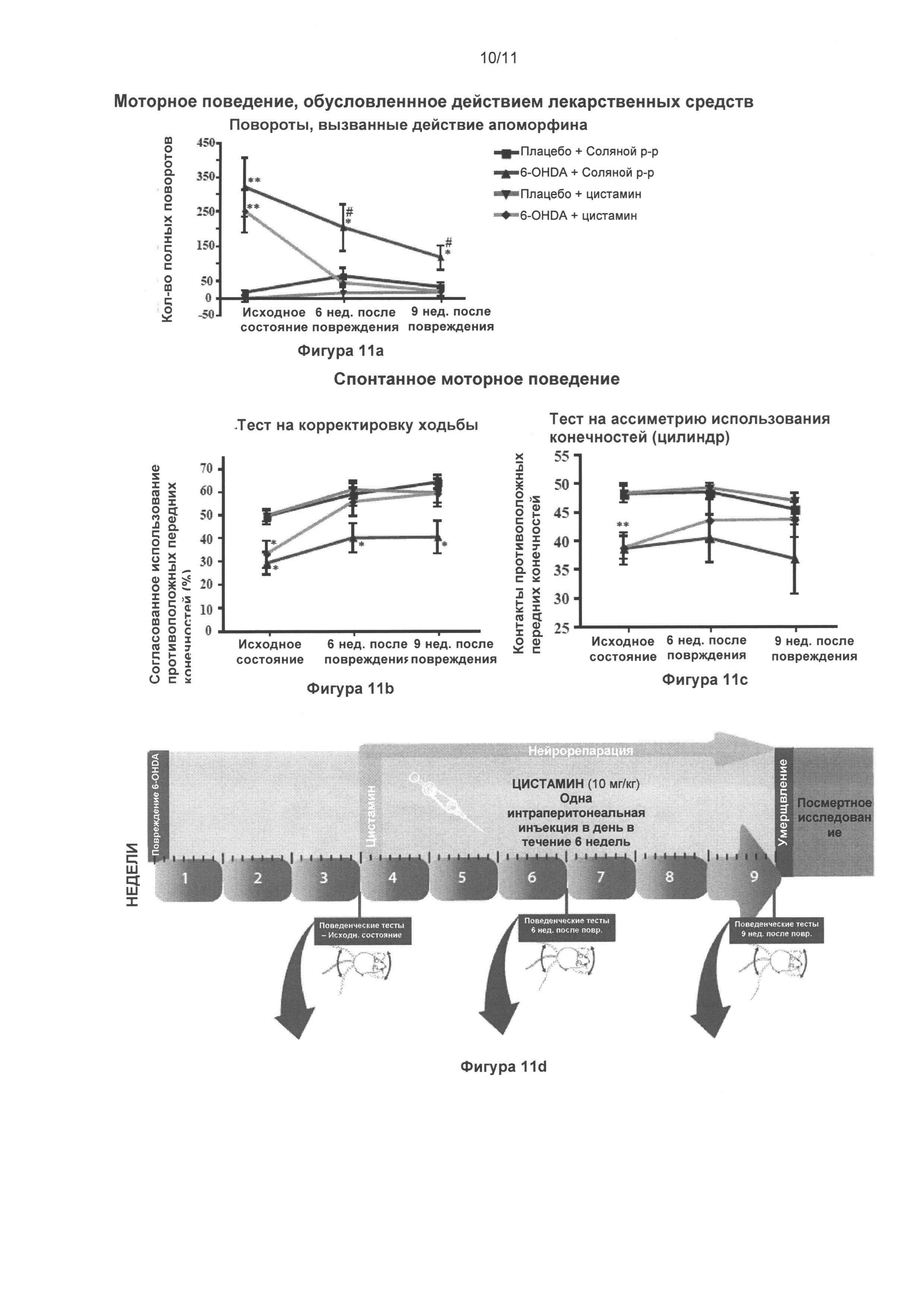
Фигура 1: Положительное влияние цистамина на тирозингидроксилаза-положительные нейроны черной субстанции.
(а) Стереологические подсчеты клеток тирозингидроксилаза (ТГ)-положительных нейронов (TH-positive neurons) в черной субстанции pars compacta (subtantia nigra pars compacta, SNpc) выявили значительное уменьшение общего количества ТГ-положительных нейронов у мышей с поражением вызванным МФТП, подвергнутых лечению солевым раствором, по сравнению с животными группы солевой раствор + солевой раствор (p<0,001). (a) Мыши, прошедшие лечение цистамином перед и после введения МФТП, показали сравнимое число ТГ-положительных нейронов что и животные, прошедшие обработку солевым раствором, (б) Микрофотоснимки SNpc, демонстрирующие повышенное число (сравнимое с солевым раствором) окрашенных крезилом и ТГ-положительных нейронов в солевом растворе и мышах, прошедших лечение цистамином после введения МФТП, по сравнению с мышами, прошедшими лечение солевым раствором после введения МФТП. Таблица (в) приводит обобщенную информацию о стереологических подсчетах указанных крезил- и ТГ-клеток. В нижней части показана хронология проведения экспериментов с предварительным и последующим лечением. Значения выражены как средние ± стандартная ошибка среднего числа. Статистические анализы провели при помощи однофакторного дисперсионного анализа (one-way ANOVA).
Значительное отличие от группы солевой раствор + солевой раствор: ***=p<0,001. Значительное отличие от группы МФТП + солевой раствор: #=p<0,05; ##=p<0,01; ###=p<0,001. Масштабная линейка в (б) = 400 мкм, вставка = 25 мкм. Сокращения: Pre-Tx (лечение цистамином перед МФТП); Post-Tx (лечение цистамином после МФТП).
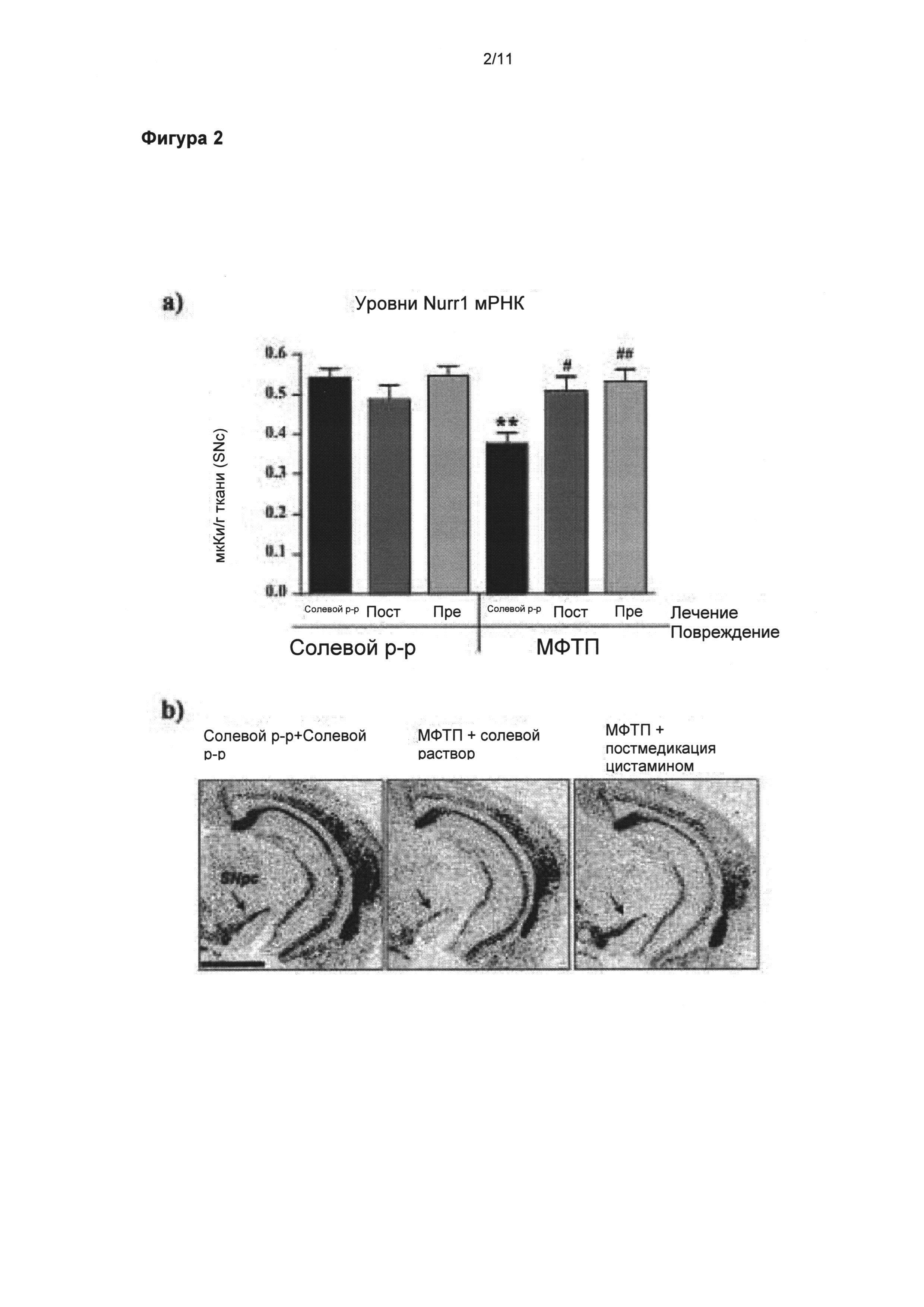
Фигура 2: Полезное влияние цистамина на экспрессию nigral Nurr1 иРНК (mRNA)
(а) Денсиметрические измерения уровней Nurr1 иРНК (гена, связанного с экспрессией и поддержанием фенотипа дофамина (ДА, DA)) в SNpc выявили, что уровни в трех контрольных группах (солевой раствор + солевой раствор; солевой раствор + цистамин Pre-Tx, солевой раствор + цистамин Post-Tx) и у животных, прошедших лечение цистамином после введения МФТП, были подобны, тогда как уровень Nurr1 иРНК у животных, прошедших лечение солевым раствором после введения МФТП, был значительно понижен (p<0,01). (б) Микрофотоснимки на уровне SNpc (см. стрелку) иллюстрируют нормальные уровни Nurr1 иРНК в контрольной группе и в группе мышей, прошедших лечение цистамином после введения МФТП, по сравнению с мышами, прошедшими лечение солевым раствором после введения МФТП (б). Значения выражены как средние ± стандартная ошибка среднего числа. Статистические анализы провели при помощи однофакторного дисперсионного анализа. Значительное отличие от группы солевой раствор + солевой раствор: **=p<0,01. Значительное отличие от группы МФТП + солевой раствор: #=p<0,05; ##=p<0,01. Масштабная линейка в (б) = 1 мм.
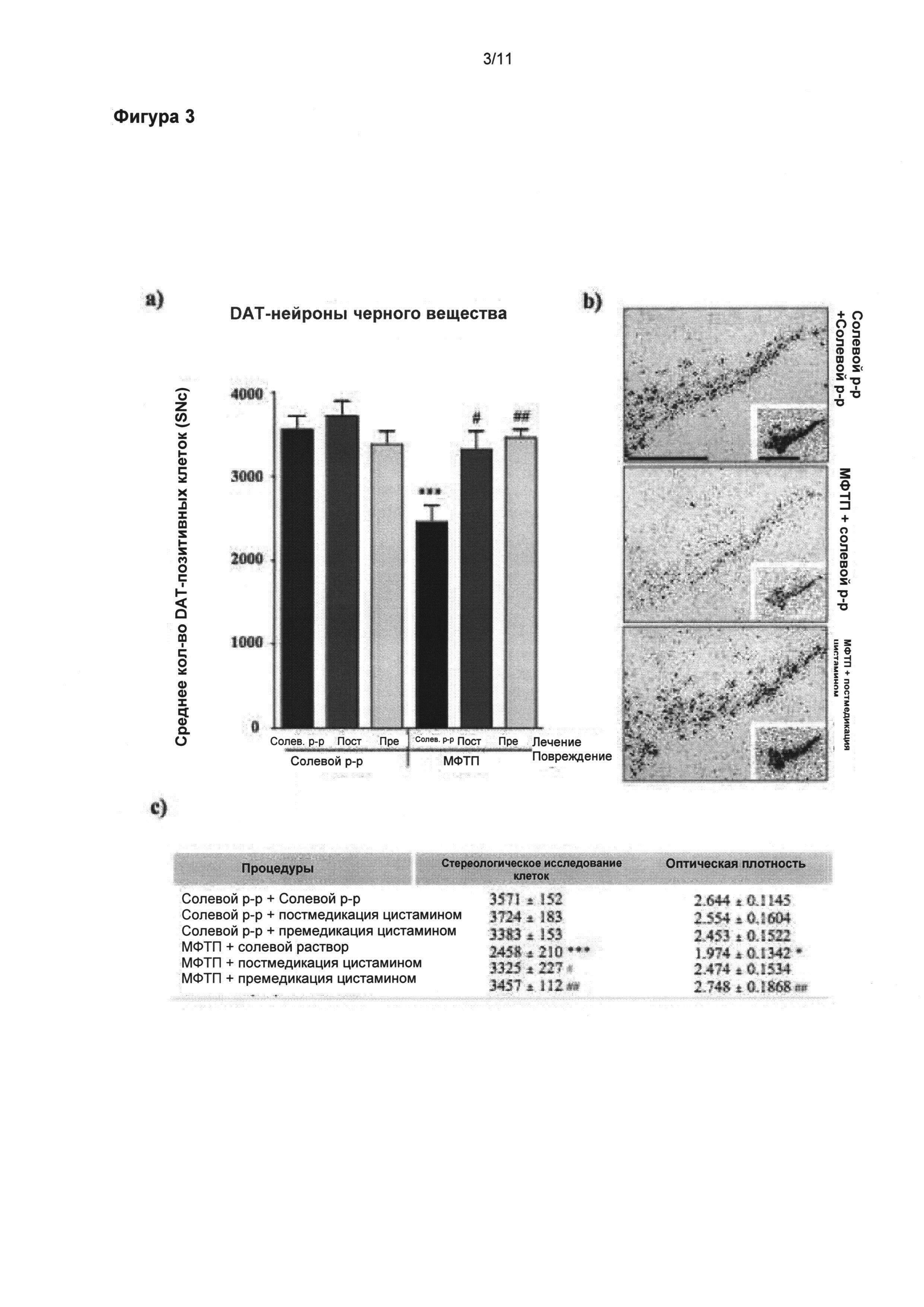
Фигура 3: Полезное влияние цистамина на положительные клетки переносчика дофамина черной субстанции (nigral DAT positive cells)
Экспрессия переносчика дофамина (ПДА, DAT) иРНК была также выявлена при помощи in situ гибридизации. (а) Стереологические подсчеты экспрессирующих клеток ПДА в SNpc показали значительное снижение общего числа нейронов у мышей, прошедших лечение солевым раствором после МФТП, по сравнению с животными группы солевой раствором + солевой раствор (p<0,001). (а) Мыши, прошедшие лечение цистамином перед и после введения МФТП, показали сравнимое число ПДА-положительных нейронов что и животные, прошедшие обработку солевым раствором. (б) Микрофотоснимки SNpc представляют экспрессирующие клетки ПДА иРНК. Вставка изображает авторадиографию ПДА иРНК перед эмульсией (измеренной денсиметрически). Таблица (в) приводит обобщенную информацию о стереологических подсчетах и денситометрических измерениях экспресии ПДА иРНК в SNpc. Значения выражены как средние ± стандартная ошибка среднего числа. Статистические анализы провели при помощи однофакторного дисперсионного анализа. Значительное отличие от группы солевой раствор + солевой раствор: ***=p<0,05. Значительное отличие от группы МФТП + солевой раствор: #=p<0,05; ##=p<0,01. Масштабная линейка в (б) = 400 мкм, вставка = 500 мкм.
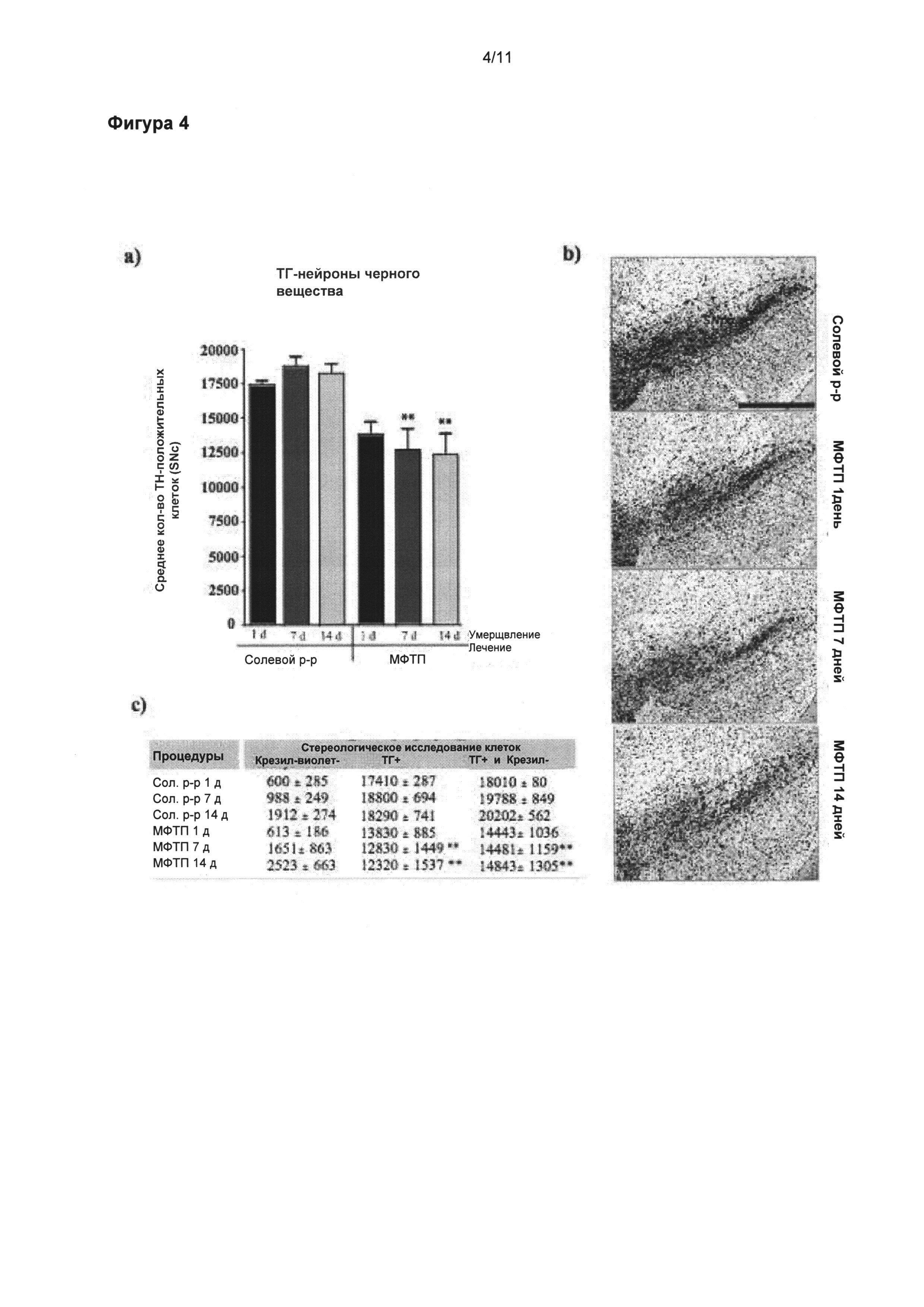
Фигура 4: Динамика потери ТГ-положительных клеток черной субстанции в подострой модели МФТП.
(а) Стереологические подсчеты клеток ТГ-положительных нейронов в SNpc выявили значительное снижение общего числа ТГ-положительных нейронов через 7 и 14 дней после последней инъекции МФТП по сравнению с солевой группой (p<0,01), и группой, получившей препарат через один день после введения МФТП; в данной группе только наблюдалась тенденция к сокращению количества нейронов (р=0,063). (б) Микрофотоснимки SNpc отображают уменьшенное число окрашенных крезилом и ТГ-положительных нейронов в группах через 7 и 14 дней после введения МФТП. Таблица (в) приводит обобщенную информацию о стереологических подсчетах указанных крезил- и ТГ-клеток. Значения выражены как средние ± стандартная ошибка среднего числа. Статистические анализы провели при помощи однофакторного дисперсионного анализа. Значительное отличие от группы солевой раствор: **=p<0,01. Масштабная линейка в (б)=400 мкм.
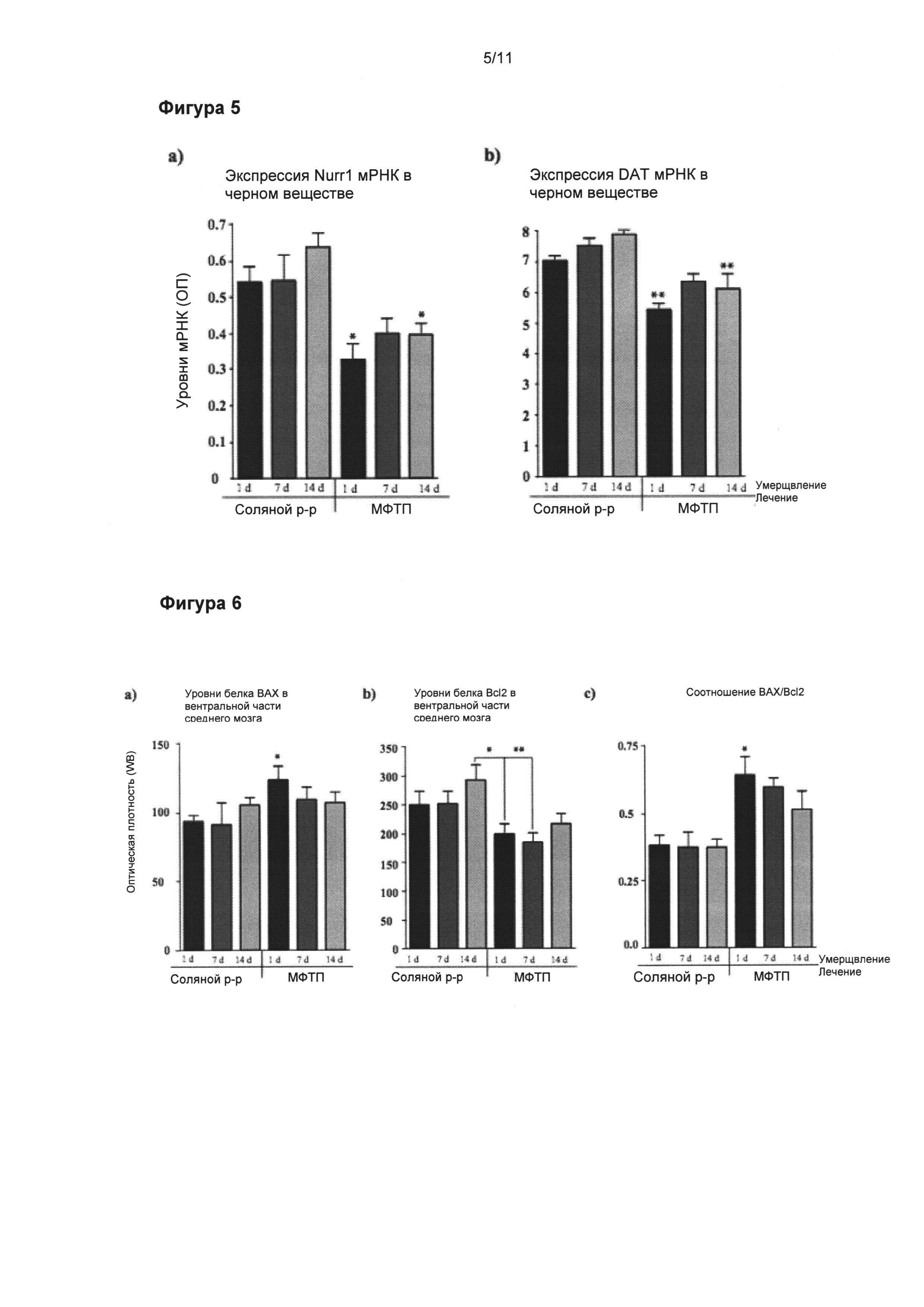
Фигура 5: Динамика снижения экспрессии Nurr1 и ПДА иРНК в подострой модели МФТП.
Денсиметрические измерения экспрессии (a) Nurr1 и (б) ПДА иРНК показали значительно сниженные уровни обоих маркеров ДА в SNpc, начиная от 24 часа после обработки МФТП (p<0,01 и p<0,05, соответственно). Значения выражены как средние ± стандартная ошибка среднего числа. Статистические анализы провели при помощи однофакторного дисперсионного анализа. Значительное отличие от контрольной группы: **=p<0,01. *=p<0,05.
Фигура 6: Динамика апоптического ДА процесса черной субстанции в подострой модели МФТП.
Вестерн-блоттинг уровней белков (а) ВАХ и (б) Bcl-2 в вентральной части среднего мозга. (в) Соотношение ВАХ/Bcl2 значительно увеличилось в течение 24 часов после последней инъекции МФТП (p<0,05), что свидетельствует, что при данном конкретном режиме доставки МФТП апоптический процесс начинается уже в тот момент. Значения выражены как средние ± стандартная ошибка среднего числа. Статистические анализы провели при помощи однофакторного дисперсионного анализа. Значительное отличие от контрольной группы: *=p<0,05.
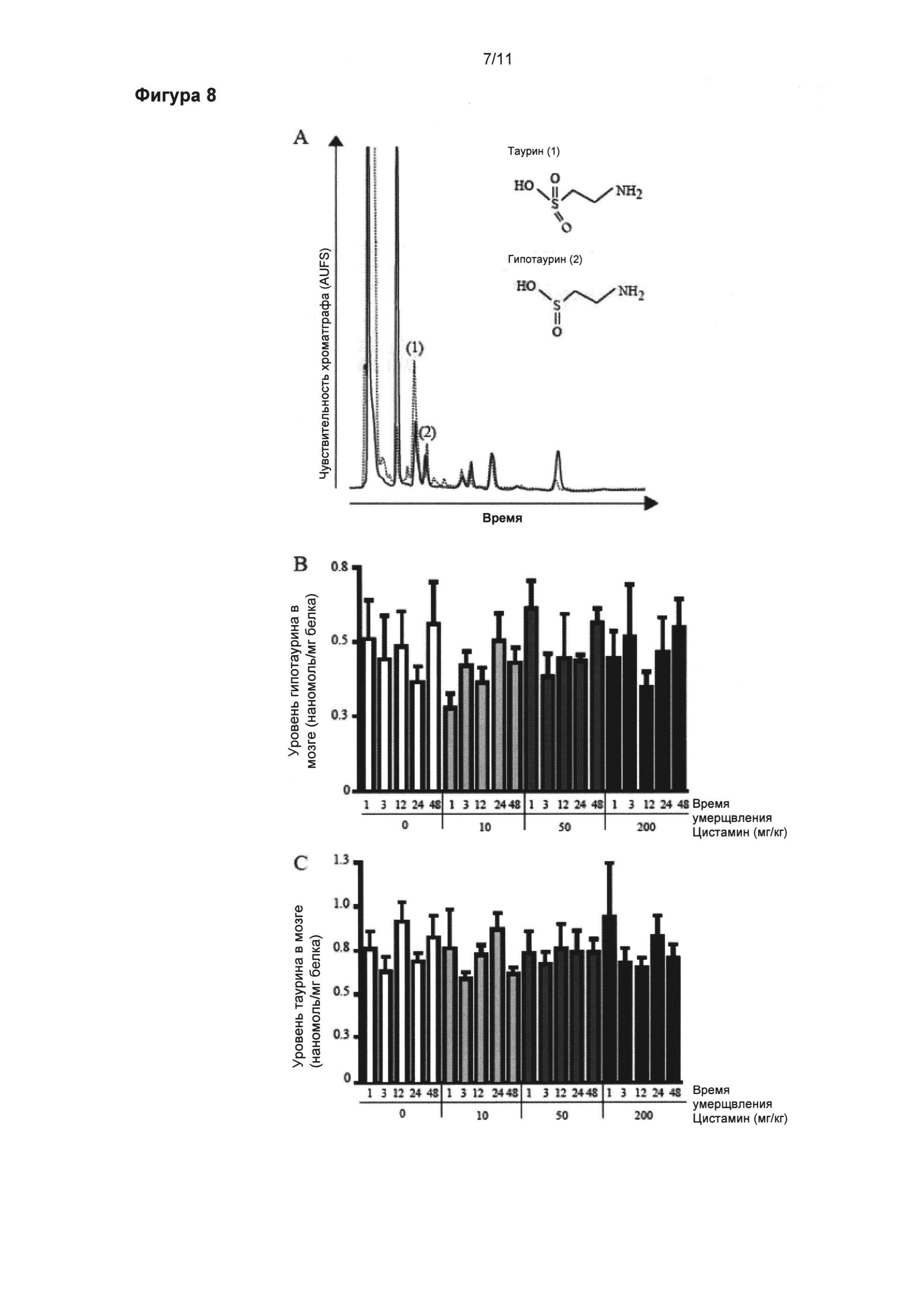
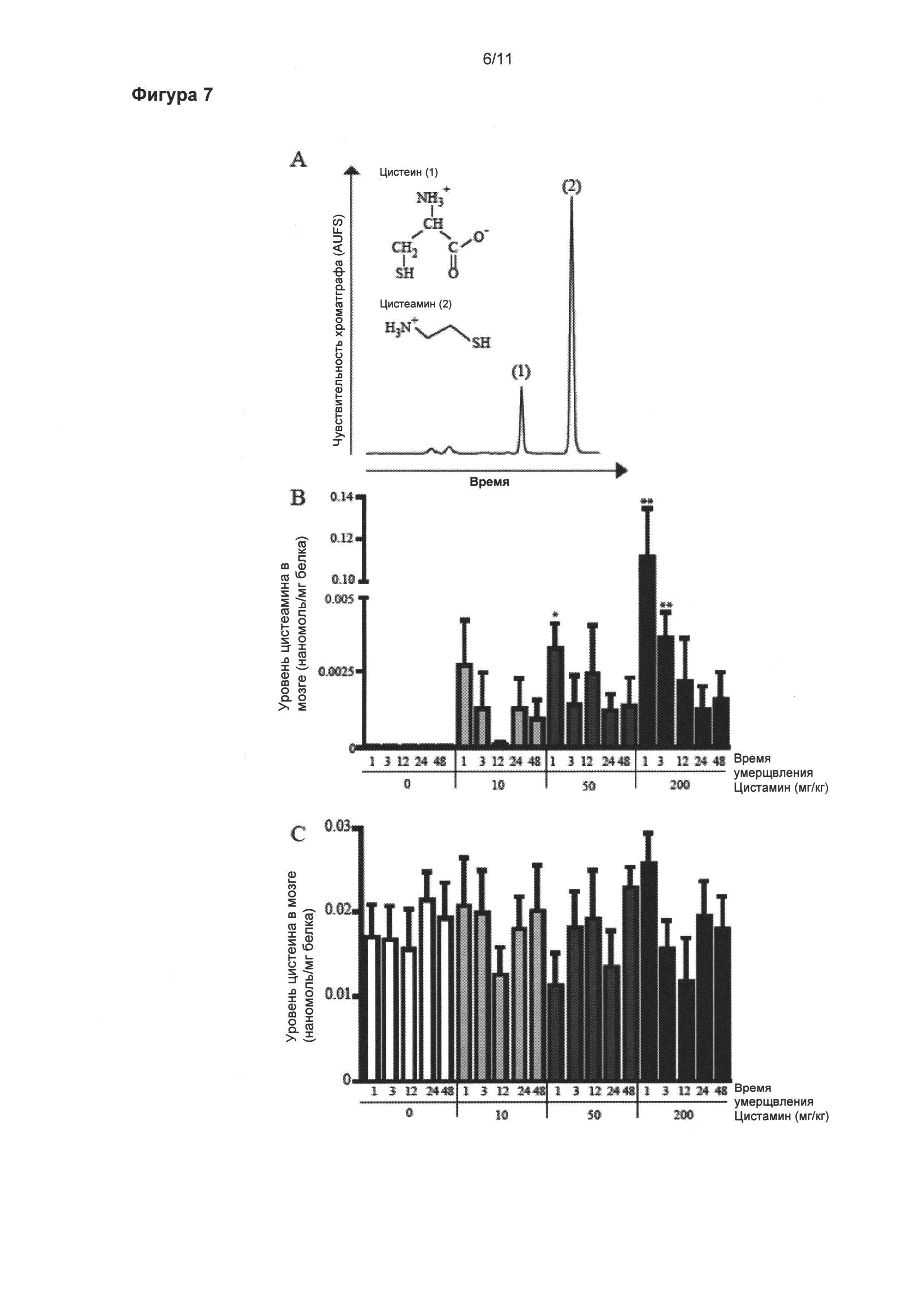
Фигура 7: Увеличенные уровни цистеамина в мозге.
Уровни цистеамина (б) и цистеина (в) в головном мозге измеряли при помощи высокоэффективной жидкостной хроматографии (ВЭЖХ, HPLC) с флуоресцентным детектированием. Молекулярные структуры и ВЭЖХ профили элюирования стандартного раствора цистеамина (2) и цистеина (1) представлены на рисунке (а). Уровень цистеамина значительно увеличился в ответ на одну интреперитонеальную инъекцию 50 мг/кг цистамина мышам, умерщвленным через 1 час после введения, в сравнении с мышами, подвергнутыми введению носителя, умерщвленными в то же самое время (p<0,05) (б). Доза в 200 мг/кг, также провоцирует значительное увеличение уровня цистеамина через 1 и 3 часа после инъекции цистамина (p<0,01) (б). Уровни цистеина в мозге оставались без изменений независимо от доз и времени перфузии (в). Данные выражены как средние (нмоль/мг белка) ± стандартная ошибка среднего числа *p<0,05; **p<0,01.
Фигура 8: Постоянные уровни гипотаурина и таурина в мозге.
Концентрации гипотаурина (б) и таурина (в) в мозге измеряли при помощи ВЭЖХ с ультрафиолетовым детектированием. Молекулярные структуры и ВЭЖХ профили элюирования стандартного раствора, содержащего 1 нг/мл таурина (1) и гипотаурина (2), представлены на рисунке (а). Наблюдались стабильные оценки гипотаурина (б) и таурина (в). Данные выражены как средние (нмоль/мг белка) ± стандартная ошибка среднего числа.
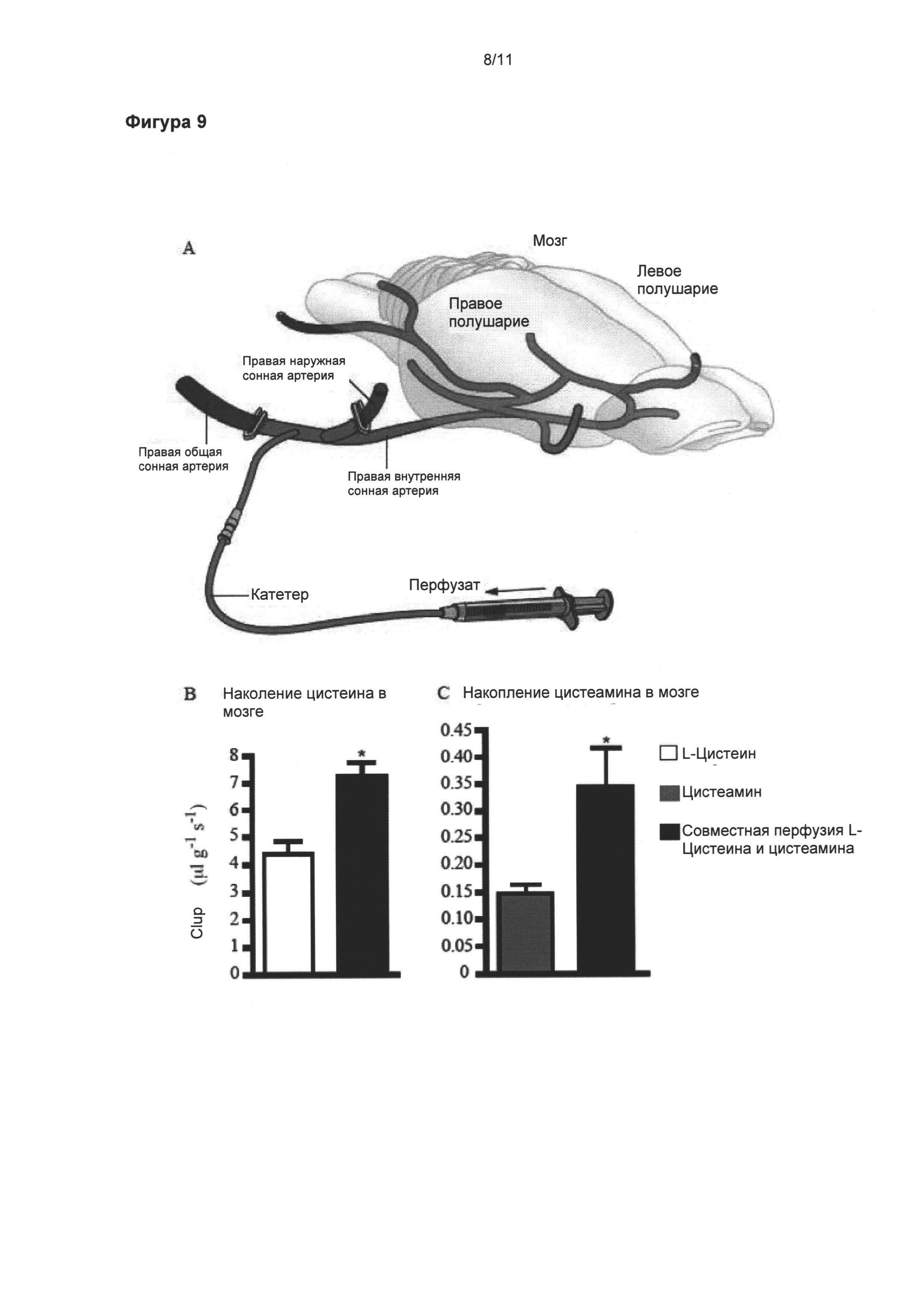
Фигура 9: Увеличенное поглощение цистеамина мозгом в присутствии цистеина.
Демонстрация поглощения мозгом цистеамина и цистеина с использованием техники in situ перфузии головного мозга и количественной оценкой методом ВЭЖХ. Схематическое изображение способа in situ перфузии головного мозга (а). Катетер введен непосредственно в правую внутреннюю сонную артерию для обеспечения 100% попадания перфузата в правое полушарие после соответственного лигирования (сосуды синего цвета) (а). Цистеин (б) и цистеамин (в) оба могут проникать через гематоэнцефалический барьер, что демонстрировалось высоким коэффициентом клиренса каждой молекулы (мкл/г/с). При одновременной перфузии цистеина и цистеамина коэффициенты клиренса значительно повышаются. Данные выражены как средние (мкл/г/с) ± стандартная ошибка среднего числа *p<0,05.
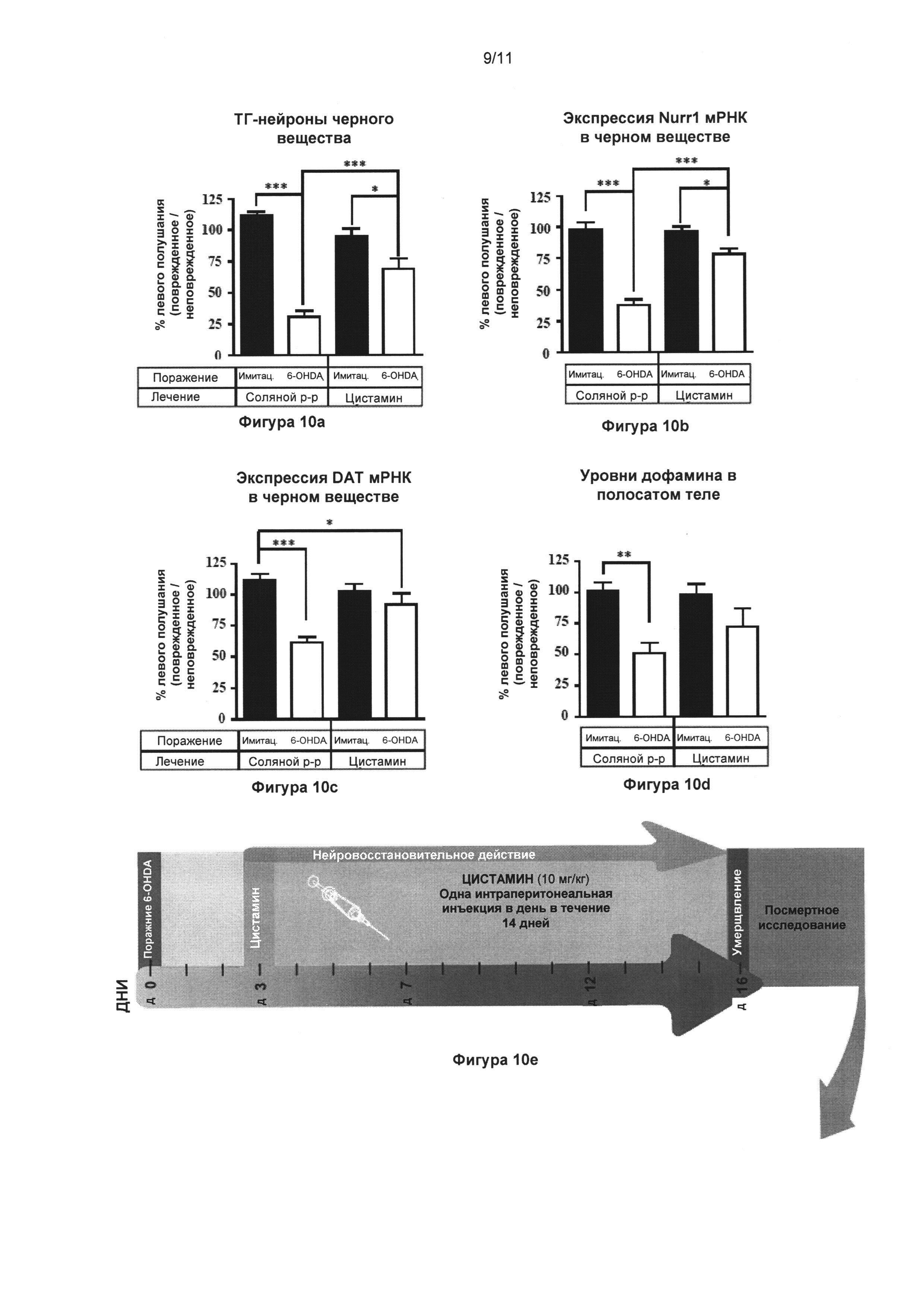
Фигура 10: Цистамин спасает дофаминергические нейроны в односторонней стриарной модели мышей, у которых болезнь Паркинсона вызвали при помощи введения 6-гидроксидопамина.
Часть (Е) иллюстрирует динамику эксперимента. Всем мышам односторонне интрастриарно инъектировали 6-гидроксидопамин (4 мкг) или эквивалентное количество носителя (плацебо). Спустя три дня во время идущего дофаминэргического дегенеративного процесса мыши получали лечение 10 мг/кг цистамина (или солевого раствора) ежедневно в течение 14 дней. Через 24 часа после последней инъекции цистамина мышей транскардиально подвергали перфузии и извлекали мозг для посмертных анализов. (А) Стереологический подсчет клеток ТГ-положительных нейронов в SNpc обнаружил значительное (72%) снижение общего количества ТГ-положительных нейронов у мышей с поражением, вызванным 6-гидроксидопамином, которым вводили солевой раствор, по сравнению с животными группы плацебо + солевой раствор (p<0,001). Мыши с поражением, вызванным 6-гидроксидопамином, которым ввели цистамин, показывали только 27% снижение общего количества ТГ-положительных нейронов по сравнению с животными группы плацебо + цистамин (p<0,05). Группа 6-гидроксидопамин + солевой раствор значительно отличалась от группы 6-гидроксидопамин + цистамин (p<0,001). (Б) и (В) Денсиметрические измерения уровней Nurr1 и ПДА иРНК в SNpc, соответственно. Данные два дополнительных маркера дофаминэргической целостности выявили ту же самую модель, что наблюдалась у окрашенных ТГ в (А), подтверждающую нейроспасательные свойства цистамина. (Г) Измерения содержания ДА в стриарном теле осуществляли при помощи ВЭЖХ, показавшей значительное снижение уровней ДА только в группе мышей с поражением, вызванным 6-гидроксидопамином, прошедшей лечение солевым раствором, по сравнению с контрольной группой (p<0,01). Значения выражены как средние ± стандартная ошибка среднего числа. Статистические анализы провели при помощи однофакторного дисперсионного анализа. *=p<0,05; **=p<0,01; ***=p<0,001.
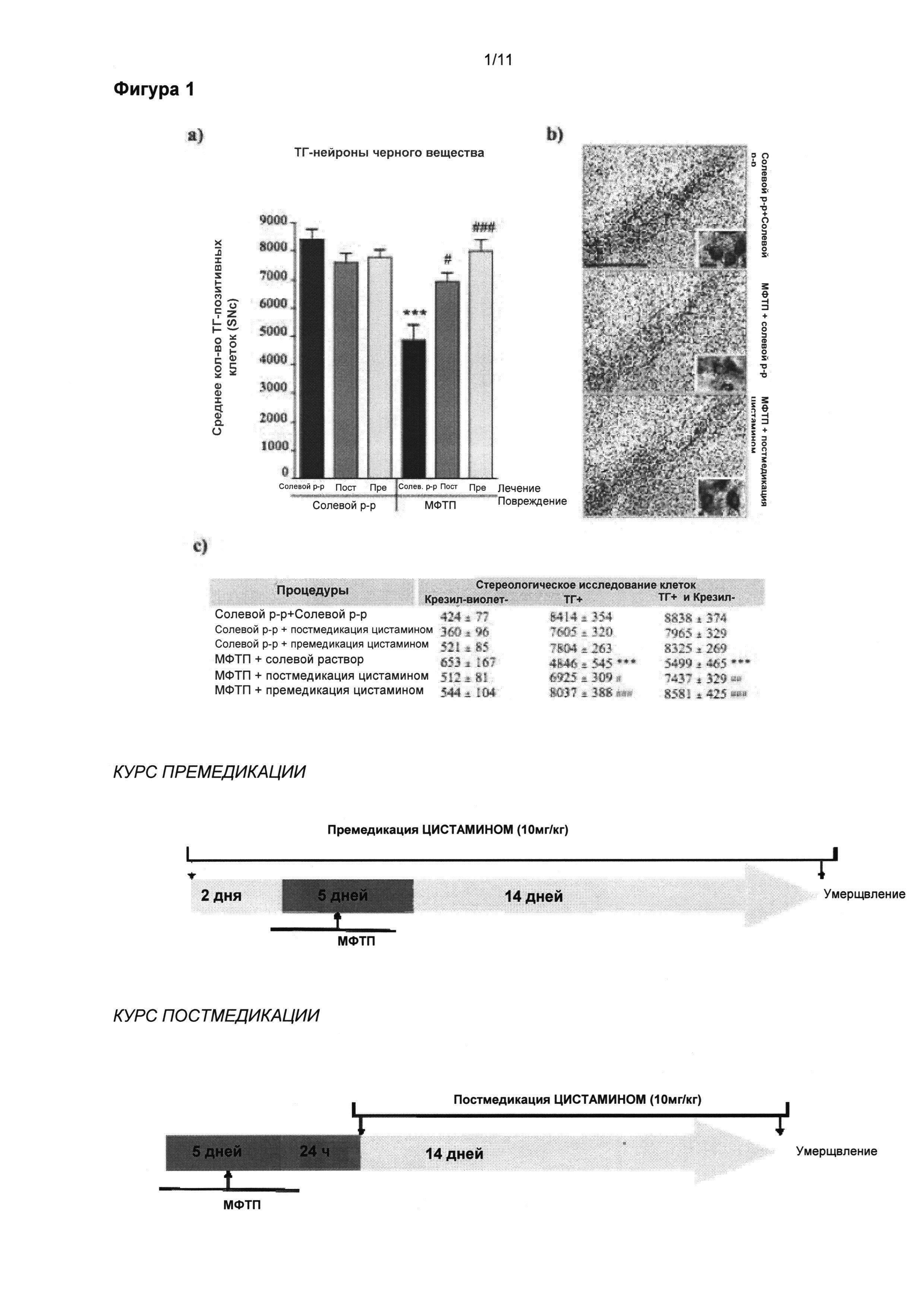
Фигура 11: Цистамин обращает нарушения поведения у мышей, вызванные поражениями в стриарном теле, пораженном 6-гидроксидопамином.
Часть (Г) иллюстрирует динамику проведения эксперимента. Всем мышам односторонне интрастриарно инвестировали 6-гидроксидопамин (4 мкг) или эквивалентное количество носителя (плацебо). Через три недели, когда поражения были стабильными, и была достигнута максимальная дегенерация, мыши получали лечение в дозировке 10 мг/кг цистамином (или солевым раствором) ежедневно в течение 6 недель. В ходе эксперимента мышей оценивали при помощи трех различных тестов в три различных момента времени: до начала лечения цистамином (через три недели после хирургического вмешательства), через 6 недель и через 9 недель после поражения. Поведенческие тесты подобрали для оценки сенсорно-двигательной асимметрии, показывающей степень одностороннего дофаминэргического поражения. (А) Совокупные контралатеральные вращения, вызванные апоморфином, измеряли при помощи ротометра. Одностороннее поражение, вызванное 6-гидроксидопамином, привело к значительному увеличению количества контралатеральных вращений через 3, 6 и 9 недель после возникновения нарушения; и значительно ослабилось вследствие лечения цистамином через 6 и 9 недель после хирургического вмешательства (p<0,05). (Б) Шаговый тест выявил снижение процента подстраивающихся шагов для контралатеральной передней лапы (по сравнению с ипсилатеральной). (В) Асимметрию использования конечностей также показали для цилиндрового теста, в котором мыши с поражением, вызванным 6-гидроксидопамином, показали значительное снижение процента контралатеральных контактов через 3, 6 и 9 недель после хирургического вмешательства, по сравнению с группой плацебо. Данную асимметрию не наблюдали у мышей с поражением, вызванным 6-гидроксидопамином, подвергнутых лечению цистамином через 6 и 9 недель после возникновения поражения. Значения выражены как средние ± стандартная ошибка среднего числа. Статистические анализы провели при помощи однофакторного дисперсионного анализа. *=p<0,05; **=p<0,01; ***=p<0,001.
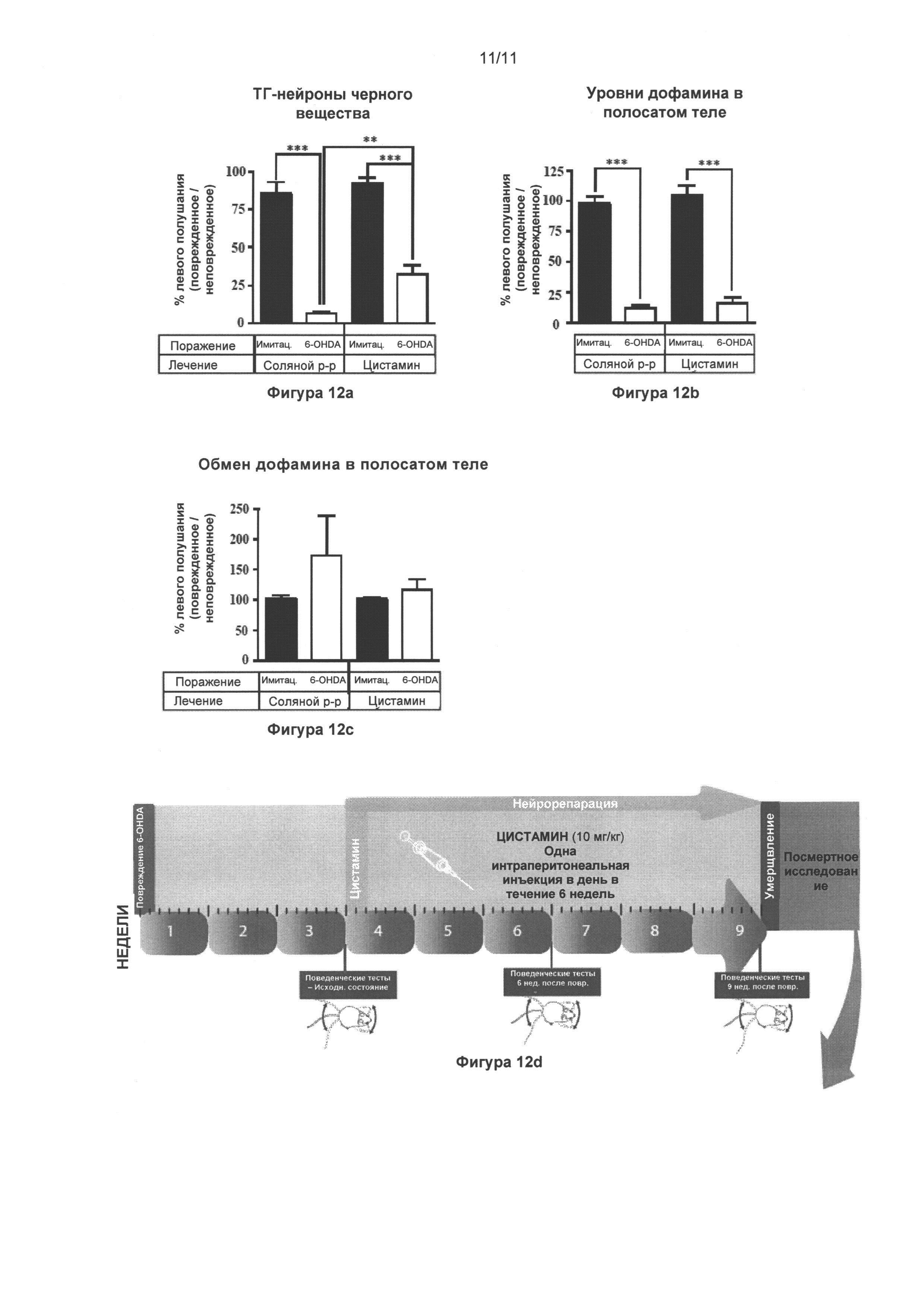
Фигура 12: Цистамин восстанавливает некоторые аспекты дофаминергической системы черной субстанции, и изменяет содержание катехоламинов в полосатом теле и динамику односторонней стриарной модели болезни Паркинсона у мышей с поражением, вызванным 6-гидроксидопамином.
Часть (Г) иллюстрирует динамику проведения эксперимента. Как показано на Фиг. 11, всем мышам односторонне интрастриарно инъектировали 6-гидроксидопамин (4 мкг) или эквивалентное количество носителя (плацебо), и лечение цистамином (или солевым раствором) начинали через 3 недели по истечении 6-недельного срока. Через 24 часа после последнего введения цистамина мышей повергали транскардиальной перфузии и обработали мозг для посмертных анализов. (А) Стереологический подсчет клеток ТГ-положительных нейронов в SNpc обнаружил значительное (93%) снижение общего количества ТГ-положительных нейронов у мышей с поражением, вызванным 6-гидроксидопамином, которым вводился солевой раствор, по сравнению с животными группы плацебо + солевой раствор (p<0,001). Мыши с поражениями, вызванными 6-гидроксидопамином, которые прошли лечение цистамином, обнаружили только 65% снижение общего числа ТГ-положительных нейронов, по сравнению с группой животных плацебо + цистамин (p<0,001). Группа 6-гидроксидопамин + солевой раствор, существенно отличалась от группы 6-гидроксидопамин + цистамин (p<0,01). (Б) ДА уровни цистамина, измеренные ВЭЖХ на мышах с поражениями, вызванными 6-гидроксидопамином, снизились на 88% и 84% в группах животных, подвергнутых лечению солевым раствором и цистамином, соответственно (p<0,001). Цистамин восстанавливает содержание ДА в пораженном полосатом теле незначительно. (В) Однако цистамин оказывал сильное влияние на нормализацию оборота ДА, по сравнению с группой мышей с поражением, вызванным 6-гидроксидопамином и подвергнутых лечению солевым раствором, что значимо соотносится с тестами поведенческой оценки поражений (данные не показаны). Значения выражены как средние ± стандартная ошибка среднего числа. Статистические анализы провели при помощи однофакторного дисперсионного анализа. *=p<0,05; **=p<0,01; ***=p<0,001.
ПРИМЕНЕНИЕ И МЕТОДЫ
В одном из вариантов осуществления настоящего изобретения, аналоги цистамина и его фармацевтически приемлемые соли могут использоваться в качестве нейроспасательного агента и/или нейровосстанавливающего агента. Данное нейроспасающее/нейровосстанавливающее действие можно отличить от действия нейрозащитного агента.
В контексте настоящего изобретения, «нейрозащитный агент» может защитить оставшиеся «здоровые» нейроны от дегенеративного процесса. Таким образом, следует понимать, что нейрозащитный агент может быть введен в момент постановки диагноза.
В контексте настоящего изобретения, «нейроспасательный агент» может остановить нейродегенеративный процесс у пораженных, но не отмерших, нейронов, что может сопровождаться функцональным восстановлением. Таким образом, можно понять, что нейроспасательный агент должен быть прописан так рано, как это возможно, но может быть введен только после постановки диагноза БП.
В контексте настоящего изобретения, «нейровосстанавливающий агент» может восстановить функцию посредством функционального и/или структурного восстановления и регенерации пораженных нейронов. Таким образом, можно иметь в виду, что нейровосстанавливающий агент является весьма актуальным в клиническом применении для БП, т.к. может показать максимальную эффективность после постановки диагноза.
В еще одном варианте осуществления настоящего изобретения, аналоги цистамина и его фармацевтически приемлемые соли могут быть применены для лечения болезни Паркинсона.
В одном из вариантов осуществления настоящего изобретения, «лечение болезни Паркинсона» характеризуется а) ослаблением нейродегенеративного процесса за счет антиапоптозного воздействия на пораженные, но не отмершие, нейроны с возможным восстановлением функциональности; и/или б) функциональным и/или структурным восстановлением и регенерацией.
В еще одном варианте осуществления настоящего изобретения, «лечение болезни Паркинсона» характеризуется одним из следующих механизмов:
а) ослабление нейродегенеративного процесса за счет антиапоптозного воздействия на пораженные, но не отмершие, нейроны с возможным восстановлением функциональности; и/или
б) функциональное и/или структурное восстановление и регенерация пораженных нейронов; и/или
в) способствование нейрогенезу.
В еще одном варианте осуществления настоящего изобретения, развитие болезни Паркинсона измеряется при помощи оценки по Общей Унифицированной рейтиновой шкале оценки симптомов болезни Паркинсона (УШОСБП). Увеличение показателя по Общей УШОСБП означает развитие симптомов болезни Паркинсона, а прирост увеличения показателя по Общей УШОСБП в течение определенного времени означает скорость развития болезни Паркинсона. См, например: Goetz CG, Tilley ВС, Shaftman SR, Stebbins GT, Fahn S, Martinez-Martin P, Poewe W, Sampaio C, Stern MB, Dodel R et al. (2008) Movement Disorder Society-sponsored revision of the Unified Parkinson's Disease Rating Scale (MDS-UPDRS): scale presentation and clinimetric testing results. Mov Disord 23: 2129-2170.
В еще одном варианте осуществления указанного способа, промежуток времени составляет 12, 24 или 36 недель после начала введения аналога цистамина или его фармацевтически приемлемой соли.
В контексте настоящего изобретения, этапы болезни Паркинсона у пациента описаны в работе Хена и Яра в следующих пяти стадиях, в зависимости от симптомов (Hoehn ММ, Yahr МD, Parkinsonism: onset, progression and mortality. Neurology 1967, 17: 427-42).
Стадия I: (легкая или ранняя болезнь): Симптомы проявляются только на одной стороне тела.
Стадия II: Симптомы проявляются на обеих сторонах тела, но осанка остается нормальной.
Стадия III (умеренная болезнь): Симптомы проявляются на обеих сторонах тела, в стоячем положении или при ходьбе наблюдается незначительное нарушение равновесия. Тем не менее, человек не нуждается в уходе.
Стадия IV (прогрессирующая болезнь): Симптомы проявляются на обеих сторонах тела, в стоячем положении или при ходьбе наблюдается нарушение равновесия, приводящее к потере трудоспособности. На данной стадии больной нуждается в значительном уходе.
Стадия V: Тяжелая, присутствует полное развитие болезни. Больной ограничен постелью или креслом.
В контексте настоящего изобретения, «пациент на ранней стадии болезни Паркинсона» означает пациента на Стадии I или II болезни Паркинсона, в соответствии с классификацией, предложенной Хеном и Яром, который не нуждается в симптоматическом лечении болезни Паркинсона. В одном из вариантов осуществления настоящего изобретения, пациенту на данной стадии болезни Паркинсона симптоматическое лечение не потребуется еще как минимум в течение следующих 9 месяцев. Пациент на ранней стадии болезни Паркинсона идентифицируется как таковой путем выполнения соответствующего тестирования.
В одном из вариантов осуществления настоящего изобретения пациент представляет собой пациента, находящегося на ранней стадии болезни Паркинсона.
В еще одном варианте осуществления настоящего изобретения пациент, находящийся на ранней стадии болезни Паркинсона, представляет собой пациента на Стадии I в соответствии с классификацией, предложенной Хеном и Яром.
В еще одном варианте осуществления настоящего изобретения пациент, находящийся на ранней стадии болезни Паркинсона, представляет собой пациента, имеющего по шкале УШОСБП общий счет менее 30; менее 25; менее 23; менее 21 или менее 20.
В еще одном варианте осуществления настоящего изобретения пациент с болезнью Паркинсона представляет собой пациента на стадии болезни Паркинсона I, II, III, IV или V в соответствии с классификацией, предложенной Хеном и Яром.
В еще одном варианте осуществления настоящего изобретения пациент с болезнью Паркинсона представляет собой пациента на стадии болезни Паркинсона III, IV или V в соответствии с классификацией, предложенной Хеном и Яром.
В еще одном варианте осуществления настоящего изобретения пациент с болезнью Паркинсона представляет собой пациента на стадии болезни Паркинсона III или IV в соответствии с классификацией, предложенной Хеном и Яром.
В еще одном варианте осуществления настоящего изобретения пациент с болезнью Паркинсона представляет собой пациента на стадии болезни Паркинсона III в соответствии с классификацией, предложенной Хеном и Яром.
Настоящее изобретение относится к применениям и способам для: снижения утомляемости пациента с болезнью Паркинсона; снижения тяжести симптомов, не связанных с двигательной активностью, у пациента с болезнью Паркинсона; замедления функциональных расстройств у пациента с болезнью Паркинсона; ослабление процесса клинического развития заболевания; или замедления клинического развития заболевания.
Согласно настоящему изобретению также предложен способ лечения пациента с симптомами болезни Паркинсона, включающий идентификацию пациентов с симптомами болезни Паркинсона, и периодическое введение идентифицированному указанным образом пациенту эффективного количества аналога цистамина, его фармацевтически приемлемой соли, или композиции или комбинации по настоящему изобретению, для лечения указанного пациента.
Настоящее изобретение относится к способу замедления или ослабления у пациентов развития болезни Паркинсона, включающий введение указанному пациенту терапевтически эффективного количества как минимум одного аналога цистамина, его фармацевтически приемлемой соли, композиции или комбинации по настоящему изобретению.
Настоящее изобретение относится к применению терапевтически эффективного количества как минимум одного аналога цистамина или его фармацевтически приемлемой соли, композиции или комбинации по настоящему изобретению для замедления развития болезни Паркинсона у пациента с болезнью Паркинсона.
Согласно настоящему изобретению также предложено применение терапевтически эффективного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции или комбинации по настоящему изобретению для замедления клинического развития болезни Паркинсона у пациента с болезнью Паркинсона.
Согласно настоящему изобретению также предложен способ замедления клинического развития болезни Паркинсона у пациента с болезнью Паркинсона, включающий введение пациенту терапевтически эффективного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции или комбинации по настоящему изобретению.
Согласно настоящему изобретению также предложено применение терапевтически эффективного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции или комбинации по настоящему изобретению для снижения тяжести не связанных с двигательной активностью симптомов у пациента с болезнью Паркинсона.
Согласно настоящему изобретению также предложен способ снижения тяжести не связанных с двигательной активностью симптомов у пациента с болезнью Паркинсона, включающий введение указанному пациенту терапевтически эффективного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции или комбинации по настоящему изобретению.
Согласно настоящему изобретению также предложен способ лечения пациента, имеющего стадию I, II, III, IV или V болезни Паркинсона (в соответствии с классификацией, предложенной Хеном и Яром), включающий идентификацию пациентов с симптомами болезни Паркинсона, и периодическое введение идентифицированному указанным образом пациенту эффективного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции, или комбинации по настоящему изобретению, для лечения указанного пациента.
Согласно настоящему изобретению также предложен аналог цистамина, или его фармацевтически приемлемая соль, или композиция или комбинация по настоящему изобретению для применения для лечения пациента с симптомами ранней болезни Паркинсона.
Согласно настоящему изобретению также предложена фармацевтическая композиция, содержащая фармацевтически эффективное количества аналога цистамина, или его фармацевтически приемлемой соли, или композиция, или комбинация по настоящему изобретению, для применения для снижения скорости развития болезни Паркинсона у пациента на ранней стадии болезни Паркинсона.
Согласно настоящему изобретению также предложено применение терапевтически эффективного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции, или комбинации по настоящему изобретению, для лечения пациента с симптомами ранней болезни Паркинсона.
Согласно настоящему изобретению также предложен способ лечения пациента с симптомами ранней болезни Паркинсона, включающий идентификации пациентов с симптомами ранней болезни Паркинсона, и периодическом введении идентифицированному указанным образом пациенту определенного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции, или комбинации по настоящему изобретению, для эффективного лечения указанного пациента.
Согласно настоящему изобретению также предложен аналог цистамина, или его фармацевтически приемлемая соль, или композиция или комбинация по настоящему изобретению для применения для снижения утомляемости у пациента на ранней стадии болезни Паркинсона.
Согласно настоящему изобретению также предложено применение терапевтически эффективного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции или комбинации по настоящему изобретению, для снижения утомляемости у пациента на ранней стадии болезни Паркинсона.
Согласно настоящему изобретению также предложен способ снижения утомляемости у пациента на ранней стадии болезни Паркинсона, включающий идентификацию пациента как пациента с симптомами ранней стадии болезни Паркинсона, и периодическом введении идентифицированному указанным образом пациенту эффективного количества аналога цистамина или его фармацевтически приемлемой соли для снижения утомляемости.
Согласно настоящему изобретению также предложен способ снижения тяжести не связанных с двигательной активностью симптомов у пациента на ранней стадии болезни Паркинсона, включающий идентификацию пациента как пациента с симптомами ранней стадии болезни Паркинсона, и периодическое введение идентифицированному указанным образом пациенту эффективного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции или комбинации по настоящему изобретению, для снижения тяжести симптомов, не связанных с двигательной активностью.
Согласно настоящему изобретению также предложен способ снижения утомляемости у пациента на ранней стадии болезни Паркинсона, включающий периодическое введение указанному пациенту на ранней стадии болезни Паркинсона эффективного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции или комбинации по настоящему изобретению, для снижения утомляемости.
Согласно настоящему изобретению также предложен способ снижения тяжести не связанных с двигательной активностью симптомов у пациентов на ранней стадии болезни Паркинсона, включающий периодическое введение пациенту на ранней стадии болезни Паркинсона эффективного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции или комбинации по настоящему изобретению для снижения тяжести не связанных с двигательной активностью симптомов.
Согласно настоящему изобретению также предложен способ замедления клинического развития болезни Паркинсона у пациентов с болезнью Паркинсона, включающий периодическое введение указанному пациенту с болезнью Паркинсона эффективного количества аналога цистамина, или его фармацевтически приемлемой соли, или композиции или комбинации по настоящему изобретению, для замедления клинического развития болезни Паркинсона у указанного пациента.
Согласно настоящему изобретению также предложен аналог цистамина, или его фармацевтически приемлемая соль, или композиция или комбинация по настоящему изобретению, для применения для замедления скорости развития болезни Паркинсона у пациента на ранней стадии болезни Паркинсона.
Согласно настоящему изобретению также предложен аналог цистамина, или его фармацевтически приемлемая соль, или композиция или комбинация по настоящему изобретению, для применения для ослабления функциональных расстройств у пациентов на ранней стадии болезни Паркинсона.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И АНАЛОГИ ЦИСТАМИНА
В одном аспекте настоящего изобретения, аналог цистамина представляет собой цистеамин, цистамин, таурин, гипотаурин или их фармацевтически приемлемую соль.
В другом аспекте настоящего изобретения, аналог цистамина представляет собой цистамин или цистеамин или их фармацевтически приемлемую соль.
В другом аспекте настоящего изобретения, аналог цистамина представляет собой битартрат цистеамина.
В другом аспекте настоящего изобретения, аналог цистамина представляет собой гидрохлорид цистеамина.
В другом аспекте настоящего изобретения, аналог цистамина представляет собой дихлоргидрат цистамина.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая по меньшей мере один аналог цистамина или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель или вспомогательное вещество.
В другом аспекте настоящего изобретения предложена комбинация, содержащая аналог цистамина или его фармацевтически приемлемую соль, и один или более дополнительных агентов, таких как бромокриптин, бензотропин, леводопа, ропинирол, прамипексол, ротиготин, каберголин, энтакопон, толкапон, амантидин, селегилин и разагилин.
В еще одном аспекте настоящего изобретения предложено применение аналога цистамина или его фармацевтически приемлемой соли, композиции или комбинации по настоящему изобретению, для производства лекарственного средства для лечения болезни Паркинсона у пациента.
В соответствии с еще одним вариантом осуществления настоящего изобретения, соединения по настоящему изобретению могут быть представлены следующими формулами:
NH2-(CH2)2-SH
Цистеамин
NH2-(CH2)2-S-S-(CH2)2-NH2
Цистамин
NH2-(CH2)2-S(O2)-OH
Таурин
NH2-(CH2)2-S(O)-OH
Гипотаурин
или их фармацевтически приемлемая соль.
Аналоги цистамина или их фармацевтически приемлемую соль можно получить с использованием способов, хорошо известных в данной области. Указанные соединения доступны из различных источников, например, в компании Sigma-Aldrich, Сент-Луис, штат Миссури, США.
В одном варианте осуществления настоящего изобретения предложена фармацевтическая композиция, содержащая как минимум один аналог цистамина или его фармацевтически приемлемую соль, как описано в настоящем изобретении, и дополнительно содержит по меньшей мере один дополнительный агент, в котором дополнительный агент представляет собой цистеин.
В еще одном варианте осуществления настоящего изобретения предложена фармацевтическая композиция, содержащая по меньшей мере один аналог цистамина или его фармацевтически приемлемую соль, как описано в настоящем изобретении, и дополнительно содержит по меньшей мере один дополнительный агент, в котором дополнительный агент представляет собой L-цистеин.
В еще одном варианте осуществления настоящего изобретения предложена комбинация, содержащая по меньшей мере один аналог цистамина, как описано в настоящем изобретении, и один или более дополнительных агентов.
В одном варианте осуществления настоящего изобретения, дополнительный агент представляет собой цистеин.
В одном варианте осуществления настоящего изобретения, дополнительный агент представляет собой L-цистеин.
В одном варианте осуществления настоящего изобретения, аналог цистамина и цистеин присутствуют в соотношении от 10:1 до 1:10 к аналогу цистамина и цистеина, соответственно. В еще одном варианте осуществления настоящего изобретения, аналог цистамина и цистеин присутствуют в соотношении 1:1.
В одном варианте осуществления комбинации по настоящему изобретению, аналог цистамина и дополнительный агент вводят или пригодны для применению последовательно.
В еще одном варианте осуществления комбинации по настоящему изобретению аналог цистамина и дополнительный агент вводят или пригодны для применения одновременно.
Комбинации, представленные выше, могут быть удобно представлены для применения в виде фармацевтического композиции; и таким образом фармацевтические композиции, содержащие комбинацию определенную выше, вместе с фармацевтически приемлемым носителем содержат еще один аспект настоящего изобретения.
Отдельные компоненты, для применения в способе по настоящему изобретению или комбинациях по настоящему изобретению могут быть введены как последовательно, так и одновременно, в отдельных или комбинированных фармацевтических композициях.
В одном варианте осуществления настоящего изобретения предложено применение соединения, состава или сочетания, как описано в настоящем изобретении, для производства лекарственного средства.
Если не указано иное, структуры, описанные в настоящем изобретении, также подразумевают включение все видов изомерных (например, энантиомерная, диастереомерная и геометрическая (или конформационная)) форм структур; к примеру, конфигурации R и S для каждого центра асимметрии, изомеры по положению двойной связи (Z) и (Е), и информационные изомеры (Z) и (Е). Следовательно, отдельные стереохимические изомеры, также как и энантиомерные, диастереоизомерные и геометрические (или конформационные) смеси данных соединений подпадают под объем притязаний по настоящему изобретения. Отдельный оптический изомер или энантомер может быть получен способом, хорошо известным в данной области, таким как хиральная ВЭЖХ, анзиматическов расщепление и хиральные вспомогательные элементы.
В одном варианта осуществления настоящего изобретения, где это применимо, аналоги цистамина или цистеин предложены в форме отдельного стереоизомера, по меньшей мере на 75%, 85%, 90%, 95%, 97% и 99% свободного от соответствующих стереоизомеров.
Предложены также фармацевтически приемлемые соли аналогов цистамина или цистеина. Под термином «фармацевтически приемлемые соли соединений» подразумевают те их них, что получены из фармацевтически приемлемых неорганических и органических кислот и оснований. Примерами походящих кислот являются соляная, бромистоводородная, серная, азотная, перхлорная, фумаровая, малеиновая, фосфорная, гликолевая, молочная, салициловая, янтарная, п-толеинсульфоновая, винная, уксусная, трифторуксусная, лимонная, метансульфоновая, муравьиная, бензойная, малоновая, 2-нафталинсульфоновая и бензолсульфоновая. Другие кислоты, такие как щавелевая кислота, хотя сами по себе и не являются фармацевтически приемлемыми, могут быть полезны в качестве промежуточных продуктов при получении солей присоединения аналогов цистамина и их фармацевтически приемлемых солей.
Настоящее изобретение также включает соли, полученные из аминокислот (например, L-аргинин, L-лизин).
Настоящее изобретение также включает соли, полученные из подходящих оснований, таких как щелочные металлы (например, натрий, литий, калий) и щелочноземельные металлы (например, кальций, магний).
Дальнейшее упоминание аналогов цистамина или цистеина включает данное соединение и его фармацевтически приемлемые соли.
В одном варианте осуществления настоящего изобретения, соль представляет собой биартрат.
В одном варианте осуществления настоящего изобретения, соль представляет собой гидрохлорид.
Что касается фармацевтически приемлемых солей, см. также перечень серийно выпускаемых солей, утвержденный Администрацией США по пищевым продуктам и лекарственным веществам (FDA), приведенный в Таблице I в работе Berge et al., Pharmaceutical Salts, J. of Phar. Sci., vol. 66, no. 1, January 1977, pp. 1-19, описание которой включено в настоящее изобретение в полном объеме посредством ссылки.
Специалистам в данной области будет понятно, что указанные соединения могут существовать в различных полиморфных формах. Как известно в данной области, полиморфизм представляет собой способность соединения кристаллизироваться в виде более чем одного отдельного кристаллического или «полиморфного» вида. Полиморф представляет собой твердую кристаллическую фазу соединения с по меньшей мере двумя различными расположениями или полиморфными формами молекулы указанного соединения в твердом состоянии. Полиморфные формы любого указанного соединения определяются той же химической формулой или составом и так отличаются по химической структуре, как и кристаллические структуры двух различных химических соединений.
Специалистам в данной области будет понятно, что указанные соединения в соответствии с настоящим изобретением могут существовать в различных сольватированных формах, например, гидратов. Сольваты аналогов цистамина или цистеина могут также формироваться, когда молекулы растворителя включаются в структуру кристаллической решетки молекулы соединения во время процесса кристаллизации.
Если не даются иные определения, все технические и научные термины, используемые в настоящем изобретении, имеют те же значения, что и обычно понимаемые средним специалистом в области, на которую распространяется настоящее изобретение. В дополнение, материалы, способы и примеры используются исключительно в ознакомительных целях и ни в коей мере не должны рассматриваться как ограничивающие.
Для целей настоящего изобретения, химические элементы обозначаются в соответствии с Периодической таблицей элементов, версия Химической реферативной службы (CAS), Handbook of Chemistry and Physics, 75th Ed. Additionally. Дополнительно, общие принципы органической химии описаны в "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999, и "March's Advanced Organic Chemistry", 5th Ed., Ed.: Smith, M.B. and March, J., John Wiley & Sons, New York: 2001.
Дополнительно, если не указано иное, аналоги цистамина или цистеина, описанные в настоящем изобретении, также подразумевают включение соединений, которые отличаются только по наличию одного или нескольких изотопно-обогащенных атомов. Например, подпадают под объем притязаний по настоящему изобретению аналоги цистамина или цистеин, в котором один или несколько атомов водорода замещаются дейтерием или тритием, или же один или несколько атомов углерода заменяются 13С- или 14С-обогащенным углеродом. Подобные соединения применимы, например, в качестве аналитических средств, зондов для биологических проб или соединений с улучшенным терапевтическим профилем.
Следует иметь в виду, что количество аналогов цистамина, необходимое ля применения при лечении, будет варьироваться не только в зависимости от выбранного конкретного соединения, но также и от пути введения, природы состояния для которого требуется лечение, и от возраста и состояния пациента и будет, в конечном счете, определяться лечащим врачом. В общем, однако, подходящая доза будет находиться в пределах от примерно 0,1 до примерно 750 мг/кг массы тела в день, например от 0,5 до 60 мг/кг/день или, например, в пределах от 1 до 20 мг/кг/день.
Требуемая доза может быть удобно представлена в виде единичной дозы, или в виде разделенной дозы, вводимой через подходящие интервалы, например, в виде 2, 3, 4 или более доз в день.
Аналог цистамина удобно вводить в единичной лекарственной дозе, например, содержащей от 5 до 2000 мг, от 10 до 1500 мг, от 20 до 1000 мг, удобнее всего от 50 до 700 мг активного ингредиента на единичную лекарственную дозу. В одном из вариантов осуществления настоящего изобретения, аналог цистамина удобно вводить в единичной лекарственной дозе равной 600 мг дважды в день.
Когда аналоги цистамина или его фармацевтически приемлемые соли используются в комбинации с вторым терапевтическим агентом, активным против болезни Паркинсона, доза каждого соединения может быть как одинаковой, так и отличаться от той дозы, в которой соединение применяют в одиночку. Подходящие дозы будут легко понятны специалистам в данной области.
Хотя и возможно, что для применения в терапии аналоги цистамина могут быть введены в виде необработанного вещества, предпочтительно представлять активный ингредиент в виде фармацевтической композиции. Таким образом, согласно настоящему изобретению далее предложены фармацевтические композиции, содержащие аналоги цистамина или их фармацевтически приемлемую соль по настоящему изобретению, вместе с одним или более фармацевтически приемлемыми носителями, следовательно, и, возможно, другими терапевтическими и/или профилактическими ингредиентами. Носитель(-ли) должен быть «приемлемым» в смысле совместимости с другими ингредиентами состава и не должен оказывать вредного действия на его получателя.
Фармацевтические композиции включают композиции, пригодные для перорального, ректального, назального, местного (включая трансбуккальное и под язык), трансдермального, вагинального или парентерального (включая внутримышечное, подкожное и внутривенное) введения или в форме, пригодной для введения ингаляцией или инсуффляцией. Где подходит, композиции могут быть удобно представлены в виде отдельных дозированных единиц и могут быть подготовлены любым из способов, хорошо известных в области фармацевтики. Все способы включают этап слияния активного вещества с жидкими носителями, или мелкоизмельченными твердыми носителями, или и теми и другими, и, в случае необходимости, придание продукту до желаемой композиции.
Фармацевтические композиции, пригодные для перорального введения, могут быть удобно представлены в виде отдельных единиц, таких как желатиновые капсулы, крахмальные капсулы или таблетки, в каждой из которой содержится заранее определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора, суспензии или в виде эмульсии. Активный ингредиент также может быть представлен в виде болюсов, лекарственной кашки или пасты. Таблетки и капсулы для перорального введения могут содержать обычные наполнители, такие как вяжущие средства, наполнители, смазывающие вещества, разрыхлители или увлажняющие агенты. Указанные таблетки могут быть покрыты оболочкой в соответствии со способами, хорошо известных в данной области. Жидкие препараты для перорального применения могут быть в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или же могут быть представлены в виде сухого продукта для смешивания с водой или другими пригодными носителями перед применением. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, эмульгирующие агенты, не-водные носители (которые могут включать пищевые масла) или консерванты.
Аналоги цистамина могут также быть приготовлены для парентерального введения (например, при помощи инъекций, таких как струйная болюсная, или непрерывная инфузия), и могут быть представлены в единичной дозировке в форме ампул, предварительно заполненных шприцов, инфузий небольшого объема, или многодозовых контейнеров с добавленными консервантами. Композиции могут иметь такие формы, как суспензии, растворы, или эмульсии в масляных/водных носителях, и могут содержать рецептурные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. В другом варианте, активный ингредиент может быть в форме порошка, полученного способом асептической изоляции стерильного сухого вещества или лиофилизацией из раствора, для смешивания с пригодным носителем, например, стерильной апирогенной водой, перед применением.
Для местного введения в эпидермис аналоги цистамина могут быть приготовлены в виде мазей, кремов или лосьонов, или в виде трансдермального пластыря. Такие трансдермальные пластыри могут содержать усилители проницаемости, такие как линалоол, карвакрол, тимол, цитраль, ментол, и т-анетол. Мази и кремы, например, могут быть приготовлены на водной или масляной основе с добавлением подходящих загустителей и/или гелеобразователей. Лосьоны могут быть изготовлены на водной или масляной основе, и обычно, так же содержат один или более эмульгирующие агенты, стабилизирующие агенты, диспергирующие агенты, суспензирующие агенты, загустители, или красители.
Композиции, пригодные для местного введения во рту, включают пастилки для рассасывания содержащие активный ингредиент на ароматизированной основе, обычно сахарозе и аравийской камеди или трагакантовой камеди; пастилки, содержащие активный ингредиент на инертной основе, такой как желатин и глицерин или сахароза и акация; и жидкости для полоскания рта, содержащие активный ингредиент на пригодном жидком носителе.
Фармацевтические композиции пригодные для ректального введения, в которых носитель представляет собой твердое вещество, например, могут быть представлены в единичной дозировке в форме суппозиториев. Пригодные носители включают кокосовое масло и другие материалы, обычно используемые в этой области, и указанные суппозитории могут быть удобно изготовлены смешением активного соединения с размягченным или расплавленным носителем(-лями) с последующим охлаждением и формированием в шаблонах.
Композиции, пригодные для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или спреев, в дополнение к активному ингредиенту также содержащих такие носители, которые известны в данной области как подходящие.
Для интраназального введения указанные соединения или комбинации могут быть использованы в виде жидких спреев или диспергируемых порошков или в форме капель. Капли могут быть изготовлены на водной или неводной основе, также содержащей один или более диспергирующих агентов, солюбилизирующих агентов или суспендирующих агентов. Жидкие спреи удобно могут находиться в упаковках под давлением.
Для введения через ингаляцию указанных соединений или комбинаций удобно использовать инсуффляторы, распылители или упаковки под давлением или другие удобные средства введения аэрозольных спреев. Упаковки под давлением могут содержать пригодные пропелленты, такие как дихлордифторметан, трихлорфторметан, тетрафтордихлорэтан, диоксид углерода или другой пригодный газ. В случае аэрозоля под давлением единичная доза может быть определена с помощью клапана для дозирования отмеренного количества.
В качестве альтеративы, для введения через ингаляцию или инсуффляцию, соединения или комбинации могут использоваться в форме композиции сухого порошка, например, порошковой смеси соединения и пригодного порошкового основания, такого как лактоза или крахмал. Порошковая композиция может быть представлена в единичной дозировочной форме, например, в капсулах или картриджах или, например, желатиновых или блистерных упаковках, из которых порошок может быть введен с помощью ингалятора или инсуффлятора.
При желании, может быть осуществлена адаптация вышеописанных композиций для возможного использования таким образом, чтобы осуществлять замедленное или измененное высвобождение активного ингредиента. Примеры составов цистеамина описаны, например, в публикации US 20090076166.
Авторы настоящего изобретения неожиданно обнаружили, что цистамин оказывает благоприятное действие на животных, больных паркинсонизмом, если он был введен до и после того, как токсин МФТП вызовет патологию. Авторы настоящего изобретения определили, что цистамин может обратить начавшийся нейродегенеративный процесс. Как описано в примерах, мыши подвергались подострой интоксикации МФТП следующим 5-дневным режимом из 7 интраперитонеальных инъекций по 20 мг/кг и введения 10 мг/кг цистамина интраперитонеального ежедневно либо 1) за 2 дня до начала инъекций МФТП, либо 2) спустя 24 часа после получения последней дозы МФТП, и которые продолжались в течение 14 дней после повреждения. В конце исследования провели посмертные анализы с целью оценки состояния дофаминергической (ДА-эргической) системы, более конкретно, направленные на болезнь Паркинсона. Авторы настоящего изобретения неожиданно обнаружили, что интраперитонеальное введение цистамина (10 мг/кг/день) МФТП-обработанным мышам, начиная после повреждения нигростриарной системы (спустя 24 часа после обработки МФТП) вызывало значительное восстановление числа дофаминэргических нейронов черной субстанции, оцененное по стереологическому подсчету ТГ-иммунореактивных клеток, (p<0,05), числа экспрессирующих клеток ДАТ иРНК (9<0,05), а также уровней содержания Nurr1 иРНК в черной субстанции (p<0,05). Авторы настоящего изобретения также определили, что цистамин спасает дофаминергические нейроны в односторонней стриарной модели болезни Паркинсона у мышей, подвергнутых обработке 6-OHDA. Далее, как показано в примерах настоящего изобретения, цистамин обращает нарушения поведения, вызванные стриарными 6-OHDA поражениями у мышей, и восстанавливает некоторые аспекты дофаминергической системы черной субстанции, и изменяет стриарное содержание катехоламинов и динамику односторонней стриарной 6-OHDA мышиной модели болезни Паркинсона. Авторы настоящего изобретения обнаружили, что роль соединений цистамина не ограничивается предохранением существующих нейронов. Указанные соединения могут также обратить апоптический процесс, и таким образом спасти поврежденные нейроны от прохождения дегенерации.
Не привязываясь к какой-либо конкретной теории, авторы настоящего изобретения полагают, что цистеамин представляет собой ключевое нейроактивное соединение после системного введения цистамина. Среди молекул, изученных при помощи измерений, полученных при помощи ВЭЖХ, которые включали цистеамин, цистеин, гипотаурин и таурин, только количество цистамина было обнаружено значительно увеличенным в мозгу мышей, ранее не подвергавшихся экспериментам ( mice), после одной интраперитонеальной инъекции 50 мг/кг и 200 мг/кг. В отличие, уровни цистеина, гипотаурина и таурина остались либо без изменений, либо были ниже порога обнаружения. В дополнение, авторы настоящего изобретения продемонстрировали, что цистеамин проникает через гематоэнцефалический барьер in vivo в значительной степени. Данные наблюдения предоставляют информацию, связанную с нейрофармакологией цистеамина, и далее подтверждают его клиническую значимость.
mice), после одной интраперитонеальной инъекции 50 мг/кг и 200 мг/кг. В отличие, уровни цистеина, гипотаурина и таурина остались либо без изменений, либо были ниже порога обнаружения. В дополнение, авторы настоящего изобретения продемонстрировали, что цистеамин проникает через гематоэнцефалический барьер in vivo в значительной степени. Данные наблюдения предоставляют информацию, связанную с нейрофармакологией цистеамина, и далее подтверждают его клиническую значимость.
Гематоэнцефалический барьер представляет собой основное препятствие для клинического применения подавляющего большинства возможных нейроактивных соединений, и должен быть учтен при определении, какой из метаболитов цистамина оказывает свой терапевтический эффект. Аминокислотные транспортеры являются хорошо изученными компонентами гематоэнцефалического барьера, и включают лейцин, аланин, серии, или С-системы (cysteine-preferring systems) (Wade and Katzman, 1975; Sershen and Lajtha, 1979). Известно, что цистеин применяет L-систему для пересечения гематоэнцефалического барьера (Wade and Brady, 1981). Способность таурина проникать через гематоэнцефалический барьер также была описана у крыс с использованием перфузии головного мозга in situ (in situ cerebral perfusion, ISCP), и по-видиму, включает натрий клеток эндотелия и хлоридозависимую систему инфлюкса (Benrabh at al., 1995). С другой стороны, механизм, посредством которого цистеамин может проникать через гематоэнцефалический барьер, требует дальнейших исследований. В настоящем изобретении для изучения пересечения цистеамином и цистеином гематоэнцефалического барьера использовался количественный и высокочувствительный метод. Это было осуществлено без ущерба для физической или функциональной целостности гематоэнцефалического барьера, и в обход процессов периферического метаболизма, связанных с системным введением. Авторы настоящего изобретения продемонстрировали способность цистеамина и цистина попадать в мозг в значительном количестве. Добавление цистеина в перфузат еще больше способствовало поглощению цистеамина мозгом.
В предыдущих и следующих примерах все температуры указаны в градусах Цельсия без поправки, и, если не указано иное, все части и процентные содержания указаны по массе.
Следующие примеры могут быть воспроизведены с аналогичным успешным результатом путем замены реактивов, описанных в общем или конкретно, и/или условий проведения работ на реактивы и условия, примененные в предыдущих примерах.
ПРИМЕРЫ
ПРИМЕР 1: Влияние цистамина после МФТП-вызванного паркинсонизма у грызунов.
Животные
Молодых взрослых (возраст 9 недель, масса 25 г) самцов мышей C57BL/6 купили в Charles River Laboratories ( , QC, Canada). Животных поместили по 4 особи в каждую клетку с обычными условиями, свободным доступом к воде и пище, рандомизировали, за ними ухаживал один и тот же исследователь при одинаковых условиях. Все эксперименты проводились в соответствии с требованиями канадского Совета по уходу за животными (Canadian Council on Animal Care) и с одобрения комитета института при Больничном центре университета Лаваль (Квебек, Канада) (Institutional Committee of the Centre Hospitaller de
, QC, Canada). Животных поместили по 4 особи в каждую клетку с обычными условиями, свободным доступом к воде и пище, рандомизировали, за ними ухаживал один и тот же исследователь при одинаковых условиях. Все эксперименты проводились в соответствии с требованиями канадского Совета по уходу за животными (Canadian Council on Animal Care) и с одобрения комитета института при Больничном центре университета Лаваль (Квебек, Канада) (Institutional Committee of the Centre Hospitaller de  Laval (CHUL,
Laval (CHUL,  , Canada)). В ходе эксперимента состояние здоровья мышей, вовлеченных в исследование, тщательно наблюдали на потерю массы и другие показатели, связанные с вопросами здоровья. Для сведения к минимуму боли и дискомфорта животных приложили максимум усилий.
, Canada)). В ходе эксперимента состояние здоровья мышей, вовлеченных в исследование, тщательно наблюдали на потерю массы и другие показатели, связанные с вопросами здоровья. Для сведения к минимуму боли и дискомфорта животных приложили максимум усилий.
Введение МФТП
Мыши получили 7 интраперитониальных инъекций, дважды в первые два дня экспериментального протокола с интервалом в 12 часов, и один раз в день в три последующих дня либо солевого раствора 0,9%, либо МФТП-HCl (20 мг/кг свободного основания; Sigma, St. Louis, МО), растворенного в солевом растворе 0,9%, свежеприготовленного (Tremblay et al., 2006; Gibrat et al., 2007; Gibrat et al., 2010).
Лечение цистамином
Благоприятное воздействие цистамина на мышей с паркинсонизмом (дигидрохлорид цистамина, Sigma, St. Louis, МО) оценивали с дозой 10 мг/кг, растворенной в стерильном солевом растворе 0,9%, свежеприготовленном, для ежедневной интраперитонеальной инъекции за 1 час до введения МФТП. Выбор дозы и режим введения основывался на наших более ранних заключениях (Tremblay et al., 2006; Gibrat et al., 2010). Первую инъекцию цистамина ввели либо 1) за 2 дня до начала инъекций МФТП (до начала лечения), либо 2) спустя 24 часа после последней дозы МФТП (по окончании лечения); указанное лечение продолжали ежедневно в течение 14 дней после повреждения.
Данное исследование разделили на два отдельных эксперимента.
Эксперимент №1. Нейроспасательные свойства цистамина у мышей с поражениями, вызванными МФТП
Влияние цистамина на токсичность МФТП изучали в следующих экспериментальных группах: Группа I, солевой раствор + солевой раствор; Группа II, солевой раствор + постобработка цистамином; Группа III, солевой раствор + пре-обработка цистамином; Группа IV, МФТП + солевой раствор; Группа V, МФТП + пост-обработка цистамином; Группа VI, МФТП + пре-обработка цистамином. В общей сложности, использовали 96 мышей (по 16 мышей в каждой группе), изменение массы которых отслеживали ежедневно и, в конечном счете, умертвили посредством перфузии спустя 24 часа после введения последней дозы цистамина (или носителя).
Эксперимент №2. Динамика отмирания дофаминэргических нейронов черной субстанции, вызванного подострым введением МФТП
Для данного эксперимента использовали в общей сложности 72 мыши, разделенные на 6 групп (по 12 мышей в каждой группе). Группы I, II и III получали подострую обработку МФТП, а группам IV, V и VI вводили солевой раствор 0,9%. Группы I и IV умертвили спустя 24 часа, группы II и V через 7 дней, и группы III и VI через 14 дней после последней инъекции МФТП (или солевого раствора).
Перфузия и обработка тканей
Животных умертвили в состоянии глубокой анестезии после введения кетамина/ксилазина (Vetalar, Bioniche, Belleville, ON/Rompun, Bayer, Toronto, ON) и подвергали перфузии в соответствии с двумя способами в условиях отсутствия рибонуклеаз.
Эксперимент №1. Всех мыши подвергли внутрисердечной перфузии 0,1 М фосфатно-буферным солевым раствором (ФБСР) в отсутствии рибонуклеаз. После внутрисердечной перфузии изъяли, и разделили два полушария. Левое полушарие пост-фиксировали в 4% растворе параформальдегида (ПФА) в течение 48 часов, а затем перенесли в 20% раствор сахарозы в 0,1 М ФБСР для защиты от низкой температуры. Корональные срезы мозга толщиной 25 мкм нарезали на замораживающем микротоме (Leica Microsystems, Montreal, QC) и последовательно собрали в антифризный раствор (0,2 М одноосновного монофосфата натрия, 0,2 М двуосновного монофосфата натрия, 30% этиленгликоль, 20% глицерин), и хранили при температуре -20°C до использования. Участки левого полушария использовали для дополнительных иммуногистохимического и гибридизации in situ протоколов. Правые полушария мгновенно заморозили в 2-метил-бутане, и затем хранили при температуре -80°C до момента криостатического препарирования для ВЭЖХ и вестерн-блотинга (ВБ).
Эксперимент №2. В данном эксперименте оба полушария каждого животного заморозили и использовали для ВЭЖХ и ВБ. Оставшиеся 5 мышей в каждой группе подвергли внутрисердечной перфузии при помощи свободного от рибонуклеаз солевого раствора (0,9%) и 4% ПФА, pH 7,4. После внутрисердечной перфузии мозг изъяли и пост-фиксировали в 4% ПФА в течение 24 часов, и перенесли в 20% раствор сахарозы в 0,1 М ФБСР для защиты от низкой температуры. Мозги нарезали на корональные срезы толщиной 25 мкм. В дальнейшем эти срезы использовали для иммуногистохимического и гибридизации in situ протоколов, требуемых для завершения эксперимента №2.
Количественное определение катехоламина при помощи ВЭЖХ
Концентрации стриарного дофамина, 3,4-дигидрофенилуксусной кислоты и гомованилиновой кислоты измерили при помощи ВЭЖХ с электрохимическим детектированием (Calon et al., 2001; Calon et al., 2003). Каждый стриарный образец содержал по 10 криостатных срезов толщиной 20 мкм из структур между уровнями +1,145 и +1,345 (Allen, 2008; Lein et al., 2007). К каждому образцу добавили 200 мкл перхлорной кислоты (0,1 н; (J.Т. Baker); потом образцы гомогенизировали и центрифугировали (13000 g) для образования надосадочной жидкости. 50 мкл на досад очной жидкости из стриарных тканей ввели непосредственно в хроматографическую систему, состоящую из автоматического инжектора автоматического пробозаборника Waters 717 plus, бинарного насоса Waters 1525, оснащенного колонкой Atlantis dC18 (3 мкм), электрохимического детектора Waters 2465, и стеклографитового электрода (Waters Limited, Lachine, QC, Canada). Электрохимический потенциал установили на уровне 10 нА. Подвижная фаза состояла из 47,8 мМ NaH2PO4, 0,9 мМ октилсульфатанатрия (J.Т. Baker), 0,4 мМ этилендиаминтетрауксусной кислоты, 2 мМ NaCl, и 8% метанола (J.Т. Baker) при pH 2,9 и была подана со скоростью 1,0 мл/мин. Пики определили при помощи программного обеспечения Breeze (Waters). Количественные величины ВЭЖХ нормировали к концентрациям белка, как это определено набором реагентов для определения белка с помощью бицинхониновой кислоты (Pierce, Rockford, IL, USA).
Иммуногистохимия ТГ
Для оценки дофаминэргической потери нейронов провели иммуногистохимическое исследование фермента ТГ, как описано выше (Tremblay et al., 2006; Gibrat et al., 2010). Вкратце, после нескольких промывок и блокировочной прединкубации, свободноплавающие срезы инкубировали в течение ночи при температуре 4°C с кроличьим анти-ТГ (Pel-Freez, Rogers, AR; 1:5000). Затем срезы инкубировали в течение 1 часа при комнатной температуре (КТ) в растворе, содержащем биотинилированный козий антикроличий иммуноглобулин (Vector Laboratories, Burlington, ON; 1:1500), а впоследствии поместили в раствор, содержащий авидин-биотин пероксидазный комплекс (ABC Elite kit; Vector Laboratories, Burlington, ON), на 1 час при комнатной температуре. Наконец, реакцию развили в растворе 3,3' диаминобензидина тетрагидрохлорида (DAB) (Sigma, St. Louis, МО) и 0,1% 30% перекиси водорода (Sigma, St. Louis, МО) при комнатной температуре. Другие срезы обработали так же, как описано выше, за исключением того, что первичные антитела исключили из инкубационной среды. Эти срезы остались практически свободны от иммунного окрашивания, и использовались в качестве отрицательной контрольной пробы. После реакции DAB срезы уложили на предметные стекла, покрытые желатином, и доокрасили при помощи крезилового фиолетового (Sigma, St. Louis, МО). В конце все срезы высушили воздухом, обезводили в этаноле с увеличивающейся концентрацией, очистили в ксилоле и заклеили покровными стеклами в заключающей среде DPX (Electron Microscopy Science, Hatfield, PA).
Гибридизация in situ для Nurr1 и DAT
Специальный, [35S]UTP-обозначенный дополнительный зонд РНК (кРНК) использовали для оценки в ткани иРНК уровня Nurr1, ядерного рецептора, связанного с дофаминэргической системой (Zetterstrom et al., 1997). Зонд кРНК для Nurr1 берет начало из 403 п.о. (учетный номер в генетическом банке: 1504-1907 NM_013613) EcoRI-BamHI фрагмента полного мышиного Nurr1 кДНК, субклонированного в pBluescript SK+ и линеаризированного с Xba I.
Зонд DAT, фрагмент длиной 2238 п. о., клонировали в плазмиду pBluescript II SK+. Линеаризация провели с использованием фермента Notl. Антисмысловой зонд синтезировали с [35S]UTP и РНК-полимеразой Т7.
Для данных маркеров также сгенерировали смысловые зонды, и не получили никаких конкретных сигналов (данные не показаны). Срезы головного мозга гибридизировали в соответствии с процедурами, описанными ниже, и ранее опубликованными протоколами (Beaudry et al., 2000; Cossette et al., 2004; Lapointe et al., 2004).
Данный in situ протокол провели в условиях отсутствия рибонуклеаз. Срезы уложили на предметные стекла Snowcoat X-tra™ (Surgipath, Winnipeg, Canada) и хранили под вакуумом в течение ночи перед использованием. Срезы мозга фиксировали в 4% ПФА pH 7,4 при комнатной температуре в течение 20 минут. Предварительную обработку проводили с последовательным использованием различных ванн (0,1 М фосфатно-солевой буферный раствор дважды по 5 минут, протеиназа К 0,1 мкг/мл 10 минут при 37°C, ванна ацетилирования (0,25% уксусный ангидрид, 0,1 М триэтаноламин) 10 минут, дважды по 5 минут в стандартном цитратно-солевом буфере (SSC) (0,3 М NaCl, 30 мМ цитрат натрия)). Для обезвоживания использовали последовательные ванны с раствором этанола (30%, 60%, 100%, 100%; по три минуты в каждой). In situ гибридизацию зондов РНК на срезах тканей проведили при температуре 58°C в течение одной ночи в стандартном буфере для гибридизации (деонизированный формамид 50%, 5 М хлорид натрия, 1 М Трис, 0,5 М ЭДТК, 50Х раствор Денхардта, сульфат декстрана 50%, тРНК 10 мг/мл, 1 М ДТТ, 35S сопряженный 2×106 cpm/мкл зонд). Постобработка проводили с последовательным использованием различных ванн: SSC 4Х на 30 мин, снятие покровных стекол, SSC 2Х дважды по 5 минут, рибонуклеаза А 20 мкг/мл на 1 час при 37°C, milliQ вода дважды по 15 сек, SSC 2Х на 15 мин, SSC 0,5Х на 30 мин при 60°C, SSC 0,1Х на 30 мин при 60°C, SSC 0,1Х на 5 мин при комнатной температуре. Для дальнейшего обезвоживания использовали последовательные ванны с раствором этанола (30%, 60%, 100%, 100%; по 3 минуты в каждой). Затем срезы тканей поместили против радиоактивных чувствительных пленок BiomaxMR (Kodak, New Haven, CT). Авторадиограммы проявили после 72 часов засветки (для Nurr1) и 5 часов засветки (для DAT).
Обезжиривание осуществили при помощи 4 ванн этанола, 2 ванн ксилена и 3 ванн этанола. После этих шагов стекла погрузили в эмульсию NTB (Kodak, New Haven, СТ) при температуре 42°C, высушили воздухом в течение 4 часов и хранили в темноте в течение 5 дней при температуре 4°C. После этого эмульсию проявили (3,5 мин) при помощи проявителя D-19 (Kodak, New Haven, СТ), промыли в деионизированной воде и закрепили (5 мин) в растворе Rapid Fixer (Kodak). Затем стекла промыли в течение одного часа в деионизированной воде, и затем окрасили. Окрашивание провели при помощи тионина (1 мин), после чего стекла погрузили в воду и этанол, а затем в 3 ванны из этанола (1 мин) и 3 ванны из ксилола (3 мин). Срезы заклеили покровными стеклами в заключающей среде DPX.
Вестерн-блоттинг
Образцы гомогенизировались в 8 объемах лизирующего буфера (150 мМ NaCl, 10 мМ NaH2PO4, 1% (объем к объему) Triton Х-100, 0,5% додецилсульфат натрия и 0,5% дезоксилата натрия), в котором содержалась смесь ингибиторов протеазы (Roche, Mississauga, ON, Canada) и ингибиторов фосфатазы (Sigma, St-Louis, МО, USA). Образцы озвучили (3×10 сек) и поместили в центрифугу при 100000 g на 20 минут при температуре 4°C. Надосадочную жидкость собрали и хранили при -80°C. Концентрацию белка в каждой фракции определили при помощи набора реагентов для определения белка с помощью бицинхониновой кислоты. 20 мкг общей выборки белка добавили к загрузочному буферу Лэмли и нагрели до температуры 95°C в течение 5 минут. Затем образцы загрузили и подвергли электрофорезу с использованием геля додецилсульфат натрия - полиакриламид (12%). Белки разделили электрофорезом на 0,45 мкм мембранах Immobilon PVDF (Millipore, Billerica, MA, USA) и блокировали в 5% обезжиренном сухом молоке и 1% альбумине бычьей сыворотки в 1Х фосфатно-буферном солевом растворе в течение 1 часа. Мембраны подвергли иммуноблоттингу с первичными антителами, кроличьими антителами ТГ (Pel-Freez; 1:5,000), кроличьими антителами ВАХ (Cell signalling technology; Danvers, MA; 1:1,000), кроличьими антителами Bcl2 (Cell signalling technology; 1:1,000), мышиными антиактиновыми антителами (ABM Inc, Ричмонд, Британская Колумбия, Канада; 1:10,000), и соответственных вторичных антител, козьих, антикроличьих или антимышиных (Jackson Immunoresearch, Уэст-Грув, Пенсильвания; 1:100,000), после чего добавили хемилюминесцентные реагенты (KPL, Mandel Scientific, Guelph, ON, Canada). Интенсивности полосы количественно измерили с использованием системы цифрового формирования изображений ImageQuant Las 4000 (программное обеспечение Science Lab 2003 Image Gauge, версия 4.2, Fujifilm, New Haven, CT).
Денситометрические измерения уровней Nurr1 и переносчика дофамина (DAT) иРНК
Уровни ауторадиографического мечения количественно измерили при помощи компьютерной денситометрии. Оцифрованные изображения мозга и их анализы сделали тем же самым оборудованием, что описано выше. Оптическую плотность авторадиограмм перевели в микрокюри/г ткани с использованием стандартов радиоактивности 14С (стандарты ARC 146-14С, American Radiolabeled Chemicals Inc., Сент-Луис, St. Louis, MO). Уровни Nurr1 и DAT иРНК измерили в черной субстанции compacta (SNc) с использованием похожих переднезадних уровней для всех срезов. Усредненное мечение каждого уровня SNc вычислили с использованием трех соседних срезов мозга одной и той же мыши. Фоновую интенсивность, взятую из лишенного Nurr1 или DAT иРНК белого поля черной субстанции reticulata (SNr), вычитали из каждого замера.
Стереологическое количественно определение ТГ-иммунореактивных нейронов
Потерю дофаминэргических нейронов определили при помощи стереологического подсчета ТГ-иммунореактивных клеток (идентифицируемая сома) при освещении методом светлого поля. Каждый десятый срез SNc проанализировали с использованием исследовательского программного обеспечения Stereo (MicroBrightfield, Colchester, VT, USA), прилагаемого к микроскопу Е800 Nikon (Nikon Canada Inc., Mississauga, ON, Canada). После очерчивания SNc при малом увеличении (объектив 4Х) на каждый срез наложили точечную сетку. Для большинства исследованных ростральных уровней SNc (брегма -3,08 мм), SNc очертили видимыми границами медиального терминального ядра. Для промежуточных (брегма -3,28 мм) и большинства исследованных каудальных уровней SNc (брегма -3,58 мм), структуру разграничивали на выходе третьего черепного нерва. Иммуноокрашенные клетки подсчитали при помощи способа оптического фракционирования при большем увеличении (объектив 20Х). Переменные для подсчета были следующими: расстояние между рамками подсчета (150 мкм × 150 мкм), размер рамки подсчета (75 мкм), толщина защитной зоны (1 мкм). Подсчитали только те клетки, которые не пересекали запрещенные линии. Способ оптического фракционирования (Glaser and Glaser, 2000) использовали для подсчета ТГ-положительных (ТГ- и крезилвиолет-положительных) и ТГ-отрицательных (только крезилвиолет-положительных) клеток. Стереологический подсчет клеток провели вслепую два независимых исследователя. Следует отметить, что анализы ТГ-иммунореактивных профилей ограничили только SNc и, таким образом, исключали вентральную область покрышки (VTA).
Статистический анализ и подготовка изображений
Все анализы выражены как групповое среднее ± стандартная ошибка среднего числа. Данные, относящиеся к эксперименту №1 и №2, оценили при помощи двухфакторного дисперсионного анализа. Когда двухфакторный дисперсионный анализ выявлял незначительное взаимодействие, данные также проверяли на значимость при помощи ретроспективного (post hoc) множественного сравнения полученных результатов методом Тьюки. Во всех случаях, величину Р менее 0,05 признавали значимой. Микрофотоснимки сделали при помощи программного обеспечения Picture Frame (MicroBrightfield), прилагаемого к микроскопу Е800 Nikon (Nikon Instruments, Toronto, ON). Изображения окончательно оформили при помощи программного обеспечения Adobe Photoshop CS3.
РЕЗУЛЬТАТЫ
Влияние цистамина на дофаминэргическую систему
Нейрозащитные свойства цистамина в подострой МФТП мышиной модели
Окончательную гистологическую оценку провели на всех мышах, включенных в данное исследование для изучения полезного действия цистамина, используя несколько специальных маркеров, связанных с дофаминовой системой. ТГ представляет собой фермент, ограничивающий скорость биосинтеза дофамина, и маркер для дофаминовых нейронов. Nurr1 представляет собой транскрипционный фактор, вовлеченный в поддержание дофаминэргического фенотипа, и переносчик дофамина, DAT; он также является специфическим маркером дофаминэргических нигростриальных нейронов и, таким образом, их экспрессия отражает состояние дофаминэргического невронального здоровья.
Введение МФТП спровоцировало значительную потерю ТГ-иммунореактивных нейронов, что было связано с одновременной потерей Ниссль-окрашенных нейронов в SNpc, что соответствует дегенерации дофаминовых нейронов в противоположность снижению экспресии ТГ (p<0,001, Фиг. 1). Данное явление сопровождалось значительным снижением уровней Nurr1 и DAT иРНК в SNpc (p<0,01, Фиг. 2; p<0,001, Фиг. 3). Ежедневное введение цистамина в дозировке 10 мг/кг начинали за 2 дня до интоксикации веществом МФТП, подтверждая нейрозащитное действие цистамина, которое проявилось в увеличении плотности ТГ-иммунореактивных клеток в SNpc (p<0,001, Фиг. 1), по сравнению с животными, которым не вводился МФТП. Посмертные анализы дофаминовой системы у пре-обработанных цистамином мышей далее выявили нормализацию уровней Nurr1 иРНК (p<0,01, Фиг. 2), а также плотности нейронов SNpc, экспрессирующих DAT (p<0,01, Фиг. 3).
Способность цистамина спасать нейроны в подострой МФТП мышиной модели
Свойства нейроспасательного лечения цистамином оценивали, начиная после 24 часов после последней инъекции МФТП. Дофаминэргическая нейротоксичность, вызванная введением МФТП, также значительно снизилась у мышей, которые прошли последующую обработку цистамином в дозировке 10 мг/кг. Мыши, прошедшие обработку цистамином после поражения вызванного МФТП, показали значительно большее число ТГ-положительных и Ниссль-положительных нейронов (p<0,01, Фиг. 1), так же как и более высокий уровень Nurr1 (p<0,5, Фиг. 2) и DAT (p<0,5, Фиг. 3) иРНК, сопоставимые с теми, что наблюдались у мышей, не подвергнутых обработке МФТП.
В общем, оценки указанных трех специфических маркеров, связанных с дофаминовой системой, выявили аналогичные шаблоны и продемонстрировали положительное влияние пост-МПТП лечения цистамином, не ограничивая нейрозащитные свойства цистамина, но расширяя его свойства до нейроспасательных.
Для того чтобы сделать вывод о способности цистамина не только предотвращать (нейрозащитные свойства), но также и останавливать (нейроспасательные свойства) нейродегенеративный процесс, авторы настоящего изобретения провели исследование с целью определения динамики протекания процесса дофаминсвязанной нейроденегерации в модели МФТП, использованной для данных экспериментов.
Динамика протекания процесса дегенерации дофаминэргических клеток черной субстанции, вызванного подострым введением МФТП
Потеря ТГ-положительных и Ниссль-положительных нейронов находилось в пределах 20-27% в группах МФТП, умерщвленных с 1-го по 14-й день после последнего введения МФТП, но было статистически значимым только в 7-й и 14-й день по сравнению с соответственными группами солевого раствора (p<0,01, Фиг. 4). Несмотря на отсутствие значительных потерь ТГ-положительных клеток в 1-й день, наблюдали значительное снижение уровней Nurr1 и DAT иРНК в SNpc (p<0,05, Фиг. 5), что указывает на некоторую уязвимость дофаминовых нейронов. Более того, содержание про- и анти-апоптических белков, ВАХ и Bc12, соответственно увеличилось и снизилось спустя 24 часа после последнего введения МФТП, как определили в ходе вестерн-блоттинга (p<0,05, Фиг. 6). Взятые вместе, данные результаты говорят о том, что хотя дегенерация дофаминэргических нейронов и не началась спустя 24 часа после последнего введения МФТП, они были задействованы в апоптическом каскаде реакций. Что важно отметить, данные результаты подтверждают, что положительные свойства цистамина представляют собой нейроспасательные свойства.
РЕЗУЛЬТАТЫ
Влияние цистамина на дофаминэргическую систему
ПРИМЕР 2: Метаболизм цистамина и транспортные свойства в мозга
Животные и введение цистамина
Молодых взрослых (возраст 9 недель, масса 25 г) самцов мышей C57BL/6 приобрели в Charles River Laboratories ( , QC, Canada). Животных поместили по 4 особи в каждую клетку с обычными условиями, свободным доступом к еде и пище, рандомизировали, за ними ухаживал один и тот же исследователь при одинаковых условиях. Все эксперименты проводились в соответствии с требованиями канадского Совета по уходу за животными и с одобрения комитета института при Больничном центре университета Лаваль. В ходе эксперимента состояние здоровья мышей, включенных в указанное исследование, тщательно наблюдали. Для ясного определения активного промежуточного продукта, возникающего после инъекции цистамина, так же, как и для того, чтобы понять его системный и церебральный метаболизм, здоровым взрослым мышам-самцам C57BL/6 ввели единичную интраперитониальную инъекцию цистамина в трех различных дозах: 10,50 и 200 мг/кг, как было определено в предыдущих публикациях (Tremblay et al., 2006; Gibrat et al., 2010). В конечном счете, указанные дозы сравнили с инъекциями солевого раствора. Цистамин растворили в стерильном солевом растворе (0,9%) и ввели за 1, 3, 12, 24 и 48 часов до умерщвления. Животных умертвили в состоянии глубокой анестезии после введения кетамина/ксилазина и подвергнуты перфузии 0,1 М фосфатно-буферным солевым раствором. После внутрисердечной перфузии мозги извлекли, мгновенно заморозили в 2-метил-бутане и затем хранили при -80°C до момента криостатического препарирования с целью проведения ВЭЖХ. В общей сложности 200 мышей (по 10 мышей в каждой группе) задействовали в данном исследовании.
, QC, Canada). Животных поместили по 4 особи в каждую клетку с обычными условиями, свободным доступом к еде и пище, рандомизировали, за ними ухаживал один и тот же исследователь при одинаковых условиях. Все эксперименты проводились в соответствии с требованиями канадского Совета по уходу за животными и с одобрения комитета института при Больничном центре университета Лаваль. В ходе эксперимента состояние здоровья мышей, включенных в указанное исследование, тщательно наблюдали. Для ясного определения активного промежуточного продукта, возникающего после инъекции цистамина, так же, как и для того, чтобы понять его системный и церебральный метаболизм, здоровым взрослым мышам-самцам C57BL/6 ввели единичную интраперитониальную инъекцию цистамина в трех различных дозах: 10,50 и 200 мг/кг, как было определено в предыдущих публикациях (Tremblay et al., 2006; Gibrat et al., 2010). В конечном счете, указанные дозы сравнили с инъекциями солевого раствора. Цистамин растворили в стерильном солевом растворе (0,9%) и ввели за 1, 3, 12, 24 и 48 часов до умерщвления. Животных умертвили в состоянии глубокой анестезии после введения кетамина/ксилазина и подвергнуты перфузии 0,1 М фосфатно-буферным солевым раствором. После внутрисердечной перфузии мозги извлекли, мгновенно заморозили в 2-метил-бутане и затем хранили при -80°C до момента криостатического препарирования с целью проведения ВЭЖХ. В общей сложности 200 мышей (по 10 мышей в каждой группе) задействовали в данном исследовании.
Измерение цистеина и цистеамина при помощи ВЭЖХ
ВЭЖХ с флуоресцентным детектированием использовали для количественного определения цистеина и цистеамина в обеих сериях экспериментов: исследование зависимости «доза-ответ» и процедуры in situ перфузии головного мозга (ISCP). Лобную долю гомогенизирована в 200 мкл (NaHCO3, а затем центрифугировали при 15700 g (4°C) в течение 20 мин. 50 мкл надосадочной жидкости непосредственно получили при помощи 30 мкл реагента 4-фтор-7-сульфамоилбензофуразан (ABD-F). Реакцию алкилирования выполнили при температуре 55°C в течение 15 мин и остановили при помощи 4,9 мкл HCl 12 н. После центрифугирования в течение 10 мин при 7500 g (4°C) надосадочную жидкость незамедлительно ввели в хроматограф, состоящий из автоматического инжектора автоматического пробозаборника Waters 717 plus при 4°C, бинарного насоса Waters 1525, оснащенного колонкой Atlantis dC18 (3 мкл; 3,9×150 мм), и детектора двойной абсорбции Waters 2487 (Waters limited, Lachine, QC, Canada). Возбуждение установили на 385 нм, а эмиссию - на 515 нм. Подвижная фаза, состоявшая из 2,5% метанола и 0,1 М уксуснокислого аммония доведенная до pH 4,0, подавалась со скоростью 1 мл/мин (Santa et al. 2006). Пиковые значения идентифицировали и количественно оценили при помощи программного обеспечения Breeze (Waters limited). Количественные величины ВЭЖХ нормировали к концентрациям белка. Измерения белка провели при помощи набора реагентов для определения белка с помощью бицинхониновой кислоты (Pierce, Rockford, IL, USA), как описано в протоколах производителя.
Измерения таурина и гипотаурина при помощи ВЭЖХ
Таурин и гипотаурин измерили при помощи ВЭЖХ с УФ-детектированием. Надосадочную жидкость мозговых NaHCO3 (брегма от 1,54 до -0,58 мм) экстрактов (подробности см. в разделе выше) получили непосредственно с использованием реагента дансил-хлорид (Sigma-Aldrich, St. Louis, МО, USA) на основании модифицированных опубликованных способов (Sailer and Czupryna 1989; Calon et al. 1999). Вкратце, 50 мкл дансил-хлорида (1,2 мг/мл) и 50 мкл образца или эталонного раствора смешали и затем инкубированы в течение 30 минут при температуре 90°C. После центрифугирования в течение 10 минут при 7500 г (4°C) надосадочную жидкость немедленно ввели в вышеописанный хроматограф. Поглощение установили на 337 нм, а чувствительность на 0,5 оптических единиц на всю шкалу. Подвижная фаза состояла из смеси вода-ацетонитрил (88,5-11,35% объем к объему), состоящей из 0,15% (объем к объему) фосфорной кислоты; и подавалась со скоростью 0,8 мл/мин. Результаты получили с использованием того же самого способа, который был описан выше.
Перфузия головного мозга in situ
Перфузию головного мозга in situ (ISCP) осуществили в состоянии глубокой анестезии после инъекции смеси кетамина/ксилазина (140/8 мг/кг), и как описано ранее (Dagenais et al., 2000; Ouellet et al., 2009). Чтобы гарантировать 100% попадание перфузата через гематоэнцефалический барьер, после лигирования наружной ветви в правую общую сонную артерию устанавливали катетер (см. Фиг. 3а для схематического представления). После этого вскрывали грудную клетка, извлекали сердце, и немедленно начинали перфузию со скоростью 2,5 мл/мин. Перфузионный раствор состоял из физиологического буферного раствора двууглекислой соли: 128 мМ NaCl, 24 мМ NaHCO3, 4,2 мМ KCl, 2,4 мМ NaH2PO4, 1,5 мМ CaCl2, 0,9 мМ MgCl2 и 9 мМ D-глюкозы. Раствор газировали 95% O2 и 5% CO2 для получения pH 7,4, после чего нагрвали при 37°C. Во всех экспериментах вместе с цистамином (259 мкМ) и цистеином (165 мкМ) производили перфузия радиоизотопной метки (14С-сахароза 0,3 микрокюри/мл) в качестве маркера целостности гематоэнцефалического барьера и сосудистого объема. Четыре отдельные ранее не подвергавшихся экспериментам группы мышей (по три в группе) оценивали в этом исследовании, и подвергали перфузии цистеином, цистеамином, обеими молекулами или одной 14С-сахарозой, которая служила для контроля.
Процедуру оканчивали обезглавливанием мышей после проведения перфузии в течение 60 секунд. Правое полушарие головного мозга извлекали, а лобную долю рассекали и мгновенно замораживали на твердой углекислоте для проведения дальнейших измерений цистеина и цистеамина при помощи ВЭЖХ. Оставшиеся ткани мозга из данного полушария расщепляли в 2 мл Solvable (Perkin-Elmer Life Sciences, Waltham, MA, USA) при 50°C в течение 48 часов и смешали с 9 мл сцинтилляционной смеси Hisafe (Perkin-Elmer Life Sciences). Аликвоты перфузионной жидкости взяли перед добавлением радиоизотопного маркера для количественного анализа при помощи ВЭЖХ, и до его изменения в результате прохождения через шприц и катетер для сцинтилляционных подсчетов, в конце каждого эксперимента, с целью вычисления коэффициента переносных свойств мозга (см. уравнение ниже). Изотоп 14С подсчитли в продукте расщепления мозга и в перфузате при помощи сцинтилляционного счетчика Wallac (Perkin-Elmer Life Sciences). Коэффициенты клиренса поглощения цистеина и цистеамина (Clup; мкл/г/с) вычислили из измеренного объема распределения цистеина или цистеамина, с поправкой на вместительность сосудов, определенную при помощи 14С-сахарозы. Вместительность сосудов была постоянной и составляла менее 20 мкл/г. Для проведения окончательных расчетов использовали следующее уравнение, как описано ранее (Dagenais et al., 2000).
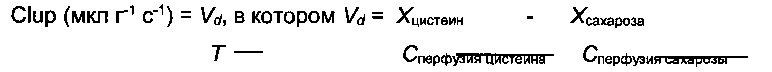
Vd (мкл/г) представляет собой объем распределения изучаемого соединения, Т (с) представляет собой время перфузии, Xцистеин - (нг/мг ткани) или Xсахароза (распадов в минуту/г) представляет собой количество цистеина или сахарозы, обнаруженное в лобной доле или в оставшейся ткани полушария, соответственно. С представляет собой концентрацию (нг/мкл; распадов в минуту/мл) в перфузионном растворе (в вышеприведенном уравнении цистеин служит в качестве примера).
Данные и статистические анализы
Все данные выражены как групповое среднее ± стандартная ошибка среднего числа. Данные оценивали при помощи двухфакторного дисперсионного анализа и проанализировали с использованием т-критерия Стьюдента. Каждую группу сравнивали с группой 0 мг/кг в указанные моменты времени (1, 3, 12, 24 или 48 часов). Применительно экспериментам по перфузии головного мозга in situ, для анализа значимости использовали т-критерий Стьюдента. Во всех случаях, значение p менее 0,05 приняли значимым.
Результаты
Общий эффект лечения цистамином
В ходе исследования «доза-ответ» летальные исходы отсутствовали, и все мыши демонстрировали хорошее состояние здоровья, за исключением группы, получавшей цистамин с дозировкой 200 мг/кг, в которой наблюдали признаки гипотермии (дрожь) и сонливости (закрывали веки) в течение примерно 2 часов, как сообщалось ранее (Gibrat et al., 2010).
Уровни цистеина и цистеамина в плазме и мозге после введения цистамина
Для изучения метаболитов, обнаруженных в плазме или мозге мышей, которым сделали единичную интраперитониальную инъекцию цистамина, использовали высокочувствительный способ ВЭЖХ, который позволил измерить конкретно цистеамин и цистеин посредством получения тиолпроизводных (-SH) используя соединение ABD-F перед флуоресцентным детектированием (Фиг. 7а). Цистеамин не обнаружили в плазме мышей, прошедших обработку цистамином. Вопреки телесному представлению, церебральные анализы концентраций цистеамина и цистеина показали заметное увеличение концентрации цистеамина в мозгу (Фиг. 7б). Данное увеличение наблюдали для всех трех введенных доз цистамина и во все целевые моменты времени данного исследования «доза-ответ». Двухфакторный дисперсионный анализ выявил значительные расхождения для двух показателей, доз и времени, также как и значительную взаимозависимость данных двух показателей (p<0,0001). Ретроспективеые (post hoc) анализы выявили значительное увеличение, в частности, через 1 час после инъекции доз 50 мг/кг (p<0,05) и 200 мг/кг (p<0,01). Уровни цистеамина оставались значительно повышенными через 3 часа после введения цистамина (p<0,01) и постепенно снижались в течение 48 часов, по сравнению с группой, которой ввели солевой раствор. Введение цистамина не повлияло на уровень цистеина в плазме (данные не приведены) или в мозге даже при самой высокой дозе 200 мг/кг (Фиг. 7в). Отсутствовали признаки каких-либо значительных изменений уровней цистеина в плазме и/или мозге для каких-либо исследованных доз или временных точек.
Уровень гипотаурина и таурина в плазме и крови после введения цистамина
Гипотаурин является основным метаболитом цистеамина, который может, в частности, образовывать таурин. Для определения концентрации данных двух молекул использовали получение первичной аминогруппы с использованием дансил-хлорида перед УФ-детектированием (Фиг. 8а). Данная реакция имеет место как в ароматическом, так и в алифатическом амине, приводя к получению устойчивых сульфаниламидных аддуктов и позволяя определить и гипотаурин (Фиг. 8а; состав 2), и таурин (Фиг. 8а; состав 1) при помощи одного и того же способа. Несмотря на некоторые различия между группами, не наблюдали значительных изменений в уровне гипотаурина и таурина в мозге для какой-либо из трех доз (10, 50 и 200 мг/кг) по сравнению с контрольными группами (Фиг. 8б и в). В мозге отсутствовали признаки накопления гипотаурина и таурина в любой временной точке, когда бы мышей не умерщвляли (через 1, 3, 12, 24 и 48 часов). Уровни гипотаурина и таурина в плазме оставались ниже порога или близко к порогу обнаружения.
Цистеин способствует переносу цистеамина мозгом
Так как подавляющее большинство эндогенных и экзогенных соединений неактивны в ЦНС, потому что не пересекают гематоэнцефалический барьер, авторы настоящего изобретения исследовали поглощение цистеамина и цистеина в мозгу. Используя перфузию головного мозга in situ (ISCP), авторы настоящего изобретения измерили параметры гематоэнцефалического переноса цистеамина и цистеина посредством их прямого введения в мозг через сонную артерию (Dagenais et al., 2000; Ouellet et al., 2009) (Фиг. 9a). Как цистеин, так и цистеамин пересекли гематоэнцефалический барьер, что наблюдали по их коэффициентам клиренса поглощения (Clup), составившим 4,39±0,47 и 0,15±0,02 мкл/г/с, соответственно (Фиг. 9б и в). Для сравнения, обычный, используемый для ЦНС препарат, такой как морфин, демонстрирует коэффициент клиренса поглощения (Clup) 0,3 мкл/г/с, тогда как коэффициент клиренса поглощения (Clup) препаратов с высокой диффундирующей способностью, таких как диазепам или жирные кислоты, достигает 40 мкл/г/с (Bourasset etal., 2003; Ouellet etal., 2009). Интересно, что одновременная перфузия цистеина и цистеамина усиливала их усвоение мозгом. Действительно, измерили значительное увеличение коэффициента клиренса поглощения (Clup) цистеамина (+133%; p<0,05) и цистеина (+59%; p<0,05), если оба препарата вводили одновременно. Повторную оценку уровня гипотаурина и таурина, которые, как было показано, проникают через гематоэнцефалический барьер, не производили (Benrabh et al., 1995).
ПРИМЕР 3 Нейроспасательные и нейровосстанавливающие свойства цистамина после интрастриарного введения 6-гидроксидопамина 6-OHDA
Материал и способы
Животные
Молодых взрослых (возраст 9 недель, масса 25 г) самцов мышей C57BL/6 купили в Charles River Laboratories (Montreal, QC, Canada). Животных поместили по 4 особи в каждую клетку с обычными условиями, свободным доступом к еде и пище, рандомизировали, за ними ухаживал один и тот же исследователь при одинаковых условиях. Все эксперименты проводили в соответствии с требованиями канадского Совета по уходу за животными и с одобрения комитета института при Больничном центре университета Лаваль. В ходе эксперимента состояние здоровья мышей, вовлеченных в исследование, тщательно наблюдали на потерю массы или другие признаки, связанные с вопросами здоровья. Для сведения к минимуму боли и дискомфорта животных приложили максимум усилий.
6-гидроксидопамин (6-OHDA) и лечение цистамином
Данный протокол основывали на односторонней стереотаксической интрастриарной инъекции 6-гидроксидопамина (6-OHDA). Интрастриарное введение 6-OHDA вызывает прогрессирующие и диссимилирующие дегенеративные изменения дофаминовых нейронов в черной субстанции (Bjorklund et al., 1997; Costantini et al., 2001). Мышей анестезировали используя изофлуран, и помещали на стереотаксическую рамку, приспособленную для мышей. 6-OHDA растворяли до концентрации 2 мкг/мкл в 0,9% солевом растворе и 0,02% аскорбиновой кислоты, и 2 мкл вводили в правый стриатум со скоростью 0,5 мкл/мин. После инъекции иглу оставляли на месте на 3 минуты перед извлечением. Инъекцию осуществляли используя шприц Гамильтона в соответствии со стереотаксическими координатами: АР: +0,04 см, ML: -0,18 см, DV: -0,31 см (соответствуют атласу Allan Р. 2008).
Чтобы служить в качестве контрольных, других мышей подвергли тем же хирургическим процедурам, но в те же координаты ввели 2 мкл только растворителя (0,9% солевой раствор и 0,02 аскорбиновая кислота). Данное исследование далее разделили на 2 отдельных эксперимента:
1) Нейроспасательное действие цистамина (дихлоргидрат цистамина (Sigma, St. Louis, МО) у мышей, пораженных 6-OHDA. Для данного эксперимента первую интраперитониальную инъекцию 10 мг/кг цистамина ввели через 3 дня после хирургического вмешательства, после чего лечение продолжали ежедневно в течение 14 дней.
2) Нейровосстанавливающее действие цистамина (дихлоргидрат цистамина, (Sigma, St. Louis, МО) у мышей, пораженных 6-OHDA. Лечение цистамином начали спустя 3 недели после хирургического вмешательства, когда дофаминергическое поражение, как известно, становится устойчивым и достигает высшей точки. Лечение продолжали ежедневно в течение 6 недель.
Влияние цистамина на токсичность 6-OHDA исследовали в следующих экспериментальных группах: Группа I, плацебо + солевой раствор; Группа II, 6-OHDA + солевой раствор; Группа III, плацебо + цистамин; Группа IV, 6-OHDA + цистамин. В общей сложности, для каждого эксперимента использовали 40 мышей (по 10 мышей для каждой группы), у которых ежедневно наблюдали изменение массы, и в конечном счете умертвили посредством перфузии через 24 часа после последней инъекции цистамина (или носителя). Результаты показаны на Фигурах 10, 11 и 12.
Перфузия и обработка тканей
Животных умертвили в состоянии глубокой анестезии после введения кетамина/ксилазина (Vetalar, Bioniche, Belleville, ON/Rompun, Bayer, Toronto, ON).
Всех мышей подвергли внутрисердечной перфузии 0,1 М фосфатно-буферноым солевым раствором (ФБСР) в отсутствии рибонуклеаз. После внутрисердечной перфузии мозг извлекли, а заднюю часть мозга каждой мыши, представлявшую собой весь средний мозг, постфиксировали в 4% растворе параформальдегида (ПФА) для дополнительного иммуногистохимического анализа и гибридизации in situ. Переднюю часть мозга, включающую правый и левый стриатум, мгновенно замораживали и использовали для ВЭЖХ и вестерн-блоттинга.
Количественного определение катехоламина при помощи ВЭЖХ, ТГ-иммуногистохимический анализ и гибридизация in situ для Nurr1 и DAT провели, как описано в Примере 1.
Денситометрические измерения уровней Nurr1 и переносчика дофамина (DAT) иРНК
Уровни ауторадиографического мечения количественно определили при помощи компьютерной денситометрии. Оцифрованные изображения головного мозга и их анализы проводили с тем же оборудованием, что описано выше. Оптическая плотность авторадиограмм переводили в микрокюри/г ткани с использованием стандартов радиоактивности 14С (стандарты ARC 146-14С, American Radiolabelled Chemicals Inc., St. Louis, МО. Уровни Nurr1 и DAT иРНК в компактной черной субстанции (SNc) измеряли, используя аналогичные переднезадние уровни всех срезов. Усредненное мечение каждого уровня SNc вычисляли по трем соседним срезам мозга одной и той же мыши. Фоновую интенсивность, взятую из белого поля лишенной Nurr1 или DAT иРНК черной субстанции reticulata (SNr), вычитали из каждого замера.
Стереологическое количественное определение ТГ-иммунореактивных нейронов
Потерю дофаминэргических нейронов определяли стереологическим подсчетом ТГ-иммунореактивных клеток (опознаваемая сома) при освещении светлым полем. Каждый десятый срез SNc анализировали с использованием исследовательского программного обеспечения (Stereo MicroBrightfield, Colchester, VT, USA), прилагаемого к микроскопу Е800 Nikon (Nikon Canada Inc., Mississauga, ON, Canada). После очерчивания SNc при малом увеличении (объектив 4Х) на каждый срез наложили точечную сетку. Для большинства исследованных ростральных уровней SNc (брегма -3,08 мм), SNc очерчивали видимыми границами медиального терминального ядра. Применительно к промежуточным (брегма -3.28 мм) и большинству исследованных каудальных участков SNc (брегма -3.58 мм), структуру разграничивали на выходе третьего черепного нерва. Подсчет клеток, окрашенных с использованием иммунных меток, производился при помощи способа оптического фракционирования при большем увеличении (объектив 20Х). Для подсчета использовали следующие переменные: расстояние между подсчетными рамками (150 мкм × 150 мкм), размер подсчетной рамки (75 мкм), толщина защитной зоны (1 мкм). Подсчитывали только те клетки, которые не пересекали запрещенные линии. Способ оптического фракционирования (Глэйсер и Глэйсер (Glaser and Glaser), 2000) использовался для подсчета ТГ-положительных (ТГ- и крезилвиолет-положительных) и ТГ-отрицательных (только крезилвиолет-положительных) экспрессирующих клеток. Стереологический подсчет клеток проводили два независимых исследователя. Следует отметить, что анализ ТГ-иммунореактивных профилей проводили только на SNc и, следовательно, не проводили на вентральном участке.
Вращение, вызванное апоморфином
Считается, что ротационное поведение представляет собой надежный физиологический показатель истощения дофамина и асимметрической стимуляции рецептора дофамина. Использование агонистов дофамина, таких какапоморфин (Anden et al., 1966; Ungerstedt et al., 1968), стимулирует рецепторы дофамина напрямую, что приводит к вращению, контралатеральному к полушарию с дофаминовым истощением. Мышей испытывали апоморфином (0,5 мг/кг, Sigma-Aldrich) через 3, 6 и 9 недель после вызванного поражения, а оценку ротационного поведения проводили через 45 минут при помощи автоматического ротометра. Результаты усредняли и представляли в виде «чистого» вращательного движения (= число контралатеральных вращательных движений - число ипсилатеральных вращательных движений), как было описано ранее (Metz, 2002). Животные позволяли привыкнуть в течение 5 минут после инъекции перед началом записи вращательных движений.
Шаговый тест
Тестирование подстраивающихся шагов адаптировали из исследований на крысах (Lindner et al., 1995) и мышах, обработанных МФТП (Blume et al., 2009). Мышей держали за основание хвоста, при этом их задние конечности висели над столом, и перемещали назад с одинаковой скоростью, чтобы они пересекали расстояние в 1 метр за 3-4 секунды. Мышей снимали, используя цифровую видеокамеру (Sony Handcam, DCR-HC90E PAL), но видеоролик анализировался в режиме оффлайн для подсчета числа подстраивающихся шагов, сделанных контралатеральной или ипсилатеральной лапой, относительно пораженного полушария, на всем расстоянии. Испытание на мышах провели три раза - через 3, 6 и 9 недель после хирургического вмешательства, и вычисляли усредненные данные для всех трех испытаний.
Цилиндровый тест
Тест на асимметричность использования конечности (цилиндровый), который измеряет движения нагруженной передней конечности, как было показано, является надежным показателем потери нигростриарных клеток при односторонней инъекции 6-OHDA крысам и мышам (Schallert et al., 2000; Tillerson et al., 2001; Lundblad et al., 2004; Lancu et al., 2005). Для изучения предпочтений при непринужденном использовании передних конечностей во время исследовательской деятельности мышей поместили в индивидуальные стеклянные цилиндры (диаметром 10 см, высотой 14 см), расположенные перед двумя вертикальными зеркалами, чтобы мышей можно было видеть под всеми углами. Сразу же после помещения мышей в цилиндры их записывали на видео в течение 3 минут. Животным не предоставляли возможность привыкнуть к цилиндрам до начала видеозаписи. В дальнейшем видеозаписи анализировали и подсчитывали число поддерживающих касаний к стенкам (контакты при полностью вытянутых пальцах), сделанных независимо передней лапой ипсилатеральной или контралатеральной поражению. Меру асимметричности использования передней конечности получили путем выражения касаний, осуществленных лапой контралатеральной поражению (правой лапой), в процентах от общего числа касаний в каждой сессии эксперимента.
Статистические анализы
Все анализы выражены как групповое среднее ± стандартная ошибка среднего числа. Оценку данных проводили при помощи двухфакторного дисперсионного анализа. Если двухфакторный дисперсионный анализ выявлял незначительное взаимодействие, данные также проверяли на значимость при помощи ретроспективного (post hoc) множественного сравнения полученных результатов по методу Тьюки. Во всех случаях величину Р менее 0.05 считали значимой.
БИБЛИОГРАФИЯ
Allen P. Allen brain atlas. Seattle (WA): Allen Institute for Brain Science; 2008. Available from: http://www.brain-map.org.
Anden, N.E., Dahlstrom, A., Fuxe, K., Larsson, K., 1966. Functional role of the nigrostriatal dopamine neurons. Acta Pharmacol. Toxicol. 24, 236-274.
Bacq Z.M. and Beaumariage M.L. (1965) Radioprotective action of cysteamine and cystamine in mice as a function of the period of time between injection of the protector and the start of X-Ray irradiation. Arch. Int. Pharmacodyn. Ther 153, 457-459.
Beaudry G, Langlois MC, Weppe I, Rouillard C, Levesque D. Contrasting (2000) patterns and cellular specificity of transcriptional regulation of the nuclear receptor nerve growth factor-inducible В by haloperidol and clozapine in the rat forebrain. J Neurochem 2000; 75:1694-702.
Benrabh H., Bourre J.M. and Lefauconnier J.M. (1995) Taurine transport at the blood-brain barrier: an in vivo brain perfusion study. Brain Res. 692, 57-65.
Bjorklund, A., Rosenblad, C., Winkler, C., Kirik, D., 1997. Studies on neuroprotective and regenerative effects of GDNF in a partial lesion model of Parkinson's disease. Neurobiol Dis 4, 186-200.
Blume SR, Cass DK, Tseng KY. Stepping test in mice: a reliable approach in determining forelimb akinesia in MPTP-induced Parkinsonism. Exp Neurol 2009; 219:208-11.
Borrell-Pages M., Canals J.M., Cordelieres F.P. et al. (2006) Cystamine and cysteamine increase brain levels of BDNF in Huntington disease via HSJ1b and transglutaminase. J. Clin. Invest 116, 1410-1424.
Bouckenooghe Т., Remade C. and Reusens B. (2006) Is taurine a functional nutrient? Curr: Opin. Clin. Nutr. Metab. Care 9, 728-733.
Bourasset F., Cisternino S., Temsamani J. and Scherrmann J.M. (2003) Evidence for an active transport of morphine-6-beta-d-glucuronide but not P-glycoprotein-mediated at the blood-brain barrier. J. Neurochem. 86, 1564-1567.
Bousquet M, Gibrat C, Saint-Pierre M, Julien C, Calon F, Cicchetti F. Modulation of brain-derived neurotrophic factor as a potential neuroprotective mechanism of action of omega-3 fatty acids in a parkinsonian animal model. Prog Neuropsychopharmacol Biol Psychiatry. 2009 Nov 13; 33(8):1401-8. Epub 2009 Jul 24.
Bousquet M., Gibrat C., Ouellet M., Rouillard C., Calon F., and Cicchetti F. (2010) Cystaminemetabolism and brain transport properties: clinical implications for neurodegenerative diseases. J. Neurochem. (2010) 114, 1651-1658.
Bousquet M, Gue K, Emond V, Julien P, Kang JX, Cicchetti F, Calon F. Transgenic conversion of omega-6 into omega-3 fatty acids in a mouse model of Parkinson's disease. J Lipid Res. (2011) Feb; 52(2):263-71. Epub 2010 Nov 29.
Calon F., Morissette M., Goulet M., Grondin R., Blanchet P.J., Bedard P.J. and Di Paolo T. (1999) Chronic DI and D2 dopaminomimetic treatment of MPTP-denervated monkeys: effects on basal ganglia GABA(A)/benzodiazepine receptor complex and GABA content. Neurochem. Int 35, 81-91.
Calon F. et al., Effect of MPTP-induced denervation on basal ganglia GABA(B) receptors: correlation with dopamine concentrations and dopamine transporter. Synapse 2001, June 1; 40(3):225-34.
Calon F. et al., Changes of GABA receptors and dopamine turnover in the postmortem brains of parkinsonians with levodopa-induced motor complications. Mov Disord. 2003 Mar; 18(3):241-53.
Cavallini D., Scandurra R. and Demarco C. (1963) The enzymatic oxidation of cysteamine to hypotaurine in the presence of sulfide. J. Bio. Chem. 238, 2999-3005.
Coloso R.M., Hirschberger L.L, Dominy J.E., Lee J.I. and Stipanuk M.H (2006) Cysteamine dioxygenase: evidence for the physiological conversion of cysteamine to hypotaurine in rat and mouse tissues. Adv. Exp. Med. Biol. 583, 25-36.
Costantini LC, Cole D, Chaturvedi P, Isacson O. Immunophilin ligands can prevent progressivedopaminergic degeneration in animal models of Parkinson's disease. Eur J Neurosci. Mar.
Cossette M, Parent A, Levesque D. Tyrosine hydroxylase-positive neurons intrinsic to the human striatum express the transcription factor Nurr1. Eur J NeuroSci. 2004; 20:2089-95.
Dagenais C., Rousselle C., Pollack G.M. and Scherrmann J.M. (2000) Development of an in situ mouse brain perfusion model and its application to mdrla P-glycoprotein-deficient mice. J. Cereb. Blood Flow Metab. 20, 381-386.
Dedeoglu A., Kubilus J.K., Jeitner Т.M. et al. (2002) Therapeutic effects of cystamine in a murine model of Huntington's disease. J. Neurosci. 22, 8942-8950.
Dohil R., Fidler M., Gangoiti J.A., Kaskel F., Schneider J.A. and Barshop B.A. (2009) Twice-daily cysteamine bitartrate therapy for children with cystinosis. J. Pediatr. 156, 71-75.
Dominy J., Eller S. and Dawson R. Jr (2004) Building biosynthetic schools: reviewing compartmentation of CNS taurine synthesis. Neurochem. Res. 29, 97-103.
Dominy J.E. Jr, Simmons C.R., Hirschberger L.L., Hwang J., Coloso R.M. and Stipanuk M.H. (2007) Discovery and characterization of a second mammalian thiol dioxygenase, cysteamine dioxygenase. J. Biol. Chem. 282, 25189-25198.
Dubinsky R. and Gray C. (2006) CYTE-I-HD: phase I dose finding and tolerability study of cysteamine (Cystagon) in Huntington's disease. Mov. Disord. 21, 530-533.
Ewetz L. and Sorbo B. (1966) Characteristics of the cysteinesulfinate-forming enzyme system in rat liver. Biochim. Biophys. Acta 128, 296-305.
Fox J.H., Barber D.S., Singh B. et al. (2004) Cystamine increases L-cysteine levels in Huntington's disease transgenic mouse brain and in a PC12 model of polyglutamine aggregation. J. Neurochem. 91, 413-422.
French E.D., Vezzani A., Whetsell W.O. Jr. and Schwarcz R. (1986) Anti-excitotoxic actions of taurine in the rat hippocampus studied in vivo and in vitro. Adv. Exp. Med. Biol. 203, 349-362.
Gibrat C., Bousquet M., Saint-Pierre M., Levesque D., Calon F., Rouillard C. and Cicchetti F. (2010) Cystamine prevents MPTP-induced toxicity in young adult mice via the up-regulation of the brain-derived neurotrophic factor. Prog. Neuropsychopharmacol. Biol. Psychiatry 34, 193-203.
Gibrat C, Saint-Pierre M, Rouillard C, Cicchetti F. (2007). Neuroprotective properties of cystamine in acute vs chronic models of Parkinson's disease. The Canadian Journal of Neurological Sciences Suppl. 3. - S42.
Gibrat C, Bousquet M, Saint-Pierre M,  D, Calon F, Rouillard C, Cicchetti F. 2009. Neuroprotective mechanisms of cystamine in a murine model of Parkinson's disease. Parkinsonism and Related Disorders 15S2, S29-S199.
D, Calon F, Rouillard C, Cicchetti F. 2009. Neuroprotective mechanisms of cystamine in a murine model of Parkinson's disease. Parkinsonism and Related Disorders 15S2, S29-S199.
Gibrat C, Saint-Pierre M, Bousquet M, Levesque D, Rouillard C, Cicchetti F. Differences between subacute and chronic MPTP mice models: investigation of dopaminergic neuronal degeneration and alpha-synuclein inclusions. J Neurochem (2009 B); 109:1469-82.
Green H. (1993) Human genetic diseases due to codon reiteration: relationship to an evolutionary mechanism. Cell 74, 955-956.
Huxtable R.J. (1992) Physiological actions of taurine. Physiol. Rev. 72, 101-163.
Iancu R, Mohapel P, Brundin P, Paul G. Behavioral characterization of a unilateral 6-OHDA-lesion model of Parkinson's disease in mice. Behav Brain Res 2005; 162:1-10.
Jeitner Т.M., Delikatny E.J., Ahlqvist J., Capper H. and Cooper A.J. (2005) Mechanism for the inhibition of transglutaminase 2 by cystamine. Biochem. Pharmacol. 69, 961-970.
Karpuj M.V., Becher M.W., Springer J.E., Chabas D., Youssef S., Pedotti R., Mitchell D. and Steinman L. (2002) Prolonged survival and decreased abnormal movements in transgenic model of Huntington disease, with administration of the transglutaminase inhibitor cystamine. Nat. Med. 8, 143-149.
Lapointe N, St-Hilaire M, Martinoli MG, Blanchet J, Gould P, Rouillard C, et (2004) Rotenone induces non-specific central nervous system and systemic toxicity. FASEB J. 2004; 18:717-9.
Lee J.I., Londono M., Hirschberger L.L. and Stipanuk M.H. (2004) Regulation of cysteine dioxygenase and gamma-glutamylcysteine synthetase is associated with hepatic cysteine level. J Nutr. Biochem. 15, 112-122.
Lein ES, Hawrylycz MJ, et al. Genome-wide atlas of gene expression in the adult mouse brain. Nature 2007; 445:168-76.
Leonardi R., Zhang Y. M., Rock С.O. and Jackowski S. (2005).
Coenzyme A: back in action. Prog. Lipid Res. 44, 125-153.
Lindner MD, Winn SR, Baetge EE, Hammang JP, Gentile FT, Doherty E, et al. Implantation of encapsulated catecholamine and GDNF-producing cells in rats with unilateral dopamine depletions and parkinsonian symptoms. Exp Neurol 1995; 132:62-76. 690.
Lundblad M, Picconi B, Lindgren H, Cenci MA. A model of I-DOPA-induced dyskinesia in 6-hydroxydopamine lesioned mice: relation to motor and cellular parameters of nigrostriatal function. Neurobiol Dis 2004; 16:110-23.
Martignoni M., Groothuis G.M. and de Kanter R. (2006) Species differences between mouse, rat, dog, monkey and human CYP-mediated drag metabolism, inhibition and induction. Expert Opin. Drug Metab. Toxicol. 2, 875-894.
Muramatsu M., Kakita K., Nakagawa K. and Kuriyama K. (1978) A modulating role of taurine on release of acetylcholine and norepinephrine from neuronal tissues. Jpn. J. Pharmacol. 28, 259-268.
Oja S.S. and Saransaari P. (1996) Taurine as osmoregulator and neu romodulator in the brain. Metab. Brain Dis. 11, 153-164.
Oldendorf W.H. and Szabo J. (1976) Amino acid assigmnent to one of three blood-brain barrier amino acid carriers. Am. J. Physiol. 230, 94-98.
Ouellet M., Emond V., Chen С.Т., Julien C, Bourasset F., Oddo S., LaFerla E, Bazinet R.P. and Calon F. (2009) Diffusion of docosahexaenoic and eicosapentaenoic acids through the blood-brain barrier: and in situ cerebral perfusion study. Neurochem. Int. 55, 476-482.
Pasantes-Morales H., Arzate N.E. and Cruz C. (1981) The role of taurine in nervous tissue: its effects on ionic fluxes. Adv Exp Med Biol 139, 273-292.
Pinto J.Т., Van Raamsdonk J.M., Leavitt B.R., Hayden M.R., Jeitner Т.M., Thaler H.Т., Krasnikov B.F. and Cooper A.J. (2005) Treatment of YAC128 mice and their wild-type littermates with cystamine does not lead to its accumulation in plasma or brain: implications for the treatment of Huntington disease. J Neurochem 94, 1087-1101.
Pinto J.Т., Khomenko Т., Szabo S., McLaren G.D., Denton Т.Т., Krasnikov B.F., Jeitner Т.M. and Cooper A.J. (2009) Measurement of sulfur-containing compounds involved in the metabolism and transport of cysteamine and cystamine. Regional differences in cerebral metabolism. J Chromatogr В Analyt Technol Biomed Life Sci 877, 3434-3441.
Pitari G., Maurizi G., Flati V., Ursini C.L., Spera L., Dupre S. and Cavallini D. (1992) Enzymatic synthesis of S-aminoethyl-L-cysteine from pantetheine. Biochim Biophys Acta 1116, 27-33.
Saller C.F. and Czupryna M.J. (1989) gamma-Aminobutyric acid, glutamate, glycine and taurine analysis using reversed-phase high-performance liquid chromatography and ultraviolet detection of dansyl chloride derivatives. J Chromatogr 487, 167-172.
Santa Т., Aoyama C., Fukushima Т., Imai K. and Funatsu T. (2006) Suppression of thiol exchange reaction in the determination of reduced-form thiols by high-performance liquid chromatography with fluorescence detection after derivatization with fluorogenic benzofurazan reagent, 7-fluoro-2,1,3-benzoxadiazole-4-sulfonate and 4-aminosulfonyl-7-fluoro-2,1,3-benzoxadiazole. Biomed Chromatogr 20, 656-661.
Schallert T, Fleming SM, Leasure JL, Tillerson JL, Bland ST. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury. Neuropharmacology 2000; 39:777-87.
Sershen H. and Lajtha A. (1979) Inhibition pattern by analogs indicates the presence of ten or more transport systems for amino acids in brain cells. J Neurochem 32, 719-726.
Stack E.C., Ferro J.L, Kim J., Del Signore S.J., Goodrich S., Matson S., Hunt B.В., Cormier K., Smith K., Matson W.R., Ryu H. and Ferrante R.J. (2008) Therapeutic attenuation of mitochondrial dysfunction and oxidative stress in neurotoxin models of Parkinson's disease. Biochim Biophys Acta 1782, 151-162.
Sun L., Xu S., Zhou M., Wang C., Wu Y. and Chan P. (2010) Effects of cysteamine on MPTP-induced dopaminergic neurodegeneration in mice. Brain Res. 1335, 74-82.
Tillerson JL, Cohen AD, Philhower J, Miller GW, Zigmond MJ, Schallert T. Forced limb-use effects on the behavioral and neurochemical effects of 6-hydroxydopamine. J Neurosci 2001; 21:4427-35.
Tremblay M.E., Saint-Pierre M., Bourhis E., Levesque D., Rouillard C. and Cicchetti F. (2006) Neuroprotective effects of cystamine in aged parkinsonian mice. Neurobiol Aging 27, 862-870.
Ungerstedt, U., 1968. 6-Hydroxydopamine-induced degeneration of central monoamine neurons. Eur. J. Pharmacol. 5, 5107-5110.
Wade L.A. and Katzman R. (1975) Synthetic amino acids and the nature of L-DOPA transport at the blood-brain barrier. J Neurochem 25, 837-842.
Wade L.A. and Brady H.M. (1981) Cysteine and cystine transport at the blood-brain barrier. J Neurochem 37, 730-734.
Wang X., Sarkar A., Cicchetti F., Yu M., Zhu A., Jokivarsi K., Saint-Pierre M. and Brownell A.L. (2005) Cerebral PET imaging and histological evidence of transglutaminase inhibitor cystamine induced neuroprotection in transgenic R6/2 mouse model of Huntington's disease. J Neurol Sci 231, 57-66.
Zetterstrom, Rolf H. Ludmila Solomin, Lottie Jansson, Barry J. Hoffer, Lars Olson, Thomas Perlmann. Dopamine neuron agenesis in Nurr1-deficient mice. Science 1997 Apr 11; 276(5310):248-50.