НОВЫЕ 1,3-БЕНЗОКСАЗОЛ-2(3Н)-ОНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ И КОСМЕТИЧЕСКИХ СРЕДСТВ
Вид РИД
Изобретение
Настоящее изобретение относится к новому классу 1,3-бензоксазол-2(3H)-онов и к их применению в качестве лекарственного препарата, предпочтительно в качестве дерматологического средства, и в качестве косметических средств. Эти новые соединения нацелены на эндоканнабиноидную систему и особенно пригодны при лечении и/или профилактике воспаления, раздражения, чесотки, зуда, боли, отечности и/или предаллергических или аллергических состояний у пациента. Обычно их применяют местно на коже или слизистой оболочке млекопитающих в форме фармацевтической или косметической композиции, содержащей соединение и фармацевтически и/или косметически приемлемый носитель.
Уровень техники изобретения
Эндоканнабиноидная система (ECS) включает каннабиноидные рецепторы (CB1 и CB2, TRPV1 и, возможно, также GPR55), лиганды, представляющие собой производные арахидоновой кислоты, и собственные регуляторные ферменты. Важная роль эндоканнабиноидной системы в периферических тканях продемонстрирована в многочисленных современных исследованиях (Di Marzo V. Targeting the endocannabinoid system: to enhance or reduce? Nat. Rev. Drug Discov., 2008 May; 7(5): 438-55). Принимая во внимание тот факт, что активация периферической эндоканнабиноидной системы часто связана с противовоспалительными и иммуносупрессорными воздействиями на кожу, роль ECS представляется более сложной. Активация CB2 рецептора, как было показано, вызывает инициацию эндорфинов, которые на местном уровне действуют как анальгетики (Ibrahim M.M., Porreca F., Lai J., Albrecht P.J., Rice F.L., Khodorova A., Davar G., Makriyannis A., Vanderah T.W., Mata H.P., Malan T.P. Jr. CB2 cannabinoid receptor activation produces antinociception by stimulating peripheral release of endogenous opioids. Proc. Natl. Acad. Sci. USA., 2005 Feb. 22; 102(8): 3093-8). При исследовании мышей с заблокированным геном CB установлено, что ECS и CB1 рецептор могут ингибировать патогенез аллергического контактного дерматита (Karsak M., Gaffal E., Date R., Wang-Eckhardt L., Rehnelt J., Petrosino S., Starowicz K., Steuder R., Schlicker E., Cravatt B., Mechoulam R., Buettner R., Werner S., Di Marzo V., Tüting T., Zimmer A. Attenuation of allergic contact dermatitis through the endocannabinoid system. Science. 2007 Jun., 8;316(5830): 1494-7).Примечательно, что в этом исследовании показано, что ингибиторы метаболического распада анандамида посредством гидролазы жирнокислотного амида (FAAH) могут быть весьма перспективной терапевтической стратегией лечения различных форм дерматита. В общем и целом, эндоканнабиноидная система кожи, представленная как CB1, так и CB2 рецепторами, обнаружена в кератиноцитах и фибробластах, и эндоканнабиноиды высвобождаются кожей там, где они, по всей видимости, регулируют множественные сигналы, задействованные в воспалении. Анандамид оказывает сильные противовоспалительные и противоаллергические воздействия (Leonti M., Casu L., Raduner S., Cottiglia F., Floris C., Altmann K.H., Gertsch J. Falcarinol is a covalent cannabinoid CB1 receptor antagonists and induces pro-allergic effects in skin. Biochem. Pharmacol. 2010, 79: 1815-1826). Кроме того, ингибиторы обратного захвата анандамида, как было показано, оказывают ряд благоприятных воздействий, включая случаи нейропатической и периферической боли (Yates M. L., Baker E.L. Inactivation and Biotransformation of the endogenous cannabinoids anandamide and 2-arachidonoyl glycerol. Mol. Pharmacol., 2009, 76: 11-17). Однако лежащие в основе механизмы еще не полностью изучены и по-прежнему остаются многочисленные вопросы, требующие ответа.
В WO2010/136221 раскрываются додека-2Е,4E-диенамиды и их применение в качестве лекарственных препаратов и косметических средств.
Таким образом, заявленный класс 1,3-бензоксазол-2(3H)-онов по настоящему изобретению не раскрыт в известном предшествующем уровне техники, не говоря уже о том, что они удобны и активны при лечении и профилактике заболеваний кожи.
Более того, даже если известно большое количество дерматологических средств и препаратов из предшествующего уровня техники для лечения любых видов кожного дискомфорта, все еще существует большой спрос на обнаружение новых активных веществ, являющихся более эффективными, для применения которых требуются еще более сниженные количества, и которые в меньшей степени обладают нежелательными побочными эффектами.
Таким образом, основной целью настоящего изобретения является предоставление новых соединений, подходящих для использования в качестве лекарственных средств. Следующая цель настоящего изобретения заключается в предоставлении новых соединений, подходящих в качестве дерматологических средств для лечения и профилактики ряда некоторых патологических состояний, включая воспаление, раздражение, чесотку, зуд, боль, отечность, и/или предаллергические или аллергические состояния, и т.д., в частности, на коже и слизистой оболочке млекопитающих, причем таких соединений, которые являются более эффективными, требующими пониженные количества активного ингредиента по сравнению с соединениями предшествующего уровня техники и в меньшей степени обладающими нежелательными побочными эффектами.
Сущность изобретения
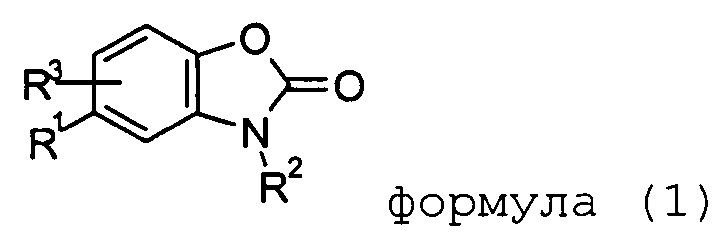
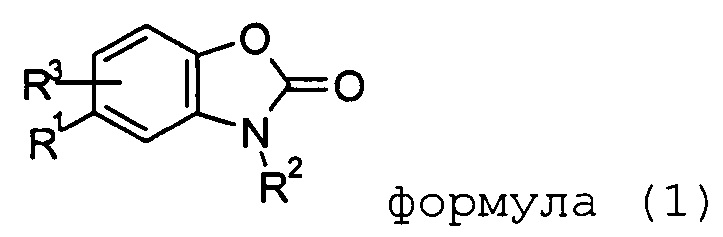
Цели, упомянутые выше, были достигнуты неожиданным образом в соответствии с настоящим изобретением. Таким образом, настоящее изобретение относится к конкретным 1,3-бензоксазол-2(3H)-онам, в соответствии с нижеприведенной формулой (1).
формула (1)
Соединения в соответствии с формулой (1) представляют собой альтернативные решения одной и той же проблемы и не являются очевидными для специалиста в данной области.
В формуле (1) остаток Rl выбирают из группы, состоящей из -(CH2)nN(R4)C(О)R5 и -C(О)NR4R6. Предпочтительно Rl представляет собой -(CH2)nN(R4)C(О)R5.
В формуле (1) остаток R2 выбирают из группы, состоящей из водорода; -C1-6алкила, необязательно замещенного одним или несколькими заместителями, выбираемыми из галогена, OH, OC1-6алкила, OC3-7циклоалкила; -C3-7циклоалкила, необязательно замещенного одним или несколькими заместителями, выбираемыми из галогена, OH, OC1-6алкила, OC3-7циклоалкила; -(C3-7циклоалкил)-C1-6-алкила, необязательно замещенного одним или несколькими заместителями, выбираемыми из галогена, OH, OC1-6алкила, OC3-7циклоалкила. Хотя вышеупомянутые необязательные заместители являются предпочтительными в соответствии с настоящим изобретением, другие заместители, упомянутые ниже в описании, являются также подходящими в соответствии с настоящим изобретением.
В формуле (1) остаток R3 выбирают из группы, состоящей из водорода, галогена, гидрокси, метокси или -CN.
В формуле (1) остаток R4 выбирают из группы, состоящей из водорода или C1-6-алкила.
В формуле (1) остаток R5 выбирают из группы, состоящей из C8-15алкила, C8-15алкенила, C8-15алкинила, (C6-10арил)-C6-10алкила, (C6-10арил)-C6-10алкенила и (C6-10арил)-C6-10алкинила. Во всех этих арилсодержащих группах арил может быть замещен одним или несколькими заместителями, указанными ниже в настоящем описании.
В формуле (1) остаток R6 выбирают из группы, состоящей из C9-16алкила, C9-16алкенила, C9-16алкинила, (C6-10арил)-C7-11алкила, (C6-10арил)-C7-11алкенила и (C6-10арил)-C7-11алкинила. Во всех этих арилсодержащих группах арил может быть замещен одним или несколькими заместителями, указанными ниже в настоящем описании.
В формуле (1) n представляет собой 0, 1 или 2, предпочтительно 0 или 1, более предпочтительно 0.
Предпочтительно, соединения в соответствии с настоящим изобретением представляют собой такие, у которых в формуле (1) R1 представляет собой -(CH2)nN(R4)C(О)R5 при n равном 0 или 1, предпочтительно 0; R2 представляет собой водород или C1-6алкил, необязательно замещенный одним или несколькими заместителями, выбираемыми из галогена, OH, OC1-6алкила, OC3-7циклоалкила; R3 представляет собой водород или галоген, предпочтительно водород; R4 представляет собой водород; и R5 выбирают из C8-15алкила, C8-15алкенила, (C6-10арил)-C6-10алкила и (C6-10арил)-C6-10алкенила. В этих определениях арил необязательно замещен одним или несколькими заместителями, указанными ниже в настоящем описании.
Предпочтительно, соединения в соответствии с настоящим изобретением являются такими, у которых в формуле (1) R1 представляет собой -C(О)NR4R6; R2 представляет собой водород или C1-6алкил, необязательно замещенный одним или несколькими заместителями, выбираемыми из галогена, OH, OC1-6алкила, OC3-7циклоалкила; R3 представляет собой водород или галоген, предпочтительно водород; R4 представляет собой водород; и R6 выбирают из C9-16алкила, C9-16алкенила, (C6-10арил)-C7-11алкила и (C6-10арил)-C7-11алкенила, где арил необязательно замещен одним или несколькими заместителями, указанными ниже в настоящем описании.
Более предпочтительно, соединения в соответствии с настоящим изобретением являются такими, у которых в формуле (1) R1 представляет собой -(CH2)nN(R4)C(О)R5 при n равном 0; R2 представляет собой водород или метил; R3 представляет собой водород; R4 представляет собой водород; и R5 выбирают из C8-15алкила, C8-15алкенила (где алкенил содержит 1, 2 или 3 двойные связи), (C6-10арил)-C6-10алкила и (C6-10арил)-C6-10алкенила (где алкенил содержит 1 или 2 двойные связи).
Еще предпочтительно, соединения в соответствии с настоящим изобретением являются такими, у которых в формуле (1) R1 представляет собой -C(О)NR4R6; R2 представляет собой водород или метил; R3 представляет собой водород; R4 представляет собой водород; и R6 выбирают из C9-16алкила, C9-16алкенила (где алкенил содержит 1, 2 или 3 двойные связи), (C6-10арил)-C7-11алкила и (C6-10арил)-C7-11алкенила (где алкенил содержит 1 или 2 двойные связи).
Более предпочтительно, соединения в соответствии с настоящим изобретением являются такими, у которых в формуле (1) R1 представляет собой -(CH2)nN(R4)C(О)R5 при n равном 0; R2 представляет собой водород или метил; R3 представляет собой водород; R4 представляет собой водород; и R5 выбирают из C8-12алкила, C8-12алкенила (где алкенил содержит 2 двойные связи), (C6-10арил)-C6-8алкила и (C6-10арил)-C6-8алкенила (где алкенил содержит 2 двойные связи).
В особенно предпочтительном варианте осуществления настоящего изобретения соединение, в соответствии с формулой (1) содержит R1, представляющий собой -(CH2)nN(R4)C(О)R5 при n равном 0, R2, представляющий собой водород или метил, и R3, представляющий собой водород. В определении R1 настоящего описания, R4 представляет собой водород и R5 выбирают из C8-12алкила, C8-12алкенила, содержащего (2E,4E)-диеновый фрагмент в качестве ненасыщенного, (C6-10арил)-C6-8алкил и (C6-10арил)-C6-8алкенил, содержащий (2E,4E)-диеновый фрагмент в качестве ненасыщенного в его алкенильной группе.
Также предпочтительно, соединения в соответствии с настоящим изобретением являются такими, у которых в формуле (1) R1 представляет собой -C(О)NR4R6; R2 представляет собой водород или метил; R3 представляет собой водород; R4 представляет собой водород; и R6 выбирают из C9-13алкила, C9-13алкенила (где алкенил содержит 2 двойные связи), (C6-10арил)-C7-9алкила и (C6-10арил)-C7-9алкенила (где алкенил содержит 2 двойные связи).
В другом особенно предпочтительном варианте осуществления настоящего изобретения соединение в соответствии с формулой (1) содержит R1, представляющий собой -C(О)NR4R6, R2, представляющий собой водород или метил, и R3, представляющий собой водород. В определении R1 настоящего описания, R4 представляет собой водород и R6 выбирают из C9-13алкила, C9-13алкенила, содержащего (2E,4E)-диеновый фрагмент в качестве ненасыщенного, (C6-10арил)-C7-9алкила и (C6-10арил)-C7-9алкенила, содержащего (2E,4E)-диеновый фрагмент в качестве ненасыщенного в его алкенильной группе.
Более того, настоящее изобретение относится к применению этих соединений в качестве медицинского препарата, предпочтительно дерматологического средства, и в качестве косметического средства. Соединения эффективны при лечении и/или профилактике воспаления, раздражения, чесотки, зуда, боли, отечности и/или предаллергических или аллергических состояний, особенно на коже и слизистой оболочке млекопитающих. Кроме того, патологические состояния распространяются на рост волос (например, формы алопеции, алопеции зачатков волос) и на нарушения деятельности сальной железы (например, акне, себорея), на доброкачественные и злокачественные кожные опухоли, гиперпролиферативные кожные заболевания (например, псориаз), чрезмерный рост волос (например, гирсутизм), различные формы дерматита, состояния сухой кожи и системную склеродермию (склеродермию).
Подробное описание изобретения
В соответствии с настоящим изобретением заявителем получены новые 1,3-бензоксазол-2(3H)-оны, определенные в формуле (1), и неожиданно обнаружено, что эти соединения можно эффективно использовать в качестве медицинского препарата, предпочтительно в качестве дерматологического средства и в качестве косметического средства благодаря их липофильной природе. Патологические состояния и заболевания, подлежащие лечению, в частности, представляют собой воспаление, чесотку, зуд, раздражение, боль, отечность и/или предаллергические или аллергические состояния. Соединения, как выяснилось, эффективны не только для лечения, но и для профилактики вышеуказанных патологических состояний. Патологические состояния также включают воспалительные реакции и раздражение кожи и слизистой оболочки млекопитающих, предпочтительно человека, например, вызванные стрессом от влияния факторов среды и такими воздействиями, как УФ-излучение, токсичные вещества и аллергены в общем смысле. Таким образом, соединения показали эффективность в уменьшении нескольких видов дискомфорта кожи и слизистой оболочки, как указано выше. В частности, они показали проявление анальгетических и противозудных свойств.
Не имея намерения установить взаимосвязь с каким либо теоретическим положением, заявитель считает, что причина активности l,3-бензоксазол-2(3H)-онов по настоящему изобретению основана на их действии в качестве модуляторов эндоканнабиноидной системы. В связи с этим известно, что эндоканнабиноиды, N-арахидоноилэтаноламид (анандамид, AEA) и 2-арахидоноилглицерин (2-AG), связываются с сопряженными с G-белком CB1 и CB2 каннабиноидными рецепторами. Рецептор CB1 главным образом (но не единственно возможным) экспрессируется в нейронах, рецептор CB2 преимущественно представлен в иммуноцитах, таких как моноциты (спленоциты), макрофаги, B-клетки, но также и в астроглиальных клетках. В коже CB рецепторы, в частности, рецептор CB2, экспрессируются в кератиноцитах и фибробластах. На фоне активации CB рецептора эндоканнабиноиды более активно транспортируются через клеточную мембрану и расщепляются. Метаболические ферменты, гидролаза амида жирной кислоты (FAAH) и липаза моноацилглицерина (MAGL) являются ответственными за гидролиз AEA и 2-AG, соответственно, приводя, таким образом, к инактивации этих сигнальных молекул. Хотя продемонстрирована активация CB1 рецептора, опосредующая явные нейрофизиологические эффекты, модуляция CB2 рецептора как посредством агонистов, так и обратных агонистов, как известно, препятствует различным воспалительным процессам. Активация CB2 рецептора может привести к противовоспалительным эффектам in vivo, и модуляция CB2 рецептора вовлечена в патофизиологию ряда заболеваний, включая хроническую боль, воспаление желудочно-кишечного тракта, остеопороз и болезни печени. Растения используют структурно аналогичные липидные сигнальные молекулы, как и у животных, в процессах передачи клеточной информации, включая подобные эндоканнабиноидам жирнокислотные производные. Поскольку растения обычно не синтезируют арахидоновую кислоту, в растениях продуцируются различные N-ацилэтаноламины, такие как, например, N-пальмитоилэтаноламид, и эти липиды, как также было показано, действуют на белки, которые непосредственно или опосредованно связаны с эндоканнабиноидной системой (ECS) у животных и человека, такие как FAAH, транзиторного рецепторного потенциала ванилоидный рецептор (TRPV1) или недавно постулированный каннабиноидный рецептор GPR55.
Таким образом, в соответствии с настоящим изобретением было обнаружено, что 1,3-бензоксазол-2(3H)-оны формулы (1) демонстрируют существенное функциональное подавляющее воздействие на ECS, что дает основание сделать вывод об их фармакологической активности. В частности, заявленные 1,3-бензоксазол-2(3H)-оны ингибируют обратный захват FAAH или AEA. В дополнение к этому, некоторые соединения по изобретению ингибируют FAAH, вдобавок к обратному захвату AEA. Иными словами, эти соединения ингибируют обратный захват AEA или активность FAAH, или оба эти процесса без воздействия на рецепторы CB1 и CB2.
Если в данном документе не описано иначе, то используемые термины для определения/описания в формуле (1) соответствующих групп R (т.e. R1-R6), включая их заместители, если вообще таковые присутствуют в соответствии с настоящим изобретением, имеют значение, описанное ниже:
Алкил представляет собой алкил с прямой или разветвленной цепью, имеющий 1, 2, 3, 4, 5 или 6 атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил или гексил.
Алкенил представляет собой алкил с прямой или разветвленной цепью, имеющий 2, 3, 4, 5 или 6 атомов углерода и одну-три двойные связи, предпочтительно одну или две двойные связи, наиболее предпочтительно одну двойную связь.
Предпочтительными примерами C2-6алкенильной группы являются этенил, проп-1-енил, проп-2-енил, изопроп-1-енил, н-бут-1-енил, н-бут-2-енил, н-бут-3-енил, изобут-1-енил, изобут-2-енил, н-пент-1-енил, н-пент-2-енил, н-пент-3-енил, н-пент-4-енил, н-пент-1,3-енил, изопент-1-енил, изопент-2-енил, неопент-1-енил, н-гекс-1-енил, н-гекс-2-енил, н-гекс-3-енил, н-гекс-4-енил, н-гекс-5-енил, н-гекс-1,3-енил, н-гекс-2,4-енил, н-гекс-3,5-енил и н-гекс-1,3,5-енил. Более предпочтительными примерами C2-6алкенильной группы являются этенил и проп-1-енил.
Алкинил представляет собой алкил с прямой или разветвленной цепью, имеющий 2, 3, 4, 5 или 6 атомов углерода и одну-три тройные связи, предпочтительно одну или две тройные связи, наиболее предпочтительно одну тройную связь. Предпочтительными примерами C2-6алкинильной группы являются этинил, проп-1-инил, проп-2-инил, н-бут-1-инил, н-бут-2-инил, н-бут-3-инил, н-пент-1-инил, н-пент-2-инил, н-пент-3-инил, н-пент-4-инил, н-пент-1,3-инил, изопент-1-инил, неопент-1-инил, н-гекс-1-инил, н-гекс-2-инил, н-гекс-3-инил, н-гекс-4-инил, н-гекс-5-инил, н-гекс-1,3-инил, н-гекс-2,4-инил, н-гекс-3,5-инил и н-гекс-1,3,5-инил. Более предпочтительными примерами C2-6алкинильной группы являются этинил и проп-1-инил.
Циклоалкил представляет собой алкильное кольцо, имеющее 3, 4, 5, 6 или 7 атомов углерода, в большинстве случаев такое, как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил, более предпочтительно 3, 4, 5 или 6 атомов углерода.
Кольца представляют собой насыщенные или (моно-)-полиненасыщенные углеродные кольцевые системы, которые могут включать один или несколько гетероатомов, таких как O, N, S и/или P. Предпочтительными являются 5- или 6-членные кольца. Кольца, в частности, включают арильное и гетероарильное кольца, которые могут быть конденсированными ароматическими кольцами.
Арил представляет собой ароматический фрагмент, имеющий 6-20 атомов углерода, предпочтительно 6-10 атомов углерода, и включающий конденсированные ароматические кольца. Наиболее предпочтительным является фенил.
Гетероарил представляет собой ароматический фрагмент, имеющий 1, 2, 3, 4, 5, 6, 7, 8 или 9 углеродных атомов и по меньшей мере один гетероатом, выбранный из O, N и/или S. Предпочтительно, гетероарил включает самое большее 10 кольцевых атомов (включая углерод и гетероатомы) и предпочтительно выбран из тиенила, пирролила, имидазолила, пиразолила, пиридила, пиразинила, пиримидинила, пиридазинила, тиазолила, оксазолила, изотиазолила, изооксазолила, фуранила, оксадиазолила, тиадиазолила, тетразолила и индазолила, более предпочтительно из тиенила, фуранила, имидазолила, пиридила, тиазолила, оксазолила, оксадиазолила, тиадиазолила, тетразолила и пиримидинила.
Гетероциклил представляет собой насыщенное или ненасыщенное кольцо, содержащее по меньшей мере один гетероатом, выбранный из O, N и/или S, и 1, 2, 3, 4, 5, 6 или 7 углеродных атомов. Предпочтительно, гетероциклил включает самое большее 11 кольцевых атомов (включая углерод и гетероатомы) и более предпочтительно представляет собой 4-8-членное кольцо, и еще более предпочтительно выбранное из тетрагидрофуранила, азетидинила, пирролидинила, пиперидинила, пиранила, морфолинила, тиазолинила, диоксанила, диоксоланила и тиоморфолинила, более предпочтительно из пиперидинила, тиазолинила, диоксанила, диоксоланила и пирролидинила.
Галоген представляет собой атом галогена, выбранный из F, Cl, Br и I, предпочтительно из F, Cl и Br.
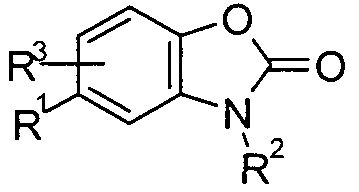
Соединения по настоящему изобретению содержат l,3-бензоксазол-2(3H)-оновую основную структуру, представленную нижеследующей формулой (1).

формула (1)
В соединениях в соответствии с формулой (1), для обязательного достижения в будущем модулирующей/целедостигающей активности в отношении эндоканнабиноидной системы, большое значение придается конкретному определению остатка R’, а именно, представляющего собой либо -(CH2)nN(R4)C(О)R5 (n равно 0, 1 или 2, предпочтительно 0 или 1, более предпочтительно 0) или -C(О)NR4R6.
Для обоих вышеприведенных определений R1 и, более того, независимо одного от другого, нижеследующие определения R2-R6 применяются в соответствии с настоящим изобретением:
R2 выбирают из группы, состоящей из водорода; -C1-6алкила, такого как метил, этил, н- или изопропил, н- или изобутил, н- или изопентил, н- или изо-гексил, каждого, необязательно замещенного одним или несколькими заместителями, выбираемыми из галогена, OH, OC1-6алкила, -OC3-7циклоалкила; -C3-7циклоалкила, необязательно замещенного одним или несколькими заместителями, выбираемыми из галогена, OH, OC1-6алкила, OC3-7циклоалкила; -(C3-7циклоалкил)-C1-6-алкила, необязательно замещенного одним или несколькими заместителями, выбираемыми из галогена, OH, OC1-6алкила, OC3-7циклоалкила. Предпочтительно, R2 представляет собой водород или C1-6алкил, необязательно замещенный одним или несколькими заместителями, выбираемыми из галогена, OH, OC1-6алкила, OC3-7циклоалкила. Более предпочтительно, R2 представляет собой водород или метил, в частности водород.
R3 выбирают из группы, состоящей из водорода, галогена, гидрокси, метокси или -CN. Предпочтительно R3 представляет собой водород или галоген, более предпочтительно водород. Соединения в соответствии с формулой (1) содержат три группы R3, которые могут быть одинаковыми или различными. Наиболее предпочтительно все они представляют собой водород.
R4 выбирают из группы, состоящей из водорода или C1-6-алкила, такого как метил, этил, н- или изопропил, н- или изобутил, н- или изопентил, н- или изогексил. Предпочтительно R4 представляет собой водород или метил, более предпочтительно водород.
R5 выбирают из группы, состоящей из C8-15алкила, C8-15алкенила, C8-15алкинила, (C6-10арил)-C6-10алкила, (C6-10арил)-C6-10алкенила и (C6-10арил)-C6-10алкинила. Во всех этих арилсодержащих группах арил может быть замещен одним или несколькими заместителями, указанными ниже в настоящем описании. Предпочтительно R5 выбирают из C8-15алкила, C8-15алкенила, (C6-10арил)-C6-10алкила и (C6-10арил)-C6-10алкенила. Более предпочтительно, R5 выбирают из C8-15алкила, C8-15алкенила (где алкенил содержит 1, 2 или 3, предпочтительно 2 двойные связи), (C6-10арил)-C6-10алкила и (C6-10арил)-C6-10алкенила (где алкенил содержит 1 или 2, предпочтительно 2 двойные связи). Наиболее предпочтительно, R5 выбирают из C8-12алкила, C8-12алкенила, содержащего (2E,4E)-диеновый фрагмент в качестве ненасыщенного, (C6-10арил)-C6-8алкила и (C6-10арил)-C6-8алкенила, содержащего (2E,4E)-диеновый фрагмент в качестве ненасыщенного в его алкенильной группе.
R6 выбирают из группы, состоящей из C9-16алкила, C9-16алкенила, C9-16алкинила, (C6-10арил)-C7-11алкила, (C6-10арил)-C7-11алкенила и (C6-10арил)-C7-11алкинила. Во всех этих арилсодержащих группах арил может быть замещен одним или несколькими заместителями, указанными ниже в настоящем описании. Предпочтительно, R6 выбирают из C9-16алкила, C9-16алкенила, (C6-10арил)-C7-11алкила и (C6-10арил)-C7-11алкенила. Более предпочтительно, R6 выбирают из C9-16алкила, C9-16алкенила (где алкенил содержит 1, 2 или 3, предпочтительно 2 двойные связи), (C6-10арил)-C7-11алкила и (C6-10арил)-C7-11алкенила (где алкенил содержит 1 или 2, предпочтительно 2 двойные связи). Наиболее предпочтительно, R6 выбирают из C9-13алкенила, содержащего (2E,4E)-диеновый фрагмент в качестве ненасыщенного, (C6-10арил)-C7-9алкила и (C6-10арил)-C7-9алкенила, содержащего (2E,4E)-диеновый фрагмент в качестве ненасыщенного в его алкенильной группе.
В частности, в случае, когда R1 представляет собой -(CH2)nN(R4)C(О)R5 при n=0, R5 не может быть прямоцепочечным C11 с (2E,4E)-диеновым фрагментом.
Аналогично, в случае, когда R1 представляет собой -C(О)NR4R6, как определено в настоящем документе, R6 не может содержать (2E,4Е)-диеновый фрагмент, или R6 не может содержать прямоцепочечной додека-(2E,4E)-диеновый, арил-гекса-(2E,4Е)-диеновый, арил-гепта-(2E,4E)-диеновый и/или арил-окта-(2E,4E)-диеновый фрагмент.
Все возможные комбинации определений R1-R6 в формуле (1), включенных в вышеприведенные списки, следует понимать как раскрытые явно и однозначно в соответствии с настоящим изобретением.
Как правило, заместители в углеродных цепях и кольцах в соответствии с изобретением представляют собой галогены, предпочтительно F, Cl, Br и I, C1-10алкил, C1-10алкокси, C6-20арил, гидроксил, -SH, -SO3H, аминогруппы, -COOH, COOR’, где R’ представляет собой C1-10алкил или атом щелочного металла, CONHR” и CON(R”)2, где R” представляет собой C1-10алкил. Как правило, особенно предпочтительные алкильные группы и алкоксигруппы, используемые в качестве заместителей в соответствии с настоящим изобретением, как описано в данном документе, представляют собой C1-6алкильную группу и C1-6алкоксигруппу, более предпочтительно метил, этил, н-пропил, изопропил, н-бутил, изобутил, н-пентил, изопентил, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, н-пентокси, изопентокси. Аналогично, особенно предпочтительные арильные группы представляют собой C6-10арильные группы, наиболее предпочтительно фенил. Подходящие заместители также выбирают из алкенила, алкинила, циклоалкила, гетероарила, гетероциклила, как определено в данном документе.
В особенно предпочтительных вариантах осуществления настоящего изобретения соединения соответствуют нижеследующей формуле (2):
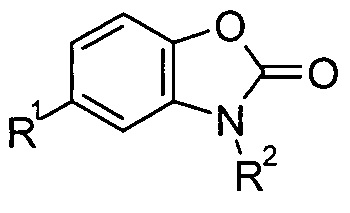
формула (2)
В формуле (2) R2 представляет собой предпочтительно либо водород, либо метил, более предпочтительно водород. Кроме того, R1 является таким, как определено выше.
В соответствии с настоящим изобретением в соединениях формул (1) и/или (2), R1 также может быть выбран из группы, состоящей из нижеследующих радикалов (которые могут быть замещены замещающими группами, как определено в данном документе):


Соединения структурной формулы (1) эффективны в качестве модуляторов эндоканнабиноидной системы и особенно эффективны в качестве ингибиторов AEAT (AEA транспорта) или FAAH. Они являются пригодными для лечения и/или профилактики нарушений, восприимчивых к ингибированию AEAT или FAAH, таких как воспаление, раздражение, чесотка, зуд, боль, отечность и/или предаллергические, аллергические состояния и другие заболевания, в частности, с вовлечением AEAT или FAAH в патологический процесс.
Оптические изомеры - Диастереомеры - Геометрические изомеры - Таутомеры
Соединения структурной формулы (1) и/или (2) содержат один или несколько асимметрических центров и могут существовать в виде рацематов и рацемических смесей, индивидуальных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Подразумевается, что настоящее изобретение охватывает все такие изомерные формы соединений структурной формулы (1) и/или (2).
Соединения структурной формулы (1) и/или (2) могут быть разделены на их индивидуальные диастереомеры посредством, например, фракционной кристаллизации из подходящего растворителя, например, метанола или этилацетата, или из их смеси, или посредством хиральной хроматографии с использованием оптически активной стационарной фазы. Абсолютная стереохимия может быть определена методом рентгеновской кристаллографии кристаллических продуктов или кристаллических промежуточных веществ, для которых при необходимости получают производные с реагентом, содержащим асимметрический центр с известной абсолютной конфигурацией.
Альтернативно, любой стереоизомер соединения общей формулы (1) и/или (2) может быть получен путем стереоспецифического синтеза с использованием оптически чистых исходных веществ или реагентов с известной абсолютной конфигурацией.
Соли
Соединения в соответствии с изобретением могут быть представлены в форме фармацевтически приемлемых солей. Термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические или органические основания и неорганические или органические кислоты. Соли, полученные из неорганических оснований, включают соли алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, трехвалентного марганца, двухвалентного марганца, калия, натрия, цинка и т.п. Особенно предпочтительными являются соли аммония, кальция, лития, магния, калия и натрия. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, такие как аргинин, бетаин, кофеин, холин, N,N’-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т.п.
Если соединения по настоящему изобретению являются основными, то соли могут быть получены из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Такие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, муравьиную, фумаровую, глюконовую, глутаминовую, бромистоводородную, хлористоводородную, изэтионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, малоновую, муциновую, азотную, памоевую, пантотеновую, фосфорную, пропионовую, янтарную, серную, виноградную, п-толуолсульфоновую, трифторуксусную кислоту и т.п. Особенно предпочтительными являются лимонная, фумаровая, бромистоводородная, хлористоводородная, малеиновая, фосфорная, серная и виноградная кислоты.
Введение, диапазоны доз и готовая лекарственная форма
Соединения по изобретению включают в фармацевтические или косметические препараты путем смешивания их с фармацевтически или косметически приемлемым носителем или эксципиентом. Подходящие носители известны специалисту в данной области техники. Предпочтительно композиция представляет собой дерматологическую композицию, подходящую для местного применения на коже или слизистой оболочке млекопитающих. Форма композиции конкретно не ограничивается, однако предпочтительными формами являются эмульсии, суспензии и растворы. В некоторых вариантах осуществления изобретения композиции представляют собой формы лосьонов, кремов, гелей, растворов, распыляемых растворов, очищающих средств, порошков, мазей, восков, помад, мыл, шампуней, водно-спиртовых растворов, суспензий, пенок, скрабов, пропитанных прокладок, средств ухода за кожей или волосами.
Композиции в соответствии с изобретением, в то же время, можно применять любым другим способом, известным специалисту в данной области техники, таким как пероральный или парентеральный. Примеры, не ограничивающие выбор, представляют собой сублингвальный, вагинальный, ректальный, внутривенный, назальный, внутримышечный, ингаляционный, глазной и чрескожный. Подходящие носители и эксципиенты общеизвестны для специалиста в данной области техники.
Композиции в соответствии с настоящим изобретением могут содержать соединения 1,3-бензоксазол-2(3H)-она в количествах 0,001-40% масс. от массы композиции, предпочтительно 0,01-5% масс., более предпочтительно 0,1-2% масс. и наиболее предпочтительно 0,5-1,5% масс.
Композиции в соответствии с настоящим изобретением могут содержать косметически и фармацевтически/дерматологически приемлемые вспомогательные вещества, обычно используемые в косметических и фармацевтических препаратах и известные специалисту в данной области техники. Таковые включают, например, консервирующие вещества, бактерицидные вещества, ароматизирующие вещества, загустители, эмульгаторы, поверхностно-активные вещества, размягчающие вещества, увлажняющие вещества, масла, жиры, воски, органические растворители, воду, спирты, полиолы, полимеры, стабилизирующие пенообразование вещества, препятствующие вспениванию вещества, способствующие проникновению вещества или другие общепринятые компоненты фармацевтических или косметических препаратов.
Получение соединений по изобретению
Соединения формулы (1) и/или (2), если они находятся в виде диастереомерной смеси, могут быть разделены на диастереомерные пары энантиомеров путем фракционной кристаллизации из подходящего растворителя, такого как метанол, этилацетат или их смесь. Пара энантиомеров, полученная таким образом, может быть разделена на индивидуальные стереоизомеры обычным способом с использованием оптически активной кислоты в качестве разделяющего агента. Альтернативно, любой энантиомер соединения формулы (1) и/или (2) может быть получен путем стереоспецифического синтеза с использованием оптически чистых исходных веществ или реагентов с известной конфигурацией.
Соединения формулы (1) и/или (2) по настоящему изобретению могут быть получены в соответствии с методами по нижеприведенным схемам и примерам, с использованием соответствующих веществ, и они дополнительно поясняются нижеприведенными конкретными примерами. Кроме того, посредством использования методов, описанных в данном документе, в сочетании с обычными познаниями специалиста в данной области техники, могут быть легко получены дополнительные соединения по настоящему изобретению, заявленные в формуле изобретения данного документа. Проиллюстрированные в примерах соединения, однако, не следует истолковывать как образующие только тот тип соединений, который рассматривается в качестве изобретения. Примеры дополнительно иллюстрируют подробности получения соединений по настоящему изобретению. Специалист в данной области техники легко поймет, что известные вариации условий и процессов нижеследующих препаративных методов могут быть использованы для получения этих соединений. Соединения, содержащие основные или кислотные группы, могут быть далее преобразованы в форму их фармацевтически приемлемых солей, таких как описано ранее. Все температуры приведены в градусах Цельсия.
На схемах, в составах препаратов и примерах, приведенных ниже, различные символы реагентов и сокращения имеют следующие значения:
|
Схема реакций 1:
Синтез этил (2E,4Е)-2,4-диеноатов и соответствующих кислот с использованием реакции Виттига-Хорнера

Исходные вещества для синтеза соединений по настоящему изобретению, необязательно замещенные этил (2E,4Е)-2,4-диеноаты, могут быть получены путем взаимодействия необязательно замещенного (2E)-2-еналя с триалкилфосфоноацетатом в присутствии основания, такого как гидрид натрия или бутиллитий, в инертном растворителе, подобном тетрагидрофурану, при подходящей температуре. Последующее омыление под действием основания, такого как гидроксид натрия, в растворителе, подобном смеси воды и метанола, при подходящей температуре приводит к соответствующей (2E,4E)-2,4-диеновой кислоте.
Схема реакций 2:
Альтернативный синтез (2E,4E)-2,4-диеновых кислот
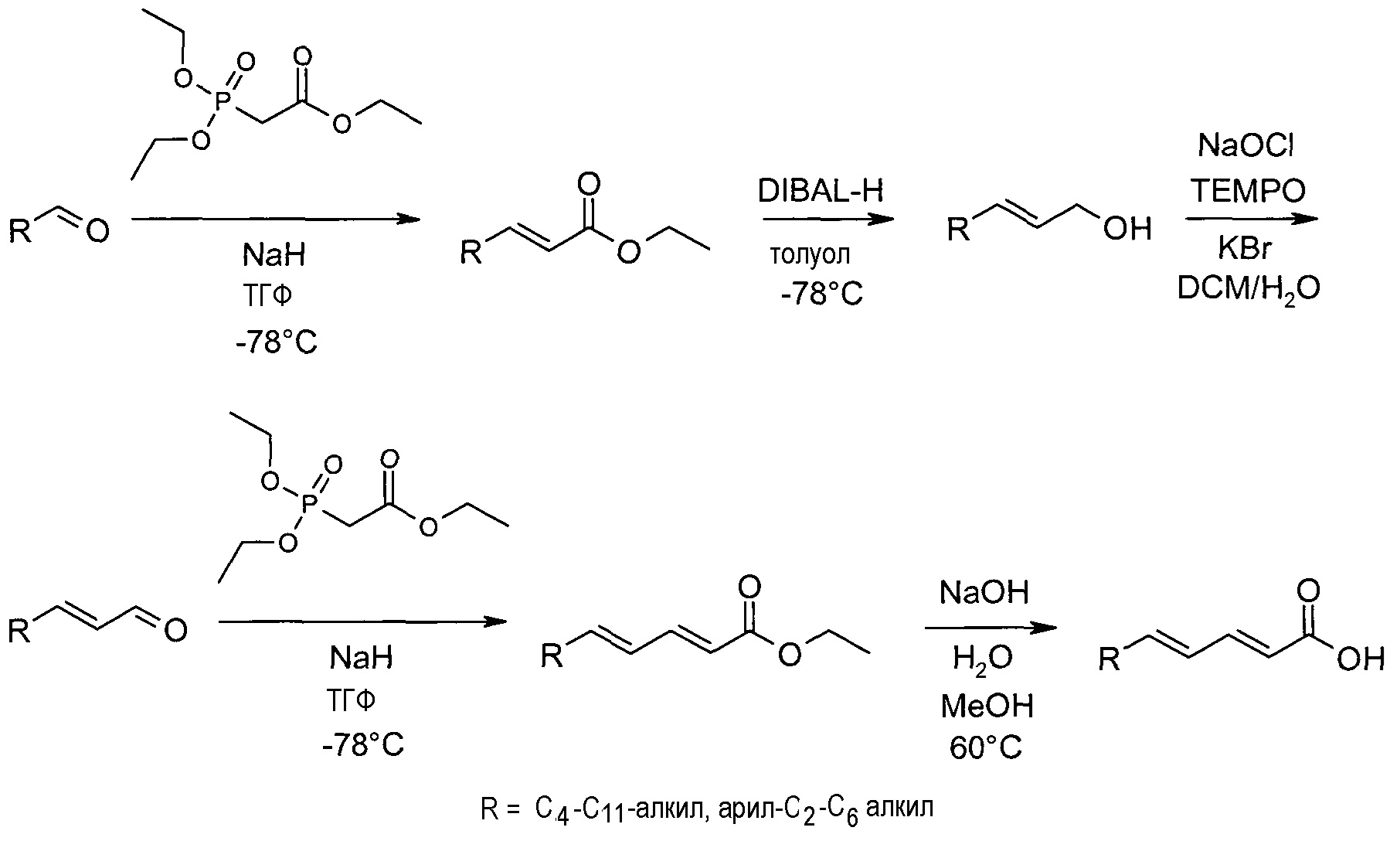
Как показано на схеме реакций 2, исходные вещества для синтеза соединений по настоящему изобретению, необязательно замещенные этил (2E,4Е)-2,4-диеноаты и (2E,4E)-2,4-диеновые кислоты, также могут быть получены исходя из необязательно замещенных насыщенных альдегидов. В этом случае две двойные связи стереоизомеров транс конфигурации вводят, применяя две реакции Виттига-Хорнера, α,β-Ненасыщенный сложный эфир получают по реакции альдегида с триалкилфосфоноацетатом в инертном растворителе, подобном тетрагидрофурану, в присутствии основания, такого как гидрид натрия или бутиллитий, при низкой температуре. Восстановление при действии DIBAL-H в подходящем растворителе, подобном толуолу, при -78°C позволяет получить соответствующий аллиловый спирт, который затем окисляют гипохлоритом натрия и TEMPO в присутствии бромида калия в подходящем растворителе, таком как смесь воды и дихлорметана, до α,β-ненасыщенного альдегида. Альтернативно, спирт может быть окислен путем применения окисления по Сверну с использованием оксалилхлорида и ДМСО в подходящем растворителе, подобном DCM, в присутствии основания, такого как триэтиламин, при -78°C. Альдегид подвергают второй реакции Виттига-Хорнера с применением описанных выше условий, получая этил (2E,4E)-2,4-диеноат. Наконец, (2E,4E)-2,4-диеновую кислоту получают путем гидролиза сложного эфира в присутствии основания, такого как водный гидроксид натрия в метаноле, при повышенной температуре.
Схема реакции 3:
Восстановление сложных эфиров (2E,4E)-2,4-диеновой кислоты
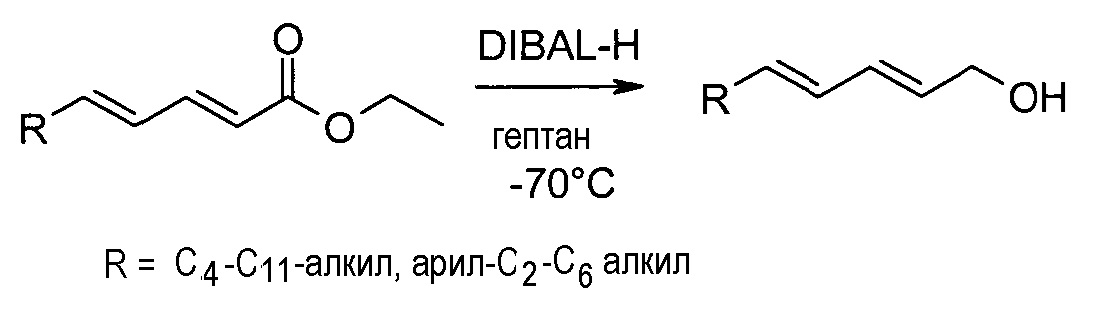
Необязательно замещенный сложный эфир (2E,4E)-2,4-диеновой кислоты может быть восстановлен до соответствующего спирта путем реакции с восстанавливающим реагентом, таким как DIBAL-H, в инертном растворителе, подобном гептану, при подходящей температуре, как описано на схеме реакции 3.
Схема реакции 4:
Синтез (2E,4Е)-2,4-диен-1-аминов

На схеме реакции 4 показано получение (2E,4E)-2,4-диен-1-аминов. Необязательно замещенный (2E,4Е)-2,4-диен-1-иловый спирт может взаимодействовать с реагентом, таким как дифенилфосфорилазид, в присутствии подходящего основания, подобного 1,8-диазабицикло[5.4.0]ундец-7-ену, в растворителе, таком как толуол, с получением соответствующего азида. Последующее восстановление с использованием восстанавливающего вещества, подобного алюмогидриду лития, в инертном растворителе, таком как диэтиловый эфир, при подходящей температуре позволяет получить целевое соединение.
Альтернативно, азид может быть восстановлен до соответствующего первичного амина по реакции Штаудингера путем взаимодействия с трифенилфосфином в подходящем растворителе, таком как смесь воды и ТГФ.
Схема реакций 5:
Синтез (2E,4E)-N-алкил-2,4-диен-1-аминов
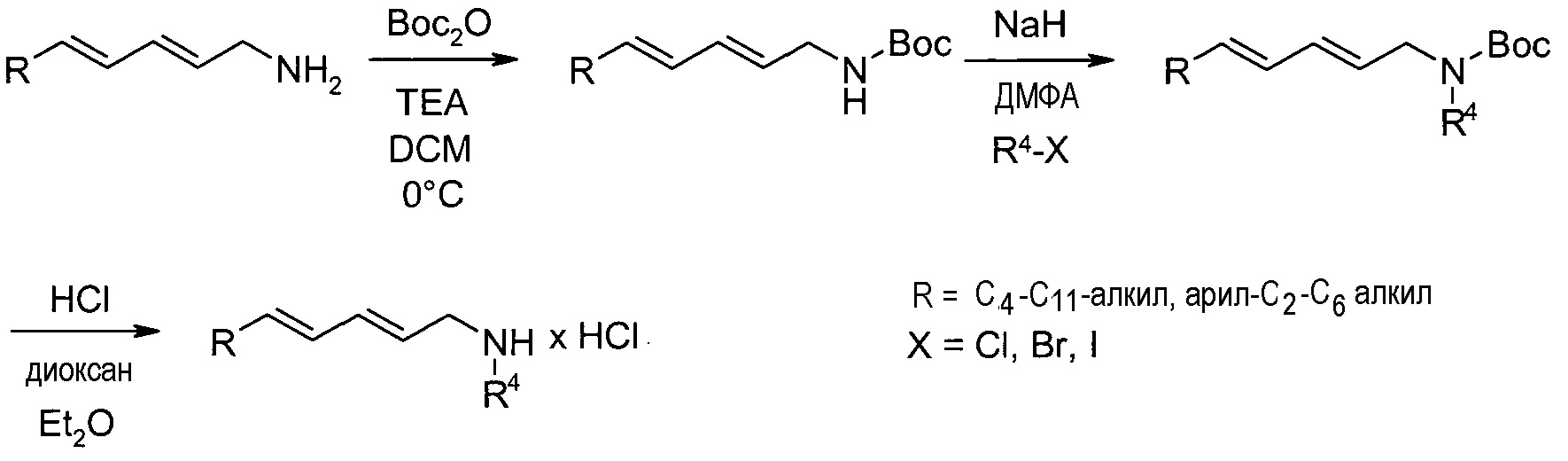
Необязательно замещенный (2E,4E)-2,4-диен-1-иламин может быть преобразован в соответствующий N-алкилированный амин, как показано на схеме реакций 5. Проводят реакцию с ди-трет-бутилдикарбонатом в присутствии основания, подобного триэтиламину, в подходящем растворителе, подобном DCM, за которой следует стадия алкилирования с участием алкилгалогенида, подобного метилйодиду, в растворителе, подобном ДМФА, в присутствии основания, такого как гидрид натрия. Алкилированный амин может быть депротонирован путем использования реагента, подобного HCl в диоксане, в подходящем растворителе, подобном диэтиловому эфиру. Продукт может быть выделен в виде гидрохлоридной соли или может быть выделено свободное основание.
Схема реакций 6:
Синтез амидов
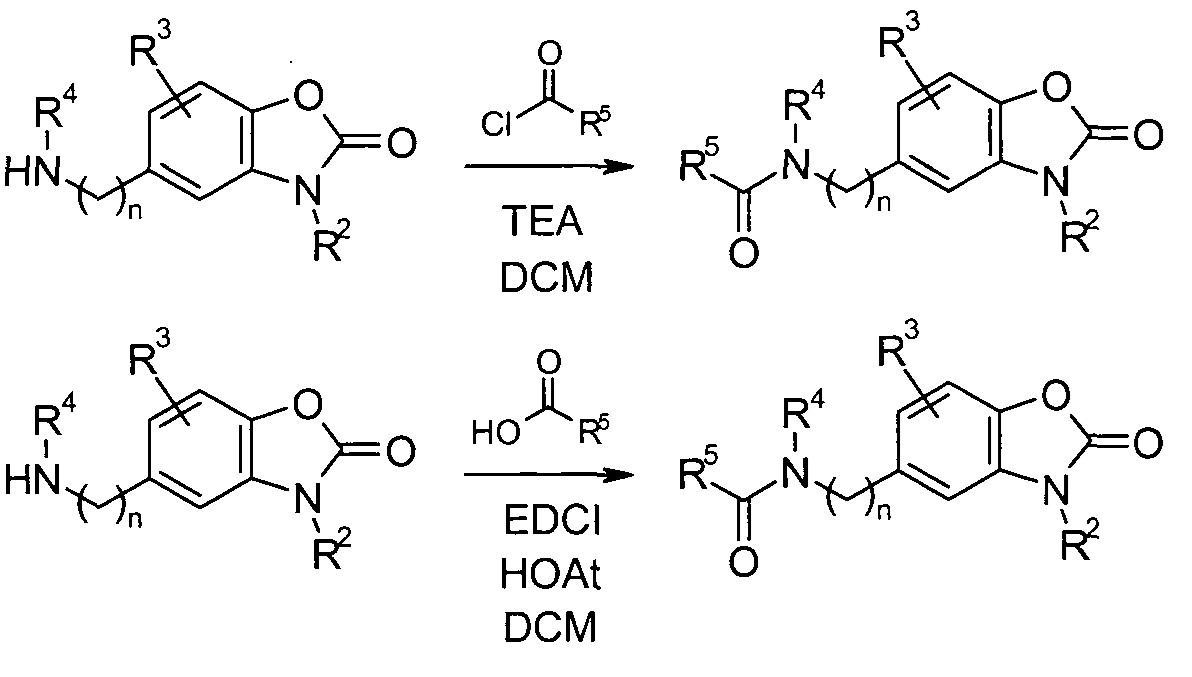
Могут быть использованы хлорангидриды из коммерчески доступных источников, или необязательно замещенная карбоновая кислота может быть подвергнута взаимодействию с оксалилхлоридом в инертном растворителе, таком как DCM, при подходящей температуре, обеспечивая возможность получения соответствующего хлорангидрида R5COCl. Необязательно замещенный хлорангидрид может быть подвергнут взаимодействию с необязательно замещенным 5-(омега-аминоалкил)-1,3-бензоксазол-2(3H)-оном в присутствии основания, такого как триэтиламин, в инертном растворителе, подобном дихлорметану, с получением соответствующего амида.
Альтернативно, синтез также можно осуществить путем взаимодействия соответствующей кислоты R5COOH с необязательно замещенным 5-(омега-аминоалкил)-1,3-бензоксазол-2(3H)-оном в растворителе, подобном DCM или ДМФА, в присутствии реагента, такого как HOAt и EDCI.
Схема реакций 7:
Синтез 2-оксо-2,3-дигидро-l,3-бензоксазол-5-карбоксамидов
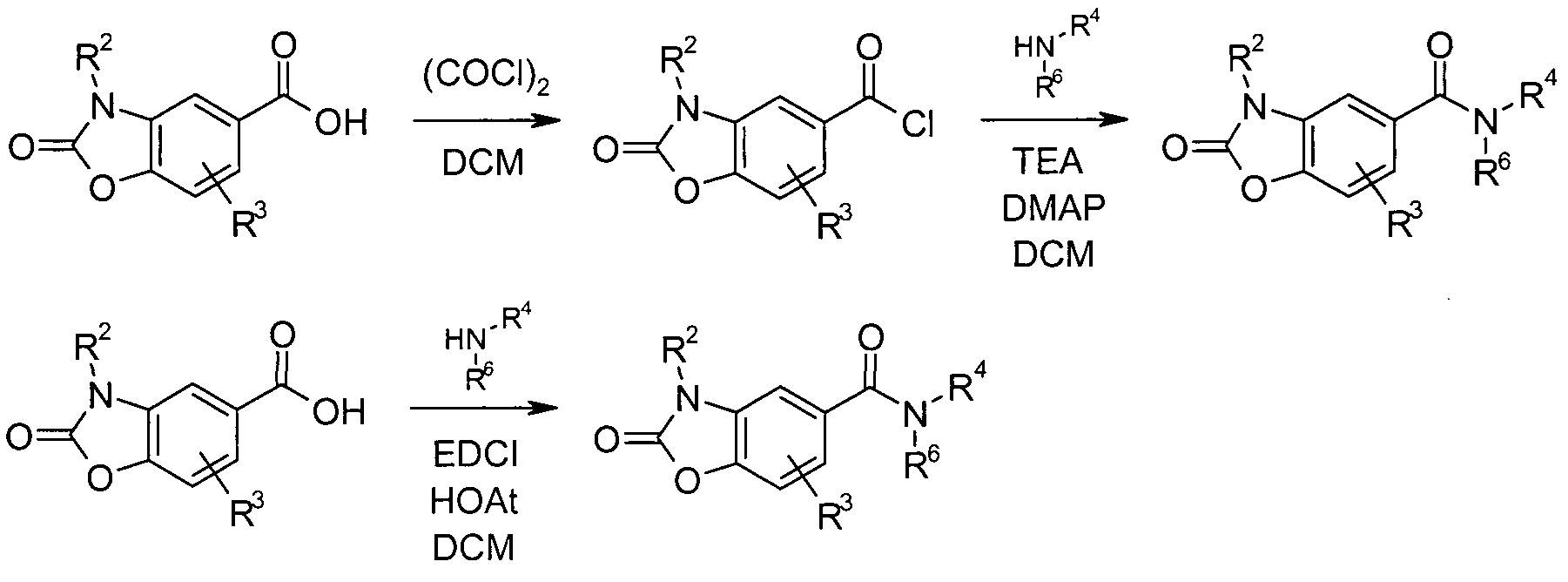
Необязательно замещенная 2-оксо-2,3-дигидро-1,3-бензоксазол-5-карбоновая кислота может быть преобразована в соответствующий хлорангидрид за счет реакции с реагентом, таким как оксалилхлорид или тионилхлорид, в подходящем растворителе, подобном DCM. Реакция с амином HNR4R6 в инертном растворителе, подобном DCM, дает целевой продукт. Реакция может быть проведена в присутствии или в отсутствие основания, такого как DMAP.
Альтернативно, синтез необязательно замещенных амидов 2-оксо-2,3-дигидро-1,3-бензоксазол-5-карбоновой кислоты также можно осуществить путем взаимодействия соответствующей кислоты с амином HNR4R6 в растворителе, подобном DCM или ДМФА, в присутствии реагента, такого как HOAt и EDCI.
Схема реакции 8:
N-алкилирование амида
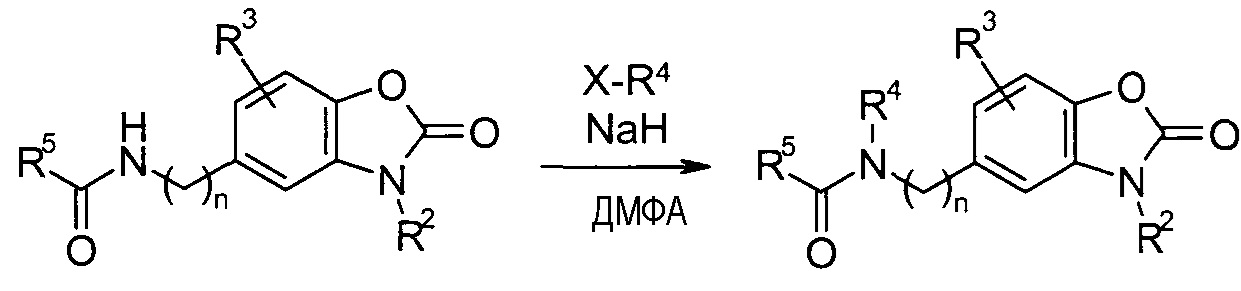
Заместители R4 при азотном атоме амида могут быть введены, как показано на схеме реакции 8. Амид депротонируют с помощью подходящего основания, такого как гидрид натрия, в подходящем растворителе, подобном ДМФА, и вслед за этим подвергают взаимодействию с реагентом X-R4, в котором X представляет собой уходящую группу, такую как галогенид.
Схема реакций 9:
Синтез замещенных 5-амино-1,3-бензоксазол-2(3H)-онов

Замещенные 5-амино-1,3-бензоксазол-2(3H)-оны могут быть получены, как указано на схеме реакций 9. Необязательно R3-замещенные 5-нитро-1,3-бензоксазол-2(3H)-оны депротонируют с помощью подходящего основания, такого как гидрид натрия, в подходящем растворителе, подобном ДМФА, при повышенной температуре и затем подвергают взаимодействию с реагентом X-R2, в котором X представляет собой уходящую группу, такую как галогенид. Нитрогруппу можно восстановить, например, применяя реагенты, подобные железу и хлориду аммония, в смеси воды и метанола при повышенной температуре, получая целевые соединения.
Аналитическая жидкостная хроматография с масс-спектрометрией (ЖХ-МС)
Обобщенные сведения об аналитических условиях:
Agilent 1100 с ELSD (PL-ELS 2100) и диодно-матричный детектор с УФ-детектированием в диапазоне между 220 и 320 нм и масс-селективный детектор (MSD), методы ионизации электрораспылением ESI+ и ESI- (диапазон масс: m/z=100-800),
Колонка: Waters Xbridge C18, 3,5 мкм, 2,1 мм × 50 мм;
Скорость подвижной фазы 0,8 мл/мин; температура колонки: 30°C;
Подвижная фаза A: ацетонитрил (0,1% HCOOH)
Подвижная фаза B: вода (0,1% HCOOH)
или
Agilent 1200 с диодно-матричным детектором с УФ-детектированием в диапазоне между 220 и 320 нм и масс-селективным детектором (MSD), методы ионизации электрораспылением ESI+ и ESI- (диапазон масс: m/z=100-800),
Колонка: Waters Xbridge C18, 3,5 мкм, 2,1 мм × 50 мм;
Скорость подвижной фазы 0,8 мл/мин; температура колонки: 30°C;
Подвижная фаза A: ацетонитрил (0,1% HCOOH)
Подвижная фаза B: вода (0,1% HCOOH)
Градиент A:
линейный градиент от 2% до 98% ацетонитрила в воде (0,1% HCOOH)
0,0 мин 2% A
3,5 мин 98% A
6,0 мин 98% A
Agilent 1100 с ELSD (PL-ELS 2100) и диодно-матричный детектор (Agilent G1315B) с УФ-детектированием в диапазоне между 220 и 320 нм, и масс-селективный детектор (MSD, Agilent LC/MSD G6130B), методы ионизации электрораспылением ESI+ и ESI- (диапазон масс: m/z=100-800),
Колонка: Waters Xbridge C18, 3,5 мкм, 2,1 мм × 50 мм;
Скорость подвижной фазы 0,8 мл/мин; температура колонки: 30°C;
Подвижная фаза A: 95% ацетонитрила + 5% 10 мМ бикарбоната аммония в воде
Подвижная фаза B: 10 мМ бикарбонат аммония в воде (pH 9,5)
Градиент B:
линейный градиент от 2% до 98% смеси 95% ацетонитрила + 5% 10 мМ бикарбоната аммония в воде
0,0 мин 2% A
3,5 мин 98% A
6,0 мин 98% A
Колонка: Waters Xselect C18, 3,5 мкм, 2,1 мм × 50 мм;
Скорость подвижной фазы 0,8 мл/мин; температура колонки: 25°C;
Подвижная фаза A: 95% ацетонитрила + 5% 10 мМ бикарбоната аммония в воде
Подвижная фаза B: 10 мМ бикарбонат аммония в воде (pH 9,5)
Градиент C:
Agilent 1100 с ELSD (PL-ELS 2100) и диодно-матричный детектор с УФ-детектированием в диапазоне между 220 и 320 нм, и масс-селективный детектор (MSD), методы ионизации электрораспылением ESI+ и ESI- (диапазон масс: m/z=100-800),
Колонка: Waters Xselect C18, 3,5 мкм, 2,1 мм × 50 мм;
Скорость подвижной фазы 0,8 мл/мин; температура колонки: 35°C;
Подвижная фаза A: ацетонитрил (0,1% HCOOH)
Подвижная фаза B вода (0,1% HCOOH)
линейный градиент от 2% до 98% ацетонитрила в воде (0,1% HCOOH)
0,0 мин 2% A
3,5 мин 98% A
8,0 мин 98% A
Градиент D:
Agilent 1100 с ELSD (PL-ELS 2100) и диодно-матричный детектор с УФ-детектированием в диапазоне между 220 и 320 нм, и масс-селективный детектор (MSD), методы ионизации электрораспылением ESI+ и ESI- (диапазон масс: m/z=100-800),
Скорость подвижной фазы 0,8 мл/мин; температура колонки: 35°C;
Подвижная фаза A: 95% ацетонитрила + 5% 10 мМ бикарбоната аммония в воде
Подвижная фаза B: 10 мМ бикарбонат аммония в воде (pH 9,5)
линейный градиент от 2% до 98% ацетонитрила в воде (0,1% HCOOH)
0,0 мин 2% A
3,5 мин 98% A
8,0 мин 98% A
Ниже приведены описания подробных примеров изобретения, в которых получение проводили по схемам реакций 1-9.

Нижеприведенные примеры представлены для того, чтобы проиллюстрировать изобретение, и никоим образом не ограничивают объем изобретения.
Типичные промежуточные соединения:
Этил (2E,4E)-додека-2,4-диеноат
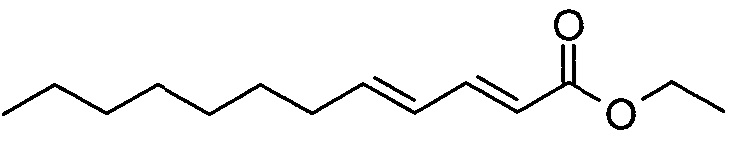
Гидрид натрия (60% масс., 3,11 г) суспендировали в сухом тетрагидрофуране (200 мл) и охлаждали до 0°C. O,O-диэтилэтоксикарбонилметилфосфонат (15,43 мл) добавляли по каплям. Реакционную смесь перемешивали при 0°C в течение 30 мин и охлаждали до -78°C, после чего добавляли по каплям (E)-дец-2-еналь (11,90 мл). Перемешивание продолжали при этой температуре в течение 2 ч, после чего смесь нагревали до комнатной температуры. Реакционную смесь выливали в воду и водную фазу экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным раствором соли, сушили над сульфатом натрия и растворитель выпаривали. Неочищенный продукт очищали методом колоночной хроматографии.
(2E,4E)-додека-2,4-диеновая кислота
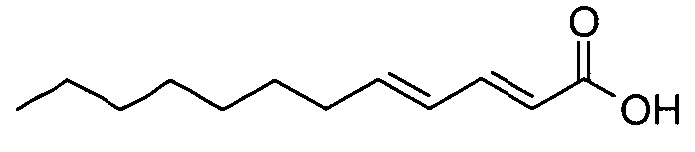
Этил (2E,4E)-додека-2,4-диеноат (11,84 г) растворяли в метаноле (130 мл) и добавляли 2M водный раствор гидроксида натрия (35 мл). Реакционную смесь нагревали до 60°C до тех пор, пока не наблюдали полное преобразование. После охлаждения до комнатной температуры смесь подкисляли разбавленной водной HCl. Реакционную смесь экстрагировали этилацетатом и органический слой промывали насыщенным раствором соли, сушили над сульфатом натрия и растворители выпаривали. Неочищенный продукт использовали для следующей стадии без дополнительной очистки.
(2E,4Е)-додека-2,4-диеноилхлорид
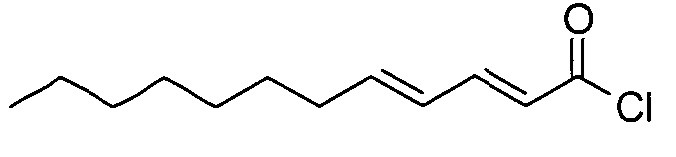
(2E,4Е)-додека-2,4-диеновую кислоту (2,5 г) растворяли в дихлорметане (25 мл). Добавляли оксалилхлорид (2,23 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Растворитель и избыток оксалилхлорида удаляли и остаток упаривали несколько раз с DCM. Неочищенный хлорангидрид использовали как таковой на следующей стадии.
(2E,4Е)-додека-2,4-диен-1-ол
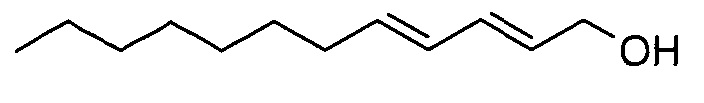
В атмосфере азота (2E,4E)-этилдодека-2,4-диеноат (6,1 г) растворяли в н-гептане (120 мл) и охлаждали до -70°C. DIBAL-H в гексане (82 мл) добавляли по каплям и смесь перемешивали при -70°C в течение 45 мин. Добавляли насыщенный раствор соли (60 мл) и диэтиловый эфир (100 мл) и смесь перемешивали в течение 45 мин, при этом нагревая до КТ. Органический слой отделяли и промывали 1 н. HCl, сушили над сульфатом натрия, фильтровали и концентрировали. Выделяли бесцветное жидкое вещество, которое затвердевало при легком охлаждении.
(2E,4E)-1-азидодека-2,4-диен
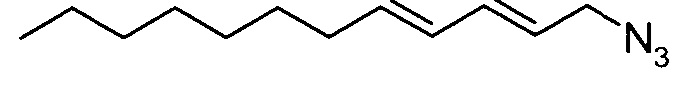
(2E,4E)-додека-2,4-диен-1-ол (4,95 г) растворяли в сухом толуоле (110 мл) и добавляли дифенилфосфинилазид (7,92 г). DBU (4,91 мл) добавляли по каплям. Смесь становилась непрозрачной при выделении тепла. Растворитель выпаривали и к остатку добавляли диэтиловый эфир. Реакционную смесь промывали 1M HCl, 1M NaOH и насыщенным раствором соли и органический слой сушили над сульфатом натрия, фильтровали и концентрировали, получая жидкое вещество светло-желтого цвета. Неочищенный продукт фильтровали через силикагель.
(2E,4E)-додека-2,4-диен-1-амин
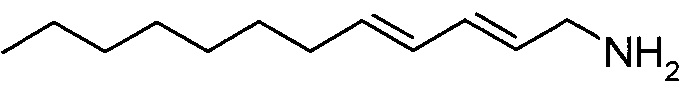
В атмосфере азота 1 M LiAlH4 в диэтиловом эфире (2,89 мл) разбавляли сухим диэтиловым эфиром (30 мл) и охлаждали на ледяной бане. Медленно добавляли раствор (2E,4E)-1-азидододека-2,4-диена (1 г) в сухом диэтиловом эфире (10 мл). Смесь перемешивали при 0°C в течение 1 ч, ледяную баню удаляли и перемешивание продолжали в течение 1 ч, при этом проходило нагревание до комнатной температуры. Осторожно добавляли воду до тех пор, пока не прекращалось выделение газа, и реакционную смесь сушили над сульфатом натрия, фильтровали и концентрировали, получая жидкое вещество желтого цвета.
Этил (2E)-5-фенилпент-2-еноат
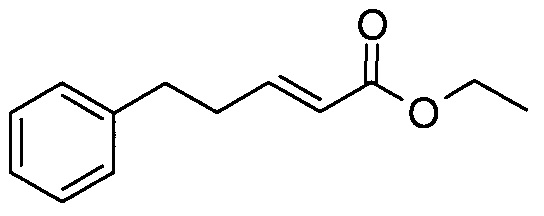
Гидрид натрия (60% масс., 181 мг) суспендировали в сухом тетрагидрофуране (5 мл) и охлаждали до 0°C. Добавляли по каплям триэтилфосфоноацетат (896 мкл). Реакционную смесь перемешивали при 0°C в течение 30 мин. После охлаждения до -78°C добавляли по каплям 3-фенилпропиональдегид (500 мкл). Реакционную смесь перемешивали при этой температуре в течение 1 ч. Реакционной смеси давали нагреться до комнатной температуры, гидролизовали смесью вода/ТГФ, выливали в воду и водный слой экстрагировали дважды, используя EtOAc. Объединенный органический слой промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали методом колоночной флэш-хроматографии.
(2Е)-5-фенилпент-2-еналь
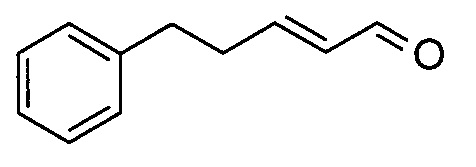
Раствор (E)-этил-5-фенилпент-2-еноата (732 мг) в сухом толуоле (5 мл) охлаждали до -78°C. Добавляли по каплям DIBAL-H (1M в гексане, 7,17 мл) и смесь перемешивали в течение 3 ч. Добавляли вторую порцию DIBAL-H (1M в гексане, 0,717 мл) и перемешивание продолжали еще в течение 3 ч. Смеси давали нагреться до КТ и гидролизовали 1M водной HCl (5 мл). Дополнительно добавляли 3M водную HCl до тех пор, пока не достигали pH 1, и водный слой экстрагировали EtOAc (3×). Объединенный органический слой промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали. Неочищенный продукт растворяли в дихлорметане (5 мл) и добавляли TEMPO (28,0 мг), бромид калия (42,6 мг) и воду (5 мл). Добавляли по каплям водный раствор гипохлорита натрия (13%, 1,642 мл). Смесь перемешивали при комнатной температуре в течение 15 ч. После разделения фаз водный слой экстрагировали CH2Cl2. Объединенный органический слой промывали 1M HCl, водой и насыщенным раствором соли, сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали методом колоночной флэш-хроматографии с получением маслообразного вещества с легким оранжевым оттенком.
Этил (2E,4E)-7-фенилгепта-2,4-диеноат

Гидрид натрия (60% масс., 74,0 мг) суспендировали в сухом тетрагидрофуране (5 мл) и охлаждали до 0°C. Добавляли по каплям триэтилфосфоноацетат (0,367 мл). Реакционную смесь перемешивали при 0°C в течение 30 мин и затем охлаждали до -78°C, после чего добавляли по каплям (E)-5-фенилпент-2-еналь (247 мг). Реакционную смесь перемешивали при этой температуре в течение 1 ч. Охлаждающую баню удаляли и реакционную смесь перемешивали еще в течение часа. Реакционную смесь гидролизовали смесью вода/ТГФ, выливали в воду и водный слой дважды экстрагировали EtOAc. Объединенный органический слой промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали. Неочищенный продукт использовали как таковой на следующей стадии.
(2E,4E)-7-фенилгепта-2,4-диеновая кислота
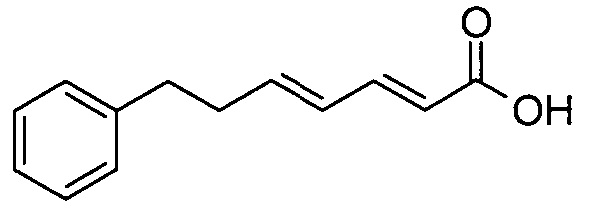
(2E,4E)-этил-7-фенилгепта-2,4-диеноат (355 мг) растворяли в метаноле (5 мл). Добавляли 2M водный раствор гидроксида натрия (1,002 мл) и полученную суспензию нагревали до 60°C. Реакционную смесь перемешивали в течение 2 ч. После охлаждения до комнатной температуры смесь подкисляли 1M водной HCl и три раза экстрагировали EtOAc. Объединенный органический слой промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали с получением твердого вещества не совсем белого цвета. Остаток поглощали 1M водным раствором NaOH (10 мл) и экстрагировали Et2O. Водный слой подкисляли 2M водной HCl и дважды экстрагировали EtOAc. Объединенный EtOAc слой промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали.
(2E,4E)-7-фенилгепта-2,4-диен-1-ол

Раствор этил (2E,4Е)-7-фенилгепта-2,4-диеноата (7,32 г) в сухом толуоле (75 мл) охлаждали до -78°C. Добавляли по каплям DIBAL-H (1M в гексане, 65,2 мл) и смесь перемешивали в течение 3 ч. Смеси давали нагреться до комнатной температуры и гидролизовали 1M водной HCl при охлаждении в бане, содержащей смесь лед/вода. Дополнительно добавляли 3M водную HCl до тех пор, пока не достигали pH 1. Слои разделяли и водный слой три раза экстрагировали EtOAc. Объединенный органический слой промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали методом колоночной хроматографии с получением бесцветного маслообразного вещества.
[(3Е,5Е)-7-азидогепта-3,5-диен-1-ил]бензол

(2E,4E)-7-фенилгепта-2,4-диен-1-ол (6,8 г) растворяли в сухом толуоле (130 мл) и охлаждали в бане, содержащей смесь льда с солью. Добавляли дифенилфосфоразидат (7,83 мл), затем по каплям добавляли DBU (6,53 мл) в сухом толуоле (15 мл). Смесь перемешивали в течение 15 ч, при этом происходило нагревание до комнатной температуры. Растворители выпаривали и остаток распределяли между диэтиловым эфиром и 1 н. NaOH. Органический слой промывали насыщенным раствором соли, сушили над сульфатом натрия, фильтровали и концентрировали. Очистка методом колоночной хроматографии приводила к получению бесцветного жидкого вещества.
трет-Бутил [(2E,4E)-7-фенилгепта-2,4-диен-1-ил]карбамат
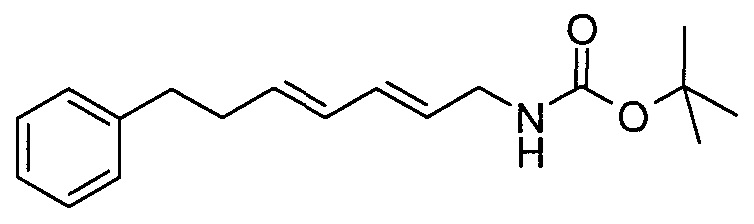
В атмосфере азота LiAlH4 (4 н. в диэтиловом эфире, 4,50 мл) и сухой диэтиловый эфир (200 мл) охлаждали до 0°C. Добавляли по каплям раствор [(3E,5E)-7-азидогепта-3,5-диен-1-ил]бензола (6,4 г) в сухом диэтиловом эфире (70 мл) и смесь перемешивали при 0°C в течение 1 ч, затем при комнатной температуре в течение 1 ч. Воду добавляли по каплям до тех пор, пока не прекращалось выделение газа. Смесь сушили над сульфатом натрия, фильтровали и концентрировали с получением промежуточного амина в виде жидкого вещества желтого цвета. Промежуточный амин (5,6 г) растворяли в дихлорметане (150 мл) и охлаждали до 0°C. Добавляли триэтиламин (4,60 мл), затем Boc2O (6,97 мл). Охлаждающую баню удаляли и смесь перемешивали при комнатной температуре в течение 15 ч. Добавляли воду (200 мл) и органический слой отделяли. Водный слой экстрагировали дихлорметаном (200 мл). Объединенный органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали методом колоночной хроматографии, получая бесцветное жидкое вещество.
(2E,4E)-7-фенилгепта-2,4-диен-1-амин

трет-Бутил (2E,4E)-7-фенилгепта-2,4-диенилкарбамат (800 мг) растворяли в хлористоводородной кислоте в диоксане (4,0M, 8,35 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель выпаривали и дважды совместно выпаривали с Et2O, добавляли Et2O, твердое вещество отфильтровывали в токе азота, получая продукт в виде твердого вещества не совсем белого цвета.
Синтез примера 4:
Пример 4:
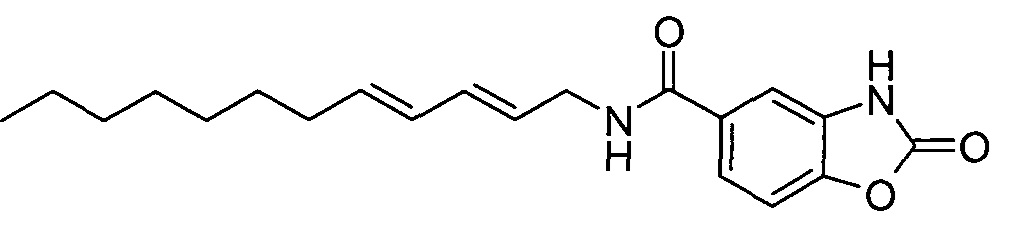
К охлажденному (0°C) раствору 2-оксо-2,3-дигидробензо[d]оксазол-5-карбоновой кислоты (150 мг) и (2E,4E)-додека-2,4-диен-1-амина (138 мг) в дихлорметане (3 мл) и сухом N,N-диметилформамиде (2 мл) добавляли EDCI.HCl (161 мг), затем добавляли 1-гидрокси-7-азабензотриазол (10,36 мг) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Неочищенное вещество растворяли в EtOAc и элюировали через небольшой слой силикагеля, используя EtOAc, затем упаривали при пониженном давлении, что позволяло получить неочищенное твердое вещество желтого цвета. К неочищенному твердому веществу добавляли H2O и EtOAc, смесь нагревали при интенсивном перемешивании до достижения полного растворения. После разделения слоев все еще в горячем виде органический EtOAc слой фильтровали, используя фазовый сепаратор, и упаривали досуха при пониженном давлении. Дальнейшая очистка методом обращенно-фазовой колоночной хроматографии давала продукт в виде твердого вещества белого цвета.
Синтез примера 10:
Пример 10:
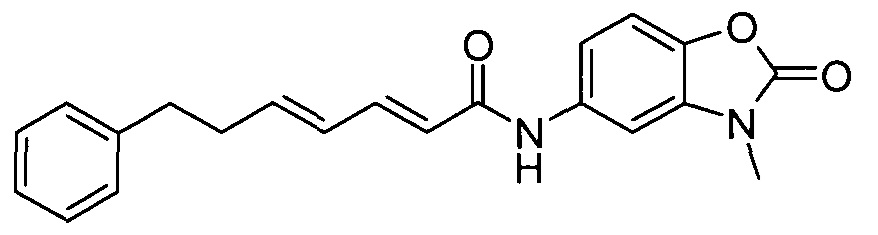
К суспензии 5-амино-3-метил-1,3-бензоксазол-2(3H)-она (125 мг) и (2E,4E)-7-фенилгепта-2,4-диеновой кислоты (140 мг) в дихлорметане (3 мл) и сухом N,N-диметилформамиде (2 мл) добавляли EDCI.HCl (146 мг), затем добавляли 1-гидрокси-7-азабензотриазол (9,42 мг) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь концентрировали и очищали методом колоночной флэш-хроматографии (10-70% EtOAc в гептане), получая продукт в виде твердого вещества белого цвета.
Примеры 1-3, 5-9 и 11-17, как указано выше в таблице 1, получали аналогичным способом, как примеры 4 и 10, используя соответствующие исходные соединения.
БИОЛОГИЧЕСКИЕ ИСПЫТАНИЯ
A. Количественный анализ вытеснения радиоактивно меченного лиганда на CB1 и CB2 рецепторах
Для CB1 рецептора эксперименты по связыванию проводили в присутствии 0,5 нМ радиоактивно меченного лиганда [3H]CP55,940 (168 Ci/ммоль) (Perkin Elmer, Waltham, MA, US) при 30°C в силиконизированных стеклянных ампулах вместе с 8,0 мкг клеточной мембраны с рекомбинантно полученной сверхэкспрессией CB1 (No. RBHCB1M, Perkin Elmer, Waltham, MA, US), которую ресуспендировали в 0,5 мл (конечный объем) используемого при испытаниях буферного раствора (50 мМ TRIS-HCl, 2,5 мМ EDTA, 5 мМ MgCl2, 0,5 мг/мл свободный от жирных кислот БСА, pH 7,4). Тестируемые соединения были представлены в различных концентрациях, и неспецифическое связывание радиоактивно меченного лиганда определяли в присутствии 10 мкM WIN55,212-2 (Tocris Cookson Ltd., Bristol, UK). По прошествии 2 ч инкубации, суспензию незамедлительно фильтровали через предварительно пропитанный 0,1% полиэтиленимином планшетный фильтр UniFilter®- 96 GF/B (Perkin Elmer, Boston MA, US), промытый двенадцать раз 167 мкл буферного раствора, охлажденного льдом. Радиоактивность высушенных и герметизированных фильтровальных планшетных пластин измеряли с помощью Perkin Elmer 1450 Microbeta TRILUX жидкостного сцинтилляционного счетчика в 40 мкл MicroScint 20 сцинтилляционной смеси (Perkin Elmer, Waltham, MA, US). Данные, полученные из трех независимых экспериментов, осуществленных в трех повторах, приводили к величине между 100% и 0% специфического связывания [3H]CP55,940. Эти данные представляли графически в виде линейной зависимости путем построения графиков Хилла, которые дают возможность рассчитать числовые значения IC50. Полученные, исходя из константы диссоциации (KD) для [3H]CP55,940 и зависящего от концентрации показателя вытеснения (значение IC50), константы ингибирования (Кi) конкурирующих соединений рассчитывали, используя уравнение Ченг-Прусофф (Cheng-Prusoff) [Ki=IC50/(1+L/KD)].
Для исследования связывания с CB2-рецептором 3,8 мкг клеточной мембраны с рекомбинантно полученной сверхэкспрессией CB2 (No. RBXCB2M, Perkin Elmer, Waltham, MA, US) ресуспендировали в 0,5 мл используемого при испытаниях буферного раствора (см. выше) вместе с 0,5 нМ радиоактивно меченного лиганда [3H]CP55,940. Исследования связывания с CB2 контролировали таким же образом, как и в случае с CB1.
B. Определения критической концентрации мицеллообразования (CMC)
Мицеллообразование с красителем проводили согласно модифицированному варианту способа, описанного в публикации Eliyahu et al., Novel dextran-spermine conjugates as transfecting agents: comparing water-soluble and micellar polymers. Gene Ther. 2005, Mar.; 12(6):494-503. Соединения (из 2 мМ основных растворов) смешивали при возрастающих концентрациях с 0,1 нМ флуоресцеином (в форме свободной кислоты, 99%, Fluka, Switzerland) при комнатной температуре в воде, дистиллированной с помощью ультрафильтра Nanopure. Эксперименты проводили на 96-луночных микротитровальных планшетах (возбуждение при 485 нм, излучение при 535 нм). Поскольку излучение флуоресцеина является pH-зависимым, то pH смеси поддерживали постоянным и равным 6,9. Диапазон значений CMC определяли как диапазон концентраций, где первое статистически значимое возрастание флуоресценции определялось. При подходящем разрешении диапазона концентраций это возрастание было не плавным, а резко скачкообразным.
C. Клеточное поглощение [3H]-AEA
Линию клеток лимфомы человека U937 культивировали на RPMI 1640 питательной среде (Invitrogen, Basel, Switzerland), дополненной 10% фетальной бычьей сыворотки, 1 г/мл фунгизона (амфотерицина B), 100 ед./мл пенициллина, 100 г/мл стрептомицина и 2 мМ L-глутамина (все от компании Invitrogen), и выделяли для проведения исследований клеточного поглощения AEA. Отбирали 2,5⋅106 клеток и суспендировали в 250 мкл среды RPMI 1640 (Invitrogen, Basel, Switzerland) при 37°C, используя силанизированные стеклянные ампулы. Клетки предварительно инкубировали 15 мин при 37°C в присутствии тестируемых соединений в концентрациях диапазона 10-11-10-5 M или в присутствии такого же количества (5 мкл) среды контрольного опыта (ДМСО). Затем добавляли смесь 0,5 нМ [3H]-AEA (60 Ci/ммоль) (American Radiolabeled Chemicals, Inc., San Louis, MO, US) и 99,5 нМ нерадиоактивного AEA (Tocris Cookson Ltd., Bristol, UK) с полученной конечной концентрацией 100 нМ AEA и образцы инкубировали при 37°C еще в течение 15 мин. Реакцию останавливали путем быстрого фильтрования через планшетный фильтр UniFilter®-96 GF/C (Perkin Elmer, Boston MA, US), предварительно промытый фосфатно-солевым буферным раствором (PBS), содержащим 0,25 % БСА (масс./об.). Клетки трижды промывали охлажденным льдом PBS буферным раствором, содержащим 1% свободного от жирных кислот БСА (137 мМ NaCl, 2,7 мМ KC1, 10 мМ Na2HPO4, 1,76 мМ KH2PO4, 1% свободного от жирных кислот БСА, pH 7,4), сушили и добавляли 40 мкл MicroScint 20 сцинтилляционной смеси (Perkin Elmer, Waltham, MA, US). Радиоактивность измеряли, используя Perkin Elmer 1450 Microbeta TRILUX жидкостной сцинтилляционный счетчик. Результаты выражали как % поглощения AEA по сравнению с клетками, обработанными в контрольном опыте растворителем, и значения EC50 и IC50 рассчитывали из сигмоидальных кривых, полученных с использованием программного обеспечения GraphPad Prism 5.0 (GraphPad Software, San Diego, CA, US).
|
D. Ингибирование гидролазы амидов жирных кислот (FAAH)
Активность FAAH определяли, используя гомогенат ткани мозга свиньи или U937, в соответствии со способом, описанным в публикации Omeir et. al. Arachidonoyl ethanolamide-[1,2-14C] as a substrate for anandamide amidase. Life sciences 56, 1999-2005 (1995) и адаптированном, согласно публикации Fowler et al. Selective inhibition of anandamide cellular uptake versus enzymatic hydrolysis - a difficult issue to handle. European journal of pharmacology 492, 1-11 (2004).
В кратком изложении, 10 мкл в контрольном опыте с растворителем или в опыте с тестируемым веществом URB597 (Cayman Chemical, Ann Arbor, MI, US), полученные с конечной концентрацией 100 нМ, или ингибитор в соответствующих концентрациях предварительно инкубировали при 37°C в течение 15 мин при скорости вращения 450 об/мин с 490 мкл разбавленного гомогената ткани мозга свиньи (200 мкг в образце) или U937 гомогената (0,63 мг белка в образце, корреляция с 106 U937 клеток) в буферном растворе для определения FAAH активности (10 мМ Tris-HCl и 1 мМ EDTA, pH 8,0, 0,1% масс./об. свободного от жирных кислот БСА (Sigma, San Louis, MO, US)). Смесь 0,5 нМ [3H]AEA (60 Ci/ммоль) и 99,5 нМ нерадиоактивного AEA, с полученной общей итоговой концентрацией 100 нМ AEA, добавляли и инкубировали в течение 15 мин. Последовательно, 1 мл смеси 1:1 (об./об.) метанол: хлороформ добавляли к каждому образцу и, после сильного встряхивания, водную и органическую фазу разделяли центрифугированием при 10000 об/мин в течение 10 мин при 4°C. Радиоактивность, связанную с [3H]-этанол амином (получен в результате FAAH-катализируемого разрушения [3H]-AEA), определяли при добавлении 3 мл Ultima Gold сцинтилляционной жидкой среды (Perkin Elmer, Waltham, MA, US) к водной (верхней) фазе, используя PACKARD TRI-CARB 2100TR жидкостной сцинтилляционный анализатор. Результаты выражали как % FAAH активности по сравнению с контрольным опытом обработки гомогената растворителем. Полученные данные приводили к нормальному виду путем вычитания неспецифического сигнала при итоговом ингибировании FAAH с помощью URB597. Отдельные значения FAAH ингибирования или значения IC50 из полученных сигмоидальных кривых рассчитывали, используя программное обеспечение GraphPad Prism 5,0 (GraphPad Software, San Diego, CA, US).
E. Ингибирование липазы моноацилглицерина (MAGL)
Активность MAGL количественно определяли, используя набор реактивов Monoacylglycerol Lipase Inhibitor Screening Assay Kit (Cayman Chemicals, MI, US), и экспериментальную методику выполняли в соответствии с протоколом к набору реактивов. В кратком изложении, 10 мкл тестируемых соединений с различными концентрациями (диапазон 0,1-20 мкM) добавляли к 150 мкл используемого в исследованиях буферного раствора, 10 мкл человеческой рекомбинантной MAGL и 10 мкл арахидоноил-1-тиоглицерина (150 мкM в испытании). Планшет инкубировали при комнатной температуре в течение 5 мин, после чего 10 мкл DTNB (5,5’-дитиобис-(2-нитробензойной кислоты), реагент Элмана) добавляли в каждую лунку. Планшет встряхивали в течение 10 с и измеряли поглощение при 415 нм, используя спектрофлуориметр Genius Pro (Tecan, Grodig, Austria). Первоначальную 100% ферментативную активность рассчитывали, используя растворитель вместо тестируемых соединений, при этом нулевой уровень определяли без человеческого рекомбинантного фермента. Результат контрольного опыта вычитали из каждой величины и результаты представляли как % от первоначальной ферментативной активности.
F. In vivo модель состояния зуда, объединенная с оксазолоновой моделью реакции гиперчувствительности замедленного типа
Чесательную активность у мышей определяли после местного нанесения тестируемого соединения. Измеряли утолщение уха и определяли гистологические характеристики (см., например, Elliott G.R. An automated method for registering and quantifying scratching activity in mice: use for drug evaluation. J. Pharmacol. Toxicol. Methods. 2000; 44:453-459 и Gijbels M.J. Therapeutic interventions in mice with chronic proliferative dermatitis (cpdm/cpdm). Exp. Dermatol. 2000; 9:351-358).
Примеры фармацевтической композиции
Пример композиции 9:
|
|
Пример композиции 7:
|
Промышленная применимость - Полезность
Приведенные выше результаты совершенно ясно показывают улучшенные технические эффекты, которые обеспечиваются предоставляемыми соединениями 1,3-бензоксазол-2(3H)-она по настоящему изобретению. Неожиданно настоящими изобретателями было обнаружено, что эти соединения являются подходящими в качестве активных ингредиентов для фармацевтических и косметических композиций, предпочтительно дерматологических средств. Более того, соединения, как было показано, эффективны при лечении и/или профилактике некоторых заболеваний и патологических состояний, включая, но не ограничиваясь ими, воспаление, раздражение, чесотку, зуд, боль, отечность и/или предаллергические или аллергические состояния, в частности, при местном применении для кожи или слизистой оболочки в форме фармацевтических или косметических композиций, содержащих подходящий носитель, предпочтительно неполярный носитель. В частности, воспаление, вызванное сигналами клеточного стресса, можно эффективно ослабить с помощью этих соединений. Более того, соединения по изобретению эффективны при лечении/профилактике патологических состояний, касающихся роста волос (например, облысение, алопеция зачатков волос), нарушения функционирования сальных желез (например, акне, себорея), доброкачественных и злокачественных опухолей кожи, гиперпролиферативных кожных заболеваний (например, псориаз), избыточного роста волос (например, гирсутизм), различных форм дерматита, состояния патологической сухости кожи и/или системного склероза (например, склеродермия). Соединения формулы (1) и/или (2) являются модуляторами эндоканнабиноидной системы и как таковые пригодны при лечении, контролировании или профилактике вышеупомянутых заболеваний, нарушений или патологических состояний, чувствительных к одному или нескольким компонентам эндоканнабиноидной системы, включая, но не ограничиваясь ими, CB1 и CB2, TRPV1, GPR55, FAAH, липазу моноацилглицерина (MAGL) или AEAT. Фармацевтические (дерматологические) композиции и лекарственные препараты, содержащие соединения по настоящему изобретению являются высокоактивными, даже в том случае, если количество активного соединения уменьшено по сравнению с соединениями предшествующего уровня техники, и демонстрируют меньшие нежелательные побочные эффекты.
При том, что изобретение описано и проиллюстрировано со ссылкой на конкретные предпочтительные варианты его осуществления, специалисту в данной области техники будет понятно, что различные изменения, модификации и замены могут быть в нем сделаны без отступления от сути и объема изобретения. Например, эффективные дозировки, иные, чем предпочтительные дозы, установленные, как указано выше, могут применяться как следствие наблюдаемых специфических фармакологических эффектов, и они могут изменяться в зависимости от конкретного выбранного активного соединения, а также от типа готовой лекарственной формы и применяемого способа введения, и такие ожидаемые изменения или отличия в результатах предполагаются в соответствии с целями и практическими вариантами осуществления настоящего изобретения. Предполагается, в силу вышесказанного, что изобретение ограничено только объемом формулы изобретения, что следует из описания, и что формуле изобретения дается толкование в широком смысле настолько, насколько это в пределах разумного.