СПОСОБ И МУЛЬТИСЕНСОРНОЕ УСТРОЙСТВО ДЛЯ НЕИНВАЗИВНОГО МОНИТОРИНГА УРОВНЯ ГЛЮКОЗЫ В КРОВИ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящая группа изобретений относится к медицине и медицинской технике, в частности, к способам и устройствам для мониторинга уровня глюкозы в крови путем измерения с помощью калориметрического метода теплового эффекта и скорости метаболизма локального участка живой ткани. Использование группы изобретений позволит осуществлять неинвазивный мониторинг уровня сахара в крови пациентов, страдающих диабетом.
УРОВЕНЬ ТЕХНИКИ
Одним из широко распространенных и опасных заболеваний современности является сахарный диабет. Согласно прогнозу Международной федерации диабета (IDF), число пациентов, страдающих диабетом, к 2035 увеличится мире до 592 млн. человек с 371 млн. в 2012. Расходы мирового здравоохранения на лечение диабета к 2035 вырастут до 936 млрд. долларов с 586 млрд. в 2012. Согласно Американской Ассоциации Диабетиков примерно 6% населения США, т.е. примерно 16 миллионов человек, страдает сахарным диабетом. Согласно докладам этой ассоциации, диабет находится на седьмом месте среди заболеваний, приводящих к летальному исходу в США. Число летальных исходов, вызываемых диабетом, составляет примерно 200000 случаев в год. Диабет является хроническим заболеванием, способы излечения которого на сегодняшний день все еще находятся в стадии разработки. Диабет часто приводит к развитию осложнений, таких как слепота, почечные нарушения, нервные заболевания и сердечно-сосудистые заболевания. Диабет является ведущим заболеванием, приводящим к слепоте в возрасте от 20 до 74 лет. Примерно от 12000 до 24000 человек в год теряют зрение по причине диабета. Диабет является ведущей причиной заболеваний почек, примерно в 40% новых случаев. Примерно 40-60% больных диабетом имеют предрасположенность к различным формам нервных заболеваний, которые могут привести к ампутации конечностей. Больные диабетом примерно в 2-4 раза более предрасположены к сердечным заболеваниям, в частности, инфаркту миокарда.
Диабет представляет собой заболевание, связанное с недостаточной продукцией или неэффективным использованием инсулина клетками организма. Несмотря на то, что причины заболевания поняты не полностью, некоторые факторы, такие как генетические, окружающей среды, вирусные, идентифицированы.
Существует две основных разновидности диабета: 1 типа и 2 типа.
Диабет 1 типа (известный как инсулин - зависимый диабет) является аутоиммунным заболеванием, при котором выработка инсулина полностью прекращается, и чаще всего развивается в детстве и юности. Больные диабетом 1 типа нуждаются в ежедневных инъекциях инсулина.
Диабет 2 типа является метаболическим заболеванием, вызванным тем, что организм не в состоянии производить достаточное количество инсулина или неэффективно использует его. Больные диабетом 2 типа составляют примерно 90-95% от общего числа диабетиков. В США заболеваемость диабетом 2 типа приближается к эпидемиологическому порогу, в основном благодаря увеличению числа американцев пожилого возраста и преобладанию малоподвижного образа жизни, ведущего к ожирению.
Инсулин способствует проникновению глюкозы в клетку с последующим ее расщеплением для получения энергии для всех метаболических процессов. У диабетиков глюкоза не может проникнуть в клетку, накапливаясь в крови, а клетки испытывают энергетический голод.
Больные диабетом 1 типа самостоятельно вводят инсулин с помощью специального шприца и картриджа. Также возможна непрерывная подкожная инъекция инсулина посредством имплантированной помпы. Инсулин обычно получают из поджелудочной железы свиньи или синтезируют химически.
Общепринятые медицинские методы лечения диабета предписывают пациентам, принимающим инсулин, осуществлять самостоятельный мониторинг содержания сахара в крови. Опираясь на знание уровня сахара в крови, пациенты могут регулировать дозу инсулина при очередной инъекции. Регулировка необходима, поскольку уровень сахара в крови меняется в течение дня и день ото дня в силу различных причин. Несмотря на важность такого мониторинга, несколько проведенных исследований показали, что доля пациентов, которые осуществляют такой мониторинг хотя бы раз в день, падает с возрастом. Это падение происходит в основном из-за того, что метод мониторинга, который сегодня используется, связан с инвазивным отбором пробы крови из пальца. Многие пациенты считают взятие пробы крови из пальца более болезненной процедурой, чем инъекция инсулина.
Создание неинвазивного (бескровного) метода мониторинга сахара крови пациентов, страдающих диабетом, и на его основе медицинского прибора, способного заменить промышленные инвазивные глюкометры, является одной из актуальных нерешенных проблем современной медицины и здравоохранения.
Известны способы и устройства для определения уровня сахара крови неинвазивным способом: [28, 19-27].
Предлагаемый способ и устройство для его осуществления позволяют определять содержание сахара в крови путем измерения с помощью калориметрического метода теплового эффекта (теплопродукции) метаболизма локального участка живой ткани и коррекции погрешностей измерения, обусловленных влиянием внешних физико-климатических факторов на характеристики живой ткани.
На существование функциональной зависимости между скоростью поглощения сахара клетками ткани и его содержанием в крови указывается в работах [2, 8, 9].
Метод калориметрии, как известно, широко используется в биологии для изучения тепловых процессов на молекулярном и клеточном уровнях [1, 29]. Метод микрокалориметрии также успешно используется для исследования тепловых процессов (выделения и поглощения тепла) в отдельных органах, в частности, в активных мышцах и нервных волокнах.
Возросшая за последнее десятилетие активность исследований, направленных на создание метода микрокалориметрии для изучения в физиологических условиях in vivo, тепловых процессов, сопряженных с метаболизмом локального участка живой ткани человека, в значительной степени обусловлена работами по созданию неинвазивного метода мониторинга сахара крови (неинвазивного глюкометра) основанного на мониторинге теплопродукции локального участка ткани человека. Научно-техническая проблема разработки неинвазивного глюкометра - прибора для бескровного мониторинга сахара крови, является сегодня одной из нерешенных актуальных проблем современной медицины [28], в решение которой вовлечены значительные финансовые и интеллектуальные ресурсы.
Известными методами физиологической калориметрии являются методы: прямой калориметрии и непрямой калориметрии [16].
Метод прямой калориметрии предусматривает непосредственное определение суммарного количества выделяемого тепла с помощью калориметрической камеры для живых объектов.
Метод непрямой калориметрии позволяет определять количество выделяемого тепла косвенным путем, на основе учета динамики дыхательного газообмена с помощью респираторных камер и различных систем. Различают две возможные модификации метода непрямой калориметрии: метод полного газового анализа (учет поглощенного О2 и выделенного СО2) и метод неполного газового анализа (учет поглощенного O2).
Близким по технической сущности к заявляемому объекту является способ измерения скорости базального метаболизма человеческого организма с помощью калориметра всего тела (прямая калориметрия), описанный в [26] (US 4386604 А, опубл. 07.06.1983). По измерению температуры воздуха и суммарного количества воды, испаряющейся с поверхности всего тела, определяют суммарную теплоотдачу всего тела и вычисляют скорость базального метаболизма.
Другим, близким по технической сущности к заявляемому объекту, является способ измерения, описанный в [25] (US 5040541 А, 20.08.1991).
Основными недостатками упомянутых способов является то, что для их реализации требуются громоздкие, стационарные и дорогостоящие калориметрические камеры всего тела. Кроме того, метод прямой калориметрии характеризуется низкой точностью.
Наиболее близким по технической сущности к заявляемым объектам, является способ измерения и устройство для микрокалориметрического измерения скорости локального метаболизма ткани, содержания воды межклеточной ткани, концентрации биохимических компонентов крови и давления в сердечно-сосудистой системе, описанный в [27], в котором по измерению теплового эффекта и скорости метаболизма локального участка ткани определяют содержание сахара в крови (RU 2396897 С2, опубл. 20.08.2010).
Величина скорости метаболизма определяется путем измерения суммарного количества воды, испаряющейся в процессе неощутимой перспирации с поверхности локального участка кожи, и измерения температуры и влажности окружающего воздуха.
Упомянутый способ измерения позволяет реализовать высокую точность в лабораторных условиях с контролируемыми параметрами микроклимата (температура и влажность воздуха) помещения, в котором проводится измерение, при неизменных значениях климатических параметров внешней среды (температура и влажность окружающей среды, атмосферное давление).
Основным недостатком упомянутого способа, ограничивающим его практическое применение, является то, что результаты измерений зависят от физико-климатических факторов окружающей среды; в каждом случае при изменении климатических факторов, при неизменных значениях параметров микроклимата помещения, в котором проводятся измерения, требуется новая калибровка измерительного канала.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Целью настоящей группы изобретений является разработка метода и устройства мониторинга уровня глюкозы в крови с помощью метода микрокалометрии для исследования тепловых процессов метаболизма произвольного локального участка живой ткани человека при контролируемых параметрах не только микроклимата помещения, в котором проводятся измерения, но и с учетом климатических параметров внешней окружающей среды.
Технический результат, достигаемый группой изобретений, заключается в повышении точности измерения теплового эффекта метаболизма за счет учета погрешностей измерений от влияния внешних условий, а также за счет учета погрешностей измерений, обусловленных физиологическими флуктуациями измеряемых параметров испытуемого.
Технический результат достигается тем, что способ мониторинга уровня глюкозы в крови характеризуется последовательностью этапов: рассчитывают величину теплового метаболизма локального участка живой ткани эффекта или интенсивности метаболизма локального участка живой ткани следующим образом: накладывают на поверхность кожи с дозированным давлением по меньшей мере один тепло- и водонепроницаемый аппликатор, образующий закрытую систему в локальной области ткани под аппликатором; измеряют временную динамику физиологических параметров локальной области ткани под аппликатором, а именно, по меньшей мере количества воды в межклеточном пространстве ткани под аппликатором; температуру глубинного слоя ткани Tskin под аппликатором или тепловой поток через участок кожи под аппликатором; эластического давления ткани под аппликатором, при этом одновременно или перед началом измерения физиологических параметров в режиме мониторинга измеряют временную динамику климатических параметров окружающей среды, а именно, по меньшей мере температуру помещения Troom и относительную влажность воздуха RHroom в помещении, в котором проводится измерение, атмосферное давление Patm, измеряют внешний тепловой поток через ограждающую конструкцию между помещением и внешней окружающей средой или температуру внешней окружающей среды Text; далее вычисляют величину энтальпии ткани с учетом влияния климатических параметров, после чего рассчитывают величину теплового эффекта метаболизма ΔQMET локального участка живой ткани с помощью основного уравнения термодинамики, связывающего энтальпию ткани с переменными термодинамического состояния и вычисляют относительные изменения уровня глюкозы в крови, пропорциональные величине теплового метаболизма локального участка живой ткани.
При этом для вычисления величины теплового эффекта метаболизма локального участка живой ткани и вычисления уровня глюкозы в крови, пропорционального величине теплового метаболизма локального участка живой ткани, проводят процедуру калибровки и определяют калибровочные параметры с целью определения постоянных коэффициентов.
Калибровочные параметры определяют индивидуально для каждого пациента по инвазивным измерениям уровня глюкозы крови. Процедура калибровки включает в себя измерение в непрерывном режиме содержания глюкозы в крови в условиях проведения теста толерантности к глюкозе и определение чувствительности ткани к инсулину.
Кроме того, временную динамику температуры глубинного слоя ткани под аппликатором Tskin определяют путем измерения временной динамики температуры поверхности кожи под аппликатором и теплового потока через эпидермис к поверхности или методом радиотермометрии.
Временную динамику количества воды и ее равновесное содержание в межклеточном пространстве нижних слоев кожи и подкожных тканей под аппликатором определяют по изменению количества воды в локальной области ткани под аппликатором.
При этом изменение количества воды в локальной области ткани под аппликатором определяют путем измерения электрических характеристик рогового слоя эпидермиса или спектральных характеристик рогового слоя эпидермиса или теплофизических характеристик рогового слоя эпидермиса.
Локальный участок живой ткани может быть расположен на кисти руки или любом другом произвольном участке на поверхности рогового слоя кожи.
Дополнительно вычисляют интенсивность теплообразования в процессе метаболизма локального участка живой ткани, интенсивность метаболизма локального участка живой ткани, в том числе базального метаболизма локального участка живой ткани.
Измеряют дополнительные физиологические и биохимические параметры, характеризующие метаболизм локального участка живой ткани.
При этом физиологический параметр выбирают из группы, включающей в себя электрофизиологические параметры, в том числе электроэнцефалограмма, электромиограмма, кожно-гальваническая реакция, электрокардиограмма. При этом дополнительный параметр также выбирают из группы, включающей в себя биохимические параметры крови, парциальное давление кислорода и/или углекислого газа в крови, частоту сердечных сокращений, кровяное давление. Биохимический параметр крови представляет собой кислотность крови, концентрацию лактата в крови, глюкокортикоидный гормон.
При этом концентрацию биохимического параметра в крови вычисляют путем измерения динамики биохимического параметра в роговом слое эпидермиса, в том числе измеряя динамику биохимического параметра в растворе пота в потовой железе под аппликатором.
Кроме того, дополнительно сравнивают измеренные показатели интенсивности базального метаболизма локального участка ткани и дополнительных физиологических и биохимических параметров с интервалом показателей, характеризующим нормальное физиологическое состояние ткани, после чего определяют отклонение величин параметров, полученных путем измерений, от интервала показателей, характеризующего нормальное физиологическое состояние ткани, а по величине отклонения определяют характер отклонения и оценивают степень патологического состояния ткани.
Дополнительно измеряют зависимость изменения количества воды в межклеточном пространстве тканей под аппликатором от воздействия внешнего физического фактора и определяют количество воды, которое обеспечивает набухание межклеточного вещества в ее нативном состоянии.
Внешний физический фактор выбирают из группы, включающей в себя внешнее давление, локальную декомпрессию, нагрев, охлаждение, воздействие электрическим током и магнитным полем.
Измеряют дополнительные параметры, определяющие состояние межклеточного вещества, выбранные из группы, включающей в себя кровяное давление, кислотность, эластическое давление. После чего сравнивают измеренные количество воды, которое обеспечивает набухание межклеточного вещества в ее нативном состоянии, и дополнительные параметры с интервалом показателей, характеризующим нормальное физиологическое состояние ткани, определяют отклонение величин параметров, полученных путем измерений, от интервала показателей, характеризующего нормальное физиологическое состояние ткани, и по величине отклонения определяют характер отклонения и оценивают степень патологического состояния межклеточной ткани.
Дополнительно определяют способ и режим внешнего физического воздействия на участок живой ткани в зависимости от состояния межклеточной ткани, осуществляют внешнее физическое воздействие и проводят контроль эффективности воздействия путем повторного измерения параметра, характеризующего состояние участка ткани.
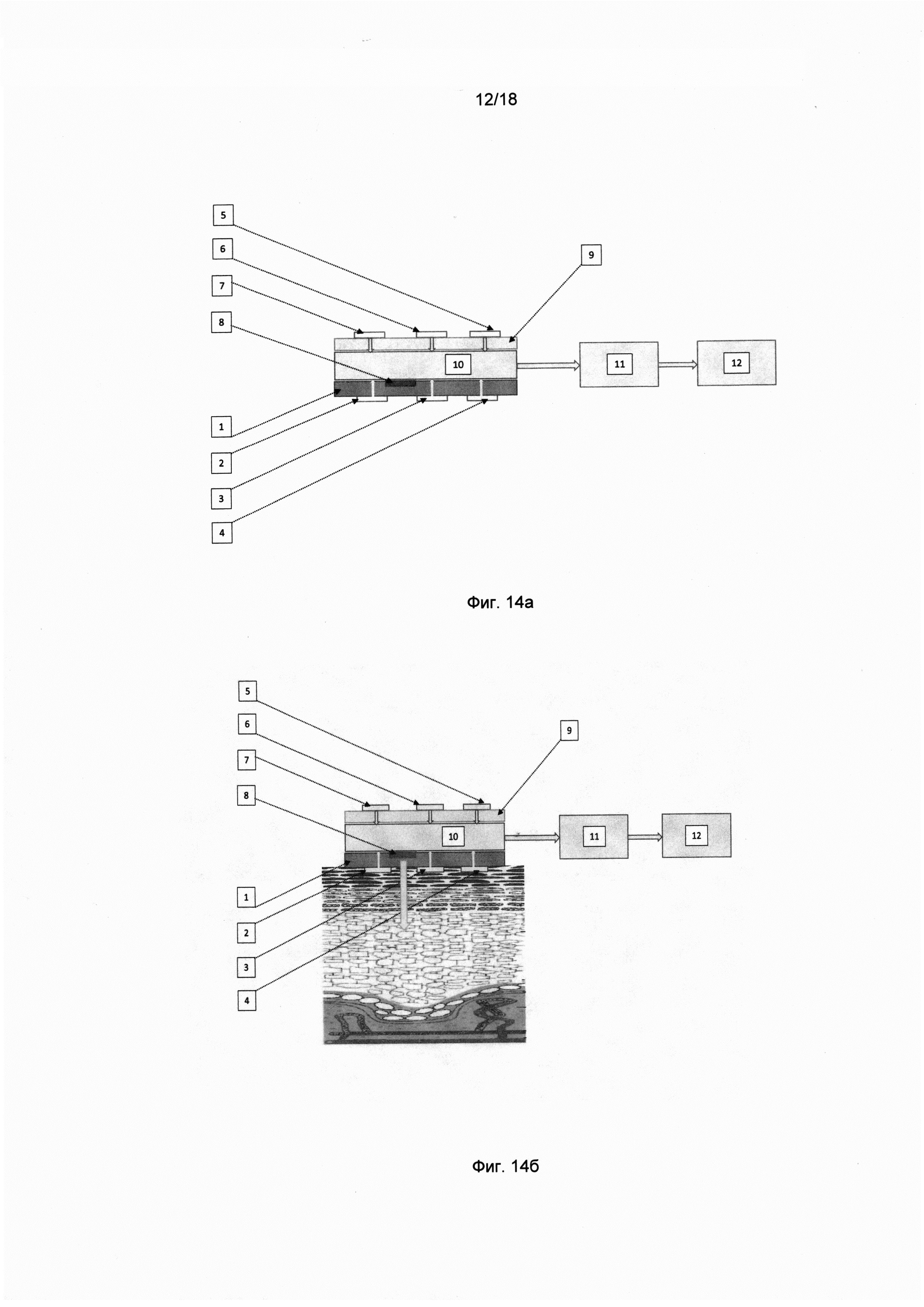
Для осуществления способа используют устройство для мониторинга уровня глюкозы в крови, содержащее тепло- и водонепроницаемый аппликатор, имеющий верхнюю и внутреннюю поверхности и выполненный с возможностью наложения на кожу с дозированным давлением, датчики физиологических параметров, датчики климатических параметров, устройство для создания калибровочного воздействия на участок ткани под аппликатором, установочную платформу для закрепления датчиков климатических параметров, закрепленную над аппликатором, при этом датчики климатических параметров расположены на установочной платформе, а датчики физиологических параметров расположены под аппликатором, при этом сигналы с вышеуказанных датчиков поступают последовательно на входы блока усилителей и/или аналогово-цифрового преобразователя, установленных на верхней поверхности аппликатора; блока обработки информации; блока отображения информации.
Кроме того, устройство для создания калибровочного воздействия на участок ткани представляет собой источник тепловой мощности, выполненный в виде резистора или элемента Пельтье; источник электрического тока или напряжения; источник электромагнитного излучения; устройство для создания дозированного давления на поверхность аппликатора.
В качестве датчиков физиологических параметров используют по меньшей мере один датчик количества воды в межклеточном пространстве ткани в локальном объеме под аппликатором; датчик температуры поверхности кожи под аппликатором, датчик теплового потока через участок кожи под аппликатором; датчик эластического давления ткани под аппликатором.
В качестве датчиков климатических параметров используют по меньшей мере датчик температуры воздуха, датчик относительной влажности воздуха в помещении, датчик теплового потока через ограждающую конструкцию между помещением и внешней окружающей средой.
Кроме того, датчиком количества воды в межклеточном пространстве ткани в локальном объеме под аппликатором является электрометрический датчик или спектральный датчик или датчик, основанный на измерении теплофизических характеристик рогового слоя кожи, или датчик, основан на измерении тканевого давления или осмотического давления межклеточного вещества, или датчик, основанный на измерении гидравлического давления в системе микроциркуляции, или датчик, основанный на измерении эластического давления.
Электрометрический датчик содержит по меньшей мере один базовый и по меньшей мере один измерительный электроды, приспособление для создания дозированного давления электродов на поверхность кожи, источник питания и измерительный блок, и, по меньшей мере, один из электродов выполнен в виде сухого водонепроницаемого электрода. Площадь базового электрода превышает площадь измерительного электрода, при этом площадь одного из электродов, измерительного, удовлетворяет условию: S (мм2)>2Р (мм) *0,4 (мм).
Рабочая поверхность базового электрода может быть сухой или снабжена средством для увеличения проводимости кожи в месте контакта, в частности, электропроводящей пастой.
Электроды могут быть выполнены в виде совмещенных дисков с суммарной площадью, определяемой большим диаметром. Кроме того, возможно выполнение электродов в виде совмещенных коаксиальных дисков.
Измерительный блок выполнен в виде устройства для измерения поперечной электропроводности рогового слоя эпидермиса на постоянном токе или низких частотах, или диэлектрической проницаемости рогового слоя эпидермиса на низких частотах.
Тепло- и водонепроницаемый аппликатор может быть выполнен в виде измерительной капсулы, образующей замкнутую полость с диффузионным и тепловым контактом с поверхностью кожи.
При этом замкнутая полость измерительной капсулы является герметичной, а рабочая поверхность указанной полости, контактирующая с кожей, выполнена в виде жесткой мембраны, проницаемой или полупроницаемой для воды и тепла.
Кроме того, замкнутая полость измерительной капсулы, накладываемая на поверхность кожи, не имеет механического контакта с поверхностью кожи.
Полость измерительной капсулы включает по меньшей мере материал, абсорбирующий воду, который служит чувствительным элементом датчика количества воды.
Датчик количества воды может быть выполнен в виде датчика давления паров воды или в виде датчика концентрации паров воды, основанного на методах спектроскопии, или в виде датчика теплофизических характеристик паров воды или в виде датчика теплоемкости или теплопроводности паров воды.
Создание дозированного давления аппликатора осуществляется с помощью устройства, выполненного с использованием пневматического, механического, пьезоэлектрического, электромагнитного, вакуумного или гидравлического принципа.
Устройство дополнительно содержит датчики для измерения физиологических параметров, характеризующих метаболизм организма, выбранных из группы, включающей в себя датчики биохимических параметров крови, датчики парциального давления кислорода и/или углекислого газа крови., датчики параметров кислотного-основного состояния организма.
Датчиком, характеризующим кислотно-основное состояние организма, является, датчик лактата в крови или датчик кислотности крови.
Дополнительным датчиком физиологического параметра является датчик кортизола крови или датчик частоты сердечных сокращений, датчик частоты сердечных сокращений, датчик электрофизиологического параметра.
Под «локальным участком живой ткани» понимается живая ткань, расположенная непосредственно под контролируемым in vivo участком поверхности кожи (роговым слоем кожи).
Под метаболизмом локального участка живой ткани понимается метаболизм контролируемой области живой ткани, расположенной непосредственно под аппликатором. Объем контролируемой области определяется как произведение площади аппликатора, накладываемого на поверхность кожи, на контролируемую длину (глубину), которая соответствует длине (определяется как расстояние от поверхности РСЭ в глубину), на которой устанавливается локальное термодинамическое равновесие ткани после наложения аппликатора на поверхность РСЭ. Длина L (от поверхности аппликатора в глубину), на которой устанавливается локальное термодинамическое равновесие ткани после наложения аппликатора на поверхность РСЭ определяется диаметром D аппликатора: L<D.
Контролируемую длину L (глубина) можно оценить - она примерно (по порядку величины) равна диаметру аппликатора, и в случае с датчиком лабораторного макета, с помощью которого производились измерения, составляет L<D=2-3 см (20-30 мм). При этом толщина эпидермиса, как хорошо известно, составляет d=0,5 мм, а толщина кожи (эпидермис + дерма) 1-2 мм.
Важная для практического применения особенность метода заключается в том, что метод позволяет измерять интенсивность метаболизма в глубине, на контролируемой глубине L<D, на которой устанавливается термодинамическое равновесие после наложения аппликатора, а не только интенсивность метаболизма в коже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ.
Прилагаемые чертежи, которые включены в состав настоящего описания и являются его частью, иллюстрируют варианты осуществления группы изобретения и совместно с общим описанием группы изобретения и нижеприведенным подробным описанием вариантов осуществления служат для пояснения принципов настоящего изобретения.
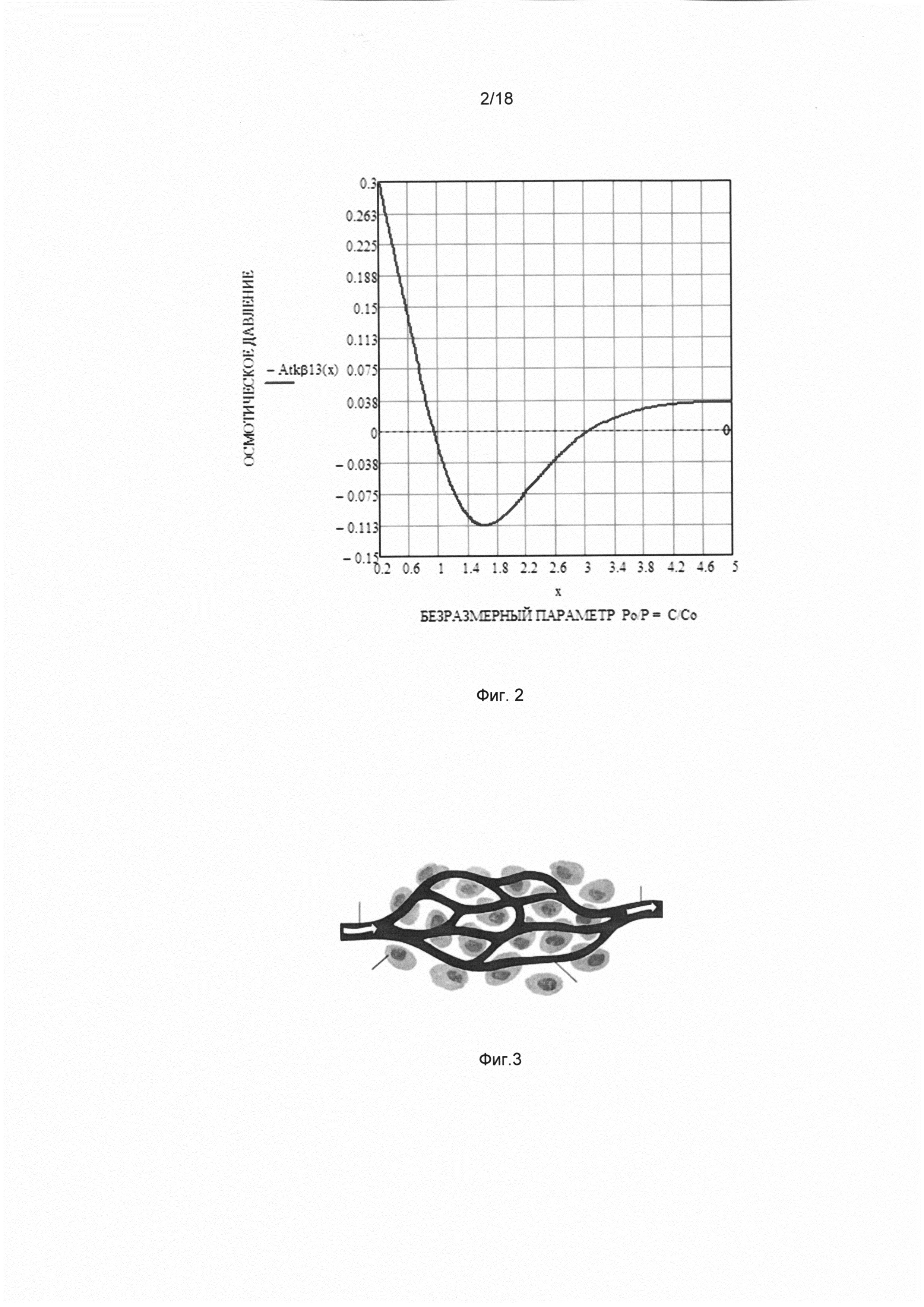
Фигура 1. Графики зависимости объема межклеточного вещества от концентрации глюкозы С в единицах безразмерного параметра х=С/С0 для разных значений внешнего давления Р0, где С0 - концентрация глюкозы, соответствующая нулевому значению осмотического давления. Кривые 1, 2 и 3 соответствуют разным значениям внешнего давления Р01, Р02, Р03, удовлетворяющим условию: Р01<Р02<Р03.
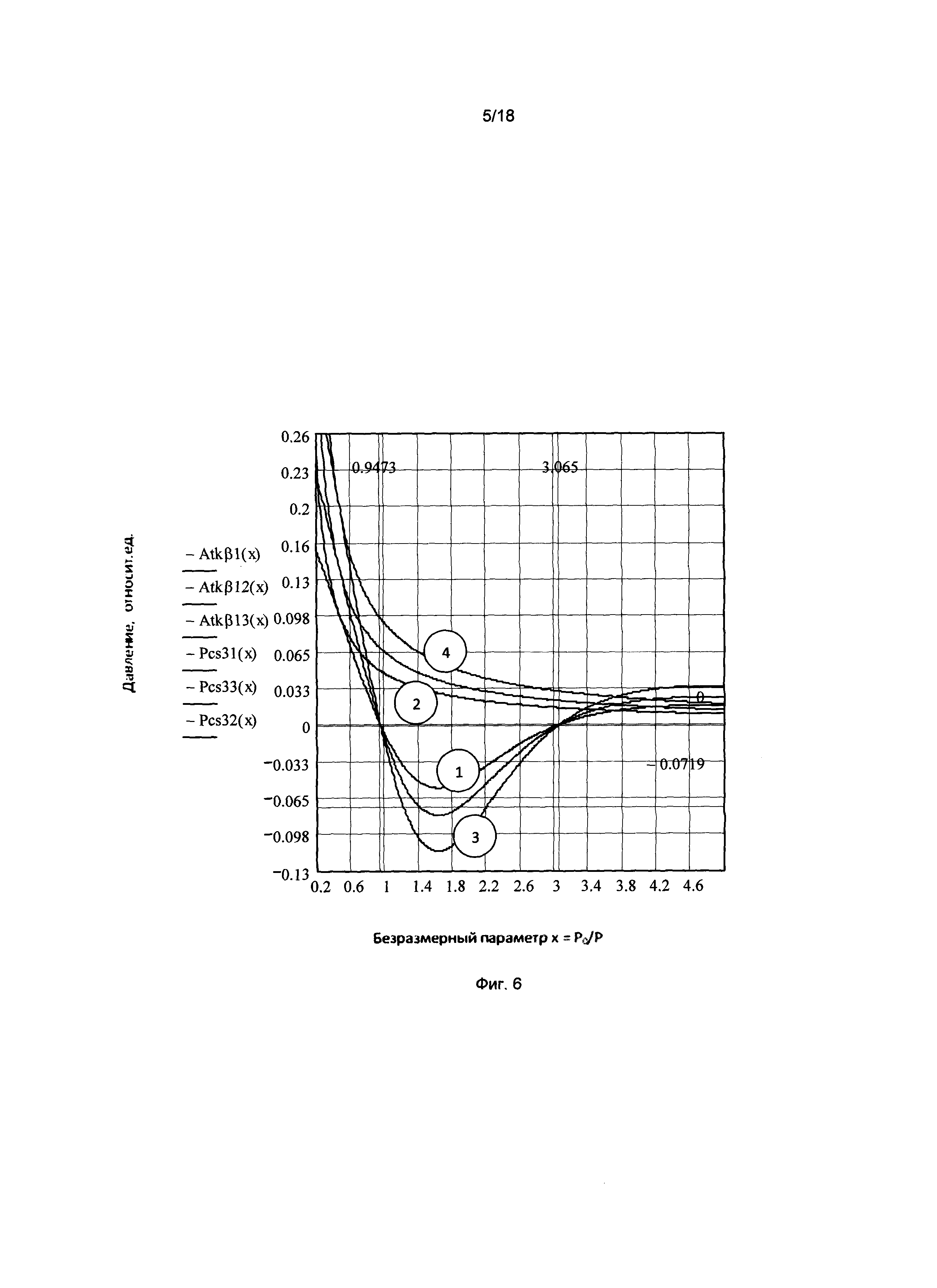
Фигура 2. График зависимости осмотического давления межклеточного вещества (тканевого давления) в зависимости от безразмерного параметра х=С/С0=Р0/Р, где С - концентрация глюкозы в крови; С0 - концентрация глюкозы, соответствующая нулевому значению осмотического давления; Р - гидравлическое давление в капилляре; Р0 - давление в капилляре, соответствующее нулевому значению осмотического давления.
Фигура 3. Структурный элемент локальной области живой ткани: основными элементами, образующими структуру ткани, являются клетки, межклеточное вещество и система кровеносных капилляров и микрососудов, образующих систему микроциркуляции в локальной области ткани.
Фигура 4. Графики зависимости осмотического давления межклеточного вещества (тканевого давления, кривая 1) и гидравлического давления Р в капилляре (кривая 2) от безразмерного параметра х=Р0/Р - обратной величины приведенного гидравлического давления в капилляре, где Р0 - величина капиллярного давления в точке нулевого потока капилляра, соответствующая нулевому значению осмотического давления.
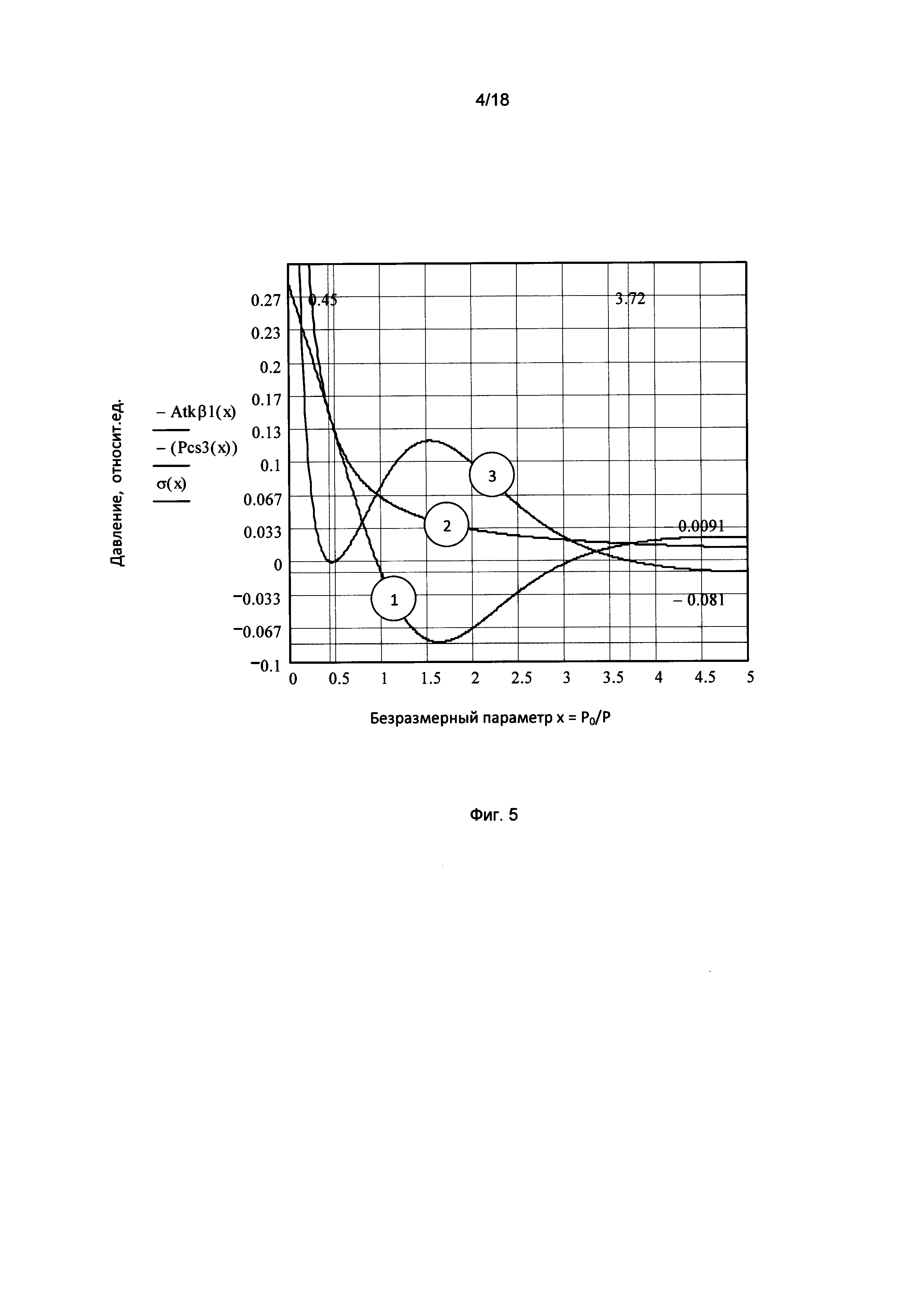
Фигура 5. График зависимости напряжения упругой деформации межклеточного вещества (эластического давления, кривая 3) от гидравлического давления в капилляре в единицах безразмерного параметра х=Р0/Р - обратной величины приведенного гидравлического давления в капилляре, где Р0 - величина капиллярного давления в точке нулевого потока капилляра.
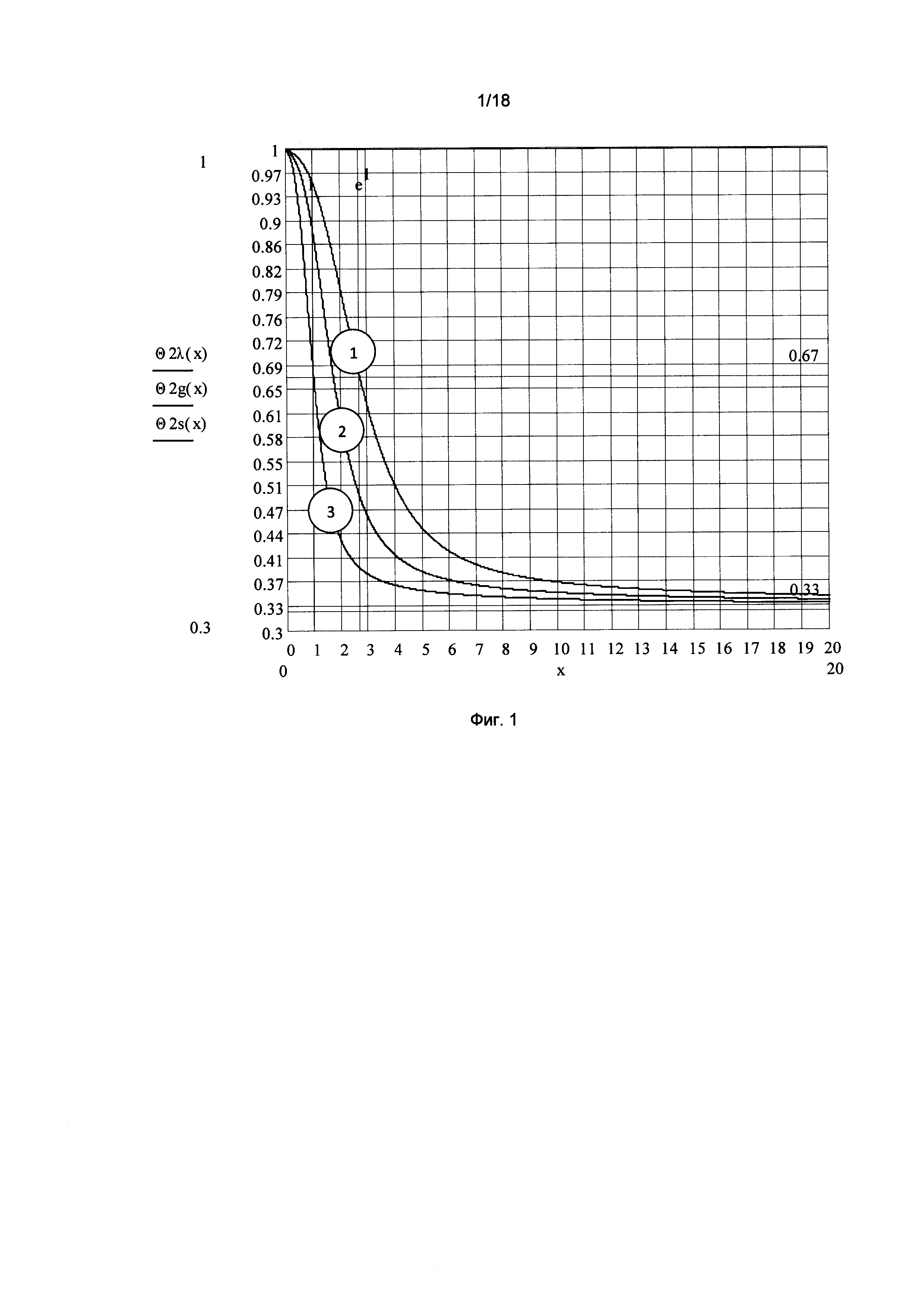
Фигура 6. Графики зависимости осмотического давления межклеточного вещества и гидравлического давления в капилляре в зависимости от обратной величины приведенного давления в капилляре (безразмерного параметра х=Р0/Р) для различных значений концентрации глюкозы в крови. Кривые 1 и 2, и кривые 3 и 4 соответствуют разным значениям концентрации глюкозы соответственно С1 и С2, удовлетворяющим условию С1>С2.
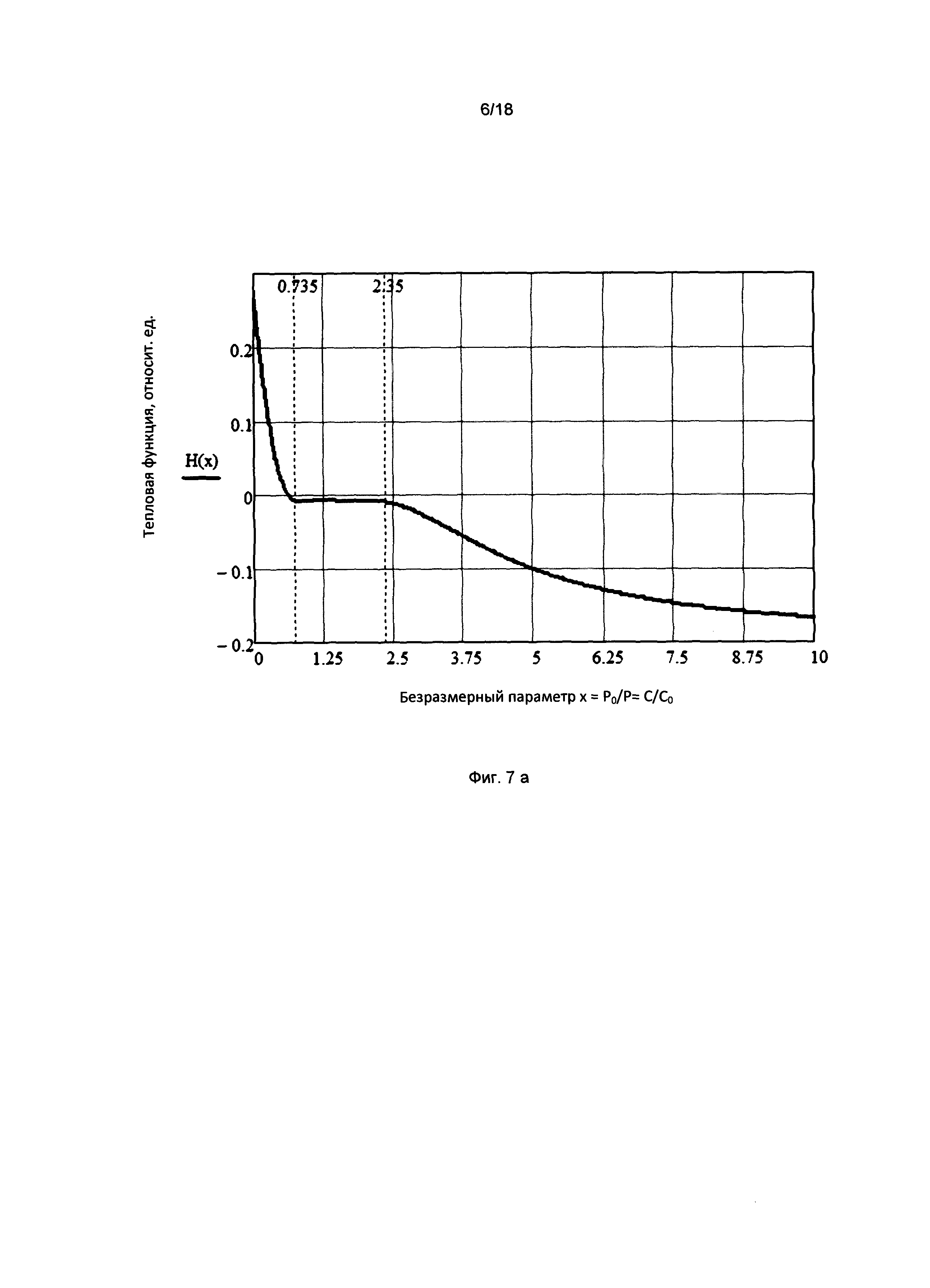
Фигура 7а. График зависимости тепловой функции (теплосодержания, энтальпии) единичного объема межклеточного вещества от концентрации глюкозы и внешнего давления в единицах безразмерного параметра х=С/С0=Р0/Р при постоянной температуре (изотерма).
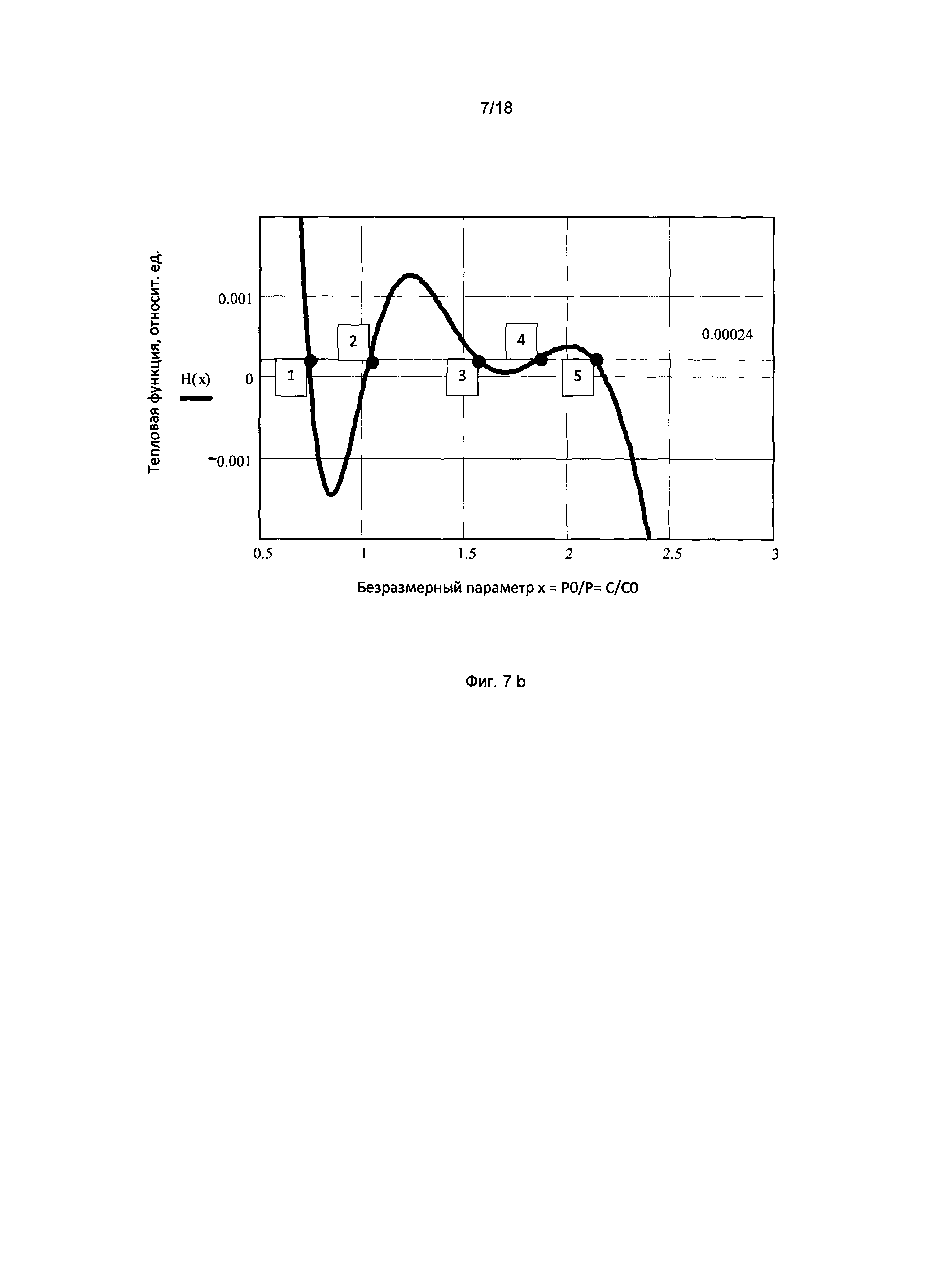
Фигура 7b. График горизонтального участка трехфазной области изотермы межклеточного вещества представлен с более высоким разрешением
Фигура 8. Структура эпидермиса кожи человека.
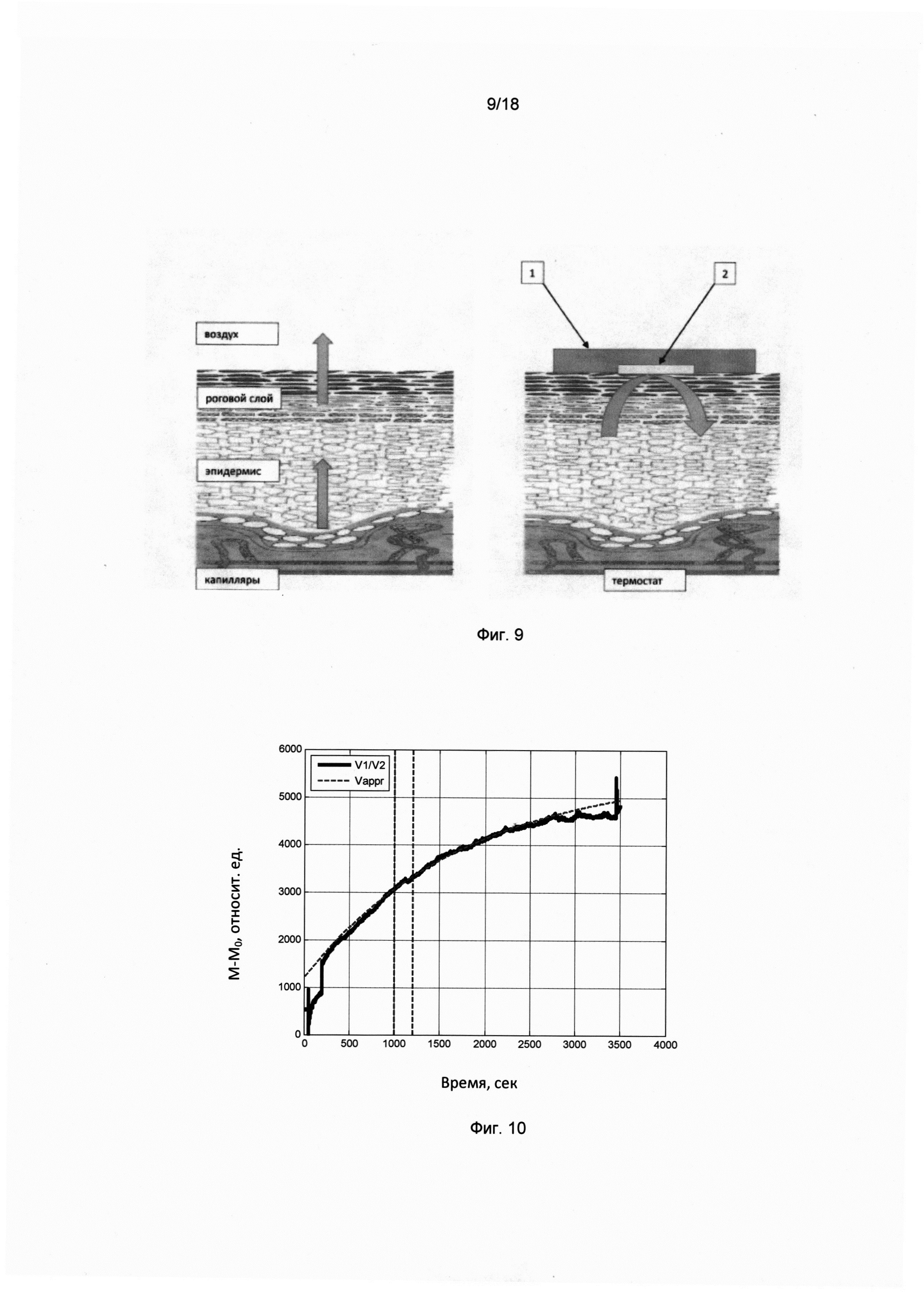
Фигура. 9. Принцип действия микрокалориметра теплового эффекта метаболизма локального участка живой ткани человека.
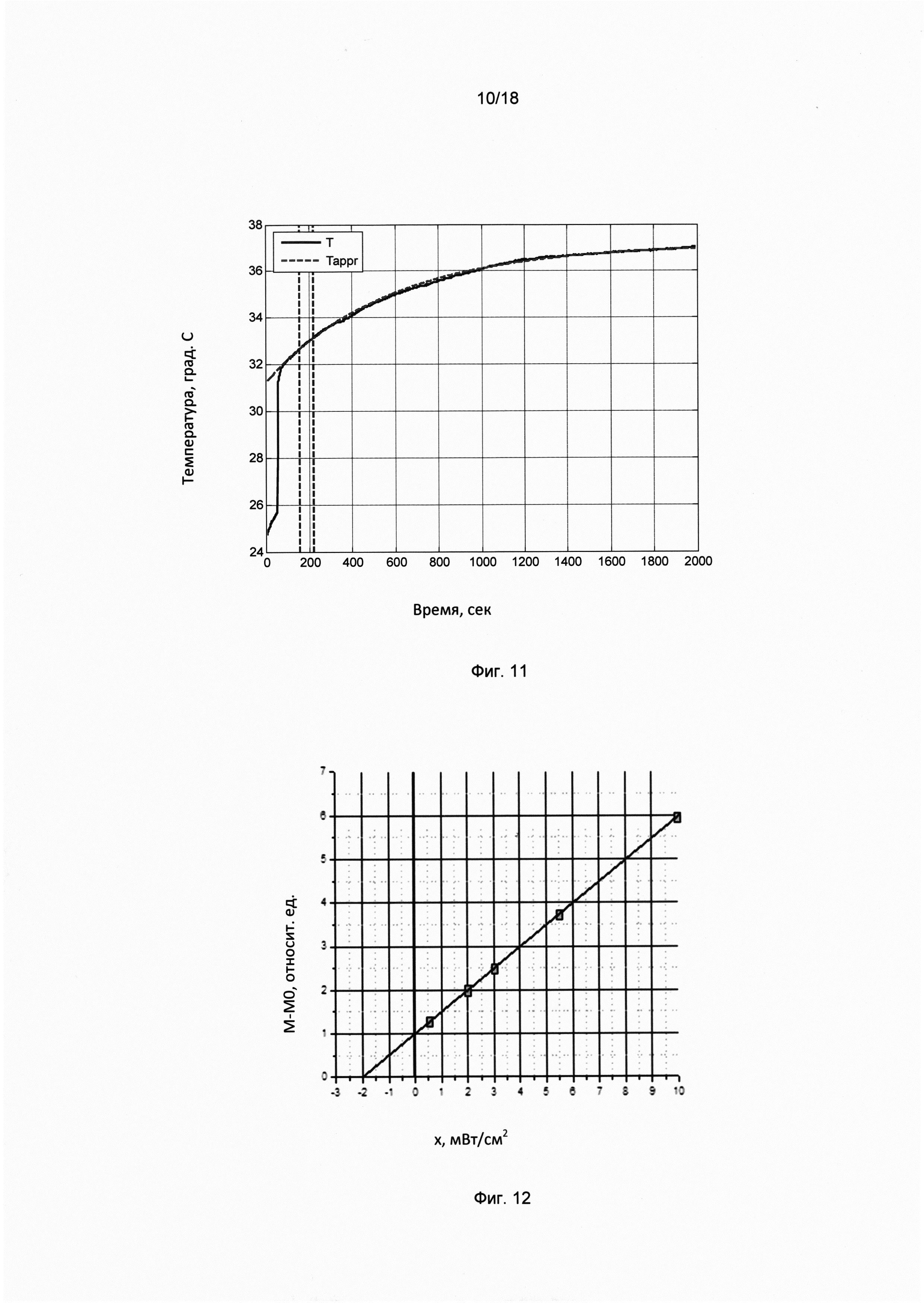
Фигура 10. Характерная временная динамика количества воды в эпидермисе в относительных единицах, обусловленная изменением граничных условий в результате наложения водонепроницаемого аппликатора на поверхность рогового слоя эпидермиса. Штриховой линией показана аппроксимация временной динамики экспонентой.
Фигура 11. Характерная временная динамика температуры поверхности рогового слоя эпидермиса человека после наложения теплонепроницаемого аппликатора (сплошная кривая). Штриховой линией показана аппроксимация временной динамики температуры экспонентом.
Фигура 12. Экспериментальная зависимость количества воды в эпидермисе (в относительных единицах) от величины внешнего теплового потока (мВт/см2). Пунктиром показана линейная аппроксимация этой зависимости в область флуктуаций физиологического параметра, определяющих пороговую мощность.
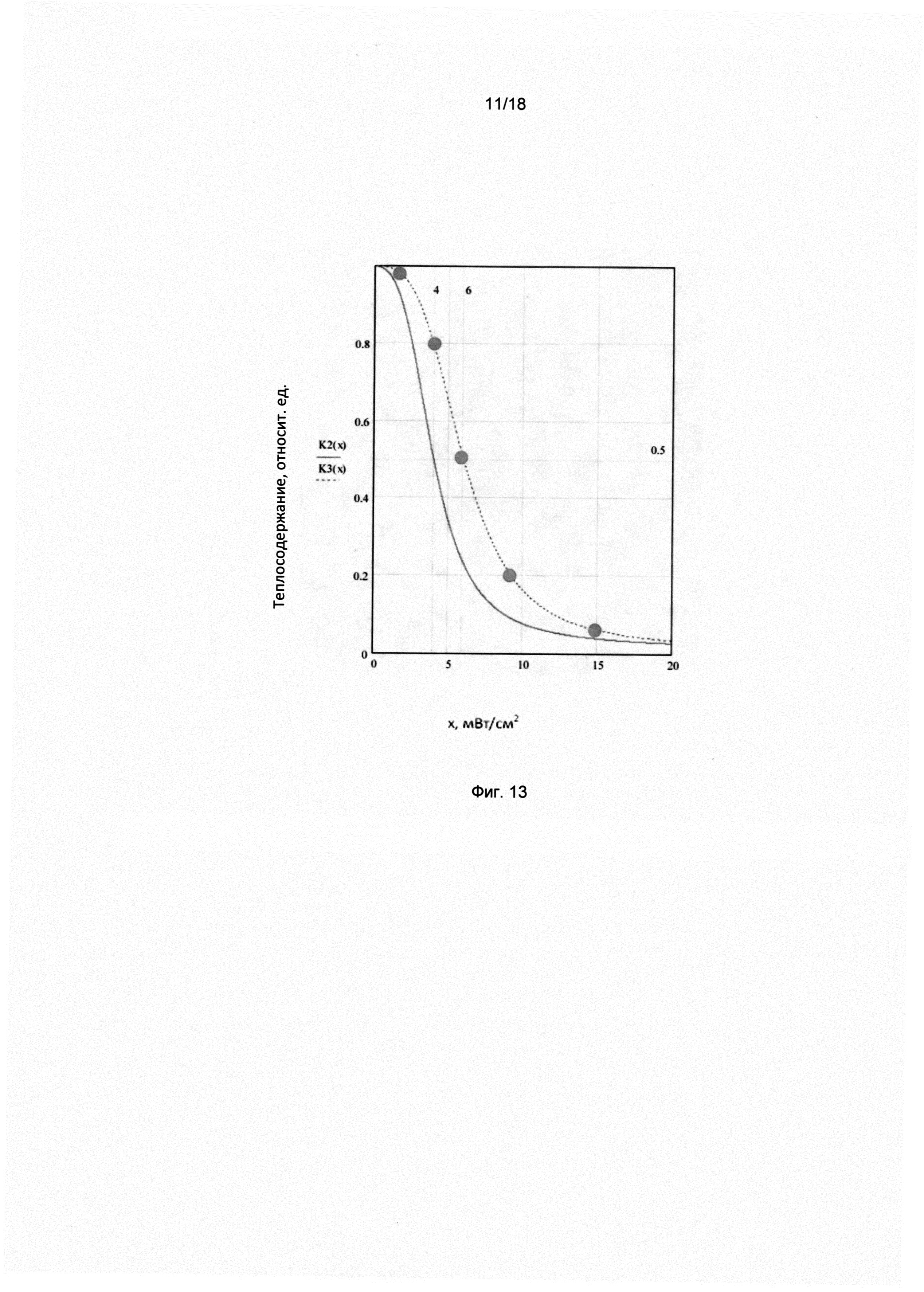
Фигура 13. Экспериментальная зависимость теплосодержания эпидермиса (в относительных единицах) от величины внешнего теплового потока через ограждающую конструкцию (в относительных единицах).
Фиг. 14(a). Схема мультисенсорного устройства для проведения измерений в режиме "климат-контроля".
Фиг. 14(б). Схема мультисенсорного устройства для проведения измерений в режиме "микрокалориметра" для измерения теплового эффекта и скорости метаболизма локального участка ткани.
Фиг. 14(в). Предполагаемые размеры и дизайн внешнего вида коммерческого варианта мультисенсорного устройства, связанного беспроводной связью со смартфоном.
Фигура 15(а). Фотография внешнего вида опытного образца микрокалориметра для неинвазивного измерения уровня сахара в крови и скорости локального метаболизма ткани, б) Фотография прототипа мультисенсорного микрокалориметра для бескровного измерения сахара в крови. Датчик микрокалориметра устанавливается на поверхности кисти руки и прикрепляется с помощью ремешков, снабженных "липучками".
Фигура 15(б) Фотография прототипа измерительной головки мультисенсорного микрокалориметра для бескровного измерения сахара в крови. Аппликатор с датчиками микрокалориметра устанавливается на поверхности кисти руки и прикрепляется с помощью ремешков, снабженных "липучками"
Фигура 16. Мониторинг сахара крови здорового пациента (58 лет, муж.) в течение дня. Временная динамика сахара крови утром натощак. Временная динамика уровня сахара крови практически здорового пациента (55 лет, муж.) в процессе сахарной нагрузки (сахарная кривая), регистрируемая двухканальным неинвазивным микрокалориметром. По оси Y отложены значения сигнала микрокалориметра в единицах ммоль/литр; по оси X отложено время в минутах. Сахарная проба (200 мл. 5% раствора глюкозы) принимается пациентом на 16 минуте эксперимента. Результаты инвазивных замеров, выполненных с помощью сертифицированного промышленного глюкометра "Accu-chec active" фирмы Roche - Diagnostics, показаны на графике кружочками. Абсолютные значения инвазивных замеров в единицах ммоль/литр, равны соответственно 5,4 (15 минута); 6,4 (30 минута); 7,3 (46 минута); 6,6 (60 минута); 5,4 (80 минута) и 5,1 (100 минута). Температура воздуха в комнате 22,4°С.
Фигура 17 (а). Мониторинг сахара крови здорового пациента (58 лет, муж.) в течение дня. Временная динамика сахара крови утром натощак.
По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр. На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 200, 500, 1000, 2000).
Результаты инвазивных замеров в ммоль/литр показаны кружочками: 5,2 (350); 5,3 (1200); 5,4 (2100).
В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера: НТР=25,6/21,5/1007,7
Климатические параметры: -1, 85%, 754, 3,0 м/с, в начале эксперимента; -1, 88%, 757, 2,0 м/с, в конце эксперимента.
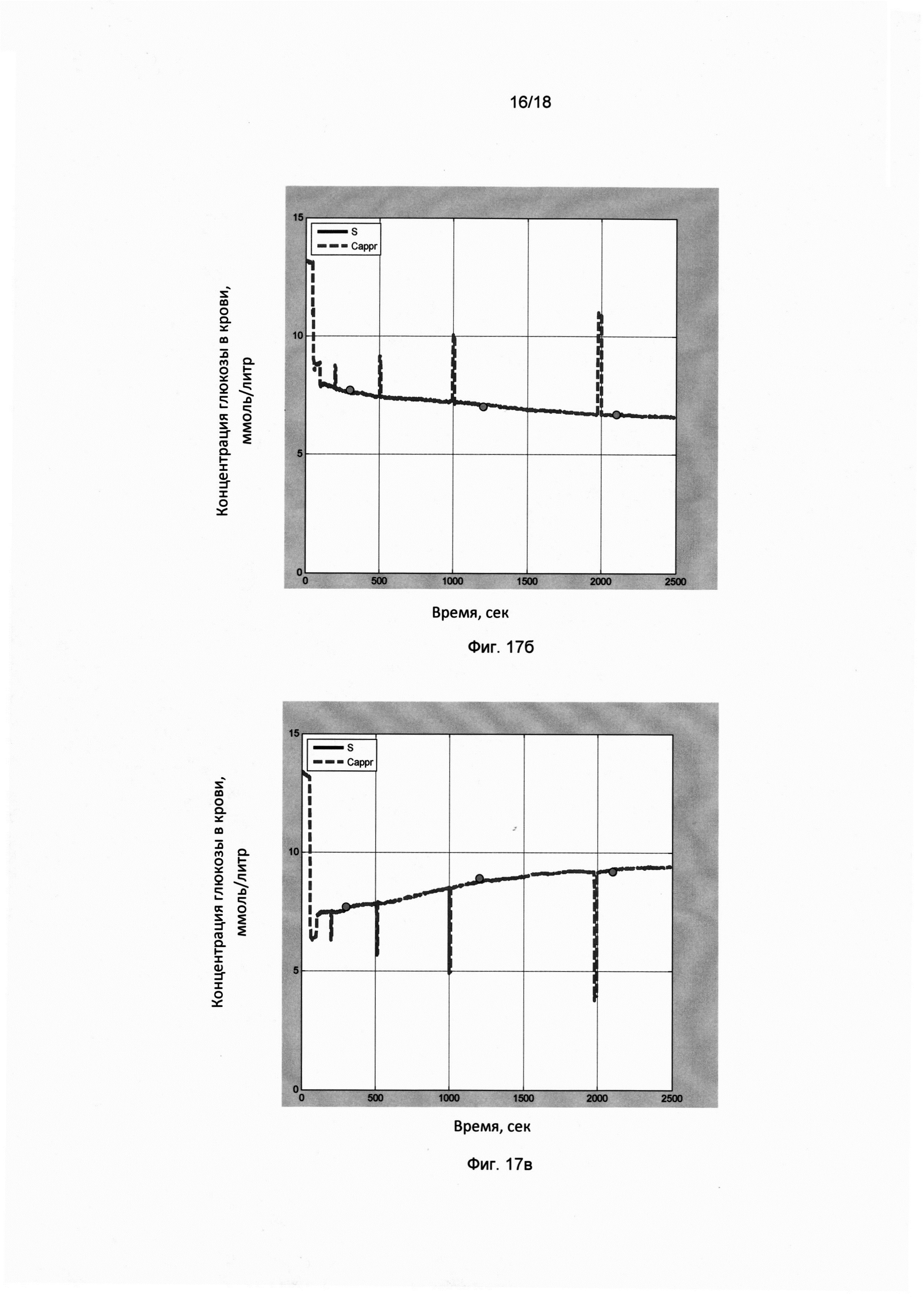
Фигура 17 (б). Мониторинг сахара крови здорового пациента (58 лет, муж.) в течение дня. Временная динамика сахара крови через 1 час после завтрака.
По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр. На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 200, 500, 1000, 2000). Результаты инвазивных замеров в ммоль/литр показаны кружочками: 7,7 (350); 7,0 (1200); 6,7 (2100). В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера:
НТР=23,8/22,2/1009,1
Климатические параметры:
-2, 85%, 756, 6,0 м/с, в начале эксперимента
-3, 84%, 756, 5,0 м/с, в конце эксперимента
Фигура 17 (в). Мониторинг сахара крови здорового пациента (58 лет, муж.) в течение дня. Временная динамика сахара крови через 1 час после обеда.
По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр. На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 200, 500, 1000, 2000). Результаты инвазивных замеров в ммоль/литр показаны кружочками: 7,7 (300); 8,9 (1200); 9,2 (2100). В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера:
НТР=23,8/22,3 /1010,2
Климатические параметры:
-3/84/757/3,0 м/с, в начале эксперимента
-3/78/757/3,0 м/с, в конце эксперимента
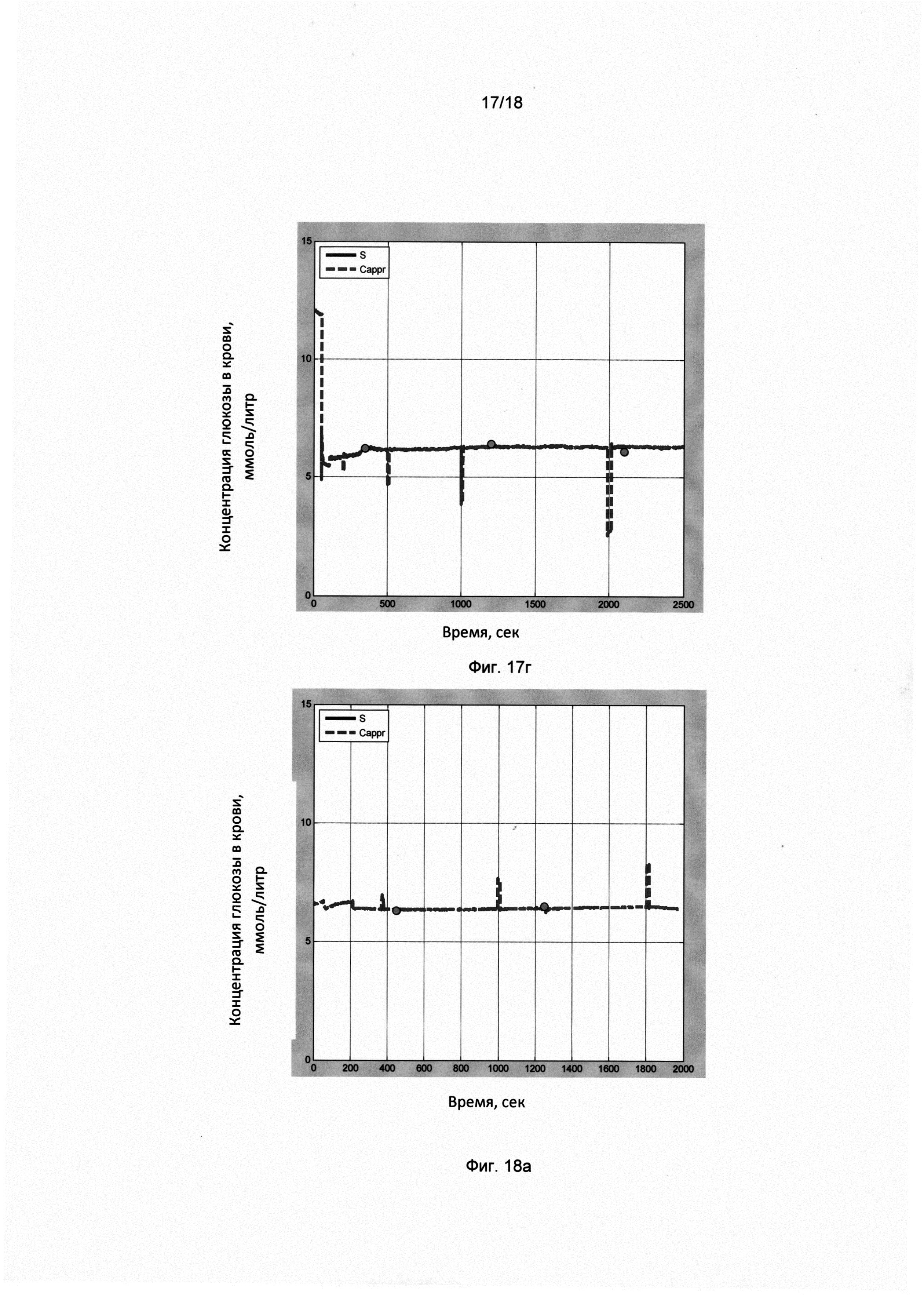
Фигура 17 (г). Мониторинг сахара крови здорового пациента (58 лет, муж.) в течение дня. Временная динамика сахара крови через 2,5 часа после обеда.
По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр. На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 200, 500, 1000, 2000). Результаты инвазивных замеров в ммоль/литр показаны кружочками: 6,2 (350); 6,4 (1200); 6,1 (2100). В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера:
СНТР=23,0/21,7/1011,6
Климатические параметры:
-3/78/757/4,0 м/с, в начале эксперимента
-3/78/757/4,0 м/с, в конце эксперимента
Фигура 18 (а). Временная динамика сахара крови пациента D с диабетом 2 типа (68 лет, муж.) перед обедом.
По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр. На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 400, 1000, 1800). Результаты инвазивных замеров в ммоль/литр показаны кружочками: 6,3 (450); 6,5 (1250). В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера:
СНТР=30,3/26,3/720,0
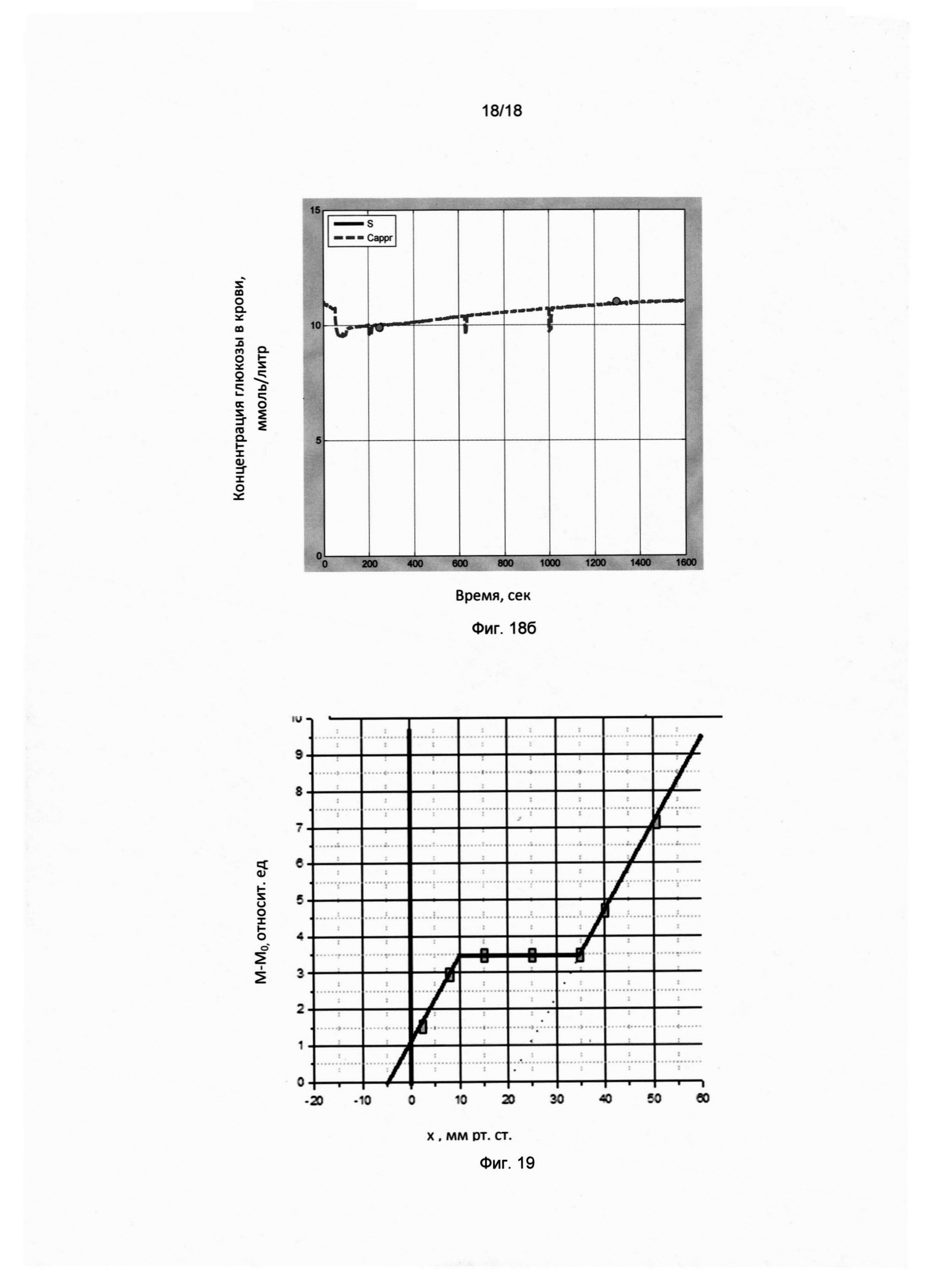
Фигура 18 (б). Временная динамика сахара крови пациента D с диабетом 2 типа (68 лет, муж.) через 1 час после обеда.
По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр. На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 200, 650, 1000). Результаты инвазивных замеров в ммоль/литр показаны кружочками: 9,9 (250); 11,0 (1300). В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера:
СНТР=29,3/26,5/718,0
Фигура 19. Зависимость содержания воды в межклеточной ткани от внешнего давления на поверхность рогового слоя эпидермиса.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Физические основы теплообмена живой ткани с окружающей средой.
Теплообмен представляет собой самопроизвольный и необратимый процесс переноса теплоты, обусловленный градиентом температуры. Различают следующие виды теплообмена: теплопроводность, конвекция, лучистый теплообмен, теплообмен при фазовых превращениях.
Теплоотдача представляет собой теплообмен между поверхностью тела и соприкасающейся с ней средой - теплоносителем (жидкостью, газом).
Испарительное охлаждение представляет собой теплообмен между тканью и окружающей средой, обусловленный испарением воды, поступающей к поверхности эпидермиса из глубинных слоев ткани. Плотность теплового потока, определяется произведением теплоты испарения (теплоты парообразования) на плотность потока воды, испаряющейся с поверхности.
Лучистый теплообмен (радиационный теплообмен, лучистый перенос) представляет собой перенос энергии от одного тела к другому, обусловленный процессами испускания, распространения, рассеяния и поглощения электромагнитного излучения. Каждый из этих процессов подчиняется определенным закономерностям.
Так, в условиях равновесного теплового излучения испускание и поглощение подчиняются закону излучения Планка, закону излучения Стефана-Больцмана, закону излучения Киргоффа.
Существенное отличие лучистого теплообмена от других видов теплообмена (конвекции, теплопроводности) заключается в том, что он может протекать при отсутствии материальной среды, разделяющей поверхности теплообмена, так как электромагнитное излучение распространяется и в вакууме.
Закон излучения Планка устанавливает связь между интенсивностью излучения, спектральным распределением и температурой черного тела. При увеличении температуры, энергия излучения возрастает. Энергия излучения зависит от длины волны. Суммарная энергия, излучаемая черным телом и измеряемая бесконтактным инфракрасным термометром, является суммарной энергией, излучаемой на всех длинах волн. Она пропорциональна интегралу уравнения Планка по длинам волн и описывается в физике законом Стефана-Больцмана.
Закон излучения Стефана-Больцмана, утверждает пропорциональность 4-й степени абсолютной температуры Т полной объемной плотности равновесного излучения:
ρ=а×Т4, где а - постоянная,
и, связанной с ней, полная испускательная способность WR:
WR=β×Т4, где β - постоянная Стефана-Больцмана.
Лучистый теплообмен между поверхностью ткани и окружающей средой определяется соотношением:
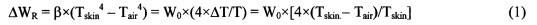
ΔT〈〈Tskin,
Tskin - температура поверхности кожи,
Тair - температура окружающего воздуха.
W0=β×Tskin4.
ΔWR - тепловое излучение с поверхности ткани в окружающую среду.
Теплопроводность представляет собой один из видов переноса теплоты от более нагретых частей тела к менее нагретым. Теплопроводность приводит к выравниванию температуры. При теплопроводности перенос энергии осуществляется в результате непосредственной передачи энергии от частиц, обладающих большей энергией, частицам с меньшей энергией. Если относительное изменение температуры Т на расстоянии средней длины свободного пробега частиц мало, то выполняется основной закон теплопроводности (закон Фурье): плотность теплового потока пропорциональна градиенту температуры ΔT:

где λ - коэффициент теплопроводности или теплопроводность, не зависящий от ΔТ. Коэффициент λ зависит от агрегатного состояния вещества, его молекулярного строения, температуры, давления, состава и т.д.
Конвекция представляет собой перенос теплоты в жидкостях и газах потоками вещества. Конвекция приводит к выравниванию температуры вещества. При стационарном подводе теплоты к веществу в нем возникают стационарные конвекционные потоки. Интенсивность конвекции зависит от разности температур между слоями, теплопроводности и вязкости среды.
Испарительное охлаждение, как было отмечено выше, представляет собой теплообмен между тканью и окружающей средой, обусловленный испарением воды, поступающей к поверхности эпидермиса из глубинных слоев ткани посредством транспорта воды по межклеточному пространству. Плотность теплового потока определяется произведением теплоты испарения (теплоты парообразования) на плотность потока воды, испаряющейся с поверхности.
Как известно, в комфортной зоне температур в нормальных условиях транспорт воды посредством потоотделения практически отсутствует и основной вклад в процесс испарительного охлаждения определяется транспортом воды к поверхности тела. В физиологии и медицине этот процесс известен как процесс неощутимой перспирации [16].
Неощутимая перспирация воды наблюдается в диапазоне температур, в котором у испытуемого не возникает субъективных тепловых ощущений (комфортный температурный диапазон):
Температура окружающей среды: 18-23°С,
Атмосферное давление: 730-770 мм рт. столба.
Известно, что интенсивность процесса испарительного охлаждения в комфортных условиях в норме составляет 400-700 мл/сутки или 10-8-10-7 г/сек×см2. Это соответствует значениям тепловых потоков 1-10 мВт/см2.
Известно, что физиологический процесс неощутимой перспирации обладает высокой чувствительностью к внешним тепловым потокам [10-15]. Порог чувствительности процесса к тепловым потокам составляет 0,1 мВт/см2, что эквивалентно чувствительности процесса к перепадам температуры внешней среды, равным 0,005 градуса.
Важным следствием высокой чувствительности физиологического процесса неощутимой перспирации к внешним тепловым потокам, имеющим практическое значение, является зависимость физических характеристик эпидермиса кожи человека от внешних физико-климатических факторов, в частности, от температуры и влажности окружающей среды и атмосферного давления. В частности, результаты измерений физиологического параметра эпидермиса кожи человека - скорости неощутимой перспирации, при неизменных значениях микроклимата помещения, в котором проводятся измерения, оказываются зависящими от физико-климатических факторов окружающей среды (температура и влажность окружающей среды, атмосферное давление). Низкочастотные флуктуации температуры внешнего воздуха в пределах даже одного градуса, при неизменных параметрах микроклимата помещения, в котором проводится измерение, приводят к значимым низкочастотным флуктуациям измеряемого физиологического параметра и, как следствие, увеличению погрешности измерений.
Физические механизмы процесса переноса воды к поверхности тела, обеспечивающего поддержание теплового баланса локального участка ткани, рассмотрены ниже в разделе "Основные положения физики межклеточного вещества: процессы переноса в эпидермисе".
Физиологические и биохимические основы теплопродукции живой ткани
Процесс окисления глюкозы, одного из основных поставщиков энергии в организме, может быть представлен в виде следующего уравнения:
Глюкоза + Кислород⇒СO2+Н2O.
Изменение стандартной свободной энергии в этой реакции при физиологических условиях равно:
ΔG=-686000 кал/моль.
Для сравнения, мужчина весом в семьдесят килограмм, поднимаясь по лестнице в течение часа, затрачивает примерно 1000000 кал. Отсюда ясно, что упомянутые выше 686000 кал представляют собой огромное количество энергии. Разумеется, работа, производимая человеком, значительно меньше расходуемой при этом энергии, так как при необратимом процессе не все изменение свободной энергии преобразуется в работу. Реальная эффективность этого преобразования, как будет пояснено ниже, не выше 40%. Более того, пища не "сгорает" сразу и непосредственно в кислороде, высвобождая энергию в форме тепла, а это высвобождение происходит поэтапно и включает ряд довольно сложных химических превращений, каждая из которых дает небольшую "порцию" энергии.
Глюкоза окисляется в организме, образуя диоксид углерода и воду; это один из самых универсальных процессов, который лежит в основе процессов дыхания и пищеварения.
При разрушении каждой молекулы глюкозы, сопровождающемся понижением свободной энергии, высвобождается энергия, достаточная для образования 93 молекул АТФ путем присоединения фосфатных групп к молекулам АДФ. Оказывается, что реально образуются не все 93 молекулы. При этом весь процесс включает большое число ферментативных реакций. Питательные вещества (углеводы, жирные кислоты и аминокислоты) вступают в серию реакций, образующих цикл Кребса (или цикл трикарбоновых кислот), в процессе которого углеродный остов молекул распадается с образованием СO2, но АТФ здесь не образуется. На следующих этапах реакции происходит перенос электронов с помощью специальных ферментов (дыхательная цепь). На этих этапах синтезируется АТФ, а последний шаг на пути длительного процесса переноса электрона заключается в присоединении его к молекулярному кислороду. Процесс переноса электрона по дыхательной цепи в целом, приводящий к накоплению энергии в молекулах АТФ, называется окислительным фосфорилированием. В результате этого процесса образуется 38 молекул АТФ в расчете на каждую потребленную молекулу глюкозы. Эффективность такого преобразования равна 38/93=40%.
Величину теплопродукции, или тепловой мощности, организма можно количественно оценить исходя из следующих простых соображений.
Энергетическая ценность питания человека составляет около 2400 ккал в сутки. В первом приближении, 2400ккал=104 Дж, 1 сутки (24 часа)=86400 секунд=105 секунд.
Тогда энергия, потребляемая организмом человека в секунду, составит 104/105=0,1 кДж×с-1 или 100 Дж×с-1=100 Вт; следовательно, тепловая мощность человека приблизительно равна мощности электрической лампочки, имеющей мощность 100 Вт.
При мышечном сокращении АТФ, донор энергии для процесса мышечного сокращения, в ходе реакции с миозином позволяет получать максимум 50 Дж×г-1 энергии. Это означает, что идеальной мышечной системе (т.е. с коэффициентом полезного действия, равным 100%) для подъема груза массой 1 кг на высоту 5 м понадобилось бы израсходовать 2×10-3 моль АТФ. На самом деле, коэффициент полезного действия мышц составляет около 30-40%, остальная же часть высвобождается в виде тепла.
В нормальных условиях жизнедеятельности организма глюкоза является основным энергетическим субстратом. Нормальная концентрация глюкозы в плазме крови человека, в зависимости от условий питания, поддерживается в пределах 50-120 мг %. После еды, в течение фазы всасывания, концентрация глюкозы в системе воротной вены может достигать более 270 мг %. Повышение содержания глюкозы в крови всегда вызывает увеличение секреции инсулина.
В организме человека в состоянии покоя натощак скорость обмена глюкозы составляет в среднем 140 мг/ч на 1 кг массы тела, причем примерно 50% глюкозы потребляется головным мозгом, 20% - мышцами, 20% - эритроцитами и почками, 20% -мышцами и только 10% глюкозы остается на другие ткани.
Скорость утилизации (скорость обмена) глюкозы у здорового человека является линейной функцией концентрации глюкозы в плазме крови. Математическая зависимость утилизации глюкозы от ее концентрации в крови у нормальных людей выражается уравнением:

А у больных некетотическим диабетом:

где Ru - скорость утилизации глюкозы, мг/ мин на 1 кг массы тела, а С - концентрация глюкозы в плазме крови, мг %, [Reichard G.A. et al., 1963; Forbath N., Hetenui C, 1966; Moorhouse J.A., 1973; Moorhouse J.A., et all., 1978; Hall S. E. H. et all., 1979., [2, 8, 9].
Термин "утилизация" глюкозы в физиологическом смысле означает скорость переноса глюкозы из крови в общий фонд глюкозы тканей и выхода из него в процессе метаболизма. С биохимической точки зрения скорость утилизации глюкозы определяется транспортом через цитоплазматическую мембрану и внутриклеточным окислительным фосфорилированием глюкозы. Широко распространенные в литературе термины "скорость оборота", "ассимиляция" и "потребление" глюкозы являются синонимами понятия "утилизация" глюкозы и в любом отношении равнозначны.
Практически во всех тканях в физиологических условиях транспорт глюкозы из межклеточной среды во внутрь клетки представляет собой первичную лимитирующую реакцию в утилизации глюкозы клетками, так как в отсутствие инсулина поток переносимой глюкозы всегда меньше скорости фосфорилирования глюкозы. Равновесие между скоростью транспорта и фосфорилированием глюкозы наступает только при больших концентрациях глюкозы (400-500 мг %). При дальнейшем увеличении концентрации глюкозы лимитирующей реакцией становится фосфорилирование [2]. Другими словами, скорость транспорта глюкозы из межклеточной среды через цитоплазматическую мембрану во внутриклеточную среду является процессом, лимитирующим скорость утилизации глюкозы живой тканью.
Исходя из сделанного выше рассмотрения, представляется логичным и вполне обоснованным заключение о том, что теплопродукция, также, как и скорость утилизации глюкозы, является линейной функцией концентрации глюкозы в крови и, измерение величины локальной теплопродукции позволяет определить уровень глюкозы в крови.
Феноменологическое уравнение теплового баланса живой ткани
В динамически равновесном (стационарном) естественном состоянии живой ткани тепловой баланс между вырабатываемым теплом (теплопродукцией) WMET, и теплом, отдаваемым в окружающую среду, обеспечивающий постоянство температуры ткани, в общем случае описывается феноменологическим уравнением:
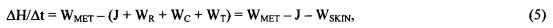
где
WMET - теплопродукция;
WSKIN=WR+WT+WC;
WR - теплоотдача посредством излучения (лучистый теплообмен),
WC - теплоотдача посредством конвекции,
WT - теплоотдача с поверхности эпидермиса посредством теплопроводности,
J - теплоотдача посредством испарения в процессе неощутимой перспирации (испарительное охлаждение),
Н - энтальпия (теплосодержание) поверхностного слоя живой ткани.
В уравнении (5), имеющим экспериментальное обоснование, учитывается, что тепловой поток, соответствующий разнице между теплопродукцией WMET и теплоотдачей J+WSKIN, равен скорости изменения теплосодержания ΔH/Δt поверхностного слоя живой ткани, соответствующего величине теплового потока, который поглощается эпидермисом в процессе теплопереноса.
В процессе исследований, проведенных нами, была экспериментально изучена зависимость процесса терморегуляции локального участка ткани от физиологических и физико-климатических параметров (переменных состояния) и установлена функциональная зависимость (уравнение состояния), связывающая между собой параметры (переменные состояния), однозначно определяющие термодинамическое поведение живой ткани.
Экспериментальным путем было установлено [10-15], что межклеточное вещество живой ткани является своеобразным природным изотермическим микрокалориметром тепловой мощности, обеспечивающим тепловой баланс локального участка ткани с окружающей средой:
ΔJ=ΔW при С=С0=const.
Изменение (увеличение) мощности теплового потока испарительного охлаждения AJ (при постоянном уровне сахара С=С0=const) равно изменению (увеличению) мощности теплового потока ΔW, обусловленного изменением климатических факторов внешней среды.
Экспериментальная зависимость мощности испарительного охлаждения J (относительных единицах) от мощности внешнего теплового потока W (мВт/см2), исследованная в работах [10-15] с помощью высокочувствительного неинвазивного метода измерения микро-потоков воды в процессе неощутимой перспирации через эпидермис [10-15], показана на фиг. 12.
Линейная аппроксимация экспериментальной зависимости в область собственных физиологических флуктуаций процесса неощутимой перспирации позволяет определить пороговую чувствительность эпидермиса кожи к тепловым потокам, которая оказалась равной 0,1 мВт/см2. Полученное пороговое значение тепловой чувствительности эквивалентно значению мощности испарительного охлаждения порядка пиколитра в секунду с квадратного сантиметра поверхности тела (10-12 литров/с×cм2).
Принципиально новые возможности и подходы, позволившие создать микрокалориметрический метод измерения теплового эффекта метаболизма живой ткани путем высокоточного измерения микро-потоков тканевой жидкости в межклеточном пространстве эпидермиса (метод контроля микрогидродинамики межклеточного вещества), открылись благодаря фундаментальным исследованиям в области физики межклеточного вещества и живой ткани, выполненным авторами проекта, основные положения которой описаны ниже.
Вполне очевидно, что свойство терморегуляции локального участка живой ткани, описанное выше, согласуется с уравнением теплового баланса (5), имеющим экспериментальное обоснование, при условии, что энтальпия живой ткани H(t) является физиологическим термодинамическим параметром, величина которой сохраняется постоянной при изменениях внешних климатических тепловых параметров и внутренних физиологических параметров, определяющих интенсивность метаболизма локального участка живой ткани.
Физика межклеточного вещества: основное предположение физической модели.
С целью объяснения особенностей термодинамического поведения живой ткани, наблюдаемых в эксперименте, в частности, высокой чувствительности живой ткани к внешним тепловым потокам (обусловленным вариациями климатических факторов внешней среды) и уникального свойства физической терморегуляции локального участка живой ткани было выполнено теоретическое исследование.
Теоретическое исследование проведено в рамках физической модельной системы, рассматривающей межклеточное вещество (основными структурными компонентами которого являются полимерная молекулярная цепь гиалуроновой кислоты, морская вода и глюкоза) как, статистическую систему, состоящую из большого числа взаимодействующих частиц. Физическую модель межклеточного вещества, позволяющую описать термодинамическое поведение и рассчитать ее статистические свойства, можно сформулировать следующим образом:
открытая система, состоящая из полимерной молекулярной цепи гиалуроновой кислоты, локализованной в резервуаре с морской водой, содержащей глюкозу, связанном с термостатом и находящимся в тепловом и диффузионном контакте с атмосферой.
Основным и единственным предположением модели является допущение, что межклеточное вещество живой ткани при нормальной физиологической температуре и нормальном атмосферном давлении находится вблизи границы устойчивости в области фазового перехода. Такое допущение, как оказалось, приводит к предсказаниям, которые хорошо согласуются с опытом.
Исследовалось термодинамическое поведение системы вблизи границы устойчивости, определяемой критической температурой упорядочения, которая в энергетических единицах равна по порядку величины характерной энергии взаимодействия между частицами системы. В рассматриваемом случае, из условия фазового перехода (близости границы устойчивости) следует, что энергия взаимодействия не соседних звеньев молекулярной цепи, которые хотя и отстоят по цепи далеко друг от друга, но случайно встретились в пространстве в результате изгибов цепи, равна кванту тепловой энергии kБТ.
Предположение модели, что межклеточное вещество живой ткани при нормальной физиологической температуре и нормальном атмосферном давлении находится в области фазового перехода вблизи границы устойчивости, равносильно, таким образом, допущению, что физиологическая температура соответствует критической температуре, которая в энергетических единицах равна по порядку величины характерной энергии взаимодействия между звеньями полимерной цепи.
Объемные взаимодействия не соседних звеньев цепи (отстоящих по цепи далеко друг от друга), следствием которых являются объемные эффекты макромолекулы, описываются, как сопряженные биохимические реакции, которые протекают с нулевым тепловым эффектом и приводят к образованию сшивок с энергией связи kБТ и изменению объема; в этом случае, кинетика химической реакции описывается, как адсорбция (связывание с тепловой энергией связи) отдельных ионов натрия и молекул глюкозы на "псевдо-узлах", имеющих 4 места связывания.
В рамках исследуемой статистической модели удалось получить точное решение для энергии межмолекулярного взаимодействия и точно рассчитать статистические свойства системы, в частности, определить термодинамические функции тканевого давления (осмотического давления межклеточного вещества) и напряжения упругой деформации межклеточной ткани (эластического давления) в зависимости от макроскопических переменных состояния межклеточного вещества: концентрации глюкозы в крови, внешнего давления и температуры.
Некоторые результаты, проведенного нами теоретического исследования, представлены в виде графиков термодинамических функций. В частности, здесь представлены графики функций (без рассмотрения аналитического выражения самих функций), описывающих тканевое (осмотическое) давление, объем, напряжение эластической деформации и теплосодержание межклеточного вещества в зависимости от переменных состояния - концентрации глюкозы (С), температура (Т), внешнего давления (Р).
На фигуре 1 представлены графики зависимости объема межклеточного вещества от концентрации сахара С в единицах безразмерного параметра х=С/С0, при фиксированных значениях двух других переменных состояния (давления Р=Р0 и температуры окружающей среды Т=Т0) для разных значений внешнего давления Р0, где С0 - концентрация глюкозы, соответствующая нулевому значению осмотического давления. Кривые 1, 2 и 3 соответствуют разным значениям внешнего давления Р01, Р02, Р03, удовлетворяющим условию: Р01<Р02<Р03. Как следует из графика, при повышении концентрации глюкозы происходит уменьшение объема системы, обусловленное образованием сшивок между не соседними звеньями цепи, отстоящими по цепи далеко друг от друга.
На фигуре 2 представлен график зависимости осмотического давления межклеточного вещества (тканевого давления) от безразмерного параметра х=С/С0=Р0/Р при фиксированных значениях двух других переменных состояния (внешнего давления Р=Р0 и температуры окружающей среды Т=Т0), где С - концентрация глюкозы в крови; С0 - концентрация глюкозы, соответствующая нулевому значению осмотического давления; Р - гидравлическое давление в капилляре; Р0 - давление в капилляре, соответствующее нулевому значению осмотического давления.
Как следует из графика, при повышении концентрации глюкозы происходит уменьшение осмотического давления вещества, которое в точке х=1 (С=С0) становится равным нулю и принимает отрицательные значения в интервале концентраций [1, е].
На фигуре 3 схематично показано изображение характерного структурного элемента локальной области живой ткани, основными структурными элементами которой являются клетки, межклеточное вещество и система кровеносных капилляров и микрососудов, образующих систему микроциркуляции локальной области живой ткани. Физика межклеточного вещества, основанная на предположении, что физиологическая температура ткани соответствует критической температуре, которая в энергетических единицах равна величине характерной энергии взаимодействия между звеньями полимерной цепи, позволяет описать явления переноса энергии и вещества (микроциркуляция, терморегуляция, клеточный метаболизм), образующие единый физиологический процесс самоорганизации (само-регуляции) локального объема живой ткани.
На фигурах 4-6 ниже представлены графики основных термодинамических функций, описывающих явления переноса в локальном объеме живой ткани, в частности, явление микроциркуляции крови, в частности, потоки тканевой жидкости между капилляром и межклеточным пространством.
На фигуре 4 ниже представлены графики зависимостей осмотического давления межклеточного вещества (тканевого давления, кривая 1) и гидравлического давления Р в капилляре (кривая 2) от безразмерного параметра х=Р0/Р - обратной величины приведенного гидравлического давления в капилляре, где Р0 - величина капиллярного давления в точке нулевого потока капилляра, соответствующая нулевому значению осмотического давления.
Графики имеют две общие точки: "а" (артериальный конец капилляра) - точка касания двух графиков; "в" (венозный конец капилляра) - точка пересечения двух графиков. В точках "а" и "в" давление внутри капилляра равно тканевому давлению (осмотическому давлению межклеточной ткани). В интервале внешних давлений [а, 1] (область высоких давлений) тканевое давление принимает положительные значения. В этом диапазоне давлений происходит набухание основного вещества и растяжение межклеточной ткани (увеличение объема). В интервале внешних давлений [1, 3] тканевое давление принимает отрицательные значения. В этом диапазоне внешних давлений происходит дегидратация и сжатие межклеточной ткани (уменьшение объема).
В интервале внешних давлений [3, в] (область низких давлений) тканевое давление принимает положительные значения. В этом диапазоне давлений происходит набухание основного вещества и растяжение межклеточной ткани. Степень набухания межклеточного вещества определяется количеством воды в объеме межклеточной ткани. Особые точки, в которых внутреннее давление в капилляре равно тканевому давлению межклеточной ткани, определяют диапазон давлений внутри капилляра, между его входом и выходом. Точка "в" определяет значение минимального (выходного) гидравлического давления внутри капилляра, а точка "а" значение максимального давления или давления на входе в капилляр. Такой характер зависимости тканевого давления межклеточного вещества от величины внешнего давления (при фиксированном значении концентрации глюкозы) приводит к возникновению неравномерного распределения напряжения упругой деформации (эластического давления) вдоль кровеносных сосудов и капилляров, в частности.
На фигуре 5 представлена зависимость напряжения упругой деформации межклеточного вещества (эластического давления, кривая 3) от гидравлического давления в капилляре в единицах безразмерного параметра х=Р0/Р - обратной величины приведенного гидравлического давления в капилляре, где Р0 - величина капиллярного давления в точке нулевого потока капилляра.
Зависимость осмотического и эластического давлений межклеточной ткани от величины гидравлического давления в капилляре имеет следующие характерные особенности:
1. Разница между капиллярным и тканевым давлениями уравновешивается эластическим давлением (напряжением упругой деформации межклеточной ткани). В этом смысле, капилляр не является трубкой, упругая оболочка которой уравновешивает внутри капиллярное давление, а представляет тоннель в межклеточной ткани, упругая деформация и тканевое давление которой уравновешивают внутри капиллярное давление.
2. Нелинейный характер зависимости напряжения упругой деформации в окрестности точки "а" (вход капилляра), приводит к образованию сужения по типу "bottle neck" ("бутылочное горло"). Просвет капилляра увеличивается в направление к его венозному концу, несмотря на уменьшение гидравлического давления в капилляре. Такое сужение оказывает основное гидравлическое сопротивление потоку через капилляр, определяет его пропускную способность и приводит к существенному падению гидравлического давления на начальном участке капилляра.
3. Область высоких (артериальных) давлений расположена слева от точки "а", а область низких (венозных) давлений расположена справа от точки "в".
4. Механическое равновесие оболочки капилляра (стенка тоннеля) определяется равновесием между гидравлическим давлением в капилляре и осмотическим и эластическим давлением межклеточной ткани.
Условие механического равновесия в точке "а" имеет вид:
тканевое давление (осмотическое давление) = гидравлическое давление внутри капилляра. Напряжение упругой деформации (эластическое давление) = нулю.
Изменение уровня сахара в крови приводит к нарушению механического равновесия и возникновению напряжения упругой деформации, неуравновешенной внутри капиллярным гидравлическим давлением.
Увеличение уровня сахара крови приводит к уменьшению площади сечения (просвета) капилляра в точке "а" на входе, обусловленное сжатием окружающей капилляр ткани, в следствие уменьшения осмотического давления межклеточного вещества.
Уменьшение площади сечения капилляра на входе приводит к увеличению гидравлического сопротивления потоку и, как следствие, увеличению давления на входе в капилляр (в точке "а"). Увеличение давления в капилляре, обусловленное увеличением концентрации сахара, приводит к переходу межклеточного вещества с состояние с новым значением осмотического давления, соответствующего новым значениям констант равновесия С0 и Р0, которые совпадают со значениями концентрации и давления в точке х=1 (С=С0, Р=Р0). Механическое равновесие устанавливается после выравнивания тканевого и капиллярного давления на входе в капилляр. Этот процесс приводит к изменению равновесных распределений гидравлического давления в капилляре и эластического давления межклеточной ткани в направление к венозному концу капилляра. Установление механического равновесия в точке "а" приводит к установлению равновесия по всей длине капилляра.
На фигуре 6 представлены графики зависимостей равновесного распределения осмотического давления межклеточного вещества и гидравлического давления в капилляре в зависимости от обратной величины приведенного давления в капилляре (безразмерного параметра х=Р0/Р) для различных значений концентрации глюкозы в крови. Кривые 1 и 2, и кривые 3 и 4 соответствуют разным значениям концентрации глюкозы соответственно С1 и С2, удовлетворяющим условию C1>С2.
Особенностью полученных зависимостей является то, что при повышении уровня сахара в крови положение точек, в которых напряжение упругой деформации межклеточной ткани равно нулю, (точки "а" и "в") на оси абсцисс остается неизменным. Это означает, что происходит пропорциональный рост давления внутри капилляра во всех точках, на протяжении от входа до выхода капилляра. Входное давление (максимальное давление в системе) и выходное давление (минимальное давление в системе), также, как и давление в любой другой точке внутри капилляра, являются линейными функциями от уровня сахара в крови, а отношение Рmах/Рmin=Ра/Рв=3,72/0,46=8,087 при этом сохраняется постоянным.
Физика межклеточного вещества: терморегуляция живой ткани
Как было показано выше, свойство терморегуляции локального участка живой ткани согласуется с уравнением теплового баланса (5) при условии, что теплосодержание живой ткани H(t) является физиологическим параметром, величина которого остается постоянной при изменениях внешних климатических параметров окружающей среды и внутренних физиологических параметров, определяющих интенсивность метаболизма локального участка живой ткани.
Основное предположение исследованной модели заключается в том, что межклеточное вещество живой ткани в своем нативном состоянии находится в области термодинамического фазового перехода вблизи границы устойчивости, которое реализуется при температуре, равной в энергетических единицах энергии взаимодействия между звеньями полимерной цепи, и соответствует (при нормальном атмосферном давлении) нормальной физиологической температуре живой ткани.
Объемные взаимодействия не соседних звеньев цепи (отстоящих по цепи далеко друг от друга), следствием которых являются объемные эффекты макромолекулы, описываются, как сопряженные биохимические реакции, которые протекают с нулевым тепловым эффектом и приводят к образованию "сахарных" сшивок с энергией связи kБT и изменению объема; в этом случае, кинетика химической реакции описывается, как адсорбция (связывание с тепловой энергией связи) отдельных ионов натрия и молекул глюкозы на "псевдо-узлах", имеющих 4 места связывания.
Одним из важных следствий, вытекающих из основного предположения статистической модели, описанной выше, является точное решение для энергии межмолекулярного взаимодействия и энтальпии межклеточного вещества.
На фигуре 7а представлен график зависимости тепловой функции (теплосодержания, энтальпии) единичного объема межклеточного вещества от концентрации глюкозы и внешнего давления в единицах безразмерного параметра х=С/С0=Р0/Р при постоянной температуре (изотерма). Следует отметить, что процессы переноса вещества и энергии в живой ткани происходят за счет перераспределения воды между кровеносной системой микрокапилляров и межклеточным пространством без изменения объема живой ткани, характеристикой которой является тепловая функция единичного объема.
Характерной особенностью зависимости тепловой функции от переменных состояния является наличие горизонтального участка в интервале значений [0,735-2,15] безразмерного параметра х, соответствующего постоянному значению энтальпии в этом интервале.
Следует заметить, что кривая зависимости теплосодержания единичного объема живой ткани при постоянной температуре, представленная на фиг. 7а, напоминает изотерму давление - объем для реального газа с заданным количеством вещества в объеме под поршнем при температуре, при которой жидкая и газообразная формы могут сосуществовать, т.е. при Т<Tкрит. Как известно, в двухфазной области системы жидкость + газ в объеме под поршнем давление постоянно, но объем может изменяться. При некой заданной температуре существует только одно значение давления, при котором жидкость и ее пар находятся в равновесии. Если при этом давлении перемещать поршень вниз, то некоторое количество газа сконденсируется, но давление остается постоянным до тех пор, пока не сконденсируется весь газ.
Горизонтальный участок кривой удельного теплосодержания живой ткани, представленной на фиг. 7а, соответствует трехфазной области газ + жидкость + твердая фаза межклеточного вещества. Горизонтальный участок трехфазной области изотермы межклеточного вещества представлен с более высоким разрешением на фигуре 7b. Как видно из графика, горизонтальный участок изотермы, показанной на фиг. 7а, имеет тонкую структуру в виде волнообразной кривой, пересекающей горизонтальную прямую в точках 1, 2, 3, 4, 5, соответствующих решениям уравнения состояния, из которых только три 1, 3, 5 физически осуществимы. Два других решения 2, 4 физически неосуществимы, поскольку находятся на участках кривой, противоречащих условию стабильности термодинамической системы (∂p/∂V)T<0.
Следует заметить, что равновесная изотерма межклеточного вещества, показанная на фиг. 7, согласуется с правилом Максвелла, имеющим теоретическое обоснование для реальных газов, поскольку суммарная площадь под участками кривой, проходящими выше горизонтальной прямой, оказывается равной суммарной площади под участками кривой, проходящими ниже горизонтальной прямой.
В области значений безразмерного параметра 0<х<0,735 при х → 0 межклеточное вещество переходит в однофазное газообразное состояние (клубок). В области значений безразмерного параметра х>2,15 при х → ∞ межклеточное вещество переходит в однофазное состояние твердая фаза (глобула).
Вполне очевидно, что фазовые состояния клубок и глобула являются несовместимыми с физико-химическими процессами, сопряженными с метаболизмом с живой ткани.
Отсюда следует понимание важного вывода, что нативное физиологическое состояние живой ткани может реализоваться исключительно в трех фазной области тепловой функции, в которой все три фазы межклеточного вещества (клубок, жидкая фаза, глобула) находятся в термодинамическом равновесии. Нормальная физиологическая температура и нормальное атмосферное давление, при которых реализуется физиологическое состояние живой ткани, соответствуют тройной точке межклеточного вещества, в которой реализуется термодинамическое равновесие между всеми тремя фазами межклеточного вещества.
Ближайшим физическим аналогом термодинамической системы в тройной точке является вода.
Как известно, тройная точка воды лежит на 0.008° выше точки плавления при нормальном атмосферном давлении. Давление же в тройной точке намного меньше атмосферного и равно примерно 4.58 мм рт. ст. Тройная точка для всякого вещества является вполне определенной величиной (в отличие, например, от температуры кипения, которая зависит от давления). С этим связано то обстоятельство, что тройная точка воды является основной реперной точкой при построении абсолютной термодинамической шкалы температур Кельвина, а также практической международной шкалы температур Цельсия. Как видно из параметров тройной точки воды, при нормальных условиях равновесное сосуществование льда, водяного пара и жидкой воды невозможно. Это обстоятельство вроде бы противоречит обыденным наблюдениям - лед, вода и пар часто наблюдаются одновременно. Тем не менее, противоречия нет - наблюдаемые фазовые состояния воды далеки от равновесных и реализуются на практике только из-за кинетических ограничений фазовых переходов.
Границы трехфазной области межклеточного вещества можно оценить исходя из средних значений сахара крови 5 ммоль/литр и капиллярного давления 20 мм рт.ст., характеризующих физиологическую норму: интервалу безразмерного параметра х [0,735-2,15] соответствует интервал значений сахара крови 3,675-10,75 ммоль/литр и среднего капиллярного давления 14,7-43,0 мм рт. столба.
Свойство терморегуляции живой ткани, хорошо известное из опыта, и высокую чувствительность живой ткани к внешним тепловым потокам можно понять на основе аналогии с термодинамическим поведением воды в тройной точке: нагрев воды, находящейся в тройной точке, приводит к фазовому превращению льда в жидкую фазу без изменения ее температуры; количество тепла, поступающего в систему, приводит к фазовому преобразованию льда в жидкую фазу без изменения ее температуры.
Воздействие внешнего теплового потока на поверхность живой ткани (обусловленное вариацией климатических тепловых параметров) приводит к его поглощению и нагреву, следствием которого является разрыв "сахарных" сшивок полимерной цепи гиалуроновой кислоты с энергией связи kБТ и увеличение объема межклеточного пространства за счет увеличения массовой доли воды в результате фазового преобразования межклеточного вещества, которое приводит к изменению долевых соотношений между фазами вещества без изменения ее температуры.
Физика межклеточного вещества: самоорганизация микроциркуляции и кровообращения
Изотермы межклеточного вещества, представленные на фиг. 7, позволяют понять природу саморегуляции микропотоков вещества и энергии в пространственной области, включающей структурный элемент живой ткани, схематично представленной на фиг. 3.
Как было показано выше, границы трехфазной области межклеточного вещества можно оценить исходя из средних значений сахара крови 5 ммоль/литр и капиллярного давления Р0=20 мм рт.ст., характеризующих физиологическую норму:
интервалу [0,735-2,15] безразмерного параметра х=Р0/Р соответствует интервал гидравлического давления в капилляре [14,7-43,0] мм рт. столба. Как хорошо известно из опыта, средние значения давления на входе и выходе капилляра в норме оказываются в интервалах [10-20] и [30-60] мм рт. столба; средне статистические значения капиллярного давления на выходе и входе соответственно равны 15 мм рт. столба и 45 мм рт. столба. Отсюда следует понимание важного вывода, что межклеточное вещество живой ткани, окружающее кровеносный капилляр по всей длине от входа до выхода (структурный элемент которого схематично представлен на фиг. 3) в нормальных физиологических условиях находится в трехфазной области, в которой сосуществуют все три фазы межклеточного вещества (клубок, жидкая фаза, глобула).
Графики, представленные на фигурах 4-5, позволяют понять механизм зависимости гидравлического давления в сердечно-сосудистой системе от уровня сахара крови: рост концентрации сахара крови приводит к увеличению массовой доли жидкой фазы межклеточного вещества (набухание) на начальном участке трех фазной области изотермы межклеточного вещества, следствием которого является уменьшение просвета капилляра на входе (в точке "а"). Просвет капилляра на выходе (в точке "в") уменьшается по аналогичной причине. Гидравлическое сопротивление капилляра локального участка живой ткани, определяемое его просветом на входе и выходе, таким образом, является функцией сахара крови (в диапазоне его регулирования) и является составляющей, которая определяет результирующую величину гидравлического сопротивление системы кровообращения всего организма.
Увеличение уровня сахара крови ведет к увеличению градиента давления на длине капилляре и, как следствие, к пропорциональному росту среднего артериального давления, обусловленного ростом артериального и венозного давлений.
Описанный выше механизм также позволяет объяснить постоянство объемного потока тканевой жидкости, циркулирующей в межклеточном пространстве (потока микроциркуляции), и осуществляющего транспорт сахара к клеткам ткани и обратный транспорт продуктов метаболизма в систему микроциркуляции.
Представленные на фигурах 4-5 зависимости имеют особенности в точках "х=1" и "х=0,25": эластическое давление в этих точках равно капиллярному давлению нулевого потока. Эластическое давление в интервале между этими точками меньше капиллярного давления нулевого потока и равно нулю в точке "х=0,46".
При значении концентрации глюкозы, равной 4,5 ммоль/литр, значения гидравлического давления соответственно равны:
25 мм рт. ст. - в точке " х=1" (капиллярное давление);
54,3 мм рт. ст. - в точке "х=0,46" (давление на входе в капилляр);
100 мм рт. ст. - в точке "х=0,25" (среднее артериальное давление);
6,7 мм рт. ст. - в точке "х=3,72" (давление на выходе из капилляра).
Капиллярное давление, соответствующее давлению нулевого потока, численно равно величине коллоидно-осмотическое (онкотическое) давления плазмы крови, поэтому при увеличении уровня сахара в крови и росте среднего капиллярного давления происходит смещение точки нулевого потока в сторону венозного конца капилляра. Такое смещение точки нулевого потока приводит к увеличению площади фильтрации, росту фильтрационного потока и росту результирующего транс капиллярного потока, который также оказывается линейной функцией уровня сахара в крови.
Таким образом, в рамках исследуемой физической модели удается получить точные решения для зависимости основных параметров, характеризующих микроциркуляцию и метаболизм, от уровня сахара крови и объяснить феномен саморегуляции потоков микроциркуляции.
Как известно [Н.М. Амосов и др., (1969)], мощность сокращения желудочка сердца меняется прямо пропорционально средней величине артериального давления (АД). Существенной особенностью этой зависимости является постоянство ударного и минутного объемов сердца. Описанная зависимость мощности сокращения сердца от среднего давления в аорте наблюдается в довольно широких, но ограниченных пределах изменения АД (приблизительно от 40-50 до 130-150 мм рт. ст.). При выходе за эти пределы влияние АД на энергию сокращения становится диаметрально противоположным. АД независимо от венозного регулирует мощность сокращения желудочка. Развиваемая сердцем мощность изменяется под влиянием АД ровно в той степени, какая необходима для обеспечения постоянства сердечного выброса. Благодаря этому сердце способно в широких пределах регулировать мощность своего сокращения, сохраняя заданный притоком ударный объем.
На прямую зависимость мощности сердечного сокращения от артериального сопротивления и венозного притока впервые указал в своих классических работах Starling (1914, 1918).
Описанный нами биофизический механизм саморегуляции в системе микроциркуляции, устанавливающий прямую зависимость гидравлического сопротивления и давления в системе микроциркуляции от содержания сахара в крови, температуры и внешнего давления, позволяет объяснить природу феномена, известного как само-регуляция сердца и сосудов. Действительно, изменение гидравлического сопротивления капиллярных сосудов, происходящее при изменении содержания сахара в крови (при неизменных окружающей температуре и атмосферном давлении), приводит к изменению перепада давления между входом и выходом капиллярного сосуда и к изменению артериального давления. Изменения артериального давления, в свою очередь, приводят к изменению мощности сокращения сердца, таким образом, что ударный и минутный объемы сердца сохраняются постоянными.
Таким образом, изменение уровня сахара в крови приводит к пропорциональным изменениям давления в системе кровообращения - изменяются среднее капиллярное давление, давление в артериальном и венозном конце капилляра, артериальное давление и венозное давление. Более того, распределение гидравлического давления в системе кровообращения является однозначной функцией биохимического состава крови, в частности, содержания сахара в крови.
Физика межклеточного вещества: межклеточная микрофлюидика.
Физика межклеточного вещества, основные положения которой рассмотрены выше, также позволяют объяснить механизм транспорта тканевой жидкости в межклеточном пространстве живой ткани, основными структурными элементами которой являются клетки, межклеточное вещество и сеть кровеносных микрососудов (капилляров), образующих систему микроциркуляции локальной области живой ткани. Характерный структурный элемент локальной области живой ткани схематично представлен на фиг. 3.
Как известно, характерное расстояние между поверхностями соседних клеток составляет величину порядка одного микрона. Отсюда следует понимание очевидного вывода, что транспорт тканевой жидкости от капилляра к клетке может осуществляться по каналам, просвет которых меньше чем характерное межклеточное расстояние.
Физические свойства межклеточного вещества, рассмотренные выше, позволяют объяснить особенности транспорта тканевой жидкости в межклеточном пространстве.
Неравномерное распределение гидравлического давления (при постоянной концентрации сахара) вдоль капиллярного сосуда (фигура 5, кривая 2) приводит к неравномерному распределению в объеме ткани осмотического давления (фигура 5, кривая 1) и эластического давления (фигура 5, кривая 3).
Градиенты давления могут образовываться, как между соседними капиллярами, так и в пределах одного капилляра. Такие градиенты давления могут приводить к формированию в межклеточном веществе узких каналов, ориентированных по градиенту давления, берущих начало в артериальной области капилляра и заканчивающихся в венозной области. Транспорт межклеточной жидкости осуществляется по этим каналам, представляющим своеобразные "микрокапилляры" в межклеточном пространстве. Движущей силой объемного потока тканевой жидкости через такой "микрокапилляр" является разность гидравлических давлений. При этом распределение тканевого давления вдоль таких каналов, в зависимости от величины гидравлического давления в канале, подчиняется аналогичным закономерностям, описывающим распределение давления в капиллярном сосуде.
Тепло, образующееся в процессе клеточного метаболизма, поглощается межклеточной водой, обладающей высокой теплоемкостью, и переносится по межклеточному пространству к поверхности тела и рассеивается в окружающую среду в процессе испарительного охлаждения.
Характерной особенностью саморегуляции процессов переноса в межклеточном пространстве является то, что величина объемного потока тканевой жидкости, циркулирующей в межклеточном пространстве, остается неизменной при изменениях гидравлического давления в системе микроциркуляции. Следствием упомянутого свойства является линейная зависимость скорости поглощения глюкозы и величины теплопродукции от концентрации сахара в крови, поскольку плотность потока глюкозы из капилляра к клетке определяется произведением объемного потока межклеточной тканевой жидкости на концентрацию сахара в крови.
Физика межклеточного вещества: транспорт воды через эпидермис.
Физика межклеточного вещества, основные положения которой рассмотрены выше, позволяет объяснить механизмы процесса переноса тепла и воды через эпидермис, в частности, объяснить высокую чувствительность эпидермиса живой ткани к внешним тепловым потокам.
В естественных (физиологических) условиях мощности потоков тепла и воды в процессе испарительного охлаждения (при фиксированных климатических параметрах окружающей среды) определяются градиентами по толщине эпидермиса физиологических параметров, характеризующих термодинамическое состояние межклеточного вещества - температуры, давления и концентрации сахара крови.
На основе пространственной структуры живой ткани, показанной схематично на фиг. 8, следует понимание вывода, что массовая доля воды, находящейся в межклеточном пространстве единичного объема ткани MINTERCELL, намного меньше массовой доли воды в этом объеме М0:
N=MINTERCELL/M0<<1.
Осмотическое давление межклеточного вещества можно описать через массовую долю воды, находящейся в межклеточном пространстве единичного объема ткани, которую можно рассматривать, как эффективную концентрацию Δn межклеточной воды в единице объема.
Выражение для осмотического давления межклеточного вещества можно представить в виде, совпадающем формально с формулой Вант - Гоффа для разбавленных растворов с малой концентрацией:

где ΔM=MINTERCELL,
T - температура,
R - универсальная газовая постоянная,
М0 - массовая доля воды в объеме ткани.
С другой стороны, как видно из графиков 1 и 3 на фиг. 6, осмотическое давление межклеточного вещества пропорционально зависит от концентрации сахара.
Отсюда следует, что выражение (10) для осмотического давления можно представить в виде:
Δπ(C)=RT×ΔN(C)=RT×ΔM(C)/М0.
Как показано выше, тепло, образующееся в процессе клеточного метаболизма, поглощается межклеточной водой, обладающей высокой теплоемкостью (обусловленной высокой теплоемкостью воды), переносится по межклеточному пространству к поверхности тела и рассеивается в окружающую среду в процессе испарительного охлаждения.
В динамически равновесном (стационарном) естественном состоянии живой ткани массоперенос из глубинных слоев эпидермиса к поверхности определяется градиентом химического потенциала, который по определению равен работе по переносу одного моля вещества.
В общем случае, выражение для разности химического потенциала Δμ с учетом влияния разностей гидравлического давления ΔР, температуры ΔT и концентрации ΔN имеет следующий вид:
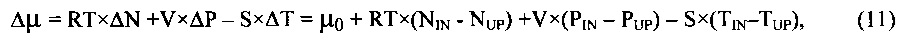
где
ΔР - разность давления,
ΔТ - разность температуры,
ΔN - разность эффективной концентрации межклеточной воды.
NIN - эффективная концентрация межклеточной воды в глубинном слое.
NUP - эффективная концентрация межклеточной воды в поверхностном слое.
V - объем ткани, соответствующий единичной площади поверхностного слоя,
РIN - гидравлическое давление в глубинном слое,
PUP - гидравлическое давление в поверхностном слое,
S - энтропия межклеточного вещества в единице объема ткани,
ТIN - температура ткани в глубинном слое,
ТUP - температура ткани в поверхностном слое.
Выражение, описывающее мощность процесса массопереноса J определяется градиентом химического потенциала Δμ/ΔХ и микро - потоком воды j:
J=XJ×j, где
Xj=Δμ/ΔX - движущая сила процесса, равная градиенту химического потенциала на толщине эпидермиса ΔХ.
Поток массы равен:
j=ΔN×ΔX/Δt.
Выражение, описывающее мощность процесса массопереноса, имеет вид:
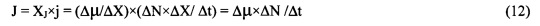
Внешние воздействия на эпидермис живой ткани, в частности, внешние тепловые потоки приводят к изменению градиента химического потенциала (11), обусловленного изменением содержания воды в межклеточном пространстве в результате поглощения тепловой мощности и, как следствие, к изменению мощности процесса массопереноса.
Следует отметить, что эффекты сжатия и расширения межклеточного вещества можно стимулировать, также, с помощью постоянного электрического поля. Постоянное электрическое поле (постоянный электрический ток) приводит к возникновению в эпидермисе живой ткани электрокинетических явлений, в частности явления электроосмоса, обусловленного изменением равновесного распределения электрических ионов тканевой жидкости в объеме ткани, что в свою очередь приводит к нарушению механического равновесия системы и к изменению содержания воды в межклеточном пространстве.
Способ измерения теплового эффекта и скорости метаболизма живой ткани
Способ микро калориметрического измерения теплового эффекта метаболизма локального участка живой ткани заключается в измерении временной динамики процессов переноса (тепло- массопереноса), которые возникают в эпидермисе при наложении (с дозированным давлением) на поверхность рогового слоя тепло- и водонепроницаемого аппликатора, исключающего теплоперенос и испарение воды с локальной ограниченной поверхности эпидермиса в окружающую среду и образующего закрытую термодинамическую систему в локальном объеме ткани под аппликатором. Микрокалориметр теплового эффекта метаболизма локального участка живой ткани схематично представлен на фиг. 9.
Вполне очевидно, что в естественных условиях эпидермис живой ткани является открытой системой, находящейся в тепловом и диффузионном контакте с окружающей средой. На фиг. 9 (рисунок слева) показано направление потоков тепла и воды через эпидермис в естественных неравновесных стационарных условиях. Движущими силами потоков тепла и массы через эпидермис (из глубины к поверхности) являются градиенты температуры и химического потенциала соответственно:
Tskin>Tрсэ; μskin>μрсэ.
На фиг. 9 (рисунок справа) показана закрытая система, которая образуется в объеме ткани под аппликатором, исключающем тепловой и диффузионный контакт живой ткани с окружающей средой. Аппликатор (1) с диаметром D>>Lskin (где Lskin - толщина эпидермиса), непроницаемый для тепла и воды, установленный с дозированным давлением на поверхности рогового слоя, образует закрытую систему эпидермиса (рисунок справа), находящуюся в тепловом и диффузионном контакте с термостатом (большим резервуаром энергии и частиц), роль которого выполняет система микроциркуляции (циркулирующая вода в системе капилляров, расположенных в глубинном слое кожи). Совокупность «система + резервуар» является замкнутой.
Временная динамика процессов переноса (тепла и воды) в замкнутой системе эпидермиса контролируется с помощью датчиков (2) физиологических параметров (температуры, осмотического давления межклеточного вещества, эластического давления), расположенных на поверхности рогового слоя под аппликатором.
Вполне очевидно, что изменение граничных условий путем наложения (с дозированным давлением) на поверхность рогового слоя эпидермиса аппликатора, исключающего перенос тепла и массы, приводит к нарушению естественного динамического равновесия в эпидермисе и возникновению переходного процесса, в процессе которого происходит самопроизвольный переход эпидермиса ткани под аппликатором из менее вероятного неравновесного состояния в более вероятное равновесное состояние, соответствующее максимуму энтропии, которое можно рассматривать, как состояние локального термодинамического равновесия. После установления термодинамического равновесия в объеме ткани под аппликатором температура и химический потенциал поверхностного слоя эпидермиса становятся равными температуре и химическому потенциалу глубинного слоя (термостата):

Вполне очевидно, что в состоянии локального термодинамического равновесия в объеме ткани под аппликатором устанавливаются равновесные распределения макроскопических параметров (количества воды М, эластического давления Р, температуры Т) в объеме ткани под аппликатором.
Отсюда следует понимание важного вывода, что значения переменных термодинамического состояния ткани в глубинном слое ткани (в приближении стационарности физиологических параметров) можно определить путем измерения временной динамики этих параметров в поверхностном роговом слое эпидермиса под аппликатором, образующем закрытую систему эпидермиса.
Уравнение, описывающее тепловой баланс ткани под аппликатором в начальный момент времени, после изменения граничных условий путем наложения на поверхность рогового слоя непроницаемого для тепла и воды аппликатора, можно получить из феноменологического уравнения (5) и представить в следующем виде:
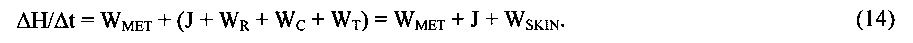
WMET - теплопродукция,
WR - теплоотдача посредством излучения (лучистый теплообмен),
WC - теплоотдача посредством конвекции,
WT - теплоотдача с поверхности эпидермиса посредством теплопроводности,
J - теплоотдача посредством испарения в процессе неощутимой перспирации (испарительное охлаждение),
WEXT - тепловой поток через ограждающую конструкцию между помещением, в котором находится испытуемый, и внешней средой,
Н - энтальпия (теплосодержание) ткани.
Следует отметить, что в отличие от уравнения (5), описывающего тепловой баланс живой ткани в неравновесном стационарном состоянии, в уравнение (14) мощности теплопереноса WSKIN и массопереноса J входят со знаком "+".
В общем случае, самопроизвольный переход закрытой термодинамической системы под аппликатором из начального (менее вероятного) неравновесного состояния, в конечное (более вероятное) равновесное состояние, соответствующее максимуму энтропии, можно описать с помощью основного уравнения термодинамики, связывающего энтальпию ткани с ее естественными переменными состояния:
ΔН=T×ΔS+S×ΔT+V×ΔР+μ×ΔN, где
Н - энтальпия,
S - энтропия,
Т - температура,
V- объем,
Р - давление.
μ - химический потенциал,
N - количество вещества.
Процесс перехода замкнутой системы эпидермиса ткани под аппликатором из начального неравновесного состояния в конечное наиболее вероятное состояние локального термодинамического равновесия можно описать с помощью основного уравнения термодинамики, связывающего энтальпию ткани с ее естественными переменными термодинамического состояния, которое можно записать в следующем виде:

или

ΔН - изменение энтальпии, в результате перехода ткани в области под аппликатором в состояние локального термодинамического равновесия;
ΔQMET - количество тепла, поступающее в объем ткани под аппликатором в процессе метаболизма,
ΔQΔT - количество тепла, поступающее в объем ткани под аппликатором в процессе теплопереноса, обусловленного градиентом температуры между поверхностью и глубиной;
ΔТ - изменение температуры РСЭ, в результате перехода ткани в области под аппликатором в состояние локального термодинамического равновесия;
ΔМ - изменение количества воды в ткани под аппликатором в процессе массопереноса, обусловленного градиентом химического потенциала между поверхностью и глубиной;
ΔР - изменение эластического давления ткани под аппликатором в процессе массопереноса;
КT, КM и КР - феноменологические константы, которые определяются путем калибровки.
Рассмотрим особенности временной динамики переходного процесса массопереноса под аппликатором.
Способ измерения содержания воды в эпидермисе заключается в измерении временной динамики процесса массопереноса, который возникает при наложении (с дозированным давлением) на поверхность рогового слоя эпидермиса водонепроницаемого аппликатора, исключающего испарение воды с ограниченной локальной поверхности рогового слоя.
Содержание воды в межклеточном пространстве эпидермиса можно определить с помощью метода, суть которого заключается в непрерывном измерении временной динамики количества воды в локальном объеме эпидермиса под водонепроницаемым аппликатором.
Одним из эффективных практических методов, позволяющих определить содержание воды в межклеточном пространстве эпидермиса, является измерение данного параметра путем регистрации временной динамики количества воды в поверхностном роговом слое эпидермиса (РСЭ) с помощью датчика количества воды 2 (фиг. 9), расположенного на поверхности РСЭ под аппликатором 1. Упомянутый метод позволяет, по характеру временной динамики количества воды в РСЭ, определить динамику количества воды и ее равновесное содержание в межклеточном пространстве глубинных слоев кожи и подкожных тканей.
Водонепроницаемый аппликатор, который накладывается на поверхность РСЭ с дозированным давлением, исключает возможность естественного испарения воды с поверхности РСЭ в процессе неощутимой перспирации. Изменение естественных граничных условий, определяющих теплообмен ткани с окружающей средой, приводит к нарушению естественного равновесия процессов переноса воды и тепла - результирующим транс-капиллярным потоком воды в глубине дермы, потоком воды, поступающим к поверхности эпидермиса из слоев дермы, в которых располагается сеть капиллярных сосудов, и потоком воды, испаряющейся с поверхности РСЭ. Нарушение естественного равновесия потоков тепла и массы приводит к возникновению процесса локального набухания межклеточного вещества эпидермиса в объеме ткани под аппликатором, которое сопровождается увеличением температуры поверхности, обусловленным поглощением тепла в локальном объеме под аппликатором.
По мере набухания межклеточной ткани происходит выравнивание температуры и химического потенциала по толщине эпидермиса под аппликатором.
На фиг. 10 представлена характерная временная динамика количества воды в эпидермисе в процессе массопереноса, обусловленного изменением граничных условий в результате наложения на поверхность РСЭ водонепроницаемого аппликатора, исключающего перенос воды и тепла с поверхности контролируемого участка тела.
Как следует из графика, содержание воды в РСЭ, равное в начальный момент времени МРСЭ(t0), стремится к новому равновесному уровню МРСЭ (t=∞), соответствующему значению содержания воды М0 (t0) в глубинном слое эпидермиса:
МРСЭ (t)→ M0(t0) при t→∞.
В простейшем случае, при постоянных значениях сахара крови и климатических параметров, временная динамика (процесса набухания) количества воды МРСЭ (t) в поверхностном роговом слое эпидермиса описывается одной экспонентой:
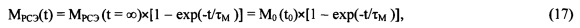
где tM - постоянная времени процесса массопереноса.
Связь между количеством воды M0(t=t0) в глубине эпидермиса и мощностью процесса массопереноса JM(t0) в начальный момент времени (t=t0), соответствующий моменту прижима аппликатора на поверхность РСЭ, можно определить путем дифференцирования выражения (14):

Таким образом, временную динамику количества воды в эпидермисе можно контролировать путем измерения неинвазивным способом временной динамики количества воды в поверхностном роговом слое эпидермиса.
Для измерения количества воды в роговом слое применимы разные физико-химические методы, основанные на разных физических принципах. В частности, для измерения количества воды в роговом слое применимы методы электрометрии, основанные на измерении электрофизических характеристик (электропроводность, диэлектрическая проницаемость); спектральные методы, основанные на измерении спектральных характеристик (коэффициенты отражения и поглощения); оптико-акустические методы; теплофизические методы, основанные на измерении теплофизических характеристик (теплопроводность, теплоемкость); электрохимические методы и др.
На фиг. 11 представлена характерная временная динамика температуры РСЭ в процессе теплопереноса, обусловленного изменением граничных условий в результате наложения на поверхность РСЭ тепло- и водонепроницаемого аппликатора, исключающего перенос воды и тепла с поверхности контролируемого участка тела.
Временная динамика теплопереноса (температуры и количества тепла) в объеме ткани под аппликатором, в простейшем случае, при постоянных значениях сахара крови и климатических параметров, также описывается экспонентой:
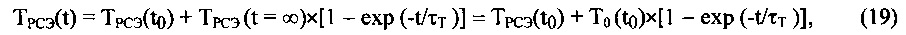
где
ТРСЭ(t0) - температура рогового слоя под аппликатором в начальный момент времени
ТРСЭ(0) - температура рогового слоя под аппликатором,
Т0 (t0) - температура ткани в глубинном слое эпидермиса под аппликатором в начальный момент времени.
Связь между температурой T0(t=t0) в глубине эпидермиса и скоростью изменения температуры РСЭ в начальный момент времени (t=t0), соответствующий моменту прижима аппликатора на поверхность РСЭ, можно определить путем дифференцирования выражения (16):
dTРСЭ(t0)/dt=T0(t=t0)/τT.
Плотность теплового потока, направленного из глубины к поверхности, в объеме ткани под аппликатором, в начальный момент времени t0 определяется градиентом температуры по толщине эпидермиса:
WРСЭ(t)/КТ=ΔQΔT/Δt=T0(t0) - TРСЭ(t)=τT×[dTРСЭ(t0)/dt] - ТРСЭ(t0).
Таким образом, значения макроскопических параметров ткани в глубинном слое под аппликатором можно определить путем измерения производной временной динамики этих параметров на начальном участке.
Отсюда следует понимание важного вывода, что уравнение (16) можно записать в виде дифференциального уравнения, связывающего потоки тепла и массы в объеме ткани под аппликатором:
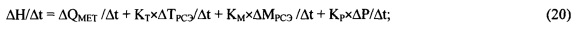
или ΔН/Δt=WMET+WSKIN+JSKIN+KP×ΔP/Δt.
Полученное уравнение (20) с точностью до члена КЗ×ΔР/Δt, описывающего работу по изменению объема ткани, совпадает с уравнением (14), описывающим тепловой баланс в объеме ткани под аппликатором:
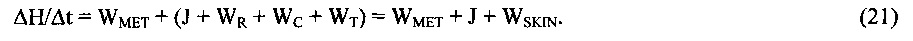
Очевидно, что скорость метаболизма WMET можно определить из последнего уравнения (21) путем измерения потоков J+WSKIN, в том случае, если можно измерить или определить независимым методом величину ΔН и скорость изменения энтальпии ΔН/Δt. Аналогичным способом, при известном значении величины изменения энтальпии ΔН в заданном временном интервале Δt, можно определить величину теплового эффекта метаболизма ΔQMET из уравнения (16), которое представляет интегральную форму уравнения (21), путем измерения в выбранном временном интервале изменений температуры ΔТ, количества воды ΔМ и эластического давления ΔР.
В процессе, выполненных нами, экспериментальных исследований была изучена зависимость термодинамических характеристик эпидермиса человека от физиологических и физико-климатических параметров и установлено, что теплосодержание ткани определяется количеством воды в межклеточном пространстве эпидермиса.
Выражение для тепловой функция или теплосодержание (энтальпия) в глубинном слое ткани, в зависимости от климатических параметров, имеет следующий вид:
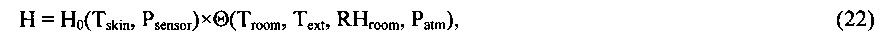
Tskin - температура глубинного слоя под аппликатором,
Psensor - давление аппликатора на поверхность эпидермиса,
Troom - температура воздуха в помещении, в котором производится измерение,
Text - температура окружающего воздуха за ограждающей конструкцией,
RHroom - относительная влажность воздуха в помещении, в котором производится измерение,
Patm - атмосферное давление.
На фиг. 13 показана экспериментальная зависимость теплосодержания ткани от климатических параметров, при фиксированных значениях физиологических параметров.
В процессе перехода ткани под аппликатором в состояние локального термодинамического равновесия величина энтальпии поверхностного слоя эпидермиса (при стационарных значениях климатических параметров, температуры глубинного слоя эпидермиса Tskin и давления прижима аппликатора Psensor) изменяется во временном интервале переходного процесса τM от 0, в поверхностном слое эпидермиса, до значения Н, равном величине энтальпии в глубинном слое эпидермиса, которая определяется выражением (22):
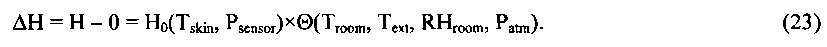
Как было показано выше, при стационарных значениях физиологических параметров живой ткани под аппликатором, скорость изменения термодинамических параметра в поверхностном слое эпидермиса однозначно определяется величиной этого параметра в глубинном слое, в котором расположена капиллярная сеть системы микроциркуляции.
Связь между энтальпией H0(t=t0) в глубинном слое эпидермиса и скоростью изменения энтальпии в поверхностном слое в начальный момент времени (t=t0), соответствующий моменту прижима аппликатора на поверхность РСЭ, определяется выражением:
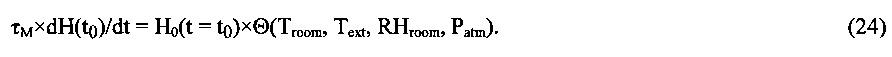
Метод микро калориметрии метаболизма локальной ткани сводится к измерению в реальном времени временной динамики физиологических (внутренних) параметров ткани (TSKIN и JM), характеризующих теплоперенос, обусловленный изменением граничных условий в результате наложения на поверхность эпидермиса тепло- и водонепроницаемого аппликатора, а также климатических (внешних) параметров окружающей среды (TROOM, RHROOM, ТЕХT, RHЕХT РАТМ), и вычислению (при известном значении константы К0, которая является характеристикой межклеточного вещества и определяется путем калибровки) теплового эффекта и скорости метаболизма с помощью уравнений (16) и (21).
Особенность метода заключается в том, что наряду с измерениями теплового потока теплообмена, обусловленного градиентом температуры, и теплового потока, обусловленного испарительным охлаждением в процессе неощутимой перспирации, и измерениями параметров микроклимата (температура и влажность воздуха, атмосферное давление) помещения, в котором проводится измерение, с целью повышения точности путем уменьшения зависимости погрешности измерений от влияния внешних условий проводят вспомогательные измерения физико-климатических параметров окружающей среды, влияющих на характеристики живой ткани, рассчитывают погрешности измерений по известной зависимости теплоотдачи локальной ткани от физико-климатических факторов окружающей среды и корректируют мгновенные значения сигналов измеряемых физиологических параметров.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Предлагаемый способ мониторинга сахара крови путем измерения теплового эффекта и скорости метаболизма локального участка живой ткани может быть реализован при помощи мультисенсорного устройства, принципиальная схема которого показана на фиг. 14.
Устройство содержит две группы датчиков, одна из которых предназначена для измерения физиологических параметров локального участка живой ткани, а вторая группа датчиков для измерения климатических параметров окружающей среды.
Устройство включает в себя аппликатор 1, непроницаемый для тепла и воды, имеющий верхнюю и нижнюю поверхности выполненный с возможностью наложения на кожу с дозированным давлением, устройство 8 для создания калибровочного воздействия на контролируемый участок ткани под аппликатором, установочную платформу 9 для закрепления датчиков климатических параметров (выполненную в виде печатной платы, расположенной над аппликатором), датчики климатических параметров, расположенные на установочной платформе 9, датчики физиологических параметров, расположенные под аппликатором, с внутренней стороны аппликатора на поверхности РСЭ, при этом сигналы с вышеуказанных датчиков поступают последовательно на входы блока 10 усилителей и/или аналогово-цифровой преобразователь (далее АЦП), установленных на верхней поверхности аппликатора 1; блока 11 обработки информации; блока 12 отображения информации.
Блоком 11 обработки информации является микропроцессор для обработки в реальном времени сигналов от датчиков физиологических параметров локальной области ткани под аппликатором и датчиков климатических параметров окружающей среды.
В одном из вариантов осуществления блок 11 обработки информации расположен на верхней поверхности аппликатора 1, в другом - является удаленным и связан проводной связью с АЦП.
Блоком 12 отображения информации является смартфон или персональный компьютер. При этом связь мультисенсорного устройства с блоком 12 отображения информации может быть в различных вариантах осуществления как беспроводной, так и проводной (посредством USB канала).
В качестве датчиков для измерения динамики физиологических параметров локальной области ткани под аппликатором, используют по меньшей мере датчик 2 количества воды (осмотического давления), с помощью которого определяют количество воды в межклеточном пространстве ткани в локальном объеме под аппликатором на контролируемой глубине, на которой устанавливается локальное термодинамическое равновесие; датчик 3 температуры РСЭ; с помощью которого определяют температуру поверхности кожи под аппликатором, датчик 4 эластического давления ткани под аппликатором.
В качестве датчиков климатических параметров окружающей среды используют по меньшей мере датчик 5 температуры, осуществляющий съем температуры воздуха в помещении, в котором проводятся измерения, датчик 6 относительной влажности воздуха в помещении, в котором проводятся измерения, датчик 7 теплового потока через ограждающую конструкцию между помещением и внешней окружающей средой. Датчик теплового потока размещается на установочной платформе.
В альтернативном варианте осуществления способа, временные изменения теплового потока через ограждающую конструкцию между помещением и внешней окружающей средой можно легко контролировать путем точного измерения двух параметров - температуры воздуха в помещении и внешней температуры за стеной. В этом случае, температуру воздуха в помещении определяет путем измерения с помощью датчика температуры, расположенного на установочной платформе, а для температуры воздуха внешней среды берут его текущее значение, соответствующее опубликованным данным метеостанций, которое вводится в программу для вычисления.
Особенность предлагаемого мультисенсорного устройства заключается в том, что способом измерения предусматривается возможность работы устройства в двух разных режимах:
- в режиме "климат - контроля" для измерения климатических параметров окружающей среды;
- в режиме "микрокалориметр" для измерения теплового эффекта и интенсивности метаболизма локального участка живой ткани.
Схема мультисенсорного устройства для проведения измерений в режиме "климат-контроля" показана на фиг. 14а. В этом режиме сигналы датчиков климатических параметров окружающей среды (датчики температуры 5 и влажности 6 помещения, датчик 7 внешнего теплового потока между помещением, в котором проводится измерение, и внешней средой), расположенных на установочной платформе 9, поступают на входы инструментальных усилителей и/или аналогово-цифрового преобразователя (блок 10), расположенных на внешней стороне аппликатора 1, после которых они поступают в блок обработки информации (11), связанный с устройством отображения информации (12), на экране которого в реальном времени отображаются текущие значения климатических параметров окружающей среды.
Схема мультисенсорного устройства для проведения измерений в режиме "микрокалориметр" показана на фиг. 14(б). Во временном интервале перед началом измерений в режиме "микрокалориметр" устройство работает в режиме "климат-контроля" и регистрирует в реальном времени текущие значения климатических параметров, которые записываются в памяти микропроцессора и используются в дальнейшем в процессе обработки сигналов физиологических датчиков.
В режиме "микрокалориметр" сигналы датчиков физиологических параметров (датчик количества воды 2, датчик температуры 3 и датчик эластического давления 4), расположенных на внутренней поверхности аппликатора 1, поступают на входы инструментальных усилителей и/или аналогово-цифрового преобразователя (блок 10), после которых поступают в блок обработки информации 11, в котором производится обработка сигналов датчиков физиологических параметров с учетом показаний датчиков климатических параметров.
Обработанная информация передается в устройство отображения 12, на экране которого в реальном времени отображаются текущие значения измеряемых параметров и/или скорости метаболизма параметров.
Следует отметить, что с помощью мультисенсорного устройства, описанного выше, можно проводить одновременные измерения в реальном времени, как физиологических параметров, так и климатических параметров. В этом случае на входы инструментальных усилителей и/или аналого-цифрового преобразователя 11 поступают сигналы со всех датчиков мультисенсорного устройства и для обработки сигналов физиологических параметров используются текущие значения климатических параметров.
Для практической реализации мультисенсорного устройства могут использоваться промышленные сертифицированные датчики для измерения климатических параметров, а также сертифицированные сенсоры для измерения температуры рогового слоя и эластического давления эпидермиса.
Например, в качестве датчика для измерения температуры рогового слоя могут быть использованы сенсоры фирмы Honeywell.
В качестве датчика для измерения климатических параметров температуры и влажности воздуха могут быть использованы, например, датчики фирмы Sensirion.
В качестве датчика для измерения эластического давления могут использовать сенсоры на основе пьезоэлемента.
Величину теплового потока через ограждающую конструкцию между помещением и внешней окружающей средой можно измерить с помощью обычных датчиков теплового потока, основанных на измерении градиента температуры воздуха в направлении к поверхности стены (ограждающей конструкции). Датчик теплового потока размещается на установочной платформе.
Датчик количества воды (2), регистрирующий динамику переноса воды в эпидермисе путем регистрации временной динамики содержания воды в роговом слое эпидермиса, может быть основан на разных физическо-химических методах, основанных на разных физических принципах. В частности, для измерения количества воды в роговом слое применимы методы электрометрии, основанные на измерении электрофизических характеристик РСЭ (электропроводность, диэлектрическая проницаемость); спектральные методы, основанные на измерении спектральных характеристик (коэффициенты отражения и поглощения); оптико-акустические методы; теплофизические методы, основанные на измерении теплофизических характеристик (теплопроводность, теплоемкость); электрохимические методы и др. Также датчик количества воды может быть основан на измерении гидравлического давления в системе микроциркуляции, на измерении эластического давления.
Устройства для измерения количества воды в эпидермисе описаны в патенте [27].
В случае применения электрометрического датчика, количество воды в эпидермисе можно определить путем измерения электрических характеристик (электропроводности и/или диэлектрической проницаемости) рогового слоя на переменном или постоянном токе. В частности, временную динамику процесса набухания межклеточного вещества можно регистрировать по временной динамике поперечного электрического сопротивления рогового слоя эпидермиса. Увеличение количества воды в межклеточном пространстве приводит к увеличению ее количества в роговом слое, что приводит к увеличению электрической проводимости поверхностного слоя эпидермиса. Характерная динамика поперечного электрического сопротивления, измеряемая таким способом, представлена на фигуре 10. В естественных условиях при отсутствии на поверхности тела измерительного электрода эти потоки уравновешены и обеспечивают перенос тепла, образующегося в процессе клеточного метаболизма, из глубинных слоев ткани к поверхности тела. Физический механизм процессов переноса воды и тепла из глубины к поверхности рассмотрен выше в разделе "транспорт тканевой воды через эпидермис".
В случае применения спектрального датчика, количество воды в эпидермисе можно определить путем измерения спектральных характеристик (коэффициента отражения и/или коэффициента поглощения) рогового слоя для электромагнитного излучения с длиной волны вблизи линии поглощения, обусловленной содержанием воды в РСЭ. В частности, временную динамику процесса набухания межклеточного вещества можно регистрировать по временной динамике коэффициента отражения рогового слоя эпидермиса. Увеличение количества воды в межклеточном пространстве приводит к изменению спектральной характеристики рогового слоя, обусловленному изменением количества воды в РСЭ.
Дозированное калибровочное воздействие выбрано из группы, включающей в себя внешнее давление, локальную декомпрессию, нагрев, охлаждение, электрический ток или напряжения и магнитное поле.
В качестве устройства 8 для создания калибровочного воздействия можно использовать, например, устройство, генерирующее импульсы электрического напряжения или тока через РСЭ, которые позволяют определить текущее значение и направление микропотоков тканевой жидкости в межклеточном веществе глубинного слоя эпидермиса путем измерения кинетических характеристик массопереноса, обусловленного электрокинетическими явлениями, в частности, электроосмосом.
В альтернативных вариантах осуществления устройством для создания калибровочного воздействия является источник тепловой мощности, выполненный в виде резистора или элемента Пельтье, или устройство для создания дозированного давления на поверхность аппликатора.
В одном из вариантов осуществления аппликатор выполнен плоским, в другом -в виде измерительной герметичной капсулы, образующей замкнутую полость с диффузионным и тепловым контактом с кожей. При этом рабочая поверхность указанной капсулы, обращенная к коже, выполнена в виде жесткой мембраны, проницаемой или полупроницаемой для воды и тепла. В одном из вариантов полость заполнена абсорбирующим воду материалом. При таких альтернативных выполнениях конструкции аппликатора, соответственно, датчик количества воды в межклеточном пространстве локального объема ткани может быть выполнен в виде датчика концентрации паров воды или датчика давления паров воды или датчика, основанного на спектрометрических или теплофизических методах измерения характеристик паров воды.
Непроницаемый для воды и тепла аппликатор (1) с закрепленными на его нижней поверхности датчиками количества воды (межклеточного осмотического давления 2), температуры 3 и эластического давления эпидермиса на аппликатор 4, фиксируется на поверхности рогового слоя эпидермиса, например, на поверхности кисти руки, с внешним дозированным давлением и прикрепляется в одном из вариантов осуществления с помощью ремешков. Следует, что измерение можно производить на любом участке поверхности тела человека, свободном от волосяного покрова, за исключением участков тела в которых расположены потовые железы, которые активируются в результате эмоционального воздействия. Примером такого участка являются ладони рук.
Предполагаемые размер, внешний вид и дизайн мультисенсорного устройства показаны на фиг. 14 (в). На фиг. 15 показаны фотографии прототипа микрокалориметра.
Процесс измерения (записи сигналов) начинается непосредственно в момент прижима по меньшей мере одного тепло- и водонепроницаемого аппликатора к поверхности РСЭ или с задержкой через 10-50 секунд с момента прижима.
После наложения аппликатора на поверхность кожи измеряют временную динамику физиологических параметров в локальной замкнутой области ткани под аппликатором в режиме «микрокалориметр», а именно, по меньшей мере тепловой поток через участок эпидермиса под аппликатором или температуру поверхности кожи под аппликатором, эластическое давление ткани под аппликатором, давление, создаваемое аппликатором на поверхность кожи, количество воды в межклеточном пространстве ткани на контролируемой глубине, на которой устанавливается локальное термодинамическое равновесие. Измеряют тепловой поток через участок эпидермиса под аппликатором или температуру на контролируемой глубине Тskin, на которой устанавливается локальное термодинамическое равновесие, при фиксированном давлении аппликатора Psensor. Указанная температура может быть определена посредством радиотермометрических методов, или путем изменения временной динамики температуры поверхности кожи под аппликатором и теплового потока через эпидермис к поверхности. После чего рассчитывают мгновенное значение величины энтальпии H0(Tskin, Psensor).
При этом перед началом измерения физиологических параметров или одновременно с ними в режиме «климат-контроля» измеряют временную динамику климатических параметров окружающей среды, а именно, по меньшей мере, атмосферное давление Patm, температуру помещения Troom и относительную влажность воздуха RHroom в помещении, в котором проводится измерение, температуру внешней окружающей среды Text или внешний тепловой поток через ограждающую конструкцию между помещением и внешней окружающей средой.
Измеренные данные поступают в блок обработки информации 11, в котором производится обработка сигналов датчиков физиологических параметров с учетом показаний датчиков климатических параметров, в частности, вычисляют величину энтальпии ткани с учетом влияния климатических параметров, измеряя динамику климатического фактора Θ (Тroom, Text, Patm, RHroom) в зависимости от величины внешнего теплового потока при фиксированных значениях относительной влажности воздуха RHroom и атмосферного давления Patm и измеряя зависимость энтальпии ткани от внешнего теплового потока при разных значениях температуры на контролируемой глубине Tskin при фиксированных значениях относительной влажности воздуха RHroom и атмосферного давления Рatm по формуле:
Н=H0(Tskin, Psensor)×Θ(Troom, Text, Patm, RHroom).
После чего рассчитывают величину теплового эффекта метаболизма ΔQМЕТ локального участка живой ткани с помощью основного уравнения термодинамики, связывающего энтальпию ткани с переменными термодинамического состояния.
ΔН=ΔQMET+ΔQΔT+КМ×ΔМ+КР×ΔР;
H0(Tskin, Psensor)×Θ(Troom>Text, RHroom, Patm)=WMET+WΔT (Tskin-Troom)+J;
где
J - мощность массопереноса;
WΔT - мощность теплового потока, обусловленного перепадом температуры на контролируемой глубине, на которой устанавливается локальное термодинамическое равновесие.
После чего измеряют относительные изменения уровня глюкозы в крови, пропорциональные величине теплового метаболизма локального участка живой ткани. Для вычисления уровня глюкозы в крови проводят процедуру калибровки и определяют калибровочные параметры с целью определения постоянных коэффициентов, необходимых для вычисления теплового эффекта метаболизма локального участка живой ткани и вычисляют уровень глюкозы в крови, пропорциональный величине теплового метаболизма локального участка живой ткани.
Число датчиков мультисенсорного устройства, описанного выше, может быть увеличено за счет включения в состав устройства дополнительных сенсоров и датчиков физиологических параметров, характеризующих метаболизм локального участка живой ткани, в частности, датчиков биохимических параметров крови (например, содержания лактата в крови), кислотности крови, частоты сердечно сосудистых сокращений. Дополнительные датчики для через-кожных измерений могут быть установлены на внутренней стороне аппликатора и интегрированы с датчиками физиологических и климатических параметров, описанными выше, в единую измерительную схему в составе мультисенсорного устройства.
Способ определения содержания биохимических компонентов крови по их содержанию в роговом слое эпидермиса
Содержание любой биохимической компоненты в крови можно определить путем измерения ее содержания бескровным способом в поверхностном роговом слое с помощью метода, описанного в разделе "Способ измерения теплового эффекта и скорости метаболизма локальной ткани", по аналогии с методом определения количества воды в межклеточном пространстве эпидермиса. Содержание биохимической компоненты в роговом слое эпидермиса определяется с помощью электрохимического биосенсора или любым другим возможным способом.
После наложения на поверхность РСЭ аппликатора с дозированным давлением в объеме ткани под аппликатором возникает массоперенос, обусловленный изменением граничных условий в результате наложения на поверхность РСЭ аппликатора, исключающего перенос воды и тепла и биохимического компонента с поверхности контролируемого участка тела.
Содержание произвольного биохимического компонента (вещества) (например, глюкозы G) в РСЭ, равное МGPCЭ(t0) в начальный момент времени (t=t0), стремится к новому равновесному уровню МGРСЭ (t=∞), соответствующему значению содержания глюкозы в крови М (t0):
МGРСЭ (t) → M0G(t0) при t→∞.
В простейшем случае, при постоянных значениях содержания биохимического компонента (вещества) G в крови и климатических параметров, временная динамика количества вещества МGРСЭ (t) в поверхностном роговом слое эпидермиса описывается одной экспонентой:
МGРСЭ(t)=МGРСЭ (t=∞)×[1-ехр(-t/τX)]=M0(t0)×[1-exp(-t/tG)],
где τG - постоянная времени процесса массопереноса глюкозы (контролируемого вещества).
Связь между количеством вещества M0G(t=t0) в глубине эпидермиса и мощностью процесса массопереноса JGM(t0) в начальный момент времени (t=t0), соответствующий моменту прижима аппликатора на поверхность РСЭ, можно определить с помощью выражений:
dMGPCЭ(t0)/dt=JGM(t0)=M0G(t=t0)/τG.
Способ измерения кровяного давления в системе микроциркуляции
Метод измерения количества воды в ткани, описанный выше, позволяет в режиме непрерывного измерения в реальном времени определять значения параметров, характеризующих состояние межклеточной ткани и микроциркуляции локального участка ткани. В частности, метод позволяет определять величины осмотического давления межклеточной ткани и гидравлического давления в системе микроциркуляции.
Кроме того, метод позволяет количественно определять величины следующих параметров: максимального давления в системе микро циркуляции (давление в артериальном конце капилляра), минимального давления в системе микро циркуляции (давление в венозном конце капилляра), осмотического давления межклеточного вещества (тканевого давления), коллоидно-осмотического (онкотического) давления плазмы крови, величины транс капиллярных потоков (результирующего, фильтрационного и абсорбционного), коэффициента фильтрации межклеточной ткани, содержание воды в межклеточной ткани, величину гидравлического сопротивления капиллярных сосудов.
Способ основан на измерении параметра, характеризующего состояние локального участка ткани, при различных значениях внешнего давления на поверхность контролируемого участка. Такими параметрами, характеризующими состояние локального участка ткани, являются, например, плотность потока воды через РСЭ, тканевое давление (осмотическое давление межклеточного вещества), количество воды в межклеточном веществе.
Способ измерения перечисленных выше параметров микроциркуляции и межклеточной ткани, основанный на измерении плотности потока воды через РСЭ, предполагает следующие стадии:
1) измеряют плотность потока воды через локальный участок РСЭ и климатические параметры (температуру и влажность окружающего воздуха, тепловой поток через ограждающую конструкцию или температуру воздуха за ограждающей конструкцией);
2) проводят измерение зависимости плотности потока воды через РСЭ от внешнего давления, оказываемого на локальный контролируемый участок ткани;
3) определяют параметры микроциркуляции локального участка ткани по характеру и изломам, получаемой по п. 2) зависимости.
Другой способ основан на измерении количества воды в глубинном слое живой ткани. Способ измерения перечисленных выше параметров микроциркуляции и межклеточного вещества предполагает следующие стадии:
1) измеряют количество воды в межклеточном веществе в режиме непрерывного мониторинга;
2) определяют зависимость количества воды в межклеточном веществе от внешнего давления, оказываемого на контролируемый локальный участок ткани;
3) определяют параметры микроциркуляции и межклеточного вещества по характеру и изломам, получаемой по п. 2) зависимости.
На фигуре 19 представлен характерный график зависимости количества воды в эпидермисе от величины внешнего давления. Значения внешнего давления, при которых обнаруживаются характерные изломы, соответствуют минимальному и максимальному давлению в системе микроциркуляции. Среднее значение давления, определяемое максимальным и минимальным давлениями, равно средней величине капиллярного давления. Наклон линейной зависимости на начальном и конечном участках позволяет определить коэффициент фильтрации межклеточной ткани для воды. Точка пересечения конечного линейного участка с осью давлений соответствует разнице между осмотическим давлением межклеточной ткани и коллоидно-осмотическим (онкотическим) давлением плазмы крови.
Возможности измерения различных параметров микроциркуляции локального участка ткани, в частности возможность измерения количества воды в РСЭ и межклеточном пространстве кожи, а также возможность измерения коэффициентов фильтрации межклеточной ткани для воды, позволяют использовать метод в косметологии для оценки эффективности воздействия косметических кремов, а также в дерматологии для диагностики патологических состояний кожи (в частности, для диагностики и мониторинга псориаза).
Способ измерения осмотического давления межклеточного вещества
На фигуре 19 представлена зависимость количества воды в межклеточной ткани от внешнего давления. Точка пересечения начального участка этой зависимости с осью абсцисс (величина внешнего давления на поверхность ткани, в мм ртутного столба) определяет величину избыточного гидравлического давления (движущей силы объемного потока воды через эпидермис). Зависимость, представленная на фигуре 19, позволяет также определить абсолютную величину осмотического давления межклеточного вещества в ее нативном состоянии.
На фигуре 12 представлена зависимость количества воды в межклеточной ткани от величины внешнего теплового потока, падающего на поверхность локального участка тела. Точка пересечения начального участка этой зависимости с осью абсцисс (плотность внешнего теплового потока, направленного на поверхность тела, в единицах мощности в мВт/см2) определяет абсолютную величину плотности потока воды через РСЭ или мощность процесса испарительного охлаждения. Зависимость, представленная на фигуре 12 также позволяет определить абсолютную величину избыточного количества воды М-М0 (где М0 - количество воды в межклеточном веществе при значении осмотического давления равном нулю) или количества воды, которое определяет набухание межклеточного вещества в ее нативном состоянии.
Абсолютная величина плотности потока воды через эпидермис, определяемая из графика, представленного на фигуре 12, и абсолютная величина движущей силы объемного потока воды, определяемая из графика, представленного на фигуре 19, позволяют определить величину коэффициента фильтрации межклеточной ткани для воды.
Описанный метод измерения позволяет не только определить абсолютную величину количества воды в межклеточной ткани, но также позволяет провести нормировку этого физиологического параметра по климатическим параметрам и уровню сахара в крови. Возможность такой нормировки позволяет определить отклонения измеряемого физиологического параметра, характеризующего состояние межклеточного вещества, от нормы.
Способ измерения избыточного количества воды (количества воды в межклеточном веществе, определяющем набухание межклеточного вещества в ее нативном состоянии) предполагает следующие стадии:
1) измеряют количество воды в межклеточном веществе с помощью описанных ранее методов;
2) измеряют зависимость количества воды в межклеточном веществе от внешнего теплового потока (и/или внешнего давления) и определяют величину избыточного количества воды (количества воды, которое определяет набухание межклеточной ткани в ее нативном состоянии);
3) измеряют содержание сахара в крови и климатические параметры;
4) нормируют полученное значение количества воды в межклеточном веществе к содержанию сахара в крови в норме (5 ммоль/л) с учетом климатических параметров;
5) определяют отклонение величины количества воды в межклеточной ткани от ее количества в норме.
Описанный метод позволяет определять изменения состояния межклеточного вещества путем измерения количества воды в межклеточной ткани и сравнения полученного значения со значением нормы.
Определение физиологической нормы живой ткани.
В разделе "Физика межклеточного вещества" было показано, что самоорганизация процессов переноса тепла и вещества (взаимосогласованное функционирование микроциркуляции и клеточного метаболизма) локального участка живой ткани осуществляется благодаря особенностям физических свойств межклеточного вещества, обусловленных особенностями термодинамического поведения межклеточного вещества в нормальных физиологических условиях.
Как было показано, нативное физиологическое состояние живой ткани может реализоваться исключительно в трех фазной области тепловой функции, в которой все три фазы межклеточного вещества (клубок, жидкая фаза, глобула) находятся в термодинамическом равновесии. Нормальная физиологическая температура и нормальное атмосферное давление, при которых реализуется физиологическое состояние живой ткани, соответствуют тройной точке межклеточного вещества, в которой реализуется термодинамическое равновесие между всеми тремя фазами межклеточного вещества.
В разделе "Осмотическое давление межклеточного вещества" выше рассмотрен метод практического измерения параметров, характеризующих физическое состояние межклеточного вещества. Такими параметрами, которые характеризуют фазовое термодинамическое состояние межклеточного вещества, являются осмотическое давление и избыточное количество воды, определяющее набухание межклеточной ткани в ее нативном состоянии.
На практике измерение абсолютной величины избыточного количества воды в межклеточном веществе позволяет определить физическое состояние межклеточного вещества, которое определяет физиологическое состояние локального участка живой ткани. Отклонение физического состояния межклеточного вещества от нормы приводит к отклонениям физиологического состояния живой ткани от нормы.
Физиологическую норму можно определить следующим образом. Физиологическое состояние локального участка живой ткани соответствует физиологической норме в том случае, если межклеточное вещество находится в трехфазной области, в которой сосуществуют все три фазы межклеточного вещества (клубок, жидкая фаза, глобула).
Избыточное количество воды, определяющее набухание межклеточного вещества, и величина движущей силы объемного потока являются индикатором, чувствительным к различным внешним воздействиям и заболеваниям. Описанный метод позволяет количественно определять с высокой точностью отклонения от нормы термодинамического состояния межклеточного вещества локального участка ткани, и как следствие, определять отклонения от нормы физиологического состояния локального участка живой ткани.
Другой способ диагностики физиологического состояния живой ткани: отклонения физиологического состояния живой ткани от физиологической нормы можно определить путем измерения параметров микроциркуляции (максимальное и минимальное давление в системе микроциркуляции, коэффициент фильтрации) с помощью метода, описанного в разделе Способ измерения кровяного давления в системе микроциркуляции.
Физиологическое состояние живой ткани соответствует норме, в том случае, если соответствуют норме параметры микроциркуляции.
В частности, метод можно использовать в косметологии для оценки эффективности воздействия косметических кремов, а также в дерматологии для диагностики патологических состояний кожи (в частности, для диагностики и мониторинга псориаза).
Способ управления транспортом микро-потоками тканевой жидкости в межклеточном пространстве. Межклеточная микрофлюидика.
Способ управления микроциркуляцией тканевой жидкости базируется на возможности изменения объемных микро-потоков тканевой жидкости, циркулирующей в межклеточном пространстве, путем воздействия на живую ткань слабыми воздействиями физической и химической природы. К внешним физическим воздействиям, с помощью которых можно управлять транспортом тканевой жидкости в межклеточном пространстве, относятся: внешнее давление, компрессия и декомпрессия, тепловой поток, постоянное магнитное поле, постоянный электрический ток и др.
На фигурах 12, 19 представлены результаты экспериментов по исследованию эффектов воздействия на локальный участок ткани различных физических факторов - внешнего теплового потока и внешнего давления. Результаты аналогичных экспериментов по исследованию влияния локальной декомпрессии и охлаждения, выполненных нами, доказывают возможность изменения локальных микро-потоков тканевой жидкости в межклеточном пространстве с помощью физических воздействий слабой интенсивности и, тем самым, и доказывают возможность эффективного управления транспортом тканевой жидкости с помощью внешних физических и химических воздействий.
Путем изменения внешнего давления (фигура 19), можно изменять степень набухания межклеточной ткани (содержание воды в межклеточной ткани) и, как следствие, объемный микро-поток тканевой жидкости в межклеточном пространстве и в системе капиллярных сосудов. Избыточное внешнее давление на локальную поверхность тела приводит к набуханию межклеточной ткани, а локальная декомпрессия (вакуум), наоборот, приводит к сжатию межклеточной ткани. При таком способе сжатия межклеточной ткани происходит увеличение просвета капиллярных сосудов и увеличение просвета каналов в межклеточном пространстве, по которым осуществляется циркуляция тканевой жидкости. Результатом такого локального воздействия является увеличение скорости объемного потока через капиллярные сосуды и объемного потока тканевой жидкости, циркулирующего в межклеточном пространстве.
В экспериментах с воздействие локальной декомпрессии было установлено, что локальное снижение давления, относительно атмосферного, приводит к эффекту уменьшения содержания воды в межклеточной ткани, вызываемого эффектом сжатия межклеточной ткани. Локальная декомпрессия в этих экспериментах осуществлялась с помощью аппарата локальной декомпрессии Алодек - 4ак. Локальное воздействие на поверхность тела осуществляется с помощью специального вакуумного аппликатора (своеобразной "банки"), внутри которого создается и поддерживается режим дозированной декомпрессии.
Такой метод локального пульсирующего воздействия на ткань приводит к периодическим пульсациям осмотического и эластического давления межклеточной ткани, а также гидравлического давления в системе капиллярных сосудов в объеме ткани под вакуумным аппликатором. Такое воздействие приводит к пульсациям объема межклеточного пространства, характеризующимся возникновением пульсирующих потоков жидкости, циркулирующих в системе: "капилляры системы кровообращения -межклеточное пространство - лимфатическая дренажная система". Таким способом, с помощью внешнего воздействия, обеспечивается управление транспортом тканевой жидкости и лимфатическим дренажом локального участка ткани.
Физиотерапевтический эффект такого воздействия становится понятным если учесть, что объемный поток тканевой жидкости обеспечивает доставку питательных веществ и кислорода к клеткам ткани и отвод продуктов клеточного метаболизма в систему кровообращения и лимфатическую систему. В результате этого процесса, инициируемого внешним воздействием, ткань начинает эффективней снабжаться сахарами, питательными веществами и кислородом. Как естественное следствие, ускоряются процессы клеточного метаболизма и обмена веществ: растет скорость метаболизма клеток ткани, что является стимулирующим фактором роста клеток и регенерации тканей.
Плавная регулировка глубины вакуума в аппликаторе позволяет регулировать и устанавливать глубину слоя ткани, в которой вызывается, стимулированный внешним воздействием, дренажный эффект. Глубина дренажного эффекта "X" связана с величиной отрицательного давления "Р" следующим соотношением:
P=F(P0, X, L0),
где Р0 - тканевое давление;
L0 - толщина (глубина) объема ткани под аппликатором.
Величину тканевого давления Р0 можно определить путем измерения количества воды в межклеточной ткани или кровяного артериального давления. Толщину (глубину) объема ткани под аппликатором можно определить путем измерения периметра окружности, контролируемого участка тела.
Плавная регулировка частоты и скважности пневмо-импульсов позволяет регулировать и устанавливать величину объемного микро-потока тканевой жидкости.
Аналогичного эффекта можно достигнуть путем изменения внешней температуры или охлаждения (нагрева). Локальное охлаждение поверхности ткани вызывает сжатие межклеточного вещества, а нагрев ткани приводит к ее набуханию. На фигурах 19 и 20 представлены результаты экспериментов по исследованию, эффекта воздействия внешних тепловых потоков на состояние межклеточного вещества. Видно, что локальное воздействие теплового потока на поверхность тела приводит к увеличению содержания воды в межклеточном веществе локального участка, вызванному его набуханием. Локальное охлаждение поверхности тела, наоборот, приводит к уменьшению содержания воды в межклеточном веществе в результате сжатия межклеточной ткани.
Эффекты сжатия и расширения межклеточного вещества можно стимулировать, также, с помощью слабого постоянного электрического поля и постоянного магнитного поля. Оказалось, что механическое равновесие системы "межклеточное вещество - капилляр", которое определяет содержание воды в межклеточной ткани, также чувствительно также к слабым постоянным электрическим и магнитным полям. Механизм такой чувствительности становится понятным, если учесть, что постоянное электрическое поле (постоянный электрический ток) приводит к возникновению в эпидермисе живой ткани электрокинетических явлений, в частности явления электроосмоса, обусловленного изменением равновесного распределения электрических ионов тканевой жидкости в объеме ткани, что в свою очередь приводит к нарушению механического равновесия системы и к изменению содержания воды в межклеточном пространстве. Электрический ток, направленный из глубины к поверхности кожи, приводит к эффекту расширения межклеточного вещества. Изменение направления электрического тока, наоборот, приводит к эффекту сжатия межклеточного вещества.
Механизм чувствительности к постоянному магнитному полю основан на том, что перенос заряженных ионов в объеме ткани осуществляется потоками межклеточной жидкости, а постоянное магнитное поле приводит перераспределению этих потоков и нарушению механического равновесия системы.
Таким образом, способ управления транспортом тканевой жидкости и лимфатическим дренажом основан на воздействии на ткань с помощью различных физических факторов, которые вызывают обратимые изменения микро-потоков тканевой жидкости в межклеточном пространстве. К числу физических факторов, с помощью которых можно управлять транспортом тканевой жидкости, относятся: локальное поверхностное охлаждение (нагрев) или тепловое электромагнитное излучение; локальная декомпрессия и избыточное давление; постоянный электрический ток и магнитное поле, акустические колебания (низкочастотная вибрация, ультразвук и т.д.) и другие факторы.
К эффектам, описанным выше, приводят, как правило, локальные воздействия низкой интенсивности. Характерные мощности и величины физических воздействий составляют: электромагнитные излучения 0-20 мВт/см2, значения локальной декомпрессии 0-100 мм рт. ст., величины постоянного электрического тока 0-100 нА, значения напряженности постоянного магнитного поля 0-50 мТл.
Метод управления транспортом тканевой жидкости, который описан выше, может быть использован при лечении различных заболеваний. Разные заболевания могут приводить к разным характерным изменениям состояния межклеточной ткани.
Лечение и профилактику заболеваний, которые сопровождаются, превышающим норму, набуханием ткани (состояние "отека ткани"), можно осуществлять с помощью воздействий, которые вызывают локальное сжатие межклеточного вещества (локальная декомпрессия, охлаждение).
Лечение и профилактику заболеваний, которые сопровождаются пониженным содержанием воды в межклеточной ткани, можно осуществлять с помощью воздействий, рассмотренных выше, которые вызывают локальное увеличение степени набухания межклеточной ткани (локальная компрессия, нагрев).
Способ управления транспортом тканевой жидкости в межклеточном пространстве живой ткани предполагает следующие стадии: (без оценки сравнительной)
1) измеряют содержание воды в объеме локального участка ткани;
2) по содержанию воды в объеме ткани определяют физиологическое состояние ткани;
3) по состоянию межклеточной ткани определяют способ внешнего воздействия и режим воздействия;
4) осуществляют внешнее воздействие;
5) контроль эффективности воздействия осуществляют путем измерения содержания воды в контролируемом объеме ткани.
К числу таких заболеваний, которые эффективно удается лечить с помощью данного способа, относятся:
заболевания позвоночника, в частности, остеохондроз;
заболевания суставов;
заболевание, известное как заболевание "апельсиновая корка" и другие заболевания;
заболевания внутренних органов.
Способ позволяет осуществлять стимуляцию роста клеток ткани молочной железы, приводит к увеличению эластичности ткани лица и других частей тела.
Способ управления транспортом тканевой жидкости, рассмотренный выше, применим, также, для лечения и профилактики диабета 2 типа.
Способ диагностики сердечно-сосудистых нарушений.
Как показано выше в разделе "Физика межклеточного вещества", термодинамическое фазовое состояние межклеточного вещества определяется однозначно биохимическим составом крови и климатическими параметрами.
В частности, показано, что при фиксированных значениях климатических параметров, распределение гидравлического давления в кровеносных сосудах, в частности, в сосудах системы микроциркуляции, однозначно определяется концентрацией сахара крови.
В общем случае, гидравлическое давление в системе кровообращения пропорционально зависит от уровня сахара крови и климатических параметров. В практическом плане, путем измерения климатических параметров и концентрации сахара крови, можно расчетным путем однозначно определить кровяное давление в различных отделах системы кровообращения.
Например, при концентрации сахара в крови равной 4.5 мМоль/литр, распределение давления в системе кровообращения характеризуется следующими значениями (в мм ртутного столба): среднее артериальное давление - 100, давление на артериальном конце капилляра - 54, среднее капиллярное давление - 25, давление на венозном конце капилляра - 7.
Метод позволяет однозначно определить, путем измерения климатических параметров и уровня сахара крови, величины следующих параметров сердечнососудистой системы: характерные гидравлические давления в системе кровообращения; артериальное, венозное и капиллярное гидравлические сопротивления; величины транс капиллярных потоков (результирующий, фильтрационный и абсорбционный); частоту и мощность сердечных сокращений. В условиях нормы, при фиксированных значениях климатических параметров, изменения уровня сахара крови приводят к пропорциональным изменениям давления в системе кровообращения. Другие параметры, характеризующие состояние сердечно - сосудистой системы, также являются функциями содержания сахара в крови.
Способ диагностики сердечно-сосудистых нарушений предусматривает следующие стадии:
1) измеряют климатические параметры и уровень сахара крови;
2) расчетным путем, по содержанию сахара крови и значениям климатических параметров с помощью методики, описанной в разделе "Физика межклеточного вещества", определяют величину, контролируемого параметра, характеризующего сердечно-сосудистую систему. В качестве такого параметра, например, может быть выбрано гидравлическое давление в системе кровообращения;
3) путем измерения определяют величину контролируемого параметра, характеризующего сердечно-сосудистую систему;
4) определяют отклонение величины контролируемого параметра, полученной путем измерения, от его значения, определенного расчетным путем по измерениям уровня сахара в крови и климатических параметров и определяют характер и причину отклонения параметра от нормы.
Методика позволяет, по известным значениям климатических параметров и уровня сахара крови, определить параметры сердечно-сосудистой системы. К числу таких параметров относятся: среднее капиллярное давление; давление на венозном и артериальном концах капилляра; артериальное, венозное и капиллярное гидравлические сопротивления; результирующий транс капиллярный поток.
Отклонение значений параметров, полученных путем прямого измерения, от величины этих параметров, определенных путем измерения температуры и уровня сахара крови ("норма"), является прямым указанием на патологические нарушения в сердечно-сосудистой системе. В частности, описанный способ диагностики позволяет осуществлять диагностику патологических состояний сердечно-сосудистой системы, которые характеризуются повышенным кровяным давлением (гипертония) и состояния, которые характеризуются пониженным кровяным давлением (гипотония).
Таким образом, отклонения величины давления в сердечно-сосудистой системе от величины давления, которое определяется расчетным путем исходя из значений уровня сахара крови и климатических параметров, позволяет осуществлять диагностику сердечно-сосудистых нарушений, в частности, определять состояния с повышенным и пониженным давлением.
Способ диагностики сердечно-сосудистых нарушений: мониторинг состояния сердечнососудистой системы у больных диабетом
Метод диагностики, описанный в предыдущем разделе "Способ диагностики сердечно-сосудистых нарушений", позволяет осуществлять диагностический мониторинг состояния системы кровообращения у больных диабетом. Как известно, диабетическое состояние сопровождается нарушениями сердечно-сосудистой системы. При заболевании диабетом патологическим изменениям подвергаются, как система периферического кровообращения, так и центрального кровообращения.
Причиной возникновения патологических изменений в системе кровообращения является повышенный уровень сахара в крови. Повышенное значение уровня сахара в крови приводит к повышенным значениям давления в системе кровообращения. Биофизический механизм, определяющий однозначную связь кровяного давления в системе микроциркуляции с уровнем сахара крови, подробно рассмотрен в разделе "Физика межклеточного вещества". Продолжительное сохранение, превышающего норму, повышенного давления в системе кровообращения сопровождается повышенной нагрузкой на работу сердца и сосудов и, как следствие, приводит к развитию патологических сердечно-сосудистых нарушений.
По указанной причине мониторинг состояния системы кровообращения диабетических больных является на сегодняшний день актуальной и злободневной задачей. Такой мониторинг позволит пациентам с заболеванием диабетом своевременно корректировать терапию и избежать развития хронических сердечно-сосудистых заболеваний, которые в настоящее время являются основной причиной смертельных исходов у пациентов с заболеваниями диабета. В частности, описанный метод позволяет осуществлять раннюю диагностику и мониторинг заболевания известного как "диабетическая стопа".
Способ диагностики физиологического состояния живой ткани
В разделе "Физика межклеточной ткани" показано, что распределение гидравлического давления в системе микроциркуляции, а также распределение осмотического давления межклеточного вещества в объеме ткани между кровеносными капиллярами определяются термодинамическим фазовым состоянием межклеточного вещества.
Термодинамическое состояние межклеточного вещества, с другой стороны, является функцией биохимического состава крови и климатических параметров. Синхронизация объемных микро-потоков вещества и тепла (включающая циркуляцию крови в системе кровеносных капилляров, тканевой жидкости в межклеточном пространстве, сахара и продуктов клеточного метаболизма) осуществляется благодаря своеобразным термодинамическим свойствам межклеточного вещества.
Изменение термодинамических свойств межклеточного вещества, в результате развития патологических нарушений различной природы, приводит к нарушениям и отклонениям от взаимосогласованного (синхронного) функционирования системы: кровеносный капилляр - межклеточная ткань - клетка ткани.
Метод измерения параметров, характеризующих термодинамическое состояние межклеточного вещества, описанный в разделе "Способ измерения осмотического давления межклеточного вещества" открывает новые возможности для диагностики физиологического состояния живой ткани.
Способ диагностики предусматривает следующие стадии:
1) измеряют величину параметра, характеризующего состояние межклеточной ткани, например, количество воды в межклеточной ткани, осмотическое давление или результирующий транс капиллярный поток;
2) измеряют климатические параметры и уровень сахара крови;
3) определяют, расчетную величину параметра, характеризующего состояние межклеточной ткани;
4) определяют отклонение величины параметра, полученной путем измерений, от величины этого параметра, полученной расчетным путем по значениям климатических параметров и уровня сахара крови;
5) по величине отклонения (п.4) определяют характер отклонения и степень патологического состояния живой ткани.
Другой способ диагностики функционального состояния локального участка ткани основан на регистрации в реальном времени динамического отклика параметра, характеризующего состояние живой ткани, в ответ на слабое внешнее воздействие. Здесь и далее под динамическим откликом понимается динамика временного изменения параметра, характеризующего физиологическое состояние ткани, в ответ на внешнее воздействие. К числу воздействий, которые приводят к изменению состояния межклеточной ткани, относятся воздействия различной природы (физической, физиологической или химической). К числу внешних физических воздействий относятся, например, внешний тепловой поток, внешнее давление и т.д.
Путем изменения внешней температуры или нагрева (охлаждения) поверхности тела можно изменять степень набухания ткани или количество воды в межклеточном пространстве. Аналогичного эффекта можно добиться за счет изменения внешнего давления относительно атмосферного давления. Локальная декомпрессия (вакуум) вызывает сжатие межклеточной ткани, а избыточное давление наоборот, приводит к ее набуханию.
Эффекты, описанные выше, являются следствием физических свойств межклеточного вещества. По этой причине, по величине и характеру динамического отклика параметра, характеризующего состояние ткани, можно определить возможные отклонения свойств живой ткани от физиологической нормы. Например, локальное тепловое воздействие на поверхность тела электромагнитного излучения (инфракрасное или оптическое) приводит в реальном времени к характерному локальному отклику параметров, характеризующих состояние межклеточной ткани контролируемого локального участка. При таком воздействии изменяется осмотическое давление межклеточной ткани, в результате которого происходит увеличение гидравлического давления в системе микроциркуляции и, как следствие, происходит возрастание результирующего транс капиллярного потока и плотности потока воды через локальный участок РСЭ. Характерной особенностью отклика, соответствующего физиологической норме, в ответ на внешнее тепловое воздействие является то, что изменение мощности испарительного охлаждения, определяемого изменением плотности потока воды через РСЭ, оказывается в точности равным мощности теплового воздействия. Тепловое воздействие, мощностью 1 мВт /см2, приводит к увеличению величины результирующего транс капиллярного потока и плотности потока воды через РСЭ, (определяющих интенсивность процесса испарительного охлаждения), эквивалентного возрастанию интенсивности испарительного охлаждения на 1 мВт /см2. Характерная постоянная времени формирования такого отклика составляет несколько секунд. Изменение свойств межклеточной ткани, которое возникает в результате нарушений и патологий различной природы, приводит к изменению характерного отклика в ответ на слабое воздействие физической природы. Характерные результаты экспериментов по исследованию эффекта воздействия тепловых потоков на состояние межклеточной ткани представлены на фигурах 18 и 19.
Способ диагностики предполагает следующие стадии:
1) в реальном времени измеряют величину параметра, характеризующего физиологическое состояние живой ткани (например, количество воды в межклеточном веществе);
2) осуществляют локальное дозированное воздействие на ткань с помощью физических факторов слабой интенсивности (примеры физических факторов: внешнее тепловое воздействие, внешнее давление, постоянный электрический ток и постоянное магнитное поле);
3) в реальном времени измеряют динамический отклик регистрируемого параметра в ответ на внешнее воздействие (например, тепловой поток) и определяют величину плотности потока воды через эпидермис;
4) по величине плотности потока воды через эпидермис и характеру динамического отклика (интенсивность отклика, временная задержка, характер временной динамики) определяют отклонение физиологического состояния локального участка ткани от нормы и осуществляют диагностику физиологического состояния.
Другая возможность функциональной диагностики локального участка ткани описана в разделе "Способ измерения осмотического давления межклеточного вещества" и основана на измерении зависимости количества воды в межклеточной ткани от внешнего воздействия.
Измерение количества воды в межклеточной ткани в зависимости от внешнего теплового воздействия (фигура 19) позволяет определить количество воды, которое определяет набухание межклеточного вещества. Описанный метод позволяет не только определить количество воды в межклеточной ткани, но также провести нормировку этого параметра по климатическим параметрам и уровню сахара крови. Возможность такой нормировки позволяет определить отклонения измеряемого параметра, характеризующего физиологическое состояние живой ткани от нормы.
Аналогичным образом осуществляется диагностика патологического состояния межклеточной ткани с применением воздействий (физических и физиологических) другой природы. К числу таких физических воздействий относятся также внешнее давление, локальная декомпрессия, постоянный электрический ток, постоянное магнитное поле и др. Примерами физиологических воздействий являются: сахарная проба, различные лекарственные препараты, оказывающие влияние на свойства межклеточной ткани.
Способ измерения количества воды в межклеточном веществе, определяющем набухание межклеточной ткани, предполагает следующие стадии:
6) измеряют количество воды в межклеточном веществе с помощью описанных ранее методов;
7) измеряют зависимость количества воды в межклеточном веществе от внешнего теплового потока (или внешнего давления) и определяют количество воды, которое определяет набухание межклеточной ткани;
8) измеряют содержание сахара крови и климатические параметры;
9) нормируют полученное значение количества воды в межклеточной ткани к содержанию сахара крови в норме (5 ммоль/л);
10) определяют отклонение величины количества воды в межклеточной ткани от ее количества в норме.
Описанный метод позволяет определять изменения физиологического состояния ткани путем измерения количества воды в межклеточном веществе и сравнения полученного значения со значением нормы.
Метод измерения избыточного количества воды (или количества воды, определяющей набухание межклеточного вещества) допускает простое количественное определение нормы физиологического состояния локального участка ткани через понятие физического состояния межклеточного вещества.
Определение физиологической нормы рассмотрено в разделе "Определение физиологической нормы".
Физиологическое состояние локального участка живой ткани соответствует физиологической норме в том случае, если термодинамическое (физическое) состояние межклеточного вещества соответствует трехфазному состоянию, в котором сосуществуют все три фазы вещества (клубок, жидкая фаза, глобула).
Избыточное количество воды, определяющее набухание межклеточной ткани, и величина движущей силы объемного потока являются индикатором, чувствительным к различным внешним воздействиям и заболеваниям. Описанный метод позволяет определять количественно с высокой точностью отклонения от нормы состояния межклеточного вещества локального участка ткани.
Методы диагностики, описанные выше, могут быть использованы для ранней диагностики различных заболеваний, развитие которых сопровождается изменением свойств межклеточной ткани. К числу таких заболеваний относятся:
злокачественные опухоли, развитие которых сопровождается характерными изменениями локализованных областей ткани;
заболевание, известное как "апельсиновая корка", и развитие которого сопровождается характерными изменениями кожи и подкожной клетчатки;
различные стадии ожирения;
заболевания диабетом 1 и 2 типа, которые сопровождаются характерными изменениями свойств межклеточной ткани (например, чувствительность ткани к инсулину) и микроциркуляции;
некоторые сердечно-сосудистые заболевания, развитие которых сопровождается характерными изменениями межклеточной ткани и многие другие заболевания.
Кроме того, описанный метод диагностики патологических состояний межклеточной ткани может использоваться в косметологии и эстетической медицине для оценки функционального состояния кожи, а также для визуализации и оценки эффективности действия различных косметологических кремов и лекарственных препаратов на кожу.
Для реализации описанного в настоящем разделе "Способ диагностики функционального (физиологического) состояния локального участка ткани" используется устройство для измерения количества воды в межклеточной ткани.
Способ определения чувствительности ткани к инсулину. Диагностика пре диабетического состояния.
Метод измерения уровня сахара в крови, описанный выше, позволяет определять уровень сахара в крови путем измерения количества воды в межклеточной ткани локального участка ткани и климатических параметров.
Данный метод позволяет проводить регистрацию уровня сахара в крови в режиме мониторинга (одно измерение через каждые 5-10 секунд). На фигуре 16 показаны результаты мониторинга уровня сахара в крови в условиях проведения стандартного теста толерантности к глюкозе ("непрерывная сахарная кривая"). Для сравнения, современные руководства определяют, как "сахарную кривую" несколько измерений (как правило, 3-4) по пробам крови, взятым из пальцев руки, с интервалом между измерениями примерно 30 минут. Экспериментальные результаты, представленные на фигуре 16, получены с помощью опытного прибора, внешний вид которого представлен на фигуре 15.
Способ регистрации сахарной кривой, основанный на непрерывном измерении временной динамики локального параметра, характеризующего состояние межклеточной ткани локального участка, открывает принципиально новые возможности для диагностики пред диабетического состояния и определения чувствительности локальной ткани к инсулину.
Нарушение толерантности к глюкозе.
Современные руководства по медицине определяют нарушение толерантности к глюкозе (НТГ) как концентрации глюкозы в крови в ходе перорального теста толерантности к глюкозе, лежащие в промежутке между нормальными и диабетическими значениями (через 2 часа после приема 75 г глюкозы - от 7,8 до 11,0 ммоль/л). По-видимому, НТГ можно считать пред диабетическим состоянием, хотя не у всех лиц с НТГ развивается диабет. В США НТГ имеется у каждого десятого взрослого, причем его частота увеличивается с возрастом, достигая каждого четвертого среди лиц в возрасте 65-74 лет. Эпидемиологические исследования, проведенные в разных странах, указывают на тесную связь между НТГ и ожирением. Например, в исследовании, проведенном в США, было обнаружено, что средний ИМТ (избыточная масса тела) у лиц, у которых впоследствии развилось НТГ, был достоверно выше, чем у лиц с нормальным ИМТ. В исследовании, проведенном в Израиле, установили, что высокий ИМТ в анамнезе сопровождался повышенной частотой развития НТГ за период 10 лет.
Способ регистрации сахарной кривой, описанный выше, позволяют проводить определение НТГ в режиме непрерывного мониторинга с более высокой точностью. В частности, метод эффективен для определения пред-диабетического состояния 2 типа.
Способ определения чувствительности ткани к инсулину.
Метод непрерывной регистрации временной динамики скорости локального метаболизма ткани (скорости поглощения сахара локальным участком ткани), описанный выше, позволяет определять чувствительность ткани к инсулину по характеру временной динамики скорости поглощения сахара тканью. Способ определения чувствительности ткани к инсулину основан на непрерывной регистрации временной динамики скорости поглощения сахара тканью. Измеряется количество воды в межклеточном веществе локального участка ткани и регистрируется изменения временной динамики в результате внешних воздействий, приводящих к характерным изменениям чувствительности ткани к инсулину. Как известно, воздействие некоторых внешних факторов, физиологических и физических, на ткань приводит к обратимым изменениям чувствительности ткани к инсулину. К числу таких факторов, относятся, в частности, мышечная нагрузка и температурные воздействия [2]. К внешним воздействиям, которые вызывают обратимые изменения чувствительности ткани к инсулину, относятся воздействия, которые приводят к обратимым изменениям фазового состояния межклеточного вещества. Внешние физические параметры, которые определяют фазовое состояние межклеточного вещества, рассмотрены в разделе "Основные положения физики межклеточного вещества". К числу таких внешних физических факторов относятся: внешнее давление; локальная декомпрессия; внешняя температура; электромагнитное излучение, вызывающее объемный нагрев ткани; слабый постоянный электрический ток; постоянное магнитное поле; локальная мышечная нагрузка на ткань и др.
Способ определения чувствительности ткани к инсулину предполагает следующие стадии:
1) в режиме непрерывного мониторинга, измеряют скорость локального метаболизма ткани (скорость поглощения сахара тканью) в процессе стандартной сахарной нагрузки (пероральный прием внутрь 75 г глюкозы), путем измерения количества воды в межклеточной ткани и климатических параметров;
2) на контролируемый локальный участок ткани оказывают внешнее физическое воздействие, которое вызывает обратимое изменение чувствительности ткани к инсулину;
3) по характеру временной динамики скорости локального метаболизма определяют чувствительность ткани к инсулину.
В экспериментах с мышечной нагрузкой было установлено, что нагрузка приводит к характерным изменениям временной динамики: происходит уменьшение регистрируемого параметра и через характерное время, равное 1-2 минутам, начинается его рост. Такой характер изменений содержания воды в межклеточной ткани связан с характерными изменениями содержания сахара в крови в условиях мышечной нагрузки. Уменьшение содержания воды в межклеточной ткани после начала нагрузки вызвано уменьшением локального содержания сахара в крови и межклеточной жидкости. Падение уровня сахара в межклеточной жидкости, на начальном участке временной динамики, связано с увеличением локальной чувствительности ткани к инсулину в ответ на мышечную нагрузку. Последующее увеличение содержания воды в межклеточной ткани, приводящее к увеличению содержания воды в РСЭ, вызвано ростом содержания сахара в тканевой жидкости в результате расщепления гликогена, содержащегося в мышечных клетках.
Способ диагностики патологического состояния внутренних органов
Способ диагностики заключается в регистрации, в реальном времени пространственно - временного распределения параметра, характеризующего физиологическое состояние живой ткани локального участка на поверхности тела. Параметрами, которые характеризуют физиологическое состояние живой ткани локального участка, являются, например, осмотическое давление межклеточного вещества, содержание воды в межклеточном веществе, величина результирующего транс капиллярного потока воды.
Регистрация пространственно-временного распределения осуществляется с помощью многоканальной системы, датчики которого устанавливаются на поверхности контролируемого участка тела, или с помощью системы сканирования.
Возможность диагностики состояния внутренних органов путем измерения содержания воды в межклеточной ткани поверхностного слоя тела, базируется на свойствах межклеточной ткани и особенностях недиффузионного механизма теплопереноса из глубины к поверхности.
В условиях физиологической нормы, температура внутреннего органа (37°), как правило, выше температуры поверхностных тканей (30°). Такая разница температуры приводит к градиенту осмотического давления межклеточного вещества и гидравлического давления в "капиллярах" межклеточной ткани, по которым осуществляется транспорт тканевой жидкости. Транспорт тканевой жидкости из глубины к поверхности осуществляется в результате разницы гидравлического давления. Этот процесс обеспечивает перенос тепла, образующегося в результате клеточного метаболизма, из глубины к поверхности и одновременно поддерживает процесс испарительного охлаждения (неощутимая перспирация).
Развитие патологического состояния внутреннего органа сопровождается изменением состояния межклеточной ткани этого органа. Например, в том случае, когда хроническое заболевание внутреннего органа характеризуется пониженным уровнем органного метаболизма, осмотическое давление межклеточной ткани и давление в системе микроциркуляции также являются пониженными. Соответственно является пониженным скорость циркуляции тканевой жидкости в направлении к поверхности. В конечном счете, этот процесс приводит к появлению пространственной неоднородности содержания воды в межклеточной ткани и плотности потока воды через РСЭ.
Таким образом, пространственно-временное динамическое картирование (в реальном времени) содержания воды в межклеточной ткани позволяет осуществлять диагностику патологического состояния внутренних органов и определять отклонения органного метаболизма от нормы:
1) регистрируют пространственно-временное распределение содержания воды в межклеточной ткани;
2) по характеру неоднородности пространственно-временного распределения проводят локализацию проблемного участка;
Способ диагностики предусматривает следующие стадии:
3) по измерениям содержания воды в межклеточной ткани в двух точках (участках, зонах) поверхности тела - непосредственно совпадающей с областью пространственной неоднородности и вне этой области, определяют величину дифференциальной разницы;
4) по дифференциальной разнице величины контролируемого параметра в двух точках поверхности осуществляют диагностику.
Метод диагностики может быть основан также на сравнении значений параметров, полученных путем прямых измерений, с их значениями, полученными исходя из измерений содержания сахара в крови и климатических параметров. Такая диагностика предусматривает следующие дополнительные стадии:
5) измеряют климатические параметры и уровень сахара крови;
6) определяют, расчетную величину параметра, характеризующего физиологическое состояние ткани;
7) определяют отклонение величины параметра, полученной путем измерений, от величины этого параметра, полученной расчетным путем (по значениям климатических параметров и уровня сахара крови);
8) по величине отклонения (п. 7) контролируемого параметра, определяют характер и степень патологического состояния внутреннего органа.
Метод измерения, описанный в разделе "Способ определения осмотического давления межклеточной ткани и давления в системе микроциркуляции", позволяет осуществить практическую реализацию "Способа диагностики патологического состояния внутренних органов", описанного выше, отличающимся способом. Такой способ предусматривает следующие стадии:
1) в реальном времени регистрируют пространственно-временное распределение содержания воды в межклеточной ткани;
2) по характеру пространственного распределения и особенностям временной динамики содержания воды в межклеточной ткани проводят локализацию проблемного участка;
3) измеряют климатические параметры и уровень сахара крови;
4) расчетным путем, по измеренным значениям климатических параметров и уровня сахара крови, определяют значение параметров микроциркуляции и межклеточного вещества;
5) измеряют параметры, характеризующие состояние локального участка живой ткани с помощью метода, описанного в разделе "Способ измерения осмотического давления межклеточной ткани и давления в системе микроциркуляции".
6) по отклонениям величин параметров, полученных путем измерений, от величин этих параметров, полученных расчетным путем, осуществляют диагностику состояния внутреннего органа.
Разновидностью методов диагностики, рассмотренных выше, является диагностика с применением физиологических проб и внешних воздействий. Метод диагностики с применением внешних воздействий и физиологических нагрузок по существу не отличается от метода, описанного в разделе "Способ диагностики патологического состояния межклеточной ткани".
Физиологические пробы могут быть локальными и общими. К числу локальных физиологических проб относятся: тепловое воздействие, внешнее давление, локальная декомпрессия, электрический ток, локальная мышечная нагрузка. Примером общей физиологической пробы является, например, стандартная сахарная нагрузка, применяемая при проведении теста толерантности к глюкозе.
В условиях упомянутых физиологических воздействий характерный отклик локального метаболизма поверхностного участка ткани, как правило, будет неоднородным при нарушениях органного метаболизма. Физиологическая нагрузка позволяет визуализировать внутренние области тела, которые характеризуются нарушенным метаболизмом ткани.
Способы диагностики, описанные выше, позволяют проводить диагностику патологического состояния внутренних органов, а также диагностику заболеваний, развитие которых сопровождаются образованием, локальных областей с измененными свойствами ткани. К числу таких заболеваний относятся злокачественные образования или раковые опухоли. В частности, метод позволяет обнаруживать рак молочной железы на ранних стадиях его развития, практически на любой глубине.
Способ диагностики рака молочной железы
Как известно, процесс образования и роста злокачественной опухоли рака молочной железы сопровождается характерными физиологическими изменениями ткани в области локализации опухоли, а также изменениями ткани в поверхностной области, определяемой проекцией области опухоли на поверхность.
К числу физиологических изменений, которые происходят в области локализации раковой опухоли, можно отнести следующие характерные изменения:
повышенный уровень метаболизма глюкозы, который характеризуется повышенной скоростью поглощения сахара раковой тканью, регистрируемой с помощью позитрон - эмиссионного томографа;
нехарактерная для нормальной ткани, высокая скорость размножения раковых клеток;
характерное уплотнение ткани, регистрируемое рентгеновскими методами;
характерные изменения микроциркуляции, регистрируемые оптическими методами.
Характерные физиологические изменения происходят и в поверхностных тканях, локализация которых определяется проекцией области опухоли на поверхность. К числу таких изменений относятся: изменения микроциркуляции, которые характеризуются изменением поверхностной температуры, регистрируемой с помощью методов тепловидения.
По мере роста раковой опухоли происходит постепенное втягивание поверхностных тканей, расположенных над областью опухоли, внутрь молочной железы.
Злокачественные опухоли обладают повышенным уровнем метаболизма глюкозы и повышенным потреблением сахара тканью и, как следствие, повышенным уровнем теплопродукции.
"Золотым стандартом" среди известных методов диагностики рака молочной железы является рентгеновский маммограф, который позволяет с высокой вероятностью обнаруживать и локализовать раковую опухоль. Однако рентгеновский метод не позволяет идентифицировать раковую опухоль, отличить раковую опухоль от доброкачественной опухоли. В клинической практике для этих целей применяют метод биопсии, который является дорогостоящим и болезненным.
Методом, который позволяет обнаруживать и идентифицировать злокачественные образования является позитрон - эмиссионной томограф.
Области раковой ткани, которые отличаются повышенной скоростью поглощения сахара, обнаруживаются, с высоким пространственным разрешением, с помощью позитрон - эмиссионного томографа (ПЭТ томограф). Однако практическое применение ПЭТ томографа для ранней диагностики и скрининга рака молочной железы ограничено, поскольку оборудование является дорогостоящим.
Анализ и осмысление характерных физиологических изменений, происходящих в процессе развития раковой опухоли, которые были проведены на основе понимания физических свойств межклеточной ткани, рассмотренных в разделе "Основные положения физики межклеточной ткани", позволяют объяснить механизм основных изменений, происходящих в ткани молочной железы, пораженной раком.
В ткани молочной железы, пораженной раковой опухолью, происходит локальное уменьшение тканевого давления и сжатие межклеточной ткани в области опухоли. Этот процесс приводит к постепенному уплотнению ткани в области опухоли. Сжатие межклеточной ткани приводит к увеличению просвета капиллярных сосудов и каналов в межклеточном пространстве, по которым осуществляется циркуляция тканевой жидкости в межклеточном пространстве, и увеличению объемного потока тканевой жидкости. В результате происходит увеличение скорости поступления Сахаров к раковой клетке. Увеличивается скорость поглощения сахара клеткой и скорость метаболизма в локальной области ткани. Такие изменения, очевидно, поддерживают процесс размножения раковых клеток.
В объеме ткани, расположенном между областью опухоли и ее проекцией на поверхность, также происходят характерные изменения ткани. Уменьшение осмотического давления межклеточной ткани в области опухоли приводит к уменьшению (или выравниванию) градиента осмотического давления межклеточной ткани в направлении от опухоли к поверхности. Следствием этого является существенное уменьшение скорости транспорта воды через эпидермис и уменьшение содержания воды в межклеточной ткани поверхностных слоев, в частности кожи и РСЭ. Уменьшение интенсивности испарительного охлаждения, при одновременном увеличении скорости метаболизма глюкозы и теплопродукции, приводит к повышению температуры ткани в области опухоли, а также температуры области поверхности, определяемой проекцией области опухоли на поверхность тела. Развитие и рост опухоли сопровождается постепенным сжатием межклеточной ткани в области между опухолью и ее проекцией на поверхность. Этот процесс приводит к появлению напряжения упругой деформации, в направлении от поверхности тела к области опухоли, в результате которого поверхность постепенно по мере роста опухоли затягивается внутрь.
Способы диагностики, описанные выше, позволяют осуществлять диагностику в двух возможных практических модификациях:
1) Дополнительная диагностика. В этом варианте метод используется, как метод дополнительный к стандартному рентгеновскому методу;
2) Основная диагностика. В этом варианте метод используется, как независимый от других методов, самостоятельный метод диагностики.
Способ ранней диагностики рака молочной железы по варианту "Дополнительная диагностика" предполагает следующие стадии:
1) С помощью рентгеновского метода осуществляют обнаружение и локализацию опухоли;
2) измеряют величину параметра, характеризующего физиологическое состояние живой ткани, например, количество воды в межклеточной ткани, осмотическое давление или результирующий транс капиллярный поток. Измерение осуществляют в двух точках (участках, зонах) поверхности тела - непосредственно совпадающей с областью проекции опухоли на поверхность и вне этой области;
3) по дифференциальной разнице величины параметра в двух точках поверхности осуществляют диагностику.
Метод диагностики может быть основан также на сравнении значений параметров, полученных путем измерений, с их значениями, полученными расчетным путем. Такая диагностика предусматривает следующие дополнительные стадии:
4) измеряют климатические параметры и уровень сахара крови;
5) определяют, расчетную величину параметра, характеризующего физиологическое состояние межклеточной ткани;
6) определяют отклонение величин параметров, полученных путем измерений, от величин этих параметров, полученных расчетным путем по значениям климатических параметров и уровня сахара крови;
7) по характерным отклонениям величин параметров определяют характер и степень патологического состояния ткани локального участка.
Физиологические изменения, происходящие в ткани в процессе развития раковой опухоли, приводят также к изменению характера динамических откликов межклеточной ткани, в ответ на различные физиологические воздействия. В частности, видоизменяется отклик межклеточной ткани на воздействие слабых тепловых потоков и внешних давлений. Также видоизменяется локальный отклик ткани в ответ на сахарную нагрузку. Эти особенности открывают дополнительные возможности для диагностики рака молочной железы. Такая диагностика основана на регистрации временной динамики параметра, характеризующего состояние межклеточной ткани, в условиях различных физиологических воздействий и предусматривает следующие дополнительные или независимые стадии:
5) в реальном времени измеряют величину параметра, характеризующего состояние межклеточной ткани (например, количество воды в межклеточной ткани);
6) осуществляют локальное дозированное воздействие на ткань с помощью физических факторов слабой интенсивности (примеры физических факторов: тепловое воздействие, внешнее давление, постоянный электрический ток и постоянное магнитное поле, сахарная нагрузка);
7) в реальном времени измеряют динамический отклик регистрируемого параметра в ответ на внешнее воздействие (например, на воздействие теплового потока);
8) по характеру динамического отклика (интенсивность отклика, временная задержка, характер временной динамики) осуществляют диагностику патологического состояния.
Способ ранней диагностики рака молочной железы по варианту "Основная диагностика", в отличие от варианта "Дополнительная диагностика", вместо стадии за номером 1) предполагает следующую стадию:
1) в реальном времени осуществляют регистрацию пространственно - временного распределения параметра, характеризующего состояние межклеточной ткани. Методы динамического картирования описаны в разделе "Способ диагностики патологического состояния внутренних органов".
Регистрация в реальном времени параметра, характеризующего состояние межклеточной ткани, позволяет осуществить (на первой стадии) локализацию области с измененными характеристиками ткани. После пространственной локализации проблемной области поверхности, с помощью последующих стадий, описанных выше, осуществляют диагностику рака молочной железы.
Микрокалориметр, принцип действия которого описан выше, позволяет проводить измерения теплопродукции ткани с высокой точностью. Микрокалориметр позволяет регистрировать слабые изменения теплопродукции с чувствительностью 0,002 мкал/сек⋅см2. Высокая чувствительность и пространственное обнаружение микрокалориметра позволяют использовать его для обнаружения злокачественных опухолей и ранней медицинской диагностике рака молочной железы.
Способ визуализации терапевтического воздействия
Способы измерения скорости локального метаболизма ткани и параметров микроциркуляции локального участка ткани, описанные выше, открывает принципиально новые возможности для визуализации эффектов терапевтического воздействия, а также позволяют определять эффективность терапевтических воздействий в реальном времени.
Способ визуализации терапевтического воздействия предусматривает следующие стадии
В режиме непрерывного мониторинга параметра, характеризующего состояние локального участка ткани (микроциркуляция и скорость метаболизма), осуществляют терапевтическое воздействие и регистрируют в реальном времени отклик контролируемого параметра. По характерным особенностям временной динамики регистрируемого параметра (отклику или реакции на воздействие) определяют эффективность терапевтического воздействия. Описанный способ применим для визуализации практически всех видов терапевтических воздействий, включающих как медикаментозные воздействия, так и не медикаментозные воздействия, такие как физиотерапевтические воздействия, воздействия методами акупунктуры, гомеопатии и др. Способ применим для визуализации как системных, обще организменных воздействий, так и локальных воздействий на различные области тканей тела.
В частности, данный способ позволяет визуализировать эффекты традиционной физиотерапии, которая на сегодняшний день включает такие способы физиотерапевтического воздействия как локальная декомпрессия, постоянное магнитное поле, электрический ток, ультразвук, электромагнитное излучение оптического и инфракрасного диапазона и др.
Описанный способ дает возможность не только визуализировать терапевтическое воздействие, но также оптимизировать режимы и дозы терапевтического воздействия с целью оптимизации терапевтического эффекта в режиме обратной связи в реальном времени.
Примеры практического использования
Внешний вид опытного прибора, принцип действия которого описан в разделе "Осуществление изобретения", показан на фигуре 15. Блок- схема мультисенсорного устройства показана на фигуре 14.
Разработанная технология позволяет уменьшить электронные компоненты прибора до размеров одной интегральной микросхемы и, тем самым, уменьшить размеры предполагаемого для практического использования уменьшить до размеров, не превышающих размеры наручных часов. Предполагаемый дизайн конструкции коммерческого варианта прибора показан на фиг. 14.
Примеры практического использования. Результаты лабораторных испытаний.
С целью подтверждения концепции метода, в феврале - июле 2015 г., было проведено более 150 экспериментов - тестов, с продолжительностью каждого теста в среднем 40 минут и числом инвазивных замеров в среднем 3 в одном тесте.
Измерения проводились с помощью опытного прибора в режиме непрерывного мониторинга (одно измерение в секунду) с продолжительностью экспериментов от 30 до 150 минут.
Калибровка опытного прибора осуществляется индивидуально для каждого пациента по 2 измерениям, сделанным по пробам крови из пальцев рук. Количество контрольных замеров по пробам крови из пальцев в течение каждого эксперимента составляло от 2 до 9 измерений. Контрольные измерения по пробам крови из пальца проводились с помощью глюкометра Accu-Chek Active (Roche Diagnostics GmbH, Roche Group). Всего было проведено более 150 экспериментов с общим количеством контрольных измерений более 600. Результаты сравнительных экспериментов представлены на фигурах 16, 17 (а, б, в, г) ("Результаты исследования на практически здоровом пациенте") и фигурах 18 (а, б) ("Результаты исследования на пациентах с диабетом").
Примеры практического использования. Результаты исследований на практически здоровом пациенте.
На Фиг. 16. представлена временная динамика уровня сахара крови практически здорового пациента (55 лет, муж.) в процессе сахарной нагрузки (сахарная кривая), регистрируемая двухканальным неинвазивным микрокалориметром. По оси Y отложены значения сигнала микрокалориметра в единицах ммоль/литр; по оси X отложено время в минутах. Сахарная проба (200 мл. 5% раствора глюкозы) принимается пациентом на 16 минуте эксперимента. Результаты инвазивных замеров, выполненных с помощью сертифицированного промышленного глюкометра "Accu- chec active" фирмы Roche - Diagnostics, показаны на графике кружочками. Абсолютные значения инвазивных замеров в единицах ммоль/литр, равны соответственно 5,4 (15 минута); 6,4 (30 минута); 7,3 (46 минута); 6,6 (60 минута); 5,4 (80 минута) и 5,1 (100 минута). Температура воздуха в комнате 22,4С.
На Фиг. 17 а) представлена временная динамика сахара крови утром натощак, записанная в процессе мониторинга сахара крови здорового пациента (58 лет, муж.) в течение дня. По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр.
На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 200, 500, 1000, 2000). Результаты инвазивных замеров в ммоль/литр показаны кружочками зеленого цвета: 5,2 (350); 5,3 (1200); 5,4 (2100). В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера: НТР=25,6/21,5/1007,7. Климатические параметры: -1, 85%, 754, 3,0 м/с, в начале эксперимента; -1, 88%, 757, 2,0 м/с, в конце эксперимента.
На Фиг. 17 б) представлена временная динамика сахара крови через 1 час после завтрака, записанная в процессе мониторинга сахара крови здорового пациента (58 лет, муж.) в течение дня. Временная динамика сахара крови через 1 час после завтрака. По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр.
На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 200, 500, 1000, 2000). Результаты инвазивных замеров в ммоль/литр показаны кружочками: 7,7 (350); 7,0 (1200); 6,7 (2100). В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера:
НТР=23,8/22,2/1009,1
Климатические параметры:
-2, 85%, 756,6,0 м/с, в начале эксперимента.
-3, 84%, 756, 5,0 м/с, в конце эксперимента.
На Фиг. 17 в) представлена временная динамика сахара крови через 1 час после обеда, записанная в процессе мониторинга сахара крови здорового пациента (58 лет, муж.) в течение дня.
По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр. На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 200, 500, 1000, 2000). Результаты инвазивных замеров в ммоль/литр показаны кружочками: 7,7 (300); 8,9 (1200); 9,2 (2100). В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера:
НТР=23,8/22,3 /1010,2
Климатические параметры:
-3/84/757/3,0 м/с, в начале эксперимента.
-3/78/757/3,0 м/с, в конце эксперимента.
На фиг. 17 г) представлена временная динамика сахара крови через 2,5 часа после обеда, записанная в процессе мониторинга сахара крови здорового пациента (58 лет, муж.) в течение дня.
По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр. На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 200, 500, 1000, 2000). Результаты инвазивных замеров в ммоль/литр показаны кружочками: 6,2 (350); 6,4 (1200); 6,1 (2100). В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера:
СНТР=23,0/21,7/1011,6
Климатические параметры:
-3/78/757/4,0 м/с, в начале эксперимента.
-3/78/757/4,0 м/с, в конце эксперимента.
Примеры практического использования. Результаты исследований на пациентах с диабетом.
Исследования проведены в условиях клиники на 4 пациентах с диабетом 2 типа (мужского и женского пола) в возрасте 40 -89 лет.
Измерения проводились с помощью опытного прибора в режиме непрерывного мониторинга с продолжительностью экспериментов от 30 до 60 минут.Количество контрольных измерений по пробам крови, взятым из пальцев рук, в течение каждого эксперимента составляло от 2 до 3 измерений.
Контрольные измерения по пробам крови из пальцев рук проводились с помощью глюкометра Accu-Chek Active (Roche Diagnostics GmbH, Roche Group). Характерные результаты этих экспериментов представлены на фигуре 12 (а,б).
На фиг. 18 а) представлена временная динамика сахара крови пациента D с диабетом 2 типа (68 лет, муж.) перед обедом.
По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр. На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 400, 1000, 1800). Результаты инвазивных замеров в ммоль/литр показаны кружочками: 6,3 (450); 6,5 (1250). В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера:
СНТР=30,3/26,3/720,0
На фиг. 18 б) представлена временная динамика сахара крови пациента D с диабетом 2 типа (68 лет, муж.) через 1 час после обеда.
По оси X отложено время в секундах, по оси Y отложены показания прибора в ммоль/литр. На временную динамику показаний прибора наложены калибровочные импульсы (в моменты времени 200, 650, 1000). Результаты инвазивных замеров в ммоль/литр показаны кружочками: 9,9 (250); 11,0 (1300). В скобках указаны моменты времени в секундах (от момента начала записи).
Значения параметров воздуха в комнате (влажность Н, температура Т, атмосферное давление Р) в момент первого инвазивного замера:
СНТР=29,3/26,5/718,0
СПИСОК ЛИТЕРАТУРЫ
1. Edsall J.T., Gutfreund Н. BIOTHERMODINAMICS. The Study of Biochemical Processes at Equilibrium. JOHN WILLEY & SONS, 1983.00.
2. Кендыш И.Н. Регуляция углеводного обмена. Издательство "Медицина", Москва.
3. Peusner Leonardo. Concepts in Bioenergetics. Peusner Biomedical Associates, Prentice - Hall, Inc., Englewood Cliffs, New Jersey, 1974.
4. Lehninger A.L. BIOCHEMISTRY. The Johns Hopkins University, School of Medicine. Worth Publishers, Inc., New York, 1972.
5. Atkins P.W. The second law. Scientific American Library, New York, 1984.
6. Мусин Р.Ф. ПАТЕНТ РФ №2087128 на изобретение "Устройство для измерения электрических свойств рогового слоя эпидермиса".
7. Мусин Р.Ф., Морозов В.А., Годик Э.Э., Гуляев Ю.В. (1986). Электрические свойства рогового слоя эпидермиса человека и транспорт воды в нем. - Биофизика, т.31, вып. 3, с. 478-480.
8. Forbath N., Hetenyi С.Glucose dynamics in normal subjects and diabetic patients before and after a glucose load. - Diabetes, 1966, vol. 15, # 11, p. 778-789.
9. Hall S.E.H., Saunders J., Sonksen P.H. Glucose and free fatty acid turnover in normal subjects and diabetic patients before and after insulin treatment. - Diabetologia, 1979, vol.16, #5, p.297-306.
10. Musin R.F., Godik E.E., Gulyaev Y.V., Morozov V.A. Natural water diffusion through the stratum corneum of the human body epidermis and its electrical properties/ - 3 International conference on water and ions in biological systems. Bucharest, Romania, 1984, p.34.
11. Мусин Р.Ф., Иванова Н.Ю., Мартынов В.А., Морозов В.А., Годик Э.Э., Гуляев Ю.В.(1986). О чувствительности кожи человека к инфракрасным тепловым потокам. - Доклады академии наук СССР, том 289, №3, с. 718-720.
12. Гуляев Ю.В., Годик Э.Э., Мусин Р.Ф., Морозов В.А., Мартынов В.А., Валиев И.В. (1989).Пороги тепловой чувствительности кожи к электромагнитным излучениям. - Сенсорные системы, том 3, №2, с. 209-212.
13. Годик Э.Э., Морозов В.А., Мусин Р.Ф. (1985). О динамике релаксации трибозаряда на поверхности рогового слоя эпидермиса кожи. - Биофизика, том 30, вып.2, с. 309-312.
14. Musin R.F., Godik Е.Е., Gulyaev Y.V., Morozov V.A., Sudarev A.M. Membrane mechanisms of water transport in epidermis. 4 International conference on water and ions in biological systems. Bucharest, Romania, 1988, p. 167-172.
15. Мусин Р.Ф., Морозов B.A., Сударев A.M. (1990). О механизмах транспорта воды в эпидермисе. - Биофизика, том 35, вып.4, с. 653-656.
16. Yas Kuno. (1959). Human Perspiration. Charles & Thomas Publ., Springfield, Illinois, USA.
17. A.B. Коробков, C.A. Чеснокова. (1986). Атлас по нормальной физиологии. М.: Высшая школа, 351 с.
18. Гомеостаз. Под ред. П.Д. Горизонтова. М., "Медицина", 1976, 464 с., ил.
19. USP # 5,795,305, August 18,1998, Cho et al. Process and device for non-invasive determination of glucose concentration in parts of human body.
20. USP #5,823,966, October 20, 1998, Buchet. Non - invasive continuous blood glucose monitoring.
21. USP # 5,890,489, April 6, 1999, Elden. Method for non - invasive determination of glucose in body fluids.
22. USP # 5,924,996, July 20, 1999, Cho et al. Process and device for detecting the exchange of heat between the human body and the invented device and its correlation to the glucose concentration in human body.
23. USP # 6,522,903, February 18, 2003, Berman et al. Glucose measurement assessment utilizing non-invasive assessment methods.
24. USP # 6,517,482, February 11, 2003, Elden et al. Method and apparatus for noninvasive determination of glucose in body fluids.
25. USP # 5,040,541, August 20,1991, Poppendiek. Whole body calorimeter.
26. USP # 4,386,604, June 7, 1993, Hershey. Determination of the basal metabolic rate of humans with a whole body calorimeter.
27. Мусин Р.Ф. ПАТЕНТ РФ на изобретение №2396897 "Способ и устройство для микрокалориметрического измерения скорости локального метаболизма ткани, содержания воды межклеточной ткани, концентрации биохимических компонентов крови и давления в сердечно-сосудистой системе".
28. John L. Smith. The Pursuit of Noninvasive Glucose: "Hunting the Deceitful Turkey". Fourth Edition, 2015.
29. Кальве Э., Прат А. Микрокалориметрия. M.: Изд-во ин. лит. 1963. 477 с.).