Результат интеллектуальной деятельности: Способ комплексной морфологической диагностики рака яичников
Вид РИД
Изобретение
Изобретение относится к области медицины, в частности к диагностике физиологических состояний человеческого организма путем исследования биологического материала (асцитической жидкости и/или смыва Дугласова пространства брюшной полости) in vitro для цитологического, иммуноцитохимического, гистологического и иммуногистохимического анализов. Изобретение может быть использовано в онкологии, гинекологии, клинической лабораторной диагностике, патологической анатомии.
Известный традиционный способ цитологической диагностики рака яичников при исследовании асцитической жидкости и смыва из брюшной полости имеет ряд недостатков:
- загрязнение фона исследуемого препарата элементами воспаления, некроза, эритроцитами и артефактами, что затрудняет цитологическую диагностику;
- плохую сохранность, повреждение и разрушение клеток, особенно злокачественных, которые очень чувствительны к изменениям внешней среды и быстро подвергаются распаду, что требует немедленного приготовления цитологических препаратов после получения экссудата или смыва брюшной полости;
- образование фибриновых сгустков при большом содержании крови, или недостаточном количестве антикоагулянта, или его отсутствии в асцитической жидкости или смыве из брюшной полости;
- большое разнообразие мезотелиального клеточного состава в связи с высокой реактивностью серозного покрова брюшной полости с постоянной декомпенсацией и регенерацией мезотелия. Мезотелий может приобретать выраженные признаки атипии, в связи с чем его становится трудно отличать от клеток рака;
- неравномерное расположение клеточного материала на предметном стекле;
- затрудненность цитологической диагностики из-за наличия единичных опухолевых клеток;
- невозможность быстрого обзора препарата из-за имеющихся участков многослойности.
Достоверность традиционного цитологического исследования экссудата брюшной полости составляет менее 40-70%, что недостаточно для установления диагноза [1; 2; 3; 4].
Известен гистологический метод диагностики рака яичников. Для получения материала для этого исследования необходимо выполнение сложных инвазивных оперативных вмешательств (лапароскопии, лапаротомии, биопсии ткани яичника), которые проводятся под общей анестезией. При этом возможен риск развития серьезных осложнений, связанных с хирургическим вмешательством (кровотечение, септические осложнения, перфорация органов брюшной полости и др.), и требуется проведение дополнительных предоперационных обследований. К выполнению этих хирургических операций имеется ряд противопоказаний: пожилой и старческий возраст пациентов, выраженная сопутствующая патология, тяжелое общее состояние, распространенный опухолевый процесс и др. [5].
Известно применение питательной среды №199 как средства повышения достоверности диагностики рака шейки матки [6] и рака мочевого пузыря [7]. Способ цитологической диагностики рака мочевого пузыря и его местных рецидивов на основе использования питательной среды 199 по патенту РФ №2547567, опубликованному 10.04.2015 г., принят за прототип. Суть способа заключается в том, что клеточный смыв, полученный с поверхности слизистой мочевого пузыря, центрифугируется, а осадок переносится в жидкую среду накопления, при этом используется питательная среда 199 для обеспечения сохранности клеточного материала без разрушения и потери клеток. Из этой клеточной суспензии с помощью цитофугирования готовится монослойный препарат, этот метод способствует устранению неоптимальных мазков как источника сомнительных результатов. При этом в монослойном цитологическом препарате отсутствуют загрязняющие его фон элементы воспаления, кристаллы мочевых солей, слизь, эритроциты, бактерии. В результате весь клеточный материал сохраняется без изменения морфологических и иммуноцитохимических свойств. Выраженное уплощение клеток значительно улучшает качество образцов для выполнения иммуноцитохимических реакций и гибридизации in situ. Чувствительность описанного цитологического метода составила 89,8%, специфичность - 93,2% [8].
Однако этот способ применяется для диагностики рака мочевого пузыря.
Цель изобретения - повышение достоверности морфологической диагностики рака яичников.
Для достижения указанной цели в способе комплексной морфологической диагностики рака яичников на основе получения клеточного осадка из экссудата брюшной полости или из смыва брюшной полости, полученного путем лапароцентеза, под контролем ультразвука или пункции заднего свода влагалища, добавления к эссудату или смыву брюшной полости раствора антикоагулянта цитрата натрия 5%, его центрифугирования при скорости 2000 об/мин в течение 10 минут, слива надосадочной жидкости, переноса клеточного осадка на предметное стекло выполняют традиционное цитологическое исследование, СОГЛАСНО ИЗОБРЕТЕНИЮ проводят комплексное исследование морфологических препаратов, полученных из клеточного осадка. При этом цитологический препарат получают из клеточной суспензии, которую готовят путем добавления к клеточному осадку питательной среды 199, цитофугирования в течение 8 минут при скорости 1000 об/мин. При этом происходит удаление фоновых элементов, разделение клеток на фракции и получение монослойных цитологических препаратов, которые используют для цитологического и иммуноцитохимического исследований. А для получения гистологических препаратов накапливают клеточный осадок в количестве не менее 0,3 см3 в центрифужной пробирке. К клеточному осадку добавляют раствор ренампластина и к образовавшемуся сгустку добавляют 10% нейтральный забуференный раствор формалина, после чего клеточный сгусток переносят в гистологический мешочек, который помещают в кассету для гистологической проводки и последовательно обрабатывают в растворах дегидратантов, в промежуточных смесях. Затем его переносят в парафин, в результате чего получают клеточный блок и производят его нарезку микротомом. Полученные срезы переносят на предметное стекло, производят окраску гистологических препаратов с последующей дегидратацией и депарафинизацией, после чего гистологические препараты покрывают клеем и покровным стеклом и используют для гистологического и иммуногистохимического исследований. А далее по результатам комплексного морфологического исследования устанавливают клинический диагноз.
Поставленная цель достигается также тем, что в способе комплексной морфологической диагностики рака яичников оптимальное соотношение экссудата или смыва брюшной полости и антикоагулянта составляет 10:1, оптимальный объем питательной среды 199-4 мл, оптимальный объем клеточной суспензии для получения монослойных препаратов для цитологического и иммуноцитохимического исследований составляет от 100 до 400 мкл, объем клеточного осадка для получения клеточного блока составляет не менее 0,3 см3, а оптимальный объем плазмы крови для получения клеточного сгустка составляет 0,25 мл.
Заявляемое изобретение направлено на решение задачи получения оптимальных клеточных образцов из экссудата или смыва брюшной полости для комплексной морфологической диагностики рака яичников.
Технический результат заключается в том, что из экссудата или смыва брюшной полости получают клеточный осадок, из которого готовят традиционные цитологические, жидкостные цитологические и гистологические препараты, что обеспечивает возможность проведения комплексного морфологического исследования для диагностики рака яичников.
Технический результат для цитологического и иммуноцитохимического исследований достигается получением монослойных препаратов с равномерным распределением клеточного материала на небольшом участке предметного стекла. А для гистологического исследования - путем приготовления клеточных блоков и изготовления из них гистологических препаратов для морфологического исследования и возможного иммуногистохимического исследования с использованием моноклональных антител. Все это в комплексе с традиционным цитологическим исследованием значительно повышает достоверность морфологической диагностики рака яичников.
Сущность заявляемого изобретения заключается в том, что жидкостная цитология с использованием питательной среды 199, в отличие от традиционного цитологического исследования асцитической жидкости или смыва брюшной полости, значительно повышает достоверность цитологического метода исследования за счет получения монослойных препаратов, которые характеризуются равномерным распределением клеточного материала на небольшом участке предметного стекла, хорошей визуализацией деталей ядра и цитоплазмы, значительным снижением числа элементов воспаления, эритроцитов, артефактов, чем достигается более тщательный анализ структуры клетки. Приготовленные монослойные препараты с использованием питательной среды 199, в отличие от традиционно используемых транспортных и накопительных сред, не вызывают деформации клеток, изменения их морфологической структуры и могут использоваться в дальнейшем для проведения иммуноцитохимических исследований с экономией дорогостоящих реактивов. Полученные клеточные блоки используют для приготовления препаратов и проведения морфологического и иммуногистохимического исследований. Комплексное использование традиционного цитологического исследования, жидкостной цитологии, клеточных блоков, иммуноцитохимические и иммуногистохимические исследования экссудата или смыва брюшной полости с использованием моноклональных антител повышает достоверность морфологической диагностики рака яичников и его рецидивов путем определения гистогенеза опухоли, степени ее дифференцировки, прогноза заболевания, что имеет немаловажное значение при выборе метода лечения, схем химио- и таргетной терапии, оценки эффективности проводимого лечения и позволяет своевременно диагностировать рецидив заболевания.
Использование в клинической онкологической, гинекологической и лабораторной практиках заявляемого способа обеспечивает повышение достоверности морфологической диагностики рака яичников.
Применяемая в данном способе технология изготовления морфологических образцов обеспечивает:
- возможность получения жидкостных монослойных препаратов для цитологического исследования, что значительно снижает количество неудовлетворительных препаратов;
- возможность сохранения клеточного материала, полученного из брюшной полости, до 6 суток без изменения морфологической структуры клеток;
- возможность получения препаратов для иммуноцитохимических исследований с моноклональными антителами;
- сокращение времени и повышение производительности исследования;
- возможность изготовления гистологических препаратов из клеточных блоков, полученных из клеточного осадка экссудата или смыва брюшной полости, и проведение морфологического и иммуногистологического исследований с моноклональными антителами;
- комплексное использование традиционного цитологического исследования, жидкостной цитологии, клеточных блоков, иммуноцитохимического и иммуногистохимического исследований экссудата или смыва брюшной полости повышает достоверность морфологической диагностики рака яичников и его местных рецидивов.
Преимущество изобретения заключается в том, что клинический диагноз устанавливается на основании комплекса морфологических исследований: традиционного цитологического, жидкостной цитологии и морфологических препаратов, полученных из клеточных блоков.
Способ реализуется следующим образом. Асцитическую жидкость для исследования получали при проведении лапароцентеза или путем пункции заднего свода влагалища. Оптимальное место для лапароцентеза выбирали путем выполнения ультразвукового исследования брюшной полости с использованием ультразвукового датчика 3-5 МГц. Лапароцентез производили с соблюдением правил асептики. Место предполагаемой пункции инфильтрировали раствором местного анестетика (раствор новокаина 0,5% или лидокаина 2% 20-25 мл), затем брюшным скальпелем №20-22 делали разрез кожи передней брюшной стенки длиной 1 см и производили прокол передней брюшной стенки троакаром №5 или №6. К троакару подсоединяли полихлорвиниловую трубку диаметром 0,5 см и собирали три порции асцитической жидкости в три флакона емкостью 200 мл, в которые предварительно добавляли 20-25 мл 5% раствора цитрата натрия для предотвращения коагуляции белка. Первую порцию асцитической жидкости собирали во флакон в начале лапароцентеза, вторую - в середине, а третью, которая содержала наибольшее количество клеточного материала, - в конце операции.
Пункцию заднего свода влагалища производили после бимануального двуручного и ректовагинального гинекологического исследований с соблюдением правил асептики. Шейку матки выводили зеркалами Симпсона. Заднюю губу шейки матки фиксировали пулевыми щипцами. Пункцию производили изогнутой иглой для пункций заднего свода №1 или №2 с ограничителем с использованием многоразового шприца типа «Рекорд» или одноразового шприца «Люэр» объемом 20 мл с переходником к игле. Затем производили аспирацию содержимого брюшной полости, которое переносится в центрифужную пробирку с 1 мл 5% раствора цитрата натрия. Если в результате пункции асцитическую жидкость не получали, то из брюшной полости брали смыв, для этого вводили 20-40 мл 0,9% раствора хлорида натрия, который собирали через иглу самотеком или аспирировали шприцем и помещали в центрифужную пробирку, содержащую 1 мл 5% раствора цитрата натрия. Содержимое пробирки тщательно перемешивали и направляли в лабораторию для исследования.
После перемешивания экссудата или смыва брюшной полости 10 мл биологической жидкости центрифугировали в центрифужной пробирке 10 минут при скорости 2000 об/мин. Надосадочную жидкость сливали, из клеточного осадка готовили препарат для традиционного цитологического исследования. Для получения монослойных цитологических препаратов методом жидкостной цитологии к полученному клеточному осадку добавляли 4 мл питательной среды 199, все перемешивали. Полученная клеточная суспензия может храниться до 6 суток при температуре +4°С. Затем 100-400 мкл клеточной суспензии помещали в фильтр-концентратор и центрифугировали 8 минут при скорости 1000 об/мин, где происходило удаление фоновых элементов (лейкоциты, эритроциты, артефакты) и разделение на фракции клеточных элементов по размеру, и таким образом получали монослойные препараты. Препарат сушили на воздухе при комнатной температуре. Полученные монослойные препараты использовали для цитологического исследования, возможно их использование и для иммуноцитохимического исследования. Фиксацию цитологических препаратов проводили фиксатором Май-Грюнвальда, а окраску - по методу Романовского-Гимзе.
Для получения клеточных блоков к полученному клеточному осадку методом накопления (не менее 0,3 см3) добавляли 5 капель донорской плазмы крови и перемешивали, затем добавляли 5 капель раствора ренампластина и оставляли на 10 минут. К образовавшемуся сгустку добавляли 10-20 мл 10% нейтрального забуференного раствора формалина на 1 час, после чего его 30 минут промывали проточной водой. Сгусток переносили в гистологический мешочек, который помещали в кассету для проведения гистологической проводки путем обезвоживания, обезжиривания и пропитывания клеточного материала минеральным маслом. Гистологическую проводку осуществляли по следующей схеме: кассету помещали в дегидратант №1 (на основе изопропилового спирта) на 15-20 минут, затем - в дегидратант №2 на 15-20 минут, в промежуточную смесь №1 (дегидратант и минеральное масло в соотношении 5:1) для обеспечения прозрачности препарата - на 20-30 минут, в промежуточную смесь №2 (соотношение дегидратанта и минерального масла 4:2) на 20-30 минут, в минеральное масло на 1 час, затем переносили в стеклянный стаканчик с парафином №1 (для растворения минерального масла) и помещали в термостат при температуре +60°С на 15 минут, затем переносили во второй стеклянный стаканчик с парафином №2 (для пропитки клеточного материала парафином и обеспечения высокой пластичности и облегчения работы на микротоме) и помещали в термостат при температуре +60°С на 15 минут. Клеточный блок извлекали из мешочка и помещали в металлическую ванночку с заливочным парафином, оставляли на 15-20 минут при комнатной температуре для затвердения. Нарезку клеточного блока проводили на микротоме. Полученные срезы переносили на предметные стекла, предварительно обработанные клеем для срезов «Блик хромоквасцовый» для улучшения адгезии. Окраску полученных препаратов осуществляли гематоксилин-эозином с последующей дегидратацией и депарафинизацией по схеме: гистологический препарат последовательно помещали в депарафинизирующий раствор на 5 минут, в дегидратант №1 на 1-2 минуты, в дегидратант №2 на 1-2 минуты, в дегидратант №3 на 1-2 минуты, в дегидратант №4 на 1-2 минуты, в дистиллированную воду на 1-2 минуты, в гематоксилин регрессивный на 5 минут, затем препарат окунали 4-5 раз в дифференцирующий раствор (50 мл концентрата дифференцирующего раствора и 970 мл дистиллированной воды) и промывали проточной водой 1 минуту. С целью докрашивания препарат помещали в подсинивающий раствор (50 мл концентрата подсинивающего раствора и 970 мл дистиллированной воды) на 1 минуту, промывали проточной водой 1 минуту и переносили в водно-спиртовой раствор эозина на 1 минуту, затем в дегидратант №1 на 1-2 минуты, в дегидратант №2 на 1-2 минуты, в дегидратант №3 на 1-2 минуты, в дегидратант №4 на 1-2 минуты, для удаления парафина из срезов - в депарафинирующий раствор №1 на 3 минуты, в депарафинирующий раствор №2 на 3 минуты. Гистологические препараты покрывали клеем Bio Mount и покровным стеклом.
Заявленный способ комплексной морфологической диагностики рака яичников является оптимальным и отвечает всем указанным требованиям.
Используемая питательная среда 199 для получения монослойных препаратов методом жидкостной цитологии, а также все расходные материалы для получения клеточных блоков и изготовления гистологических препаратов выпускаются отечественной промышленностью, что обуславливает невысокую себестоимость, а также обеспечивает соответствие заявляемого способа критерию промышленной применяемости.
Сущность изобретения поясняется графическими материалами, которые представлены на:
ФИГ. 1. Образец препарата, приготовленного для морфологического исследования традиционным способом.
ФИГ. 2. Образец препарата, приготовленного для морфологического исследования методом жидкостной цитологии.
ФИГ. 3. Образец препарата, приготовленного для морфологического исследования из клеточных блоков.
ФИГ. 4. Цитологический препарат, приготовленный традиционным цитологическим методом (микрофотография). Скопления из пролиферирующих клеток мезотелия. Видны фоновые элементы (лейкоциты, клетки эпителия). Окраска препарата по Романовскому-Гимзе, × 1000.
ФИГ. 5. Цитологический препарат, приготовленный способом жидкостной цитологии с использованием питательной среды 199 (микрофотография). Аденокарцинома яичника. В связи с тем, что фоновые элементы (лейкоциты) при цитофугировании удалены, раковые клетки отчетливо видны в маленьком окне. Окраска препарата по Романовскому-Гимзе, × 1000.
ФИГ. 6. Препарат, приготовленный из клеточного блока. Аденокарцинома яичника. Окраска препарата Гематоксилин-эозином, × 100.
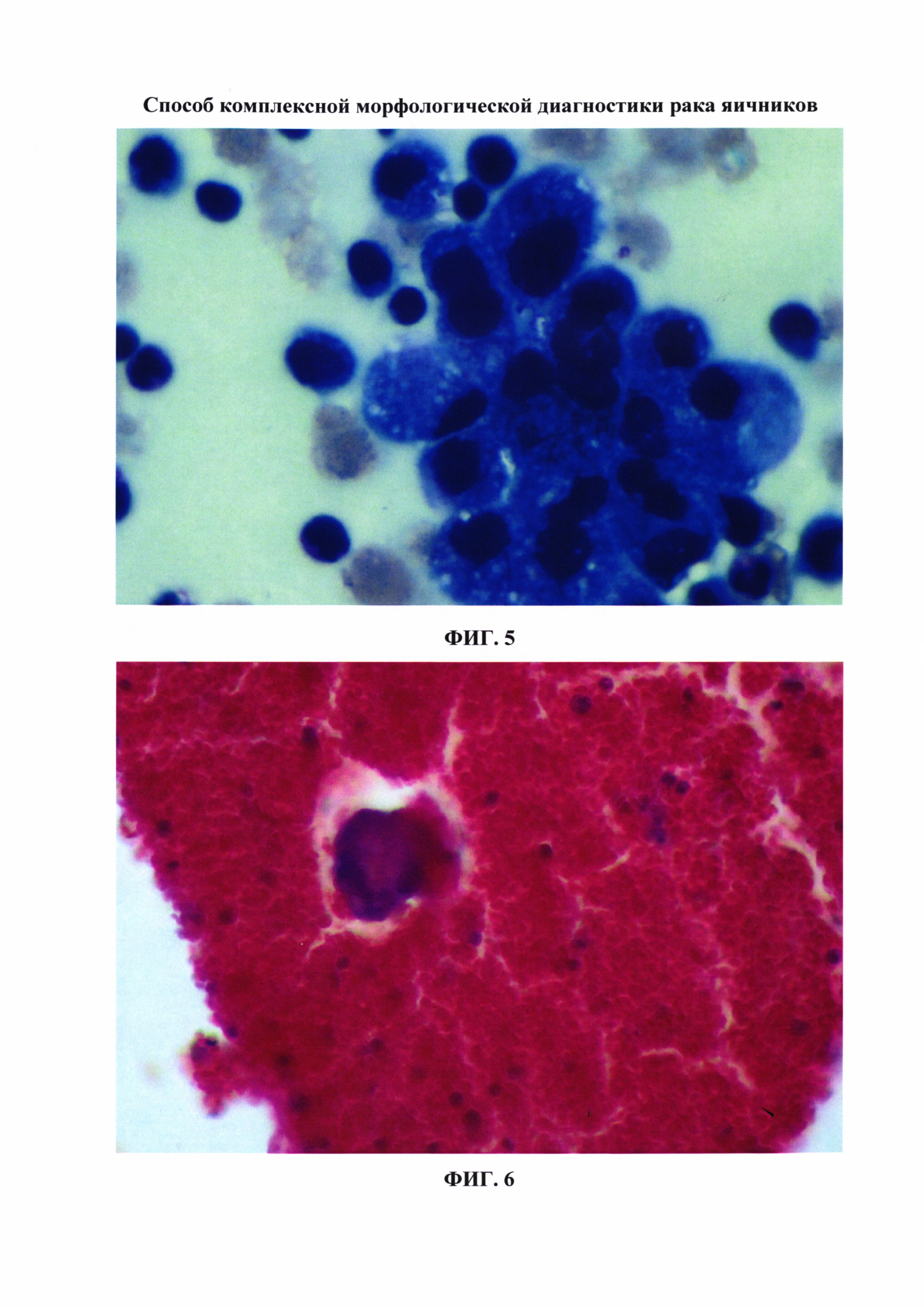
ФИГ. 7. Цитологический препарат, приготовленный традиционным цитологическим методом (микрофотография). Аденокарцинома. Видны фоновые элементы (лейкоциты, клетки эпителия). Окраска препарата по Романовскому-Гимзе, × 1000.
ФИГ. 8. Цитологический препарат, приготовленный способом жидкостной цитологии с использованием питательной среды 199 (микрофотография). Аденокарцинома яичника. В связи с тем что фоновые элементы (лейкоциты) при цитофугировании удалены, раковые клетки отчетливо видны в маленьком окне. Окраска препарата по Романовскому-Гимзе, × 1000.
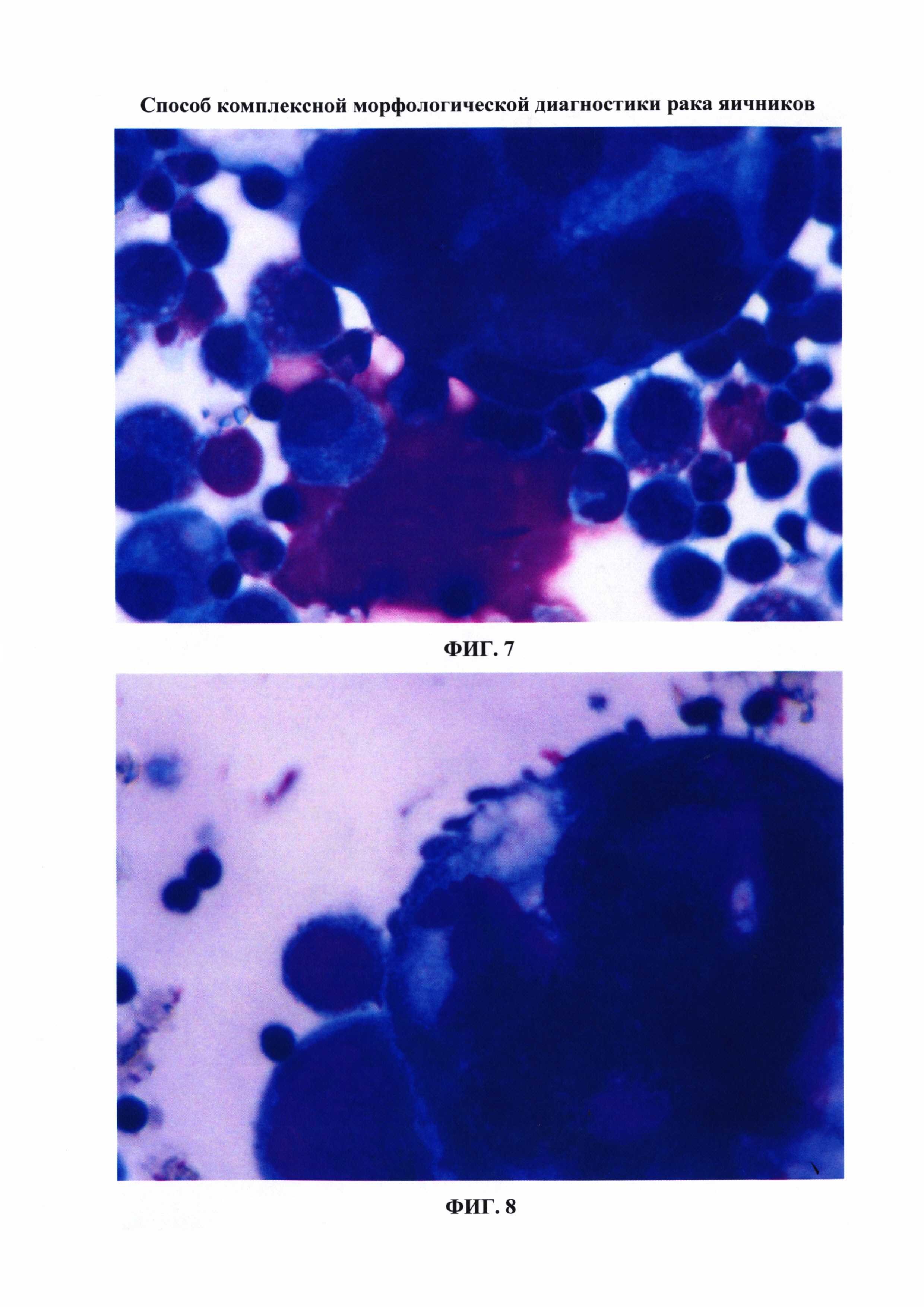
ФИГ. 9. Препарат, приготовленный из клеточного блока. Аденокарцинома яичника. Окраска препарата Гематоксилин-эозином, × 100.
Примеры использования способа.
Больная М., 63 года, обратилась в ГБУЗ «Онкологический диспансер №3» (г. Новороссийск) 15.05.14 г. по направлению врача акушера-гинеколога женской консультации с жалобами на слабость, недомогание, увеличение в объеме живота, одышку.
Первые признаки заболевания почувствовала два месяца назад, когда появились слабость, недомогание, дискомфорт после приема пищи, увеличение в объеме живота, одышка после умеренной физической нагрузки. 18.04.2015 г. обратилась к врачу акушеру-гинекологу в женскую консультацию, где ей было проведено клинико-лабораторное и инструментальное обследования. СА 125 128,36 Ед./мл. УЗИ органов малого таза - ЭХО признаки солидно-кистозного образования правого яичника размером 75×80 мм с неровными четкими контурами, при ЦДК наличие интранодулярного типа кровотока. В брюшной полости значительное количество асцитической жидкости. Больная направлена в ГБУЗ «Онкологический диспансер №3» (г. Новороссийск) с целью уточнения диагноза и определения тактики лечения.
В онкологическом диспансере больной выполнено обследование по заявляемому способу - лапароцентез под контролем ультразвука. Получено около 8,5 л асцитической жидкости. Цитологическое исследование клеточного осадка экссудата брюшной полости выполнено традиционным методом, методом жидкостной цитологии с использованием питательной среды 199 и морфологическое исследование препаратов, полученных из клеточного блока. В результате проведенного традиционного цитологического исследования обнаружены скопления из пролиферирующих клеток мезотелия (ФИГ. 4), в препаратах, полученных методом жидкостной цитологии (ФИГ. 5) и из клеточных блоков (ФИГ. 6), обнаружены клетки аденокарциномы. В результате использования заявляемого способа комплексной морфологической диагностики был установлен диагноз рака яичников (клетки аденокарциномы).
В дальнейшем 28.05.2014 г. выполнена операция: лапаротомия. Экстирпация матки с придатками. Экстирпация большого сальника. ПГИ №8354-68 папиллярная цистоаденокарцинома правого яичника, папиллярная цистоаденокарцинома яичника слева с инвазией в маточную трубу, метастаз папиллярной аденокарциномы в большой сальник (ФИГ. 2). При этом было зафиксировано совпадение результатов цитологических исследований экссудата брюшной полости по заявляемому способу комплексной морфологической диагностики рака яичников (методом жидкостной цитологии и клеточных блоков) с результатами выполненного гистологического исследования операционного материала.
Заключительный клинический диагноз: рак яичников pT3NxM0 III стадия. II клиническая группа.
Больная П., 57 лет, наблюдается в ГБУЗ «Онкологический диспансер №3» (г. Новороссийск) с 02.09.13 г. по поводу рака яичников. 12.09.13 г. была выполнена операция: надвлагалищная ампутация матки с придатками. Резекция большого сальника. ПГИ №1254-77 папиллярная аденокарцинома обоих яичников с метастазами в большой сальник. В послеоперационном периоде больной проведено 6 курсов полихимиотерапии по схеме цисплатинт 75 мг/м2, циклофосфан 750 мг/м2. Больная находилась под диспансерным наблюдением.
При контрольном обследовании в июне 2014 г. выполнено ультразвуковое исследование малого таза и органов брюшной полости - обнаружено незначительное количество асцитической жидкости в малом тазу, СА 125 12,57 ЕД./мл, произведена пункция заднего свода влагалища, получен смыв из брюшной полости. Из клеточного осадка, полученного из смыва брюшной полости, были приготовлены морфологические препараты традиционным способом, методом жидкостной цитологии и из клеточных блоков. В результате использования заявляемого способа комбинированной морфологической диагностики рака яичников были обнаружены клетки аденокарциномы во всех препаратах (ФИГ. 7-9). По результатам выполненного обследования у больной диагностирован рецидив рака яичников.
Заключительный клинический диагноз: рак яичников III стадия pT3NxMo. Состояние после комбинированного лечения. Рецидив заболевания. II клиническая группа.
Приведенные примеры могут служить подтверждением того, что использование комплексной морфологической диагностики рака яичников и его рецидивов повышает точность установления клинического диагноза.
Источники информации
1. Петрова А. С.Цитологическое исследование в диагностике опухолей. Патологоанатомическая диагностика опухолей человека / под ред. Н.А. Краевского. - М.: Медицина, 1993. - 185 с.
2. Долгов В.В., Шабалова И.П., Миронова И. И. и соавт. Выпотные жидкости. Лабораторное исследование. - Москва-Тверь: ООО «Издательство «Триада», 2006. - 161 с.
3. Савостикова М.В. Жидкостная цитология и иммуноцитохимическое исследование в цитологической диагностике биологических жидкостей и смывов с брюшины при онкогинекологических заболеваниях // Онкогинекология. - 2013. - №4. - С. 41-55.
4. Волченко H.Н., Славнова Ε.Н., Тугулукова А.А. Жидкостная цитология в онкологии // Онкология. Журнал им. П.А. Герцена. - 2013. - №5. - С. 26-31.
5. Новикова Е.Г., Антошечкина Е.Т. Ошибки в диагностике и лечении злокачественных опухолей яичников. В кн.: Ошибки клинической онкологии / под ред. В.И. Чиссова, Α.X Трахтенберга. - М.: Медицина, 2001. - С. 435-447.
6. Леонов М.Г., Шелякина Т.В. Современные возможности профилактики и ранней диагностики рака шейки матки. - М.: Вузовская книга, 2012. - 288 с.
7. Леонов М.Г., Тхагапсо Α.Α., Ершова Я. Х.-Б. Способ цитологической диагностики рака мочевого пузыря. - М., 2015. Патент РФ №2547567. Опубликован 10.04.2015 г. Прототип.
8. Леонов М.Г., Шелякина Т.В., Тхагапсо А.А. Диагностика и скрининг рака мочевого пузыря. - Ростов-на-Дону, 2015. - 84 с.