Результат интеллектуальной деятельности: СЛИТЫЕ ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ДОМЕН WAP, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Родственные заявки
[0001] Настоящая заявка испрашивает приоритет предварительной заявки на патент США № 61/502052, поданной 28 июня 2011 г.; предварительной заявки на патент США № 61/565625, поданной 1 декабря 2011 г., и предварительной заявки на патент США № 61/638168, поданной 25 апреля 2012 г., и предварительной заявки на патент США № 61/638516, поданной 26 апреля 2012 г. Содержание каждой из этих заявок полностью включено в настоящее описание путем ссылки.
Область, к которой относится изобретение
[0002] Настоящее изобретение относится к молекулам, в частности полипептидам, конкретнее, к слитым белкам, которые включают полипептид, содержащий домен сывороточного кислотного белка (WAP), или к аминокислотной последовательности, которая получена из содержащего домен WAP полипептида, и второй полипептид. Кроме того, изобретение относится к слитым белкам, которые включают содержащий домен WAP полипептид, или аминокислотную последовательность, которая получена из содержащего домен WAP полипептида, и второй полипептид, и третий полипептид. В частности, настоящее изобретение относится к слитым белкам, которые включают полипептиды, содержащие домен WAP, и второй полипептид, или слитые белки, которые включают полипептиды, содержащие домен WAP, второй полипептид, и третий полипептид, где второй и третий полипептиды слитых белков по изобретению могут представлять собой по меньшей мере один из следующих: полипептид Fc или аминокислоту, происходящую из полипептида Fc; полипептид альбумина или аминокислотную последовательность, которая происходит из полипептида альбумина; нацеливающие на цитокин полипептиды или аминокислотную последовательность, которая происходит из нацеливающего на цитокин полипептида; и серпиновый полипептид или аминокислотную последовательность, которая происходит из серпинового полипептида. Настоящее изобретение также относится к способам применения таких молекул по разнообразным терапевтическим и диагностическим показаниям, а также к способам получения таких молекул.
Предпосылки изобретения
[0003] Аберрантная активность сериновой протеазы или дисбаланс протеаз и их ингибиторов может привести к опосредованному протеазами разрушению ткани и к воспалительным реакциям. Соответственно существует потребность в терапевтических средствах и способах лечения, которые нацелены на аберрантную активность сериновой протеазы и/или дисбаланс протеаз и их ингибиторов.
Краткое описание сущности изобретения
[0004] Описанные здесь слитые белки включают по меньшей мере полипептид, содержащий домен сывороточного кислотного белка (WAP), или аминокислотную последовательность, которая происходит из содержащего домен WAP полипептида (Полипептид 1), и второй полипептид (Полипептид 2). Кроме того, слитые белки, описанные здесь, включают полипептид, содержащий домен сывороточного кислотного белка (WAP), или аминокислотную последовательность, которая происходит из содержащего домен WAP полипептида (Полипептид 1), второй полипептид (Полипептид 2), и третий полипептид (Полипептид 3). В частности, настоящее изобретение относится к слитым белкам, которые включают содержащий домен WAP полипептид, и второй полипептид или содержащий домен WAP полипептид, второй полипептид и третий полипептид, где второй и третий полипептиды могут включать по меньшей мере один из следующих: полипептида Fc или аминокислоты, происходящей из полипептида Fc; полипептида альбумина или аминокислотной последовательности, которая происходит из полипептида альбумина; нацеливающих на цитокин полипептидов или аминокислотных последовательностей, которые происходят из нацеливающих на цитокин полипептидов; и серпинового полипептида или аминокислотной последовательности, которая происходит из серпинового полипептида.
[0005] Взаимозаменяемо используемые в настоящем описании термины «слитый белок» и «слитый полипептид» относятся к полипептиду, содержащему домен WAP, или к аминокислотной последовательности, происходящей из содержащего домен WAP полипептида, функционально связанным по меньшей мере со вторым полипептидом, или аминокислотной последовательностью, происходящей из второго полипептида. Индивидуализированные элементы слитого белка могут быть связаны любым из разнообразных путей, включая, например, прямое прикрепление, использование промежуточного или спейсерного пептида, использование линкерной области, использование шарнира, или использование и линкера, и шарнира. В некоторых вариантах осуществления, линкерная область может укладываться в пределы шарнира, или, альтернативно, шарнир может укладываться в пределы линкерной области. Предпочтительно, линкерная область представляет собой пептидную последовательность. Например, линкерный пептид включает примерно от нуля до 40 аминокислот, например, от нуля до 35 аминокислот, от нуля до 30 аминокислот, от нуля до 25 аминокислот или от нуля до 20 аминокислот. Предпочтительно, шарнир представляет собой пептидную последовательность. Например, шарнирный пептид включает примерно от нуля до 75 аминокислот, например, от нуля до 70 аминокислот, от нуля до 65 аминокислот или от нуля до 62 аминокислот. В вариантах осуществления, где слитый белок включает и линкерную область, и шарнир, предпочтительно, каждая из линкерной области и шарнира представляет собой пептидную последовательность. В этих вариантах осуществления, шарнирный пептид и линкерный пептид вместе включают примерно от нуля до 90 аминокислот, например, от нуля до 85 аминокислот или от нуля до 82 аминокислот.
[0006] В некоторых вариантах осуществления, часть на основе домена WAP и часть на основе второго полипептида слитого белка могут быть связаны не ковалентно через промежуточный связывающий полипептид. В некоторых вариантах осуществления, часть на основе домена WAP и часть на основе второго полипептида слитого белка могут быть не ковалентно связаны.
[0007] В некоторых вариантах осуществления, слитые белки в соответствии с изобретением могут иметь одну из следующих формул, в направлении от N-конца к C-концу или в направлении от C-конца к N-концу:
Полипептид 1(a) - шарнирm - Полипептид 2(b)
Полипептид 1(a) - линкерn - Полипептид 2(b)
Полипептид 1(a) - линкерn - шарнирm - Полипептид 2(b)
Полипептид 1(a) - шарнирm - линкерn - Полипептид 2(b)
Полипептид 1(a) - Полипептид 2(b) - Полипептид 3(C)
Полипептид 1(a) - шарнирm - Полипептид 2(b) - шарнирm - Полипептид 3(C)
Полипептид 1(a) - линкерn - Полипептид 2(b) - линкерn - Полипептид 3(C)
Полипептид 1(a) - шарнирm - линкерn - Полипептид 2(b) - шарнирm - линкерn - Полипептид 3(c) Полипептид 1(a) - линкерn - шарнирm - Полипептид 2(b) - линкерn - шарнирm - Полипептид 3(C)
где n обозначает целое число от нуля до 20, где m обозначает целое число от 1 до 62, и где a, b, и c обозначают целое число по меньшей мере единицу. Эти варианты осуществления включают указанные выше составы и любой их вариант или комбинацию. Например, порядок полипептидов в формулах также включает Полипептид 3(C) - Полипептид 1(a) - Полипептид 2(b), Полипептид 2(b) - Полипептид 3(C) - Полипептид 1(a) или любой их вариант или комбинацию.
[0008] В некоторых вариантах осуществления, Последовательность Полипептида 1 включает полипептид, содержащий домен сывороточного кислотного белка (WAP). Домен WAP представляет собой эволюционно сохранный мотив последовательности из 50 аминокислот, содержащий восемь цистеинов, обнаруживаемый в характерном 4-дисульфидном коровом расположении (также называемом «четырехдисульфидный мотив»). Мотив последовательности домена WAP представляет собой функциональный мотив, характеризуемый активностью ингибирования серин-протеазы в ряде белков. Полипептиды, содержащие домен WAP, подходящие для использования в слитых белках по настоящему изобретению включают, в качестве не ограничивающего примера, секреторный лейкоцитарный ингибитор протеаз (SLPI), Элафин и Эппин.
[0009] В некоторых вариантах осуществления, последовательность Полипептида 1 включает полипептидную последовательность секреторного лейкоцитарного ингибитора протеаз (SLPI) или аминокислотную последовательность, которая происходит из SLPI. В некоторых вариантах осуществления, последовательность Полипептида 1 включает часть в форме белка SLPI, такую как, например, домен WAP2 или его подчасть. В предпочтительном варианте осуществления, полипептидная последовательность SLPI или аминокислотная последовательность, которая происходит из SLPI, происходит из полипептидной последовательности человеческого SLPI.
[0010] В некоторых вариантах осуществления, слитый белок включает полноразмерную полипептидную последовательность человеческого SLPI, имеющую следующую аминокислотную последовательность:

[0011] В некоторых вариантах осуществления, слитый белок включает полипептидную последовательность человеческого SLPI, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 1.
[0012] В некоторых вариантах осуществления, слитый белок включает часть в форме полноразмерной полипептидной последовательности человеческого SLPI, где часть имеет следующую аминокислотную последовательность:

[0013] В некоторых вариантах осуществления, слитый белок включает полипептидную последовательность человеческого SLPI, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 2.
[0014] В некоторых вариантах осуществления, слитый белок включает домен WAP2 полноразмерной полипептидной последовательности человеческого SLPI, где домен WAP2 имеет следующую аминокислотную последовательность:
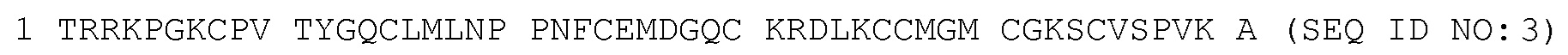
[0015] В некоторых вариантах осуществления, слитый белок включает полипептидную последовательность человеческого SLPI, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 3.
[0016] В некоторых вариантах осуществления, полипептидная последовательность SLPI представляет собой или аминокислотная последовательность, происходящая из полипептида SLPI, происходит из одной или более полипептидных последовательностей человеческого SLPI, показанных в номерах доступа в Генном Банке CAA28187.1, NP_003055.1, EAW75869.1, P03973.2, AAH20708.1, CAB64235.1, CAA28188.1, AAD19661.1 и/или BAG35125.1.
[0017] В некоторых вариантах осуществления, слитый белок включает полноразмерную полипептидную последовательность человеческого Элафина, имеющую следующую аминокислотную последовательность:

[0018] В некоторых вариантах осуществления, слитый белок включает полипептидную последовательность человеческого Элафина, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 4.
[0019] В некоторых вариантах осуществления, слитый белок включает часть в форме полноразмерной полипептидной последовательности человеческого Элафина, где эта часть имеет следующую аминокислотную последовательность:

[0020] В некоторых вариантах осуществления, слитый белок включает полипептидную последовательность человеческого Элафина, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 5.
[0021] В некоторых вариантах осуществления, слитый белок включает домен WAP полноразмерной полипептидной последовательности человеческого Элафина, где домен WAP имеет следующую аминокислотную последовательность:
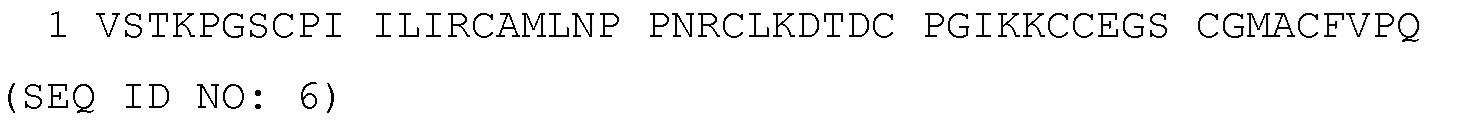
[0022] В некоторых вариантах осуществления, слитый белок включает полипептидную последовательность человеческого Элафина, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 6.
[0023] В некоторых вариантах осуществления, полипептидная последовательность Элафина представляет собой или аминокислотная последовательность, происходящая из полипептида Элафина, происходит из одной или более из полипептидных последовательностей человеческого элафина, показанных в номерах доступа в Генном Банке P19957.3, NP 002629.1, BAA02441.1, EAW75814.1, EAW75813.1, Q8IUB2.1 и/или NP_542181.1.
[0024] В некоторых вариантах осуществления, последовательность Полипептида 1 включает полипептидную последовательность эппина или аминокислотную последовательность, которая происходит из эппина. В некоторых вариантах осуществления, последовательность Полипептида 1 включает часть в форме белка эппина, такой как, например, домен WAP или его подчасть. В предпочтительном варианте осуществления, полипептидная последовательность эппина представляет собой или аминокислотная последовательность, которая происходит из эппина, происходит из полипептидной последовательности человеческого эппина.
[0025] В некоторых вариантах осуществления, полипептидная последовательность эппина представляет собой или аминокислотная последовательность, происходящая из полипептида эппина, происходит из одной или более полипептидных последовательностей человеческого эппина, показанных в номерах доступа в Генном Банке 095925.1, NP 065131.1, AAH44829.2, AAH53369.1, AAG00548.1, AAG00547.1 и/или AAG00546.1.
[0026] В некоторых вариантах осуществления, слитые белки содержат одну или несколько мутаций. Например, слитый белок содержит по меньшей мере одну мутацию метионинового (Met) остатка в не-Fc части слитого белка, например, в части SLPI слитого белка. При этих мутациях Met, остаток Met может быть замещен любой аминокислотой. Например, остаток Met может быть замещен аминокислотой с гидрофобной боковой цепью, такой как, например, лейцин (Leu, L) или валин (Val, V). Без желаемой связи с теорией, мутация (мутации) Met предотвращают окисление и последующую инактивацию ингибиторной активности слитых белков по изобретению. В некоторых вариантах осуществления, мутация Met находится в положении 98 полипептида SLPI, например, мутация Met представляет собой Met98Leu (M98L) в SEQ ID NO: 8.
[0027] В некоторых вариантах осуществления, слитые белки модифицированы для увеличения или иного ингибирования протеолитического расщепления мутацией сайтов протеолитического расщепления.
В некоторых вариантах осуществления, мутация сайта протеолитического расщепления происходит в остатке в части в форме SLPI слитого белка. Например, мутация сайта протеолитического расщепления происходит в остатке в аминокислотной последовательности SEQ ID NO: 2, выбранном из Ser15, Ala16, Glu17, и их комбинаций.
[0028] В некоторых вариантах осуществления, второй полипептид (Полипептид 2) содержащего домен WAP слитого белка представляет собой полипептид Fc или происходит из полипептида Fc. Эти варианты осуществления совместно именуются в настоящем описании как «слитые белки WAP-Fc». Слитые белки WAP-Fc, описанные здесь, включают по меньшей мере содержащий домен WAP полипептид, или аминокислотную последовательность, которая происходит из содержащего домен WAP полипептида, и полипептид Fc или аминокислотную последовательность, которая происходит из полипептида Fc.
[0029] В некоторых вариантах осуществления, слитый белок WAP-Fc включает полипептид, содержащий один домен WAP. В других вариантах осуществления, слитые белки WAP-Fc включают полипептид, содержащий несколько доменов WAP, совместно именуемые здесь как «слитый белок WAP(a’)-Fc», где (a’) обозначает целое число, составляющее по меньшей мере 2. В некоторых вариантах осуществления, полипептиды, содержащие домен WAP, в слитом белке WAP(a’)-Fc, могут включать одинаковую аминокислотную последовательность. Например, полипептиды, содержащие домен WAP слитого белка WAP(a’)-Fc, могут происходить из полипептида SLPI или Элафина, но ни из обоих (например, Элафин-Fc-Элафин, или SLPI-Fc-SLPI). В других вариантах осуществления, полипептиды, содержащие домен WAP в слитом белке WAP(a’)-Fc, могут включать отличающиеся аминокислотные последовательности. Например, слитый белок включает аминокислотные последовательности, происходящие и из SLPI, и из Элафина (например, SLPI-Fc-Элафин, или Элафин-Fc-SLPI).
[0030] В некоторых вариантах осуществления содержащий домен WAP полипептид слитого белка WAP-Fc происходит из любой из аминокислотных последовательностей SEQ ID NOs 1-6. В некоторых вариантах осуществления, содержащий домен WAP полипептид, слитого белка WAP-Fc, имеет идентичность последовательности по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% с любой из аминокислотных последовательностей, имеющих SEQ ID NO. 1, 2, 3, 4, 5 или 6.
[0031] В некоторых вариантах осуществления, содержащий домен WAP полипептид, слитого белка WAP-Fc, представляет собой или происходит из последовательностей, показанных в номерах доступа Генного Банка CAA28187.1, NP_003055.1, EAW75869.1, P03973.2, AAH20708.1, CAB64235.1, CAA28188.1, AAD19661.1, BAG35125.1, P19957.3, NP_002629.1, BAA02441.1, EAW75814.1, EAW75813.1, Q8IUB2.1 и/или ΝΡ_542181.1, 095925.1, ΝΡ_065131.1, АΑΗ44829.2, AAH53369.1, AAG00548.1, AAG00547.1 и/или AAG00546.1.
[0032] В некоторых вариантах осуществления, полипептид Fc слитого белка WAP-Fc представляет собой человеческий полипептид Fc, например, полипептидную последовательность Fc человеческого IgG или аминокислотную последовательность, которая происходит из полипептидной последовательности Fc человеческого IgG. В некоторых вариантах осуществления, полипептид Fc представляет собой полипептид Fc человеческого IgG1 или аминокислотную последовательность, которая происходит из полипептидной последовательности Fc человеческого IgG1. В некоторых вариантах осуществления, полипептид Fc представляет собой полипептид Fc человеческого IgG2 или аминокислотную последовательность, которая происходит из полипептидной последовательности Fc человеческого IgG2. В некоторых вариантах осуществления, полипептид Fc представляет собой полипептид Fc человеческого IgG3 или аминокислотную последовательность, которая происходит из полипептидной последовательности Fc человеческого IgG3. В некоторых вариантах осуществления, полипептид Fc представляет собой полипептид Fc человеческого IgG4 или аминокислотную последовательность, которая происходит из полипептидной последовательности Fc человеческого IgG4. В некоторых вариантах осуществления, полипептид Fc представляет собой полипептид Fc человеческого IgM или аминокислотную последовательность, которая происходит из полипептидной последовательности Fc человеческого IgM.
[0033] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG1, имеющую следующую аминокислотную последовательность:

[0034] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG1, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 7.
[0035] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG2, имеющую следующую аминокислотную последовательность:

[0036] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG2, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 8.
[0037] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG3, имеющую следующую аминокислотную последовательность:

[0038] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG3, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 9.
[0039] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG4, имеющую следующую аминокислотную последовательность:

[0040] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgG4, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 10.
[0041] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgGM, имеющую следующую аминокислотную последовательность:

[0042] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептид Fc, полипептид Fc слитого белка включает полипептидную последовательность Fc человеческого IgM, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 11.
[0043] В некоторых вариантах осуществления слитых белков по настоящему изобретению, второй полипептид (Полипептид 2) содержащего домен WAP слитого белка представляет собой нацеливающий на цитокин полипептид или происходит из нацеливающего на цитокин полипептида. Эти варианты осуществления совместно именуются здесь «слитые белки, состоящие из WAP-нацеливающего на цитокин полипептида». Слитые белки WAP-нацеливающий на цитокин полипептид, описанные здесь, включают по меньшей мере содержащий домен WAP полипептид или аминокислотную последовательность, которая происходит из содержащего домен WAP полипептида, и нацеливающий на цитокин полипептид или его производное. В некоторых вариантах осуществления, слитый белок WAP-нацеливающий на цитокин полипептид включает полипептид, содержащий один домен WAP. В других вариантах осуществления слитый белок WAP-нацеливающий на цитокин полипептид включает полипептид, содержащий несколько доменов WAP, и эти варианты осуществления совместно именуются здесь как «слитые белки WAP(a’)-нацеливающий на цитокин полипептид», где (a’) обозначает целое число по меньшей мере 2. В некоторых вариантах осуществления, каждый содержащий домен WAP полипептид в слитом белке WAP(a’) -нацеливающий на цитокин полипептид может включать одинаковую аминокислотную последовательность. В других вариантах осуществления, каждый содержащий домен WAP полипептид в слитом белке WAP(a’)-нацеливающий на цитокин полипептид может включать различные аминокислотные последовательности.
[0044] В некоторых вариантах осуществления, содержащий домен WAP полипептид слитого белка из WAP-нацеливающего на цитокин полипептида происходит из любой из аминокислотных последовательностей SEQ ID NO 1-6. В некоторых вариантах осуществления, содержащий домен WAP полипептид слитого белка из WAP-нацеливающего на цитокин полипептида имеет идентичность последовательности по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% с любой из аминокислотных последовательностей, имеющих SEQ ID NO. 1, 2, 3, 4, 5 или 6.
[0045] В некоторых вариантах осуществления, содержащий домен WAP полипептид слитого белка из WAP-нацеливающего на цитокин полипептида представляет собой или происходит из последовательностей, показанных в номерах доступа Генного Банка CAA28187.1, NP_003055.1, EAW75869.1, P03973.2, AAH20708.1, CAB64235.1, CAA28188.1, AAD19661.1, BAG35125.1, P19957.3, NP_002629.1, BAA02441.1, EAW75814.1, EAW75813.1, Q8IUB2.1, и/или NP_542181.1, 095925.1, NP_065131.1, AAH44829.2, AAH53369.1, AAG00548.1, AAG00547.1 и/или AAG00546.1.
[0046] В некоторых вариантах осуществления, нацеливающий на цитокин полипептид слитого белка из WAP-нацеливающего на цитокин полипептида представляет собой цитокиновый рецептор или происходит из цитокинового рецептора. В предпочтительном варианте осуществления, нацеливающий на цитокин полипептид представляет собой или аминокислотная последовательность, которая происходит из цитокинового рецептора, происходит из последовательности человеческого цитокинового рецептора. В других вариантах осуществления, нацеливающий на цитокин полипептид представляет собой антитело или фрагмент антитела, например антитело к цитокину или фрагмент антитела к цитокину. Термин фрагмент антитела включает одиночную цепь, фрагмент Fab, фрагмент F(ab')2, scFv, scAb, dAb, антитело к домену одиночной тяжелой цепи и антитело к домену одиночной легкой цепи. В предпочтительном варианте осуществления, нацеливающий на цитокин полипептид представляет собой или аминокислотную последовательность, которая происходит из антитела, или фрагмент антитела происходит из последовательности химерного, гуманизированного или полностью человеческого антитела. В других вариантах осуществления, нацеливающий на цитокин полипептид связывает цитокиновый рецептор и предотвращает связывание цитокина с рецептором.
[0047] Слитый белок WAP-нацеливающий на цитокин полипептид может включать часть слитого белка WAP-Fc. Например, антитело содержит полипептид Fc. Поэтому, в некоторых вариантах осуществления, где нацеливающий на цитокин полипептид представляет собой нацеленное на цитокин антитело, слитый белок WAP-нацеливающий на цитокин полипептид включает часть слитого белка WAP-Fc. Кроме того, большинство рецепторных слитых белков, которые могут иметь терапевтическое применение, представляют собой слитые белки Fc. Так, в некоторых вариантах осуществления, где слитый белок из WAP-нацеливающего на цитокин полипептида представляет собой слитый белок WAP-цитокиновый рецептор, то слитый белок WAP-нацеливающий на цитокин полипептид может включать полипептид Fc в дополнение к части в виде содержащего домен WAP полипептида и части в виде цитокинового рецептора.
[0048] В некоторых вариантах осуществления, где слитый белок WAP-нацеливающий на цитокин полипептид включает последовательность полипептида Fc, то последовательность полипептида Fc происходит из одной из аминокислотных последовательностей, имеющих SEQ ID NO. 7, 8, 9, 10 или 11. В некоторых вариантах осуществления, где слитый белок WAP-нацеливающий на цитокин полипептид включает последовательность полипептида Fc, то последовательность полипептида Fc имеет идентичность последовательности по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% с аминокислотной последовательностью любой из последовательностей, имеющих SEQ ID NO. 7, 8, 9, 10 или 11.
[0049] В некоторых вариантах осуществления, содержащий домен WAP полипептид, и нацеливающий на цитокин полипептид функционально связаны через линкерную область, например, глицин-сериновый линкер или линкер на глицин-сериновой основе. В некоторых вариантах осуществления, содержащий домен WAP полипептид, и нацеливающий на цитокин полипептид функционально связаны через шарнир. В некоторых вариантах осуществления, содержащий домен WAP полипептид, и нацеливающий на цитокин полипептид функционально связаны через линкерную область и шарнир. В других вариантах осуществления, серпиновый полипептид и нацеливающий на цитокин полипептид скреплены непосредственно.
[0050] В некоторых вариантах осуществления слитых белков по настоящему изобретению, второй полипептид (Полипептид 2) содержащего домен WAP слитого белка представляет собой серпиновый полипептид или происходит из серпинового полипептида. Эти варианты осуществления совместно именуются здесь как «слитые белки WAP-серпин». Слитые белки WAP-серпин, описанные здесь, включают по меньшей мере содержащий домен WAP полипептид, или аминокислотную последовательность, которая происходит из содержащего домен WAP полипептида, и серпиновый полипептид или аминокислотную последовательность, которая происходит из серпинового полипептида.
[0051] В некоторых вариантах осуществления, содержащий домен WAP полипептид слитого белка WAP-серпин происходит из любой из аминокислотных последовательностей SEQ ID NOs 1-6. В некоторых вариантах осуществления, содержащий домен WAP полипептид слитого белка WAP-серпин имеет идентичность последовательности по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% с любой из аминокислотных последовательностей, имеющих SEQ ID NO. 1, 2, 3, 4, 5 или 6.
[0052] В некоторых вариантах осуществления, содержащая домен WAP полипептидная последовательность слитого белка WAP-серпин представляет собой или происходит из последовательностей, показанных в номерах доступа Генного Банка CAA28187.1, NP_003055.1, EAW75869.1, P03973.2, AAH20708.1, CAB64235.1, CAA28188.1, AAD19661.1, BAG35125.1., P19957.3, NP_002629.1, BAA02441.1, EAW75814.1, EAW75813.1, Q8IUB2.1 и/или NP_542181.1, 095925.1, NP065131.1, AAH44829.2, AAH53369.1, AAG00548.1, AAG00547.1 и/или AAG00546.1.
[0053] Слитые белки WAP-серпин, описанные здесь, включают содержащий домен WAP полипептид и серпиновый полипептид или аминокислотную последовательность, которая происходит из серпинового полипептида. Серпины представляют собой группу белков с одинаковыми структурами, которые сначала идентифицировали как набор белков, способных ингибировать протеазы. Серпиновые белки, подходящие для использования в слитых белках по настоящему изобретению, включают в качестве не ограничивающего примера, альфа-1 антитрипсин (AAT), связанный с антитрипсином белок (СЕРПИНA2), альфа-1 антихимотрипсин (СЕРПИНA3), каллистатин (СЕРПИНA4), ингибитор эластазы моноцитов и нейтрофилов (СЕРПИНB1), PI-6 (СЕРПИНB6), антитромбин (СЕРПИНC1), ингибитор активатора плазминогена 1 (СЕРПИНE1), альфа-2 антиплзмин (СЕРПИНF2), ингибитор комплемента 1 (СЕРПИНG1) и нейросерпин (СЕРПИНI1).
[0054] В некоторых вариантах осуществления, последовательность серпинового полипептида содержит полипептидную последовательность альфа-1 антитрипсина (AAT) или аминокислотную последовательность, которая происходит из AAT. В некоторых вариантах осуществления, последовательность серпинового полипептида содержит часть белка AAT. В некоторых вариантах осуществления, последовательность серпинового полипептида содержит по меньшей мере часть в виде петли реактивного участка белка AAT. В некоторых вариантах осуществления, где слитый белок по изобретению включает серпиновый полипептид, серпиновый полипептид слитого белка включает часть в виде петли реактивного участка белка AAT или включает по меньшей мере аминокислотную последовательность GTEAAGAMFLEAIPMSIPPEVKFNK (SEQ ID NO: 12). В предпочтительном варианте осуществления, полипептидная последовательность AAT представляет собой или аминокислотная последовательность, которая происходит из AAT, происходит из полипептидной последовательности человеческого AAT. В некоторых вариантах осуществления, где слитый белок по изобретению включает серпиновый полипептид, серпиновый полипептид слитого белка включает модифицированный вариант части в виде петли реактивного участка белка AAT или включает по меньшей мере аминокислотную последовательность GTEAAGAEFLEAIPLSIPPEVKFNK (SEQ ID NO: 38).
[0055] В некоторых вариантах осуществления слитых белков WAP-серпин, серпиновый полипептид включает полноразмерную полипептидную последовательность человеческого AAT, имеющую следующую аминокислотную последовательность:


[0056] В некоторых вариантах осуществления слитых белков WAP-серпин, серпиновый полипептид включает полипептидную последовательность человеческого AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 13.
[0057] В некоторых вариантах осуществления слитых белков WAP-серпин, серпиновый полипептид включает полипептидную последовательность AAT или аминокислотную последовательность, происходящую из полипептида AAT или происходящую из одной или нескольких полипептидных последовательностей человеческого AAT, показанных в номерах доступа Генного Банка AAB59495.1, CAJ15161.1, P01009.3, AAB59375.1, AAA51546.1, CAA25838.1, NP_001002235.1, CAA34982.1, NP_001002236.1, NP_000286.3, NP_001121179.1, NP_001121178.1, ΝΡ_001121177.1, NP_001121176.16, NP_001121175.1, NP_001121174.1, NP_001121172.
[0058] В некоторых вариантах осуществления, слитый белок WAP-серпиновый домен может также включать полипептид Fc или аминокислотную последовательность, которая происходит из полипептида Fc. Эти варианты осуществления совместно именуются здесь как «слитые белки WAP-Fc-серпин». В этих вариантах осуществления, данную терминологию не следует трактовать как конкретный порядок расположения частей. Например, порядок расположения частей слитого белка может представлять собой WAP-Fc-серпин, серпин-WAP-Fc или любой их вариант или комбинацию. Слитые белки WAP-Fc-серпин, описанные здесь, включают по меньшей мере содержащий домен WAP полипептид или аминокислотную последовательность, которая происходит из содержащего домен WAP полипептида, серпиновый полипептид или аминокислотную последовательность, которая происходит из серпинового полипептида, и полипептид Fc или аминокислотную последовательность, которая происходит из полипептида Fc.
[0059] В некоторых вариантах осуществления, где слитый белок WAP-серпиновый полипептид включает последовательность полипептида Fc, то последовательность полипептида Fc происходит из любой из аминокислотных последовательностей, имеющих SEQ ID NO. 7, 8, 9, 10, или 11. В некоторых вариантах осуществления, где слитый белок WAP-серпин включает последовательность полипептида Fc, то последовательность полипептида Fc имеет идентичность последовательности по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% с аминокислотной последовательностью любой из последовательностей, имеющих SEQ ID NO. 7, 8, 9, 10 или 11.
[0060] В некоторых вариантах осуществления, слитый белок WAP-серпиновый домен может также включать полипептид альбумина или аминокислотную последовательность, которая происходит из полипептида альбумина. Эти варианты осуществления совместно именуются здесь как «слитые белки WAP-альбумин-серпин». В этих вариантах осуществления, данную терминологию не следует трактовать как конкретный порядок расположения частей. Например, порядок расположения частей слитого белка может представлять собой WAP-альбумин-серпин, серпин-альбумин-WAP или любой их вариант или комбинацию. Слитые белки WAP-альбумин-серпин, описанные здесь, включают по меньшей мере содержащий домен WAP полипептид или аминокислотную последовательность, которая происходит из содержащего домен WAP полипептида, серпиновый полипептид или аминокислотную последовательность, которая происходит из серпина, и полипептид альбумина или аминокислотную последовательность, которая происходит из полипептида альбумина.
[0061] В некоторых вариантах осуществления, где слитый белок WAP-серпиновый домен включает полипептид альбумина, полипептидную последовательность альбумина, то последовательность происходит из любой из аминокислотных последовательностей SEQ ID NO. 14-15, описанных здесь. В других вариантах осуществления, где слитый белок серпин-домен WAP включает полипептидную последовательность альбумина, то полипептидная последовательность альбумина имеет идентичность последовательности по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% с любой из аминокислотных последовательностей, имеющих SEQ ID NO. 14 или 15.
[0062] В некоторых вариантах осуществления слитого белка по настоящему изобретению, второй полипептид (Полипептид 2) содержащего домен WAP слитого белка представляет собой полипептид альбумина или происходит из полипептида альбумина. Эти варианты осуществления совместно именуются здесь как «слитые белки WAP-альбумин». Слитые белки WAP-альбумин, описанные здесь, включают по меньшей мере содержащий домен WAP полипептид или аминокислотную последовательность, которая происходит из содержащего домен WAP полипептида, и полипептид альбумина или аминокислотную последовательность, которая происходит из полипептида альбумина. Кроме того, настоящее изобретение относится к слитым белкам из содержащего домен WAP полипептида и связывающего альбумин полипептида, где альбумин функционально связан с содержащим домен WAP полипептидом через промежуточную связывающую молекулу. В данном случае, содержащий домен WAP полипептид не ковалентно или ковалентно связан с человеческим сывороточным альбумином.
[0063] В некоторых вариантах осуществления, содержащий домен WAP полипептид слитого белка WAP-альбумин происходит из любой из аминокислотных последовательностей SEQ ID NO 1-6. В некоторых вариантах осуществления, содержащий домен WAP полипептид слитого белка WAP-альбумин имеет идентичность последовательности по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% с любой из аминокислотных последовательностей, имеющих SEQ ID NO. 1, 2, 3, 4, 5 или 6.
[0064] В некоторых вариантах осуществления, содержащая домен WAP полипептидная последовательность слитого белка WAP-альбумин представляет собой или происходит из последовательностей, показанных в номерах доступа Генного Банка CAA28187.1, NP_003055.1, EAW75869.1, P03973.2, AAH20708.1, CAB64235.1, CAA28188.1, AAD19661.1, BAG35125.1, P19957.3, NP_002629.1, BAA02441.1, EAW75814.1, EAW75813.1, Q8IUB2.1 и/или NP_542181.1, 095925.1, NP065131.1, AAH44829.2, AAH53369.1, AAG00548.1, AAG00547.1 и/или AAG00546.1.
[0065] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептидную последовательность альбумина, то полипептидная последовательность альбумина слитого белка представляет собой полипептид человеческого сывороточного альбумина (HSA) или аминокислотную последовательность, происходящую из HSA. В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептидную последовательность альбумина, то полипептидная последовательность альбумина слитого белка в слитом белке включает полипептидную последовательность HSA, имеющую следующую аминокислотную последовательность:

[0066] В некоторых вариантах осуществления, где слитый белок по изобретению включает полипептидную последовательность альбумина, то полипептидная последовательность альбумина слитого белка включает полипептидную последовательность человеческого сывороточного альбумина, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 14.
[0067] В некоторых вариантах осуществления слитых белков WAP-альбумин, полипептидная последовательность альбумина включает домен 3 полипептидной последовательности человеческого сывороточного альбумина, имеющей следующую аминокислотную последовательность:

[0068] В некоторых вариантах осуществления слитых белков WAP-альбумин, полипептидная последовательность альбумина включает полипептидную последовательность человеческого сывороточного альбумина, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 15.
[0069] В некоторых вариантах осуществления, содержащий домен WAP полипептид связан с человеческим сывороточным альбумином через промежуточный связывающий альбумин полипептид. Связывающий альбумин полипептид может представлять собой антитело или фрагмент антитела или происходить из антитела или фрагмента антитела. В предпочтительном варианте осуществления, связывающий альбумин полипептид представляет собой или аминокислотная последовательность, которая происходит из антитела или фрагмента антитела, происходит из последовательности химерного, гуманизированного или полностью человеческого антитела. Термин фрагмент антитела включает одиночную цепь, фрагмент Fab, фрагмент F(ab')2, scFv, scAb, dAb, антитело к домену одиночной тяжелой цепи и антитело к домену одиночной легкой цепи. Кроме того, связывающий альбумин полипептид может представлять собой связывающий альбумин пептид. Другой вариант осуществления настоящего изобретения представляет собой слияние содержащего домен WAP полипептида - связывающего альбумин полипептида, где связывающий альбумин полипептид представляет собой домен 3 стрептококкового белка G или последовательность, происходящую из домена 3 стрептококкового белка G. В других вариантах осуществления, содержащий домен WAP полипептид и человеческий сывороточный альбумин соединены непосредственно.
[0070] В некоторых вариантах осуществления, слитые белки содержат одну или несколько мутаций. Например, слитый белок содержит по меньшей мере одну мутацию остатка метионина (Met) не в части Fc слитого белка, например в части SLPI слитого белка. При этих мутациях Met, остаток Met может быть замещен любой аминокислотой. Например, остаток Met может быть замещен аминокислотой с гидрофобной боковой цепью, такой как, например, лейцин (Leu, L) или валин (Val, V). Без желаемой связи с теорией, мутация (мутации) Met предотвращают окисление и последующую инактивацию ингибиторной активности слитых белков по изобретению. В некоторых вариантах осуществления, мутация Met находится в положении 98 полипептида SLPI. Например, мутация Met, которая происходит в остатке аминокислотной последовательности SEQ ID NO: 8, представляет собой Met98Leu (M98L).
[0071] В некоторых вариантах осуществления, слитые белки модифицируются для увеличения или в иных случаях ингибирования протеолитического расщепления, например, путем мутации сайтов протеолитического расщепления. В некоторых вариантах осуществления, мутация сайта протеолитического расщепления происходит в остатке в части SLPI слитого белка. Например, мутация сайта протеолитического расщепления происходит в остатке в аминокислотной последовательности SEQ ID NO: 2, выбранном из Ser15, Ala16, Glu17 и их комбинаций.
[0072] В некоторых вариантах осуществления, слитые белки модифицируются для изменения или модуляции иным образом эффекторной функции Fc слитого белка при одновременном сохранении связывания и ингибиторной функции, по сравнению с неизмененным слитым белком. Эффекторные функции Fc включают, в качестве не ограничивающих примеров, связывание с Fc рецептором, предотвращение высвобождения провоспалительных медиаторов после связывания с Fc рецептором, фагоцитоз, модифицированную антитело-зависимую клеточно опосредованную цитотоксичность (ADCC), модифицированную компленент-зависимую цитотоксичность (CDC), модифицированное гликозилирование в остатке Asn297 (показатель EU нумерации Kabat, Kabat et al., 1991 Sequences of Proteins of Immunological Interest) Fc полипептида. В некоторых вариантах осуществления, слитые белки мутируются или иным образом модифицируются для влияния на связывание с Fc рецептором. В некоторых вариантах осуществления, полипептид Fc модифицируются для усиления связывания с FcRn. Примерами мутаций полипептида Fc, которые усиливают связывание с FcRn, являются Met252Tyr, Ser254Thr, Thr256Glu (M252Y, S256T, T256E) (нумерация Kabat, Dall'Acqua et al., 2006, J. Biol Chem Vol 281(33) 23514-23524) или Met428Leu и Asn434Ser (M428L, N434S) (Zalevsky et al., 2010 Nature Biotech, Vol 28(2) 157-159). (показатель EU нумерации Kabat, Kabat et al., 1991 Sequences of Proteins of Immunological Interest).
[0073] Слитые белки и их варианты по настоящему изобретению проявляют ингибиторную активность, например, ингибированием серин-протеазы, такой как человеческая нейтрофильная эластаза (NE), серин-протеаза укладки хемотрипсина, которая секретируется нейтрофилами во время воспалительной реакции. Слитые белки по настоящему изобретению полностью или частично снижают или иным образом модулируют экспрессию или активность серин-протеазы после связывания или иного взаимодействия с серин-протеазой, например человеческой серин-протеазой. Снижение или модуляция биологической функции серин-протеазы являются полными или частичными после взаимодействия между слитыми белками и белком, полипептидом и/или пептидом человеческой серин-протеазы. Считается, что слитые белки полностью ингибируют экспрессию или активность серин-протеазы, когда уровень экспрессии или активности серин-протеазы в присутствии слитого белка уменьшается по меньшей мере на 95%, например, на 96%, 97%, 98%, 99% или 100%, по сравнению с уровнем экспрессии или активности серин-протеазы в отсутствие взаимодействия, например, связывания с описанным здесь слитым белком. Считается, что слитые белки частично ингибируют экспрессию или активность серин-протеазы, когда уровень экспрессии или активности серин-протеазы в присутствии слитого белка уменьшается менее чем на 95%, например, 10%, 20%, 25%, 30%, 40%, 50%, 60%, 75%, 80%, 85% или 90%, по сравнению с уровнем экспрессии или активности серин-протеазы в отсутствие взаимодействия, например, связывания, с описанным здесь слитым белком.
[0074] Описанные здесь слитые белки полезны при разнообразных терапевтических, диагностических и профилактических показаниях. Например, слитые белки полезны при лечении разнообразных заболеваний и расстройств у субъекта. В некоторых вариантах осуществления, описанные здесь слитые белки полезны при лечении, смягчении симптомов, облегчения течения и/или задержки прогрессирования заболевания и расстройства у субъекта, страдающего или идентифицированного как имеющего риск заболевания или расстройства, выбранного из недостаточности альфа-1-антитрипсина (AAT), эмфиземы, хронического обструктивного легочного заболевания (COPD), острого респираторного дистресс синдрома (ARDS), аллергической астмы, муковисцедоза, различных форм рака легких, ишемического-реперфузионного повреждения, включая, например, ишемию/реперфузионное повреждение после трансплантации сердца, инфаркта миокарда, артрита, ревматоидного артрита, септического артрита, псориатического артрита, анкилозирующего спондилита, болезни Крона, псориаза, сахарного диабета I и/или II типа, бактериальных инфекций, грибковых инфекций, вирусных инфекций, пневмонии, сепсиса, болезни трансплантат против хозяина (GVHD), заживления ран, системной красной волчанки и рассеянного склероза.
[0075] Слитые белки и их варианты по настоящему изобретению проявляют ингибиторную активность, например, ингибированием серин-протеазы. Слитые белки по настоящему изобретению полностью или частично снижают или иным образом модулируют экспрессию или активность серин-протеазы после связывания или иного взаимодействия с серин-протеазой, например человеческой серин-протеазой. Снижение или модуляция биологической функции серин-протеазы является полной или частичной после взаимодействия между слитыми белками и белком, полипептидом и/или пептидом человеческой серин-протеазой. Считают, что слитые белки полностью ингибируют экспрессию или активность серин-протеазы, когда уровень экспрессии или активности в присутствии слитого белка уменьшается по меньшей мере на 95%, например на 96%, 97%, 98%, 99% или 100%, по сравнению с уровнем экспрессии или активности серин-протеазы в отсутствие взаимодействия, например связывания, с описанным здесь слитым белком. Считают, что слитые белки частично ингибируют экспрессию или активность серин-протеазы, когда уровень экспрессии или активности в присутствии слитого белка уменьшается менее чем на 95%, например на 10%, 20%, 25%, 30%, 40%, 50%, 60%, 75%, 80%, 85% или 90%, по сравнению с уровнем экспрессии или активности серин-протеазы в отсутствие взаимодействия, например, связывания, с описанным здесь слитым белком.
[0076] Фармацевтические композиции в соответствии с изобретением могут включать слитый белок по изобретению, включая модифицированные слитые белки и другие варианты, наряду с подходящим носителем. Эти фармацевтические композиции могут быть включены в наборы, такие как, например, диагностические наборы.
Краткое описание чертежей
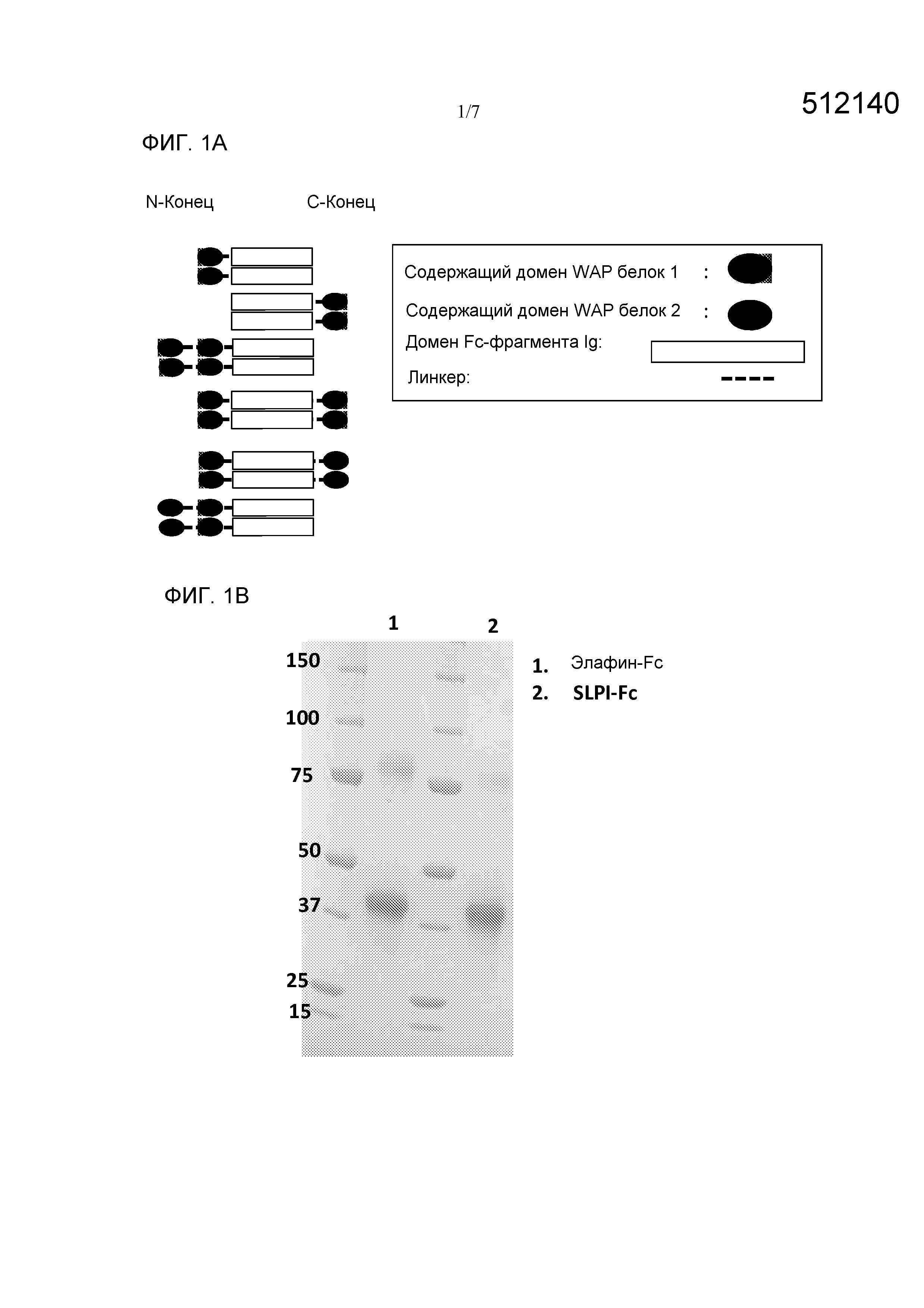
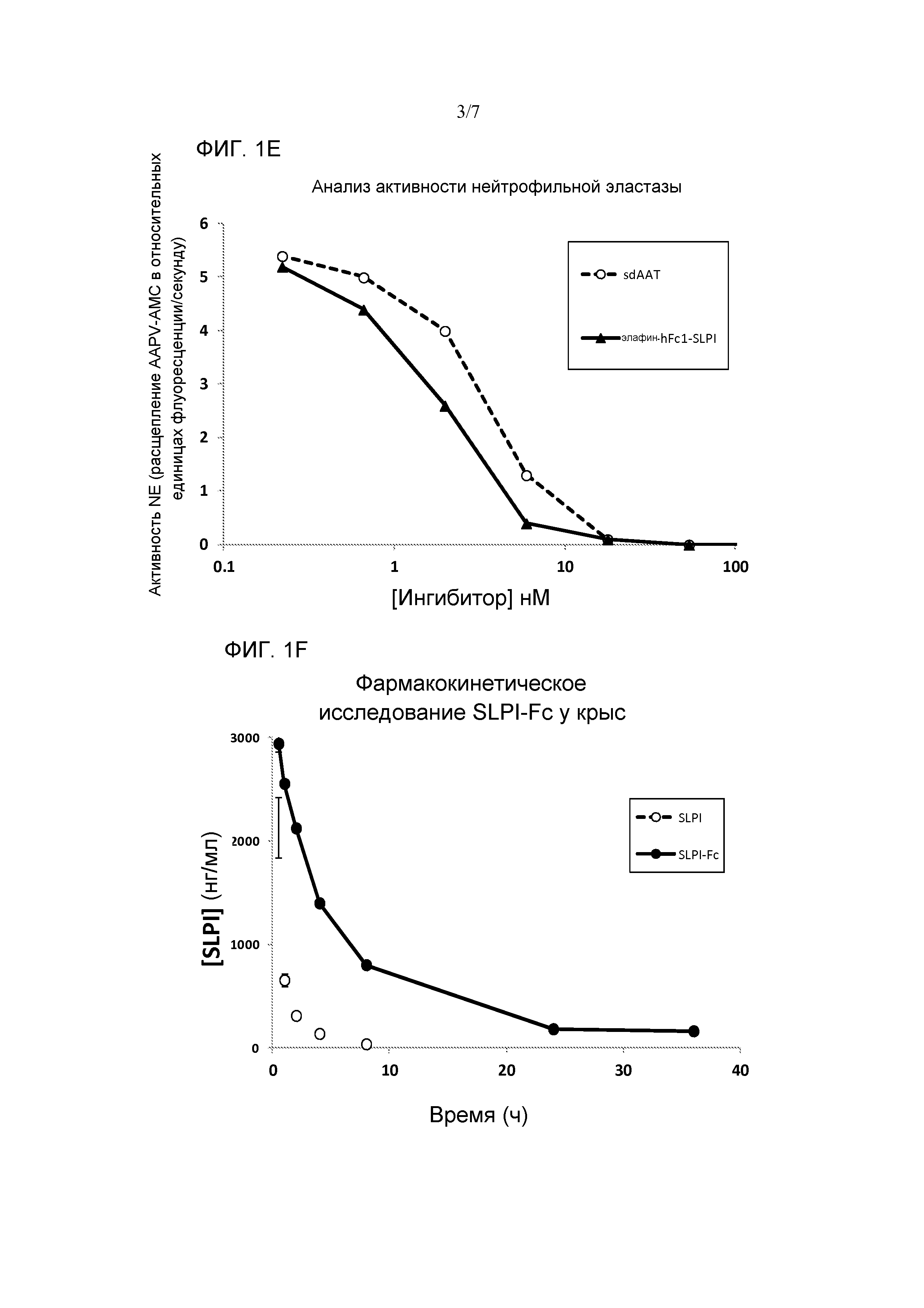
[0077] Фиг. 1А является схематическим представлением некоторых вариантов осуществления слитых белков из содержащего домен WAP полипептида-Fc в соответствии с изобретением. Содержащий домен WAP полипептид может локализоваться в любом положении в пределах слитого белка. Представлены также варианты этих слитых белков, включающих полипептид, содержащий несколько доменов WAP. Фиг. 1B является фотографией геля SDS-PAGE (электрофореза в полиакриламидном геле в присутствии додецилсульфата), показывающая Элафин-Fc1 (полоса 1, человеческий IgG1 Fc), и SLPI-Fc1 (полоса 2, человеческий IgG1 Fc). Фиг. 1C представляет собой график, показывающий ингибирование активности эластазы нейтрофилов слитыми белками Элафин-Fc и SLPI-Fc. Фиг. 1D является фотографией геля SDS-PAGE, показывающая слитый белок, состоящий из Элафин-Fc-SLPI. Фиг. 1E представляет собой график, показывающий ингибирование активности эластазы нейтрофилов слитым белком Элафин-Fc-SLPI. Полученный из сыворотки AAT (альфа-1-антитрипсин) показан в качестве контроля для ингибирования NE (эластазы нейтрофилов). Фиг. 1F представляет собой график, изображающий сывороточные концентрации в динамике во времени рекомбинантного SLPI, по сравнению с SLPI-Fc у крыс (3 на тестируемый белок) которым вводили l0 мг/кг белка. период полувыведения SLPI-Fc существенно длиннее, чем период полувыведения рекомбинантного SLPI.
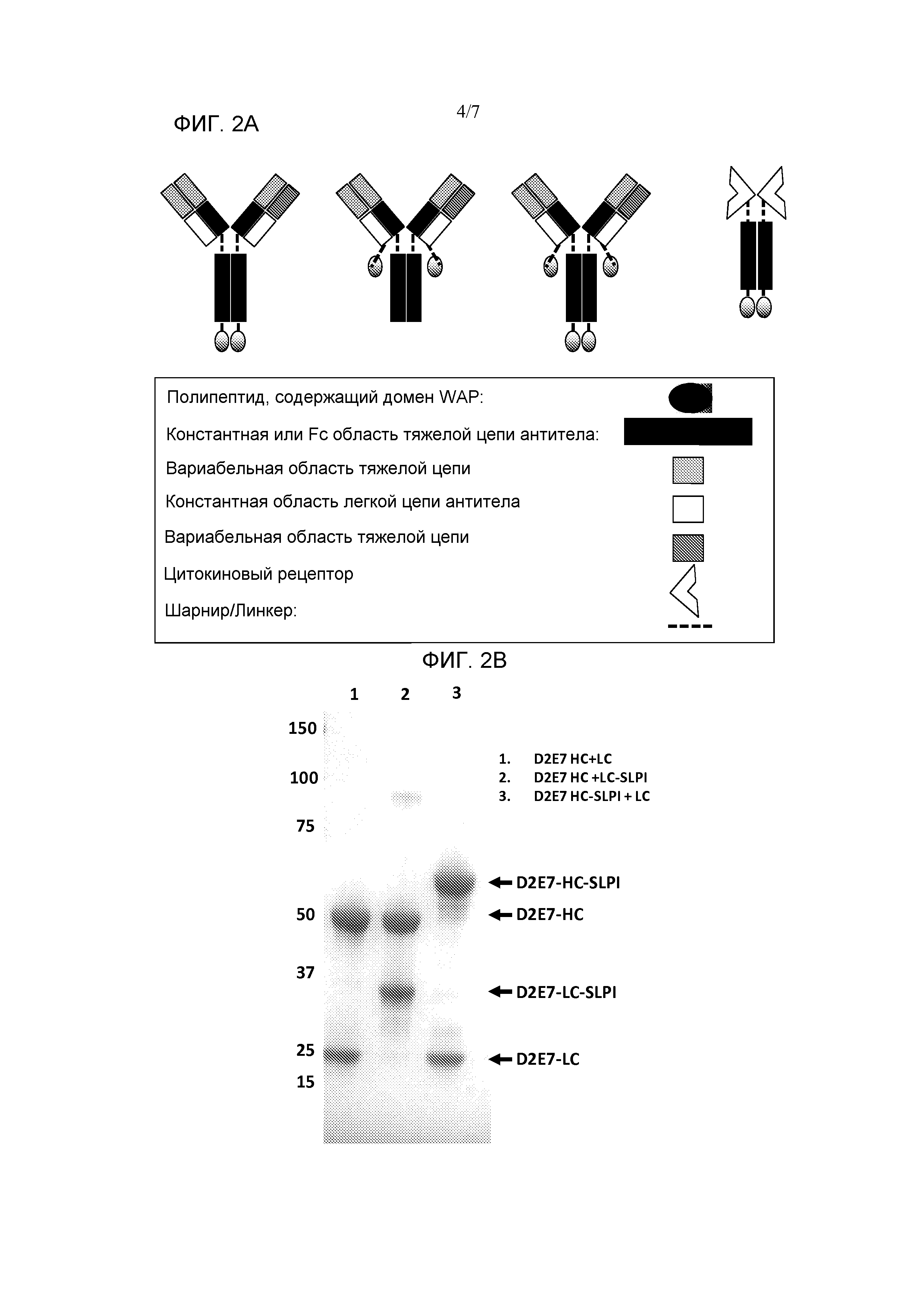
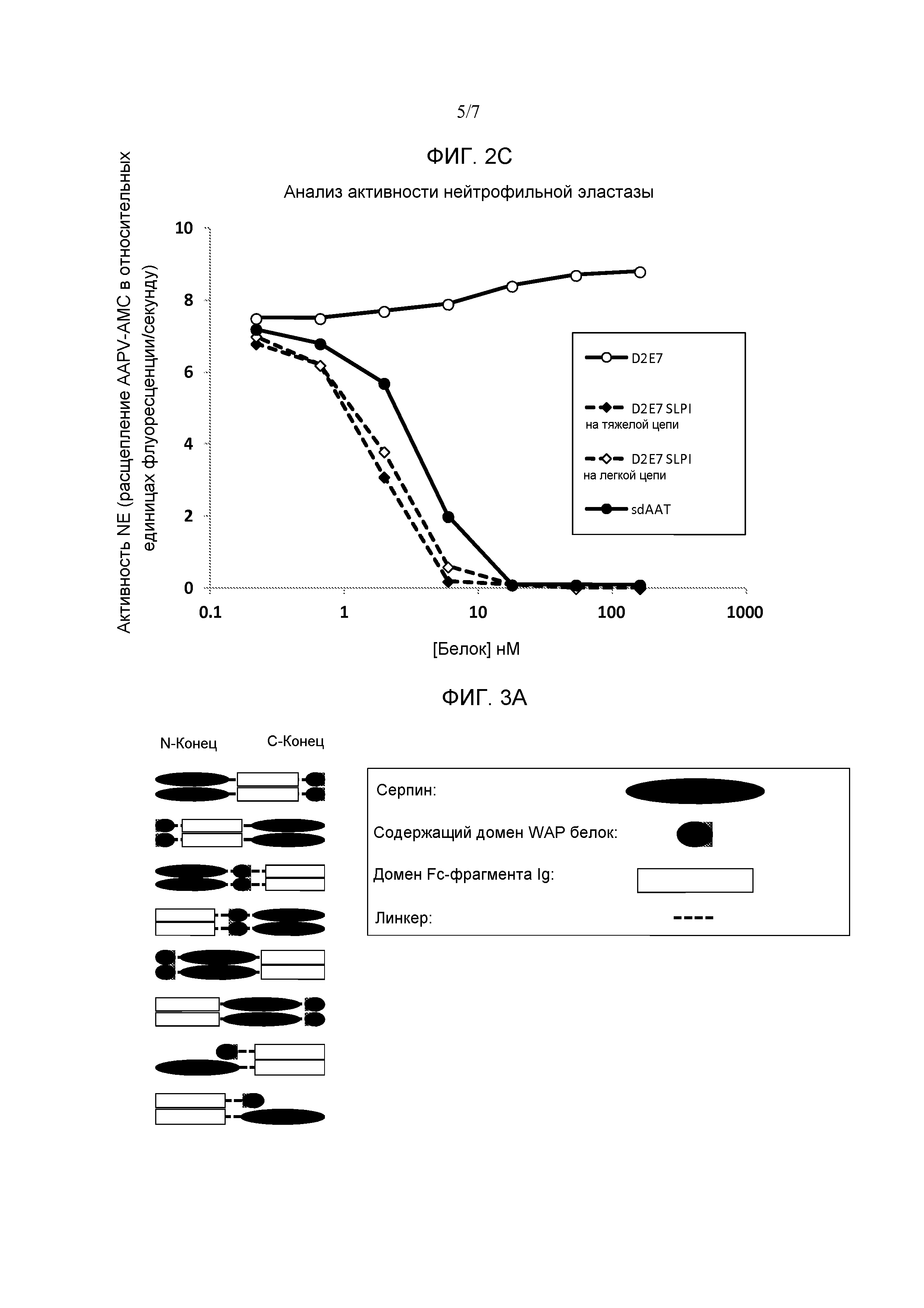
[0078] Фиг. 2A является схематическим представлением некоторых вариантов осуществления слитых белков по изобретению из содержащего домен WAP полипептида - нацеливающего на цитокин полипептида. Содержащий домен WAP полипептид может быть слит или с тяжелой цепью, или с легкой цепью антитела, или с обеими. Изображены также слитые белки из содержащего домен WAP полипептида - рецептора цитокина. Фиг. 2B является фотографией геля SDS-PAGE, показывающей антитело D2E7 (полоса 1), антитело D2E7 с SLPI, слитым с тяжелой цепью (полоса 2), и антитело D2E7 с SLPI, слитым с легкой цепью (полоса 3). Фиг. 2C представляет собой график, показывающий ингибирование активности эластазы нейтрофилов антителом D2E7, слитым с SLPI или на тяжелой цепи, или на легкой цепи. Показан сывороточный AAT и положительный контроль, тогда как одно антитело D2E7 показано в виде отрицательного контроля для ингибирования NE.
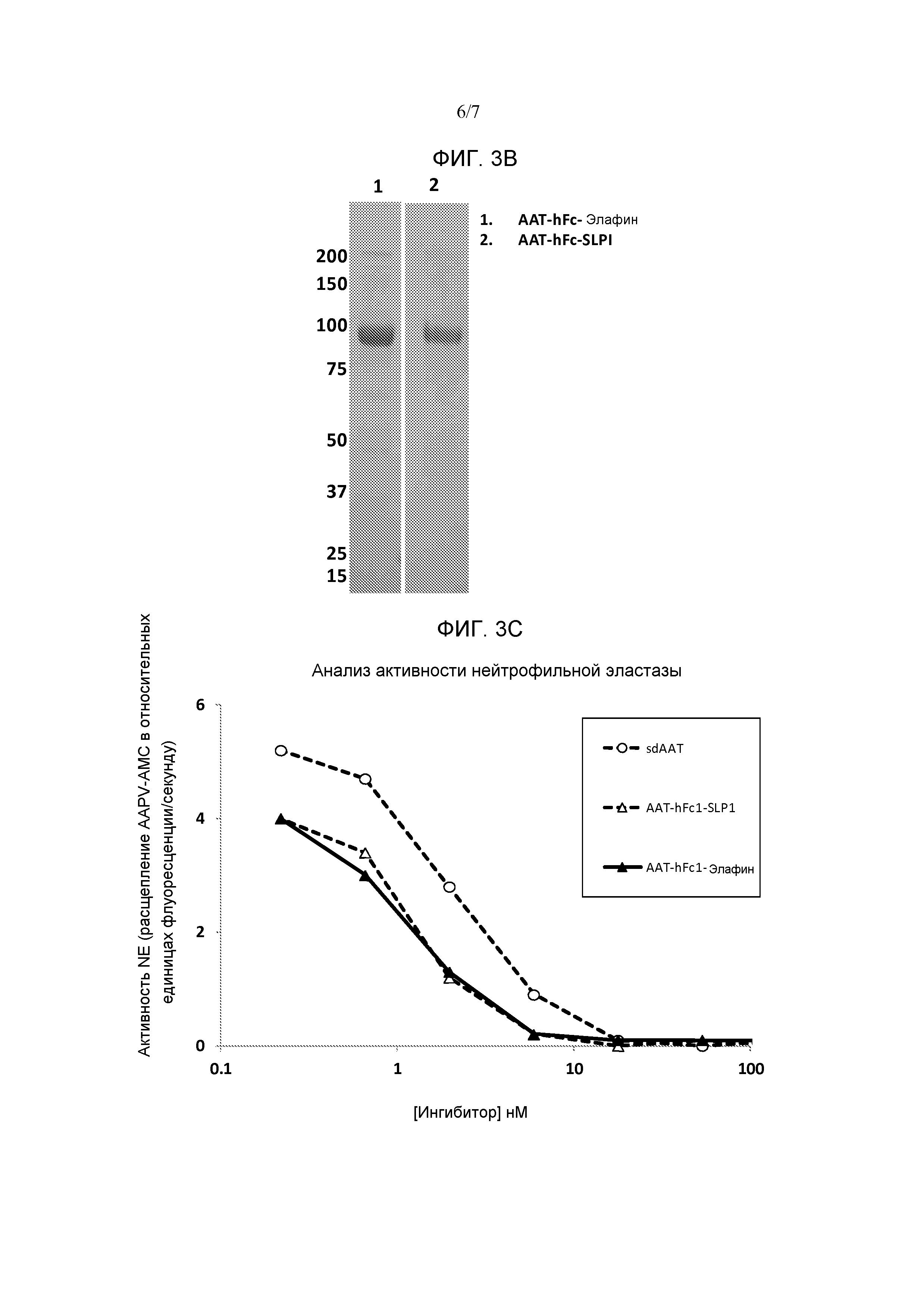
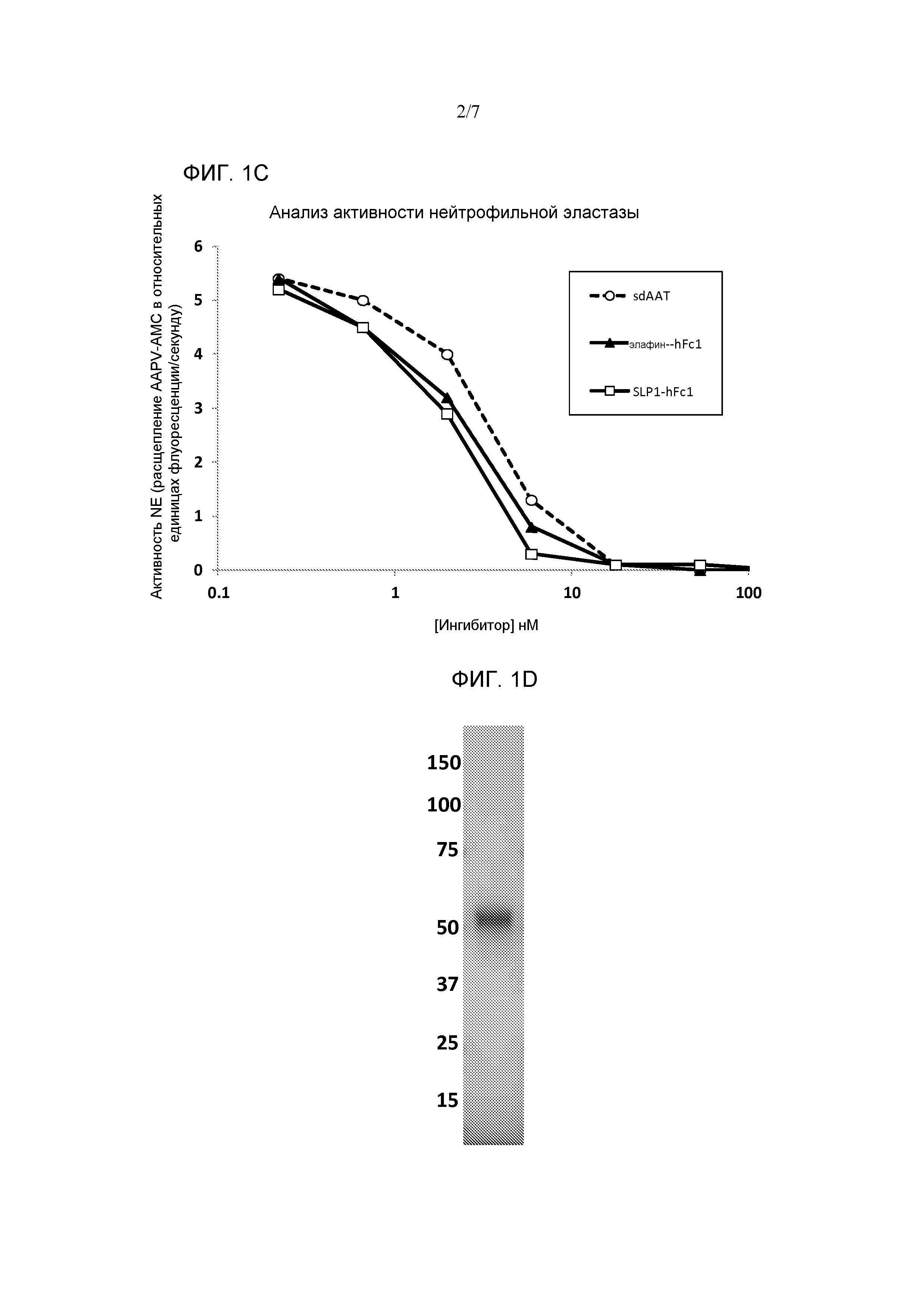
[0079] Фиг. 3A является схематическим представлением некоторых вариантов осуществления слитых белков из серпина-Fc-WAP. Фиг. 3B является фотографией геля SDS-PAGE, показывающей AAT-Fc-Элафин (полоса 1) и AAT-Fc-SLPI (полоса 2). Фиг. 3C представляет собой график, показывающий ингибирование активности эластазы нейтрофилов слитым белком AAT-Fc-Элафин и слитым белком AAT-Fc-SLPI. Слитый белок AAT-Fc и сывороточный AAT включены для сравнения.
[0080] Фиг. 4 является схематическим представлением некоторых вариантов осуществления слитых белков из содержащего домен WAP полипептида - HSA.
Подробное описание изобретения
[0081] Домен сывороточного кислотного белка (WAP) представляет собой мотив приблизительно из 50 аминокислот, характеризуемый восемью сохраненными цистеинами в определенных положениях, которые образуют четыре дисульфидных связей (Ranganathan et al., 1999 J. Mol. Graphics Modell. 17, 134-136). Лучше всего охарактеризованной функцией домена WAP является ингибирование серин-протеазы. Несколько содержащих домен WAP белков участвуют во врожденной иммунной защите множественных эпителиальных поверхностей (Abe et al., 1991 J. Clin. Invest. 87(6): 2207-15; Maruyama et al., 1994 J Clin Invest. 94(l):368-375; Si-Tahar et al., 2000 Gastroenterology 118(6): 1061-71; King et al., 2003 Reproductive Biology и Endocrinology 1: 116). Было показано, что некоторые из этих белков обладают антибактериальной активностью. Иллюстративными содержащими домен WAP белками являются секреторный лейкоцитарный ингибитор протеаз (SLPI), Элафин и Эппин.
[0082] Гены SLPI и Элафин являются членами семейства генов Trappin. Белки, кодируемые членами семейства генов Trappin, характеризуются N-концевым доменом субстрата трансглутаминазы и C-концевым доменом WAP (Schalkwijk et al., 1999 Biochem. J. 340:569-577). SLPI и Элафин являются ингибиторами нейтрофильных серин-протеаз и при этом имеют слабо дифференцированные протеазы-мишени. Хотя и SLPI, и Элафин являются сильнодействующими ингибиторами нейтрофильных протеаз, SLPI также ингибирует катепсин G, но не протеиназу-3, а Элафин ингибирует протеиназу-3, но не катепсин G (Eisenberg, et al.. 1990 J. Biol. Chem. 265, 7976-7981, Rao et al., 1993 Am. J. Respir. Cell Mol. Biol. 8, 612-616, Ying et al., 2001 Am. J. Respir. Cell Mol. Biol. 24, 83-89). Кроме того, Элафин ингибирует эндогенную сосудистую эластазу (EVE), серин-протеазу, продуцируемую пораженной сосудистой тканью (Rabinovitch, M. 1999 Am. J. Physiol. Lung Cell. Mol. Physiol. 277, L5-L12; Cowan, et al., 1996 J. Clin. Invest. 97,2452-2468).
[0083] Во время воспаления и травмы, протеазы, высвобождаемые из нейтрофилов, в целом служат для амплификации воспалительной реакции, посредством разрушения ECM (мультимерина эндотелиальных клеток), генерирования хемотаксических пептидов, активации MMP (матричной металлопротеиназы) и индукции протеолитических каскадов передачи сигналов и провоспалительных цитокинов. SLPI и Элафин представляют эндогенные регуляторы передачи сигналов воспалительной реакции, которые служат для предотвращения избыточного воспаления и защиты тканей от протеолитического разрушения в участках локального воспаления.
[0084] В многочисленных исследованиях in vitro и in vivo и SLPI, и Элафин продемонстрировали поддержание обширных противовоспалительных свойств (Doumas et al., 2005. Infect Immun 73, 1271-1274; Williams et al., 2006 Clin Sci (Lond) 110, 21-35, Scott et al., 2011 Biochem. Soc. Trans. 39(5) 1437-1440; Shaw and Wiedow, 2011 Biochem. Soc. Trans. 39, 1450-1454). Хотя многие из видов противовоспалительной активности этих белков связаны с ингибированием протеаз, и SLPI, и Элафин обладают противовоспалительными способностями, которые независимы от прямого ингибирования протеаз. Например, оба связывают бактериальные LPS (липополисахариды) и предотвращают их связывание с CD14 и передачу сигналов ниже по ходу транскрипции макрофагами (Ding et al., 1999 Infect. Immun. 67 4485-4489, McMichael et al., 2005 Am. J. Respir. Cell Mol. Biol. 32 443-452). Исследования с использованием человеческих моноцитов, подвергнутых воздействию LPS, показали, что SLPI ингибировал Toll-подобные рецепторы и активацию NF-KB (ядерного фактора каппа B) и последующую передачу сигналов, вызывающую продукцию IL-8 (интерлейкина-8) и TNFα (фактора некроза опухолей альфа) в моноцитах, подвергнутых воздействию LPS (Lentsch et al., 1999 Am. J. Pathol. 154, 239-247; Taggart et al., 2005 J. Exp. Med. 202, 1659-1668). Мыши с дефицитом SLPI значительно больше восприимчивы у вызванному LPS эндотоксиновому шоку и имели более высокие показатели смертности (Nakamura et al., 2003 J. Exp. Med. 197, 669-674). Аналогичным образом, у мышей со сверхэкспрессией Элафин проявилась сниженная продукция провоспалительных цитокинов, включая TNFα, MIP-2 (воспалительный белок макрофагов-2) и MCP-1 (моноцитарный хемотаксический белок-1), по сравнению с мышами дикого типа, после провокационной пробы с LPS (Sallenave et al., 2003 Infect. Immun. 71, 3766-3774).
[0085] В дополнение к своим антипротеазным и противовоспалительным видам активности, SLPI и Элафин обладают противоинфекционными функциями против широкого класса патогенов, включая вирусы, бактерии и грибы. И SLPI, и Элафин продемонстрировали антибактериальную активность против грамположительных и грамотрицательных видов. Было обнаружено, что SLPI эффективен против патогенных видов, обычно встречающихся в верхних дыхательных путях, таких как Pseudomonas aeruginosa и Staphylococcus aureus, в дополнение к Staphylococcus epidermidis и Escherichia coli. Хотя Элафин также проявляет бактерицидную активность против Ps. aeruginosa и S. Aureus (Hiemstra, et al., 1996 Infect. Immun. 64, 4520-4524; Wiedow et al., 1998 Biochem. Biophys. Res. Commun. 248, 904-909; Simpson et al., 2001 Hum. Gene Ther. 12, 1395-1406; Meyer-Hoffert et al., 2003 Exp. Dermatol. 12, 418-425; Simpson et al., 1999 FEBS Lett. 452, 309-313). Было продемонстрировано, что SLPI обладает фунгицидной активностью против патогенных грибов Aspergillus fumigatus и Candida albicans (Tomee et al., 1997 J. Infect. Dis. 176:740-747; Chattopadhyay et al., 2004 Infect. Immun. 72: 1956-1963). Было также показано, что SLPI обладает активностью против ВИЧ (McNeely et al., 1995 J. Clin. Investig. 96:456-464; McNeely et al., 1997 Blood 90: 1141-1149; Hocini et al., 2002 Clin. Diagn. Lab. Immunol. 7:515-518; Pillay et al., 2001 J. Infect. Dis. 183:653-656).
[0086] На основании опубликованных результатов исследований, предполагалось, что рекомбинантный человеческий SLPI может быть полезен при лечении аллергической астмы, эмфиземы, муковисцедоза, недостаточности AAT, COPD, ARDS (респираторного дистресс синдрома взрослых), артрита, бактериальных, грибковых и вирусных инфекций, травм спинного мозга, заживлении ран и ишемии/реперфузионного повреждения после трансплантации сердца (Lucey, E.C., Stone, P.J., Ciccolella, D.E., Breuer, R., Christensen, T.G., Thompson, R.C., и Snider, G.L. (1990). Recombinant human secretory leukocyte-protease inhibitor: in vitro properties, and amelioration of human neutrophil elastase-induced emphysema and secretory cell metaplasia in hamster. J Lab Clin Med 115, 224-232; Stolk, J., Rudolphus, A., and Kramps, J.A. (1991). Lipopolysaccharide-induced alveolar wall destruction in hamster is inhibited by intratracheal treatment with r-secretory leukocyte protease inhibitor. Ann N Y Acad Sci 624, 350-352; Stromatt, S.C. (1993). Secretory leukocyte protease inhibitor in cystic fibrosis. Agents Actions Suppl 42, 103-110; Watterberg, K.L., Carmichael, D.F., Gerdes, J.S., Werner, S., Backstrom, C, and Murphy, S. (1994). Secretory leukocyte protease inhibitor and lung inflammation in developing bronchopulmonary dysplasia. J Pediatr 125, 264-269; McNeely, T.B., Dealy, M., Dripps, D.J., Orenstein, J.M., Eisenberg, S.P., and Wahl, S.M. (1995). Secretory leukocyte protease inhibitor: human saliva protein exhibiting anti-human immunodeficiency virus 1 activity in vitro. J Clin Invest 96, 456-464; Fath, M.A., Wu, X., Hileman, R.E., Linhardt, R.J., Kashem, M.A., Nelson, R.M., Wright, CD., and Abraham, W.M. (1998). Interaction of secretory leukocyte protease inhibitor with heparin inhibits proteases involved in asthma. J Biol Chem 273, 13563-13569; Jin, F., Nathan, C.F., Radzioch, D., and Ding, A. (1998). Lipopolysaccharide-related stimuli induce expression of secretory leukocyte protease inhibitor, a macrophage-derived lipopolysaccharide inhibitor. Infect Immun 66, 2447-2452; Song, X., Zeng, L., Jin, W., Thompson, J., Mizel, D.E., Lei, K., Billinghurst, R.C., Poole, A.R., and Wahl, S.M. (1999). Secretory leukocyte protease inhibitor suppresses the inflammation and joint damage of bacterial cell wall-induced arthritis. J Exp Med 190, 535-542; Wright, CD., Havill, A.M., Middleton, S.C., Kashem, M.A., Lee, P.A., Dripps, D.J., O'Pviordan, T.G., Bevilacqua, M.P., and Abraham, W.M. (1999). Secretory leukocyte protease inhibitor prevents allergen-induced pulmonary responses in animal models of asthma. J Pharmacol Exp Ther 289, 1007-1014; Ashcroft, G.S., Lei, K., Jin, W., Longenecker, G., Kulkarni, A.B., Greenwell-Wild, T., Hale-Donze, H., McGrady, G., Song, X.Y., and Wahl, S.M. (2000). Secretory leukocyte protease inhibitor mediates non-redundant functions necessary for normal wound healing. Nat Med 6, 1147-1153; Mulligan, M.S., Lentsch, A.B., Huber-Lang, M., Guo, R.F., Sarma, V., Wright, CD., Ulich, T.R., and Ward, P.A. (2000). Anti-inflammatory effects of mutant forms of secretory leukocyte protease inhibitor. Am J Pathol 156, 1033-1039; Forteza, R.M., Ahmed, A., Lee, T., and Abraham, W.M. (2001). Secretory leukocyte protease inhibitor, but not alpha-1 protease inhibitor, blocks tryptase-induced bronchoconstriction. Pulm Pharmacol Ther 14, 107-110; Pillay, K., Coutsoudis, A., Agadzi-Naqvi, A.K., Kuhn, L., Coovadia, H.M., and Janoff, E.N. (2001). Secretory leukocyte protease inhibitor in vaginal fluids and perinatal human immunodeficiency virus type 1 transmission. J Infect Dis 183, 653-656; Feuerstein, G. (2006). Inflammation and stroke: therapeutic effects of adenoviral expression of secretory Leukocyte Protease inhibitor. Front Biosci 11, 1750-1757; Weldon, S., McGarry, N., Taggart, C.C, and McElvaney, N.G. (2007). The role of secretory leucoprotease inhibitor in the resolution of inflammatory responses. Biochem Soc Trans 35, 273-276; Nishimura, J., Saiga, H., Sato, S., Okuyama, M., Kayama, FL, Kuwata, H, Matsumoto, S., Nishida, T., Sawa, Y., Akira, S., Yoshikai, Y., Yamamoto, M., and Takeda, K. (2008). Potent antimycobacterial activity of mouse secretory leukocyte protease inhibitor. J Immunol 180, 4032-4039; Schneeberger, S., Hautz, T., Wahl, S.M., Brandacher, G., Sucher, R., Steinmassl, O., Steinmassl, P., Wright, CD., Obrist, P., Werner, E.R., Mark, W., Troppmair, J., Margreiter, R., and Amberger, A. (2008). The effect of secretory leukocyte protease inhibitor (SLPI) on ischemia/reperfusion injury in cardiac transplantation. Am J Transplant 8, 773-782; Ghasemlou, N., Bouhy, D., Yang, J., Lopez-Vales, R., Haber, M., Thuraisingam, T., He, G., Radzioch, D., Ding, A., and David, S. (2010). Beneficial effects of secretory leukocyte protease inhibitor after spinal cord injury. Brain 133, 126-138; Marino, R., Thuraisingam, T., Camateros, P., Kanagaratham, C, Xu, Y.Z., Henri, J., Yang, J., He, G., Ding, A., and Radzioch, D. (2011). Secretory leukocyte protease inhibitor plays an important role in the regulation of allergic asthma in mice. J Immunol 186, 4433-4442).
[0087] Были генерированы и вводились человеку рекомбинантные варианты SLPI и Элафин. В действительности, в настоящее время проводится оценка рекомимфбинантного Элафина в клиническом испытании у людей для лечения воспалительного компонента различных типов сосудистых повреждений (ссылка). Рекомбинантные варианты и SLPI, и Элафина проявляют очень короткие периоды полувыведения из сыворотки (<3 часов, Bergenfeldt et al., 1990 Scand J Clin Lab Invest. 50(7):729-37, заявка на Международный патент WO/2011/107505). Короткий период полувыведения представляет основное ограничение терапевтическому применению этих белков. Таким образом, эффективное лечение этими вариантами белков потребовало бы частого введения (множество доз в день).
[0088] Слитые белки по настоящему изобретению были генерированы для повышения терапевтического потенциала SLPI и Элафин. Для удлинения периода полувыведения рекомбинантных SLPI и Элафин, были созданы слитые белки из Fc и альбумина. Хотя было известно, что слияние доменов Fc или альбумина с некоторыми белками, белковыми доменами или пептидами может удлинить периоды их полувыведения (см., например, Jazayeri, J. A., and Carroll, G.J. (2008). Fc-based cytokines: prospects for engineering superior therapeutics. BioDrugs 22, 11-26; Huang, C. (2009). Receptor-Fc fusion therapeutics, traps, and MIMETIBODY technology. Curr Opin Biotechnol 20, 692-699; Kontermann, R.E. (2009). Strategies to extend plasma half-lives of recombinant antibodies. BioDrugs 23, 93-109; Schmidt, S.R. (2009). Fusion-proteins as biopharmaceuticals-applications и challenges. Curr Opin Drug Discov Devel 12, 284-295), до описанных здесь исследований было неизвестно, смогут ли домен Fc или альбумин, слитые с SLPI или Элафин, устранить их способность ингибировать эластазу нейтрофилов или оказывать желательный эффект увеличения периода полувыведения из сыворотки. Описанные здесь исследования демонстрируют, что слитые белки по настоящему изобретению способны активно ингибировать NE и проявляют увеличенные периоды полувыведения из сыворотки. Эти слитые белки по настоящему изобретению обеспечивают более эффективные терапевтические средства относительно предыдущих не модифицированных вариантов SLPI или Элафин.
[0089] В некоторых вариантах осуществления, слитые белки с доменом WAP включают полипептидные последовательности SLPI или Элафин, слитые с нацеливающим на цитокин белком.
[0090] В некоторых вариантах осуществления, слитые белки, описанные здесь, включают по меньшей мере содержащий домен WAP полипептид или аминокислотную последовательность, которая происходит из содержащего домен WAP полипептида, и нацеливающий на цитокин полипептид или аминокислотную последовательность, которая происходит из нацеливающего на цитокин полипептида. Например, изобретение относится к содержащему домен WAP полипептиду или последовательности, происходящей из содержащего домен WAP полипептида, слитым с человеческим цитокиновым рецептором или его производным. Другой вариант осуществления изобретения относится к содержащему домен WAP полипептиду или к последовательности, происходящей из содержащего домен WAP полипептида, слитым с нацеливающим на цитокин антителом, например, анти-цитокиновым антителом, или с последовательностью, происходящей из нацеливающего на цитокин антитела, например, анти-цитокинового антитела, или последовательностью, происходящей из фрагмента нацеливающего на цитокин антитела, например, фрагмента анти-цитокинового антитела. Например, изобретение относится к содержащему домен WAP полипептиду или к последовательности, происходящей из содержащего домен WAP полипептида, слитым с нацеливающим на цитокин полипептидом, в котором нацеливающий на цитокин полипептид связывает любой из следующих человеческих цитокинов: TNFα, IgE, IL-12, IL-23, IL-6, IL-1α, IL-1β, IL-17, IL-13, субъединицы p40 IL-12 и IL-23, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32.
[0091] Например, в некоторых вариантах осуществления, нацеливающий на цитокин полипептид нацелен на TNFα и включает любой из следующих нацеливающих на TNFα полипептидов или последовательностей, происходящих из следующих нацеливающих на TNFα полипептидов: Remicade®, Humira®, Simponi®, Cimiza® или Enbrel®.
[0092] Например, в некоторых вариантах осуществления, нацеливающий на цитокин полипептид нацелен на IgE и включает любой из следующих нацеливающих на IgE полипептидов или последовательностей, происходящих из следующих нацеливающих на IgE полипептидов: Xolair® или FcsRI.
[0093] Например, в некоторых вариантах осуществления, нацеливающий на цитокин полипептид нацелен на субъединицу p40, разделяемую IL-12 и IL-23, и включает полипептид Stelara® или последовательности, происходящие из полипептида Stelara®.
[0094] Например, Stelara®, нацеливающий на цитокин полипептид нацелен на IL-13 и включает полипептид CDP7766 или последовательности, происходящие из полипептида CDP7766.
[0095] Изобретение относится к содержащему домен WAP полипептиду или к последовательности, происходящей из содержащего домен WAP полипептида, слитой с нацеливающим на цитокин полипептидом, причем нацеливающий на цитокин полипептид связывается с любым из следующих человеческих цитокиновых рецепторов TNFα, IgE, IL-12, IL-23, IL-6, IL-1α, IL-1β, IL-17, IL-13, субъединицы p40 IL-12 и IL-23, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32, посредством этого предотвращая связывание между рецептором и цитокином.
[0096] В некоторых вариантах осуществления, описанные здесь слитые белки включают по меньшей мере полипептид SLPI или аминокислотную последовательность, которая происходит из SLPI, и нацеливающий на цитокин полипептид или аминокислотную последовательность, которая происходит из нацеливающего на цитокин полипептида. Например, изобретение относится к SLPI, слитому с нацеливающим на цитокин полипептидом, причем нацеливающий на цитокин полипептид связывается с любым из следующих человеческий цитокинов: TNFα, IgE, IL-6, IL-1α, IL-1β, IL-12, IL-17, IL-13, IL-23, субъединицы p40 IL-12 и IL-23, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32.
[0097] В некоторых вариантах осуществления, описанные здесь слитые белки включают по меньшей мере полипептид Элафина или аминокислотную последовательность, которая происходит из Элафина, и нацеливающий на цитокин полипептид или аминокислотную последовательность, которая происходит из нацеливающего на цитокин полипептида. Например, изобретение относится к Элафину, слитому с нацеливающим на цитокин полипептидом, в котором нацеливающий на цитокин полипептид связывает любой из следующих человеческих цитокинов: TNFα, IgE, IL-6, IL-1α, IL-1β, IL-12, IL-17, IL-13, IL-23, субъединицы p40 IL-12 и IL-23, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32.
[0098] В некоторых вариантах осуществления нацеливающий на цитокин полипептид связывается с цитокиновым рецептором и предотвращает связывание между рецептором и цитокином. Например, настоящее изобретение включает серпин, слитый с антителом, нацеленным на цитокиновый рецептор. Например, изобретение относится к SLPI, слитому с нацеливающим на цитокин полипептидом, где нацеливающий на цитокин полипептид связывается с рецептором любого из следующих человеческих цитокинов: TNFα, IgE, IL-6, IL-1α, IL-1β, IL-12, IL-17, IL-13, IL-23, субъединицы p40 IL-12 и IL-23, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32. Например, изобретение относится к Элафину, слитому с нацеливающим на цитокин полипептидом, где нацеливающий на цитокин полипептид связывается с рецептором любого из следующих человеческих цитокинов: TNFα, IgE, IL-6, IL-1α, IL-1β, IL-12, IL-17, IL-13, IL-23, субъединицы p40 IL-12 и IL-23, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32.
[0099] Например, в некоторых вариантах осуществления, нацеливающий на цитокин полипептид нацелен на рецептор IL-6 и включает полипептид Actemra® или последовательности, происходящие из полипептида Actemra®. Например, нацеливающий на цитокин полипептид Actemra® нацелен на рецептор IL-6 и включает полипептид тоцилизумаб или последовательности, происходящие из полипептида тоцилизумаб.
[00100] Нацеливание на воспалительные цитокины и иммуностимулирующие агенты белковыми терапевтическими средствами продемонстрировали клинический успех при многочисленных воспалительных состояниях. Большинство обычных белков, используемых в качестве нацеленных на цитокины средств, представляют собой растворимые цитокиновые рецепторы и моноклональные антитела и их фрагменты. Существенным недостатком нацеливания на цитокины является повышенный риск инфекции у этих пациентов, о чем свидетельствуют нацеленные на TNFα биологические средства Remicade®, Humira®, Simponi®, Cimiza® и Enbrel®, и антитело, нацеленное на p40 IL-12/23, Stelara®. Это, вероятно, общая проблема терапии, нацеленной на воспалительные цитокины, которая приводит к подавлению иммунитета у пациентов. Как указано выше, SLPI и Элафин демонстрируют и противоинфекционную, и противовоспалительную активность. Так, слитые белки из содержащего домен WAP полипептида - нацеленного на цитокины полипептида по настоящему изобретению могут ослаблять аберрантную активность цитокинов, в то же время снижая риск инфекций.
[00101] В некоторых вариантах осуществления, описанные здесь слитые белки включают по меньшей мере следующие компоненты: содержащий домен WAP полипептид или аминокислотная последовательность, которая происходит из содержащего домен WAP полипептида, серпиновый полипептид или аминокислотная последовательность, которая происходит из серпина, и полипептид Fc или аминокислотная последовательность, которая происходит из полипептида Fc. Например, изобретение относится к содержащему домен WAP полипептиду, серпиновому полипептиду и производным человеческих IgG1-Fc, IgG2-Fc, IgG3-Fc, IgG4-Fc или IgM-Fc, функциональной связанных вместе в любой функциональной комбинации. В некоторых вариантах осуществления, серпиновый полипептид представляет собой человеческий AAT или происходит из AAT. Ожидается, что слитые белки из WAP-Fc-серпина по изобретению обладают усиленными анти-протеазными, противоинфекционными и противовоспалительных свойств относительно слитых белков, составленных только из содержащего домен WAP полипептида или серпинового полипептида.
[00102] В некоторых вариантах осуществления, описанные здесь слитые белки включают по меньшей мере содержащий домен WAP полипептид или аминокислотную последовательность, которая происходит из содержащего домен WAP полипептида, и полипептид человеческого сывороточного альбумина (HSA) или аминокислотную последовательность, которая происходит из полипептида HSA. Дополнительные варианты осуществления изобретения включают слитые белки, состоящие из содержащего домен WAP полипептида - связывающего альбумин полипептида, где связывающий альбумин полипептид ответствен за ассоциацию содержащего домен WAP полипептида и HSA. Таким образом, изобретение включает и ковалентные, и не ковалентные связи серпинового полипептида и полипептида HSA или последовательностей, происходящих из содержащего домен WAP полипептида или полипептида HSA. Например, изобретение относится к содержащему домен WAP полипептиду, слитому с человеческим HSA или производными HSA, или к связывающему HSA пептиду или полипептидам.
[00103] В некоторых вариантах осуществления, описанные здесь слитые белки включают по меньшей мере полипептид SLPI или аминокислотную последовательность, которая происходит из SLPI, и полипептид HSA или аминокислотную последовательность, которая происходит из полипептида HSA. Например, изобретение относится к SLPI, слитому с HSA или фрагментом, происходящим из HSA, или связывающим альбумин полипептидом. В некоторых вариантах осуществления, описанные здесь слитые белки включают по меньшей мере полипептид Элафина или аминокислотную последовательность, которая происходит из Элафина, и полипептид HSA или аминокислотную последовательность, которая происходит из полипептида HSA. Например, изобретение относится к Элафину, слитому с HSA, или фрагментом, происходящим из HSA, или связывающим альбумин полипептидом.
[00104] Ожидается, что описанные здесь слитые белки и производные слитых белков будут полезны при лечении разнообразных показаний, включая, в качестве не ограничивающего примера, недостаточность альфа-1-антитрипсина (AAT), эмфизему, хроническое обструктивное легочное заболевание (COPD), повреждение, вызванное ишемией-реперфузией, включая, например, вызванное ишемией-реперфузией повреждение после трансплантации сердца, артрит, аллергическую астму, острый респираторный дистресс синдром (ARDS), муковисцедоз, сахарный диабет I типа и/или II типа, недостаточность, бактериальные, грибковые и вирусные инфекции, травму спинного мозга, заживление ран, отторжение трансплантата, болезнь трансплантат против хозяина (GVHD), легочную артериальную гипертензию (PAH), хроническую тромбоэмболическую легочную гипертензию и вызванное ишемией-реперфузией повреждение после трансплантации сердца.
[00105] Пока нет иных определений, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые общепонятны средним специалистам в данной области. Кроме того, пока контекст не требует иного, термины в единственном числе должны включать множественные числа, и термины во множественном числе должны включать термины в единственном числе. В целом, номенклатуры, используемые в связи с описанными здесь клеточными и тканевыми культурами и их технологиями, молекулярной биологией и химией и гибридизацией белков и олиго- или полинуклеотидов, представляют собой те, которые хорошо известны и обычно используются в данной области. Стандартные методики используются для рекомбинантной ДНК, синтеза олигонуклеотидов и культуры и трансформации тканей {например, эдектропорации, липофекции). Методики ферментативных реакций и очистки выполняются в соответствии со спецификациями производителей или как обычно осуществляется в данной области или описано здесь. Указанные выше методики и процедуры в целом выполняются в соответствии с обычными способами, хорошо известными в данной области, и как описано в различных общих и более конкретных ссылках, которые приведены и обсуждаются по всему настоящему описанию. См., например, руководство Sambrook et al., Molecular Cloning: Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)). Номенклатуры, используемые в настоящем описании в связи с аналитической химией, синтетической органической химией и медицинской и фармацевтической химией и лабораторными процедурами и методиками, представляют собой хорошо известные и обычно используемые в данной области. Стандартные методики используются для химического синтеза, химических анализов, получения фармацевтических препаратов, их составления и доставки для лечения пациентов. Термин пациент включает человеческих и ветеринарных субъектов.
[00106] Следует понимать, что введение терапевтических средств в соответствии с изобретением должно проводиться с подходящими носителями, буферами, эксципиентами и другими агентами, которые включаются в препаративные формы для обеспечения улучшенного переноса, доставки, переносимости и тому подобного. Множество соответствующих препаративных форм можно найти в фармакологическом справочнике, известном всем провизорам: Remington's Pharmaceutical Sciences (15th ed, Mack Publishing Company, Easton, PA (1975)), в частности, в его главе 87, написанной Blaug, Seymour. Эти препаративные формы включают, например, порошки, пасты, мази, желе, воски, масла, липиды, содержащие липиды пузырьки (катионные или анионные) (такие как Lipofectin™), конъюгаты ДНК, безводные абсорбционные пасты, эмульсии масла в воде и воды в масле, эмульсии карбовакс (полиэтиленгликоли с различной молекулярной массой), полутвердые гели и полутвердые смеси, содержащие карбовакс. Любые из указанных выше смесей могут быть целесообразны при лечении и в лечебных средствах в соответствии с настоящим изобретением, при условии, что активный ингредиент в препаративной форме не инактивируется препаративной формой, и препаративная форма физиологически совместима и переносима при пути введения. См. также документы Baldrick P. ʺPharmaceutical excipient development: the need for preclinical guidance.ʺ Regul. Toxicol Pharmacol. 32(2):210-8 (2000), Wang W. ʺLyophilization and development of solid protein pharmaceuticals.ʺ Int. J. Pharm. 203(1-2): 1-60 (2000), Charman WN ʺLipids, lipophilic drugs, and oral drug delivery - some emerging concepts.ʺ J Pharm Sci. 89(8):967-78 (2000), Powell et al. ʺCompendium of excipients for parenteral formulationsʺ PDA J Pharm Sci Technol. 52:238-311 (1998) и ссылки в них для дополнительной информации, относящейся к препаративным формам, эксципиентам и носителям, хорошо известным провизорам.
[00107] Терапевтические препаративные формы по изобретению, которые включают слитый белок по изобретению, используются для лечения или облегчения симптомов, вызванных заболеванием или расстройством, связанных с аберрантной активностью сериновой протеазы у субъекта. Настоящее изобретение также относится к способам лечения или облегчения симптома, вызванного с заболеванием или расстройством, связанным с аберрантной активностью серин-протеазы у субъекта. Схема лечения осуществляется идентификацией субъекта, например, пациента, страдающего (или имеющего риск развития) заболевания или расстройства, связанного с аберрантной активностью серин-протеазы, с использованием стандартных способов, включая любые из разнообразных клинических и/или лабораторных процедур. Термин пациент включает человеческих и ветеринарных субъектов. Термин субъект включает людей и других животных.
[00108] Эффективность лечения определяется в связи с любым известным способом диагностики или лечения конкретного заболевания или расстройства, связанного с аберрантной активностью сериновой протеазы. Облегчение одного или нескольких симптомов заболевания или расстройства, связанного с аберрантной активностью сериновой протеазы, указывает на то, что слитый белок обеспечивает клинический эффект.
[00109] Способы скрининга слитых белков, которые обладают желательной специфичностью, включают без ограничения ферментный иммуносорбентный анализ (ELISA), ферментативные анализы, проточную цитометрию и другие иммунологически опосредованные методики, известные в данной области.
[00110] Слитые белки, описанные в настоящем документе, могут использоваться в способах, известных в данной области, относящихся к определению локализации и/или количественному анализу мишени, такой как сериновая протеаза, например, для использования при измерении уровней этих мишеней внутри соответствующих физиологических образцов, для использования в диагностических способах, для использования при визуализации белка и тому подобных). Термины «физиологический образец» и «биологический образец», используемые взаимозаменяемо в настоящем описании, включают ткани, клетки и биологические жидкости, выделенные у субъекта, а также ткани, клетки и жидкости, присутствующие внутри организма субъекта. Поэтому в пределы использования терминов «физиологический образец» и «биологический образец» включаются кровь и фракция или компонент крови, включая сыворотку крови, плазму крови или лимфу.
[00111] В данном варианте осуществления, слитые белки, специфичные для данной мишени, или его производного, фрагмента, аналога или гомолога, которые содержат связывающий мишень фрагмент, используются в качестве фармакологически активных соединений (далее именуемых здесь «терапевтическими средствами»).
[00112] Слитый белок по изобретению может использоваться для выделения конкретной мишени с использованием стандартных методик, таких как иммуноаффинитет, хроматография или иммунопреципитация. Выявление может содействовать соединению (т.е., физическому соединению) слитого белка с выявляемым веществом. Примеры выявляемых веществ включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы, биолюминесцентные материалы и радиоактивные материалы. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают умбеллиферон, флуоресцеин, флуоресцеин изотиоцианат, родамин, дихлортриазиниламинфлуоресцеин, дихлортриазиниламинфлуоресцеин, дансилхлорид или фикоэритрин; пример люминесцентного материала включает луминол; примеры биолюминесцентных материалов включают люциферазу, люциферин и экворин, и примеры подходящего радиоактивного материала включают 125I, 131I, 35S или 3H.
[00113] Терапевтически эффективное количество слитого белка по изобретению относится в целом к количеству, необходимому для достижения терапевтической цели. Как отмечено выше, это может быть взаимодействие связывания между слитым белком и его мишенью, которое в определенных случаях препятствует функционированию мишени. Количество, требуемое для введения, будет, кроме того, зависеть от аффинитета связывания слитого белка с его специфической мишенью, и будет также зависеть от скорости, с которой введенный слитый белок выведется из свободного объема жидкости субъекта, которому он введен. Обычные диапазоны для терапевтически эффективного количества вводимого слитого белка по изобретению или его фрагмента могут составлять, в качестве не ограничивающего примера, от примерно 0,1 мг/кг массы тела до примерно 250 мг/кг массы тела. Обычные частоты введения могут находиться в диапазоне, например, от двух раз в день до одного раза в месяц.
[00114] Когда используются фрагменты слитого белка, то предпочтителен самый маленький ингибиторный фрагмент, который, в частности, связывается с мишенью. Например, могут быть сконструированы пептидные молекулы, которые сохраняют способность связывать мишень. Такие пептиды могут быть синтезированы химически и/или получены технологией рекомбинантной ДНК (см., например, документ Marasco et al., Proc. Natl. Acad. Sci. USA, 90: 7889-7893 (1993)). Препаративная форма может также содержать несколько активных соединений, в соответствии с необходимостью для лечения по поводу конкретного показания, предпочтительно, соединений с комплементарными видами активности, которые не оказывают неблагоприятного воздействия друг на друга. Альтернативно, или дополнительно, композиция может содержать средство, которое усиливает ее функцию, такое как, например, цитотоксическое средство, цитокин, химиотерапевтическое средство, подавляющее рост средство, противовоспалительное средство или антиинфекционное средство. Такие молекулы могут подходящим образом присутствовать в комбинации в количествах, которые эффективны для предполагаемых назначений.
[00115] Активные ингредиенты могут быть также заключены в микрокапсулы, полученные, например, технологиями коацервации или межповерхностной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы, соответственно, в коллоидных системах доставки лекарственных средств (например, липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях.
[00116] Препаративные формы, подлежащие применению для введения in vivo, должны быть стерильными. Это легко осуществляется фильтрацией через стерильные фильтрационные мембраны.
[00117] Могут быть получены препараты пролонгированного высвобождения. Подходящие примеры препаратов длительного высвобождения включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие слитый белок, причем матрицы представлены в форме профилированных изделий, например, пленок или микрокапсул. Примеры матриц пролонгированного высвобождения включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, не разлагаемые сополимеры этилена-винилацетата, разлагаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, составленные из сополимера молочной кислоты-гликолевой кислоты и лейпролида ацетата), и поли-D-(-)-3-гидроксимасляная кислота. Хотя полимеры, такие как этилен-винилацетат и молочная кислота-гликолевая кислота обеспечивают возможность высвобождения молекул в течение более чем 100 дней, определенные гидрогели высвобождают белки в течение более коротких периодов времени.
Фармацевтические композиции
[00118] Слитые белки по изобретению (также именуемые в настоящем описании «активными соединениями») и его производные, фрагменты, аналоги и гомологи могут быть включены в фармацевтические композиции, подходящие для введения. Такие композиции обычно содержат слитый белок и фармацевтически приемлемый носитель. Используемый в настоящем описании термин «фармацевтически приемлемый носитель» предназначен для включения любых и всех растворителей, дисперсионных сред, покрытий, антибактериальных и противогрибковых средств, изотонических и задерживающих абсорбцию агентов и тому подобных, совместимых с фармацевтическим введением. Подходящие носители описаны в самом последнем издании документ Remington's Pharmaceutical Sciences, стандартном справочнике в данной области, который включен в настоящее описание путем ссылки. Предпочтительные примеры таких носителей или разбавителей включают без ограничения воду, солевой раствор, растворы Рингера, раствор декстрозы и 5% человеческий сывороточный альбумин.
Могут также использоваться липосомы и не водные основы, такие как фиксированные масла. Использование таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области. За исключением случаев, когда любые обычные среды или агент несовместимы с активным соединением, предусматривается их использование в композициях. Дополнительные активные соединения могут быть также включены в композиции.
[00119] Фармацевтическая композиция по изобретению составляется для совместимости с предполагаемым путем ее введения. Примеры путей введения включают парентеральное, например, внутривенное, интрадермальное, подкожное, пероральное (например, ингаляционное), трансдермальное (т.е., топическое), трансмукозальное и ректальное введение. Растворы или суспензии, используемые для парентерального, интрадермального или подкожного применения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, солевой раствор, фиксированные масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисуфльфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (EDTA); буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. pH может регулироваться кислотами или основаниями, такими как хлористоводородная кислота или гидроксид натрия. Парентеральный препарат может быть заключен в ампулы, одноразовые шприцы или многодозовые флаконы, исполненные из стекла или пластика.
[00120] Фармацевтические композиции, подходящие для инъекционного применения, включают стерильные водные растворы (при растворимости в воде) или дисперсии и стерильные порошки для получения стерильных инъецируемых растворов или дисперсий непосредственно перед введением. Для внутривенного введения, подходящие носители включают физиологический солевой раствор, бактериостатическую воду, кремофор ELTM (BASF, Parsippany, N.J.) или забуференный фосфатом солевой раствор (PBS). Во всех случаях, композиции должны быть стерильными и должны быть текучими в такой степени, чтобы обеспечивалась возможность легкого введения через шприц. Композиция должна быть устойчивой в условиях получения и хранения и должна быть защищена против загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобные) и их подходящие смеси. Должная текучесть может поддерживаться, например, использованием покрытия, такого как лецитин, поддержанием требуемого размера частиц в случае дисперсии и использованием поверхностно-активных веществ. Предотвращение действия микроорганизмов может быть достигнуто различными антибактериальными и противогрибковыми средствами, например, парабенами, хлорбутанолом, фенолом, аскорбиновой кислотой, тимеросалом и тому подобными. Во многих случаях, будет предпочтительным включение изотонических агентов, например, сахаров, полиспиртов, таких как маннит, сорбит, хлорид натрия в композиции. Продолжительное всасывание инъецируемых композиций может быть обеспечено включением в композицию агента, который задерживает всасывание, например, моностерата алюминия и желатина.
[00121] Стерильные инъецируемые растворы могут быть получены включением активного соединения в требуемом количестве в соответствующем растворителе при необходимости с одним или комбинацией перечисленных выше ингредиентов, с последующей стерилизацией фильтрованием. В целом, дисперсии получают включением активного соединения в стерильную основу, которая содержит основную дисперсионную среду и требуемые другие ингредиенты из тех, которые перечислены выше. В случае стерильных порошков для получения стерильных инъецируемых растворов, способы получения представляют собой вакуумную сушку и сублимацию, которая дает порошок активного ингредиента, плюс любой дополнительный желательный ингредиент из его ранее стерилизованного фильтрацией раствора.
[00122] Пероральные композиции в целом включают инертный разбавитель или съедобный носитель. Они могут быть заключены в желатиновые капсулы или прессованы в таблетки. С целью перорального терапевтического введения, активное соединение может быть включено с эксципиентами и применяться в форме таблеток, пастилок или капсул. Пероральные композиции могут быть также получены с использованием жидкого носителя для применения в качестве полоскания для ротовой полости, причем соединение в жидком носителе применяется перорально для полоскания ротовой полости, в качестве отхаркивающего средства и или для приема внутрь. Фармацевтически совместимые связывающие агенты и/или адъювантные материалы могут быть включены в виде части композиции. Таблетки, пилюли, капсулы, пастилки и тому подобные могут содержать любые из следующих ингредиентов или соединений сходной природы: связывающий агент, такой как микрокристаллическая целлюлоза, смола трагаканта или желатин; эксципиент, такой как крахмал и лактоза, разрыхлитель, такой как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния или Sterotes; глянцеватель, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизирующий агент, такой как мята перечная, метилсалицилат или апельсиновая отдушка.
[00123] Для введения путем ингаляции, соединения доставляются в форме аэрозольного спрея из находящегося под избыточным давлением контейнера или раздаточного устройства, которое содержит подходящий пропеллент, например, газ, такой как диоксид углерода, или небулайзера.
[00124] Системное введение может также осуществляться трансмукозальными или трансдермальными средствами. Для трансмукозального или трансдермального введения, в препаративной форме используются усилители проницаемости, соответствующие подлежащему проникновению барьеру. Такие усилители проницаемости в целом известны в данной области техники и включают, например, для трансмукозального введения, детергенты, желчные соли и производные фузидовой кислоты. Трансмукозальное введение может осуществляться посредством использования интраназальных спреев или суппозиториев. Для трансдермального введения, активные соединения включаются в состав мазей, бальзамов, гелей или кремов, как общеизвестно в данной области техники.
[00125] Соединения могут быть также получены в форме суппозиториев (например, с обычными основаниями суппозиториев, такими как масло какао и другие глицериды) или ретенционных клизм для ректальной доставки.
[00126] В одном варианте осуществления, активные соединения получают с носителями, которые защитят соединение против быстрого выведения из организма, такими как препаративная форма контролируемого высвобождения, включая имплантаты и микроинкапсулированные системы доставки.
Могут использоваться биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы получения таких препаративных форм очевидны для специалистов в данной области техники. Материалы могут быть также закуплены у компаний Alza Corporation и Nova Pharmaceuticals, Inc. Липосомальные суспензии могут также использоваться в качестве фармацевтически приемлемых носителей. Они могут быть получены в соответствии со способами, известными специалистам в данной области техники, например, как описано в патенте США № 4522811.
[00127] Особенно предпочтительно составление пероральных или парентеральных композиций в виде стандартной лекарственной формы для облегчения введения и однородности дозировки. Используемый в данной описании термин стандартная лекарственная форма относится к физически дискретным единицам, пригодным в качестве стандартных дозировок для подлежащего лечению субъекта; причем каждая единица содержит заданное количество активного соединения, рассчитанное для достижения желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Спецификация для стандартных лекарственных форм по изобретению определяется и находится в прямой зависимости от отличительных характеристик активного соединения, подлежащего достижению конкретного терапевтического эффекта и ограничений, присущих области компаундирования такого активного соединения для лечения субъектов.
[00128] Фармацевтические композиции могут быть включены в контейнер, упаковку или раздаточное устройство вместе с инструкциями по введению.
[00129] Далее изобретение будет описано в следующих примерах, которые не ограничивают объем изобретения, описанный в формуле изобретения.
ПРИМЕРЫ
Пример 1: Слитые белки SLPI-Fc и Элафин-Fc и их варианты
[00130] Иллюстративные, но не ограничивающие примеры слитых белков SLPI-Fc и Элафин-Fc в соответствии с изобретением включают следующие последовательности, где часть слитого белка в виде полипептида SLPI или Элафин показана жирным шрифтом, домен WAP подчеркнут, часть слитого белка в виде полипептида IgG-Fc выделена курсивом, мутация Met98Leu (ML) в SLPI окаймлена рамкой, мутации Fc Met252Tyr, Ser254Thr, Thr256Glu (YTE) или Met428Leu, Asn434Ser (LS), которые усиливают связывание FcRn, окаймлены рамкой, выделены жирным шрифтом, и окрашены в серый цвет. Притом, что эти примеры включают шарнирную последовательность и/или линкерную последовательность, слитые белки по изобретению могут быть получены с использованием любой шарнирной последовательности и/или линкерной последовательности, пригодным по длине и/или гибкости. Альтернативно, слитые белки могут быть получены без использования шарнирной и/или линкерной последовательности. Например, полипептидные компоненты могут быть прикреплены непосредственно.
[00131] Иллюстративный слитый белок SLPI-Fc представляет собой SLPI-hFc. Как показано ниже, часть в виде полипептида SLPI слитого белка показана жирным шрифтом (SEQ ID NO: 2), домен WAP подчеркнут, и часть в виде полипептида IgG-Fc слитого белка выделена курсивом (SEQ ID NO: 7).
SLPI-hFc1 (фрагмент Fc человеческого IgG1, длинный Шарнир) (SEQ ID NO: 16)

[00132] Иллюстративный слитый белок SLPI-Fc представляет собой SLPI-hFc2 (человеческий IgG2 Fc, длинный Шарнир). Как показано ниже, часть в виде полипептида SLPI слитого белка показана жирным шрифтом (SEQ ID NO: 2), домен WAP подчеркнут, и часть в виде полипептида IgG-Fc слитого белка выделена курсивом (SEQ ID NO: 8).
SLPI-hFc2 (фрагмент Fc человеческого IgG2, длинный Шарнир) (SEQ ID NO: 17)

[00133] Иллюстративный слитый белок SLPI-Fc представляет собой SLPI-ML-hFc1. Как показано ниже, часть в виде полипептида SLPI слитого белка показана жирным шрифтом (SEQ ID NO: 39), домен WAP подчеркнут, часть в виде полипептида IgG-Fc слитого белка выделена курсивом (SEQ ID NO: 7), и мутация Met98Leu (ML) в SLPI окаймлена рамкой.
SLPI-ML-hFc1 (фрагмент Fc человеческого IgG1, Met98Leu) (SEQ ID NO: 18)

[00134] Иллюстративный слитый белок SLPI-Fc представляет собой SLPI-hFc1-YTE. Как показано ниже, часть в виде полипептида SLPI слитого белка показана жирным шрифтом (SEQ ID NO: 39), домен WAP подчеркнут, часть в виде полипептида IgG-Fc слитого белка выделена курсивом (SEQ ID NO: 40), и мутации Fc Met252Tyr, Ser254Thr, Thr256Glu (YTE) окаймлены рамкой, выделены жирным шрифтом и окрашены в серый цвет.
SLPI-hFc1-YTE (человеческий IgG1 Fc, Met252Tyr, Ser254Thr, Thr256Glu) (SEQ ID NO: 19)

[00135] Иллюстративный слитый белок SLPI-Fc представляет собой SLPI-hFc1-LS. Как показано ниже, часть в виде полипептида SLPI слитого белка показана жирным шрифтом (SEQ ID NO: 39), домен WAP подчеркнут, часть в виде полипептида IgG-Fc слитого белка выделена курсивом (SEQ ID NO: 41), и Met428Leu, Asn434Ser (LS), которые усиливают связывание FcRn, окаймлены рамкой, выделены жирным шрифтом и окрашены в серый цвет.
SLPI-hFc1-LS (человеческий IgG1 Fc, Met428Leu, Asn434Ser)

[00136] Иллюстративный слитый белок Элафин-Fc представляет собой Элафин-hFc1. Как показано ниже, часть в виде полипептида Элафин слитого белка показана жирным шрифтом (SEQ ID NO: 5), домен WAP подчеркнут, часть в виде полипептида IgG-Fc слитого белка выделена курсивом (SEQ ID NO: 41), и Asn434Ser (LS), которые усиливают связывание FcRn, окаймлены рамкой, выделены жирным шрифтом и окрашены в серый цвет.
Элафин-hFc1 (человеческий IgG1)

[00137] Иллюстративный слитый белок SPLI-Fc представляет собой SLPI-hFc1-SLPI. Как показано ниже, часть в виде полипептида SLPI слитого белка показана жирным шрифтом (SEQ ID NO: 39), домен WAP подчеркнут, и часть в виде полипептида IgG-Fc слитого белка выделена курсивом (SEQ ID NO: 7).
SLPI-hFc1-SLPI (человеческий IgG1)


[00138] Иллюстративный слитый белок Элафин-Fc представляет собой Элафин-hFc1-Элафин. Как показано ниже, часть в виде полипептида Элафин слитого белка показана жирным шрифтом (SEQ ID NO: 5), домен WAP подчеркнут, и часть в виде полипептида IgG-Fc слитого белка выделена курсивом (SEQ ID NO: 7).
Элафин-hFc1-Элафин (человеческий IgG1)

[00139] Иллюстративный слитый белок Элафин-Fc представляет собой Элафин-hFc1-SLPI. Как показано ниже, часть в виде полипептида SLPI слитого белка показана жирным шрифтом (SEQ ID NO: 39), при подчеркнутом домене WAP, часть в виде полипептида Элафин (SEQ ID NO: 5) слитого белка показана жирным шрифтом и курсивом, домен WAP подчеркнут, часть в виде полипептида IgG-Fc слитого белка выделена курсивом (SEQ ID NO: 7).
Элафин-hFc1-SLPI (человеческий IgG1)

[00140] Иллюстративный слитый белок SLPI-Fc представляет собой SLPI-hFc1-Элафин. Как показано ниже, часть в виде полипептида SLPI слитого белка показана жирным шрифтом (SEQ ID NO: 39), при подчеркнутом домене WAP, часть в виде полипептида Элафин (SEQ ID NO: 5) слитого белка показана жирным шрифтом и курсивом, домен WAP подчеркнут, и часть в виде полипептида IgG-Fc слитого белка выделена курсивом (SEQ ID NO: 7).
SLPI-hFc1-Элафин (человеческий IgG1)

[00141] Эти иллюстративные слитые белки SLPI-Fc и Элафин-Fc были получены с использованием следующих технологий.
[00142] Гены, кодирующие человеческие SLPI и Элафин, были амплифицированы PCR (полимеразной цепной реакцией, ПЦР) из человеческой селезеночной кДНК (Zyagen). Специфические точечные мутации внутри гена, кодирующего SLPI, Элафин или области Fc, генерировали перекрывающейся ПЦР. Ген, кодирующий SLPI или Элафин, клонировали в рамке с геном, кодирующим шарнир, с последующим клонированием домена CH2 и домена CH3 человеческих IgG1, IgG2, IgG3, IgG4, или IgM в экспрессионный вектор млекопитающих, содержащий сигнальную последовательность секреции млекопитающих выше по ходу транскрипции участка вставки генов SLPI или Элафин. В некоторых случаях, эти векторы дополнительно модифицировали, причем ген, кодирующий линкерную последовательность, и или SLPI, или Элафин, клонировали в рамке в 3' конец домена CH3 для генерирования SLPI-Fc-SLPI, Элафин-Fc-Элафин, SLPI-Fc-Элафин или Элафин-Fc-SLPI. Эти экспрессионные векторы трансфецировали в клетки млекопитающих (в частности, клетки HEK293 или CHO) и выращивали в течение нескольких дней в 8% CO2 при 37°C. Рекомбинантные слитые белки SLPI-Fc и Элафин-Fc очищали из экспрессионного клеточного супернатанта хроматографией белка A. На фиг. IB показан восстанавливающий гель SDS-PAGE слитых белков Элафин-Fc (SEQ ID NO:21, полоса 1) и SLPI-Fc (SEQ ID NO: 16, полоса 2). На фиг. 1D показан восстанавливающий гель SDS-PAGE Элафин-Fc-SLPI (SEQ ID NO:24). Белки визуализировали окрашиванием Кумасси синим.
[00143] Для мониторинга активности эластазы человеческих нейтрофилов (NE) использовали микропланшет для флуоресцентного анализа. Ингибиторную активность измеряли сопутствующим снижением остаточной активности NE, используя следующий анализ. Этот аналитический буфер состоит из 100 мМ Tris pH 7,4, 500 мМ NaCl и 0,0005% Triton X-100. Человеческую NE использовали в конечной концентрации 5 нМ (но можно также использовать от 1 до 20 нМ). В анализе флуоресцентный пептидный субстрат AAVP-AMC использовали в конечной концентрации 100 мкМ. Для считывания кинетики анализа использовали планшетное считывающее устройство Gemini EM от компании Molecular Devices, используя длины волны возбуждения и эмиссии соответственно 370 нм и 440 нм, и отсечку 420 нм. Результаты анализа считывали в течение 10 мин при комнатной температуре, сканируя каждые 5-10 секунд. Vmax в секунду соответствует остаточной активности NE, которая наносится на график для каждой концентрации ингибитора. Отрезок, отсекаемый на оси x, указывает концентрацию ингибитора, требуемую для полной инактивации исходной концентрации NE в анализе. AAT (sdAAT), происходящую из человеческой сыворотки, использовали в качестве положительного контроля ингибирования NE в этих анализах. Слитые белки Элафин-Fc и SLPI-Fc проявляли сильное ингибирование NE (Фиг. 1C). Слитый белок Элафин-Fc-SLPI также был сильным ингибитором NE (Фиг. 1E).
[00144] Кроме того, слитый белок SLPI-Fc проявлял более длинный период полувыведения из сыворотки у крыс, по сравнению с не модифицированным SLPI, продуцируемым E.coli (Фиг. 1F), демонстрируя, что слитые белки по изобретению обладают улучшенными фармакокинетическими свойствами и представляют собой превосходящий терапевтический формат относительно не модифицированных вариантов SLPI и Элафин для лечения многочисленных воспалительных состояний у людей.
Пример 2: Слитые белки SLPI-TNFα с нацеливающей молекулой
[00145] В представленных в настоящем описании исследованиях описано несколько не ограничивающих примеров производных рекомбинантного SLPI, содержащих человеческий SLPI, слитый с антителом к TNFα или производным рецептора TNFα. Эти примеры приведены ниже для дополнительной иллюстрации различных признаков настоящего изобретения. Примеры также иллюстрируют полезную методологию практического осуществления изобретения. Эти примеры не предназначены для ограничения заявленного изобретения.
[00146] Представленные ниже слитые белки включают нацеливающие на цитокин полипептидные последовательности, которые взяты из или происходят из (i) антитела к TNFα D2E7 (также известного как адалимумаб или Humira®), или (ii) внеклеточного домена рецептора TNFα 2-го типа (TNFR2-ECD). Часть слитого белка в форме полипептида SLPI выделена жирным шрифтом, домен WAP подчеркнут, константные области антитела (CH1-шарнир-CH2-CH3, или CL) выделены курсивом, и D2E7-VH, D2E7-VK и TNFR2-ECD окрашены в серый цвет и выделены жирным шрифтом. Притом, что эти примеры включают шарнирную последовательность и/или линкерную последовательность, слитые белки по изобретению могут быть получены с использованием любой шарнирной последовательности и/или линкерной последовательности, подходящей по длине и/или гибкости. Альтернативно, слитые белки могут быть получены без использования шарнирой и/или линкерной последовательности. Например, полипептидные компоненты могут быть прикреплены непосредственно.
[00147] Иллюстративный слитый белок SLPI-TNFα с нацеливающей молекулой представляет собой D2E7-Легкая Цепь-Линкер SLPI (G3S)2. Как показано ниже, часть слитого белка в форме полипептида SLPI выделена жирным шрифтом (SEQ ID NO: 2), домен WAP подчеркнут, константные области антитела (CH1-шарнир-CH2-CH3 или CL) выделены курсивом (SEQ ID NO: 43), и D2E7-VK окрашена в серый цвет и выделена жирным шрифтом (SEQ ID NO: 42).
D2E7-Легкая Цепь-SLPI Линкер (G3S)2

[00148] Иллюстративный слитый белок SLPI-TNFα с нацеливающей молекулой представляет собой D2E7-Легкая Цепь-Линкер SLPI ASTGS. Как показано ниже, часть слитого белка в форме полипептида SLPI выделена жирным шрифтом (SEQ ID NO: 2), домен WAP подчеркнут, константные области антитела (CH1-шарнир-CH2-CH3 или CL) выделены курсивом (SEQ ID NO: 43), и D2E7-VK окрашена в серый цвет и выделена жирным шрифтом (SEQ ID NO: 42).
D2E7-Легкая Цепь-SLPI Линкер ASTGS


[00149] Иллюстративный слитый белок SLPI-TNFα с нацеливающей молекулой представляет собой D2E7-Тяжелая Цепь-Линкер SLPI (G3S)2. Как показано ниже, часть слитого белка в форме полипептида SLPI выделена жирным шрифтом (SEQ ID NO: 2), домен WAP подчеркнут, константные области антитела (CH1-шарнир-CH2-CH3 или CL) выделены курсивом (SEQ ID NO: 45), и D2E7-VH окрашена в серый цвет и выделена жирным шрифтом (SEQ ID NO: 44).
D2E7-Heavy Chain-SLPI Линкер (G3S)2

[00150] Иллюстративный слитый белок SLPI-TNFα с нацеливающей молекулой представляет собой D2E7-Тяжелая Цепь-SLPI Линкер ASTGS. Как показано ниже, часть слитого белка в форме полипептид SLPI выделена жирным шрифтом (SEQ ID NO: 2), домен WAP подчеркнут, константные области антитела (CH1-шарнир-CH2-CH3 или CL) указаны курсивом (SEQ ID NO: 45), и D2E7-VH окрашен в серый цвет и выделен жирным шрифтом (SEQ ID NO: 44).
D2E7-Тяжелая Цепь-SLPI Линкер ASTGS


[00151] Иллюстративный слитый белок SLPI-TNFα с нацеливающей молекулой представляет собой TNFR2-ECD-Fc1-SLPI Линкер (G3S)2. Как показано ниже, часть слитого белка в форме полипептид SLPI выделена жирным шрифтом (SEQ ID NO: 2), домен WAP подчеркнут, часть в форме фрагмента Fc полипептида выделена курсивом (SEQ ID NO: 47), и TNFR2-ECD окрашен в серый цвет и выделен жирным шрифтом (SEQ ID NO: 46).
TNFR2-ECD-Fc1-SLPI Линкер (G3S)2

[00152] Иллюстративный слитый белок SLPI-TNFα с нацеливающей молекулой представляет собой TNFR2-ECD-Fc1-SLPI Линкер ASTGS. Как показано ниже, часть слитого белка в форме полипептид SLPI выделена жирным шрифтом (SEQ ID NO: 2), домен WAP подчеркнут, часть в форме фрагмента Fc полипептида выделена курсивом (SEQ ID NO: 47), и TNFR2-ECD окрашен в серый цвет и выделен жирным шрифтом (SEQ ID NO: 46).
TNFR2-ECD-Fc1-SLPI Линкер ASTGS


[00153] Эти иллюстративные слитые белки SLPI-TNFα с нацеливающей молекулой получали, используя следующие технологии.
[00154] Гены, кодирующие вариабельную область тяжелой цепи (VH) и вариабельную область каппа-цепи (VK) антитела к TNFα, D2E7, генерировали синтезом генов. Ген D2E7-VH клонировали в рамке с геном, кодирующим константную область тяжелой цепи человеческого IgG1 антитела, состоящую из домена CH1, шарнирного домена, домена CH2 и домена CH3, в экспрессионный вектор млекопитающих, содержащий сигнальную последовательность секреции млекопитающих выше по ходу транскрипции участка вставки домена VH (D2E7-HC). Ген D2E7-VK клонировали в рамке с доменом константной области легкой каппа-цепи (CL) человеческого антитела в экспрессионный вектор млекопитающего, содержащий сигнальную последовательность секреции млекопитающих выше по ходу транскрипции участка вставки домена VK (D2E7-LC). Ген, кодирующий SLPI, и примыкающую 5' линкерную последовательность клонировали в рамке в конец 3' или домена CH3 гена тяжелой цепи D2E7 (D2E7-HC-SLPI), или домена CL гена легкой цепи D2E7 (D2E7-LC-SLPI), кодирующего последовательности в описанных выше экспрессионных векторах млекопитающих. Внеклеточный домен Рецептора 2 TNFα (TNFR2-ECD) генерировали синтезом генов и клонировали в рамке с геном, кодирующим шарнирную область, с последующим клонированием домена CH2 и домена CH3 человеческого IgG1 (hFc1) в экспрессионный вектор млекопитающего, содержащий сигнальную последовательность секреции млекопитающих выше по ходу транскрипции участка вставки TNFR2-ECD. Ген, кодирующий SLPI, и примыкающий 5' линкеркерную последовательность, клонировали в конец 3' гена, кодирующего TNFR2-ECD-hFc1, в экспрессионный вектор млекопитающего (TNFR2-ECD-hFc1-SLPI).
[00155] Экспрессионный вектор D2E7-HC-SLPI котрансфецировали или с D2E7-LC, или с экспрессионным вектором D2E7-LC-SLPI в клетки млекопитающих (в частности, клетки HEK293 или CHO) для генерирования антитела D2E7 с SLPI слитым с C-концом тяжелой цепи, или с C-концом и тяжелой цепи, и легкой цепи, соответственно. D2E7-LC-SLPI котрансфецировали с экспрессионным вектором D2E7-HC в клетки млекопитающих для генерирования антитела D2E7 с SLPI, слитым с C-концом легкой цепи. Экспрессионный вектор TNFR2-hFc1-SLPI трансфецировали в клетки млекопитающих. Трансфецированные клетки выращивали в течение нескольких дней в 8% CO2 при 37°C.
[00156] Рекомбинантные нацеливающие слитые белки SLPI-TNFα очищали из экспрессионного клеточного супернатанта хроматографией белка A. На фиг. 2B показан восстанавливающий гель SDS-PAGE одного антитела D2E7 (полоса 1), антитела D2E7 с SLPI, слитым с легкой цепью (SEQ ID NO: 27, котрансфецированной с тяжелой цепью D2E7, полоса 2), антитела D2E7 с SLPI, слитым с тяжелой цепью (SEQ ID NO: 29, котрансфецированной с легкой цепью D2E7, полоса 3). Стрелки обозначают модифицированные (слитые с SLPI) и не модифицированные (без SLPI) тяжелые и легкие цепи. Белки визуализировали окрашиванием Кумасси синим.
[00157] Очищенные слитые белки SLPI-TNFα с нацеливающей молекулой тестировали для выявления активности путем определения их способности ингибировать эластазу нейтрофилов. AAT (sdAAT), происходящий из человеческой сыворотки, использовали в качестве положительного контроля в этих анализах (фиг. 2C). Относительно происходящего из сыворотки AAT, слитые белки D2E7-антитело-SLPI проявляют сходное ингибирование эластазы нейтрофилов, указывая на то, что ингибиторная способность SLPI не была нарушена его слиянием с антителом. Анализы ингибирования NE проводили, как описано выше.
Пример 3 AAT-Fc-SLPI и AAT-Fc-Элафин
[00158] Исследования, представленные здесь, описывают несколько не ограничивающих примеров производных рекомбинантного AAT, содержащих человеческий AAT, слитых с белком, содержащим домен WAP. Эти примеры приведены ниже для дополнительной иллюстрации различных признаков настоящего изобретения. Примеры также иллюстрируют полезную методологию для осуществления на практике изобретения. Часть слитого белка в форме полипептида AAT показана жирным шрифтом и окрашена в серый цвет, часть в виде фрагмента Fc указана курсивом, часть в виде SLPI и Элпафина выделена жирным шрифтом, и содержащий домен WAP полипептид подчеркнут. Притом, что эти примеры включают шарнирную последовательность и/или линкерную последовательность, слитые белки по изобретению могут быть получены с использованием любой шарнирной последовательности и/или линкерной последовательности, подходящей по длине и/или гибкости. Альтернативно, слитые белки могут быть получены без использования шарнирной и/или линкерной последовательности. Например, полипептидные компоненты могут быть прикреплены непосредственно.
[00159] Иллюстративный слитый белок AAT-Fc-SLPI представляет собой AAT-hFc1-SLPI (фрагмент Fc человеческого IgG1). Как показано ниже, часть в виде полипептида AAT слитого белка показана жирным шрифтом и окрашена в серый цвет (SEQ ID NO: 13), часть в виде Fc выделена курсивом (SEQ ID NO: 7), часть в виде SLPI показана жирным шрифтом (SEQ ID NO: 2), и содержащий домен WAP полипептид подчеркнут (SEQ ID NO: 3).
AAT–hFc1-SLPI (фрагмент Fc человеческого IgG1)


[00160] Иллюстративный слитый белок AAT-Fc-Элафин представляет собой AAT-hFc1-Элафин. Как показано ниже, часть слитого белка в форме полипептида AAT показана жирным шрифтом и окрашена в серый цвет (SEQ ID NO: 13), часть в форме фрагмента Fc выделена курсивом (SEQ ID NO: 7), часть в форме Элафина показана жирным шрифтом (SEQ ID NO: 5), и содержащий домен WAP полипептид подчеркнут (SEQ ID NO: 6).
AAT-hFc1-Элафин (фрагмент Fc человеческого IgG1)


[00161] Гены, кодирующие SLPI и Элафин, были амплифицированы ПЦР из человеческой селезеночной кДНК (Zyagen). Эти гены и фланкирующие линкерные последовательности клонировали в рамке в экспрессионные векторы млекопитающих, содержащие гены, кодирующие AAT и область Fc Ig, где сигнальная последовательность секреции млекопитающих предшествует гену AAT. Эти экспрессионные векторы трансфецировали в клетки млекопитающих (в частности, клетки HEK293 или CHO) и выращивали в течение нескольких дней в 8% CO2 при 37°C. Слитые белки рекомбинантный AAT-Fc-домен WAP очищали из экспрессионного клеточного супернатанта хроматографией белка A. Использовали буфер с почти нейтральным pH (Gentle Ag/Ab Elution Buffer, Thermo Scientific) для элюирования слитого белка AAT-Fc-домен WAP из смолы белка A. На фиг. 3B показан восстанавливающий гель SDS-PAGE очищенных слитых белков: AAT-Fc-Элафин (SEQ ID NO: 33, полоса 1) и AAT-Fc-SLPI (SEQ ID NO: 32, полоса 2).
[00162] Очищенные слитые белки AAT-Fc-домен WAP тестировали для выявления активности путем определения их способности ингибировать эластазу нейтрофилов. AAT (sdAAT), происходящий из человеческой сыворотки, использовали в качестве положительного контроля в этих анализах (фиг. 3C). Относительно происходящего из сыворотки AAT, слитые белки с нацеливающей молекулой AAT-Fc-WAP проявляют повышенную активность ингибирования эластазы нейтрофилов. Анализы ингибирования NE проводили, как описано выше.
Пример 4 SLPI-Альбумин и Элафин-Альбумин
[00163] В представленных здесь исследованиях описываются несколько не ограничивающих примеров производных рекомбинантного AAT, содержащих человеческий SLPI, слитый с полипептидом альбумина. Эти примеры приведены ниже для дополнительной иллюстрации различных признаков настоящего изобретения. Примеры также иллюстрируют полезную методологию для практического осуществления изобретения. Эти примеры не ограничивают и не предназначены для ограничения заявленного изобретения. Часть в форме AAT выделена жирным шрифтом, часть в форме альбумина обозначена курсивом и домен WAP подчеркнут. Притом, что эти примеры включают линкерную последовательность, слитые белки по изобретению могут быть получены с использованием любой линкерной последовательности, подходящей по длине и/или гибкости. Альтернативно слитые белки могут быть получены без использования линкерной последовательности.
[00164] Иллюстративный слитый белок SLPI-Альбумин представляет собой SLPI-HSA. Как показано ниже, часть в форме SLPI выделена жирным шрифтом (SEQ ID NO: 2), часть в форме альбумина обозначена курсивом (SEQ ID NO: 14).
SLPI-HSA

[00165] Иллюстративный слитый белок SLPI-Альбумин представляет собой SLPI-Домен 3 HSA. Как показано ниже, часть в форме SLPI выделена жирным шрифтом (SEQ ID NO: 2), и часть в форме альбумина показана курсивом (SEQ ID NO: 15).
SLPI-Домен 3 HSA

[00166] Иллюстративный слитый белок SLPI-Альбумин представляет собой Элафин-HSA. Как показано ниже, часть в форме Элафин выделена жирным шрифтом (SEQ ID NO: 5), часть в форме альбумина обозначена курсивом (SEQ ID NO: 14), и Домен WAP подчеркнут.
SLPI-HSA

[00167] Иллюстративный слитый белок Элафин-Альбумин представляет собой Элафин-домен 3 HSA. Как показано ниже, часть в форме Элафина выделена жирным шрифтом (SEQ ID NO: 5), часть в форме альбумина обозначена курсивом (SEQ ID NO: 15), и Домен WAP подчеркнут (SEQ ID NO: 6).
Элафин-Домен 3 HSA

[00168] Ген, кодирующий человеческий сывороточный альбумин (HSA), был амплифицирован ПЦР из человеческой печеночной кДНК (Zyagen). Генерировали экспрессионный вектор млекопитающих, где ген, кодирующий HAS или домен 3 HAS, клонировали в рамке в 3' конец SLPI или гена, кодирующего Элафин, содержащего сигнальную последовательность секреции млекопитающих выше по ходу транскрипции от SLPI или Элафина.
[00169] Эти экспрессионные векторы трансфецировали в клетки млекопитающих (в частности, клетки HEK293 или CHO) и выращивали в течение нескольких дней в 8% CO2 при 37°C. Слитые белки рекомбинантного SLPI-HSA и Элафина-HSA очищали из экспрессионного клеточного супернатанта, используя фенил-сефарозу.
Другие варианты осуществления
[00170] Хотя изобретение было представлено в сочетании с его подробным описанием, представленное выше описание предназначено для иллюстрации, а не ограничения объема изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в пределах объема следующей формулы изобретения.