СТЕРИЛИЗОВАННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПО МЕНЬШЕЙ МЕРЕ ОДНУ ГИАЛУРОНОВУЮ КИСЛОТУ И АСКОРБИЛФОСФАТ МАГНИЯ
Вид РИД
Изобретение
[0001] Гиалуроновую кислоту используют в течение более пятнадцати лет в области эстетической пластики, в которой была доказана ее безвредность и эффективность. В настоящее время на рынке заполняющих гелей, предназначенных для целей эстетической пластики или в качестве "наполнителей", гели на основе сшитой гиалуроновой кислоты биоферментативного происхождения представляют собой наиболее часто применяемые продукты.
[0002] Применение гиалуроновой кислоты биоферментативного происхождения в таких случаях, как заполнение морщин, вискосупплементация, лечение глаз или также лечение недержания мочи, тем более признается и ценится, поскольку в силу ее естественного присутствия в организме человека и, в частности, в коже, синовиальной жидкости и роговице риски, обусловленные побочными эффектами, являются минимальными.
[0003] Для улучшения этих композиций гиалуроновой кислоты и/или придания им особых свойств к этим композициям могут быть прибавлены некоторые добавки.
[0004] Одним из основных недостатков прибавления добавок к композициям является возможное ухудшение их реологических и/или вязкоупругих свойств или их стабильности как непосредственно при прибавлении, так и на стадиях стерилизации, а также, например, во время хранения.
[0005] Аскорбиновая кислота, известная также под названием витамин C, представляет собой мощный антиоксидант, вовлеченный в большое число биологических процессов, таких как синтез коллагена и метаболизм некоторых аминокислот. К сожалению, витамин C является нестабильным в водных растворах и, следовательно, не может быть использован в композициях гиалуроновой кислоты, которые получены с применением воды. Некоторые из его производных соединений, такие как соли сложных фосфатных эфиров аскорбиновой кислоты, традиционно называемые аскорбилфосфатными солями, являются стабильными в водных композициях.
[0006] Таким образом, теоретически они могут быть введены в композиции гиалуроновой кислоты.
[0007] Диметилсульфон представляет собой мощное противовоспалительное средство, которое ингибирует аллергический ответ, вызванный ксенобиотиками, способен защищать одновременно кератиноциты и фибробласты от отрицательного действия ультрафиолетовых лучей и ингибирует действие цитокинов.
[0008] Следовательно, введение диметилсульфона также представляет интерес при разработке композиций, предназначенных для заполнения морщин или для вискосупплементации.
[0009] Описано много композиций, содержащих гиалуроновую кислоту и аскорбилфосфатную соль, в частности косметические композиции, такие как, например, композиции, описанные в заявке WO 1996/19099, поданной на имя компании LVMH, или в заявке GB 2228197, поданной на имя компании CHISSO Corporation, однако эти композиции большей частью представляют собой композиции, в которых гиалуроновая кислота не является основным компонентом, при этом соотношение между содержанием гиалуроновой кислоты и содержанием аскорбилфосфатной соли в общем случае меньше 1. Кроме того, они предназначены для топического применения, а не для вискосупплементации или заполнения и вследствие этого не подвергаются операциям стерилизации.
[00010] Другие композиции, описанные в WO 2000/71094, поданной на имя компании AMWAY Corporation, обладают такими же характеристиками, что и композиции, описанные в указанных ранее заявках, но в случае этих композиций, хотя и позволяющих подтвердить перспективность аскорбилфосфатных солей, не указана возможность получать препараты для заполнения или вискосупплементации, основным компонентом которых является гиалуроновая кислота с аскорбилфосфатной солью.
[00011] В противоположность этому, в заявке WO 2011/086458, поданной на имя компании ALLERGAN, описаны композиции, предназначенные для заполнения морщин или вискосупплементации и подвергнутые стерилизации, при этом они содержат гиалуроновую кислоту и производные соединения витамина C, такие как 2-гликозидаскорбиновая кислота, аскорбилфосфат натрия или также аскорбилфосфат магния, с содержанием в интервале от 0,6 до 2 мас.% по отношению к массе композиции.
[00012] По мнению патентообладателя, композиции, содержащие 2-гликозидаскорбиновую кислоту, могут позволить получать композиции, которые являются стабильными и обладают повышенной стабильностью, см. пример 6, в случае повышенной концентрации 2-гликозидаскорбиновой кислоты.
[00013] Композиции, содержащие 2% аскорбилфосфата натрия, см. пример 5, считаются стабильными.
[00014] В противоположность этому, композиции, содержащие аскорбилфосфат магния с содержанием 2 мас.% по отношению к общей массе композиции, описаны патентообладателем, см. пример 4, как композиции, которые не являются стабильными после стерилизации паровым автоклавированием, при этом содержание гиалуроновой кислоты в указанных композициях не раскрыто, так что соотношение [HA]/[MAP] не может быть рассчитано, а результаты не могут быть применены на практике и воспроизведены.
[00015] В заявке WO 2012/104419, поданной на имя компании Q-MED, описаны подвергнутые стерилизации композиции, приемлемые для инъекций и предназначенные для заполнения морщин или вискосупплементации. Они содержат гиалуроновую кислоту, местноанестезирующее средство и производное соединения аскорбиновой кислоты, такое как, в частности, аскорбилфосфат натрия, аскорбилфосфат магния или также 2-гликозидаскорбиновую кислоту с содержанием в интервале от 0,01 до 1 мг/мл.
[00016] Присутствие в этих композициях производного соединения аскорбиновой кислоты позволяет предотвращать или уменьшать отрицательное действие местноанестезирующего средства на вязкость и/или эластичность композиции в ходе стерилизации. Действительно, в этой заявке описано значительное увеличение вязкости и показателя эластичности G' композиций вследствие прибавления местноанестезирующего средства.
[00017] В этой заявке уточнено, что композиции, содержащие производное соединения аскорбиновой кислоты, не обладают стабильностью, улучшенной по сравнению с такими же композициями, не содержащими аскорбиновую кислоту, а прибавление производных соединений аскорбиновой кислоты может индуцировать легкое уменьшение стабильности композиций.
[00018] Примеры свидетельствуют о том, что прибавление аскорбилфосфата магния позволяет нейтрализовать действие лидокаина на эластичность композиций со сшитой гиалуроновой кислотой. В этом случае эластичность композиции уменьшается вследствие прибавления аскорбилфосфата магния.
[00019] Другие примеры свидетельствуют о том, что прибавление аскорбилфосфата магния позволяет нейтрализовать действие лидокаина на вязкость композиций с несшитой гиалуроновой кислотой. В этом случае вязкость композиции уменьшается вследствие прибавления аскорбилфосфата магния.
[00020] В заявке WO 2009/005790, поданной на имя компании CARBYLAN BIOSURGERY, описаны композиции, используемые в инъецируемых или имплантируемых препаратах, применяемых, например, для вискосупплементации, или в адгезивных композициях для биомедицинского применения. Эти композиции подвергаются стерилизации и содержат гиалуроновую кислоту, химически модифицированную введением заместителя, содержащего меркаптогруппу, и аскорбиновую кислоту или одно из ее производных соединений, таких как аскорбат натрия или пальмитоиласкорбат.
[00021] Эти композиции, содержащие модифицированную гиалуроновую кислоту, обладают улучшенной стабильностью.
[00022] Таким образом, совершенно неожиданно и непредвиденно с учетом ранее описанной информации предшествующего уровня техники было выявлено, что аскорбилфосфат магния при значениях содержания, меньших или равных 1%, в композициях, содержащих сшитую гиалуроновую кислоту, улучшает или сохраняет реологические характеристики показателя эластичности G' после стерилизации по сравнению с композициями, содержащими только сшитую гиалуроновую кислоту.
[00023] Как показано в примерах, такой эффект не наблюдается в случае композиций, содержащих аскорбилфосфат натрия.
[00024] Заявителем также было выявлено, что аскорбилфосфат магния при содержании, меньшем или равном 1%, в композициях, содержащих несшитую гиалуроновую кислоту, позволяет сохранять вязкость композиций после стерилизации, и улучшает или сохраняет реологические характеристики показателя эластичности G' после стерилизации по сравнению с композициями, содержащими только несшитую гиалуроновую кислоту.
[00025] Таким образом, настоящее изобретение позволяет получать композиции, которые содержат гиалуроновую кислоту и аскорбилфосфатную соль магния и реологические характеристики которых после стерилизации улучшены или сохранены.
[00026] В одном из вариантов осуществления в случае, когда гиалуроновая кислота является сшитой, композиции по настоящему изобретению обладают после стерилизации улучшенными реологическими характеристиками по сравнению с композициями, которые не содержат аскорбилфосфатную соль магния.
[00027] Настоящее изобретение относится к композиции, содержащей по меньшей мере одну сшитую или несшитую гиалуроновую кислоту или одну из ее солей индивидуально или в смеси и аскорбилфосфатную соль, к способам получения указанной композиции и ее применению для получения композиции для заполнения морщин или композиции для вискосупплементации.
[00028] Настоящее изобретение относится к стерилизованной композиции, содержащей по меньшей мере одну гиалуроновую кислоту или одну из ее биологически приемлемых солей индивидуально или в смеси и аскорбилфосфат магния с массовым соотношением между содержанием гиалуроновой кислоты или одной из ее солей [HA] и содержанием аскорбилфосфата магния [MAP], [HA]/[MAP], превышающим или равным 1, причем содержание аскорбилфосфата магния находится в интервале от 0,001 до 1 мас.% по отношению к общей массе указанной композиции, показатель эластичности G' которой сохранен или улучшен после стерилизации и находится в интервале от 5 до 400 Па.
[00029] В одном из вариантов осуществления показатель эластичности G' сохранен или улучшен после стерилизации и находится в интервале от 5 до 350 Па.
[00030] В одном из вариантов осуществления показатель эластичности G' сохранен или улучшен после стерилизации и находится в интервале от 50 до 300 Па.
[00031] В одном из вариантов осуществления композицию стерилизуют паровым автоклавированием.
[00032] В одном из вариантов осуществления композицию стерилизуют этиленоксидом.
[00033] В одном из вариантов осуществления композицию стерилизуют облучением гамма-лучами γ.
[00034] Под биологически приемлемой гиалуроновой кислотой или одной из ее солей, применяемых индивидуально или в смеси, понимают сшитую или несшитую гиалуроновую кислоту, применяемую индивидуально или в смеси и при необходимости химически модифицированную замещением индивидуально или в смеси.
[00035] В одном из вариантов осуществления композиция по настоящему изобретению содержит по меньшей мере одну несшитую гиалуроновую кислоту или одну из ее солей индивидуально или в смеси.
[00036] В одном из вариантов осуществления композиция по настоящему изобретению содержит по меньшей мере одну сшитую гиалуроновую кислоту или одну из ее солей индивидуально или в смеси.
[00037] В одном из вариантов осуществления композиция по настоящему изобретению содержит по меньшей мере одну комбинированным образом сшитую гиалуроновую кислоту или одну из ее солей индивидуально или в смеси.
[00038] В одном из вариантов осуществления композиция по настоящему изобретению содержит по меньшей мере одну гиалуроновую кислоту, химически модифицированную замещением, или одну из ее солей индивидуально или в смеси.
[00039] В одном из вариантов осуществления гиалуроновая кислота находится в виде соли натрия или калия.
[00040] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что массовое соотношение между содержанием гиалуроновой кислоты или одной из ее солей [HA] и содержанием аскорбилфосфата магния [MAP], [HA]/[MAP], находится в интервале от 10 до 30.
[00041] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что массовое соотношение между содержанием гиалуроновой кислоты или одной из ее солей [HA] и содержанием аскорбилфосфата магния [MAP], [HA]/[MAP], находится в интервале от 15 до 25.
[00042] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что массовое соотношение между содержанием гиалуроновой кислоты или одной из ее солей [HA] и содержанием аскорбилфосфата магния [MAP], [HA]/[MAP], приблизительно равно 20.
[00043] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание аскорбилфосфата магния находится в интервале от 0,01 до 0,5 мас.% по отношению к общей массе композиции.
[00044] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание аскорбилфосфата магния находится в интервале от 0,03 до 1 мас.% по отношению к общей массе композиции.
[00045] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание аскорбилфосфата магния находится в интервале от 0,05 до 0,15 мас.% по отношению к общей массе композиции.
[00046] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание аскорбилфосфата магния находится в интервале от 0,03 до 0,1 мас.% по отношению к общей массе композиции.
[00047] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание аскорбилфосфата магния находится в интервале от 0,07 до 0,1 мас.% по отношению к общей массе композиции.
[00048] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание аскорбилфосфата магния в композиции находится в интервале от 0,01 до 10 мг/г.
[00049] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание аскорбилфосфата магния в композиции находится в интервале от 0,3 до 10 мг/г.
[00050] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание аскорбилфосфата магния в композиции находится в интервале от 0,1 до 5 мг/г.
[00051] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание аскорбилфосфата магния в композиции находится в интервале от 0,5 до 1,5 мг/г.
[00052] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание аскорбилфосфата магния в композиции находится в интервале от 0,3 до 1 мг/г.
[00053] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание аскорбилфосфата магния в композиции находится в интервале от 0,7 до 1 мг/г.
[00054] Под Mw или "молекулярной массой" понимают среднемассовую молекулярную массу полимеров, определенную в дальтонах.
[00055] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что молекулярная масса Mw гиалуроновой кислоты или одной из ее солей находится в интервале от 0,01 до 5 МД.
[00056] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что молекулярная масса Mw гиалуроновой кислоты или одной из ее солей находится в интервале от 0,1 до 3,5 МД.
[00057] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что общее содержание гиалуроновой кислоты или одной из ее солей находится в интервале от 0,2 до 5 мас.% по отношению к общей массе композиции.
[00058] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что общее содержание гиалуроновой кислоты или одной из ее солей превышает или равно 1 мас.% по отношению к общей массе композиции.
[00059] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что общее содержание гиалуроновой кислоты или одной из ее солей в композиции находится в интервале от 2 до 50 мг/г.
[00060] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что общее содержание гиалуроновой кислоты или одной из ее солей в композиции находится в интервале от 4 до 40 мг/г.
[00061] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что общее содержание гиалуроновой кислоты или одной из ее солей в композиции находится в интервале от 5 до 30 мг/г.
[00062] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что общее содержание гиалуроновой кислоты или одной из ее солей в композиции находится в интервале от 10 до 30 мг/г.
[00063] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что она содержит по меньшей мере одну несшитую гиалуроновую кислоту или одну из ее солей.
[00064] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что она содержит по меньшей мере одну сшитую гиалуроновую кислоту или одну из ее солей.
[00065] По настоящему изобретению степень сшивания X определяют как соотношение:

[00066] В одном из вариантов осуществления сшитая гиалуроновая кислота имеет степень сшивания X в интервале от 0,001 до 0,5.
[00067] В одном из вариантов осуществления сшитая гиалуроновая кислота имеет степень сшивания X в интервале от 0,01 до 0,25.
[00068] В одном из вариантов осуществления сшитая гиалуроновая кислота имеет степень сшивания X в интервале от 0,1 до 0,2.
[00069] В одном из вариантов осуществления гиалуроновая кислота сшита комбинированным образом соответственно описанному в заявке WO 2000/046253.
[00070] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что она содержит смесь сшитых и несшитых гиалуроновых кислот или их солей.
[00071] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что она содержит смесь сшитых гиалуроновых кислот или их солей.
[00072] В одном из вариантов осуществления смесь сшитых гиалуроновых кислот или их солей представляет собой однородную смесь, соответствующую описанной в заявке WO 2009/071697.
[00073] В одном из вариантов осуществления смесь сшитых гиалуроновых кислот или их солей представляет собой смесь, полученную смешиванием нескольких гиалуроновых кислот или их солей с молекулярными массами, отличающимися степенью сшивания, соответствующей описанному в заявке WO 2004/092222.
[00074] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что она содержит по меньшей мере одну гиалуроновую кислоту или одну из ее солей, содержащие в качестве заместителя группировку, придающую липофильные или гидратирующие свойства, такую как, например, замещенные гиалуроновые кислоты, соответствующие описанным в заявке FR 1161125, поданной на имя заявителя.
[00075] В одном из вариантов осуществления композиция дополнительно содержит другой полисахарид.
[00076] В одном из вариантов осуществления другой полисахарид выбирают из группы, в которую входят целлюлоза, альгиновая кислота или их соли.
[00077] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что она дополнительно содержит диметилсульфон.
[00078] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание диметилсульфона находится в интервале от 0,001 до 5 мас.% по отношению к общей массе композиции.
[00079] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание диметилсульфона находится в интервале от 0,1 до 1 мас.% по отношению к общей массе композиции.
[00080] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание диметилсульфона в композиции находится в интервале от 0,1 до 20 мг/г.
[00081] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание диметилсульфона в композиции находится в интервале от 1 до 10 мг/г.
[00082] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что указанная композиция дополнительно содержит по меньшей мере один дополнительный агент.
[00083] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что дополнительный агент выбирают из антиоксидантов, местноанестезирующих средств индивидуально или в смеси.
[00084] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что местноанестезирующие средства выбирают из группы, в которую входят лидокаин, прокаин, мепивакаин, ропивакаин, бупивакаин или их фармацевтически приемлемые соли.
[00085] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что местноанестезирующее средство представляет собой гидрохлорид лидокаина.
[00086] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что антиоксиданты выбирают из полиолов.
[00087] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что антиоксиданты выбирают из маннита и сорбита индивидуально или в смеси.
[00088] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что антиоксидант представляет собой маннит.
[00089] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что антиоксидант представляет собой сорбит.
[00090] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что антиоксидант представляет собой смесь маннита и сорбита.
[00091] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание дополнительного агента находится в интервале от 0,01 до 10 мас.% по отношению к общей массе композиции.
[00092] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание дополнительного агента находится в интервале от 0,1 до 5 мас.% по отношению к общей массе композиции.
[00093] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание дополнительного агента в композиции находится в интервале от 0,1 до 100 мг/г.
[00094] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что содержание дополнительного агента в композиции находится в интервале от 1 до 50 мг/г.
[00095] В одном из вариантов осуществления настоящее изобретение относится к композиции для вискосупплементации, отличающейся тем, что она содержит по меньшей мере одну композицию по настоящему изобретению.
[00096] В одном из вариантов осуществления настоящее изобретение относится к композиции для лечения ксерофтальмии или сухости глаз, отличающейся тем, что она содержит по меньшей мере одну композицию по настоящему изобретению.
[00097] Согласно вариантам осуществления указанные композиции используют в качестве искусственных слез, слезозаменяющих гелей или смазочных веществ.
[00098] В одном из вариантов осуществления композиция по настоящему изобретению отличается тем, что ее показатель эластичности G' сохранен или улучшен после стерилизации и находится в интервале от 5 до 400 Па.
[00099] В одном из вариантов осуществления показатель эластичности G' сохранен или улучшен после стерилизации и находится в интервале от 5 до 350 Па.
[000100] В одном из вариантов осуществления показатель эластичности G' сохранен или улучшен после стерилизации и находится в интервале от 50 до 300 Па.
[000101] В одном из вариантов осуществления настоящее изобретение относится к применению аскорбилфосфата магния с концентрацией в интервале от 0,3 до 10 мг/г для сохранения или улучшения эластичности после стерилизации композиции, содержащей по меньшей мере одну гиалуроновую кислоту или одну из ее биологически приемлемых солей индивидуально или в смеси.
[000102] В одном из вариантов применения содержание гиалуроновой кислоты или одной из ее солей индивидуально или в смеси в композиции находится в интервале от 0,2 до 5 мас.% по отношению к общей массе композиции.
[000103] В одном из вариантов применения содержание гиалуроновой кислоты или одной из ее солей индивидуально или в смеси в композиции превышает или равно 1 мас.% по отношению к общей массе композиции.
[000104] В одном из вариантов применения гиалуроновая кислота или одна из ее солей является сшитой.
[000105] В одном из вариантов применения гиалуроновая кислота или одна из ее солей имеет степень сшивания в интервале от 0,001 до 0,5.
[000106] В одном из вариантов применения концентрация аскорбилфосфата магния в композиции находится в интервале от 0,3 до 10 мг/г с целью улучшения эластичности указанной композиции после стерилизации.
[000107] В одном из вариантов применения гиалуроновая кислота или одна из ее солей является несшитой.
[000108] В одном из вариантов применения концентрация аскорбилфосфата магния в композиции находится в интервале от 0,7 до 3 мг/г.
[000109] В одном из вариантов применения концентрация аскорбилфосфата магния в композиции находится в интервале от 0,7 до 1 мг/г с целью улучшения эластичности указанной композиции после стерилизации.
[000110] Изобретение относится также к применению аскорбилфосфата магния в качестве агента для сохранения или улучшения эластичности после стерилизации композиции, содержащей по меньшей мере одну гиалуроновую кислоту или одну из ее биологически приемлемых солей индивидуально или в смеси, причем концентрация аскорбилфосфата магния находится в интервале от 0,3 до 10 мг/г, а массовое соотношение между содержанием гиалуроновой кислоты или одной из ее солей [HA] и содержанием аскорбилфосфата магния [MAP], [HA]/[MAP], превышает или равно 1.
[000111] Настоящее изобретение относится также к способу сохранения или улучшения эластичности после стерилизации композиции, содержащей по меньшей мере одну гиалуроновую кислоту или одну из ее биологически приемлемых солей индивидуально или в смеси, причем способ состоит в прибавлении к композиции аскорбилфосфата магния с концентрацией в интервале от 0,3 до 10 мг/г, при этом массовое соотношение между содержанием гиалуроновой кислоты или одной из ее солей [HA] и содержанием аскорбилфосфата магния [MAP], [HA]/[MAP], превышает или равно 1.
[000112] В одном из вариантов осуществления способа и/или применения молекулярная масса Mw гиалуроновой кислоты или одной из ее солей в композиции находится в интервале от 0,01 до 5 МД.
[000113] В одном из вариантов осуществления способа и/или применения содержание гиалуроновой кислоты или одной из ее солей индивидуально или в смеси в композиции находится в интервале от 0,2 до 5 мас.% по отношению к общей массе композиции.
[000114] В одном из вариантов осуществления способа и/или применения содержание гиалуроновой кислоты или одной из ее солей индивидуально или в смеси в композиции превышает или равно 1 мас.% по отношению к общей массе композиции.
[000115] В одном из вариантов осуществления способа и/или применения композиция содержит сшитую гиалуроновую кислоту или одну из ее солей.
[000116] В одном из вариантов осуществления способа и/или применения гиалуроновая кислота или одна из ее солей в композиции имеет степень сшивания в интервале от 0,001 до 0,5.
[000117] В одном из вариантов осуществления способа и/или применения концентрация аскорбилфосфата магния в композиции находится в интервале от 0,3 до 10 мг/г с целью улучшения эластичности указанной композиции после стерилизации.
[000118] В одном из вариантов осуществления способа и/или применения композиция содержит несшитую гиалуроновую кислоту или одну из ее солей.
[000119] В одном из вариантов осуществления способа и/или применения концентрация аскорбилфосфата магния в композиции находится в интервале от 0,7 до 3 мг/г.
[000120] В одном из вариантов осуществления способа и/или применения концентрация аскорбилфосфата магния в композиции находится в интервале от 0,7 до 1 мг/г с целью улучшения эластичности указанной композиции после стерилизации.
[000121] Изобретение относится также к способу получения композиции по настоящему изобретению.
[000122] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что он включает по меньшей мере:
- одну стадию гидратации волокон по меньшей мере одной гиалуроновой кислоты или одной из ее солей индивидуально или в смеси для получения гидрогеля;
- одну стадию смешивания раствора аскорбилфосфата магния с гидрогелем, полученным на предыдущей стадии;
- одну стадию гомогенизации;
- одну стадию стерилизации.
[000123] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что стадию гидратации осуществляют при комнатной температуре.
[000124] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что стадию гомогенизации осуществляют при комнатной температуре.
[000125] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что стадию смешивания раствора аскорбилфосфата магния с гидрогелем, полученным на стадии гидратации, осуществляют при температуре, адаптированной к способу получения. В одном из вариантов осуществления стадию смешивания осуществляют при комнатной температуре.
[000126] В одном из вариантов осуществления стадию стерилизации осуществляют паровым автоклавированием.
[000127] В одном из вариантов осуществления стадию стерилизации осуществляют с этиленоксидом.
[000128] В одном из вариантов осуществления стадию стерилизации осуществляют облучением гамма-лучами γ.
[000129] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что стерилизацию паровым автоклавированием осуществляют при температуре от 121 до 134°C в течение промежутка времени, адаптированного к температуре.
[000130] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что он дополнительно включает по меньшей мере одну стадию расфасовки гомогенизированной смеси в шприцы.
[000131] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что он дополнительно включает по меньшей мере одну стадию расфасовки гомогенизированной смеси во флаконы стандартной дозы.
[000132] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что он дополнительно включает по меньшей мере одну стадию сшивания.
[000133] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что стадию сшивания осуществляют между стадией гидратации и стадией смешивания.
[000134] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что стадию сшивания осуществляют посредством по меньшей мере одного сшивающего агента.
[000135] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что сшивающий агент является би- или полифункциональным.
[000136] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что би- или полифункциональный сшивающий агент выбирают из группы, состоящей из этиленгликольдиглицидилового эфира, бутандиолдиглицидилового эфира (BDDE), полиглицеринполиглицидилового эфира, полиэтиленгликольдиглицидилового эфира, полипропиленгликольдиглицидилового эфира, бис- или полиэпоксидов, таких как 1,2,3,4-диэпоксибутан или 1,2,7,8-диэпоксиоктан, диалкилсульфона, дивинилсульфона, формальдегида, эпихлоргидрина или также глутарового альдегида, карбодиимидов, таких как, например, гидрохлорид 1-этил-3-[3-диметиламинопропил]карбодиимида (EDC).
[000137] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что бифункциональный сшивающий агент представляет собой бутандиолдиглицидиловый эфир (BDDE) или 1,2,7,8-диэпоксиоктан.
[000138] В одном из вариантов осуществления способ получения по настоящему изобретению отличается тем, что стадию сшивания осуществляют способами, известными специалистам в данной области техники.
[000139] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что он включает после стадии сшивания по меньшей мере одну стадию очистки и промывки, осуществляемую способами, известными специалистам в данной области техники.
[000140] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что он дополнительно включает по меньшей мере одну стадию смешивания раствора диметилсульфона с гидрогелем, полученным на стадии гидратации.
[000141] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что стадию смешивания раствора диметилсульфона с гидрогелем, полученным на стадии гидратации, осуществляют перед стадией гомогенизации.
[000142] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что стадию смешивания раствора диметилсульфона с гидрогелем, полученным на стадии гидратации, осуществляют при температуре, адаптированной к способу получения. В одном из вариантов осуществления стадию смешивания осуществляют при комнатной температуре.
[000143] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что он дополнительно включает по меньшей мере одну стадию смешивания раствора по меньшей мере одного дополнительного агента с гидрогелем, полученным на стадии гидратации.
[000144] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что стадию смешивания раствора по меньшей мере одного дополнительного агента с гидрогелем, полученным на стадии гидратации, осуществляют перед стадией гомогенизации.
[000145] В одном из вариантов осуществления способ по настоящему изобретению отличается тем, что стадию смешивания раствора по меньшей мере одного дополнительного агента с гидрогелем, полученным на стадии гидратации, осуществляют при температуре, адаптированной к способу получения. В одном из вариантов осуществления стадию смешивания осуществляют при комнатной температуре.
[000146] Настоящее изобретение относится к применению композиции по настоящему изобретению для получения композиции для заполнения морщин.
[000147] Настоящее изобретение относится к применению композиции по настоящему изобретению для получения композиции для вискосупплементации.
[000148] Предусматриваемые варианты применения более предпочтительно представляют собой варианты применения, обычно распространенные в отношении вязкоупругих средств, приемлемых для инъекций, и полисахаридов, применяемых или потенциально приемлемых для применения в случае следующих патологий или терапии:
- инъекции для эстетической пластики в области лица: заполнение морщин, дефекты кожи или объема (скулы, подбородок, губы);
- инъекции для увеличения объема частей тела: увеличение грудей и ягодиц, увеличение точки G, вагинопластика, реконструкция половых губ, увеличение размера пениса;
- лечение артроза, инъекции в суставы для замещения или возмещения дефицита синовиальной жидкости;
- периуретральные инъекции для лечения недержания мочи, вызванного недостаточностью сфинктера;
- послеоперационные инъекции предпочтительно для избежания перитонеального спайкообразования;
- инъекции, осуществляемые после хирургического лечения пресбиопии лазерными надрезами склеры;
- инъекции в полость стекловидного тела;
- инъекции при хирургическом лечении катаракты;
- инъекции в области половых органов.
[000149] В случае пластической хирургии в зависимости от вязкоупругих свойств и последействия композиция, получаемая способом по настоящему изобретению, более предпочтительно может быть использована:
- для заполнения мелких, средних или глубоких морщин инъекциями с иглами малого диаметра (например, калибра 27);
- в качестве увеличителя объема при инъекциях иглами большего диаметра (например, калибра 22-26) и большей длины (например, от 30 до 40 мм); в этом случае когезивный характер композиции будет позволять гарантировать сохранение позиции введенного вещества.
[000150] Композиция по настоящему изобретению находит важное применение также при хирургическом лечении суставов и зубов, например для заполнения пародонтальных карманов.
[000151] Эти примеры применения не являются в какой-либо степени ограничительными, при этом композиция по настоящему изобретению в более широко смысле предусмотрена:
- для заполнения объемов;
- для создания прослоек во внутренней структуре некоторых тканей, благоприятствующих таким образом их оптимальному функционированию;
- для возмещения дефицита физиологических жидкостей.
[000152] Настоящее изобретение относится также к набору, содержащему композицию по настоящему изобретению, расфасованную в шприцы и стерилизованную после расфасовки.
[000153] Настоящее изобретение относится также к набору, содержащему композицию по настоящему изобретению, расфасованную во флаконы стандартной дозы и стерилизованную после расфасовки.
[000154] Композиция по настоящему изобретению находит применение также в области косметических или фармацевтических средств.
[000155] В области косметических средств композиция по настоящему изобретению более предпочтительно может быть использована в качестве активного увлажняющего ингредиента в косметической композиции.
[000156] В области фармацевтических средств композиция по настоящему изобретению может быть использована в качестве композиции для увлажнения глаз, пораженных сухостью глаз, а именно в качестве искусственных слез.
[000157] В случае этих косметических и/или фармацевтических вариантов применения композиции могут содержать, кроме того, любые косметически или фармацевтически приемлемые ингредиенты.
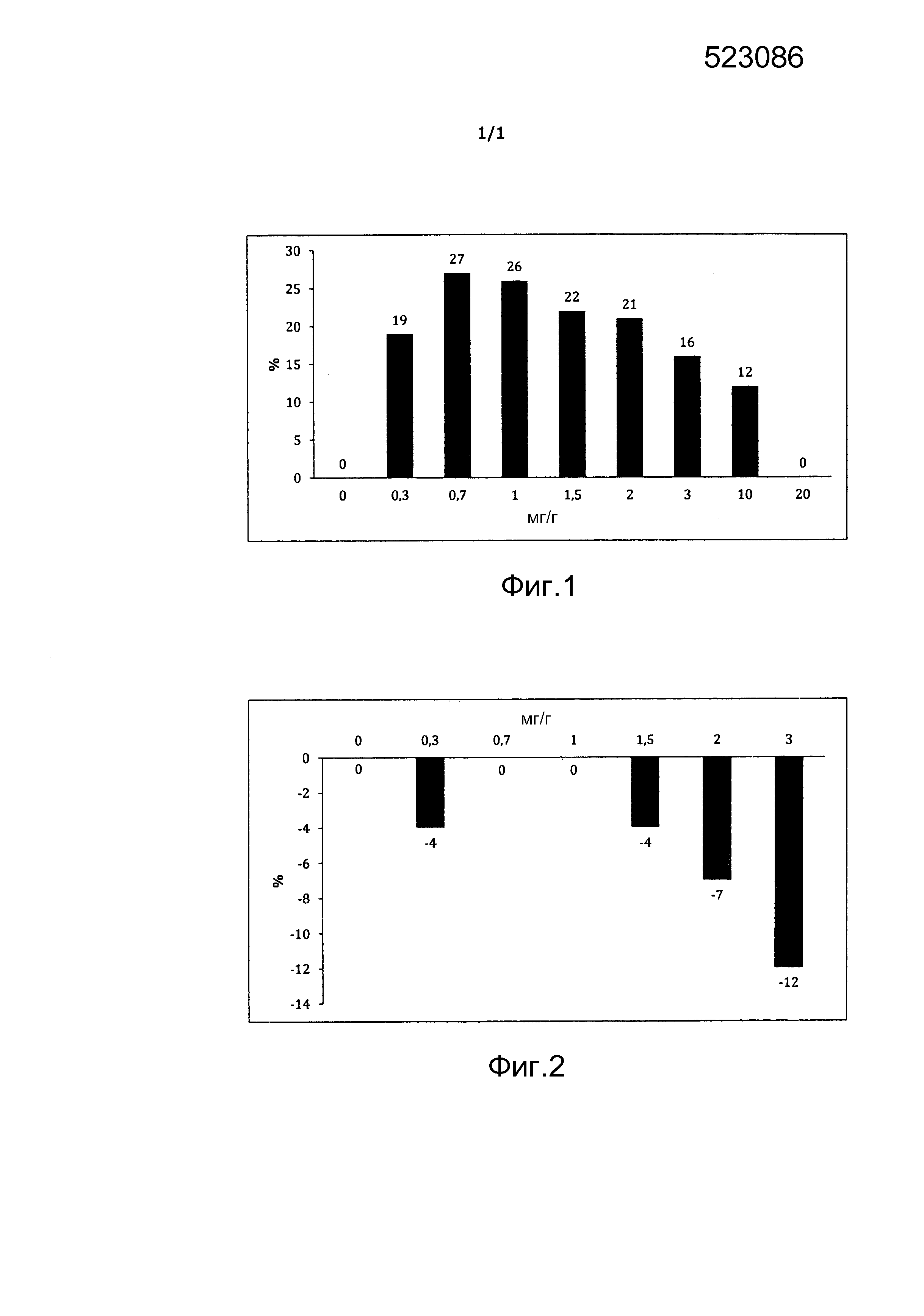
[000158] На фиг. 1 представлена диаграмма, поясняющая степень улучшения в процентах, отложенную по оси ординат диаграммы, показателя эластичности G' в зависимости от содержания, отложенного по оси абсцисс диаграммы, аскорбилфосфата магния в мг/г в композиции после стерилизации паровым автоклавированием композиций, содержащих сшитую гиалуроновую кислоту и аскорбилфосфат магния.
[000159] На фиг. 2 представлена диаграмма, поясняющая степень улучшения в процентах, отложенную по оси ординат диаграммы, вязкости η в зависимости от содержания, отложенного по оси абсцисс диаграммы, аскорбилфосфата магния в мг/г в композиции после стерилизации паровым автоклавированием композиций, содержащих несшитую гиалуроновую кислоту и аскорбилфосфат магния.
[000160] Характеристики композиции по настоящему изобретению, а также способы ее получения и их особенности пояснены в примерах, приведенных далее.
Пример 1
[000161] В этом примере пояснена композиция по настоящему изобретению, содержащая несшитую гиалуроновую кислоту и аскорбилфосфат магния.
[000162] Волокна гиалуроната натрия (NaHA) с качеством, приемлемым для инъекций (1 г; молекулярная масса: около 2,7 МД), взвешивают в сосуде. Прибавляют водный фосфатный буферный раствор (32,3 г) и смесь гомогенизируют приблизительно в течение 1 часа шпателем при комнатной температуре и атмосферном давлении 900 мм рт. ст.
[000163] Полученный таким образом гидрогель несшитого NaHA содержит около 30 мг/г NaHA.
[000164] Аскорбилфосфат магния (MAP) (60 мг или 2,4⋅10-4 моль) солюбилизируют в фосфатном буферном растворе (19,94 г) для получения водного раствора аскорбилфосфата магния с содержанием 3 мг/г.
[000165] Гидрогель NaHA, полученный на предыдущей стадии, разбавляют прибавлением водного раствора аскорбилфосфата магния, полученного ранее. Затем полученную таким образом композицию гомогенизируют.
[000166] Таким образом, получают композицию, содержащую несшитый NaHA с содержанием 20 мг/г и MAP с содержанием 1 мг/г; при этом массовое соотношение [HA]/[MAP] равно 20.
[000167] Полученную таким образом композицию расфасовывают в шприцы, которые стерилизуют паровым автоклавированием (T=121°C, 10 мин).
Пример 2
[000168] В этом примере пояснен пример композиции по настоящему изобретению, содержащей сшитую гиалуроновую кислоту и аскорбилфосфат магния.
[000169] Композицию, содержащую сшитую гиалуроновую кислоту, получают по методике сшивания, описанной в WO 2009/071697 (пример 1, первая часть), поданной на имя компании VIVACY, исходя из волокна гиалуроната натрия (NaHA) (1 г; молекулярная масса: около 2,7 МД) и бутандиолдиглицидилового эфира (BDDE) (54 мг). Полученная таким образом композиция содержит около 30 мг/г NaHA, сшитого со степенью сшивания X около 0,12.
[000170] Водный раствор аскорбилфосфата магния с содержанием 3 мг/г получают соответственно примеру 1.
[000171] Гидрогель сшитого NaHA, полученный на предыдущей стадии, разбавляют прибавлением водного раствора аскорбилфосфата магния, полученного ранее. Затем полученную таким образом композицию гомогенизируют.
[000172] Таким образом, получают композицию, содержащую сшитый NaHA с содержанием 20 мг/г и аскорбилфосфат магния с содержанием 1 мг/г; при этом массовое соотношение [HA]/[MAP] равно 20.
[000173] Полученную таким образом композицию расфасовывают в шприцы, которые стерилизуют паровым автоклавированием (T=121°C, 10 мин).
Пример 3
[000174] В этом примере пояснен пример композиции по настоящему изобретению, содержащей сшитую гиалуроновую кислоту, аскорбилфосфат магния и лидокаин.
[000175] Композицию, содержащую сшитый NaHA, получают по методике, описанной в примере 2, исходя из гидрогеля NaHA с содержанием 30 мг/г и аскорбилфосфата магния с содержанием 10 мг/г.
[000176] Прибавление раствора лидокаина с содержанием 13 мг/г к полученной ранее композиции осуществляют по методике, описанной в WO 2009/024670, поданной на имя компании ANTEIS, или по методике, описанной в заявках US 61/791977 или FR 13/52971, поданных на имя компании VIVACY.
[000177] Полученная таким образом композиция содержит сшитую гиалуроновую кислоту с содержанием 20 мг/г, лидокаин с содержанием 3 мг/г и аскорбилфосфат магния с содержанием 1 мг/г; при этом массовое соотношение [HA]/[MAP] равно 20.
[000178] Полученную таким образом композицию расфасовывают в шприцы, которые стерилизуют паровым автоклавированием (T=121°C, 10 мин).
Пример 4
[000179] В этом примере пояснен пример композиции по настоящему изобретению, содержащей несшитую гиалуроновую кислоту, аскорбилфосфат магния и диметилсульфон.
[000180] Композицию, содержащую несшитую гиалуроновую кислоту и аскорбилфосфат магния, получают по методике примера 1 исходя из гидрогеля гиалуроновой кислоты с содержанием 30 мг/г и раствора аскорбилфосфата магния с содержанием 10 мг/г.
[000181] К полученной ранее композиции также прибавляют раствор диметилсульфона с содержанием 4,3 мг/г.
[000182] Затем полученную таким образом композицию гомогенизируют.
[000183] Таким образом, получают композицию, которая содержит несшитую гиалуроновую кислоту с содержанием 20 мг/г, диметилсульфон с содержанием 1 мг/г и аскорбилфосфат магния с содержанием 1 мг/г; при этом массовое соотношение [HA]/[MAP] равно 20.
[000184]
[000185] Полученную таким образом композицию расфасовывают в шприцы, которые стерилизуют паровым автоклавированием (T=121°C, 10 мин).
Пример 5
[000186] В этом примере пояснен пример композиции по настоящему изобретению, содержащей сшитую гиалуроновую кислоту, аскорбилфосфат магния и диметилсульфон.
[000187] Композицию, содержащую сшитый NaHA, получают по методике, описанной в примере 2, исходя из гидрогеля NaHA с содержанием 30 мг/г и аскорбилфосфата магния с содержанием 10 мг/г.
[000188] К полученной ранее композиции также прибавляют раствор диметилсульфона с содержанием 4,3 мг/г.
[000189] Затем полученную таким образом композицию гомогенизируют.
[000190] Таким образом, получают композицию, которая содержит сшитую гиалуроновую кислоту с содержанием 20 мг/г, диметилсульфон с содержанием 1 мг/г и аскорбилфосфат магния с содержанием 1 мг/г; при этом массовое соотношение [HA]/[MAP] равно 20.
[000191] Полученную таким образом композицию расфасовывают в шприцы, которые стерилизуют паровым автоклавированием (T=121°C, 10 мин).
Пример 6
[000192] В этом примере пояснен пример композиции, содержащей несшитую гиалуроновую кислоту, аскорбилфосфат магния и маннит.
[000193] Композицию, содержащую несшитый NaHA, получают по методике, описанной в примере 1, исходя из гидрогеля NaHA с содержанием 30 мг/г и аскорбилфосфата магния с содержанием 10 мг/г.
[000194] К полученной ранее композиции также прибавляют раствор маннита с содержанием 4,3 мг/г.
[000195] Затем полученную таким образом композицию гомогенизируют.
[000196] Таким образом, получают композицию, которая содержит несшитую гиалуроновую кислоту с содержанием 20 мг/г, аскорбилфосфат магния с содержанием 1 мг/г и маннит с содержанием 1 мг/г; при этом массовое соотношение [HA]/[MAP] равно 20.
[000197] Полученную таким образом композицию расфасовывают в шприцы, которые стерилизуют паровым автоклавированием (T=121°C, 10 мин).
Пример 7
[000198] В этом примере пояснен пример композиции, содержащей сшитую гиалуроновую кислоту, аскорбилфосфат магния и маннит.
[000199] Композицию, содержащую сшитый NaHA, получают по методике, описанной в примере 2, исходя из гидрогеля NaHA с содержанием 30 мг/г и аскорбилфосфата магния с содержанием 10 мг/г.
[000200] К полученной ранее композиции также прибавляют раствор маннита с содержанием 4,3 мг/г.
[000201] Затем полученную таким образом композицию гомогенизируют.
[000202] Таким образом, получают композицию, которая содержит сшитую гиалуроновую кислоту с содержанием 20 мг/г, аскорбилфосфат магния с содержанием 1 мг/г и маннит с содержанием 1 мг/г; при этом массовое соотношение [HA]/[MAP] равно 20.
[000203] Полученную таким образом композицию расфасовывают в шприцы, которые стерилизуют паровым автоклавированием (T=121°C, 10 мин).
Пример 8
[000204] В этом примере пояснен пример композиции, содержащей сшитую гиалуроновую кислоту и аскорбилфосфат натрия (SAP).
[000205] Композицию, содержащую сшитую гиалуроновую кислоту и аскорбилфосфат натрия, получают по методике примера 2 исходя из геля гиалуроновой кислоты с содержанием 30 мг/г и аскорбилфосфата натрия с содержанием 3 мг/г.
[000206] Полученная таким образом композиция содержит сшитую гиалуроновую кислоту с содержанием 20 мг/г и аскорбилфосфат натрия с содержанием 1 мг/г; при этом массовое соотношение [HA]/[SAP] равно 20.
[000207] Полученную таким образом композицию расфасовывают в шприцы, которые стерилизуют паровым автоклавированием (T=121°C, 10 мин).
Пример 9
[000208] В этом контр-примере пояснен пример композиции, содержащей несшитую гиалуроновую кислоту и маннит.
[000209] Композицию, содержащую несшитую гиалуроновую кислоту и маннит (MAN), получают по методике примера 1 исходя из гидрогеля гиалуроновой кислоты с содержанием 30 мг/г и раствора маннита с содержанием 3 мг/г.
[000210] Полученная таким образом композиция содержит несшитую гиалуроновую кислоту с содержанием 20 мг/г и маннит с содержанием 1 мг/г; при этом массовое соотношение [HA]/[MAN] равно 20.
[000211] Полученную таким образом композицию расфасовывают в шприцы, которые стерилизуют паровым автоклавированием (T=121°C, 10 мин).
Пример 10
[000212] В этом контр-примере пояснен пример композиции, содержащей сшитую гиалуроновую кислоту и маннит.
[000213] Композицию, содержащую сшитый NaHA, получают по методике, описанной в примере 2, исходя из гидрогеля NaHA с содержанием 30 мг/г и маннита с содержанием 3 мг/г.
[000214] Полученная таким образом композиция содержит сшитую гиалуроновую кислоту с содержанием 20 мг/г и маннит с содержанием 1 мг/г; при этом массовое соотношение [HA]/[MAN] равно 20.
[000215] Полученную таким образом композицию расфасовывают в шприцы, которые стерилизуют паровым автоклавированием (T=121°C, 10 мин).
Пример 11
[000216] Определение реологических характеристик композиций, содержащих сшитую гиалуроновую кислоту и ранее поясненных примерами, до и после стерилизации паровым автоклавированием
[000217] Показатель эластичности G' композиций, содержащих сшитую гиалуроновую кислоту, до и после стерилизации паровым автоклавированием определяли реометром TA Instrument AR 2000 Ex, возбуждая колебания при 25°C, при этом значения показателя эластичности G' определяли при частоте 1 Гц.
[000218] В случае всех измерений сравнительную композицию получали, используя вместо водного раствора аскорбилфосфата магния эквивалентное количество водного фосфатного буферного раствора.
[000219] Степень улучшения показателя эластичности G' в процентах определяли как:
степень улучшения G', %=(Y-Y')/Y·100,
где:
Y=процентная доля уменьшения показателя эластичности G' сравнительной композиции при стерилизации;
Y=процентная доля уменьшения показателя эластичности G' испытуемой композиции при стерилизации.
[000220] Восемь композиций, содержащих сшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием в композиции в интервале от 0,3 до 20 мг/г, получали по методике, описанной в примере 2.
[000221] Три композиции, содержащие сшитую гиалуроновую кислоту и маннит с содержанием в композиции в интервале от 1 до 10 мг/г, получали по методике, описанной в примере 10.
[000222] Две композиции, содержащие сшитую гиалуроновую кислоту и аскорбилфосфат натрия с содержанием в композиции в интервале от 1 до 5 мг/г, получали по методике, описанной в примере 8.
[000223] Сравнительную композицию, содержащую сшитую гиалуроновую кислоту, получали по методике, описанной в примере 2. Водный раствор аскорбилфосфата магния заменяли эквивалентным количеством водного фосфатного буферного раствора.
[000224] Показатель эластичности испытуемых композиций определяли до и после стерилизации и рассчитывали степень улучшения показателя эластичности G' в процентах; полученные результаты представлены в таблице 1, приведенной далее.
|
[000225] Приведенные результаты, полученные в случае композиций, содержащих MAP, показаны также на фиг. 1, представляющей собой диаграмму, на которой показано улучшение показателя эластичности G' в процентах в зависимости от содержания аскорбилфосфата магния после стерилизации паровым автоклавированием композиций, содержащих сшитую гиалуроновую кислоту и аскорбилфосфат магния.
[000226] В случае композиций, содержащих сшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием в интервале от 0,3 до 20 мг/г, видно, что показатель эластичности G' улучшен относительно сравнительной композиции в случае, когда содержание аскорбилфосфата магния находится в интервале от 0,3 до 10 мг/г, с резким падением в случае, когда это содержание превышает 10 мг/г.
[000227] Эти результаты находятся в противоречии с результатами, полученными в случае композиций, содержащих сшитую гиалуроновую кислоту и маннит, и свидетельствующими о том, что чем больше содержание маннита в композиции, тем в большей степени улучшается показатель эластичности G' относительно сравнительной композиции.
[000228] Они также находятся в противоречии с результатами, полученными с композициями, которые содержат сшитую гиалуроновую кислоту и SAP и показатель эластичности G' которых ухудшен в случае двух испытуемых концентраций.
Пример 12
[000229] Определение реологических характеристик композиций, содержащих несшитую гиалуроновую кислоту, до и после стерилизации паровым автоклавированием
[000230] Композиции, содержащие несшитую гиалуроновую кислоту, характеризовали по их вязкости η.
[000231] Вязкость η композиций определяли реометром TA Instruments A 2000 Ex, прикладывая механическое напряжение при 25°C. Вязкость определяли при приложении механического напряжения с частотой 0,02 с-1.
[000232] Шесть композиций, содержащих несшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием в композиции в интервале от 0,3 до 3 мг/г, получали по методике, описанной в примере 1.
[000233] Сравнительную композицию, содержащую несшитую гиалуроновую кислоту, получали по методике, описанной в примере 1. Водный раствор аскорбилфосфата магния, описанный в методике примера 1, заменяли эквивалентным количеством водного фосфатного буферного раствора.
[000234] Степень улучшения вязкости η в процентах определяли как:
степень улучшения вязкости η, %=(Z-Z')/Z⋅100,
где:
Z=процентная доля потерь вязкости η сравнительной композиции при стерилизации;
Z'=процентная доля потерь вязкости η испытуемой композиции при стерилизации.
[000235] Вязкость испытуемых композиций определяли до и после стерилизации и рассчитывали степень улучшения вязкости в процентах; полученные результаты представлены в таблице 2, приведенной далее.
|
[000236] Приведенные результаты показаны также на фиг. 2, представляющей собой диаграмму, на которой показано улучшение вязкости η в процентах в зависимости от содержания аскорбилфосфата магния после стерилизации паровым автоклавированием композиций, содержащих несшитую гиалуроновую кислоту и аскорбилфосфат магния.
[000237] Наблюдается сохранение вязкости в случае композиций по настоящему изобретению с содержанием аскорбилфосфата магния в интервале от 0,7 до 1 мг/г относительно сравнительной композиции.
Пример 12bis a)
[000238] Такое же испытание осуществляли с реологическим анализом показателя эластичности G'.
[000239] Семь композиций, содержащих несшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием в композиции в интервале от 0,3 до 1,25 мг/г, получали по методике, описанной в примере 1 (молекулярная масса гиалуроната натрия составляет около 2,7 МД).
[000240] Сравнительную композицию, содержащую несшитую гиалуроновую кислоту, получали по методике, описанной в примере 1. Водный раствор аскорбилфосфата магния, описанный в методике примера 1, заменяли эквивалентным количеством водного фосфатного буферного раствора.
[000241] Показатель эластичности G' испытуемых композиций определяли до и после стерилизации и рассчитывали степень улучшения показателя эластичности G' в процентах; полученные результаты представлены в таблице 3, приведенной далее.
|
[000242] Наблюдается улучшение эластичности в случае композиций по настоящему изобретению с содержанием аскорбилфосфата магния в интервале от 0,3 до 1 мг/г относительно сравнительной композиции, а также сохранение эластичности в случае содержания аскорбилфосфата магния, равного 1,25 мг/г.
Пример 12bis b)
[000243] Осуществляли испытание, идентичное описанному ранее испытанию 12bis a), с композициями, содержащими несшитый гиалуронат натрия с молекулярной массой около 1,4 МД, и реологический анализ показателя эластичности G'. Композиции получали по методике, описанной в примере 1, с заменой гиалуроната натрия с молекулярной массой 2,7 МД гиалуронатом натрия с молекулярной массой 1,4 МД.
[000244] Показатель эластичности G' испытуемых композиций определяли до и после стерилизации и рассчитывали степень улучшения показателя эластичности G' в процентах; полученные результаты представлены в таблице 4, приведенной далее.
|
[000245] Наблюдается улучшение эластичности в случае композиций по настоящему изобретению с содержанием аскорбилфосфата магния в интервале от 0,7 до 1 мг/г относительно сравнительной композиции, а также сохранение эластичности в случае содержания аскорбилфосфата магния, равного 3 мг/г.
Пример 13
[000246] Определение реологических характеристик композиций, содержащих сшитую гиалуроновую кислоту, аскорбилфосфат магния и дополнительный агент, до и после стерилизации паровым автоклавированием
[000247] Реологические характеристики композиций, содержащих сшитую гиалуроновую кислоту, аскорбилфосфат магния и дополнительный агент, определяли до и после стерилизации паровым автоклавированием и рассчитывали степень улучшения показателя эластичности G' в процентах по методике, описанной в примере 11.
[000248] Четыре композиции, содержащие сшитую гиалуроновую кислоту, аскорбилфосфат магния с содержанием 1 мг/г и дополнительный агент с содержанием 1 мг/г, получали по методике, описанной в примере 7. Дополнительные агенты, использованные в примерах, представляли собой маннит (MAN), сорбит (SOR), водорастворимую калиевую соль октасульфата сахарозы (KSOS) и гидрохлорид лидокаина (LIDO).
[000249] Композицию, содержащую сшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием 1 мг/г, получали по методике, описанной в примере 2.
[000250] Сравнительную композицию, содержащую сшитую гиалуроновую кислоту, получали по методике, описанной в примере 2. Водный раствор аскорбилфосфата магния заменяли эквивалентным количеством водного фосфатного буферного раствора.
[000251] Показатель эластичности испытуемых композиций определяли до и после стерилизации и рассчитывали степень улучшения показателя эластичности G' в процентах; полученные результаты представлены в таблице 5, приведенной далее.
|
[000252] Видно, что улучшение реологических характеристик, наблюдаемое в примере 11 в случае композиций, содержащих гиалуроновую кислоту и аскорбилфосфат магния, сохраняется в присутствии всех дополнительных агентов. Только лишь прибавление гидрохлорида лидокаина вызывает заметное уменьшение этого улучшения.
Пример 13bis
[000253] Определение реологических характеристик композиций, содержащих сшитую гиалуроновую кислоту, аскорбилфосфат магния и лидокаин с содержанием 3 мг/г, до и после стерилизации паровым автоклавированием
[000254] Показатель эластичности испытуемых композиций определяли до и после стерилизации и рассчитывали степень улучшения показателя эластичности G' в процентах; полученные результаты представлены в таблице 6, приведенной далее.
|
[000255] Видно, что только лишь прибавление лидокаина вызывает уменьшение показателя эластичности G' композиции после стерилизации. Прибавление MAP с содержанием 1 мг/г не позволяет нейтрализовать действие лидокаина на эластичность композиции. В противоположность этому, прибавление MAP с содержанием в интервале от 3 до 10 мг/г позволяет улучшить эластичность композиции в присутствии лидокаина. Эти результаты являются неожиданными и противоречат сведениям и эффектам, описанным на предшествующем уровне техники и, в частности, в WO 2012/104419, поданной на имя указанной ранее компании Q-MED.
Пример 14
[000256] Определение реологических характеристик композиций, содержащих несшитую гиалуроновую кислоту, аскорбилфосфат магния и дополнительный агент, до и после стерилизации паровым автоклавированием
[000257] Реологические характеристики композиций, содержащих несшитую гиалуроновую кислоту, аскорбилфосфат магния и дополнительный агент, определяли до и после стерилизации паровым автоклавированием и рассчитывали степень улучшения вязкости в процентах по методике, описанной в примере 12.
[000258] Три композиции, содержащие несшитую гиалуроновую кислоту, аскорбилфосфат магния с содержанием 1 мг/г и дополнительный агент с содержанием 1 мг/г, получали по методике, описанной в примере 6. Дополнительные агенты, использованные в примерах, представляли собой маннит (MAN), сорбит (SOR) и водорастворимую калиевую соль октасульфата сахарозы (KSOS).
[000259] Композицию, содержащую несшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием 1 мг/г, получали по методике, описанной в примере 1.
[000260] Сравнительную композицию, содержащую несшитую гиалуроновую кислоту, получали по методике, описанной в примере 1. Водный раствор аскорбилфосфата магния, описанный в методике примера 1, заменяли эквивалентным количеством водного фосфатного буферного раствора.
[000261] Вязкость испытуемых композиций определяли до и после стерилизации и рассчитывали степень улучшения вязкости в процентах; полученные результаты представлены в таблице 7, приведенной далее.
|
[000262] Наблюдается сохранение вязкости в случае всех композиций.
Пример 15
[000263] Определение реологических характеристик композиций, содержащих сшитую гиалуроновую кислоту, аскорбилфосфат магния и диметилсульфон (DMS), до и после стерилизации паровым автоклавированием
[000264] Реологические характеристики композиций, содержащих сшитую гиалуроновую кислоту, аскорбилфосфат магния и диметилсульфон (DMS), определяли до и после стерилизации паровым автоклавированием и рассчитывали степень улучшения показателя эластичности G' в процентах по методике, описанной в примере 11.
[000265] Две композиции, содержащие сшитую гиалуроновую кислоту, аскорбилфосфат магния с содержанием 1 мг/г и диметилсульфон с содержанием в интервале от 1 до 10 мг/г, получали по методике, описанной в примере 5.
[000266] Композицию, содержащую сшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием 1 мг/г, получали по методике, описанной в примере 2.
[000267] Сравнительную композицию, содержащую сшитую гиалуроновую кислоту, получали по методике, описанной в примере 2. Водный раствор аскорбилфосфата магния заменяли эквивалентным количеством водного фосфатного буферного раствора.
[000268] Показатель эластичности испытуемых композиций определяли до и после стерилизации и рассчитывали степень улучшения показателя эластичности G' в процентах; полученные результаты представлены в таблице 8, приведенной далее.
|
[000269] Видно, что улучшение реологических характеристик, наблюдаемое в примере 11 в случае композиций, содержащих гиалуроновую кислоту и аскорбилфосфат магния, сохраняется в присутствии DMS с содержанием в интервале от 1 до 10 мг/г.
Пример 16
[000270] Определение реологических характеристик композиций, содержащих несшитую гиалуроновую кислоту, аскорбилфосфат магния и диметилсульфон (DMS), до и после стерилизации паровым автоклавированием
[000271] Реологические характеристики композиций, содержащих несшитую гиалуроновую кислоту, аскорбилфосфат магния и диметилсульфон (DMS), определяли до и после стерилизации паровым автоклавированием и рассчитывали степень улучшения вязкости в процентах по методике, описанной в примере 12.
[000272] Композицию, содержащую несшитую гиалуроновую кислоту, аскорбилфосфат магния с содержанием 1 мг/г и диметилсульфон с содержанием 1 мг/г по настоящему изобретению, получали и стерилизовали по методике, описанной в примере 4, при этом реологические характеристики определяли согласно примеру 12.
[000273] Композицию, содержащую несшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием 1 мг/г, получали по методике, описанной в примере 1.
[000274] Сравнительную композицию, содержащую несшитую гиалуроновую кислоту, получали по методике, описанной в примере 1. Водный раствор аскорбилфосфата магния, описанный в методике примера 1, заменяли эквивалентным количеством водного фосфатного буферного раствора.
[000275] Вязкость испытуемых композиций определяли до и после стерилизации и рассчитывали степень улучшения вязкости в процентах; полученные результаты представлены в таблице 9, приведенной далее.
|
[000276] Наблюдается сохранение вязкости в случае композиции, содержащей несшитую гиалуроновую кислоту, аскорбилфосфат магния с содержанием 1 мг/г и диметилсульфон с содержанием 1 мг/г.
Пример 17
[000277] Сравнение с композициями, описанными на предшествующем уровне техники
[000278] В международной заявке WO 2011/086458, поданной на имя компании ALLERGAN, в примере 4 описана композиция, содержащая сшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием в интервале от 0,6 до 2 мас.% по отношению к общей массе композиции. По мнению патентообладателя, эти композиции не могут быть стабильными, поскольку значения Δtan δ при 1 Гц в случае указанных композиций превышают 0,1.
[000279] Значения Δtan δ при 1 Гц в случае композиций, содержащих сшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием 0,6 и 1% соответственно, не были определены.
[000280] Единственное определенное значение Δtan δ при 1 Гц в случае композиции, содержащей сшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием 2%, составило 0,344, что представляет собой значение, превышающее 0,1.
[000281] В WO 2011/086458 также указано, что чем больше содержание в композиции аскорбилфосфата магния, тем в большей степени значение Δtan δ при 1 Гц в случае указанной композиции имеет тенденцию уменьшаться и стремится приблизиться к значению 0,1.
[000282] Согласно ранее указанной заявке исследованные композиции характеризуются показателем Δtan δ при 1 Гц, представляющим собой разницу между tan δ при 1 Гц в случае испытуемой композиции и tan δ при 1 Гц в случае сравнительной композиции, причем tan δ при 1 Гц представляет собой отношение показателя эластичности G'' к показателю эластичности G'.
[000283] Значения Δtan δ при 1 Гц в случае испытуемых композиций относительно сравнительной композиции представлены в таблице 7, приведенной далее.
|
[000284] Видно, что значения Δtan δ при 1 Гц в случае композиций, содержащих сшитую гиалуроновую кислоту и аскорбилфосфат магния с содержанием в интервале от 0,3 до 20 мг/г, меньше 0,1.
[000285] Также можно видеть, что значения Δtan δ при 1 Гц в случае композиций, содержащих сшитую гиалуроновую кислоту и маннит с содержанием в интервале от 1 до 10 мг/г, меньше 0,1, а также меньше значений Δtan δ при 1 Гц в случае композиций, содержащих сшитую гиалуроновую кислоту и SAP с содержанием в интервале от 1 до 5 мг/г.
[000286] Таким образом, результаты, полученные в случае композиций, содержащих сшитую гиалуроновую кислоту и аскорбилфосфат магния в интервале от 0,3 до 20 мг/г, находятся в противоречии с результатами, приведенными в WO 2011/086458, поскольку значения содержания аскорбилфосфата магния в композициях по настоящему изобретению равны или меньше значений содержания, указанных в WO 2011/086458, а значения Δtan δ при 1 Гц в случае этих композиций меньше 0,1.
[000287] Такие же определения Δtan δ при 1 Гц были выполнены в случае композиций, содержащих сшитую гиалуроновую кислоту, аскорбилфосфат магния и дополнительный агент; полученные значения представлены в таблице 8, приведенной далее.
|
[000288] Так же, как и ранее, видно, что значения Δtan δ при 1 Гц после стерилизации паровым автоклавированием меньше 0,1.
[000289] Такие же определения Δtan δ при 1 Гц были выполнены в случае композиций, содержащих сшитую гиалуроновую кислоту, аскорбилфосфат магния и диметилсульфон (DMS); полученные значения представлены в таблице 9, приведенной далее.
|
[000290] В данном случае также можно видеть, что значения Δtan δ при 1 Гц меньше 0,1.