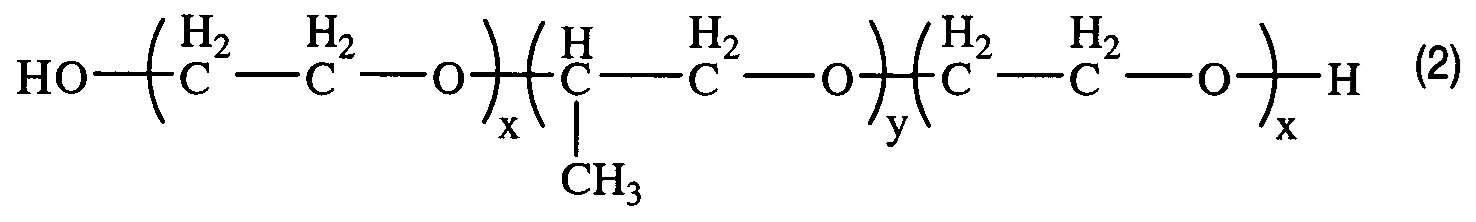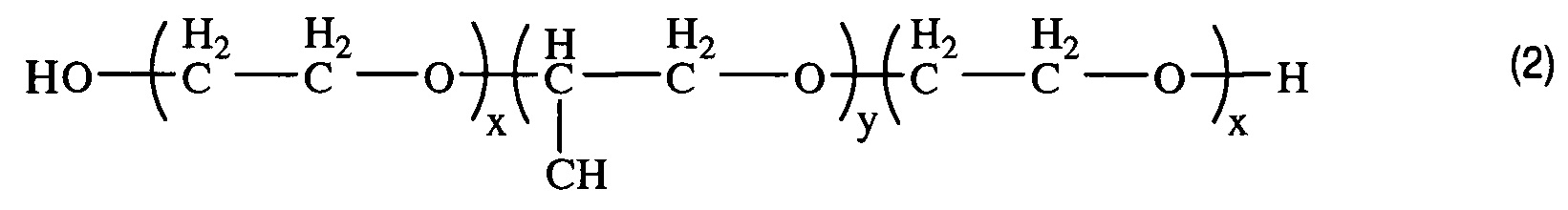Результат интеллектуальной деятельности: СРЕДСТВО ДЛЯ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ В КЛЕТКИ И ТКАНИ ОРГАНИЗМА И ЕГО ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Изобретение относится к области удовлетворения жизненных потребностей человека и может быть использовано для доставки биологически активных веществ (далее по тексту - БАВ), в том числе лекарственных средств (далее по тексту - ЛС), в клетки и ткани живого организма в медицине, ветеринарии, биологии, фармацевтике.
Известна лекарственная композиция US 6322805 [1], содержащая гидрофобное лекарственное вещество с носителем, представляющим собой полимерные мицеллы, которые состоят: (А) от 70 до 99,(9) процентов по массе из биоразлагаемых мицелл амфифильного блоксополимера структуры БА, АБА или БАБ, где Б-блок сополимера - гидрофильный полиалкиленоксидный компонент, А-блок - биоразлагаемый гидрофобный полимерный компонент из ряда: поли(молочная кислота), поли(гликолевая кислота), сополимер молочной и гликолевой кислот, поли(капролактон); амфифильный блоксополимер [1] имеет молекулярную массу в диапазоне от 1430 до 6000 дальтон; содержание в нем гидрофильного Б-компонента составляет от 50 до 70% от общей массы блоксополимера, и (Б) от 0,000001 до 30 процентов по массе - из гидрофобного ЛС, которое физически захвачено (инкапсулированного) внутри гидрофобного полимерного ядра мицеллярного носителя.
Существенным недостатком указанных носителей [1] является то, что они неприменимы для доставки гидрофильных ЛС в клетки и ткани организма, а для доставки гидрофобных ЛС их (ЛС) необходимо дополнительно инкапсулировать в полимерные мицеллы многоэтапным способом [1], что повышает трудоемкость процесса получения лекарственной композиции, расход реагентов и ограничивает область применения носителей [1]. Другим недостатком носителей [1] является отсутствие способности усиливать активность доставляемых ЛС в клетки и ткани организма, что также ограничивает область их (носителей) применения.
Известна композиция RU 2166934 [2], включающая противоопухолевое ЛС и полиэфирный блоксополимер, имеющий критическую концентрацию мицеллообразования (далее по тексту - ККМ) в диапазоне от 0,000001 до 0,5 процентов (масса/объем) при плюс 37°С в изотоническом водном растворе и способный образовывать жидкую композицию при смешении с водой. Указанный блоксополимер включает множество линейных полимерных сегментов, повторяющиеся единицы которых имеют молекулярные массы в диапазоне от 30 до 500 дальтон, в которых не менее 80 процентов связей, соединяющих повторяющиеся единицы каждого из полимерных сегментов, включают простую эфирную связь. Известен также способ лечения объекта, по которому объект обладает устойчивостью к ЛС, включающий обработку объекта композицией ЛС с полиэфирным блоксополимером [2]. Указанные полиэфирные блоксополимеры [2] известны также как триблоксополимеры этиленоксида (далее по тексту - ЭО) и пропиленоксида (далее по тексту - ПО) под маркой компании BASF Плуроники® (далее по тексту - плуроники). На основе плуроника L61 и плуроника F127 разработана содержащая доксорубицин противоопухолевая композиция SP1049C, применяемая для лечения резистентных опухолей желудочно-кишечного тракта (разработчик - компания Supratek Pharma Inc., www.supratek.com) [3].
Существенным недостатком полиэфирных блоксополимеров и содержащих их лекарственных композиций [2, 3] являются высокая токсичность для живых клеток и организмов используемых в изобретении [2, 3] гидрофобных плуроников вследствие их (плуроников) значительного мембраноповреждающего, цитотоксического и проапоптотического действия [4]. Недостаток ограничивает область применения [2, 3] в лекарственной терапии.
Наиболее близким к изобретению, прототипом [5] (Патент RU 2501570), является группа трифункциональных сополимеров ЭО и ПО для внутриклеточной доставки БАВ, например противоопухолевых ЛС. Указанный полимерный носитель для повышения накопления БАВ в живых клетках отличается тем, что он представляет собой сополимеры на основе глицерина, с числом мономерных единиц ЭО от 1 до 10, ПО от 1 до 30, и конъюгаты сополимеров с янтарной кислотой. Известна лекарственная композиция по прототипу [5], включающая указанный полимерный носитель и антрациклиновый антибиотик или указанный полимерный носитель и субстрат мембранных Р-гликопротеинов.
Существенным недостатком прототипа [5] является высокая склонность трифункциональных сополимеров к агрегации (слипанию) в физиологических условиях. Недостаток приводит к низкой (недостаточной) эффективной концентрации трифункциональных сополимеров в биологических жидкостях и их (сополимеров) биологической доступности, следствием чего является их (сополимеров) неудовлетворительная для лекарственной терапии способность доставлять БАВ в живые клетки и ткани. Трифункциональные сополимеры по прототипу [5] для доставки БАВ применимы на клеточном уровне, тогда как многие клинические случаи требуют преодоления неклеточных тканевых оболочек, например оболочек спинного мозга при локальной доставке БАВ. Недостаток существенно ограничивает область применения прототипа [5].
Целью изобретения является разработка средства для доставки БАВ в клетки и ткани организма на основе модифицированных блок-сополимеров ЭО и ПО, обладающего:
- пониженной склонностью к агрегации (слипанию) в физиологических условиях;
- более высокой способностью к доставке БАВ через мембрану внутрь клеток человека;
- более высокой способностью усиливать чувствительность клеток человека к действию ЛС, например опухолевых клеток к противоопухолевым ЛС;
- способностью преодолевать тканевые оболочки и повышать проницаемость тканей для БАВ, например тканей спинного мозга для модельного БАВ,
а также применение заявленного средства в композиции с БАВ, а именно:
- применение окисленных блок-сополимеров ЭО и ПО для усиления доставки БАВ в клетки человека и повышения чувствительности клеток к действию БАВ;
- применение окисленных блок-сополимеров ЭО и ПО для повышения проницаемости тканей организма для БАВ.
Цели достигают:
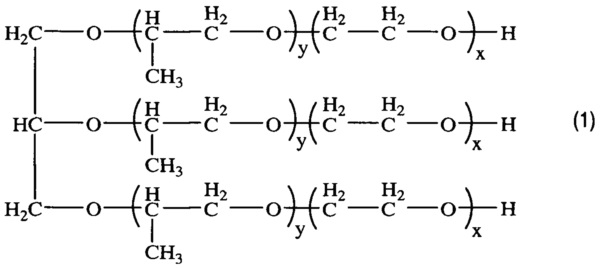
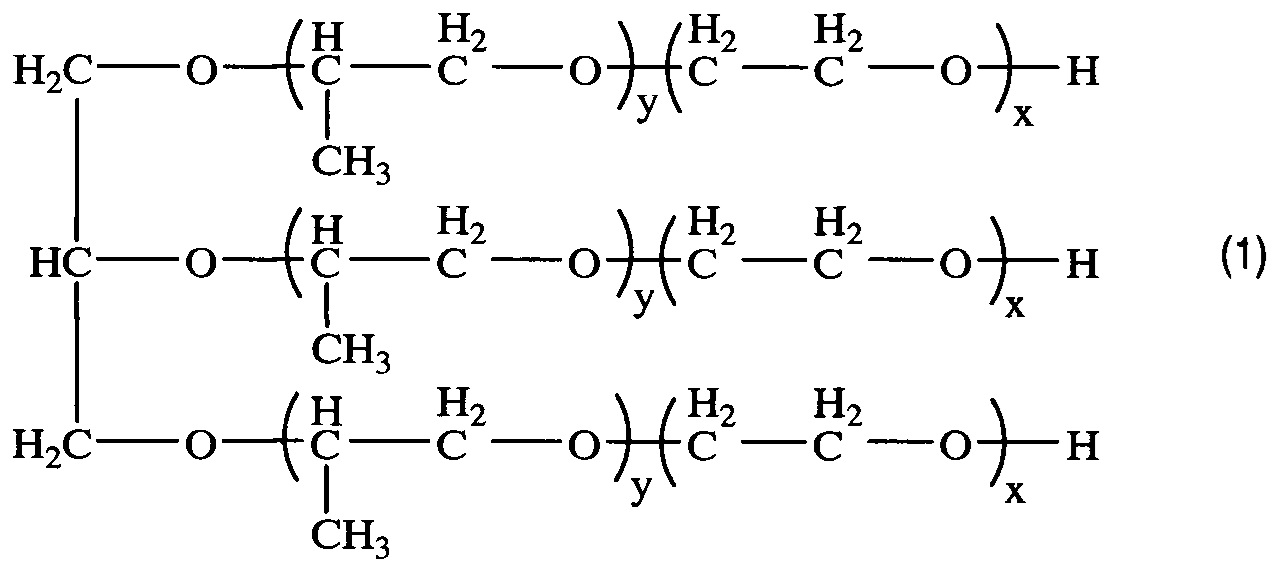
Получением средства для доставки биологически активных веществ в клетки и ткани организма путем окисления блок-сополимера со структурой (1)
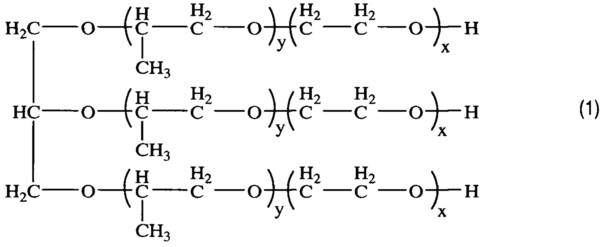 , где x=8,1; y=27,8,
, где x=8,1; y=27,8,
характеризующегося тем, что степень модификации концевых гидроксильных групп блок-сополимера в карбоксильные группы составляет 80%.
Получением средства для доставки биологически активных веществ в клетки и ткани организма путем окисления блок-сополимера со структурой (2)
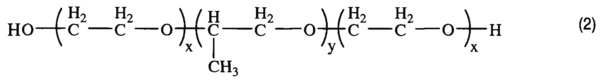 , где x=2,3; y=31,
, где x=2,3; y=31,
характеризующегося тем, что степень модификации концевых гидроксильных групп блок-сополимера в карбоксильные группы составляет 67%.
Применением указанных средств в композиции с активным веществом для усиления доставки активного вещества в клетки человека и повышения чувствительности клеток человека к действию активного вещества. Применением указанных средств в композиции с активным веществом для повышения проницаемости тканей организма для активного вещества.
Заявленное средство для доставки биологически активных веществ в клетки и ткани организма получают из используемых в качестве исходных полимеров простых полиэфиров - продуктов блок-сополимеризации ЭО и ПО с различной структурой.
Заявленное техническое решение поясняется следующими материалами - таблицей и фиг. 1-4. Комментарии к таблице и фиг. 1-4 - в тексте описания.
В таблице приведены характеристики заявленного средства - окисленных блок-сополимеров ЭО и ПО, показывающие, что блок-сополимеры ЭО и ПО с разной функциональностью (дву-, три-) и разной молекулярной массой могут быть модифицированы карбоксильной группой при окислении.
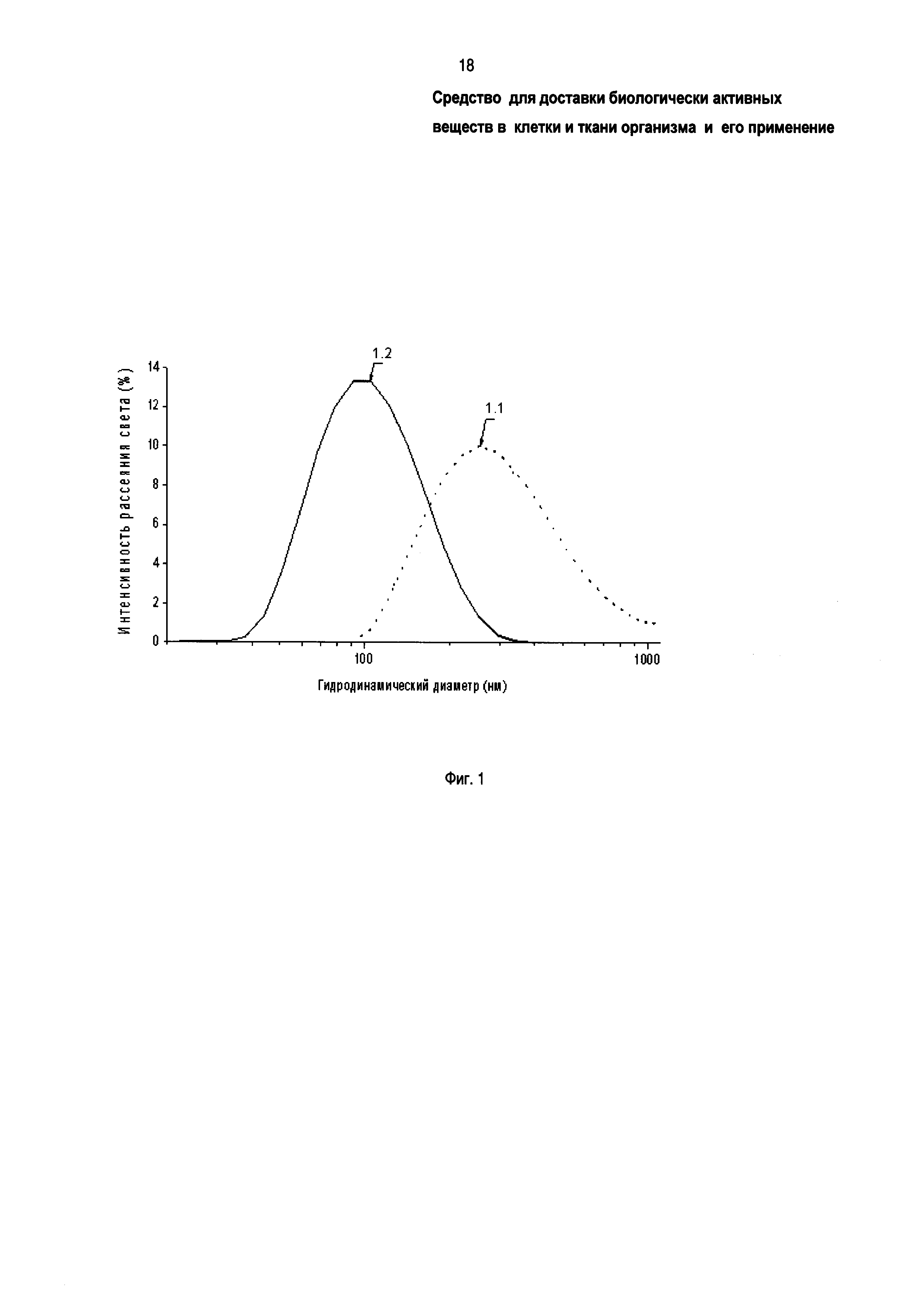
На фиг. 1 показано влияние окислительной модификации блок-сополимеров ЭО и ПО на их агрегацию в физиологических условиях по данным динамического рассеяния света. Показано распределение гидродинамического диаметра агрегатов блок-сополимеров ЭО и ПО в питательной среде DMEM при температуре плюс 37°С, концентрации сополимеров 2,0 мг/мл, где 1.1 - блок-сополимер Л6003 (прототип); 1.2 - заявленное средство, блок-сополимер Л6003-СООН. Окислительная модификация существенно понижает агрегационные свойства (размеры агрегатов) заявленных блок-сополимеров по сравнению с прототипом.
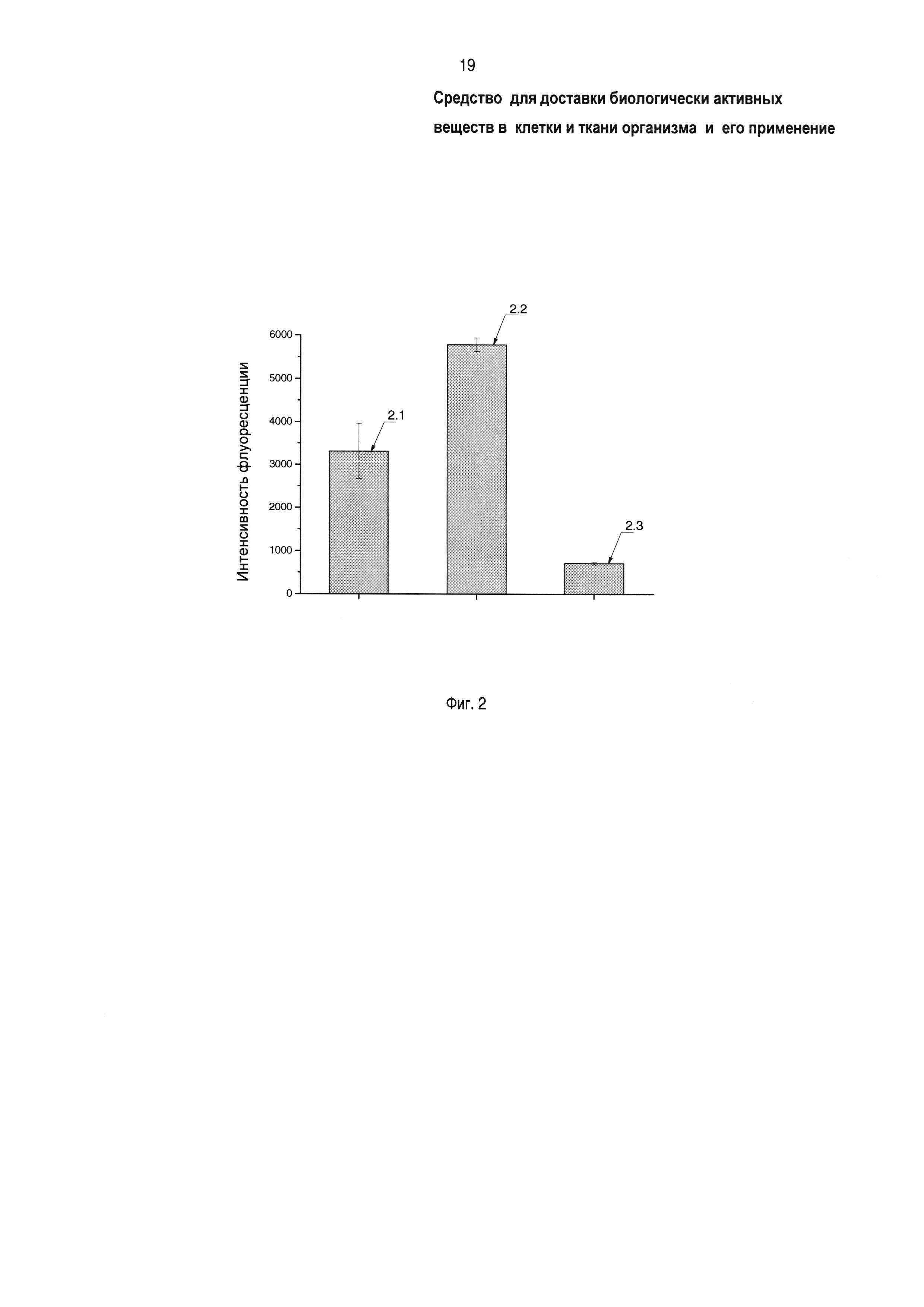
На фиг. 2 показано влияние заявленного средства доставки на проникновение модельного БАВ - родамина 123 - в клетки нейробластомы (линия SH-SY5Y), где 2.1 - интенсивность флуоресценции лизата клеток, обработанных композицией родамин 123 + прототип (блок-сополимер Л6003), 2.2 - интенсивность флуоресценции лизата клеток, обработанных композицией родамин 123 + заявленное средство (блок-сополимер Л6003-СООН), 2.3 - интенсивность флуоресценции лизата клеток, обработанных родамином 123 в отсутствие сополимеров. Заявленный окисленный блок-сополимер усиливает внутриклеточную доставку родамина 123 в 1,7 раза по сравнению с прототипом.
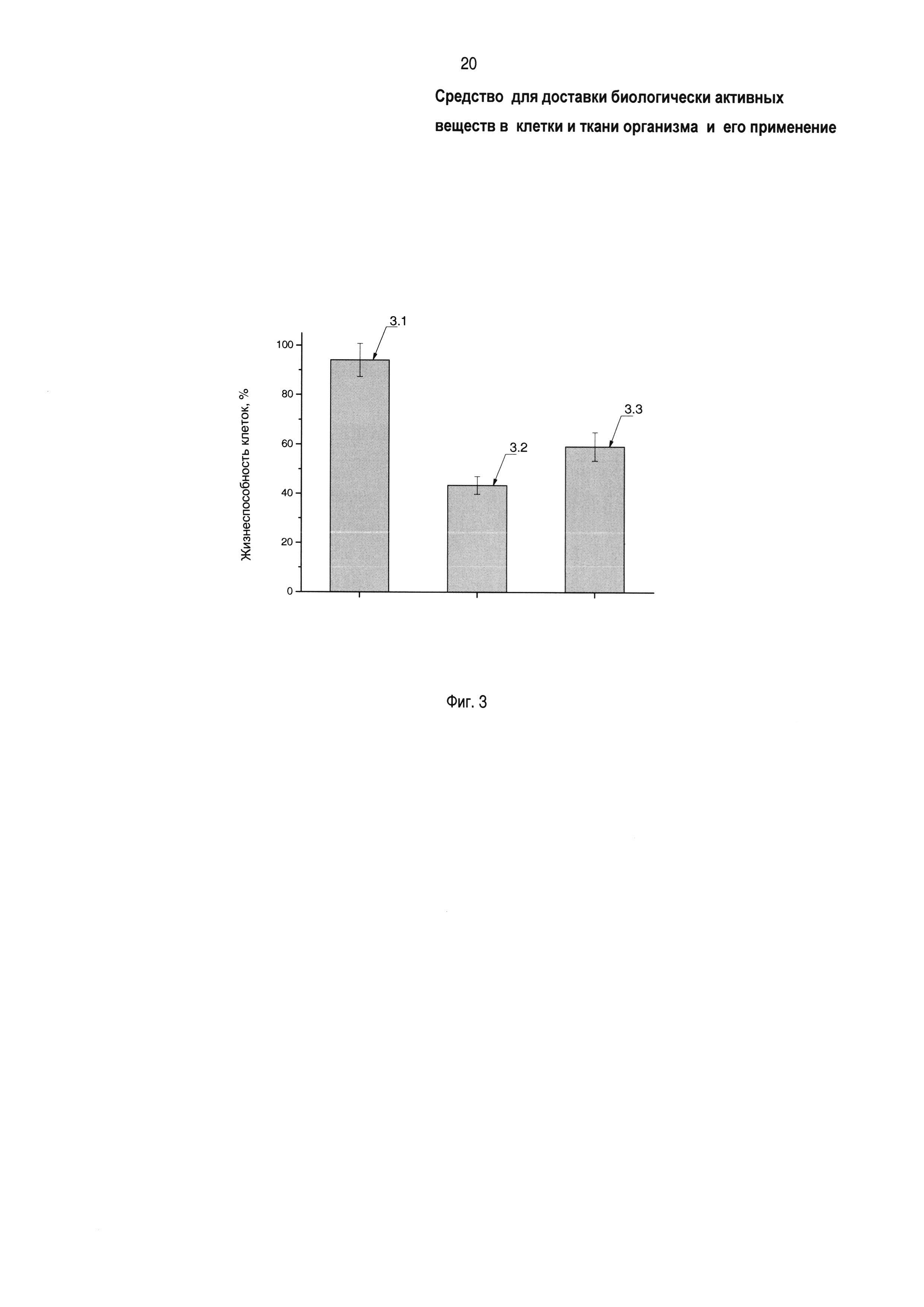
На фиг. 3 показано влияние лекарственных композиций на жизнеспособность опухолевых клеток (линия РСЗ) in vitro: 3.1 - доксорубицин (100 нМ) + прототип (блок-сополимер Л6003, 50 мкг/мл), 3.2 - доксорубицин (100 нМ) + заявленное средство (блок-сополимер Л6003-СООН, 50 мкг/мл), 3.3 - доксорубицин (100 нМ) в отсутствие сополимеров. Окисленный блок-сополимер повышает чувствительность опухолевых клеток к цитотоксическому действию доксорубицина более чем в 2 раза по сравнению с прототипом.
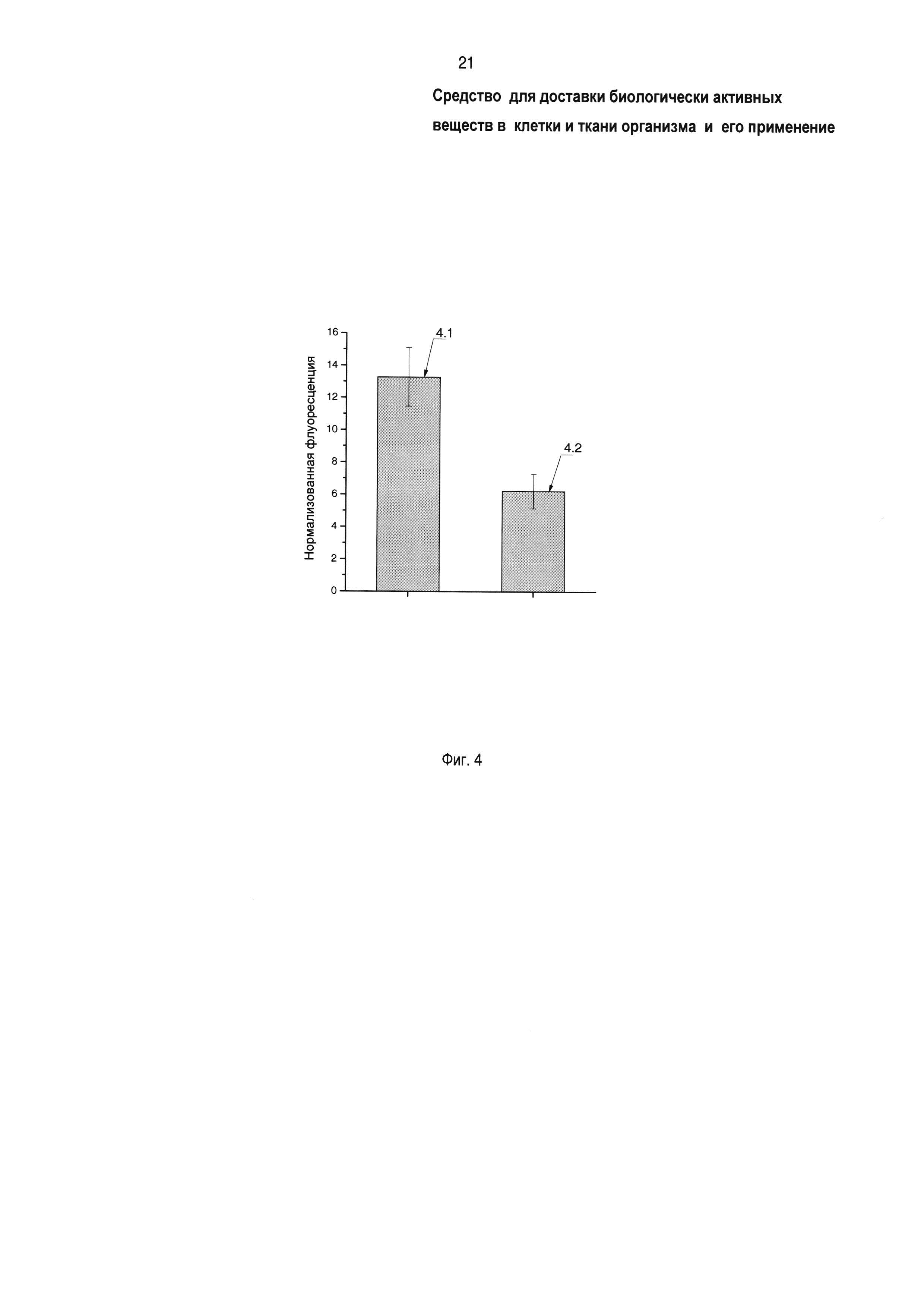
На фиг. 4 показано влияние заявленного средства доставки на проникновение родамина 123 из геля наружного применения в спинной мозг крысы по данным конфокальной микроскопии, где 4.1 - нормализованная интенсивность флуоресценции ткани спинного мозга, обработанного композицией родамин 123 + прототип (блок-сополимер Л6003-СООН), 4.2 - нормализованная интенсивность флуоресценции ткани спинного мозга, обработанного родамином 123 в отсутствие сополимеров. Заявленное средство усиливает доставку БАВ через оболочки спинного мозга в 2,25 раз.
Заявленное средство получают, например, следующими путями, известными и применяемыми ранее для модификации полиэтиленгликолей карбоксильной группой [6]. Величины выхода продуктов и степени их модификации по концевым группам приведены в таблице.
Пример 1, показывающий способ получения и характеристики средства доставки БАВ - окисленного трифункционального блок-сополимера ЭО и ПО.
В качестве исходного соединения для получения заявленного средства для доставки используют блоксополимер со структурой (1)
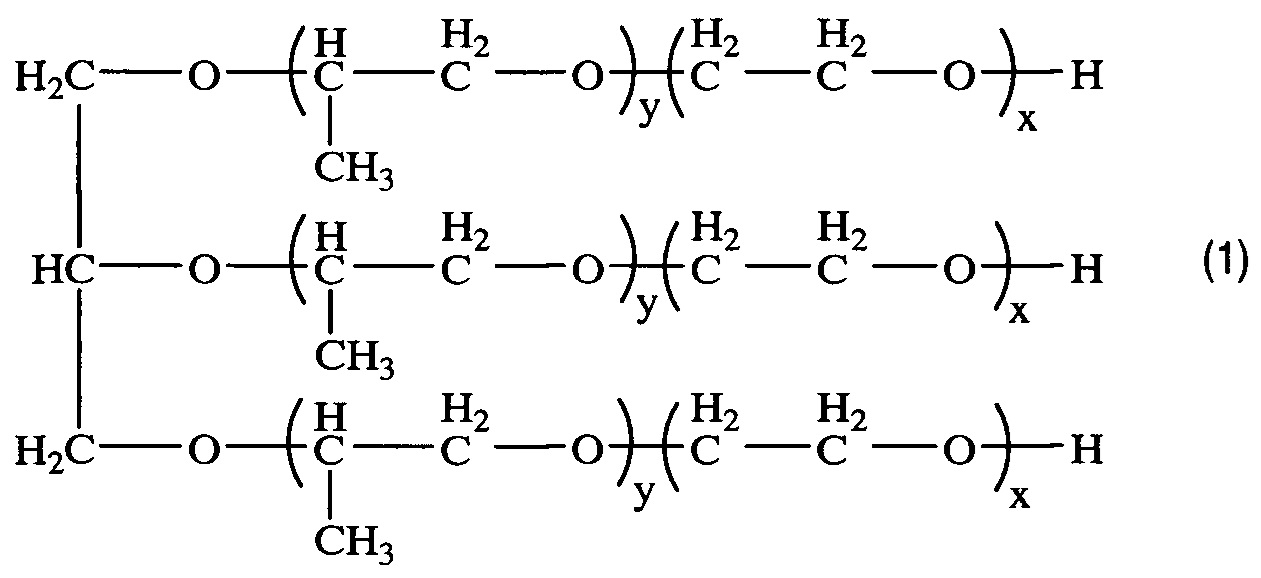
Изобретение реализуют, например, путем окисления типичного представителя трифункциональных блок-сополимеров ЭО и ПО - коммерческого блочного сополимера Лапрол® марки 6003-2Б-18 (далее по тексту - Л6003) с x=8,1; y=27,8.
Окисление блок-сополимера ЭО и ПО проводят, например, следующим путем.
Берут необходимые для получения конечного продукта реагенты - блок-сополимер Лапрол Л6003, оксид хрома (VI), серную кислоту, дистиллированную воду, дихлорметан, хлорид натрия, сульфат магния безводный. Готовят 25% раствор серной кислоты.
Готовят реакционную смесь, содержащую Лапрол Л6003, например, 15 г и оксид хрома (VI) (Acros Organics, США) 1,8 г, в 75 мл 25%-ного раствора серной кислоты. Происходит реакция окисления блок-сополимера. Смесь при постоянном перемешивании инкубируют в течение 24 ч при атмосферном давлении, комнатной температуре, например при плюс 22°С. Получают продукт реакции - окисленный блок-сополимер Лапрол Л6003 (далее по тексту - Л6003-СООН) в растворе серной кислоты с оксидом хрома. Продукт экстрагируют двукратным объемом дихлорметана, например, 3 раза. Растворенный в дихлорметане продукт промывают, например, двукратно дистиллированной водой в объеме 1/10 доли растворенного в дихлорметане продукта. Затем промытый водой продукт промывают, например, однократно насыщенным раствором хлорида натрия в объеме 1/10 доли ранее промытого водой продукта. Получают промытый в воде и растворе хлорида натрия экстракт окисленного блок-сополимера Л6003-СООН в дихлорметане. Далее экстракт блок-сополимера в дихлорметане при атмосферном давлении и комнатной температуре, например плюс 22°С, сушат над безводным сульфатом магния и выпаривают (растворитель дихлорметан) на ротационном испарителе, например, при 100 об/мин.
Получают продукт - маслообразное вязкое вещество с желтоватым оттенком, со слабовыраженным запахом. Присутствие карбоксильной группы в окисленных сополимерах подтверждено известными методами кислотно-основного титрования (ГОСТ 25210-82) и ИК-Фурье спектроскопии в режиме неполного внутреннего отражения на спектрометре Frontier (фирмы Perkin Elmer), по появлению специфической полосы спектра при волновом числе 1/λ=1735 см-1.
По данным кислотно-основного титрования получено значение степени модификации гидроксильных концевых групп в карбоксильные группы, равное 80% (таблица). Таким образом, полученный блок-сополимер является заявленным средством доставки БАВ в ткани и клетки живых организмов, полученным путем окисления блок-сополимера со структурой (1), где x=8,1; y=27,8, и характеризующимся тем, что степень модификации концевых гидроксильных групп блок-сополимера (1) в карбоксильные группы составляет 80%.
Пример 2, показывающий способ получения и характеристики средства доставки БАВ - окисленного двуфункционального блок-сополимера ЭО и ПО.
В качестве исходного соединения для получения заявленного средства доставки используют блок-сополимер со структурой (2)
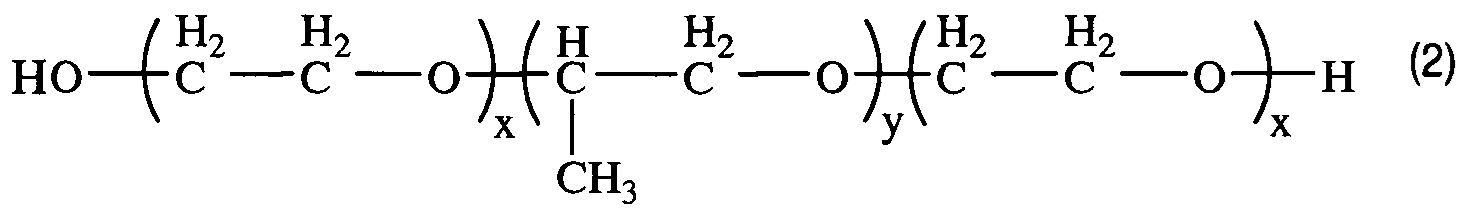
Изобретение реализуют, например, путем окисления типичного представителя двуфункциональных блок-сополимеров - плуроника L61 производства Sigma-Aldrich (США) с ЭО х=2,3, ПО у=31.
Окисление двуфункционального блок-сополимера, плуроника L61, выполняют аналогичным описанным в Примере 1 путем, но с иным соотношением реагентов.
Готовят реакционную смесь, содержащую блок-сополимер L61, например, 10 г, и оксид хрома (VI) 2,4 г, в 75 мл 25%-ном растворе серной кислоты. Последующие манипуляции до получения конечного продукта и подтверждения присутствия карбоксильной группы в составе блок-сополимера выполняют аналогичным описанным в Примере 1 путем.
По данным кислотно-основного титрования получено значение степени модификации гидроксильных концевых групп в карбоксильные группы, равное 67% (таблица). Таким образом, полученный блок-сополимер является заявленным средством доставки БАВ в ткани и клетки живых организмов, полученным путем окисления блок-сополимера со структурой (2), где x=2,3; y=31, и характеризующимся тем, что степень модификации концевых гидроксильных групп блок-сополимера (2) в карбоксильные группы составляет 67%.
Окислительная модификация по изобретению позволяет ввести концевую карбоксильную группу в молекулу сополимера ЭО и ПО напрямую - без введения промежуточного алкильного компонента как при конъюгации блок-сополимеров ЭО и ПО по прототипу [5]. Прямое введение концевой карбоксильной группы предотвращает нежелательное увеличение молекулярной массы носителя и усиление агрегационных (мицеллообразующих) свойств модифицированных сополимеров ЭО и ПО. Повышение молекулярной массы носителя и его склонности к агрегации приводят к увеличению размеров частиц носителя и снижают его проникающую способность в живые клетки и ткани. Карбоксильная группа в заявленных окисленных блок-сополимерах ЭО и ПО не подвержена разрушению, устойчива к ферментативному и неферментативному отщеплению по сравнению с остатком янтарной кислоты по прототипу, присоединяемому к сополимеру лабильной сложноэфирной связью. Указанные преимущества существенно расширяют по сравнению с прототипом область применения заявленного средства доставки БАВ.
Пример 3, показывающий понижение агрегации окисленного трифункционального блок-сополимера ЭО и ПО в растворе.
Способность полимерного носителя повышать проницаемость биологических барьеров для БАВ зависит от размера мицелл (агрегатов молекул), образованных молекулами носителя. Размер мицелл, в свою очередь, определяется степенью агрегации молекул. Размеры агрегатов блок-сополимеров определяют, например, методом динамического рассеяния света (далее по тексту - ДРС) на анализаторе Zetasizer Nano ZS (Malvern Instruments, Великобритания). Регистрируют гидродинамический диаметр и индекс полидисперсности в модифицированной Дюльбекко среде Игла для культивирования клеток (далее по тексту - питательной среде DMEM [7]), содержащей 5% эмбриональную телячью сыворотку (далее по тексту - ЭТС), при температуре плюс 37°С,что соответствует физиологическим условиям. Измерения проводят в трех повторностях. При одинаковых условиях опыта также руководствуются правилом: чем больше размер агрегатов, тем менее прозрачен (более мутный) исследуемый раствор.
На фиг. 1 показано влияние окислительной модификации трифункциональных блок-сополимеров ЭО и ПО на их агрегацию в физиологических условиях. Показано распределение гидродинамического диаметра агрегатов в питательной среде DMEM при температуре плюс 37°С, где 1.1 - блок-сополимер Л6003 (прототип); 1.2 - заявленное средство, блок-сополимер Л6003-СООН; концентрации блок-сополимеров 2,0 мг/мл.
Окисленные трифункциональные блок-сополимеры ЭО и ПО (Л6003-СООН) в среде DMEM с ЭТС образуют агрегаты, имеющие существенно меньшие (до 10-крат) гидродинамический диаметр и полидисперсность по сравнению с исходными немодифицированными сополимерами в тех же условиях. При визуальном анализе, в равных условиях заявленное средство (Л6003-СООН) образует раствор, существенно более прозрачный (менее мутный), чем прототип (Л6003). То есть заявленное средство менее склонно к переходу в нерастворимую форму (микрофазу), чем прототип. Наблюдаемые различия заявленного средства доставки (модифицированного окислением блок-сополимера) и исходного (немодифицированного) блок-сополимера ЭО и ПО обусловлены наличием анионной карбоксильной группы, вводимой в блок-сополимер посредством предлагаемой модификации по Примеру 1.
Пример 3 показывает, что заявленное средство доставки характеризуется меньшей степенью агрегации и большей устойчивостью в физиологических условиях (в растворе) по сравнению с прототипом [5]. Благодаря этому заявленное средство доставки БАВ имеет более высокую эффективную концентрацию в растворе, например, в форме наноразмерных мицелл, которые в отличие от микрофазы доступны для взаимодействия с клетками и тканями, что характеризует его (заявленное средство) как более эффективное по сравнению с прототипом средство доставки БАВ. По данным ДРС заявленное средство (окисленные блок-сополимеры ЭО и ПО) образует значительно более однородную систему агрегатов (частиц) по сравнению с исходными сополимерами со средним размером около 100 нм и близким к 0,1 индексом полидисперсности (фиг. 1). Повышенная по сравнению с прототипом однородность агрегатов (частиц) является важным преимуществом заявленного средства доставки БАВ.
Пример 4, показывающий понижение агрегации окисленного двуфункционального блок-сополимера ЭО и ПО в растворе.
Выполняют действия, аналогичные описанным в Примере 3.
Размеры агрегатов блок-сополимеров определяют, например, методом ДРС на анализаторе Zetasizer Nano ZS (Malvern Instruments, Великобритания). Регистрируют гидродинамический диаметр и индекс полидисперсности в питательной среде DMEM [7], содержащей 5% ЭТС, при температуре плюс 37°С, что соответствует физиологическим условиям. Измерения проводят в трех повторностях. При одинаковых условиях опыта также руководствуются правилом: чем больше размер агрегатов, тем менее прозрачен (более мутный) исследуемый раствор.
Окисленный блок-сополимер ЭО и ПО, например L61-COOH, в питательной среде DMEM образует агрегаты, имеющие значительно меньшие гидродинамический диаметр (более чем в 3 раза) и полидисперсность по сравнению с исходным немодифицированным блок-сополимером (плуроник L61) в тех же условиях, аналогично Примеру 3.
Пример 5, показывающий применение заявленного средства по Примеру 1 для усиления доставки активного вещества в клетки человека.
В качестве модельного объекта для доставки БАВ используют, например, клетки нейробластомы человека (линия SH-SY5Y от компании АТСС, США).
Клетки нейробластомы SH-SY5Y культивируют в стандартных стерильных условиях: питательная среда DMEM [7], 10% ЭТС, 5% СО2, температура плюс 37°С. Получают суспензию клеток SH-SY5Y в фосфатно-солевом буферном растворе (далее по тексту - ФСБ) плотностью 1,5⋅106 клеток/мл. В суспензию клеток SH-SY5Y добавляют заявленное средство доставки, например - Л6003-СООН, в конечной концентрации 1,0 мг/мл, суспензию перемешивают и инкубируют 15 мин в ФСБ при плюс 37°С. Далее в суспензию клеток SH-SY5Y добавляют родамин 123 (Sigma-Aldrich, США) с молекулярной массой 380,8 дальтон в концентрации 5 мкМ в качестве модельного БАВ [4] и инкубируют 30 мин при температуре плюс 37°С.
Обработанные композицией блок-сополимера и родамина 123 клетки нейробластомы SH-SY5Y отмывают в ФСБ и лизируют в 0,1% детергенте Тритон Х100 в деионизованной воде. Детектируют флуоресценцию родамина 123 в клеточном лизате в 96-луночном планшете на микропланшетном анализаторе Infinite М200 PRO (Tecan, Швейцария) при длине волны (λ) λэкситации=480 нм и λэмиссии=530 нм.
На фиг. 2 показано влияние заявленного средства доставки на проникновение родамина 123 в клетки нейробластомы SH-SY5Y, где 2.1 - интенсивность флуоресценции лизата клеток, обработанных композицией родамин 123 + прототип (блок-сополимер Л6003), 2.2 - интенсивность флуоресценции лизата клеток, обработанных композицией родамин 123 + заявленное средство (блок-сополимер Л6003-СООН), 2.3 - интенсивность флуоресценции лизата клеток, обработанных родамином 123 в отсутствие блок-сополимеров. Интенсивность флуоресценции 2.2 в 1,7 раза больше интенсивности флуоресценции 2.1 и в 8 раз больше флуоресценции 2.3. Таким образом, заявленное средство доставки существенно (в 8 раз) повышает результативность доставки родамина 123 в клетки нейробластомы SH-SY5Y и в 1,7 раза результативней прототипа в равных условиях.
Пример 6, показывающий применение заявленного средства по Примеру 2 для усиления доставки активного вещества в клетки человека.
Выполняют аналогичные описанным в Примере 5 действия.
В качестве модельного объекта для доставки БАВ используют, например - клетки нейробластомы человека (линия SH-SY5Y от компании АТСС, США).
Клетки нейробластомы SH-SY5Y культивируют в стандартных стерильных условиях: питательная среда DMEM [7], 10% ЭТС, 5% СО2, температура плюс 37°С. Получают суспензию клеток SH-SY5Y в фосфатно-солевом буферном растворе (далее по тексту - ФСБ) плотностью 1,5⋅106 клеток/мл. В суспензию клеток SH-SY5Y добавляют заявленное средство доставки, например L61-COOH, в конечной концентрации 1,0 мг/мл, суспензию перемешивают и инкубируют 15 мин в ФСБ при плюс 37°С. Далее в суспензию клеток SH-SY5Y добавляют родамин 123 (Sigma-Aldrich, США) с молекулярной массой 380,8 дальтон в концентрации 5 мкМ в качестве модельного БАВ [4] и инкубируют 30 мин при температуре плюс 37°С.
Обработанные композицией блок-сополимера и родамина 123 клетки нейробластомы SH-SY5Y отмывают в ФСБ и лизируют в 0,1% детергенте Тритон Х100 в деионизованной воде. Детектируют флуоресценцию родамина 123 в клеточном лизате в 96-луночном планшете на микропланшетном анализаторе Infinite М200 PRO (Tecan, Швейцария) при длине волны (λ) λэкситации=480 нм и λэмиссии=530 нм.
Результаты интенсивности флуоресценции лиазата клеток аналогичны показанным на фиг. 2 - флуоресценция лизата клеток с заявленным средством доставки (окисленным блок-сополимером L61-СООН) до 60 процентов интенсивнее флуоресценции лизата с исходным (немодифицированным) плуроником L61. Таким образом, заявленное средство доставки более существенно повышает результативность доставки родамина 123 в клетки нейробластомы SH-SY5Y по сравнению с прототипом в равных условиях.
Пример 7, показывающий применение заявленного средства по Примеру 1 для повышения чувствительности клеток человека к действию активного вещества.
Действие заявленного средства испытывают на клетках опухоли простаты человека (линия РС3 от компании АТСС, США). Клетки культивируют в условиях по Примеру 5. Клетки рассеивают в 96-луночные планшеты и культивируют 3-е суток с добавлением аликвоты известного противоопухолевого ЛС - доксорубицина (ЗАО «Брынцалов-А», Россия) в конечной концентрации 100 нМ и композиции доксорубицина с заявленным средством доставки, например Л6003-СООН, в конечной концентрации 50 мкг/мл (нетоксичной для клеток). Жизнеспособность клеток определяют с помощью стандартного МТТ-теста [8] по величине оптического сигнала продукта восстановления реагента МТТ (Promega, США) и выражают в процентах от контроля (необработанные клетки).
На фиг. 3 показано влияние лекарственных композиций на жизнеспособность опухолевых клеток (линия РС3) in vitro: 3.1 - доксорубицин (100 нМ) + прототип (блок-сополимер Л6003, 50 мкг/мл) в физиологическом растворе, 3.2 - доксорубицин (100 нМ) + заявленное средство (блок-сополимер Л6003-СООН, 50 мкг/мл) в физиологическом растворе, 3.3 - доксорубицин (100 нМ) в физиологическом растворе (без блок-сополимеров). Жизнеспособность опухолевых клеток РСЗ составляет: при использовании композиции 3.1 (прототип + доксорубицин) около 95 процентов, доксорубицина без блок-сополимеров 3.3 - около 60 процентов, композиции 3.2 (заявленное средство + доксорубицин) - около 43 процентов. Наблюдаемое понижение жизнеспособности клеток РС3 доказывает повышенную, по сравнению с контролем и композицией 3.1 (прототип + доксорубицин), цитотоксичность композиции 3.2 (заявленное средство + доксорубицин) для опухолевых клеток.
Таким образом, заявленное средство (окисленный блок-сополимер Л6003-СООН) повышает чувствительность опухолевых клеток к противоопухолевому ЛС и, следовательно, повышает результативность противоопухолевой терапии. В тех же условиях исходный немодифицированный блок-сополимер Л6003 (прототип [5]) не повышает противоопухолевый эффект 100 нМ доксорубицина, а напротив, понижает этот эффект почти до уровня, соответствующего жизнеспособности необработанных клеток РС3 (100%). То есть исходный блок-сополимер Л6003 (прототип [5]) способен приводить к нежелательному результату - понижению чувствительности опухолевых клеток к действию противоопухолевых ЛС.
Сравнительное испытание заявленного средства с прототипом доказывает преимущество заявленных окисленных блок-сополимеров ЭО и ПО в качестве средства доставки, повышающего чувствительность клеток человека к действию ЛС.
Пример 8, показывающий применение заявленного средства по Примеру 2 для повышения чувствительности клеток человека к действию активного вещества.
Действие заявленного средства испытывают на клетках опухоли простаты человека (линия РСЗ от компании АТСС, США). Клетки культивируют в условиях по Примеру 5. Клетки рассеивают в 96-луночные планшеты и культивируют 3-е суток с добавлением аликвоты известного противоопухолевого ЛС - доксорубицина (ЗАО «Брынцалов-А», Россия) в конечной концентрации 100 нМ и композиции доксорубицина с заявленным средством доставки, например Л6003-СООН, в конечной концентрации 50 мкг/мл. Жизнеспособность клеток определяют с помощью стандартного МТТ-теста [8] по величине оптического сигнала продукта восстановления реагента МТТ (Promega, США) и выражают в процентах от контроля (необработанные клетки).
Результаты действия заявленного средства доставки - окисленного блок-сополимера L61-COOH - в отношении опухолевых клеток РС3 подобны описанным в Примере 7. Заявленное средство повышает чувствительность опухолевых клеток к доксорубицину более результативно по сравнению с исходным плуроником L61.
Пример 9, показывающий применение заявленного средства по Примеру 1 для повышения проницаемости тканей организма для активного вещества.
Готовят образцы водных гелей для наружного применения, например, на основе полиакриловой кислоты (Carbopol 934 Serva, Германия), следующих составов:
1) полиакриловая кислота - 2,0% (по массе), родамин 123 - 50 мкМ, pH 7,0 (контроль - без заявленного средства);
2) полиакриловая кислота - 2,0% (по массе), родамин 123 - 50 мкМ, заявленное средство - окисленный блок-сополимер Л6003-СООН - 5,0 мг/мл, pH 7,0 (опыт - с заявленным средством).
Для исследования используют 8 самцов крыс линии Вистар массой от 250 до 400 г (по 4 животных на группу). Исследования проводят в соответствии с действующими правилами по работе с экспериментальными животными [9]. На всех крысах проводят хирургическую операцию в асептических условиях с использованием ингаляционного наркоза (изофлуран). Проводят ламинектомию позвоночного сегмента Th13 и удаляют твердую мозговую оболочку, оголяют спинной мозг в области сегмента, создают открытый доступ к тканевой оболочке спинного мозга. Аликвоту геля (100 мкл на сегмент) наносят на открытую поверхность оболочки спинного мозга, выдерживают 2 ч, далее обработанный сегмент спинного мозга промывают ФСБ. Животных дополнительно наркотизируют путем внутрибрюшинной инъекции хлоралгидрата (Acros Organics, США) в дозе 300 мг/кг и подвергают стандартной перфузии раствором 4% формалина в ФСБ. Обработанные сегменты спинного мозга вырезают, фиксируют раствором 4,0% n-формальдегида + 0,1% глутарового альдегида (Acros Organics, США) в ФСБ, замораживают в жидком азоте для получения срезов. Поперечные срезы спинного мозга толщиной 20 мкм получают с использованием микротома/криостата Microm НМ 560 (Thermo Scientific, США) и переносят на предметные стекла. Ядра клеток окрашивают кратковременным выдерживанием срезов спинного мозга с раствором интеркалирующего красителя DAPI - 4',6-диамидино-2-фенилиндола (Sigma-Aldrich, США).
Окрашенные срезы спинного мозга после контакта с гелями, содержащими родамин 123 (контроль) и композицию родамина 123 с окисленным блок-сополимером Л6003-СООН (опыт), анализируют методом лазерной сканирующей конфокальной микроскопии на микроскопе Zeiss LSM 780 (Carl Zeiss, Германия) с использованием аргонового лазера и 5-кратного воздушного объектива.
Количество проникшего через оболочку в ткани спинного мозга родамина 123 оценивают по конфокальным микрофотографиям с помощью программного обеспечения Image J (Национальный институт здоровья, США) путем определения параметра интегрированной плотности (флуоресценции родамина 123) в одной четверти спинного мозга в пересчете на единицу площади (мкм2). Анализируют не менее 6-ти микрофотографий спинного мозга для каждой группы. Значения представляют в виде среднего ± стандартной ошибки. На фиг. 4 показано влияние заявленного средства доставки на проникновение родамина 123 из геля наружного применения в спинной мозг крысы, где 4.1 - нормализованная интенсивность флуоресценции ткани спинного мозга, обработанного композицией родамин 123 + заявленное средство (блок-сополимер Л6003-СООН), 4.2 - нормализованная интенсивность флуоресценции ткани спинного мозга, обработанного родамином 123 в отсутствие блок-сополимера.
Фиг. 4 показывает, что интенсивность флуоресценции обработанной родамином 123 ткани спинного мозга 4.2 (контроль) составляет 6 отн. единиц, интенсивность флуоресценции обработанной композицией заявленного средства (Л6003-СООН) с родамином 123 ткани спинного мозга 4.1 (опыт) составляет 13,5 отн. единиц. Таким образом, заявленное средство в составе геля для наружного применения повышает интенсивность флуоресценции родамина 123 в тканях спинного мозга в 2,25 раза, что свидетельствует о повышении количества проникнувшего в ткани спинного мозга флуоресцентного красителя - модельного ЛС, по-видимому, за счет повышения проницаемости мозговых оболочек, например паутинной и мягкой оболочек, для БАВ.
Это доказывает возможность применения заявленного средства для локальной доставки БАВ в ткани спинного мозга в отличие от прототипа [5].
Пример 10, показывающий применение заявленного средства по Примеру 2 для повышения проницаемости тканей организма для активного вещества.
Выполняют аналогичные описанным в Примере 9 действия, применив в качестве заявленного средства окисленный двуфункциональный блок-сополимер L61-COOH.
Готовят образцы водных гелей для наружного применения, например, на основе полиакриловой кислоты (Carbopol 934 Serva, Германия), следующих составов:
1) полиакриловая кислота - 2,0% (по массе), родамин 123 - 50 мкМ, pH 7,0 (контроль - без заявленного средства);
2) полиакриловая кислота - 2,0% (по массе), родамин 123 - 50 мкМ, заявленное средство - окисленный блок-сополимер L61-COOH - 5,0 мг/мл, pH 7,0 (опыт - с заявленным средством).
Дальнейшие действия по хирургии и использованию заявленного средства доставки аналогичны Примеру 9. Влияние L61-COOH на проникновение родамина 123 в ткани спинного мозга аналогичны Примеру 9. Результаты доказывают возможность применения заявленного средства для локальной доставки БАВ в ткани спинного мозга в отличие от прототипа [5].
В совокупности Примеры 5-10 доказывают более результативную способность заявленного средства - окисленных дву- и трифункциональных блок-сополимеров ЭО и ПО - усиливать доставку БАВ через мембрану клеток человека (Примеры 5 и 6), тканевые оболочки (Примеры 9 и 10) и повышать чувствительность клеток человека к ЛС (Примеры 7 и 8) по сравнению с прототипом - неокисленными трифункциональными трифункциональными блок-сополимерами ЭО и ПО [5]. Повышенная результативность заявленного средства как носителя БАВ обусловлена влиянием образующейся при окислительной модификации блок-сополимеров карбоксильной группы, наличие которой существенно понижает агрегационные свойства блок-сополимеров в физиологических условиях, уменьшает размер агрегатов и, следовательно, повышает эффективную концентрацию блок-сополимеров и их биологическую доступность.
Таким образом, заявленное техническое решение достигает следующие поставленные цели.
Получено новое средство для доставки биологически активных веществ в клетки и ткани организма, представляющее собой двуфункциональные и трифункциональные окисленные блок-сополимеры ЭО и ПО и по сравнению с прототипом обладающее:
- пониженной склонностью к агрегации (слипанию) в физиологических условиях;
- более высокой (в 1,7 раз) способностью к доставке БАВ через мембрану внутрь клеток человека;
- более высокой способностью усиливать чувствительность клеток человека к действию ЛС, например - опухолевых клеток к противоопухолевым ЛС (в 2,2 раза);
- способностью преодолевать тканевые оболочки и повышать проницаемость тканей для БАВ, например тканей спинного мозга для модельного БАВ (в 2,25 раз).
Показано применение заявленного средства в композиции с БАВ, а именно:
- применение окисленных блок-сополимеров ЭО и ПО для усиления доставки БАВ в клетки человека и повышения чувствительности клеток к действию БАВ;
- применение окисленных блок-сополимеров ЭО и ПО для повышения проницаемости тканей организма для БАВ;
Изобретение может быть использовано в области медицины, ветеринарии, биологии и фармацевтики.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, так как при анализе идентифицированных источников информации не выявлены иные химически модифицированные блок-сополимеры ЭО и ПО с признаками, совпадающими с отличительными признаками изобретения.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, поскольку не выявлены технические решения, имеющие признаки, совпадающие с существенными отличительными признаками изобретения, и не установлена известность влияния отличительных признаков на указанный технический результат.
Заявленное техническое решение соответствует критерию «промышленная применимость», предъявляемому к изобретениям, поскольку его можно реализовать в промышленном производстве (с использованием продуктов крупнотоннажных химических производств) и применять в деятельности организаций здравоохранения посредством использования известных стандартных технических устройств и оборудования.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Патент US 6322805 В1, МПК A61K 47/34, A61K 9/107. Biodegradable polymeric micelle-type drug composition and method for the preparation thereof / S.-C. Kim, E.-O. Chang, I.-S. Song, C.-M. Pai, Samyang Corporation. Опубликован 27.11.2001. Описание патента.
2. Патент RU 2166934, МПК7 А61Р 35/00, A61K 9/107, A61K 47/34. Композиции, включающие биологический агент / А.В. Кабанов, В.Ю. Алахов, П.Г. Свешников, Е.С. Северин, Супратек Фарма, Инк. Приоритет от 07.06.1996. Опубликован 20.05.2001. Описание патента.
3. Valle J.W. A phase 2 study of SP1049C, doxorubicin in P-glycoprotein-targeting pluronics, in patients with advanced adenocarcinoma of the esophagus and gastroesophageal junction / J.W. Valle, A. Armstrong, C. Newman, V. Alakhov, G. Pietrzynski, J. Brewer, S. Campbell, P. Corrie, E.K. Rowinsky, M. Ranson // Investigational new drugs. 2011, Vol. 29 (5), P. 1029-1037.
4. Bondar O.V. Lipid-like trifunctional block copolymers of ethylene oxide and propylene oxide: Effective and cytocompatible modulators of intracellular drug delivery / O.V. Bondar, Y.V. Badeev, Y.G. Shtyrlin, T.I. Abdullin // International Journal of Pharmaceutics. 2014, Vol. 461, P. 97-104.
5. Патент RU 2501570, МПК (2006.01) A61K 47/34, A61K 31/704. Трехфункциональные блоксополимеры этиленоксида и пропиленоксида для доставки активных веществ в живые клетки / Штырлин Ю.Г., Абдуллин Т.И., Бондарь О.В., Сагитова А.В., Бадеев Ю.В. Приоритет от 11.05.2012. Опубликован 20.12.2013. Описание патента.
6. A. Fishman, A. Acton, E.L. Ruff, A simple preparation of PEG-carboxylates by direct oxidation, Synth. Commun. 34 (2004) 2309-231.
7. Фрешни Р.Я. Культура животных клеток [пер. с англ.] / Р.Я. Фрешни. - Москва: Бином. Лаборатория знаний, 2010. - 691 с. - перевод изд: Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications / R. Ian Fresney. / Wiley-Blackwell. 2005.
8. Техническое руководство по использованию продуктов G4000 AND G4100. Компания Promega. www.promega.com
9. «Правила проведения работ с использованием экспериментальных животных». Утверждены Приказом Минвуза России №742 от 13.11.1984.

* Степень перевода концевых гидроксильных групп в карбоксильные группы по данным кислотно-основного титрования.