СИСТЕМА ДОЗИРОВАННОГО РАСПРЕДЕЛЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к системам и способам доставки лекарственных средств топического применения отмеренной дозой.
Уровень техники
Анальгетики местного применения доступны во множестве дозированных форм, включая растворы, жидкости, пены, гели, кремы, мази и т.п. Они упакованы в различные системы упаковки/укупорки, такие как тюбики, бутылки, пакеты и канистры. Одной из распространенных проблем многих анальгетических продуктов топического применения является неточное распределение единичных доз из многодозовых контейнеров, которые могут вызвать у пациента недозировку или передозировку.
Карта дозирования является известным способом для измерения полутвердых лекарственных средств местного применения. Коммерчески доступное противовоспалительное и противоревматоидное средство «Волтарен®» в форме гелей является примером использования дозирующей карты дозирования в качестве первичного способа измерения дозы. Когда медицинский гель выдавливается из тюбика для покрытия предварительно определенной области на карте дозирования, то предполагается, что распределяется правильная доза. Хотя указанная область служит в качестве руководства, для пользователей каждый раз не всегда легко покрыть точную область, и ее двухмерная природа также ограничивает точность распределения.
В данной области требуются новые пути для доставки вязких трансдермальных медикаментов, вводимых топическим образом. Требуются способы, которые позволят точно и удобно дозировать вязкий раствор или гель для местных топических анальгетиков. Способы улучшения точности дозирования необходимы для предотвращения неправильных количеств дозы. Настоящее изобретение удовлетворяет эти и другие потребности.
Раскрытие изобретения
В настоящем изобретении предлагаются системы и способы для введения топических агентов. В силу этого в одном воплощении в настоящем изобретении предлагается: способ введения рекомендованной дозировки топического обезболивающего средства в вязком растворе, который включает:
приведение в действие ручного насоса:
a) приведение в действие толкателя, имеющего присоединенный к нему стержень, при этом пружина сжимается, а стержень скользит вдоль поршня и попадает в отмеряющую камеру, удерживающую первое предварительно определенное количество топического обезболивающего средства в вязком растворе;
b) приведение выпускного клапана отмеряющей камеры в открытое состояние, которое позволяет первому предварительно определенному количеству топического обезболивающего средства в вязком растворе протечь в канал или отверстие стержня; и затем
c) перемещение поршня, до тех пор, пока ограничитель хода толкателя не соединится с ограничителем хода поршня, где первое предварительно определенное количество топического болеутоляющего средства в вязком растворе удаляется через выходную трубку толкателя, который поднимается вверх под действием пружины; и затем
d) приведение выпускного клапана отмеряющей камеры в закрытое состояние, и создание вакуума внутри отмеряющей камеры и заполнение камеры;
e) необязательный повтор стадий а)-d) для доставки рекомендованной дозы; и
f) распределение вязкого раствора по коже.
В другом воплощении в настоящем изобретении предлагается способ лечения признаков и симптомов остеоартрита, который включает:
нажатие ручного насоса для выдачи 1/n дозы топического обезболивающего средства в вязком растворе из ручного насоса, где n является целым положительным числом, где ручной насос сконфигурирован для выдачи 1/n дозы в пределах допуска, указанного соответствующей инструкцией, утвержденной правительственным регуляторным органом; и распределение топического раствора по коже.
В еще одном воплощении в настоящем изобретении предлагаются распределяющая система для топического обезболивающего средства в вязком растворе, которая включает:
топическое обезболивающее средство в вязком растворе, включающее диклофенак натрия;
запечатанный пакет, удерживающий вязкий раствор; и
ручной насос, находящийся в жидкостной связи с вязким раствором, который включает:
насос, вмещающий определенную отмеряющую камеру;
толкатель, имеющий присоединенный к нему стержень, где при сжатии пружины стержень скользит вдоль поршня и попадает в отмеряющую камеру, удерживающую первое предварительно определенное количество топического обезболивающего средства в вязком растворе; где отмеряющая камера имеет размеры для выпуска 1/n дозы натрия диклофенака, где n является целым положительным числом, где первое предварительно определенное количество топического болеутоляющего средства в вязком растворе откачивается через выходную трубку толкателя, который поднимается вверх под действием пружины для выдачи 1/n дозы в пределах допуска, указанного соответствующей инструкцией, утвержденной правительственным регуляторным органом; и распределение топического раствора по коже.
В еще одном воплощении в настоящем изобретении предлагается способ лечения признаков и симптомов остеоартрита коленного сустава у пациентов-людей с помощью топического препарата диклофенака, который включает:
выдачу терапевтически эффективного количества диклофенака из топического препарата диклофенака, упакованного в фармацевтически приемлемый ручной насос;
нанесение терапевтически приемлемого количества диклофенака на колено,
где пациент получает терапевтические уровни диклофенака в крови в пределах 4-12 часов после введения препарата и поддержания облегчения боли в течение около 12 часов после введения препарата.
Преимущественно, в настоящем изобретении улучшается приверженность пациента лечению. В определенных аспектах способы и системы данного документа включают инструкции для пациентов для улучшения правильного применения контейнера и точного дозирования. Эти и другие аспекты, объекты и преимущества станут более очевидными, при прочтении подробного описания и чертежей ниже.
Краткое описание чертежей
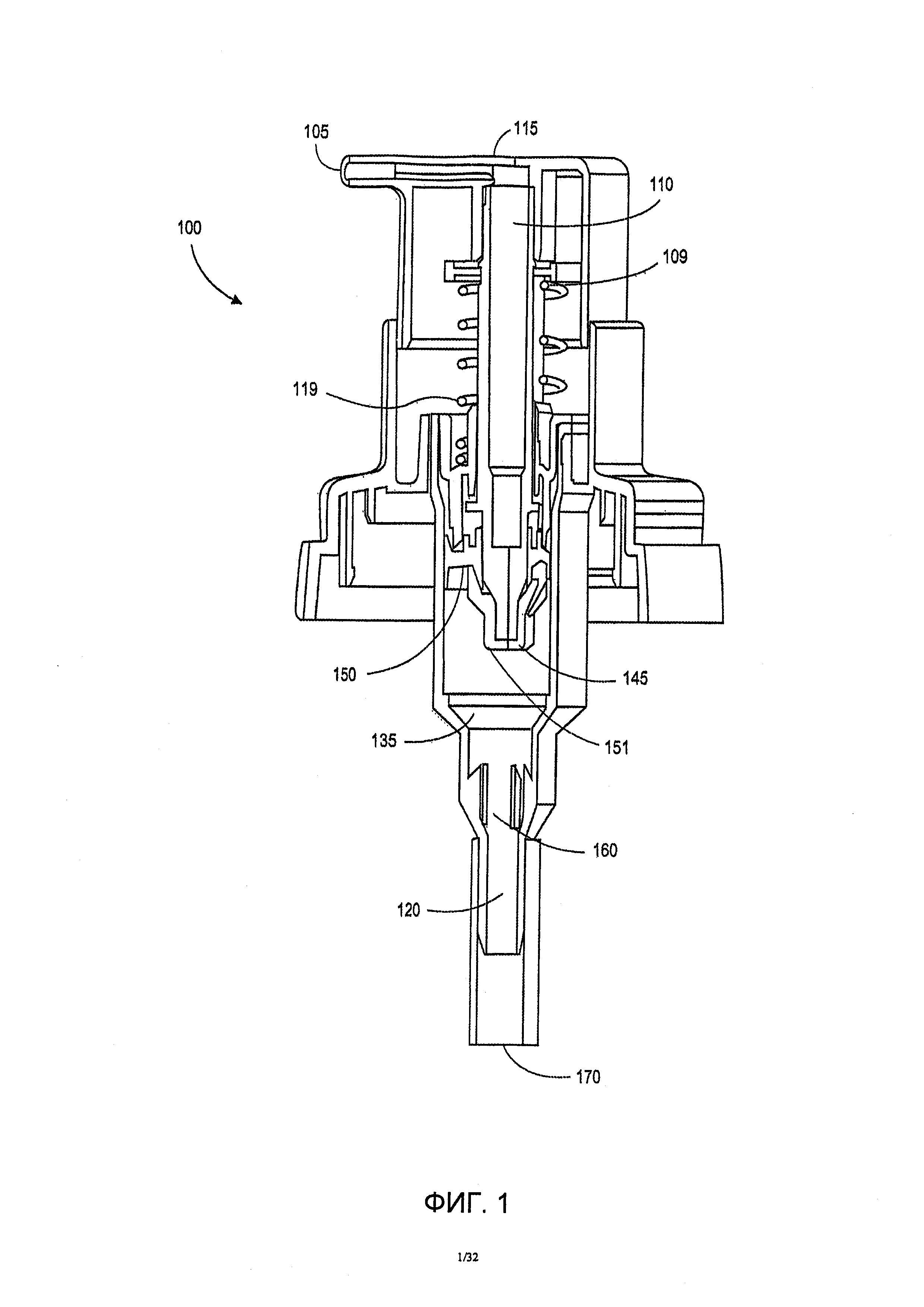
На фиг. 1 показан ручной насос, подходящий для применения в настоящем изобретении.
На фиг. 2Α-2Ζ показана инструкция-образец, которая может быть одобрена правительственным регулирующим органом. Каждый чертеж является одной страницей одной и той же инструкции.
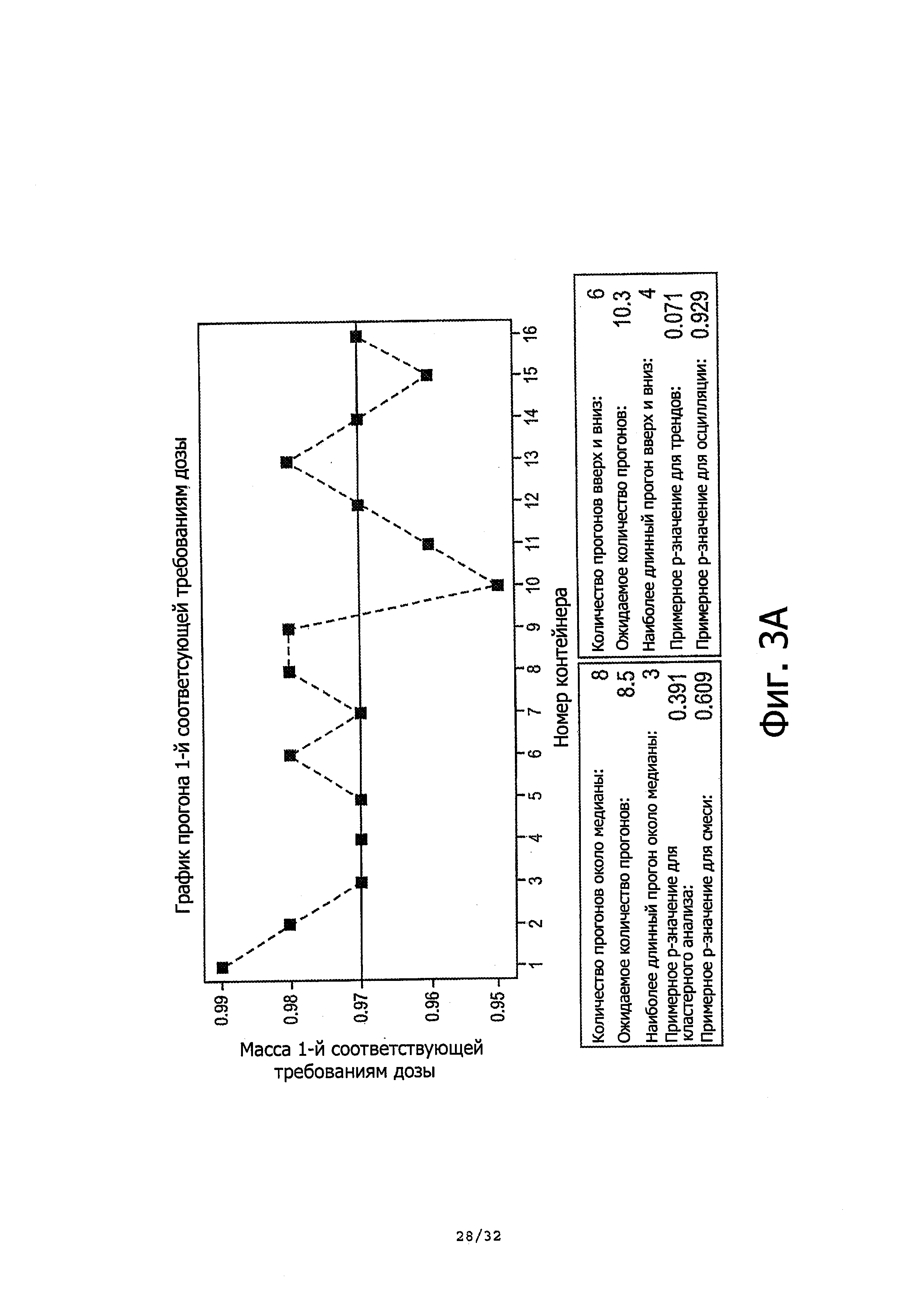
На фиг. 3А-3В показана схема прогона и статистическая графическая сводка, соответственно, для массы первой, соответствующей требованиям дозы для каждого контейнера (следующая доза после первого продукта выгружается в ходе первичного заполнения).
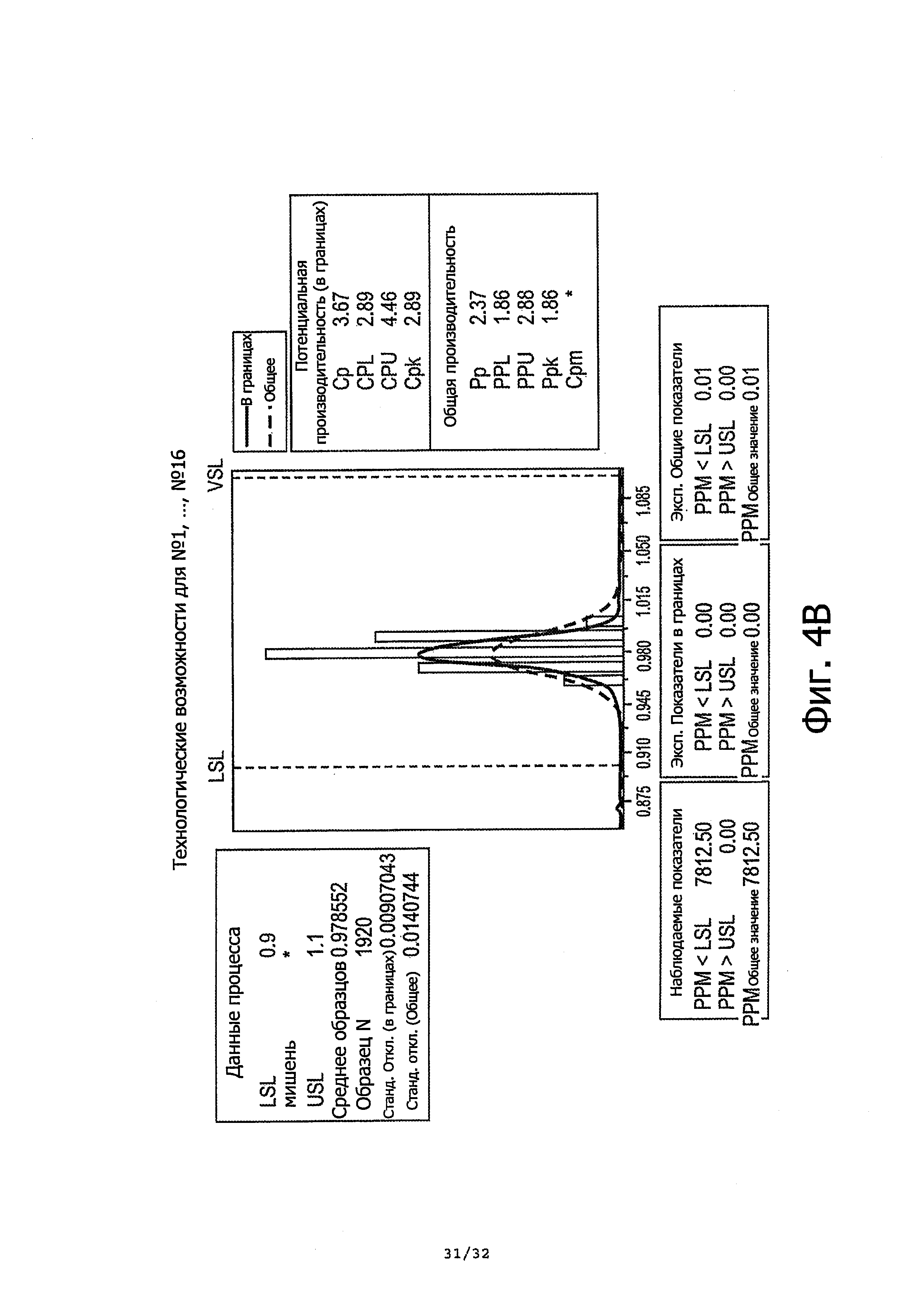
На фиг. 4А-4В показаны анализы соответствия по массам единичной дозы в нормативных пределах 0,8-1,2 г и 0,9-1,1 г, соответственно.
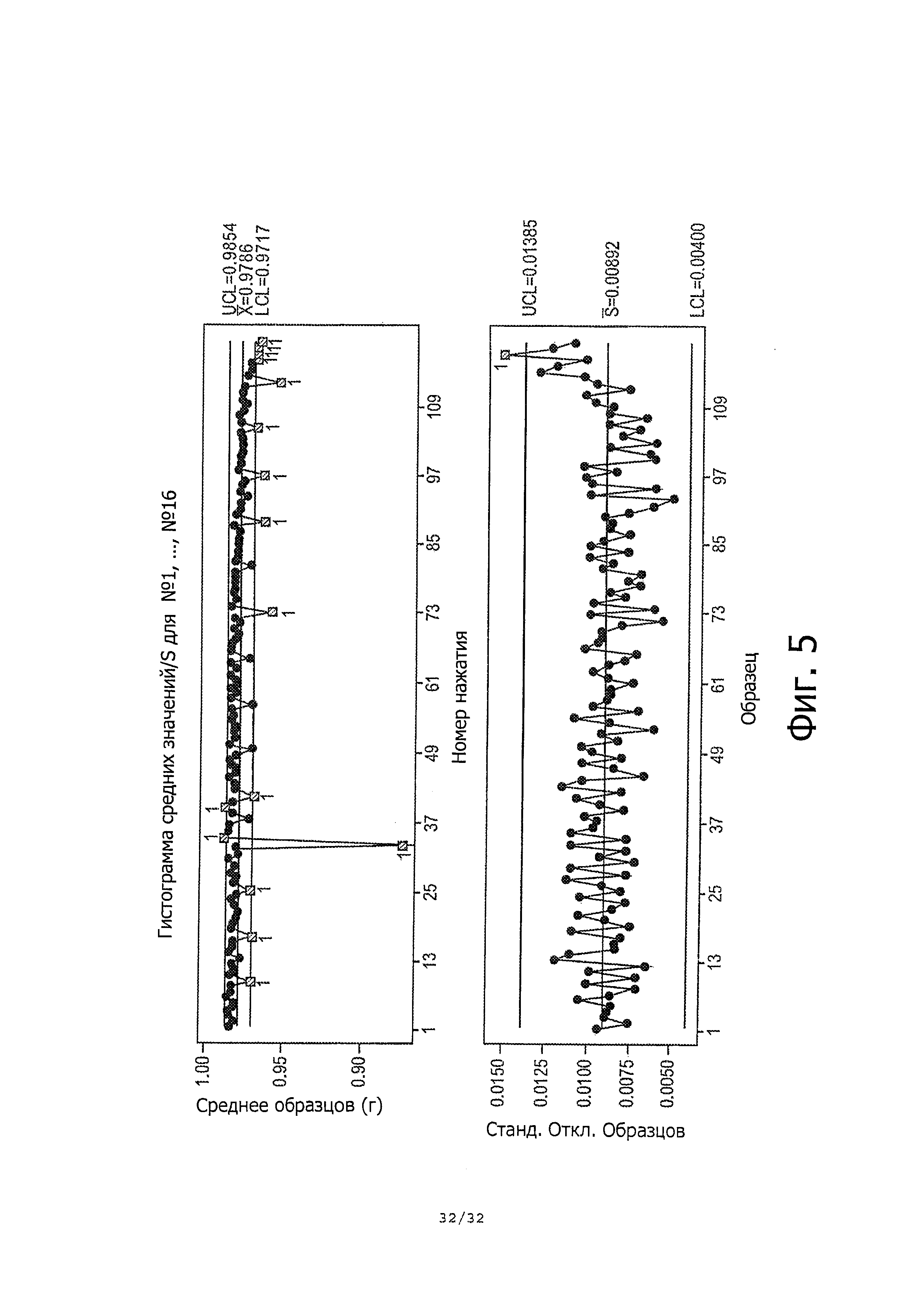
На фиг. 5 показана статистическая карта технологического контроля для массы единичной дозы.
Осуществление изобретения
I. Воплощения
В настоящем изобретении предлагаются способы и системы для введения топических агентов. В определенных аспектах способы и системы используют систему, не находящуюся под давлением. В одном воплощении в настоящем изобретении предлагается: способ введения рекомендованной дозировки топического обезболивающего средства в вязком растворе, который включает:
приведение в действие ручного насоса:
a) приведение в действие толкателя, имеющего присоединенный к нему стержень для сжатия пружины, при этом стержень скользит относительно поршня и попадает в отмеряющую камеру, удерживающую первое предварительно определенное количество топического обезболивающего средства в вязком растворе;
b) приведение выпускного клапана отмеряющей камеры в открытое состояние, которое позволяет первому предварительно определенному количеству топического обезболивающего средства в вязком растворе протечь в канал или отверстие стержня; и затем
c) перемещение поршня, до тех пор, пока ограничитель хода толкателя не соединится с ограничителем хода поршня, где первое предварительно определенное количество топического болеутоляющего средства в вязком растворе удаляется через выходную трубку толкателя, которое поднимается вверх под действием пружины; и затем
d) приведение выпускного клапана отмеряющей камеры в закрытое состояние, и создание вакуума внутри отмеряющей камеры и заполнение камеры;
e) необязательный повтор стадий а)-d) для доставки рекомендованной дозы; и
f) распределение вязкого раствора по коже.
В определенных аспектах топическое обезболивающее средство включает натрия диклофенак. В определенных аспектах вязкий раствор или гель включает 1,5% - 3 масс. % диклофенака натрия, например, около 2 масс. % диклофенака натрия.
На фиг. 1 показан ручной насос 100, подходящий для применения в настоящем изобретении. Система доступна у «Rexam PLC» (Англии и Уэльса) как насос, имеющий идентификатор SP943. Толкатель 109 активируется нажатием верхушки 115 и сжатием пружины 119. Толкатель 109 соединен со стержнем 110, имеющим канал 145, который скользит вдоль поршня 150 и попадает в отмеряющую камеру 135. Отмеряющая камера 135 заполняется вязким раствором, гелем, или составом. В процессе работы выпускной клапан отмеряющей камеры открывается, что позволяет вязкому раствору, гелю или составу протечь в камеру или отверстие 145 из входного отверстия 120. Когда ограничитель хода контактирует с поршнем 150, выводное отверстие позволяет давлению в контейнере стать равным атмосферному давлению. Затем при продолжении перемещения поршня 150, вязкий раствор, гель или состав удаляется через выходную трубку толкателя. Сразу после удаления продукта, поршень высвобождается и поднимается вверх под действием пружины. При этом движении выходной клапан закрывается, поскольку стержень возвращается в водонепроницаемое положение. Вакуум, образованный внутри отмеряющей камеры, поднимает шаровой контрольный клапан 160 и открывает путь для засасывания вязкого раствора, геля или состава в дозирующую камеру. В конце поршневого восходящего хода выводное отверстие и поршневая камера более не связаны, что восстанавливает общую герметичность системы.
Отмеряющая камера 135 соединяется с погружной трубкой 170 посредством шарового контрольного клапана 160. Поршень 150 скользит внутри корпуса насоса и, конкретнее, внутри отмеряющей камеры 135. В одном воплощении для применения в настоящем изобретении подходит насос, описанный в документе US 7,243,820, выданном 17 июля 2007 года.
В определенных аспектах способ дополнительно включает аспирацию второго предварительно определенного количества топического болеутоляющего средства из запечатанного пакета, удерживающего вязкий раствор, посредством чего происходит сжатие пакета. В определенных случаях насос 100 размещен выше пакета с погружной трубкой 170, вставленной в пакет. Предпочтительно, если пакет облицован металлом или покрыт полиэстером или полиэтиленом. Предпочтительно, если металлический мешочек инертен по отношению к составу болеутоляющего средства. Металлическая тара может быть сделана из алюминия или алюминиевого сплава. В определенных случаях ручной насос удлинен и приведение в действие происходит, когда удлиненный ручной насос удерживается под углом относительно вектора поля тяготения. В других случаях ручной насос удлинен и приведение в действие происходит когда удлиненный ручной насос находится в перевернутом положении относительно вектора поля тяготения. Пример вкладыша - в «Rexam Sof'Bag», который является ламинированным фольгой пакетом в виде мягкой упаковки-вкладыша.
В другом воплощении в настоящем изобретении предлагается способ лечения признаков и симптомов остеоартрита, который включает:
нажатие ручного насоса для выдачи 1/n дозы топического обезболивающего средства в вязком растворе из ручного насоса, где n является целым положительным числом, где ручной насос сконфигурирован для выдачи 1/n дозы в пределах допуска, указанного соответствующей инструкцией, утвержденной правительственным регуляторным органом; (например, Управлением по контролю за продуктами и лекарствами США (FDA); и затем
распределение топического раствора по коже.
В определенных случаях допуск дозы составляет около ±0-20%, например, ±0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20%. В других случаях допуск дозы составляет около ±5-10%. Термин «допуск дозы» включает точность или аккуратность первой дозы по сравнению с последующей дозой, или как известно в данной области. Например, если первая доза составляет 1 г, допуск дозы ±10% составляет от 0,9 до 1,1 г.
В определенных случаях целое число «n» имеет значение от около 1 до около 10, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. В одном примере, n=1 и нажатие ручного насоса один раз распределяет целую дозу вязкого топического болеутоляющего средства в вязком растворе. В других случаях, n=2, где нажатие ручного насоса дважды распределяет полудневную дозу вязкого топического болеутоляющего средства в вязком растворе. Ежедневная доза может быть двумя применениями по 2 мл, или всего 4 действиями.
На фиг. 2A-2Z показана инструкция-образец, которая может быть одобрена правительственным регулирующим органом. Такие метки могут включать инструкции для болеутоляющего средства, которые предоставляются или распространяются с болеутоляющим средством, для пациентов, докторов, фармацевтов и т.п. Инструкция-образец на чертеже предназначена для топического раствора диклофенака натрия, в насосе в соответствии с воплощением изобретения.
В еще одном воплощении в настоящем изобретении предлагаются распределяющая система для топического обезболивающего средства в вязком растворе, которая включает:
топическое обезболивающее средство в вязком растворе, включающее натрия диклофенак;
запечатанный пакет, удерживающий вязкий раствор; и
ручной насос, находящийся в жидкостной связи с вязким раствором, который включает:
насос, вмещающий определенную отмеряющую камеру;
толкатель, имеющий присоединенный к нему стержень, сжимает пружину, при этом стержень скользит вдоль поршня и попадает в отмеряющую камеру, удерживающую первое предварительно определенное количество топического обезболивающего средства в вязком растворе; где отмеряющая камера имеет размеры для выпуска 1/n дозы натрия диклофенака, где n является целым положительным числом, где первое предварительно определенное количество топического болеутоляющего средства в вязком растворе откачивается через выходную трубку толкателя, который поднимается вверх под действием пружины для выдачи 1/n дозы в пределах допуска, указанного соответствующей инструкцией, утвержденной правительственным регуляторным органом; и распределение топического раствора по коже.
В определенных предпочтительных аспектах запечатанный пакет, удерживающий вязкий раствор, не допускает воздух, тем самым позволяя ручному насосу и запечатанному пакету распределять вязкий раствор из любой ориентации относительно вектора силы тяжести. Предпочтительно, система дополнительно включает бутыль, кан или другую емкость, охватывающую пакет.
«Вектор силы тяжести» включает направление, в котором сила тяжести оказывает силовое воздействие на вещество или, в ином случае, как известно в данной области.
II. Топический Состав
В определенных аспектах состав или вязкий раствор топического обезболивающего средства является нестероидным противовоспалительным ("NSAID") лекарственным средством или ее фармацевтически приемлемой солью. Более предпочтительно, если нестероидным противовоспалительным средством является диклофенак, который может существовать в различных солевых формах, включая натриевую, калиевую или диэтиламиновую формы. В предпочтительном воплощении используется натриевая соль диклофенака. Диклофенак натрия или натрий диклофенак может присутствовать в диапазоне примерно от около 0,1% до около 10%, например, около 1, 2, 3, 4 или 5% масс./масс. В предпочтительном аспекте раствор насоса содержит вязкий раствор или гель, являющийся 2% масс./масс. диклофенака натрия.
«Около» подразумевает диапазон уровня допуска ±1%, ±2%, ±3%, ±4%, ±5%, ±10%, ±15%, ±20%, ±25%, или в ином случае как известно в данной области.
В определенных аспектах настоящий состав активного ингредиента или вязкий состав включают усилитель проникновения. Усилителем проникновения может быть диметилсульфоксид («DMSO») или его производные. DMSO может присутствовать в количестве по массе от около 1% до около 70%, а более предпочтительно от около 25% до около 60%, например, около 25, 30, 40, 45, 50, 55 или 60% масс./масс. Предпочтительно, DMSO используют в настоящем изобретении в концентрации от около 40% до около 50% масс./масс, например, около 41, 42, 43, 44, 45, 46, 47, 48, 49 и 50% и во всех дробных концентрациях, например, 44, 44.5, 45, 45.5, 46, 46.5%, и т.п.
[0001] В определенных аспектах настоящее изобретение включает низкомолекулярный спирт, например, метанол, этанол, пропанол, бутанол и их смеси. В определенных воплощениях спирт составляет от около 1 до около 50% масс./масс. Предпочтительно, если используется около 1-50% масс./масс. этанол, например, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50% масс./масс. и все дробные количества диапазона.
В определенных аспектах настоящее изобретение включает многоатомный спирт, например, гликоль. Подходящие гликоли включают этиленгликоль, пропиленгликоль, бутиленгликоль, дипропиленгликоль, гексантриол и их комбинацию. Предпочтительно, если используется около 1-15% масс./масс. пропиленгликоля, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15% масс./масс. и все дробные количества диапазона.
В определенных воплощениях настоящее изобретение включает глицерол (также называемый в данном документе глицерином) в концентрации 0-12% масс./масс. Предпочтительно, если используется 1-4% масс./масс. глицерина, например, 1, 2, 3 или 4% масс./масс. и все дробные количества диапазона. В некоторых воплощениях глицерин не используется в составе, т.е. вязкий раствор или гель необязательно содержит глицерин.
В предпочтительном аспекте топическое обезболивающее средство, включающее раствор диклофенака, имеет, по меньшей мере, один загуститель для получения вязкого раствора. По меньшей мере, один загуститель настоящего изобретения может быть акриловым полимером (например, полимерами Карбопола, поликарбофилами Новеон и полимерными эмульгаторами Пемулен, которые коммерчески доступны у «Noveon Inc.», Кливленд, Огайо), производным акрилового полимера, целлюлозным полимером, производным целлюлозного полимера, поливиниловым спиртом, полоксамерами, полисахаридами и их смесями. Предпочтительно, если, по меньшей мере, один загуститель представляет собой гидроксипропилцеллюлозу (НРС), используемую так, чтобы конечная вязкость составляла от около 10 до около 50000 сантипуаз (cps). Более предпочтительно, если конечная вязкость составляет от около 500 до около 20000 cps или около 500-3000 cps или около 1000-2000 cps. В определенных аспектах загуститель присутствует в количестве около 1-10%, или около 1-3%, например, около 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10% масс./масс. и все значения между ними, такие как около 2,5% масс./масс.
Настоящий вязкий раствор или гелевый состав необязательно может включать, по меньшей мере, один антиоксидант и/или один хелатирующий агент и/или консервант.
К тому же, топические составы, пригодные для настоящего изобретения также могут включать агент, корректирующий рН. В одном конкретном воплощении, агент, корректирующий рН, является основанием. Подходящие корректирующие рН основания включают бикарбонаты, карбонаты и гидроксиды, такие как гидроксиды щелочных или щелочноземельных металлов, а также гидроксиды переходных металлов. В ином случае, агент, корректирующий рН, также может быть кислотой, кислой солью, или их смесями. Кроме того, агент, корректирующий рН, также может быть буфером. Подходящие буферы включают буферы цитрата/лимонной кислоты, буферы ацетата/уксусной кислоты, буферы фосфата/фосфорной кислоты, буферы формиата/муравьиной кислоты, буферы пропионата/пропионовой кислоты, буферы лактата/молочной кислоты, буферы карбоната/угольной кислоты, буферы аммония/аммиака и т.п. Агент, корректирующий рН присутствует в количестве, достаточном для коррекции рН композиции от около рН 4,0 до около 10,0, более предпочтительно от около рН 6,9 до около 9,8. В определенных воплощениях нескорректированное рН смешанных компонентов составляет от 8 до 10, например, 9, без необходимости добавления любых агентов, корректирующих рН.
В определенных аспектах состав обезболивающего средства или вязкий раствор, содержащий нестероидное противовоспалительное лекарственное средство (NSAID) имеет вязкость, по меньшей мере, 100 cps. Предпочтительно, гелевый состав имеет вязкость, по меньшей мере, 500 cps. Более предпочтительно, состав имеет вязкость, по меньшей мере, 1000 cps. В других воплощениях вязкость составляет около 1000-10000 cps, или около 10000-15000 cps, или около 15000-20000 cps. В предпочтительном воплощении вязкий раствор или составы имеют вязкость около 800-5000 cps, например, около 800, 900, 1000, 2000, 3000, 4000 или 5000 cps и все значения между ними. Например, состав имеет вязкость около 900, 925, 950, 975, 1000, 1025, 1050, 1075, 1100, 1125, 1150, 1175, 1200, 1225, 1250, 1275, 1300, 1325, 1350, 1375, 1400, 1425, 1450, 1475, 1500, 1525, 1550, 1575, 1600, 1625, 1650, 1675, 1700, 1725, 1750, 1775, 1800, 1825, 1850, 1875, 1900, 1925, 1950, 1975 или 2000 cps. В ином случае, состав имеет вязкость около 0-25 cps или 3-25 cps.
Вязкий раствор включает раствор, имеющий вязкость больше, чем у воды (т.е. 1,0020 cps при 20°С) или в ином случае, как известно в данной области.
В одном воплощении состав топического обезболивающего средства включает, по существу состоит из, или состоит из:
(i) диклофенака натрия;
(ii) ДМСО;
(ii) этанола;
(iii) пропиленгликоля;
(v) загущающего агента;
(vi) необязательно глицерина; и
(vii) воды.
В другом воплощении состав используется для лечения признаков и симптомов остеоартрита у объекта, страдающего от суставной боли, путем топического введения на пораженную область сустава объекта терапевтического количества состава.
В другом воплощении топический состав включает, по существу состоит из, или состоит из:
(i) около 1-2% масс./масс. диклофенака натрия;
(ii) около 40-50% масс./масс. DMSO;
(iii) около 23-29% масс./масс. этанола;
(iv) около 10-12% масс./масс. пропиленгликоля;
(v) около 1-10% масс./масс. загустителя (такого как гидроксипропилцеллюлоза); и
(vi) воды до 100% масс./масс.
В еще одном воплощении, в настоящем изобретении предлагается топический состав, включающий, состоящий по существу из, или состоящий из: раствора диклофенака натрия и, по меньшей мере, одного загустителя, который может быть выбран из полимера целлюлозы, полимера карбомера, производного карбомера, производного целлюлозы, поливинилового спирта, полоксамеров, полисахаридов, и их смесей.
В аспекте вышеуказанных воплощений, агенты-загустители могут быть выбраны из целлюлозных полимеров, полимеров карбополимера, производного карбомера, целлюлозного производного, поливинилового спирта, полоксамеров, полисахаридов, и их смесей.
В другом аспекте вышеуказанных воплощений, диклофенак натрия присутствует в количестве около 2% масс./масс; DMSO присутствует в количестве около 45,5% масс./масс; этанол присутствует в количестве около 23-29% масс./масс; пропиленгликоль присутствует в количестве около 10-12% масс./масс; гидроксипропилцеллюлоза (HY119) присутствует в количестве около 0-6% масс./масс; глицерин присутствует в количестве 0-4%; и воду добавляют до 100% масс./масс. В других аспектах глицерин отсутствует в гелевом составе, а гидроксипропилцеллюлоза (H119) присутствует в количестве 1-6% масс./масс. В других аспектах конечная вязкость геля составляет около 500-5000 сентипуаз.
Характерная особенность вышеуказанных гелевых составов заключается в том, что когда такие составы наносят на кожу, скорость высыхания быстрее и трансдермальный поток выше, чем у ранее описанных композиций, таких как в патентных документах US No. 4,575,515 и 4,652,557. Дополнительные характерные особенности предпочтительных составов включают снижение деградации диклофенака натрия, который деградирует меньше чем 0,04% в течение 6 месяцев, и рН 6,0-10,0, например, около рН 9,0. В одном аспекте топический состав описан в патентном документе US No. 12/134,121.
В другом воплощении топический состав включает, по существу состоит из, или состоит из:
(i) около 1-2% масс./масс. диклофенака натрия;
(ii) около 40-50% масс./масс. DMSO;
(iv) около 10-12% масс./масс. пропиленгликоля;
(iii) около 1-30% масс./масс. этанола;
(v) необязательно глицерина;
(vi) воды; и
(vii), по меньшей мере, одного загустителя, выбранного из группы, состоящей из целлюлозного полимера, полимера карбомера, производного карбомера, производного целлюлозы, гидроксипропилцеллюлозы и их смесей.
Предпочтительно, если топический состав имеет вязкость около 500-5000 cps, например, вязкость, по меньшей мере, 1000 cps. В других воплощениях вязкость составляет около 1000-10000 cps, или около 10000-15000 cps, или около 15000-20000 cps. В предпочтительном воплощении вязкий раствор или составы имеют вязкость около 800-5000 cps, например, около 800, 900, 1000, 2000, 3000, 4000 или 5000 cps и все значения между ними.
В одном неограничивающем примере, коммерчески доступный 1,5% топический раствор PENNSAID® упаковывается в контейнер с отмеряющим насосом. Вместо отсчета 40 капель для одной дозы при помощи текущего коммерческого контейнера, одно одиночное действие доставляет заявленную единичную дозу 1,2 мл.
В другом неограничивающем примере, вязким составом с 2% диклофенака натрия и загустителем, заполняли контейнеры с отмеряющими насосами. Одно действие точно доставляет 1 грамм вязкого состава, который является половиной заявленной дозы.
III. Способы Применения
Топические составы болеутоляющего средства особенно подходят для применения при лечении связанных с болью заболеваний, расстройств или состояний, например, длительного лечения признаков и симптомов остеоартрита (OA). Также пригодны для лечения других хронических заболеваний суставов, характеризующихся болью в суставах, дегенерацией суставного хряща, нарушенным движением и жесткостью. Подходящие суставы включают колено, локоть, ладонь, запястье и бедро. Предпочтительно, сустав включает колено.
Из-за свойств более высокого истечения и in vivo абсорбции, считается, что составы настоящего изобретения могут быть введены в меньшей дозе, чем ранее описанные составы. В частности, композиции изобретения могут быть использованы при введении дозы дважды в день или один раз в день при лечении OA. Это значимое улучшение, поскольку меньшее количество доз связано с лучшей приверженностью пациента лечению, важному фактору при лечении хронических состояний.
Подходящие количества на одно введение будут, в общем, зависеть от размера сустава, который варьирует в зависимости от индивидуума и в зависимости от сустава, однако подходящее количество может находиться в диапазоне от 0,5 мкл/см2 до 4,0 мкл/см2. Предпочтительно количество находится в диапазоне от 2,0 до 3,0 мкл/см2. В предпочтительном аспекте доза принимается 1, 2, 3 или 4 раза в день при этом каждая доза составляет от 0,1 до 4 мл. В предпочтительном аспекте доза принимается 2 раза в день при 2 мл на дозу (всего 4 мл/ежедневно).
IV. Фармакокинетические свойства
[0002] In vivo инструменты могут показать влияние изменений в топическом вязком растворе на локальную доставку. FDA идентифицировали четыре потенциальных технологии исследования:
(1) Для демонстрации эффективности и/или определения рабочих характеристик топических вязких растворов могут быть использованы фармакокинетические исследования. Исследования биоэквивалентности с фармакокинетическими или клиническими конечными показателями могут быть проведены для демонстрации эквивалентности между двумя различными топическими вязкими растворами. Для многих топических вязких растворов, можно детектировать в плазме количество лекарственного средства достигшего системного кровотока и сравнивать топические вязкие растворы между собой, несмотря на то, что их отношение к местной доставке все еще неизвестно.
(2) Соскоб кожи удаляет верхние слои кожи для анализа концентрации лекарственного средства.
(3) Микродиализ включает вставку под кожу малой полупроницаемой капиллярной трубки в дерму на около 1000 мм. Капиллярная трубка проницаема для лекарственного средства; следовательно, так как через капилляр протекает перфузионная жидкость, она забирает лекарственное средство из экстраклеточной жидкости ткани.
(4) Спектроскопия в ближней инфракрасной области детектирует уникальный сигнал, который указывает на концентрацию конкретного лекарственного средства и предлагает возможность неинвазивного теста доставки лекарственного средства в кожу.
См. Critical Path Opportunities for Generic Drugs. Office of Generic Drugs, Office of Pharmaceutical Science, Center for Drug Evaluation and Research, от 1 мая 2007 года, доступный на веб-сайте FDA.gov. Исследование раздражения и сенсибилизации кожи также может помочь в определении биоэквивалентности между топическими вязкими растворами, особенно, если различия включают потенциальные усилители проникновения. См. FDA Draft Guidance on Diclofenac Sodium, пересмотренный в июне 2011 года.
Вязкий раствор, топический препарат диклофенака, раскрытый в данном документе, включает терапевтически эффективное количество диклофенака натрия, такое, при котором пациент быстро получает достаточные концентрации в плазме диклофенака натрия (например, в пределах 4-12 часов, например, около 4, 5, 6, 7, 8, 9, 10, 11 или 12 часов) после введения раствора и сохраняет болеутоляющее средство в течение около 12 часов после введения раствора. Хотя системная циркуляция диклофенака, детектированная в плазме, не коррелирует напрямую с локальной доставкой, FDA, в некоторых случаях, полагается на фармакокинетические данные для определения биоэквивалентности между двумя топическими растворами диклофенака. Если 90% доверительные области для соотношений геометрических средних (тест: эталон) AUC и Cmax попадают между 80% и 125%, тест является биоэквивалентным по отношению к эталону и предполагается, что он обеспечивает схожий с эталоном терапевтический эффект. См. FDA Draft Guidance on Diclofenac Sodium, пересмотренный в июне 2011 года.
Топический препарат диклофенака раскрытый в данном документе, при топическом введении объекту, может продуцировать профиль в плазме, характеризуемый средним Cmax (пиковая концентрация в плазме) для диклофенака натрия от около 10,0 нг/мл до около 25,0 нг/мл. В другом воплощении среднее Cmax для диклофенака натрия может находиться в диапазоне от около 12,4 нг/мл до около 19,5 нг/мл. В дополнительном воплощении, среднее Cmax для диклофенака натрия может составлять около 2,5, 13,0, 13,5, 14,0, 14,5, 15,0, 15,1, 15,2, 15,3, 15,4, 15,5, 15,6, 15,7, 15,8, 15,9, 16,0, 16,5, 17,0, 17,5, 18,0, 18,5, 19,0 или 19,5 нг/мл. Более того, среднее Cmax для диклофенака натрия в равновесном состоянии может находиться в диапазоне от 12,0 нг/мл до около 30,0 нг/мл, или от около 15,6 нг/мл/мг до около 25,0 нг/мл/мг. В дополнительном воплощении, среднее Cmax для диклофенака натрия в равновесном состоянии может составлять около 15,5, 16,0, 16,5, 17,0, 17,5, 18,0, 18,5, 19,0, 19,5, 19,6, 19,7, 19,8, 19,9, 20,0, 20,5, 21,0, 21,5, 22,0, 22,5, 23,0, 23,5, 24,0, 24,5 или 25,0 нг/мл.
В дополнительном воплощении топический препарат диклофенака, при топическом введении объекту, может продуцировать профиль в плазме, характеризуемый средним AUC0-12 для диклофенака натрия от около 60 нг⋅ч/мл до около 140,0 нг⋅ч/мл. В дополнительном воплощении среднее AUC0-12 для диклофенака натрия может составлять от около 76,0 нг⋅ч/мл до около 124,0 нг⋅ч/мл. В другом воплощении среднее AUC0-12 для диклофенака натрия может составлять 75,0, 80,0, 85,0, 90,0, 91,0, 92,0, 93,0, 94,0, 94,5, 95,0, 95,5, 96,0, 96,5, 97,0, 97,5, 98,0, 99,0, 99,5, 100,0, 105,0, 110,0, 115,0, 120,0 или 125,0 нг⋅ч/мл.
В дополнительном воплощении топический препарат диклофенака, при топическом введении объекту, может продуцировать профиль в плазме, характеризуемый средним AUC0-24 для диклофенака натрия от около 100 нг⋅ч/мл до около 300 нг⋅ч/мл. В дополнительном воплощении среднее AUC0-24. Для диклофенака натрия может составлять от около 150 нг⋅ч/мл/мг до около 250 нг⋅ч/мл/мг. В другом воплощении среднее AUC0-24 для диклофенака натрия может составлять около 150, 155, 160, 165, 170, 175, 180, 185, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 205, 210, 215, 220, 225, 240, 235, 240, 245 или 250 нг«ч/мл. Кроме того, среднее AUC0-24 для диклофенака натрия в равновесном состоянии может находиться в диапазоне от около 200 нг⋅ч/мл до около 450 нг⋅ч/мл, или от около 250 нг⋅ч/мл до около 405 нг⋅ч/мл. В другом воплощении среднее AUC0-24. Для диклофенака натрия в равновесном состоянии может составлять около 250, 260, 270, 280, 290, 300, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 330, 340, 350, 360, 370, 380, 390, 400 или 405 нг⋅ч/мл.
В дополнительном воплощении топический препарат диклофенака, при топическом введении объекту, может продуцировать профиль в плазме, характеризуемый медианным Tmax (время пиковой концентрации в плазме) для диклофенака натрия от около 4,0 часов до около 12,0 часов. В альтернативном воплощении медианное Tmax для диклофенака натрия может составлять от около 6,0 часов до около 10,0 часов. В другом воплощении, медианное Tmax для диклофенака натрия может составлять около 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 10,5, 11,0, 11,5 или 12,0 часов. Более того медианное Tmax для диклофенака натрия в равновесном состоянии может находится в диапазоне от около 0 часов до около 12,0 часов, или от около 0,5 часов до около 8,0 часов относительно времени введения последней дозы. В другом воплощении медианное Tmax для диклофенака натрия в равновесном состоянии может составлять около 0,5, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5 или 8,0 часов.
В определенных аспектах способы и системы настоящего изобретения обеспечивают AUC0-24 для диклофенака около 195,51±166,03 нг⋅ч/мл при нанесении топического препарата диклофенака в вязком растворе на колено пациента.
В определенных аспектах способы и системы настоящего изобретения обеспечивают Cmax. Для диклофенака около 15,57±12,96 нг/мл при нанесении топического препарата диклофенака в вязком растворе на колено пациента.
В определенных аспектах способы и системы настоящего изобретения обеспечивают AUC0-24 Для диклофенака в равновесном состоянии около 319,51±162,36 нг⋅ч/мл при нанесении топического препарата диклофенака в вязком растворе на колено пациента.
В определенных аспектах способы и системы настоящего изобретения обеспечивают Cmax для диклофенака в равновесном состоянии около 19,79±10,12 нг/мл при нанесении топического препарата диклофенака в вязком растворе на колено пациента.
В определенных аспектах способы и системы настоящего изобретения обеспечивают AUC0-12 для диклофенака от около 76,0 нг⋅ч/мл до около 124,0 нг⋅ч/мл при нанесении топического препарата диклофенака в вязком растворе на колено пациента.
В определенных аспектах топический препарат диклофенака, описанный в данном документе, достигает профилей в плазме, раскрытых в данном документе, при введении из ручного насоса 100 (Фиг. 1). В одном аспекте ручной насос доставляет 0,5-5 мл на действие насоса, например, 1, 2, 3, 4 или 5 мл на действие насоса. В предпочтительном воплощении действие насоса доставляет 1 мл на действие насоса.
В определенных аспектах в настоящем изобретении предлагается способ лечения признаков и симптомов остеоартрита колена человеческого пациента с топическим препаратом диклофенака, который включает:
выдачу терапевтически эффективного количества диклофенака из топического препарата диклофенака, упакованного в фармацевтически приемлемый ручной насос;
нанесение терапевтически приемлемого количества диклофенака на колено; где пациент получает терапевтические уровни диклофенака в крови в диапазоне 4-12 часов, например, через 4, 5, 6, 7, 8, 9, 10, 11 или 12 часов и все дробные промежуточные значения после введения препарата, и сохраняет болеутоляющее в течение около 12 часов после введения препарата.
В одном аспекте, пациентам дают следующие инструкции. 1) Удалить крышку насоса. 2) Первично заполнить насос, удерживая бутыль в вертикальном, но наклоненном положении, нажать насос вниз сильно и уверенно несколько раз в бумажное полотенце или ткань, до тех пор, пока не выйдет некоторое количество исследуемого лекарственного средства. 3) После первичного заполнения насоса бутыль готова к применению и не нуждается в первичном заполнении опять. 4) Для распределения лекарственного средства, сильно и уверенно нажать головку насоса вниз для распределения лекарственного средства в ладонь руки. Отпустить головку насоса. 5) Нанести лекарственное средство равномерно над всей областью его применения.
V. Примеры
Пример 1 иллюстрирует оценку функционирования 100 мл бутыли «Rexam Sof'Bag» с 1 мл распределяющим насосом для 2% масс/масс. местного диклофенака натрия.
1. Краткое описание
Текущее исследование проводили для оценки атрибутов доставки дозы контейнером «Rexam Sof'Bag» с отмеряющим насосом для 2,0% масс./масс. местного диклофенака натрия. Исследование проводили на 16 контейнерах в течение одномесячного (16 бизнес дней) периода. Результаты показали, что контейнер, при заполнении до полной емкости, способен сообразно доставить требуемое количество доз с высокой точностью. Средняя масса единичной дозы, доставляемой каждым контейнером, варьирует от 0,97 до 0,99 г, что находится в 5% диапазоне от целевой дозы (1,00 г). Стандартное отклонение массы единичной дозы из каждой бутыли было стабильно при 0,01 г.
2. Введение
2,0% масс/масс. топический гель диклофенака натрия является лекарственным средством, исследуемым для лечения признаков и симптомов остеоартрита колена.
Согласно руководству FDA «Системы упаковки/укупорки для упаковки человеческих лекарственных средств и биопрепаратов», исследование степени эффективности функционирования контейнера включает исследования «функциональности и/или доставки лекарственных средств». Данное исследования проводили для оценки следующих аспектов эффективности функционирования: параметры первичного заполнения контейнера, аккуратность и точность доставки, количество соответствующих требованиям доз, процент восстановления, остаточный объем и объем отходов.
3. Материалы, Оборудование, Способы и Процедуры
Исследование проводили с помощью бутыли «Rexam» и насосной насадки. Внутренний мешочек бутыли «Rexam 100 mL» имеет номинальное давление 0,5 бар (7,2 psi). Все инструменты, включая датчик давления и выравниватель давления, были в пределах калибровки в течение всего этого исследования.
Атрибуты доставки исследовали в общей сложности в течение шестнадцати (16) бизнес-дней. Заполняли контейнеры, насосы, и осуществляли первые две сессии распределения. Контейнеры хранили при комнатной температуре в течение этого периода.
4. Результаты и обсуждение
4.1. Масса наполнения контейнера и доставляемая масса
Бутыли перед заполнением вручную накачивали при 6 psi. Каждый контейнер был заполнен до полной емкости: сразу ниже нижней части бутылочного горлышка и выше плечей бутыли. Записывали массы контейнера перед и после заполнения, и перед и после распределения. Рассчитывали наполняемую емкость контейнера и доставляемые массы. Общую массу собранных образцов из каждого контейнера также рассчитывали суммированием индивидуальных масс единичных доз. Ключевые статистические данные суммированы ниже в таблице 1.
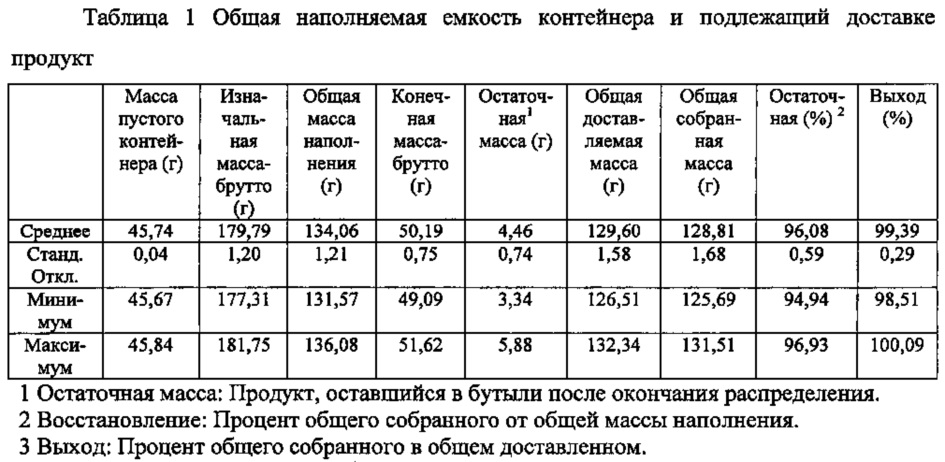
В условиях заполнения, использованных данном исследовании, результаты доставляемой массы (всего доставлено) соответствуют требованиям USP <698> для мультиединичных контейнеров. Средняя поставляемая масса представляет собой NLT 100% 120 г минимального требования, и ни один из объектов не меньше 95% минимума.
4.2. Требования первичного заполнения
Изначальные данные, собранные вначале распределения из бутыли, были использованы для оценки количества действий, требуемых для полного первичного заполнения насоса. Данные указывают на то, что как только продукт выгружен, следующее действие всегда дает полную дозу.
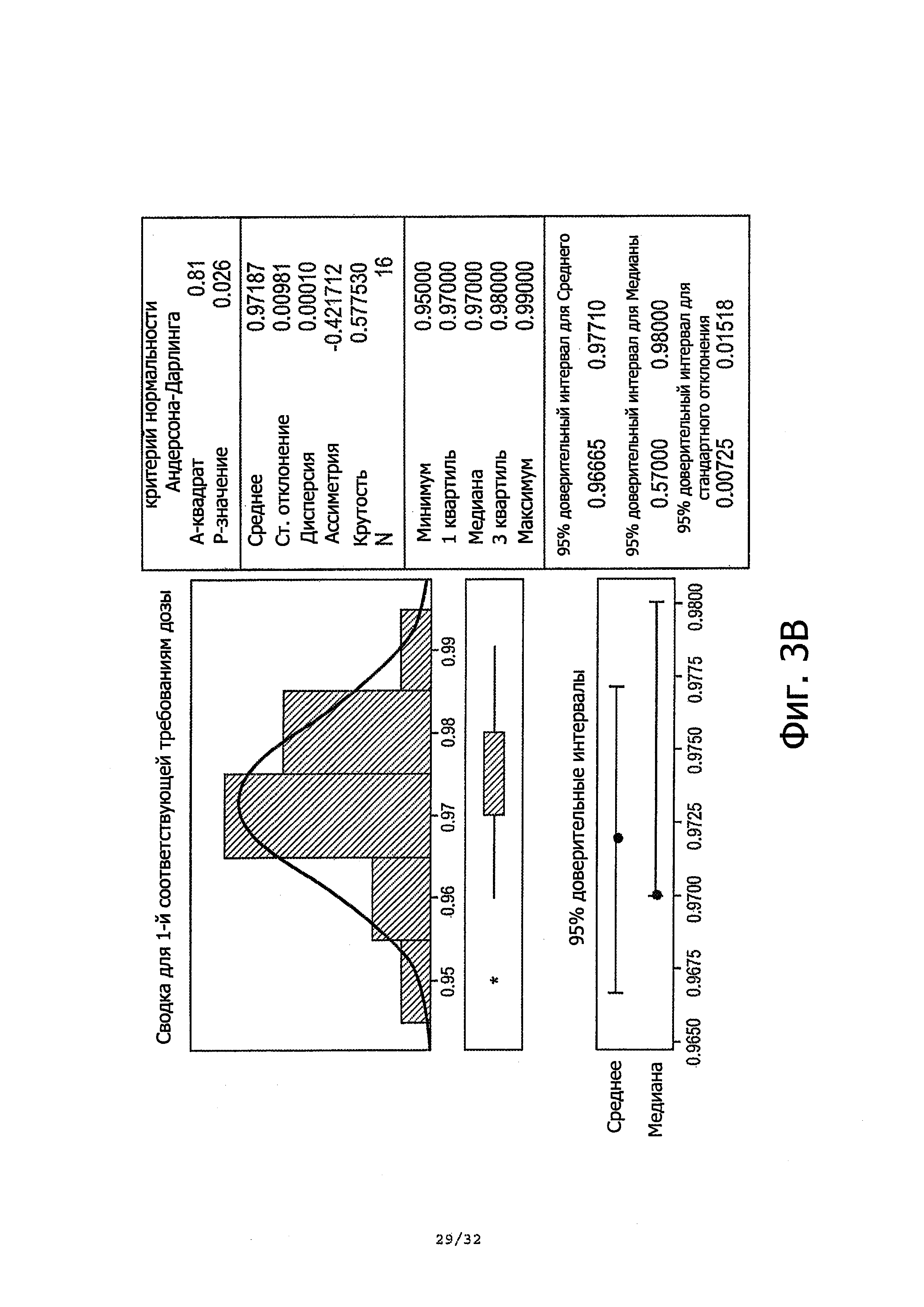
Фиг. 3А-3В демонстрирует схему прогона (фиг. 3А) и статистическую сводку первой соответствующей требованиям дозы из всех контейнеров (фиг. 3В).
Количество действий для первичного заполнения зависит от уровня наполнения контейнера. В данном исследовании все контейнеры были наполнены до полной емкости, и два, три, четыре или пять действий требовались для полного первичного заполнения насоса, в зависимости от того, насколько полно были наполнены бутыли.
Результаты исследования показали, что каждая бутыль была способна доставить больше, чем 120 соответствующих требованиям доз. Для взаимосогласованности и сравнения между всеми контейнерами, в данной сессии анализировали только первые 120 последовательных доз после первичного заполнения. Соответствующие требованиям дозы в течение первичного заполнения и в конце описаны в 4.4.
4.3.1. Общая статистика
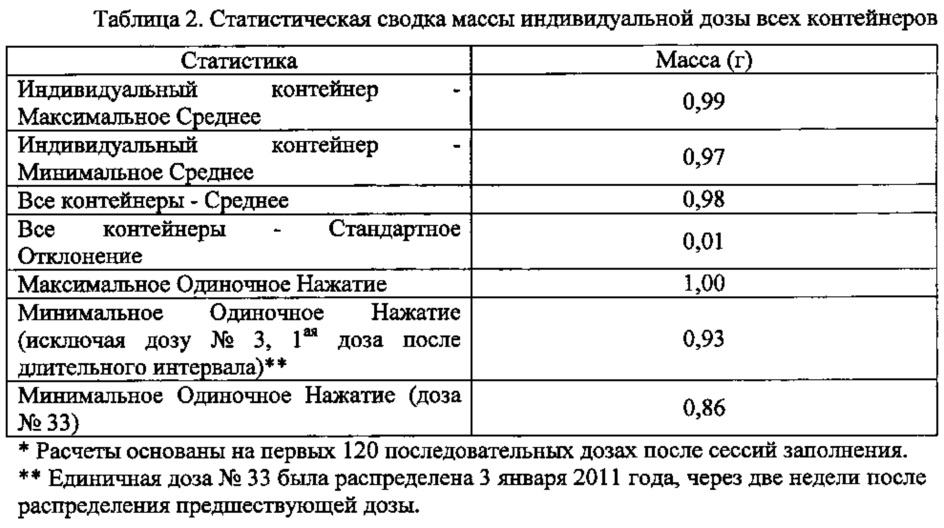
Общая статистика перечислена в таблице 2 ниже. Среди всех 16 контейнеров доза номер 33 была сообразно наиболее низкой дозой среди 120 единичных доз. Это было вызвано испарением растворителя через головку насоса после стояния в течение двух недель.
4.3.2. Анализ производительности
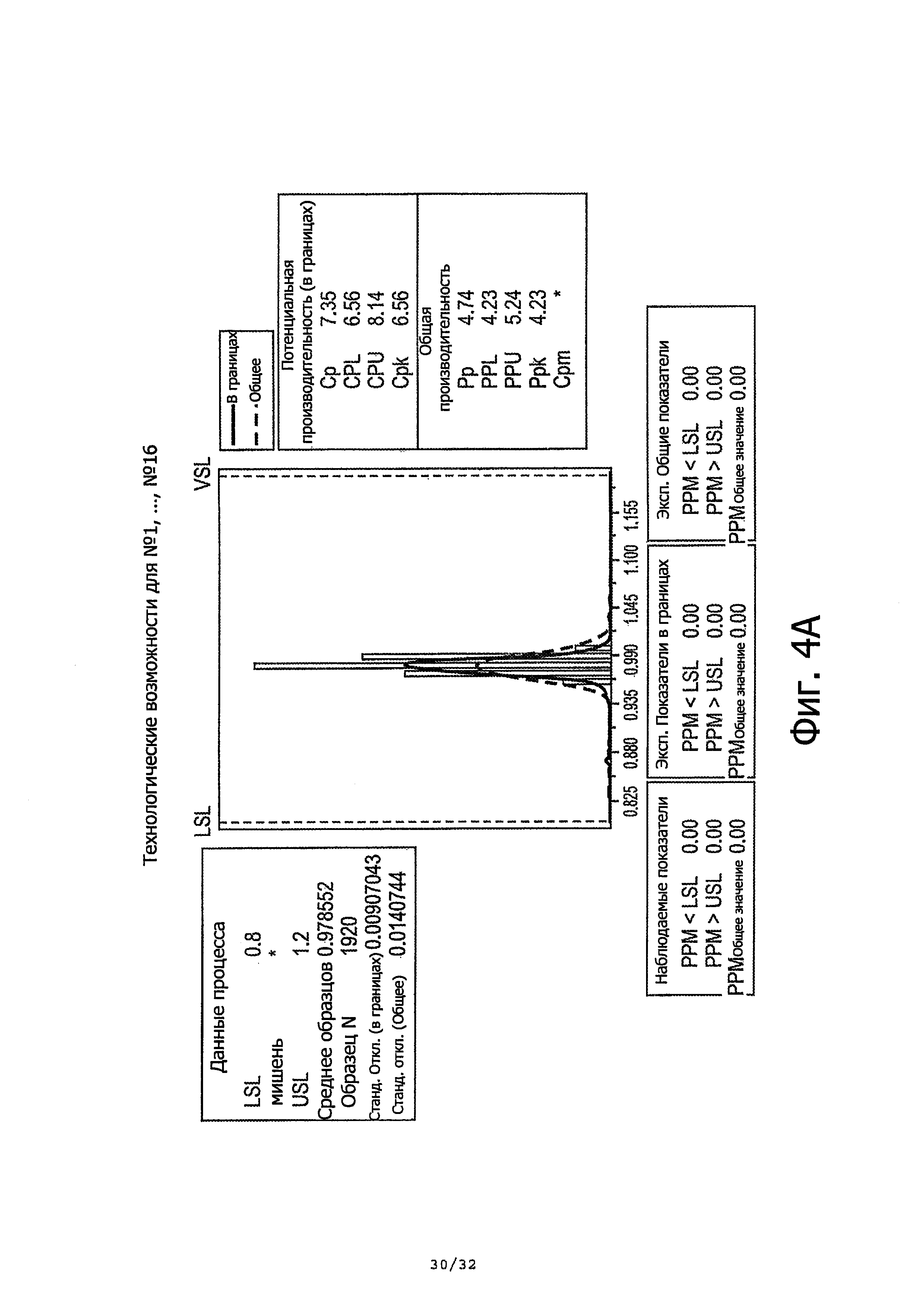
Описание текущего предложенного продукта требует среднюю массу дозы в пределах 0,8-1,2 г. Как показано в таблице 2 выше, средние массы единичных доз находятся в пределах описания. Для дальнейшей проверки производительности контейнерного насоса, проводили анализ производительности на всех единичных дозах, разбитых на подгруппы по контейнерам. Результаты демонстрируют высокую производительность по последовательно доставляемым единичным дозам в пределах диапазона 0,8-1,2 г. Даже когда диапазон установлен между 0,9-1,1 г, получали общее Cpk 2,89 и Ppk 1,86. Количественные показатели производительности были выше при исключении из анализа особого случая, т.е. дозы номер 33.
Фиг. 4А-4В суммирует результаты анализа производительности.
Таблица 2А (ниже) демонстрирует сравнительные эмпирические данные среди других конструкций насосов, которые были протестированы. Три насоса были протестированы по требованиям первичного заполнения, аккуратности и точности распределяемых количеств, остаточному продукту, остающемуся в бутылях, и т.п. Аккуратность и точность отражены в таблице.
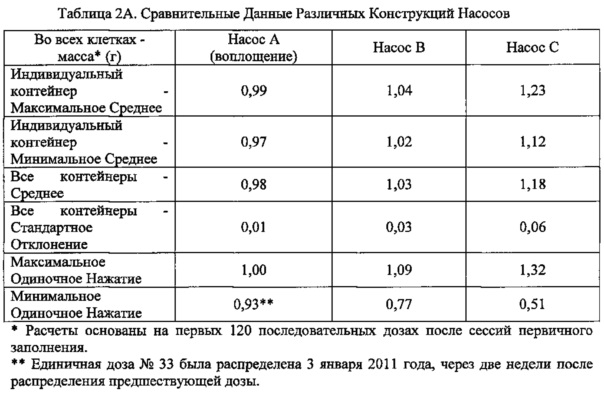
Как показано в таблице, конструкция Насоса А распределяет продукт более точно (т.е. в пределах 0,02 г при 1,00 г), чем конструкция Насоса В (т.е. в пределах 0,03 г при 1,00 г) и конструкция Насоса С (т.е. в пределах 0,18 г от 1,00 г). Точность при распределении является важной для того, чтобы продукт не нуждался в изменении рецептуры (например, разведении, концентрировании), чтобы насос распределял корректную дозу. Избегание изменения рецептуры сохраняет время и усилия при получении у регулятора разрешения для реализации продукта на рынке. Аккуратность и точность распределенной дозы, в недорогом, надежном и дружелюбном для потребителя диспенсере, повышает безопасность и эффективность болеутоляющего средства.
Также, как показано в таблице, конструкция Насоса А распределяет продукт более точно (т.е. в пределах стандартного отклонения 0,01 г к его среднему), чем конструкция Насоса В (т.е. в пределах стандартного отклонения 0,03 г к его среднему) и конструкция Насоса С (т.е. в пределах стандартного отклонения 0,06 г к его среднему). Точность распределения важна для того, чтобы дозы были воспроизводимыми. Поэтому максимальные и минимальные одиночные действия продукта должны быть близкими к среднему значению для того, чтобы минимизировать дозы с резко выпадающими значениями.
Таким образом, в соответствии с воплощением изобретения Насос А показан как более качественный, чем Насосы В и С.
4.3.3. Анализ контроля технологических процессов
Фиг. 5 представляет собой гистограмму средних значений X-bar/S, которую использовали для статистического контроля при исследовании дозирования. Каждая точка в верхней части гистограммы представляет собой среднюю массу единичных доз для каждого из 16 контейнеров, тогда как в нижней части гистограммы показаны все соответствующие стандартные отклонения. График подтверждает общее среднее 0,98 г на единичную дозу, со стандартным отклонением 0,01 г. Хотя некоторые точки данных выпадают из полос ±3σ, общее распределение доз, по-видимому, имеет хорошую статистику. Доза номер 33 является особым случаем из-за испарения продукта после длительного хранения. Тщательная проверка низких доз перед последней стадией распределения показала, что многие из них совпадают с первой единичной дозой утром, что опять-таки связано со слабым испарением. Спад средней массы единичной дозы в конце вызван низким количеством продукта в контейнерах. В целом, масса единичной дозы остается стабильной и вполне попадает в диапазон 0,9-1,1 г. Фиг. 5 демонстрирует статистическую карту технологического контроля для массы единичной дозы.
4.4. Количество соответствующих требованиям доз
Все 120 проанализированных выше доз подпадают под описание продукта 0,8-1,2 г, они также соответствуют следующим жестким ограничениям, предложенным в данном протоколе: в пределах 20 последовательных доз, не более 2 доз выпадают из диапазона 0,9-1,1 г и ни одна - из диапазона 0,8-1,2 г.
На основании вышеуказанных критериев, были получены дополнительные соответствующие требованиям дозы. Согласно протоколу, после того, как был распределен первый продукт, были осуществлены три нажатия. Как обсуждалось в 4.2, все три нажатия дали дозы, соответствующие требованиям. Дозы, соответствующие требованиям в большей мере, также были получены после распределения 120 единичных доз. В целом, общее количество соответствующих требованиям доз находилось в диапазоне от 126 до 132.
4.5. Общие отходы
Общее количество отходов включает, дозы первичного заполнения, несоответствующие требованиям дозы в конце и остаток в контейнере. Средняя масса отходов составляла 6,58 г, со стандартным отклонением 1,12 г.
4.6. Давление надувания и емкость заполнения
После надувания при 6 psi, все контейнеры заполняли до одинакового уровня. Средняя масса наполнения составляла 134,6 г, со стандартным отклонением 1,21 г. Значения варьировали от 131,57 до 136,08 г.
Отдельно от этого протокола, было проведено исследование для оценки влияния давления надувания на емкость наполнения. Осуществляли дисперсионный анализ, результаты суммированы ниже. Было проведено сравнение средней емкости при каждом давлении против емкостей при всех других давлениях, с использованием парного критерия Фишера. Статистические различия в емкостях наполнения были отмечены между следующими давлениями: 3 и 5 и выше, 4 и 5 и выше, 5 и 7 psi.

(Примечания: Source - источник; Pressure - давление; Error - ошибка; Total - Всего; Lavel - уровень; Mean - среднее; StDev - стандартное отклонение; Individual 95% CIs For Mean Based on Pooled StDev - Индивидуальные 95% доверительные области для среднего, основанные на суммарном стандартном отклонении.)
Вышеуказанное является сводкой дисперсионного анализа влияния давления на емкость наполнения.
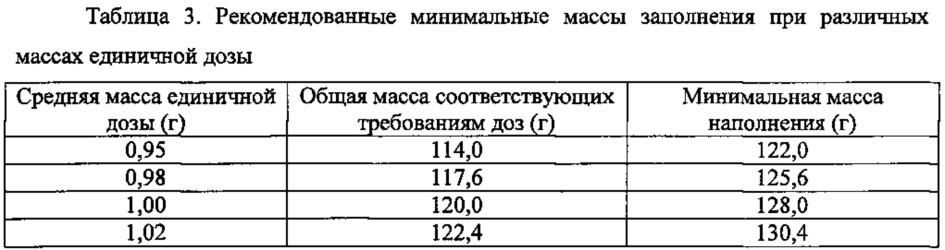
4.7. Рекомендуемая минимальная масса наполнения
Количество соответствующих требованиям доз прямо зависит от массы наполнения контейнера и массы единичной дозы. Основываясь на установившимся общем количестве отходов, равном 8 граммам, следующие минимальные массы наполнения предложены при различных массах единичной дозы.

5. Заключение
Контейнер «Rexam Sof'Bag 100 mL» с 1 мл распределяющим насосом способен доставить единичные дозы NLT 120 геля Pennsaid с высокой точностью и аккуратностью. Средняя масса единичной дозы, доставляемая всеми контейнерами, составляет 0,98 г, со стандартным отклонением 0,01 г. Атрибуты доставки дозы оставались стабильными в течение 30 сессий распределения и одномесячного периода исследования.
6. Отклонения
Протокол определил целевую массу наполнения 132 г (диапазон 131-133 г). Однако, для оценки вариабельности емкости наполнения при установленном давлении 6 psi, все контейнеры заполняли до полной емкости. Актуальные массы наполнения находились в диапазоне 131,57-136,08 г.
Пример 2. Клинический Фармакокинетический анализ Топического Вязкого Раствора 2,0% масс/масс. Диклофенака Натрия - Множественная Доза
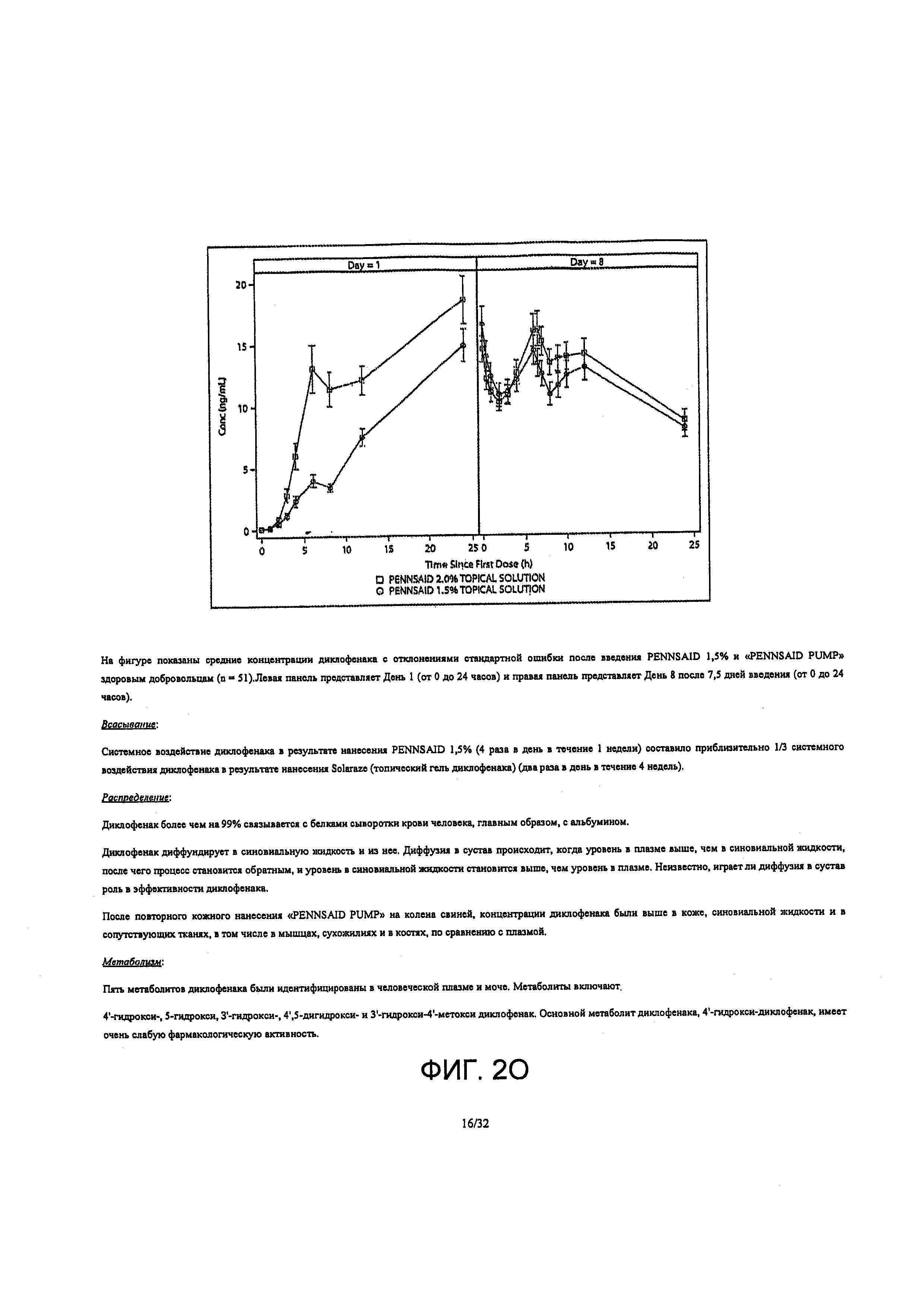
Топический вязкий раствор 2% масс/масс. диклофенака натрия по настоящему изобретению наносили на оба колена (2 мл [40,4 мг] на колено), топически, каждые 12±0.5 часа в течение 7,5 дней подряд в сытом состоянии. Объекты распределяли раствор из ручного Насоса А Примера 1 и наносили топический вязкий раствор на чистую сухую кожу. Для того чтобы избежать потерь, 2 мл (2 насоса) топического вязкого раствора распределяли вначале на руку, а затем на колено. Топический вязкий раствор распределяли равномерно вокруг передней, задней и боковых поверхностей колена. Процедуру повторяли на другом колене, осуществляя нанесение досуха.
Определяли следующие фармакокинетические параметры для диклофенака натрия:
День 1: Максимальная наблюдаемая концентрация в плазме (Cmax), время до Cmax (Tmax) и площадь под кривой концентрации в плазме для интервалов дозирования 0-12 часов (AUC0-12) и скорректированная для периода времени от 0 до 24 часов (AUC0-24);
День 8: Параметры равновесного состояния: AUC0-24SS; максимальная наблюдаемая концентрация лекарственного средства в плазме в равновесном состоянии (Cmax SS), наблюдаемое время до Cmax в равновесном состоянии (Tmax SS).
Фармакокинетические параметры диклофенака определяли и рассчитывали для топического вязкого раствора в пределах интервала дозирования от 0 до 12 часов. Арифметическое среднее и SD для фармакокинетических параметров для диклофенака, рассчитанные для топического вязкого раствора, представлены в таблице 4 ниже:
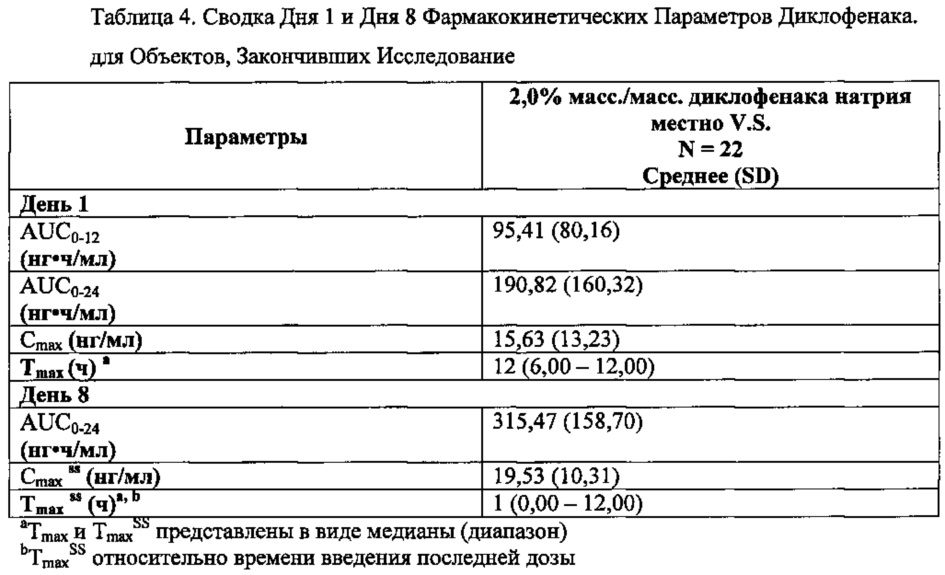
После исходного введения дозы топического вязкого раствора, средние концентрации диклофенака в плазме быстро повысились в пределах 6 часов и продолжали расти до 24 часов. Измерения равновесного состояния (перед утренней дозой со 2 по 8 Дни) показали, что концентрации диклофенака остаются повышенными, примерно 20 нг/мл, с 24 по 168 часы. Измерения сразу после последнего введения дозы в 168 час показали, что концентрации диклофенака повысились примерно в 10 раз, а затем постепенно снижались до 10 нг/мл в 192 часа (24 часа после последней дозы).
Пример 3. Клинический Фармакокинетический анализ Топического Вязкого Раствора 2,0% масс/масс. Диклофенака Натрия - Множественная Доза
Топический вязкий раствор 2% масс/масс. диклофенака натрия по настоящему изобретению наносили на оба колена (2 мл [40,4 мг] на колено), топически, дважды в день в течение 7,5 дней подряд. Общая ежедневная доза составляла примерно 162 г. Топический вязкий раствор поставляли в полипропиленовых бутылях для насоса, отмеряющего дозы, содержащих по 120 мл каждая. Каждый насос распределял примерно 1 мл топического вязкого раствора. Объекты распределяли раствор из ручного Насоса А Примера 1 и наносили топический вязкий раствор на чистую сухую кожу. Для того чтобы избежать потерь, 2 мл (2 насоса) топического вязкого раствора распределяли вначале на руку, а затем на колено. Топический вязкий раствор распределяли равномерно вокруг передней, задней и боковых поверхностей колена. Процедуру повторяли на другом колене, позволяя нанесению полностью высохнуть. Обработку проводили дважды в день (в 6 утра и 6 вечера). Следующие ФК параметры для диклофенака определяли для обеих обработок:
День 1: площадь под кривой концентрации в плазме для первого интервала внесения дозы с 0 до 12 ч (AUC0-12) и скорректированная для периода времени от 0 до 24 ч (AUC0-24), максимальная наблюдаемая концентрация в плазме (Cmax), и время наблюдаемой максимальной концентрации в плазме (Tmax); День 8: AUC для последнего интервала введения дозы, скорректированная для периода времени от 0 до 24 ч (AUC0-24 SS), Cmax в равновесном состоянии (CmaxSS), Tmax в равновесном состоянии (Tmax SS).
AUC0-12 и AUC0-12SS рассчитывали для топического вязкого раствора, в интервале дозирования от 0 до 12 ч на День 1 и День 8. Для того, чтобы сравнение между экспонированием каждой из обработок можно было оценить на ежедневной основе, AUC0-24 и AUC0-24 SS рассчитывали как AUC0-12 и AUC0-12 SS × 2 для 2% масс/масс.топического вязкого раствора диклофенака натрия.
После изначального дозирования топическим вязким раствором, среднее концентрации в плазме диклофенака натрия быстро повышалось в течение 6 часов и продолжали повышаться до достижения среднего (SD) 14,65 нг/мл (12,38) в 24 ч. Измерения стационарного состояния (перед утренней дозой на со 2 по 8 Дни) показали, что средние концентрации диклофенака сохранялись между 12 и 16 нг/мл с 24 по 168 ч. На 8 День, топический вязкий раствор имел AUC0-24 SS 322,57 нг⋅ч/мл (52% вариационный коэффициент [CV]) и Cmax SS 19,99 нг/мл (51% CV). На 8 День, топический вязкий раствор имел AUC0-24 SS of 251.24 нг⋅ч/мл (61% CV) и Cmax SS 14,61 нг⋅ч/мл (63% CV).
Высокая межиндивидуальная изменчивость является характеристикой топических составов. Арифметическое среднее и SD для ФК-параметров диклофенака, рассчитанные для топического вязкого раствора, представлены в таблице 5 ниже.
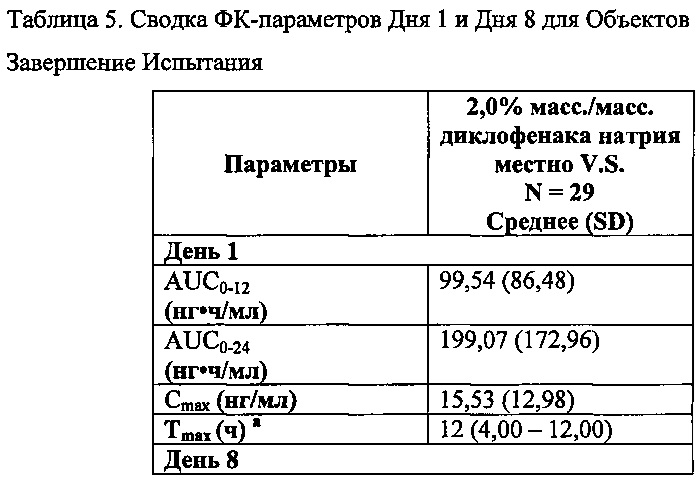

Пример 4
В таблице 6 представлены фармакокинетические параметры диклофенака 51 здоровых волонтеров-людей, обработанных топически 2,0% масс/масс, топического вязкого раствора диклофенака натрия по настоящему изобретению (распределенного из ручного насоса А Примера 1) на оба колена (2 мл [40,4 мг] на колено), топически, дважды в день в течение 7,5 дней подряд.
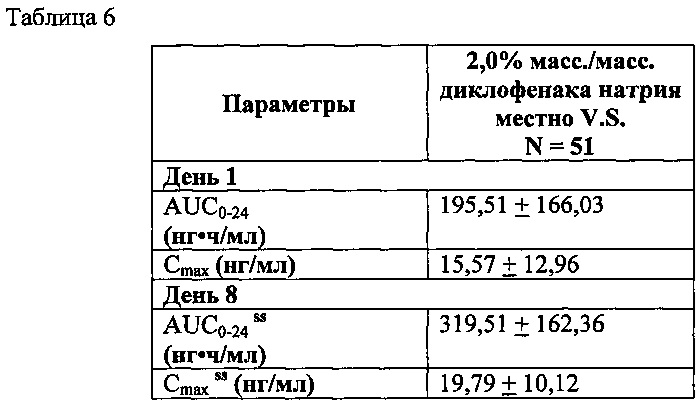
Данные представляют среднее +/- стандартное отклонение
Понятно, что примеры и варианты, описанные в данном документе, даны в иллюстративных целях и, что с их учетом специалистами в данной области будут предложены различные модификации или изменения, которые включаются в соответствии с духом и сферой применения настоящей заявки и объемом притязаний прилагаемой формулы изобретения. Все публикации, патенты и патентные заявки, процитированные в данном документе, включены ссылкой во всей полноте и для всех целей.