Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ АРОМАТИЧЕСКИХ АЦЕТИЛЕНОВЫХ КЕТОНОВ
Вид РИД
Изобретение
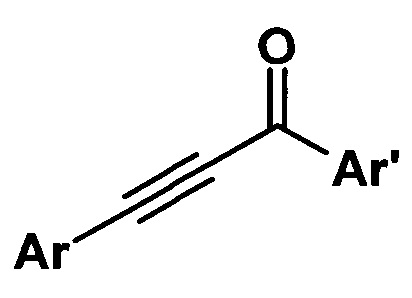
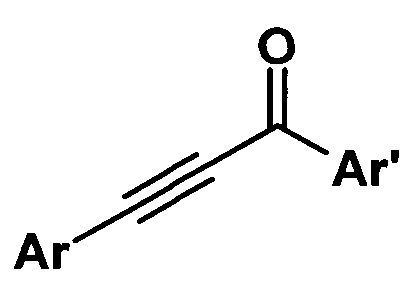
Изобретение относится к способу получения ароматических ацетиленовых кетонов общей формулы
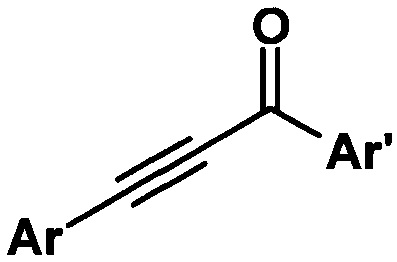
где Ar, Ar' - ароматические радикалы.
Ароматические ацетиленовые кетоны находят разнообразное применение в синтезе различных гетероциклических соединений [Ponpandian Т. Sequential [3+2] cycloaddition/air oxidation reactions: Triazoloyl ion assisted oxidative cleavage of alkynes / Ponpandian Т., Muthusubramanian S., Rajagopal S. // Eur. J. Org. Chem. - 2013. - №19 - C. 3974-3977; Harigae R. Preparation of 3,5-disubstituted pyrazoles and isoxazoles from terminal alkynes, aldehydes, hydrazines, and hydroxylamine / Harigae R., Moriyama K., Togo H. // J. Org. Chem. - 2014. - T. 79 - №5 - C. 2049-2058; Yoshida M. A concise total synthesis of biologically active frutinones via tributylphosphine-catalyzed tandem acyl transfer-cyclization / Yoshida M., Saito K., Fujino Y., Doi T. // Tetrahedron - 2014. - T. 70 - №21 - C. 3452-3458; Zhou J. Synthesis of phosphonylated and thiolated indenones by manganese(III)- mediated addition of phosphorus- and sulfur-centered radicals to 1,3-diarylpropynones / Zhou J., Zhang G.L., Zou J.P., Zhang W. // Eur. J. Org. Chem. - 2011. - №19 - C. 3412-3415.], а также проявляют биологическую активность [Glazunova N.P. Antimicrobial activity of acetylene keto-ethers / Glazunova N.P., Kirillova L.P., Yashina O.G., Vereshchagin L.I. // Translated from Khtmiko Farmatsevticheskti Zhurnal - 1974. - T. 8 - №4 - C. 18-22; Gavrilov L.D. Synthesis of diarylpropynones and their antibiotic activity / Gavrilov L.D., Meshcheryakov V.I., Glazunova N.P., Kalyagina G.F., Dobronravova Z.A., Vereshchagin L.I. // Translated from Khtmiko Farmatsevticheskti Zhurnal - 1978. - T. 12 - №9 - С. 42-45].
Известны способы получения ацетиленовых кетонов взаимодействием 1-алкинов с хлорангидридами карбоновых кислот в присутствии палладиевого катализатора и основания [Hoven B.G. Van den Chemo- and regioselective cyclohydrocarbonylation of keto alkynes catalyzed by a zwitterionic rhodium complex and triphenyl phosphite / Hoven B.G. Van den, Ali B. El, Alper H. // J. Org. Chem. - 2000. - T. 65 - №13 - C. 4131-4137; Palimkar S.S. Copper-, ligand- and solvent-free synthesis of ynones by coupling acid chlorides with terminal alkynes / Palimkar S.S., Kumar P.H., Jogdand N.R., Daniel Т., Lahoti R.J., Srinivasan K.V. // Tetrahedron Letters - 2006. - T. 47 - №31 - C. 5527-5530]. Однако использование палладиевого катализатора является весьма дорогостоящим, а хлорангидриды карбоновых кислот являются весьма агрессивными реагентами.
Известен способ получения ацетиленовых кетонов взаимодействием йодацетиленов с альдегидами в присутствии индия. Взаимодействие проводят в дихлорэтане в присутствии 1,5 эквивалента индия по отношению к йодацетилену при 80°C в течение 6 часов [ Indium-mediated formation of propargyl ketones from aldehydes or acyl chlorides /
Indium-mediated formation of propargyl ketones from aldehydes or acyl chlorides /  Lubin-Germain N., Seghrouchni L. // Tetrahedron Letters - 2003. - T. 44 - №4 - C. 819-821]. При этом ацетиленовые кетоны образуются с выходами до 93%, однако способ требует применения дорогостоящих йодацетиленов.
Lubin-Germain N., Seghrouchni L. // Tetrahedron Letters - 2003. - T. 44 - №4 - C. 819-821]. При этом ацетиленовые кетоны образуются с выходами до 93%, однако способ требует применения дорогостоящих йодацетиленов.
Известны так же двухстадийные методы получения ацетиленовых кетонов, основанные на взаимодействии ацетиленидов магния [Glazunova N.P. Antimicrobial activity of acetylene keto-ethers / Glazunova N.P., Kirillova L.P., Yashina O.G., Vereshchagin L.I. // Translated from Khtmiko Farmatsevticheskti Zhurnal - 1974. - T. 8 - №4 - C. 18-22; Gavrilov L.D. Synthesis of diarylpropynones and their antibiotic activity / Gavrilov L.D., Meshcheryakov V.I., Glazunova N.P., Kalyagina G.F., Dobronravova Z.A., Vereshchagin L.I. // Translated from Khtmiko Farmatsevticheskti Zhurnal - 1978. - T. 12 - №9 - C. 42-45; Miiller V.E. Synthesen von Chinonen / Miiller V.E., Beijner C., Jakle H., Langer E., Odenigbo G., Sauerbier M., Segnitz A., Streichjiufl D., Thomas R. // Liebigs Ann. Chem. - 1971. - T. 754 - C. 64-89] или ацетиленидов лития [Livingston R. 1,3-Diethynylallenes: Carbon-rich modules for three-dimensional acetylenic scaffolding / Livingston R., Cox L.R., Odermatt S., Diederich F. // Helvetica Chimica Acta - 2002. - T. 85 - №10 - C. 3052-3077; Jong T.-T. Intramolecular cyclisation catalysed by silver(I) ion; a convenient synthesis of aurones / Jong T.-T., Leu S.-J. // J. of the Chem. Soc., Perkin Trans. 1 - 1990. - №2 - C. 423; Schmidt B. Tandem Claisen Rearrangement/6-endo Cyclization Approach to Allylated and Prenylated Chromones / Schmidt В., Riemer M, Schilde U. // Eur. J. Org. Chem. - 2015. - T. 2015 - №34 - C. 7602-7611; Shao J. Synthesis of N-alkyl-substituted 4-quinolones via tandem alkenyl and aryl C-N bond formation / Shao J., Huang X., Hong X., Liu В., Xu B. // Synthesis - 2012. - T. 44 - №12 - C. 1798-1808] с альдегидами с последующим окислением полученных спиртов диоксидом марганца или йодом [Ushijima S. Facile preparation of aromatic ketones from aromatic bromides and arenes with aldehydes / Ushijima S., Dohi S., Moriyama K., Togo H. // Tetrahedron - 2012. - T. 68 - №5 - C. 1436-1442]. Однако данные методы весьма трудоемки и длительны в исполнении.
Наиболее близким аналогом к предлагаемому техническому решению является способ получения ароматических ацетиленовых кетонов взаимодействием 1-алкинов с альдегидами в присутствии триэтиламина и бромида индия при 40°C в растворе диэтилового эфира при перемешивании в течение 24 часов [Ogiwara Y. Oxidative Coupling of Terminal Alkynes with Aldehydes Leading to Alkynyl Ketones by Using Indium(III) Bromide / Ogiwara Y., Kubota M., Kurogi K., Konakahara Т., Sakai N. // Chemistry - A European Journal - 2015. - T. 21 - №51 - C. 18598-18600].
При этом происходит присоединение ацетилена к альдегиду с образованием ацетиленового спирта и его окисление по Опенауэру второй молекулой альдегида. Ароматические ацетиленовые кетоны получаются с выходом до 84%.
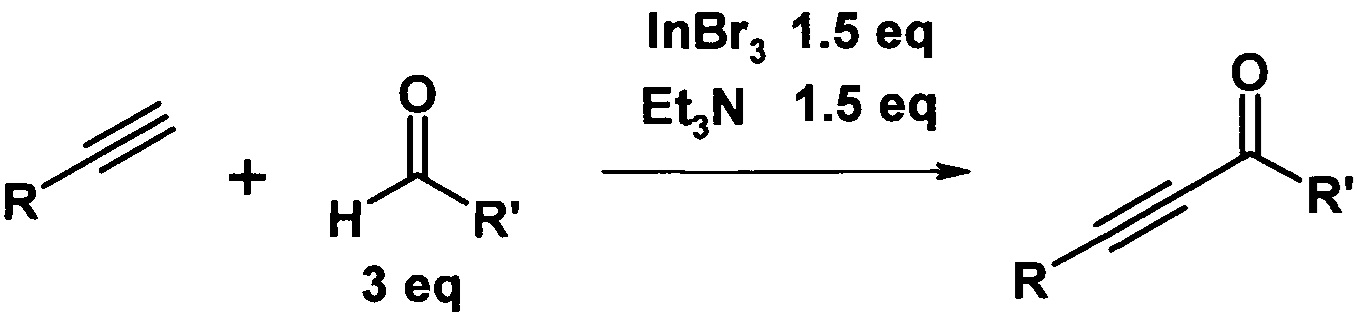
Способ имеет ряд недостатков, а именно, для повышения выхода конечного продукта, например, до 83% необходимо применение 3 эквивалентов альдегида, что ведет к перерасходу реагента.
Катализатор на основе бромида индия и триэтиламина берут в количестве 1,5 эквивалента по отношению к ацетилену. Взаимодействие протекает в течение 24 часов под давлением, поскольку температура проведения синтеза 40°C, т.е. выше температуры кипения диэтилового эфира (34,6°C). Итак, способ длительный, затратный.
Техническим результатом предлагаемого способа является упрощение способа получения ароматических ацетиленовых кетонов, сокращение времени получения конечного продукта, а также снижение расхода реагента (альдегида) и катализатора.
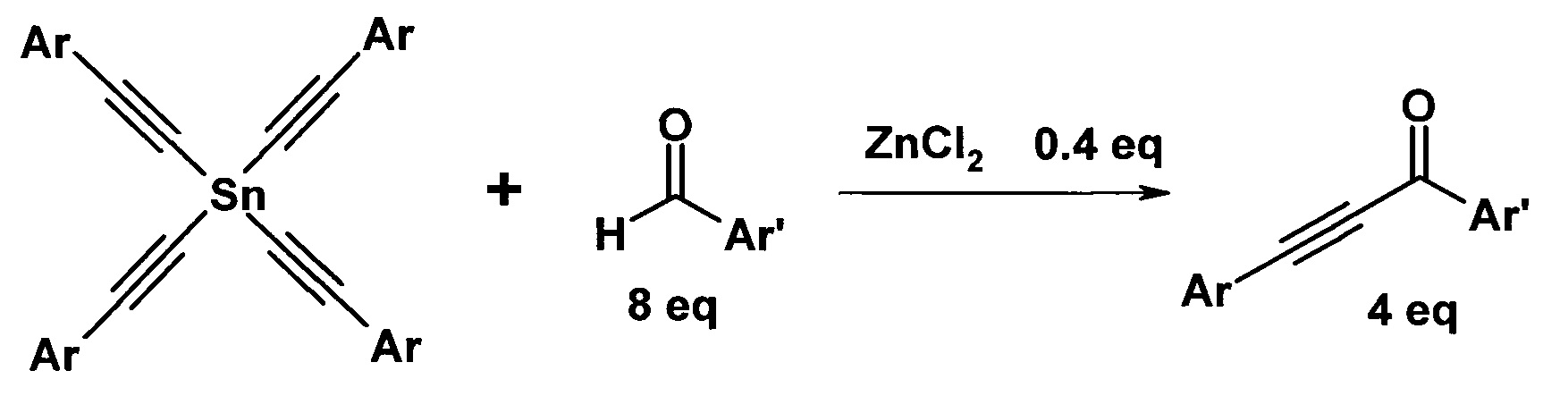
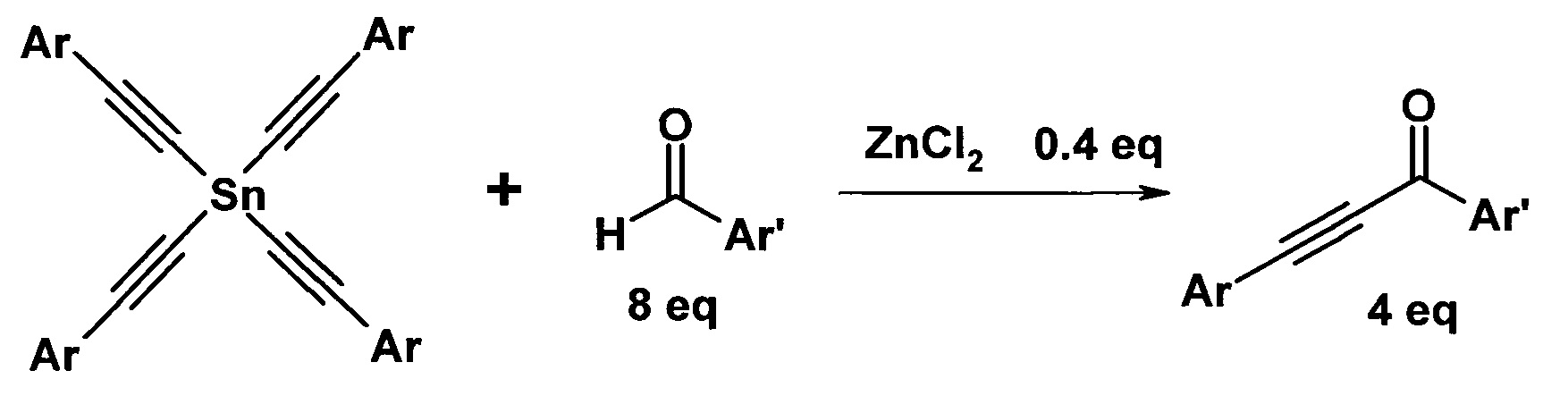
Для достижения технического результата предлагается проводить взаимодействие альдегидов с тетраалкинилидами олова в среде толуола в присутствии 0,1 эквивалента хлорида цинка по отношению к ацетиленовому фрагменту в качестве катализатора при температуре 40-60°C при перемешивании в течение 4-6 часов. Реакция протекает по схеме:
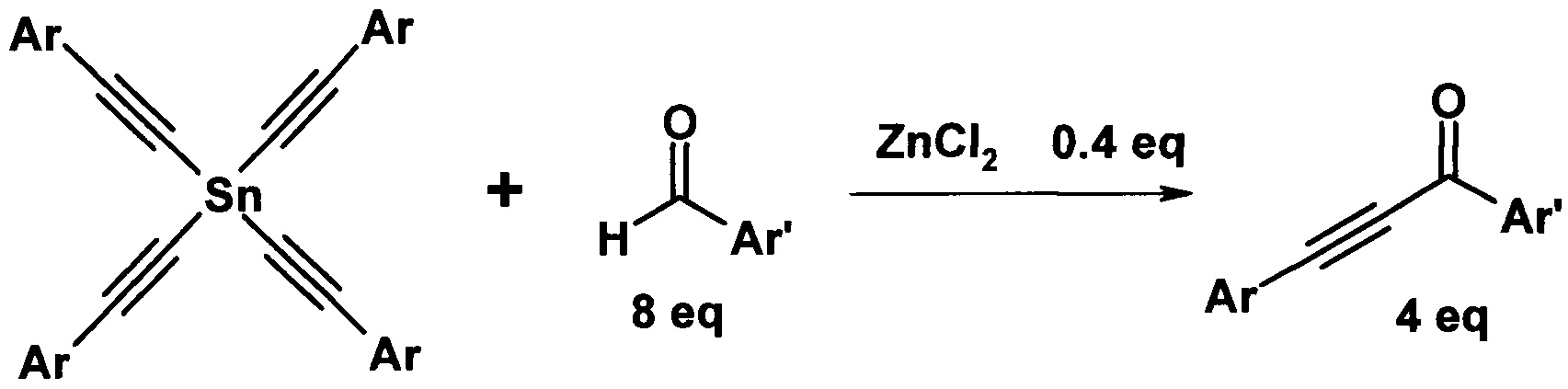
Присоединение оловоацетилена к альдегиду происходит с образованием ацетиленового спирта и его окислением по Опенауэру второй молекулой альдегида. При этом на 1 эквивалент ацетиленового фрагмента расходуют 2 эквивалента альдегида. Выходы ароматических ацетиленовых кетонов составляют до 98% без применения избыточного количества альдегида. Проведение реакции не требует повышенного давления.
Тетраалкинилиды олова являются доступными веществами и могут быть легко получены взаимодействием 1-алкинов с четыреххлористым оловом [патент РФ №2317993, Левашов А.С., Андреев А.А., Комаров Н.В. / Способ получения три- и тетраорганилалкинилолова, заявка №2006126447/04, заявл. 20.07.2006, Россия, МПК C07F 7/22 (2006.01, опубл. 27.02.2008, Бюл. №6].
Пример 1. Получение 1,3-дифенилпроп-2-ин-1-она
В вайл помещают 10,4 мг (0,076 ммоль) безводного хлорида цинка, 0,8 мл толуола, 100 мг (0,191 ммоль) тетрафенилэтинилолова и 155 мкл (1,53 ммоль) бензальдегида. Перемешивают при 60°C в течение 5 часов, гидролизуют реакционную смесь 1М раствором соляной кислоты, продукт экстрагируют хлороформом и очищают методом колоночной хроматографии. Получают 154 мг 1,3-дифенилпроп-2-ин-1-она (98%). ЯМР 1H δ 7.40-7.55 (m, 5 Н, ArH), 7.61-7.71 (m, 3 Н, ArH), 8.24 (d, J=8.0 Гц, 2 Н, ArH);
ЯМР 13C δ 86.8, 93.1, 120.0, 128.6, 128.6, 129.5, 130.8, 133.0, 134.1, 136.8, 178.0.
Пример 2. Получение 1,3-дифенилпроп-2-ин-1-она
В вайл помещают 10,4 мг (0,076 ммоль) безводного хлорида цинка, 0,8 мл толуола, 100 мг (0,191 ммоль) тетрафенилэтинилолова и 155 мкл (1,53 ммоль) бензальдегида. Перемешивают при 40°C в течение 5 часов, гидролизуют реакционную смесь 1М раствором соляной кислоты, продукт экстрагируют хлороформом и очищают методом колоночной хроматографии. Получают 154 мг 1,3-дифенилпроп-2-ин-1-она (97%).
ЯМР 1H δ 7.40-7.55 (m, 5 Н, ArH), 7.61-7.71 (m, 3 Н, ArH), 8.24 (d, J=8.0 Гц, 2 Н, ArH);
ЯМР 13C δ 86.8, 93.1, 120.0, 128.6, 128.6, 129.5, 130.8, 133.0, 134.1, 136.8, 178.0.
Пример 3. Получение 1,3-дифенилпроп-2-ин-1-она
В вайл помещают 10,4 мг (0,076 ммоль) безводного хлорида цинка, 0,8 мл толуола, 100 мг (0,191 ммоль) тетрафенилэтинилолова и 155 мкл (1,53 ммоль) бензальдегида. Перемешивают при 80°C в течение 5 часов, гидролизуют реакционную смесь 1М раствором соляной кислоты, продукт экстрагируют хлороформом и очищают методом колоночной хроматографии. Получают 154 мг 1,3-дифенилпроп-2-ин-1-она (88%).
ЯМР 1H δ 7.40-7.55 (m, 5 Н, ArH), 7.61-7.71 (m, 3 Н, ArH), 8.24 (d, J=8.0 Гц, 2 Н, ArH);
ЯМР 13C δ 86.8, 93.1, 120.0, 128.6, 128.6, 129.5, 130.8, 133.0, 134.1, 136.8, 178.0.
Пример 4. Получение 1,3-дифенилпроп-2-ин-1-она
В вайл помещают 10,4 мг (0,076 ммоль) безводного хлорида цинка, 0,8 мл толуола, 100 мг (0,191 ммоль) тетрафенилэтинилолова и 155 мкл (1,53 ммоль) бензальдегида. Перемешивают при 60°C в течение 4 часов, гидролизуют реакционную смесь 1М раствором соляной кислоты, продукт экстрагируют хлороформом и очищают методом колоночной хроматографии. Получают 154 мг 1,3-дифенилпроп-2-ин-1-она (97%).
ЯМР 1H δ 7.40-7.55 (m, 5 Н, ArH), 7.61-7.71 (m, 3 Н, ArH), 8.24 (d, J=8.0 Гц, 2 Н, ArH);
ЯМР 13C δ 86.8, 93.1, 120.0, 128.6, 128.6, 129.5, 130.8, 133.0, 134.1, 136.8, 178.0.
Пример 5. Получение 1,3-дифенилпроп-2-ин-1-она
В вайл помещают 10,4 мг (0,076 ммоль) безводного хлорида цинка, 0,8 мл толуола, 100 мг (0,191 ммоль) тетрафенилэтинилолова и 155 мкл (1,53 ммоль) бензальдегида. Перемешивают при комнатной температуре (25°C) в течение 5 часов, гидролизуют реакционную смесь 1М раствором соляной кислоты. Взаимодействие не происходит.
Пример 6. Получение 1,3-дифенилпроп-2-ин-1-она
В вайл помещают 0,8 мл толуола, 100 мг (0,191 ммоль) тетрафенилэтинилолова и 155 мкл (1,53 ммоль) бензальдегида. Перемешивают при 60°C в течение 5 часов, гидролизуют реакционную смесь 1М раствором соляной кислоты. Взаимодействие не происходит.
Пример 7. Получение 1-(4-метоксифенил)-3-фенилпроп-2-ин-1-она
В вайл помещают 10,4 мг (0,076 ммоль) безводного хлорида цинка, 0,8 мл толуола, 100 мг (0,191 ммоль) тетрафенилэтинилолова и 186,2 мкл (1,53 ммоль) 4-метоксибензальдегида. Перемешивают при 60°C в течение 6 часов, гидролизуют реакционную смесь 1М раствором соляной кислоты, продукт экстрагируют хлороформом и очищают методом колоночной хроматографии. Получают 98,8 мг 1-(4-метоксифенил)-3-фенилпроп-2-ин-1-она (55%).
ЯМР 1H δ 3.90 (s, 3 Н, OCH3), 7.00 (d, J=8.7 Гц, 2 Н, ArH), 7.39-7.51 (m, 3 Н, ArH), 7.66-7.68 (m, 2 Н, ArH), 8.20 (d, J=8.7 Гц, 2 Н, ArH);
ЯМР 13C δ 55.6, 86.9, 92.3, 113.9, 120.4, 128.7, 130.3, 130.6, 132.0, 132.9, 164.4, 176.7.
Пример 8. Получение 4-(3-фенилпроп-2-иноил)фенилбензоата
В вайл помещают 6,7 мг (0,05 ммоль) безводного хлорида цинка, 0,5 мл толуола, 64,4 мг (0,123 ммоль) тетрафенилэтинилолова и 222,6 мг (0,984 ммоль) 4-формилфенил бензоата. Перемешивают при 60°C в течение 6 часов, гидролизуют реакционную смесь 1М раствором соляной кислоты, продукт экстрагируют хлороформом и очищают методом колоночной хроматографии. Получают 133,3 мг 4-(3-фенилпроп-2-иноил)фенилбензоата (83%).
ЯМР 1H δ 7.38-7.44 (m, 4Н, ArH), 7.47-7.55 (m, 3H, ArH), 7.64-7.70 (m, 3 Н, ArH), 8.20-8.22 (d, J=8.25 Гц, 2 Н, ArH), 8.31 (d, J=9.1 Гц, 2 H, ArH);
ЯМР 13C δ 86.8, 93.4, 120.1, 122.1, 128.7, 129.0, 130.3, 130.9, 131.3, 133.1, 134.0, 134.6, 155.6, 164.5, 176.8.
Пример 9. Получение 1-(4-бромфенил)-3-(4-метилфенил)проп-2-ин-1-она
В вайл помещают 6,7 мг (0,05 ммоль) безводного хлорида цинка, 0,5 мл толуола, 66 мг (0,114 ммоль) тетратолилэтинилолова и 168,7 мг (0,912 ммоль) 4-бромбензальдегида. Перемешивают при 60°C в течение 6 часов, гидролизуют реакционную смесь 1М раствором соляной кислоты, продукт экстрагируют хлороформом и очищают методом колоночной хроматографии. Получают 116,3 мг 1-(4-бромфенил)-3-(4-метилфенил)проп-2-ин-1-она (85%).
ЯМР 1H δ 2.41 (s, 3 Н, CH3), 7.21 (d, J=7.8 Гц, 2 Н, ArH), 7.58 (d, J=7.8 Гц, 2 H, ArH), 7.65 (d, J=8.7 Гц, 2 H, ArH), 8.07 (d, J=8.7 Гц, 2 H, ArH);
ЯМР 13C δ 21.8, 88.5, 94.4, 116.8, 129.4, 129.6, 130.9, 132.0, 133.2, 135.8, 141.8, 176.9.
Пример 10. Получение 3-(4-хлорфенил)-1-фенилпроп-2-ин-1-она
В вайл помещают 6,7 мг (0,05 ммоль) безводного хлорида цинка, 0,5 мл толуола, 81,3 мг (0,123 ммоль) тетра(4-хлорфениллэтинил)олова и 100 мкл (0,986 ммоль) бензальдегида. Перемешивают при 60°C в течение 6 часов, гидролизуют реакционную смесь 1М раствором соляной кислоты, продукт экстрагируют хлороформом и очищают методом колоночной хроматографии. Получают 56,2 мг 3-(4-хлорфенил)-1-фенилпроп-2-ин-1-она (47,5%).
ЯМР 1H δ 7.40 (d, J=8.7 Гц, 2 Н, ArH), 7.49-7.53 (m, 2 H, ArH), 7.59-7.65 (m, 3H, ArH), 8.20 (d, 2 H, ArH);
ЯМР 13C δ 87.9, 91.9, 118.9, 129.0, 129.5, 129.9, 134.5, 137.0, 137.5, 178.1.
Обобщенные данные по примерам 1-10 представлены в таблице.
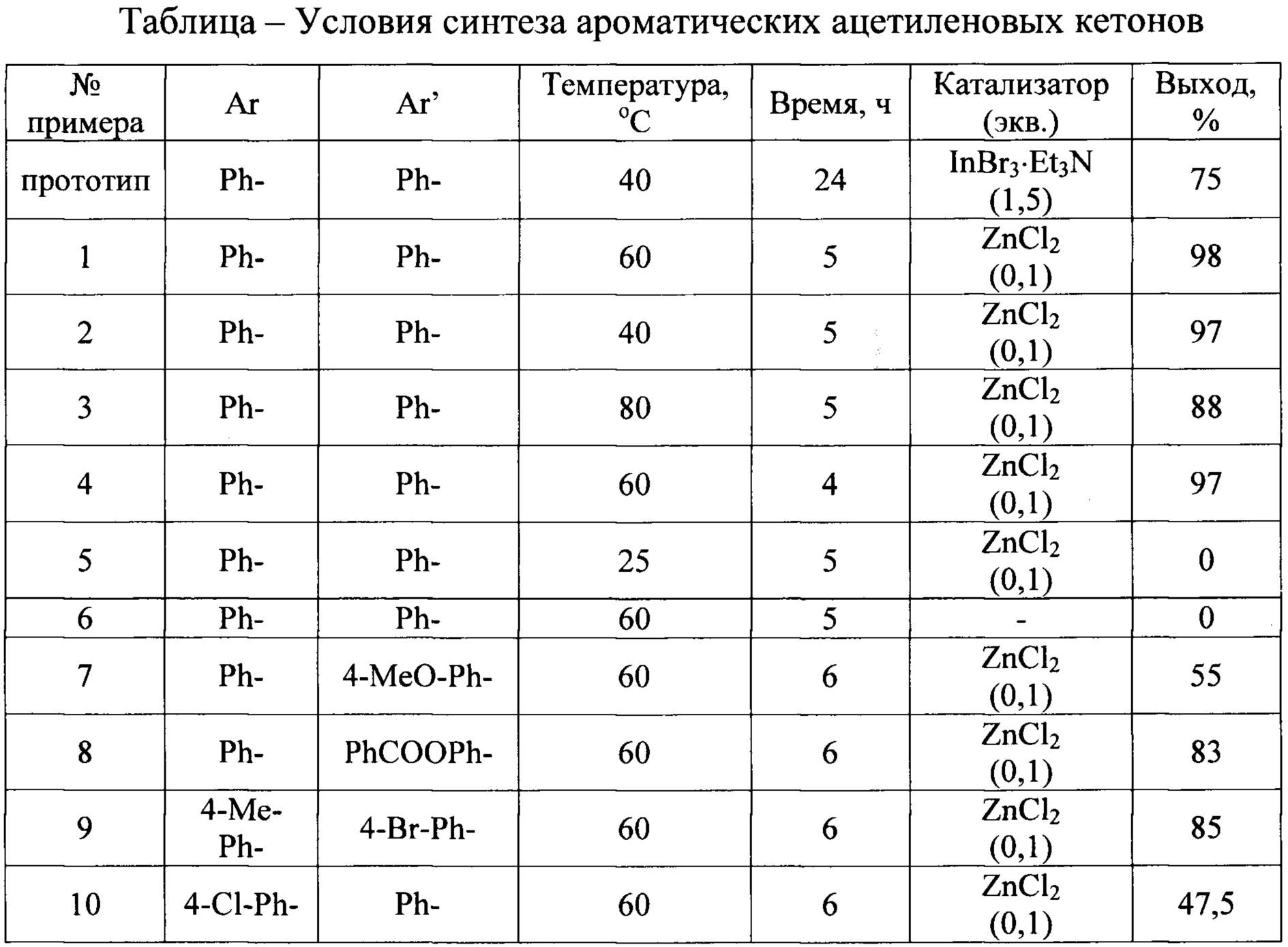
Как видно из приведенных примеров конкретного выполнения, при комнатной температуре реакция не протекает (пример 5). Так же реакция не протекает без применения кислоты Льюиса (пример 6). Проведение реакции при температуре выше 60°C приводит к протеканию побочных реакций, в результате чего выход целевого продукта снижается (пример 3). Примеры 1, 7-10 иллюстрируют возможность достижения технического результата для различных тетраалкинилидов олова и ароматических альдегидов, время взаимодействия от 4 до 6 часов.
Итак, время протекания реакции уменьшается в 4-6 раз. Предлагаемый способ проще, так как не требуется повышенного давления для его осуществления, а также снижаются расходы реагента (альдегида) и катализатора.
На основании изложенного делаем вывод, что предлагаемое техническое решение является новым, обладает изобретательским уровнем и промышленно применимо, т.е. является изобретением.