Результат интеллектуальной деятельности: КРИСТАЛЛИЧЕСКИЕ МИКРОЧАСТИЦЫ БЕТА-АГОНИСТА, ПОКРЫТЫЕ ЖИРНОЙ КИСЛОТОЙ
Вид РИД
Изобретение
Настоящее изобретение относится к кристаллическим микрочастицам, содержащим бета2-агонист, подходящим для применения в композициях для введения путем ингаляции для лечения респираторных заболеваний.
Изобретение также относится к фармацевтическим аэрозольным композициям, содержащим указанные микрочастицы, и к способу их изготовления.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Введение фармакологически активных ингредиентов посредством ингаляции в легкие является широкоиспользуемой методикой, особенно для лечения обратимой обструкции дыхательных путей, воспаления и гиперчувствительности.
Вдыхаемые препараты включают композиции в форме сухих порошков, находящиеся под давлением дозируемые (pMDI) композиции, содержащие пропелленты, такие как гидрофторалканы (HFA), или не содержащие пропеллента водные композиции для введения посредством подходящих устройств, таких как небулайзеры.
Лекарственные средства, присутствующие в композициях, могут быть либо растворенными, либо суспендированными.
Специфическая группа лекарственных средств, вводимых посредством легочного пути, представляет собой бронходилататоры, обладающие местным терапевтическим действием в легких и/или системным терапевтическим действием после абсорбции в кровь.
Например, широкоиспользуемые бронходилататоры представляют собой бета2-агонисты, принадлежащие к классу фенилалкиламиновых производных, таких как рац-(R,R)-N-[2-гидрокси-5-[1-гидрокси-2-[1-(4-метоксифенил)пропан-2-иламино]этил]фенил]формамид, известный также как формотерол.
Однако формотерол, а также другие лекарственные средства, принадлежащие к указанному классу, могут иметь проблемы, связанные с химической стабильностью, обусловленные тем, что функциональные группы, присутствующие в молекулах, такие как формамидные и гидроксиэтиловые группы, чувствительны к окислительным условиям.
Некоторые из указанных групп, такие как формамид, также являются чувствительными к реакциям сольволиза.
С другой стороны, молекулы, принадлежащие к указанному классу, могут также иметь проблемы, связанные с физической стабильностью их композиций в виде суспензий. Причина состоит в частичной растворимости лекарственных средств в пропелленте в виде сжиженного газа. Эта частичная растворимость, в свою очередь, может приводить к нежелательному увеличению размера частиц во время хранения и/или к образованию агрегатов.
Кроме того, композиции бета2-агониста в пропелленте HFA могут иметь склонность к абсорбции лекарственного средства резиновыми компонентами клапанов устройства для введения. Позже это может стать причиной заклинивания клапанов, приводящего к снижению массы тонкодисперсных частиц, и/или агрегаты частиц будут хуже проникать в нижние дыхательные пути, вызывая впоследствии проблемы с однородностью доз.
Для преодоления проблем физической стабильности и адсорбции лекарственного средства в данной области техники было предложено покрывать частицы добавками, такими как поверхностно-активные вещества, и суспендировать указанные покрытые частицы в пропелленте HFA.
Например, в WO 92/08447 и WO 91/04011 раскрыто покрытие активного агента способом, включающим стадии растворения поверхностно-активного вещества в растворителе, в котором фармацевтически активный агент по существу нерастворим, перемешивания некоторого количества фармацевтически активного агента, в микронизированной форме, в растворе поверхностно-активного вещества и извлечения частиц активного агента, покрытого поверхностно-активным веществом, либо путем фильтрации и сушки, либо путем удаления растворителя посредством выпаривания.
Однако до сих не была доказана возможность изготовления полезных композиций таким путем. Например, трудно достичь однородного покрытия, используя методики такого рода, потому что способ, в котором поверхностно-активный агент осаждается из испаряющегося растворителя, может быть непредсказуемым.
В WO 2006/059152 раскрыто получение покрытых частиц при помощи диспергирующих агентов, таких как поверхностно-активные вещества, посредством механодиффузионных процессов. Однако известно, что частицы, полученные таким путем, являются в основном аморфными. С другой стороны, аморфные или в основном аморфные вещества имеют тенденцию абсорбировать воду в большем количестве, чем кристаллические вещества, и это может представлять опасность для активных ингредиентов, подверженных деградации путем гидролиза.
В WO 00/61108 раскрыты частицы салметерола, покрытые поверхностно-активным веществом и не содержащие любого другого покрывающего эксципиента. Их получают способом, включающим стадии суспендирования активного ингредиента в форме частиц в среде, предпочтительно воде, затем диспергирования поверхностно-активного вещества и подвергания суспензии сушке распылением.
Однако, также в этом случае, хорошо известно, что использование воды может давать некоторое количество аморфного вещества. Кроме того, трудно достигать однородного покрытия, если поверхностно-активное вещество диспергируют и не растворяют в указанной среде.
В WO 2008/152398 раскрыты частицы, покрытые полимерами, такими как PVP (поливинилпирролидон), однако нет какого-либо упоминания об их химической стабильности.
В US 2004/101483 раскрыты композиции в форме суспензионного аэрозоля на основе гидрофторалканов, содержащие микронизированные частицы активных ингредиентов и кальциевые соли, магниевые соли и цинковые соли пальмитиновой кислоты и стеариновой кислоты в качестве твердых эксципиентов. Продемонстрированное преимущество заключается в том, что указанные суспензии показывают заметно улучшенную легкость использования клапана.
В US 2004/013611 композиции в форме суспензионного аэрозоля, содержащие терапевтически эффективное количество микронизированного альбутерол сульфата, от примерно 5 до 15% масс. этанола, от примерно 0,05 до примерно 0,5% масс. поверхностно-активного вещества, выбранного из группы, состоящей из олеиновой кислоты и сорбитана триолеата, и HFC 227 в качестве по существу единственного пропеллента. Указанные композиции отличаются тем, что они демонстрируют по существу отсутствие роста размера частиц или изменения в морфологии кристаллов лекарственного средства в течение продолжительного периода, являются по существу и легко повторно диспергируемыми, и при повторном диспергировании не флокулируют до такой степени быстро, чтобы мешать воспроизводимому дозированию лекарственного средства. Об их химической стабильности ничего не сказано.
Принимая во внимание сказанное выше, по-прежнему существует потребность в частицах бета2-агонистов с высокой химической стабильностью, а также способных образовывать физически стабильные суспензии с медленной скоростью осаждения и пониженным прилипанием к компонентам устройства.
Эта проблема решается посредством частиц по настоящему изобретению.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В первом аспекте изобретение относится к кристаллическим микрочастицам, состоящим из фенилалкиламинового бета2-адренергического агониста, покрытым C12-C20 жирной кислотой в количестве, составляющем от 0,2 до 2,5% масс.
Преимущественно, указанный бета2-агонист выбран из производного, соответствующего общей формуле (I):
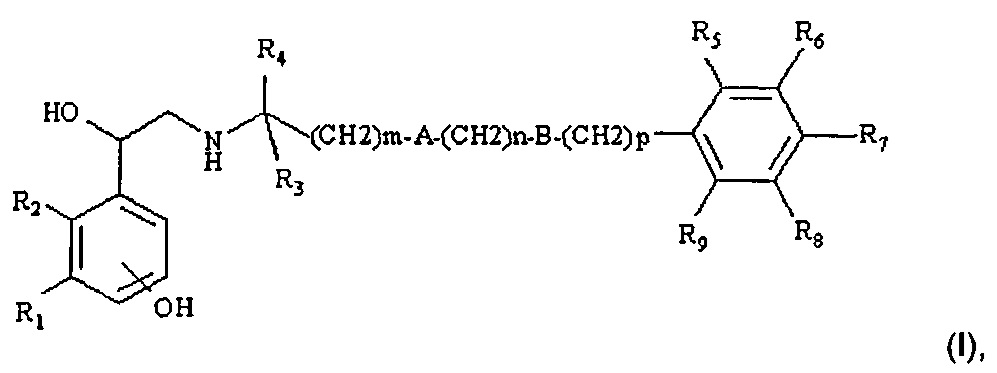
где
R1 представляет собой CH2OH или NHCOR10,
при условии, что когда R1 представляет собой CH2OH, R2 представляет собой водород, при этом когда R1 представляет собой NHCOR10, R2 и R10 могут независимо представлять собой водород или образовывать вместе радикал винилен (-CH=CH-) или этокси(-CH2-O-);
m представляет собой целое число от 0 до 5, предпочтительно 0 или 5;
n представляет собой целое число от 0 до 4, предпочтительно 0, 2 или 4;
p представляет собой целое число от 0 до 2, предпочтительно 0 или 1;
A представляет собой кислород или связь;
B представляет собой кислород или связь;
R3 и R4 представляют собой водород или метил; или, когда m равен 1, n, p равны 0, A и B представляют собой связи и R3 представляет собой водород, R4 может образовывать с R5 метиленовый мостик -(CH2)q-, где q представляет собой 1 или 2, предпочтительно 1;
R5, R6, R7, R8, и R9, которые являются одинаковыми или разными, независимо выбраны из водорода, гидроксила, C1-С4алкила, C1-С4алкокси, атомов галогена, SO2NH2 и 2-гидрокси-2-фенил-этиламино; предпочтительно они представляют собой водород, атомы галогена, C1-С4алкил и C1-С4алкокси,
и его фармацевтически приемлемых солей и/или сольватов.
Во втором аспекте изобретения предложены фармацевтические аэрозольные композиции для дозированных ингаляторов под давлением (pMDI), содержащие указанные выше микрочастицы в суспензии в сжиженном газе-пропелленте.
В третьем аспекте изобретения предложен дозированный ингалятор под давлением (pMDI), содержащий аэрозольный баллон, заполненный вышеупомянутой аэрозольной фармацевтической композицией, и дозирующий клапан для доставки суточной терапевтически эффективной дозы активного ингредиента.
Четвертый аспект изобретения относится к фармацевтической композиции в форме сухого порошка, содержащей указанные выше микрочастицы и возможно носитель.
В пятом аспекте изобретения предложен порошковый ингалятор, заполненный вышеупомянутой композицией в форме сухого порошка.
В шестом аспекте изобретение относится к способу изготовления микрочастиц по изобретению, включающий стадии:
а) получения раствора C12-C20 жирной кислоты во фторированном типичном пропелленте, в котором бета2-агонист по существу нерастворим, выбранном из группы перфторпентана, 2H,3H-перфторпентана (HPFP), перфторгексана и 1H-перфторгексана;
б) добавления микронизированного порошка лекарственного средства к раствору жирной кислоты;
в) смешивания с получением гомогенной суспензии; и
г) распылительной сушки полученной суспензии с получением покрытых микрочастиц.
В седьмом аспекте изобретение также относится к микрочастицам по изобретению для применения в предупреждении и/или лечении респираторного заболевания.
В восьмом аспекте изобретение относится к применению микрочастиц по изобретению в изготовлении лекарственного средства для предупреждения и/или лечения респираторного заболевания.
В девятом аспекте изобретения предложен способ предупреждения и/или лечения респираторного заболевания у пациента, включающий введение терапевтически эффективного количества микрочастиц по изобретению.
В десятом аспекте изобретение относится к кристаллическим микрочастицам, состоящим из фенилалкиламинового бета2-адренергического агониста, покрытым C12-C20 жирной кислотой в количестве, составляющем от 0,2 до 2,5% масс., где указанные микрочастицы получают способом, включающим стадии:
а) получения раствора C12-C20 жирной кислоты во фторированном типичном пропелленте, выбранном из группы перфторпентана, 2H,3H-перфторпентана (HPFP), перфторгексана и 1H-перфторгексана, где бета2-агонист по существу нерастворим;
б) добавления микронизированного порошка лекарственного средства к раствору жирной кислоты;
в) смешивания с получением гомогенной суспензии; и
г) распылительной сушки полученной суспензии с получением покрытых микрочастиц.
В еще одном аспекте изобретение относится к способу получения кристаллических микрочастиц, состоящих из лекарственного средства, подлежащего введению посредством ингаляции, покрытых C12-C20 жирной кислотой, где указанный способ включает стадии:
а) получения раствора C12-C20 жирной кислоты во фторированном типичном пропелленте, в котором лекарственное средство по существу нерастворимо, выбранном из группы перфторпентана, 2H,3H-перфторпентана (HPFP), перфторгексана и 1H-перфторгексана;
б) добавления микронизированного порошка лекарственного средства к раствору жирной кислоты;
в) смешивания с получением гомогенной суспензии; и
г) распылительной сушки полученной суспензии с получением покрытых микрочастиц.
Изобретение также относится к кристаллическим покрытым микрочастицам, получаемым указанным способом.
ОПРЕДЕЛЕНИЯ
Термин "атомы галогена" при использовании в данном описании изобретения включают фтор, хлор, бром и йод.
Выражение “C1-C4алкил” относится к алкильным группам с прямой и разветвленной цепью, где количество атомов углерода находится в диапазоне от 1 до 4. Конкретные алкильные группы представляют собой метил, этил, н-пропил, изопропил и трет-бутил, предпочтительно метил и этил.
Выражение " C1-C4алкокси" относится к алкоксигруппам с прямой и разветвленной цепью, где количество атомов углерода находится в диапазоне от 1 до 4. Типичные группы представляют собой метокси, этокси и бутилокси.
Термин «покрытый» относится к микрочастицам, имеющим поверхность, покрытую сплошной пленкой жирной кислоты.
Термин "разовая терапевтически эффективная доза" означает количество активного ингредиента, введенное за один раз посредством ингаляции при активации ингалятора pMDI или DPI.
Указанная доза может быть доставлена в течение одной или более активаций, предпочтительно при одной активации (выбросе) ингалятора.
Термин "активация" относится к высвобождению активного ингредиента из устройства посредством разовой активации (например, механической или вдохом).
Под "фторированным типичным пропеллентом" подразумевают фторированное производное алкана, жидкое при комнатной температуре и при атмосферном давлении, в котором обычные бета2-агонисты являются нерастворимыми. Типичные вещества этого класса представляют собой перфторпентан, 2H,3H-перфторпентан, перфторгексан и 1H-перфторгексан. 2H,3H-перфторпентан также известен как HPFP (Rogueda Р Drug Dev Ind Pharm 2003, 29(1), 39-49).
"По существу нерастворимый" относится к активному ингредиенту, имеющему растворимость в заданной среде менее 1,0% масс./об., предпочтительно менее 0,5%, более предпочтительно менее 0,1% масс./об.
В общих чертах, размер частиц оценивали количественно путем измерения характерного диаметра эквивалентной сферы, известного как объемный диаметр, посредством лазерной дифракции.
Размер частиц можно также оценивать количественно путем измерения массового диаметра посредством подходящих инструментов и методик, известных специалисту, таких как просеивание.
Объемный диаметр (VD) связан с массовым диаметром (MD) посредством плотности частиц (допуская, что размер является независимым от плотности частиц).
В настоящей заявке интервал размеров частиц выражают в показателях массового диаметра. Иначе распределение частиц по размеру выражают в показателях: (1) объемный медианный диаметр (VMD), который соответствует диаметру 50% по массе или объему, соответственно, частицы, например d(v0,5), и (2) объемный диаметр (VD) в микронах 10% и 90% частиц соответственно, например d(v0,1) и d(v0,9).
При распылении аэрозоля размер частиц выражают в виде массового аэродинамического диаметра (MAD) и распределение частиц по размеру в виде масс-медианного аэродинамического диаметра (MMAD). MAD показывает способность частиц во взвешенном виде переноситься в потоке воздуха. MMAD соответствует массовому аэродинамическому диаметру 50% масс. частиц.
Выражение "физически стабильный" относится к композициям, которые демонстрируют по существу отсутствие роста размера частиц или изменений в морфологии кристаллов суспендированных частиц в течение продолжительного периода, легко подвергаются повторному диспергированию, и при повторном диспергировании не флокулируют до такой степени быстро, чтобы мешать воспроизводимому дозированию активного ингредиента.
Выражение "химически стабильный" относится к композиции, которая при хранении удовлетворяет требованиям руководства Европейского агентства по контролю лекарственных средств (ЕМЕА Guideline) CPMP/QWP/122/02 со ссылкой на "Stability Testing of Existing Active Substances и Related Finished Products".
Выражение "вдыхаемая фракция" относится к показателю процентного содержания активных частиц, которые проникают глубоко в легкие пациента.
Вдыхаемую фракцию, также называемую тонкодисперсной фракцией (FPF), оценивают, используя подходящий in vitro прибор, такой как импактор нового поколения (NGI), многокамерный каскадный импактор или многокаскадный жидкостной импинджер (MLSI), согласно процедурам, описанным в общеизвестных Фармакопеях.
Ее вычисляют посредством отношения доставленной дозы и массы тонкодисперсных частиц (ранее - дозы тонкодисперсных частиц).
Доставленную дозу вычисляют по накопленному в приборе осадку, в то время как массу тонкодисперсных частиц вычисляют по осадку в камере N (где N равно целому числу) на фильтре (AF), соответствующей частицам с размером 5,0 микрон и меньше.
Термин «терапевтическое количество» означает количество активного ингредиента, которое при доставке в легкие обеспечивает желательный биологический эффект.
Термин "предупреждение" означает подход для снижению риска начала заболевания.
Термин «лечение» означает подход для получения полезных или желательных результатов, включая клинические результаты. Полезные или желательные клинические результаты могут включать, без ограничения, облегчение или улучшение одного или более симптомов или состояний, снижение степени заболевания, стабилизированное (то есть отсутствие ухудшения) состояние заболевания, предупреждение распространения заболевания, отсрочка или замедление развития заболевания, улучшение или временное облегчение болезненного состояния и ремиссию (частичную или полную), определяемую или неопределяемую.
Графические материалы
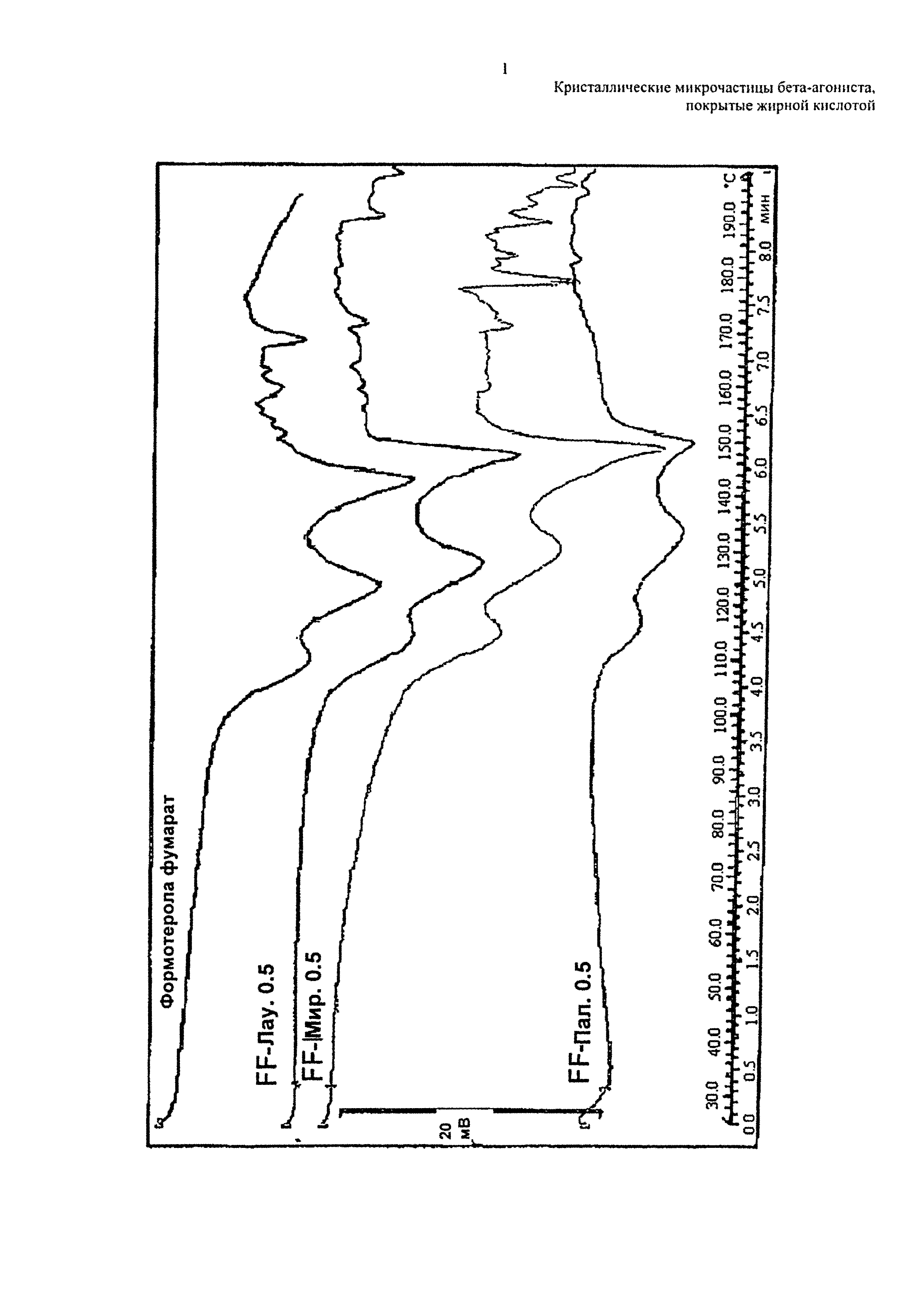
На чертеже представлена термограмма микрочастиц по изобретению в сравнении с кристаллическими микрочастицами формотерола фумарата дигидрата (верхняя линия).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к кристаллическим микрочастицам, состоящим из фенилалкиламинового бета2-адренергического агониста и его фармацевтически приемлемых солей и/или сольватов.
Фенилалкиламиновые бета2-адренергические агонисты представляют собой лекарственные средства, обладающие бронходилатационной активностью, и включают, например, сальбутамол (альбутерол), бамбутерол, фентерол, прокатерол, салметерол, индакатерол и формотерол.
Фармацевтически приемлемые соли включают соли, полученные путем взаимодействия аминогруппы соединения с неорганической или органической кислотой с образованием соли, например, гидрохлорида, гидробромида, сульфата, фосфата, метансульфоната, камфоры сульфоната, оксалата, малеата, фумарата, сукцината, цитрата, циннамата, ксинафоата и трифенатата.
Преимущественно, указанный бета2-агонист выбран из производного, соответствующего общей формуле (I).
Соединения общей формулы (I) могут содержать асимметрические центры. Поэтому изобретение включает все оптические стереоизомеры и их смеси.
Первый класс предпочтительных соединений представляет собой такой, где:
R1 представляет собой NHCOR10, где R10 представляет собой H, R4 представляет собой метил, m равен 1, n, p равны 0, A и B представляют собой связи, R3, R5, R6, R8 и Rg представляют собой Н, и R7 представляет собой метокси.
Если фенольная группа располагается рядом с R1, то соединение известно как формотерол.
Так как формотерол содержит два хиральных центра, предпочтительно его используют в форме 1:1 (R,R), (S,S)рацемата или (R,R)энантиомера, более предпочтительно в виде рацемата.
Особенно предпочтительная соль представляет собой фумарата дигидрат.
Второй класс предпочтительных соединений представляет собой такой, где:
R1 представляет собой NHCOR10, где R10 образует вместе с R2 радикал винилен(-CH=CH-), R4 представляет собой H, R3 образует с R5 метиленовый мостик -(CH2)q-, где q равен 1, m равен 1, n, р равны 0, A и B представляют собой связи, R6 и R9 представляют собой Н, и R7 и R8 представляют собой этиловую группу.
Когда фенольная группа располагается рядом с R1, то соединение известно как индакатерол.
Так как индакатерол содержит хиральный центр, его используют предпочтительно в форме R-энантиомера, более предпочтительно в виде малеатной соли.
Третий класс предпочтительных соединений представляет собой такой, где:
R1 представляет собой CH2OH, R2 R6, R7 и R8 представляют собой H, R5 и R9 представляют собой атомы хлора, A и B представляют собой O, m равен 5, n равен 2, p равен 1.
Если фенольная группа располагается рядом с R1, то соединение известно как вилантерол. Вилантерол предпочтительно используют в форме R-энантиомера в виде соли трифенатат.
Четвертый класс предпочтительных соединений представляет собой такой, где:
R1 представляет собой NHCOR10 с R10, образующим вместе с R2 радикал этокси(-CH2-O-), R3 и R4 представляют собой метил, m равен 1, A и B представляют собой связи, n и р равны 0, R5, R6, R8 и R9 представляют собой Н, R7 представляет собой метокси. Когда фенольная группа находится в положении мета к R1, то соединение известно как олодатерол, которое предпочтительно используют в виде R-энантиомера.
Пятый класс предпочтительных соединений представляет собой такой, где:
R1 представляет собой NHCOR10, где R10 представляет собой Н, R2, R3, R4, R8, R6, R8 и R9 представляют собой Н, m равен 1, A и B представляют собой связи, пир равны 0, R7 представляет собой 2-гидрокси-2-фенил-этиламино.
Если фенольная группа располагается рядом с R1, то соединение известно как милветерол. Так как милветерол содержит два хиральных центра, то его предпочтительно используют в форме (R,R)энантиомера, более предпочтительно в виде гидрохлоридной соли.
Шестой класс предпочтительных соединений представляет собой такой, где:
представляет собой CH2OH, R2, R3, R4, R5, R6, R8 и R9 представляют собой Н, m равен 5, n равен 4, p равен 0, А представляет собой О, и B представляет собой связь.
Если фенольная группа располагается рядом с R1, такое соединение известно как салметерол. Так как салметерол содержит один хиральный центр, его предпочтительно используют в рацемической форме (R,S), более предпочтительно в виде ксинафоатной соли.
Предпочтительно, соединение формулы (I) представляет собой бета2-агонист длительного действия, выбранный из группы, состоящей из формотерола, салметерола, вилантерола, олодатерола, милветерола, индакатерола и их фармацевтически приемлемых солей и/или сольватов.
В конкретном воплощении предпочтительными соединениями являются такие, где R1 представляет собой NHCOR10, R2 и R10 представляют собой Н и другие заместители, и индексы имеют значения, указанные выше.
В сущности, фенилалкиламиновые производные, несущие указанную группу, являются особенно чувствительными к реакциям сольволиза.
Предпочтительное соединение указанного класса представляет собой формотерол предпочтительно в форме дигидратной соли фумарата.
В другом конкретном воплощении предпочтительными соединениями являются соединения, где R1 представляет собой CH2OH, R2 представляет собой Н, и другие заместители и индексы имеют значения, указанные выше.
Предпочтительное соединение указанного класса представляет собой салметерол, предпочтительно в форме ксинафоатной соли.
Размер указанных микрочастиц ниже 15 микрон, предпочтительно ниже 10 микрон. Предпочтительно, по меньшей мере 90% частиц имеет объемный диаметр меньше примерно 5 микрон. Более предпочтительно, не более 10% микрочастиц имеет объемный диаметр [d(v,0.1)] меньше 0,6 микрон, и не более 50% частиц имеет объемный диаметр [d(v,0.5)] меньше 1,5 микрон.
Предпочтительно [d(v,0.5)] составляет от 1,5 до 3,0 микрон.
Размер частиц можно измерять посредством лазерной дифракции согласно известным способам.
Микрочастицы соединения общей формулы (I) покрыты C12-C20 жирной кислотой в количестве, составляющем от 0,2 до 2,5% по массе указанных частиц, предпочтительно от 0,5 до 2,0% масс. В одном воплощении предпочтительное количество может составлять от 1,0 до 2,0% масс., тогда как в другом воплощении оно может составлять от 0,5 до 1,0% масс.
С12-С20 жирная кислота преимущественно выбрана из группы, состоящей из насыщенных и мононенасыщенных соединений, таких как лауриновая кислота (С12:0), миристиновая кислота (С14:0), пальмитиновая кислота (С16:0), пальмитолеиновая кислота (С16:1), стеариновая кислота (С18:0), олеиновая кислота (С18:1) и арахиновая кислота (С20:0) или их смеси.
Более предпочтительно, жирная кислота представляет собой насыщенную жирную кислоту, выбранную из группы, состоящей из миристиновой кислоты, пальмитиновой кислоты, стеариновой кислоты и арахиновой кислоты. В предпочтительном воплощении жирная кислота представляет собой миристиновую кислоту. Фактически, при равном процентном содержании, миристиновая кислота способна обеспечить более высокие характеристики в показателях вдыхаемой фракции (FPF), как это видно из примеров.
В качестве мононенасыщенной кислоты можно предпочтительно использовать олеиновую кислоту.
Жирная кислота должна образовывать сплошную пленку на поверхности микрочастиц.
В зависимости от количества жирной кислоты, покрытие может вовлекать часть микрочастиц или все микрочастицы (полное покрытие), предпочтительно все микрочастицы.
Количество бета2-адренергического агониста зависит от его разовой терапевтически эффективной дозы, которая, в свою очередь, зависит от вида и тяжести заболевания и характеристик (масса, пол, возраст) пациента.
Например, в случае формотерола разовая терапевтически эффективная доза может составлять 6 или 12 мкг, вычисленная в пересчете на дигидратную соль фумарата.
После того, как микрочастицы по изобретению суспендируют в сжиженном газе-пропелленте, соответствующие суспензии становятся химически и физически стабильными в течение длительного времени и способны обеспечить отличную вдыхаемую фракцию. Неожиданно указанные композиции демонстрируют более низкую скорость осаждения, чем соответствующие композиции, содержащие непокрытые микрочастицы.
Таким образом, в настоящем изобретении предложены дозированные ингаляторы под давлением (pMDI), содержащие указанные выше микрочастицы в суспензии в сжиженном газе-пропелленте.
Можно использовать любой сжиженный газ-пропеллент, предпочтительно пропеллент гидрофторалкан (HFA). Преимущественно сжиженный газ-пропеллент представляет собой 1,1,1,2,3,3,3-гептафтор-н-пропан (HFA227) или 1,1,1,2-тетрафторэтан (HFA 134a) и их смесь.
Композиции по изобретению могут также содержать другие фармацевтически приемлемые эксципиенты, напримерповерхностно-активные вещества. Подходящие поверхностно-активные вещества известны в данной области техники и включают: сложные эфиры сорбитана, такие как сорбитан триолеат, сорбитан монолаурат, сорбитан моноолеат и их этоксилированные производные, такие как полисорбат 20, полисорбат 80; сополимеры окись этилена/окись пропилена и другие агенты, такие как натуральный или синтетический лецитин, олеиновая кислота, поливинилпирролидон (PVP) и поливиниловый спирт.
Количество поверхностно-активного вещества, которое может присутствовать в композиции по изобретению для pMDI, обычно находится в диапазоне от 0,001 до 3,0% (масс./масс.), предпочтительно от 0,005 до 1,0% (масс./масс.).
Композиции по изобретению могут дополнительно содержать другие активные ингредиенты, полезные для предупреждения и/или лечения респираторных заболеваний, например кортикостероиды или антимускариновые лекарственные средства, суспендированные или растворенные в сжиженном газе-пропелленте.
Примеры кортикостероидов представляют собой беклометазона дипропионат (BDP), флутиказона пропионат, флутиказона фуроат, мометазона фуроат, будесонид и циклесонид.
Примеры антимускариновых лекарственных средств представляют собой ипратропия бромид, тиотропия бромид, гликопиррония бромид и аклидиниума бромид.
Согласно другому аспекту в настоящем изобретении предложен дозированный ингалятор под давлением (pMDI), содержащий аэрозольный баллон, заполненный фармацевтической композицией по изобретению, и дозирующий клапан для доставки суточной терапевтически эффективной дозы активного ингредиента.
Аэрозольную композицию по изобретению следует расфасовывать в pMDI.
Указанные pMDI содержат аэрозольный баллон, оснащенный дозирующим клапаном. Активация дозирующего клапана позволяет высвобождать небольшую порцию распыляемого продукта.
Часть или все внутренние поверхности аэрозольного баллона могут быть изготовлены из стекла или металла, например, алюминия или нержавеющей стали, или анодированного алюминия.
Альтернативно, часть поверхностей или все внутренние поверхности металлического аэрозольного баллона могут быть футерованы инертным органическим покрытием. Примеры предпочтительных покрытий представляют собой эпоксифенольные смолы, перфорированные полимеры, такие как перфторалкоксиалканы, перфторалкоксиалкилены, перфторалкилены, такие как политетрафторэтилен (Teflon), фторированный этилен-пропилен, полиэфирсульфон, фторированный этилен-пропилен (FEP), и фторированный этилен-пропилен полиэфирсульфон (FEP-PES), их смеси или комбинация. Другие подходящие покрытия могут представлять собой полиамид, полиимид, полиамидимид, полифенилен сульфид или их комбинации.
Аэрозольный баллон закрывают при помощи дозирующего клапана для доставки суточной терапевтически эффективной дозы активного ингредиента.
Обычно комплектация дозирующего клапана включает соединительную муфту, имеющую сделанное в ней отверстие, отлитый корпус, присоединенный к соединительной муфте, который вмещает дозирующую камеру, шток, включающий стержень и наконечник стержня, внутренний и наружный изолирующий слой вокруг дозирующей камеры, пружину вокруг стержня и уплотнительную прокладку для предотвращения утечки пропеллента через клапан.
Уплотнительная прокладка может содержать любое подходящие эластичное вещество, такое как, например, полиэтилен низкой плотности, хлорбутил, черные и белые бутадиенакрилонитрильные резины, бутиловая резина, неопрен, EPDM (полимер этиленпропилендиенового мономера) и ТРЕ (термопластичный эластомер). Резины EPDM являются особенно предпочтительными.
Подходящие клапаны имеются в продаже от производителей, хорошо известных в производстве аэрозолей, например от Valois, France, Bespak, pic UK and 3M, Neotechnic Ltd UK.
Композиция должна активироваться посредством дозирующего клапана, способного доставлять объем от 25 мкл до 100 мкл, например 25 мкл, 50 мкл, 63 мкл или 100 мкл.
Преимущественно устройство MDI, заполненное композицией, может быть снабжено счетчиком доз.
Удивительным образом, при введении в виде порошка посредством подходящего устройства, микрочастицы по изобретению обеспечивают значительно более высокую вдыхаемую фракцию, чем соответствующие непокрытые микрочастицы.
Таким образом, в изобретении также предложена фармацевтическая композиция в форме сухого порошка, содержащая указанные выше микрочастицы и возможно носитель.
Частицы носителя можно изготавливать из любого физиологически приемлемого фармакологически инертного вещества или комбинации веществ, подходящих для ингаляционного применения. Например, частицы носителя могут состоять из одного или более веществ, выбранных из сахарных спиртов; полиолов, например сорбита, маннита и ксилита, и кристаллических сахаров, включая моносахариды и дисахариды.
Предпочтительно, частицы носители получены из лактозы, более предпочтительно, из альфа-лактозы монгидрата.
Преимущественно указанные частицы носителя имеют массовый диаметр (MD) по меньшей мере 50 микрон, более преимущественно более 90 микрон. Предпочтительно MD составляет от 50 микрон до 500 микрон.
В конкретных воплощениях изобретения MD может составлять от 90 до 150 микрон.
В других воплощениях MD может составлять от 150 до 400 микрон с MMD предпочтительно более 175 микрон, и более предпочтительно MD может составлять от 210 до 355 микрон.
Желательный размер частиц можно получать путем просеивания согласно известным способам.
Вышеупомянутая композиция в виде порошка может также преимущественно содержать вспомогательное вещество, предпочтительно связанное с поверхностью частиц носителя. Указанное вспомогательное вещество может представлять собой аминокислоту, предпочтительно выбранную из лейцина или изолейцина, или водорастворимое поверхностно-активное вещество, например, лецитин, в частности соевый лецитин, или смазывающее вещество, выбранное из группы, состоящей из стеариновой кислоты и ее солей, таких как стеарат магния, лаурилсульфат натрия, натрия стеарил фумарат и стеариловый спирт.
Композиции в виде сухого порошка, описанные в данном описании изобретения, можно использовать во всех обычных порошковых ингаляторах, таких как ингаляторы со стандартной дозой или многодозовые.
Например, указанными композициями можно наполнять твердые желатиновые капсулы, в свою очередь загружаемые в ингалятор со стандартной дозой, такой как модель Aerolizer™ или RS01/7, имеющиеся в продаже от Plastiape, Italy.
Альтернативно, ими можно наполнять многодозовый ингалятор, содержащий емкость для порошка, как описано в WO 2004/012801.
В настоящем изобретении дополнительно предложен способ изготовления микрочастиц по изобретению, включающий стадии:
а) получения раствора C12-C20 жирной кислоты во фторированном типичном пропелленте, в котором бета2-агонист по существу нерастворим, выбранном из группы перфторпентана, 2H,3H-перфторпентана (HPFP), перфторгексана и 1H-перфторгексана;
б) добавления микронизированного порошка лекарственного средства к раствору жирной кислоты;
в) смешивания с получением гомогенной суспензии; и
г) распылительной сушки полученной суспензии с получением покрытых микрочастиц.
В сущности было обнаружено, что благодаря физико-химическим свойствам используемого типичного пропеллента, характеристики твердого тела у частиц при сушке не изменяются, и они сохраняются по существу кристаллическими. Преимущественно, микрочастицы по изобретению имеют степень кристалличности, выраженную в % массы кристаллического соединения относительно общей массы соединения, по меньшей мере 90%, предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 98%, которую определяют согласно способам, известным в данной области техники, таким как дифференциальная сканирующая калориметрия (DSC), микрокалориметрия или дифракция рентгеновских лучей на порошке.
Кроме того, так как жирную кислоту добавляют в виде раствора, добиваются однородного и всестороннего покрытия микрочастиц. Указанное покрытие жирной кислотой осуществляют в отсутствие любого другого покрывающего эксципиента.
Не будучи ограниченным теорией, указанное однородное и всестороннее покрытие может способствовать улучшению химической стабильности активного ингредиента. Кроме того, оно предотвращает как частичную солюбилизацию, так и образование агрегатов лекарственного средства после суспендирования в сжиженном газе-пропелленте, делая возможным получение композиций, отличающихся улучшенной физической стабильностью.
Полагают, что свойства покрытия объясняют лучшие ингаляционные характеристики микрочастиц по изобретению после введения в виде порошка по сравнению с непокрытыми микрочастицами.
Фторированный типичный пропеллент следует выбирать в зависимости от характеристик растворимости активного ингредиента и жирной кислоты.
Предпочтительно указанный типичный пропеллент представляет собой перфторпентан или 2H,3H-перфторпентан (HPFP), более предпочтительно 2H,3H-перфторпентан.
Количество жирной кислоты в растворе будет варьировать в зависимости от количества активного ингредиента, добавленного на стадии (б), и будет выбрано таким образом, чтобы получить процентное содержание в конечных покрытых микрочастицах, составляющее от 0,2 до 2,5% масс.
Содержание активного ингредиента в суспензии, полученной на стадии (б), может варьировать в широких пределах, обычно в диапазоне от 1 до 40% масс./об., предпочтительно от 2 до 20% масс./об., более предпочтительно от 5 до 10% масс./об.
На указанной стадии микронизированный порошок лекарственного средства можно добавлять к раствору жирной кислоты и затем смешивать с использованием методик, известных в данной области техники, например путем диспергирования ультразвуком или перемешивания, с получением гомогенной суспензии (стадия (в)).
На стадии (г) полученную суспензию, сохраняемую при перемешивании, подвергают сушке распылением в подходящем устройстве.
Рабочие параметры устройства, такие как скорость потока суспензии, достигающего сушильной камеры, размер выпускного отверстия, температура на входе и на выходе, давление распыления и скорость потока распыляющего воздуха могут регулироваться специалистом согласно рекомендациям производителя.
Подходящая распылительная сушилка представляет собой, например, Buchi 191 Mini Spray Dryer (Buchi Company, Switzerland). Обычными являются следующие параметры:
температура воздуха на входе: 60-150°C, предпочтительно 95-105°C, более предпочтительно 100°C;
температура на выходе: 40-110°C, предпочтительно 55-65°C, более предпочтительно 60°C;
скорость потока воздуха: 600 л/ч;
подача потока суспензии: 4 мл/мин; и
диаметр выпускного отверстия: 0,7 мм.
Собранные микрочастицы имеют диаметр менее 15 микрон.
Возможно, их можно подвергать обычным методикам размола для регулирования размера.
Введение микрочастиц по изобретению может быть показано для предупреждения и/или лечения легких, средних или тяжелых острых или хронических симптомов или для профилактического лечения воспаления или обструкции дыхательных путей, такой как астма и хроническая обструктивная болезнь легких (ХОБЛ).
Следующие примеры дополнительно иллюстрируют изобретение.
ПРИМЕРЫ
Пример 1 - Изготовление микрочастиц формотерола фумарата по изобретению
5 мг миристиновой кислоты растворяли в 100 мл 2H,3H-перфторпентана при 30-35°C на водяной бане. Добавляли 995 мг формотерола фумарата дигидрата в виде микронизированных частиц и диспергировали, суспензию диспергировали ультразвуком и затем поддерживали при перемешивании.
Полученная таким образом суспензия содержала 99,5% масс. формотерола фумарата дигидрата и 0,5% масс. миристиновой кислоты.
Эту суспензию сушили распылением в Buchi 191 Mini Spray Dryer, используя следующие параметры:
температура воздуха на входе: 100°C;
температура на выходе: 60°C;
скорость потока воздуха: 600 л/ч;
подача потока суспензии: 4 мл/мин; и
диаметр выпускного отверстия: 0,7 мм.
Выход способа составлял 69,0%.
Аналогично получали микрочастицы формотерола фумарата дигидрата (FF), имеющие следующие составы:
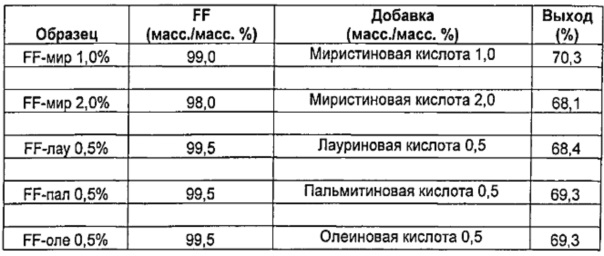
Пример 2 - Характеристика микрочастиц из Примера 1
Микрочастицы, полученные в Примере 1, подвергали следующему анализу.
Сканирующая электронная микроскопия (SEM) - Морфологические свойства исследовали, используя сканирующий электронный микроскоп (СЭМ) (SEM, Zeiss SUPRA 40, Oberkochen, Germany). Каждый образец осторожно устанавливали на держатель образца, с тем чтобы обеспечить репрезентативные изображения, и анализировали без напыления покрытия.
Микроснимки СЭМ получали, используя встроенное программное обеспечение захвата изображений.
Полученные изображения демонстрируют, что микрочастицы по изобретению не изменяют свой морфологический аспект по сравнению с непокрытыми микрочастицами FF.
Дифференциальная сканирующая калориметрия (ДСК)
Кристаллические свойства дополнительно исследовали посредством дифференциальной сканирующей калориметрии (ДСК).
Данные получали на Mettler Toledo Instrument DSC821c, программное обеспечение STARe.
Применяемый стандарт калибрования представляет собой индий. Приблизительно от 2 до 5 мг образца помещали в тигель для ДСК и точно измеряли и записывали массу. Тигель герметично закупоривали. Образец нагревали в атмосфере азота со скоростью 20°C/мин от 25°C до конечной температуры 200°C.
Термограмма, представленная на чертеже, показывает, что завершение характерного эндотермического перехода примерно при 160°C, типичное для кристаллического формотерола фумарата дигидрата, по-прежнему присутствует у микрочастиц по изобретению, что указывает на то, что способ сушки распылением не изменил характеристики твердого тела у лекарственного средства.
Микрочастицы, покрытые вспомогательным веществом в количестве от 1,0 до 2,0% масс./об., являются более кристаллическими, чем микрочастицы, покрытые меньшим количеством, то есть 0,5% масс./об.
Определение размера частиц посредством лазерной дифракции
Распределения частиц по размеру определяли посредством лазерной дифракции (Spraytec® S, Malvern Instruments, Worcestershire, UK).
Порошки диспергировали в смеси Span85:циклогексан 0,1% масс./об.
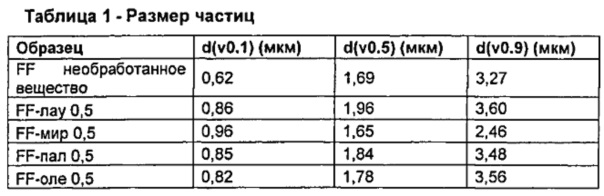
Результаты представлены в Таблице 1.
После сушки распылением размер микрочастиц по изобретению не изменяется по существу по сравнению с размером микрочастиц необработанного формотерола фумарата дигидрата.
Пример 3 - Композиция для pMDI, содержащая микрочастицы по Примеру 1
Для получения аэрозольных композиций в виде суспензии для pMDI с номинальной дозой активного ингредиента 12 мкг, алюминиевые баллоны заполняли в камере с регулируемой газовой средой посредством ввода последовательно 2,4 мг микрочастиц по Примеру 1 и затем 10 мл находящегося под давлением газа HFA134a.
Устройства оснащали 50 мкл клапаном APTAR и 0,3 мм активатором Bespak.
Для целей сравнения, также готовили аэрозольные композиции в виде суспензии для pMDI, содержащие микронизированный формотерола фумарата дигидрат.
Скорость осаждения определяли, используя устройство Turbiscan (Formulaction SA, France).
Композиции для pMDI, полученные с использованием микрочастиц по изобретению, показывают хорошее гомогенное распределение суспендированных частиц, а также более высокий уровень физической стабильности, чем сравнительная композиция, так как частицы осаждаются более медленно и менее подвержены образованию агломератов.
Композиции для pMDI также характеризовали в показателях аэрозольных характеристик.
Их оценивали, используя импактор нового поколения, согласно процедуре, описанной в Европейской Фармакопее, 7-е издание, 2011, раздел 2.9.18.
Количественное определение формотерола фумарата дигидрата (FF) выполняли, используя способ ВЭЖХ.
Определяли следующие параметры:
1) доставленную дозу (DD) вычисляют по накопленному осадку в ACI, разделенному на количество активаций в эксперименте;
2) массу тонкодисперсных частиц (FPM) получают посредством интерполяции накопленного процентного содержания меньше заданного размера на кривой зависимости номинально отсекаемого диаметра от массы осадка лекарственного средства. FPM соответствует частицам с диаметром 5,0 микрон или меньше, разделенным на количество активаций в эксперименте.
3) вдыхаемую фракцию (фракцию тонкодисперсных частиц, FPF), которая представляет собой процентное отношение массы тонкодисперсных частиц к доставленной дозе.
4) масс-медианный аэродинамический диаметр (MMAD), который представляет собой диаметр, около которого массовые аэродинамические диаметры испущенных частиц распределяются одинаково.
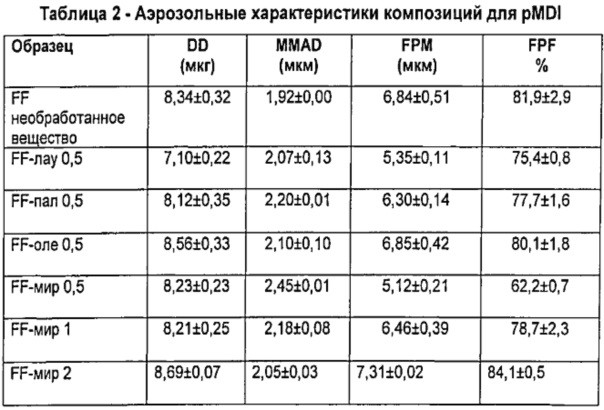
Результаты (в виде среднего значения±стандартное отклонение (S.D.)) изложены в Таблице 2.
Очевидно, что композиции для PMDI, содержащие микрочастицы по изобретению, имеют результатом отличную вдыхаемую фракцию, сравнимую с таковой для композиции, содержащей непокрытый микронизированный FF.
Пример 4 - Композиция в виде порошка, содержащая микрочастицы формотерола фумарата по изобретению
Для получения композиций в виде порошка микрочастицы по Примеру 1 FF-мир 0,5 и FF-мир 2,0 смешивали в миксере Turbula с моногидратом альфа-лактозы в качестве носителя, имеющим массовый диаметр, составляющий от 90 до 150 мкм, до получения соотношения 6 мкг лекарственного средства на 10 мг носителя.
Для целей сравнения также получали композицию в виде порошка, содержащую микронизированный формотерола фумарата дигидрат.
Каждым порошком наполняли твердые желатиновые капсулы НМРС, в свою очередь загруженные в ингалятор со стандартной дозой RS01/7 (Plastiape, Italy).
Аэрозольные характеристики оценивали, используя импактор нового поколения (NGI) согласно процедуре, описанной в Европейской Фармакопее, 7-е издание, 2011, раздел 2.9.18, стр. 281-285.
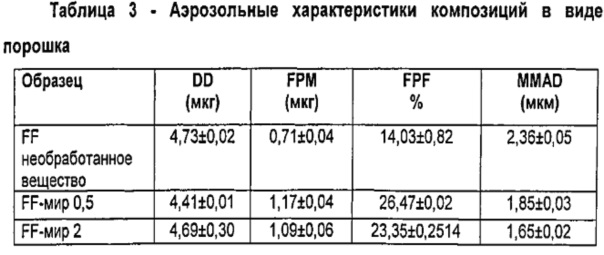
Результаты (среднее значение±S.D.) в показателях доставленной дозы (DD), массы тонкодисперсных частиц (FPM), фракции тонкодисперсных частиц (FPF) и масс-медианного аэродинамического диаметра (MMAD), представлены в Таблице 3.
Данные демонстрируют, что композиции в виде порошка, содержащие микрочастицы по изобретению, обеспечивают значительно более высокие значения вдыхаемых фракций, чем композиции, содержащие непокрытый микронизированный FF.
Пример 5 - Получение микрочастиц салметерола ксинафоата по изобретению
10 мг миристиновой кислоты растворяли в 100 мл 2H,3H-перфторпентана при 30-35°C на водяной бане. Добавляли 990 мг салметерола ксинафоата (SX) в виде микронизированных частиц и диспергировали, суспензию обрабатывали ультразвуком и затем поддерживали при перемешивании.
Полученная таким образом суспензия содержала 99% формотерола фумарата дигидрата и 1,0% миристиновой кислота по массе.
Эту суспензию сушили распылением в Buchi 191 Mini Spray Dryer со следующими параметрами:
температура воздуха на входе: 100°C;
температура на выходе: 64°C;
скорость потока воздуха: 600 л/ч;
подача потока суспензии: 4 мл/мин; и
диаметр выпускного отверстия: 0,7 мм.
Аналогично получали микрочастицы SX с олеиновой кислотой. Микрочастицы имеют следующий состав:

Пример 6 - Композиция для pMDI, содержащая микрочастицы по Примеру 5
Для получения аэрозольных композиций в виде суспензии для pMDI с номинальной дозой активного ингредиента 25 мкг, баллоны, покрытые FEP, заполняли в камере с регулируемой газовой средой путем ввода последовательно 3,0 мг микрочастиц Примера 5 и затем 6 мл находящегося под давлением газа HFA134a.
Устройство оснащали 50 мкл клапаном APTAR и активатором 0,3 мм Bespak.
Для целей сравнения также получали аэрозольные композиции в виде суспензии для pMDI, содержащие микронизированный салметерола ксинафоат.
Композиции для pMDI характеризовали в показателях аэрозольных характеристик.
Их оценивали, как описано в Примере 3.
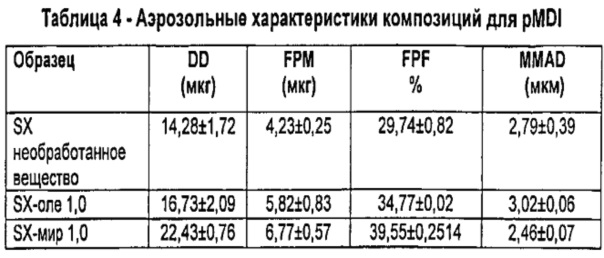
Результаты (в виде среднего значения±S.D.) представлены в Таблице 4.
Очевидно, что композиции для PMDI, содержащие микрочастицы по изобретению, обеспечивают удовлетворительную вдыхаемую фракцию, немного лучше таковой для композиции, содержащей непокрытый микронизированный SX.